PERTUMBUHAN DAN PRODUKTIVITAS SEKUNDER
LARVA CHIRONOMIDAE PADA DUA DANAU BERBEDA
SITI ANINDITA FARHANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Pertumbuhan dan Produktivitas Sekunder Larva Chironomidae pada Dua Danau Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SITI ANINDITA FARHANI. Pertumbuhan dan Produktivitas Sekunder Larva Chironomidae pada Dua Danau Berbeda. Dibimbing oleh YUSLI WARDIATNO dan MAJARIANA KRISANTI.
Produktivitas sekunder adalah salah satu metode untuk mengkuantifikasi ketersediaan biomassa organisme heterotrof bagi tingkat trofik selanjutnya dalam suatu rantai makanan. Penelitian mengenai produktivitas sekunder masih sangat jarang dilakukan di Indonesia. Penulis memilih topik penelitian mengenai perhitungan produktivitas sekunder mengingat peran produktivitas sebagai indikator ekologis dan kesehatan lingkungan. Pengukuran produktivitas sekunder dilakukan dengan objek organisme makroinvertebrata bentik seperti larva serangga. Salah satu larva serangga yang ditemukan hampir di seluruh habitat perairan adalah larva chironomid termasuk Danau Sipin dan Danau Teluk. Kedua danau tersebut terletak di Provinsi Jambi dan memiliki kondisi yang berbeda. Danau Sipin terletak di sekitar lingkungan padat kegiatan manusia dan hanya memiliki ±20% tutupan lahan hijau di area sempadan sedangkan Danau Teluk berada di daerah yang sangat sedikit mendapat pengaruh kegiatan antropogenik serta masih memiliki tutupan lahan hijau lebih dari 80%.
Tujuan dari penelitian ini adalah mendeskripsikan komunitas larva chironomid dan kecenderungan pertumbuhan larva chironomid yang ditemukan selama penelitian. Penelitian juga bertujuan untuk mengukur besarnya produktivitas sekunder larva chironomid dan membandingkan produktivitas di kedua danau lokasi penelitian. Penelitian dilaksanakan dari bulan Mei – September 2014 di Danau Sipin dan Danau Teluk, Provinsi Jambi. Metode analisis frekuensi ukuran digunakan untuk menghitung produktivitas sekunder larva chironomid. Biomassa diperoleh dengan mengkonversi volume larva menjadi berat kering.
Hasil penelitian menunjukkan bahwa kondisi perairan Danau Sipin dan Danau Teluk secara umum tidak berbeda secara signifikan. Parameter yang menunjukkan perbedaan signifikan adalah parameter kecerahan (p-value = 0,0020). Tutupan lahan dan kecerahan mempengaruhi preferensi serangga dewasa dalam memilih tempat memijah dan meletakkan massa telur (ovoposition). Spesies dominan yang ditemukan di kedua danau adalah Chironomus riparius dengan komposisi lebih dari 80%. Berdasarkan kurva distribusi frekuensi panjang dapat disimpulkan bahwa larva Chironomus riparius mengalami pertumbuhan yang signifikan selama penelitian.
Berdasarkan perhitungan jumlah individu, kelimpahan larva di Danau Teluk lebih tinggi dibandingkan Danau Sipin, demikian pula dengan produktivitas sekunder. Produktivitas Danau Teluk yang terukur sebesar 18 kali lipat produktivitas Danau Sipin. Hal tersebut menggambarkan bahwa kualitas lingkungan sekitar danau serta kondisi perairan Danau Teluk lebih cocok dan mendukung bagi kehidupan larva chironomid.
SUMMARY
SITI ANINDITA FARHANI. Growth and Secondary Productivity of Chironomidae Larvae at Two Different Lakes. Supervised by YUSLI WARDIATNO and MAJARIANA KRISANTI.
Secondary productivity is a method for biomass quantifying of heterotrophic organisms that will be used for the next trophic level in a food chain. The research about secondary productivity is very rare in Indonesia. Therefore, author choose research theme about secondary productivity considering the important purpose of productivity as ecological and environmental health indicator. Secondary productivity measurement is conducted with benthic macroinvertebrate organism such as insect larvae. One of insect larvae which can be found at whole water habitat is chironomid larvae. This larvae also can be found in Lake Sipin and Lake Teluk. Both of them is in Jambi Province and have different condition. Lake Sipin is located in heavy human activity region and only has ±20% plant coverage at border area. On the other side, Lake Teluk is in the area with sparse anthropogenic activity and has more than 80% plant coverage.
This research aimed to describe chironomid larvae community and the tendency of chironomid growth which was found. The research also has purpose to measure chironomid larvae secondary productivity and compare between two lakes. Research was conducted from May through September 2014 in Lake Sipin and Lake Teluk, Jambi Province. Size-frequency analysis method was used to calculate chironomid larvae secondary productivity. Biomassa was obtained with volume-dry weight conversion.
The result showed Lake Sipin and Lake Teluk water condition were not different significantly. Water transparency showed significant difference with p-value = 0,0020. Plant coverage and transparency influenced adult insect preference at choosing mating place and placing egg masses (ovoposition). Chironomus riparius was dominant species with composition more than 80%. Based on length–frequency distribution curve, C. riparius experienced significant growth.
According to total organism calculation, larvae abundance in Lake Teluk was higher compared to Lake Sipin. Secondary productivity also showed higher amount in Lake Teluk. Chironomid larvae in Lake Teluk was 18 times higher than Lake Sipin. Those showed environmental quality and water condition in Lake Teluk was more suitable for chironomid larvae.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pengelolaan Sumberdaya Perairan
PERTUMBUHAN DAN PRODUKTIVITAS SEKUNDER
LARVA CHIRONOMIDAE PADA DUA DANAU BERBEDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Pertumbuhan dan Produktivitas Sekunder Larva Chironomidae pada Dua Danau Berbeda
Nama : Siti Anindita Farhani NIM : C251120141
Disetujui oleh Komisi Pembimbing
Dr Ir Yusli Wardiatno, MSc Ketua
Dr Majariana Krisanti, SPi, MSi Anggota
Diketahui oleh
Ketua Program Studi Pengelolaan Sumberdaya Perairan
Dr Ir Sigid Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur Penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2014 ini ialah produktivitas sekunder, dengan judul Pertumbuhan dan Produktivitas Sekunder Larva Chironomidae pada Dua Danau Berbeda.
Terima kasih Penulis ucapkan kepada Dr Ir Yusli Wardiatno dan Dr Majariana Krisanti selaku komisi pembimbing serta Dr Jojok Sudarso sebagai penguji luar komisi. Di samping itu, penghargaan Penulis sampaikan kepada Lembaga Pengelola Dana Pendidikan, Kementerian Keuangan Republik Indonesia yang telah membantu seluruh pembiayaan penelitian ini. Penulis juga mengucapkan terima kasih kepada Badan Lingkungan Hidup Provinsi Jambi, Universitas Jambi dan Laboratorium Biomikro, Bagian Produktivitas dan Lingkungan Perairan Institut Pertanian Bogor atas segala bantuan yang telah diberikan kepada penulis selama penelitian. Ungkapan terima kasih juga disampaikan kepada Alm. Marzuki Nurdin, Zuleha Sy, Nur Rafidah serta seluruh sahabat (Yunita M. Anzani, Dwi Y. Wulandari, Nuralim Pasisingi, Wahyu M, Fuquh RS, Bambang K dan L Panji IA) atas segala doa dan semangatnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan dan Manfaat Penelitian 3
Hipotesis Penelitian 3
2 METODE 4
Waktu dan Lokasi Penelitian 4
Alat 5
Bahan 6
Prosedur Pelaksanaan Penelitian 7
Analisis Data 8
3 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 17
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 24
DAFTAR TABEL
1 Metode dan alat yang digunakan pada pengukuran parameter 7 2 Karakteristik ukuran larva Chironomus sp. (Klemm 2001) 9 3 Parameter kualitas air dan uji statistika untuk melihat perbedaan
kondisi 11
4 Kelimpahan dan persentase masing-masing genus pada kedua lokasi
penelitian 12
5 Produktivitas sekunder Danau Sipin dan Danau Teluk 16 6 Perbandingan produktivitas sekunder beberapa perairan berbeda 17
DAFTAR GAMBAR
1 Diagram alir perumusan masalah 4
2 Lokasi penelitian (A: Danau Sipin, B: Danau Teluk) 5 3 Paket substrat buatan untuk pengambilan sampel larva chironomid 6 4 Kelimpahan larva Chironomidae di Danau Sipin dan Danau Teluk 12
5 Kepala dan idenfikasi gigi C. riparius 12
6 Kurva pertumbuhan C. riparius di Danau Teluk 13 7 Kurva regresi kelompok pergeseran modus subpopulasi C. riparius 15 8 Pengelompokkan larva Chironomus riparius berdasarkan instar 16
DAFTAR LAMPIRAN
1 Peta satelit kondisi tutupan lahan hijau di sekitar danau lokasi
penelitian 24
1
1
PENDAHULUAN
Latar Belakang
Produktivitas sekunder didefinisikan sebagai biomassa yang dihasilkan oleh suatu populasi (organisme heterotrof) pada suatu interval waktu dan luasan tertentu, tanpa mempertimbangkan tingkat kelangsungan hidup populasi tersebut hingga akhir interval (Kimmerer 1987). Estimasi produktivitas sekunder menjadi dasar bagi para ekologis untuk mengkuantifikasi peran dari konsumen khususnya makroinvertebrata bentik dalam siklus materi dan aliran energi dalam ekosistem akuatik (Walther et al. 2006). Produksi dari suatu populasi biologi seringkali menjadi fokus utama dari para peneliti karena dapat menjelaskan aliran energi yang terjadi pada populasi dan dapat digunakan sebagai indikator fisiologi serta status nutrisi. Estimasi nilai produktivitas sekunder menjadi informasi dasar yang penting untuk pengelolaan sumberdaya alam secara rasional. Produktivitas sekunder adalah instrumen pokok untuk evaluasi potensi suatu trofik sebagai salah satu komponen dari ekosistem. Sebagai contoh, invertebrata bentik dapat merepresentasikan hubungan antara produsen primer dan ikan dalam aliran energi serta daur bahan organik (Tumbiolo & Dawning 1994).
Kelompok organisme yang sering digunakan dalam pengukuran produktivitas sekunder adalah organisme invertebrata bentik (Benke 1994). Sifat organisme bentik adalah tidak memiliki pergerakan luas sehingga sangat kuat mendapat pengaruh dari lingkungan dan menjadi organisme yang tepat untuk menggambarkan nilai produktivitas sekunder. Penelitian ini menggunakan larva chironomid sebagai objek pengukuran produktivitas sekunder. Larva chironomid dipilih karena memiliki kelimpahan tinggi, pertumbuhan dan siklus hidup yang cepat, serta menjadi konsumen primer paling produktif dalam sebuah ekosistem (Entrekin 2007; Ree 2012; Senderovich & Halpern 2012). Organisme heterotrof ini digunakan oleh tingkat trofik di atasnya sebagai sumber energi dalam bentuk pakan (Benke 1998).
Produktivitas sekunder merupakan fungsi dari lingkungan (ketersediaan makanan, suhu, kadar oksigen terlarut, dan kedalaman). Kajian mengenai produktivitas dapat digunakan sebagai indikator ekologis dan kesehatan suatu perairan (Kirgiz 1988 in Ozkan et al. 2010). Pengukuran produksi invertebrata bentik seringkali dihitung dari rata-rata tahunan biomassa populasi dan data literatur mengenai tingkat turnover (P/B). Pendekatan dilakukan pada level taksonomi tertentu seperti genus atau spesies dengan prosedur estimasi yield (Lohlein 1999). Perhitungan dengan menggunakan rata-rata tahunan biomassa seringkali digunakan di daerah subtropis karena siklus hidup organisme yang memang tahunan (minimal 1 tahun), sedangkan untuk daerah tropis seperti Indonesia penggunaan rentang tahunan kurang tepat karena organisme bentik rata-rata memiliki siklus hidup yang singkat.
2
pada perairan yang telah terkontaminasi misalnya kolam stabilisasi limbah (Halpern et al. 2002). Berdasarkan hasil penelitian mengenai siklus hidup chironomid, diketahui bahwa chironomid memiliki 4 fase hidup yang terdiri dari telur, larva, pupa, dan serangga dewasa. Chironomid dalam bentuk larva yang memiliki habitat di air adalah salah satu organisme heterotrof yang dapat digunakan sebagai objek dalam pengukuran produktivitas sekunder (Ramirez & Pringle 2006). Famili Chironomidae menjadi penyusun 10% hingga 50% biomassa makroinvertebrata air yang masing-masing subfamili maupun ordonya memiliki preferensi tertentu terhadap kondisi suatu lingkungan perairan (Odume & Muller 2011). Fase larva chironomid terutama genus Chironomus sp. berlangsung dalam waktu 3 hingga 4 minggu dan terdiri dari 4 kelompok berdasarkan ukuran atau instar (Farhani 2012). Larva Chironomidae berperan sangat penting dalam rantai makanan di lingkungan perairan (Zilli et al. 2008). Organisme ini bermanfaat sebagai pakan alami juvenil dan invertebrata lain serta berperan penting dalam proses penguraian bahan organik (Bay 2003; Pinder 1986). Larva chironomidae merupakan pemanfaat bahan organik langsung, hal ini dibuktikan oleh penelitian Biasi et al. (2013) yang menyatakan bahwa keberadaan Chironomidae dalam densitas tinggi berasosiasi dengan ketersediaan detritus sehingga Chironomidae dapat dipertimbangkan sebagai salah satu pengurai yang berperan dalam proses dekomposisi.
Larva Chironomidae juga sangat cepat merespon perubahan kondisi perairan (Heinrich et al. 2006). Oleh karena itu, larva insekta ini sering dimanfaatkan sebagai bioindikator pencemaran lingkungan. Batas toleransi dan sensitivitas masing-masing spesies chironomid berbeda sehingga dapat menjadi indikator yang sempurna bagi pencemaran organik, kontaminasi logam berat maupun degradasi habitat (Odume & Muller 2011; Carew et al. 2003). Sebagian besar spesies Larva Chironomidae memiliki habitat di perairan yang kaya bahan organik (Arimoro et al. 2007). Struktur komunitas seperti komposisi jenis, diversitas dan kelimpahan dipengaruhi oleh kondisi lingkungan. Oleh karena itu komunitas larva Chironomidae diharapkan mampu menggambarkan kondisi perairan habitatnya.
Penelitian mengenai produktivitas sekunder larva chironomid sangat jarang dilakukan di Indonesia. Penelitian mengenai larva chironomid dilakukan pertama kali di Indonesia oleh Kikuchi & Sasa pada tahun 1990 di Danau Toba, Sumatera Utara. Penelitian lain mengenai larva chironomid di Indonesia dilakukan di lahan gambut, Kalimantan Tengah. Penelitian yang dilakukan oleh Yulintine et al. (2007) ini bertujuan untuk menghitung densitas dan biomassa larva chironomid di kanal irigasi pertanian di sekitar lahan gambut. Wardiatno & Krisanti (2013) juga melakukan penelitian mengenai komposisi dan kelimpahan komunitas larva chironomid dengan menggunakan substrat buatan di Danau Lido, Jawa Barat.
3 untuk melihat pertumbuhan populasi larva chironomid di kedua lokasi penelitian dan produktivitas sekunder larva chironomid pada masing-masing danau. Kedua data tersebut dapat digunakan sebagai dasar informasi biodiversitas dan produktivitas sekunder larva chironomid pada kondisi yang berbeda sebagai dasar pengelolaan untuk keberlanjutan dan kelestarian danau.
Perumusan Masalah
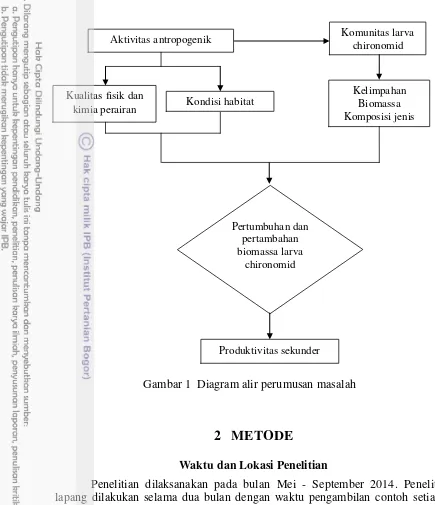
Aktivitas antropogenik seperti pemukiman, perkantoran, kegiatan pariwisata di sekitar perairan, transportasi maupun Keramba Jaring Apung (KJA) menyumbang masukan bahan organik ke suatu perairan. Masukan tersebut mempengaruhi kualitas perairan baik secara fisik maupun kimia. Aktivitas antropogenik juga menyebabkan perubahan kondisi habitat di sekitar badan air. Kebutuhan maupun alih fungsi lahan untuk kepentingan manusia melalui kegiatan pengurugan dan penimbunan, menjadi suatu ancaman tersendiri bagi habitat di sekitar badan air. Di samping itu, aktivitas antropogenik secara tidak langsung juga mempengaruhi struktur komunitas organisme yang mendiami suatu badan air. Pengaruh dari kegiatan antropogenik baik kualitas air maupun perubahan kondisi habitat menyebabkan perubahan kelimpahan, biomassa dan komposisi jenis organisme termasuk larva chironomid. Perubahan-perubahan tersebut terkait dengan bahan organik akan mempengaruhi pertumbuhan dan pertambahan biomassa larva chironomid. Pertumbuhan dan pertambahan biomassa merupakan parameter penting yang digunakan dalam kajian produktivitas sekunder suatu perairan. Diagram alir perumusan masalah dalam penelitian ini dapat dilihat pada Gambar 1.
Tujuan dan Manfaat Penelitian
Tujuan penelitian ini adalah untuk menganalisis pertumbuhan larva chironomid di kedua danau lokasi penelitian. Penelitian juga bertujuan untuk menghitung dan membandingkan produktivitas sekunder larva chironomid di kedua danau tersebut. Manfaat dari penelitian ini adalah memberikan informasi mengenai komunitas dan pertumbuhan larva chironomid di Danau Sipin dan Danau Teluk serta menggambarkan pengaruh kualitas air dan lingkungan sekitar danau terhadap pertumbuhan dan produktivitas sekunder larva chironomidae sebagai dasar konsep pengelolaan danau.
Hipotesis Penelitian
4
2
METODE
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada bulan Mei - September 2014. Penelitian lapang dilakukan selama dua bulan dengan waktu pengambilan contoh setiap 2 hari selama 2 bulan karena menurut Farhani (2012), chironomid pada fase larva (khususnya genus Chironomus) memerlukan waktu lebih kurang 1 bulan untuk mencapai fase pupa sehingga diharapkan dapat mewakili lebih dari satu siklus hidup larva chironomid. Lokasi dan titik pengambilan contoh yang dipilih adalah Danau Teluk dengan kedalaman rata-rata 4 m dan Danau Sipin yang memiliki kedalaman rata-rata 8 m. Kedua danau tersebut terletak di Provinsi Jambi (Gambar 2). Kedua danau tersebut memiliki perbedaan luas tutupan lahan hijau pada area sempadan. Persentase tutupan lahan hijau dihitung dengan menggunakan google earth.
Gambar 1 Diagram alir perumusan masalah
Kualitas fisik dan kimia perairan
Aktivitas antropogenik Komunitas larva chironomid
Kondisi habitat
Produktivitas sekunder Pertumbuhan dan
pertambahan biomassa larva
chironomid
5
Alat
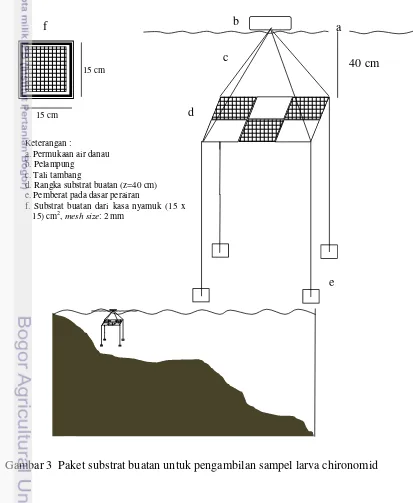
Substrat buatan (Gambar 3) digunakan sebagai trap atau perangkap larva chironomid (Krisanti 2012). Satu kerangka substrat berukuran 45 x 30 cm2 dibagi menjadi tiga unit berukuran 15 x 15 cm2. Masing-masing unit terbuat dari jaring dengan mesh-size 2 mm. Peralatan yang digunakan dalam proses identifikasi dan
A
B
Gambar 2 Lokasi penelitian (A: Danau Sipin, B: Danau Teluk)
103º35‟0”E 103º35‟30”E
103º35‟30”E
103º36‟15”E 103º35‟50”E
6
pengukuran morfologi larva chironomid adalah mikroskop stereo dan mikroskop cahaya trinokuler. Mikroskop cahaya trinokuler dihubungkan langsung dengan Axio Camera ERc5s untuk pembuatan arsip visual dalam bentuk gambar elektronik pada Personal Computer (PC). Pengukuran panjang total dilakukan dengan menggunakan kamera dino-lite.
Bahan
Bahan utama yang digunakan pada penelitian ini adalah organisme chironomid yang berada pada fase larva. Larutan Rose Bengal dan alkohol dengan konsentrasi 70% merupakan bahan yang digunakan untuk prosedur analisis laboratorium. Bahan lain yang digunakan yaitu larutan KOH 10% dan larutan Entellan.
Gambar 3 Paket substrat buatan untuk pengambilan sampel larva chironomid 15 cm
15 cm
Keterangan :
a. Permukaan air danau b. Pelampung
c. Tali tambang
d. Rangka substrat buatan (z=40 cm) e. Pemberat pada dasar perairan
f. Substrat buatan dari kasa nyamuk (15 x 15) cm2, mesh size: 2 mm
a b
c
d
e f
7
Prosedur Pelaksanaan Penelitian
Metode penelitian yang digunakan berupa percobaan langsung lapangan di Danau Sipin dan Danau Teluk, Provinsi Jambi. Penelitian dilakukan dengan pengambilan sampel larva chironomid dan beberapa parameter pendukung berupa kondisi lingkungan di sekitar danau dan data kualitas air. Hasil penelitian yang didapat dijabarkan secara deskriptif, kausal, dan komparatif. Data yang diperoleh yaitu deskripsi pertumbuhan larva chironomid, produktivitas sekunder larva chironomid serta beberapa parameter lingkungan sebagai data pendukung. Berdasarkan data tersebut dijelaskan perbandingan kondisi di sekitar danau terutama tutupan lahan hijau serta kualitas air kedua danau yang diukur. Selanjutnya, dilakukan penentuan hubungan kausalitas dan faktor apa saja yang paling berpengaruh terhadap pertumbuhan dan produktivitas sekunder larva chironomid. Produktivitas sekunder yang diperoleh akan dibandingkan secara spasial antara Danau Teluk dan Danau Sipin. Hasil yang diperoleh diharapkan dapat menjelaskan pengaruh kondisi lingkungan terhadap pertumbuhan dan produktivitas sekunder larva chironomid.
Metode dan alat yang digunakan pada pengukuran parameter fisika-kimia perairan pada penelitian ini ditunjukkan pada Tabel 1. Penelitian dilakukan selama 40 hari dengan frekuensi pengambilan setiap 2 hari. Hari ke-0 seluruh unit substrat buatan yang telah disiapkan dipasang di lokasi penelitian. Substrat buatan dipasang sebanyak 20 unit pada masing-masing danau dengan kedalaman 40 cm dari permukaan air. Kedalaman ditentukan berdasarkan pertimbangan kecerahan yang cukup rendah di Danau Sipin. Selanjutnya substrat buatan diambil secara acak pukul 08.00-10.00 WIB. Contoh biologi yang diambil adalah larva chironomid. Pengambilan contoh larva dilakukan bersamaan dengan pengukuran parameter fisika perairan yaitu suhu, kecerahan dan kedalaman perairan. Sementara itu, parameter BOD (Biological Oxygen Demand) dan pH hanya diukur sebanyak 5 kali selama waktu penelitian.
Pengambilan contoh larva dilakukan dengan cara memisahkan (menyortir) larva dari endapan lainnya pada substrat buatan dengan sikat, saringan halus dan pipet tetes pada contoh yang telah ditetesi Rose Bengal. Contoh yang diperoleh dimasukkan ke dalam botol film dan ditambahkan preservasi alkohol 70%. Selanjutnya contoh awetan dipanaskan dengan KOH 10% selama ±10 menit. Contoh awetan yang telah dipanaskan dibersihkan dengan cara direndam dengan akuades selama ±5 menit. Prosedur selanjutnya yaitu hidrasi dengan Tabel 1 Metode dan alat yang digunakan pada pengukuran parameter
fisika-kimia perairan
Parameter Unit Alat Metode Pustaka
8
menggunakan alkohol bertingkat (70%, 80%, dan absolut) selama masing-masing 5 menit (modifikasi Epler 2001). Contoh larva selanjutnya ditetesi Entellan secukupnya lalu ditutup dengan menggunakan kaca penutup. Tahap selanjutnya yaitu identifikasi dan pengukuran parameter morfologi. Parameter morfologi berupa panjang total dan lebar total digunakan sebagai dasar penentuan produktivitas sekunder. Panjang dan lebar kapsul kepala digunakan sebagai dasar pengelompokkan larva chironomid berdasarkan instar.
Analisis Data
Uji U Mann Whitney
Tujuan dari penggunaan prosedur ini adalah menguji perbedaan dua kelompok data yang tidak memenuhi asumsi populasi normal. Uji U Mann Whitney termasuk dalam uji non parametrik yang dipakai untuk ukuran contoh yang kecil sampai sedang (Kvanli 1988). Uji U menjadi alternatif uji t untuk menguji apakah parameter kualitas air pada kedua danau lokasi penelitian berbeda secara signifikan. Berikut hipotesis yang digunakanpada uji U Mann Whitney pada penelitian ini:
H0 : Parameter kualitas air (suhu, kecerahan, pH, DO, dan BOD) di Danau Sipin dan Danau Teluk memiliki distribusi peluang yang identik
H1 : Parameter kualitas air di Danau Sipin dan Danau Teluk berbeda secara signifikan
Penentuan kohort melalui analisis distribusi frekuensi panjang larva chironomid
Data yang diperoleh selama pengamatan berlangsung akan diolah untuk menghasilkan penjelasan secara deskriptif. Ciri-ciri penting sejumlah besar data dengan segera dapat diketahui melalui pengelompokan data tersebut ke dalam beberapa kelas dan kemudian dihitung banyaknya pengamatan yang masuk kedalam tiap kelas. Susunan dari data ini biasanya disajikan dalam bentuk tabel yang disebut sebaran frekuensi. Data yang disajikan dibuat dalam bentuk kelompok untuk memperoleh gambaran yang lebih baik mengenai populasi yang sedang diamati.
Penentuan banyaknya kelas yang dihitung dengan menggunakan rumus sebagai berikut, dengan n sebagai jumlah data panjang:
Jumlah kelas =1+(3,32× log n )
Kemudian ditentukan wilayah dengan mengurangi nilai maksimum dengan minimum data keseluruhan. Selanjutnya adalah penentuan lebar kelas sesuai dengan rumus:
Lebar kelas=(nilai maksimum -nilai minimum ) jumlah kelas
9 diperoleh dengan menambah atau mengurangi selang kelas dengan setengah kali nilai satuan terkecil. Nilai tengah didapat dengan merata-ratakan batas kelas atas dan batas kelas bawah. Selanjutnya nilai frekuensi ditentukan pada masing-masing kelas dan yang terakhir adalah pengecekan jumlah kolom frekuensi memiliki jumlah yang sama terhadap banyaknya total pengamatan (Walpole 1992).
Penentuan kohort larva chironomid dilakukan dengan menggunakan data yang sudah terdistribusi pada selang kelas tertentu. Kohort merupakan gambaran mengenai organisme yang memiliki umur yang sama dan berada pada kondisi lingkungan perairan yang sama (Battacharya 1967 in Spare & Venema 1999). Penentuan nilai kohort pada larva chironomida dapat menjelaskan mengenai kelompok ukuran larva chironomid pada setiap waktu pengamatan. Penentuan kohort dan sebaran distribusinya per minggu dilakukan dengan metode NORMSEP (Normal Separation) dan bantuan program FISAT II. Pergeseran sebaran distribusi ke arah kanan memperlihatkan bahwa telah terjadi pertumbuhan.
Pengelompokan larva chironomid berdasarkan instar
Setelah dilakukan pengukuran panjang dan lebar kepala, data yang diperoleh diolah dengan menggunakan MINITAB 15 untuk mengelompokkan data berdasarkan instar. Larva chironomid terdiri dari 4 instar dan masing-masing instar memiliki kisaran panjang tersendiri. Tabel 2 merupakan dasar pengelompokan instar, tabel tersebut dijadikan pedoman dalam menentukan centroid atau pemusatan data panjang dan lebar kapsul kepala dari larva chironomida. Selanjutnya data diolah dengan menggunakan perangkat lunak MINITAB 15.
Biomassa
Biomassa dihitung per instar (instar I-IV) sehingga didapat biomassa rata-rata per instar. Penentuan biomassa chironomid diperoleh dari bobot dikali dengan jumlah individu. Pengukuran bobot seringkali tidak dapat dilakukan dengan menggunakan timbangan digital karena tingkat ketelitian timbangan terlalu besar sehingga tidak dapat mendeteksi bobot chironomid per individu. Oleh karena itu digunakan pendekatan biovolume untuk menduga bobot chironomid. Pendekatan ini dapat dihitung dari panjang total tubuh larva yang telah diperoleh dari analisis laboratorium dengan menggunakan mikroskop dan kamera khusus yang terhubung ke PC. Volume tubuh larva chironomid diperoleh dengan menggunakan rumus tabung dengan asumsi bahwa tubuh larva chironomid berbentuk seperti tabung. Berat basah dan volume memiliki perbandingan 1,05 sedangkan berat kering dan berat basah memiliki perbandingan 0,142 (Smit et al. 1993). Berat kering larva chironomid diperoleh dengan rumus sebagai berikut. Tabel 2 Karakteristik ukuran larva Chironomus sp. (Klemm 2001)
10
Produktivitas sekunder larva chironomid dihitung menggunakan metode non-kohort karena contoh yang diperoleh berasal dari penelitian lapang dan tidak dapat ditelusuri kohortnya. Oleh karena itu digunakan metode distribusi frekuensi ukuran (size-frequency method) dengan asumsi sampel yang dikumpulkan mendekati kurva mortalitas dari kohort rata-rata (Benke 1979 in Benke & Huryn 2007). Metode ini membutuhkan data panjang total untuk menyusun selang kelas ukuran. Data panjang total dikelompokkan dalam selang kelas. Selanjutnya produktivitas sekunder ditentukan dengan formulasi berikut.
P=Bawal+ N∆W t
1
P adalah produktivitas, Bawal adalah biomassa pada hari pertama pengambilan contoh (gram), N adalah kepadatan rata-rata (ind/m2), sedangkan
∆W adalah pertambahan biomassa individu (gram) dan t menggambarkan waktu
pengambilan contoh produktivitas. Produktivitas sekunder yang dihitung hanya untuk genus paling dominan yang ditemukan.
3
HASIL DAN PEMBAHASAN
Hasil
Kondisi sekitar dan kualitas air di Danau Sipin dan Danau Teluk
Danau Sipin dan Danau Teluk merupakan danau yang terletak di Provinsi Jambi. Sungai Batanghari menjadi sumber air kedua danau tersebut (Lampiran 1). Danau Sipin berbentuk seperti tapal kuda atau yang biasa disebut oxbow lake sedangkan Danau Teluk berbentuk membulat agak menjari. Keduanya merupakan danau alami yang sama-sama dimanfaatkan sebagai lokasi kegiatan penangkapan ikan. Namun Danau Sipin juga dimanfaatkan sebagai lokasi wisata dan sarana transportasi air. Selain itu, selama penelitian sedang dilakukan proses pemasangan bronjong sebagai turap di sekitar Danau Sipin (Lampiran 2) dengan meratakan dan menimbun area sempadan danau.
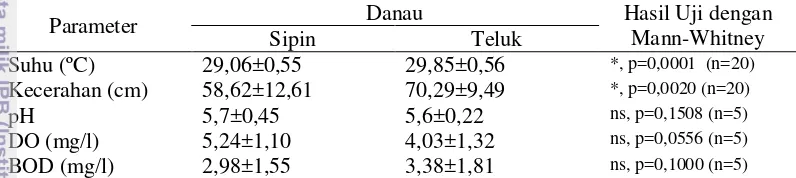
11 Parameter pH, DO dan BOD di kedua danau lokasi penelitian menunjukkan perbedaan yang tidak signifikan berdasarkan uji beda statistika. Hal ini menggambarkan kesamaan kondisi kualitas air di Danau Sipin dan Danau Teluk berdasarkan ketiga parameter tesebut. Parameter kualitas air yang berbeda secara signifikan pada kedua danau lokasi penelitian adalah parameter kecerahan (p=0,0020). Kecerahan rata-rata yang terukur di Danau Sipin adalah 58,62 cm. Nilai tersebut jauh lebih rendah dibandingkan nilai rata-rata kecerahan pada Danau Teluk yaitu sebesar 70,29 cm. Kedalaman menunjukkan rata-rata yang sama yaitu 2,38 m, hal ini disebabkan pemasangan alat diatur pada lokasi dengan kedalaman yang hampir sama.
Kelimpahan dan struktur komunitas larva chironomid di Danau Sipin dan Danau Teluk
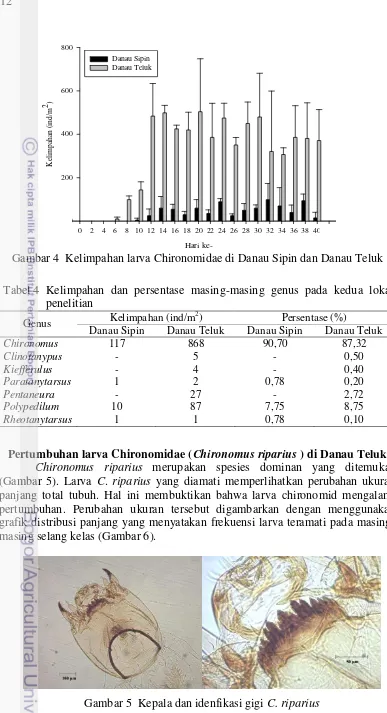
Uji-t statistika menunjukkan bahwa kelimpahan rata-rata larva chironomid di Danau Sipin dan Danau Teluk berbeda secara signifikan (p=7,96x10-8). Kelimpahan larva chironomid setiap pengambilan contoh ditunjukkan pada Gambar 4. Kelimpahan rata-rata larva Chironomid pada Danau Sipin selama 40 hari penelitian sebesar 51 ekor/m2, sedangkan Danau Teluk sebesar 361 ekor/m2. Gambar 4 menunjukkan variasi kelimpahan pada setiap pengambilan contoh. Diagram batang tersebut menggambarkan bahwa kelimpahan larva chironomid pada setiap pengambilan contoh lebih besar di Danau Teluk dibanding Danau Sipin.
Berdasarkan hasil identifikasi, diperoleh 2 Sub famili larva Chironomidae yaitu Chironominae dan Tanypodinae. Sub famili Chironominae terdiri dari Chironomus, Kiefferulus, Polypedilum, Rheotanytarsus dan Paratanytarsus sedangkan Sub famili Tanypodinae yang ditemukan adalah Pentaneura dan Clinotanypus. Seluruh genus tersebut ditemukan di Danau Teluk, sementara di Danau Sipin hanya ditemukan empat genus yaitu Chironomus, Polypedilum, Paratanytarsus dan Rheotanytarsus. Tabel 4 menunjukkan kelimpahan masing-masing genus larva chironomid yang ditemukan. Chironomus merupakan genus larva dominan yang ditemukan di Danau Sipin maupun Danau Teluk dengan persentase berturut-turut 90,70% dan 87,32%.
Tabel 3 Parameter kualitas air dan uji statistika untuk melihat perbedaan kondisi kedua danau yang diteliti
Parameter Danau Hasil Uji dengan
Mann-Whitney Sipin Teluk
Suhu (ºC) 29,06±0,55 29,85±0,56 *, p=0,0001 (n=20)
Kecerahan (cm) 58,62±12,61 70,29±9,49 *, p=0,0020 (n=20)
pH 5,7±0,45 5,6±0,22 ns, p=0,1508 (n=5)
DO (mg/l) 5,24±1,10 4,03±1,32 ns, p=0,0556 (n=5)
12
Gambar 4 Kelimpahan larva Chironomidae di Danau Sipin dan Danau Teluk
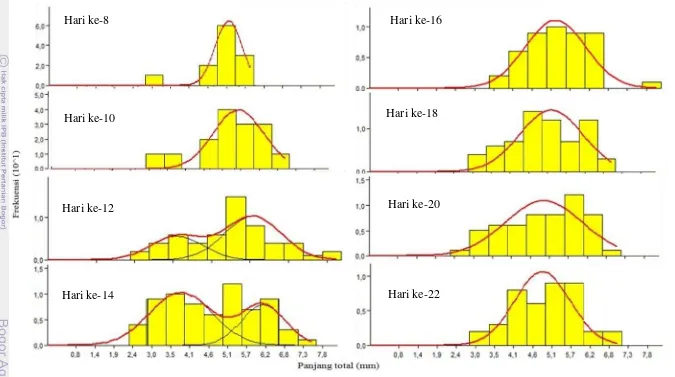
Pertumbuhan larva Chironomidae (Chironomus riparius ) di Danau Teluk
Chironomus riparius merupakan spesies dominan yang ditemukan (Gambar 5). Larva C. riparius yang diamati memperlihatkan perubahan ukuran panjang total tubuh. Hal ini membuktikan bahwa larva chironomid mengalami pertumbuhan. Perubahan ukuran tersebut digambarkan dengan menggunakan grafik distribusi panjang yang menyatakan frekuensi larva teramati pada masing-masing selang kelas (Gambar 6).
Gambar 5 Kepala dan idenfikasi gigi C. riparius
Tabel 4 Kelimpahan dan persentase masing-masing genus pada kedua lokasi penelitian
Genus Kelimpahan (ind/m
2
) Persentase (%)
Danau Sipin Danau Teluk Danau Sipin Danau Teluk
13
Hari ke-8
Hari ke-10 Hari ke-18
Hari ke-12 Hari ke-20
Hari ke-22 Hari ke-14
Hari ke-16 Hari ke-8
14
15
Analisis pertumbuhan yang digunakan dalam penelitian ini adalah metode NORMSEP (Normal Separation). C. riparius diklasifikasikan menjadi beberapa selang kelas panjang dan diolah menjadi grafik distribusi panjang dengan piranti lunak FISAT II. Gambar 6 menunjukkan kurva pertumbuhan larva C. riparius.
Berdasarkan Gambar 6 diketahui bahwa terjadi pergeseran nilai modus setiap interval waktu penelitian. Hal ini dapat dilihat dari pergeseran garis merah ke arah kanan. Pergeseran garis merah ke arah kanan menggambarkan terjadinya perubahan nilai modus setiap interval waktu penelitian. Berdasarkan metode ini dapat dijelaskan bahwa pertumbuhan panjang larva chironomid cukup signifikan dilihat dari perubahan nilai modus yang terjadi. Sementara itu, pertumbuhan larva chironomid di Danau Sipin tidak bisa dinyatakan dalam grafik distribusi frekuensi panjang total. Hal ini dikarenakan jumlah organisme yang ditemukan pada masing-masing pengambilan contoh tidak mencukupi dalam pembuatan kurva normal untuk melihat pergeseran modus.
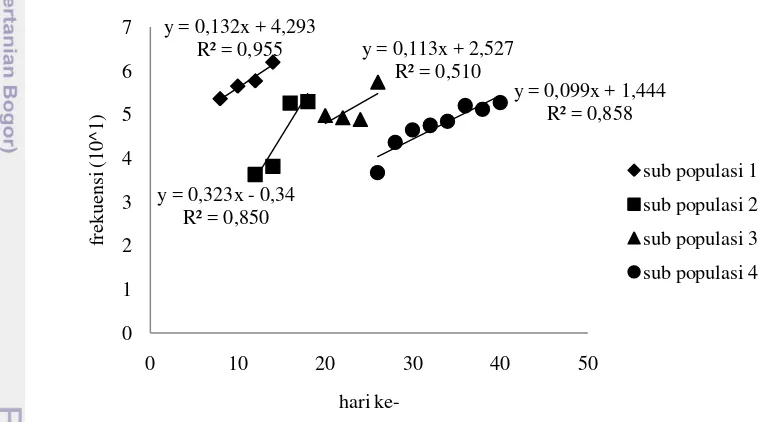
Pergeseran modus ke arah kanan menggambarkan bahwa lingkungan perairan di Danau Teluk mendukung pertumbuhan larva C. riparius. Selama 40 hari waktu penelitian dengan frekuensi pengambilan contoh setiap 2 hari terdapat 5 kelompok pergeseran modus. Masing-masing kelompok pergeseran modus menunjukkan satu siklus hidup larva chironomid. Gambar 6 memperlihatkan kurva regresi masing-masing kelompok pergeseran modus larva C. riparius.
Pengelompokan larva C. riparius pada danau berbeda berdasarkan instar
Larva chironomid memiliki tubuh yang beruas-ruas. Bagian anterior berupa kepala mengeras membentuk kapsul. Kapsul kepala dari larva chironomid terbuat dari zat kitin sehingga untuk setiap instar (stadia antar pergantian kulit), kapsul kepala ini akan mengalami pergantian kulit (molting) (Epler 2001). Oleh karena itu ukuran kapsul kepala dapat dijadikan dasar dalam pengelompokkan larva chironomid berdasarkan instar. Berdasarkan pengelompokkan instar, pada Danau Sipin dan Danau Teluk terbagi menjadi 2 kelompok (Gambar 7). Pengelompokan larva ini didasarkan pada penelitian Klemm 2001. Penelitian
y = 0,132x + 4,293
16
menunjukkan bahwa larva C. riparius yang diperoleh mengelompok menjadi instar III dan instar IV.
Produktivitas sekunder C. riparius pada danau berbeda
Produktivitas sekunder menggambarkan pertambahan biomassa populasi organisme heterotrof di suatu lokasi pada waktu tertentu. Produktivitas sekunder dapat diduga berdasarkan populasi dari umur yang sama (kohort), namun untuk penelitian langsung di lapangan, kohort sulit dipisahkan. Oleh karena itu digunakan metode distribusi frekuensi ukuran. Berdasarkan hasil perhitungan produktivitas sekunder C. riparius, Danau Teluk memiliki nilai produktivitas sekunder yang lebih besar dibandingkan Danau Sipin (Tabel 5).
Tabel 5 Produktivitas sekunder Danau Sipin dan Danau Teluk
Nilai produktivitas sekunder dipengaruhi oleh kondisi lingkungan terutama ketersediaan makanan. Tabel 5 menunjukkan nilai rata-rata bobot larva C. riparius di Danau Teluk (1,40 mg) lebih besar dibandingkan Danau Sipin (0,63 mg). Bobot rata-rata tersebut berbanding lurus dengan biomassa sehingga dapat dilihat pada tabel bahwa biomassa larva di Danau Teluk 10 kali lipat biomassa larva di Danau Sipin yaitu sebesar 1,06 g/m2. Demikian pula dengan produktivitas sekunder. Nilai produkivitas sekunder di Danau Teluk yang diperoleh menunjukkan nilai 18 kali lipat dibandingkan Danau Sipin. Hasil ini menggambarkan bahwa keadaan lingkungan di Danau Teluk lebih mendukung kehidupan larva chironomid. Tabel 6 memperlihatkan perbandingan nilai produktivitas sekunder dari penelitian di beberapa daerah tropis.
Lokasi
Danau Sipin Danau Teluk
Jumlah selang kelas 8 11
Rata-rata densitas (ind/m2) 22 118 Rata-rata bobot (mg) 0,63 1,40
Biomassa (g/m2) 0,10 1,06
Produktivitas (g/m2/tahun) 0,25 4,50
P/B kohort 2,5 4,3
P/B tahunan 5,91 10,24
Gambar 8 Pengelompokan larva Chironomus riparius berdasarkan instar
17 Nilai produktivitas sekunder larva chironomid terutama yang berasal dari subfamili Chironominae berkisar dari 0,25 – 9,89 g/m2/tahun. Produktivitas yang tinggi diperoleh pada lokasi perairan dengan kandungan bahan organik tinggi seperti daerah KJA (9,89 g/m2/tahun) dan lahan gambut (11,3 g/m2/tahun).
Pembahasan
Pengukuran parameter fisika-kimia perairan menggambarkan bahwa Danau Sipin dan Danau Teluk memiliki kondisi yang relatif sama berdasarkan beberapa parameter kualitas air. Parameter lingkungan yang menunjukkan perbedaan yang signifikan adalah kecerahan. Kecerahan yang terukur di Danau Sipin jauh lebih rendah dibandingkan kecerahan di Danau Teluk. Rendahnya nilai kecerahan secara tidak langsung dipengaruhi oleh kurangnya tutupan hijau (pepohonan) pada area sempadan danau. Hal ini menyebabkan tingginya tingkat erosi sehingga meningkatkan masukan tanah permukaan ke danau. Aliran run-off yang membawa tanah dan endapan dari darat meningkatkan nilai kekeruhan. Kekeruhan secara langsung mempengaruhi proses respirasi organisme akuatik termasuk larva chironomid. Menurut Dunlop et al. (2005), terdapat beberapa penelitian yang membuktikan pengaruh kekeruhan terhadap komunitas avertebrata. Penelitian oleh Quinn et al. (1992) in Dunlop et al. membuktikan bahwa kelimpahan avertebrata akibat sedimentasi dengan nilai kekeruhan ±145 NTU menyebabkan penurunan kelimpahan di lokasi penelitian mulai dari 9% hingga 45%. Berdasarkan penelitian yang dilakukan oleh Zuazo (2011), disimpulkan bahwa penggunaan tutupan tanaman menjadi rekomendasi untuk menurunkan tingkat erosi dan risiko pencemaran. Tutupan tanaman yang kurang menyebabkan lahan di sekitar danau mudah tergerus aliran air permukaan. Tanah yang masuk dari daratan di sekitar danau merupakan bagian dari padatan total tersuspensi yang menyebabkan turunnya intensitas cahaya yang masuk ke badan air.
Parameter warna perairan yang diukur secara visual juga menunjukkan perbedaan. Warna perairan Danau Sipin cenderung putih keruh hingga kekuningan, sedangkan Danau Teluk menunjukkan warna hijau hingga hijau gelap. Parameter kecerahan, tutupan lahan hijau, dan warna perairan menyebabkan perbedaan kelimpahan larva chironomid di kedua danau tersebut. Kecerahan yang tinggi berkaitan dengan ketersediaan oksigen terlarut dan kondisi perairan yang lebih nyaman bagi kehidupan larva (Bhatnagar & Devi 2013). Nilai kecerahan yang tinggi mendukung proses fotosintesis menjadi lebih optimal. Tabel 6 Perbandingan produktivitas sekunder beberapa perairan berbeda
Organisme Produktivitas Sumber Lokasi
Polypedilum 9,89 g/m2/tahun (KJA)
1,90 g/m2/tahun (non-KJA)
Krisanti 2012 D. Lido, Indonesia
Polypedilum Rheocricotopus
11,3 g/m2/tahun 9,8 g/m2/tahun
Benke 1998 S. Ogeechee, USA (lahan gambut)
18
Kecerahan berkaitan dengan intensitas cahaya yang mampu menembus badan air. Menurut Ryther (1956), cahaya akan selalu menjadi pembatas pada proses fotosintesis populasi plankton. Darchambeau et al. (2014) menyatakan bahwa pada musim kering dengan kedalaman eufotik lebih besar dibandingkan musim penghujan menyebabkan perbedaan biomassa fitoplankton yang diperoleh. Biomassa fitoplankton mencapai puncaknya pada musim kering. Hal ini dipengaruhi oleh intensitas cahaya yang cukup untuk proses fotosintesis pada fitoplankton. Plankton dan perifiton juga merupakan makanan bagi larva chironomid terutama chironomid jenis predator (Pinder 1986).
Danau Teluk memiliki rata-rata kecerahan lebih tinggi sehingga menjadi habitat yang lebih cocok bagi larva chironomid. Berdasarkan perhitungan kelimpahan diketahui bahwa kelimpahan rata-rata maupun kelimpahan harian larva chironomid di Danau Teluk lebih tinggi dibandingkan Danau Sipin. Hal ini juga disebabkan karena kondisi habitat di sekitar Danau Teluk lebih mendukung untuk kehidupan larva maupun serangga dewasa chironomid. Tutupan vegetasi tumbuhan di sekitar danau dijadikan tempat memijah (mating) oleh serangga dewasa. Persentase lahan hijau yang lebih tinggi di Danau Teluk juga ikut mendukung tingginya kelimpahan larva chironomid di danau tersebut. Di samping itu, tumbuhan dapat menjadi sumber nektar sebagai makanan chironomid dewasa (komunikasi pribadi) meskipun sebagian besar genus chironomid tidak membutuhkan makanan saat fase dewasa (Houseman 2015).
Kelimpahan larva juga berkaitan dengan preferensi indukan (serangga dewasa) dalam memilih tempat peneluran (oviposition). Preferensi serangga betina chironomid dalam meletakkan telur tidak berkaitan dengan organ pembau (olfaktori), namun berkaitan dengan organ visual. Serangga dewasa melakukan pemijahan saat senja (Armitage et al. 1995). Setelah proses pemijahan, serangga jantan akan mati dan serangga betina akan meletakkan telur di permukaan air. Telur yang dihasilkan berbentuk massa telur berjumlah ratusan hingga ribuan dan terbungkus gelatin bening. Meltser et al. 2008 in Lerner et al. (2008) menyatakan bahwa serangga betina tidak meletakan telurnya secara acak, melainkan memilih permukaan air yang memiliki lebih banyak substrat untuk tempat meletakan telur seperti tumbuhan air atau benda mengapung lain (Halpern et al. 2003). Berdasarkan penelitian yang dilakukan oleh Lerner et al. (2008), diketahui bahwa chironomid betina memiliki preferensi peletakan telur pada perairan yang cenderung berwarna hijau (panjang gelombang 490 – 510 nm). Preferensi ini juga berkaitan dengan kesukaan serangga pada area yang lebih terang. Berdasarkan penelitian yang dilakukan oleh Frouz (1997) diketahui bahwa kelimpahan larva Chironomidae maupun Chironomidae dewasa jenis terestrial lebih tinggi pada habitat yang memiliki vegetasi terutama vegetasi yang cenderung terbuka dan rendah (semak). Area dengan vegetasi tersebut dijadikan sebagai tempat memijah serangga dewasa. Hal ini sesuai dengan hasil penelitian bahwa kelimpahan larva chironomid lebih tinggi ditemukan pada Danau Teluk yang memiliki lebih banyak vegetasi di sekitar danau sebagai lahan hijau.
19 menyatakan bahwa subfamili Chironominae merupakan subfamili yang paling melimpah di alam. Chironominae dapat ditemukan hampir di semua habitat perairan mulai dari air tawar, payau hingga air laut. Sebagian besar larva dilengkapi oleh tubes atau „rumah‟ yang berfungsi sebagai pelindung tempat tinggal dan pelindung dari serangan predator. Larva Chironominae (terutama Chironomus) memiliki haemoglobin (Hb) yang memberi warna merah pada tubuh larva dan kemampuan untuk hidup pada kondisi perairan dengan kadar oksigen rendah. Genus tersebut sangat toleran terhadap kondisi lingkungan yang kurang baik. Chironomus memiliki kemampuan adaptasi karena dilengkapi oleh Hb (Epler 2001). Genus Chironomus seringkali ditemukan sebagai genus dominan dalam beberapa penelitian seperti penelitian yang dilakukan oleh Silva et al. (2008) di sistem perairan mengalir di Brazil.
Berdasarkan pengelompokan instar, larva Chironomus yang ditemukan hanya terdiri dari instar III dan IV. Hal ini disebabkan karena pada fase instar I larva chironomid masih bersifat planktonik. Fase instar II berukuran sangat kecil (kurang dari 3 mm) (Klemm 2001) sehingga dengan mudah dipredasi oleh juvenil ikan maupun invertebrata lain. Larva Chironomus yang ditemukan di Danau Teluk juga menunjukkan pertumbuhan yang signifikan. Hal ini digambarkan oleh pergeseran nilai modus pada kurva distribusi frekuensi panjang total ke arah kanan. Selama penelitian diperoleh lima kelompok pergeseran modus. Masing-masing kelompok menunjukkan satu siklus instar III dan instar IV larva Chironomus. Setiap kelompok pergeseran modus menggambarkan bahwa rata-rata satu siklus instar III dan instar IV larva Chironomus berlangsung selama ±9 hari.
Kondisi lingkungan berbanding lurus dengan data perbandingan kelimpahan larva yang ditemukan. Kelimpahan larva yang lebih tinggi di Danau Teluk menghasilkan biomassa yang lebih besar. Ketersediaan biomassa yang lebih besar dan ditunjukkan oleh tingginya produktivitas sekunder menggambarkan ketersedian nutrisi tingkat trofik selanjutnya yang lebih banyak di Danau Teluk dibandingkan Danau Sipin. Penyebab utama produktivitas sekunder di Danau Teluk lebih tinggi dibandingkan Danau Sipin adalah pengaruh kegiatan antropogenik yang lebih besar di Danau Sipin sehingga menyebabkan penurunan kualitas lahan maupun kualitas air.
20
4
SIMPULAN DAN SARAN
Simpulan
Spesies dominan yang ditemukan baik di Danau Sipin maupun Danau Teluk adalah C. riparius. Larva C. riparius menunjukkan pertumbuhan yang signifikan selama penelitian dilaksanakan. Berdasarkan penelitian dapat disimpulkan bahwa kelimpahan larva chironomid di Danau Teluk lebih tinggi dibandingkan Danau Sipin. Perhitungan produktivitas sekunder juga menunjukkan nilai produktivitas yang lebih tinggi di Danau Teluk. Produktivitas yang lebih tinggi menggambarkan kondisi perairan Danau Teluk merupakan habitat yang lebih sesuai untuk larva chironomid dibandingkan Danau Sipin sehingga mampu menyediakan biomassa larva chironomid yang lebih besar untuk tingkat trofik selanjutnya.
Saran
Penelitian selanjutnya diharapkan dapat mengintegrasikan produktivitas sekunder larva chironomid dengan tingkat trofik selanjutnya yaitu ikan dan invertebrata lain. Parameter kualitas air juga diharapkan dapat diperluas terutama parameter-parameter penanda pencemaran. Hal ini dapat digunakan untuk menjelaskan proses yang terjadi dalam rantai makanan serta mengkuantifikasi besarannya. Di samping itu, metode peletakan substrat buatan dan pengukuran morfologi larva chironomid juga disesuaikan dengan kebutuhan penelitian. Data tersebut menjadi dasar pengelolaan danau berbasis ekologi.
DAFTAR PUSTAKA
Arimoro FO, Ikomi RB, Iwegbue CMA. 2007. Water quality changes in relation to diptera community patterns and diversity measured at an organic effluent ampacted stream in the Niger Delta, Nigeria. Ecological Indicators. 7: 541-552.
Armitage PD, Cranston PS, Pinder LCV. 1995. The Chironomidae: The Biology and Ecology of Non-Biting Midges. London. Chapman & Hall.
Bay EC. 2003. Chironomida Midges. Washington State University. USA.
Benke AC. 1998. Production dynamics of riverine chironomids: Extremely high biomass turnover rates of primary consumers. Ecology. 79(4): 899-910. Benke AC, Huryn AD. 2007. Secondary production of macroinvertebrates. dalam
Hauer FR and Lamberti GA (EDS) Methods in Stream Ecology. 2nd Edition. Elsevier Inc. Amsterdam p. 691-710.
21 Biasi C, Tonin AM, Restello RM, Hepp LU. 2013. The colonisation of leaf litter by Chironomidae (Diptera): the influence of chemical quality and exposure duration in a subtropical stream. Limnologica. 43: 427-433. Carew ME, Pettigrove V, and Hoffmann AA. 2003. Identifying Chironomidas
(Diptera: Chironomidae) for Biological Monitoring with PCR-RFLP. Bulletin of Entomological Research. Australia.
Darchambeau F, Sarmento H, Descy JP. 2014. Primary production in a tropical large lake: The role of phytoplankton composition. Science of the total environment. 473-474: 178-188.
Dunlop J. McGregor G, Horrigan N. 2005. Characterisation of impacts and a discussion of regional target setting for riverine ecosystems in Queensland. Aquatic Ecosystem Health Unit Water Quality and Monitoring Natural Resources Sciences Queensland Departement of Natural Resources and Mines. The State of Queensland.
Entrekin SA, Wallace JB, Eggert SL. 2007. The response of Chironomidae (Diptera) to a long-term exclusion of terrestrial organic matter. Hydrobiologia. 575: 401-413.
Epler JH. 2001. Identification manual for the larval Chironomidae (Diptera) of north and south Carolina. North Carolina Department of environment and natural resources. Division of Water Quality. Crawfordville.
Farhani SA. 2012. Perkembangan dan pertumbuhan larva Chironomus sp pada level bahan organik berbeda dalam skala laboraorium [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Frouz J. 1997. The effect of vegetation patterns on oviposition habitat preference: a driving mechanism in terrestrial chironomid (Diptera: Chironomidae) succession? Researches Population Ecology. 39(20): 207-213.
Habashy MM. 2005. Culture of chironomid larvae (insecta-diptera-Chironomidae) under different feeding systems. Egyptian Journal of Aquatic Research. 31(2): 403-418.
Halpern M, Gasith A, Broza M. 2002. Does the tube of a benthic chironomida larva play a role in protecting its dweller against chemical toxicants?. Departement of Biology, University of Haifa. Israel.
Halpern M, Broza YB, Mittler S, Arakawa E, Broza M. 2003. Chironomid egg masses as a natural reservoir of Vibrio cholerae non-01 and non-0139 in freshwater habitats. 47: 341-349. Microbial Ecology.
Heinrich ML, Barnekov L, Rosenberg S. 2006. A comparison of chironomid biostratigraphy from Lake Vuolep Njakajaure with vegetation, lake-level, and climate changes in Abisko National Park, Sweden. Journal of Paleolimnology. 36: 119-131.
Houseman. 2015. Chironomid midges. [Internet]; [diunduh 9 Juli 2015 ]. Tersedia pada: http://extension.missouri.edu/explorepdf/agguides/pests/g07402. pdf Kikuchi M, Sasa M. 1990. Studies on the chironomid midges (Diptera,
Chironomidae) of the Lake Toba area, Sumatra, Indonesia. The Japan Society of Medical Entomology and Zoology. 41(4): 291-329.
22
Klemm. 2001. Chironomidas (Diptera, Nematocera) of Temporary Pools – an Ecological Case Study [disertasi]. Universitast Marburg. Philipps.
Krebs CJ. 1972. The experimental analysis of distribution and abundance. Harper and Row Publisher, Inc. New York. USA. 694 p.
Krisanti M. 2012. Produktivitas larva Chironomidae pada substrat buatan di kedalaman perairan dan kandungan bahan organik berbeda [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Kvanli AH. 1988. Statistic: A computer integrated approach. West Publishing Company. USA.
Lerner A, Meltser N, Sapir N, Erlick C, Shashar N, Broza M. 2008. Reflected polarization guides chironomid females to oviposition sites. The Journal of Experimental Biology. 211(22): 3536-3543.
Lohlein Boris. 1999. Assessment of secondary production of Naididae (Oligochaeta): an example from a North German Lake. Hydrobiologia 406: 191-198.
Odum EP. 1971. Fundamentals of ecology. WB Saunders Company. Philadephia. 574 p.
Odume ON, Muller WJ. 2011. Diversity and structure of Chironomidae communities in relation too water quality differences in the Swartkops River. Aquaculture. 36: 929-938.
Ozkan N, Moubayed-Breil J, Camur-Elipek B. 2010. Ecological analysis of chironomid larvae (Diptera, Chironomidae) in Ergene River Basion (Turkush Thrace). Turkish Journal of Fisheries and Aquatic Sciences. 10: 93-99.
Pinder LCV. 1986. Biology of freshwater Chironomidae. Annual Review of Entomology, 31: 1-23.
Ramirez A, Pringle CM. 2006. Fast growth and turnover of chironomid assemblages in response to stream phosphorus levels in a tropical lowland landscape. Limnology and Oceanography. 51(1): 189-196.
Ree HI. 2012. Eight new and four newly recorded species of Chironomidae (Insecta: Diptera) from Korea. Animal Systematics, Evolution and Diversity. 28(4): 241-260.
Ryther JH. 1956. Photosynthesis in the ocean as a function of light. Lymnology and Oceanography. 1(1): 61-70.
Sahandi J. 2011. Natural food production for aquaculture: cultivation and nutrition of chironomid larvae (insecta, diptera). AES Bioflux. 3(3): 268-271.
Sanseverino AM, Nessimian JL. 2008. The food of larval chironomidae (insecta, diptera) in submerged litter in a forest stream of the Atlantic Forest (Rio de Janeiro, Brazil). Acta Limnologica Brasiliensia. 22(1): 23-24.
Saputra D. 2015. Bronjong Danau Sipin Jambi Ambruk. [Internet]: [diunduh 2015 Juni]. www.AntaraJambi.com/Berita/306036/bronjong-danau-sipin-jambi-ambruk.
Senderovich Y, Halpern M. 2012. Bacterial community composition associated with chironomid egg masses. Journal of Insect Sciences. 12(49):1-14. Silva FL, Ruiz SS, Bochino GL, Moreira DC. 2008. Functional feeding habits of
23 Smit H, Dudok van Heel E, Wiersma S. 1993. Biovolume as tool in biomass determination of Oligochaeta and Chironomidae. Freshwater Biology. 29: 37-46.
Sparre P&Venema SC. 1999.Introduksi pengkajian stok ikan tropis.FAO.
Tumbiolo ML & Dawning JA. 1994. An empirical model for the prediction of secondary production in marine benthic invertebrate populations. Marine ecology progress series 114: 165-174.
Walpole RE. 1992. Pengantar statistika edisi ke-3. Gramedia Pustaka Utama. Jakarta. 512.
Walther DA, Whiles MR, Flinn MB, Butler DW. 2006. Assemblage-level estimation of nontanypodinae chironomid growth and production in a southern Illinois stream. Journal of The North American Benthological Society. 25(2): 444-452.
Wardiatno Y, Krisanti M. 2013. The vertical dynamics of larval chironomids on artificial substrates in Lake Lido (Bogor, Indonesia). Tropical Life Sciences Research. 24(2): 13-29.
Wilhm JL. 1975. Biological Indicator of Pollution. Blackwell Scientific Publications. Oxford. p. 375-402.
Yulintine, Wulandari L, Septiani T, Trisliana, Yurenfrie, Welsiana S, Limin SH, Jauhiainen J, Vassander H, Haraguchi A. 2014. Density and biomass of chironomid larvae in a peat channel in Central Kalimantan, Indonesia. [Internet]; [diunduh 2014 November]. Tersedia pada: http://www.geog.le.ac.uk/carbopeat/media/pdf/yogyapapers/p56.pdf Zilli FL. Montalto L, Paggi A, Merchese C. 2008. Biometry and life cycle of
chironomus calligraphus Goeldi 1905 (Diptera, Chironomidae) in laboratory conditions. Association Interciencia. 33: 767-770.
24
Lampiran 1 Peta satelit kondisi tutupan lahan hijau di sekitar danau lokasi penelitian
25
RIWAYAT HIDUP
Penulis lahir di Kota Jambi pada tanggal 1 Juni 1989, merupakan putri pertama dari pasangan suami istri Alm. Bapak Marzuki Nurdin dan Ibu Zuleha Sy. Penulis menamatkan program sarjananya di Departemen Manajemen Sumberdaya Perairan, Institut Pertanian Bogor (IPB) pada tahun 2012 kemudian melanjutkan studi pascasarjana S2 di IPB Program Studi Pengelolaan Sumberdaya Perairan pada tahun 2012. Sebuah karya ilmiah yang merupakan bagian dari tesis Penulis telah diterbitkan pada Jurnal Ilmu-ilmu Pertanian Indonesia tahun 2014 dengan