Sintasan dan Pertumbuhan Larva Kepiting Bakau (Scylla paramamosain) Zoea 2
Sampai Zoea 5 Melalui Pemberian Jenis Bakteri Probiotik yang Berbeda
Survival Rate and Growth of Mud Crab Larvae (Scylla Paramamosain) Zoea 2 to 5 through Different Probiotic Addition
Soelkifli Saputra*), Moh Nuh Ibrahim **), dan Yusnaini ***) Program Studi Budidaya Perairan FPIK Universitas Halu Oleo
Kampus Hijau Bumi Tridharma Anduonohu Kendari 93232 E-mail: *[email protected], **@yahoo.co.id, *** @yahoo.co.id
Abstrak
Penelitian ini bertujuan untuk mengetahui sintasan dan pertumbuhan larva kepiting bakau (S. paramamosain) zoea 2 sampai zoea 5 melalui pemberian jenis probiotik yang berbeda. Penelitian dilakukan selama 1 bulan (Februari sampai Maret 2012) di Instalasi Penelitian Marana, Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP) Maros, Sulawesi Selatan. Penelitian menggunakan rancangan acak kelompok (RAK) dengan 3 perlakuan dan 3 ulangan. Jenis probiotok yang diuji cobakan yaitu A. Probiotik Nitrosomonas eutorpha (EM), B. Probiotik bacillus lichenhormis (BPPBAP), C. Probiotik nitrobacter (NB). Hasil penelitian menunjukkan bahwa pemberian probiotik yang berbeda berpengaruh nyata terhadap sintasan dan pertumbuhan larva kepiting bakau. Persentase sintasan larva kepiting bakau terbaik adalah pada perlakuan B Probiotik bacillus
lichenhormis (BPPBAP) dengan nilai sintasan sebesar 7,84 %; kemudian pada perlakuan C Probiotik nitrobacter
(NB) 4,31 %; perlakuan A Probiotik Nitrosomonas eutorpha (EM) 0,78 %. Pertumbuhan panjang karapaks larva kepiting bakau terbaik adalah pada perlakuan A Probiotik Nitrosomonas eutorpha (EM) dengan nilai sebesar 43,33 µm; kemudian pada perlakuan perlakuan B Probiotik bacillus lichenhormis (BPPBAP) 33,33 µm; perlakuan C Probiotik nitrobacter (NB) 20 µm. Pertumbuhan lebar karapaks larva kepiting bakau (S.
paramamosain) terbaik adalah pada perlakuan A (Probiotik EM) dengan nilai sebesar 37,67 µm; kemudian pada
perlakuan C Probiotik nitrobacter (NB) 29,33 µm; perlakuan B Probiotik bacillus lichenhormis (BPPBAP) 14,67 µm. Pengamatan kualitas air selama penelitian menunjukkan nilai kisaran yang mendukung kelangsungan hidup larva kepiting bakau, dimana suhu berada pada kisaran 29-31oC; nilai pH 7,3-8,2; oksigen terlarut 4,9-6,8
mg/l; salinitas pada kisaran 28-30 ppt; amoniak dengan kisaran 0,103-0,583 mg/l dan nitrit kisaran 0,015-4,722. Kata kunci : Sintasan, pertumbuhan, probiotik, Scylla Paramamosain
Abstract
This study aimed to determine the survival rate and growth of mud crab larvae (Scylla paramamosain) zoea 2 to 5 through the addition of different probiotics. This research was conducted on February-March 2012 in Intstallation of Marana Research, Central of Brackish Water Aquaculture of Maros, South Sulawesi. This research used Complete Randomized Block Design (CRBD) with 3 treatments and 3 replications. The probiotics types tested were A A. Probiotik Nitrosomonas eutorpha (EM), B. Probiotik bacillus lichenhormis (BPPBAP), and C Probiotics nitrobacter (NB). Results showed that different probiotic had significantly response on the survival rate and the growth of mud crab larvae. The best survival rate percentage was in treatment B i.e. probiotics Bacillus lichenhormis (BPPBAP) with survival rate reaching 7,87%; followed by treatment C probiotics nitrobacter (NB) 4,31 %; while the lowest survival rate was in treatment A i.e probiotics
Nitrosomonas eutorpha (EM) reaching 0,78%. The highest absolute growth of long carapace of mud crab larvae
was in treatment A, probiotics Nitrosomonas eutorpha (EM) with reaching 43,33 µm; followed by treatment B, probiotics Bacillus lichenhormis (BPPBAP) 33,33 µm; while the lowest was in treatment C, probiotics
nitrobacter (NB) 20 µm. The highest growth of width carapace was in treatment A, probiotics Nitrosomonas eutorpha (EM) with reaching 37,67 µm; followed by treatment C probiotics nitrobacter (NB) 29,33 µm; and
while the lowest was in treatment B probiotics Bacillus lichenhormis (BPPBAP) 14,67 µm. Observations of water quality throughout the study supported the survival of mud crab larvae, i.e. temperature ranged 29-31oC;
pH ranged 7,3-8,2; dissolved oxygen ranged 4,9-6,8 mg/l; salinity ranged 28-30 ppt; ammonia ranged 0,103- 0,583 mg/l and nitrite ranged 0,015-4,722 mg/l.
Keywords : Survival rate, growth, probiotics, Scylla Paramamosain
Pendahuluan
Kepiting bakau termasuk satu diantara komoditas perikanan bernilai ekonomis penting di wilayah Indo-Pasifik. Kepiting bakau dikenal sebagai salah satu sumber pangan yang memiliki nilai gizi cukup tinggi yakni mengandung berbagai nutrien penting dan potensial untuk dibudidayakan. Berkembangnya pangsa pasar kepiting bakau baik di dalam maupun di luar negeri merupakan tantangan untuk meningkatkan produksi secara berkesinambungan (Catacutan, 2002).
Kebutuhan ekspor kepiting bakau selama ini masih mengandalkan hasil penangkapan di hutan bakau, akibatnya produktifitas dan kontinuitasnya tidak menentu dari waktu ke waktu sehingga perlu suatu upaya alternatif. Untuk memenuhi kebutuhan ekspor yang terus meningkat, maka peningkatan produksi kepiting bakau hanya mungkin dilakukan melalui usaha budidaya (Direktorat Jenderal Perikanan, 1992). Untuk mengatasi hal tersebut adalah perlu di kembangkan usaha pembenihan dan pembesaran kepiting bakau. Kendala yang dihadapi selama ini adalah masih rendahnya presentase sintasan pada benih yang dihasilkan dan belum ada teknologi pembenihan kepiting bakau yang mudah diaplikasikan.
Dari 4 spesies kepiting bakau yang terdapat di perairan Indonesia, Scylla paramamosain merupakan salah satu diantaranya yang potensial untuk dibudidayakan. Spesies ini banyak ditemukan di perairan pulau Jawa, Madura dan Bali. Dengan demikian, pengembangan kepiting ini dapat membawa konsekuensi terhadap peningkatan pendapatan petani tambak. Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP) Maros telah berhasil melakukan produksi massal benih kepiting bakau. Upaya pengontrolan lingkungan media pemeliharaan larva saat ini dilakukan secara biologis dengan memanfaatkan bakteri yang menguntungkan yaitu bakteri yang dapat menekan populasi mikroorganisme yang merugikan sebagai alternatif penggunaan antibiotik. Sebagai pengontrol biologis digunakan isolate bakteri yang mampu menekan populasi bakteri patogen dan memacu sistem pencernaan larva kepiting bakau (S. paramamosain).
Penggunaan desinfektan dan antibiotik pada organisme budidaya masih sering dilakukan oleh para petani tambak tanpa di sadari pemberian desinfektan dan antibiotik itu malah merugikan, dalam proses pembesaran maupun pembenihan (pemeliharaan larva) telah dianjurkan karena untuk tidak menggunakan
desinfektan atau antibiotik karena dapat mengurangi tingkat kelangsungan hidup pada larva itu sendiri. Sampai saat ini pengendalian penyakit dalam kegiatan budidaya ikan atau crustacea di Indonesia masih mengandalkan pada penggunaan desinfektan dan antibiotik meskipun tingkat keberhasilannya relative kecil (Balcázar dan Rojas-Luna, 2007). Penggunaan antibiotik yang tidak bijaksana telah meningkatkan kekhawatiran terhadap produk perikanan dan kesehatan manusia.
Astin dan Austin (1999) menyatakan, diantara strategi pengendalian penyakit pada budidaya perikanan yang banyak dilakukan dan memberikan hasil yang baik adalah melalui kontrol biologis, salah satunya adalah dengan aplikasi probiotik. Penerapan probiotik dalam usaha budidaya terbukti dapat meningkatkan resistensi biota yang dibudidayakan terhadap infeksi, karena itu penggunaan probiotik merupakan salah satu cara preventif yang dapat mengatasi penyakit. Tujuannya untuk memperbaiki dan mempertahankan lingkungan, menekan bakteri merugikan, menghasilkan enzim yang dapat membantu sistem pencernaan, menghasilkan nutrisi yang bermanfaat serta meningkatkan kekebalan organisme itu sendiri (Fahri, 2009).
Pribadi (2002) menyatakan bahwa pemberian probiotik juga dapat memperbaiki kualitas air, probiotik juga dapat mengatur kondisi mikrooganisme, meningkatkan keragaman mikroorganisme, meningkatkan kesehatan inang dengan menghambat atau meminimalisasikan efek bakteri pathogen. Jenis bakteri probiotik antara lain: Bacillus sp., Nitrosomonas eutorpha., Nitrobacter winogradskyi., Paracoccus pantotrophus., Bacillus megaterium., Bacillus licheniformis. Oleh karena itu penelitian mengenai sintasan dan pertumbuhan larva kepiting bakau (S. paramamosain) melalui pemberian jenis bakteri probiotik yang berbeda penting untuk dilakukan, dengan asumsi bahwa pemberian jenis bakteri probiotik yang berbeda terhadap larva kepiting bakau dapat meningkatkan sintasan, dan pertumbuhan, dan secara tidak langsung dapat mengoptimalkan konsentrasi kualitas air. Metode Penelitian
Penelitian ini dilaksanakan pada bulan Februari – Maret 2012 bertempat di Balai Penelitian dan Pengembangan Budidaya Air Payau (BPPBAP) Maros Sulawesi Selatan.
Alat dan bahan yang digunakan dalam penelitian ini dapat dilihat pada Tabel 1 berikut :
Tabel 1. Alat dan bahan beserta kegunaannya
No. Alat dan bahan Kegunaan
I. Alat
Galon Media pemeliharaan larva
Selang air Mengaliri air
Filter bag Menyaring air
Aerator/blower Menyuplai oksigen
Seser
Kamera Membersihkan kotoran Dokumentasi
Thermometer Mengukur suhu
Kertas pH Mengukur keasaman
Jangka sorong (mm) Mengukur panjang hewan uji
Timbangan analitik Menimbang berat hewan uji
Hand refraktometer Mengukur salinitas
pH meter Mengukur Ph
Ember dan gayung Membran dan Ozon
Wadah pakan Menyaring air II Bahan
Air Laut
Air tawar Media hidup larva kepiting bakau Mencuci peralatan yang digunakan
Probiotik Bahan penelitian
Pakan Artemia salina dan Branchionus plicitalis Pakan alami Larva kepiting bakau (S. paramamosain)
Induk kepiting Bakau (S. paramamosain) Hewan uji pada larva stadia 2 Sebelum penelitian dilakukan perlu
mempersiapkan wadah sebagai tempat pemeliharaan hewan uji, karena wadah pemeliharaan merupakan salah satu parameter kunci dalam usaha pembenihan kepiting bakau. Wadah penelitian yang digunakan yaitu galon, terlebih dahulu dicuci dengan rinso kemudian dibilas dengan air tawar, setelah itu dikeringkan. Setelah wadah benar-benar kering kemudian diisi dengan air yang telah disterilkan.
Calon induk yang digunakan pada penelitian ini adalah induk yang merupakan turunan pertama (F1). Kepiting yang diambil merupakan kepiting petelur (kepiting yang memiliki telur pada pleopod) dengan persyaratan panjang karapaks 15-20 cm dan berat 200-250 gr. Hal ini sesuai dengan pernyataan Kordi (2007), kepiting bakau sudah dapat dipijahkan pada umur 12-14 bulan dengan persyaratan panjang karapaks 150-200 mm dan berat 180-200 g. Kepiting bakau yang dipilih untuk calon induk harus sehat, nafsu makannya tinggi, dan tidak cacat. Ditambahkan oleh Kanna (2002), bahwa calon induk kepiting bakau yang baik memiliki sebagai berikut :
1. Calon induk kepiting sehat yang dicirikan dengan adanya reaksi yang cepat jika kaki jalan atau kaki renangnya di tarik dan mata yang aktif bergerak jika diganggu.
2. Calon induk kepiting tidak cacat (organ tubuhnya lengkap): bila kedua capitnya hilang sedangkan massa telurnya dalam kondisi baik, maka kesanggupan induk tersebut untuk menetaskan telurnya mengalami penurunan.
Bak pemeliharaan induk dapat berupa fiberglass yang berbentuk kerucut dengan menggunakan substrat pasir putih setebal 5 cm dan sistem air mengalir (resirkulasi). Ketinggian air dalam tangki berkisar 40-50 cm. Padat tebar induk dalam bak berkisar 2 ekor per m2. Pakan yang diberikan untuk induk yang siap memijah berupa ikan rucah, cumi-cumi, belut dan daging kerang-kerangan dengan perbandingan 1:1 dan dengan dosis 15% berat tubuh dengan tingkat kematangan gonad (TKG) I dan menurun sampai 5% pada TKG III atau menjelang pemijahan. Pakan induk diberikan 1 kali perhari pada pagi hari. Untuk menjaga kualitas air dilakukan pengontrolan setiap hari dengan mengangkat sisa pakan pada wadah pemeliharaan induk. Pemijahan induk kepiting bakau biasanya berlangsung 1–2 minggu setelah dipelihara dalam bak. Selama masa inkubasi induk kepiting tidak diberi makan hal ini untuk menjaga kebersihan lingkungan.
Selama pemeliharaan induk, dilakukan pengamatan terhadap ovary induk betina dengan cara melihat warna-warna ovary pada celah yang terdapat antara bagian karapaks dan abdomen. Celah tersebut dapat ditekan dengan jari tangan atau benda pipih. Menurut Kanna (2002), perkembangan ovary kepiting dapat di bedakan menjadi 4 tingkatan yang dapat diamati dari luar, yaitu sebagai berikut :
1. Tingkat I : belum matang (immatuting), yaitu belum ada tanda-tanda perkembangan telur pada calon induk.
2. Tingkat II : sedang dalam proses pematangan (matturing), yaitu perkembangan telur sudah
mulai terlihat penuh dan masih berada dalam tubuh kepiting
3. Tingkat III : matang (ripe) telur kepiting telah dibuahi dan diletakan pada abdomen (telah dikeluarkan). Pada saat baru dikeluarkan, telur berwarna kuning muda, telur ini akan mengalami perkembanan menjadi kuning tua, keabu-abuan, kehitam-hitaman, kemudian menetas.
4. Tingkat IV : salin (spent), yaitu tingkat terakhir dimana seluruh telur menetas sehingga ruang di bawah abdomen terlihat kosong.
Untuk memudahkan mengamati tingkat kematangan telur pada kepitng bakau, cukup memperhatikan perubahan warna pada telur kepiting tersebut dengan seksama yang masing-masing dicirikan pada warna ovari, yaitu tingkat I berwarna putih, tingkat II kekuning-kuningan sampai kuning kemerah-merahan, tingkat III orange, dan tingkat IV (tingkat akhir) berwarna merah cerah. Setelah tingkat kematangan ovari akhir, telur akan dikeluarkan dari ovary (pemijahan) dan pada saat bersamaan terjadi pembuahan, kepiting yang memijah ditandai
dengan menempelnya massa telur pada bagian abdomen.
Setelah memijah, kepiting mengerami telurnya 10–12 hari pada kondisi salinitas 28-35 ppt dan suhu air 27–30. Selama masa pengeraman, telur-telur mengalami perubahan warna yang dapat diamati secara langsung. Pengeraman dilakukan pada bak fiber glass berukuran 1 m x 0,5 m dengan padat tebar induk 1 ekor/bak. Jika dicampur maka bak pengeraman harus diberi sekat pemisah antara satu dan lainnya agar tidak saling mengganggu.
Induk kepiting yang sedang mengerami telur mengipas kaki renangnya secara teratur. Pada masa telur berada di abdomennya, Induk kepiting sering berenang dan sering berdiri pada kaki jalan. Hal ini dimaksudkan untuk memberikan aliran air yang berfungsi sebagai pengudara bagi telur yang dierami. Massa telur yang makin tua secara teratur juga sering digaruk dengan menggunakan kaki jalan. Pada saat pengeraman telur, sirkulasi air dilakukan secara nonstop 24 jam dan aerasinya selalu diperhatikan. Induk yang diinkubasi tidak diberi pakan.
Gambar 1. Induk kepiting bakau dan perubahan warna telur Pemeliharaan Larva
Sebelum air laut dimasukkan ke dalam bak pemeliharaan larva, air laut terlebih dahulu ditampung ke dalam bak penampungan yang telah dimurnikan dengan sinar ultraviolet (UV) lalu disaring dengan membran filter. Hal ini bertujuan agar air yang akan digunakan benar-benar steril. Setelah itu air laut ditreatment dengan klorin sebanyak 20 ppm, air didiamkan selama 24 jam. Setelah 24 jam air media kemudian diberikan thiosulfat sebanyak 40 ppm, dan dibiarkan selama 3-4 jam. Pemberian thiosulfat bertujuan untuk menetralkan kandungan klorin. Setelah air netral dari kandungan klorin, dengan ciri tidak berbau klorin, air media siap digunakan untuk proses pemeliharaan larva. Hal ini sesuai dengan pendapat Kanna (2002) dan Soim (1994), bahwa sebelum air laut digunakan terlebih dahulu harus disterilisasi dengan klorin 10 ppm selama 24 jam, selanjutnya ditambahkan Na-thiosulfal
dengan dosis 5 ppm untuk menetralkan klorin yang masih tersisa di dalam air laut.
1. Pemeliharaan Zoea
Larva kepiting bakau yang digunakan adalah stadia zoea 2 sampai mencapai zoea 5 dangan padat penebaran larva sebanyak 10 ekor/liter dalam media 17 liter air. Sebelum dilakukan penebaran pada media pemeliharaan, terlebih dahulu larva diadaptasikan dengan air media pemeliharaan, terutama suhu dan salinitas, agar tidak terjadi stress pada larva kepiting bakau. Pergantian air dilakukan mulai hari ke 5 sebanyak 10%.
2. Pemberian Pakan
Pakan yang digunakan pada penelitian ini adalah berupa Rotifera Brchionus pticatilis dan Artemia salina. Ukuran pakan larva yang digunakan disesuaikan dengan perkembangan ukuran mulut serta stadia larva. Pada zoea-2 sampai zoea-3 diberi pakan alami rotifer
Brachionus sp. dengan kepadatan 10–15 individu/L. larva stadia zoea 3 sampai zoea 5 diberikan pakan alami berupa naupli artemia salina dengan kepadatan 40-60 ekor/zoea. 3. Pemberian Probiotik
Pemberian probiotik dengan dosis 6 sel/liter dikultur dalam 1/2 liter air payau yang ditambahkan sukrosa sebanyak 2 gram dengan pengaerasian selama 12 jam. Pemberian probiotik dilakukan setiap dua hari sekali, dan diberi pada pagi hari.
Rancangan Percobaan
Rancangan percobaan yang digunakan berupa Rancangan Acak Kelompok (RAK) yang
terdiri dari 3 perlakuan dan 3 ulangan. Sebagai perlakuan dalam penelitian ini adalah pemberian jenis bakteri probiotik yang berbeda yaitu : - Perlakuan A : Pemberian probiotik jenis EM
dengan kandungan (Nitrosomonas eutorpha dan Nitrobacter winogradskyi);
- Perlakuan B : Pemberian probiotik jenis BPPBAP dengan kandungan (Bacillus licheniformis);
- Perlakuan C : Pemberian probiotik jenis NB dengan kandungan (Paracoccus pantotrophus dan Bacillus megaterium). Adapun sketsa penempatan wadah penelitian yang akan dilakukan sebagai berikut :
Gambar 2. Tata Letak Satuan Percobaan
Keterangan : A, B, C, : Perlakuan; 1, 2, 3, : Ulangan.
Variabel yang Diamati
Pada penelitian ini variabel yang diamati pada larva kepiting bakau (S. paramamosain) adalah sebagai berikut :
1. Sintasan
Sintasan larva kepiting bakau (S. paramamosain) dilakukan dengan cara
mengambil hewan uji kemudian dilakukan penyamplingan tiap wadah, adapun rumus yang dianjurkan oleh Effendi (1997) adalah sebagai berikut :
SR = 𝑁𝑡
𝑁𝑜 x 100% Dimana :
SR = Sintasan (%);
Nt = Jumlah individu pada akhir penelitian (ind);
No = Jumlah individu pada awal penelitian (ind). 2. Pertumbuhan Mutlak
Pertumbuhan mutlak larva kepiting bakau dilakukan dengan cara mengukur panjang
karapaks mulai dari dihitung dengan menggunakan rumus sebagai berikut:
∆CW = CW1 – CW0 Dimana :
∆CW = Pertumbuhan panjang/lebar karapaks (µm);
CW1 = Panjang/lebar karapaks rata-rata pada akhir penelitian (µm);
CW0 = Panjang/lebar karapaks rata-rata pada awal penelitian (µm).
Pengamatan panjang dan lebar karapaks menggunakan Mikroskop Olympus CX-21 LED Fluorescence. Metode pengukuran larva yaitu mengambil sampel sebanyak 1-2 ekor larva kepiting bakau kemudian diamati dibawah mikroskop, setelah itu ditandai menggunakan garis panjang dan lebar pada larva.
3. Kualitas Air
Parameter kualitas air yang diukur meliputi meliputi parameter kualitas fisika air (salinitas, suhu, pH dan DO), kualitas kimia air (amonia dan nitrit).
A3
C2
B1
B2
A1
C1
B3
Tabel 2. Parameter Kualitas Air
No. Parameter Alat Pengukuran
1. 2. 3. 4. 5. 6. Salinitas Suhu pH Oksigen terlarut Amonia Nitrit Hand refraktometer Thermometer Kertas pH DO meter Titrasi Titrasi setiap 5 hari setiap 5 hari setiap 5 hari setiap 5 hari
awal, tengah, akhir penelitian awal, tengah, akhir penelitian 4. Populasi bakteri vibrio sp
Pengamatan populasi bakteri vibrio sp dilakukan pada akhir penelitian, dengan cara mengambil sampel air media pemeliharaan setian perlakuan kemudian dianalisis dilaboratorium Balai Pengembangan Budidaya Air Payau Maros.
Analisis Data
Data kualitas air yang diperoleh dianalisis secara deskriptif dan data sintasan dan pertumbuhan dianalisis dengan menggunakan sidik ragam. Untuk mengetahui pengaruh perlakuan terhadap pertumbuhan dan kelangsungan hidup larva kepiting bakau, data yang diperoleh dianalisis denga menggunakan analisis ragam (ANOVA) pada taraf kepercayaan 95%. Bila berpengaruh nyata, dilanjutkan dengan uji beda nyata terkecil (BNT) untuk melihat perbedaan antara perlakuan (Gasperz, 1994).
Hasil
1. Sintasan (Kelangsungan Hidup)
Dari hasil pengamatan didapatkan bahwa nilai rata-rata persentase sintasan larva kepiting bakau terbaik adalah pada perlakuan B dengan nilai sintasan sebesar 7,84 %; kemudian pada perlakuan C 4,31 %; perlakuan A 0,78 %; dan terendah pada perlakuan. Hasil analisis ragam menunjukkan bahwa pemberian probiotik bacillus licheniformis berpengaruh nyata terhadap sintasan larva kepiting bakau.
Hasil uji beda nyata terkecil (BNT) menunjukkan bahwa perlakuan B berbeda nyata pada perlakuan A dan C , selanjutnya perlakuan C berbeda nyata pada perlakuan B, dan A, Perlakuan A berbeda nyata pada perlakuan perlakuan B dan C. Nilai rata-rata presentase sintasan larva kepiting bakau dari ketiga perlakuan dapat dilihat pada Gambar 3.
2. Pertumbuhan Mutlak
a. Pertumbuhan Mutlak Berdasarkan Panjang Karapaks
Dari hasil pengamatan didapatkan bahwa nilai rata-rata persentase berdasarkan
pertumbuhan panjang karapaks larva kepiting bakau terbaik adalah pada perlakuan A panjang karapaks rata-rata 43,33 µm, selanjutnya pada perlakuan B 33,33 µm, kemudian perlakuan C 20 µm, Hasil analisis ragam menunjukkan bahwa pemberian probiotik nitromonas eutorpha dan nitrobacter winogradskyi berpengaruh nyata terhadap pertumbuhan berdasarkan panjang karapaks larva kepiting bakau.
Hasil uji beda nyata terkecil (BNT) menunjukkan bahwa Perlakuan A tidak berbeda nyata dengan perlakuan B namun berbeda nyata dengan perlakuan C, selanjutnya perlakuan B tidak berbeda nyata dengan perlakuan A dan perlakuan C, Perlakuan C tidak berbeda nyata dengan perlakuan B, namun berbeda nyata dengan perlakuan A. Nilai rata-rata presentase pertumbuhan panjang karapaks larva kepiting bakau dari ke tiga perlakuan dapat dilihat pada Gambar 4.
b. Pertumbuhan Mutlak Berdasarkan Lebar Karapaks
Dari hasil pengamatan didapatkan bahwa nilai rata-rata persentase berdasarkan pertumbuhan lebar karapaks larva kepiting bakau terbaik adalah pada perlakuan A dengan nilai sebesar 37,67 µm, kemudian pada perlakuan C 29,33 µm, perlakuan B 14,67 µm. Hasil analisis ragam menunjukkan bahwa pemberian probiotik nitromonas eutorpha dan nitrobacter winogradskyi berpengaruh nyata terhadap pertumbuhan berdasarkan lebar karapaks larva kepiting bakau. Nilai rata-rata presentase pertumbuhan lebar karapaks larva kepiting bakau dari ke empat perlakuan dapat dilihat pada Gambar 5.
Hasil uji beda nyata terkecil (BNT) menunjukkan bahwa Perlakuan A tidak berbeda nyata dengan perlakuan C, namun berbeda nyata dengan perlakuan B, Perlakuan C tidak berbeda nyata dengan perlakuan A, namun berbeda nyata dengan perlakuan B, selanjutnya perlakuan B berbeda nyata dengan perlakuan A dan C.
Gambar 3. Histogram sintasan larva kepiting bakau (S. paramamosain)
Gambar 4. Histogram pertumbuhan mutlak panjang karapaks larva kepiting bakau (S. paramamosain)
Gambar 5. Histogram pertumbuhan mutlak lebar larva kepiting bakau (S. paramamosain) a a,b b,c c 0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 45.00 50.00 A B C D P anja ng K ara pa ks ( µm ) Perlakuan
c
a
b
0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 9.00 A B C D Si ntas an (%) Perlakuan a b a c 0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 45.00 A B C D L ebar K arapak s (µm ) Perlakuan1. Kualitas air
Tabel 3. Parameter kualitas air yang diamati pada semua perlakuan
Parameter A B Perlakuan C D pH 7,3 – 8,1 7,3 – 8,1 7,3 – 8,0 7,3 – 8,2 DO (mg/l) 4,9 – 6,8 5,0 – 6,8 4,9 – 6,8 5,0 – 6,7 Suhu (oC) 29-31 29-31 29-31 29-31 Salinitas (ppt) 28-30 28-30 28-30 29-30 Nitrit (mg/l) 0,022 - 2.128 0,017 – 0,613 0,015 – 1,322 0,021 – 4,722 Amoniak (mg/l) 0,109 - 0.583 0,103 – 0,234 0,113 – 0,562 0,113 – 1,022 2. Populasi bakteri Vibrio sp.
Hasil penelitian menunjukkan indikasi bahwa penggunaan probiotik BPPBAP mampu menekan populasi bakteri Vibrio sp. Dibandingkan dengan perlakuan kontrol dan kedua jenis probiotik komersial lainnya. Populasi bakteri Vibrio sp. di air media
pemeliharaan tertinggi didapatkan pada perlakuan D mencapai 5,4 x 102 cfu/g, disusul
perlakuan A (3,95 x 102 cfu/g); C (3,85 x 102 cfu/g); dan terendah pada
perlakuan B (2,25 x 102 cfu/g). Total populasi bakteri Vibrio sp. setiap perlakuan di akhir penelitian disajikan pada Tabel 4.
Tabel 4. Total populasi bakteri Vibrio sp. setiap perlakuan di akhir penelitian
Perlakuan (Jenis Probiotik) Total Vibrio sp. (Log cfu/g)
Probiotik EM 3,95 x 102
Probiotik BPPBAP 2,25 x 102
Probiotik NB 3,85 x 102
Kontrol (tanpa probiotik) 5,4 x 102
Pembahasan
Dari semua perlakuan bahwa presentase sintasan larva kepiting bakau tertinggi sampai akhir penilitian didapatkan pada perlakuan perlakuan B dengan nilai sintasan sebesar 7,84 %; kemudian pada perlakuan C 4,31 %; perlakuan A 0,78 %. Tingginya sintasan pada perlakuan B diduga karena pemberian probiotik BPPBAP mengandung Bacillus licheniformis yang mampu memperbaiki kualitas air. Menurut (Andriyanto, 2010) Bakteri ini telah terbukti memiliki potensi sebagai agens pengendali hayati yang baik, misalnya terhadap bakteri patogen. Bacillus licheniformis memiliki beberapa keunggulan diantaranya memiliki daya hambat pada bakteri patogen, memiliki enzim ekstraseluler bakteri yang lengkap (protease, amilase dan lipase) serta pertumbuhan bakteri Bacillus licheniformis yang cepat (Soegijono, 2010).
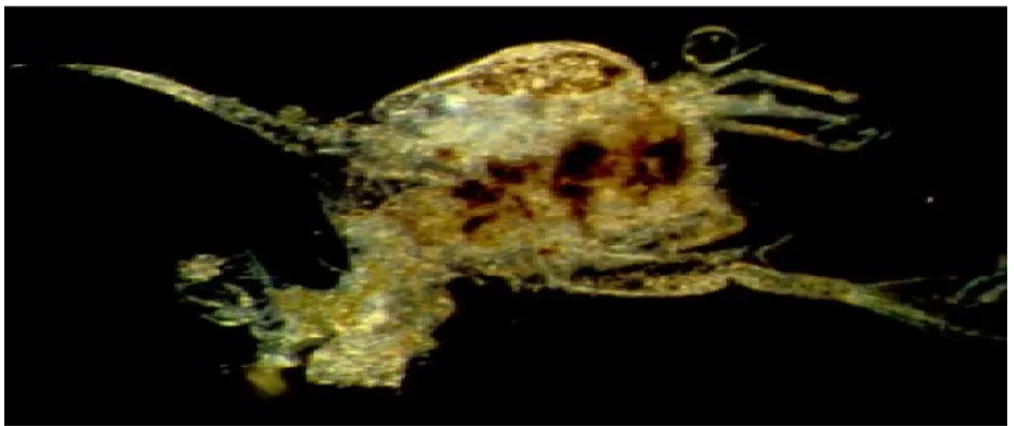
Rendahnya sintasan pada perlakuan A diduga karna jenis probiotik yang digunakan belum mampu meminimalisir pertumbuhan
bakteri, hal itu terlihat dari hasil pengukuran vibrio sp yang mencapai nilai tertinggi sebesar 3,95 x 102 dibandingkan dengan perlakuan yang lain, sehingga larva kepiting bakau sangat mudah terserang oleh penyakit yang muncul pada perairan, salah satunya adalah larva kepiting bakau terserang oleh protozoa yang merusak organ dalam dari tubuh larva (Gambar 6). Selain itu kondisi organ pencernaan yang belum terbentuk dengan sempurna membuat larva kepiting bakau mengalami kesulitan dalam proses pencernaanya. Hal ini sesuai dengan pernyataan Tangko et al., (2007) bahwa dalam bidang akuakultur penggunaan probiotik bertujuan untuk menjaga keseimbangan mikroba dan pengendalian patogen dalam saluran pencernaan, air, serta lingkungan perairan melalui proses biodegredasi. Di tambahkan oleh Salminen et al, (1999) bahwa probiotik merupakan segala bentuk preparasi sel mikroba atau komponen sel mikroba yang memiliki pengaruh menguntungkan bagi kesehatan dan kehidupan inang.
Gambar 6. Larva yang terinfeksi protozoa (Saputra, 2012) Affandi dan Tang (2004)
mengemukakan pertumbuhan adalah proses perubahan ukuran (panjang, berat dan volume) pada periode waktu tertentu. Hasil Pengamatan pertumbuhan mutlak berdasarkan panjang karapaks selama penelitian tertinggi yaitu pada perlakuan A dengan rata-rata panjang karapaks 43,33 µm, disusul Perlakuan B 33,33 µm, kemudian perlakuan C 20 µm.
Tingginya pertumbuhan mutlak berdasarkan panjang karapaks pada perlakuan A, Hal tersebut diduga karena kemampuan bakteri probiotik ini mampu memperbaiki kualitas air dan peranannya membantu pada proses pencernaan pertumbuhan larva kepiting bakau. Menurut Khasani (2007), bahwa probiotik EM berguna untuk memperbaiki kualitas air pemeliharaan, menstabilkan pH, mengurangkan bau, dan mengurangkan kehilangan nutrien dalam media pemeliharaan. Berdasarkan hasil identifikasi probiotik EM mengandung Nitrosomonas eutorpha dan Nitrobacter winogradskyi merupakan bakteri auototrof yang berperan mengoksidasi amoniak.
Selain hal tersebut pertumbuhan juga sangat ditentukan oleh pakan yang diberikan. Pemberian pakan alami berupa rotifera dan artemia diduga memberikan tambahan gizi bagi larva guna membantu proses pertumbuhan, Rotifera mempunyai keuntungan, diantaranya gerakannya lambat sehingga mudah dimangsa oleh larva dan mempunyai nilai gizi yang baik untuk pertumbuhan larva kepiting (Adi, 2011).
Laju pertumbuhan panjang karapaks terendah ditunjukkan oleh perlakuan C, rendahnya laju pertumbuhan panjang karapaks larva kepiting bakau disebabkan serangan bakteri patogen (Vibrio sp.) dan protozoa. Hal ini merupakan pengaruh dari penurunan kualitas air pada media pemeliharan karena tidak adanya bakteri probiotik pengendali bakteri patogen dan pengurai amonia. Menurut (Wang et al., 1999 dalam Irianto (2003) penggunaan probiotik pada
budidaya ikan maupun udang yaitu menjaga keseimbangan mikroba dan mengurangi jumlah patogen, secara bersamaan mengurangi penggunaan senyawa-senyawa kimia dan meningkatkan pertumbuhan serta kesehatan hewan inang.
Sama halnya dengan pertumbuhan berdasarkan panjang karapaks, Laju pertumbuhan lebar karapaks terbaik ditunjukkan oleh perlakuan A yaitu 37,67 µm, kemudian pada perlakuan C 29,33 µm, perlakuan B 14,67 µm. Hal ini diduga disebabkan oleh efektifitas probiotik ini dalam menjaga kualitas air sangat baik untuk media pemeliharaan larva kepiting bakau. Bakteri-bakteri probiotik seperti Nitrosomonas eutorpha dan Nitrobacter winogradskyi mampu mengurai bahan-bahan organik dalam air sehingga kualitas air tetap terjaga. They (2005) menyatakan bahwa bakteri probiotik dianggap menguntungkan karena dapat mengurai bahan organik. Ditambahkan oleh Moriarty (1996) bahwa efektivitas penggunaan bakteri probiotik untuk mengendalikan mikroorganisme patogen sangat dipengaruhi oleh jenis bakteri yang digunakan. Selain itu, pertumbuhan juga sangat dipengaruhi oleh ketersediaan pakan untuk menunjang keberhasilan pemeliharaan larva kepiting bakau. Menurut Kanna (2002) Larva kepiting bakau membutuhkan pakan dalam jumlah tertentu untuk menunjang aktivitas pertumbuhannya.
Sebaliknya laju pertumbuhan mutlak berdasarkan lebar karapaks terendah didapatkan pada perlakuan B, diduga karna jenis probiotik ini belum mampu memaksimalkan serangan bakteri protozoa dan kurang maksimalnya jenis probiotik yang diberikan dalam membantu proses pencernaan (imunostimulan) pada larva kepiting bakau. Menurut Moriarty (1996) menyatakan bahwa probiotik adalah makanan tambahan (suplemen) berupa sel-sel mikroba hidup, yang memiliki pengaruh menguntungkan bagi hewan inang yang mengkonsumsinya
melalui penyeimbangan flora mikroba intestinalnya yang berperan sebagai bioremediasi dan imunostimulan.
Hasil pengukuran Salinitas semua perlakuan berada pada kisaran 28-30 ppt. Kisaran ini masih layak untuk mendukung daya hidup larva kepiting bakau. Menurut Fibro (2010), larva Kepiting bakau mampu mentolerir kisaran salinitas antara 33-34 ppt. Salinitas merupakan salah satu faktor lingkungan yang berpengaruh penting pada konsumsi pakan, metabolisme, sintasan, dan pertumbuhan organisme akuatik. Salinitas berpengaruh terhadap setiap fase kehidupan kepiting bakau, terutama pada saat moulting (Ansari, 2010).
Karim (2007) melaporkan bahwa tingkat salinitas tidak berpengaruh nyata terhadap sintasan kepiting bakau S. paramamosain, tetapi berpengaruh nyata terhadap laju pertumbuhannya. Salinitas dapat memodifikasi peubah fisika dan kimia air menjadi satu kesatuan pengaruh yang menjadi satu kesatuan pengaruh yang berdampak osmotik pada osmoregulasi dan bioenergetik.
Hasil pengukuran suhu selama penelitian untuk semua perlakuan diperoleh kisaran 29-310C. Fluktuasi tidak terlalu tajam karena semua media pemeliharaan dilengkapi heater selama 24 jam untuk mempertahankan suhu air. Kisaran ini masih layak untuk mendukung daya hidup larva kepiting bakau (Kuntiyo et al., 1994). Zacharia dan Kakati (2004) menyatakan, Suhu merupakan salah satu faktor abiotik penting yang mempengaruhi aktivitas, nafsu makan, konsumsi oksigen dan laju metabolisme krustase. Suhu yang optimun untuk kepiting bakau adalah 26 sampai 320C (Kuntiyo et al., 1994). Berdasarkan hal tersebut, kisaran suhu media pemeliharaan cukup optimum dalam mendukung sintasan dan pertumbuhan kepiting bakau.
Hasil pengukuran pH selama penelitian berkisar antara 7,3–8,2. Kisaran ini masih layak untuk mendukung daya hidup larva kepiting bakau. Menurut Christensen et al. (2005), pH optimum untuk larva kepiting bakau berkisar antara 7,5 dan 8,5. Organisme air dapat hidup dalam suatu perairan yang mempunyai nilai pH netral dengan kisaran toleransi antara asam lemah sampai basa lemah. Nilai pH yang sangat rendah akan menyebabkan terjadinya gangguan metabolisme dan respirasi. Disamping itu pH yang sangat rendah akan menyebabkan mobilitas berbagai senyawa logam yang bersifat toksik semakin tinggi yang tentunya akan mengancam kelangsungan hidup organisme akuatik. Sementara pH yang tinggi akan
menyebabkan terganggunya keseimbangan antara ammonium dan ammoniak dalam air, dimana kenaikan pH di atas netral akan meningkatkan konsentrasi amoniak yang juga bersifat sangat toksik bagi organisme (Barus, 2004).
Hasil pengukuran oksigen terlarut (DO) selama penelitian berkisar antara 4,9–6,8 mg/L. Nilai ini masih dalam kisaran yang normal untuk pertumbuhan larva kepiting bakau. Menurut Yunus et al. (2001) melaporkan bahwa konsentrasi DO sebesar 5,60–5,68 mg/L mendukung sintasan larva kepiting bakau. Disolved oxygen (DO) merupakan banyaknya oksigen terlarut dalam suatu perairan. Oksigen terlarut merupakan suatu faktor yang sangat penting di dalam ekosistem perairan, terutama sekali dibutuhkan untuk proses respirasi bagi sebagian besar organisme air. Kelarutan oksigen sangat dipengaruhi oleh beberapa faktor terutama suhu. Kelarutan maksimum oksigen di dalam air terdapat pada suhu sebesar 14,16 mg/L. Konsentrasi ini akan menurun sejalan dengan meningkatnya suhu air. Dengan peningkatan suhu akan menyebabkan konsentrasi oksigen akan menurun dan sebaliknya suhu yang semakin rendah akan meningkatkan konsentrasi oksigen terlarut semakin tinggi (Barus, 2004).
Konsentrasi amoniak dari awal hingga akhir penelitian mengalami fluktuasi. Konsentrasi ammonia tertinggi adalah pada perlakuan A sebesar 0,5833 mg/L, perlakuan C sebesar 0,5617 mg/L dan terendah pada perlakuan B sebesar 0,2344 mg/L. Hal ini menunjukkan bahwa penggunaan bakteri probiotik mampu meningkatkan penghilangan amoniak dan bahan organik menjadi senyawa-senyawa sederhana yang justru dibutuhkan oleh produser primer untuk pertumbuhannya. Ghosh et al., (2008) juga melaporkan penurunan kadar amoniak dan bahan organik dengan aplikasi bakteri probiotik Bacillus subtilis. Keberadaan produser primer pada sistem budidaya sangat dibutuhkan untuk menjaga stabilitas media pemeliharaan agar sesuai dengan kebutuhan hewan budidaya. Hal ini sesuai dengan pendapat Triyanto (2005) bahwa bakteri Nitrosomonas eutorpha dan Nitrobacter winogradsky mampu dengan baik mengoksidasi amoniak dalam media pemeliharaan, sedangkan bakteri Paracoccus pantotrophus dan Bacillus megaterium mampu merombak karbohidrat dan bahan organik. Kualitas air terutama kadar total amoniak yang melebihi ambang batas merupakan salah satu faktor penyebab penurunan produksi udang (Arifin et
al, 2007), Amonia terutama berasal dari proses amonifikasi bahan organik yang terdapat pada sisa pakan dan ekskresi amoniak secara langsung oleh organisme air. Menurut Boyd (1990) bahan organik yang berasal dari pakan yang tidak termakan, plankton mati, aplikasi pemupukan dan faeces dalam proses dekomposisi nitrogen organik, penguraian nitrogen menjadi amonium, nitrit dan nitrat tidaklah menimbulkan efek toksik, tetapi apabila yang terbentuk amoniak maka dalam kadar rendahpun akan menimbulkan gangguan pada organisme akuatik bahkan mematikan.
Nitrit merupakan salah satu bentuk nitrogen hasil dari proses nitrifikasi nitrogen oleh mikroba pengurai (Septiningsih, 2009). Konsentrasi nitrit selama penelitian juga berfluktuasi. Konsentrasi nitrit tertinggi pada perlakuan A sebesar 2,884717 mg/L, perlakuan C sebesar 2,831483 mg/L dan terendah pada perlakuan B sebesar 1,84305 mg/L. Ada kecendrungan bahwa pada konsentrasi probiotik yang kecil menyebabkan proses nitrifikasi nitrit menjadi nitrat menjadi lambat sedangkan proses perombakan amonia menjadi nitrit semakin cepat. Hasil ini mengindikasikan bahwa penambahan probiotik 6 sel/liter mampu mereduksi konsentrasi nitrit dalam media pemeliharaan krablet kepiting bakau. Nitrit yang didapatkan dari semua perlakuan tergolong cukup tinggi, dimana maksimal sebesar 0,01 mg/L (Boyd, 1990; Wardoyo, 1998) dan tidak melebihi 0,1 mg/L (Adiwijaya et al., 2003). Malone dan Burden (1998) menyatakan nilai optimal nitrit diperairan <0,5 mg/L. Sementara Effendi (2003) melaporkan bahwa konsentrasi nitrit >0,05 mg/L dapat bersifat toksik bagi biota laut. Moore (1991) melaporkan bahwa kadar nitrit >0,5 mg/L akan bersifat toksik bagi organisme air terutama udang yang dibudayakan, namun karena ketersediaan oksigen yang cukup dan penyerapan senyawa tannin dalam tubuh menyebabkan udang masih dapat hidup dan tumbuh dengan baik. Demikian halnya pada pemeliharaan krablet kepiting bakau, dimana krablet masih dapat hidup dan tumbuh dengan baik meski media pemeliharaan mengandung konsentrasi nitrit yang cukup tinggi.
Populasi bakteri Vibrio sp. pada perlakuan A lebih tinggi dibandingkan total bakteri Vibrio sp. pada perlakuan B dan C. Hal ini menunjukan bahwa penambahan probiotik dapat menurunkan populasi bakteri Vibrio sp. Menurut Soundarapandian et al., (2010) bahwa penambahan probiotik pada media budidaya dapat menurunkan dan menekan bakteri vibrio
sp pada budidaya udang windu. Hal ini sesuai dengan pendapat Yudiati et al., (2006) yang melaporkan bahwa bakteri probiotik yang berasal dari media budidaya pembesaran udang adalah potensial dan dapat menekan pertumbuhan bakteri pathogen diantaranya Vibrio sp.
Hasil penelitian (Ika, 2007) menunjukan bahwa golongan bakteri bacillus sp. terutama Bacillus subtilis UTM 126 berfungsi untuk menekan pertumbuhan plankton supaya tidak terlalu pekat, selain itu bakteri ini juga mengeluarkan enzim yang berguna untuk menekan perkembangan bakteri vibrio. Aplikasi probiotik memberikan efek positif terhadap kualitas air dan berpengaruh terhadap populasi bakteri vibrio. Beberapa probiotik yang telah terbukti menekan populasi bakteri vibrio adalah Bacillus spp (Dalmin et al., 2001), Bacillus subtilis BT23 (Vaseeharan dan Ramasamy, 2003), Bacillus subtilis UTM 126 (Balcázar dan Rojas-Luna, 2007).
Simpulan
Berdasarkan hasil dan pembahasan dapat disimpulkan Pemberian probiotik mampu meningkatkan sintasan dan pertumbuhan dalam pemeliharaan larva kepiting bakau. Probiotik Bacillus licheniformis memberikan respon sintasan yang tertinggi. Probiotik Nitrosomonas eutorpha dan Nitrobacter winogradskyi memberikan pertumbuhan mutlak panjang karapaks terbaik sama halnya dengan pertumbuhan lebar karapaks.
Persantunan
Penulis menyampaikan terima kasih kepada Prof. Dr. Ir. La Ode Muh. Aslan, M.Sc, dekan Fakultas Perikanan dan Ilmu Kelautan, Universitas Haluoleo, Kendari.
Kepala dan Staf Balai Budidaya Air Payau Maros, Sulawesi Selatan, atas bantuan dan bimbingan selama melakukan penelitian. Daftar Pustaka
Adi, Y.S. 2011. Sintasan Larva Rajungan (Portunus
pelagicus) Stadia Zoea pada Berbagai
Frekuensi Pemberian Pakan Alami enis
Brachionus plicitalis. Skripsi. Fakultas
Pertanian, Universitas Muhammadiyah Makassar. 46 hal.
Affandi dan Tang. 2004. Fisiologi Hewan Air. Badan Penerbit Universitas Riau. Pekan Baru. 10 hal.
Ansari, N, R. 2010. Pemacauan Pergantian Kulit Kepiting Bakau (Scylla serrata) Melalui Manipulasi Lingkungan untuk
Menghasilkan Kepiting Lunak. Prosiding Forum Inovasi Teknologi Akuakultur. 179-185 Hal.
Andriyanto, S. 2010. Pengaruh Pemberian Probiotik dengan Dosis yang Berbeda terhadap Sintasan dan Pertumbuhan Benih Patin Jambal (Pangasius djambal). Prosiding Forum Inovasi Teknologi Akuakultur. 117-122 hal.
Arifin, Z., C. Kokarkin dan T.P. Priyoutomo. 2007. Penerapan Best Management Practices (BMP) pada Budidaya Udang Windu (Penaeus monodon) Intensif. Juknis. Departemen Kelautan dan Perikanan. Ditjen. Perikanan Budidaya. Balai Besar Pengembangan Budidaya Air Payau. Jepara. 68 hal.
Astin, B. and D. A Austin. 1999. Bacterial fish Pathogens, Disease of Farmed & Wish, 3 rd (revised) ed. Springer-Praxis, Godalman. 3: 263-296.
Balca´zar, J.L., & T. Rojas-Luna. 2007. Inhibitory Activity of Probiotic Bacillus subtilis UTM 126 Against Vibrio Species Confers Protection Against Vibriosis in Juvenile Shrimp (Litopenaeus vannamei), Curr.
Microbiol 55: 409–412.
Barus, T.A. (2004). Pengantar Limnologi: Studi tentang Ekosistem Air Daratan. Penerbit USU Press.
Boyd C. E. 1990. Water Quality in Pond for Aquaculture. Auburn University,
Alabama. 482 pp.
Catacutan, M. R. 2002. Growth and Body Composition of Juvenile Mud Crab, Scylla
serrata, Fed Different Dietary Protein and
Lipid Levels and Protein To Energy Ratio. Aquaculture, 208:113-123.
Christensen, S.M, D.J. Macintosh, & N.T. Phuong. 2005. Pond Production of The Mud Crab
Scylla paramamosain (Estampador) & S. olivacea (Herbst) in The Mekong Delta,
Vietnam, Using Two Different Supplementary Diets. Aqua. Res. 35: 1013-1024.
Direktorat Jendral Perikanan. 1992. Ekspor dan Impor Hasil Perikanan. Departemen Pertanian, Indonesia Jakarta. 3 hal.
Effendi M.I. 1997. Biologi Perikanan. Yayasan Pustaka Nusatama. Yogyakarta. 163 hal. Effendi, H. 2003. Telaah Kualitas Air Bagi
Pengelolaan Sumberdaya dan Lingkungan Perairan. Kanisius. Yogyakarta. 249 hal. Fahri, M. 2009. Aplikasi Probitik Untuk Pencegahan
Penyakit dilingkungan Tambak. Brawijaya University. Malang. 50 hal.
Fibro, A, W. 2010. Laju Pemangsaan Larva Kepiting Bakau (Scylla sarrata) terhadap Pakan Alami Rotifera (Brachionus sp.). Balai Riset Perikanan Budidaya Air Payau Maros. Jurnal Prosiding Forum Inovasi Teknologi Akuakultur: 139-144.
Gaspersz, V. 1994. Metode Perancangan Percobaan Untuk Ilmu-ilmu Pertanian, Ilmu-ilmu Teknik dan Biologi. CV Armico. Bandung. 472 hal.
Ghosh, S, A. Sinha and C. Sahu. 2008. Bioaugmentation in the Growth and Water Quality of Livebearing Ornamental Fishes. Aquaculture International 16: 393-403. Ika, R, M. 2005. Sensifitas Berbagai stadia kepiting
Bakau (Scylla paramamosain) terhadap White Spot Syndrome Virus.
Bioteknologi. 2 (1): 27-33.
Irianto, A. 2003. Probiotik Akuakultur. Gadjah Mada University Press. Yogyakarta. 125 hal. Kanna. I. 2002. Budidaya Kepiting Bakau
(Pembenihan dan Pembesaran). Kanisius. Yogyakarta. 130 hal.
Karim, M. Y. 2008. Kajian Osmoregulasi Kepiting Bakau (Scylla serrata Forsskal) pada salinitas Berbeda. Ichthyos. 7 (1) : 21-26. Khasani, I. 2007. Aplikasi Probiotik Menuju Sistem
Budidaya Perikanan Berkelanjutan. Media Akuakultur. 2 (2): 86-90.
Kordi, K. 2007. Pemeliharaan Udang Vanname. Penerbit Indah. Surabaya. 16 hal.
Malone, R.F., and D.G. Burden. 1998. Design of Recilculating Blue Crab Shedding Systems. Lousiana Sea Grand College Program. Louisiana Sea Grant College Program, Lousiana State University, Baton Rouge, Lousiana, 76 pp.
Moriarty, D.J.W. 1996. Microbial Biotechnology: a key Inggradient for Sustainable Aquaculture. Infofish. 55: 123-142.
Pribadi. 2002. Probiotik Dalam Budidaya. Kumpulan Majalah Mitra Bahari Edisi 1996 – 2002. 5 hal.
Salminen, S., Ouwehand, A., Benno, Y. & Lee Y.K. 1999. Probiotics: how should be defined. Trends in Food Science and Technology 10:107 – 110.
Septiningsih, E. 2009. Pengaruh Dekomposisi Serasah Daun Mangrove Rhizophora
Mucronata Terhadap Kualitas Air, Pertumbuhan dan Sintasan Udang Vannamaei Lithopenaeus vannamei. Tesis Program Pascasarjana Universitas Hasanuddin. Makassar. 84 hal.
Soim, A. 1993. Pembesaran Kepiting. Penebar Swadaya. Jakarta. 61 hal
Soundarapandian, P., V. Ramanan and G.K. Dinakaran. 2010. Effect of Probiotics on the Growth and Survival of Penaeus monodon. Current Research Journal of Social Sciences 2: 51-57.
Soegijono. 2010. httpcoba-cobasendiri.blogspot .com201008pemanfaatan-bakteri-bacillus. Pemanfaatan Bakteri Bacillus Megatarium Sebagai Probiotik Untuk Meningkatkan Aktifitas Enzim Pencernaan Dan Respon Pertumbuhan Udang Vannamei (Litopenaeus vannamei). Diakses pada tanggal 4 oktoker 2012.
Tangko, A. M., Mansyur, A., dan Reski. 2007. Penggunaan Probiotik pada Pakan Pembesaran Ikan Bandeng dalam Keramba Jaring Apung di Laut. Pusat Riset Perikanan Budidaya. Jakarta. J. Ris. Akuakultur. 2 (1): 33-40.
Triyanto. 2005. Isolation and Characterization of Proteolitic, Nitrifying, and Denitrifying Bacteria From Mangrove Sediment. Laporan Penelitian. Universitas Gadjah Mada . Yogyakarta. 121 pp.
Vaseeharan, B. & P. Ramasamy. 2003. Control Of Pathogenic Vibrio Spp. By Bacillus Subtilis Bt23, A Possible Probiotic Treatment For Black Tiger Shrimp Penaeus monodon. Lett Appl Microbiol. 36: 83-7.
Yudiati E., Subagiyo dan A. Isnansetyo. 2006. Eksplorasi dan Aplikasi Marine Bakteri Antagonis Terhadap Bakteri Pathogen Dalam Upaya Pengendalian Penyakit Ikan dan Udang Secara Terpadu. Laporan Penelitian. Universitas Diponegoro, Semarang.
Yunus, I. Rusdi, Haryanti, dan K. Sugama. 2001. Pemeliharaan Larva Kepiting Bakau (Scylla
paramamosain) Skala Massal. Laporan
Balai Besar Perikanan Budidaya Laut. 144 hal.
Zacharia, S. and V.S. Kakati. 2004. Optimal Salinity and Temperatur of Early Developmental Stages of Penaeus merguensis de Man. Aquaculture, 232: 378-382