PADA SUBSTRAT BUATAN DI KEDALAMAN PERAIRAN
DAN KANDUNGAN BAHAN ORGANIK BERBEDA
MAJARIANA KRISANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Disertasi berjudul Produktivitas Larva Chironomidae pada Substrat Buatan di Kedalaman Perairan dan Kandungan Bahan Organik Berbeda adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2012
Majariana Krisanti
MAJARIANA KRISANTI. Chironomidae Larvae Productivity on Artificial Substrates Positioned at Different Water Depth and Organic Content. Under Direction of D. DJOKOSETIYANTO, YUSLI WARDIATNO, and ISMUDI MUCHSIN.
Chironomids larva plays important role in aquatic food webs. Substrates were important factor for chironomids larvae. Artificial substrates were means as tools to gain information about chironomids larva by reducing physical variation such as substrate types, water depth, and light penetration. The research was conduct to gather information about secondary productivity of chironomids larvae. Artificial substrates were positioned in cage culture and non-cage culture sites at Lido Lake, West-Java. Chironomids larva specimens were collected every day for 30 days in order to gather larvae dimensions (head capsule width and length, total body length and width). Research also conduct under laboratory condition using egg mass collected from Lido Lake which reared in a given organic content (0 mg/L, 0.5 mg/L, and 1.0 mg/L). Higher organic added in laboratory study was caused the Chironomus larvae spend less time in third instar
and gain fourth instar faster (P<0,05), also emerge faster than the lower organic added. As for chironomids larvae found on artificial substrates (Polypedilum),
the instar development and growth was faster at cage culture site than at non-cage culture site (P<0,05). Growth rate of chironomids larvae was affected by organic content as seen in laboratory and artificial substrates (P<0,05). Polypedilum
productivity was higher at cage culture site than non-cage culture site. The COD value that represented as all type of organic was give significant effect for chironomids larvae (P<0,05) at cage culture site.
MAJARIANA KRISANTI. Produktivitas Larva Chironomidae pada Substrat Buatan di Kedalaman Perairan dan Kandungan Bahan Organik Berbeda. Dibimbing oleh D. DJOKOSETIYANTO, YUSLI WARDIATNO, dan ISMUDI MUCHSIN.
Larva chironomida merupakan organisme yang memiliki peran penting bagi rantai makanan dan tingkart trofik level di suatu ekosistem perairan. Faktor yang turut berperan dalam perkembangan populasi larva chironomida adalah substrat tempat menempelnya. Penggunaan substrat buatan untuk mendapatkan data larva chironomida dimaksudkan untuk meminimalisasi bentuk variasi fisik, seperti jenis substrat, kedalaman, dan penetrasi cahaya. Alat ini juga dapat digunakan karena tidak merusak habitat asli dari organisme yang hidup di kawasan tersebut. Penelitian ini bertujuan untuk memperoleh informasi mengenai dinamika komunitas dan produktivitas sekunder dari larva chironomida dalam suatu ekosistem perairan. Dengan demikian informasi ini dapat digunakan sebagai acuan dalam pemanfaatan larva chironomida.
Substrat buatan diletakkan di Danau Lido di lokasi yang terdapat Karamba Jaring Apung (KJA) dan yang tidak terdapat KJA (Non-KJA). Penelitian juga dilaksanakan di laboratorium pada Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan Ilmu Kelautan IPB. Substrat buatan yang digunakan terbuat dari bahan kasa nyamuk yang berbahan nilon dengan mata jaring 2 mm, dibentuk persegi dengan ukuran 15x15 cm2 menggunakan bingkai kawat, tiga buah substrat buatan digabungkan menggunakan bingkai dari bambu dengan ukuran 45x30 cm2 untuk menjadi rangkaian substrat buatan. Substrat ini disusun berselang-seling antara kedalaman 1 m dan 2 m untuk memberi peluang yang sama terhadap penempelan larva chironomida serta terakumulasinya bahan organik baik dalam bentuk detritus maupun bahan organik hidup seperti alga atau hewan air lain (COD, AFDM, dan klorofil-a).
Penelitian yang dilakukan di laboratorium dilaksanakan menggunakan wadah plastik berukuran 34x26x7 cm3 sebagai tempat hidup larva chironomida yang menjadi objek penelitian. Larva chironomida yang ditumbuhkan di laboratorium diambil dalam bentuk massa telur yang berasal dari Danau Lido. Massa telur ditetaskan pada cawan petri yang berbeda lalu dilakukan pengamatan selama lebih kurang 24 jam pertama sejak telur diambil dari alam dengan frekuensi pengamatan setiap 4 jam dengan kamera yang dihubungkan dengan mikroskop. Setelah telur menetas menjadi larva, larva kemudian dipindahkan ke wadah plastik pemeliharaan berukuran 34x26x7 cm3 yang diisi air Danau Lido setinggi 4 cm. Setiap wadah diberi tambahan bahan organik berupa kotoran kuda sebagai perlakuan penambahan bahan organik (0 mg/L; 0.5 mg/L; dan 1,0 mg/L).
hari sekali selama 21 hari. Sampel chironomida dibuat preparat permanen untuk membantu dalam proses identifikasi dan pengukuran dimensi kkepala dan tubuh. Identifikasi dilakukan dengan acuan Eppler (2001). Data yang diperoleh dianalisis secara deskriptif dalam bentuk tabulasi dan grafik serta analisis statistik menggunakan cluster analysis (K-means), Discriminant Analysis, Analisis
Produktivitas sekunder Non-Kohort menggunakan modifikasi metode
instantaneous growth rate method.
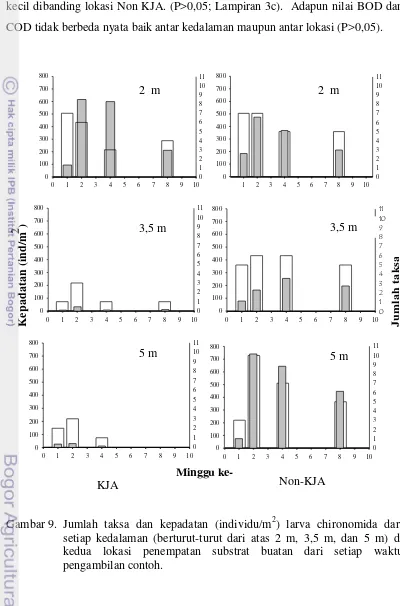
Larva chironomida yang ditemukan di lokasi Non-KJA memiliki jumlah taksa dan kepadatan yang lebih besar dibandingkan dengan lokasi KJA. Akan tetapi di lokasi KJA terlihat adanya penurunan jumlah taksa dan kepadatan yang menyolok seiring dengan meningkatnya kedalaman. Secara statistik kandungan oksigen terlarut memiliki perbedaan yang nyata antar kedalaman di lokasi KJA (P<0,05), sedangkan di lokasi Non-KJA tidak berbeda nyata (P>0,05). Akan tetapi terdapat perbedaan yang nyata pada kandungan oksigen terlarut antara lokasi KJA dengan Non-KJA di kedalaman yang sama dengan oksigen terlarut di lokasi KJA lebih kecil dibandingkan lokasi Non KJA. (P<0,05). Adapun nilai BOD dan COD tidak berbeda nyata baik antar kedalaman maupun antar lokasi (P>0,05). Mengingat kisaran kandungan oksigen lokasi KJA di kedalaman 3,5 m dan 5 m yang rendah bahkan tidak ada (0 mg/L) di kedalaman 5 m, maka kedalaman 2 m sebagai posisi untuk melakukan kajian pada penelitian lanjutan dari perkembangan dan pertumbuhan larva chironomida.
Pada percobaan di laboratorium, massa telur yang dipelihara adalah dari Genus Chironomus. Diperoleh informasi bahwa telur yang diambil dari Danau
Lido menetas setelah 17 jam sejak pengambilan massa telur. Waktu capaian instar untuk perlakuan 0 mg/l adalah 7 hari dan hanya mencapai instar I. Waktu capaian instar untuk perlakuan 0,5 mg/L dan 1,0 mg/L berturut-turut dari instar I-IV adalah 4, 2, 13, dan 2 hari serta 4, 2, 10, dan 5 hari. Bahan organik terutama mempengaruhi lama waktu larva menjadi instar III (P<0,05). Penambahan bahan organik yang lebih tinggi menyebabkan larva Chironomus lebih cepat mencapai
instar IV, namun jangka waktu untuk instar IV menjadi lebih lama.
Kandungan COD di lokasi KJA sampai hari ke-15 lebih tinggi dibandingkan dengan lokasi Non-KJA, sedangkan pada hari ke-22 nilai COD di lokasi Non-KJA lebih tinggi daripada di lokasi KJA. Secara umum, pada kedalaman 1 m di lokasi KJA memiliki kandungan AFDM lebih tinggi daripada kedalaman 2 m (P<0,05); sebaliknya di lokasi Non KJA kedalaman 2 m memiliki kandungan AFDM yang lebih tinggi daripada kedalaman 1 m. Kandungan klorofil-a pada lokasi Non-KJA lebih tinggi daripada KJA, hal ini dikarenakan tingkat kecerahan lokasi Non-KJA lebih tinggi sehingga memungkinkan organisme autotrof untuk berfotosintesis lebih besar.
Larva chironomida yang ditemukan di substrat buatan adalah Genus
Polypedilum. Perkembangan instar secara umum lebih cepat pada lokasi KJA
dibandingkan dengan lokasi Non KJA. Hal ini disebabkan oleh ketersediaan makanan pada lokasi KJA lebih banyak dibandingkan lokasi Non KJA. Secara umum ukuran kapsul kepala larva Polypedilum yang ditemukan di substrat buatan
kepala yang besar.
Pada kegiatan penelitian di laboratorium terhadap larva Chironomus yang
mendapat perlakuan bahan organik berbeda pertumbuhan larva dapat dilihat dari perubahan ukuran panjang total tubuh selama percobaan. Selain untuk perlakuan bahan organik 0 mg/L, perlakuan 0,5 mg/L dan 1,0 mg/L memperlihatkan pola pertumbuhan berbentuk sigmoid pada larva Chironomus yang dipelihara di
laboratorium R2= 0,6505 dan 0,6735. Secara umum laju pertumbuhan larva
Polypedilum di KJA lebih cepat dibandingkan Non-KJA (P<0,05). Laju
pertumbuhan juga meningkat dari instar I sampai ke instar III, akan tetapi pada instar IV laju pertumbuhannya lebih kecil. Fenomena ini terjadi untuk kedua lokasi KJA maupun Non-KJA.
Penghitungan nilai produktivitas larva Chironomus dilakukan
menggunakan teknik kohort dengan metode jumlah-penambahan ( increment-summation method). Penghitungan hanya dilakukan pada perlakuan penambahan
bahan organik 0,5 mg/L dan 1,0 mg/L. berat rata-rata individu pada perlakuan 0,5 mg/L kurang dari berat rata-rata individu pada perlakuan bahan organik 1,0 mg/L. Biomassa rata-rata pada perlakuan 0,5 mg/l adalah 0,45 gram/m2, sedangkan pada perlakuan 1,0 mg/L sebesar 0,62 gram/m2. Produktivitas larva Chironomus pada
perlakuan 0,5 mg/L dan 1,0 mg/L berturut-turut adalah 1,861 gram/m2/tahun dan 3,08 gram/m2/tahun. Rasio P/B kohort dan rasio P/B tahunan untuk perlakuan 0,5 mg/L serta 1,0 mg/L adalah 2,4 dan 42,4 serta 2,9 dan 50,2.
Metode yang digunakan untuk menghitung produktivitas larva
Polypedilum mengikuti teknik Non-Kohort dengan menggunakan metode
frekuensi-ukuran (size-frequency method) (Benke & Huryn 2007). Biomassa
rata-rata pada lokasi KJA 1 dan 2 m adalah 2,4188 gram/m2 dan 1,4396 gram/m2; sedangkan pada lokasi Non-KJA 1 dan 2 m adalah 0,3740 gram/m2 dan 0,5794 gram/m2. Produktivitas larva Polypedilum pada lokasi KJA 1 dan 2 m serta
Non-KJA 1 dan 2 m berturut-turut adalah 9,8927 gram/m2/bulan, 5,5420 gram/m2/bulan, 1,9037 gram/m2/bulan, dan 0,5794 gram/m2/bulan. Rasio P/B kohort dan rasio P/B tahunan untuk setiap lokasi dan kedalaman adalah berturut-turut 4,1; 3,8; 5,1; dan 4,8 serta 49,1; 46,2; 61,1; dan 57,2.
Berdasarkan analisis regresi berganda terhadap larva Polypedilum di lokasi
KJA diperoleh persamaan regresi: Polypedilum = 2,557 + 0,020 COD - 3,266AFDM - 11,768Chl-a. Berdasarkan persamaan regresi berganda tersebut,
dapat dilihat bahwa larva Polypedilum lebih dipengaruhi oleh nilai COD dengan
R2=99%. Untuk lokasi Non-KJA, tidak dapat dilakukan persamaan regresi berganda, sehingga digunakan regresi sederhana antara larva Polypedilum dengan
masing-masing tipe bahan organik. Tidak terdapat hubungan antara larva dengan COD dan AFDM, akan tetapi terdapat keeratan hubungan antara larva
Polypedilum dengan kandungan klorofil-a meskipun hanya dengan R2= 79,4%.
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PADA SUBSTRAT BUATAN DI KEDALAMAN PERAIRAN
DAN KANDUNGAN BAHAN ORGANIK BERBEDA
MAJARIANA KRISANTI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : Dr. Ir. Bambang Widigdo
Dr. Ir. Isdradjad Setyobudiandi, M.Sc.
Kedalaman Perairan dan Kandungan Bahan Organik Berbeda
Nama : Majariana Krisanti
NIM : C 161050041
Disetujui Komisi Pembimbing
Prof. Dr. Ir. D. Djokosetiyanto, DEA Ketua
Dr. Ir. Yusli Wardiatno, M.Sc. Prof. Dr. Ir. Ismudi Muchsin
Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Perairan
Prof. Dr. Ir. Enang Harris, M.S. Dr. Ir. Dahrul Syah, M.Sc. Agr.
Penulis melakukan penelitian dengan topik Produktivitas Larva Chironomidae pada Substrat Buatan di Kedalaman Perairan dan Kandungan Bahan Organik Berbeda diawali bulan Maret 2010 hingga Agustus 2011. Disertasi ini disusun sebagai pemaparan kegiatan selama pelaksanaan penelitian serta pemikiran terhadap berbagai fenomena yang terkait kegiatan penelitian. Disertasi ini merupakan salah satu syarat program Doktor pada Program Studi Ilmu Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-besarnya kepada: Dosen komisi pembimbing, Prof. Dr. Ir. D. Djokosetiyanto, DEA, Dr. Ir. Yusli Wardiatno, M.Sc, dan Prof. Dr. Ir. Ismudi Muchsin, yang telah memberikan bimbingan, arahan, serta saran dalam pelaksanaan penelitian dan penyusunan Disertasi. Dosen Penguji Tamu pada Sidang Ujian Tertutup, Dr. Ir. Bambang Widigdo dan Dr. Ir. Isdradjad Setyobudiandi serta Dosen Penguji Tamu pada Sidang Ujian Terbuka, Prof. Dr. Ir. Woro Anggraitoningsih N. dan Dr. Ir. Ario Damar, M.Si., yang telah memberikan masukan dan saran yang sangat berarti untuk penyempurnaan Disertasi ini. Kementerian Pendidikan Nasional yang telah memberi kesempatan dan beasiswa untuk melanjutkan studi S3. Prof. Dr. Ir. Enang Harris, MS selaku Ketua Program Studi yang telah memberi kesempatan dan dorongan untuk menyelesaikan studi. Dr. Ir. Niken TM Pratiwi untuk diskusi, saran, dan motivasi yang diberikan. Keluarga tercinta Bapak, Suami (alm. Mhd. Yudha Bakti), Anak-anak (Shafira Chairunnisa dan Latifah Dewi Mayangsari), Adik-adik, dan seluruh Keluarga Besar Sjamsoe atas do’a,
kasih sayang, dan motivasi yang diberikan. Staf pada Program Studi Ilmu Perairan serta seluruh staf dan karyawan Departemen Manajemen Sumberdaya Perairan, FPIK-IPB yang telah membantu memperlancar proses penelitian serta penulisan Disertasi ini. Pimpinan, Pak Afandi, dan saudara Yudi selaku staf Instalasi Riset Plasma Nutfah Perikanan Air Tawar-KKP di Cijeruk yang telah menyediakan sarana KJA di Danau Lido dan bantuan di lapangan. Saudara Herman Sukmana, Rachmawaty Syarief, Dinda Fitriyanti, Hendry Arif Favian, Desnita, Ade Willy Surtini, Siti Anindita Farhani, Ayu Ervinia, dan Arif Nurcahyanto atas bantuan dan kerjasama selama penelitian dan pengolahan data. Teman-teman seperjuangan (AIR 2005: Bu Sriati, Pak Fadli, dan Bu Jusri) untuk semangat dan kekompakan yang diberikan. Semua pihak yang tidak bisa disebutkan namanya satu-persatu yang telah membantu penulis dalam menyelesaikan disertasi ini.
Penulis menyadari bahwa disertasi ini masih jauh dari kesempurnaan. Semoga Laporan disertasi ini bermanfaat.
Bogor, Januari 2012
Penulis dilahirkan di Bogor pada tanggal 31 Oktober 1969 sebagai anak sulung dari tiga bersaudara pasangan Sukotjo Adisukresno dan Djuwita Chairunnisa (almh). Pendidikan sarjana ditempuh di Jurusan Manajemen Sumberdaya Perairan, Fakultas Perikanan, IPB, lulus tahun 1993. Penulis melanjutkan ke jenjang S2 di Program Studi Ilmu Perairan pada Program Pascasarjana IPB dengan beasiswa BPPS dan tamat pada tahun 2003. Kesempatan untuk melanjutkan ke Program Doktor pada program studi yang sama dan pada perguruan tinggi yang sama diperoleh pada tahun 2005. Beasiswa pendidikan pascasarjana diperoleh dari Kementerian Pendidikan Nasional Indonesia dalam bentuk BPPS.
Penulis bekerja sebagai Staf Pendidik di Deparemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan-IPB sejak tahun 1995. Penulis menjadi anggota Asosiasi Peneliti dan Pemerhati Lingkungan Perairan Indonesia. Artikel berjudul Studi populasi larva Polypedilum (Insekta:
xxi
2.4. Lingkungan perairan yang mempengaruhi chironomida ... 17
2.4.1. Kedalaman... 17
3.4.1. Penentuan letak substrat berdasarkan kedalaman dari permukaan air ... 23
3.4.2. Penelusuran capaian instar larva chironomida ... 25
3.4.3. Perkembangan bahan organik pada substrat buatan... 26
3.4.4. Perkembangan dan pertumbuhan larva chironomida ... 27
3.4.5. Penentuan produktivitas larva chironomida ... 29
3.5. Analisis Sampel ... 30
3.6.3. Analisis perkembangan bahan organik pada substrat buatan 33 3.6.4. Analisis perkembangan dan pertumbuhan larva chironomida 34 3.6.5. Produktivitas larva chironomida ... 37 3.6.6. Keterkaitan antara larva chironomida dengan bahan organik 38
4. HASIL DAN PEMBAHASAN
4.1. Hasil ... 41 4.1.1. Penentuan letak substrat berdasarkan kedalaman dari
permukaan air ... 41 4.1.2. Penelusuran capaian instar larva chironomida ... 45 4.1.3. Perkembangan bahan organik pada substrat buatan ... 53 4.1.4. Perkembangan larva chironomida ... 59 4.1.5. Pertumbuhan larva chironomida ... 68 4.1.6. Produktivitas larva chironomida ... 74 4.1.7. Hubungan bahan organik dengan larva chironomida ... 76 4.2. Pembahasan ... 77
5. KESIMPULAN DAN SARAN
5.1. Kesimpulan ... 87 5.2. Saran ... 87
xxiii
Halaman 1. Metode dan alat yang digunakan pada pengukuran parameter
fisika-kimia perairan ... 24 2. Karakteristik ukuran larva Chironomus sp. berdasarkan instar
(Sumber: Dettinger-Klemm 2003). ... 35
3. Jenis-jenis larva chironomida yang ditemukan di lokasi penelitian beserta kisaran jumlah individu yang ditemukan di setiap
kedalaman ... 42 4. Kisaran nilai hasil pengukuran kualitas air di lokasi KJA dan
Non-KJA di ketiga posisi kedalaman substrat buatan ... 44
5. Karakteristik ukuran larvadan waktu capaian instar C. calligraphus
(Sumber: Zilli et al. 2001) ... 52
6. Karakteristik ukuran larvadan waktu capaian instar berdasarkan hasil penelitian ... 52 7. Tabel sidik ragam rancangan faktorial in time RAL yang
memperlihatkan interaksi kedalaman dan lokasi penempatan substrat buatan ... 58
8. Ukuran instar larva Polypedilum berdasarkan cluster analysis ... 61
9. Fungsi diskriminan instar Polypedilum hasil pengamatan
di Danau Lido ... 61 10. Ukuran instar larva Polypedilum berdasarkan Discriminant
Analysis ... 62
11. Nilai produktivitas larva Chironomus menggunakan metode
jumlah penambahan (increment-summation method) pada
penambahan bahan organik 0,5 mg/L dan 1,0 mg/L ... 75 12. Nilai produktivitas larva Polypedilum pada substrat buatan
di lokasi KJA (K) dan Non-KJA (N) di kedalaman
1 m dan 2 m ... 75
13 Perbandingan Nilai Produktivitas, Biomassa, dan rasio P/B beberapa jenis chironomida di berbagai ekosistem sungai
xxv
Halaman 1. Kerangka pemikiran produktivitas Chironomidae pada substrat
buatan di kedalaman perairan dan kandungan bahan organik
berbeda ... 7 2. Gambar siklus hidup Chironomus riparius. Telur dan larva instar
pertama umumnya planktonik, sementara instar-instar yang lebih tua bermigrasi ke sedimen sebagai benthos, dan dewasa hidup
di udara (Sumber: modifikasi Charles et al. 2004) ... 10
3. Bentuk larva chironomida (Sumber: Hilsenhoff 2001). ... 11 4. Kohort hipotetik dari serangga sungai yang menggambarkan
pertumbuhan individu dalam massa (W) dan kematian/mortalitas individu (N) (Sumber: modifikasi Benke 1984 in
Benke & Huryn 2007) ... 14 5. Peta lokasi dan peletakan substrat buatan di Danau Lido. I, lokasi
Karamba Jaring Apung (KJA); II, lokasi tanpa Karamba Jaring Apung (Non-KJA). (Sumber: pengukuran koordinat di lapangan dan peta
Bakosurtanal 2000) ... 21 6. Posisi substrat buatan di dalam air untuk penentuan letak substrat
sebagai habitat larva chironomida ... 24 7. Rangkaian substrat buatan dan cara penempatannya di danau ... 28 8. Batas pengukuran dimensi morfologi larva chironomida. A, kepala;
B, seluruh tubuh; a, panjang kapsul kepala; b, lebar kapsul kepala; c, panjang total tubuh; dan d, lebar tubuh ... 31
9. Jumlah taksa dan kepadatan (individu/m2) larva chironomida dari setiap kedalaman (berturut-turut dari atas 2 m, 3,5 m, dan 5 m) di kedua lokasi penempatan substrat buatan dari setiap waktu
pengambilan contoh ... 43 10. Massa telur (a) dan butiran telur (b) Chironomus yang diambil dari
Danau Lido ... 46
11. Larva Chironomus (A, seluruh tubuh; B, kepala dari arah ventral)
serta Pupa Chironomus (C. Pupa dengan isi, D. Pupa kosong/
exuviae) (Sumber: Dokumentasi pribadi) ... 46
12. Nilai kandungan COD (mg/L) di wadah pemeliharaan Chironomus
selama 21 hari penelitian ... 47
13. Nilai kandungan oksigen terlarut (mg/L) di wadah pemeliharaan
14. Tahap perkembangan larva Chironomus berdasarkan lebar kapsul
kepala (mm) dan panjang total tubuh (mm) pada penambahan
bahan organik 0 mg/L (a); 0,5 mg/L (b); dan 1,0 mg/L (c) ... 51
15. Grafik nilai COD pada substrat buatan di kedalaman 1 m dan 2 m
di lokasi KJA dan Non-KJA ... 54 16. Grafik nilai AFDM pada substrat buatan di kedalaman 1 m dan 2 m
di lokasi KJA dan Non-KJA ... 55 17. Grafik nilai kandungan klorofil-a (mg/l) pada substrat buatan
di kedalaman 1 m (hitam) dan 2 m (arsir) di lokasi KJA (kiri) dan
Non-KJA (kanan) ... 56 18. Grafik nilai Indeks Autotrofik pada substrat buatan di kedalaman
1 m (hitam) dan 2 m (arsir) di lokasi KJA (kiri) dan
Non-KJA (kanan). ... 57
19. Larva Polypedilum. (a) seluruh tubuh dari lateral; dan (b) bagian
ventral kepala memperlihatkan bentuk gigi mentum yang menjadi
penciri genus (Sumber: Dokumentasi pribadi) ... 59 20. Tahap perkembangan instar larva Polypedilum di lokasi KJA
kedalaman 1 m (a) dan 2 m (b), FD 1 memisahkan antara instar I dan II, FD 2 antara instar II dan III, dan FD 3 antara
instar III dan IV ... 63 21. Tahap perkembangan instar larva Polypedilum di lokasi Non-KJA
kedalaman 1 m (a) dan 2 m (b), FD 1 memisahkan antara instar I dan II, FD 2 antara instar II dan III, dan FD 3 antara
instar III dan IV ... 65 22. Tahap perkembangan larva berdasarkan panjang dan lebar kapsul
kepala Polypedilum lokasi KJA pada substrat buatan yang
dilindungi jaring di kedalaman 1 m (a) dan 2 m (b) ... 67 23. Tahap perkembangan larva berdasarkan panjang dan lebar kapsul
kepala Polypedilum lokasi Non-KJA pada substrat buatan
yang dilindungi jaring di kedalaman 1m (a) dan 2 m (b). ... 68 24. Sebaran nilai panjang total tubuh (mm) larva Chironomus setiap
hari pada penambahan bahan organik 0 mg/L (a); 0,5 mg/ L(b);
dan 1,0 mg/L(c) ... 70 25. Grafik pola hubungan panjang-berat larva Polypedilum pada
substrat buatan berturut-turut dari atas ke bawah pada instar 1 sampai dengan instar 4 di lokasi KJA (kiri) dan Non-KJA
(kanan) ... 72 26. Grafik pola hubungan panjang-berat larva Polypedilum pada
substrat buatan yang dilindungi jaring berturut-turut dari atas ke bawah pada instar 1 sampai dengan instar 4 di lokasi KJA (kiri)
xxvii
Halaman 1. Foto lokasi peletakan substrat buatan ... 99 2. Posisi peletakan rangkaian substrat buatan di Danau lido ... 100 3. Analisis ragam terhadap suhu air di lokasi KJA dan Non KJA
Danau Lido pada kedalaman 2 m, 3,5 m, dan 5 m ... 101
4. Analisis ragam untuk melihat pengaruh perlakuan bahan organik
terhadap nilai COD terlarut pada kegiatan kajian capaian instar .... 104
5. Analisis ragam untuk melihat pengaruh perlakuan bahan organik
terhadap nilai oksigen terlarut pada kegiatan kajian capaian instar . 106
6. Nilai rata-rata parameter kualitas air pendukung pada tahap
penelitian penentuan capaian instar larva Chironomus ... 108
7. Penentuan waktu capaian instar larva Chironomus mengacu pada
Zilli et al. (2001) ... 110
8. Uji BNT bagi waktu capaian instar antar perlakuan bahan organik 111
9. Uji t dan analisis ragam terhadap penumpukan bahan organik (COD) pada substrat buatan di lokasi KJA dan Non KJA Danau Lido pada kedalaman 1 m dan 2 m ... 112
10. Uji t dan analisis ragam terhadap penumpukan bahan organik (AFDM) pada substrat buatan di lokasi KJA dan Non KJA Danau Lido pada kedalaman 1 m dan 2 m ... 115
11. Uji t dan analisis ragam terhadap penumpukan bahan organik (klorofil-a) pada substrat buatan di lokasi KJA dan Non KJA Danau Lido pada kedalaman 1 m dan 2 m ... 117
12. Gambar rangkaian substrat buatan yang diberi pelindung jaring
dengan ukuran mata jaring 0,5 cm ... 119
13. Genus larva chironomida yang ditemukan tiap lokasi peletakan
substrat buatan ... 120
14. Uji-t bagi nilai b pada masing-masing instar di substrat buatan
tanpa jaring (lokasi KJA dan Non KJA) ... 121
15. Uji t bagi nilai b pada masing-masing instar di substrat buatan
16. Tahap penghitungan Produktivitas Sekunder dan P/B rasio Teknik Kohort menggunakan metode jumlah-penambahan (increment- summation method) larva Chironomus dengan perlakuan
penambahan bahan organik 0,5 mg/L ... 126
17. Tahap penghitungan Produktivitas Sekunder dan P/B rasio Teknik Kohort menggunakan metode jumlah-penambahan (increment- summation method) larva Chironomus dengan perlakuan
penambahan bahan organik 1,0 mg/L ... 127
18. Tahap penghitungan Produktivitas Sekunder dan P/B rasio Non-kohort menggunakan metode frekuensi-ukuran (size frequency method) larva Polypedilum di lokasi KJA
kedalaman 1 m. ... 128
19. Tahap penghitungan Produktivitas Sekunder dan P/B rasio Non-kohort menggunakan metode frekuensi-ukuran (size-frequency
method) larva Polypedilum di lokasi KJA kedalaman 2 m ... 129
20. Tahap penghitungan Produktivitas Sekunder dan P/B rasio Non-kohort menggunakan metode frekuensi-ukuran (size-frequency
method) larva Polypedilum di lokasi Non-KJA kedalaman 1 m ... 130
21. Tahap penghitungan Produktivitas Sekunder dan P/B rasio Non-kohort menggunakan metode frekuensi-ukuran (size-frequency
method) larva Polypedilum di lokasi Non-KJA kedalaman 2 m ... 131
22. Analisis regresi linear berganda untuk melihat pengaruh ketersediaan berbagai jenis bahan organik terhadap keberadaan jumlah larva instar III di lokasi KJA ... 132
23. Analisis regresi polinomial untuk melihat pengaruh klorofil-a
xxix
Instar : Periode atau stadia antar pergantian kulit (molt) pada serangga selama stadia nimfa atau larva dalam daur hidupnya; instar biasanya diberi bernomor, larva instar satu adalah stadia setelah menetas dari telur sampai pergantian kulit pertama.
Kapsul kepala : Bagian kepala pada beberapa jenis serangga, keras seperti cangkang karena dilindungi kitin
Kitin : Polisakarida nitrogenus (Nitrogenous polysaccharide) dengan
formula (C8H13O5N)n yang kaku dan keras; tidak larut dalam air, alcohol, alkali, asam-asam pelarut, dan cairan digestif dari kebanyakan hewan
Larva : Istilah untuk stadia muda dari hewan yang hidup bebas, aktif, dengan bentuk morfologi tidak mirip hewan dewasa; tumbuh menjadi dewasa melalui metamorfosis sempurna.
1.
PENDAHULUAN
1.1.
Latar belakang
Salah satu kelompok serangga perairan yang dijumpai di perairan tergenang adalah larva chironomida. Larva chironomida merupakan organisme yang memiliki peran penting bagi rantai makanan dan tingkart trofik level di suatu ekosistem perairan. Larva chironomida memiliki peranan penting dalam rantai makanan di ekosistem perairan sebagai makanan bagi ikan (Pinder 1986; Batzer 1998; Kakareko 2002; Lobinske et al. 2002; Kamler et al. 2008) dan organisme
avertebrata lainnya (Pinder 1986).
Famili Chironomidae atau yang sering disebut non-biting midges
merupakan serangga air dengan larva yang hidup pada berbagai tipe habitat perairan dan tersebar di seluruh dunia. Larva serangga air ini dapat ditemukan pada berbagai tipe perairan tawar, baik mengalir maupun tergenang, sampai ke perairan bersalinitas (Bervoets et al. 1995; Bidwell & Gorrie 2006) bahkan
sebagai bentuk adaptasi, ada yang hidup di darat (Delettre 1995; Frouz 1999; Delettre 2000; Delettre 2005). Epler (2001) menyatakan bahwa larva chironomida merupakan komunitas yang biasanya ditemukan melimpah pada perairan tawar, baik dalam jumlah spesies maupun jumlah individu. Hal ini diperkuat oleh pernyataan Frouz et al. (2003) dan Zilli et al. (2008) yang
menyatakan bahwa larva chironomida merupakan komponen penting pada ekosistem perairan karena populasi yang melimpah dan peran sertanya dalam rantai makanan pada eksosistem perairan sebagai makanan bagi makroavertebrata yang lebih besar dan ikan.
Larva chironomida membutuhkan lingkungan perairan yang tepat agar dapat tumbuh dan berkembang secara optimal. Beberapa jenis di antaranya mempunyai kemampuan toleransi terhadap penurunan kandungan oksigen (Pinder 1986), peningkatan kandungan bahan organik (Arimoro et al. 2007), bahkan peningkatan
kandungan logam berat (Groenendijk et al. 1998; Bhattacharya et al. 2005; Dias et al. 2008; Gillis & Wood 2008). Perubahan-perubahan pada parameter kualitas
lingkungan tersebut juga dapat berpengaruh terhadap pola penyebaran komunitas larva chironomida (Pinder 1986; Gardarsson et al. 2004; Arimoro et al. 2007;
Davanso & Henry 2007; García & Suárez 2007). Kondisi lingkungan juga dapat berpengaruh terhadap kondisi morfologi larva chironomida berupa perubahan bentuk kepala (Jeyasingham & Ling 1997), gigi (Madden et al. 1992; Servia et al.
1998), atau antena (Servia et al. 1998; Bhattacharya et al. 2005).
Larva chironomida hidup dengan memanfaatkan bahan organik terlarut (Pinder 1986), algae perifitik (Goldfinch & Carman 2000; Tarkowska-Kukuryk & Mieczan 2008), bahkan organisme lain yang lebih kecil ukurannya (Tarkowska-Kukuryk & Mieczan 2008) sebagai bahan makanannya. Cara makan larva chironomida ada yang bersifat detrivor (memakan organisme atau algae yang sudah mati), grazer (memakan algae dan fitoplankton), dan beberapa ada yang bersifat predator (memangsa avertebrata lain yang lebih kecil) (Pinder 1986).
Faktor yang turut berperan dalam perkembangan populasi larva chironomida adalah substrat tempat menempelnya. Berbagai jenis benda yang tenggelam di dalam air dapat menjadi substrat bagi larva chironomida, di antaranya batu, sedimen halus, kayu tenggelam, dan tumbuhan air; bahkan ada yang epizoik atau menempel pada hewan lain (Pinder 1986). Kebanyakan larva chironomida hidup membentuk tabung pada substrat (Pennak 1978; McCafferty 1981; Pinder 1986). Substrat bagi larva chironomida berperan sebagai rumah dan tempat berlindung dari kondisi lingkungan yang tidak nyaman (Pennak 1978; Halpern et al.2002).
Komposisi larva chironomida sangat tergantung pada tipe dan keberadaan substrat sebagai habitat hidupnya. Substrat buatan merupakan suatu alat yang digunakan sebagai tempat atau habitat suatu organisme (Taylor & Kovats 1995). Substrat buatan dapat digunakan untuk melihat proses kolonisasi dan suksesi pada chironomida. Tipe dan posisi kedalaman substrat mempengaruhi kepadatan populasi dan perkembangan larva chironomida. Keragaman kondisi perairan di setiap kedalaman juga akan mempengaruhi distribusi larva chironomida pada setiap kedalaman (Ward 1992).
merusak habitat asli dari organisme yang hidup di kawasan tersebut. Selain itu penelitian mengenai dinamika (jumlah dan ukuran) larva chironomida sangat jarang dilakukan di Indonesia.
Berbagai penelitian lain di danau yang mengkuantifikasi makroavertebrata menggunakan alat pengambil contoh benthos yang konvensional hanya menemukan larva chironomida dalam jumlah yang sedikit (Sudarso 2008 dan Lukman et al. 2008) dan tidak ditemukan pada kedalaman di mana kondisi
oksigen rendah (Heinis & Davids 1993). Penggunaan alat konvensional seperti grab dalam penelitian yang mengkaji komunitas bentik memberikan data larva chironomida yang minim bahkan tidak ditemukan adanya larva chironomida.
Dalam perkembangannya, untuk mengkuantifikasi larva chironomida dengan menggunakan alat pengambilan contoh benthos yang konvensional, seperti grab, pada kondisi tertentu kurang efektif sehingga digunakan substrat buatan untuk mengakomodasi dari pemecahan masalah tersebut. Sudarso et al.
(2002) dalam penelitiannya menggunakan substrat buatan dapat menjelaskan terjadinya kolonisasi makroavertebrata termasuk larva chironomida dalam kaitannya dengan pencemaran bahan organik. Hal ini berkaitan dengan kandungan oksigen terlarut yang seringkali rendah di dasar perairan pada lokasi yang tercemar bahan organik.
Rendahnya nilai kandungan oksigen di dasar perairan pada lokasi yang mendapat masukan bahan organik berlebih, seperti di daerah karamba jaring apung (KJA), tidak memberikan peluang yang banyak bagi larva chironomida untuk dapat bertahan hidup. Oleh sebab itu, substrat buatan digunakan untuk mendapatkan dan melihat kolonisasi larva chironomida pada kedalaman tertentu berkaitan dengan dinamika perkembangan dan kelimpahan organisme tersebut.
produktivitas larva chironomida di berbagai kedalaman perairan dan waktu tertentu pada substrat buatan belum pernah dilakukan.
1.2. Perumusan Masalah
Kualitas air merupakan faktor yang sangat penting bagi larva chironomida. Terdapat faktor pada kualitas air yang dapat menjadi penentu pertumbuhan dan perkembangan hidupnya, antara lain suhu, kandungan oksigen, dan kedalaman perairan. Sebagai kelompok organisme yang hidup di substrat dasar perairan, kedalaman perairan akan berpengaruh terhadap keberlangsungan hidup organisme tersebut.
Larva chironomida merupakan larva serangga air yang di dalam ekosistem perairan memiliki peran sebagai perantara organisme autotrof dengan organisme heterotrof pada tingkat trofik lebih tinggi. Banyak jenis larva chironomida yang memanfaatkan algae sebagai makanannya. Selain itu, ada juga jenis-jenis larva chironomida yang memanfaatkan bahan organik sebagai makanan. Selanjutnya larva chironomida ini akan menjadi makanan bagi hewan-hewan pada tingkat trofik yang lebih tinggi.
Kondisi suatu perairan yang kaya bahan organik dapat menjadi pendukung pertumbuhan dan perkembangan larva chironomida. Dengan demikian bila larva chironomida dapat ditumbuhkan di suatu perairan yang kaya bahan organik, diharapkan dapat dilakukan pengkajian mengenai produktivitas sekunder dari larva chironomida. Selain itu perairan yang akan kaya bahan organik dapat dimanfaatkan untuk pertumbuhan larva chironomida.
menjadi sarana dalam mengkaji pengaruh posisi kedalaman dan kandungan bahan organik berbeda terhadap pertumbuhan dan perkembangan larva chironomida.
1.3. Tujuan dan Manfaat
Tujuan dari penelitian ini adalah untuk:
1) Membuat pola perkembangan penumpukan bahan organik yang terdapat pada substrat buatan.
2) Membedakan perkembangan chironomida pada substrat buatan yang diletakkan pada kedalaman perairan dan kandungan bahan organik berbeda.
3) Membandingkan pola pertumbuhan chironomida pada substrat buatan yang diletakkan pada kedalaman perairan dan kandungan bahan organik berbeda.
4) Menentukan produktivitas larva chironomida terkait bahan organik. 5) Menghubungkan keterkaitan antara produktivitas larva chironomida
dengan bahan organik.
Adapun manfaat dari penelitian ini adalah memberikan informasi mengenai dinamika komunitas dan produktivitas sekunder dari larva chironomida dalam suatu ekosistem perairan. Dengan demikian informasi ini dapat digunakan sebagai acuan dalam pemanfaatan larva chironomida.
1.4. Hipotesis
Jika substrat buatan diletakkan pada kedalaman dan kandungan bahan organik yang memadai, maka substrat tersebut dapat menjadi habitat dan penyedia makanan bagi larva chironomida serta akan terbentuk lingkungan yang akan mampu mendukung pertumbuhan populasi chironomida, sehingga produktivitas sekunder chironomida dapat dipelajari.
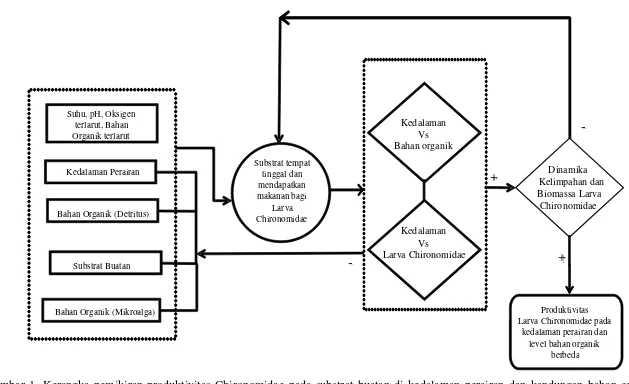
1.5. Kerangka Pemikiran
Kedalaman perairan akan mempengaruhi ketersediaan oksigen yang dibutuhkan bagi kelangsungan hidup larva chironomida. Bahan organik, baik dalam bentuk detritus maupun mikroalga, pada jumlah yang sesuai dapat menjadi sumber makanan bagi beberapa jenis larva chironomida.
Dinamika komunitas larva chironomida sangat tergantung pada substrat sebagai habitatnya. Pemanfaatan bahan organik oleh larva chironomida akan lebih mudah diteliti jika disediakan suatu substrat buatan bagi chironomida. Substrat buatan ini diharapakan dapat menjadi tempat tinggal dan tempat untuk memperoleh makanan sehingga mendukung pertumbuhan dan perkembangan larva chironomida. Dengan demikian terjadi dinamika komunitas dan biomassa dari larva chironomida yang pada akhirnya dapat mendukung produktivitas larva chironomida. Kerangka pemikiran penelitian ini dapat dilihat pada Gambar 1.
1.6. Nilai kebaruan (novelty)
Penelitian ini memiliki nilai kebaruan dalam dua aspek, yaitu aspek keilmuan dan aspek metode. Nilai kebaruan dari aspek keilmuan terutama terkait dengan informasi biologi larva chironomida di daerah tropis. Hal ini dimungkinkan karena informasi mengenai waktu capaian setiap instar pada larva dari Famili Chironomidae kebanyakan berasal dari daerah subtropis (Pinder 1986; Frouz et al. 2002). Terdapat tiga nilai kebaruan dari aspek keilmuan, pertama
-+
Bahan Organik (Detritus)
Bahan Organik (Mikroalga) Kedalaman Perairan Suhu, pH, Oksigen
terlarut, Bahan Organik terlarut
Substrat Buatan
-Substrat tempat tinggal dan mendapatkan makanan bagi
Larva Chironomidae
Produktivitas Larva Chironomidae pada
kedalaman perairan dan level bahan organik
berbeda
Dinamika Kelimpahan dan Biomassa Larva
Chironomidae Kedalaman
Vs Bahan organik
Kedalaman Vs
Larva Chironomidae
+
Gambar 1. Kerangka pemikiran produktivitas Chironomidae pada substrat buatan di kedalaman perairan dan kandungan bahan organik
2.
TINJAUAN PUSTAKA
2.1. Chironomidae
Chironomidae merupakan salah satu famili dari serangga Ordo Diptera. Serangga dari ordo Diptera memiliki nama yang berasal dari jumlah sayap (ptera)
pada hewan dewasa yang hanya dua (Di-), bukan empat seperti kebanyakan serangga lainnya (McCafferty 1981). Sebagai serangga air, Diptera sangat banyak ditemukan pada berbagai tipe perairan. Larva chironomida dapat ditemukan di daerah litoral maupun profundal perairan tergenang (Hershey & Lamberti 2001). Kebanyakan larva chironomida hidup meliang di dasar substrat, beberapa membentuk tabung pada substrat (Pennak 1978; McCafferty 1981; Pinder 1986). Tidak seperti larva nyamuk yang hidup terutama dekat permukaan air, larva chironomida hidup di dasar atau di atas tumbuhan air dan objek yang tenggelam. Beberapa spesies yang hidup di danau umumnya larva yang berenang bebas, bahkan beberapa spesies yang hidup sebagai benthos memiliki larva yang berenang bebas pada instar awal.
2.1.1.Perkembangan hidup chironomida
Chironomida seperti semua Diptera yang memiliki metamorfosis sempurna, memiliki empat stadia hidup, yaitu telur, larva, kepompong, dan dewasa (Pennak 1978; McCafferty 1981). Biasanya, setelah proses pemijahan, hewan betina meletakkan massa telur di permukaan air yang akan tenggelam ke dasar perairan, dan selanjutnya menetas dan berkembang menjadi larva (Ciborowski 2002). Siklus hidup sejak dari telur hingga dewasa berkisar antara kurang dari satu minggu hingga lebih dari satu tahun, tergantung dari spesies dan musim. Pada Gambar 2 diilustrasikan siklus Chironomus riparius sebagai contoh siklus hidup
dari Famili Chironomidae. Menurut Hilsenhoff (2001) siklus hidup Chironomidae bervariasi untuk setiap spesies, dari univoltine (satu generasi dalam
Gambar 2. Gambar siklus hidup Chironomus riparius. Telur dan larva instar
pertama umumnya planktonik, sementara instar-instar yang lebih tua bermigrasi ke sedimen sebagai benthos, dan dewasa hidup di udara. (Sumber: modifikasi Charles et al. 2004).
Chironomidae dewasa melakukan perkawinan di udara dalam bentuk gerombolan, akan tetapi beberapa spesies melakukan perkawinan di tanah. Telur terdapat dalam kantung-kantung bergelatin yang merupakan pelindung massa telur yang kompleks, yang diletakkan di air. Massa telur dapat tenggelam ke dasar perairan atau melekat dengan tali jangkar gelatin di tumbuhan atau substrat tenggelam. Beberapa spesies meletakkan telur yang mengapung di permukaan air seperti massa gelatin. Setiap massa telur, tergantung spesiesnya, memiliki kurang dari 100 sampai dengan 2000 butir telur. Telur biasanya menetas setelah 24 sampai 36 jam (Hershey & Lamberti 2001).
Gambar 3. Bentuk larva chironomida (Sumber: Hilsenhoff 2001).
2.1.2.Pertumbuhan larva chironomida
Pertumbuhan adalah pertambahan ukuran panjang atau berat dalam suatu waktu. Pada serangga pertumbuhan bersifat diskontinyu, terutama karena ada bagian tubuh yang tersusun dari sklerotin, kutikula yang kaku membatasi pembesaran tubuh. Dalam memperbesar tubuh, serangga harus melakukan molting, yaitu pembentukan secara periodik kutikula baru yang lebih besar untuk menggantikan kutikula yang lama. Oleh karena itu, pada ruas dan anggota tubuh yang memiliki sklerit, peningkatan ukuran tubuh terbatas pada periode postmolt sesaat setelah molting, sebelum kutikula menjadi kaku dan mengeras (Gullan & Cranston 2005).
Kajian mengenai perkembangan serangga melibatkan dua komponen pertumbuhan. Yang pertama adalah pertambahan karena molting, yaitu pertambahan ukuran yang terjadi antara satu instar denga instar yang lain. Umumnya peningkatan ukuran dihitung sebagai peningkatan dimensi tunggal (misalnya panjang atau lebar) dari bagian tubuh yang bersklerotin. Pertambahan bobot tidak dapat digunakan sebagai acuan pengukuran karena dapat memberikan informasi yang keliru akibat adanya keragaman makanan dan lingkungan perairan. Komponen kedua adalah periode intermolting, dikenal sebagai stadium atau capaian instar, yang didefinisikan sebagai waktu antara dua molting yang berurutan. Besarnya pertambahan molting dan periode intermolting dipengaruhi oleh ketersediaan makanan, suhu, kepadatan larva, dan kerusakan fisik (hilangnya anggota tubuh), dan dapat berbeda antara individu jantan dan betina pada spesies yang sama (Pinder 1986).
fitoplankton, dan beberapa ada yang bersifat predator atau memangsa avertebrata lain yang lebih kecil (Pinder 1986). Jenis herbivor dan detritivor memakan dengan cara grazing partikel halus di atas substrat, beberapa filter feeder yang
melengkapi dirinya dengan jaring untuk menyaring air yang dialirkan melalui tabungnya. Kebanyakan larva yang bersifat predator hidup bebas, akan tetapi kebanyakan spesies memiliki tabung yang terbuat dari partikel substrat halus yang direkatkan oleh sekresi air liurnya (Hilsenhoff 2001).
Larva Chironomida pada setiap habitat memiliki pola adaptasi yang berbeda pula, khususnya terhadap suhu dan oksigen (McCafferty 1981; Pinder 1986; Frouz et al. 2003). Banyak spesies larva Chironomidae yang tahan terhadap
kandungan oksigen yang rendah. Hal ini berkaitan dengan darahnya yang mengandung hemoglobin.
Beberapa jenis membuat tabung yang menjulang di atas substrat dalam rangka mempertahankan konsentrasi oksigen lebih dari 7 mg/L di bukaan tabung (Pinder 1986). Akan tetapi, kelimpahan larva Chironomida juga menunjukkan korelasi yang negatif terkait keberadaan oksigen. Diduga kondisi ini sebagai korelasi yang positif dengan kandungan bahan organik (Pinder 1986). Dengan demikian, chironomida seringkali menjadi salah satu organisme yang menjadi indikator kondisi perairan. Larva dari salah satu jenis chironomida sangat sensitif terhadap perubahan lingkungan dan bentuk polusi, sementara chironomida jenis lainnya merupakan jenis yang toleran terhadap perubahan kondisi perairan.
Larva chironomida membantu membongkar sedimen organik, yaitu dengan membersihkan air dan memecahkan bahan-bahan yang membusuk. Chironomida memiliki peran penting dalam jala makanan di perairan. Larva chironomida memiliki peranan penting dalam rantai makanan pada ekosistem perairan sebagai makanan bagi ikan (Pinder 1986; Batzer 1998; Kakareko 2002; Lobinske et al.
2002; Kamler et al. 2008) dan organisme avertebrata lainnya (Pinder 1986). Di
bahwa banyak larva spesies Chironomidae yang cenderung menyukai kedalaman tertentu dari perairan. Beberapa jenis cenderung berpindah posisi kedalaman seiring dengan perkembangan siklus hidupnya.
2.2. Produktivitas Sekunder
Produktivitas sekunder adalah pembentukan biomassa heterotrofik sepanjang waktu (Downing & Rigler 1984; Benke & Huryn 2007) atau laju pembentukan biomassa baru oleh organisme konsumer. Produktivitas sekunder tahunan, misalnya, adalah jumlah semua biomassa yang diproduksi suatu populasi selama satu tahun. Termasuk juga sisa produksi di akhir tahun dan semua kehilangan produksi selama periode ini. Kehilangan tersebut termasuk karena kematian (karena penyakit, parasitisme, kanibalisme, predasi), kehilangan cadangan jaringan (molting, kelaparan), dan emigrasi. Laju produksi sekunder juga dapat diartikan sebagai jumlah jaringan tubuh yang bertambah dari avertebrata air tawar per unit waktu per unit area (Clarke 1946; Waters & Crawford 1973 in Downing &Rigler 1984).
yang relatif konstan sekitar 5 (dengan rentang nilai biasanya antara 3 sampai 8). Karena dihitung selama suatu periode waktu yang bervariasi (yaitu selama daur hidupnya), lebih merupakan suatu rasio (tidak memiliki satuan) daripada suatu nilai mutlak.
Saat suatu kohort tumbuh seiring waktu, terjadi penurunan jumlah individu (N), yang disebabkan oleh kematian, dan peningkatan massa individu (W), terkait dengan pertumbuhan. Hal ini dijelaskan melalui pendekatan populasi serangga sungai pada Gambar 4. Selang produksi (waktu antara dua pengambilan contoh) dapat dihitung dari data lapangan menggunakan metode jumlah-peningkatan (increment-summation method) sebagai hasil dari kepadatan rata-rata antara dua pengambilan contoh dan penambahan massa individu ∆W (N×∆W).
Gambar 4. Kohort hipotetik dari serangga sungai yang menggambarkan pertumbuhan individu dalam massa (W) dan kematian/mortalitas individu (N). (Sumber: modifikasi Benke 1984 in Benke & Huryn
2007).
Asumsi yang digunakan adalah hanya ada satu generasi setiap tahun, sehingga produksi tahunan dapat dihitug sebagai jumlah dari seluruh perkiraan selang, ditambah biomassa awal, yang memenuhi persamaan:
∑ ̅ (1)
Pendugaan produksi pada populasi yang tidak dapat ditelusuri sebagai satu kohort dari data di lapangan harus dilakukan menggunakan metode Non-kohort. Metode ini memerlukan pendekatan bebas dari waktu pertubuhan atau laju pertubuhan biomassa. Pada metode frekuensi-ukuran (size-frequency method),
digunakan asumsi bahwa distribusi frekuensi-ukuran distribusi yang ditentukan dari sampel selama setahun mendekati kurva kematian bagi kohort rata-rata (Hynes and Colemen 1968, Hamilton 1969, Benke 1979 in Benke & Huryn 2007).
Dengan demikian pada metode ini penurunan jumlah individu dari satu ukuran ke ukuran berikutnya harus dikalikan dengan rata-rata biomassa antara dua selang ukuran. Hal ini dilakukan karena diasumsikan terdapat perkembangan total dalam satu tahun dan terdapat kohort dengan jumlah yang sama selama satu tahun saat ukuran dikelompokkan. Kohort P/B memiliki nilai yang sama dengan jumlah kolom biomassa (rata-rata biomassa tahunan) dibagi dengan jumlah kolom terakhir (produksi diasumsikan dalam satu tahun (Benke & Huryn 2007).
2.3. Substrat Buatan
Substrat bagi Chironomidae merupakan tempat untuk beristirahat, mendapatkan makanan, bereproduksi dan pertumbuhan (misalnya sebagai tempat menempel kepompong), maupun tempat berlindung dari predator dan kondisi fisik yang tidak nyaman (Hershey & Lamberti 2001). Substrat buatan merupakan sarana yang dibuat dari material alami maupun buatan dengan berbagai komposisi dan konfigurasi, yang ditempatkan dalam air pada kedalaman tertentu selama periode pemaparan, untuk kolonisasi komunitas makroavertebrata (Eaton et al.1995; WDNR 1998; Klemm et al. 1990 in Saliu & Ovuorie 2007). Substrat
buatan merupakan manipulasi atau imitasi dari karakteristik substrat alami (Allan 1995 in Saliu & Ovuorie 2007). Seperti halnya pada substrat alami yang
tenggelam (misalnya ranting kayu), kolonisasi utama pada substrat buatan dilakukan oleh larva serangga air, diikuti oleh crustacea, coelenterata, bryozoan, cacing, gastropoda, dan moluska (Eaton et al.1995, Taylor & Kovats 1995).
Kegunaan substrat buatan adalah untuk mendapatkan sampel populasi hewan avertebrata bentik, mengingat bahwa habitat organisme tidak memungkinkan bagi suatu alat sampling kuantitatif seperti grabs, dredges, nets,
1982 in Saliu & Ovuorie 2007). Substrat buatan untuk mendapatkan sampel
makroavertebrata juga diyakini memberikan nilai keragaman yang lebih rendah dikarenakan substrat buatan memiliki bentuk habitat yang seragam untuk proses kolonisasi.
Taylor & Kovats (1995) menyebutkan keuntungan utama dalam penggunaan substrat buatan untuk mendapatkan data makroavertebrata adalah untuk meminimalisasi bentuk variasi fisik seperti jenis substrat, kedalaman, dan penetrasi cahaya. Alat ini juga dapat digunakan karena tidak menggangu keberadaan organisme asli di kawasan tersebut. Substrat buatan baik digunakan untuk mendapatkan data mengenai populasi makroavertebrata ketika alat konvensional tidak efisien dan tidak efektif untuk digunakan, khususnya pada perairan yang memiliki karakteristik sebagai berikut.
1. Sifat badan air yang memiliki kedalaman tinggi dan keruh. 2. Sifat substrat yang tidak stabil berupa pasir dan lumpur. 3. Sifat dasar perairan yang berupa bebatuan besar dan keras. 4. Sifat badan air yang memiliki arus yang kencang.
Melalui substrat buatan, habitat yang tidak cocok untuk organisme benthik dapat diatasi dengan menyeragamkan bentuk dasar dari habitat yang dapat diletakkan pada area mana pun sesuai dengan kondisi yang diinginkan. Asumsi mengenai hal ini adalah bahwa komposisi dari organisme yang mengalami kolonisasi di substrat buatan dapat digunakan untuk menduga dampak dari kegiatan antropogenik dan merupakan hal yang sama saat menggunakan alat grab
(Hellawell 1978 in Saliu & Ovuorie 2007). Flannagan & Rosenberg (1982)
membagi substrat buatan menjadi 8 tipe sebagai berikut.
1. Kontainer berisi macam-macam substrat (containers filled with various substrates);
2. Multiplate (atau multiple-plate) samplers;
3 Papan, panel, ubin; 4. Batu bata dan balok;
5. Lembaran plastik, polyethylene dan kain, tali temali;
6. Substrat implant;
7. Substrat organik alami; dan
2.4. Lingkungan perairan yang mempengaruhi chironomida 2.4.1. Kedalaman
Kedalaman merupakan salah satu parameter fisika perairan yang berkaitan erat dengan intensitas cahaya matahari, tekanan, dan suhu di dalam kolom perairan. Semakin dalam perairan, semakin berkurang intensitas cahaya matahari yang masuk. Semakin besar kedalaman, semakin besar tekanan air. Tekanan pada air berpengaruh terhadap proses osmosis dalam tubuh organisme sehingga organisme akan berusaha agar tekanan osmosis lingkungan sesuai dengan keadaan tubuh dan proses osmoregulasi dalam tubuh organisme. Hal ini berpengaruh terhadap pola penyebaran organisme, khususnya makroavertebrata pada kolom perairan dengan kedalaman yang berbeda (Pinder 1986; Wetzel 2001).
Kedalaman juga dapat berpengaruh terhadap stratifikasi suhu dalam kolom perairan berkenaan dengan panas yang diterima pada setiap kolom perairan. Hal ini disebabkan oleh semakin besarnya gaya yang bekerja pada lapisan yang lebih dalam. Kedalaman merupakan wadah penyebaran atau faktor fisik yang berhubungan dengan banyaknya air yang masuk ke dalam suatu sistem perairan dan berpengaruh terhadap penyebaran organisme perairan.
2.4.2. Suhu
Suhu merupakan parameter penting dalam perairan dan berpengaruh secara langsung maupun tidak langsung terhadap kehidupan di perairan. Suhu suatu perairan dipengaruhi oleh musim, lintang (latitude), ketinggian dari permukaan
laut (altitude), waktu dalam hari, sirkulasi udara, penutupan awan, dan aliran serta
kedalaman badan air. Perubahan suhu berperan terhadap proses fisika, kimia, dan biologi badan air. Suhu juga sangat berperan dalam mengendalikan kondisi ekosistem perairan. Peningkatan suhu mengakibatkan peningkatan viskositas, reaksi kimia, evaporasi, dan volatilitas. Peningkatan suhu juga menyebabkan terjadinya peningkatan dekomposisi bahan organik oleh mikroba (Wetzel 2001).
Dytiscidae dan Hydrophylidae; Hemiptera; dan Odonata (Ward 1992). Menurut Casper in Rossaro (1991), suhu, substrat, dan kecepatana arus merupakan factor
penentu struktur komunitas chironomida. Suhu adalah salah satu faktor penentu penting bagi laju pertumbuhan dan perkembangan serangga air. Ukuran serangga dewasa sangat tergantung pada suhu perairan yang diterimanya pada saat perkembangan larva di air (Pinder 1986).
2.4.3. Oksigen terlarut
Dissolved Oxygen (DO) atau oksigen terlarut adalah jumlah mg/L gas
oksigen yang terlarut dalam air. Kadar oksigen yang terlarut bergantung pada suhu, salinitas, turbulensi air, dan tekanan atmosfer. Semakin besar suhu dan ketinggian, serta semakin kecil tekanan atmosfer, kadar oksigen terlarut akan semakin kecil (Wetzel 2001).
Fluktuasi harian oksigen dapat mempengaruhi parameter kimia yang lain, terutama pada saat kondisi tanpa oksigen, yang dapat mengakibatkan perubahan sifat kelarutan beberapa unsur kimia di perairan. Selain itu, penurunan konsentrasi DO juga dapat menyebabkan dampak yang kurang baik bagi makroavertebrata karena oksigen terlarut dibutuhkan untuk respirasi makroavertebrata seperti serangga akuatik sehingga merupakan parameter lingkungan yang sangat penting (Ward 1992). Beberapa jenis anggota Chironomidae tahan terhadap kandungan oksigen yang rendah (Pinder 1986).
Distribusi dan kelimpahan benthos (misalnya larva serangga, crustacea, dan moluska) sangat dipengaruhi oleh konsentrasi oksigen dan tipe dasar perairan. Kebanyakan populasinya ditemukan di atas sedimen pada lapisan termoklin dan tepi danau yang mengalami turbulensi oksigen dan yang memiliki makanan melimpah. Pada bagian bawah termoklin, jumlah mereka turun karena terjadi penurunan suhu. Organisme yang memiliki spesialisasi tertentu saja yang dapat mendiami zona profundal danau eutrof yang juga memiliki kandungan oksigen rendah (Goldman & Horne 1983).
2.4.4. Bahan organik
dan industri. Berbagai jenis bahan organik yang terdapat di alam ini dirombak (didekomposisi) melalui proses oksidasi, yang dapat berlangsung dalam suasana aerob (keberadaan oksigen) maupun anaerob (tanpa oksigen). Produk hasil akhir dari dekomposisi atau oksidasi bahan organik pada kondisi aerob adalah senyawa-senyawa yang stabil. Sementara produk akhir dari dekomposisi pada kondisi anaerob, selain karbondioksoda dan air, juga berupa senyawa-senyawa yang tidak stabil dan bersifat toksik, misalnya amonia, metana, dan hidrogen sulfida. Keberadaan bahan organik di perairan juga dapat menjadi sumber makanan bagi beberapa kelompok organisme, terutama kelompok organisme pemakan detritus (Pinder 1986).
2.4.5. Nilai pH
Puissanced’Hydrogen (pH atau kekuatan hidrogen) didefinisikan sebagai
logaritma negatif dari ion hidrogen (Goldman&Horne 1983). Nilai pH penting untuk mengindikasikan jumlah ion hidrogen bebas yang berada di dalam air karena adanya logaritma negatif (pH= -log10 [H+]). Perkiraan dari alkalinitas, karbondioksida, dan reaksi asam basa diperoleh dengan menggunakan nilai pH. Konsentrasi ion hidrogen juga merupakan salah satu indikator utama untuk evaluasi kualitas air permukaan mengontrol reaksi kimia berbagai nutrien di danau (Goldman & Horne 1983).
Derajat keasaman (pH) normal memiliki nilai 7 sementara bila nilai pH > 7 menunjukkan zat tersebut memiliki sifat basa, sedangkan nilai pH < 7 menunjukkan keasaman. Nilai pH=0 menunjukkan derajat keasaman tertinggi, dan pH 14 menunjukkan derajat kebasaan tertinggi. Umumnya indikator sederhana yang digunakan adalah kertas lakmus yang berubah menjadi merah bila keasamannya tinggi dan biru bila keasamannya rendah. Selain mengunakan kertas lakmus, indikator asam basa dapat diukur dengan pH meter yang bekerja berdasarkan prinsip elektrolit/konduktivitas suatu larutan.
Nilai pH bersama suhu perairan, oksigen terlarut, nitrat, alkalinitas, ukuran partikel, dan kandungan bahan organik merupakan beberapa faktor yang mempengaruhi kekayaan jenis, kelimpahan, komposisi, dan distribusi chironomida di ekosistem perairan (Pinder 1986, Rossaro 1991, Lobinske et al.
empat genus chironomida yang menyukai nilai pH tertentu. Genera
Paratanytarsus, Procladius (Psilotanypus), dan Thienemannimyia menyukai pH
3. METODE PENELITIAN
3.1. Lokasi dan Waktu Penelitian
Penelitian utama dilaksanakan di Danau Lido (Gambar 5) yang terletak diketinggian 502,2 m dpl. Terdapat dua titik di danau yang digunakan sebagai lokasi peletakan substrat untuk kebutuhan penelitian. Lokasi pertama berada pada koordinat 106o48’42” BT dan 06o44’29” LS, sedangkan lokasi kedua berada pada koordinat 106o 48’30” BT dan 06o44’47” LS. Lokasi satu adalah kawasan dengan karamba jaring apung (KJA), sedangkan lokasi dua merupakan kawasan yang tidak terdapat karamba jaring apung (Non-KJA) (Lampiran 1). Penelitian juga dilakukan di laboratorium pada Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Seluruh rangkaian penelitian dilaksanakan dari Bulan Maret 2009 sampai dengan Bulan Juli 2011.
outlet
inlet
3.2. Alat dan Bahan
Alat-alat dalam penelitian ini meliputi alat yang digunakan dalam penelitian pendahuluan dan penelitian utama. Alat tersebut berupa substrat buatan beserta alat yang digunakan untuk pengambilan sampel dan analisis sampel larva chironomida dan kualitas air pendukung.
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan yang digunakan dalam penelitian pendahuluan dan penelitian utama. Bahan tersebut mencakup bahan pembuatan substrat buatan, serta untuk pengawet sampel dan pembuatan preparat permanen larva chironomida. Selain itu juga digunakan bahan-bahan untuk pengawetan dan analisis sampel kualitas air.
3.3. Metode dan Rancangan Penelitian
Penelitian dilakukan dengan metode ekperimental lapangan (didahului survey post facto) serta dalam bentuk eksperimental laboratorium. Penelitian
ekperimental lapangan dilaksanakan di Danau Lido, Jawa Barat. Kegiatan ekperimental laboratorium dilakukan di laboratorium pada Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Penelitian dirancang dalam bentuk rangkaian tahap penelitian.
Data yang digunakan merupakan data primer yang berasal dari penelitian pendahuluan dan penelitian utama. Data yang digunakan meliputi data ukuran morfologi dari sampel larva chironomida, serta nilai kualitas air pendukung yang meliputi suhu, TSS, kekeruhan, pH, DO, dan bahan organik.
3.4. Tahapan Penelitian
Rangkaian penelitian yang dirancang untuk mengetahui produktivitas sekunder dari Chironomidae melalui tahapan sebagai berikut.
1. Penentuan letak substrat berdasarkan kedalaman dari permukaan air. 2. Penentuan capaian instar larva chironomida.
3. Perkembangan bahan organik pada substrat buatan. 4. Perkembangan dan pertumbuhan larva chironomida.
3.4.1. Penentuan letak substrat berdasarkan kedalaman dari permukaan air
Tahap ini bertujuan untuk menentukan kedalaman posisi substrat buatan yang dapat mendukung komunitas larva chironomidae. Hal ini perlu dilakukan karena kedalaman perairan akan mempengaruhi kolonisasi chironomida berdasarkan ketersediaan oksigen.
Kedalaman yang dicobakan, berturut-turut dari permukaan air, adalah 2 m; 3,5 m; dan 5 m. Pemilihan posisi ini didasarkan pada penelitian pendahuluan mengenai gradien oksigen di Danau Lido. Kedalaman yang dipilih adalah posisi yang memberikan kelimpahan dan produktivitas chironomida tertinggi.
Dalam rangka mencapai tujuan tahap ini dibuat rangkaian substrat buatan yang diletakkan di lokasi yang telah ditentukan di Danau Lido. Rangkaian substrat buatan ini dibuat dari bahan kawat nyamuk berbahan nilon, kawat besi, kayu, botol plastik dengan ukuran 1,5 liter sebagai pelampung, dan batu sebagai pemberat. Kawat besi digunakan sebagai bingkai dibentuk persegi dengan ukuran 30x30 cm2. Bingkai ditutupi kawat nyamuk yang berbahan nilon dengan ukuran mata jaring 2 mm dan dijahit pada setiap sisinya sehingga berbentuk seperti saringan persegi. Langkah selanjutnya adalah membuat rangkaian substrat buatan untuk proses kolonisasi chironomida dengan menggunakan bambu dan tali tambang. Kayu bambu dibuat persegi panjang dengan ukuran panjang 1,3 m dan lebar 30 cm mengikuti panjang sisi kawat besi yang telah dirangkai. Kemudian kawat besi yang sudah dirangkai dengan kawat nyamuk diletakkan pada bambu persegi panjang seperti yang terlihat pada Gambar 6. Pada bagian paling bawah tiap sudut alat diikatkan pemberat dari batu, sedangkan pada bagian atas diikatkan pelampung yang terbuat dari botol plastik minuman mineral ukuran 1,5 liter.
Gambar 6. Posisi substrat buatan di dalam air untuk penentuan letak substrat sebagai habitat larva chironomida.
Analisis laboratorium untuk sampel air secara ex situ dilakukan di
Laboratorium Fisika-Kimia Perairan, Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis sampel chironomida dilakukan di Laboratorium Biomikro I Bagian Produktivitas dan Lingkungan Perairan, Fakultas Perikanan dan Ilmu Kelautan.
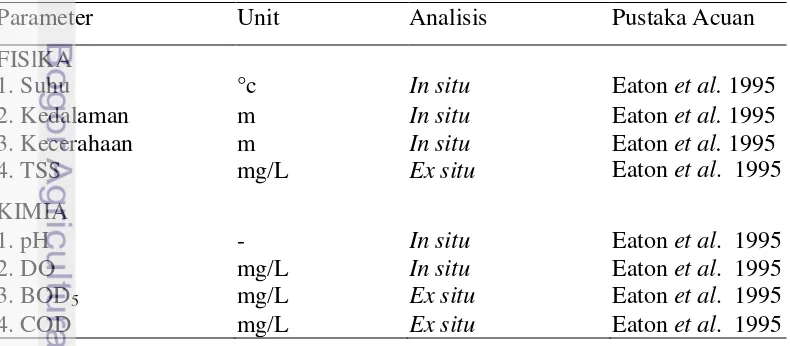
Tabel 1. Metode dan alat yang digunakan pada pengukuran parameter fisika-kimia perairan
Parameter Unit Analisis Pustaka Acuan
FISlKA
1. Suhu °c In situ Eaton et al. 1995
2. Kedalaman m In situ Eaton et al. 1995
3. Kecerahaan m In situ Eaton et al. 1995
4. TSS mg/L Ex situ Eaton et al. 1995
KIMIA
1. pH - In situ Eaton et al. 1995
2. DO mg/L In situ Eaton et al. 1995
3. BOD5 mg/L Ex situ Eaton et al. 1995
4. COD mg/L Ex situ Eaton et al. 1995
3.4.2. Penelusuran capaian instar larva chironomida
Penelitian dilaksanakan di Laboratorium Biologi Mikro I, Bagian Produktivitas Lingkungan, Departemen Manajemen Sumberdaya Perairan, Institut Pertanian Bogor. Penelitian dilakukan pada skala laboratorium dengan lingkungan yang terkontrol. Pada tahap ini digunakan wadah plastik berukuran 34x26x7 cm3 sebagai tempat hidup larva chironomida yang menjadi objek penelitian. Pertimbangan penggunaan wadah plastik ini adalah untuk mempermudah pemeliharaan, kuantifikasi, maupun pengamatan larva chironomida.
Larva chironomida yang ditumbuhkan di laboratorium diambil dalam bentuk massa telur yang berasal dari Danau Lido. Pengambilan massa telur dilakukan pada pagi hari. Massa telur yang diambil diusahakan dalam kuantitas yang sama untuk masing-masing wadah agar jumlah larva yang nantinya dipelihara untuk masing-masing wadah pemeliharaan berjumlah seragam. Pengambilan massa telur dilakukan di sekitar karamba jaring apung dengan menggunakan bantuan kuas.
Di laboratorium, massa telur ditetaskan pada cawan petri yang terpisah untuk masing-masing wadah. Pengamatan selama lebih kurang 24 jam pertama sejak telur yang diambil dari alam diletakkan dalam wadah dilakukan setiap 4 jam dengan kamera yang dihubungkan dengan mikroskop. Larva yang telah menetas dipindahkan ke wadah plastik pemeliharaan berukuran 34x26x7 cm3 yang diisi air Danau Lido setinggi 4 cm. Wadah pemeliharan dilengkapi dengan penutup yang dibuat dari kain kasa nyamuk untuk menghindari serangga lain yang berkemungkinan menjadi predator bagi larva chironomida.
Massa telur yang dipelihara di dalam wadah pemeliharaan diberi tambahan bahan organik berupa kotoran kuda sebagai perlakuan penambahan bahan organik. Pemilihan kotoran kuda sebagai sumber bahan organik yang digunakan dalam penelitian ini merupakan adaptasi dari penelitian McLarney et al. (1974).