PRODUKSI BIOETANOL DARI NIRA AREN (
Arenga pinnata
)
OLEH
Zymomonas mobilis
IIS SOLIHAT
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Produksi Bioetanol dari Nira Aren (Arenga pinnata) Oleh Zymomonas mobilis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Iis Solihat
ABSTRAK
IIS SOLIHAT. F34110045. Produksi Bioetanol dari Nira Aren (Arenga pinnata) oleh Zymomonas mobilis. Dibimbing Oleh MUHAMMAD ROMLI dan LIESBETINI HADITJAROKO.
ABSTRACT
IIS SOLIHAT. F34110045. Arenga pinnata for Bioethanol Production by
Zymomonas mobilis. Supervised by MUHAMMAD ROMLI dan LIESBETINI HADITJAROKO.
The availability of fuel oil as a non-renewable energy are increasingly depleted and scarce especially gasoline, so need to find an alternative fuel that can replace gasoline. Palm juice is one of material that is highly prospective for bioethanol production as it is contains high sugar. This study aims to get the best conditions appropriate to increase the yield of bioethanol. Fermentation was done by using Zymomonas mobilis at room temperature for 72 hours. Analysis of the products was done every 12 hours. In this study evaluated the effect of using
Zymomonas mobilis inokulum concentrations of 5%, 10%, and 15% (v/v) and the impact of the sugar concentration in the sap X1 (18.61%), X2 (22.77%) and X3 (33.66%). The result of chemical analysis showed that total sugar of palm juice 183.4 g/L, the levels of reducing sugars of 95.16 g/L, total carbon at 8.07% ± 0.05% total nitrogen at 0.089 ± 0.02 and urea required 1.53 g/100ml media. The best result of fermentation was by adding 15% of inoculum and sugar content X1 (18.61%). Effect of inoculum concentration and concentration of sugar were accelerate the rate of growth and the inhibition of the formation of the product to high concentrations of sugar. Results of the highest ethanol content was 40.75 g/L or 4.08% (b/v), biomass 8.05 g/L, µ max 1.56 h-1, Y x/s 0.01 g cell/ g substrate, Y p/x 33.96 g ethanol/g cell, Y p/s 0.27 g ethanol/ g substrate, qp 53.07 g product/ g cell. h, dan qs 194.20 g substrate/ g cell.h.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
PRODUKSI BIOETANOL DARI NIRA AREN (
Arenga pinnata
)
OLEH
Zymomonas mobilis
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2015 sampai Februari 2016 ini adalah Produksi Bioetanol dari Nira Aren (Arenga pinnata) Oleh Zymomonas mobilis.
Dalam pembuatan karya tulis ini penulis mendapat banyak bantuan dari banyak pihak, khususnya penulis ucapkan terima kasih kepada:
1. Terima kasih pula penulis ucapkan kepada ibu, kakak dan nenek yang selalu ada dan mendukung dari fisik maupun mental serta Almarhum Bapak yang selalu menjadi pemacu semangat.
2. Bapak Prof Dr Ir Muhammad Romli, M Sc St dan Ibu Dr Ir Liesbetini Haditjaroko, MS selaku pembimbing yang telah memberikan arahan selama penelitian dan penulisan skripsi.
3. Terima kasih kepada Dr Prayoga Suryadarma, STP, MT sebagai dosen penguji.
4. Terima kasih kepada keluarga Bpk. Teddy selaku orang tua asuh.
5. Terima kasih kepada teman-teman Teknologi Industri Pertanian angkatan 48 yang selalu memberi dukungan dan semangat.
6. Terima kasih kepada seluruh Laboran Teknologi Industri Pertanian. semoga skripsi ini bermanfaat.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
METODOLOGI PENELITIAN 3
HASIL DAN PEMBAHASAN 7
Karakteristik Nira Aren 7
Hasil Fermentasi 8
Penentuan Konsentrasi Inokulum Terbaik 8
Penetapan Konsentrasi Gula Terbaik 14
SIMPULAN DAN SARAN 21
Simpulan 21
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 25
DAFTAR TABEL
1 Variabel Perlakuan 5
2 Karakteristik Nira Aren (pada 100 ml) 7
3 Hasil perbandingan parameter kinetika pada konsentrasi inokulum 5%,
10%, dan 15% 13
4 Hasil perbandingan parameter kinetika pada konsentrasi inokulum X1,
X2, dan X3. 18
5 Kinetika fermentasi pada konsentrasi inokulum 15% dan konsentrasi gula
186.1 g/L 20
6 Perkiraan produktivitas etanol tanaman aren per hektar 21
DAFTAR GAMBAR
1 Diagram Alir Tahapan Penelitian 3
2 Grafik biomassa kering pada berbagai konsentrasi inokulum 9
3 Kurva Pertumbuhan 9
4 Grafik kadar etanol pada berbagai konsentrasi inokulum 5%, 10% dan
15% 10
5 Grafik kadar gula pereduksi pada penentuan konsentrasi inokulum 12 6 Grafik total gula pada penentuan konsentrasi inokulum 13 7 Grafik biomassa kering pada penentuan kandungan gula 14 8 Grafik kadar etanol pada berbagai konsentrasi gula X1, X2 dan X3 15 9 Grafik kadar gula pereduksi pada penentuan kandungan gula 16 10 Grafik total gula pada penentuan kandungan gula 17 11 Grafik hubungan antara kadar etanol, biomassa sel dan kadar gula sisa 19
12 Grafik laju pertumbuhan spesifik 20
DAFTAR LAMPIRAN
1 Analisis Karakterisasi Bahan 25
2 Prosedur Analisa Total Gula dan Gula Pereduksi 26
3 Analisis hasil fermentasi 28
4 Perhitungan Rasio C/N 29
5 Hasil Fermentasi 30
6 Perhitungan Anova 36
PENDAHULUAN
Latar Belakang
Bioetanol merupakan bahan bakar alternatif bensin yang dapat dibuat dari bahan organik seperti, singkong, ubi, nira aren dan bahan yang mengandung gula lainnya. Aren (Arenga pinnata MERR) termasuk salah satu jenis tanaman palma, yang tersebar hampir di seluruh wilayah Indonesia, terutama di 14 provinsi, yaitu Papua, Maluku, Maluku Utara, Sumatera Utara, Sumatera Barat, Jawa Barat, Jawa Tegah, Banten, Sulawesi Utara, Sulawesi Selatan, Sulawesi Tenggara, Bengkulu, Kalimantan Selatan dan Aceh dengan total luas areal sekitar 70.000 Ha. Bioetanol yang dihasilkan dari nira aren mempunyai prospek yang lebih tinggi dibandingkan dengan menggunakan umbi-umbian. Hal ini disebabkan jumlah nira aren di Indonesia melimpah dan belum termanfaatkan secara keseluruhan. Potensi tanaman aren untuk dijadikan etanol saat ini sudah cukup besar yaitu mencapai 1.43 juta KL bioetanol per tahun (Efendi 2010), serta kandungan gula nira aren
yang berkisar pada 6˗16% merupakan kandungan gula yang baik untuk fermentasi (Tangkuman et al. 2010).
Pembuatan bioetanol dilakukan dengan bantuan mikroba dalam proses fermentasinya. Mikroba yang dapat digunakan salah satunya yaitu Zymomonas mobilis. Zymomonas mobilis merupakan mikroba yang termasuk ke dalam jenis bakteri yang dapat memecah glukosa, fruktosa dan sukrosa menjadi etanol. Selain itu, sifat Zymomonas mobilis memiliki keuntungan dibandingkan Saccharomyces cerevisiae yaitu, produktivitas yang lebih tinggi dan waktu fermentasi yang lebih cepat karena konsumsi gula yang lebih cepat, sehingga didapatkan rendemen bioetanol yang lebih efisien (Springer (1996), Gunasekaran dan Raj (1999); Glazer dan Nikaido (2007); Letti et al. (2012). Produktivitas Zymomonas mobilis
yang tinggi menunjukkan bahwa laju pertumbuhan Z. mobilis lebih cepat dibandingkan dengan Saccharomyces cerevisiae. Untuk mempercepat laju pertumbuhan maka dilakukan pengaturan media. Faktor penting dalam pembuatan bioetanol ini yaitu konsentrasi mikroba yang ditambahkan dan konsentrasi gula dalam media. Konsentrasi inokulum yang ditambahkan dalam nira harus sesuai dengan substrat yang ada untuk mendapatkan kadar etanol tinggi. Kandungan gula dalam nira juga merupakan faktor penentu dalam pembentukan bioetanol oleh mikroba.
Etanol didapatkan melalui fermentasi dengan mengubah gula yang terdapat dalam media menjadi produk yaitu etanol dengan bantuan mikroba. Akan tetapi untuk mendapatkan hasil terbaik penambahan mikroba harus sesuai dengan media yang akan difermentasikan. Hal tersebut harus dilakukan untuk mendapatkan media terbaik, sehingga didapatkan produk yaitu etanol tinggi. Diperlukan penelitian untuk mengetahui persentase inokulum terbaik yang dapat menghasilkan etanol tinggi. Dosis inokulum yang semakin besar terlalu tinggi dengan lingkungan yang tidak sesuai dengan habitat Zymomonas mobilis
Zymomonas mobilis yaitu sukrosa, glukosa, dan fruktosa. Sukrosa dalam bahan akan diubah terlebih dahulu menjadi glukosa dan fruktosa (Sahm et al. 2006). Menurut Cazetta et al. (2007) Zymomonas mobilis memanfaatkan jalur Entner-Doudoroff untuk memfermentasi glukosa, fruktosa dan sukrosa menjadi piruvat.
Z. mobilis memiliki waktu fermentasi yang lebih singkat dan hasil etanol yang lebih tinggi dibandingkan dengan Saccharomyces (Pleitt 2010). Pada nira dengan kualitas baik, kandungan gula terbanyak yaitu sukrosa. Semakin rusak nira, sukrosa akan menurun dan kandungan gula invert akan meningkat. Penentuan persentase konsentrasi gula dilakukan untuk mengetahui konsentrasi gula terbaik dalam melakukan fermentasi nira aren menjadi bioetanol. Selain itu, penelitian ini dilakukan untuk mengetahui pengaruh konsentrasi gula dalam fermentasi yang dilakukan oleh mikroba yaitu Zymomonas mobilis. Konsentrasi gula yang tinggi menyebabkan produksi etanol menurun secara signifikan akibat adanya efek inhibisi substrat (Cazetta et al. 2007; Pleitt 2010).
Perumusan Masalah
Mengacu pada konteks dan fokus penelitian, masalah penelitian yang dapat dirumuskan adalah pemanfaatan nira aren yang memiliki kandungan gula yang cukup tinggi sebagai bahan baku fermentasi bioetanol. Perbedaan konsentrasi gula dan perbedaan konsentrasi inokulum akan berpengaruh terhadap rendemen bioethanol yang dihasilkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan konsentrasi gula terbaik dan jumlah inokulum bakteri Zymomonas mobilis terbaik, sehingga dapat meningkatkan rendemen bioetanol yang dihasilkan dari nira aren.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini yaitu mendapatkan hasil rendemen bioetanol yang tinggi dari bahan baku nira aren dan penggunaan
Zymomonas mobilis.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah:
1. Karakterisasi nira aren sebagai bahan baku bioetanol
2. Fermentasi Nira aren dengan bantuan bakteri Zymomonas mobilis 3. Pengujian kualitas bioetanol dan rendemen bioetanol yang didapat
METODOLOGI PENELITIAN
Bahan dan Peralatan
Bahan Baku
Bahan baku utama yang digunakan adalah nira aren yang diperoleh dari Kecamatan Karangmande, Kabupaten Cianjur dan mikroba yang digunakan untuk fermentasi bioetanol adalah Zymomonas mobilis yang diperoleh dari Laboratorium Bioindustri, Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Bahan Kimia
Bahan yang digunakan dalam penelitian berupa bahan untuk pertumbuhan antara lain PDA, ekstrak khamir, ammonium sulfat, glukosa, magnesium sulfat, kalium dihidrogen orthofosfat, dan urea. Bahan kimia yang digunakan untuk analisa antara lain, H2SO4 pekat, fenol 5%, larutan DNS, larutan glukosa standar, alkohol 70%, etanol 95%, Ca(OH)2, HCl 0.01 N, H2SO4 0.32, NaOH 1.25 N, NaOH 0.2 N, Na – K Tartarat, dan Na – metabisulfit.
Peralatan
Peralatan yang digunakan yaitu labu Erlenmeyer 1000 ml, labu Erlenmeyer 100 ml, shaker (inkubator goyang), gelas piala 2000 ml, gelas ukur 100 ml, oven, tabung ulir, jarum Ose, kapas, autoklaf, termometer, cawan aluminium, desikator, pipet, penangas air, spektrofotometer UV-Vis, timbangan analitik, pH meter Beckman, buret, pipet mikro, pipet volumetrik, destilator, dan piknometer.
Tahapan Penelitian
Penyiapan Inokulum
Pada proses penyiapan inokulum, bahan yang digunakan dalam pembuatan agar miring yaitu PDA. PDA sebanyak 4 gram dilarutkan dalam aquades hingga volumenya 100 ml kemudian dididihkan sampai semua agar melarut dan di masukkan ke dalam tabung reaksi masing-masing 6 ml, dan mulut tabung ditutup dengan kapas. Setelah itu agar dalam tabung reaksi disterilkan dalam autoclave
pada suhu 121oC selama 15 menit, lalu didinginkan dalam posisi miring, setelah agar mengeras, biakan murni diambil dengan kawat Ose steril dalam agar miring dan digoreskan pada permukaan media agar yang baru dan tabung reaksi ditutup kembali dengan kapas kemudian diinkubasi pada suhu 30oC (Widjaja et al. 2008). Pada tahap preculture, agar miring tersebut diambil koloni yang terbentuk pada media agar. Koloni tersebut selanjutnya ditanam dalam media cair dengan volume 10 ml yang terdiri dari 20 g/L glukosa, 10 g/L ekstrak khamir, 1 g/L kalium dihidrogen orthofosfat, 1 g/L amonium sulfat dan 1 g/L magnesium sulfat dengan suhu 30oC selama 18 jam hingga 20 jam menggunakan inkubator goyang. Kemudian dilakukan penyiapan inokulum dengan volume 500 ml menggunakan bahan media yang sama. Biakan Zymomonas mobilis yang digunakan dalam penelitian ini berumur 18 jam hingga 20 jam (fase eksponensial). Hal ini disebabkan biakan diatas 20 jam Zymomonas mobilis sudah masuk ke dalam fase stasioner (Tanate dan Surya 2012).
Karakterisasi Nira Aren
Nira aren yang didapat dari Kecamatan Karangmande Kabupaten Cianjur dikarakterisasi terlebih dahulu. Karakterisasi yang dilakukan berupa uji kadar air, kadar abu, kadar protein, kadar gula pereduksi, dan kadar total gula (Lampiran 1). Hasil uji karakteristik tersebut digunakan untuk menghitung rasio C/N sebagai acuan penambahan urea ke dalam media fermentasi.
Persiapan Bahan
Nira aren yang digunakan untuk fermentasi disterilisasi dalam otoklaf selama 15 menit dengan suhu 121oC untuk membunuh dan menghentikan aktivitas mikroba lain yang tidak diinginkan dalam fermentasi. Kemudian dilakukan pengaturan pH dan pemenuhan sumber nitrogen dengan penambahan urea sesuai dengan perhitungan C/N yang mengacu pada penelitian yang dilakukan Puspitasari (2014).
Fermentasi
Tabel 1 Variabel Perlakuan
Kode konsentrasi gula Konsentrasi (%b/v) Tahap penelitian 2
(Kadar gula total)
X1 18.61
X2 24.77
X3 33.66
Tahap penelitian pertama yaitu melakukan fermentasi untuk menentukan konsentrasi inokulum terbaik. Menurut Widjaja et al. (2008), pembuatan bioetanol dari nira yaitu mencampur nira dengan mikroba (v/v) sesuai dengan konsentrasi inokulum yang diinginkan yaitu 5%, 10%, dan 15%. Fermentasi dilakukan secara anaerobik pada suhu ruang 30oC secara batch dengan waktu 72 jam dengan menggunakan pH awal 5.5, kemudian dilakukan analisis setiap 12 jam. Penggunaan pH tersebut sesuai menurut Cazetta et al. (2007) bahwa Zymomonas mobilis memiliki toleransi terhadap pH dari 3.5 - 7.5 dan terbaik pada kisaran 5.0
– 7.0. Walaupun dalam jumlah yang sedikit oksigen tetap diperlukan dalam proses fermentasi oleh mikroba untuk menjaga kehidupan dalam konsentrasi sel tinggi (Nowak 2000).
Pada tahap penelitian kedua, fermentasi dilakukan untuk mendapatkan konsentrasi gula total terbaik. Pada rencana awal penelitian, konsentrasi gula yang digunakan merupakan konsentrasi yang telah ditetapkan yaitu 15%, 20%, dan 25%. Pada selang konsentrasi tersebut, Zymomonas mobilis masih bisa hidup. Akan tetapi, konsentrasi yang ditetapkan dan didapatkan dalam proses pemekatan (pemanasan) tidak sesuai, sehingga konsentrasi gula yang digunakan tercantum dalam Tabel 1. Tahapan fermentasi pada tahap penelitian kedua sama dengan tahapan fermntasi pada tahap pertama. Perbedaannya pada tahap ini, nira yang didapat dilakukan pemanasan terlebih dahulu untuk mendapatkan konsentrasi gula berbeda.
Pengambilan Sampel
Pengambilan sampel dilakukan setiap 12 jam sekali hingga waktu fermentasi berlangsung 72 jam. Sampel diambil dalam keadaan aseptis di dalam
clean bench. Sampel yang diambil dipisahkan untuk uji lanjut yaitu konsentrasi bioetanol dan konsentrasi biomassa dengan sentrifugasi.
Destilasi dilakukan untuk memisahkan etanol dari cairan kultivasi (sebagian besar adalah air dan etanol). Titik didih etanol murni adalah 78oC sedangkan air adalah 100oC (kondisi standar) dengan memanaskan larutan pada suhu rentang 78oC-100oC akan mengakibatkan sebagian besar etanol menguap dan melalui unit kondensasi akan menghasilkan etanol dengan konsentrasi 95% (Dwiastuti 2008).
dipisahkan dengan supernatant. Kemudian, endapan biomassa dimasukkan dalam oven suhu 50oC selama 24 jam kemudian ditimbang untuk mendapatkan biomassa kering. Supernatant yang telah dipisahkan untuk diuji gula pereduksi sisa dan total gula.
Pengamatan dan Analisa
Pengamatan dan analisa fermentasi yaitu pH, biomassa, gula pereduksi sisa, total gula, dan kadar etanol. Prosedur pengujian terdapat pada Lampiran 2
dan Lampiran3.
Kinetika Fermentasi
Perhitungan laju pertumbuhan spesifik (µ) adalah sebagai berikut.
Menurut Stanbury dan Whitaker (1993), pada kondisi fermentasi batch
laju pertumbuhan spesifik konstan dan tidak tergantung perubahan konsentrasi nutrisinya, sehingga terintegrasi menjadi:
∫
Dimana:
µ : laju pertumbuhan spesifik (jam-1) x2 : biomassa sel pada saat t (g/L) x1 : biomassa sel awal (g/L) t : waktu (jam)
Sehingga dapat dirumuskan, sebagai berikut:
Parameter kinetika fermentasi lainnya yang menunjukkan konversi substrat menjadi produk adalah efisiensi pemakaian substrat terhadap pembentukan sel dan produk (Yx/s dan Yp/s), serta rendemen pembentukan produk terhadap sel (Yp/x) (Collins dan Walter dalam Bouwkamp 1985) selain itu dihitung pula nilai laju pembentukan produk spesifik (qp), dan laju penggunaan substrat spesifik (qs). Berikut merupakan rumus perhitungan parameter kinetika fermentasi.
⁄
⁄
⁄
HASIL DAN PEMBAHASAN
Karakteristik Nira Aren
Nira aren adalah cairan manis yang keluar dari tandan bunga jantan dan berwarna jernih dan agak keruh. Nira aren mudah mengalami kerusakan karena dipengaruhi oleh kondisi lingkungan selama penyadapan dan pengangkutan ke tempat pengolahan dan kerusakan akibat fermentasi. Fermentasi tersebut disebabkan adanya aktivitas enzim invertase yang dihasilkan oleh mikroba yang mengkontaminasi nira. Bahan yang digunakan sebagai substrat fermentasi yaitu nira aren yang berasal dari Kecamatan Karangmande, Cianjur. Nira aren yang digunakan dilakukan uji karakteristik terlebih dahulu. Hasil uji karakteristik nira yang telah dilakukan, dapat dilihat pada Tabel 2 berikut.
Tabel 2 Karakteristik Nira Aren (pada 100 ml)
Komposisi Nira Aren (%) *literatur
Kadar air 84.87 ± 0.04 84.2
Kadar Abu 0.66 ± 0.07 0.66
Kadar Protein 0.2 ± 0.02 0.2
Kadar Karbohidrat (by difference) 14.77 ± 0.05 14.77
pH 5.5 -
*Sumber: Susanto dan Saneta (1994)
Dapat terlihat pada Tabel 2, karakteristik nira yang dilakukan dalam penelitian mirip dengan karakteristik nira yang dilakukan oleh Susanto dan Suneto (1994). Analisis kadar air dilakukan untuk mengetahui kandungan air yang terikat didalam nira aren sebagai basis total padatan dengan air yang terdapat dalam nira. Hasil yang didapat dari pengujian dan literatur dapat dilihat bahwa kadar air pada nira sangat tinggi hal ini disebabkan kandungan utama dalam nira yaitu air sekitar 80%. Kadar air yang terdapat dalam nira yang berasal dari Cianjur, Jawa Barat hampir sama dengan kadar air yang disebutkan dalam Susanto dan Saneta (1994) yaitu sebesar 84.87%.
Kadar abu merupakan kadar zat anorganik yang terdapat dalam bahan atau media. Hasil kadar abu yang diperoleh dari penelitian sama dengan hasil kadar abu yang diperoleh dari pengujian oleh Susanto dan Saneta (1994) yaitu sebesar 0.66%. Nilai kadar abu yang didapat dari hasil pengujian akan menjadi basis perhitungan untuk mendapatkan nilai total karbon.
Kadar protein merupakan banyaknya protein yang terkandung dalam nira dan merupakan basis penentu kadar nitrogen yang dibutuhkan dalam media fermentasi. Kadar protein dalam nira aren yang diuji dalam penelitian ini memiliki nilai yang sama dengan literatur yaitu sebesar 0.2%.
Karbohidrat merupakan senyawa organik yang banyak ditemui di alam, salah satunya yaitu gula. Dari hasil pengujian didapatkan nilai karbohidrat pada nira aren yang berasal dari Kabupaten Cianjur memiliki nilai yang sama dengan hasil yang didapat oleh Susanto dan Saneta (1994) yaitu sebesar 14.77%.
pernyataan Lasekan et al. (2007) bahwa nira yang dihasilkan berwarna transparan dan berbau khas nira. Kandungan gula dalam nira yang digunakan dalam penelitian ini yaitu sekita 183 – 186 g/L. Hasil tersebut lebih tinggi dibandingkan dengan hasil yang didapat oleh Lasekan et al. (2007) yaitu kandungan gula 100-144g/kg dan Daliabard (1999) 10-12% dengan kandungan gula utama yaitu sukrosa.
Nilai pH awal nira yang digunakan dalam penelitian yaitu 5.5. Hal tersebut sesuai dengan pernyataan Dachlan (1984), bahwa nira aren memiliki derajat keasaman pH 5.5 hingga 6.0. Nilai pH akan berubah selama proses fermentasi. Pada saat fermentasi berlangsung, nilai pH mengalami penurunan akibat adanya mikroba dalam media yang menghasilkan senyawa-senyawa asam. Hasil tersebut sesuai dengan pernyataan Judoamidjojo et al. (1989), penurunan nilai pH terjadi karena adanya akumulasi senyawa asam organik dari mikroba yang ada dalam nira.
Perhitungan lanjut dari uji karakterisasi yaitu perhitungan rasio C/N. Rasio C/N dihitung untuk mengetahui kekurangan nutrisi yaitu nitrogen dalam media. Perhitungan tersebut mengacu pada penelitian terdahulu yang dilakukan Puspitasari (2014) yang menyatakan bahwa hasil fermentasi terbaik didapat pada media yang telah diberi urea dan menurut Syamsu et al (2002) bahwa rasio C/N yang dibutuhkan dalam media fermentasi etanol adalah sebesar 10. Nutrisi yang ditambahkan pada media fermentasi didapatkan dengan menambahkan urea sebagai sumber nitrogen ke dalam nira. Perhitungan rasio C/N dapat dilihat pada Lampiran 4. Dari hasil perhitungan tersebut, diketahui bahwa urea yang harus ditambahkan dalam media fermentasi per 100 ml sebesar 1.53 gram untuk menutupi kekurangan nitrogen dalam media.
Hasil Fermentasi
Fermentasi merupakan proses pengubahan gula (substrat) menjadi etanol (produk) dengan bantuan mikroba. Dalam penelitian ini mikroba yang digunakan yaitu bakteri Zymomonas mobilis yang diketahui merupakan bakteri gram negatif dan dianggap sebagai mikroba alternatif yang dapat menghasilkan bahan bakar etanol dengan skala besar, serta memiliki keunggulan atau kelebihan dibandingkan mikroba lainnya yaitu penyerapan gula lebih tinggi dan etanol yang dihasilkan tinggi, produksi biomassa rendah, toleransi kadar etanol yang lebih tinggi, dan tidak memerlukan penambahan dan pengendalian oksigen selama fermentasi (Gunasekaran dan Raj 1999). Fermentasi nira aren ini seperti yang sudah disebutkan dibagi menjadi dua tahap, tahap pertama penentuan konsentrasi inokulum dan tahap kedua penentuan konsentrasi gula. Hasil tahap 1 dan tahap 2 dilakukan pengujian dan pengukuran, yaitu pertumbuhan biomassa, gula pereduksi, total gula dan kadar etanol.
Penentuan Konsentrasi Inokulum Terbaik
Pertumbuhan Biomassa
stasioner dan fase kematian yang sama. Fase lag merupakan fase dimana mikroba beradaptasi dengan lingkungan baru. Fase eksponensial merupakan fase peningkatan pesat dalam populasi karena ketersediaan nutrisi. Fase stasioner merupakan fase pertumbuhan menjadi stabil karena tingkat kematian dan taraf kelahiran menjadi sama. Fase kematian merupakan fase tekanan lingkungan yang menyebabkan penurunan aktivitas metabolik atau autolisis (Diaz 2013).
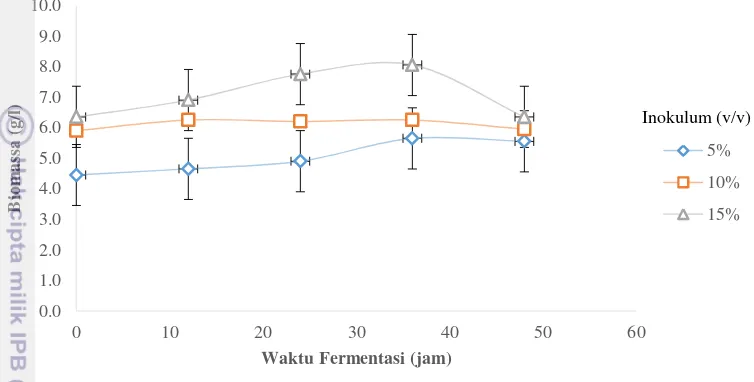
Gambar 2 Grafik biomassa kering pada berbagai konsentrasi inokulum Hasil menunjukkan fase lag terjadi pada waktu kurang dari 12 jam, fase eksponensial pada 12-48 jam, fase stasioner pada 48-60 jam fermentasi dan fase kematian pada 60–72 jam fermentasi. Hal tersebut sesuai dengan pernyataan Ndaba et al. (2014), yang menyebutkan bahwa waktu antara 3 sampai 24 jam merupakan fase eksponensial. Penetapan fase tersebut mengacu pada kurva pertumbuhan hasil pengujian Tanate dan Surya (2012).
Gambar 3 Kurva Pertumbuhan Sumber: Tanate dan Surya (2012)
berpengaruh nyata terhadap biomassa yaitu Fhitung<Ftabel, sehingga tidak dilanjutkan dengan uji Duncan. Hasil biomassa untuk konsentrasi inokulum 5%, 10%, dan 15% secara berturut-turut yaitu sebesar 5.65 g/L, 6.25 g/L dan 8.05 g/L dengan biomassa awal secara berturut-turut sebesar 4.45 g/L, 5.90 g/L, dan 6.35 g/L. Dari hasil tersebut, dapat dilihat bahwa semakin banyak konsentrasi inokulum yang ditambahkan dalam media semakin banyak pula jumlah biomassa yang terdapat dalam media. Dosis inokulum yang semakin besar terlalu tinggi dengan lingkungan yang tidak sesuai dengan habitat Zymomonas mobilis
menyebabkan pengurangan kelangsungan hidup sel (Gibbons dan Westby (1986); Osho (2005)). Hal tersebut disebabkan pertambahan biomassa dalam media merupakan adanya pertumbuhan sel dalam media. Semakin banyak sel dalam media maka etanol yang dihasilkan akan sejalan dengan pertambahan sel. Sebaliknya, penambahan inokulum yang terlalu banyak ke dalam media maka kompetisi antar sel dalam konsumsi substrat akan semakin tinggi. Oleh karena itu, penambahan konsentrasi inokulum harus sesuai untuk mendapatkan hasil produk terbaik.
Kadar Etanol
Ketiga perlakuan menghasilkan etanol yang tidak jauh berbeda pada 12 jam pertama fermentasi, akan tetapi pada 24 jam fermentasi nira dengan inokulum 5% dan 10% mengalami fase stasioner dan untuk nira dengan inokulum 15% masih mengalami peningkatan. Penentuan konsentrasi inokulum terbaik ditentukan dengan analisis ANOVA pada kadar etanol. Analisis ANOVA pada kadar etanol didapatkan bahwa ketiga perlakuan berpengaruh nyata terhadap kadar etanol yaitu Fhitung>Ftabel, sehingga dilanjutkan dengan uji Duncan. Hasil uji Duncan diperoleh yaitu untuk ketiga konsentrasi inokulum 15% mendapatkan nilai rata-rata tertinggi. Hasil penelitian menunjukkan kadar etanol tertinggi untuk setiap konsentasi inokulum 5%, 10%, dan 15% (v/v) secara berturut-turut sebesar 47 g/L, 35.95 g/L dan 50.35 g/L.
Pada Gambar 4, waktu fermentasi terbaik yaitu pada jam ke 36 untuk semua konsentrasi inokulum.
Hasil menunjukkan bahwa konsentrasi yang terpilih pada perhitungan menggunakan metode ANOVA yaitu konsentrasi inokulum 15%. Hal ini sesuai dengan Admianta (2001), semakin banyak dosis mikroba yang ditambahkan, sehingga kadar bioetanol semakin meningkat. Semakin lama waktu fermentasi maka jumlah mikroba semakin menurun, dan akan menuju ke fase kematian karena alkohol yang dihasilkan semakin banyak dan nutrien yang ada sebagai bahan makanan mikroba semakin menurun (Kunaepah 2008). Hal tersebut dikarenakan bakteri Zymomonas mobilis lebih tidak tahan terhadap etanol tinggi dibandingkan Saccharomyces cerevisiae karena memiliki membran sel yang lebih tipis. Gambar 4 menunjukkan bahwa kadar etanol tertinggi sebesar 50.35 g/L dengan waktu fermentasi 36 jam dan penambahan inokulum sebanyak 15%.
Kadar etanol merupakan banyaknya etanol yang dihasilkan pada metabolisme mikroba sebagai bentuk aktivitas mikroba yaitu Zymomonas mobilis
dalam menggunakan substrat dan hasil yang keluar dari peggunaan substrat tersebut. Proses fermentasi pada Zymomonas mobilis dilakukan pada jalur ED (Ertner-Doudoroff). Dalam media fermentasi yaitu nira sebagai besar gula yang terkandung yaitu sukrosa (Cazetta et al. 2007). Sukrosa yang terdapat dalam nira akan dihidrolisis oleh enzim sukrase yang ada dalam Z. mobilis. Enzim tersebut
akan memutus ikatan α 1-4 pada sukrosa, sehingga terbentuk glukosa dan fruktosa. Glukosa akan diuraikan melalui jalur ED dan terbentuk suatu unit 2-keto-3-deoksi-6-fosoglukonat (KDGF) kemudian komponen tersebut akan dipecah oleh aldolase menjadi gliseraldehid-3P dan akan memecah piruvat dengan enzim piruvat dekarboksilase menjadi asetaldehida dan CO2 (Ferdiaz 1988). Hal tersebut berbeda dengan mikroba pada umumnya yang menggunakan jalur EMP. Mekanisme Entner-Doudoroff, diikuti oleh dekarboksilasi piruvat. Asetaldehida yang terbentuk kemudian direduksi menjadi etanol (Swing dan De Ley 1977). Selain menghasilkan etanol Zymomonas mobilis juga menghasilkan hasil samping salah satunya asam asetat, hasil samping tersebut yang membedakan dengan
Saccharomyces cerevisiae.
Gula Pereduksi
Pada analisa data menggunakan ANOVA, hasil ketiga konsentrasi inokulum tidak berpengaruh nyata terhadap gula pereduksi Fhitung<Ftabel, sehingga tidak dilanjutkan dengan uji Duncan. Hasil menunjukkan penurunan kadar gula pereduksi selama fermentasi dengan gula pereduksi awal sebesar 95.17 g/L. Hasil yang didapat setelah 72 jam fermentasi, gula pereduksi sisa pada konsentrasi inokulum 5% yaitu sebesar 3.59 g/L dengan persentase penggunan gula sebesar 96.22%, konsentrasi inokulum 10% yaitu sebesar 3.4 g/L dengan persentase penggunaan gula sebesar 96.34% dan pada konsentrasi inokulum 15% yaitu sebesar 2.11 g/L dengan persentase penggunaan gula sebesar 97.78%.
mengubah sukrosa yang tersisa dalam media menjadi glukosa dan fruktosa, sehingga terjadi peningkatan gula pereduksi kembali.
Gambar 5 Grafik kadar gula pereduksi pada penentuan konsentrasi inokulum Pada hasil perhitungan terlihat gula pereduksi menunjukkan penurunan dengan pereduksi sisa terendah adalah pada media dengan konsentrasi inokulum 15%. Kandungan gula pereduksi dalam bahan mengalami penurunan dan kemudian pada waktu fermentasi 48 jam gula pereduksi semakin sedikit. Hal ini membuktikan bahwa semakin lama fermentasi berlangsung maka kandungan gula dalam media akan semakin berkurang karena adanya konsumsi substrat oleh mikroba untuk menghasilkan produk.
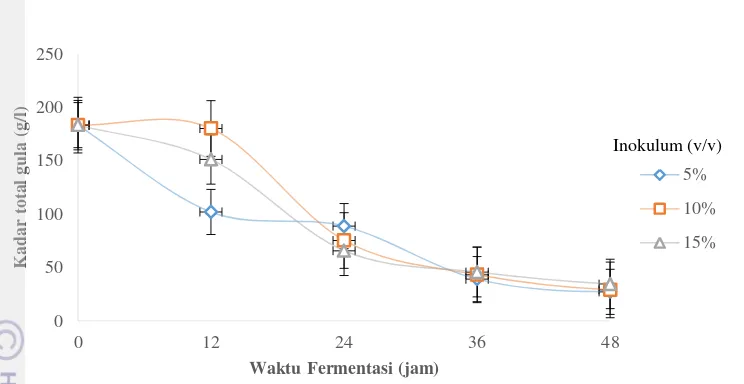
Total Gula
Perhitungan ANOVA untuk total gula pada pemilihan konsentrasi inokulum hasilnya menunjukkan konsentrasi inokulum tiap perlakuan tidak berpengaruh nyata terhadap total gula Fhitung<Ftabel, sehingga tidak dapat dilanjutkan dengan uji Duncan. Hasil penelitian menunjukkan penurunan total gula selama fermentasi dengan total gula awal sebesar 183.38 g/L. Hasil yang didapat pada konsentrasi 5% yaitu dengan persentase penggunaan gula sebesar 78.65%, konsentrasi inokulum 10% yaitu dengan persentase penggunaan gula sebesar 76.42% dan konsentrasi 15% dengan persentase penggunaan gula sebesar 75.06%. Persentase penggunaan gula total lebih rendah dibandingkan dengan persentase penggunaan gula pereduksi dikarenakan pada total gula keseluruhan gula terhitung termasuk sukrosa. Pada Zymomonas mobilis sebelum dikonsumsi untuk menghasilkan produk, sukrosa diubah terlebih dahulu menjadi glukosa dan fruktosa oleh enzim sukrase yang terdapat dalam Zymomonas mobilis (Ferdiaz (1988); Swing dan De Ley (1977)).
Tingkat konsumsi gula terbaik terjadi pada waktu fermentasi 12 - 48 jam yaitu lebih dari 75% dari total gula awal telah dikonsumsi oleh Zymomonas mobilis. Pada grafik total gula mulai terlihat penurunan kandungan total gula dalam media selama 48 jam fermentasi. Kemudian, kandungan gula dalam media akan terus mengalami penurunan dan pada waktu fermentasi 72 jam gula akan semakin sedikit. Pada total gula dapat terlihat bahwa semakin banyak sukrosa yang telah diubah menjadi glukosa dan fruktosa maka akan terjadi penurunan total gula pada media dan peningkatan gula pereduksi pada media.
Gambar 6 Grafik total gula pada penentuan konsentrasi inokulum
Selain menggunakan metode ANOVA, pemilihan perlakuan terbaik juga dilakukan dengan menentukan parameter kinetika fermentasi. Nilai parameter kinetika yang diperoleh dari perhitungan tersebut yaitu laju pertumbuhan (µ), koefisien antara hasil sel hidup terhadap sumber karbon yang dikonsumsi (Yx/s), koefisien konversi nutrien dalam substrat menjadi produk pada periode tertentu (Yp/s), koefisien produk terhadap jumlah sel hidup (Yp/x), laju pembentukan produk spesifik (qp), dan laju penggunaan substrat spesifik (qs). Berikut ini disajikan hasil perhitungan kinetika fermentasi pada setiap perlakuan konsentrasi inokulum (Tabel 3).
Tabel 3 Hasil perbandingan parameter kinetika pada konsentrasi inokulum 5%, 10%, dan 15%.
qs (g substrat/sel.jam) 203.15 714.02 164.72
Efisiensi penggunaan gula (%) 96.22 96.34 97.78 Hasil parameter kinetika menunjukkan laju pertumbuhan maksimum dari ketiga perlakuan konsentrasi, perlakuan penambahan konsentrasi inokulum 15% mendapatkan nilai yang tinggi dibandingkan dengan konsentrasi inokulum 5% dan 10%. Koefisien antara hasil sel hidup terhadap sumber karbon yang dikonsumsi (Yx/s) tertinggi diperoleh pada penambahan konsentrasi inokulum 15%. Koefisien konversi nutrien dalam substrat menjadi produk pada periode tertentu (Yp/s) tertinggi diperoleh pada penambahan konsentrasi inokulum 15%. Koefisien produk terhadap jumlah sel hidup (Yp/x) tertinggi diperoleh pada penambahan konsentrasi inokulum 15%. Laju pembentukan produk spesifik (qp) tertinggi diperoleh pada penambahan konsentrasi inokulum 10%, dan laju
penggunaan substrat spesifik (qs) tertinggi diperoleh pada penambahan konsentrasi inokulum 10%. Hal tersebut menunjukkan pada konsentrasi inokulum 10% pertumbuhan sel sesuai dengan kondisi substrat atau konsentrasi inokulum lebih sedikit dibandingkan dengan substrat yang tersedia dalam media, sehingga kompetisi tidak terlalu besar. Berbeda halnya dengan konsentrasi inokulum 15%, susbstrat yang tersedia sebanding dengan jumlah sel dalam media sehingga laju pembentukan produk dan penggunaan substrat lebih lambat. Dari hasil perhitungan menggunakan metode ANOVA dan perhitungan kinetika fermentasi, konsentrasi inokulum terbaik yaitu 15%. Konsentrasi inokulum terbaik ini akan digunakan pada tahap selanjutnya yaitu tahap penetapan konsentrasi gula terbaik yang dibutuhkan dalam media fermentasi.
Penetapan Konsentrasi Gula Terbaik
Pertumbuhan Biomassa
Pada tahap 2 dapat dilihat pada Gambar 7 sama halnya dengan tahap 1 bahwa Zymomonas mobilis pada masing-masing perlakuan kandungan gula yaitu X1 dan X2 mengalami fase lag pada waktu kurang dari 12 jam, fase eksponensial pada 12-48 jam, fase stasioner pada 48-60 jam fermentasi dan fase kematian pada 60 – 72 jam fermentasi. Akan tetapi berbeda dengan X1 dan X2, X3 telah mengalami fase eksponensial pada 12 jam fermentasi, fase stasioner pada 12-24 jam fermentasi dan fase kematian pada 24-72 jam. Hal tersebut dapat terjadi dikarenakan tingginya konsentrasi gula dalam substrat dapat menjadi inhibitor dalam pembentukan etanol. Hal ini sesuai dengan Frobisher (1962) yang menyatakan bahwa semakin tinggi kadar gula maka akan semakin besar tekanan osmosis terhadap sel. Kepekatan yang lebih tinggi diluar sel akan mengakibatkan terjadi osmosis balik yaitu cairan diluar sel akan masuk ke dalam sel, sehingga dapat menyebabkan kematian pada sel. Hal tersebut yang terjadi pada perlakuan X3 karena mengandung gula tinggi yaitu sebesar 336.6 g/L.
Gambar 7 Grafik biomassa kering pada penentuan kandungan gula
Metode pemilihan konsentrasi gula terbaik sama dengan metode pemilihan konsentrasi inokulum pada tahap pertama yaitu menggunakan metode ANOVA dan perhitungan kinetika fermentasi. Hasil analisa data ANOVA untuk biomassa pada tahap kedua ini yaitu ketiga perlakuan konsentrasi gula tidak berpengaruh nyata terhadap biomassa yaitu Fhitung<Ftabel, sehingga uji Duncan tidak dilakukan. Tingginya kandungan gula pada perlakuan X3 yaitu sebesar 336.60 g/L dan hasil yang didapatkan perlakuan X3 dari pengujian sesuai dengan pernyataan menurut Rehm dan Reed (1983), kadar gula minimal dan maksimal yang dapat menghambat pertumbuhan sel yaitu dibawah 1 g/L dan diatas 300 g/L. Biomassa tertinggi dicapai pada waktu fermentasi 36 jam. Pada X1 yaitu sebesar 4.95 g/L, pada X2 yaitu sebesar 6.55 g/L dan pada X3 yaitu sebesar 6.15 g/L. Dari hasil tersebut dapat dilihat bahwa semakin tinggi kandungan gula dalam media maka semakin banyak pula jumlah biomassa yang terdapat dalam media.
Kadar Etanol
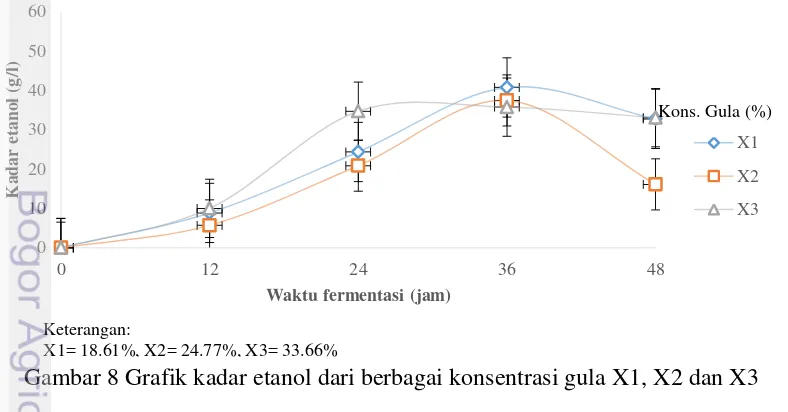
Hasil analisa data ANOVA untuk kadar etanol untuk ketiga perlakuan konsentrasi gula berpengaruh nyata terhadap kadar etanol Fhitung>Ftabel, sehingga dilanjutkan dengan uji Duncan. Hasil yang didapat dari uji Duncan yaitu perlakuan X1 dengan konsetrasi gula sebanyak 186.1 g/L tidak berbeda signifikan terhadap perlakuan X3 dengan konsentrasi gula sebanyak 336.6 g/L. akan tetapi berbeda signifikan terhadap X2 dengan konsentrasi gula sebanyak 247.7 g/L. Kadar etanol pada penentuan kandungan gula, X1=18.61% X2=24.77% dan X3=33.66%, hasil kadar etanol tertinggi dicapai pada 36 jam fermentasi. Pada waktu fermentasi 36 jam persentase gula X3 mendapatkan hasil etanol yang paling rendah yaitu sebesar 35.75 g/L dibandingkan dengan persentase gula X2 sebesar 37.45 g/L dan X1 sebesar 40.75 g/L.
Hasil kadar etanol pada perlakuan X3 rendah dikarenakan konsentrasi gula terlalu tinggi. Hasil tersebut didukung dengan pernyataan Roukas (1996), bahwa penurunan bioetanol terjadi pada konsentrasi glukosa yang berlebih sebagai efek inhibisi substrat dan produk. Konsentrasi substrat yang terlalu tinggi mengurangi jumlah oksigen terlarut dalam media. Gambar 7 menunjukkan bahwa kadar etanol tertinggi sebesar 4.08% (b/v) pada waktu fermentasi 36 jam dan persentase gula sebesar 18.61%.
Gambar 8 Grafik kadar etanol dari berbagai konsentrasi gula X1, X2 dan X3
Dari hasil penggunaan gula tersebut dapat dilihat bahwa kandungan gula terbaik untuk media fermentasi nira menjadi bioetanol yaitu kandungan gula X1 yaitu sebesar 18.61% dibandingkan dengan kandungan gula X2= 24.77% dan X3= 33.66%. Hal ini sesuai dengan Cazetta et al. (2007) dan Pleitt (2010) yang menyatakan konsentrasi gula yang terlalu tinggi menyebabkan produksi etanol menurun secara signifikan. Akan tetapi jika ditinjau kembali dari banyaknya biomassa yang diperoleh, kadar etanol yang dihasilkan, waktu penyiapan bahan dan biaya yang dibutuhkan maka perlakuan X1 dengan konsentrasi gula 18.61% terpilih menjadi konsentrasi gula terbaik. Hal tersebut dikarenakan perlakuan X1 menghasilkan biomassa rendah, etanol tinggi, tidak memerlukan waktu pemanasan yang lama, dan biaya yang dibutuhkan sedikit karena tidak memerlukan waktu pemanasan yang lama sehingga tidak membutuhkan nira yang terlalu banyak untuk menghasilkan 1 liter bioetanol. Hasil etanol yang didapatkan tidak jauh berbeda dengan hasil yang didapatkan pada penelitian Cazetta et al.
(2007) dengan bahan baku molase sebesar 46.43 g/L pada 200 g/L konsentrasi padatan terlarut di suhu 35oC. Akan tetapi, hasil tersebut jauh lebih rendah dibandingkan dengan penggunaan Saccharomyces cerevisiae, karena membrane sel pada bakteri Zymomonas mobilis tidak tahan terhadap konsentrasi etanol yang tinggi dibandingkan Saccharomyces cerevisiae.
Gula Pereduksi
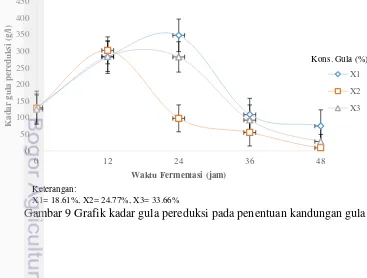
Perhitungan ANOVA gula pereduksi pada pemilihan konsentrasi inokulum yaitu Fhitung<Ftabel menunjukkan bahwa konsentrasi gula setiap perlakuan tidak berpengaruh nyata terhadap gula pereduksi, sehingga tidak dilanjutkan dengan uji Duncan. Pada perlakuan X1 gula pereduksi sisa sebesar 10.16 g/L dengan gula pereduksi awal sebesar 130.51 g/L, pada perlakuan X2 gula pereduksi sisa 4.23 g/L dengan gula pereduksi awal 127.28 g/L dan pada perlakuan X3 gula pereduksi sisa sebesar 7.30 g/L dengan gula pereduksi awal sebesar 125.08 g/L.Tingkat penggunaan gula yang paling terbaik terjadi pada waktu fermentasi 24-36 jam. Pada perlakuan X1 tingkat penggunaan gula sebesar 92.22%, pada X2 yaitu sebesar 96.67% dan pda X3 sebesar 94.16%.
Gambar 9 Grafik kadar gula pereduksi pada penentuan kandungan gula
Pada grafik gula pereduksi menunjukkan peningkatan pada waktu fermentasi 12-24 jam dan penurunan pada waktu fermentasi 24 jam – 72 jam. Hal tersebut dikarenakan pada penetapan konsentrasi gula, nira yang digunakan memiliki kualitas yang cukup baik, sehingga pada jam ke 0 gula pereduksi rendah dan baru mengalami peningkatan pada jam ke 12 karena sebagian besar gula yang terdapat dalam nira yaitu sukrosa. Sukrosa yang ada dalam nira akan diubah terlebih dahulu oleh enzim sukrase dalam Zymomonas menjadi glukosa dan fruktosa (Ferdiaz (1988); Swing dan De Ley (1977)). Sehingga, pada 12 jam fermentasi gula pereduksi meningkat dan pada 24–36 jam terjadi penurunan dikarenakan Zymomonas mobilis mulai mengkonsumsi gula pereduksi dan menghasilkan produk yaitu etanol.
Total Gula
Pada hasil analisa data ANOVA konsentrasi gula tidak berpengaruh nyata terhadap total gula yaitu Fhitung<Ftabel, sehingga tidak dilanjutkan dengan uji Duncan. Pada perlakuan X1 total gula sisa sebesar 9.51 g/L dengan total gula awal sebesar 186.10 g/L, pada perlakuan X2 total gula sisa 8.55 g/L dengan total gula awal 247.75 g/L dan pada perlakuan X3 total gula sebesar 16.26 g/L dengan total gula awal sebesar 336.60 g/L. Tingkat penggunaan gula yang paling terbaik pada masing-masing perlakuan terjadi pada waktu fermentasi 24-36 jam. Pada perlakuan X1 tingkat penggunaan gula sebesar 94.90%, pada X2 yaitu sebesar 96.55% dan pda X3 sebesar 95.17%.
Gambar 10 Grafik total gula pada penentuan kandungan gula
dan De Ley (1977)). Dalam perhitungan kinetika fermentasi tahap ini sama halnya dengan perhitungan kinetika fermentasi pada pemilihan konsentrasi inokulum yaitu diperoleh nilai µ, Yx/s, Yp/s, Yp/x, qp, dan qs. Hasil perhitungan kinetika fermentasi dapat dilihat pada Tabel 4.
Tabel 4 Hasil perbandingan parameter kinetika pada konsentrasi inokulum X1, X2, dan X3.
qs (g substrat/sel.jam) 194.20 151.03 229.10
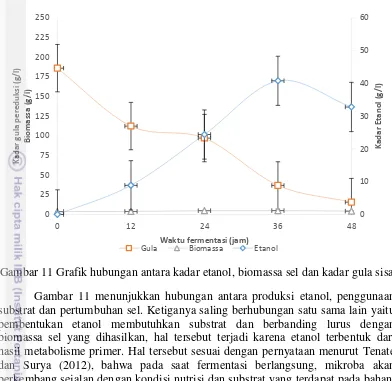
Efisiensi penggunaan gula (%) 92.22 96.67 94.16 Hasil yang didapat dari percobaan tahap 1 dan tahap 2 didapatkan konsentrasi inokulum terbaik yaitu 15% dan kandungan gula terbaik yaitu perlakuan X1 sebesar 18.61%. Hasil Percobaan ditunjukkan pada Gambar 11. Kadar etanol terbaik yaitu pada waktu fermentasi selama 36 jam sebesar 4.08% (b/v) atau dengan tingkat penggunaan gula sebesar 80.13%. Kandungan gula awal sebesar 186.61 (g/L) dan tersisa menjadi 36.97 (g/L). Kinetika pertumbuhan dan peningkatan produk menggambarkan kemampuan sel dalam merespon lingkungan (Wang et al 2006).
Hasil parameter kinetika pada Tabel 4 menunjukkan koefisien antara hasil sel hidup terhadap sumber karbon yang dikonsumsi (Yx/s) tertinggi diperoleh pada konsentrasi gula 186.1 g/L. Koefisien konversi nutrien dalam substrat menjadi produk pada periode tertentu (Yp/s) tertinggi diperoleh pada konsentrasi gula 186.1 g/L. Koefisien produk terhadap jumlah sel hidup (Yp/x) tertinggi diperoleh pada konsentrasi gula 186.1 g/L. Laju pembentukan produk spesifik (qp) tertinggi diperoleh pada konsentrasi gula 186.1 g/L.
Gambar 11 Grafik hubungan antara kadar etanol, biomassa sel dan kadar gula sisa Gambar 11 menunjukkan hubungan antara produksi etanol, penggunaan substrat dan pertumbuhan sel. Ketiganya saling berhubungan satu sama lain yaitu pembentukan etanol membutuhkan substrat dan berbanding lurus dengan biomassa sel yang dihasilkan, hal tersebut terjadi karena etanol terbentuk dari hasil metabolisme primer. Hal tersebut sesuai dengan pernyataan menurut Tenate dan Surya (2012), bahwa pada saat fermentasi berlangsung, mikroba akan berkembang sejalan dengan kondisi nutrisi dan substrat yang terdapat pada bahan. Ketiga faktor tersebut menunjukkan etanol tertinggi didapat pada waktu fermentasi 36 jam dan mulai terjadi penurunan etanol dan pertumbuhan sel pada waktu fermentasi 48 jam. Hal tersebut sesuai dengan Mc Lellan (1999) yang menyatakan bahwa produksi etanol dapat menurun ketika jumlah sel menurun.
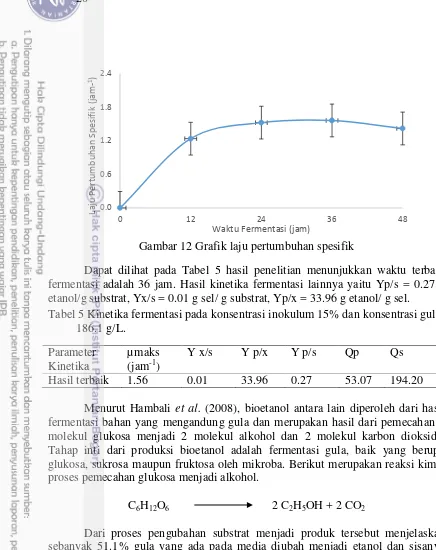
Kinetika fermentasi merupakan pengujian yang dapat menunjukkan perkembangbiakan mikroba yang bisa dilihat dari meningkatnya konsentrasi biomassa pada media fermentasi karena konsentrasi substrat. Selain itu, menurut Reed dan Rehm (1983), kinetika fermentasi juga dapat menunjukkan kecepatan pertumbuhan sel yang dipengaruhi oleh lingkungan fisik dan kimianya. Kinetika fermentasi dilihat dari beberapa parameter yaitu, laju pertumbuhan spesifik (µ), koefisien antara hasil sel hidup terhadap sumber karbon yang dikonsumsi (Yx/s), koefisien konversi nutrien dalam substrat menjadi produk pada periode tertentu (Yp/s), koefisien produk terhadap jumlah sel hidup (Yp/x), laju pembentukan produk spesifik (qp), dan laju penggunaan substrat spesifik (qs).
Gambar 12 Grafik laju pertumbuhan spesifik
Dapat dilihat pada Tabel 5 hasil penelitian menunjukkan waktu terbaik fermentasi adalah 36 jam. Hasil kinetika fermentasi lainnya yaitu Yp/s = 0.27 g etanol/g substrat, Yx/s = 0.01 g sel/ g substrat, Yp/x = 33.96 g etanol/ g sel. Tabel 5 Kinetika fermentasi pada konsentrasi inokulum 15% dan konsentrasi gula
186.1 g/L. fermentasi bahan yang mengandung gula dan merupakan hasil dari pemecahan 1 molekul glukosa menjadi 2 molekul alkohol dan 2 molekul karbon dioksida. Tahap inti dari produksi bioetanol adalah fermentasi gula, baik yang berupa glukosa, sukrosa maupun fruktosa oleh mikroba. Berikut merupakan reaksi kimia proses pemecahan glukosa menjadi alkohol.
C6H12O6 2 C2H5OH + 2 CO2
Dari proses pengubahan substrat menjadi produk tersebut menjelaskan sebanyak 51.1% gula yang ada pada media diubah menjadi etanol dan sisanya 48.9% diubah menjadi karbondioksida. Penurunan laju pertumbuhan spesifik pada 48 jam fermentasi terjadi akibat adanya inhibitor salah satunya asam asetat. Menurut Wang (2008), asam asetat merupakan inhibitor untuk pertumbuhan
Zymomonas mobilis. Sejumlah kecil asam asetat dapat mengubah laju pertumbuhan spesifik. Asam asetat juga mempengaruhi produksi etanol dan konsumsi glukosa. Fase lag meningkat dan laju pertumbuhan spesifik menurun dengan adanya asam asetat. Peningkatan konsentrasi asam asetat akan menyebabkan laju pertumbuhan spesifik menurun dan fase lag meningkat. Konsentrasi asam asetat yang lebih tinggi mengakibatkan laju pertumbuhan spesifik yang lebih rendah dan menurunkan produksi biomassa serta menyebabkan terjadinya fase lag kembali.
Berdasarkan hasil etanol yang didapat dari hasil penelitian yaitu sebesar 40.75 g/L menunjukkan bahwa dalam menghasilkan 1 liter bioetanol membutuhkan 22 liter nira aren. Berikut perkiraan perhitungan produktivitas etanol dalam 1 hektar tanaman aren.
Tabel 6. Perkiraan produktivitas etanol tanaman aren per hektar
Uraian Hasil
Jumlah Tanaman *100
Jumlah Tandan 3
Produksi Nira (l/hari/pohon) 10
Produksi Nira (l/hari/hektar) 1000
Produksi Nira (ton/bln/ha) 30
Produksi Nira (ton/thn/ha) 360
Produksi etanol (ton/thn/ha) 16
*Sumber: Syakir dan Effendi (2010)
Pada Tabel 6, jumlah pohon per hektar 100 pohon dan diasumsikan setiap pohon berproduksi memiliki minimal 3 tandan yang menghasilkan nira. Hasil perhitungan perkiraan produktivitas menujukkan bahwa etanol yang diproduksi dari bahan baku nira sangat prospektif untuk dijadikan bioetanol karena minimal per tahun menghasilkan 16 ton/thn/ha bioetanol. Hasil tersebut lebih besar dibandingkan dengan perhitungan yang dilakukan oleh Syakir dan Effendi (2010), untuk menghasilkan 1 liter bioetanol membutuhkan 25 liter nira, sehingga bioetanol yang diproduksi sebesar 14.40 ton/thn/ha.
SIMPULAN DAN SARAN
Simpulan
18.61% (b/v). Waktu terbaik fermentasi nira aren menjadi bioetanol yaitu selama 36 jam. Perkiraan perhitungan produktivitas yaitu untuk mendapatkan 1 liter etanol dibutuhkan 22 liter nira dan dari 1 hektar tanaman aren, etanol yang bisa diproduksi sebanyak 16 ton/tahun.
Saran
Waktu pengambilan sampel dilakukan pada selang waktu yang lebih pendek, agar fase lag terlihat pada kurva pertumbuhan karena fase lag dan eksponensial terjadi pada selang waktu kurang dari 12 jam. Hasil penelitian perlu dilanjutkan dalam skala besar sehingga dapat diaplikasikan dalam masyarakat.
DAFTAR
PUSTAKA[JICA]. Japan International Cooperation Agency. 1978. Method of Soil Chemical Analysis doumen BARISTAN INDAG. Bogor: JICA.
Admianta, Noer Z, Fitrianida. 2001. Pengaruh jumlah yeast terhadap kadar alkohol pada fermentasi kulit nanas dengan menggunakan fermentor.
Jurnal. Teknik Kimia ITN Malang.
AOAC (Association of Official Analytical Chemist). 1995.Official methods of analysis. Association of Official Analytical Chemist. Washington DC. Cazetta M L, M A P C Celligoi, J B Buzato, I S Scarmino. 2007. Fermentation of
molasses by Zymomonas mobilis: Effect of temperature and sugar concentration on ethanol production. Journal Bioresource Technology 98, 2824-2828. Brazil: Londrina State University.
Dachlan M A. 1984. Proses Pembuatan Gula Merah. Jakarta: Industry and Agricultural Development, R & D Department.
Dalibard C. 1999. Overall view on the tradition of topping palm trees and prospects for animal production. Livestock Research for Rural Development.1-37.
Diaz M. 2013. Biomass now- Sustainable Growth and Use. Environtmental Engineering. Mexico: Universidad Autónoma de Guadalajara, Guadalajara. Dubois M, Gilles K A, Hmilton JK, Rebers PA, Smith F. 1956. Colorimetric
method for determination of sugars and related substances. J Anal Chem. 28 (3): 350-356.
Dwiastuti I. 2008. Analisis manajemen strategi industri energi alternatif: Studi kasus biofuel. Jurnal Ekonomi dan Pembangunan. Vol. XVI (1). ISSN 0854-526X.
Efendi D S. 2010. Prospek pengembangan tanaman aren (Arenga pinata Merr) mendukung kebutuhan bioetanol di Indonesia. Vol. 9 No. 1 / Juni 2010. Hal 36 – 46 ISSN: 1412-8004. [terhubung berkala]. http://perkebunan.litbang.deptan.go.id/. Diakses pada tanggal 29 Maret 2015.
Gibbons W R, C A Westby.1986. Effect of inoculum size on solid-phase fermentation of fodder beets for fuel etanol production. Journal Applied and Environmental Microbiology. 52: 960-962.
Glazer A N, Nikaido H. 2007. Microbial biotechnology fundamentals of applied microbiology, second edition. New York: Cambridge University Press. Gunasekaran P, Raj K C. 1999. Fermentation technology-Zymomonas mobilis.
India: Departement of Microbial Technology, School of Biological Science, Mandurai Kamanaj University.
Hambali E, S Mujdalipah, AH Tambunan, AW Pattiwi, R Hendroko. 2008. Teknologi bioenergi. Jakarta: AgroMedia.
Judoamidjojo R M, Said E G, Hartoto L.1989. Bioconversion. Bogor: Bogor Agriculture Institute.
Kunaepah U. 2008. Pengaruh lama konsentrasi dan konsentrasi glukosa terhadap aktivitas antibakteri, polifenol total dan mutu kimia kefir susu kacang merah. Tersedia pa- da:http://pdfsearchpro.com/pengaruh lama fermentasi dan konsentrasi glukosa terhadappdf.html (September 2015).
Lasekan O, Buettner A, Christlbauer M. 2007. Investigation of important odorants of palm wine. Journal Food Chemistry.15-23.
Letti L, Susan G K, Adenise L W. 2012. Ethanol production from soybean molasses by Zymomonas mobilis. Journal Biomass and Bioenergy 44, 80-86. Brazil: Federal University of Parana.
Mc Lellan PJ, AJ Daugulis, J Li, 1999. The incidence of oscillatory behavior in the continous fermentations of Z. mobilis. Journal Biotechnology Progress 15 (4): 667-680.
Miller GC. 1959. Use of dinitrosalicylic acid reagent for the determination of reducing sugar. Journal Analitical Chemist. 31: 420-428.
Ndaba B, Idan C, Sanetta M, George O. 2014. Effect of Saccharomyces cerevisiae
and Zymomonas mobilis on the co-fermentation of sweet sorghum bagasse hydrolysates pretreated under varying. Journal Biomass and Bioenergy 71, 350-356. Kenya: University of Nairobi.
Nowak J. 2000. Bioetanol yield and productivity of Zymomonas mobilis in various fermentation methods. Electronic Journal of Polish Agricultural Universities, Vol. 3, No. 2, seri Food Science and Technology.
Osho A. 2005. Ethanol and sugar tolerance of wine yeast isolated from fermenting cashew apple juice. Af J of Biotechnology 4: 660-662.
Pleitt K. 2010. Zymomonas mobilis. [terhubung berkala]. http:// www. Web.mst.edu/microbio/BIO221_2010/Z.mobilis.
Puspitasari S. 2014. Pemanfaatn limbah padat nata de coco untuk produksi bioetanol menggunakan Zymomonas mobilis. Skripsi. Bogor: Institut Pertanian Bogor.
Reed G, HJ Rehm. 1983. Biotechnology Vol III. Industrial Biotechnology. Wstport, Connecticut: AVI Publishing Company Inc.
Roukas T. 1996. Continuous bioetanol production from nonsterilized carob pod extract by immobilized Saccharomyces cerevisiae on mineral kissiris using a tworeactor system. Journal Applied Biochemistry and Biotechnology. 59 (3).
Sprenger G A. 1996.Carbohydrate metabolism in Zymomonas mobilis: a catabolic highway with some scenic routes. Federation of European Microbiology Societies Microbiology Letters 145(3): 301-307.
Susanto T, Saneta B. 1994. Teknologi Pengolahan Hasil Pertanian, P T Bina Ilmu.
Jurnal. Surabaya. Hal 206.
Swing J, De Ley J .1977. The Biology of Zymomonas. Laboratory of microbiology and microbial genetic, Faculty of Science, State University, B-9000 Gent, Belgium, USA.
Syakir, D S Effendi. 2010. Prospek pengembangan tanaman aren (Arenga pinnata MERR) untuk bioethanol, peluang dan tantangan, Workshop Peluang, Tantangan, dan Prospek Pengembangan Aren untuk Bioetanol Skala Industri dan UMKM, Hotel Salak Bogor 21 Januari 2010, hlm 17.
Syamsu K, Suryani A, Fauzi A M, dan Wicaksono BWD. 2003. Optimasi produksi, karakterisasi, aplikasi dan pengujian biodegradasi bioplastik yang dihasilkan oleh Ralstonia europha pada substrat hidrolisat minyak sawit. Laporan Akhir Hibah Bersaing IX. Pusat Penelitian Bioteknologi IPB. Tanate T S, Surya R P. 2012. Pembuatan etanol menggunakan Zymomonas
mobilis pada kondisi steril dan nonsteril dengan memanfaatkan limbah padat pabrik rokok kretek sebagai substrat. Surabaya: Institut Teknologi Sepuluh Nopember.
Tangkuman H D, Johnly A R, Dolfie P, Gerald T. 2010. Produksi bioetanol dari nira aren menggunakan energi geothermal. Jurnal Chemical. Programing. 3 (1). Manado: Universitas Sam Ratulangi.
Wang D, X Wu, S Bean, JP Wilson. 2006. Ethanol production from pearl millet using Saccharomycess cereviseae. Cereal Chem. 83 (2): 127-131.
Wang Y. 2008. Development of Acetic-acid Tolerant Zymomonas mobilis Strains through Adaptation. Thesis. Georgia: Georgia Institute of Technology. Widjaja T, Mulyanto, Aulia A, Tutik M. 2008. Produksi Etanol dari Nira Tebu
LAMPIRAN
Lampiran 1 Analisis Karakterisasi Bahan 1. Kadar Air (AOAC 1995)
Cawan alumunium yang telah dikeringkan dan diketahui bobotnya, diisi sebanyak 2-3 gram sampel lalu ditimbang (W1) kemudian dimasukkan kedalam oven suhu 105oC selama 1-2 jam. Cawan alumunium dan sampel yang telah dikeringkan dimasukkan ke dalam desikator kemudian ditimbang. Ulangi pemanasan sampai dihasilkan bobot konstan (W2). Sisa contoh dihitung sebagai total padatan dan air yang hilang sebagai kadar air.
Kadar air (%) =
×100% 2. Kandungan nitrogen (N) dengan metode Kjedahl
Sebanyak 0.25 gam sampel dimasukkan ke dalam labu kjedahl dan ditambahkan 2.5 ml H2SO4 pekat dan 1 g katalis. Larutan tersebut kemudian didestruksi hingga jernih. Selanjutnya ditambahkan NaOH 40% ke dalam larutan dekstruksi dingin sebanyak 15 ml. Disiapkan pula larutan penampung di dalam erlenmeyer 250 ml yang terdiri dari 19 ml H3BO3 4% dan indikator mensel 2-3 tetes. Setelah itu larutan sampel dimasukkan ke dalam labu destilasi. Destilasi dihentikan apabila tidak ada lagi terbentuk gelembung-gelembung yang keluar pada larutan penampung. Hasil destilasi kemudian dititrasi dengan H2SO4 0.02 N.
% N =
3. Kandungan karbon (C) (JICA 1978)
Perhitungan kadar karbon didasarkan pada kadar abu dalam bahan. Penentuan kadar abu berdasar pada prinsip sisa mineral hasil pembakaran bahan organik pada suhu 550oC. Cawan porselen dikeringkan terlebih dahulu di dalam oven pada suhu 105oC selama 1 jam, kemudian didinginkan selama 30 menit didalam desikator dan ditimbang hingga diperoleh berat konstan (A). Lalu ditimbang contoh sebanyak 2 gam (B), dan dimasukkan ke dalam cawan porselin dan dipijarkan menggunakan pembakar Bunsen sampai tidak membentuk asap lagi. Kemudian dimasukkan ke dalam tanur listrik (furnace) pada suhu 550oC selama ± 12 jam. Selanjutnya cawan didinginkan selama 30 menit pada desikator, dan ditimbang hingga didapatkan berat konstan (C).
Kadar abu (%) = ×100%
Kadar C (%) =
4. Kadar Karbohidrat (by different)
Pada pengujian kadar karbohidrat total menggunakan metode carbohydrate by difference dengan rumus:
Lampiran 2 Prosedur Analisa Total Gula dan Gula Pereduksi 1. Penetapan Total Gula Metode Fenol H2SO4 (Dubois et al. 1956)
Sebelum dilakukan pengukuran total gula pada sampel, maka perlu diketahui kurva standar fenol yang digunakan. Tahapan pembuatan kurva fenol antara lain, 2 ml larutan glukosa standar yang mengadung 0, 10, 20, 30, 40 dan
60 μg glukosa masing – masing dimasukan ke dalam tabung reaksi. Setelah itu, ditambahkan 1 ml larutan fenol 5 % dan dikocok. Kemudian 5 ml asam sulfat pekat ditambahkan dengan cepat. Setelah itu ditunggu selama 10 menit. Kemudian, sampel dikocok dan ditempatkan dalam penangas air selama 15 menit. Selanjutnya, diukur absorbansinya pada panjang gelombang 490 nm.
Gambar 13 Kurva Standar fenol sulfat 2. Penetapan Total Gula Pereduksi Metode DNS (Miller 1959)
Prinsip uji: Suasana alkali gula pereduksi akan mereduksi asam 3.5 – dinitrosolisilat (DNS) membentuk senyawa yang dapat diukur absorbansinya pada panjang gelombang 550 nm.
Tahapan prosesnya terdiri dari penyiapan pereaski DNS, penentuan kurva standar, dan penetapan total gula pereduksi. Pereaksi DNS dibuat dengan melarutkan 10.6 g asam 3.5 - dinitrosalisilat dan 19.8 g NaOH ke dalam 1416 ml air. Setelah itu, ditambahkan 306 g Na – K Tartarat, 7.6 g fenol yang dicairkan pada suhu 50 oC, dan 8.3 g Na – Metabisulfit. Larutan ini diaduk rata. Kemudian, sebanyak 3 ml larutan ini dititrasi dengan HCl 0,1 N dengan indikator fenolftalein. Banyaknya titran berkisar 5 – 6 ml. Jika kurang dari itu harus ditambahkan 2 g NaOH untuk setiap ml kekurangan HCl 0,1 N.
Penentuan kurva standar dibuat dengan mengukur untuk mengetahui nilai gula pereduksi pada glukosa pada selang 0.2 – 0.5 mg/L. Kemudian nilai gula pereduksi dicari dengan metode DNS. Hasil yang didapatkan diplotkan dalam grafik secara linier.
Gambar 14 Kurva Standar DNS y = 0.0036x - 0.0591
R² = 0.982
-0.2 0 0.2 0.4 0.6 0.8 1
0 50 100 150 200 250 300
Ab
so
rb
an
si
Lampiran 3 Analisis hasil fermentasi
1. Kadar Etanol metode specific gravity (AOAC 1995)
Sebanyak 25 ml contoh dimasukkan ke dalam labu distilasi sambil diukur suhunya, kemudian ditambahkan akuades dengan volume yang sama. Distilasi dihentikan setelah diperoleh distilat ±23 ml dan diatur suhunya agar sama dengan suhu pada saat pemipetan. Destilat tersebut kemudian dimasukkan ke dalam piknometer 25 ml yang telah diketahui bobotnya (P), selanjutnya ditepatkan hingga tanda tera dengan menambahkan akuades dan ditutup. Dinding piknometer dikeringkan kemudian ditimbang (D). Piknometer dicuci dengan aseton, kemudian dikeringkan dan dibiarkan hingga mencapai suhu kamar. Dengan menggunakan piknometer yang sama, ditentukan pula bobot air suling (W). Kadar etanol ditentukan dengan bantuan tabel hubungan antara bobot jenis dengan kadar etanol pada berbagai suhu. Rumus perhitungan bobot jenis adalah sebagai berikut.
2. Biomassa kering
Sebanyak 1 ml sampel di sentrifuse dengan kecepatan 10000 rpm selama 5 menit. Selanjutnya sampel dikeringkan menggunakan oven pada suhu 50oC selama 24 jam. Sebelum ditimbang, biomassa disimpan terlebih dahulu di dalam desikator selama 1 jam.
Lampiran 4 Perhitungan Rasio C/N Rasio C/N media = 89.11
Rasio C/N untuk fermentasi = 10 (Syamsu et al 2003)
Tabel 4 Perhitungan Kebutuhan Urea (gram) dalam 100 ml substrat
Parameter Jumlah
Total C 8.02 ± 0.02
Total N 0.09 ± 0.02
Total N yang ditambahkan 10% x 8.02 = 0.80
Kekurangan N 0.80 – 0.09 = 0.71
Urea (CO(NH2)2) yang ditambahkan
Lampiran 5 Hasil Fermentasi
BIOMASSA SEL
Tabel 5 Biomassa Tahap 1 (g/ml)
Kode/Waktu 0 12 24 36 48 60 72 Tabel 6 Biomassa Tahap 1 (g/L)
Kode/Waktu 0 12 24 36 48 60 72
Tabel 7 Biomassa Tahap 2 (g/ml)
Tabel 8 Biomassa Tahap 2 (g/L)
Tabel 9 Gula pereduksi Tahap 1 (g/ml)
Kode/Waktu 0 12 24 36 48 60 72
Tabel 10 Gula pereduksi Tahap 1 (g/L)
Tabel 11 Gula pereduksi Tahap 2 (g/ml)
Kode/Waktu 0 12 24 36 48 60 72
X.1.1 0.14 0.27 0.42 0.15 0.09 0.02 0.01
1.2 0.14 0.29 0.27 0.06 0.06 0.01 0.01
Mean 0.14 0.28 0.35 0.11 0.07 0.02 0.01
SD 0.00 0.01 0.10 0.06 0.02 0.01 0.00
X.2.1 0.14 0.31 0.10 0.06 0.01 0.01 0.01
2.2 0.14 0.29 0.09 0.05 0.01 0.01 0.01
Mean 0.14 0.30 0.10 0.05 0.01 0.01 0.01
SD 0.00 0.01 0.01 0.00 0.00 0.00 0.00
X.3.1 0.14 0.29 0.26 0.08 0.03 0.01 0.01
3.2 0.13 0.28 0.31 0.11 0.03 0.01 0.01
Mean 0.13 0.28 0.28 0.09 0.03 0.01 0.01
SD 0.00 0.00 0.04 0.02 0.00 0.00 0.00
Tabel 12 Gula pereduksi Tahap 2 (g/L)
Kode/Waktu 0 12 24 36 48 60 72
X.1.1 135.56 272.59 421.09 154.08 90.19 21.68 11.95 1.2 135.99 291.12 273.70 63.57 58.49 13.04 8.37 Mean 135.78 281.85 347.39 108.83 74.34 17.36 10.16
SD 0.31 13.09 104.22 63.99 22.41 6.11 2.53
X.2.1 136.53 306.53 102.05 55.02 10.08 4.90 4.48 2.2 135.08 297.65 92.85 54.78 7.59 4.42 3.97
Mean 135.80 302.09 97.45 54.90 8.84 4.66 4.22
SD 1.02 6.27 6.50 0.16 1.75 0.33 0.36
X.3.1 136.50 286.07 257.54 77.30 26.00 7.48 6.04 3.2 131.60 282.22 307.37 107.19 29.51 13.19 8.56 Mean 134.05 284.14 282.45 92.25 27.75 10.33 7.30
TOTAL GULA
Tabel 13 Total gula Tahap 1 (g/ml)
Kode/Waktu 0 12 24 36 48 60 72
Tabel 14 Total gula Tahap 1 (g/L)
Kode/Waktu 0 12 24 36 48 60 72
Tabel 15 Total gula Tahap 2 (g/ml)
Tabel 16 Total gula Tahap 2 (g/L)
Tabel 17 Kadar etanol Tahap 1 (%b/v)
Kode/Waktu 0 12 24 36 48 60 72
Tabel 18 Kadar etanol Tahap 1 (g/L)
Tabel 19 Kadar etanol Tahap 2 (%b/v)
Kode/Waktu 0 12 24 36 48 60 72
X.1.1 0.00 0.00 2.46 4.13 3.41 1.93 4.17
1.2 0.00 1.77 2.41 4.02 3.14 4.70 4.78
Mean 0.00 0.89 2.44 4.08 3.28 3.32 4.48
SD 0.00 1.25 0.04 0.08 0.19 1.96 0.43
X.2.1 0.00 0.30 2.54 3.49 1.88 3.90 4.50
2.2 0.00 0.84 1.63 4.00 1.34 3.39 4.00
Mean 0.00 0.57 2.09 3.75 1.61 3.65 4.25
SD 0.00 0.38 0.64 0.36 0.38 0.36 0.35
X.3.1 0.00 0.79 3.91 3.65 4.48 3.49 4.56
3.2 0.00 1.21 3.03 3.50 2.13 1.52 5.19
Mean 0.00 1.00 3.47 3.58 3.31 2.51 4.88
SD 0.00 0.30 0.62 0.11 1.66 1.39 0.45
Tabel 20 Kadar etanol Tahap 2 (g/L)
Kode/Waktu 0 12 24 36 48 60 72
X.1.1 0.00 0.00 24.60 41.30 34.10 19.30 41.70
1.2 0.00 17.70 24.10 40.20 31.40 47.00 47.80
Mean 0.00 8.85 24.35 40.75 32.75 33.15 44.75
SD 0.00 12.52 0.35 0.78 1.91 19.59 4.31
X.2.1 0.00 3.00 25.40 34.90 18.80 39.00 45.00
2.2 0.00 8.40 16.30 40.00 13.40 33.90 40.00
Mean 0.00 5.70 20.85 37.45 16.10 36.45 42.50
SD 0.00 3.82 6.43 3.61 3.82 3.61 3.54
X.3.1 0.00 7.90 39.10 36.50 44.80 34.90 45.60
3.2 0.00 12.10 30.30 35.00 21.30 15.20 51.90
Mean 0.00 10.00 34.70 35.75 33.05 25.05 48.75
Lampiran 6 Perhitungan Anova
1. Perhitungan Anova Pemilihan Konsentrasi Inokulum 1.1 Kadar etanol
sumber
keragaman db JK JKR Fhitung F tabel
5%
waktu 4 3506.59 4.46
inokulum 2 3702.42 1851.21 88.84
error 8 166.71 20.84
total 14
Keterangan: F hitung> F tabel
Sehingga kadar etanol pada ketiga perlakuan berpangaruh nyata terhadap waktu fermentasi yang dilakukan. Maka hasil yang didapat ini dilanjutkan dengan uji Duncan.
Standar Error Rata-rata 2.04
Range 3.26 3.39
LSR 6.66 6.92
B C A
Rata-rata 20.02 21.13 23.37
C-B 1.11 1.11< 6.66
A-B 3.35 3.35<6.92
A-C 2.24 2.24<6.66
Keterangan: A=B=C
Dari hasil Duncan diketahui antar perlakuan tidak berbeda signifikan sehingga penentuan konsentrasi inokulum terbaik dilihat dari hasil rata-rata terbesar yaitu konsentrasi inokulum 15%.
1.2 Biomassa
sumber
keragaman db JK JKR Fhitung F tabel
5%
waktu 4 -90.96 4.46
inokulum 2 14.17 7.08 0.60
error 8 94.72 2181.73
total 14 28105.83
Keterangan: F hitung< F tabel