DETEKSI MOLEKULER DAN KERAGAMAN VIRUS
NEWCASTLE DISEASE
PADA AYAM KAMPUNG DI
WILAYAH ACEH
DARNIATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi molekuler dan keragaman virus Newcastle Disease pada ayam kampung di wilayah Aceh adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DARNIATI. Deteksi Molekuler dan Keragaman Virus Newcastle Disease pada Ayam Kampung di Wilayah Aceh. dibimbing oleh SURACHMI SETIYANINGSIH dan AGUSTIN INDRAWATI.
Newcastle Disease (ND) merupakan penyakit unggas yang sangat menular dan penting dalam industri peternakan. Kejadian penyakit bersifat akut sampai kronis dan menyerang berbagai jenis unggas terutama ayam, baik ayam ras maupun ayam buras. Distribusi ND terjadi di seluruh dunia dan menyebabkan kerugian ekonomi yang cukup tinggi akibat depopulasi unggas sakit dan biaya penanggulangan penyakit. Di Aceh, Newcastle Disease merupakan penyakit endemik dan terjadi setiap tahun. Perjalanan penyakit sangat cepat dan meluas dari satu daerah ke daerah lain akibat sistem pemeliharaan yang dilakukan dengan diumbar dan sistem pemasaran melalui pengepul yang membeli dan menjual unggas kepada masyarakat. Sistem pemeliharaan dan pemasaran ini akan meningkatkan kontak baik langsung maupun tidak langsung antara unggas dengan VND dan memperluas sirkulasi virus. Meskipun upaya vaksinasi dan pengawasan lalu lintas unggas telah dilakukan, namun kasus ND masih dilaporkan terjadi. Hal tersebut kemungkinan disebabkan oleh ketidaksesuaian antara galur virus vaksin dengan galur virus yang bersirkulasi di lapangan.
Secara umum penelitian ini bertujuan untuk mendeteksi keberadaan virus, menentukan rute ekskresi, isolasi virus dan mengkaji keragaman isolat virus. Sampel penelitian berupa usapan kloaka dan orofaring dari 177 ekor ayam kampung yang diambil dari unggas pekarangan dan pasar unggas di 10 kecamatan dalam wilayah Kabupaten Aceh Besar dan Kota Banda Aceh. Penapisan virus dilakukan pada sampel pool dengan real-time reverse-transcriptation polymerase chain reaction (rRT-PCR) dengan target gen matriks. Inokulasi 309 sampel representasi 157 ayam asal pool positif matriks pada telur ayam berembrio spesifik pathogen free (SPF) menghasilkan 69 isolat yang berasal dari 51 ekor ayam. Sebagian besar (45.09%) ayam mengeluarkan virus melalui orofaring, 25.39% melalui kloaka dan orofaring, serta 19,61% melalui kloaka.
Karakterisasi keragaman isolat dilakukan dengan uji HI menggunakan serum Komarov dan Hitchner B1, rRT-PCR gen fusi dan uji Elusi. Adanya keragaman epitop permukaan virus ditunjukkan dengan titer HI yang bervariasi antar isolat, perbedaan mencapai 4 log dengan serum Komarov, dan 3 log dengan B1. Sebagian besar isolat mempunyai afinitas yang lebih tinggi terhadap serum Komarov yang mengindikasikan kecenderungan kepada galur virulen. Penentuan patogenisitas menggunakan rRT-PCR menunjukkan 73.95% isolat termasuk ke dalam galur virulen, sementara dari uji elusi menunjukkan 72.46% isolat termasuk galur velogenik, 20.29% mesogenik dan 6.25% dari galur lentogenik.
SUMMARY
DARNIATI. Molecular Detection and Diversity ofNewcastle Disease Virus from Native Chickens in Aceh. under direction of SURACHMI SETIYANINGSIH and AGUSTIN INDRAWATI.
Newcastle disease (ND) is a highly contagious disease in poultry that playing the important role in the livestock. Incidency of disease from acute to chronic and attaches all types of poultries, especially chickens, both broilers and native chicken. Newcastle Disease has worldwide distribution and highly economic impact cause of depopulation and preventive medicine. In Aceh, Newcastle Disease is still endemic that occurs every year. The disease can rapidly transmitted from one area to another as a result of system maintenance that still done by backyard and marketing through the collectors who traded poultries to the community. These system maintenance and marketing will increase contact either directly or indirectly between the NDV and expanding poultry viruses circulating. Eventhough Government has made efforts to control traffic and vaccination program, the cases are still reported. It may coused by inappropriate NDV vaccine to native NDV.
The aims of this research were to detect the presence and examine route of excretion, isolation and the diversity of Newcastle Disease virus (NDV) isolates. The samples were cloacal and oropharynx swabs taken from 177 native chickens from backyard farms and live birds markets in 12 districts in Aceh Besar and Banda Aceh. Screening was done by real-time reverse-transcriptation-polymerase chain reaction (rRT-PCR) to detect matrix gene in pooled samples. SPF egg inoculation of 309 samples representing 157 chikens from matrix positive yielded 69 isolates originated from 51 individual chickens. Majority (45.09%) of the chickens shed the virus via oropharynx, 25.39% via cloaca and oropharynk, and 19.61% through cloaca.
Characterization of viral isolates performed by the HI test using Komarov and Hitchner B1 antisera, fusion rRT-PCR and elution test. The existence of surface epitop diversity was indicated by HI titer variation among isolates; up to 3 log or 4 log differences with B1 and Komarov, respectively, was achieved. Most of isolates had higher affinity to Komarov antibody indicating a tendency toward virulent strain. Pathogenicity determination using fusion rRT-PCR showed 73.95% of isolates belonging to the virulent strain (mesogenic/velogenic), while the elution time demonstrated 72.46% of isolates were grouped to velogenic strain, 20.29% mesogenic and 7.25% lentogenic strains.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
DETEKSI MOLEKULER DAN KERAGAMAN VIRUS
NEWCASTLE DISEASE
PADA AYAM KAMPUNG DI
WILAYAH ACEH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Deteksi Molekuler dan Keragaman Virus Newcastle Disease pada Ayam Kampung di Wilayah Aceh
Nama : Darniati NIM : B253120011
Disetujui oleh Komisi Pembimbing
Drh Surachmi Setiyaningsih, P hD Ketua
Dr drh. Agustin Indrawati, M Biomed Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof Dr drh Fachriyan H. Pasaribu
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, M Sc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2013 – Maret 2014 ini ialah Deteksi Molekuler dan Keragaman Virus Newcastle Disease pada Ayam Kampung di Wilayah Aceh.
Terima kasih penulis ucapkan kepada Ibu drh Surachmi Setiyaningsih, Ph D dan Ibu Agustin Indrawati, M Biomed yang telah banyak memberi saran dan masukan. Di samping itu, penghargaan penulis sampaikan kepada Bapak Prof Dr drh Fachriyan Hasmi Pasaribu selaku ketua program studi Mikrobiologi Medik. Terima kasih untuk Para Staff Lab. Terpadu Mikrobiologi FKH IPB. Terima kasih untuk drh Aprizal Panus, Pupimadita Tizar Audora S Si dan drh. M. Dauk AK atas bantuan dan dorongan semangat selama ini. Terima kasih kepada teman-teman MKM 2012 semoga silaturrahmi kita tetap terjalin. Ungkapan terima kasih juga saya sampaikan kepada Ayahanda M. Zain (alm) dan ibunda Salmiah serta Ayahanda Abdullah (alm) dan ibunda Raliah yang telah memberikan do’a dan dukungannya. Terima kasih untuk suamiku tercinta Zakaria S. Pdi dan dua jagoan kecilku Faizul Ghiffari Dzakir dan Fatih Athari Dzakir yang memberikan motivasi dan kekuatan yang sangat besar, juga keluarga yang telah mendukung selama penulis menyelesaikan pendidikan.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
Hipotesis 4
2 TINJAUAN PUSTAKA 4
Sejarah Newcastle Disease (ND) 4
Virus Newcastle Disease 4
Virulensi dan patogenitas 9
Keragaman Antigenik Virus Newcastle Disease 10
Epidemiologi dan Transmisi Virus 11
Gejala Klinis Newcastle Disease 13
Perubahan Patologis Infeksi Newcastle Disease 14
Uji Laboratorium 15
3 METODE 18
Waktu dan Tempat Penelitian 18
Bahan 18
Alat 18
Metode Penelitian 19
Analisis Data 21
4 HASIL DAN PEMBAHASAN 22
Deteksi dan Isolasi Virus Newcastle Disease. 22
Keragaman Antigenik Virus Newcastle Disease 26
Deteksi Virulensi dan Keragaman Virus Dengan rRT-PCR Fusion 28
Deteksi Virulensi Dengan Uji Elusi 29
Perbedaan Karakter Virus yang Diekresikan dari Kloaka dan Orofaring 31
Deteksi Penyebaran VND di Wilayah Aceh 33
5 SIMPULAN DAN SARAN 35
Simpulan 35
Saran 36
DAFTAR TABEL
1. Inang dari masing-masing family Avian paramyxovirus. 11 2. Pasangan primer dan probe untuk mendeteksi virus ND. 17 3. Hasil isolasi dan identifikasi virus ND di wilayah Aceh. 25 4. Pengelompokan virus berdasarkan tingkat patogenitas dengan uji
elusi dan deteksi dengan rRT-PCR F. 30
5. Isolat virus ND virulen yang tidak terdeteksi pada rRT-PCR. 31 6. Perbedaan karakter virus yang diekskresikam melalui kloaka dan
orofaring dari satu individu ayam. 32
DAFTAR GAMBAR
1. Struktur virus Newcastle Disease secara mikroskopis. 5
2. Struktur virus ND (Rout 2007). 6
3. Siklus hidup dan infeksi virus ND ke dalam sel (Rout 2007). 8 4. Skema transkripsi dan replikasi virus ND (Rout 2007). 8 5. Gejala klinis ayam yang yang terinfeksi virus ND. 13 6. Perubahan patologi anatomi organ visceral ayam. 15 7. Lokasi pengambilan sampel dan sampel pool positif gen matriks. 22 8. Amplifikasi rRT-PCR sampel positif gen matriks. 23
9. Kematian embrio akibat infeksi VND. 24
10. Uji HI isolat terisolasi menggunakan serum Komarov dan B1. 27
11. Sebaran virus ND di wilayah Aceh. 33
12. Sebaran keragaman virus ND di wilayah Aceh. 34
1 PENDAHULUAN
Latar Belakang
Usaha perunggasan mempunyai arti ekonomi yang sangat penting dibandingkan dengan jenis usaha peternakan lainnya. Teknik beternak ayam yang relatif mudah sehingga dapat dilakukan oleh banyak orang, harga produk yang murah, bernilai gizi tinggi serta produk utama dan sampingan yang dapat dimanfaatkan (Tarmudji 2005). Usaha peternakan ayam mempunyai resiko tinggi karena dapat terserang wabah penyakit menular, salah satunya adalah Newcastle Disease (ND). Penyakit ND merupakan penyakit unggas yang sangat penting sehingga termuat dalam “office International Des Epizooties Zoonisatory Code” dan dimasukkan ke dalam List A (Epidemiological Major Disease) (Alexander 2000). Newcastle Disease bersifat menular dan sangat merugikan para peternak ayam. Kejadian penyakit bersifat akut sampai kronis, dapat menyerang semua jenis unggas terutama ayam, baik ayam ras maupun ayam bukan ras (buras) (Tabbu 2003).
Penyakit ND pertama kali dilaporkan terjadi di Jawa, Indonesia dan Newcastle upon Tyne, Inggris pada tahun 1926 sehingga disebut dengan Newcastle Disease. Penyakit tersebut menyebar dengan cepat ke belahan dunia lainnya dan pada akhirnya menjadi penyakit yang bersifat universal. Di Amerika Serikat, penyakit menimbulkan gangguan pernafasan unggas pada tahun 1930. Selanjutnya wabah juga terjadi di Eropa Tengah selama 30 tahun. Kejadian di negara-negara Asia seperti Asia Timur Tengah terjadi pada tahun 1940-1948 dan pada tahun 1962-1972 (Hines dan Miller 2012). Indonesia merupakan daerah endemik ND, kejadian penyakit ND terjadi hampir sepanjang tahun dan meluas dari satu wilayah ke wilayah lain. Infeksi virus melalui inhalasi mempermudah transmisi virus antar unggas (Seal et al. 1995).
Kerugian akibat penyakit ND disebabkan oleh angka morbiditas dan mortalitas yang sangat tinggi. Mortalitas maupun morbiditas dapat mencapai 50-100% akibat infeksi virus ND galur velogenik terutama pada kelompok ayam yang peka, 50% pada galur mesogenik, dan mencapai 30% pada infeksi virus galur lentogenik (Tabbu 2003). Rata-rata morbiditas dan mortalitas ND dalam suatu flok ayam bervariasi antara 90-100% sehingga industri peternakan mengalami kerugian yang serius setiap tahun. Pada tahun 2002, wabah penyakit terjadi di California, USA. Wabah tersebut menyebabkan kerugian 200.000.000 US $ akibat depopulasi unggas yang terinfeksi (Kapzynski dan King 2005; Haque et al. 2010). Menurut data yang dilaporkan OIE, kejadian ND di Indonesia pada tahun 2007, sekitar 1.500-8.000 ekor ayam terinfeksi tiap bulannya di Bali. Pada tahun 2009 dan 2010, wabah ND terjadi pada ayam komersial, yang menyebabkan kematian sebesar 70-80% (Xiao et al. 2012). Kerugian akibat Newcastle Disease di Indonesia diperkirakan mencapai 142 milyar rupiah pertahun. Hal ini disebabkan karena tingkat kematian yang tinggi, menurunnya produksi daging dan telur, serta tingginya biaya pengendalian penyakit (Putra et al. 2012).
2
dipergunakan tidak mampu melindungi ayam dari serangan virus yang bersirkulasi di lapangan. Sa'idu dan Abdu (2008) melaporkan terjadinya wabah viscerotropic velogenic Newcastle Disease (VVND) di Nigeria pada ayam petelur umur 6 minggu yang telah divaksinasi karena infeksi virus lapang yang tidak homolog dengan virus vaksin.
Sepanjang tahun 2012 penyakit pernafasan masih mendominasi perunggasan Aceh. Newcastle Disease adalah penyakit klasik yang kerap menyerang ayam buras sepanjang tahun, disusul dengan Chronic respiratory disease (CRD), Infectious bursal disease (IBD), Pullorum, Kolera, dan beberapa kasus Avian influenza (AI). Pada beberapa beberapa lokasi peternakan rakyat dilaporkan terjadi kasus very virulent ND (vvND) (DISNAK 2012).
Penyakit ND menjadi perhatian utama pemerintah di Kabupaten Aceh Besar selain Avian Influenza. Selama tahun 2011, hampir seluruh Kecamatan dalam wilayah Aceh Besar mengalami kasus ND dengan rata-rata 100 kasus di tiap kecamatan. Usaha penanggulangan dilakukan dengan melaksanakan vaksinasi dan pengawasan lalu lintas unggas dari daerah-daerah yang diduga tercemar virus ND (DISNAK 2012).
Seringnya terjadi kasus ND pada ayam buras disebabkan sistem pemeliharaan dan pemasaran unggas yang masih tradisional. Pemeliharaan unggas dengan cara diumbar akan mempermudah terjadinya penularan penyakit karena tingginya kontak, baik langsung ataupun tidak langsung antar unggas. Sistem pemasaran unggas melalui pengepul yang membeli dan menjual unggas dari masyarakat dengan menggunakan kendaraan bermotor sampai ratusan kilometer dari tempat asal unggas dapat memperluas penyebaran VND di lapangan. Virus tersebar sepanjang jalan yang dilalui oleh kendaraan pengepul dan infeksi lateral antar unggas dalam keranjang pengepul yang terus terjadi sampai ke tempat tujuan baru. Ayam baru yang masuk ke dalam suatu populasi sangat beresiko menjadi sumber infeksi karena virus dapat dikeluarkan oleh ayam terinfeksi beberapa hari sebelum atau sesudah gejala klinis muncul.
Diagnosa penyakit di Aceh biasanya dilakukan berdasarkan gejala klinis dan patologis. Sampai saat ini belum ada upaya untuk melakukan isolasi, identifikasi dan karakterisasi virus ND di Aceh. Perbedaan karakter virus dapat menyebabkan kegagalan vaksinasi di lapangan sehingga diperlukan pemilihan vaksin dan metode vaksinasi yang tepat untuk menanggulangi infeksi ND. Untuk mengetahui galur vaksin yang tepat terlebih dahulu harus diketahui jenis dan tingkat virulensi virus lapangan.
3
Perumusan Masalah
Berdasarkan laporan banyaknya kasus penyakit pernafasan yang terjadi di Aceh dan belum ada upaya deteksi dan isolasi virus yang bersirkulasi, maka diperlukan penelitian untuk mendeteksi keberadaan virus dengan menggunakan teknologi yang lebih sensitif dan spesifik dan juga karakterisasi virus untuk mengetahui keragaman antigenisitas dan tingkat patogenitas virus dari lapang. Deteksi dengan metode molekuler diharapkan dapat mengkonfirmasi keberadaan dan penyebaran virus. Hasil karakterisasi dan identifikasi tersebut berguna dalam mengelompokkan virus ke dalam galur tertentu dan mengetahui tingkat virulensi dari virus tersebut.
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mengkaji keberadaan virus ND pada ayam kampung di wilayah Aceh. Secara khusus penelitian ini bertujuan untuk mendeteksi keberadaan virus, rute ekskresi dan isolasi virus. Menguji karakter virulensi virus dengan uji HI, uji real-time reverse-transcriptation polymerase chain reaction (rRT-PCR) pada gen fusi dan uji elusi. Mengelompokkan virus ke dalam galur tertentu dan mendeteksi distribusi virus ND di Aceh.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang keberadaan dan keragaman galur virus ND yang bersirkulasi di Aceh, sehingga dapat diketahui perubahan atau mutasi dari virus sebagai pertimbangan pemerintah dalam melakukan pemilihan galur vaksin yang tepat sesuai dengan tipe virus yang beredar, mengatur sistem pemeliharaan dan pemasaran untuk pencegahan dan pengendalian penyakit yang efektif.
Ruang Lingkup Penelitian
Pada penelitian ini dilakukan serangkaian kegiatan yaitu koleksi sampel usapan orofaring dan kloaka dari ayam kampung di Kabupaten Aceh Besar dan Kota Banda Aceh, pooling sampel usapan, deteksi VND dengan rRT-PCR matriks, isolasi VND pada telur ayam berembrio (TAB) specific pathogen free (SPF), konfirmasi keberadaan VND dengan uji haemaglutination (HA) dan rRT-PCR Matriks. Karakterisasi VND dengan uji haemaglutination inhibition (HI), rRT-PCR fusion dan uji elusi.
4
Hipotesis
Virus Newcastle Disease yang bersirkulasi di Kabupaten Aceh Besar dan Kota Banda Aceh dapat dideteksi dengan rRT-PCR, dan ditumbuhkan pada telur ayam berembrio (TAB). Karakterisasi isolat virus dapat dilakukan dengan uji HI, rRT-PCR fusion, dan Uji Elusi. Virus ND yang terisolasi memiliki karakter yang beragam dan tersebar di seluruh area pengambilan sampel.
2 TINJAUAN PUSTAKA
Sejarah Newcastle Disease (ND)
Penyakit ND secara resmi dilaporkan pada tahun 1927, sewaktu terjadi wabah penyakit yang ganas di daerah Newcastle Upon Tyne, Inggris. Kejadian wabah tersebut belum diketahui penyebabnya sehingga disebut sebagai Newcastle Disease. Di Indonesia, ND pertama kali dilaporkan dan diidentifikasi oleh Professor Kranevelt yang bekerja di laboratorium Balai Besar Penelitian Veteriner (BBalitvet) Bogor pada tahun 1926. Penyakit yang diduga ND juga pernah diidentifikasi pada tahun 1924 di Semenanjung Korea dan di Eropa pada pertengahan tahun 1926 (Alexander dan Senne 2008a). Beberapa tahun kemudian ND menyebar dengan cepat ke beberapa negara (panzootik) dan menjadi penyakit yang universal. Di Amerika Serikat pada tahun 1930 terjadi wabah yang menunjukkan gejala klinis gangguan pernafasan pada unggas sehingga disebut Pneumoencephalitis. Di Eropa Timur muncul pada kurun waktu 1926-1960; Timur Tengah pada tahun 1940-1948 dan tahun 1962-1972 (Hines dan Miller 2012).
Newcastle Disease di Indonesia menyebar ke berbagai daerah baik di Jawa maupun diluar Jawa. Saat ini hampir seluruh wilayah Indonesia merupakan daerah tertular dan belum ada satu daerah yang bebas dari ND (Tarmudji 2005). Serangan ND umumnya mulai meningkat pada awal musim hujan dan mencapai puncaknya pada pertengahan musim atau pada saat peralihan dari musim hujan ke musim kemarau.
Virus Newcastle Disease Etiologi
5 pencernaan, tipe neurotropic velogenic dengan gejala gangguan pernafasan dan saraf, tipe mesogenic yang kurang patogen dan biasanya menimbulkan gangguan pada hewan muda, dan tipe lentogenic dengan gejala pernafasan ringan dan tipe asymptomatic enteric yang disebabkan oleh infeksi sub klinis galur lentogenik. Tipe lentogenik dan mesogenik sering dijadikan bahan pembuat vaksin untuk pengendalian ND (Alexander dan Senne 2008a).
Virus ND merupakan virus RNA, memiliki amplop, berbentuk pleomorfik dengan diameter 13-18 nm. Genom tidak bersegmen, berutas tunggal (single stranded) dan berpolaritas negatif. Partikel virus memiliki berat molekul 5x106,
terdiri dari 20-25% lipid dan 6% Karbohidrat (Alexander 2000; Mohammadamin dan Qubih 2011).
Struktur dan karakteristik virus
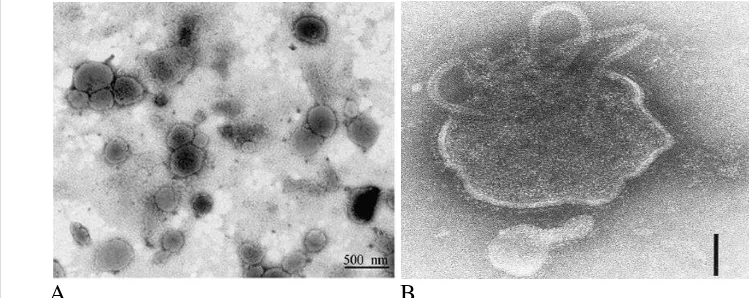
Pemeriksaan dengan mikroskop elektron virus ND pada cairan alantois menunjukkan bentuk pleomorphic (Gambar 1) dengan diameter 100-500 nm, permukaan partikel virus ditutupi dengan tonjolan-tonjolan protein HN dengan panjang 8 nm.
Berdasarkan kandungan nukleotida genom, VND dikelompokkan menjadi 2 kelas yatu: kelas I yang terdiri dari 15.198 nukleotida dan kelas II yang memiliki 15.186 atau 15.192 nukleotida. Virus virulen yang sering ditemukan pada ayam, burung peliharaan dan unggas air dikelompokkan ke dalam kelas II (Dortmans et al. 2011). Genom virus mempunyai enam “Open Reading Frames (ORF)” yang mengkode nucleocapsid protein (NP), beberapa molekul fospoprotein (P), matrix protein (M), fusion protein (F), tiga protein inti dan tiga protein amplop termasuk dua glikoprotein besar hemaglutinin-neuraminidase (HN) dan large RNA-directed RNA polymerase (L). selain itu terdapat non-structural protein (V) dan second protein (W) yang dihasilkan pada saat pengubahan RNA pada proses transkripsi gen P (Oberdorfer dan Werner 1998; Adi et al. 2010). Dari enam protein tersebut hanya dua jenis protein yang mempunyai peranan dalam proses kekebalan yaitu
A B
Gambar 1 Struktur virus Newcastle Disease secara mikroskopis.
6
protein F dan HN, karena keduanya dapat merangsang pembentukan antibodi protektif terhadap VND (Cho et al. 2008).
Protein F galur velogenik dam mesogenik tersusun atas multiple basic amino acid (arginin atau lisin) yang mengapit arginin pada posisi 114 (N terminus sub unit F2) dan phenilalanin pada posisi 117 (N terminus sub unit F1). Efisiensi pembelahan protein F0 dan virulensi VND tergantung kehadiran satu atau kedua arginin pada posisi 112 dan 115 serta phenilalanin pada posisi 117. (Hines dan Miller 2012). Fusion protein (precursor F glycoprotein, F0) berperan penting pada saat virus menginfeksi sel inang, karena protein ini dapat terpecah menjadi F1 dan F2. Polipeptida aktif F1 memperantarai fusi antara membran lipid virus dengan membran sel inang, fusi membran diikuti dengan masuknya genom virus ke dalam sitoplasma sel. Protease inang secara umun dapat membelah protein F vNDV dan mNDV (Rout 2007). Galur VND dengan virulensi rendah hanya memiliki single basic amino acid dan leucin pada posisi 117 pada protein F yang dapat terpeceh dengan kehadiran trypsin like enzyme. Perbedaan komposisi protein ini mempengaruhi kecepatan replikasi virus dan menentukan tingkat virulensi (Hines dan Miller 2012).
Hemaglutinin-neuraminidase (HN) merupakan immunoprotective glycoprotein (immunogenic determinant) yang berperan sebagai antigen permukaan amplop virus ND (Rout 2007). Protein HN juga berperan dalam menentukan tropisme sel pada jaringan inang. Hemaglutinin memiliki fungsi esensial pada fase Attachment; merupakan fase perlekatan partikel virus dengan reseptor cialic acid pada sel inang. Molekul sialic acid merupakan glikoprotein dan glikolipid (Hewajuli dan Dharmayanti 2011). Fase Entry; berperan sebagai fasilitator saat terjadi aktifitas fusi dari protein F pada membran sel inang. Perlekatan hemaglutinin pada membran sel menempatkan protein F sedekat mungkin dengan sel inang sehingga protein F dapat membelah dengan memanfaatkan protease inang dan membentuk pori untuk memulai proses fusi dan transfer genom. Fase Release; merupakan aktifitas dari neuraminidase pada saat budding untuk melepaskan diri dari permukaan sel dan menghilangkan sisa cialic acid pada progeni virus (Hines dan Miller 2012).
Virus ND mempunyai kemampuan mengaglutinasi dan melisiskan sel darah merah (eritrosit) ayam, mamalia dan reptilia, mengeluarkan toksin dan hemolisin
7 (Alexander 1982). Protein HN dapat rusak dan kehilangan kemampuan mengaglutinasi eritrosit jika dipanaskan pada suhu 56o C, sehingga daya infeksi
dan imunogenitasnya juga menurun (Ibu et al. 2010).
Protein NP memperantarai enkapsidasi genom RNA membentuk nukleokapsid yang menjadi template untuk transkripsi dan replikasi virus. Protein P penting untuk sintesis RNA virus dan membentuk komplek terpisah dengan NP, protein L dan nukleokapsid (EFSA 2007).
Karakteristik biologik Paramyxovirus ditentukan berdasarkan aktivitas hemaglutinin, neuraminidase, fusi sel. Kemampuan VND mengaglutinasi eritrosit disebabkan oleh ikatan hemaglutinin pada reseptor permukaan sel. Hambatan aglutinasi oleh antisera spesifik dapat digunakan untuk mengidentifikasi virus ND. Enzim neuraminidase berperan untuk melepaskan progeni virus dari permukaan sel dan mencegah reattachmnet dan self aggregation sehingga dapat menginfeksi sel-sel baru. Aktivitas neuraminidase akan menghambat kerja hemaglutinin untuk menempel pada sel inang dengan memecah secara enzimatis reseptor sialic acid pada permukaan sel (Rout 2007). Reaksi fusi dapat menyebabkan penggabungan dua atau lebih sel inang hingga membentuk syncytia (giant cell) ketika partikel virus membentuk tunas pada sel. Membran sel eritrosit yang kaku akan lisis ketika virus keluar dari sel (Alexander dan Senne 2008a).
Replikasi Virus Newcastle Disease
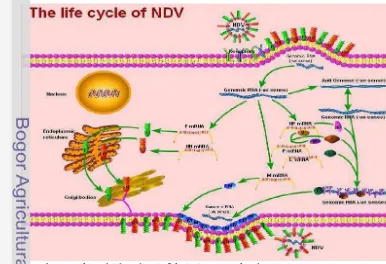
Proses infeksi virus diawali dengan perlekatan virion pada sialic acid yang merupakan protein permukaan sel dan berperan sebagai reseptor pada sel target. Ikatan ini akan menggertak pembelahan protein F menjadi F1 dan F2 yang menyebabkan penggabungan amplopvirus dengan membran plasma sel inang dan membentuk pori pada permukaan sel sehingga nukleokapsid virus dapat masuk ke dalam sel (Rout 2007). Setelah nukleokapsid virus/ribonukleoprotein complex (RNP) yang mengandung genom RNA masuk ke dalam sel, nucleocapsid virus terpisah dari protein M dan dilepaskan ke dalam sitoplasma. Transkripsi genom RNA terjadi melalui kompleks viral polymerase (P-L), aktivitas katalitik dari polimerase dan fungsi dari protein L dan P bertanggung jawab untuk pengikatan kompleks P-L pada nukleokapsid. kemudian complex viral polymerase mentranskripsikan genom RNA virus untuk menghasilkan mRNAs yang dibutuhkan untuk sintesis protein virus. Ikatan kompleks virus dengan nucleocapsid diperantari oleh protein P, sedangkan protein L berfungsi pada proses katalitik (Dortmans et al. 2011).
Peralihan dari transkripsi ke replikasi genom terjadi apabila jumlah protein virus yang terakumulasi sudah mencukupi. Complex polymerase bertanggung jawab dalam sintesis long-length RNA antigenomik positif, yang berfungsi sebagai template untuk sintesis untai RNA genomik negatif. Nucleocapsid virus dibentuk dengan bersatunya NP pada RNA genomik yang baru dengan complex polymerase. NP mulai berikatan dengan rantai utama, proses di dalam protein P berperan sebagai pembawa NP kepada RNA baru, kompleks NP-P memulai proses transkripsi dan replikasi (Rout 2007).
8
membentuk kompleks replikasi virus. Semua komponen partikel virus dibawa ke membran plasma, komponen-komponen tersebut dirakit oleh protein M, kemudian virion akan dilepaskan dari sel melalui proses pertunasan. Melalui aktivitas neuraminidase yang difasilitasi oleh protein HN, virus melepaskan diri dari sel inang dan membuang sisa cialic acid pada partikel virus untuk mencegah penyatuan kembali (Hines dan Miller 2012).
9
Virulensi dan patogenitas
Tingkat virulensi berhubungan dengan tropisme jaringan dan sistem kekebalan inang. Spesies inang, status immun, umur, lingkungan, infeksi skunder oleh organisme lain, dosis virus dan jalur paparan juga dapat mempengaruhi keparahan penyakit (Umali et al. 2013). Faktor yang menentukan tingkat virulensi antar galur antara lain terletak pada kecepatan multiplikasi virus, semakin cepat virus bereplikasi akan semakin ganas. Selama proses replikasi, protein fusi virus (F0) akan terpecah menjadi menjadi F1 dan F2 yang memperantarai fusi virus dengan membran sel inang (Rout 2007). Protein F0 pada galur virulen dapat terpecah oleh kebanyakan protease inang yang terdapat di semua jaringan, sehingga dapat menyebar dengan cepat dan meluas dalam tubuh inang, sedangkan protein F0 pada galur avirulen dapat membelah dalam sel yang mengandung “trypsin-like enzyme” dan hanya terdapat pada mukosa saluran pecernaan dan respirasi. Hal ini menunjukkan bahwa variasi antara galur virulen dan avirulen disebabkan oleh adanya perbedaan sekuen nukleotida pada daerah pembelahan protein F0 (Alexander 2000).
Pengujian tingkat patogenitas dan virulensi dari virus ND secara in vivo dapat dilakukan dengan beberapa cara yaitu Mean death time (MDT), Intravenous pathogenicity index (IVPI), Intracerebral pathogenicity index (ICPI), Cytophatic effect (CPE). Pengujian secara in vitro dapat dilakukan dengan teknik molekuler menggunakan RT-PCR dan uji stabilitas hemaglutinat (elusi) (Ezeibe dan Ndip 2005; Alexander dan Senne 2008a; Fazel et al. 2012).
Uji MDT dilakukan dengan menginokulasikan virus pada telur ayam berembrio (TAB). Mean death time adalah waktu kematian embrio yang dihitung setelah TAB diinokulasi virus. Lamanya waktu kematian dari embrio menentukan tingkat keganasan dari virus. Virus yang mampu mematikan embrio dalam waktu < 60 jam setelah inokulasi digolongkan ke dalam galur velogenik, jika kematian embrio terjadi antara 60-90 jam maka dimasukkan dalam galur mesogenik dan virus yang mematikan embrio dalam waktu > 90 jam maka termasuk dalam galur lentogenik (Cattoli et al. 2011)
Uji patogenisitas dengan ICPI dilakukan pada anak ayam umur sehari (Day old chicken) dan uji IVPI dilakukan pada anak ayam umur 6 minggu. Uji ICPI dan IVPI menggunakan sistem skoring untuk mengevaluasi tingkat morbiditas atau mortalitas pada ayam. Nilai pada uji ICPI berkisar pada angka 0 sampai 2.0, virus yang virulen akan mencapai angka 2.0, sementara galur lentogenik akan mendekati angka 0.0. Pada uji IVPI nilai skoring berkisar antara 0 sampai 3.0. Galur velogenik akan mencapai angka 3.0, sedangkan galur menghasilkan plak ditunjukkan oleh galur-galur virulen pada ayam dan telur berembrio (Reeve dan Poste 1971)
10
(mesogenik/velogenik). Pengembangan rRT-PCR dapat mendeteksi sejumlah besar APMV-I yang akan meningkatkan kemampuan diagnostik terhadap VND. Kombinasi primer dan probe matriks dapat mendeteksi hampir semua APMV –I dari kelas II dan sebagian besar kelas I, sedangkan primer dan probe fusion digunakan untuk mendeteksi RNA virus ND pada gen fusion yang dapat mendeteksi galur ND virulen (mesogenik dan velogenik) dari kelas II (Hines dan Miller 2012). Deteksi virus secara molekuler dengan rRT-PCR pada gen matriks APMV-1 lebih sensitif (96.7%) dari pada deteksi pada gen fusion (91.26%), sehingga gen matriks APMV-1 digunakan untuk melakukan penafisan terhadap sampel dan pengujian virus ND velogenik pada gen fusion (F) digunakan untuk mengkonfirmasi hasil dari gen matriks APMV-1. Sampel yang menunjukkan hasil positif pada gen matriks dan gen F menunjukkan kepastian adanya virus ND virulen di dalam sampel (NVSL 2005).
Hemaglutinat (aglutinasi eritrosit) yang terbentuk pada uji HA dapat terurai kembali oleh aktivitas enzim neuraminidase atau disebut juga dengan elusi. Stabilitas hemaglutinat diantara galur virus ND bervariasi tergantung kepada patotipe atau tingkat virulensinya. Waktu elusi yang berbeda-beda dapat menjadi acuan dalam pengelompokkan virus lapang. Virus velogenik mempunyai waktu elusi dari 84 sampai 189 menit, sedangkan virus mesogenik mempunyai waktu elusi antara 43 sampai 78 menit. Virus yang termasuk lentogenik mempunyai waktu elusi 20 sampai 45 menit (Ezeibe dan Ndip 2005; Wibowo et al. 2012).
Keragaman Antigenik Virus Newcastle Disease
Berbagai genotipe yang berbeda dari Avian paramyxovirus serotype 1 (APMV-1) bersirkulasi di penjuru dunia. Family Paramyxovirus mempunyai 10 serogrup, yaitu Paramyxovirus-1 sampai Paramyxovirus-10. Serogrup yang paling penting dan paling patogen pada ayam adalah Paramyxovirus-1 (dengan prototype Newcastle Disease virus), Paramyxovirus-2 dan Paramyxovirus- 3. Serogrup lainnya umumnya menyerang itik, angsa, merpati, betet, dan beberapa jenis burung lainnya (Saepulloh dan Darminto 2005). Meskipun semua virus ND adalah anggota dari APMV-1 namun keragaman antigenik dan genetik di dalam serogrup tersebut telah dikenali dan dikelompokkan berdasarkan tingkat patogenitasnya (Miller et al. 2013).
11 dalam virus low virulent yang mengalami peningkatan patogenitas setelah bersirkulasi pada peternakan ayam.
Isolat-isolat virus ND secara antigenik mempunyai serotipe/kelompok yang sama. Teknologi monoklonal menyediakan pendekatan baru untuk membedakan variasi antigenik antar isolat. Antibodi monoklonal (ABM) dapat mendeteksi sedikit variasi pada antigenisitas misalnya perubahan asam amino tunggal pada epitop. Beberapa peneliti sudah menggunakan ABM untuk membedakan antara virus dari galur vaksin yang umum digunakan yaitu Hitchner B1 dan La Sota, sedangkan ABM yang lain dapat memisahkan virus vaksin dengan virus epizootik (Alexander dan Senne 2008a)
Epidemiologi dan Transmisi Virus
Inang (Host)
Pada umumnya virus ND menyerang unggas seperti ayam, itik, angsa, merpati, betet, dan beberapa jenis burung lainnya. Sekitar 236 spesies burung memiliki catatan dapat diisolasi virus ND dan ayam dianggap spesies unggas yang paling rentan terhadap infeksi (Tabel 1). Burung air dianggap paling tahan terhadap infeksi. Beberapa isolat dengan virulensi rendah dari unggas air yang bermigrasi di Amerika Serikat digunakan sebagai vaksin komersial galur B1 dan La Sota (EFSA 2007).
Tabel 1 Inang dari masing-masing family Avian paramyxovirus.
Prototipe Inang sensitif Keadaan Penyakit
Virus Primer Sekunder PMV-5 Bugerigars Tidak ada Infeksi tidak diketahui PMV-6 Itik, Angsa Kalkun Pada itik dan angsa tidak PMV-8 Itik, Angsa Tidak ada Infeksi tidak diketahui PMV-9 Itik Tidak ada Tidak tampak gejala klInis
pada itik komersil
12
Penyebaran Geografis
Epizootik Avian paramyxovirus (APMV-1) yang berkelanjutan terjadi di Amerika Tengah, Amerika Selatan, Afrika dan Asia, sedangkan epizootik sporadik terjadi di Eropa. Galur virulen endemik di Amerika dan Kanada, tetapi pada peternakan unggas komersial bebas dari galur velogenik. Isolat lentogenik ditemukan pada unggas di seluruh dunia dan umumnya isolat lapang yang beredar di Amerika merupakan virus dari galur low virulent. Pada wabah ND di Australia tahun 1998-2000, ditemukan virus lokal dari galur low virulen yang mengalami peningkatan virulensi menjadi virus virulen setelah terpapar pada unggas domestik (Hines dan Miller 2012).
Distribusi ND sangat tergantung pada eradikasi dan kontrol yang dilakukan. Keberhasilan program eradikakasi juga tergantung pada jenis populasi unggas di suatu negara. Resiko terjadi ND lebih besar pada negara yang mayoritas memiliki populasi ayam kampung dibandingkan dengan negara yang mayoritas memiliki peternakan ayam komersial. Penyebaran virus secara alami juga mempengaruhi distribusi penyakit (Alexander dan Senne 2008a)
Transmisi/Penularan
Transmisi virus ND dapat terjadi melalui inhalasi dan ingesti. Virus dapat disebarkan oleh hewan atau media yang berkontak langsung dengan unggas yang sensitif. Penularan virus ND dapat terjadi secara langsung antar ayam dalam satu kelompok ternak. Sumber virus berasal dari ekskreta ayam terinfeksi baik melalui pakan, air minum, lendir, feses, maupun udara yang tercemar virus, peralatan dan pekerja kandang. Virus ND dapat ditularkan melalui saluran pernafasan atau pencernaan. Unggas Gallinaceous mengeluarkan virus 1-2 minggu setelah terinfeksi (Alexander dan Senne 2008a).
Pasar unggas hidup memiliki kontribusi untuk menyebarkan virus. Unggas yang dipasarkan dapat berasal dari daerah-daerah lain yang akan membawa variasi patotipe virus dari daerah asal. Virus ini dapat ditularkan pada unggas lain di area pasar dan juga wilayah yang memiliki lokasi berdekatan dengan pasar. Burung liar yang bermigrasi juga mampu mentransmisikan virus melalui kontak langsung atau mengkontaminasi makanan dan minuman dengan agen infeksius (Hines dan Miller 2012)
Jarak penularan melalui aerosol masih menjadi perdebatan, hasil studi menyatakan virus masih dapat ditemukan pada jarak 64 meter. Ketahanan virus pada penularan secara aerosol tergantung pada kelembaban dan faktor lingkungan lain, serta kepadatan populasi suatu peternakan. Anak ayam yang baru menetas dapat tertular dari cangkang telur yang terkontaminasi feses yang mengandung virus ND (OIE 2008). Virus dapat bertahan pada cangkang telur dan terutama pada feses. Ketahanan virus di lingkungan dipengaruhi oleh kelembaban, suhu, agen suspensi dan paparan cahaya. Virus ND dapat bertahan pada lantai kandang selama 10-14 hari, dan pada suhu 20 oC di tanah selama 22 hari. Pada suhu diatas 1-2 oC virus masih bertahan pada kulit ayam selama 60 hari dan dalam sum-sum
13 Penularan virus dari ayam terinfeksi tergantung pada tempat replikasi dari virus. Ayam yang menunjukkan gejala pernafasan akan mengeluarkan eksudat dan udara yang mengandung virus dan menginfeksi ayam lain melalui inhalasi. Virus ND yang bereplikasi dalan saluran pencernaan akan dikeluarkan melalui feses. Penularan virus dapat terjadi melalui oral akibat ingesti dari feses yang mengandung virus, makanan dan minuman yang tercemar atau melalui inhalasi karena terhirup virus dari feses yang telah kering (Tabbu 2003).
Masa Inkubasi
Masa inkubasi penyakit ND pada unggas bervariasi pada kisaran 2-15 hari tergantung pada tingkat virulensi dan kerentanan dari suatu populasi (Alexander dan Senne 2008a). Masa inkubasi tergantung pada galur virus, umur, status immun, spesies dan faktor lingkungan. Pada infeksi alami umumnya masa inkubasi berlangsung antara 2-6 hari (OIE 2012).
Gejala Klinis Newcastle Disease
Berdasarkan keparahan penyakit secara klinis, galur NDV diklasifikasikan menjadi 5 patotipe (OIE 2012): Viscerotropic velogenic: merupakan bentuk yang sangat patogen dimana lesi perdarahan pada usus sering terlihat. Neurotropic velogenic : bentuk yang memperlihatkan kematian tinggi, biasanya diikuti dengan gejala pernafasan dan saraf. Mesogenic: bentuk yang memperlihatkan gejala pernafasan, kadang-kadang gejala saraf tetapi tingkat kematian yang rendah. Lentogenic: bentuk yang memperlihatkan infeksi ringan dan subklinis. Asymptomatic enteric: bentuk yang menyebabkan infeksi enterik subklinis oleh galur lentogenik. Gejala klinis yang muncul pada penyakit ND bervariasi tergantung dari galurvirus dan spesies unggas yang terinfeksi.
A B
Gambar 5 Gejala klinis ayam yang yang terinfeksi virus ND.
14
Menurut Alexander dan Senne (2008a) tipe Viscerotropic Velogenic Newcastle Disease (VVND) merupakan bentuk akut yang menimbulkan mortalitas tinggi pada unggas semua umur dengan mortalitas mencapai 100%. Tipe ini juga dikenal dengan bentuk Doyle yaitu dicirikan dengan adanya lesi perdarahan pada saluran pencernaan. Gejala yang sering muncul antara lain unggas terlihat lesu, pembengkakan pada daerah sekitar mata, diare dengan feses berwarna hijau atau putih yang dapat bercampur darah, gangguan saraf pusat menyababkan terjadi tortikolis, tremor otot serta paralisis kaki dan sayap.
Neurotropic Velogenic Newcastle Disease (NVND) dikenal dengan bentuk beach yang menimbulkan gejala klinis pada saluran pernafasan dan saraf yang menyebabkan mortalitas sampai 50% pada unggas dewasa dan 90% pada unggas muda. Gejala klinis yang sering muncul adalah sesak nafas, gorok dan tortikolis. Virus ND galur mesogenik hanya menyebabkan kematian pada unggas muda yang dikenal dengan bentuk beaudette. Tingkat virulensi bentuk ini kurang ganas dibandingkan bentuk beach (Hines dan Miller 2012).
Virus ND galur lentogenik memiliki gejala klinis yang bersifat ringan, tidak menimbulkan kematian pada unggas dewasa dan biasanya banyak digunakan sebagai vaksin. Infeksi dapat menjadi parah jika ayam yang terinfeksi virus juga mengalami infeksi skunder oleh mikoorganisme lain. Bentuk asymptomatic enteric merupakan bentuk yang tidak menunjukkan gejala klinis dan gambaran patologis, tetapi ditandai dengan infeksi usus ringan oleh virus galur lentogenik yang tidak menyebabkan penyakit (Alexander 2000)
Perubahan Patologis Infeksi Newcastle Disease
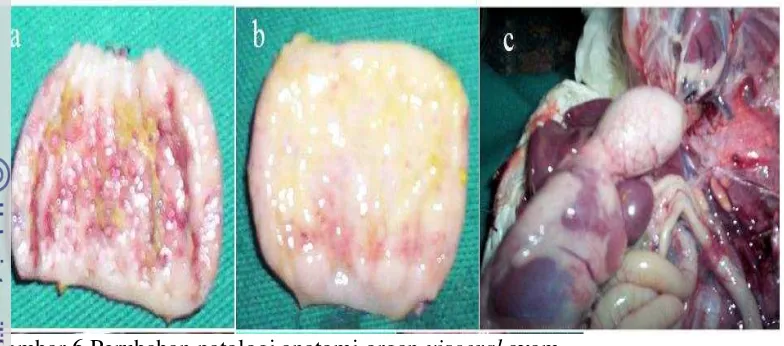
Lesi organ visceral yang signifikan sering ditemukan pada unggas yang terinfeksi oleh virus dari galur velogenik. Kepala atau daerah periorbital membengkak, dan jaringan interstisial pada leher mengalami edematous, terutama didekat toraks. Kongesti atau hemoragi terlihat pada pharing bagian bawah dan mukosa trakeal, dipteritis membran mukosa orofaring, trakea dan esophagus. Pada mukosa proventrikulus dapat ditemukan Ptechie dan echimosa kecil. Hemoragi, ulcer, edema dan/atau nekrosis sering terjadi pada seka tonsil dan jaringan limfoid usus (termasuk peyer’s patches). Perubahan patologi anatomi yang ditandai dengan adanya ptechie pada proventrikulus, ventrikulus, usus, seka tonsil, trakea, dan paru-paru merupakan perubahan patognomonis akibat infeksi VND (Kencana et al. 2012).
Limpa membengkak, rapuh dan berwarna merah kehitaman atau belang-belang. Kerusakan limposit dapat terlihat pada daerah kortikal dan germinal limpa dan timus. Nekrosis pada pankreas dan edema pada paru-paru, edematous pada ovarium atau atropi dan hemoragi, ditemukan pada beberapa unggas. Ayam yang mati mendadak biasanya lesi yang terlihat hanya sedikit atau tidak ada lesi sama sekali (Piacenti et al. 2006; Alexander dan Senne 2008a).
15 dan 1 atau 2 hari berikutnya terjadi kelumpuhan kaki, sayap dan tortikolis leher (Kommers 2001).
Gambar 6 Perubahan patologi anatomi organ visceral ayam.
Derajat ptechi pada proventikulus (a,b) dan kongesti organ visceral akibat infeksi VND (Abdel-Moneim et al. 2006)
Uji Laboratorium
Uji laboratorium untuk mendiagnosa Newcastle Disease dapat dilakukan dengan cara konvensional dan molekuler. Deteksi virus secara konvensional dilakukan dengan mengisolasi virus pada telur ayam berembrio (TAB) dan kultur sel. Isolasi virus merupakan standar referensi untuk mendiagnosa VND. Isolasi virus penting untuk mengkonfirmasi keberadaan virus dan untuk karakterisasi virus selanjutnya (Terregino dan Capua 2009). Telur ayam berembrio spesific pathogen free (SPF) umur 9-11 hari sering digunakan untuk isolasi karena merupakan inang yang paling sensitif untuk isolasi virus dan dapat digunakan pada semua tipe sampel seperti organ, usap kloaka, usap trakea dan oropharingeal (OIE 2012).
Virus ND virulen dapat bereplikasi pada berbagai kultur sel unggas dan non unggas. Kultur sel yang banyak digunakan antara lain chicken embryo fibroblast (CEF), chicken embryo liver (CEL), chicken embryo kidney (CEK), African green monkey kidney, chicken-embryo-related (CER), baby hamster kidney (BHK-21), HeLa cells, KB cells dan vero cell (Ahamed et al. 2004). Pertumbuhan virus pada sel monolayer dapat mengakibatkan perubahan sel atau cytopathic effect dan syncytia. Umumnya virus ND membentuk plak dengan diameter dari 0.5 mm sampai 4.0 mm. Mayoritas galur velogenik dan mesogenik membentuk formasi plak yang jelas, sedangkan galur lentogenik untuk efektifitas pembentukan plak membutuhkan ion Mg2+ dan diethylaminoethyl dextran atau trypsin (0.01 mg/ml) dalam kultur medium (Reeve dan Poste 1971; Cattoli et al. 2011).
16
hemaglutinin yang terdapat pada amplop virus. Aktifitas HA virus dapat dikonfirmasi dengan uji Haemagglutination inhibition (HI) dengan menggunakan antisera poliklonal spesifik terhadap NDV. Uji HI berdasarkan pada kemampuan antibodi spesifik untuk menghambat aktifitas hemagglutinin virus (Miller et al. 2013)
Patogenisitas virus ND dapat diketahui dengan beberapa uji: 1). Mean death time (MDT) pada embrio ayam, 2) Intracerebral pathogenicity index (ICPI) pada anak ayam umur 1 hari, 3). Intravenous pathogenicity index (IVPI) pada anak ayam umur 6 minggu. Virus ND dari telur berembrio dan spesimen lapangan dapat diidentifikasi menggunakan reverse-trancriptation polymerase chain reaction (RT-PCR), gene sequencing, analisis enzim restriksi (restriction enzyme analysis) (OIE 2012).
Teknik Molekuler untuk mendiagnosa Virus Newcastle Disease dengan Polymerase chain reaction (PCR) telah dikembangkan dan menjadi teknik yang revolusioner. Teknik PCR menggunakan metode enzimatis untuk menggandakan secara eksponensial sekuen nukleotida secara in vitro. Teknik real-time reverse-transcriptation PCR (rRT-PCR) merupakan hasil pengembangan RT-PCR konvensional yang memungkinkan untuk dilakukan pemonitoran amplifikasi RNA pada saat proses amplifikasi berlangsung. Real-time reverse-transcriptation PCR merupakan perangkat saintifik untuk mendeteksi ribonuclease acid (RNA), deoxyribonucleic acid (DNA) dan complementary DNA (cDNA). Teknik rRT-PCR sangat sensitif yang memungkinkan amplifikasi dan kuantifikasi urutan nukleotida spesifik dan menurukan resiko kontaminasi setelah amplifikasi (Hoffmann et al. 2009).
Deteksi hasil amplifikasi dilakukan dengan memonitor flourescen yang dihasilkan oleh intercalating dyes, primer yang dilabel fluorophor atau probe spesifik. Penggunaan probe spesifik meningkatkan spesifisitas dibandingkan PCR konvensional yang dilakukan pada agarose. Target kuantifikasi dicapai dengan menentukan jumlah siklus amplifikasi yang dibutuhkan untuk menghasilkan produk PCR pada awal fase eksponensial PCR yang akan memotong garis fluorescenthreshold cycle (Ct) (Hoffmann et al. 2009). Nilai Ct menggambarkan konsentrasi relatif target PCR. Fluorescen dyes seperti ethidium bromide yang spesifik untuk double-stranded DNA (dsDNA) adalah sistem pertama yang digunakan pada pengujian rRT-PCR. SYBR Green I merupakan intercalating dyes yang paling banyak digunakan pada rRT-PCR. Dyes ini 100 kali lebih tinggi afinitas pengikatannya dibandingkan ethidium bromide (Hoffman et al. 2009).
Real-time reverse-transcriptation PCR juga sudah dikembangkan untuk mendeteksi RNA Avian paramyxovirus serotype-1 (APMV-1) dari sampel klinis yang berasal dari burung. Pengujian ini menggunakan protokol single tube dengan fluorogenic hydrolysis probes. Real-time RT-PCR yang digunakan untuk memeriksa sampel klinis dari unggas yang diinfeksi secara eksperimen dengan galur VND yang bertanggung jawab pada epizootic di Amerika. Hasil penelitian ini menunjukkan adanya korelasi positif antara hasil rRT-PCR dengan hasil isolasi virus dari sampel klinis (Wise et al. 2004).
17 (Hoffman et al. 2009). Beberapa pasang primer dan probe yang sudah dipublikasi untuk mendeteksi genom NDV tersaji pada Tabel 2.
Tabel 2 Pasangan primer dan probe untuk mendeteksi virus ND. Gen berkembang dimana industri peternakan berkembang sangat pesat, wabah karena VND sangat merugikan, bukan hanya karena kematian, tetapi juga pengeluaran biaya ekstra untuk vaksinasi dan biosekuriti (Alexander dan Senne 2008). Biosekuriti yang baik dapat mencegah terjadinya ND pada peternakan unggas. Unggas yang dipelihara tidak diperbolehkan untuk kontak dengan unggas lain yang status kesehatannya belum jelas. Pekerja kandang dilarang kontak dengan unggas diluar peternakan. Pengendalian penyakit di Indonesia, selain dilakukan dengan penerapan biosekuriti juga dilakukan dengan vaksinasi.
Prinsip vaksinasi terhadap penyakit virus adalah untuk mendapatkan respon imun terhadap virus sehingga tidak menyebabkan penyakit. Sistem kekebalan pada unggas merupakan suatu interaksi kompleks antara sel–sel limpoid dan faktor-faktor lainyya yang mampu meningkatkan efektifitas respon terhadap infeksi patogen. Respon kekebalan humoral dan seluler berperan penting dalam melawan infeksi VND. Respon kekebalan humoral dan seluler timbul setelah 2 - 3 hari pasca vaksinasi ND(Hewajuli dan Dharmayanti 2011).
18
menetukan pada keberhasilan program vaksinasi. Pemberian vaksin yang baik akan mempengaruhi keberhasilan vaksinasi. Aplikasi vaksin yang tidak tepat merupakan penyebab umum kegagalan vaksinasi (Marangon dan Busani 2006).
Beberapa aplikasi pemberian vaksin aktif pada vaksinasi ND antara lain dengan cara melalui air minum, spray dan tetes mata atau hidung. Keuntungan pemberian vaksin melalui air minum yaitu aplikasi mudah karena bisa dicampur langsung ke dalam air minum, tetapi kekurangannya adalah respon imun yang dihasilkan tidak seragam, sedangkan keuntungan menggunakan semprotan (spray) adalah meminimalkan handling sehingga hewan tidak stres, respon mukosal baik dan tidak mahal. Kekurangan metode ini kemungkinan dosis vaksin yang diberikan tidak cukup. Pemberian vaksin melalui tetes mata dan hidung keuntungannya efektif dan akurat dan menimbulkan imunitas humoral dan mukosal (Marangon dan Busani 2006).
3 METODE
Waktu dan Tempat Penelitian
Pengambilan sampel penelitian dilakukan di 2 pasar unggas dan unggas pekarangan pada beberapa kecamatan dalam wilayah Aceh dari bulan Juli - Agustus 2013. Penelitian dilaksanakan di bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesmavet Fakultas Kedokteran Hewan IPB dari bulan September 2013 sampai Maret 2014.
Bahan
Isolasi virus menggunakan telur ayam berembrio (TAB) specifik patogen free (SPF) berumur 10 hari, penicillin, streptomycin dan alkohol. Uji Haemaglutination (HA) dan Haemaglutination Inhibition (HI) menggunakan Phosphat Buffer Saline (PBS) pH 7.2, red blood cell (RBC) ayam. Virus kontrol 4 HAU dari galur La Sota dan serum poliklonal spesifik ND yaitu serum Komarov dan Hichtner B1 (koleksi BBPMSOH).
Alat
Sampel usap kloaka dan orofaring diambil dengan menggunakan cotton swab steril dan media transport Brain Heart Infusion Broth (BHIB). Isolasi RNA virus menggunakan Roche High Pure Viral Nucleic Acid kit. Untuk amplikasi rRT-PCR dilakukan dengan menggunakan Ag-Path IDTM one-step RT-PCR kit dari Ambion® dengan plat optik 96 sumuran pada mesin Applied Biosystems 7500
19
Metode Penelitian
Pengambilan sampel swab kloaka dan orofaring
Sebanyak 177 ekor ayam yang berasal dari Kabupaten Aceh Besar dan Kota Banda Aceh. Sampel diambil dari ayam pekarangan dan yang diperjualbelikan oleh padagang pengepul di pasar unggas. Pengambilan sampel kloaka dan orofaring dari dilakukan dengan cara diulas menggunakan cotton swab dan dimasukkan ke dalam tabung eppendorf 2 ml yang berisi media virus Brain Heart Infusion Broth (BHIB). Tabung diberi kode berdasarkan jenis, asal, dan tanggal pengambilan sampel. Sampel ditranportasikan dalam rantai dingin (4 - 8 °C) dan dibawa ke laboratorium untuk disimpan pada deep freezer (- 80 0C) sampai saat
akan dilakukan pengujian. Sampel usapan kloaka dan orofaring dipooling berdasarkan asal, waktu pengambilan dan jenis sampel. Pooling dilakukan pada 5 - 6 individu (100 µl per individu).
Isolasi RNA (Roche)
Sebanyak 200 µl working solution (campuran poly A dan binding buffer) dimasukkan ke mikrocentrifuge 1.5 µl. Proteinase K ditambahkan sebanyak 50 µl dan sampel 200 µl kemudian dihomogenkan dan diinkubasi pada suhu 72 °C selama 10 menit. Selanjutnya ditambahkan 100 µl binding buffer, dihomogenkan dan ditransfer seluruh suspensi ke dalam High pure (HP) filter tube dan disentrifus selama 1 menit pada 8000 g. Tabung HP filter tube dipindahkan pada collection tube baru, ditambahkan 500 µl inhibitor removal buffer dan disentrifugasi pada 8000 g selama 1 menit. Collection tube diganti kembali dan dicuci dua kali dengan 450 ml wash buffer selanjutnya disentrifus 8000 g, 1 menit dan dilanjutkan dengan sentrifugasi pada kecepatan 13.000 g selama 10 detik. Berikutnya ditambahkan 50 µl elution buffer ke dalam HP filter tube dan disentrifugasi pada 8000 g selama 1 menit. Hasil elusi RNA disimpan dalam microcentrifuge pada suhu -80 oC.
Uji Real-Time Reverse-Transcriptation Polymerase Chain Reaction (rRT-PCR)
Master mix PCR dibuat dengan mencampur bahan sebagai berikut: H2O
20
mesin Applied Biosystems 7500 Real-time PCR System dengan kondisi sebagai berikut: tahap 1 (1×): reverse transkripsi 45 oC, 10 menit; denaturasi 95 oC, 10
menit; tahap 2 (40x): denaturasi 94 oC, 10 detik; annealing 56 oC, 30 detik;
ekstensi 72 oC 10 detik. Hasil PCR dianalisis menggunakan Applied B1osystems 7500 Real-Time PCR Systemsoftware.
Isolasi Virus pada Telur Ayam Berembrio
Isolasi virus dilakukan terhadap sampel individual kloaka dan orofaring yang menunjukkan positif terdapat gen matriks dengan rRT-PCR. Sampel usapan Kloaka dan orofaring sebagai inokulum disuspensi dengan Penicillin-streptomycin (100.000 IU) dan diinokulasikan pada telur ayam berembrio spesific pathogen free (SPF) berumur 10 hari melalui ruang alantois (allantoic cavity). Telur yang telah diinokulasi akan diinkubasikan dan diobservasi selama 4-7 hari pada suhu 37 °C dengan kelembaban 60-65% (OIE 2012). Cairan alantoik dipanen dan diuji keberadaan aktivitas virus dengan uji HA. Jika pada pasase pertama tidak terdeteksi aktivitas virus, cairan alantoik diinokulasikan kembali pada telur berembrio (pasase kedua). Jika aktifitas virus tetap tidak diperoleh pada pasase kedua ini, sample dianggap negatif. Sampel yang telah menunjukkan adanya aktivitas virus pada uji HA. Selanjutnya dilakukan ekstraksi RNA virus dan pengujian dengan rRT-PCR terhadap gen matriks (M) untuk meneguhkan jika virus yang terisolasi adalah virus ND.
Uji Haemaglutination (HA) metode mikro (OIE 2012)
Prosedur pengujian Haemaglutinasi dilakukan dengan cara: Larutan PBS sebanyak 25 µl dimasukkan ke dalam plat mikro berdasar V pada sumuran 2-12 dari kolom A sampai kolom E. Pada sumuran 1, kolom A sampai F, dimasukkan 50 µl suspensi virus. Pengenceran virus kelipatan dua dari sumuran 1 ke sumuran 2 (A - E). Pada sumur 2-B dilakukan pengenceran 1/3 kali dengan menambahkan 25 µl PBS, dihomogenkan dan dibuang sebanyak 25 µl. Pada sumur 2-C dilakukan pengenceran 1/5 kali dengan menghomogenkan dan membuang 75 µl PBS, sumur 2-D diencerkan 1/7 dengan menambahkan 127 µl PBS dan sumur 2-E diencerkan 1/9 kali dengan menambahkan 175 µl PBS. Selanjutnya dilakukan pengenceran kelipatan dua dari sumuran ke-2 sampai ke sumuran ke-12. Sel darah merah 1% sebanyak 25 µl dimasukkan ke setiap sumuran. Kemudian dilakukan shaker dengan hati-hati dan plat ditempatkan pada temperatur ruang (20–24 oC).
Hasil dapat dibaca setelah 30 menit. Hasil positif ditunjukkan dengan adanya aglutinasi dari sel darah merah pada dasar sumuran plat.
Uji Haemaglutination Inhibition (HI) metode mikro (OIE 2012)
21 buffer saline (PBS) dimasukkan 25 µl ke dalam tiap sumuran plat mikrotiter berdasar V. Kemudian 25 µl serum standar dimasukkan pada kolom sumuran pertama. Pengenceran kelipatan dua dilakukan dari sumuran pertama sampai sumuran ke-12. Lalu ditambahkan cairan alantoik yang mengandung virus 4 HAU ke setiap sumuran. Secara pelan digoyang dan plat ditempatkan pada suhu 4 oC
selama 60 menit. Suspensi sel darah merah 1 % ditambahkan sebanyak 25 µl ke semua sumuran dan digoyang secara perlahan dan ditempatkan pada suhu ruang. Plat dibaca setelah 30-60 menit, hasil positif dutunjukkan dengan terbentuknya tear drop pada saat plat dimiringkan.
Uji rRT-PCR dengan Primer Oligonucleotida (F)
Ekstraksi RNA dilakukan terhadap sampel cairan alantoik yang positif pada uji HA dan dikonfirmasi sebagai VND dengan di uji kembali pada rRT-PCR matriks. Pengujian pada gen fusion (gen F) untuk melihat virulensi VND menggunakan primer olligonukleotida untuk primer forward fusion F+ 4829 5’- GGT GAG TCT ATC CGG ARG ATA CAA G-3’ dan reverse fusion (M-4894) 5’ AGC TGT TGC AAC CCA AG-3’. Probe yang digunakan adalah M+4939 5’FAM AAG CGT TTC TGT CTC CTT CCT CCA [BHQ]-3’(CVL 2007)
Uji Elusi
Uji elusi dilakukan untuk melihat waktu yang diperlukan oleh tiap galur virus untuk melepaskan kembali ikatan eritrosit (waktu elusi) oleh enzim neuraminidase. Uji Elusi dilakukan dengan metode Ezeibe dan Ndip (2005), yaitu dengan memasukkan 50 µl PBS pada plat mikro dari sumuran 1 sampai 12. Kemudian sebanyak 50 µl VND dimasukkan pada sumuran pertama dan dihomogenkan sampai ke sumuran 12. Sebanyak 50 µl eritrosit ayam 0.6% dimasukkan ke tiap sumuran, digoyang perlahan dan ditempatkan pada suhu ruang. Penghitungan waktu elusi dimulai setelah reaksi aglutinasi terjadi dengan sempurna (30-40 menit, atau setelah eritrosit kontrol turun). Pengamatan waktu elusi dilakukan pada sumuran terakhir yang masih menunjukkan reaksi aglutinasi sampai virus melepaskan eritrosit yang ditunjukkan dengan turunnya eritrosit ‘tears drop’.
Analisis Data
22
4 HASIL DAN PEMBAHASAN
Deteksi dan Isolasi Virus Newcastle Disease.
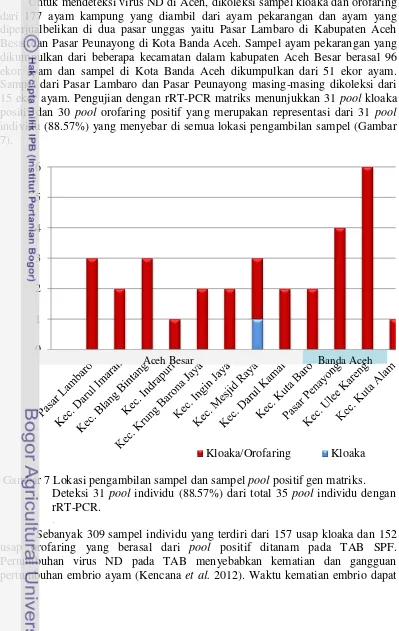
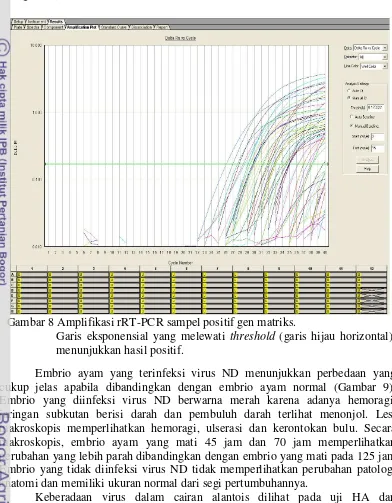
Untuk mendeteksi virus ND di Aceh, dikoleksi sampel kloaka dan orofaring dari 177 ayam kampung yang diambil dari ayam pekarangan dan ayam yang diperjualbelikan di dua pasar unggas yaitu Pasar Lambaro di Kabupaten Aceh Besar dan Pasar Peunayong di Kota Banda Aceh. Sampel ayam pekarangan yang dikumpulkan dari beberapa kecamatan dalam kabupaten Aceh Besar berasal 96 ekor ayam dan sampel di Kota Banda Aceh dikumpulkan dari 51 ekor ayam. Sampel dari Pasar Lambaro dan Pasar Peunayong masing-masing dikoleksi dari 15 ekor ayam. Pengujian dengan rRT-PCR matriks menunjukkan 31 pool kloaka positif dan 30 pool orofaring positif yang merupakan representasi dari 31 pool individu (88.57%) yang menyebar di semua lokasi pengambilan sampel (Gambar 7).
Sebanyak 309 sampel individu yang terdiri dari 157 usap kloaka dan 152 usap orofaring yang berasal dari pool positif ditanam pada TAB SPF. Pertumbuhan virus ND pada TAB menyebabkan kematian dan gangguan pertumbuhan embrio ayam (Kencana et al. 2012). Waktu kematian embrio dapat
Gambar 7 Lokasi pengambilan sampel dan sampel pool positif gen matriks. Deteksi 31 pool individu (88.57%) dari total 35 pool individu dengan rRT-PCR.
. 0 1 2 3 4 5 6
Kloaka/Orofaring Kloaka
23 menjadi acuan dalam menentukan virulensi virus pada uji Mean death time (MDT); virus yang mampu mematikan embrio dalam waktu < 60 jam setelah inokulasi digolongkan ke dalam galur velogenik, jika kematian embrio terjadi antara 60-90 jam maka virus tersebut termasuk ke dalam galur mesogenik dan virus yang mematikan embrio dalam waktu > 90 jam termasuk dalam galur lentogenik (Cattoli et al. 2011).
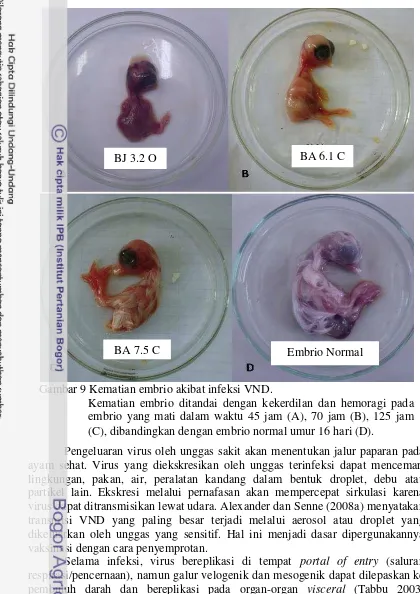
Embrio ayam yang terinfeksi virus ND menunjukkan perbedaan yang cukup jelas apabila dibandingkan dengan embrio ayam normal (Gambar 9). Embrio yang diinfeksi virus ND berwarna merah karena adanya hemoragi, jaringan subkutan berisi darah dan pembuluh darah terlihat menonjol. Lesi makroskopis memperlihatkan hemoragi, ulserasi dan kerontokan bulu. Secara makroskopis, embrio ayam yang mati 45 jam dan 70 jam memperlihatkan perubahan yang lebih parah dibandingkan dengan embrio yang mati pada 125 jam. Embrio yang tidak diinfeksi virus ND tidak memperlihatkan perubahan patologi anatomi dan memiliki ukuran normal dari segi pertumbuhannya.
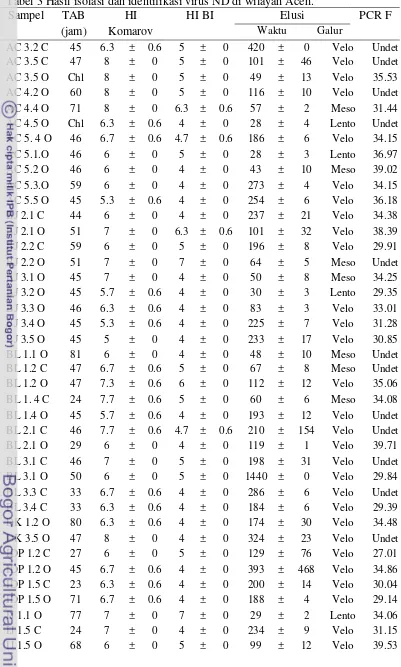
Keberadaan virus dalam cairan alantois dilihat pada uji HA dan dikonfirmasi dengan rRT-PCR matriks. Dari hasil isolasi diperoleh 69 isolat VND yang berasal dari 51 ekor ayam (Tabel 3). Sebanyak 23 ekor ayam (45.09%) mengeluarkan virus melalui orofaring, 10 ekor (19.61%) mengeluarkan virus melalui kloaka dan 36 isolat dikeluarkan oleh 18 ekor ayam (25.39%) melalui kloaka dan orofaring.
Gambar 8 Amplifikasi rRT-PCR sampel positif gen matriks.
24
Pengeluaran virus oleh unggas sakit akan menentukan jalur paparan pada ayam sehat. Virus yang diekskresikan oleh unggas terinfeksi dapat mencemari lingkungan, pakan, air, peralatan kandang dalam bentuk droplet, debu atau partikel lain. Ekskresi melalui pernafasan akan mempercepat sirkulasi karena virus dapat ditransmisikan lewat udara. Alexander dan Senne (2008a) menyatakan transmisi VND yang paling besar terjadi melalui aerosol atau droplet yang dikeluarkan oleh unggas yang sensitif. Hal ini menjadi dasar dipergunakannya vaksinasi dengan cara penyemprotan.
Selama infeksi, virus bereplikasi di tempat portal of entry (saluran respirasi/pencernaan), namun galur velogenik dan mesogenik dapat dilepaskan ke pembuluh darah dan bereplikasi pada organ-organ visceral (Tabbu 2003; Alexander dan Senne 2008a). Infeksi galur velogenik menyebabkan lesi pada otak, hemoragi dan nekrosis saluran intestinal, respirasi dan seka tonsil. Hemoragi juga dapat ditemukan pada tembolok, jantung, kulit, dan kelopak mata dan kerusakan organ limpoid dan hiperplasia pada hati. Organ terinfeksi dapat digunakan untuk mengisolasi virus tetapi intestinal dan orofaring merupakan organ yang paling banyak mengandung virus (Cattoli et al. 2011; Hines dan Miller 2012).
Gambar 9 Kematian embrio akibat infeksi VND.
Kematian embrio ditandai dengan kekerdilan dan hemoragi pada embrio yang mati dalam waktu 45 jam (A), 70 jam (B), 125 jam (C), dibandingkan dengan embrio normal umur 16 hari (D).
BA 7.5 C
BJ 3.2 O BA 6.1 C
25
26
IJ 2.5 O 80 7 ± 0 5.7 ± 0.6 66 ± 12 Meso Undet
KB 1. 1 O 47 7.3 ± 0.6 4 ± 0 92 ± 2 Velo 31.81
KB 1. 2 O 51 7.3 ± 0.6 4 ± 0 138 ± 66 Velo 32.15
KB 1.2 C 46 5.7 ± 0.6 4 ± 0 208 ± 7 Velo 23.75
KB 1.4 O 70 6.7 ± 0.6 4 ± 0 191 ± 1 Velo 34.57
KB 1.5 O 51 6.7 ± 0.6 4 ± 0 213 ± 80 Velo 29.1
KTP 2.1 C 47 6.7 ± 0.6 4.7 ± 0.6 1440 ± 5 Velo 35.53
KTP 2.1 O 46 5.7 ± 0.6 4.7 ± 0.6 159 ± 32 Velo 32.97
KTP 2.5 C 46 7.7 ± 0.6 7 ± 0 99 ± 41 Velo Undet
KTP 2.5 O 30 5.7 ± 0.6 4 ± 0 164 ± 29 Velo 34.91
MR 1.1 C 21 6 ± 0 4 ± 0 244 ± 16 Velo 37.86
MR 1.1 O 71 6 ± 0 4 ± 0 133 ± 2 Velo 34.07
BA 6.1.C 70 7.7 ± 0.6 6 ± 0 125 ± 26 Velo 36.72
BA 7.5 C Chl 8.7 ± 0.6 6 ± 0 137 ± 3 Velo 34.35
SGL 1.2 O 42 5 ± 0 4 ± 0 43 ± 9 Meso 27.6
SGL 1.4 O 42 6 ± 0 4 ± 0 51 ± 9 Meso 32.49
UK 2.1 C Chl 7 ± 0 6.3 ± 0.6 48 ± 4 Meso 37.9
UK 2.1 O 84 8.7 ± 0.6 6 ± 0 72 ± 3 Velo Undet
UK 2.6 C 71 9.3 ± 0.6 4 ± 0 85 ± 7 Velo Undet
UK 4.3 C 28 7.7 ± 0.6 4 ± 0 287 ± 12 Velo Undet
UK 4.3 O 29 9 ± 0 7 ± 0 67 ± 12 Meso 34.96
UK 4.4 C 97 6.7 ± 0.6 7 ± 0 31 ± 1 Lento Undet
UK 5.1 C 23 7.7 ± 0.6 4 ± 0 209 ± 5 Velo 36.22
UK 5.1 O 45 6 ± 0 4 ± 0 95 ± 6 Velo 30.38
UK 5.2 C 27 5.7 ± 0.6 4 ± 0 193 ± 3 Velo 32.8
UK 5.2 O 44 6 ± 0 4.7 ± 0.6 194 ± 6 Velo 36.89
KA 1.3 C 22 7 ± 0 4 ± 0 190 ± 0 Velo 29.75
KA 1.4 C 31 7 ± 0 4.7 ± 0.6 360 ± 0 Velo 32.79
KA 1.4 O 43 5.3 ± 0.6 4 ± 0 265 ± 50 Velo 29.72
Keragaman Antigenik Virus Newcastle Disease
27
Uji HI dengan serum B1 memberikan variasi titer antibodi mencapai 3 log (4 Log2 sampai 7 Log2) sedangkan pada serum Komarov menunjukkan perbedaan yang lebih tinggi, yaitu 4 log (5 Log2 sampai 9 Log2). Tiga puluh delapan isolat yang memiliki reaksi homolog pada pengujian dengan serum B1, ternyata memberikan reaksi yang beragam pada saat di uji dengan serum Komarov. Dari hasil uji HI diketahui 95.65% isolat memiliki reaksi yang lebih tinggi terhadap serum Komarov yang mengindikasikan kecendrungan isolat
Gambar 10 Uji HI isolat terisolasi menggunakan serum Komarov dan B1. Titer antibodi terhadap berbagai isolat VND bervariasi dan mencapai 5 Log (A) dan 4 Log (B). Variasi afinitas serum referensi terhadap virus yang di uji (C).
A B
C