DIPANEN PADA WAKTU BERBEDA
HERDITYO HARYO PUTRO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
HERDITYO HARYO PUTRO. Profil Metabolit Volatil Rimpang Jahe Merah
(
var. Rubrum) yang Dipanen pada Waktu Berbeda. Dibimbing
oleh EDY DJAUHARI PURWAKUSUMAH dan MOHAMAD RAFI.
ABSTRACT
HERDITYO HARYO PUTRO. Volatile Metabolite Profiling of Red Ginger
(
Var. Rubrum) Rhizome with Different Harvesting Time.
Under the direction of EDY DJAUHARI PURWAKUSUMAH and MOHAMAD
RAFI.
PROFIL METABOLIT VOLATIL RIMPANG JAHE
MERAH (
var. Rubrum) YANG
DIPANEN PADA WAKTU BERBEDA
HERDITYO HARYO PUTRO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokima
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
,
-.
/ 0
,
1
/
/ /-
/
.
2
-/ $
2
-
/ 2
/ 3
.
!
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karuniaNya yang telah diberikan, sehingga skripsi ini berhasil diselesaikan. Tema
yang penulis pilih adalah mengenai profil minyak atsiri jahe merah (
) dengan menggunakan instrumen GC/MS, serta melihat
salah satu aktivitas biologis dari minyak atsiri tersebut, yaitu aktivitas
antioksidannya. Penelitian ini dilakukan selama kurang lebih 4 bulan dan
dilaksanakan di Pusat Studi Biofarmaka (PSB), Bogor, Jawa Barat, di Balai Besar
Pengembangan Budidaya Air Tawar (BBPBAT), Sukabumi, Jawa Barat dan di
Pusat Laboratorium Forensik (PUSLABFOR), Jakarta Selatan, DKI Jakarta.
Terima kasih penulis ucapkan kepada Drs. Edy Djauhari Purwakusumah
M.Si sebagai pembimbing utama, Mohamad Rafi S.Si.,M.Si sebagai pembimbing
kedua dalam penelitian ini serta tidak lupa kami ucapkan terima kasih kepada
Herry S.Si, M.Si.. Terima kasih penulis ucapkan juga kepada bapak dan ibuku
tercinta, Staf laboratorium, laboran dan teman5teman yang telah memberi
masukan dan semangatnya dalam laporan penelitian ini. Terima kasih atas doa dan
dukungannya. Semoga karya ilmiah ini dapat diterima dan bermanfaat.
RIWAYAT HIDUP
Penulis dilahirkan di Rumah Sakit Bersalin Asih, Kebayoran Baru, Jakarta
Selatan, DKI Jakarta pada tanggal 28 Maret 1988 dengan nama lengkap Herdityo
Haryo Putro. Penulis berayahkan Haryo Trenggono dan Ibu Yusi Herniana
Wandaningrum. Penulis merupakan anak pertama dari dua bersaudara. Penulis
masuk ke Institut Pertanian Bogor (IPB) pada tahun 2006 melalui jalur Seleksi
Penerimaan Mahasiswa Baru (SPMB) setelah sebelumnya mengenyam
pendidikan di SMA Labschool Kebayoran. Di IPB, penulis mengambil jurusan
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Jahe Merah (
var. Rubrum) ... 2
Minyak Atsiri Jahe Merah ... 2
... 3
Profil Metabolit ... 4
Radikal Bebas... 5
Antioksidan ... 5
BAHAN DAN METODE
Bahan dan Alat ... 6
Metode ... 6
HASIL DAN PEMBAHASAN
Pemanenan Rimpang Jahe Merah ... 7
Destilat Rimpang Jahe Merah ... 8
Profil Kromatogram Minyak Atsiri Jahe Merah ... 8
Perbedaan Profil Kromatogram α5Zingiberen pada Waktu Panen Berbeda 9
Pengaruh Gen pada Metabolisme α5Zingiberen ... 11
Aktivitas Antioksidan ... 11
SIMPULAN DAN SARAN
Simpulan ... 11
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
Halaman
1 Rimpang jahe merah ... 2
2 Instrumen GC/MS ... 4
3 Skema destilasi Stahl ... 7
4 Persentase kadar air dan rendemen rimpang jahe merah ... 8
5 Profil α5zingiberen pada kromatogram jahe merah panen pagi dan sore ... 10
6
!
sintesis seskuiterpen (Sallaud
. 2009) ... 11
7 Kurva % inhibisi vs konsentrasi jahe panen pagi, sore, dan vitamin C ... 11
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 17
2 Senyawa total kromatogram GCMS dan contoh perhitungan
t5test .. 18
3 Perhitungan koreksi kadar air dan uji5t pada rendemen minyak atsiri ... 21
4 Proses penentuan aktivitas antioksidan dengan
... 22
PENDAHULUAN
Pencarian akan kecantikan dan kesehatan telah menjadi obesesi manusia semenjak dulu. Berbagai macam ramuan, terapi, dan pengobatan dipercaya dapat mempertahankan atau meningkatkan kecantikan dan kesehatan seseorang. Berdirinya pusat kecantikan, seperti salon dan spa, telah menjadi bagian dari pencarian tersebut. Keberadaan pusat kecantikan tersebut merupakan suatu usaha infusi dari usaha manusia untuk tetap cantik dan sehat. Tren bisnis kecantikan sedang berkembang cukup pesat dalam dua dekade terakhir (Spivack 1998). Beberapa pusat kecantikan memiliki tren menggabungkan cara dan pengobatan tradisional dengan alat5 alat modern (Patin 2009).
Salah satu tehnik pengobatan yang lazim digunakan oleh pusat kecantikan tersebut adalah aromaterapi (Cooke & Ernst 2000). Aromaterapi adalah penggunaan konsentrat minyak atsiri yang diekstrak dari bagian tumbuhan untuk kebutuhan terapi melawan atau mencegah terjadinya penyakit (Cooke & Ernst 2000; Buckle 2001; Halm 2008). Awal penggunaan aromaterapi di kawasan Timur Tengah dan India sebatas untuk menghasilkan aroma yang menyenangkan. Aroma tersebut disinyalir dapat memberikan suasana kondusif bagi penyembuhan (Cooke & Ernst 2000). Salon dan pada umumnya menggabungkan aromaterapi dengan seni pijat. Hal tersebut diyakini dapat membantu menghilangkan stress, menyehatkan kulit, bahkan menyembuhkan diabetes (Buckle 2001). Minyak atsiri jahe merupakan salah satu bagian dari pengobatan aromaterapi (Geiger 2005). Minyak atsiri ini biasanya digunakan bersama campuran minyak atsiri lainnya untuk keperluan pijat, yoga, dan spa (Patin 2009).
Sampai saat ini jahe masih dianggap sebagai obat universal oleh pengobatan India dan Cina. Jahe masih menjadi komponen penting dari sekitar 50% obat5obatan herbal (Arnaudon 2002). Tumbuhan ini dipercaya memiliki khasiat sebagai obat antiinflamasi, nyeri sendi, nyeri otot, tonikum, obat batuk, dan antioksidan (Ravindran & Babu 2005; Sari 2006; Stoilova 2007). Minyak atsiri dari jahe merupakan komponen yang volatil atau mudah menguap sehingga cocok digunakan untuk aromaterapi. Minyak atsiri jahe umumnya digunakan bersama dengan campuran minyak atsiri lainnya karena minyak atsiri jahe dipercaya dapat meningkatkan khasiat obat. Minyak
atsiri jahe dikenal memiliki kemampuan sebagai afrodisiak, menambah nafsu makan dan mengobati flu. Briceno (2007) mengemukakan bahwa aromaterapi pada lalat buah dapat meningkatkan frekuensi seksnya. Penelitian terbaru juga menunjukkan beberapa jenis jahe memiliki kemampuan antioksidan dalam komponen minyak atsirinya (Bua5in & Paisooksantivatana 2009).
Dalam produksi senyawa pada tumbuhan, waktu disinyalir memiliki peran penting. Loivamaki (2007) mengungkapkan bahwa produksi senyawa isopentenil pirofosfat (IPP) pada tumbuhan . dipengaruhi oleh jam biologis yang terpengaruh oleh adanya cahaya matahari sehingga tumbuhan . yang mendapat paparan sinar matahari lebih lama akan menghasilkan senyawa IPP yang lebih banyak. Beberapa turunan dari senyawa IPP merupakan penyusun dari berbagai komponen dalam minyak atsiri jahe. Hal tersebut mengindikasikan adanya kemungkinan perbedaan volume minyak atsiri, komposisi, dan profil senyawa kimia minyak atsiri jahe pada waktu pemanenan berbeda, misalnya pagi dan sore, yang nantinya dapat mempengaruhi karakteristik aktivitas antioksidan minyak atsiri tersebut.
5 "
(GCMS) dapat dipergunakan untuk mengetahui profil minyak atsiri. Penggunaan GCMS ini tepat digunakan pada minyak atsiri karena karakter minyak ini yang volatil. Penggunaan GCMS sebagai alat untuk analisis sidik jari atau profil minyak atsiri jahe menunjukkan hasil menjanjikan (Mahdi 2010). Hasil profil GCMS tersebut akan dibandingkan dengan aktivitas antioksidannya sehingga dapat diperoleh informasi mengenai korelasi keduanya.
tumbuhan jahe yang menerima paparan sinar matahari lebih lama. Profil kromatogram tersebut dapat mempengaruhi aktivitas antioksidan dari jahe merah tersebut. Penelitian ini bermanfaat dalam memberikan informasi mengenai korelasi antara pola dari profil kromatogram dengan aktivitas antioksidan minyak atsiri dari jahe merah pada waktu pemanenan berbeda.
TINJAUAN PUSTAKA
Jahe Merah ( var
Rubrum)
Jahe merupakan spesies tumbuhan dengan klasifikasi : kingdom Plantea, subkingdom Tracheobionta, divisi Spermatophyta, subdivisi Angiospermae, kelas Monokotyledonae, sub kelas Commenlinidae, bangsa Zingiberales, suku Zingiberaceae, marga Zingiber, dan spesies
(Muhlisah 1999, Duke 2002). Setiap jenis jahe memiliki perbedaan fungsi yang sesuai dengan karakteristik masing5masing varietas. Jahe besar/gajah lebih banyak digunakan untuk produk makanan dan minuman. Jahe kecil atau emprit banyak digunakan sebagai penyedap rasa makanan dan juga digunakan sebagai bahan baku obat karena kandungan senyawa kimianya yang lebih pekat (Herlina 2002). Bagian jahe yang banyak digunakan adalah rimpangnya yang berumur antara 9 sampai 11 bulan (Koeswara 1995).
Jahe merah (
Rubrum) atau jahe emprit memiliki aroma yang kuat dan rasa yang lebih pedas daripada jahe lainnya. Rimpang jahe merah (Gambar 1) memiliki penampilan fisik yang relatif lebih kecil dibandingkan jenis jahe lainnya (Sari
2006). Pada umumnya, tumbuhan ini tumbuh dengan ketinggian batang 30–60 cm tapi dapat juga mencapai 1,25 meter. Jahe emprit tumbuh tinggi dengan batang semu, tumbuh tegak, dan tidak bercabang. Tumbuhan ini merupakan tanaman monokotil dengan ciri daun tunggal, berbentuk lanset dan berujung runcing (Guzman & Siemonsma 1999). Tumbuhan ini memiliki mahkota bunga yang berwarna merah sampai merah jambu, berbentuk corong dengan panjang 2 – 2.5 cm. Tanaman ini mempunyai buah yang berbentuk bulat panjang berwarna cokelat dengan biji berwarna hitam (Ravindran & Babu 2005).
Jahe merah seperti jahe lainnya diyakini mempunyai efek melancarkan sirkulasi darah, antireumatik, antiradang, antimuntah, peluruh
Gambar 1 Rimpang jahe merah keringat, peluruh dahak ( # ), antibatuk ( ) (Wijayakusuma 2006). Jahe merah juga memiliki khasiat analgesik dan antiinflamasi yang baik dengan cara menghambat biosintesis prostalglandin (Sidik 1997). Han (2005) menyebutkan bahwa senyawa aktif pada jahe dapat digunakan sebagai obat antiobesitas. Senyawa metabolit sekunder jahe juga diketahui dapat menghambat pertumbuhan mikroorganisme patogen yang merugikan kehidupan manusia (Nursal 2006).
Beberapa senyawa dalam jahe yang dianggap potensial sebagai obat yaitu gingerol, zingeron, dan dehidrozingeron. Gingerol pada jahe memiliki aktivitas antiproliferasi, antioksidan, dan memberi efek pada proses apoptosis (Harliansyah 2007). Gingerol yang terdapat dalam ekstrak diklorometana jahe juga terbukti mampu menangkap radikal 1, 15difenil 25pikrilhidrazil (DPPH) (Matsuda 2004). Senyawa zingeron dan dehidrozingeron memiliki aktivitas antioksidasi dan menghambat tirosinase (Kuo 2005). Berbagai komponen bioaktif lain dalam ekstrak jahe seperti shogaol, diarilheptanoid dan curcumin mempunyai aktivitas antioksidan yang melebihi tokoferol (Kikuzaki & Nakatani 1993). Ekstrak jahe juga dapat melindungi sel limfosit tikus maupun manusia dari kerusakan oksidatif (Khadem5Ansari 2008).
Minyak Atsiri Jahe Merah
karena memiliki titik uap yang rendah. Hal tersebut menjadikan minyak atsiri termasuk kedalam golongan volatil (mudah menguap). Secara kimiawi, minyak atsiri tersusun atas campuran dari berbagai macam senyawa kimia. Mayoritas senyawa kimia tersebut merupakan golongan senyawa organik terpena dan terpenoid (Vernin & Parkanyi 2005). Secara fitokimia, kandungan jahe merah umunya dibagi atas komponen volatil dan non5volatil. Komponen volatil ini biasanya dikaitkan dengan minyak atsiri, sedangkan komponen non5volatil dikaitkan dengan oleoresin. Jahe ini memiliki kandungan minyak atsiri yang volatil sebesar 153% (Rukmana 2000, Sari 2006). Menurut Nurliana (2008) kandungan minyak atsiri pada jahe umumnya didominasi oleh senyawa citral pada jahe merah dengan umur 8 bulan ke atas, sedangkan pada umur di bawah 8 bulan minyak atsiri jahe merah didominasi oleh senyawa geranil asetat. Minyak atsiri jahe merah juga mengandung zingiberin, β5sesquihelladrin, bisabolin, kurkumin, cineol, dan citral (Pino 2004). Kandungan senyawa kimia non5volatil dalam jahe merah didominasi oleh gingerol dan shogaol (Vernin & Parkanyi 2005).
Gas Chromatography/Mass Spectroscopy
"
(GCMS) merupakan gabungan dari dua jenis instrumen, yaitu kromatografi gas dan spektroskopi massa. Kombinasi kedua alat ini biasanya digunakan untuk identifikasi dan kuantifikasi dari senyawa organik volatil atau semi volatil dalam campuran yang kompleks (Gohlke & McLafferty 1993; Kitson 1996; Hites 1997). Kromatografi gas atau
(GC) memberikan kemampuan untuk separasi senyawa volatil dan semi volatil dengan resolusi yang tinggi (Fowlin 1995). Spektroskopi massa (MS) di lain pihak memberikan kemampuan untuk mengidentifikasikan dan memberikan informasi mengenai struktur senyawa (Kitson
1996; Hites 1997).
Kromatografi gas adalah teknik kromatografi yang bisa digunakan untuk memisahkan senyawa organik yang mudah menguap. Kromatografi gas pada prinsipnya sama dengan kromatografi kolom, HPLC, dan TLC (Fowlin 1995). Instrumen ini menggunakan kolom seperti kromatografi kolom dan HPLC, serta umumnya menggunakan mikroinjeksi seperti HPLC sehingga hanya dibutuhkan sedikit sampel
untuk analisis. Perbedaan utama GC dengan instrument kromatografi lainnya adalah adanya oven pengatur suhu (Fowlin 1995). Pengaturan suhu tersebut memungkinkan GC untuk memisahkan komponen dari campuran berdasarkan titik didih (atau tekanan uap) sehingga mirip dengan prinsip penyulingan. Senyawa5senyawa yang dapat ditetapkan dengan kromatografi gas sangat banyak, namun ada batasan yang dapat ditentukan oleh instrument ini. Senyawa5senyawa tersebut harus mudah menguap dan stabil pada temperatur pengujian, utamanya dari 50 – 300°C (Fowlin 1995). Senyawa yang tidak mudah menguap atau tidak stabil pada temperatur pengujian, dapat diproses secara derivatisasi menjadi komponen yang volatil agar dapat dianalisis dengan kromatografi gas (Fowlin 1995; Kitson 1996).
Kromatografi gas menggunakan fase gerak atau berupa gas. Umumnya gas yang digunakan merupakan gas murni seperti helium yang tidak reaktif, akan tetapi gas hidrogen dan nitrogen juga terkadang dapat digunakan (Kitson 1996). Fase diam atau pada instrumen ini merupakan bagian permukaan, dapat berupa lapisan cair atau polimer, yang dapat mendukung sirkulasi gas murni di dalamnya. Fase diam ini dapat bekerja menjerap senyawa5senyawa yang diinginkan karena molekul dapat berkondensasi pada fase diam, molekul larut pada fase diam, atau molekul tetap menjadi gas (Fowlin 1995; Kitson 1996). Fase diam umumnya ditunjang pada permukaan tanah diatom (tanah/batu yang sangat berpori) dan dibungkus oleh tabung kaca atau logam. Komponen tersebut lazim disebut kolom (Kitson 1996; Hites 1997). Kolom ini merupakan ”jantung” atau pusat dari GC karena pada bagian kolom ini pemisahan terjadi (Fowlin 1995).
Penafsiran hasil dari GC ditentukan melalui waktu retensi. Waktu retensi merupakan waktu yang digunakan oleh senyawa tertentu untuk bergerak melalui kolom sampai ke detektor (Fowlin 1995). Waktu ini diukur berdasarkan waktu dari saat sampel diinjeksikan pada titik dimana tampilan menunjukkan tinggi puncak maksimum untuk senyawa itu. Setiap senyawa memiliki waktu retensi yang berbeda.
mempengaruhi waktu retensi karena senyawa yang mendidih pada temperatur yang lebih tinggi daripada temperatur kolom akan menghabiskan hampir seluruh waktunya untuk berkondensasi sebagai cairan pada awal kolom sehingga titik didih yang tinggi akan memiliki waktu retensi yang lama. Kelarutan dalam fase diam berpengaruh waktu retensi karena senyawa yang lebih mudah larut dalam fase diam akan mempunyai waktu yang lebih singkat untuk dibawa oleh gas pembawa sehingga senyawa dengan kelarutan yang tinggi dalam fase diam memiliki waktu retensi yang lama. Terakhir, temperatur kolom mempengaruhi waktu retensi dikarenakan oleh pergerakan molekul meningkat sejalan dengan peningkatan suhu kolom dalam fase gas. Hal ini akan mempersingkat waktu retensi bagi seluruh sampel yang diinjeksikan (Fowlin 1995).
Waktu retensi ini akan kemudian menjadi puncak atau $ pada kromatogram. Kromatogram terdiri dari aksis waktu dan ordinat kelimpahan (Kitson 1996). Penafsiran hasil kemudian dilanjutkan setelah kromatogram didapatkan.
Spektroskopi massa adalah suatu instrument yang dapat menyeleksi molekul5 molekul gas bermuatan berdasarkan massa atau beratnya. Teknik ini tidak mencerminkan metode spekstroskopi pada umumnya. Pemilihan nama spektroskopi disebabkan oleh persamaan fungsinya dalam mencatat berkas sinar dan spektrum garis optik (Kitson 1996). Spektrum massa diperoleh dengan mengubah senyawa suatu sampel menjadi ion5 ion yang bergerak cepat yang kemudian dipisahkan berdasarkan perbandingan massa terhadap muatan (Kitson 1996).
Spektrometer massa dapat digunakan sendiri atau ditandemkan dengan instrument lainnya, seperti GC. Spektrometer massa sendiri dapat digunakan untuk analisis kuantitatif suatu campuran senyawa5senyawa yang dekat hubungannya (Kitson 1996). Analisis dengan instrumen ini juga dapat dipergunakan untuk menganalisis senyawa campuran, baik senyawa organik ataupun anorganik yang bertekanan uap rendah. Instrumen ini akan menghasilkan berkas ion dari suatu zat uji. Berkas tersebut kemudian dipilah dan dikelompokkan menjadi spektum5spektrum yang akan sesuai dengan perbandingan massa terhadap muatan serta merekam kelimpahan relatif tiap jenis ion yang ada. Secara umum, hanya ion positif yang dapat dipelajari karena ion negatif yang
Gambar 2 Instrumen GCMS dihasilkan dari sumber tumbukan umumnya kecil sehingga dapat diabaikan (Kitson 1996).
Beberapa instrumen menunjang kerja sistem GCMS (Gambar 2) sehingga dapat digunakan secara tandem. Pertama adalah interfase GCMS yang merupakan suatu alat yang dapat mentransport eluen dari GC ke MS. Alat ini menjaga agar eluen tidak terkondensasi atau terdekomposisi dalam perjalanannya ke MS. Kedua, merupakan detektor. Kehadiran detektor ini akan memberikan hasil final dari keseluruhan proses injeksi ke GCMS. Detektor yang umum digunakan adalah detektor %
atau " &
(MSD) (Kitson 1996). Terakhir, adanya metode pengionan. Metode pengionan ini umumnya dilakukan dengan '
atau pengionan secara kimiawi (Kitson 1996).
Profil Metabolit
Membandingkan profil metabolit merupakan bagian dari analisis metabolisme yang berusaha untuk memperoleh profil dari hasil metabolisme suatu sel atau jaringan. Profil metabolit merupakan bagian penting dari kajian metabolomik dan metabonomik. Pemrofilan biasanya dilakukan pada cairan tubuh seperti darah, urin, dan air liur. Pembuatan profil metabolit umumnya ditunjang oleh instrumen spektrofotometer massa atau oleh (
(NMR) (Harrigan & Goodacre 2003). Konsep mengenai adanya profil metabolik dari tiap individu pertama kali diperkenalkan oleh Roger Williams pada akhir 1940an. Williams merupakan perintis dalam penggunaan kromatografi kertas pada urin dan air liur individu normal dengan penderita
Data yang diperoleh saat itu masih merupakan data kualitatif (Gates & Sweeley 1978). Baru pada awal 1970, data kuantitatif profil metabolit diperoleh. Greef dan Smilde (2005) menyatakan bahwa istilah pemrofilan metabolit pertama kali digunakan pada 1971 oleh Horning dan rekannya untuk melaporkan keberhasilannya dalam menggunakan GCMS untuk memperoleh profil data kuantitatif metabolit dari urin dan jaringan tubuh manusia.
Penggunaan profil metabolit saat ini digunakan diberbagai bidang. Bidang ilmu toksikologi dapat mengaplikasikan profil metabolit untuk mendeteksi perubahan fisiologis, dengan melihat profil metabolitnya, karena masuknya toksin atau senyawa kimia ke dalam tubuh (Robertson 2005). Bidang ilmu genomik fungsional juga menggunakan profil metabolomik. Profil metabolit digunakan sebagai alat pembanding untuk melihat perubahan fenotip yang disebabkan oleh manipulasi gen. Hal ini biasa dilakukan untuk mendeteksi perubahan metabolisme pada tanaman yang telah dimodifikasi secara genetik (Saghatelian . 2004).
Radikal Bebas
Pentingnya antioksidan dalam diet manusia dikarenakan ancaman radikal bebas. Radikal bebas merupakan molekul yang kehilangan elektron sehingga molekul tersebut menjadi tidak stabil dan sangat reaktif. Kondisi tersebut mengakibatkan molekul ini dapat mengambil elektron dari molekul lainnya (Seis 1997). Radikal bebas sesungguhnya dibutuhkan oleh tubuh untuk metabolisme (Jain 2008). Proses metabolisme beberapa biomolekul seperti lipid dan protein dapat menghasilkan radikal bebas (Seis 1997). Radikal bebas yang dihasilkan dapat berupa ion hidroksil, hidrogen peroksida, superoksida, dan lain sebagainya (Seis 1997). Selain karena proses metabolisme tubuh, radikal bebas juga dapat berasal dari luar tubuh karena polusi, pemaparan sinar ultra violet (UV), dan bahan aditif makanan.
Mekanisme pembentukan radikal bebas secara umum dibagi menjadi 3 tahapan. Tahap pertama adalah tahap inisiasi atau tahap pembentukan awal radikal bebas yang terjadi karena molekul stabil terpapar oleh molekul yang reaktif seperti radikal hidroksil. Kedua, tahap propagasi atau tahap terjadinya reaksi berantai yang menyebabkan terbentuknya radikal5radikal bebas lainnya oleh karena
molekul yang terinisiasi tadi. Tahap terakhir adalah terminasi. Pada tahap ini terjadi penggabungan dua radikal bebas sehingga terbentuk molekul yang stabil dan tidak reaktif (Sunarti 2008). Mekanisme reaksinya sebagai berikut:
Inisiasi:
RH + OH ———> H2O + R* Propagasi:
R* + O2 ——> ROO* + RH — —> ROOH + R*
Terminasi:
ROO* + ROO* ——> ROOR + O2 ROO* + R* ——> ROOR R* + R* ——> RR
Antioksidan
Antioksidan diartikan sebagai zat yang dapat menghambat / memperlambat proses oksidasi (Seis 1997; Suhartono 2005). Antioksidan bekerja secara kimia dengan menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga proses oksidasi dapat diredam (Seis 1997). Antioksidan tersebut dapat diperoleh dari makanan secara alami atau melalui suplemen antioksidan buatan (sintetik) (Dalimartha & Soedibyo 1999). Secara alami, antioksidan dapat diperoleh dari berbagai rempah5rempah, buah5buahan, dan sayur (Subramaniam 2003).
Tubuh manusia juga membentuk antioksidan. Antioksidan ini sering disebut antioksidan endogen. Antioksidan ini terdapat dalam bentuk enzim, bilirubin, senyawa5 senyawa tiol, NADH dan NADPH, asam urat, dan ubikuinon (Percival 1998). Antioksidan tubuh ini perlu ditunjang oleh asupan mikronutrien berupa selenium, zink, mangan, besi dan mineral kelumit lainnya untuk bekerja secara optimum. Beberapa penelitian sebelumnya, menunjukkan kemampuan tubuh berkurang dalam menyerap mikronutrien seiring dengan proses penuaan (Percival 1998). Hal ini menunjukkan ketergantungan manusia yang tinggi terhadap asupan antioksidan eksogen pada usia lanjut.
Antioksidan sintetis dapat juga digunakan untuk menangkal radikal bebas. Beberapa contoh antioksidan sintetik adalah
# (BHT),
# (BHA), dan *
# % (TBHQ) (Rohman & Riyanto 2005). Senyawa BHA dan BHT dianggap sangat efektif dalam menghambat radikal bebas (Komayaharti & Paryanti 2009). Rohman & Riyanto (2005) menyatakan bahwa keefektifan tersebut diikuti oleh meningkatnya karsinogenitas. Resiko yang harus ditanggung dengan penggunaan antioksidan sintetis membuat masyarakat beralih ke antioksidan alami (Rohman & Riyanto 2005; Komayaharti & Paryanti 2009). Terdapat beberapa metode untuk pengujian aktivitas antioksidan. Secara umum uji aktivitas antioksidan secara atau diluar sel dibagi menjadi dua, yaitu dengan assay kimia atau * (Honsel 2008). Pengujian dengan assay kimia dapat dilakukan hanya dengan mereaksikan substrat dengan assay, sedangkan pengujian dengan
* memerlukan tambahan sel kedalam campuran assay dan substrat. Pengujian dengan * lebih relevan secara biologis dibandingkan pengujian dengan assay kimia saja (Honsel 2008). Contoh metode * untuk penentuan aktivitas antioksidan adalah metode CAP5e dan ROS PMN (Honsel 2008).
Pengujian dengan menggunakan DPPH (1,1 Diphenyl525picrylhidrazyl) termasuk pengujian dengan assay kimia. Metode DPPH merupakan metode yang sederhana dan dapat memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal stabil. Metode uji ini memberikan serapan kuat pada panjang gelombang 518 nm menurut Stoilova (2007) atau pada 517 nm menurut Veeru (2009). Penangkap radikal bebas
menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil (Kuncahyo & Sunardi 2007).
BAHAN DAN METODE
Bahan dan Alat
Bahan5bahan yang digunakan adalah rimpang jahe merah segar dengan waktu pemanenan pagi hari, jahe merah segar dengan waktu pemanenan sore hari metanol, etanol 96%, serbuk DPPH, vitamin C (asam askorbat), DMSO, dan akuades.
Alat5alat yang dignakan di antaranya peralatan gelas, pipet Mohr, pipet volumetrik, pipet mikro, pisau, labu erlemeyer, neraca analitik, destilator, kertas saring Whatman
No.45, , , GCMS.
Perangkat lunak yang digunakan adalah Microsoft Excel.
Metode
Penelitian ini diawali dengan preparasi bahan baku dan proses destilasi untuk mendapatkan minyak atsirinya. Kemudian minyak atsiri dianalisis dengan perangkat GC MS dan diuji aktivitas antioksidannya (Lampiran 1).
Preparasi Bahan Baku
Rimpang jahe merah dengan waktu pemanenan pagi dan sore disiapkan. Setelah itu, rimpang dikupas lalu dicuci hingga bersih kemudian diiris dengan ketebalan ± 456 mm. Sebanyak 1005200 g jahe merah segar yang telah diiris kemudian ditumbuk secara kasar. Sampel dari kedua cara pemanenan langsung didestilasi dengan menggunakan metode hidrodestilasi.
Destilasi Minyak Atsiri Jahe
jam (Azlina 2005). Hasil destilasi kemudian disaring dengan kertas saring. Sampel kemudian di pisahkan menjadi dua bagian, yaitu sampel rimpang jahe merah panen pagi dan sampel rimpang jahe merah panen sore. Masing5masing kelompok kemudian dibagi menjadi tiga yang bertindak sebagai ulangan dalam percobaan.
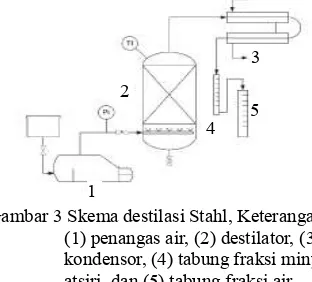
Gambar 3 Skema destilasi Stahl, Keterangan: (1) penangas air, (2) destilator, (3) kondensor, (4) tabung fraksi minyak atsiri, dan (5) tabung fraksi air (Cerpa 2008)
Analisis Minyak Atsiri dengan GCMS Analisis minyak atsiri dengan GCMS akan dilakukan dengan instrumentasi GCMS. Kolom yang digunakan adalah kolom HP5 5MS (5% fenil metil siloksan) dengan dimensi (30 x 250 Um x 0,25 Um) dan berupa gas helium (Sukari 2008; Mahdi
2010). Temperature oven yang digunakan antara 1005250 oC dengan laju perubahan suhu 5 oC menit51 dengan
satu menit bagi tiap tingkatan temperatur dan dengan suhu meningkat secara bertahap sampai pada selama 10 menit. Deteksi pada spektroskopi massa akan dilakukan dengan detektor ' + & (EID) pada tegangan 70 eV (Mahdi
2010). Data yang diperoleh dari GCMS akan kemudian dibandingkan dan ditelaah dengan basis data spektral Wiley atau Wiley 7n. 1 (Sukari 2008; Mahdi 2010).
Uji Aktivitas Antioksidan Minyak Atsiri Uji aktivitas antioksidan dan persiapan assay dilaksanakan sesuai dengan Batubara
(2009) (Lampiran 4). Disiapkan larutan DPPH dalam ethanol dengan konsentrasi 0.3 mM, larutan disiapkan segar dan disimpan dalam ruang gelap pada suhu 4oC. Sebanyak 300 VL larutan DPPH ditambahkan ke dalam ekstrak sampel dengan beberapa konsentrasi (1,6516,66 Vg/ml) (Batubara 2009). Campuran tersebut kemudian dikocok sampai merata. Larutan tersebut didiamkan selama 30 menit, kemudian diukur secara
spektrofotometri pada panjang gelombang 517 nm. Blanko yang digunakan adalah campuran larutan DPPH dan etanol 96% tanpa sampel. Dilakukan juga pengujian aktivitas antioksidan asam askorbat (Vitamin C) sebagai pembanding karena Vitamin C merupakan antioksidan yang telah digunakan secara umum. Pengujian aktivitas antioksidan dilakukan triplo. Aktivitas antioksidan diukur dalam satuan persen (%) inhibisi. Perhitungan (%) inhibisi berdasarkan Yen & Duh (1994) dihitung mengikuti persamaan :
(%) inhibisi=
[(ABlanko – Asampel) / ABlanko] x100 Keterangan:
ABlanko: Nilai absorban dari blanko Asampel : Nilai absorban dari sampel
Analisis Statistik
Pengolahan data dari hasil kromatogram dilakukan dengan Uji5t, tingkat kepercayaan 95%, tidak berpasangan dengan satu peubah, yaitu waktu pemanenan. Data hasil kromatogram diambil dari dua sampel dengan tiga ulangan. Hasil analisis Uji5t dapat menentukan perbedaan komposisi minyak atsiri secara statistik. Perlakuan waktu pemanenan memberikan hasil yang berbeda nyata apabila t " lebih besar t . Pengolahan data dari uji aktivitas antioksidan dilakukan dengan komparasi persen inhibisi terhadap konsentrasi. Data absorban dirata5rata dan dikonversi ke persen inhibisi. Data akan diolah dengan analisis regresi logaritmik.
HASIL DAN PEMBAHASAN
Pemanenan Rimpang Jahe Merah Jahe merah yang digunakan sebagai sampel diperoleh dari daerah Cihideung, kecamatan Batu tulis, Bogor Barat, Bogor, Jawa Barat. Jahe merah yang dipanen berusia 10 bulan dengan kuantitas sekitar tiga kilogram. Sampel jahe merah yang dipanen sore diambil sekitar pukul 15.00 pada tanggal 30 mei 2010, dengan kondisi cuaca mendung/berawan dengan berat 1,5 kg. Sampel jahe merah yang dipanen pagi diambil sekitar pukul 8.00 pada tanggal 31 mei 2010, dengan kondisi cuaca cerah dengan kuantitas 1,5 kg. Kedua sampel ini dibagi manjadi tiga ulangan dengan ukuran tiap ulangannya ±200 g dan kemudian dimasukan ke dalam lemari pendingin dengan suhu 054 oC sampai waktu destilasi tiba. Penyimpanan sampel pada suhu tersebut dilakukan untuk meniadakan atau 1
2
3
mengurangi efek perubahan metabolisme.
Destilat Rimpang Jahe Merah Sampel jahe yang dipanen pada pagi hari dan sore hari dikeluarkan dari lemari pendingin dan dilakukan ! pada sampel selama kurang lebih 10515 menit. Ukuran permukaan sampel tersebut kemudian dihaluskan dengan bantuan mortar dan lumpang sampai cukup halus. Hal ini dilakukan untuk memperbesar luas permukaan sampel yang akan berinteraksi dengan air pada proses destilasi. Metode destilasi yang digunakan adalah metode hidrodestilasi atau destilasi air.
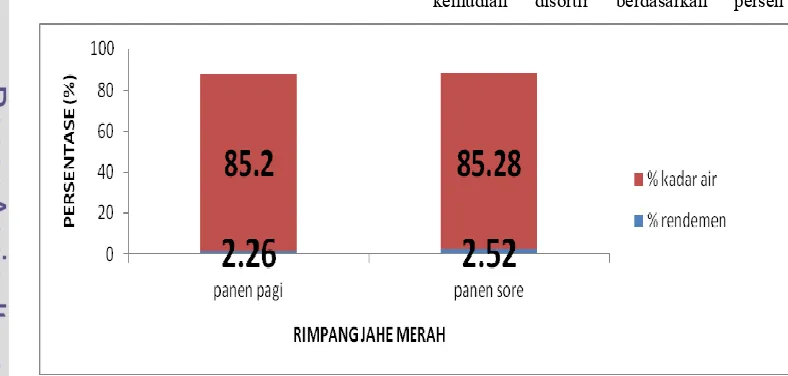
Suhu yang digunakan saat destilasi berkisar antara 1005120 oC. Hasil dari proses destilasi dapat ditunjukkan oleh Gambar 4. Berdasarkan perhitungan (Lampiran 3) diperoleh nilai rendemen pada jahe merah panen sore sebesar 2.52% dan diperoleh nilai rendemen pada jahe merah panen pagi sebesar 2.26%. Nilai ini menunjukkan hasil rendemen yang cukup baik mengingat sampel dalam keadaan segar dan kandungan minyak atsiri jahe merah hanya sekitar 153% (Rukmana 2000, Sari 2006). Rendemen minyak atsiri jahe merah menunjukkan rendemen yang lebih baik ketimbang minyak atsiri dari varian jahe gajah. Sultan . (2005) melaporkan minyak atsiri varian jahe gajah yang telah dikeringkan hanya mencapai 151,5%.
Hasil uji5t, dengan tingkat kepercayaan 95%, nilai rendemen dari kedua perlakuan tidak berbeda nyata dengan nilai t 0,489. Persentase (%) kadar air dari kedua juga menunjukkan tidak ada perbedaan signifikan. Kadar air kedua sampel berkisar antara 85%
dengan nilai t " 0,026.
Profil Kromatogram Minyak Atsiri Jahe Merah
Hasil kromatogram (Lampiran 2) memperlihatkan bahwa minyak atsiri dari jahe merah memiliki 26530 senyawa. Sampel yang dipanen di sore hari menunjukkan adanya variasi dalam komposisi senyawa kimia yang terdeteksi dalam minyak atsiri tersebut. Satu buah sampel memiliki 27 senyawa dan dua buah sampel menunjukkan ada 30 senyawa kimia yang terdeteksi di dalamnya. Minyak atsiri dari jahe merah yang dipanen di pagi hari juga menunjukkan hal yang sama, dengan dua buah sampel memiliki 26 senyawa yang terdeteksi dan satu buah sampel terdeteksi dengan 28 senyawa. Keseluruhan senyawa volatil yang terdeteksi oleh GCMS adalah 47 senyawa. Hasil kromatogram yang didapat menunjukkan proses separasi yang cukup baik, akan tetapi belum optimal. Sukari (2008) melaporkan sekitar 34 senyawa kimia terdapat dalam minyak atsiri satu jahe merah. Perbedaan dalam jumlah senyawa yang terdeteksi dapat juga disebabkan oleh perbedaan cara pemilihan sampel dari kedua metode penelitian. Penelitian ini menentukan umur yang sama pada setiap sampelnya, yaitu pada umur 10 bulan sedangkan pada penelitian Sukari . (2008) sampel diambil secara acak dari pasar tanpa membedakan umur rimpang. Perbedaan umur dalam hitungan bulan pada rimpang jahe merah dapat mengubah profil dari komposisi minyak atsiri rimpang jahe merah, sebagaimana yang telah dilaporkan Nurliana (2008). Keseluruhan senyawa yang teridentifikasi kemudian disortir berdasarkan persen
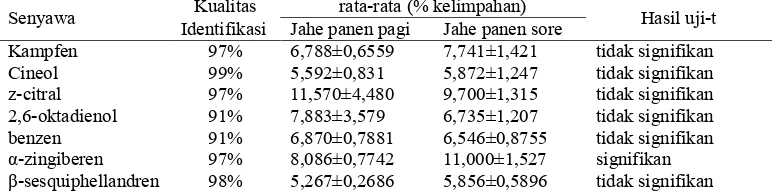
kelimpahan (%) senyawa terhadap keseluruhan senyawa dan dilihat kualitas identifikasinya. Beberapa senyawa utama ( , ) yang terdapat dalam sampel kedua jahe merah adalah senyawa kamfen (6,158,7%), cineol (4,556,9%), citral (8,2516,7%), 2,65oktadienol (5,4512%), benzen (6 %), α5zingiberen (7,6512,5%), dan β5sesquiphellandren (5,10356,521%). Senyawa utama dapat didefinisikan sebagai senyawa yang terdeteksi pada kromatogram GCMS dengan persen kuantitas diatas 5% dari keseluruhan minyak atsiri (Herebian
2009). Tujuh senyawa ini terdapat pada seluruh sampel dan memiliki persen kelimpahan yang besar dibanding senyawa lain yang terdeteksi.
Keberadaan senyawa utama yang terdeteksi dapat menjadi profil dari kromatogram minyak atsiri jahe merah pada umur 10 bulan, sehingga membedakan jahe merah pada umur 10 bulan dengan jahe merah pada umur lain. Dalam menentukan perbedaan profil minyak atsiri jahe merah panen pagi dan sore perlu dilakukan pengujian statistik karena senyawa utama dari kedua sampel sama. Pengujian secara statistik difokuskan pada perbedaan rata5rata komposisi senyawa utama jahe merah pada kedua waktu panen. Hasil uji5t pada rataan persen kelimpahan senyawa utama pada sampel minyak atsiri rimpang jahe merah yang dipanen pagi dan sore dapat dilihat pada Tabel 1. Perbedaan persen kelimpahan menunjukkan profil yang berbeda antara sampel jahe merah yang dipanen pagi dan sore hari.
Hasil dari uji5t menunjukkan bahwa senyawa α5zingiberen berbeda secara statistik kuantitasnya antara sampel jahe merah yang dipanen pada pagi hari dengan yang dipanen pada sore hari dengan nilai t " 5,705. Senyawa lainnya tidak menunjukkan beda signifikan secara statistik. Perbedaan kuantitas senyawa tersebut dapat menjadi faktor yang membedakan profil kromatogram dari metabolisme jahe merah di siang dan di
malam hari.
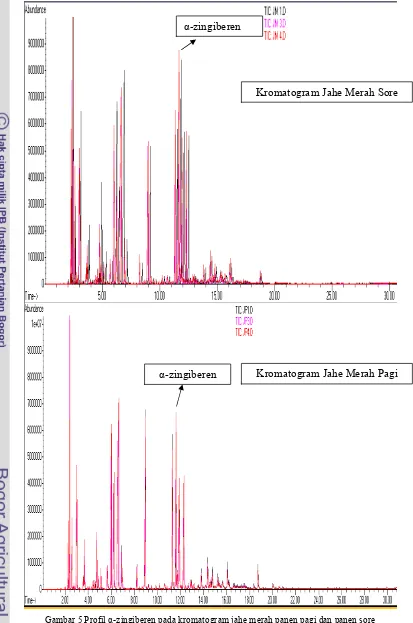
Perbedaan Profil α8Zingiberen
Profil dari kromatogram (Gambar 5) menunjukkan adanya puncak senyawa α5 zingiberen antara waktu retensi 11,6035 11,855. Rataan persen kelimpahan α5 zingiberen pada jahe merah yang dipanen pagi hari adalah 8,086. Rataan persen kelimpahan pada jahe merah yang dipanen sore hari adalah 11,000. Hasil uji5t dari kedua rataan tersebut menunjukkan adanya perbedaan kuantitas yang konsisten dari komponen α5zingiberen pada kedua sampel. Sampel jahe merah yang dipanen pada sore hari (hasil metabolisme siang hari) memiliki jumlah senyawa α5zingiberen yang lebih banyak dibanding sampel jahe merah yang diambil pada pagi hari (hasil metabolisme malam hari). Hal ini sejalan dengan yang dilaporkan oleh Anasori & Asghari (2008) mengenai produksi senyawa geraniol dan α5 zingiberen yang meningkat oleh karena pengaruh cahaya matahari. Dalam laporan tersebut dijelaskan bahwa tumbuhan jahe yang tidak memperoleh paparan cahaya matahari, tidak memiliki pita senyawa zingiberen pada kromatogram kromatografi lapis tipisnya.
Perbedaan ini juga menunjukkan adanya kehilangan α5zingiberen pada sampel jahe merah panen pagi. Sampel jahe panen pagi diambil 17 jam setelah sampel jahe panen sore. Hal ini menunjukkan terjadinya kehilangan α5zingiberen hasil metabolisme 12 jam sebelumnya. Hal ini dapat terjadi karena senyawa α5zingiberen merupakan senyawa volatil yang mudah menguap, sehingga senyawa tersebut dapat menguap pada malam hari. Penjelasan lain mengenai hilangnya senyawa tersebut dapat terjadi karena minyak atsiri tersebut sengaja dikeluarkan ke lingkungan sebagai pengusir serangga oleh tumbuhan tersebut. Hal ini sejalan dengan apa yang telah dilaporkan Yamahara (1988).
Tabel 1 Senyawa utama dari minyak atsiri rimpang jahe merah umur 10 bulan dan hasil uji5t Senyawa Kualitas rata5rata (% kelimpahan) Hasil uji5t
Identifikasi Jahe panen pagi Jahe panen sore
Gambar 5 Profil α5zingiberen pada kromatogram jahe merah panen pagi dan panen sore
Kromatogram Jahe Merah Pagi
α5zingiberen
Pengaruh Gen pada Metabolisme α8 Zingiberen
Senyawa seskuiterpen α5zingiberen merupakan senyawa turunan isopren. Senyawa ini merupakan golongan terpenoid, seskuiterpen. Seskuiterpen adalah senyawa terpenoid dengan rantai karbon berjumlah 15 (C15) Davidovich5Rikanati
2008;Sallaud 2009). jalur metabolisme seskuiterpen. Secara umum jalur tesebut dapat dilihat pada Gambar 6. Menurut Sallaud (2009) sebagian besar seskuiterpen disintesis dari senyawa prekursor farnesil difosfat (FPP). Senyawa FPP dapat dihasilkan dari dua jenis ! , yaitu !
mevalonat dan deoksixilulosa 55fosfat (DXP). Kedua ! ini menghasilkan isopentenil pirofosfat (IPP) dan dimetilalil pirofosfat (DMAPP) yang merupakan prekursor FPP. Terdapatnya senyawa α5zingiberen dapat menjadi petunjuk terdapatnya dua buah gen pada tumbuhan jahe merah. Kedua gen tersebut adalah gen penyandi
(ISPS) dan gen penyandi
) (ZIS). Kedua buah gen ini dibutuhkan dalam sintesis metabolisme sekunder α5zingiberene (Loivamaki . 2007; Davidovich5Rikanati 2008). Gen ISPS dibutuhkan dalam sintesis IPP dan gen ZIS dibutuhkan dalam sintesis α5zingiberen. Loivamaki . (2007) menunjukkan pula bahwa aktivitas ISPS dipengaruhi intensitas cahaya matahari. Makin besar intensitas cahaya, maka makin tinggi aktivitas tersebut. Hal ini dapat menjadi penyebab lebih tingginya produksi α5zingiberen pada jahe merah yang dipanen sore hari karena tanaman tersebut terpapar sinar matahari lebih lama daripada sampel yang dipanen pagi hari.
Gambar 6 ! sinthesis seskuiterpen (Sallaud 2009)
Aktivitas Antioksidan
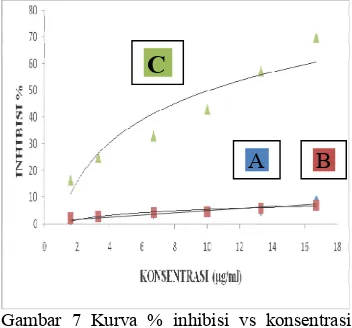
Uji aktivitas antioksidan dilakukan dengan mengukur persen inhibisi dari radikal DPPH. Pengukuran persen inhibisi ini dilakukan dengan menggunakan
dan pada panjang
gelombang 517 nm. Gambar 7 menunjukkan aktivitas antioksidan dari kedua sampel dan juga aktivitas antioksidan vitamin C yang merupakan kontrol positif antioksidan. Aktivitas antioksidan dari kedua sampel tidak berbeda signifikan. Aktivitas antioksidan dari kedua sampel tergolong rendah apabila dibandingkan dengan aktivitas antioksidan standar yang digunakan, yaitu asam askorbat atau vitamin C (Lampiran 5). Persamaan logaritmik dari aktivitas vitamin C adalah y = 21.46ln(x) + 0.367 dengan nilai R² =0.887. Persamaan logaritmik dari aktivitas antioksidan jahe panen pagi adalah y = 2.451ln(x) 5 0.313 dan aktivitas antioksidan dari jahe panen sore ditunjukkan oleh persamaan y = 1.927ln(x) + 0.804. Nilai regresi dari aktivitas jahe panen pagi dan sore secara berturut5turut adalah R²= 0.738 dan R²= 0.907.
Senyawa zingiberen belum diketahui potensi bioaktivitasnya sebagai antioksidan. Senyawa tersebut lebih dikenal memiliki aktivitas biologis sebagai pengusir serangga dan dapat mengobati peradangan (Yamahara 1988; Moon 2010-. Pengujian aktivitas biologi dari kedua hal tersebut dapat diujicobakan untuk penelitian lebih lanjut.
Gambar 7 Kurva % inhibisi vs konsentrasi jahe panen pagi (A), panen sore (B), dan vitamin C (C)
SIMPULAN DAN SARAN
Simpulan
Metabolisme α5zingiberen pada jahe
C
merah terpengaruh oleh adanya sinar matahari. Jahe merah yang dipanen sore hari mengandung minyak atsiri dengan komposisi senyawa α5zingiberen yang lebih tinggi dari jahe merah yang dipanen pada pagi hari. Komponen utama dari minyak atsiri jahe merah adalah kampfen, cineol, citral, 2,65 oktadienol, benzen, β5sesquiphellandren dan α5zingiberen. Aktivitas antioksidan jahe merah yang dipanen sore dan pagi tergolong rendah dan besar aktivitas antioksidan jahe merah yang dipanen sore dan pagi tidak berbeda signifikan.
Saran
Penggunaan sampel jahe merah yang telah dikeringkan dapat dilakukan untuk menurunkan waktu ekstraksi. Separasi senyawa dalam minyak atsiri jahe merah dengan GCMS dapat dioptimalkan dengan penambahan waktu instrument GCMS. Penggunaan basis data terbaru dapat membantu mengidentifikasi beberapa senyawa dalam rimpang jahe merah yang belum teridentifikasi secara spesifik. Penentuan aktivitas antioksidan rimpang jahe merah panen pagi dan panen sore secara
perlu dilakukan untuk membandingkannya dengan hasil percobaan yang telah dilakukan secara .
DAFTAR PUSTAKA
Anasori P, Asghari G. 2008. Effects of light and differentiation on gingerol and zingiberene production in callus culture of Rosc. "3:59563. Arnaudon H. 2002. . + $
" . Kathmandu: MEDEP.
Azlina N. 2005. Study on important parameters affecting the hydro5destilation for ginger oil production [tesis]. Johor: Faculty of Chemical and Natural Resources Engineering, Universiti Teknologi Malaysia.
Bagchi M . 1999. Acute and chronic stress5induced oxidative gastrointestinal injury in rats and the protective ability of a novel grape seed proanthocyanidin
extract. ( 19:11895
1199.
Batubara I, Mitsunaga T, Ohashi H. 2009. Screening antiacne potency of Indonesian medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. /
0 " 55:2305235.
Briceno D, Eberhard W, Shelly T. 2007. Male courtship behavior in
(Diptera: Tephritidae) that have received aromatherapy with ginger root oil.
1 ' 90:1755179.
Bua5in S, Paisooksantivatana Y. 2009. Essential oil and antioxidant activity of Cassumunar Ginger (Zingiberaceae: (Koenig) Link ex Dietr.) collected from various part of Thailand. 2 / ( " 43:4675 475.
Buckle J. 2001. Aromatherapy and diabetes.
& " 14:1245126.
Cerpa MG, Mato RB, Cocero MJ. Modeling steam distillation of essential oils application to lavandin super oil. .+ ' / 54:9095917.
Cooke B, Ernst E. 2000. Aromatherapy: a systematic review [ulas balik]. 3 /
50:4935496.
Dalimartha S, Soedibyo M. 1999. Awet muda dengan tumbuhan obat dan diet suplememen.4 . ! 1:36540. Davidovich5Rikanati R . 2008.
Overexpression of the lemon basil α5 zingiberene synthase gene increases both mono5 and sesquiterpene contents in tomato fruit. 4 / 56:2285 238.
Duke JA 2002. $
. Boca Raton: CRC Pr. Fowlin IA. 1995. . Ed
ke52. Chichester: John Wiley & Sons. Gates SC, Sweeley CC. 1978. Quantitative
metabolic profiling based on gas chromatography. 24:16635 1673.
Geiger JL. 2005. The essential oil of ginger, Zingiber officinale, and anaesthesia. 4
+ / .
15:7514.
Gohlke RS, McLafferty FW. 1993. Early gas chromatography / mass spectrometry. /
. " " 4:3675371.
Greef J van der, Smilde AK. 2005. Symbiosis of chemometrics and metabolomics: past, present, and future. / 19:3765 386.
" *' . 5 ( 675 " . Bogor: Prosea.
Halm MA. 2008. Essential oil for management of symptoms in critically ill patients [ulas balik]. . /
17:1605163.
Han LK, Gong XJ, Kawano S, Saito M. 2005 Antiobesity action of
Roscoe. 8 $ $ 125:2135217. Harliansyah, Murad NA, Wan Ngah WZ,
Mohd Yusof YA. 2007. Antiproliferative, . antioxidant, and apoptosis effect of and 65gingerol on HepG2 cells. . / 3 2:4215426. Harrigan GG, Goodacre R. 2003. Introduction. Di dalam: Harrigan GG, Goodacre R,
editor. 9 +
3 $ & 1
. . Dordrecht: Kluwer Academic Pb. hlm. 158.
Hasler CM. 1998. Fuctional foods: Their role in disease prevention and health promotion. 1 4 52(11):63570. Herebian D, Choi JH, El5Aty AMA, Shim JH,
Spiteller M. 2009. Metabolite analysis in using various GC5 MS and LC5MS separation and detection techniques. 3
23:9515965.
Herlina R, Murhananto J, Endah L, Pribadi
ST. 2002. 2 /
" ., Jakarta: Agro Media
Pustaka.
Hites RA. 1997. Gas Chromatography Mass Spectrometry. Di dalam: Settle F, editor.
$ + 4 %
. . New Jersey:
Prentice Hall. hlm. 6095626.
Honzel D 2008. Comparison of chemical and cell5based antioxidant methods for evaluation of foods and natural products: generating multifaceted data by parallel testing using erythrocytes and polymorphonuclear cells. / . 1 56:831958325.
Jain PK, Ravichandran V, Sharma S, Agrawal RK. 2008. The antioxidant activity of some medicinal plants. 4 $ / 3
32:1975202.
Khadem5Ansari MH, Karimipour M, Salami S, Shirpoor A. 2008. The effect of ginger ( ) on oxidative stress
status in the small intestine of diabetic rats. + / ' 3:1445150. Kikuzaki H, Nakatani N. 1993. Antioxidant
effects of some ginger constituents. /
1 " 58:1.40751.410.
Kitson FG, Larsen BS, McEwan CN. 1996.
" . London: Academic Pr.
Koeswara S. 1995. /
: . Jakarta: Pustaka Sinar Harapan.
Kohnhorst A. 1996. Fuctional foods and disease prevention. " / " 4 3:31538.
Komayaharti A, Paryanti D. 2009. Ekstrak daun sirih sebagai antioksidan pada minyak kelapa [skripsi]. Semarang: Fakultas Tehnik, Universitas Diponegoro. Kuncahyo I, Sunardi. 2007. Uji aktivitas
antioksidan belimbing wuluh (. 5 L.) terhadap 1,1 Diphenyl525 picrylhidrazyl (DPPH). Di dalam:
4 $ 2 : * .
" ( 4 $ ; Yogyakarta,
24 November 2007. Yogyakarta: DIKNAS. hlm. 159.
Kuo . 2005. Isolation of natural antioxidant dehidrozingeron from zingiber officinale and synthesis of its analogues for recognition of effective antioxidant and antithyrosinase agents.
. 28:5185528.
Loivamaki M 2007. Circadian rhythms of isoprene biosynthesis in grey poplar leaves. 143:5405551. Mahdi HJ, Andayani R, Ishak. 2010.
Metabolic fingerprinting of three malaysian ginger (
Roscoe) using gas chromatography5mass spectrometry. . / . " 7:17523. Matsuda Y, Kikuzaki H, Hisamoto M,
Nakatani N. 2004. Antioxidant properties of gingerol related compound from ginger. 3 1 21(1):abstrak [terhubungberkala].http://iospress.metapr ess.com/content/w5cghrt4l5ha2x5l. [28 Mar 2010].
Moon HI, Cho SB, Kim SK. 2010. Composition and immunotoxicity activity of essential oil from leaves of Zingiber officinale Roscoe againts Aedes Aegypti
Inpress.
Muhlisah F. 1999. 4 * ' *
5 3 & .
Yogyakarta: Kanisius.
Nurliana D. 2008. Analisis kuantitatif dan kualitatif minyak atsiri dari rimpang jahe
merah ( var. Rubrum)
dengan variasi waktu panen yang berbeda [skripsi]. Semarang: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Diponegoro.
Nursal. 2006. Bioaktivitas ekstrak jahe
( Roscoe) dalam
menghambat pertumbuhan koloni bakteri
' dan3 /
3 2:64566.
Patin R, Kanlayavattanakul M, Lourith N. 2009. Aromatheraphy and essential oil in thai spa business. + / " 5:1605 166.
Percival M. 1998. Antioxidant [ulasan].
( + 1(10):154.
Pino JA, Marbot R, Rosado A, Batista A. 2004. Chemical composition of
( ;) from Cuba. / ' : 16:1865188.
Ravindran PN, Babu KN, editor. 2005.
9 4 . Boca
Raton: CRC Pr.
Robertson DG. 2005. Metabonomics in toxicology: a review. 4 # "
85:8095822.
Rohman A, Riyanto S. 2005. Daya antioksidan ekstrak etanol Daun
Kemuning ( (L) Jack)
secara . , 1
+ 16:1365140.
Rukmana R. 2000. < 4 / . Yogyakarta: Kanisius.
Saghatelian . 2004. Assignment of endogenous substrates to enzymes by global metabolite profiling. 3
43(45):14332514339.
Sallaud C . 2009. A novel pathway for sesquiterpenes biosynthesis from z,z5 farnesyl pyrophosphate in the wild
tomato " . 4
21:3015317.
Sari HC, Darmanti S, Hastuti ED. 2006. Pertumbuhan tanaman jahe emprit
( var. Rubrum) pada
media tanam pasir dengan salinitas yang
berbeda. 3 . 1
14:19529.
Seis H. 1997. Oxidative stress: oxidant and antioxidant. '# 82:2915295. Selmi S, Sadok S. 2008. The effect of natural
antioxidant (4 Linnaeus) on flesh quality of tuna (4
(Linnaeus)) during chilled storage. *
. / .% " 3:36545.
Sidik. 1997. . " .
Yogyakarta: UGM.
Spivack SE. 1998. Health spa development in the US: a burgeoning component of sport tourism. / $ 4:65577. Subramaniam V, Adenan MI, Ahmad AR, Sahdan R. Natural Antioxidant:
(Kadok) and (Mengkudu). / ( 9:41551.
Suhartono E, Setiawan B, Edyson, Ramlah. 2005. Uji aktivitas antioksidan jus buah
mengkudu ( ) dan
perannya sebagai inhibitor
(AGEs) akibat reaksi glikolisasi. 3 + 2 37:156. Stoilova 2007. Antioxidant activity of a
ginger extract ( ). 1
102:7645770.
Sukari 2008. Chemical constituent variantions of essential oils from rhizomes of four Zingiberaceae species.
/ . " 12:6385644.
Sultan M, Bhatti HN, Iqbal Z. 2005. Chemical analysis of essential oil of ginger. $ / 3 " 8:157651578.
Sunarti, Maudisa R, Asdie RH, Hakimi M. 2008. Effect of homocysteine and antioxidants on peroxidation lipid of essential hypertension in Central Java, Indonesia. 3 + 2 40:1655171.
Wijayakusuma H. 2006. . . < $ . Jakarta: Puspa Swara.
Veeru P, Kishor MP, Meenakshi M. 2008. Screening of medicinal plant extract for antioxidant activity. /
3:6085612.
Vernin G, Parkanyi C. 2005. Chemistry of Ginger. Di dalam: Ravindran PN, Babu
KN, editor. 9 4 .
Yamahara J 1988. The anti5ulcer in rats of ginger constituent. / '
23:2995304
Yen GC, Duh PD. 1994. Scavenging effect of methanolic extracts of peanut hulls on free5radical and active oxygen species. J.
Lampiran 1 Alur kerja penelitian
Preparasi Bahan
Baku
Destilasi Minyak
Atsiri Jahe Merah
Uji Aktivitas
Antioksidan
Minyak Atsiri
Analisis
Minyak Atsiri
dengan
GC/MS
Analisis
Statistik
Interpretasi Data
Jahe Merah
Waktu Panen
Pagi Hari
Jahe Merah
Waktu Panen
Lampiran 2 Senyawa total kromatogram GC/MS dan contoh perhitungan
t5test
Kromatogram Jahe Merah Sore
Lampiran 2 Senyawa total kromatogram GC/MS dan contoh perhitungan
t5test
(Lanjutan)
Senyawa Ulangan (pagi) Ulangan (sore) Signifikan
1 2 3 1 2 3
trisiklene NA NA NA 0.281 NA NA NA
α5pinene 1,498 1,698 1,517 2,682 2,139 1,561 tidak
camphene 6,274 7,527 6,564 8,760 8,345 6,117 tidak
β5mycrene 1,662 1,731 1,377 2,253 1,914 1,497 tidak
β5phellandrene NA 1,847 NA NA NA NA NA
cineol 6,407 4,745 5,625 4,500 6,938 6,177 tidak
25nonanone 0.293 NA NA NA NA 0.256 NA
Delta carene NA NA NA 2,334 NA NA NA
linalool 1,720 1,723 1,516 0.605 0.826 1,382 tidak
α5terpinolene 0.373 NA NA 0.397 0.302 0.370 tidak
borneol 1,929 1,863 1,681 1,512 2,091 2,789 tidak
cyclooctane 0.577 NA NA NA 0.471 NA NA
35cyclohexane 0.689 NA NA NA NA NA NA
α5terpineol NA 0.605 0.539 0.495 NA 0.867 NA
β5citronelol 1,055 1,150 0.983 0.912 1,097 1,377 tidak
z5citral 16,714 9,473 8,523 8,217 10,154 10,728 tidak
2,65oktadienol 6,004 12,011 5,634 6,943 7,824 5,437 tidak
E5citral 10,051 NA NA NA NA NA NA
z5citral(2) NA NA NA 15,373 18,926 NA NA
cyclohexanone NA NA NA 0.412 NA NA NA
pulegone NA NA NA NA 0.731 0.744 NA
cyclohexene5methanol NA NA NA NA 0.680 NA NA
bicycloheptanon NA NA NA NA NA 0.433 NA
bicycloheptenol NA NA NA NA NA 0.479 NA
bicycloheptanol 1,131 1,024 1,516 0.977 0.815 0.983 tidak
geraniol NA 5,762 NA 2,719 4,273 NA tidak
citral NA 16,788 14,746 NA NA 19,433 NA
cis52,65dimethyl52,65octadiene 0.815 0.960 1,005 0.909 0.679 0.581 tidak
2,65oktadienol(2) 11,162 NA 13,510 6,943 NA 5,731 NA
25undecanone 0.459 NA 0.517 NA NA 0.329 NA
benzene 6,074 6,885 7,650 7,528 6,265 5,846 tidak
1,3cyclohexadiene/α5zingiberene 8,969 7,522 7,768 12,466 9,418 11,116 YA
germacrene NA 0.871 NA NA NA NA NA
α5farnesene 6,230 4,027 6,452 7,163 6,254 6,418 tidak
β5bisabolen 0.645 1,865 NA 0.689 NA 0.545 NA
zingiberene 0.779 1,020 1,215 NA 0.789 NA NA
α5amorphene NA NA 0.975 NA NA NA NA
naphtalene/γ5cadinene 0.856 NA NA 1,028 0.877 0.841 NA
β5sesquiphellandrene 5,212 5,103 5,577 6,521 5,396 5,652 tidak farnesol(?)/4,4 dimethyl5251,5 hexadiene/cyclohexane 0.927 1,201 1,413 1,133 0.945 0.817 tidak di5epi5α5cedrene/α5cedrene/methanoazulene/italicene 0.539 0.673 0.893 0.628 0.466 0.455 tidak
E5farnesene/farnesene NA NA 0.940 NA 0.649 NA NA
napthalenmethanol NA NA 0.551 0.373 NA NA NA
β5himachalene NA NA NA 0.940 NA NA NA
trimethylbicyclo NA NA NA 0.592 NA NA NA
2,6,10 dodecatrien515ol NA NA NA NA 0.735 NA NA
benzocyclohepten NA NA NA NA NA 0.682 NA
Lampiran 2 Senyawa total kromatogram GC/MS dan contoh perhitungan
t5test
(Lanjutan)
Hipotesis 0 :
Tidak ada perbedaan antara komposisi zingiberen jahe merah panen pagi
dengan sore.
Hipotesis 1 : Ada perbedaan antara komposisi zingiberen jahe merah panen pagi dengan sore.
Student t5Test: zingiberene
Mean 8086.333333 11000
Variance 599454.3333 2332668
Observations 3 3
Pearson Correlation 0.90901536 Hypothesized Mean Difference 0
df 2
t Stat 5.70582144
P(T<=t) one5tail 0.014684742 t Critical one5tail 2.91998558 P(T<=t) two5tail 0.029369484 t Critical two5tail 4.30265273
tStat lebih besar dari nilai t Crit, maka Hipotesis 0 dapat ditolak.
Lampiran 3 Perhitungan koreksi kadar air dan perhitungan uji5t pada rendemen minyak atsiri
Koreksi kadar air jahe merah panen pagi
Koreksi kadar air jahe merah panen sore
Contoh perhitungan:
% rendemen =
x 100%
(100%5 kadar air) x (bobot)
= 0.7
x 100%
(100%5 87.2%) x (198.487)
= 2.7%
! " #
$ % &
' ( (
) % &
* # + ( , $ - .. & .
/ "
) 012 " 3 & " ) 012 4 "
3 & 4 "
Lampiran 4 Proses penentuan aktivitas antioksidan dengan
1. Larutan stok
konsentrasi 10,000 Ug/ml dalam DMSO
2. Larutan DPPH
0,3 mM DPPH dalam 10 ml etanol (disiapkan segar).
3. Sampel
4 l larutan stok ditambahkan kedalam 396 l etanol (pengenceran 100x)
4. Uji aktivitas
(semua dalam l):
Konsentrasi
Sample etanol DPPH
0
0
100
100
1.6
5
95
100
3.3
10
90
100
6.7
20
80
100
10
30
70
100
13.3
40
60
100
16.7
50
50
100
Sampel A Sampel B Vit C
Lampiran 5 Pengukuran aktivitas antioksidan
Data Uji Antioksidan Minyak Atsiri Jahe Merah Waktu Panen Pagi
sampel
Konsentrasi
(Vg/ml)
A 1
A 2
A 3
Rata5Rata %Inhibisi
kontrol
0,351
0,354
0,351
0,352
P1
1,6
0,344
0,348
0,350
0,347
1,42
P2
3,3
0,328
0,345
0,349
0,341
3,125
P3
6,7
0,335
0,340
0,345
0,339
3,69
P4
10
0,331
0,339
0,340
0,336
4,54
P5
13,3
0,331
0,338
0,337
0,335
4,829
P6
16,7
0,314
0,327
0,321
0,321
8,806
Data Uji Antioksidan Minyak Atsiri Jahe Merah Waktu Panen Sore
sampel
Konsentrasi
(Vg/ml)
A 1
A 2
A 3
Rata5
Rata
%Inhibisi
kontrol
0,354
0,355
0,350
0,353
S1
1,6
0,345
0,343
0,347
0,345
2,26
S2
3,3
0,343
0,342
0,344
0,343
2,83
S3
6,7
0,336
0,339
0,340
0,338
4,24
S4
10
0,335
0,337
0,338
0,337
4,53
S5
13,3
0,335
0,331
0,331
0,332
5,94
S6
16,7
0,329
0,329
0,327
0,328
7,08
Contoh perhitungan:
% daya hambat P1 = absorban kontrol – absorban ekstrak x 100%
absorban kontrol
= 0,352– 0,347 x 100%
0,352
Lampiran 5 Pengukuran aktivitas antioksidan (Lanjutan)
Data Uji Antioksidan Vitamin C
sampel
Konsentrasi
(Vg/ml)
A 1
A 2
A 3
Rata5Rata %Inhibisi
kontrol
0,325
0,319
0,309
0,317667
C1
1,6
0,242
0,291
0,262
0,265
16,57922
C2
3,3
0,24
0,24
0,234
0,238
25,0787
C3
6,7
0,221
0,215
0,202
0,212667 33,05352
C4
10
0,191
0,177
0,175
0,181
43,02204
C5
13,3
0,149
0,126
0,132
0,135667 57,29276
C6
16,7
0,103
0,092
0,091
0,095333 69,98951
Contoh perhitungan:
% daya hambat c1 = absorban kontrol – absorban ekstrak x 100%
absorban kontrol
= 0,317667– 0,265 x 100%
0,317667