(
Jatropha curcas
LINN.) KULTIVAR DOMPU
RUDIYANTO
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa Tesis berjudul Optimasi Proliferasi dan Perkecambahan Embrio Somatik serta Pertumbuhan Planlet Jarak Pagar(Jatropha curcas Linn.) Kultivar Dompu adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2014
Rudiyanto
RINGKASAN
RUDIYANTO. Optimasi Proliferasi dan Perkecambahan Embrio Somatik serta Pertumbuhan Planlet Jarak Pagar (Jatropha curcas Linn.) Kultivar Dompu. Dibimbing oleh DARDA EFENDI dan TRI MUJI ERMAYANTI
Jatropha curcas Linn., merupakan salah satu tanaman berpotensi sebagai sumber biofuel bersifat non-edible. Dengan embriogenesis somatik dapat dihasilkan embrio dalam jumlah banyak. Melalui tahap pendewasaan dan perkecambahan, embrio dapat menjadi planlet. Penelitian ini terdiri dari 4 percobaan yakni optimasi proliferasi embrio somatik, perkecambahan embrio, pertumbuhan planlet, dan induksi akar serta aklimatisasi. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh sukrosa yang dikombinasikan dengan 2,4-D terhadap proliferasi embrio somatik, mengetahui pengaruh sukrosa yang dikombinasikan dengan Polyethylene-glycol (PEG) terhadap perkecambahan embrio somatik, mengetahui pengaruh Kinetin, 2-iP dan BAP pada berbagai konsentrasi terhadap pertumbuhan planlet J. curcas dan mengetahui pengaruh modifikasi media MS yang dikombinasikan dengan IAA dan IBA pada konsentrasi yang berbeda terhadap perakaran planlet J. curcas. Embrio somatik fase globular dengan bobot 0.025-0.030 g dan diameter 0.4-0.5 cm dikulturkan pada media MS yang dipadatkan dengan 3 g/l agar Gelzan. Pada tahap proliferasi, media MS ditambah dengan 20, 30, 40, dan 50 g/l sukrosa dikombinasikan dengan 0.0, 0.5, 1.0 dan 2.0 mg/l 2,4-D. Pada tahap perkecambahan, media MS ditambah dengan 20, 30, 40, dan 50 g/l sukrosa dan dikombinasikan dengan 0.0, 2.5, 5.0, 10.0, dan 15.0% PEG. Pada tahap pertumbuhan planlet, embrio yang telah berkecambah dikultur pada media MS yang mengandung Kinetin, 2-iP atau dan BAP dengan konsentrasi 0.0, 0.5, 1.0 dan 2.0 mg/l dan pada tahap perakaran, planlet dikulturkan pada media ½ MS dan MS yang dikombinasikan dengan 0.0, 1.0 dan 2.0 mg/l IAA dan IBA. Hasil penelitian menunjukkan bahwa Media MS yang mengandung 30 g/l sukrosa yang dikombinasikan dengan 1 mg/l 2,4-D serta media MS dengan 50 g/l sukrosa tanpa 2,4-D menghasilkan diameter clump embrio dan jumlah embrio yang tinggi. Media MS yang mengandung 20 dan 30 g/l sukrosa yang dikombinasikan dengan 5% PEG menghasilkan nilai yang tinggi untuk beberapa
peubah diantaranya jumlah embrio berkecambah/ clump, persentase kecambah
normal, serta persentase clump berkecambah. PEG dengan konsentrasi 10 dan 15% yang dikombinasikan dengan berbagai konsentrasi sukrosa (20, 30, 40 dan 50 g/l) menghambat perkecambahan embrio. Media MS yang mengandung 1 mg/l BAP menghasilkan planlet dengan nilai jumlah daun dan jumlah buku yang tinggi, sedangkan media MS yang mengandung 2 mg/l 2-iP menghasilkan planlet dengan tinggi tanaman tertinggi berbeda nyata dengan perlakuan lainnya serta nilai bobot basah tertinggi dan berbeda nyata dengan perlakuan lainnya kecuali dengan perlakuan 1 mg/l BAP. Media ½ MS, dan MS tanpa penambahan zat pengatur tumbuh IAA maupun IBA menghasilkan jumlah akar tertinggi dan berbeda nyata dengan perlakuan lainnya. Planlet yang telah berumur 10 minggu dan berakar dengan baik dapat diaklimatisasi di rumah kaca dengan daya hidup 30%.
SUMMARY
RUDIYANTO. Optimization on Proliferation and Germination of Somatic Embryo and Growth of Jatropha Plantlets (Jatropha curcas Linn.) Cultivar Dompu. Supervised by DARDA EFENDI and TRI MUJI ERMAYANTI
Jatropha curcas L., is a potential plant species useful as source of a non-edible biofuel. Somatic embryogenesis produce a large number of embryos at defined stages of development, and allows alterations through manipulations of the culture conditions. There were 4 experiments in this research, which were optimization of somatic embryo proliferation, embryo germination, planlet growth, root induction and acclimatization. The aims of the study were to investigate the effect of sucrose in combination with 2,4-D on somatic embryo proliferation, the effect of sucrose in combination with Polyethylene-glycol (PEG) on somatic embryo germination, the effect of Kinetin, 2-ip and BAP in different concentrations and investigate the effect of MS modification medium supplemented with IAA and IBA in different concentration on planlet rooting of J. curcas. Globular somatic embryos at 0.025-0.030 g fresh weight having 0.4-0.5 cm in diameter was grown on MS medium solidified with 3 g/l of Gelzan supplemented with sucrose at 20, 30, 40, and 50 g/l in combination with 0.0, 0.5, 1.0 and 2.0 mg/l 2,4-D on proliferation medium and sucrose at 20, 30, 40, and 50 g/l in combination with PEG at 0.0, 2.5, 5.0, 10.0, and 15.0% on germination medium. On planlet growth medium, germinated embryos were cultured on MS medium supplemented with Kinetin, 2-iP, and BAP at 0, 0.5, 1 and 2 mg/l and on rooting medium, planlets were cultured on ½ MS and MS medium in combination with 0, 1 and 2 mg/l IAA and IBA. The results showed that MS medium containing 30 g/l of sucrose in combination with 1 mg/l 2,4-D and MS medium containing 50 g/l of sucrose without 2,4-D had high value on somatic embryo clump diameter and number of embryos. MS medium containing 20 and 30 g/l of sucrose in combination with 5% PEG produced high value for several variables such as number of germinated embryos/ clump, normal germinated embryos and percentage of germinated embryos/ clump. Polyethylene-glycol on 10 and 15% in combination with different concentrations of sucrose (20, 30, 40 and 50 g/l) inhibited embryos germination. MS medium containing 1 mg/l BAP produce plantlets with highest number of leaves and number of nodes, meanwhile MS medium containing 2 mg/l 2-iP produced highest plantlets and significantly different from other treatments as well as the value of fresh weight were significantly different from other treatments except treatment with 1 mg/l of BAP. Treatment ½ MS and MS basal medium without addition of IAA and IBA produced highest root number. Plantlets 10 weeks after culture with well root formation could be acclimatization with survival rate of 30%.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
OPTIMASI PROLIFERASI DAN PERKECAMBAHAN
EMBRIO SOMATIK SERTA PERTUMBUHAN PLANLET
JARAK PAGAR (
Jatropha curcas
LINN.) KULTIVAR DOMPU
RUDIYANTO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis: Optimasi Proliferasi dan Perkecambahan Embrio Somatik serta Pertumbuhan Planlet Jarak Pagar (Jatropha curcas Linn.) Kultivar Dompu
Nama : Rudiyanto NIM : A253110241
Disetujui oleh Komisi Pembimbing
Dr. Ir. Darda Efendi, Msi Dr. Ir. Tri Muji Ermayanti
Ketua Anggota
Diketahui oleh
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman Dekan Sekolah Pascasarjana
Dr. Ir. Yudiwanti Wahyu E.K., MS. Dr. Ir. Dahrul Syah, Msc.Agr
Tanggal Ujian: Tanggal Lulus:
PRAKATA
Puji dan Syukur penulis panjatkan kehadirat Allah –Subhanahu Wa Ta’alla- karena atas berkah, rahmat, hidayah, dan karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan Tesis ini dengan baik sebagai persyaratan untuk memperoleh gelar master di Institut Pertanian Bogor.
Dalam pelaksanaan penelitian maupun dalam penyusunan Tesis ini, penulis banyak mendapatkan bimbingan dan bantuan dari berbagai pihak. Oleh karena itu, pada kesempatan ini penulis menghaturkan terima kasih serta penghargaan kepada:
1. Dr.Ir. Dahrul Syah, M.Sc. Agr selaku Dekan Sekolah Pascasarjana IPB
2. Dr. Ir. Yudiwanti Wahyu EK, MS selaku Ketua Program Studi Pemuliaan dan Bioteknologi Tanaman IPB
3. Dr. Ir. Darda Efendi, Msi dan Dr. Ir. Tri Muji Ermayanti selaku komisi pembimbing
4. Dr. Ir. Agus Purwito, M.Sc.Agr selaku penguji luar komisi pada ujian Tesis 5. Seluruh staf pengajar Departemen Agronomi dan Hortikultura, Fakultas
Pertanian IPB
6. Kementerian Negara Riset dan Teknologi (KNRT) selaku sponsor beasiswa 7. Keluargaku tercinta: Supari (Ayah), Rumiyati (Ibu), Rini Dwi Kusuma Astuti
(Istri), Muhammad Sa’id As-Tsaqif (anak), Fathimah Ashfiya (anak)
8. Rekan-rekan di Laboratorium Biak Sel dan Jaringan Tanaman Puslit Bioteknologi LIPI yaitu Dyah Retno Wulandari, Erwin Al-Hafiizh, Andri Fadhillah Martin, Betalini Widhi Hapsari, Deritha Ellfy Rantau, Evan Maulana dan Lutvinda Ismanjani
9. Teman-teman seperjuangan di Program Studi Pemuliaan dan Bioteknologi Tanaman yaitu Boby, Alfa, Helfy, Candra, Mas Punjung dan yang lainnya 10.Semua pihak yang telah membantu penulis yang tidak dapat disebutkan satu
per satu
Penulis menyadari sepenuhnya bahwa Tesis ini masih jauh dari kesempurnaan, namun semoga informasi yang terdapat dalam Tesis ini dapat bermanfaat bagi pembaca sekalian.
Bogor, November 2014
Rudiyanto
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiv
1. PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2. TINJAUAN PUSTAKA 5
Tanaman Jarak Pagar (Jatropha curcas Linn.) 5
Embriogenesis Somatik 6
Optimasi Pertumbuhan Planlet dan Aklimatisasi 9
3. METODE 10
Waktu dan Tempat 10
Bahan dan Alat 10
Analisis Data 10
Pelaksanaan Percobaan 10
Percobaan I. Optimasi Proliferasi Embrio Somatik 10
Percobaan II. Perkecambahan Embrio Somatik 11
Percobaan III. Optimasi Pertumbuhan Planlet 11
Percobaan IV. Optimasi Perakaran dan Aklimatisasi 12
4. HASIL DAN PEMBAHASAN 13
Percobaan I. Optimasi Proliferasi Embrio Somatik 13
Percobaan II. Perkecambahan Embrio Somatik 21
Percobaan III. Optimasi Pertumbuhan Planlet 28
Percobaan IV. Optimasi Perakaran dan Aklimatisasi 35
Pembahasan Umum 42
5. SIMPULAN 45
DAFTAR PUSTAKA 45
LAMPIRAN 51
RIWAYAT HIDUP 56
DAFTAR TABEL 1. Anova pada perlakuan sukrosa yang dikombinasikan dengan 2,4-D untuk peubah diameter kalus dan jumlah embrio somatik umur 8 minggu 16 2. Diameter clump embrio dan rerata skor jumlah embrio pada proliferasi embrio somatik J. curcas kultivar Dompu umur 8 minggu 17 3. Warna, ukuran embrio serta morfologi embrio somatik J. curcas
kultivar Dompu umur 8 minggu 19
4. Anova pada perlakuan sukrosa yang dikombinasikan dengan PEG untuk peubah diameter kalus, jumlah kecambah/clump serta persentase
5. Diameter clump embrio, jumlah embrio berkecambah/clump, persentase kecambah normal serta persentase clump berkecambah pada embrio
somatik J. curcas umur 8 minggu 24
6. Warna dan morfologi kecambah J. curcas umur 8 minggu 26 7. Anova pada perlakuan zat pengatur tumbuh sitokinin yang
dikombinasikan dengan konsentrasi untuk peubah jumlah daun, tinggi tanaman, jumlah buku, jumlah akar dan berat basah planlet J. curcas
umur 8 31
8. Jumlah daun, tinggi tanaman, jumlah buku, jumlah akar dan berat basah
planlet J. curcas umur 8 minggu 32
9. Morfologi planlet J. curcas kultivar Dompu umur 8 minggu 33 10.Rerata jumlah akar planlet J. curcas kultivar Dompu umur 0-8 minggu 37 11. Rerata panjang akar (cm) planlet J. curcas kultivar Dompu umur 0-8
minggu 38
12.Anova pada perlakuan media dasar yang dikombinasikan dengan auksin untuk peubah tinggi tanaman, jumlah daun, jumlah buku, jumlah
akar, serta panjang akar umur 8 minggu setelah kultur 38 13. Tinggi tanaman, jumlah daun, jumlah akar serta panjang akar planlet J.
curcas yang ditumbuhkan pada media induksi pengakaran dengan media dasar ½ MS dan MS yang dikombinasikan dengan zat pengatur tumbuh: 0.0, 1.0 dan 2.0 mg/l IAA, 1.0 dan 2.0 mg/l IBA umur 8 0.0, 0.5, 1.0, 1.5 dan 2.0 mg/l yang dikombinasikan dengan sukrosa. A
20 g/l sukrosa, B 30 g/l sukrosa, C 40 g/l sukrosa dan D 50 g/l sukrosa 13 3. Jumlah embrio J. curcas pada media dengan penambahan 0.0, 0.5, 1.0,
1.5 dan 2.0 mg/l 2,4-D yang dikombinasikan dengan sukrosa umur 1-8 minggu. A 20 g/l sukrosa, B 30 g/l sukrosa, C 40 g/l sukrosa dan D 50
g/l sukrosa 15
4. Proliferasi embrio somatik J. curcas pada media MS yang mengandung 20, 30, 40 dan 50 g/l sukrosa dikombinasikan dengan 0.0, 0.5, 1.5, dan
2.0 mg/l 2,4-D umur 8 minggu (Perbesaran 12,5 kali) 20
5. Perkecambahan embrio somatik J. curcas kul. Dompu pada media 20, 30, 40 dan 50 g/l sukrosa yang dikombinasikan dengan 0.0, 2.5, 5.0,
10.0 dan 15.0% PEG umur 8 minggu (Perbesaran mikroskop 12.5 kali) 22 6. Perkecambahan embrio somatik J. curcas kul. Dompu pada media 20,
30, 40 dan 50 g/l sukrosa yang dikombinasikan dengan 0.0, 2.5, 5.0,
10.0 dan 15.0% PEG umur 8 minggu (Perbesaran mikroskop 12.5 kali) 27 7. Kecambah embrio somatik J. curcas yang normal dan abnormal. A. Kecambah
normal. B. Kecambah abnormal (hipokotil tidak berkembang dengan baik). C. Kecambah abnormal (terjadi fusi di antara 2 embrio). D. kecambah abnormal (kecambah berubah menjadi kalus kembali). Tanda panah menunjukkan
8. Jumlah daun planlet J. curcas umur 0-8 minggu pada media MS dengan penambahan zat pengatur tumbuh sitokinin dengan konsentrasi 0.0, 0.5,
1.0 dan 2.0 mg/l (A). Kinetin (B). 2-iP dan (C). BAP 29
9. Tinggi tanaman planlet J. curcas umur 0-8 minggu pada media MS dengan penambahan zat pengatur tumbuh sitokinin dengan konsentrasi
0.0, 0.5, 1.0 dan 2.0 mg/l (A). Kinetin (B). 2-iP dan (C). BAP 30 10.Planlet J. curcas umur 8 minggu yang tumbuh pada media MS dengan
penambahan Sitokinin dengan konsentrasi 0.0, 0.5, 1.0 dan 2.0 mg/l A. Kinetin, tanda panah menunjukkan terbentuknya kalus embriogenik. B. 2-iP, tanda panah menunjukkan terbentuknya kalus embriogenik serta daun yang berukuran lebar dan C. BAP, tanda panah menunjukkan terbentuknya kalus embriogenik serta daun yang berukuran kecil dan
bergerigi 35
11.Tinggi tanaman planlet J. curcas umur 0-8 minggu yang ditumbuhkan pada media induksi perakaran dengan zat pengatur tumbuh: 0, 1 dan 2 mg/l IAA, 1 dan 2 mg/l IBA. A. Media dasar ½ MS, B. Media dasar
MS 36
12.Jumlah daun planlet J. curcas umur 0-8 minggu yang ditumbuhkan pada media induksi perakaran dengan zat pengatur tumbuh: 0, 1 dan 2 mg/l IAA, 1 dan 2 mg/l IBA. A. Media dasar ½ MS, B. Media dasar
MS 36
13. Morfologi planlet, akar dan pangkal batang J. curcas umur 8 minggu ditumbuhkan pada media induksi perakaran dengan media dasar ½ MS dan MS yang dikombinasikan dengan zat pengatur tumbuh: 0, 1 dan 2
mg/l IAA, 1 dan 2 mg/l IBA 40
14.Jatropha curcas hasil regenerasi embrio somatik. A. Planlet J. curcas
yang telah berakar, B. Tanaman J. curcas umur 3 minggu setelah aklimatisasi, C. Tanaman J. curcas umur 8 minggu setelah pindah
tanam 41
15.Jatropha curcas yang telah diaklimatisasi A. Umur 4 minggu B. Umur
8 minggu C. Umur 10 minggu D. Umur 12 minggu 42 clump, persentase kecambah normal pada Percobaan II.
Perkecambahan Embrio Somatik 52
2.3 Analisis Sidik Ragam Jumlah daun, tinggi tanaman, jumlah buku, jumlah akar, bobot basah pada Percobaan III. Optimasi
Pertumbuhan Planlet 53
1. PENDAHULUAN
Latar Belakang
Terbatasnya ketersediaan energi bahan bakar tak terbarukan telah menjadi fokus perhatian berbagai pihak, karena sumber energi untuk kendaraan bermotor dan industri di Indonesia saat ini sebagian besar masih sangat tergantung pada minyak dan gas bumi. Sejak tahun 2003 Indonesia tidak lagi menjadi negara pengekspor minyak (Anonim, 2012). Tingkat konsumsi yang lebih tinggi dibandingkan produksi membuat Indonesia harus mengimpor minyak dari negara-negara Timur Tengah. Rata-rata produksi minyak bumi Indonesia pada tahun 2011 adalah sebesar 0.9 juta barel per hari, sedangkan tingkat konsumsi mencapai 1.3 juta barrel per hari. Saat ini diperkirakan pasar Indonesia menyerap hingga 65 juta kiloliter bahan bakar minyak per tahun. Menurut data dari Kementrian Energi dan Sumber Daya Mineral, pada tahun 2009 Indonesia mengimpor 22 juta kiloliter. Impor minyak bumi ini mengakibatkan kenaikan harga minyak di dalam negeri (Anonim, 2012). Di lain pihak, krisis energi akibat menurunnya cadangan minyak dan gas alam berdampak terhadap melambungnya harga minyak di pasar dunia (Daryanto, 2005). Salah satu alternatif pengganti energi minyak bumi yang potensial untuk dikembangkan adalah pemanfaatan biofuel. Dalam rangka menjamin pasokan energi dalam negeri, telah diterbitkan Peraturan Presiden RI No. 5 Tahun 2006 tentang kebijakan Energi Nasional. Dalam Peraturan Presiden tersebut antara lain disebutkan bahwa penyediaan biofuel pada tahun 2025 minimal 5% dari kebutuhan energi nasional (Anonim, (2012).
Pemanfaatan biofuel, selain dipergunakan untuk mengurangi ketergantungan terhadap minyak (diversifikasi energi), juga mempunyai keuntungan lain yaitu mengurangi dampak lingkungan, karena biofuel merupakan bahan bakar rendah emisi bahan pencemar (polutan), biodegradable, tidak beracun dan mengurangi emisi gas rumah kaca sampai 90% (Syaufina dan Mansur, 2005). Biofuel dapat dibuat dari minyak nabati seperti kelapa sawit, kelapa, J. curcas, kapok, dan nyamplung. Bioetanol dibuat dari bahan-bahan bergula atau berpati seperti tetes tebu, nira sorgum, nira nipah, singkong, ganyong dan ubi jalar. Peran kedua jenis bahan bakar alternatif ini sangat penting untuk mengatasi masalah krisis energi di Indonesia (Kardono, 2008)
Dari berbagai riset dan pengembangan terhadap produksi energi berbasis
biofuel, tanaman J. curcas Linn (jarak pagar) berpotensi menghasilkan biofuel. Selain bersifat berkelanjutan (sustainable), tanaman ini mampu beradaptasi pada berbagai kondisi lingkungan dengan produktivitas cukup tinggi dan ekonomis (Daryanto, 2005). Jatropha curcas merupakan anggota dari famili Euphorbiaceae, berasal dari Amerika Tengah dan menyebar sampai ke Afrika dan Asia (Thepsamran, 2007). Aksesi J. curcas yang berpotensi dikembangkan di Indonesia adalah aksesi Dompu yang toleran kekeringan dan memiliki kandungan minyak cukup tinggi yaitu 30-37% dengan bobot biji 2.0-2.23 g (Hasnam, 2007).
permasalahan tersebut, salah satu alternatif perbanyakan J. curcas dapat dilakukan melalui pembentukan embrio somatik. Teknik ini memiliki keunggulan diantaranya dapat menghasilkan bibit dalam jumlah banyak dalam waktu yang relatif singkat, tidak memiliki fase dorman, bersifat bipolar dengan ujung tunas serta akar tunjang dan dapat dimanfaatkan sebagai bahan eksplan untuk transformasi genetik guna perbaikan sifat genetik tanaman (Jha et al., 2007), dengan demikian permasalahan dari perbanyakan konvensional dapat diatasi.
Regenerasi tanaman melalui embriogenesis somatik mempunyai tahapan spesifik, yaitu 1) inisiasi pro-embrio, 2) proliferasi kalus embriogenik, 3) pra-pendewasaan embrio somatik, 4) pra-pendewasaan embrio somatik, dan 5) perkecambahan (Arnold et al., 2002). Setiap tahap perkembangan embrio somatik tersebut ditentukan oleh komposisi media, zat pengatur tumbuh dan bahan lain yang berbeda di setiap tahapnya.
Perkembangan embrio somatik J. curcas antara lain dipengaruhi oleh sukrosa, auksin serta PEG yang ditambahkan pada media. Konsentrasi sukrosa yang ditambahkan pada media memiliki peran penting pada tahap perkembangan embrio somatik. Jumlah sukrosa secara signifikan mempengaruhi perkembangan sel dan regenerasi embrio somatik. Pada Dianthus caryophyllus dan Acacia sinuata konsentrasi sukrosa mempengaruhi induksi kalus embriogenik, perkembangan dan regenerasi embrio somatik (Gerdakaneh, et al., 2009). Auksin 2,4-D efektif meningkatkan proliferasi embrio somatik. Keberadaan 2,4-D di dalam media dapat memblok ekspresi gen-gen yang dibutuhkan untuk perubahan bentuk perkembangan tahap jantung, kotiledon dan perkecambahan sehingga tahap proliferasi embrio dapat terus berlangsung (Sianipar et al., 2007).
Polyethylene-glycol (PEG) merupakan polimer dengan berat molekul tinggi yang mampu memberikan stimulasi efek stres kekeringan untuk meningkatkan perkecambahan serta proses konversi embrio somatik menjadi planlet, sebagaimana proses yang terjadi pada perkecambahan embrio zigotik (biji). Hal ini telah dibuktikan pada penelitian embrio somatik Pinus sylvestris,
Abies numidica, Panax ginseng, Cryptomeria japonica, Abies cephalonica, Aesculus hippocastanum dan Carica papaya (Koehler et al. 2013).
Embrio somatik yang telah berkecambah dan menjadi planlet perlu mendapatkan sitokinin dan auksin yang memadai di dalam media untuk memacu pertumbuhan tunas dan akar. Sitokinin yang paling umum digunakan pada kultur
in vitro untuk meningkatkan pertumbuhan tunas diantaranya Kinetin, BAP (6-Benzyl amino purine) dan Zeatin. Zeatin adalah adalah sitokinin yang disintesis secara alamiah, sedangkan Kinetin dan BAP adalah sitokinin sintetik. Selain zeatin, terdapat pula sitokinin alami yang lebih murah dibandingkan zeatin yakni 2-iP (isopentenyl-aminopurine) (Zulkarnain, 2009).
Pemberian sitokinin baik Kinetin, 2-iP atau BAP sering menyebabkan bagian pangkal batang planlet membesar dan mengkalus. Planlet yang bagian pangkalnya mengkalus dan tidak terbentuk akar sulit beradaptasi pada tahap aklimatisasi. Untuk mengatasi permasalahan ini maka diperlukan optimasi pembentukan akar agar dapat meningkatkan persentase keberhasilan dalam aklimatisasi. Konsentrasi yang diperlukan dalam menginduksi akar bervariasi, tergantung dari jenis tanaman, jenis eksplan dan jenis auksin yang digunakan.
1-Naphthalen-eacetic-acid (NAA) pada konsentrasi 0,05-1 mg/l, dan Indole-3-butyric acid (IBA) pada konsentrasi 0.5–3 mg/l (Rostiana dan Seswita, 2007).
Penelitian ini merupakan penelitian lanjutan dari penelitian sebelumnya yang telah berhasil menginisiasi terbentuknya embrio somatik J. curcas kultivar Dompu dengan perlakuan jenis eksplan dan zat pengatur tumbuh auksin. Embrio somatik telah berhasil diinisiasi dari aksis embrio dewasa yang dikulturkan pada media MS padat dengan penambahan picloram dengan konsentrasi 2.5; 3.0; 4.0 dan 5 mg/l. Embriogenesis somatik terbentuk secara langsung maupun tidak langsung dari potongan eksplan. Proliferasi kalus embriogenik dan pendewasaan embrio somatik terjadi pada media MS padat tanpa penambahan zat pengatur tumbuh (Al-Hafiizh, et al., 2012). Optimasi media untuk tahap proliferasi, perkecambahan serta pertumbuhan planlet dan aklimatisasi hasil regenerasi embrio somatik J. curcas perlu dikembangkan, dengan demikian penelitian ini dilakukan untuk optimasi proliferasi embrio somatik, perkecambahan, optimasi pertumbuhan planlet yang diregenerasikan dari embrio somatik serta optimasi pengakaran planlet J. curcas dan aklimatisasi.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mempelajari pengaruh konsentrasi sukrosa yang dikombinasikan dengan 2,4-D pada media MS terhadap proliferasi embrio somatik J. curcas kultivar Dompu secara in vitro. Mengetahui pengaruh konsentrasi sukrosa yang dikombinasikan dengan PEG terhadap perkecambahan embrio somatik J. curcas. Mengetahui pengaruh zat pengatur tumbuh Kinetin, 2-iP dan BAP pada konsentrasi yang berbeda terhadap pertumbuhan planlet J. curcas yang diregenerasikan dari embrio somatik. Mengetahui pengaruh media dasar ½ MS dan MS yang dikombinasikan dengan IAA dan IBA pada konsentrasi yang berbeda terhadap perakaran planlet J. curcas serta mengetahui tingkat keberhasilan aklimatisasi tanaman J. curcas hasil regenerasi embrio somatik.
Manfaat Penelitian
Manfaat dari kegiatan peneletian ini adalah didapatkan protokol untuk perbanyakan tanaman J. curcas melalui embrio somatik.
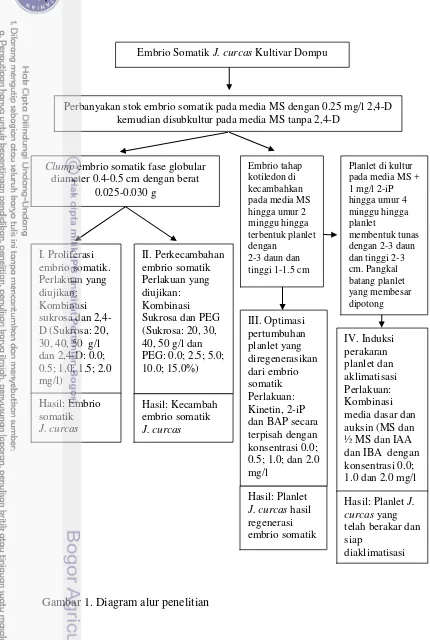
Ruang lingkup penelitian
Gambar 1. Diagram alur penelitian Embrio Somatik J. curcas Kultivar Dompu
Perbanyakan stok embrio somatik pada media MS dengan 0.25 mg/l 2,4-D kemudian disubkultur pada media MS tanpa 2,4-D
2. TINJAUAN PUSTAKA
Jatropha curcas Linn.
Di Indonesia terdapat berbagai jenis tanaman jarak antara lain jarak kepyar (Ricinus communis), jarak bali (Jatropha podagrica), jarak ulung (Jatropha gossypifolia)dan jarak pagar (Jatropha curcas). Di antara tanaman jarak tersebut, jenis yang memiliki potensi sebagai penghasil biofuel adalah jarak pagar (J. curcas) karena bijinya memiliki kandungan minyak yang tinggi yakni sekitar 30-50% (Hariyadi, 2005).
Jatropha curcas merupakan tanaman yang termasuk dalam famili Euphorbiaceae. Tanaman ini berbentuk perdu dengan tinggi 1-7 m, bercabang tidak teratur, dan batangnya berkayu berbentuk silindris. Batang tanaman yang masih muda bergetah jernih. Warna batang muda hijau, sedangkan batang tua berwarna cokelat (Mahmud et al., 2006). Daun tanaman J. curcas lebar berbentuk jantung, bertangkai panjang dengan lekuk tunggal dan bersudut 3 atau 5. Bentuk daun agak menjari (5-7 lekukan) dengan panjang dan lebar 6-15 cm yang tersusun secara selang seling dengan panjang tangkai daun sekitar 4-15 cm. Jatropha curcas mempunyai daun tunggal berwarna hijau muda sampai hijau tua dengan permukaan bagian bawahnya lebih pucat dibandingkan dengan bagian atasnya (Mahmud et al., 2006).
Jatropha curcas merupakan tanaman monoecious, bunganya bersifat uniseksual dan tersusun dalam rangkaian. Bunga memiliki 5 sepala dan 5 petala yang berwarna hijau kekuningan atau coklat kekuningan. Bunga betina lebih besar dibandingkan dengan bunga jantan (Hasnam, 2007). Jatropha curcas mempunyai buah berbentuk bulat telur dengan diameter 2-4 cm. Panjang buah 2 cm dengan ketebalan sekitar 1 cm. Buahnya berbentuk kendaga, saat muda berwarna hijau, apabila telah matang berwarna kuning dan berubah menjadi kehitaman jika telah masak dan kering. Buah J. curcas masak 40-50 hari setelah pembuahan (Prastiwi
et al., 2006). Buah memiliki tiga rongga dengan setiap rongganya berisi satu biji (Hambali, 2007).
Jatropha curcas menyerbuk silang, hal ini dikarenakan adanya perbedaan waktu mekarnya bunga jantan dan bunga betina yang biasa disebut protandri dan protogeni (Hasnam, 2007). Jatropha curcas merupakan spesies diploid dengan jumlah kromosom 2n=2x= 22. Karyotipe J. curcas tersusun atas 22 kromosom metasentrik dan submetasentrik yang berukuran relatif kecil berkisar antara 1.71-1.24 μm (Carvalho et al., 2008). Ukuran genom J. curcas juga relatif kecil yaitu sekitar 286 Mb (Sato et al., 2011).
Jatropha curcas tumbuh di dataran rendah sampai ketinggian sekitar 1000 m dpl dengan curah hujan berkisar antara 300-600 mm/tahun. Suhu yang sesuai untuk pertumbuhan tanaman J. curcas adalah 26-30oC. Tanaman J. curcas
merupakan tanaman tahunan, relatif tahan terhadap cekaman kekeringan karena memiliki sistem perakaran yang mampu menahan air. Tanaman ini dapat tumbuh pada tanah berpasir, tanah berbatu, tanah lempung, atau tanah liat. Tanaman ini juga dapat beradaptasi pada tanah yang kurang subur, memiliki drainase baik, tidak tergenang, dan pH tanah 5.0-6.5 (Hambali, 2007).
drainase jelek tidak cocok untuk pertumbuhannya. Jatropha curcas tidak tahan tergenang maupun pada tanah dengan kadar garam tinggi. Tanaman berproduksi baik pada berbagai macam jenis tanah yang memiliki solum tanah dalam dan aerasi baik. Tanaman J. curcas toleran terhadap kondisi kering, sehingga tanaman ini dapat tumbuh pada areal bercurah hujan 300-600 mm/tahun. Apabila tiga bulan pertama penanaman cukup air, maka tanaman J. curcas pada musim kemarau dapat tumbuh dan terus berbuah sepanjang tahun walaupun tanpa pengairan (Soenardi, 2002).
Selain sebagai sumber energi domestik, J. curcas juga dapat dimanfaatkan sebagai minyak pelumas, pestisida, sabun dan bahan obat-obatan. Getah tanaman
J. curcas berfungsi sebagai desinfektan pada infeksi rnulut dan menghentikan pendarahan. Daunnya dapat digunakan sebagai obat malaria serta keperluan memijat. Minyak yang dihasilkan dapat pula digunakan untuk obat penyakit kulit. Tanaman J. curcas juga dapat dimanfaatkan sebagai sekat bakar (fire break) untuk mengurangi kerusakan hutan akibat terjadinya kebakaran serta dapat dimanfaatkan pula sebagai tanaman fitoremediasi pada lahan bekas tambang (Syaufina dan Mansur, 2005). Perbaikan genetik J. curcas dapat diarahkan pada jumlah bunga betina lebih banyak, produksi biji dan kandungan minyak tinggi, genjah, tahan terhadap hama dan penyakit, toleran terhadap kekeringan, tanaman pendek dan percabangan banyak (Divakara et al., 2010).
Embriogenesis Somatik
Proses pembentukan embrio (embriogenesis) pada tanaman dapat dibedakan menjadi dua tipe yaitu embriogenesis zigotik dan embriogenesis somatik. Embriogenesis zigotik adalah proses pembentukan embrio dari zigot (hasil pembuahan sel telur), sedangkan embriogenesis somatik adalah proses perkembangan sel somatik menjadi tanaman lengkap melalui karakteristik stadia pembentukan embrio tanpa melalui peleburan sel gamet (Santos et al., 2006). Pada embriogenesis somatik, sel somatik dalam kondisi terinduksi akan menghasilkan sel-sel embriogenik, kemudian mengalami serangkaian perubahan morfologi dan biokimia dan akhirnya terbentuk embrio somatik (Jimenez, 2001). Semua sel somatik di dalam tanaman mengandung seri informasi yang dibutuhkan untuk menghasilkan tanaman utuh dan fungsional, sehingga embriogenesis somatik merupakan bentuk dasar dari sifat totipotensi (total genetic potential) sel (Quiroz-Figueroa et al., 2006).
Embriogenesis somatik dapat diaplikasikan untuk memproduksi bibit bermutu secara masal yang seragam dan stabil, regenerasi tanaman transgenik, dan produksi biji sintetis (artificial seed) (Mamiya dan Sakamoto, 2001; Nieves
et al., 2001; Brischia et al., 2002). Regenerasi tanaman melalui somatik embriogenesis mempunyai tahapan inisiasi kalus embriogenik, proliferasi kalus embriogenik, pra-pendewasaan embrio somatik, pendewasaan embrio somatik, dan perkecambahan (Arnold et al., 2002).
1). Inisiasi Pro-embrio (Kalus Embriogenik)
terjadinya pembelahan sel dan diferensiasi jaringan pada organ multiselular. Untuk inisiasi dan pendewasaan embrio somatik diperlukan NH4+ dan NO3
-dengan konsentrasi yang tepat. Konsentrasi NO3- yang terlalu tinggi dapat
meningkatkan pH media sehingga kalus tidak dapat membentuk embrio somatik (Vesco dan Guerra, 2001).
Induksi kalus embriogenik umumnya dilakukan dengan cara menumbuhkan eksplan pada media yang mengandung auksin dengan konsentrasi antara 2.5-5 mg/l. Zat pengatur tumbuh 2,4-D merupakan auksin yang efektif untuk induksi kalus embriogenik (Hoque et al., 2007; Sisharmini et al., 2010; Manil dan Senthil, 2011). Untuk inisiasi kalus embriogenik dibutuhkan ekpresi gen yang dikendalikan oleh auksin. Auksin penting dalam reaktivasi siklus sel dan inisiasi pembentukan embrio somatik. Auksin mampu mengaktivasi sinyal tranduksi sehingga sel dapat melakukan pemograman kembali ekspresi gen yang diperlukan untuk menginduksi kalus embriogenik (Arnold et al. 2002). Di samping auksin, sitokinin seperti 6-Benzylaminopurine (BAP), Thidiazuron
(TDZ) atau Kinetin dapat diberikan secara bersamaan (Carimi et al., 2005; Arunyanart dan Chaitrayagun, 2005; Te-chato et al., 2006; Thengane et al., 2006; Yan et al., 2009; Manzila et al., 2010; Malabadi et al, 2011).
2) Proliferasi Kalus Embriogenik
Zat pengatur tumbuh merupakan faktor penting penentu keberhasilan embriogenesis somatik. Peran auksin dalam embriogenesis somatik antara lain untuk inisiasi embriogenesis somatik, induksi kalus embriogenik, dan proliferasi kalus embriogenik (Manil dan Senthil, 2011).
Proliferasi kalus embriogenik dapat dilakukan pada media padat atau cair yang mengandung zat pengatur tumbuh yang sama dengan konsentrasi yang sama atau lebih rendah dari tahap inisiasi. Media proliferasi kalus sangat bervariasi untuk setiap jenis tanaman, diantaranya ½ MS +0.5 µM TDZ untuk cabai (Khan
et al., 2006); ½ MS + 13.62 mM TDZ atau 0.5 mg/l BAP untuk Phalaenopsis
(Chen dan Chang, 2004; Gow et al., 2009); B5 + 1.5 mg/l 2,4-D untuk Allium chinense (Yan et al., 2009); MS + 1,5-2.0 mg/l 2,4-D untuk krisan (Manil dan Senthil, 2011); MS + 4.52 μM 2,4-D + 2.27 μM TDZ untuk mangga (Malabadi et al, 2011). Pada tahap proliferasi kalus embriogenik, kehadiran auksin masih diperlukan. Auksin berfungsi untuk mencegah terjadinya diferensiasi sel ke tahap selanjutnya. Pada krisan media MS yang mengandung 1.5 mg/l 2,4-D menghasilkan proliferasi kalus tertinggi (Manil dan Senthil, 2011).
Produksi embrio meningkat pada media bertekanan osmotik tinggi (Percy
induksi kalus embriogenik, perkembangan serta regenerasi embrio somatik (Gerdakaneh, et al., 2009).
3) Pra-pendewasaan Embrio Somatik
Pra-pendewasaan merupakan tahap transisi dari proembrio menjadi embrio somatik. Tahap ini mencegah proses proliferasi kalus embriogenik dan menstimulasi tahap awal pembentukan embrio somatik. Kalus embriogenik umumnya disubkultur pada media tanpa zat pengatur tumbuh atau media yang mengandung sitokinin seperti BAP tanpa auksin. Auksin pada media menyebabkan kalus terus melakukan proliferasi sehingga konversi kalus menjadi embrio menjadi terhambat. Pada krisan pra pendewasaan embrio somatik berhasil dilakukan pada media MS + 1 mg/l BAP (Manil dan Senthil, 2011). Gow et al.
(2009) melaporkan bahwa untuk pra pendewasaan embrio pada Phalaenopsis amabilis dilakukan pada media ½ MS + 0.5 mg/l BAP. Saxena et al. (2012) menyatakan bahwa tahap prapendewasaan embrio somatik J. curcas optimal pada media yang mengandung 0.2 mg/l indole-3-acetic-acid (IAA) yang dikombinasikan dengan 1.5 mg/l 6-benzil-amino-purin (BAP).
4) Pendewasaan Embrio Somatik
Pendewasaan adalah tahap perkembangan dari struktur globular membentuk kotiledon dan primordia akar. Penambahan Abscisic Acid (ABA) dan sukrosa dengan konsentrasi 40-50 g/l umumnya ditambahkan pada tahap ini (Rai
et al., 2008; Husni et al., 2010; Malabadi et al., 2011). Persentase pematangan embrio somatik jambu meningkat sejalan dengan peningkatan konsentrasi ABA (0.01-1.0 mg/l) (Rai et al., 2008). Peningkatan sukrosa yang tinggi (5%) berpengaruh terhadap pematangan embrio somatik Phalaenopsis amabilis (Chen dan Chang, 2004). Pada tahap ini sering juga digunakan auksin dan atau TDZ pada konsentrasi 0-1 mg/l seperti pada cabai (Khan et al., 2006) dan Garcinia indica (Thengane et al., 2006).
5) Perkecambahan
Perkecambahan adalah fase dimana embrio somatik membentuk tunas dan akar. Perkecambahan umumnya dilakukan pada media dengan kandungan zat pengatur tumbuh rendah (sampai 1 mg/l) atau bahkan pada media tanpa zat pengatur tumbuh (Purnamaningsih, 2002; Arnold et al., 2002). Setiap jenis tanaman membutuhkan media perkecambahan yang berbeda-beda, pada
Optimasi Pertumbuhan Tunas dan Pengakaran Planlet J. curcas Hasil Regenerasi Embrio Somatik dengan Penambahan Zat Pengatur Tumbuh.
Kehadiran sitokinin seperti Kinetin, 2-iP dan BAP sangat penting dalam pertumbuhan planlet dengan metode kultur jaringan. Meskipun demikian, pemberian sitokinin secara berkepanjangan dapat menimbulkan hasil yang tidak diinginkan karena tunas dapat mengalami habituasi terhadap sitokinin yakni kurangnya pembentukan akar dan terjadinya hambatan pada respon pembungaan. Hal ini disebabkan oleh pertumbuhan tunas pucuk yang berlebihan dan mengakibatkan penghambatan pembentukan akar serta penundaan induksi pertumbuhan generatif (Zulkarnain, 2009).
Planlet yang mengalami habituasi harus segera diberi perlakuan untuk menormalkan kondisi planlet. Perlakuan 123.03 µM IBA selama 4 minggu terhadap kultur pucuk Kalmia latifolia yang mengalami habituasi sitokinin menghasilkan proporsi planlet normal yang tinggi, merangsang pertumbuhan akar dan mengurangi pembentukan pucuk majemuk (Rice at al., 1992; Zulkarnain, 2009).
Dalam kultur jaringan terdapat dua jenis zat pengatur tumbuh yang sangat penting yaitu sitokinin dan auksin. Zat pengatur tumbuh ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur jaringan. Auksin banyak digunakan dalam kultur jaringan untuk perpanjangan sel, pembentukan akar adventif, dan menghambat pembentukan tunas adventif dan tunas ketiak. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen menentukan arah perkembangan suatu kultur. Penambahan auksin atau sitokinin eksogen, mengubah level zat pengatur tumbuh di dalam sel (Rostiana dan Seswita, 2007). Jika rasio auksin endogen dalam tanaman seimbang dengan sitokinin, akan mengarah pada pembentukan kalus, sementara jika auksin lebih tinggi daripada sitokinin organogenesis cenderung mengarah pada pembentukan akar. Konsentrasi hormon yang tinggi akan menghambat pertumbuhan, meracuni bahkan mematikan tanaman (George et al., 2007; Kristina dan Syahid 2012).
Auksin sintetik yang sering digunakan untuk menginduksi perakaran in vitro adalah 1-Naphthalen-eacetic-acid (NAA) dan Indole-3-butyric acid (IBA) pada konsentrasi rendah. Konsentrasi yang diperlukan untuk menginduksi akar bervariasi, tergantung dari jenis tanaman, jenis eksplan dan jenis auksin yang digunakan. Indole 3-Acetic Acid (IAA) digunakan pada kisaran konsentrasi 0.1– 10 mg/l, NAA antara 0.05–1.00 mg/l dan IBA antara 0.5–3.0 mg/l (Rostiana dan Seswita, 2007).
3. METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Mei-November 2013 di laboratorium Biak Sel dan Jaringan Tanaman, Pusat Penelitian Bioteknologi LIPI Cibinong Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini antara lain embrio somatik J. curcas
kultivar Dompu yang telah diinisiasi dari eksplan hipokotil embrio buah dewasa yang diambil dari kebun percobaan PT Indocement Tunggal Tbk, Cibinong dari penelitian sebelumnya (Al-Hafiizh, et al., 2012). Media kultur yang digunakan adalah media MS (Murashige dan Skoog, 1962; Lampiran 1), zat pengatur tumbuh 2,4-Dichloro-phenoxyacetic-acid (2,4-D), Kinetin, isopentenyl-amino-purine (2-iP), 6-Benzyl-amino-purine (BAP), Indole-3-acetic-acid (IAA), Indole-3-butyric-acid (IBA), Polyethylene-glycol (PEG) dan sukrosa. Alat yang digunakan adalah peralatan kultur jaringan diantaranya: laminar air flow cabinet,
autoclave, shaker, timbangan analitik, pH meter, erlenmeyer, pipet, pisau skalpel, lampu spiritus, alkohol, dan hand sprayer.
Analisis Data
Data kuantitatif dianalisis dengan menggunakan Analysis of Variance (ANOVA) untuk mengetahui pengaruh antar perlakuan. Perlakuan yang berbeda nyata kemudian diuji lanjut dengan menggunakan Duncan’s Multiple Range Test (DMRT) dengan tingat kepercayaan 1 dan 5%.
Model statistik percobaan acak lengkap dengan dua faktor menurut Mattjik dan Sumertajaya (2006), yaitu:
Yijk= μ + αi+ βj+ (αβ)ij+ εijk
Dimana,
i = 1,2…,r; j=1,2…,r; k=1,2…r
Yijk = Nilai pengamatan pada faktor pertama taraf ke-1 faktor kedua taraf ke-j
dan ulangan ke-k
μ = Rataan umum αi = Pengaruh utama Faktor pertama
βj = Pengaruh utama Faktor kedua
(αβ)ij = Pengaruh interaksi faktor pertama ke-i dan faktor kedua ke-j
εijk = Pengaruh galat untuk pengamatan taraf ke (i,j,k)
Pelaksanaan Percobaan
Percobaan I. Proliferasi Embrio Somatik
Setiap perlakuan terdiri dari 5 cawan petri sebagai ulangan, setiap cawan petri diisi dengan 5 clump embrio somatik pada fase globular dengan diameter 0.4-0.5 cm dengan berat 0.025-0.030 g, sehingga jumlah satuan percobaan sebanyak 500 satuan percobaan. Peubah yang diamati adalah diameter clump embrio, skor jumlah embrio, warna embrio, ukuran embrio dan morfologi embrio. Pengamatan diameter clump embrio dan skor jumlah embrio dilakukan seminggu sekali pada berukuran kecil ukuran diameter: 0-0.5 mm, sedang ukuran diameter: 0.5-2 mm, besar ukuran diameter: lebih dari 2 mm.
Percobaan II. Perkecambahan Embrio Somatik
Tahap penelitian ini bertujuan untuk mengetahui pengaruh perlakuan sukrosa yang dikombinasikan dengan PEG terhadap perkecambahan embrio somatik J. curcas. Pada tahap ini, embrio somatik hasil proliferasi dikulturkan pada media padat sesuai perlakuan.
Media dasar yang digunakan adalah media MS (Murashige dan Skoog, 1962; Lampiran 1). Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor. Faktor pertama adalah konsentrasi sukrosa dengan 4 taraf yaitu: 20, 30, 40, dan 50 g/l media sedangkan faktor kedua adalah konsentrasi PEG dengan 5 taraf yaitu: 0.0; 2.5; 5.0; 10.0; dan 15.0%. Setiap perlakuan terdiri dari 5 cawan petri sebagai ulangan dimana setiap cawan petri diisi dengan 5 clump embrio somatik pada fase globular dengan diameter 0.4-0.5 cm dengan berat 0.025-0.030 g, sehingga jumlah satuan percobaan sebanyak 500 satuan percobaan. Peubah yang diamati adalah diameter clump embrio, jumlah embrio berkecambah/clump, persentase kecambah normal, persentase clump
berkecambah, warna embrio, serta struktur dan morfologi. Pengamatan jumlah embrio berkecambah/clump dilakukan seminggu sekali pada umur 0-8 minggu setelah kultur. Pengamatan diameter clump embrio, persentase kecambah normal, persentase clump berkecambah, warna embrio, serta morfologi kecambah dilakukan pada umur 8 minggu setelah kultur.
Percobaan III. Optimasi Pertumbuhan Planlet Hasil Regenerasi Embrio Somatik
Tujuan tahap penelitian ini adalah untuk mengetahui pengaruh Kinetin, 2-iP dan BAP pada konsentrasi yang berbeda terhadap pertumbuhan planlet J. curcas yang berasal dari embrio somatik.
pengatur tumbuh selama 8 minggu hingga membentuk kecambah. Kecambah embrio kemudian disubkultur ke media MS hingga umur 2 minggu. Planlet yang telah membentuk tunas dengan 2-3 daun dan tinggi 1-1.5 cm serta telah memiliki calon akar kemudian dikulturkan pada media sesuai dengan perlakuan. Peubah yang diamati adalah jumlah daun, tinggi tanaman, jumlah buku, jumlah akar, bobot basah serta morfologi planlet. Pengamatan jumlah daun dan tinggi tanaman dilakukan seminggu sekali pada umur 0-8 minggu setelah kultur. Pengamatan jumlah buku, jumlah akar, bobot basah serta morfologi planlet dilakukan pada umur 8 minggu setelah kultur.
Percobaan IV. Induksi Pengakaran Planlet dan Aklimatisasi
Tujuan dari penelitian tahap ini adalah untuk mengetahui pengaruh media dasar ½MS dan MS yang dikombinasikan dengan konsentrasi Indole-3-Acetic Acid (IAA) dan Indole-3-butyric acid (IBA) terhadap pengakaran planlet J. curcas
yang berasal dari embrio somatik.
Media dasar yang digunakan adalah media MS (Murashige dan Skoog, 1962; Lampiran 1). Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan dua faktor. Faktor pertama adalah media dasar ½MS dan MS sedangkan faktor kedua adalah zat pengatur tumbuh IAA dan IBA dengan konsentrasi 0.0, 1.0 dan 2.0 mg/l. Setiap perlakuan terdiri dari 4 ulangan. Jumlah satuan percobaan adalah sebanyak 40 satuan percobaan. Planlet berasal dari embrio yang dikulturkan pada media MS tanpa penambahan zat pengatur tumbuh selama 8 minggu hingga membentuk kecambah. Kecambah embrio kemudian dikulturkan pada media MS dengan penambahan 1 mg/l 2-iP hingga umur 4 minggu. Bagian pangkal batang planlet yang membesar dan membentuk kalus dipotong, kemudian planlet yang telah membentuk tunas dengan 2-3 daun dan tinggi 2-3 cm tersebut dikulturkan pada media sesuai dengan perlakuan. Peubah yang diamati adalah tinggi tanaman, jumlah daun, jumlah akar, panjang akar, serta morfologi planlet (warna, bentuk dan performa planlet). Pengamatan tinggi tanaman, jumlah daun, jumlah akar dan panjang akar dilakukan seminggu sekali pada umur 0-8 minggu setelah kultur. Pengamatan morfologi planlet dilakukan pada umur 8 minggu setelah kultur.
4. HASIL DAN PEMBAHASAN
Percobaan I. Optimasi Proliferasi Embrio Somatik J. curcas
Pola perkembangan diameter clump embrio somatik J. curcas yang ditanam pada media MS dengan penambahan 20, 30, 40 dan 50 g/l sukrosa yang dikombinasikan dengan 0.0, 0.5, 1.0, 1.5 dan 2.0 mg/l 2,4-D pada umur 1-8 minggu setelah kultur dapat dilihat pada Gambar 2. Pada perlakuan 20 g/l sukrosa pertumbuhan diameter kalus embrio somatik mulai terlihat pada umur 1 minggu. Diameter terus meningkat antara minggu ke 1-6 setelah kultur. Pada umur 6 minggu pertumbuhan diameter embrio dengan perlakuan 1.5 mg/l 2,4-D terhenti dan tidak menunjukkan adanya peningkatan hingga umur 8 minggu. Pada perlakuan tanpa penambahan 2,4-D pertumbuhan diameter embrio lambat, namun terdapat pertumbuhan hingga embrio berumur 8 minggu. Pada umur 6-8 minggu diameter embrio pada perlakuan 1 mg/l 2,4-D tidak berbeda dengan 0.5, 1.5 dan 2.0 mg/l 2,4-D (Gambar 2A).
Gambar 2. Pertumbuhan diameter clump embrio somatik J. curcas umur 0-8 minggu pada media MS dengan penambahan 2,4-D pada konsentrasi 0.0, 0.5, 1.0, 1.5 dan 2.0 mg/l yang dikombinasikan dengan sukrosa. A 20 g/l sukrosa, B 30 g/l sukrosa, C 40 g/l sukrosa dan D 50 g/l sukrosa.
B
C D
Pada perlakuan 30 g/l sukrosa pertumbuhan diameter kalus embrio somatik J. curcas meningkat mulai minggu ke 1 hingga minggu ke 6 setelah kultur. Pada perlakuan 0.5 mg/l 2,4-D pertumbuhan diameter embrio meningkat lebih tinggi pada umur 3-5 minggu tetapi pada umur 6-8 minggu diameter embrio tidak berbeda dengan perlakuan 1.0, 1.5 dan 2.0 mg/l 2,4-D. Diameter embrio pada umur 8 minggu hampir sama untuk seluruh perlakuan kecuali perlakuan tanpa 2,4-D yang lebih rendah (Gambar 2B).
Perlakuan 40 g/l sukrosa, dengan penambahan 0-2 mg/l 2,4-D pertumbuhan menghasilkan diameter embrio relatif sama pada umur 1-5 minggu. Pada umur 6-8 minggu pertumbuhan diameter embrio pada perlakuan 1 mg/l 2,4-D meningkat sehingga pada umur 8 minggu lebih tinggi dibandingkan dengan perlakuan lainnya (Gambar 2C).
Pada perlakuan 50 g/l sukrosa pertumbuhan diameter embrio untuk seluruh perlakuan 2,4-D menunjukkan peningkatan pada umur 1-8 minggu setelah kultur. Pada umur 1-2 minggu pertumbuhan diameter embrio lambat sedangkan pada umur 2-8 minggu pertumbuhan diameter embrio meningkat. Pada umur 8 minggu diameter embrio tertinggi terdapat pada perlakuan tanpa 2,4-D kemudian diikuti perlakuan 1.0, 1.5, 2.0 dan 0.5 mg/l 2,4-D (Gambar 2 D).
Pada beberapa tanaman auksin 2,4-D lebih efektif dibandingkan dengan IAA atau IBA untuk meningkatkan proliferasi kultur embriogenik. Pada konsentrasi rendah 2,4-D dapat memblok ekspresi gen-gen yang dibutuhkan untuk perubahan bentuk perkembangan tahap hati, kotiledon dan perkecambahan sehingga proses proliferasi dapat terus berlangsung (Sianipar et al., 2007). Hal ini serupa pada embrio J. curcas pada perlakuan 30 dan 40 g/l sukrosa dimana pada perlakuan 1 mg/l menghasilkan diameter embrio yang tinggi (Gambar 2B dan 2C).
C
Gambar 3. Jumlah embrio J. curcas pada media dengan penambahan 0.0, 0.5, 1.0, 1.5 dan 2.0 mg/l 2,4-D yang dikombinasikan dengan sukrosa umur 1-8 minggu. A 20 g/l sukrosa, B 30 g/l sukrosa, C 40 g/l sukrosa dan D 50 g/l sukrosa. Skor jumlah embrio 1: Sangat sedikit (jumlah embrio <20 ); 2: sedikit (jumlah embrio 21-40), 3: Sedang (jumlah embrio 41-60), 4: Banyak (jumlah embrio 61-80), 5: Sangat banyak (jumlah embrio >80)
Pada 30 g/l sukrosa yang dikombinasikan dengan 0.5, 1.0 dan 2.0 mg/l 2,4-D menyebabkan jumlah embrio meningkat pada umur 1 minggu. Jumlah embrio somatik terus mengalami pertambahan secara cepat pada umur 2-6 minggu setelah kultur. Pada umur 5-8 minggu perlakuan 0.5, 1.0, 1.5, dan 2.0 mg/l 2,4-D menghasilkan jumlah embrio yang relatif sama. Jumlah embrio somatik terendah terdapat pada perlakuan tanpa penambahan 2,4-D (Gambar 3B). Pada 40 g/l sukrosa, perlakuan 0.5, 1.5, dan 2.0 mg/l 2,4-D jumlah embrio meningkat pada umur 1 minggu. Jumlah embrio meningkat dengan pesat pada umur 2-5 minggu. Pada umur 6-8 minggu pertambahan jumlah embrio melambat pada perlakuan 0.5, 1.0, 1.5, dan 2.0 mg/l 2,4-D. Perlakuan tanpa 2,4-D pertambahan jumlah embrio lebih rendah dibandingkan dengan perlakuan lainnya pada umur 2-8 minggu (Gambar 3C). Pada 50 g/l sukrosa dikombinasikan dengan 0.5, 1.0, 1.5, dan 2.0 mg/l 2,4-D, jumlah embrio meningkat pada umur 1-3 minggu, lebih tinggi dibandingkan pada perlakuan tanpa 2,4-D. Akan tetapi pada umur 4-8 minggu pertambahan jumlah embrio pada perlakuan tanpa 2,4-D meningkat dengan pesat sehingga memiliki jumlah embrio lebih tinggi dibandingkan dengan perlakuan lainnya (Gambar 3D).
A B
Pada 50 g/l sukrosa tanpa penambahan 2,4-D memiliki jumlah embrio lebih tinggi karena dalam proses pembelahan sel embrio somatik J. curcas sudah mendapatkan cukup stres dari tingginya konsentrasi sukrosa yang diberikan. Hal ini mengakibatkan perkembangan embrio kearah pendewasaan terhambat sehingga proliferasi embrio dapat terus berlangsung. Pada konsentrasi sukrosa tinggi pemberian 2,4-D mengakibatkan jumlah embrio somatik J. curcas
menurun. Zat pengatur tumbuh 2,4-D tidak hanya berperan pada proses diferensiasi jaringan tanaman tetapi juga potensi embriogenik yang dimiliki oleh tanaman tersebut (Kim et al., 2000). Konsentrasi sukrosa yang diberikan berperan sangat penting pada tahap proliferasi embrio somatik. Sukrosa pada beberapa konsentrasi yang berbeda signifikan mempengaruhi perkembangan sel serta proliferasi embrio somatik. Pada tanaman Fragaria xananassa konsentrasi sukrosa yang berbeda berpengaruh terhadap proliferasi kalus embriogenik, perkembangan embrio serta regenerasi embrio somatik (Gerdakaneh et al., 2009).
Pengaruh perlakuan faktorial antara konsentrasi sukrosa dengan 2,4-D berpengaruh nyata terhadap diameter kalus dan jumlah embrio somatik J. curcas
pada umur 8 minggu. Pada diameter kalus pengaruh tunggal perlakuan sukrosa pada beberapa konsentrasi berbeda sangat nyata dan pengaruh konsentrasi 2,4-D berbeda nyata akan tetapi pengaruh interaksi dari kombinasi perlakuan tidak signifikan. Pada peubah jumlah embrio somatik selain pengaruh faktor tunggal sukrosa dan 2,4-D terdapat pula pengaruh interaksi antara konsentrasi sukrosa yang dikombinasikan dengan 2,4-D (Tabel 1; Lampiran 2.1).
Tabel 1. Anova pada perlakuan sukrosa yang dikombinasikan dengan 2,4-D untuk peubah diameter kalus dan jumlah embrio somatik umur 8 minggu
No Variabel Signifikansi
Sukrosa 2,4-D Sukrosa x 2,4-D
1 Diameter embrio ** * ts
2 Skor jumlah embrio somatik ** ** **
Keterangan : *: signifikan pada taraf <5%; **: sangat signifikan pada taraf <1%; ts: tidak signifikan
Diameter clump embrio dan skor jumlah embrio somatik pada umur 8 minggu dapat dilihat pada Tabel 2. Diameter clump embrio somatik J. curcas
fotosintesis (Winata, 1988). Dengan sukrosa yang cukup, maka pembelahan, pembesaran dan diferensiasi sel dapat berlangsung dengan baik (Srilestari, 2005). Oleh karena itu pada konsentrasi sukrosa 50 g/l tanpa penambahan 2,4-D embrio tetap dapat berproliferasi lebih cepat dan jumlah embrio yang dihasilkan lebih banyak dibandingkan dengan 20 dan 40 g/l sukrosa tanpa 2,4-D (Tabel 2).
Tabel 2. Diameter clump embrio dan rerata skor jumlah embrio pada proliferasi embrio somatik J. curcas kultivar Dompu umur 8 minggu
Keterangan: Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji jarak berganda Duncan pada α = 5%. Skor jumlah embrio 1: Sangat sedikit (jumlah embrio <20 ); 2: sedikit (jumlah embrio 21-40), 3: Sedang (jumlah embrio 41-60), 4: Banyak (jumlah embrio 61-80), 5: Sangat banyak (jumlah embrio >80)
menurun drastis diakibatkan oleh pembelahan dan diferensiasi sel terganggu sehingga potensi sel embriogenik akan hilang secara bertahap (Bhojwani dan Razdan, 1996).
Warna, ukuran serta morfologi embrio somatik J. curcas umur 8 minggu dapat dilihat pada Tabel 3. Warna dan ukuran embrio somatik J. curcas bervariasi sesuai dengan perlakuan baik pada 20, 30, 40 maupun 50 g/l sukrosa. Sebagian besar embrio didominasi warna kuning-putih dengan ukuran embrio kecil hingga sedang. Pada 20 g/l sukrosa yang dikombinasikan dengan 0.0, 0.5 dan 1.0 mg/l 2,4-D, embrio somatik yang terbentuk berwarna kuning-hijau, sedangkan pada perlakuan 1.5 dan 2.0 mg/l 2,4-D didominasi oleh warna kuning coklat dan putih dengan ukuran embrio somatik berkisar antara kecil-sedang. Pada perlakuan 30 g/l sukrosa tanpa 2,4-D warna embrio somatik cenderung hijau dan perlakuan dengan penambahan 0.5, 1.0, 1.5 dan 2.0 mg/l 2,4-D terlihat putih kekuningan dan kuning cerah dengan ukuran embrio berkisar kecil-sedang.
Pada 40 g/l sukrosa yang dikombinasikan dengan 2,4-D pada konsentrasi yang berbeda respon embrio lebih bervariasi. Pada perlakuan tanpa penambahan D warna embrio kuning-hijau sedangkan pada perlakuan 0.5 dan 1.0 mg/l 2,4-D embrio berwarna kuning-putih dan kuning-cerah, sementara pada perlakuan dengan 1.5 mg/l 2,4-D berwarna kuning-hijau dengan ukuran embrio somatik berkisar kecil hingga sedang, sementara pada perlakuan 2.0 mg/l 2,4-D embrio berwarna putih hijau dengan ukuran besar. Hal serupa juga terlihat pada perlakuan 50 g/l sukrosa bahwa pemberian 2,4-D pada berbagai konsentrasi menghasilkan variasi warna dan ukuran embrio somatik (Tabel 3).
Pada media dengan 20 dan 30 g/l sukrosa tanpa 2,4-D proliferasi embrio somatik minim terjadi bahkan mengarah pada maturasi dan perkecambahan (Tabel 3). Pada 40 dan 50 g/l sukrosa tanpa 2,4-D tidak membuat proliferasi terhenti atau mengarah ke maturasi akan tetapi proliferasi tetap berlangsung. Hal ini ditunjukkan dari nilai diameter embrio yang tinggi serta masih banyak terdapat embrio dalam fase globular (Tabel 3). Saat kultur embriogenik ditanam pada media tanpa auksin maka proses yang menghambat diferensiasi sel terhenti kemudian embrio pada tahap globular mengalami perkembangan ke tahap selanjutnya. Proses diferensiasi terjadi dengan terbentuknya formasi protoderm di sekitar embrio globular. Tahap globular kemudian berkembang ke tahap pendewasaan (Bhojwani dan Razdan, 1996).
Tabel 3. Warna, ukuran embrio serta morfologi embrio somatik J. curcas kultivar
20 0 hijau kecil-sedang Sebagian besar embrio telah membentuk kotiledon dan berkecambah
0.5 kuning, kehijauan
kecil-sedang Globular, bulat, kotiledon yg terbentuk mengarah ke pembentukan kalus kembali, terbentuk kalus remah
1 hijau sedang-besar Seluruh embrio somatik berubah menjadi kalus remah baru
1.5 kuning kecoklatan
kecil-sedang Globular, bulat, sebagian embrio berubah menjadi kalus remah
2 putih kekuningan
kecil-sedang Globular, bulat, sebagian terbentuk kotiledon, terbentuk kalus remah 30 0 hijau kecil-sedang Sebagian besar embrio telah membentuk
kotiledon dan berkecambah
kecil-sedang Sebagian kecil embrio masih berbentuk Globular, sebagian embrio membesar dan membentuk kalus remah, kotiledon yg terbentuk mengarah ke pembentukan kalus remah kembali.
1.5 kuning cerah kecil-sedang Globular, bulat, sebagian membentuk kotiledon, sebagian terbentuk kalus remah 2 Putih
kekuningan
kecil- sedang Globular, bulat, sebagian membentuk kotiledon, terbentuk embrio baru
0.5 kuning cerah kecil-sedang Globular, sebagian terbentuk kotiledon, terbentuk kalus remah baru
1 kuning putih kecil-sedang Globular bulat, sebagian sampai tahap kotiledon, terbentuk embrio baru berukuran kecil, tidak ada kalus remah 1.5 kuning hijau kecil-sedang Embrio sampai tahap torpedo, kotiledon,
terbentuk embrio baru berukuran kecil, tidak terbentuk kalus remah
2 putih hijau besar Ukuran embrio membesar membentuk kalus remah baru
50 0 kuning cerah kecil Globular, bulat, terbentuk embrio baru berukuran kecil, tidak terbentuk kalus remah 0.5 kuning hijau kecil-sedang Globular, bulat, sebagian sampai tahap
kotiledon, terbentuk kalus remah 1 putih hijau sedang-besar Ukuran embrio membesar dan terbentuk
kalus remah, kotiledon berubah menjadi kalus remah kembali
1.5 kuning putih kecil-sedang Globular bulat, terbentuk kalus remah, kotiledon mengarah ke pembentukan kalus remah kembali
Berbeda dengan perlakuan sukrosa dengan konsentrasi lebih rendah, pada 50 g/l sukrosa tanpa pemberian 2,4-D proses proliferasi sangat dominan terjadi dan sebagian besar embrio berada pada fase globular (Gambar 4). Selain adanya pengaruh stres osmotik yang mempengaruhi peningkatan proliferasi pada perlakuan 50 g/l sukrosa, hal ini terjadi karena akumulasi auksin endogen dari embrio somatik yang dalam konsentrasi rendah dapat memacu laju proliferasi. Setelah embrio somatik terbentuk maka embrio tersebut mampu mensintesa auksin endogen dalam selnya sendiri melalui alternative pathway sehingga auksin yang sebelumnya berperan dalam menginduksi embrio berubah menjadi senyawa penghambat pendewasaan embrio sehingga proliferasi dapat terus berlangsung (Zimmerman, 1993).
Gambar 4. Proliferasi embrio somatik J. curcas pada media MS yang mengandung 20, 30, 40 dan 50 g/l sukrosa dikombinasikan dengan 0.0, 0.5, 1.5, dan 2.0 mg/l 2,4-D umur 8 minggu (Perbesaran 12,5 kali)
2,4-D (mg/l)
Sukrosa (g/l)
20 30 40 50
0
0.5
1
1.5
Kombinasi 30 g/l sukrosa dengan 1.0 mg/l 2,4-D menghasilkan diameter
clump untuk fase globular yang tinggi, akan tetapi fase embrio yang terbentuk sangat beragam mulai dari fase globular, jantung, torpedo dan kotiledon. Sebagian besar didominasi oleh embrio dengan fase globular (Gambar 4). Pada media dengan 10-30 g/l sukrosa tanpa penambahan zat pengatur tumbuh, kultur embrio somatik J. curcas mengarah pada tahap pendewasaan dan perkecambahan tanpa melalui proses proliferasi kalus embriogenik. Sementara itu, embrio yang dikulturkan pada media dengan penambahan 2,4-D konsentrasi tinggi, tahap proliferasi tidak berlangsung dengan optimal dan bahkan kehilangan potensi embriogeniknya. Pada perlakuan ini terbentuk kalus remah asimetris. Pemberian 2,4-D pada konsentrasi optimal secara signifikan mampu menghambat proses pendewasaan dan perkecambahan embrio somatik sehingga proses proliferasi serta terbentuknya embrio sekunder dapat terus berlangsung (Lin-Cai et al., 2011).
Percobaan II. Perkecambahan Embrio Somatik J. curcas
Sukrosa yang dikombinasikan dengan PEG dapat menstimulasi pendewasaan dan perkecambahan embrio somatik J. curcas. Jumlah embrio berkecambah/ clump umur 0-8 minggu dapat dilihat pada Gambar 5. Pada 20 g/l sukrosa embrio mulai berkecambah pada umur 1 minggu pada perlakuan 0.0, 2.5, dan 5.0% PEG. Jumlah embrio berkecambah pada perlakuan 2.5 dan 5.0% PEG meningkat pada umur 2-5 minggu, kemudian terhenti pada umur 6-7 minggu dan meningkat lagi pada umur 8 minggu. Pada perlakuan tanpa PEG pertumbuhan jumlah embrio mengalami peningkatan pada umur 3-8 minggu. Pada perlakuan 10.0 dan 15.0% PEG pertumbuhan jumlah embrio berkecambah lambat. Pada umur 8 minggu jumlah embrio berkecambah paling sedikit terdapat pada perlakuan 15.0% PEG (Gambar 5A).
Pada 30 g/l sukrosa tanpa PEG dan dengan 2.5% PEG embrio mulai berkecambah pada umur 1 minggu dan terus mengalami peningkatan hingga umur 6 minggu setelah kultur kemudian menurun setelah umur 6 minggu. Pada perlakuan 5.0% PEG embrio mulai berkecambah pada umur 3 minggu. Jumlah embrio berkecambah meningkat dengan pesat pada umur 4-8 minggu setelah kultur. Pada perlakuan 10.0 dan 15.0% PEG embrio mulai berkecambah pada umur 5 minggu. Pertambahan jumlah embrio berkecambah terjadi pada umur 6-8 minggu pada perlakuan 10.0% PEG, sementara pada perlakuan 15.0% PEG jumlah embrio berkecambah tidak mengalami peningkatan pada umur 6-8 minggu. Pada umur 8 minggu jumlah embrio tertinggi terdapat pada perlakuan 5.0% PEG. Perlakuan 2.5, 10.0, dan 15.0% PEG lebih rendah dibandingkan perlakuan tanpa PEG (Gambar 5B).
Pada umur 8 minggu jumlah embrio berkecambah tertinggi terdapat pada perlakuan 5.0% PEG diikuti perlakuan 0.0, 2.5, 10.0 dan 15.0% PEG (Gambar 5C).
Pada 50 g/l sukrosa yang dikombinasikan dengan 0.0 dan 2.5% PEG embrio mulai berkecambah pada umur 1 minggu setelah kultur. Pada perlakuan tanpa PEG jumlah embrio terus meningkat hingga umur 5 minggu sementara pada perlakuan 2.5% PEG jumlah embrio berkecambah terus meningkat hingga umur 6 minggu. Pada perlakuan 5.0% PEG embrio mulai berkecambah pada umur 2 minggu setelah kultur dan terus meningkat hingga umur 8 minggu setelah kultur. Pada perlakuan 10.0% PEG embrio mulai berkecambah pada umur 6 minggu dan terus meningkat hingga umur 8 minggu akan tetapi pertumbuhannya lebih lambat dibandingkan dengan perlakuan 0.0, 2.5 dan 5.0% PEG. Pada perlakuan 15.0% PEG tidak terdapat embrio somatik yang berkecambah. Pada umur 8 minggu jumlah embrio berkecambah tertinggi terdapat pada perlakuan 5.0% PEG diikuti perlakuan 2.5, 0.0, 10.0 dan 15.0% PEG (Gambar 5D).
Gambar 5. Jumlah embrio berkecambah per clump embrio somatik J. curcas umur 0-8 minggu pada media MS dengan perlakuan PEG dengan konsentrasi 0.0, 2.5, 5.0, 10.0 dan 15.0 % yang dikombinasikan dengan sukrosa. A. 20 g/l sukrosa, B. 30 g/l Sukrosa, C. 40 g/l Sukrosa dan D. 50 g/l sukrosa.
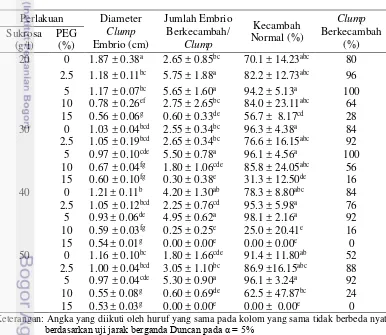
Sukrosa dan PEG pada berbagai konsentrasi berpengaruh nyata terhadap diameter clump embrio, jumlah kecambah/clump serta persentase kecambah normal embrio somatik J. curcas pada umur 8 minggu. Dari ketiga peubah tersebut, selain mempunyai pengaruh tunggal dari perlakuan sukrosa dan PEG pada konsentrasi yang berbeda terdapat pula pengaruh interaksi dengan tingkat
A B
signifikansi sangat nyata. Pada peubah diameter clump embrio dan jumlah kecambah/ clump pengaruh tunggal sukrosa dan PEG sangat nyata sedangkan pada peubah persentase kecambah normal pengaruh tunggal dari konsentrasi sukrosa berbeda nyata dan pengaruh konsentrasi PEG berbeda sangat nyata (Tabel 4; Lampiran 2.2).
Tabel 4. Anova pada perlakuan sukrosa yang dikombinasikan dengan PEG untuk peubah diameter kalus, jumlah kecambah/clump serta persentase kecambah normal pada umur 8 minggu setelah kultur.
No Variabel Signifikansi
Sukrosa PEG Sukrosa x PEG
1 Diameter clump embrio ** ** **
2 Jumlah kecambah/ clump ** ** **
3 Persentase kecambah normal * ** **
Keterangan: * : signifikan pada taraf <5%; **: sangat signifikan pada taraf <1%
Diameter clump embrio, jumlah embrio berkecambah, persentase kecambah normal serta persentase clump berkecambah pada umur 8 minggu dapat dilihat pada Tabel 5. Pemberian PEG memperlambat pertumbuhan diameter
clump embrio J. curcas pada minggu ke-8 setelah kultur, dengan semakin tingginya konsentrasi PEG yang diberikan maka diameter embrio semakin lambat pertumbuhannya (Tabel 5). Hal ini mengindikasikan bahwa pemberian PEG dapat memberikan stres kekeringan yang mengakibatkan pembentukan embrio somatik baru terhambat dan mengarahkan pertumbuhan embrio ke arah maturasi dan perkecambahan. Polyethylene-glycol (PEG) merupakan polimer dengan berat molekul tinggi yang mampu memberikan stimulasi efek stres kekeringan untuk meningkatkan perkecambahan serta proses konversi embrio somatik menjadi planlet, sebagaimana proses yang terjadi pada perkecambahan embrio zigotik (biji). Hal ini telah dibuktikan pada penelitian embrio somatik pada tanaman
Pinus sylvestris, Abies numidica, Panax ginseng, Cryptomeria japonica, Abies cephalonica, Aesculus hippocastanum dan C. papaya (Koehler et al., 2013).
Jumlah embrio berkecambah/clump terbanyak terdapat pada perlakuan 20 g/l sukrosa yang dikombinasikan dengan 2.5 dan 5.0% PEG, 30 g/l sukrosa yang dikombinasikan dengan 5.0% PEG, 40 g/l sukrosa tanpa PEG dan kombinasi dengan 5.0% PEG serta 50 g/l sukrosa yang dikombinasikan dengan 5.0% PEG berbeda nyata dengan perlakuan lainnya. Pada perlakuan tanpa pemberian PEG pada 20, 30, dan 50 g/l sukrosa jumlah embrio berkecambah/clump yang terbentuk lebih sedikit dibandingkan dengan perlakuan dengan 2.5 dan 5.0% PEG. Pada 20, 30, 40 dan 50 g/l sukrosa yang dikombinasikan dengan 10.0% PEG serta 20 dan 30 g/l sukrosa yang dikombinasikan dengan 15.0% PEG jumlah embrio berkecambah/clump semakin menurun. Pada 40 dan 50 g/l sukrosa yang dikombinasikan dengan 15% PEG bersifat lethal bagi embrio somatik J. curcas
sehingga tidak ada embrio yang mampu berkecambah (Tabel 5).