GAMBARAN SEL RADANG PADA SEKUM AYAM YANG
TERINFEKSI
Eimeria
spp. SECARA ALAMI DAN TELAH
DIBERI EKSTRAK ETANOL DAUN
Cassia siamea
Lamk.
ARUM PRAMESTHI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Gambaran Sel Radang pada Sekum Ayam yang Terinfeksi Eimeria spp. Secara Alami dan Telah Diberi Ekstrak Etanol Daun Cassia siamea Lamk. adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2011
Arum Pramesthi
ABSTRAK
ARUM PRAMESTHI. Gambaran Sel Radang pada Sekum Ayam yang Terinfeksi Eimeria spp. Secara Alami dan Telah Diberi Ekstrak Etanol Daun Cassia siamea Lamk. Dibimbing oleh SRI UTAMI HANDAJANI dan
EKOWATI HANDHARYANI.
Penelitian ini bertujuan untuk mengetahui respon peradangan pada sekum ayam petelur jantan yang terinfeksi Eimeria spp. secara alami dan telah diberi ekstrak etanol daun Cassia siamea Lamk (C. siamea). Sembilan puluh ayam petelur digunakan dalam penelitian ini dan dibagi menjadi 6 kelompok yaitu 1) kelompok KN (kontrol negatif), 2) kelompok KP (kontrol positif), 3) kelompok KO (kontrol obat), 4) kelompok J1 (ekstrak etanol daun C. siamea
dengan dosis 4.09 mg/0.5 ml), 5) kelompok J2 (ekstrak etanol daun C. siamea dengan dosis 8.18 mg/0.5 ml), dan 6) kelompok J3 (ekstrak etanol daun C. siamea dengan dosis 16.38 mg/0.5 ml). Hasil dari penelitian ini menunjukkan bahwa ekstrak etanol daun C. siamea dengan dosis 4.09 mg/0.5 ml, 8.18 mg/0.5 ml, dan 8.18 mg/0.5 ml mampu meningkatkan jumlah makrofag, limfosit dan sel plasma. Sementara jumlah heterofil dan eosinofil tidak berubah. Hasil ini mendukung bahwa ekstrak etanol daun C. siamea merupakan imunostimulan.
ABSTRACT
ARUM PRAMESTHI. Inflammatory Cells in Caecum of Chickens that
Naturally Infected with Eimeria spp. and Treated Using Extract Ethanol of Cassia siamea Lamk. Leaves. Supervised by SRI UTAMI HANDAJANI and
EKOWATI HANDHARYANI.
This study was aimed to investigate inflammatory responses on the caecum of male laying pullets, that have been naturally infected with Eimeria spp. and then treated with extract ethanol of Cassia siamea Lamk (C. siamea.) leaves. Ninety laying pullets were used in this research, and divided into 6 groups such as 1) KN (negative control) group, 2) KP (positive control) group, 3) KO (medicine
control) group, 4) J1 (extract ethanol of C. siamea leaves with dose 4.09 mg/0.5 ml) group, 5) J2 (extract ethanol of C. siamea leaves with dose
8.18 mg/ 0.5 ml) group, and 6) J3 (extract ethanol of C. siamea leaves with dose
16.38 mg/0.5 ml) group. The results showed that extract ethanol of C. siamea leaves with dose 4.09 mg/0.5 ml, 8.18 mg/0.5 ml, and 16.38 mg/0.5 ml
increased the number of macrophages, lymphocytes and plasma cells. While the numbers of eosinophils and heterophils does not change. This results were also supported that extract ethanol of C. siamea leaves is an immunostimulant.
© Hak Cipta Milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
GAMBARAN SEL RADANG PADA SEKUM AYAM YANG
TERINFEKSI
Eimeria
spp. SECARA ALAMI DAN TELAH
DIBERI EKSTRAK ETANOL DAUN
Cassia siamea
Lamk.
ARUM PRAMESTHI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Gambaran Sel Radang pada Sekum Ayam yang Terinfeksi Eimeria spp. Secara Alami dan Telah Diberi Ekstrak Etanol Daun Cassia siamea Lamk.
Nama : Arum Pramesthi NIM : B04061975
Disetujui,
Dr. drh. Sri Utami Handajani, MS drh. Ekowati Handharyani, MSi, PhD, APVet
Ketua Anggota
Diketahui,
Dr. dra. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan karunianya-Nya sehingga penulis dapat menyelesaikan Tugas Akhir berupa penulisan skripsi untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Dalam kesempatan ini penulis ingin mengucapkan terima kasih dan penghargaan setinggi-tingginya kepada:
1. Dr. drh. Rr. Sri Utami Handajani, MS selaku dosen pembimbing skripsi atas segala bimbingan, arahan serta ilmu yang tidak pernah habis diberikan.
2. Drh. Ekowati Handharyani, MSi, PhD, APVet selaku dosen pembimbing skripsi atas segala bimbingan, arahan serta ilmu yang tidak pernah habis diberikan.
3. Dr. drh. Dwi Jayanti Gunandini, MSi, selaku dosen pembimbing akademik atas segala bimbingan dan nasihatnya.
4. Dr. drh. Aryani Sismin Satyaningtijas, MSc selaku dosen penguji skripsi yang telah memberi banyak masukan, saran, dan arahan.
5. Dr. drh. Yusuf Ridwan MS dan drh. Herwin Pisestyani, MSi selaku dosen penilai dan moderator seminar yang banyak memberikan masukan.
6. Kepada Ayah dan Ibu: Marsidi dan Mariyam atas doa, kasih sayang, dan dukungan yang selalu diberikan, baik moril dan materil.
7. Kepada adikku Singgih Candra Prayoga yang selalu menjadi penyemangat bagi penulis.
8. Teman seperjuangan Melati Anggraini, Fifit Diah, dan Yulia Riza yang tiada henti memberi bantuan, semangat, dan dukungan hingga penelitian ini dapat terselesaikan dengan baik.
9. Sahabat-sahabat tercinta „Al-Quds‟ (Septi Rubiyani, Ria Octaviani, dan Septiani PH) untuk semangat, canda tawa, doa, dukungan, dan nasihat sehingga penulis dapat menyelesaikan tugas skripsi dengan baik.
10. Sahabat yang tidak kalah pentingnya yang selalu membantu dan memberikan nasehat Gita Rima, Made Fera, Apri, Nanda, Novi Tandria, Novi HS, Yuvita,
sahabat 1ββ+, serta Aesculapius ‟4γ yang selalu kompak.
11. Kepada seluruh staf dan pegawai laboratorium Protozoologi dan laboratorium Patologi Fakultas Kedokteran Hewan serta pihak-pihak yang tidak mungkin untuk disebutkan satu persatu yang turut membantu dalam menyelesaikan skripsi ini.
Penulis menyadari dalam penulisan ini masih banyak terdapat kekurangan, namun penulis masih mengharapkan karya tulis ini dapat bermanfaat bagi pihak yang berkepentingan dan membutuhkannya.
Bogor, Januari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Metro, Lampung pada tanggal 13 Mei 1988 dari Ayah Marsidi, SPd dan Ibu Mariyam, SPd. Penulis merupakan anak pertama dari dua bersaudara. Pendidikan penulis diawali di TK Aisiyah Metro pada tahun 1992-1994. Kemudian melanjutkan pendidikan di SDN 2 Karangrejo Metro pada tahun 1994-2000, SLTPN 2 Metro pada tahun 2000-2003, dan SMAN 1 Metro pada tahun 2003-2006. Pada tahun 2006 penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Setelah menyelesaikan Program Tingkat Persiapan Bersama (TPB) penulis memilih mayor Kedokteran Hewan. Selama menempuh pendidikan di jenjang perguruan tinggi, penulis aktif di Himpunan Minat dan Profesi Ruminansia dan Ikatan Mahasiswa Kedokteran Hewan Indonesia. Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan, penulis melakukan penelitian dan menyusun skripsi yang
berjudul “Gambaran Sel Radang pada Sekum Ayam yang Terinfeksi Eimeria spp.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA ... 3
Eimeria spp. ... 3
Klasifikasi dan Etiologi ... 3
Siklus Hidup ... 4
Gejala Klinis ... 6
Patologi Anatomi ... 6
Histopatologi ... 7
Peradangan ... 8
Makrofag ... 8
Limfosit ... 10
Eosinofil ... 11
Heterofil ... 12
Basofil... 13
Cassia siamea ... 13
Bahan Kimia daun Cassia siamea ... 14
MATERI DAN METODE ... 16
Waktu dan Tempat penelitian ... 16
Bahan dan Alat ... 16
Metode Penelitian ... 16
Hewan Coba ... 16
Koksidiostat ... 16
Pembuatan Ekstrak daun C. siamea Lamk ... 17
Disain Penelitian ... 17
Infeksi Eimeria spp. ... 19
Pengamatan Ookista ... 20
Pemeriksaan Histopatologi ... 20
Pengolahan Data ... 21
x
SIMPULAN DAN SARAN ... 29
Simpulan ... 30
Saran ... 30
DAFTAR PUSTAKA ... 31
DAFTAR TABEL
Halaman
1. Rataan jumlah ookista pada feses berdasarkan hari nekropsi. ... 22
2. Rataan jumlah makrofag pada sekum ayam ... 24
3. Rataan jumlah limfosit pada sekum ayam ... 25
4. Rataan jumlah sel plasma pada sekum ayam ... 26
5. Rataan jumlah eosinofil pada sekum ayam ... 27
DAFTAR GAMBAR
Halaman
1. Skema siklus hidup Eimeria spp. ... 5
2. Makrofag pada jaringan ... 9
3. Limfosit pada jaringan ... 10
4. Eosinofil pada jaringan ... 12
5. Heterofil pada darah ... 12
6. Basofil pada jaringan ... 13
7. Cassia siamea ... 14
8. Bagan pemeriksaan feses, pencekokan dan nekropsi ... 19
DAFTAR LAMPIRAN
Halaman
1. Analisis data makrofag hari ke-0 dengan uji Analysis of Varian (ANOVA)- SPS System dan uji Duncan Multiple Range Test. ... 34
2. Analisis data makrofag hari ke-6 dengan uji Analysis of Varian (ANOVA)- SPS System dan uji Duncan Multiple Range Test. ... 35
3. Analisis data limfosit hari ke-0 dengan uji Analysis of Varian (ANOVA)- SPS System dan uji Duncan Multiple Range Test. ... 36
4. Analisis data limfosit hari ke-6 dengan uji Analysis of Varian (ANOVA)- SPS System dan uji Duncan Multiple Range Test. ... 37
5. Analisis data sel plasma hari ke-0 dengan uji Analysis of Varian (ANOVA) SPS System dan uji Duncan Multiple Range Test. ... 38
6. Analisis data sel plasma hari ke-6 dengan uji Analysis of Varian (ANOVA) SPS System dan uji Duncan Multiple Range Test. ... 39
7. Analisis data eosinofil hari ke-0 dengan uji Analysis of Varian (ANOVA)- SPS System dan uji Duncan Multiple Range Test. ... 40
8. Analisis data eosinofil hari ke-6 dengan uji Analysis of Varian (ANOVA)- SPS System dan uji Duncan Multiple Range Test. ... 41
9. Analisis data heterofil hari ke-0 dengan uji Analysis of Varian (ANOVA)- SPS System dan uji Duncan Multiple Range Test. ... 42
PENDAHULUAN
Latar Belakang
Koksidiosis atau yang lebih dikenal dengan penyakit berak darah
merupakan salah satu penyakit yang sering menyerang ayam. Koksidiosis
disebabkan oleh protozoa genus Eimeria. Protozoa ini menyerang usus dan
sekum hewan. Infeksi protozoa ini menyebabkan hewan menjadi lemah dan
mengalami penurunan produksi yang signifikan. Koksidiosis menyebar dengan
sangat cepat dan infeksi oleh penyakit ini juga dapat terjadi berulang. Besarnya
kerugian yang ditimbulkan oleh koksidiosis menyebabkan penyakit ini menjadi
ancaman yang besar bagi bidang perunggasan.
Berbagai jenis obat telah dikembangkan untuk menangani kasus koksidiosis,
obat yang biasa digunakan diantaranya adalah zoalin, amprolium, dan
sulfaquinoxalin (Chapman 2000). Di sisi lain, pemberian obat-obat tersebut
memberikan efek negatif yaitu timbulnya residu pada daging ataupun telur, serta
menyebabkan munculnya galur Eimeria yang resisten (Chapman 2000;
Edgar 1993). Residu obat dan resistensi galur Eimeria merupakan masalah baru,
sehingga mendorong para peneliti untuk mengembangkan obat alternatif
koksidiosis. Obat alternatif yang dapat digunakan adalah herbal yang
diperkirakan aman dan ampuh dalam mengendalikan penyakit tersebut.
Cassia siamea merupakan tanaman berkayu keras yang sering digunakan
sebagai peneduh tepi jalan. Di Indonesia tanaman ini disebut sebagai johar.
C. siamea juga memiliki beberapa sebutan, di Sumatra disebut johor atau
bujuk atau dulang sedang di Jawa sering disebut sebagai juwar. Menurut Mursito
(2002) daun C. siamea mengandung bahan aktif seperti flavonoid, karotenoid, dan
tanin yang diduga dapat mengobati koksidiosis dengan cara meningkatkan respon
imun hewan terinfeksi. Kemampuan C. siamea sebagai imunostimulan dapat
dilihat salah satunya melalui respon sel pertahanan tubuh yang muncul saat terjadi
2
Tujuan Penelitian
Penelitian ini bertujuan mengetahui respon peradangan pada sekum ayam
yang terinfeksi Eimeria spp. secara alami dan setelah diberikan ekstrak etanol
daun C. siamea.
Manfaat Penelitian
Hasil penelitian ini diharapkan memberikan informasi data dasar tentang
ekstrak etanol daun C. siamea sebagai alternatif penanganan prefentif koksidiosis
TINJAUAN PUSTAKA
Eimeria spp.
Klasifikasi dan Etiologi
Eimeria adalah protozoa yang menyebabkan koksidiosis. Protozoa jenis
ini memperbanyak diri di dalam usus atau sekum, fase skizogoninya
menyebabkan kerusakan pada saluran pencernaan. Terdapat 9 spesies Eimeria
yang biasa menyerang ayam yaitu E. acervulina, E. brunetti, E. maxima, E. mitis,
E. mivati, E. necatrix, E. praecox, E. tenella, dan E. hagani. Eimeria bersifat
spesies spesifik artinya jenis Eimeria yang ditemukan pada ayam tidak dapat
menginfeksi jenis unggas atau hewan lain atau sebaliknya (Tabbu 2002).
Menurut Levine (1995), Eimeria diklasifikasikan sebagai berikut:
filum : Apicomplexa kelas : Sporozoasida subkelas : Coccidiasina ordo : Cocidia subordo : Eimeriorina famili : Eimeriidae genus : Eimeria
Menurut Tabbu (2002), spesies Eimeria dapat diidentifikasi berdasarkan
sifat-sifat yang spesifik, yaitu lokasi lesi yang ditimbulkan, gambaran lesi secara
makroskopis, ukuran, warna dan bentuk ookista, ukuran skizon dan merozoit,
lokasi parasit di dalam jaringan, periode prepaten minimal pada infeksi buatan,
waktu minimal untuk sporulasi, dan sifat imunogenisitas terhadap galur Eimeria
yang murni. Setiap spesies Eimeria memiliki lokasi infeksi yang berbeda-beda,
adapun lokasi infeksi antara lain adalah sepertiga usus bagian depan, sepertiga
usus bagian tengah, atau sepertiga usus bagian belakang. E. acervulina menyerang
sepertiga usus bagian depan, menyebabkan enteritis ringan hingga sedang dan
menyebabkan penebalan mukosa usus. E. acervulina ini biasanya menyerang
ayam tua. E. necratix dan E. maxima menyerang sepertiga usus bagian tengah.
E. necratix merupakan jenis Eimeria yang sangat patogen dan mengakibatkan
angka kematian yang tinggi. E. necratix menyebabkan enteritis berat pada
sepertiga usus bagian tengah. Enteritis sering disertai dengan perdarahan dan
4
sedang hingga berat pada sepertiga usus bagian tengah, kadang-kadang disertai
dengan penebalan dinding usus dan perdarahan di usus. E. brunetti dan E. tenella
merupakan spesies yang menyerang daerah sepertiga usus belakang. E. tenella
menyebabkan enteritis dan perdarahan di sekum sehingga terjadi berak darah.
E. tenella bersifat patogen dan menyebabkan kematian yang tinggi pada anak
ayam (Tabbu 2002).
Siklus hidup Eimeria spp.
Eimeria memiliki siklus hidup yang kompleks dan khas, yang berlangsung
sekitar 7 hari. Siklus hidup parasit ini pada ayam meliputi beberapa tahapan, yaitu
tahap aseksual dan tahap seksual (Levine 1995). Menurut Soulsby (1982), tahap
aseksual terjadi pada fase skizogoni sedangkan tahap seksual terjadi pada fase
gemetogoni.
Soulsby (1982) menyatakan bahwa ookista merupakan zigot berdinding
tebal yang terdapat di dalam feses hospes yang terinfeksi. Ookista terdiri atas satu
sel tunggal yang memulai proses sprorulasi untuk menghasilkan stadium infektif
dengan membentuk sporokista dalam waktu sekitar 48 jam. Sporulasi ookista
berlangsung optimal pada temperatur 25-30 °C dengan kelembaban dan kadar
oksigen yang tinggi. Noble & Glenn (1989) mengemukakan bahwa setiap ookista
infektif mengandung 4 sporokista dan setiap sporokista mengandung 2 sporozoit.
Menurut Tabbu (2002), siklus hidup Eimeria spp. dimulai saat ookista diingesti,
maka dinding ookista akan digerus di dalam ventrikulus, ookista akan pecah dan
membebaskan sporokista. Kimotripsin dan garam empedu di dalam usus akan
membantu pembebasan sporozit dari sporokista. Sporozoit yang bebas akan
memasuki sel epitel dan berkembang menjadi tropozoit, setelah matang tropozoit
akan pecah sehingga merusak epitel usus. Setelah pecah tropozoit akan
berkembang menjadi merozoit. Merozoit ini akan masuk ke dalam epitel kembali
dan berkembang menjadi fase tropozoit tahap 2 dan pecah membentuk merozoit.
Tahap tropozoit dan merozoit ini disebut sebagai fase skizogoni yang dapat
berulang antara 2 hingga 4 kali. Tabbu (2002) juga menyatakan bahwa ada
beberapa spesies, seperti E. tenella dan E. necatrix menyebabkan kerusakan
generasi kedua E. tenella dan E. necatrix menyebabkan mukosa usus mengalami
ruptur karena membebaskan merozoitnya yang berukuran besar. Selanjutnya
merozoit akan berkembang menjadi makrogamet dan mikrogamet. Sejumlah
mikrogamet yang kecil dan motil akan mencari dan bersatu dengan makrogamet.
Zigot yang dihasilkan akan menjadi dewasa dan membentuk ookista yang akan
dibebaskan dari mukosa usus dan bercampur dengan feses. Seluruh proses
membutuhkan 4-6 hari, namun ookista dapat dikeluarkan selama beberapa hari
setelah siklus pembelahan berakhir (Tabbu 2002). Skema siklus hidup Eimeria
spp. disajikan pada Gambar 1.
Gambar 1 Skema siklus hidup Eimeria spp. [Sumber: Novindo 2009]
Ookista bersifat resisten terhadap kondisi lingkungan dan berbagai
6
tetapi ketahanannya di dalam litter hanya beberapa hari karena pengaruh amoniak,
jamur, dan bakteri yang ada di dalam litter. Ookista dapat bertahan selama
beberapa minggu pada kondisi optimal, tetapi akan mati dengan cepat jika kontak
dengan temperatur tinggi, temperatur sangat rendah atau kondisi kekeringan.
Ookista akan mati dengan cepat pada temperatur 55 °C atau pada keadaan beku.
Ookista tersebut dapat juga mati pada temperatur 37 °C selama 2-3 hari. Kejadian
koksidiosis biasanya lebih rendah pada cuaca panas dan kering dibandingkan
dengan cuaca yang dingin dan lembab (Tabbu 2002).
Gejala Klinis
Gejala klinis koksidiosis sangat dipengaruhi oleh spesies Eimeria yang
menginfeksi. Jumlah koksidia yang menginfeksi dan resistensi hospes juga
mempengaruhi gejala klinis yang ditimbulkan (Noble & Glenn 1989). Fase
skizogoni Eimeria terjadi di dalam epitel usus atau sekum, pada fase itu Eimeria
akan menyebabkan kerusakan epitel usus atau sekum. Kerusakan epitel usus
mengakibatkan gangguan proses digesti dan absorbsi nutrien, dehidrasi,
perdarahan, dan menurunnya sistem imun akibatnya ayam menjadi lesu, nafsu
makan turun, produksi turun, dan mudah terserang penyakit (Soulsby 1982).
Infeksi Eimeria tertentu seperti E. tenella dan E. necatrix menunjukkan gejala
klinis berupa berak darah. Berak darah disebabkan adanya perdarahan dan ruptur
pada jaringan usus akibat perkembangan skizon E. tenella dan E. necatrix yang
berukuran besar pada epitel usus. Diagnosis dari penyakit ini adalah dengan
pemeriksaan tinja, kerokan usus atau isi usus. Ayam yang sembuh dari koksidiosis
akan mempunyai sejumlah antibodi yang bersifat sementara terhadap spesies
Eimeria tertentu (Johnson 2004).
Patologi Anatomi
Patologi anatomi yang biasa ditemukan adalah lesi pada bagian serosa usus
atau sekum. Proses yang terjadi adalah intestinum membengkak dan menebal
akibat perkembangan fase skizongoni Eimeria. Tahap lebih lanjut vili megalami
kerusakan sedangkan sel-sel epitel mengelupas dan diganti tiap dua hari akibatnya
mukosa usus atau sekum akan menipis dan tertutup oleh plak berwarna putih yang
Glenn 1989). Usus atau sekum terkadang terlihat pucat dan mengandung cairan
encer. Lesi pada infeksi ringan akan menunjukkan beberapa plak pada setiap
sentimeter. Sebaliknya pada infeksi berat, lesi dapat meluas dan beberapa plak
dapat bersatu. Plak yang mengandung skizon, gametosit, atau ookista yang
sedang berkembang akan ditemukan jika infeksinya berat. Pemeriksaan ulas dari
lesi pada usus akan menunjukkan adanya sejumlah ookista (Tabbu 2002).
Perubahan jaringan juga sangat dipengaruhi oleh spesies Eimeria yang
menginfeksinya (Soulsby 1982). Patologi anatomi yang terlihat pada infeksi
E. tenella ialah hemoragi, petechiae pada bagian serosa, dinding sekum menebal
dan kadang-kadang terdapat massa menyerupai keju di lumen sekum.
E. acervulina menyebabkan mukosa usus tipis dan tertutup oleh plak berwarna
putih, usus berwarna pucat dan mengandung cairan. infeksi ringan E. acervuliana
menunjukkan lesi terbatas hanya di duodenum sedangkan pada infeksi berat lesi
terlihat sepanjang usus. Patologi anatomi yang terjadi pada infeksi ringan
E. brunetti adalah perdarahan petechiae di mukosa, sedangkan pada infeksi berat
terdapat nekrosis dan koagulasi di seluruh mukosa usus. E. maxima menyebabkan
enteritis ringan sampai berat pada jejunum dan ileum, kadang-kadang disertai
penebalan dinding usus. Infeksi E. mitis mengakibatkan ileum pucat dan lunak.
Infeksi E. mivati menyebabkan lesi pada duodenum, jika infeksi telah parah lesi
meluas hingga sekum dan kloaka. Lesi yang ditimbulkan mirip dengan E.
acervulina. E. necatrix mengakibatkan usus bagian tengah akan membengkak,
mukosa menebal, lumen terisi cairan darah, runtuhan jaringan, terlihat plak dan
perdarahan petechiae pada bagian serosa. Perubahan makroskopik yang terjadi
akibat infeksi E. praecox adalah lumen berisi cairan kadang-kadang mengandung
mukus, hemoragi, petechiae pada bagian mukosa duodenum (Johnson 2004).
Hitopatologi
Pemeriksaan mikroskopis pada organ usus atau sekum ditemukan adanya
gametosit intraseluler yang berbentuk ovoid yang terletak di dalam sel epitel pada
vili usus. Pada infeksi yang bersifat moderat hingga berat, maka ujung vili akan
mengalami nekrosis, ditemukan koksidia enterosit sehingga vili akan terpotong
8
terinfeksi E. tenella adalah infiltrasi heterofil pada submukosa dan ditemukannya
skizon pada lamina propria. Sedangkan pada infeksi berat terjadi kerusakan
jaringan, baik pada lapis mukosa maupun muskularis. Sebagai akibat dari
kerusakan sel epitel maka tubuh akan merespon dengan kehadiran sel radang. Sel
radang bertugas memfagositosis benda asing dan sel yang rusak serta
meningkakan sistem imunitas tubuh (Conway & McKenzie 2007).
Peradangan
Menurut Price (1995), radang merupakan suatu reaksi vaskular yang
merupakan pengiriman sel-sel dari aliran darah terhadap suatu rangsang atau
cidera. Jaringan yang mengalami peradangan akan bengkak, kemerahan, panas,
kaku, nyeri, daya gerak berkurang (Sudiono et al. 2003).
Menurut Sudiono et al. (2003), proses peradangan dikelompokkan dalam
3 kejadian yaitu perubahan dalam pembuluh darah (perubahan hemodinamik),
eksudasi cairan (perubahan permeabilitas) dan perubahan eksudasi seluler
(perubahan sel leukosit). Proses tersebut meliputi vasodilatasi pembuluh darah
sehingga aliran pembuluh darah menjadi cepat, permeabilitas kapiler meningkat,
mengalami eksudasi cairan berlebih, konsentrasi eritrosit dalam kapiler, stasis atau
aliran darah yang menjadi lambat, perelakatan dari sel leukosit pada dinding
kapiler (pavementing), kemudian eksudat sel leukosit dari pembuluh darah
bermigrasi ke jaringan (Spector 1993; Sudiono et al. 2003). Ada beberapa tipe sel
pada radang yang mengambil bagian dalam proses radang diantaranya adalah sel
polimorfonuklear (neutrofil, eosinofil, basofil), limfosit, makrofag, dan sel plasma
(Sudiono et al. 2003)
Makrofag
Makrofag merupakan sel yang relatif besar dengan diameter sekitar
10-γ0 μm, bergerak dengan cara ameboid, memberikan respon terhadap
rangsangan kemotaksis tertentu (sitokin dan kompleks antigen-antibodi) dan
mempunyai kemampuan fagositik untuk mencerna mikroorganisme dan sel debris.
Saat melakukan gerak amuboit, makrofag memiliki bentuk yang tidak teratur
(Efendi 2003). Bila dibandingkan dengan neutrofil, makrofag memiliki jangka
banyak jenisnya. Selain itu, makrofag dapat membatasi organisme (agen asing)
yang hidup jika tubuh tidak mampu membunuhnya dengan enzim lisosom.
Apabila makrofag kemudian ikut serta dalam reaksi hipersensitivitas tipe lambat
terhadap organisme tersebut, makrofag sering mengalami kematian dan
melepaskan enzim lisosomnya sehingga menyebabkan nekrosis yang meluas
(Efendi 2003).
Makrofag pada jaringan yang mengalami radang berasal dari monosit darah
yang telah bermigrasi keluar dari pembuluh darah dan mengalami aktivasi di
dalam jaringan. Karena itu makrofag merupakan bagian dari sistem fagosit
mononuklear. Pada jaringan ikat makrofag tersebar secara difus, sedangkan di
organ dijumpai makrofag yang khas seperti sel kupffer (hati), sel mikroglia (otak)
atau makrofag alveolus (paru) (Efendi 2003). Aktivasi makrofag saat bermigrasi
ke daerah yang mengalami peradangan diperlihatkan dalam bentuk ukurannya
yang bertambah besar, sintesis protein, mobilitas, aktivitas fagositik dan
kandungan enzim lisosom yang dimilikinya (Kusmardi et al. 2006). Berikut
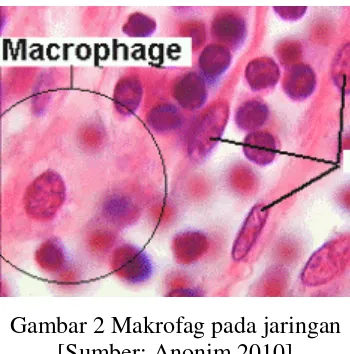
adalah gambar histologi makrofag yang ada pada jaringan.
Gambar 2 Makrofag pada jaringan [Sumber: Anonim 2010]
Aktivasi makrofag diinduksi oleh sinyal berupa sitokin yang diproduksi oleh
limfosit-T yang tersensitisasi (IFN ), endotoksin bakteri, berbagai mediator
selama radang akut dan protein matriks ekstrasel seperti fibronektin. Makrofag
yang sudah teraktivasi siap untuk menjalankan proses fagositosis akan
menghasilkan produk berupa protease asam dan protease netral yang merupakan
mediator kerusakan jaringan pada peradangan, spesies oksigen reaktif berfungsi
10
seperti prostaglandin dan leukotrien merupakan mediator dalam proses
peradangan, sitokin seperti IFN α dan , IL 1, 6 dan 8, faktor nekrosis tumor (TNF α) komponen komplemen dan faktor koagulasi, meliputi protein komplemen
C1-C5, properdin, faktor koagulasi V, VIII dan faktor jaringan serta berbagai
faktor pertumbuhan yang mempengaruhi proliferasi sel otot polos, fibroblas dan
matriks ekstraselular (Kumar et al. 2000; Underwood 1999).
Saat radang terjadi kronik, makrofag dapat berakumulasi dan berproliferasi
di tempat peradangan. Limfosit yang teraktivasi akan mengeluarkan IFN- yang
akan mengaktivasi makrofag. Makrofag teraktivasi, selain bekerja memfagositosis
penyebab radang dan mengeluarkan mediator-mediator lain, juga akan
mengeluarkan IL-1 dan TNF yang akan mengaktivasi limfosit, sehingga dengan
demikian akan membentuk suatu timbal balik antara makrofag dan limfosit, yang
menyebabkan makrofag akan bertambah banyak di jaringan dan menyebabkan
terbentuknya fokus radang. Selain itu makrofag juga dapat berfungsi menjadi sel
besar berinti banyak disebut sel Datia (Kumar et al. 2000; Underwood 1999).
Limfosit
Limfosit memiliki ukuran lebih kecil dibandingkan sel PMN
(polimorfonuklear). Biasanya didominasi dengan inti yang bulat serta
mengandung kromatin yang padat sedang sitoplasmanya sedikit. Limfosit
dibentuk dalam limfonodus dan kadang-kadang dalam folikel limfoit (Dellmann
& Brown 1992). Berikut ini gambar infiltrasi limfosit pada jaringan.
Umur limfosit berkisar 4-5 hari. Fungsi utama dari limfosit adalah
melepaskan antibodi (Partodiredjo 1998; Sudiono et al. 2003). Limfosit terdiri
atas limfosit B (sel plasma) yang bertanggung jawab dalam kekebalan humoral
dan limfosit T yang berperan dalam proses kekebalan seluler. Limfosit T dan
limfosit B sangat berperan dalam kekebalan spesifik. Limfosit T dan limfosit B
bermigrasi ke tempat radang dengan menggunakan beberapa pasangan molekul
adhesi dan kemokin yang serupa dengan molekul yang merekrut monosit.
Limfosit dimobilisasi pada keadaan setiap ada rangsang imun spesifik (infeksi)
dan peradangan yang diperantarai non imun (infark atau trauma jaringan). Telah
disebutkan di atas bahwa aktivasi limfosit memiliki hubungan dengan aktivasi
makrofag sehingg terjadi fokus radang akibat proliferasi dan akumulasi makrofag
di tempat cedera (Kumar et al. 2000; Underwood 1999). Sel plasma merupakan
produk akhir dari aktivasi sel limfosit-B yang mengalami diferensiasi akhir. Sel
plasma dapat menghasilkan antibodi yang diarahkan untuk melawan antigen di
tempat radang atau melawan komponen jaringan yang berubah.
Eosinofil
Eosinofil merupakan leukosit polimorfonuklear yang biasa dijumpai pada
jaringan yang terinfeksi parasit. Keberadaan eosinofil dipicu oleh adanya protein
asing. Eosinofil juga akan bermigrasi dari pembuluh darah dalam jumlah besar
jika terjadi proses penyembuhan dari radang yang nonspesifik (Sudiono et al.
2003).
Ukuran eosinofil sekitar 12-17 µm. Eosinofil mengandung sejumlah zat
kimiawi antara lain histamin, eosinofil peroksidase, lipase, deoksiribonuklease,
ribonuklease, dan beberapa asam amino yang dirilis melalui proses degranulasi
setelah eosinofil teraktivasi. Zat-zat di atas bersifat toksin terhadap parasit dan
jaringan tubuh. Eosinofil merupakan sel substrat peradangan dalam reaksi alergi.
Aktivasi dan pelepasan racun oleh eosinofil diatur dengan ketat untuk mencegah
penghancuran jaringan yang tidak diperlukan (Sudiono et al. 2003). Bentuk
12
. Gambar 4 Eosinofil pada jaringan [Sumber: Caceci 2011]
Heterofil
Heterofil adalah leukosit polimorfonuklear yang berhubungan dengan
pertahanan tubuh terhadap infeksi bakteri dan proses peradangan kecil lainnya,
serta menjadi sel yang pertama hadir ketika terjadi infeksi di suatu tempat.
Heterofil memiliki sifat fagositik yang mirip dengan makrofag. Proses fagositosis
heterofil terdiri dari beberapa tahapan yaitu kemotaksis, perlekatan, penelan dan
pencernaan. Heterofil melawan patogen dengan serangan respiratori menggunakan
berbagai macam substansi beracun yang mengandung bahan pengoksidasi kuat,
seperti hidrogen peroksida, oksigen radikal bebas, dan hipoklorit. Heterofil
merupakan sel radang yang pertama muncul untuk memfagosit benda asing tetapi
heterofil memiliki sediaan energi yang terbatas sehingga tidak mampu bertahan
lama, untuk itu heterofil sering disebut sebagai baris pertahanan pertama. Jumlah
heterofil akan meningkat menjadi sepuluh kali lipatnya jika terjadi inflamasi akut.
Sel hetrofil yang rusak terlihat sebagai nanah (Sudiono et al. 2003).
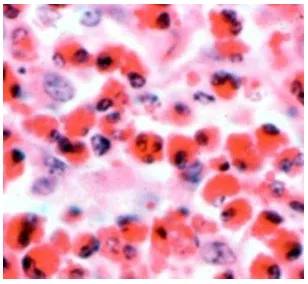
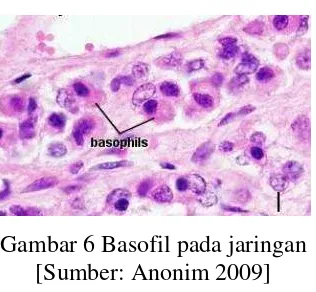
Basofil
Basofil adalah sel meiloid yang jumlahnya paling sedikit dalam darah yaitu
0.5 % dari leukosit darah. Basofil merupakan leukosit polimorfonuklear yang
memiliki ukuran kurang lebih 12 µm. Basofil memiliki satu inti yang besar dan
berbentuk pilihan irreguler, umumnya bentuk huruf S, sitoplasma basofil terisi
granul yang lebih besar, dan seringkali granul menutupi inti, granul bentuknya
irreguler berwarna metakromatik, dengan campuran jenis Romanvaki tampak
lembayung, warna granul ini kuat dengan zat warna yang bersifat basoili. Granul
basofil metakromatik, mensekresi histamin dan heparin. Histamin yang
disekresikan basofil berfungsi untuk meningkatkan aliran darah ke jaringan yang
cedera sedangkan heparin berfungsi membantu mencegah pembekuan darah
intravaskular. Basofil berfungsi membangkitkan perbaharuan akut pada tempat
deposisi antigen(Dellmann & Brown 1992).
Gambar 6 Basofil pada jaringan [Sumber: Anonim 2009]
Cassia siamea
Cassia siamea merupakan tumbuhan asli dari Asia Selatan dan Asia
Tenggara yang hidup pada ketinggian 1-1.000 m (Kardono 2003). Tinggi pohon
antara 2-20 m dengan batang lurus dan pendek. Kulit batang berwarna abu-abu
kecoklatan pada cabang yang muda, percabangan melebar membentuk tajuk yang
padat dan membulat. Daun C. siamea bertulang menyirip genap. Menurut
Kardono (2003), secara umum daun C. siamea berwarna hijau sampai hijau tua
berbentuk oval dengan ujung membulat, panjang 3-7,5 cm lebar atara 1-2,5 cm.
C. siamea merupakan tanaman yang tidak berasa dan tidak berbau. Ekstrak
14
Cassia siamea Lamk dalam bahasa Indonesia disebut sebagai juwar, johar,
atau johor (Ministry of Health-RI 1989). Nama asing dari C. siamea adalah
Kasood tree. Klasifikasi dan gambar C. siamea adalah sebagai berikut: kingdom : Plantae
divisi : Magnoliophyta kelas : Magnoliopsida subkelas : Rosidae ordo : Fabales famili : Fabaceae
subfamili : Caesalpinioideae bangsa : Cassieae
subbangsa : Cassiinae genus : Senna
spesies : Cassia siamea
Bahan kimia daun C. siamea
Daun dan polong C. siamea mengandung alkaloid, steroid, tripenoid,
saponin, flavonoid, dan tannin (Ministry of Health-RI 1989). Selain itu dalam
dalam ekstrak alkohol C. siamea mengandung barokol, γα, 8-dihidroksi -
2,5-dimetil – 1,4-dioksafenalen (Thongsaard et al. 2001). Fraksi dari ekstrak alkohol
serbuk daun C. siamea dibentuk wax, -sitosterol, flavonoid barakol, apigenin
dan kaemferol. -sitosterol, siamin, cassiamin A, anhidrobarakol, fiskion,
kisofanol, apigenin-7-O-galaktosit, asam p-koumarik, rein, cassiakromon,
krisofanol, dan krisfanoldiaton dapat di isolasi dari daun C. siamea. Daun
C. siamea akan menghasilkan isoquinolon alkaloid siamin,
4-(trans)-asetil-3,6,8-trihidroksi-3metildihidronaptalenon, 3 alkaloit siamin A, 5-asetil-7-hidroksi
metilkromon, cassia kromon (5-asetonil-7-hidroksi-2-metilkromon), siamin C,
lueolin, siamin B, 4-(cis)-asetil-3,6,8-trihidroksi-3-metildihidronaptalenon
(Ingkaninan et al. 2000; El-Syyad et al. 1984; Teeyapant et al. 1998). Berikut ini
adalah gambar tumbuhan C. siamea.
Menurut Kusmardi et al. (2006), kandungan flavonoid dan karotenoid
yang tinggi pada ekstrak etanol daun C. siamea dapat berperan sebagai
imunostimulator dengan cara meningkatkan aktivitas dan kapasitas fagositosis sel
makrofag. Flavonoid berpotensi bekerja terhadap limfokin yang dihasilkan oleh
sel T sehingga akan merangsang sel-sel fagosit untuk melakukan respon
fagositosis. Peningkatan dosis ekatrak etanol daun C. siamea juga akan
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan Februari hingga September 2010 di Laboratorium
dan Kandang penelitian Departemen Ilmu Penyakit Hewan dan Kesehatan
Masyarakat Veteriner serta Laboratorium Patologi, Departemen Klinik
Reproduksi dan Patologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah hewan coba berupa DOC
ayam petelur jantan, ekstrak daun C. siamea, koksidiostat, etanol, propilen glikol,
laktosa, kertas saring, pakan ayam yang tidak mengandung kosidiostat, vaksin
ND, larutan garam jenuh, NaCl fisiologis, buffer netral formalin 10%, alkohol
70%, alkohol 80%, alkohol 98%, alkohol absolut, xylol, parafin, object glass,
larutan lithium karbonat, pewarna hematoxilin eosin (HE), perekat permount,
tissue, dan minyak emersi.
Alat yang digunakan adalah mortar, cawan penguap, kandang ayam, kamar
penghitung ookista, tissue cassette, automatic tissue processor, pemanas parafin,
refrigerator (4-6 °C), mikrotom, inkubator, counter chamber, dan mikroskop
cahaya.
Metode Penelitian
Hewan Coba
Penelitian ini menggunakan DOC ayam petelur jantan. Saat ayam berusia
1 minggu diberikan vaksin ND, setelah diberikan vaksin ayam-ayam tersebut
dimasukkan ke dalam kandang berdasarkan kelompok perlakuan. Ayam diberikan
pakan dalam bentuk pellet yang tidak mengandung kosidiostat. Minum diberikan
ad libitum.
Koksidiostat
Koksidiostat yang digunakan berasal dari golongan sulfonamida
(Colibact® yang diproduksi oleh PT. Sanbe Farma) yaitu sulfadiazine 200 mg dan
Pembuatan Ekstrak daun Cassia siamea Lamk.
Serbuk daun C. siamea kering dimaserasi dengan cara direndam dalam
etanol 70% selama 24 jam yang sebelumnya dilakukan pengadukan selama 2 jam.
Perbandingan serbuk daun C. siamea kering dan etanol 70% adalah 1 : 10 artinya
1 bagian daun C. siamea (1 kg) dengan 10 bagian etanol (10 liter). Kemudian
disaring sehingga diperoleh filtrat pertama dan ampas. Ampas dilarutkan kembali
dengan pelarut etanol 70%, diaduk selama 2 jam, didiamkan selama 24 jam atau
hingga larutan menjadi bening dan disaring sehingga diperoleh filtrat kedua dan
ampas. Filtrat pertama dan filtrat kedua digabung dan dipekatkan dengan
rotavapor pada suhu 40-50 °C hingga diperoleh ekstrak kental. Berikutnya
ekstrak kental dievaporasi kembali untuk membentuk ekstrak kering daun
C. siamea (Kusmardi et al. 2006). Pelarutan ekstrak daun C. siamea dilakukan
dengan menggunakan propilen glikol untuk memperoleh dosis bertingkat yaitu
dosis rendah (4.09 mg/0.5 ml), dosis sedang (8.18 mg/0.5 ml), dan dosis tinggi
(16.38 mg/0.5 ml) dengan bobot badan ayam ± 200 g/ekor (Rama 2008).
Cara perhitungan dosis ekstrak daun C. siamea adalah sebagai berikut:
- Dosis standar = 6.79 mg (J2)
- Dosis rendah dan tinggi diperoleh dengan deret hitung sehingga
dosis rendah = ½ x 6.79 mg = 3.395 mg dan dosis tinggi = 2 x 6.79 mg
= 13.58 mg
- Ekstrak yang tersedia
- Ekstrak yang dibutuhkan untuk dosis rendah (J1)
- Ekstrak yang dibutuhkan untuk dosis sedang (J2)
- Ekstrak yang dibutuhkan untuk dosis tinggi (J3)
- Masing-masing dosis C. siamea dilarutkan dalam 0.5 ml propilen glikol
Disain Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan 6
kelompok perlakuan. Keenam kelompok perlakuan terdiri atas kelompok kontrol
negatif (KN), kelompok kontrol positif (KP), kelompok kontrol obat (KO),
18
kelompok yang diberikan ekstrak etanol daun C. siamea dengan dosis sedang (J2),
dan kelompok yang diberikan ekstrak etanol daun C. siamea dengan dosis tinggi
(J3). Kelompok kontrol negatif adalah kelompok ayam yang tidak terinfeksi
Eimeria spp. dan tidak diberikan ekstrak etanol daun C. siamea. Kelompok
kontrol positif adalah kelompok ayam yang terinfeksi Eimeria spp. dan tidak
diberikan ekstrak daun etanol C. siamea. Kelompok kontrol obat adalah
kelompok ayam yang terinfeksi Eimeria spp. dan diberikan koksidiostat dengan
dosis 0.25 mg/0.5 ml per ekor. Kelompok ayam yang diberikan ekstrak etanol
daun C. siamea. dengan dosis rendah adalah kelompok ayam yang terinfeksi
Eimeria spp. dan diberi ekstrak etanol daun C. siamea dengan dosis
4.09 mg/0.5 ml per ekor. Kelompok ayam yang diberikan ekstrak etanol daun
C. siamea dengan dosis sedang adalah kelompok ayam yang terinfeksi
Eimeria spp. dan diberi ekstrak etanol daun C. siamea dengan dosis
8.18 mg/0.5 ml per ekor. Kelompok ayam yang diberikan ekstrak etanol daun
C. siamea dengan dosis tinggi adalah kelompok ayam yang terinfeksi Eimeria
spp. dan diberi ekstrak etanol daun C. siamea dosis 16.38 mg/0.5 ml per ekor.
Penelitian ini menggunakan 90 ekor DOC ayam petelur jantan. DOC ayam
petelur jantan dipelihara pada kandang yang bebas Eimeria spp. hingga ayam
berusia 1 minggu. Saat ayam berusia 1 minggu, ayam diberikan vaksin ND.
Setelah diberikan vaksin ayam-ayam tersebut dimasukkan ke dalam kandang
berdasarkan kelompok perlakuan dan setiap kelompok perlakuan terdiri atas 15
ekor ayam.
Kelompok KN diletakkan pada kandang yang bebas Eimeria spp. sedangkan
kelompok perlakuan lain diletakkan pada kandang yang telah terkontaminasi
Eimeria spp. Selain kelompok KN, semua ayam ditunggu hingga terinfeksi
Eimeria spp. secara alami. Pemeriksaan ookista pada feses ayam dilakukan setiap
hari untuk mengidentifikasi adanya infeksi Eimeria spp. dan mengetahui tingkat
keparahannya melalui jumlah ookista yang ditemukan pada feses.
Saat ditemukan infeksi Eimeria spp. pada semua ayam kecuali kelompok
KN dilakukan pencekokan koksidiostat atau ekstrak daun C. siamea sesuai
dengan kelompoknya. Kelompok KN dan kelompok KP tidak dilakukan
0.25 mg/0.5 ml per ekor 2 kali sehari, kemompok J1 dicekok dengan ekstrak
etanol daun C. siamea dengan dosis 4.09 mg/0.5 ml per ekor 2 kali sehari,
kelompok J2 dicekok ekstrak etanol daun C. siamea dengan dosis 8.18 mg/0.5 ml
per ekor 2 kali sehari, kelompok J3 dicekok ekstrak etanol daun C. siamea dengan
dosis 16.38 mg/0.5 ml per ekor 2 kali sehari. Ekstrak etanol daun C. siamea atau
Colibact diberikan pada ayam dengan sistem 3 hari diberikan eksrak etanol daun
C. siamea atau Colibact , 3 hari berikutnya tidak diberikan ekstrak etanol
C. siamea, 3 hari setelah itu diberikan ekstrak etanol C. siamea atau Colibact
kembali dan dilakukan secara berulang.
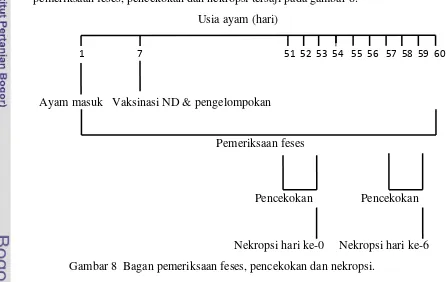
Nekropsi dilakukan setelah hari ketiga pencekokan. Nekropsi dilakukan
pada setiap kelompok perlakuan, diambil masing-masing organ sekum dari 3 ekor
ayam setiap kelompok perlakuan untuk dibuat preparat histopatologi. Bagan
pemeriksaan feses, pencekokan dan nekropsi tersaji pada gambar 8.
Usia ayam (hari)
Ayam masuk Vaksinasi ND & pengelompokan
Pemeriksaan feses
Pencekokan Pencekokan
[image:33.595.80.526.346.628.2]
Nekropsi hari ke-0 Nekropsi hari ke-6
Gambar 8 Bagan pemeriksaan feses, pencekokan dan nekropsi.
Infeksi Eimeria spp.
Masing-masing kelompok perlakuan dimasukkan ke dalam kandang yang
pernah terinfeksi Eimeria spp. pada periode sebelumnya, ditunggu hingga ayam
terinfeksi Eimeria spp. secara alami. Sedangkan kelompok kontrol negatif
20
pernah terkontaminasi Eimeria spp. dan tetap dijaga sanitasinya agar terbebas dari
Eimeria spp.
Pengamatan ookista
Evaluasi ookista dilakukan dengan cara menimbang 1 gram feses ayam
segar dan melarutkannya ke dalam 29 ml larutan garam jenuh hingga homogen.
Selanjutnya tabung disentrifus dengan kecepatan 1500 rpm selama 10 menit.
Bagian supernatan (permukaan) dari campuran tersebut diambil dengan
menggunakan pipet kemudian dimasukkan ke dalam kamar hitung Mc. Master.
Pengamatan ini dilakukan setiap hari pada ayam yang sama (Conway &
McKenzie 2007).
Pemeriksaan ookista yang ada dalam kamar hitung Mc. Master dilakukan di
bawah mikroskop cahaya dengan perbesaran 100x (10x lensa objektif dan 10x
lensa okuler). Jumlah ookista dari kedua kotak yang terdapat pada kamar hitung
Mc. Master dijumlahkan selajutnya dibagi dua. Hasil jumlah rata-rata ookista
tersebut lalu dikalikan 200 untuk memperoleh jumlah ookista per gram tinja.
Berikut adalah perhitungan faktor pengali ookista.
= 200 x jumlah ookista
Pemeriksaan Histopatologi
Organ sekum dari setiap sampel yang dinekropsi, ditriming dengan tebal
± 0.3 cm, kemudian dimasukkan ke dalam tissue cassette. Jaringan kemudian
dihilangkan kandungan airnya dengan dipindah ke dalam alkohol 70%,
alkohol 80%, alkohol 98%, alkohol absolut I, alkohol absolut II masing-masing
selama 2 jam. Setelah itu dilakukan clearing (penjernihan) dengan memasukkan
ke dalam xylol I, xylol II masing-masing selama 2 jam. Lalu diinfiltrasi parafin
dengan bantuan alat automatic tissue processor. Tahapan selanjutnya proses
embedding, yaitu proses penanaman organ kedalam parafin cair suhu 60 °C dan
dibiarkan hingga mengeras dalam cetakan blok parafin. Blok tersebut kemudian
disimpan dalam refrigerator (4-6 °C) sebelum diiris dengan mikrotom. Setiap
dipotong jaringan tersebut diletakkan di atas air hangat agar jaringan tidak
mengkerut dan potongan tersebut dilekatkan di atas object glass. Object glass
dengan potongan jaringan disimpan didalam inkubator selama ± 24 jam
(Staff Patologi 1991).
Proses pewarnaan dilakukan setelah object glass dan potongan jaringan
dikeluarkan dari inkubator. Pewarnaan yang digunakan adalah pewarnaan
hematoksilin eosin (HE). Pewarnaan HE diawali dengan deparafinisasi, preparat
dimasukkan ke dalam larutan xylol I dan xylol II masing-masing selama 2 menit.
Proses selanjutnya dehidrasi dengan memasukkan ke dalam alkohol absolut
selama 2 menit, alkohol 95% dan alkohol 80%, masing-masing selama 1 menit.
Setelah itu preparat dicuci dengan air kran selama 1 menit. Berikutnya dilakukan
pewarnaan preparat dengan hematoksilin selama 8 menit kemudian dicuci degan
air kran selam 30 detik. Preparat kemudian dicelupkan dalam larutan Lithium
carbonat lalu dilakukan pewarnaan dengan eosin selama 2-3 menit. Preparat
dimasukkan dalam alkohol absolut I, alkohol absolut II, masing-masing selama
10 celupan. Preparat kemudian dimasukkan ke dalam larutan xylol I selama
1 menit, xylol II selama 2 menit. Tahap akhir preparat ditutup dengan
menggunakan cover glass yang telah dilapisi perekat entellan. Pengamatan
histopatologi dilakukan dengan mikroskop cahaya. Jumlah sel radang dihitung
pada 10 lapang pandang, dan dilakukan terhadap 3 ekor ayam untuk
masing-masing perlakuan (Staff Patologi 1991).
Pengolahan data
Pengolahan data dilakukan dengan uji Analysis of Varian (ANOVA)-SPS
System kemudian dilanjutkan dengan uji Duncan Multiple Range Test untuk
HASIL DAN PEMBAHASAN
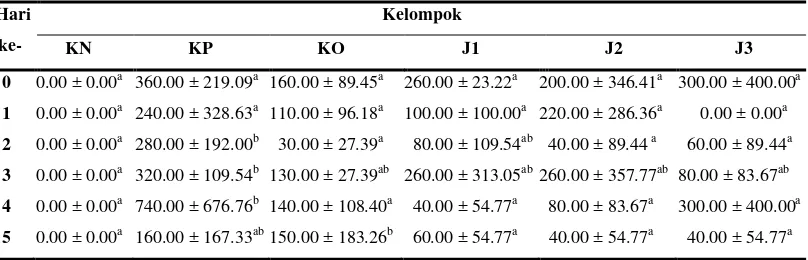
Penurunan jumlah ookista dalam feses merupakan salah satu indikator
bahwa zat yang diberikan dapat berfungsi sebagai koksidiostat. Rataan jumlah
[image:36.595.109.513.204.334.2]ookista pada feses ayam berdasarkan hari nekropsi tersaji dalam Tabel 1.
Tabel 1 Rataan jumlah ookista pada feses berdasarkan hari nekropsi.
Hari ke-
Kelompok
KN KP KO J1 J2 J3
0 0.00 ± 0.00a 360.00 ± 219.09a 160.00 ± 89.45a 260.00 ± 23.22a 200.00 ± 346.41a 300.00 ± 400.00a 1 0.00 ± 0.00a 240.00 ± 328.63a 110.00 ± 96.18a 100.00 ± 100.00a 220.00 ± 286.36a 0.00 ± 0.00a 2 0.00 ± 0.00a 280.00 ± 192.00b 30.00 ± 27.39a 80.00 ± 109.54ab 40.00 ± 89.44 a 60.00 ± 89.44a 3 0.00 ± 0.00a 320.00 ± 109.54b 130.00 ± 27.39ab 260.00 ± 313.05ab 260.00 ± 357.77ab 80.00 ± 83.67ab 4 0.00 ± 0.00a 740.00 ± 676.76b 140.00 ± 108.40a 40.00 ± 54.77a 80.00 ± 83.67a 300.00 ± 400.00a 5 0.00 ± 0.00a 160.00 ± 167.33ab 150.00 ± 183.26b 60.00 ± 54.77a 40.00 ± 54.77a 40.00 ± 54.77a
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata dengan P < 0.05. KN: kontrol negatif, KP: kontrol positif, KO: kontrol obat, J1: pemberian johar dosis rendah, J2: pemberian johar dosis sedang, J3: pemberian johar dosis tinggi.
Berdasarkan hasil pengolahan secara statistik antar kelompok perlakuan
pada setiap hari pengambilan data tidak menunjukkan perbedaan yang signifikan
kecuali pada kelompok perlakuan kontrol positif yang selalu memiliki nilai yang
relatif lebih tinggi jika dibandingkan dengan kelompok perlakuan yang lain.
Sedangkan kontrol negatif selalu memiliki nilai yang lebih rendah bila
dibandingkan dengan kelompok perlakuan lain. Pada kelompok kontrol obat
jumlah ookista ditekan pertumbuhannya oleh koksidiostat Colibact yang bekerja
mengikat PABA (para amino benzoic acid) dan menghambat metabolisme asam
folat Eimeria sehingga sintesa DNA dari ookista terganggu dan menyebabkan
kegagalan pembentukan ookista. Kelompok perlakuan yang diberikan ekstrak
daun C. siamea L. tidak menunjukkan respon yang cukup berarti sebagai
penghambat pertumbuhan ookista.
Pengamatan histopatologi organ sekum ayam pada masing-masing
kelompok perlakuan ditemukan adanya sejumlah sel radang. Sel radang yang
ditemukan pada organ sekum yaitu makrofag, limfosit, eosinofil, dan sel plasma.
Berikut ini adalah gambaran histopatologi organ sekum dengan sejumlah sel
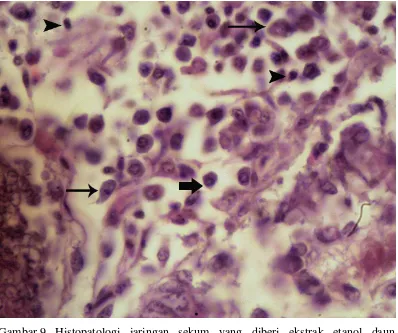
Gambar 9 Histopatologi jaringan sekum yang diberi ekstrak etanol daun C. siamea dosis rendah (J1). Sel radang pada sekum terdiri atas makrofag (panah garis), limfosit (kepala garis) dan sel plasma (panah tebal). Pewarnaan HE; obyektif 100 .
Makrofag merupakan bagian dari sistem fagosit mononuklear yang berasal
dari monosit darah dan telah bermigrasi keluar dari pembuluh darah serta
mengalami aktivasi di dalam jaringan. Karena itu makrofag merupakan sel
radang yang berfungsi memfagositosis mikroorganisme bakteri dan jamur.
Makrofag membuat C3 dan C4, dan lisosom yang merupakan komplemen dan zat
dalam fagositosis dan opsonisasi (Effendi 2003). Fungsi lain dari makrofag
adalah membantu pelepasan IgA intraselular ke jaringan, membentuk sel raksasa,
meningkatkan aktivitas limfosit, membantu pengangkutan dan penyimpanan
imunoglobulin, serta berpartisipasi dalam pembentukan suatu faktor pertumbuhan
sel epitel usus dan maturasi enzim dalam brush border usus (laktoperidase).
Berdasarkan fungsinya tersebut maka perlu dilakukan perbandingan rata-rata
[image:37.595.115.513.84.417.2]24
statistik rata-rata jumlah makrofag pada masing-masing kelompok perlakuan
[image:38.595.113.512.158.224.2]disajikan pada Tabel 2.
Tabel 2 Rataan jumlah makrofag pada sekum ayam.
Nekropsi hari ke-
Kelompok
KN KP KO J1 J2 J3
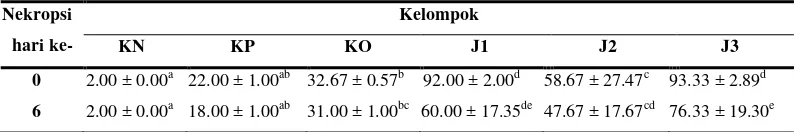
0 2.00 ± 0.00a 22.00 ± 1.00ab 32.67 ± 0.57b 92.00 ± 2.00d 58.67 ± 27.47c 93.33 ± 2.89d 6 2.00 ± 0.00a 18.00 ± 1.00ab 31.00 ± 1.00bc 60.00 ± 17.35de 47.67 ± 17.67cd 76.33 ± 19.30e
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata dengan P < 0.05. KN: kontrol negatif, KP: kontrol positif, KO: kontrol obat, J1: pemberian johar dosis 1, J2: pemberian johar dosis 2, J3: pemberian johar dosis 3.
Berdasarkan analisis statistik di atas rataan jumlah makrofag hari ke-0
pada kelompok yang diberikan ekstrak etanol daun C. siamea memiliki nilai yang
lebih tinggi dan menunjukkan perbedaan yang nyata (P < 0.05) jika dibandingkan
dengan kelompok perlakuan yang lain, sedangkan antar kelompok KN, KP dan
KO tidak menunjukkan perbedaan yang nyata. Jumlah makrofag pada kelompok
JI dan J3 lebih tinggi dan berbeda nyata dengan kelompok J2. Menurut analisis
statistik di atas rataan jumlah makrofag pada hari ke-6 tidak menunjukkan
perbedaan yang nyata antar kelompok perlakuan. Namun demikian, kelompok
perlakuan yang diberikan ekstrak etanol daun C. siamea memiliki jumlah
makrofag yang lebih tinggi dibandingkan kelompok perlakuan lain. Jumlah
makrofag tertinggi pada kelompok J3, sedangkan kelompok J1 memiliki jumlah
makrofag yang lebih tinggi dibandingkan J2. Kelompok J3 dan kelompok J1
menunjukkan rata-rata jumlah makrofag yang lebih tinggi baik pada hari ke-0
ataupun hari ke-6 bila dibandingkan dengan kelompok perlakuan lain. Tingginya
jumlah makrofag pada kedua kelompok perlakuan ini diduga karena adanya
kandungan flavonoid dan karotenoid pada ekstrak daun C. siamea.
Menurut Kusmardi et al. (2006) kandungan flavonoid dan karotenoid
yang tinggi pada ekstrak daun C. siamea dapat berperan sebagai imunostimulator
dengan cara meningkatkan aktivitas dan kapasitas fagositosis sel makrofag.
Flavonoid berpotensi bekerja terhadap limfokin yang dihasilkan oleh sel T
sehingga akan merangsang sel-sel fagosit untuk melakukan respon fagositosis.
Peningkatan dosis ekatrak daun C. siamea juga akan meningkatkan aktivitas dan
Menurut Underwood (1999), aktivasi makrofag saat bermigrasi ke daerah
yang mengalami peradangan diperlihatkan dalam bentuk dan ukurannya yang
bertambah besar, sintesis protein, mobilitas, aktivitas fagositik dan kandungan
enzim lisosom yang dimilikinya. Aktivasi ini diinduksi oleh sinyal seperti sitokin
yang diproduksi oleh limfosit-T yang tersensitisasi (interferon ), endotoksin
bakteri, berbagai mediator selama radang akut dan protein matriks ekstrasel
seperti fibronektin. Makrofag yang sudah teraktivasi siap untuk menjalankan
proses fagositosis. Makrofag ini akan menghasilkan protease asam dan protease
netral yang merupakan mediator kerusakan jaringan pada peradangan, spesies
oksigen reaktif berfungsi dalam proses fagositosis dan degradasi mikroba,
metabolit asam arakhidonat seperti prostaglandin dan leukotrien merupakan
mediator dalam proses peradangan, sitokin seperti IFN α dan , IL 1, 6 dan 8,
faktor nekrosis tumor (TNF α) komponen-komplemen dan faktor koagulasi,
meliputi protein komplemen C1-C5, properdin, faktor koagulasi V, VIII dan
faktor jaringan(Kumar et al. 2000; Underwood 1999). Peningkatan jumlah
makrofag yang diduga karena adanya flavonoid dan karotenoid yang terkandung
dalam ekstrak etanol daun C. siamea diharapkan dapat digunakan sebagai
imunostimulan pada koksidiosis.
Hasil dari penghitungan dan analisis statistik rata-rata jumlah limfosit
pada masing-masing kelompok perlakuan tersebut disajikan pada Tabel 3.
Tabel 3 Rataan jumlah limfosit pada sekum ayam.
Nekropsi hari ke-
Kelompok
KN KP KO J1 J2 J3
0 47.00 ± 1.00a 384.00 ± 10.00 b 389.33 ± 169.89b 615.67 ± 5.03 c 534.33 ± 17.21c 362.00 ± 21.17b 6 47.00 ± 1.00a 126.67 ± 14.64 ab 264.00 ± 10.00bc 469.67 ± 197.79d 368.67 ± 61.78cd 411.67 ± 62.07cd Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata dengan P < 0.05. KN: kontrol
negatif, KP: kontrol positif, KO: kontrol obat, J1: pemberian johar dosis 1, J2: pemberian johar dosis 2, J3: pemberian johar dosis 3.
Menurut perhitungan dan analisis statistik, rataan jumlah limfosit hari ke-0
pada kelompok J1 dan J2 lebih tinggi dan berbeda nyata jika dibandingkan dengan
kelompok perlakuan lain. Kelompok J3, KP dan KO memiliki rataan jumlah
limfosit yang tidak berbeda nyata sedangkan kelompok KN memiliki rataan
jumlah limfosit terkecil dan berbeda nyata dengan kelompok perlakuan lain. Hasil
26
perbedaan yang tidak nyata kecuali kelompok KN yang memiliki jumlah limfosit
terendah dan kelompok J1 yang memiliki jumlah limfosit tertinggi dengan
perbedaan yang nyata dengan kelompok perlakuan lain. Adanya flavonoid pada
ekstrak etanol daun C. siamea diduga menjadi faktor pemicu tingginya rata-rata
jumlah limfosit pada kelompok J1. Menurut Jiao & Wen (2006), senyawa
flavonoid meningkatkan aktivitas IL-2 dan meningkatkan proliferasi limfosit. Hal
inilah yang mungkin menyebabkan peningkatan jumlah limfosit secara nyata
antara kelompok perlakuan yang diberi ekstrak etanol daun C. siamea.
Limfosit merupakan salah satu sel radang yang terdiri atas limfosit B yang
berperan dalam respon imun humoral dan limfosit T yang berfungsi mengenali
dan menghancurkan antigen. Limfosit T terdiri atas sel T-helper yang dengan
bantuan major histocompatibility complex II (MHCII) akan mengenali adanya
antigen dan sel T-sitotoksik yang dengan bantuan MHCI akan langsung
menghancurkan antigen (Kumar et al. 2000; Underwood 1999). Peningkatan
jumlah limfosit pada kelompok perlakuan yang diberikan ekstrak etanol daun C.
siamea diharapkan dapat meningkatkan kemampuan tubuh ayam yang terinfeksi
koksidia untuk mengenali dan menghancurkan antigen serta meningkatkan respon
imun.
Berdasarkan hasil perhitungan dan analisis statistik rata-rata jumlah sel
[image:40.595.112.514.526.590.2]plasma pada setiap kelompok perlakuan tertulis pada Tabel 4.
Tabel 4 Rataan jumlah sel plasma pada sekum ayam.
Nekropsi hari ke-
Kelompok
KN KP KO J1 J2 J3
0 1.00 ± 1.00a 57.00 ± 1.00b 80.67 ± 2.08bc 61.00 ± 1.73b 118.33 ± 16.04c 79.00 ± 51.21bc 6 7.00 ± 1.00a 58.00 ± 1.00b 113.00 ± 5.00c 63.33 ± 4.73b 66.00 ± 26.89b 58.00 ± 19.92b Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata dengan P < 0.05. KN: kontrol
negatif, KP: kontrol positif, KO: kontrol obat, J1: pemberian johar dosis 1, J2: pemberian johar dosis 2, J3: pemberian johar dosis 3.
Berdasarkan analisis statistik pada Tabel 4, antar kelompok perlakuan
tidak menunjukkan perbedaan yang nyata namun jumlah sel plasma pada
kelompok perlakuan yang diberikan ekstrak daun C. siamea dan kelompok
perlakuan yang diberikan Colibact memiliki jumlah sel plasma yang lebih tinggi
dibandingkan kelompok kontrol positif dan kontrol negatif baik pada hari ke-0
menunjukkan peningkatan sel plasma disebabkan oleh adanya flavonoid pada
ekstrak etanol daun C. siamea tersebut. Sel plasma merupakan sel limfosit B
plasma sehingga flavonoid yang meningkatkan rata-rata jumlah limfosit juga akan
meningkatkan rata-rata jumlah limfosit B plasma atau sel plasma. Limfosit B
berdiferensiasi menjadi sel plasma untuk membentuk antibodi (Ig) (Kusmardi
2006; Underwood 1999). Ekstrak etanol daun C. siamea pada analisis statistik ini
menunjukkan hasil yang baik karena dapat meningkatkan antibodi dari ayam yang
terinfeksi koksidia.
Hasil dari penghitungan dan analisis statistik rata-rata jumlah eosinofil dan
heterofil pada masing-masing kelompok perlakuan tersebut disajikan pada
Tabel 5 dan Tabel 6.
Tabel 5 Rataan jumlah eosinofil pada sekum ayam.
Nekropsi hari ke-
Kelompok
KN KP KO J1 J2 J3
0 0.00 ± 0.00a 11.00 ± 1.00b 1.00 ± 0.00a 0.33 ± 0.58a 2.67 ± 4.61a 1.67 ± 1.53a
6 0.00 ± 0.00a 2.00 ± 1.00ab 0.00 ± 0.00a 3.67 ± 4.04ab 4.00 ± 2.65b 0.33 ± 0.58ab Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata dengan P < 0.05. KN: kontrol
[image:41.595.113.513.345.410.2]negatif, KP: kontrol positif, KO: kontrol obat, J1: pemberian johar dosis 1, J2: pemberian johar dosis 2, J3: pemberian johar dosis 3.
Tabel 6 Rataan jumlah heterofil pada sekum ayam.
Nekrosi hari ke-
Kelompok
KN KP KO J1 J2 J3
0 0.00 ± 0.00a 7.00 ± 1.00b 2.00 ± 0.00a 1.33 ± 0.58a 3.33 ± 4.16a 3.33 ± 2.08a
6 0.00 ± 0.00a 0.00 ± 1.00a 0.00 ± 0.00a 28.00 ± 45.90a 1.00 ± 1.73a 2.00 ± 1.73a
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata dengan P < 0.05. KN: kontrol negatif, KP: kontrol positif, KO: kontrol obat, J1: pemberian johar dosis 1, J2: pemberian johar dosis 2, J3: pemberian johar dosis 3.
Menurut analisis data statistik di atas, rata-rata jumlah eosinofil dan
heterofil pada semua perlakuan baik pada hari ke-0 ataupun hari ke-6 tidak
menunjukkan perbedaan yang nyata, kecuali nilai eosinofil dan heterofil pada
kontrol positif lebih tinggi dan berbeda nyata jika dibandingkan dengan kelompok
perlakuan lain. Hal ini diduga disebabkan karena koksidiosis telah mengalami self
limiting disease sehingga jumlah eosinofil dan heterofil pada jaringan sekum
kembali menuju nilai normal. Selain itu koksidiosis diduga telah mengalami self
limiting disease juga didukung dengan jumlah ookista yang semakin sedikit, baik
[image:41.595.115.514.471.537.2]28
jaringan sekum. Sedangkan jumlah limfosit, makrofag, dan sel plasma yang
sangat tinggi pada setiap perlakuan mendukung asumsi bahwa koksidiosis ini
bersifat kronis. Menurut Underwood (1999) pada radang kronis, makrofag dapat
berakumulasi dan berproliferasi di tempat peradangan. Limfosit teraktivasi akan
mengeluarkan IFN- yang akan mengaktivasi makrofag. Makrofag yang aktif,
selain bekerja memfagositosis penyebab radang dan mengeluarkan
mediator-mediator lain, juga akan mengeluarkan IL-1 dan TNF yang akan mengaktivasi
limfosit, sehingga akan membentuk suatu timbal balik antara makrofag dan
limfosit, yang menyebabkan makrofag akan bertambah banyak di jaringan dan
menyebabkan terbentuknya fokus radang. Limfosit-T dan limfosit-B bermigrasi
ke tempat radang dengan menggunakan beberapa pasangan molekul adhesi dan
kemokin yang serupa dengan molekul yang menarik monosit. Limfosit yang
dimobilisasi merupakan sel yang siap pada saat ada rangsang imun spesifik
(infeksi) dan peradangan yang diperantarai non imun (infark atau trauma
jaringan).
Kerjasama yang terjadi pada radang kronis adalah infiltrat jaringan
limfositik meliputi dua jenis utama limfosit, yaitu limfosit-B dan limfosit-T. Saat
limfosit-B kontak dengan antigen maka limfosit B akan berubah menjadi sel
plasma, yang merupakan sel khusus yang sesuai untuk produksi antibodi.
Sedangkan limfosit-T bertanggung jawab pada sel perantara imunitas. Sedang saat
kontak dengan antigen, limfosit-T memproduksi berbagai faktor pelarut yang
disebut sitokin yang memiliki sejumlah aktivitas yaitu pengumpulan makrofag,
produksi mediator bakteri, pengumpulan limfosit lain, destruksi sel target, dan
memproduksi interferon. Makrofag dikumpulkan ke daerah lesi terutama
dipengaruhi oleh faktor penghambat migrasi atau migration inhibition factors
(MIF) yang akan mengikat makrofag dalam jaringan. Faktor pengaktif makrofag
akan merangsang makrofag untuk memakan dan membunuh benda asing.
Limfosit-T memproduksi sejumlah mediator radang, termasuk sitokin, faktor
kemotaksis untuk neutrofil, dan faktor lain yang meningkatkan permeabilitas
vaskuler. Interleukin merangsang limfosit lain untuk membelah dan memberikan
kemampuan membentuk sel perantara respon imun terhadap berbagai antigen.
Faktor-faktor seperti perforin diproduksi untuk menghancurkan sel lain melalui
perusakan membran selnya. IFN- diproduksi oleh sel-T teraktivasi, mempunyai
sifat antivirus dan pada saat tertentu mengaktifkan makrofag. IFN-α dan IFN
-diproduksi oleh makrofag dan fibroblas, yang mempunyai sifat antivirus dan sel
SIMPULAN DAN SARAN
Simpulan
Infeksi alami Eimeria spp. menyebabkan peningkatan jumlah sel radang.
Pemberian ekstrak daun C. siamea pada ayam yang terinfeksi Eimeria spp. secara
alami menyebabkan jumlah makrofag yang lebih tinggi sehingga ada indikasi
bahwa ekstrak etanol daun C. siamea dapat berfungsi sebagai imunostimulan.
Saran
1. Perlu dilakukan penelitian lebih lanjut terhadap senyawa aktif yang
terkandung dalam daun C. siamea terhadap adanya infeksi Eimeria spp.
2. Perlu dilakukan penelitian lebih lanjut dalam penggunaan ekstrak daun
C. siamea dengan berbagai konsentrasi lainnya sebagai alternatif obat
DAFTAR PUSTAKA
[Anonim]. 1996. Avian Blood Cells. [terhubung berkala]. http://ahdc.vet.cornell.edu/clinpath/modules/heme1/avian.htm. 20 Mei 2010 .
[Anomin]. 2009. Blue Histology-Endocrines. School of Anatomy and Human
Biology. [terhubung berkala]
http://www.lab.anhb.uwa.edu.au/mb140/corepages/endocrines/endocrin.htm . [10 Januari 2011]
[Anonim]. 2010. Lympha
![Gambar 1 Skema siklus hidup Eimeria spp. [Sumber: Novindo 2009]](https://thumb-ap.123doks.com/thumbv2/123dok/806664.375581/19.595.103.545.272.673/gambar-skema-siklus-hidup-eimeria-spp-sumber-novindo.webp)
![Gambar 3 Limfosit pada jaringan [Sumber: Ownby 2007]](https://thumb-ap.123doks.com/thumbv2/123dok/806664.375581/24.595.238.388.537.694/gambar-limfosit-pada-jaringan-sumber-ownby.webp)