ANALISIS FUNGSI GEN
OSNAC6
YANG BERASAL DARI PADI (
Oryza sativa
L.) KULTIVAR
BATUTEGI UNTUK MENINGKATKAN KETAHANAN
TERHADAP KEKERINGAN
AGUS RACHMAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul “Analisis Fungsi Gen OsNAC6 yang Berasal dari Padi (Oryza sativa L.) Kultivar Batutegi untuk Meningkatkan Ketahanan Padi terhadap Kekeringan” adalah karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Agus Rachmat
RINGKASAN
AGUS RACHMAT. Analisis Fungsi Gen OsNAC6 yang Berasal dari Padi (Oryza sativa L.) Kultivar Batutegi untuk Meningkatkan Ketahanan terhadap Kekeringan. Dibimbing oleh HAJRIAL ASWIDINNOOR, SUDARSONO, DEWI SUKMA dan SATYA NUGROHO.
Beras merupakan salah satu bahan pokok untuk kebutuhan pangan bagi masyarakat pada umumnya. Produksi beras perlu terus ditingkatkan untuk mengimbangi laju pertumbuhan penduduk. Produktivitas padi seringkali mengalami kegagalan karena adanya kendala faktor biotik dan abiotik. Tuntutan produksi yang besar tidak lepas dari berbagai permasalahan yang seringkali menyebabkan turunnya produktivitas padi secara nasional, salah satu kendala dalam produksi padi adalah semakin sempitnya luas lahan pertanian produktif dan kondisi iklim yang sulit diprediksi. Kekeringan merupakan bencana alam yang berpengaruh langsung pada produksi hasil pertanian. Kemajuan teknologi memungkinkan pendekatan molekuler untuk meningkatkan ketahanan tanaman terhadap cekaman biotik dan abiotik dengan memperbaiki ekspresi gen-gen terkait ketahanan terhadap cekaman lingkungan.
Faktor transkripsi mempunyai peranan penting dalam regulasi selular dan perubahan fisik sebagai respon terhadap cekaman lingkungan pada tanaman. C-repeat binding factor/dehydration responsive element binding factor
(CBF/DREB), faktor transkripsi NAM, ATAF, dan CUC, zinc finger protein dan faktor transkripsi lainnya merupakan regulator yang penting pada respon tanaman terhadap cekaman lingkungan. Faktor transkripsi OsNAC6 merupakan salah satu gen yang berperan dalam cekaman kekeringan dengan cara mempengaruhi ekspresi beberapa gen pengkode protein yang berperan dalam kondisi cekaman.
Serangkaian penelitian telah dilakukan dengan tujuan untuk mengkarakterisasi faktor transkripsi OsNAC6 yang berasal dari kultivar Rojolele, Batutegi dan Nipponbare serta mempelajari mekanisme fungsi faktor transkripsi
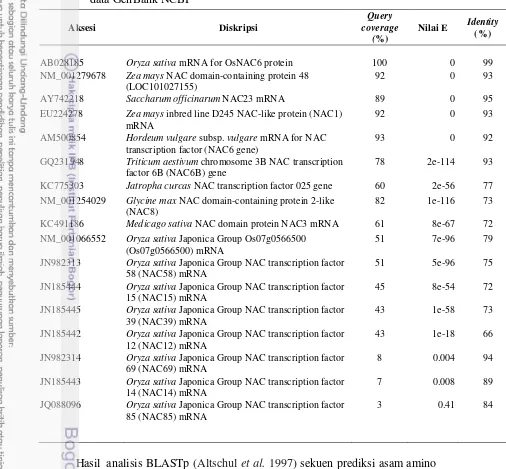
OsNAC6 terhadap cekaman kekeringan dan salinitas. Karakterisasi faktor transkripsi OsNAC6 yang berasal dari ketiga kultivar dibandingkan dengan aksesi yang terdeposit dalam pangkalan data GenBank menggunakan BLASTn dan BLASTp. Translasi runutan DNA menjadi asam amino menggunakan perangkat lunak Geneious Pro 5.6.6 (Biomatters, USA) dan ClustalW2. Hasil analisis BLASTn dan BLASTp faktor transkripsi OsNAC6 asal tiga kultivar Rojolele, Batutegi, Nipponbare menunjukan kesamaan identitas yang tinggi dengan faktor transkripsi OsNAC6 aksesi AB028185 yang terdeposit pada pangkalan data GenBank, mempunyai motif EVQSQPK pada daerah TAR, sehingga dapat disimpulkan bahwa fragmen gen tersebut adalah OsNAC6 dan termasuk dalam subfamili ATAF.
masalah utama pada transformasi padi kultivar Ciherang. Rendahnya efisiensi transformasi diduga karena kultivar ini rekalsitran untuk kegiatan transformasi. Jumlah plantlet putatif transforman yang dihasilkan 39 plantlet, hasil analisis PCR menunjukkan 21 tanaman positif hpt. Keberadaan gen hpt dalam genom dapat menjadi indikasi keberadaan gen target OsNAC6. Analisis jumlah salinan transgen dengan Southern blot menunjukkan tanaman transgenik memiliki jumlah salinan antara 1 - 3.
Ekspresi OsNAC6 di bawah kondisi perlakuan ABA, PEG dan NaCl memperlihatkan peningkatan, baik pada tanaman kontrol maupun tanaman transgenik. Pada tanaman kontrol peningkatan ekspresi lebih rendah dibanding pada tanaman transgenik. Ekspresi OsNAC6 pada tanaman transgenik dengan perlakuan PEG dan salinitas pada 0 jam maupun 24 jam tidak menunjukkan adanya perbedaan. Hal ini diduga disebabkan oleh penggunaan promoter konstitutif CAMV 35S yang berekspresi terus menerus baik ada maupun tidak ada cekaman. Hasil evaluasi terhadap tanaman transgenik selain meningkatkan ekspresi OsNAC6 juga meningkatkan ekspresi relatif gen responsif lainnya seperti
AP2, Zincfinger protein dan MYB. Faktor transkripsi AP2 merupakan famili yang cukup besar pada tanaman dan mempunyai peranan penting terhadap cekaman lingkungan atau cekaman biotik.
SUMMARY
AGUS RACHMAT. Functional Analysis of OsNAC6 Gene from Batutegi Rice (Oryza sativa L.) Cultivar to Enhance Drought Tolerance. Supervised by HAJRIAL ASWIDINNOOR, SUDARSONO, DEWI SUKMA and SATYA NUGROHO.
Rice (Oryza sativa L.) is the major staple crop in Indonesia and in many other developing countries in the world. Increased production of rice often fail due to the constraints of biotic and abiotic stresses. Large production demands can not be separated from the problems that often cause a decrease in productivity of rice; such as the lack of fertil land, decrease of water resource as well as climate change due to global warming. Advances in technology allow molecular approaches to improve plant resistance to biotic and abiotic stresses by influencing the expressions of stress responsive genes. Transcription factors play important role in the regulation of cellular and physical changes in response to environmental stresses in plants. C-repeat binding factor/ dehydration responsive element binding factor (CBF/DREB) transcription factor NAM, ATAF, and CUC, zinc finger proteins and other transcription factors are important regulators in plant responses to environmental stress.
Drought is one of the main abiotic stress that influences plant growth and decreases its production. OsNAC6 is one of the transcription factor plays a role in drought-stress responses and influences the expression of several genes encoding proteins in stress conditions. A series of studies have been conducted to characterize OsNAC6 obtained from Rojolele, Batutegi and Nipponbare rice cultivars and to analys the function under drought and salinity stresses. OsNAC6
derived from the three cultivars were compared with the accessions deposited in the GenBank database using the BlastN and BLASTp. Translation of DNA into amino acid sequences was done using the software Geneious Pro 5.6.6 (Biomatters, USA) and ClustalW2. BLASTn and BLASTp analysis results
OsNAC6 from the three rice cultivars Rojolele, Batutegi, Nipponbare showed high similarity with the OsNAC6 deposited in the GenBank database, has EVQSQPK motif in the TAR, so it can be concluded that the gene fragment was
OsNAC6 and includes in the subfamily Ataf.
Agrobacterium-mediated transformation method was used to introduce
OsNAC6 genes into rice cv. Ciherang cultivars to analys the function of OsNAC6. Out of 39 putative transformant lines obtained, 21 were identified to harbour hpt marker gene, which my indicate the presence of the OsNAC6 transgene. Southern blot analysis showed that the putative first generation (T1) of the transgenic rice integrated a range of 1-3 copies of transgenes. Expression level of
OsNAC6 under ABA (absisic acid; hormone related to stress responsive), PEG (polyethilene glycol; water limiting agent) dan NaCl (natrium chloride; salinity stress) treatments at seedling stage indicated that they were generally higher in transgenic than non-transgenic rice. There was no significant increased of
The expression of AP2, Zinc finger protein and MYB which are regulatory genes for many plant stress responses were up regulated in transgenic lines, indicating the roles of OsNAC6 in regulating the expression of other important drought responsive gene. AP2 is the largest plant transcription factor family with plays important role in regulating responses for biotic or abiotic stress.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
ANALISIS FUNGSI GEN
OSNAC6
YANG BERASAL DARI PADI (
Oryza sativa
L.) KULTIVAR
BATUTEGI UNTUK MENINGKATKAN KETAHANAN
TERHADAP KEKERINGAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Penguji pada Ujian Tertutup: 1.Dr. Sintho Wahyuning Ardie, SP. MSi 2. Dr. Desta Wirnas, SP. M.Si
Judul Disertasi : Analisis Fungsi Gen OsNAC6 yang Berasal dari Padi (Oryza sativa L.) Kultivar Batutegi untuk Meningkatkan Ketahanan terhadap Kekeringan
Nama : Agus Rachmat NIM : A263090061
Disetujui oleh Komisi Pembimbing
Dr. Ir. Hajrial Aswidinnoor, M.Sc Prof. Dr.Ir. Sudarsono, M.Sc Ketua Anggota
Dr. Dewi Sukma, SP. M.Si Dr. Satya Nugroho Anggota Anggota
Diketahui oleh
Ketua Program Studi Pemuliaan dan
Bioteknologi Tanaman
Dr. Ir. Yudiwanti Wahyu E.K., MS
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MSc. Agr
PRAKATA
Dengan Menyebut Asma Allah Yang Maha Pengasih dan Penyayang. Ucapan puji dan syukur saya panjatkan ke hadirat Allah SWT atas segala limpahan rahmat, petunjuk dan pertolongan-Nya, sehingga penulis dapat melaksanakan penelitian sampai tersusunnya penulisan disertasi dengan judul: “Analisis Fungsi Gen OsNAC6 yang Berasal dari Padi (Oryza sativa L.) Kultivar Batutegi untuk Meningkatkan Ketahanan terhadap Kekeringan”.
Penelitian dan penulisan disertasi ini dapat terlaksana karena bantuan dari berbagai pihak. Untuk itu pada kesempatan ini penulis ingin mengucapkan terimakasih kepada Dr. Ir. Hajrial Aswidinnoor, MSc selaku ketua komisi pembimbing yang dengan konsisten telah memberikan bimbingan, arahan dan masukan mulai dari menyusun proposal sampai penulisan disertasi, Prof. Dr. Ir. Sudarsono, MSc, Dr. Dewi Sukma, SP. MSi dan Dr. Satya Nugroho selaku anggota komisi pembimbing yang ditengah kesibukannya secara tulus memberikan masukan, arahan, dan bimbingan mulai dari penyusunan proposal sampai penulisan disertasi. Penulis juga menyampaikan terimakasih kepada Dr. Sintho Wahyuning Ardie, SP. MSi, Dr. Desta Wirnas, SP. MSi, Dr. Ir. Nurhayati, MSc, Dr. Ir. Yudiwanti Wahyu EK. MS, Dr. Ir. Nurul Khumaida, MSi dan Prof. (R) Dr. M. Herman yang telah bersedia menjadi penguji luar komisi pada ujian pra kualifikasi program Doktor, Ujian Tertutup dan Ujian Terbuka, serta memberikan masukan dan saran perbaikan untuk kesempurnaan disertasi ini.
Terima kasih juga penulis ucapkan kepada Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia, yang telah memberi kesempatan dan dukungan biaya kepada penulis untuk melangsungkan studi S3 di IPB, Kementrian Riset dan Teknologi yang telah memberikan dana penelitian. Tidak lupa penulis ucapkan terima kasih kepada teknisi dan seluruh teman-teman di Laboratorium Genomik dan Perbaikan Mutu Tanaman Pusat Penelitian Bioteknologi LIPI dan Laboratorium Pemuliaan dan Biologi Molekuler Tanaman IPB atas kerjasama, kebersamaan dan dukungannya selama penulis melakukan
penelitian dan menyelesaikan studi. Terimakasih juga penulis ucapkan kepeda Dr. Agus Sutanto dan Heni Safitri, M.Si yang telah membantu dalam
menganalisis statistik dan analisis bioinformatik.
Ungkapan terima kasih juga penulis sampaikan kepada istri tercinta Wulansih Dwi Astuti atas doa yang dengan penuh kesabaran mendampingi penulis selama menempuh pendidikan S3, serta anak-anak tersayang Ardelia Clarissa Bella, Fadhil Rajendra Akhtar dan Farhan Ghaisan Akmal yang telah menginspirasi untuk tetap bersemangat. Terimakasih juga penulis sampaikan kepada kedua orang tua H. Emo Padma (Alm) dan Hj. Rd. Djulaeha serta mertua Ir. Soemardi, APU dan Ir. Rumiati, MSi atas do’a, semangat dan kasih sayang yang telah diberikan. Penulis menyadari masih banyak kekurangan, sehingga besar harapan penulis atas saran dan kritik yang bersifat membangun demi penyempurnaan disertasi. Akhir kata penulis berharap semoga disertasi ini bermanfaat bagi kemajuan ilmu pengetahuan dan biologi molekuler tanaman, khususnya tanaman padi di Indonesia.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
PENDAHULUAN
Latar Belakang 1
Tanaman Padi 2
Karakteristik Padi Kultivar Ciherang 3
Transformasi Genetika 3
Peranan Air bagi Tumbuhan 6
Cekaman Kekeringan 6
Fungsi dan Peranan NAC pada Cekaman Biotik 7
Pengaturan Faktor Transkripsi NAC oleh Infeksi Patogen 7
Peranan dan Fungsi NAC terhadap Adanya Cekaman Abiotik 11
Cekaman Kekeringan, Salinitas Tinggi, Suhu Rendah dan Osmotik 12
Interaksi antara Beberapa Faktor Transkripsi terhadap Kekeringan 14
Prospek Faktor Transkripsi NAC 14
Penggunaan Polietilena Glikol (PEG) 17
Aktin 17
OVEREKSPRESI FAKTOR TRANSKRIPSI OsNAC6 ASAL KULTIVAR PADI INDONESIA UNTUK MENINGKATKAN KETAHANAN TERHADAP
KEKERINGAN DAN SALINITAS
Abstrak 59
Abstract 60
Pendahuluan 61
Bahan dan Metode 62
Hasil dan Pembahasan 66
Simpulan 82
PEMBAHASAN UMUM 83
SIMPULAN DAN SARAN 87
DAFTAR PUSTAKA 89
DAFTAR TABEL
1 Fungsi faktor transkripsi pada cekaman biotik 11
2 Fungsi faktor transkripsi pada cekaman abiotik 16 3 Homologi residu basa nukleotida dari fragmen OsNAC yang diisolasi
dari padi Rojolele dan 17 gen NAC transcription factor yang berasal dari padi dan tanaman lain yang terdeposit dalam pangkalan data
GenBank NCBI 30
4 Homologi antara runutan asam amino dari gen OsNAC6 yang diisolasi dari padi Batutegi dan 17 protein dari faktor transkripsi NAC yang berasal dari padi dan tanaman lain yang terdeposit dalam pangkalan
data GenBank NCBI. 32
5 Komposisi asam amino dari sekuen gen OsNAC6 yang berasal dari padi
kultivar Batutegi, Rojolele dan Nipponbare 35
6 Media yang digunakan untuk transformasi varietas padi Ciherang 44 7 Efisiensi transformasi gen OsNAC6 pada padi kultivar Ciherang dengan
menggunakan Agrobacterium 48
8 Analisis pewarisan untuk parameter keberadaan gen hpt dalam genom 52 9 Jumlah salinan gen hpt pada galur tanaman transgenik terpilih hasil
transformasi dengan Agrobacterium 53
10 Pertumbuhan tanaman transgenik pada fase vegetatif 56
11 Pengamatan agronomis tanaman transgenik 56
12 Primer forward dan reverse yang digunakan dalam
kuantitatif RT-PCR 63
13 Kerapatan stomata pada galur transgenik dan tanaman kontrol 76
DAFTAR GAMBAR
1 Faktor transkripsi NAC sebagai komponen kunci dalam regulasi transkripsi dari ekspresi gen selama infeksi virus 8 2 Faktor transkripsi NAC berperan sebagai komponen kunci pada regulasi
transkripsi dari ekspresi gen pada saat terjadi serangan patogen, integrasi antara mekanisme regulasi positif dan negatif 9 3 Peran faktor transkripsi NAC pada jalur signal respon biotik dan abiotik 10 4 Regulasi jaringan transkripsional cis acting elements dan faktor
transkripsi yang dilibatkan dalam ekspresi gen terhadap respon
cekaman abiotik 12
5 Ruang lingkup dan alur penelitian 20
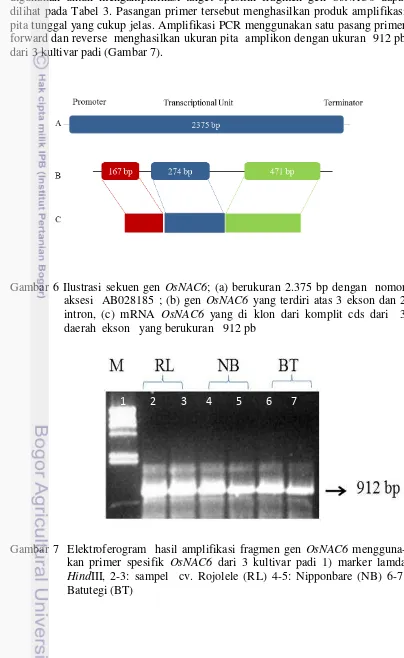
6 Representasi amplifikasi gen OsNAC6; (a) komplit sekuen berukuran 4817 bp dengan nomor aksesi AF254558; (b) gen OsNAC6 yang di klon dari komplit cds dari 3 daerah ekson yang berukuran total 912
pb 26
7 Elektroferogram hasil amplifikasi fragmen gen OsNAC6 menggunakan
primer spesifik OsNAC6 dari 3 kultivar padi 26
8 Sekuen DNA dan prediksi asam amino dari fragmen cDNA yang diperoleh dari padi Batutegi. Residu asam amino yang diberi latar belakang
9 Hasil pensejajaran sekuen-sekuen gen OsNAC6 yang berasal dari tiga varietas padi (RL:Rojolele, NB: Nipponbare, BT: Batutegi) dengan
OsNAC6 dari GenBank nomor aksesi AB028185 (GB) 28 10 Hasil pensejajaran protein OsNAC6 yang berasal dari tiga varietas padi
(RL:Rojolele, NB: Nipponbare, BT: Batutegi), dengan OsNAC6 dari
GenBank nomor aksesi AB028185 (GB) 31
11 Hasil analisis pensejajaran sekuen residu asam amino yang diprediksi dari sekuen fragmen produk cDNA padi, Rojolele, Batutegi, dan Nipponbare (OsNAC6_RL, OsNAC6_BT, OsNAC6_NB) dan gen NAC yang tersedia
pada GenBank NCBI 33
12 Dendogram hasil analisis filogenetik sekuen residu asam amino yang diprediksi dari sekuen fragmen produk cDNA padi kultivar Rojolele, Batutegi, Nipponbare dan (OsNAC6_RL, OsNAC6_BT, OsNAC6_NBdan
OsNAC6_GB) dan 10 gen NAC tanaman lain yang tersedia pada GenBank
NCBI 34
13 Dendogram hasil analisis filogenetik sekuen prediksi asam amino asal
OsNAC6 padi Rojolele, Batutegi, Nipponbare dan gen-gen NAC asal padi Triticum aestivum, Hordeum vulgare dan Tamarix hispida yang terdeposit pada NCBI dan Plant Transcription Factor Database 36 14 Motif terkonservasi di luar domain NAC pada group SNAC pada
tanaman padi (Oryza sativa L.), T. aestivum dan H. vulgare 37 15 Konstruksi vektor pARNAC6, membawa transgen OsNAC6 dan hpt
dalam T-DNA. Menggunakan promoter konstitutif CaMV 35S 42 16 Plasmid pCAMBIA 1305.1 yang digunakan sebagai vektor untuk
transformasi A. tumefaciens ke genom tanaman 43 17 Kegiatan transformasi dan regenerasi pada padi kultivar Ciherang
dengan menggunakan A. tumefaciens untuk menghasilkan tanaman padi kultivar Ciherang yang mengandung overekspresi OsNAC6 yang
dikendalikan oleh promoter CaMV 35S 49
18 Amplifikasi fragmen gen hpt tanaman transgenik (T1) terpilih hasil transformasi dengan A. tumefaciens pembawa plasmid pCAMBIA 1501 51 19 Hasil uji higromisin pada daun tanaman kontrol dan galur tanaman
transgenik pada T1 52
20 Hasil hibridisasi Southern DNA tanaman kultivar Ciherang yang
ditransformasi dengan gen OsNAC6 54
21 Ekspresi OsNAC6 yang diisolasi dari daun muda pada tanaman kontrol kultivar Ciherang yang tidak ditransformasi dan tanaman transgenik
galur C.72, C.83 dan C.91 55
22 Pertumbuhan tanaman kontrol kultivar Ciherang yang tidak ditransformasi dan galur transgenik (C.72, C.83 dan C.91) pada fase kecambah pada umur 2 minggu dalam kondisi normal tanpa ada
perlakuan 55
23 Konstruksi vektor pARNAC6, membawa transgen OsNAC6 dan hpt
dalam T-DNA 61
24 Seleksi tanaman transgenik dengan menggunakan media yang
mengandung higromisin 50 mg l-1 65
26 Perlakuan salinitas (NaCl 200 mM) pada tanaman kontrol dan tanaman
transgenik 68
27 Pola ekspresi OsNAC6 pada daun muda tanaman padi kontrol kultivar Ciherang yang tidak ditransformasi dan tanaman transgenik galur C.72, C.81 dan C.91 terhadap respon ABA,PEG dan NaCl 70 28 Analisis pola ekspresi gen AP2, MYB dan zincfinger protein yang
responsif terhadap cekaman abiotik yang disimulasikan dengan PEG
(20%) pada tanaman transgenik 72
29 Uji cekaman kekeringan pada padi transgenik yang mengandung overekspresi OsNAC6 dan tanaman kontrol pada tanaman umur 4
minggu 73
30 Grafik peningkatan konsentrasi prolin tanaman µmol g-1 pada perlakuan 0,14 dan 21 HSP cekaman kekeringan pada tanaman kontrol
dan galur transgenik 75
31 Stomata pada tanaman kontrol kultivar Ciherang yang tidak ditransformasi dan transgenik setelah 14 HSP kekeringan A (Kontrol )
dan B(C. 72) 77
32 Stomata pada tanaman transgenik setelah 14 HSP kekeringan C (C.83)
dan D (C.91) 78
33 Kandungan klorofil a dan b (mg/g) pada tanaman kontrol dan galur
Produksi padi di Indonesia pada tahun 2013 adalah sebesar 71,29 juta ton Gabah Kering Giling (GKG) atau naik sebesar 2,24 juta ton (2,24 persen) dibanding tahun 2012. Kenaikan produksi ini terjadi di Jawa sebesar 0,97 juta ton dan di luar Jawa sebesar 1,27 juta ton. Kenaikan produksi terjadi karena kenaikan luas panen seluas 391,69 ribu hektar (2,91 persen) dan kenaikan produktivitas sebesar 0,16 kuintal/hektar (0,31 persen). Dengan peningkatan produksi yang dicapai, bukan tidak mungkin Indonesia menjadi eksportir beras terbesar. Namun dengan tingkat konsumsi beras yang sangat tinggi yaitu mencapai 140 kg/orang/tahun, Indonesia masih belum bisa menjadi eksportir beras terbesar (BPS 2014).
Kendala dalam produksi padi adalah semakin sempitnya luas lahan pertanian produktif dan kondisi iklim yang sulit diprediksi. Penyebab penyempitan luas lahan pertanian produktif antara lain karena adanya alih fungsi sawah menjadi pemukiman dan kawasan industri (Hakim 2002). Kekeringan merupakan salah satu faktor yang berpengaruh langsung pada produksi pertanian, dan dapat menyebabkan kegagalan panen. Sifat toleran kekeringan sangat kompleks, dikendalikan oleh banyak gen yang tersebar di banyak lokus dan diwariskan secara kuantitatif (Valliyo dan Nguyen 2006; Fleury
et al. 2010; Lang dan Buu 2010). Sebagian tanaman menghindari kekeringan dengan meningkatkan penyerapan air dan meminimalkan kehilangan air. Tanaman toleran kekeringan melibatkan mekanisme osmotic adjustment, antioksidan, dan ketahanan desikasi. Namun bagaimana mekanisme molekuler tanaman dalam merespon dan beradaptasi terhadap kekeringan belum sepenuhnya dimengerti.
Berbagai pendekatan telah diupayakan untuk mempelajari mekanisme toleran kekeringan pada level molekuler. Sejumlah gen terinduksi kekeringan telah berhasil diidentifikasi pada level transkripsi menggunakan analisis
microarray pada tanaman model Arabidopsis dan padi (Seki et al. 2001; Seki et al. 2002; Rabbani et al. 2003; Zhou et al. 2007), namun belum semua mekanisme fungsi gen terkait cekaman kekeringan dapat diketahui. Analisis fungsional genomik sangat penting dilakukan untuk memahami lebih mendalam mengenai fungsi gen terkait dan bagaimana mekanisme pengaturannya pada level molekuler. Berdasarkan pengaturan ekspresi gen, Yamaguchi-Shinozaki dan Shinozaki (1993) mengelompokkan gen-gen yang terlibat dalam mekanisme toleran kekeringan ke dalam dua kelompok utama, yaitu kelompok yang ekspresinya bergantung pada ABA (ABA dependent) dan tidak bergantung pada ABA (ABA-independent). Berdasarkan peran atau fungsi proteinnya maka Shinozaki et al. (2003) mengelompokkan gen-gen yang terlibat dalam mekanisme toleran kekeringan pada dua kelompok utama, protein fungsional (seperti osmoprotektan, LEA, transporter, chaperon) dan protein regulator (misalnya faktor transkripsi dan protein kinase).
(Aida et al. 1997), perkembangan akar lateral (He et al. 2005), pembentukan dinding sekunder (Zhong et al. 2007), pembelahan sel (Kim et al. 2006), perkembangan serat (Ko et al. 2007), perkembangan embrio (Duval et al. 2002), dan perkembangan biji (Sperotto et al. 2009), pembungaan (Sablowski dan Meyerowitz 1998), respon terhadap hormon (Greve et al. 2003), respon terhadap infeksi patogen (Xie et al. 1999; Olsen et al. 2005; Nakashima et al. 2007), penuaan (Liu et al. 2006), serta respon terhadap berbagai cekaman abiotik (Tran
et al. 2004; He et al. 2005; Hu et al. 2006; Bhatnagar-Mathur et al. 2007; Nakashima et al. 2007; Yoo et al. 2007). Gen NAC juga terlibat dalam respon terhadap cekaman biotik dan abiotik seperti kekeringan, infeksi jamur dan salinitas tinggi (Gao et al. 2007).
Overekspresi gen NAC dari tiga aksesi Arabidopsis thaliana (ANAC019,
ANAC055 dan ANAC072) meningkatkan ekspresi gen-gen terkait toleransi terhadap cekaman kekeringan, salinitas, dan cekaman temperatur rendah pada tanaman A. thaliana (Tran et al. 2004). Lebih jauh lagi, beberapa peneliti melaporkan pentingnya fungsi gen ini untuk ketahanan terhadap cekaman biotik dan abiotik selama siklus hidup tanaman. OsNAC6 dan OsNAC10 merupakan gen yang berasal dari Oryza sativa berperan dalam respon terhadap cekaman kekeringan dan meningkatkan ekspresi beberapa gen pengkode protein dalam kondisi tercekam (Nakashima et al. 2007; Jeong et al. 2010) dan termasuk dalam sub famili ATAF (Arabidopsis Transcription Activation Factor) (Kikuchi et al.
2000; Ooka et al. 2003). Faktor transkripsi NAC responsif terhadap cekaman abiotik, khususnya dari famili gen SNAC1, mempunyai peranan penting dalam mengkontrol respon terhadap kondisi cekaman kekeringan.
Pemahaman yang baik mengenai fisiologi dan biologi molekular padi pada saat toleransi cekaman abiotik dapat memberikan dasar pengetahuan untuk mengembangkan varietas padi toleran cekaman kekeringan dan salinitas (Gao et al. 2007). Oleh karena itu, penelitian mengenai analisis fungsi gen OsNAC6 pada padi kultivar Ciherang penting dilakukan sehingga gen tersebut dapat dimanfaatkan untuk peningkatan toleransi kekeringan pada tanaman padi.
Tanaman Padi (Oryza sativa L.)
Padi termasuk ke dalam genus Oryza yang terdiri atas dua spesies hasil kultivasi dan 21 spesies wildtype. Dua spesies hasil kultivasi tersebut adalah
Oryza sativa L. dan Oryza glaberrima Steud. Oryza sativa merupakan spesies yang telah dibudidayakan secara luas, sedangkan O. glaberrima merupakan padi Afrika dan hanya tumbuh di beberapa negara di Afrika Barat. O. sativa dibagi menjadi dua subspesies, yaitu indica dan japonica. Subspesies indica dan japonica dapat dibedakan berdasarkan sifat resistan terhadap potasium klorat (KClO3), toleransi terhadap dingin, panjang rambut apikal, dan reaksi terhadap fenol. Subspesies japonica terbagi menjadi dua berdasarkan analisis isozim, yaitu japonica tropis (tropical japonica) dan japonica subtropis (temperate japonica) (Khush 1997).
Koshihikari. Subspesies javanica banyak dibudidayakan di Indonesia, khususnya di Pulau Jawa, dan contoh kultivar subspesies javanica adalah Rojolele (Soerjani
et al. 1987). Padi kultivar Batutegi merupakan padi gogo yang hidup di lahan kering. Kultivar tersebut memiliki tinggi 120-128 cm, batang tegak, waktu panen berkisar 112-120 hari, dan potensi hasil 6 ton/ha. Kultivar tersebut tahan terhadap penyakit blas daun, blas leher, dan bercak daun. Selain itu, kultivar tersebut juga toleran terhadap keracunan aluminium dan tahan terhadap kekeringan (Suprihatno
et al. 2007).
Karakteristik Padi Kultivar Ciherang
Salah satu varietas padi yang saat ini paling banyak ditanam petani adalah varietas Ciherang. Varietas ini dilepas Balai Besar Padi Sukamandi pada tahun 2000. Varietas ini cocok ditanam pada musim hujan dengan ketinggian di bawah 500 m dpl sehingga disukai oleh para petani. Padi varietas Ciherang adalah hasil persilangan antara varietas IR18349-53-1-3-1-3/2*IR19661-131-3-1-//4*IR64, umur tanaman 116-125 hari, tinggi tanaman 107-115 cm, anakan produktif 14-17
batang, tahan terhadap wereng cokelat biotipe 2 dan agak tahan biotipe 3, tahan terhadap hawar daun bakteri strain III dan IV, potensi hasil
sekitar 8.5 ton/ha GKG (Suprihatno et al. 2010). Sebagian sifat IR64 juga dimiliki oleh Ciherang, termasuk hasil dan mutu berasnya yang tinggi, sehingga varietas Ciherang lebih disukai oleh banyak orang (Hermanto 2006). Pada preferensi uji varietas ditunjukkan bahwa varietas Ciherang lebih dikenal oleh petani dibandingkan varietas lainnya, serta lebih disukai mulai dari tampilan tanaman saat vegetatif, jumlah anakan dan panjang malai, bentuk dan warna gabah serta beras, dan penerimaan umum terhadap organoleptik nasi (Ruskandar
et al. 2008).
Transformasi Genetika
dikembangkan, dan pemilihan metode sangat tergantung pada kemampuan jaringan atau sel tanaman untuk beregenerasi.
Transformasi Agrobacterium merupakan teknik yang paling umum digunakan saat ini, karena memiliki kelebihan antara lain tidak memerlukan peralatan yang mahal, dapat diaplikasikan secara luas baik pada kelompok tanaman dikotil maupun monokotil, pola integrasi DNA lebih mudah diprediksi dan yang paling penting adalah kemungkinan untuk mendapatkan tanaman dengan satu salinan gen sangat tinggi (Roy et al. 2000; Dai et al. 2001). Tanaman homozigot dengan satu salinan gen sangat penting didalam pemuliaan tanaman dan kajian fungsi gen karena tanaman dianggap sudah stabil dan lebih mudah dalam interpretasi datanya.
Pada awalnya transformasi dengan Agrobacterium hanya dapat dilakukan pada tanaman dikotil, namun sejak 1993 telah berhasil digunakan pada tanaman monokotil (Hiei et al.1994). Hal ini terkait dengan penggunaan senyawa fenolik yang ditambahkan saat transformasi tanaman monokotil. Senyawa fenolik secara alami dihasilkan tanaman dikotil sebagai respon pelukaan. Senyawa ini diperlukan bakteri untuk menginduksi gen-gen vir yang diperlukan untuk mengangkut T-DNA dari sel bakteri dan menyisipkannya ke dalam genom tanaman (Sheng dan Citovsky 1996). Senyawa fenolik asetosiringone yang ditambahkan ke dalam media ko-kultivasi saat transformasi telah memungkinkan diperolehnya tanaman padi transgenik (Hiei et al.1994).
Saat ini berbagai kultivar tanaman padi telah berhasil ditransformasi menggunakan Agrobacterium. Ashikari et al. (2005) mengintroduksikan gen yang meregulasi sitokinin oksidase ke dalam padi indica varietas Habataki dan ke dalam padi japonica varietas Koshihikari. Supartana et al. (2005) melakukan transformasi secara in planta menggunakan Agrobacterium strain LBA-4404 pada padi Koshihikari. Mulyaningsih et al. (2010) berhasil mengintroduksikan gen regulator HD-Zip pada padi indica kultivar Batutegi dan Kasalath. Gen HD-Zip merupakan salah satu faktor transkripsi yang terkait dengan adaptasi perkembangan tanaman terhadap cekaman kekeringan. Gen isopenteny-ltransferase (ipt) berhasil diintroduksikan ke dalam genom padi kultivar Nipponbare (Wagiran et al. 2010), kultivar TSC10 dan IR72 (Aldemita et al.1996), kultivar Minghui 63, Zhensan 97, W9864S dan Zhong 419 (Lin dan Zhang 2005), kultivar Pusa Basmati I (Zhang et al. 1997), serta kultivar IR 64 (Khanna dan Raina 2002).
pertumbuhan dalam media. Genotipe padi yang digunakan ini mewakili keragaman plasma nutfah padi indica. Modifikasi yang dilakukan ialah pada media induksi kalus, media subkultur dan media regenerasi. Percobaan modifikasi media subkultur dan regenerasi pada empat kultivar indica berhasil meningkatkan laju pertumbuhan tanaman, kualitas, diferensiasi kalus dan efisiensi transformasi (Lin dan Zhang 2005).
Beberapa faktor penting untuk keberhasilan transformasi genetika antara lain: tipe dan umur jaringan, genotipe dan berbagai kondisi kultur jaringan yang digunakan, jenis vektor, ukuran vektor, strain Agrobacterium, konsentrasi dan jenis antibiotik (Hiei et al. 1994). Efisiensi transformasi yang rendah pada indica diduga terkait pula dengan antibiotik yang digunakan, karena antibiotik dapat meracuni kalus (Rashid et al.1996). Pemilihan jaringan sebagai material awal yang akan digunakan adalah faktor penting yang menentukan keberhasilan transformasi. Inisiasi kalus dari skutelum padi japonica yang akan transformasi lebih baik dibanding penggunaan material lain seperti tunas dan immature embryo
(embrio zigotik muda) (Hiei et al. 1994).
Percobaan menggunakan jaringan muda dan segar dari tanaman sehat yang berupa embrio zigotik muda serta kokultivasi pada jaringan segar juga menentukan keberhasilan transformasi Indica (Hiei dan Komari 2006). Ketepatan pemilihan jaringan dan waktu transformasi dapat mempengaruhi waktu yang diperlukan untuk mendapatkan tanaman transgenik. Penggunaan kalus dari bagian skutelum benih padi japonica memerlukan waktu 3 bulan untuk mendapatkan tanaman transgenik. Toki et al. (2006) dengan waktu pra kultur yang singkat (1-5 hari) yang kemudian ditransformasi dapat menghemat waktu dua bulan dibandingan menggunakan kalus embriogenik. Teknik ini berhasil dilakukan pada padi japonica seperti Nipponbare, Koshihikari, Dontokoi dan Indica Basmati 370, meskipun nilai efisiensi transformasi tidak dikemukakan.
Secara alami Agrobacterium adalah bakteri patogen tanah yang dapat menyebabkan penyakit tumor pada tumbuhan. Tumor disebabkan oleh suatu plasmid Agrobacterium yang sangat besar yang kemudian disebut dengan plasmid Ti (Tumor inducing). Plasmid Ti mengandung T-DNA yang diapit oleh 23 pasang sekuen basa berulang dan satu set gen virulen (virA, virB, virC, virD, virE, virG,
dan virH) yang diperlukan untuk mengangkut T-DNA dari sel bakteri dan menyisipkannya ke dalam genom tanaman. T-DNA mengandung gen penyandi senyawa opine (octopin, nopalin, atau leucinopin) yang diperlukan oleh
Agrobacterium dan gen penyandi hormon pertumbuhan tanaman yang mengakibatkan pertumbuhan sel tidak terkendali dan membentuk tumor. Proses transfer gen oleh Agrobacterium sudah banyak diulas sebelumnya diantaranya oleh Sheng dan Citovsky (1996) serta Tinland (1996).
Peranan Air bagi Tumbuhan
Air merupakan komponen utama tumbuhan, yaitu membentuk 80-90% bobot segar jaringan yang sedang tumbuh aktif. Air sebagai komponen esensial tumbuhan memiliki peranan antara lain: (a) sebagai pelarut, didalamnya terdapat, garam, dan zat terlarut lainnya, yang bergerak keluar masuk sel, (b) sebagai pereaksi dalam fotosintesis dan pada berbagai proses hidrolisis, dan (c) air esensial untuk menjaga turgiditas diantaranya dalam pembesaran sel, pembukaan stomata (Griffin et al. 2004). Pada keadaan normal tumbuhan membutuhkan keseimbangan potensial air antara tanah-akar-daun-atmosfer. Keseimbangan ini berarti gradien potensial air antara bagian-bagian tersebut yang memungkinkan tumbuhan untuk melakukan transpor air dan hara dari akar ke daun. Air akan mengalir dari potensial air tinggi ke potensial air rendah yang dipengaruhi oleh proses transpirasi (Taiz dan Zeiger 2002).
Proses transpirasi di daun terutama terjadi pada siang hari dan dipengaruhi oleh cahaya matahari. Ketika terjadi proses transpirasi pada tumbuhan, maka tekanan turgor akan mengalami penurunan. Penurunan ini menyebabkan potensial air di daun lebih rendah dari pada di akar, sehingga akan mempermudah aliran air di xilem dari akar sampai ke daun. Peningkatan aliran air ini dibutuhkan untuk pertumbuhan sel tanaman. Aliran air ke sel akan mengakibatkan pembesaran dan pemanjangan sel, sehingga sel dapat tumbuh (Kramer dan Boyer 1995). Pada kondisi lingkungan tertentu tumbuhan dapat mengalami defisit air. Defisit air berarti terjadi penurunan gradien potensial air tanah, daun dan atmosfer, sehingga laju transpor air dan hara menurun (Taiz dan Zeiger 2002). Penurunan ini akan mengakibatkan gangguan pada pertumbuhan tanaman, terutama pada jaringan yang sedang tumbuh (Kramer dan Boyer 1995).
Cekaman Kekeringan
Cekaman kekeringan akan mengakibatkan rendahnya laju penyerapan air oleh akar tanaman. Ketidakseimbangan antara penyerapan air oleh akar dan kehilangan air akibat transpirasi membuat tanaman menjadi layu. Cekaman kekeringan dapat terjadi karena beberapa hal yaitu: (1) tingginya kecepatan evaporasi yang melebihi persediaan air dari tanah ke akar yang akan mengakibatkan penurunan potensial air, (2) adanya senyawa yang bersifat osmotik, seperti pada tanah bergaram, yang dapat menurunkan daya pengambilan air sehingga terjadi penurunan potensial osmosis dan tidak cukupnya pengambilan air oleh tanaman yang diserap dari tanah (Borges 2003). Cekaman kekeringan merupakan cekaman terbesar yang memengaruhi pertumbuhan dan produksi tanaman pangan. Kondisi tersebut dapat memicu respons fisiologis, biokimia, dan molekuler (Kalefetoğlu dan Ekmekçi 2005).
tanaman yang disebabkan cekaman air berbeda. Hal ini disebabkan perbedaan tanggap masing-masing jenis tanaman tersebut.
Gen responsif terhadap kekeringan dapat dibedakan menjadi e arly-response genes dan delayed-response genes. Early-response genes, yaitu gen yang cepat terinduksi. Induksi gen tidak membutuhkan sintesis protein baru karena semua komponen sinyal telah tersedia. Delayed-response genes, yaitu gen yang teraktivasi dengan lambat dan terdiri atas gen-gen terinduksi kekeringan lainnya. Early-response genes umumnya mengkode faktor transkripsi yang mengaktivasi delayed-response genes(Kalefetoğlu dan Ekmekçi 2005).
Mekanisme toleransi tanaman terhadap kekeringan pada saat mengalami cekaman kekeringan dapat dikelompokkan menjadi tiga, yaitu (1)
escape, tanaman menyelesaikan siklus hidupnya sebelum mengalami cekaman berat, dengan pembungaan atau pematangan buah lebih awal, (2)
tolerance, tanaman tetap tumbuh dalam kondisi cekaman kekeringan dan potensial air rendah, dengan osmotic adjustment dan (3) avoidance, tanaman menghindar dari cekaman kekeringan, dengan mengembangkan sistem perakaran dan efisiensi membuka dan menutupnya stomata. Karakter akar yang berhubungan dengan kemampuan tanaman untuk beradaptasi secara
avoidance dapat ditandai secara visual, yaitu akar lebih tebal, lebih panjang dan lebih banyak (Lestari et al. 2005). Kandungan prolin pada daun yang masih muda maupun yang sudah tua mengalami peningkatan pada cekaman kekeringan. Kandungan prolin pada daun muda lebih tinggi dibandingkan dengan daun yang sudah tua (Mostajeran dan Rahimi-Eichi 2009).
Padi tersebar luas di seluruh dunia dan tumbuh dihampir semua belahan bumi yang memiliki cukup air dan suhu udara yang cukup hangat. Padi menyukai tanah yang lembab dan becek. Kebutuhan padi yang tinggi akan air pada tahap kehidupannya, merupakan masalah tersendiri bagi daerah yang memiliki curah hujan yang rendah untuk melakukan penanaman padi. Di beberapa daerah tadah hujan, dikembangkan padi gogo, suatu tipe padi lahan kering yang relatif toleran tanpa penggenangan seperti di sawah (Prasetyo, 2001).
Fungsi dan Peranan NAC pada Cekaman Biotik
Sebagian besar laporan terkait dengan faktor transkripsi NAC
mengindikasikan bahwa multigen berperan dalam pengaturan pemograman ulang transkripsi (transcriptional reprogramming) terkait dengan respon kekebalan pada tanaman. Faktor transkripsi NAC merupakan komponen inti dalam berbagai aspek ketahanan tanaman, pertahanan dasar dan systemic acquired resistance
(SAR).
Pengaturan Faktor Transkripsi NAC oleh Infeksi Patogen
2010). Beberapa peneliti telah mengembangkan vektor VIGS berbasis brome mosaic virus (BMV) yang sangat berguna untuk analisis fungsi gen pada barley, padi dan jagung (Ding 2006; Pacak et al. 2010; Biruma et al. 2012). Pada benih padi, ekspresi gen NAC 19 dan NAC 13 meningkat setelah terjadinya infeksi rice stripe virus (RSV) dan rice tungro spherical virus (RTSV) setelah inokulasi (Nuruzzaman et al. 2010). Beberapa protein NAC dapat menghambat multiplikasi virus dengan cara berinteraksi dengan protein virus (Xie et al. 1999; Ren et al.
2000, 2005; Selth et al. 2005; Jeong et al. 2008; Yoshii et al. 2009), dan meningkatkan level ekspresi gen NAC sebagai respon terhadap serangan oleh virus (Gambar 1), serta fungi dan bakteri (Gambar 2) (Xie et al. 1999; Ren et al.
2000; Collinge dan Boller, 2001; Mysore et al. 2002; Hegedus et al. 2003; Oh et al. 2005; Selth et al. 2005; Jensen et al. 2007; Lin et al. 2007; Jeong et al. 2008; Wang et al. 2009a,b; Xia et al. 2010a,b).
Gambar 1 Faktor transkripsi NAC sebagai komponen kunci dalam regulasi transkripsi dari ekspresi gen selama infeksi virus. Singkatan: TCV,
turnip crinkle virus; TIP, TCV-interacting protein; TLCV, tomato leaf curl virus; TMV, tobacco mosaic virus; WDV, wheat dwarf gemini virus (Nuruzzaman et al. 2013)
toleransi terhadap penyakit blas (Nakashima et al. 2007). Overekspresi ATAF2
meningkatkan kerentanan terhadap fungi nekrotropik Fusarium oxysporum dalam kondisi steril akibat represi gen pathogenesis-related (PR) (Delessert et al. 2005) namun gen PR yang terinduksi, mengurangi akumulasi virus mosaik tembakau di lingkungan non-steril (Wang et al. 2009b).
Gambar 2 Faktor transkripsi NAC berperan sebagai komponen kunci pada regulasi transkripsi dari ekspresi gen pada saat terjadi serangan patogen, integrasi antara mekanisme regulasi positif (panah) dan negatif (garis) (Nuruzzaman et al. 2013)
Penelitian mengenai interferensi RNA dan overekspresi telah menunjukkan fungsi faktor transkripsi NAC dalam berbagai interaksi antara tanaman-patogen. Sejumlah protein NAC dapat mengatur secara positif respon pertahanan tanaman dengan mengaktifkan gen PR, merangsang respon hipersensitif (HR), dan kematian sel pada lokasi infeksi (Jensen et al. 2007, 2008; Kaneda et al. 2009 ; Seo et al. 2010). ATAF1 dan homolognya pada barley
HvNAC6 secara positif mengatur ketahanan terhadap penetrasi fungi biotrophik
Blumeria graminisf sp. hordei (Bgh) (Jensen et al. 2007, 2008) namun mengurangi resistensi terhadap patogen lainnya, seperti Pseudomonas syringae, Botrytis cinerea, dan Alternaria brassicicola (Wang et al. 2009a; Wu et al. 2009). Tidak seperti ATAF2 dan ATAF,HvNAC6 adalah aktivator transkripsi dan secara tidak langsung dapat mengatur represi gen PR melalui hypothetical negative regulator (Gambar 2).
famili NAC, ERF dan WRKY telah diidentifikasi (Eulgem dan Somssich, 2007; Gutterson dan Reuber 2004) dan diketahui mempunyai peranan penting dalam mengatur ekspresi gen yang berkaitan dengan pertahanan. Beberapa percobaan overekspresi atau pembungkaman (knockdown) dari ekspresi gen NAC (Tabel 1) menunjukkan adanya efek pada sistem pertahanan tanaman (Collinge dan Boller, 2001; Delessert et al. 2005; He et al. 2005; Jensen et al. 2007, 2008, 2010).
Gen NAC yang responsif terhadap cekaman pada Arabidopsis, seperti
RD26, responsif terhadap JA, phitohormon yang terlibat secara fungsional dalam mengatur respon terhadap pelukaan dan cekaman biotik (Fujita et al. 2004, 2006). Oleh karena itu, adalah wajar untuk menganggap bahwa faktor SNAC yang responsif terhadap JA dapat berfungsi dalam respon terhadap cekaman biotik dan abiotik. Pada padi, sebagian besar gen yang termasuk dalam kelompok SNAC
memberikan respon terhadap JA. Di antara, SNAC1, OsNAC3, OsNAC4, OsNAC5, OsNAC6, dan OsNAC10 berada dalam kelompok filogenetik SNAC yang sama. Secara khusus, kelompok SNAC terdiri dari beberapa gen yang mengatur jalur ketahanan terhadap penyakit, seperti dapat disimpulkan adanya peningkatan resistensi terhadap patogen pada tanaman overekspresi di bawah kendali promotor konstitutif. Data menunjukkan bahwa faktor transkripsi NAC juga memiliki peran penting dalam regulasi respon pertahanan tanaman terhadap patogen yang berbeda (Gambar 3).
Penerapan hormon tanaman eksogenus, seperti JA, SA, dan ET, juga telah diketahui dapat menginduksi gen NAC pada beberapa spesies (Tran et al. 2004; Hu et al. 2006; Sindhu et al. 2008; Lu et al. 2007; Nakashima et al. 2007; Yokotani et al. 2009; Zheng et al. 2009; Xia et al. 2010a, b; Yoshii et al. 2010; Nuruzzaman et al. 2012b). Oleh karena itu, faktor transkripsi NAC kemungkinan dapat memodulasi regulasi phitohormonal pada jaringan selular terhadap cekaman biotik.
Peranan dan Fungsi NAC terhadap Adanya Cekaman Abiotik
Faktor transkripsi NAC berfungsi sebagai komponen penting dalam sinyal kompleks dan berlangsung selama respon tanaman terhadap adanya cekaman. Mengingat jumlah faktor transkripsi NAC yang relatif besar dari berbagai tanaman yang berbeda dan mempunyai fungsi yang beragam, sampai saat ini tetap merupakan tantangan untuk menjelaskan peran faktor transkripsi NAC
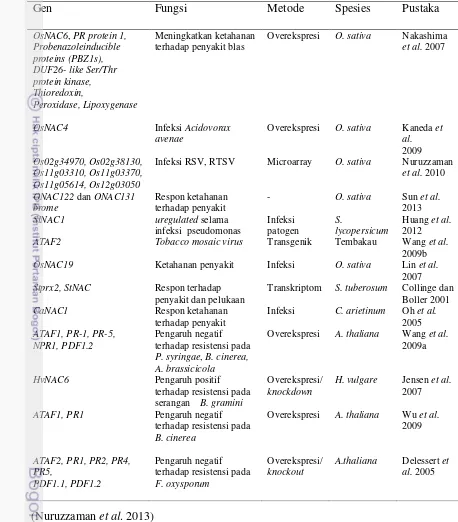
Gen Fungsi Metode Spesies Pustaka
OsNAC6, PR protein 1, Probenazoleinducible proteins (PBZ1s), DUF26- like Ser/Thr protein kinase, Thioredoxin,
Peroxidase, Lipoxygenase
Meningkatkan ketahanan terhadap penyakit blas
Overekspresi O. sativa Nakashima et al. 2007
OsNAC4 Infeksi Acidovorax avenae
Overekspresi O. sativa Kaneda et al. 2009 Os02g34970, Os02g38130,
Os11g03310, Os11g03370, Os11g05614, Os12g03050
Infeksi RSV, RTSV Microarray O. sativa Nuruzzaman et al. 2010
ONAC122 dan ONAC131 brome
Respon ketahanan terhadap penyakit
- O. sativa Sun et al. 2013 SlNAC1 uregulated selama
infeksi pseudomonas
Infeksi patogen
S.
lycopersicum
Huang et al. 2012 ATAF2 Tobacco mosaic virus Transgenik Tembakau Wang et al.
2009b OsNAC19 Ketahanan penyakit Infeksi O. sativa Lin et al.
2007 Stprx2, StNAC Respon terhadap
penyakit dan pelukaan
Transkriptom S. tuberosum Collinge dan Boller 2001
CaNAC1 Respon ketahanan
terhadap penyakit
Infeksi C. arietinum Oh et al. 2005 ATAF1, PR-1, PR-5,
NPR1, PDF1.2
Pengaruh negatif terhadap resistensi pada P. syringae, B. cinerea, A. brassicicola
Overekspresi A. thaliana Wang et al. 2009a
HvNAC6 Pengaruh positif terhadap resistensi pada serangan B. gramini
Overekspresi/ knockdown
H. vulgare Jensen et al. 2007
ATAF1, PR1 Pengaruh negatif terhadap resistensi pada B. cinerea
Overekspresi A. thaliana Wu et al. 2009
ATAF2, PR1, PR2, PR4, PR5,
PDF1.1, PDF1.2
Pengaruh negatif terhadap resistensi pada F. oxysporum
Overekspresi/ knockout
[image:30.595.81.539.108.630.2]A.thaliana Delessert et al. 2005 Tabel 1. Fungsi faktor transkripsi pada cekaman biotik
terhadap cekaman abiotik. Peranan protein NAC dalam respon terhadap cekaman abiotik disimpulkan secara tidak langsung dari profil transkripsi. Data terbaru menunjukkan bahwa fungsi dari sebagian besar faktor transkripsi NAC mengatur transkripsi yang terkait respon tanaman terhadap cekaman abiotik (Gambar 4 dan Tabel 2). Regulasi yang ketat dan pengaturan gen NAC selama respon tanaman terhadap cekaman berkontribusi pada pembentukan sinyal yang kompleks, dan peranan penting dari gen NAC pada respon tanaman terhadap cekaman abiotik menjadikan gen NAC sebagai kandidat potensial untuk mengatur toleransi terhadap cekaman.
Gambar 4 Regulasi jaringan transkripsional cis acting elements dan faktor transkripsi yang dilibatkan dalam ekspresi gen terhadap respon cekaman abiotik. Faktor transkripsi mengendalikan ekspresi gen yang diinduksi oleh cekaman ditunjukkan dalam bentuk elips. cis acting elements berperan dalam respon terhadap cekaman ditunjukan dengan kotak (Nakashima et al. 2012).
Cekaman Kekeringan, Salinitas Tinggi, Suhu Rendah dan Osmotik
Cekaman abiotik memicu berbagai respon tanaman, dari perubahan ekspresi gen dan metabolisme sel terhadap perubahan pertumbuhan tanaman, pengembangan, dan produksi tanaman. Dengan demikian, memahami mekanisme toleransi terhadap kekeringan dan salinitas menjadi penting untuk peningkatan produksi pertanian. Faktor transkripsi NAC memiliki berbagai fungsi penting terhadap perkembangan tanaman dan respon terhadap cekaman. Gen-gen dalam kelompok SNAC memiliki peran penting dalam pengendalian toleransi terhadap cekaman lingkungan (Nakashima et al. 2012), dan dapat mengikat NACR (NAC
al. 2009; Jeong et al. 2010) dan SNAC1 meningkatkan produksi gabah (21-34%) pada kondisi cekaman kekeringan (Hu et al. 2006).
Gen Arabidopsis SNAC yang responsif terhadap cekaman, seperti gen
RD26 dan ATAF1, gen SNAC seperti SNAC1 pada padi, OsNAC6/SNAC2, dan
OsNAC5 dapat meningkatkan toleransi terhadap cekaman kekeringan dan/atau salinitas ketika dioverekspresikan (Tran et al. 2004;. Hu et al. 2006; Nakashima
et al. 2007, 2012; Takasaki et al. 2010). Overekspresi gen responsif cekaman dari
NACs menggunakan promoter yang responsif terhadap cekaman LIP9, OsNAC6, atau OsHox24 pada padi efektif meningkatkan toleransi terhadap cekaman tanpa menimbulkan efek penghambatan NAC pada tanaman (Nakashima et al.
2007, 2012, 2014; Takasaki et al. 2010). Penelitian terbaru menunjukkan bahwa promotor RCc3 yang spesifik pada akar tertentu, bermanfaat bagi overekspresi
SNACs seperti SNAC1 dan OsNAC10 untuk meningkatkan toleransi terhadap cekaman abiotik pada tanaman padi di lapangan (Jeong et al. 2010, 2013; Redillas
et al. 2012). Hasil tersebut menunjukkan bahwa SNACs memiliki peran penting dalam pengendalian respon dan toleransi terhadap cekaman abiotik dan memungkinkan untuk meningkatkan toleransi cekaman dengan overekspresi
SNACs menggunakan promotor yang sesuai di lapangan. Beberapa jenis promotor yang responsif terhadap kekeringan atau spesifik jaringan/organ tertentu pada akar/stomata dapat menjadi alat yang efektif untuk mengendalikan ekspresi faktor responsif terhadap kekeringan (Nakashima et al. 2007, 2014, Rai et al. 2009; Wu
et al. 2009; Xiao et al. 2009; Yi et al. 2010; Ganguly et al. 2011; Yang dan Xiong 2011; Bang et al. 2013 ; Rusconi et al. 2013). Berdasarkan hasil analisis fusi promotor-GUS yang diinduksi suhu rendah SNAC2/OsNAC6, OsNAC10,
RD29A, COR15A, KIN1, dan COR6 pada tanaman padi dan Arabidopsis, gen tersebut diatur selama pertumbuhan tanaman (akar, daun dan serbuk sari) pada saat terjadi cekaman kekeringan dan suhu rendah (Sindhu et al. 2008;. Jeong et al. 2010).
You et al. (2013) melaporkan bahwa OsOAT merupakan target langsung dari faktor transkripsi NAC yang responsif terhadap cekaman, SNAC2, dan overekspresi OsOAT pada padi menghasilkan peningkatan toleransi terhadap cekaman kekeringan dan osmotik. Tanaman dengan overekspresi GmNAC085
menunjukkan peningkatan toleransi terhadap kekeringan (Le et al. 2011), sedangkan overekspresi GmNAC11 menyebabkan peningkatan kepekaan terhadap cekaman salinitas dan manitol (Hao et al. 2011). Microaray dari akar dan daun padi dengan cekaman kekeringan menunjukkan bahwa gen NAC17 terinduksi oleh perlakuan cekaman kekeringan baik pada kondisi cekaman berat atau ringan (Nuruzzaman et al. 2012b).
SiNAC juga terinduksi secara simultan oleh perlakuan dehidrasi, salinitas dan metil jasmonat (Puranik et al. 2011). Demikian pula dengan ekspresi dari
DgNAC1, TaNAC2a dan EcNAC1 yang terinduksi oleh cekaman NaCl dan kekeringan pada tanaman tembakau transgenik (Liu et al. 2011; Ramegowda et al.
2012; Tang et al. 2012.). Beberapa gen ekspresinya meningkat pada saat terjadi cekaman kekeringan dan salinitas seperti: ZmSNAC1 (Lu et al. 2012), TaNAC69
(Xue et al. 2011), CarNAC3 (Peng et al. 2009), miR319, AsNAC60 (Zhou et al.
2013), AhNAC2 (Liu et al. 2011), RhNAC2 atau RhEXPA4 (Dai et al. 2012),
ClNAC (Huang et al. 2012), CsNAM (Paul et al. 2012), SiNAC (Puranik et al.
TaNAC6, dan TaNAC4 (Tang et al. 2012; Xia et al. 2010a). Overekspresi
OsNAC6 yang berasal dari Batutegi menunjukan pertumbuhan yang lebih baik dibanding tanaman kontrol pada saat terjadi cekaman kekeringan dan salinitas (Rachmat et al. 2014) (Tabel 2).
Interaksi antara Beberapa Faktor Transkripsi terhadap Kekeringan
Bukti adanya interaksi antara AREB/ABFs dan DREB/CBFs telah dilaporkan. Motif DRE/CRT di promotor untuk gen yang responsif terhadap kekeringan merupakan daerah pengikatan untuk ABA-independent DREB/CBF TF dan berfungsi sebagai cis element untuk ABRE pada ekspresi gen ABA-dependent
(Narusaka et al. 2003). Lee et al. (2010) menunjukkan bahwa protein DDREB1A/CBF3, DREB2A, dan DREB2C berinteraksi secara fisik dengan protein AREB/ABF. Data ini menunjukkan adanya interaksi antara unsur-unsur dari jalur respon ABA-dependent dan independent. Selain itu, telah diketahui adanya tanda-tanda interaksi pada jalur sinyal. Kim et al. (2012) melaporkan bahwa sekuen dari promotor ABRE, AREB/ABF TF, dan SnRK2s terlibat dalam ekspresi gen DREB2A dalam kondisi cekaman osmotik, menunjukkan adanya interaksi yang kompleks antara AREB dan DREB pada tingkat ekspresi gen serta tingkat protein.
Interaksi antara AREB/ABFs dan NACs juga telah ditunjukkan pada level ekspresi gen. Jensen et al. (2013) melaporkan bahwa Arabidopsis faktor transkripsi SNAC, ATAF1 secara langsung mengatur gen biosintesis ABA NCED3
di Arabidopsis, menunjukkan bahwa SNAC kemungkinan dapat mengatur ekspresi gen ABA-dependent dari ABRE. Di sisi lain, promotor gen SNAC
mengandung urutan basa ABRE (Nakashima et al. 2012). Baru-baru ini, Xu et al.
(2013) melaporkan bahwa Arabidopsis ANAC096 bekerja sama dengan faktor
AREB/ABF (ABF2/AREB1 dan ABF4/AREB2) dalam respon terhadap cekaman dehidrasi dan osmotik. Hasil ini menunjukkan interaksi yang kompleks antara
AREB/ABF dan NAC.
Cheng et al. (2013) melaporkan bahwa Arabidopsis eRF1 mengatur ekspresi gen dengan cara mengikat dua jenis cis-element, GCC box dan DRE/ CRT, sebagai respons terhadap sinyal adanya cekaman yang berbeda. ERF1 adalah upstream TF baik pada signal etilen dan jasmonat dan terlibat dalam resistensi terhadap patogen. Hasil penelitian menunjukkan bahwa ERF1 terikat pada GCC box namun tidak pada DRE/CRT sebagai respon terhadap cekaman biotik, dan pada DRE/CRT pada cekaman abiotik. Hasil ini menunjukkan bahwa ERF1 dapat mengintegrasikan signal etilen, jasmonat, dan ABA serta memainkan peran penting dalam respon terhadap cekaman biotik dan abiotik.
Prospek Faktor Transkripsi NAC
Gen Fungsi Metode Spesies Pustaka ANAC019/AT1G52890 Kekeringan ,
salinitas dan sinyal ABA
Overekspresi A. thaliana Tran et al. 2004
RD26, RD20, Glyoxalase, Kekeringan, salinitas dan respon ABA
Overekspresi A. thaliana Fujita et al. 2004 Glutathione, transferase,
Aldo/keto reductase, senesence ANAC019, COR47, RD29b, FER1 ERD11
Suhu rendah, sinyal ABA
Overekspresi A. thaliana Jensen et al. 2010 anac092-1, ANAC083, ANAC041 Regulator germinasi
benih dibawah kondisi salinitas
Mutant A. thaliana Balazadeh et al. 2010
ANAC054, ANAC084
ATAF1, COR47, ERD10, KIN1, RD22, RD29A
Regulator toleran kekeringan
knockouts (ataf1-1/2)
A. thaliana Lu et al. 2007
ATAF1, ADH1, RD29A, COR47 Regulator toleran kekeringan
Overekspresi A. thaliana Wu et al. 2009
ONAC063 Salinitas dan osmotik Overekspresi A. thaliana Yokotani et al. 2009 AhNAC2, RD29A, RD29B,
RAB18, ERD1, AtMYB2, AtMYC2, COR47, COR15a, KIN1, AREB1, CBF1
Toleran kekerinan dan salinitas
Overekspresi A. thaliana Liu et al. 2011
ANAC019, ANAC055 Ketahanan terhadap penyakit, jalur JA
Overekspresi A. thaliana Bu et al. 2008
TaNAC2 Kekeringan, salinitas
dan suhu rendah
Overekspresi A. thaliana
SNAC2/OsNAC6/Os01g66120 Salinitas, kekeringan, suhu rendah,dan ABA
Overekspresi O. sativa Sindhu et al. 2008
OsNAC5/ Os11g08210 ABA, salinitas, toleran suhu rendah
Overekspresi O. sativa Sperotto et al. 2009 ONAC04/Os11g033005 Toleran kekeringan,
salinitas dan suhu rendah
Overekspresi O. sativa Zheng et al. 2009
OsNAC10/Os11g03300 Kekeringan, salinitas, ABA
Overekspresi O. sativa Jeong et al. 2010 OsOAT, SNAC2 Toleran kekeringan
dan cekaman oksidatif
Overekspresi O. sativa You et al. 2013
SNAC1, OsSRO1c Cekaman oksidatif Overekspresi O. sativa You et al. 2013 GmNAC11, DREB1A, ERD11,
Cor15A, ERF5, RAB18, KAT2
Toleran salinitas Overekspresi G. max Hao et al. 2011 Os01g28050, Os01g29840 OsNAC6 Kekeringan Kekeringan, salinitas, ABA Microarray Overexpresi O. sativa O. sativa Nuruzzaman et al. 2012b Rachmat et al. 2014 Tabel 2. Fungsi faktor transkripsi pada cekaman abiotik
Penggunaan Polietilena Glikol (PEG)
Simulasi cekaman kekeringan banyak dilakukan dengan menggunakan larutan osmotikum yang dapat mengkontrol pontensial air dalam media tanaman. Terdapat tiga jenis bahan osmotikum yang sering digunakan yaitu melibiose, mannitol dan polietilena glikol (polyethilene glycol, PEG). Menurut Verslues et al. (2006) diantara ketiga bahan osmotikum tersebut ternyata PEG merupakan bahan yang terbaik untuk mengkontrol potensial air dan tidak dapat diserap tanaman atau menyebabkan keracunan pada tanaman. PEG adalah senyawa inert non ionik dan polimer dari ethylene oxyde dengan rumus HCOH2(CH2OCH2)n CH2OH; n adalah banyaknya grup oksi etilen. Senyawa ini tidak mudah dipecah oleh organisme hidup sehingga tidak bersifat toksik. PEG juga bersifat non metabolik sehingga tidak dapat disintesa oleh tanaman. PEG memiliki berat molekul 3.000 – 20.000 yang dapat larut sempurna dalam air.
Penggunaan larutan PEG meyebabkan penurunan potensial air secara homogen sehingga dapat digunakan untuk meniru besarnya potensial air tanah. Penurunan potensial air tergantung pada konsentrasi dan bobot molekul PEG yang terlarut. Total massa -CH2-O-CH2- atau kekuatan matriks subunit-etilen dalam mata rantai polimer PEG merupakan faktor penting yang mengkontrol besarnya penurunan potensial air. Bila PEG dilarutkan dalam air maka molekul air (H2O) akan tertarik ke atom oksigen pada subunit etilen oksida melalui ikatan hidrogen sehingga menyebabkan potensial air menurun. Semakin pekat konsentrasi PEG semakin banyak zat terlarut yang menahan masuknya air ke dalam jaringan tanaman akibatnya akar tanaman semakin sulit untuk menyerap air.
Menurut Chazen dan Neuman (1994) penggunaan PEG 6000 dalam jangka panjang pada tanaman relatif aman, karena PEG 6000 tidak dapat masuk ke dalam jaringan akar tanaman atau dinding selulosa hanya dapat dilewati oleh PEG dengan berat maksimum 3500. Namun menurut Blum (2004) akar yang rusak atau putus dapat mengabsorbsi PEG 6000-8000 sehingga dalam percobaan dihindari terjadinya kerusakan akar. Simulasi cekaman kekeringan dengan menggunakan larutan PEG dapat mendeteksi dan membedakan respon tanaman terhadap cekaman kekeringan. Keunggulan sifat PEG tersebut memungkinkan PEG dapat digunakan sebagai alternatif dalam seleksi genotipe pada kondisi cekaman kekeringan pada fase perkecambahan (Ogawa dan Yamauchi 2006).
Aktin
Aktin adalah protein yang sangat penting bagi sel eukariotik. Protein ini berperan penting dalam membentuk jaringan yang memberikan dukungan mekanik sel, menentukan bentuk sel, pergerakan sel, dan juga pembelahan sel (Vantard dan Blanchoin 2002; Blessing et al. 2004). Aktin juga penting dalam morphogenesis sel pada tumbuhan, sebagai komponen dinding sel, terlibat dalam pertumbuhan rambut akar, sel trikom, tabung pollen, perpanjangan sel dan apikal meristem (Gilliland et al. 2003). Kehilangan ekspresi gen ACT11 pada jaringan vegetatif dapat menyebabkan perubahan morfologi organ tanaman Arabidopsis
Aktin disandi oleh multigen famili pada tanaman (Li et al. 2005; Feng et al.
2006).
Pada Arabidopsis ada dua kelompok gen aktin yaitu kelompok vegetatif, yang diekspresikan dominan pada daun, batang, akar, petal dan sepal, serta kelompok generatif yang diekspresikan secara kuat pada polen, ovule, dan jaringan embrionik (Kandasamy et al. 2002). Gen-gen aktin Arabidopsis tersebut tersebar di kromosom 1, 2, 3 dan 5 (McKinney et al. 1998). Gen aktin termasuk
housekeeping gene (Tu et al. 2007), yaitu gen yang memiliki tingkat ekspresi yang stabil di berbagai jaringan pada semua tahapan perkembangan. Sifat gen yang seperti ini menjadikan gen aktin digunakan sebagai kontrol internal pada analisis ekspresi, khususnya analisis ekspresi gen dengan metode qRT-PCR (quantitative real time polymerase chain reaction) yang merupakan metode analisis ekspresi yang berkembang saat ini (Bas et al. 2004). Gen aktin adalah salah satu gen yang paling sering digunakan sebagai internal kontrol pada studi qRT-PCR (Bezier et al. 2002; Thomas et al. 2003; Chen et al. 2010).
Gen aktin telah digunakan sebagai kontrol ekspresi gen pada kentang (Nicot et al. 2005), kedelai (Jian et al. 2008), gandum (Paolacci et al. 2009), dan padi (Zhang et al. 2009). Menurut Maroufi et al. (2010), aktin termasuk salah satu kontrol internal yang paling stabil pada uji ekspresi gen di daun dan akar
Cichorium intybus. Hal yang sama direkomendasikan untuk uji ekspresi gen pada padi (Ambavaram dan Preira 2011) dan uji ekspresi gen perkembangan bantalan buah pada kurma China (Sun et al. 2009). Bahkan Olbrich et al. (2008) hanya merekomendasikan aktin sebagai kontrol internal untuk qRT-PCR pada tanaman
Fagus sylvatica L., setelah menguji kestabilan beberapa housekeeping gene, yaitu aktin, 18 rRNA, glyceraldehyd 3-phosphate dehydrogenase (GAPDH1, GAPDH2), tubulin dan ubiqitin likeprotein.
Tujuan Penelitian
1. Isolasi dan karakterisasi gen OsNAC6 yang berasal dari padi kultivar Rojolele, Nipponbare dan Batutegi.
2. Transformasi faktor transkripsi OsNAC6 asal cv. Batutegi ke tanaman padi cv. Ciherang menggunakan Agrobacterium.
3. Mempelajari pola ekspresi gen OsNAC6 berasal dari Batutegi melalui padi transgenik cv. Ciherang yang tercekam kekeringan dan salinitas.
Manfaat Penelitian
1. Mendapatkan informasi mengenai regulasi gen OsNAC6 yang sangat berguna dalam mempelajari fungsi gen OsNAC6 yang berasal dari kultivar Batutegi. 2. Meningkatkan efisiensi transformasi pada tanaman cv. Ciherang yang sulit
ditransformasi dengan metode Agrobacterium.
Kerangka Pemikiran
Indonesia memiliki lahan-lahan sub optimal potensial, salah satunya lahan kering. Luas lahan kering Indonesia mencapai 51 juta ha (Ar-Riza 2000) yang belum dimanfaatkan maksimal. Tuntutan produksi yang besar tidak lepas dari berbagai permasalahan yang seringkali menyebabkan turunnya produktivitas padi secara nasional. Permasalahan tersebut antara lain penyempitan areal lahan sawah akibat konversi fungsi lahan, berkurangnya sumber air, dan perubahan iklim ekstrim akibat pemanasan global. Fenomena perubahan iklim ekstrim antara lain adalah kemarau panjang.
Perubahan iklim dari musim hujan ke musim kering atau sebaliknya menjadi sulit untuk diprediksi. Cekaman kekeringan merupakan faktor yang sangat berpengaruh terhadap penurunan hasil panen. Untuk itu diupayakan merakit tanaman yang diharapkan meningkatkan ketahanan tanaman padi terhadap cekaman kekeringan. Pengaruh kekeringan terhadap tanaman bergantung pada genetik tanaman dan tingkat kekeringan yang terjadi. Perbedaan morfologi, anatomi dan metabolisme akan menghasilkan respon yang berbeda pada tanaman terhadap cekaman kekeringan. Untuk mempelajari gen terkait kekeringan maka dilakukan analisis karakterisasi gen OsNAC6 dengan memanfaatkan kemajuan dibidang bioinformatik. Introduksi gen OsNAC6 yang berasal dari padi cv. Batutegi ke kultivar Ciherang dengan menggunakan promoter konstitutif CaMV 35S diharapkan dapat memberikan informasi mengenai fungsi gen OsNAC6
terkait cekaman kekeringan dan salinitas.
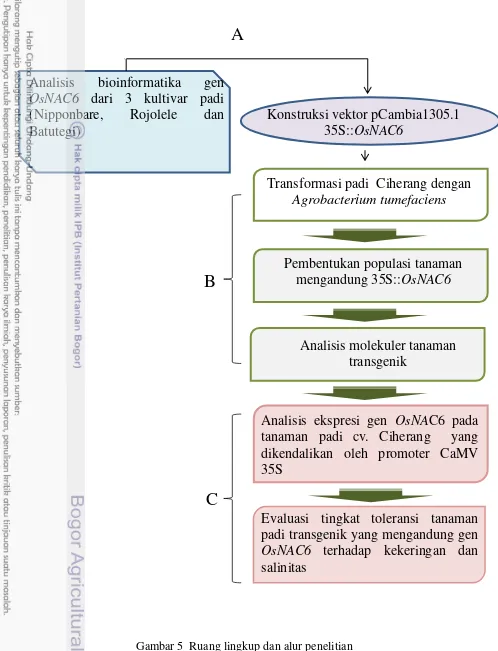
Kegiatan yang dilakukan dalam penelitian ini memiliki ruang lingkup yang saling berkaitan untuk mencapai tujuan yang diharapkan. Tahapan-tahapan yang dilakukan dalam penelitian ini adalah sebagai berikut: Percobaan 1) Isolasi dan karakterisasi gen OsNAC6 yang berasal dari DNA genom tanaman padi.
Percobaan 2) Transformasi padi indica dengan gen regulator OsNAC6 untuk perakitan padi toleran kekeringan. Percobaann 3) Overekspresi faktor transkripsi
Gambar 5 Ruang lingkup dan alur penelitian
Transformasi padi Ciherang dengan
Agrobacterium tumefaciens
Analisis
bioinformatika
gen
OsNAC6
dari 3 kultivar padi
(Nipponbare,
Rojolele
dan
Batutegi)
Evaluasi tingkat toleransi tanaman
padi transgenik yang mengandung gen
OsNAC6
terhadap kekeringan dan
salinitas
Analisis ekspresi gen
OsNA
C6 pada
tanaman padi cv. Ciherang yang
dikendalikan oleh promoter CaMV
35S
Pembentukan populasi tanaman
mengandung 35S::
OsNAC6
Analisis molekuler tanaman
transgenik
Konstruksi vektor pCambia1305.1
35S::
OsNAC6
A
B
SEKUEN DAN ANALISIS FILOGENETIKA DARI GEN
NAC
YANG BERASAL DARI DNA GENOM TANAMAN PADI
(
Oryza sativa
L.)
Abstrak
Isolasi dan karakterisasi gen OsNAC6 (Oryza sativa NAC 6) asal padi
Oryza sativa L. kultivar Rojolele, Nipponbare dan Batutegi diharapkan dapat bermanfaat bagi pengembangan program pemuliaan padi khususnya terkait toleran terhadap cekaman kekeringan dan salinitas. Faktor transkripsi mempunyai p