BIOMASSA DIATOM PERIFITIK
PADA SUBSTRAT
ZEOCRETE
DENGAN KONSENTRASI P YANG BERBEDA
DHINA MARETHA
SKRIPSI
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
BIOMASSA DIATOM PERIFITIK PADA SUBSTRAT ZEOCRETE
DENGAN KONSENTRASI P YANG BERBEDA
Adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini
Bogor, Januari 2006
Dhina Maretha. C24101054. Biomassa Diatom Perifitik pada Substrat Zeocrete dengan Konsentrasi P yang Berbeda. Di bawah bimbingan Kadarwan Soewardi dan Majariana Krisanti.
RINGKASAN
Diatom perifitik merupakan salah satu komunitas penyusun perifiton yang dapat dimanfaatkan sebagai pakan alami bagi larva udang. Diatom perifitik dapat hidup di suatu perairan karena perairan mampu memenuhi faktor-faktor biologis yang mendukung pertumbuhannya. Apabila diupayakan suatu tempat hidup bagi diatom perifitik dengan kondisi yang juga mampu memenuhi faktor-faktor biologis yang dibutuhkan, maka diatom perifitik dapat hidup di sana. Oleh karena itu direalisasikan sebuah substrat buatan yang terdiri dari campuran zeolit, semen, ijuk dan unsur hara yang diberi istilah zeocrete sebagai tempat hidup diatom perifitik. Unsur hara yang dikeluarkan oleh substrat zeocrete akan dimanfaatkan oleh diatom perifitik untuk pertumbuhannya. Untuk mengetahui kemampuan substrat zeocrete sebagai tempat hidup bagi diatom perifitik perlu dilakukan pengkajian mengenai biomassa diatom perifitik yang ditumbuhkan pada substrat tersebut.
Diatom perifitik ditumbuhkan pada empat tipe perlakuan substrat zeocrete,
yaitu substrat zeocrete tanpa penambahan unsur hara (ZK0) serta substrat zeocrete
yang diberi tambahan unsur hara dengan konsentrasi P = 0,02 (ZK1); 0,2 (ZK2); dan 2 (ZK3) ppm, pada rasio N:P = 30:1. Unsur hara yang dicampurkan ke dalam substrat berasal dari larutan pupuk urea, TSP, dan sodium metasilika. Parameter lingkungan (intensitas cahaya, suhu, salinitas, pH, DO) mengalami pengontrolan selama penelitian agar tetap pada kondisi optimum untuk pertumbuhan diatom.
Media pertumbuhan diatom perifitik menyediakan ammonia, nitrat, ortofosfat, dan silika yang dilepaskan oleh substrat zeocrete. Substrat zeocrete
akan melepaskan unsur hara bila unsur hara di perairan kurang memadai dalam mendukung pertumbuhan diatom, dan akan menyerap unsur hara bila unsur hara di perairan berlebih.
Semua jenis diatom perifitik dapat tumbuh dan berkembang pada substrat
BIOMASSA DIATOM PERIFITIK
PADA SUBSTRAT
ZEOCRETE
DENGAN KONSENTRASI P YANG BERBEDA
DHINA MARETHA
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Manajemen Sumberdaya Perairan
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : Biomassa Diatom Perifitik pada Substrat Zeocrete dengan Konsentrasi P yang Berbeda
Nama : Dhina Maretha
NIM : C24101054
Disetujui,
Pembimbing I Pembimbing II
Dr. Ir. Kadarwan Soewardi Majariana Krisanti, S.Pi., M.Si NIP. 130805031 NIP. 132133970
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Dr. Ir. Kadarwan Soewardi. NIP. 130805031
PRAKATA
Puji syukur kehadirat Allah SWT atas rahmat, taufik, dan hidayah-Nya sehingga penulis mampu menyelesaikan tugas akhir ini dengan baik.
Tugas akhir ini berjudul “Biomassa Diatom Perifitik Pada Substrat Zeocrete Dengan Konsentrasi P Yang Berbeda” yang disusun sebagai salah satu syarat dalam memperoleh Sarjana Perikanan pada Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian ini berlangsung selama empat bulan yaitu sebagai bagian dari penelitian mahasiswa pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada :
1. Dr. Ir. Kadarwan Soewardi danMajariana Krisanti, S.Pi, M.Si selaku dosen pembimbing yang telah banyak memberikan masukan, arahan dan bimbingan selama penyusunan skripsi ini.
2. Ir. Niken T. M. Pratiwi, M.Si. selaku dosen yang telah memberikan kesempatan kepada penulis untuk ikut serta dalam penelitian ini dan telah memberikan saran, nasehat serta bimbingan kepada penulis.
3. Dosen pe nguji departemen atas masukan serta saran-saran yang telah diberikan, sehingga penulisan skripsi ini dapat menjadi lebih baik.
4. Prof. Dr. Ir. Djamar T. F. Lumbanbatu, M.Agr selaku dosen pembimbing akademik, yang telah memberikan nasehat kepada penulis selama kuliah. 5. Papi, Mami, Ikha, Ocha, dan Esa yang telah banyak memberi doa, dukungan
dan nasehat kepada penulis.
6. Dian Ary ‘Blondho’ atas pengertian, kasih sayang, doa dan dukungan kepada penulis.
7. Inna, Fadia, Icha, Anton, Bram, dan Hendro yang senantiasa memberikan kasih sayang, nasehat dan semangat kepada penulis.
8. K’Moko, Grace, Idham, Ria, Komang, Ibu Siti dan M’Inna atas kerjasamanya selama penelitian.
9. Teman-teman MSP, FPIK, IPB atas kebersamaannya selama ini.
Bogor, Januari 2006
IV. HASIL DAN PEMBAHASAN... 21
A. Hasil ... 21
1. Kelimpahan dan Biomassa Diatom Perifitik ... 21
1.1. Kelimpahan Diatom Perifitik ... 21
1.2. Biomassa Diatom Perifitik ... 22
2. Kandungan Unsur Hara ... 24
B. Pembahasan ... 27
1. Kelimpahan da n Biomassa Diatom Perifitik ... 27
1.1. Kelimpahan Diatom Perifitik ... 27
1.2. Biomassa Diatom Perifitik ... 29
2. Kandungan Unsur Hara ... 32
V. KESIMPULAN DAN SARAN ... 37
A. Kesimpulan ... 37
B. Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
Tabel Halaman
1. Metode dan alat yang digunakan selama penelitian
(APHA, 1989) ... 13
2. Tabel sidik ragam dari rancangan petak terpisah
DAFTAR GAMBAR
Gambar Halaman
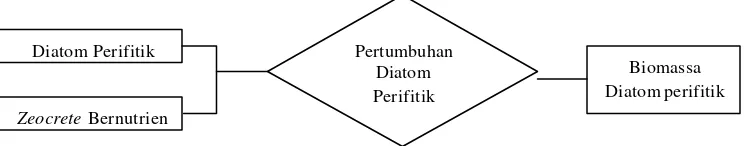
1. Skema perumusan masalah biomassa diatom perifitik pada substrat zeocrete dengan konsentrasi
P yang berbeda ... 2
2. Substrat zeocrete dan sketsa peletakan di dalam
bingkai... 15
3. Susunan substrat zeocrete di dalam bingkai ... 15
4. Kelimpahan diatom perifitik (sel/cm2) seluruh
perlakuan selama penelitian ... 23
5. Biomassa total diatom perifitik (ì g/cm2) seluruh perlakuan selama penelitian Grafik kandungan nitrat (mg/l) media pada seluruh perlakuan selama
penelitian ... 24
6. Kandungan ortofosfat media pada seluruh perlakuan
selama penelitian ... 25
7. Kandungan ammonia media pada seluruh perlakuan
sela ma penelitian ... 26
8. Kandungan nitrat media pada seluruh perlakuan
selama penelitian ... 26
9. Kandungan silika media pada seluruh perlakuan
selama penelitian ... 27
10. Kelimpahan total diatom perifitik (sel/cm2) seluruh
DAFTAR LAMPIRAN
Lampiran Halaman
1. Bahan-bahan yang digunakan dalam pengambilan data ... 43
2. Tahap-tahap aktivasi zeolit ... 44
3. Perhitungan pupuk ... 45
4. Diatom perifitik yang diamati selama penelitian ... 46
5. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete tanpa penambahan nutrien selama penelitian... 47
6. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete dengan konsentrasi P 0,02 ppm selama penelitian ... 47
7. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete dengan konsentrasi P 0,2 ppm selama penelitian... 47
8. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete dengan konsentrasi P 2 ppm selama penelitian... 47
9. Biomassa total diatom perifitik (x 102 ìg/cm2) seluruh perlakuan selama penelitian ... 48
10. Uji sidik ragam biomassa total diatom perifitik ... 48
11. Kandungan ortofosfat (mg/l) media pada semua perlakuan selama penelitian ... 49
12. Kandungan ammonia (mg/l) media pada semua perlakuan selama penelitian ... 49
13. Kandungan nitrat (mg/l) media pada semua perlakuan selama penelitian ... 49
14. Kandungan silika (mg/l) media pada semua perlakuan selama penelitian ... 50
I. PENDAHULUAN
A. Latar Belakang
Perifiton adala h mikroflora atau fauna yang tumbuh di atas substrat di bawah permukaan air (Welch, 1980). Odum (1971) mengartikan perifiton sebagai tumbuhan atau hewan yang tumbuh menempel pada objek tenggelam. Round in
Wood (1967) menggunakan istilah perifiton untuk digunakan pada algae yang tumbuh di permukaan substrat buatan (bewuch) atau substrat alami (aufwuch). Komunitas perifiton pada umumnya terdiri atas algae mikroskopik yang bersifat sesil, satu sel maupun filamen, terutama kelompok Diatom, kelompok Conjugales, Cyanophyceae, Xantophyceae, dan Chrysophyceae (Round, 1964 in Wetzel, 1975).
Kelompok Diatom yang hidup pada substrat di suatu perairan termasuk komunitas perifiton sehingga dapat disebut dengan Diatom perifitik. Diatom perifitik adalah perifiton nabati dari kelompok diatom yang menempel pada permukaan batuan dan dapat melakukan proses fotosintesis dengan memanfaatkan energi matahari untuk mengubah senyawa anorganik menjadi senyawa organik. Diatom perifitik merupakan pakan alami yang sangat disukai oleh larva udang karena mengandung asam lemak tak jenuh, vitamin, serta asam-asam amino yang lebih lengkap bila dibandingkan dengan pakan buatan. Permasalahan yang sering ditemui di tambak udang adalah sulitnya menumbuhkan diatom pada awal penebaran larva udang. Pada umumnya awal penebaran larva udang dilakukan dua minggu setelah pemupukan. Apabila dalam rentang waktu penebaran larva udang kepadatan diatom tinggi, maka larva udang akan tumbuh dengan baik.
perifitik dengan kondisi yang juga mampu memenuhi faktor-faktor biologis yang dibutuhkan, maka diatom perifitik dapat hidup di sana. Oleh karena itu direalisasikan sebuah substrat buatan yang terdiri dari campuran zeolit, semen putih dan nutrien yang diberi istilah zeocrete sebagai tempat hidup diatom perifitik. Zeolit adalah mineral kristalin dari kelompok tektosilikat, yaitu aluminosilikat terhidrasi dengan kation alkali dan alkali tanah, yang mempunyai struktur tiga dimensi (Ming dan Mumpton, 1989 in Krisanti, 2003). Zeolit mempunyai kemampuan menyerap ion-ion bila perairan memiliki kandungan unsur hara yang berlebih dan sebaliknya akan melepaskan ion-ion apabila kandungan unsur hara di perairan berkurang.
Unsur hara yang dikeluarkan oleh substrat zeocrete akan dimanfaatkan oleh diatom perifitik untuk pertumbuhannya, sehingga dapat diketahui biomassa diatom perifitik dengan metode pengukuran klorofil yang merupakan bagian dari tubuh diatom perifitik. Klorofil adalah pigmen fotosintetik utama yang terkandung di dalam tanaman berfotosintesis, tumbuhan tingkat tinggi dan alga hijau. Dalam penelitian ini akan diukur klorofil sebagai metode pendugaan biomassa diatom perifitik.
B. Pendekatan Masalah
Penelitian ini menggunakan diatom perifitik karena mampu menempel pada substrat buatan (zeocrete) yang digunakan. Substrat zeocrete menyediakan unsur hara (N dan P) yang dibutuhkan untuk pertumbuhan diatom perifitik dengan perlakuan yang berbeda (konsentrasi P berbeda). Konsentrasi N mengikuti konsentrasi P yang diterapkan pada rasio 30:1. Dari penerapan konsentrasi P yang berbeda (0.02 ppm, 0.2 ppm, dan 2 ppm) pada substrat-substrat zeocrete, dapat diketahui biomassa dari diatom perifitik yang hidup pada masing-masing perlakuan substrat tersebut.
Gambar 1. Skema perumusan masalah biomassa diatom perifitik pada substrat
zeocrete dengan konsentrasi P yang berbeda.
C. Tujuan
II. TINJAUAN PUSTAKA
A. Komposisi Perifiton
Perifiton sebagai aufwuchs yaitu kelompok organisme (umumnya mikroskopik) yang hidup menempel pada benda atau pada permukaan tumbuhan air yang terendam; tidak menembus substrat; diam atau bergerak di permukaan substrat tersebut (Pennak, 1964). Weitzel (1979) menyatakan bahwa perifiton meliputi seluruh tumbuhan kecuali makrofita yang tumbuh pada materi yang tenggelam; materi yang dimaksud adalah sedimen, batu, debris, dan organisme hidup. Dengan demikian yang dimaksud dengan perifiton adalah organisme baik nabati ataupun hewani yang hidup menempel pada substrat di suatu badan air.
Menurut Umaly, Launders, dan Cuvin, in Supriyanti (2001) komposisi organisme yang menyusun perifiton dapat berupa zoo-glea dan bakteri berfilamen, jenis-jenis protozoa yang hidup menempel, rotifer, dan alga, termasuk mikroorganisme yang ditemukan berenang, merayap, atau tersangkut pada substrat. Ruttner (1973) menyatakan bahwa tipe substrat sangat menentukan proses kolonisasi dan komposisi perifiton, hal ini berkaitan dengan kemampuan dan alat penempelnya. Proses kolonisasi merupakan pembentukan koloni perifiton pada substrat yang berlangsung setelah perifiton menempel pada substrat. Menurut Wetzel (1975) berdasarkan substrat penempelannya, perifiton dapat dibedakan atas :
1. Epipelik yaitu perifiton yang menempel pada permukaan sedimen. 2. Epilitik yaitu perifiton yang menempel pada permukaan batuan. 3. Epifitik yaitu perifiton yang menempel pada permukaan tumbuhan. 4. Epizooik yaitu perifiton yang menempel pada permukaan hewan.
5. Epipsamik yaitu perifiton yang menempel pada permukaan butir-butir pasir. Welch (1980) menyatakan bahwa perifiton dapat tumbuh pada substrat buatan seperti plexiglass, gelas obyek, kayu, dan blok-blok beton. Adapun keuntungan menggunakan substrat buatan adalah :
1. Mudah standarisasinya.
3. Pengumpulan datanya mudah.
4. Perifiton adalah petunjuk yang peka dari kualitas air.
B. Zeocrete
Zeocrete merupakan substrat buatan yang terdiri dari campuran zeolit, semen, dan ijuk. Zeolit adalah mineral kristal aluminosilikat terhidrasi dengan kation-kation alkali dan alkali tanah yang memiliki struktur kristal tiga dimensi yang tidak terbatas (Ming dan Mumpton, 1989 in Krisanti, 2003). Susunan tiga dimensinya adalah (Si, Al)O4 tetrahedral, memiliki pori yang berisi molekul air
dan kation yang dapat dipertukarkan.
Rumus umum zeolit menurut Gottardi in Krisanti (2003) adalah (Mx+, My2+)(Al(x+2y)Sin-(x+2y)O2n).mH2O
dengan M+ dan M2+ sebagai kation monovalen dan divalen, x dan y adalah bilangan tertentu, m adalah jumlah molekul air kristal yang selalu berubah-ubah. Kation yang berada pada tanda kurung pertama adalah kation yang dapat ditukar, sedangkan kation dalam tanda kurung kedua disebut kation struktural, karena bersama -sama oksigen membentuk kerangka struktur mineral.
Zeolit merupakan mineral silikat sekunder yang mempunyai kapasitas tukar kation tinggi. Kapasitas tukar kation dari zeolit ini terutama merupakan fungsi dari tingkat penggantian Si oleh Al dalam struktur kerangka. Makin besar penggantian makin besar pula kekurangan muatan positif sehingga makin banyak pula jumlah kation alkali atau alkali tanah yang dibutuhkan untuk menetralkan muatan listriknya (Suyartono, 1986). Zeolit dicirikan oleh kemampuannya untuk mengikat dan melepaskan air serta pertukaran kation-kation tanpa terjadi perubahan pada strukturnya. Sifat pertukaran ion pada zeolit berbeda dengan mineral lain. Mekanisme pertukaran ion pada zeolit bersifat selektif terhadap kation-kation yang diperlukan (Munson dan Shepard, 1974 in Tobing, 1999).
C. Biomassa
Penentuan biomassa yang digunakan dalam penelitian ini adalah dengan pendekatan klorofil yaitu berdasarkan kandungan klorofil dari diatom perifitik yang menempel pada substrat zeocrete.
Menurut Lee (1980) diatom memiliki klorofil-a, c1, dan c2 serta pigmen
karotenoid yang akan memberi karakteristik warna pada sel diatom. Klorofil-a ini memiliki peran penting dalam proses fotosintesis sehingga diatom mampu untuk mengubah zat anorganik menjadi bahan organik sebagai sumber makanan di perairan. Proses fotosintesis ini dapat dinyata kan sebagai berikut :
sinar matahari + klorofil
6CO2 + 6H2O C6H12O6 + 6O2
Produk turunan dari klorofil, phaeophytin, secara struktural sama dengan klorofil kecuali magnesium yang hilang dari struktur cincin. Banyaknya total pigmen ditentukan dengan aseton alkalin (klorofil ditambahkan dengan phaeophytin). Sampel yang sama diasamkan, sampai klorofil diturunkan menjadi phaeophytin, sehingga konsentrasi klorofil bisa ditentukan dengan absorbansi yang berbeda (Wetzel dan Likens, 1991).
Teknik pengukuran klorofil secara kimia yang sudah pernah digunakan antara lain secara spektrofotometrik dan fluorometrik. Pengukuran secara spektrofotometrik dilakukan menggunakan panjang gelombang yang dapat diatur sesuai dengan keperluan penelitian. Menurut Aminot dan Rey (2000), klorofil-a merupakan pigmen paling maksimal dalam menyerap cahaya matahari dengan tingkat optimum berada pada wilayah panjang gelombang kurang dari 0.46 ì m (violet) dan 0,63-0,67 ì m (merah).
D. Fisika-kimia Perairan
Beberapa faktor fisik-kimiawi perairan yang mempunyai keterkaitan dengan perubahan kelimpahan, dan biomassa diatom perifitik antara lain : intensitas cahaya, suhu, pH, salinitas, dan oksigen terlarut.
1. Intensitas cahaya
yang menyebabkan perubahan suhu dan akan berakibat pada kecocokan perairan sebagai habitat bagi organisme akuatik, karena setiap organisme akuatik memiliki kisaran suhu minimum dan maksimum tertentu untuk hidupnya. Fungsi kedua yaitu cahaya sebagai sumber energi bagi proses fotosintesis oleh alga dan tumbuhan air (Jeffries dan Mills, 1996 in Effendi, 2003).
Diatom akan mendominasi perairan saat intensitas cahaya tinggi dan suhu rendah. Alga hijau melimpah pada kondisi intensitas cahaya tinggi dan suhu tinggi, sedangkan alga biru akan mendominasi apabila intensitas cahaya rendah dan suhu tinggi (Hutchinson in Welch, 1980). Bila dikaitkan dengan salinitas, maka diatom cenderung meningkat seiring dengan peningkatan salinitas dan berlaku sebaliknya untuk alga hijau (Saanin, 1986 in Andarias, 1991).
2. Suhu
Menurut Pescod (1973), suhu air mempengaruhi sifat fisik, kimia, dan biologi perairan. Suhu merupakan fungsi dari kelarutan gas-gas dalam air laut dimana kelarutan akan meningkat pada saat temperatur rendah (Sumich, 1992).
Wardoyo (1981) menyatakan bahwa kenaikan suhu menyebabkan penurunan oksigen terlarut sehingga proses dekomposisi bahan organik oleh mikroorganisme yang dapat menghasilkan unsur hara menjadi menurun. Suhu yang baik untuk kultur alga di laboratorium berkisar antara 20-30 ºC, suhu optimum untuk kebanyakan alga berkisar antara 20-25 ºC (Fogg, 1975).
3. Salinitas
Menurut Schuster (1952) in Andarias (1991) salinitas optimum untuk pertumbuhan algae di tambak berkisar dari 19-45‰. Pada salinitas tinggi organisme yang dominan adalah diatom, sedangkan pada salinitas rendah organisme yang dominan adalah alga biru. Barnes dan Green (1972) menyatakan bahwa semakin tinggi salinitas umumnya kadar nitrat dan ortofosfat semakin rendah.
4. pH
Nilai pH merupakan hasil pengukuran aktivitas ion hidrogen dalam perairan dan menunjukkan keseimbangan antara asam dan basa air. Nilai pH dipengaruhi oleh beberapa faktor antara lain aktivitas biologis seperti fotosintesis dan respirasi organisme, suhu, dan keberadaan ion-ion dalam perairan tersebut (Pescod, 1973).
Perubahan nilai pH air laut (asam atau basa) akan sangat mempengaruhi pertumbuhan dan aktivitas biologis. Keberadaan unsur hara di laut secara tidak langsung dapat dipengaruhi oleh perubahan nilai pH. Nilai pH perairan juga dpat dipengaruhi oleh kandungan oksigen terlarut dan karbondioksida (CO2) di
perairan (Boyd, 1990). Menurut Odum (1971) pH perairan yang cocok untuk pertumbuhan organisme air berkisar antara 6-9.
5. Oksigen Terlarut
Oksigen terlarut adalah besarnya kandungan oksigen yang terlarut dalam air yang biasa dinyatakan dalam satuan mg/l. Kelarutan oksigen di perairan dipengaruhi oleh suhu, tekanan parsial gas-gas yang ada di udara maupun di air, kadar garam dan unsur-unsur yang mudah teroksidasi di dalam perairan. Semakin meningkat suhu air, kadar garam, dan tekanan gas -gas terlarut maka semakin berkurang kelarutan oksigen dalam air (Wardoyo, 1981). Peningkatan suhu sebesar 1 ºC akan meningkatkan konsumsi oksigen sekitar 10 % (Brown, 1987 in
E. Unsur Hara
Unsur hara merupakan salah satu faktor penentu yang diperlukan untuk pertumbuhan dan kelangsungan hidup organisme ototrof. Unsur hara utama yang diperlukan diatom adalah N, P, dan Si, walaupun unsur lainnya seperti Fe, Mn, Cu, Zn, dan Mo juga diperlukan untuk pertumbuhan tetapi dalam jumlah yang relatif sedikit. Unsur P dalam ortofosfat dan N dalam bentuk nitrat berfungsi untuk membentuk jaringan protoplasma, sedangkan Si berfungsi untuk membentuk dinding sel atau cangkang.
Kesuburan perairan adalah deskripsi kualitatif yang menyatakan konsentrasi unsur hara yang terdapat dalam suatu perairan. Tingkat kesuburan suatu perairan dipengaruhi oleh kandungan unsur hara, baik unsur hara organik maupun anorganik. Senyawa fosfat dan nitrat merupakan unsur hara yang dapat dijadikan sebagai petunjuk kesuburan perairan dan dibutuhkan organisme ototrof dalam pertumbuhan dan perkembangan hidupnya (Nybakken, 1992).
1. Fosfor
Unsur fosfor merupakan salah satu unsur esensial bagi pembentukan protein dan metabolisme sel organisme. Wardoyo (1981) menyatakan bahwa dalam perairan, unsur fosfor terdapat dalam senyawaan fosfat yang berada dalam bentuk anorganik (ortofosfat, metafosfat, dan polifosfat) dan organik (dalam tubuh organisme melayang, asam nukleat, fosfolipid, gula fosfat, dan senyawa organik lainnya). Ketiga bentuk fosfat anorganik tersebut dinyatakan sebagai fosfat total. Fosfat merupakan salah satu faktor yang diperlukan dan mempunyai pengaruh terhadap pertumbuhan dan perkembangan hidup organisme di laut (Nybakken, 1992). Fosfor sering dianggap sebagai faktor pembatas, didasarkan pada kenyataan bahwa fosfor sangat diperlukan dalam transfer energi. Dalam jumlah yang sangat sedikit akan menyebabkan defisiensi zat hara yang dapat menekan pertumbuhan fitoplankton, serta mengurangi produktivitas dalam suatu perairan (Sumawidjaja, 1983 in Dwikorawati, 1994).
tersuspensi seperti tanah atau sedimen. Konsekuensinya ortofosfat jarang ditemukan dalam bentuk larutan (Henderson-Seller dan Markland, 1987). Menurut Wetzel (1975) perairan akan didominasi diatom jika kadar fosfat rendah (0.00-0.02 mg/l), pada kadar fosfat 0,02-0,05 mg/l di perairan banyak tumbuh Chlorophyceae, dan pada kadar yang lebih tinggi dari 0,10 mg/l banyak terdapat Cyanophyceae.
Faktor-faktor penentu ketersediaan unsur P potensial di suatu perairan adalah konsentrasi P dari dalam dan P dari luar. Unsur ini sebagian akan larut dalam air dan langsung efektif bagi pertumbuhan fitoplankton (Fleming, 1975). Unsur P yang sedikit jumlahnya serta dalam perbandingannya dengan unsur N tidak serasi seringkali merupakan faktor pembatas bagi pertumbuhan fitoplankton (Parsons etal., 1997). Menurut Pratiwi (1997) penambahan unsur hara, terutama P ke dalam suatu perairan akan mendorong laju pertumbuhan dan peningkatan biomassa fitoplankton. Tetapi hal ini harus didukung oleh faktor cahaya, suhu, serta kondisi fisika-kimia yang layak dan serasi dengan ketersediaan unsur P efektif.
2. Nitrogen
Senyawa nitrogen terdapat di perairan laut dalam bentuk yang beragam mulai dari molekul nitrogen terlarut hingga bentuk partikel. Senyawa nitrogen merupakan salah satu senyawa yang sangat penting dan menjadi faktor pembatas di laut (Grahame, 1987). Senyawa dalam air laut terdapat dalam tiga bentuk utama, yaitu ammonia, nitrit, dan nitrat. Senyawa nitrogen tersebut sangat dipengaruhi oleh kandungan oksigen bebas dalam air. Pada saat oksigen tinggi, nitrogen berubah menjadi nitrat. Dengan demikia n, nitrat merupakan akhir dari oksidasi nitrogen dalam air (Hutagalung dan Rozak, 1997). Unsur nitrogen yang terdapat dalam senyawa nitrat merupakan zat-zat hara anorganik utama yang diperlukan oleh pertumbuhan fitoplankton.
terionisasi (NH3). Ammonia dalam bentuk tidak terionisasi lebih beracun
daripada yang terionisasi (Goldman dan Horne, 1983). Urea adalah contoh pupuk yang mengandung ammonium, berfungsi untuk menambah pasokan nitrogen ke dalam tanah yang dimanfaatkan secara langsung oleh tumbuhan. Ammonia jarang ditemukan pada perairan yang mendapat cukup pasokan oksigen. Pada wilayah anoksik (tanpa oksigen), biasanya terjadi di dasar perairan, kadar ammonia relatif tinggi (Effendi, 2003).
Batas toleransi fitoplankton terhadap kandungan ammonia di perairan adalah kurang dari 0,2 mg/l (Pescod, 1973). Kandungan ammonia pada perairan yang baik biasanya tidak lebih dari 1,0 mg/l (Lind, 1979).
Nitrat adalah bentuk nitrogen utama di perairan alami. Sifatnya mudah larut dan stabil. Nitrat merupakan nutrien utama bagi pertumbuhan fitoplankton. Konsentrasi nitrat di perairan dikontrol dalam proses nitrifikasi, yang merupakan proses oksidasi senyawa ammonia dalam kondisi aerob oleh bakteri autotrof. Proses nitrifikasi dipengaruhi oleh beberapa faktor seperti keberadaan senyawa beracun di perairan, suhu, pH, kandungan oksigen terlarut, dan salinitas (Novotny dan Olem, 1994). Kadar nitrat yang dibutuhkan untuk pertumbuhan optimal fitoplankton berkisar antara 0,900-3,500 mg/l, namun bila kandungan nitrat kurang dari 0,144 mg/l maka nitrat akan menjadi faktor pembatas (Mackenthum, 1969 in Lestari, 2003).
3. Silika
Silika termasuk salah satu unsur yang esensial bagi makhluk hidup. Diatom (Bacillariophyceae) membutuhkan silika untuk pembentukan frustul (dinding sel) (Reynolds, 1984). Unsur Si diserap dalam bentuk ortosilikat yang pelarutan dan penguraiannya dipengaruhi oleh CO2 bebas dan asam-asam organik
III. METODE PENELITIAN
A. Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan Februari-Juni 2005. Penelitian dilaksanakan di Laboratorium Kultur Plankton, Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis fisika dan kimia dilakukan di Laboratorium Fisika-Kimia Perairan Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan. Analisis biologi dilakukan di Laboratorium Bio Mikro I (BIMI I) Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan.
B. Alat dan Bahan
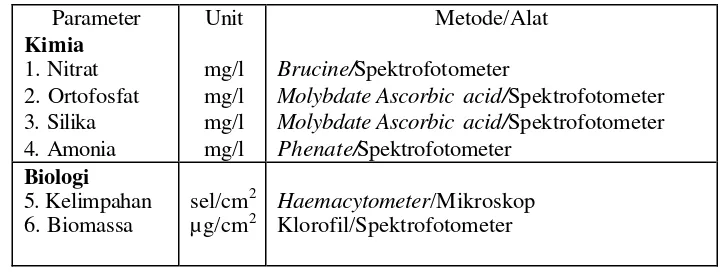
Secara umum metode dan alat yang digunakan dalam penelitian ini disajikan pada Tabel 1.
Tabel 1. Metode dan alat yang digunakan selama penelitian (APHA, 1989).
Parameter Unit Metode/Alat
Kimia
Molybdate Ascorbic acid/Spektrofotometer
Molybdate Ascorbic acid/Spektrofotometer
Phenate/Spektrofotometer
Bahan-bahan yang digunakan adalah inokulan perifiton, substrat zeocrete, pupuk TSP (32% P2O5), pupuk urea (46% N), dan Na2SiO3 (34% Si(OH)2), HCl,
kaporit, larutan Na-thiosulfat, air laut steril dengan salinitas 28o/o o, akuades,
C. Persiapan Penelitian
1. Sterilisasi alat dan bahan
Sterilisasi peralatan seperti wadah, pipet, dan alat-alat lain dilakukan dengan pencucian menggunakan larutan deterjen, dibilas dengan air bersih, direndam larutan HCl 0.2 N selama ± 30 menit, kemudian dibilas kembali dengan akuades dan direbus dalam air mendidih selama 10 menit serta ditiriskan. Setelah itu, pada bagian dalam dan luar wadah disemprot dengan alkohol 70% secara merata. Akuades yang digunakan juga disterilkan dengan cara pendidihan pada suhu 100 ºC. Wadah pendidihan akuades harus disterilkan terlebih dahulu untuk menghindari kontaminasi.
Ruangan yang digunakan adalah ruangan tertutup yang dilengkapi pendingin udara (AC) dengan suhu antara 20-25oC dan dipasang lampu TL sehingga cahaya bisa diatur, yaitu cahaya 12 jam terang dan 12 jam gelap. Intensitas cahaya dalam ruangan diatur sehingga mewakili cahaya antara pukul 10.00-12.00 WIB (4000-5500 lux).
2. Penyediaan air laut
Air laut yang digunakan disterilkan terlebih dahulu dengan larutan kaporit berdosis 20 ppm kemudian diaerasi minimal 12 jam. Setelah itu, air laut dinetralkan dengan larutan thiosulfat minimal 12 jam sambil terus diaerasi. Kemudian air laut disaring dengan menggunakan planktonnet yang dilapisi kapas steril. Air laut hasil saringan dipanaskan dan diangkat pada saat pertama kali mendidih dengan tujuan agar tidak menjadi keruh dan bebas dari organisme kontaminan. Setelah menjadi dingin, salinitas air laut diturunkan menjadi 28‰ dengan penambahan akuades steril.
3. Pembuatan substrat zeocrete
ZK3) pada rasio N:P yang sama yaitu 30:1. Lalu ditambahkan perlakuan substrat
zeocrete tanpa penambahan nutrien (dilambangkan dengan ZK0). Pupuk yang digunakan adalah TSP yang mengandung 32% P2O5, urea yang mengandung 46%
N, serta Na2SiO3 yang mengandung 34% Si(OH)2 (Lampiran 3). Substrat ini
berbentuk kepingan berukuran 1 x 1 cm2 dengan ketebalan 2 cm berselubung lilin, kecuali permukaan atasnya yang dibiarkan terbuka agar mendapat kontak langsung dengan air dan menjadi tempat menempel bagi diatom perifitik (Gambar 2A). Substrat disusun dalam suatu bingkai dari alumunium yang dirancang khusus untuk menjaga agar substrat berada dalam posisi yang tetap dan memudahkan dalam pengambilan contoh. Dinding bingkai sedikit lebih tinggi dari permukaan kepingan untuk mengurangi kontak antar kepingan (Gambar 2B, 2C, 2D dan 3).
A. C. 1 cm
B. D.
tinggi substrat
1 cm 2 cm
Gambar 2. Substrat zeocrete dan sketsa peletakan di dalam bingkai.
A. Penampang atas substrat zeocrete yang ditumbuhi diatom perifitik; B. Bentuk blok substrat zeocrete; C. Susunan substrat zeocrete dilihat
dari atas; D. Susunan substrat zeocrete dilihat dari samping.
4. Perifiton awal
Inokulan perifiton berupa enam genus yang termasuk kelompok diatom yaitu Amphora, Cyclotella, Melosira, Navicula, Phaeodactylum, dan
Thalassisosira (Lampiran 4). Inokulan diperoleh dari Balai Penelitian Budidaya Laut Gondol, Bali; P2O LIPI, Jakarta; PT. Bratasena, Lampung dan hasil kultur
Laboratorium Riset Plankton, Departemen MSP, FPIK, IPB. Inokulan perifiton tersebut ditampung dalam wadah dengan media standar untuk selanjutnya ditebarkan sebagai inokulan di atas substrat dalam akuarium di laboratorium.
D. Pelaksanaan Penelitian
Substrat-substrat zeocrete yang telah disusun sesuai dengan perlakuan yang diberikan dimasukkan ke dalam akuarium yang sudah bersih, masing-masing tiga ulangan. Kemudian akuarium tersebut diisi dengan air laut dengan salinitas 28‰ setinggi bingkai dan didiamkan selama tiga hari dengan kondisi ruangan tanpa cahaya dengan tujuan agar unsur hara yang terkandung dalam substrat
zeocrete keluar ke air media serta agar tidak ada mikroalgae lain yang memanfaatkan unsur hara tersebut. Setelah itu inokulan diatom perifitik ditebarkan secara merata di atas substrat dengan pendekatan nilai luas permukaan sel yang hampir sama antar masing-masing genus diatom perifitik. Adapun kepadatan awal yang digunakan adalah sebagai berikut :
a. Amphora = 22043sel/cm2 d. Navicula = 4290 sel/cm2
b. Cyclotella = 6543 sel/cm2 e. Phaeodactylum = 16006 sel/cm2
c. Melosira = 429 sel/cm2 f. Thalassiosira = 1004 sel/cm2
Inokulan diatom perifitik didiamkan kembali selama tiga hari dengan tujuan agar diatom perifitik dapat beradaptasi sebelum penambahan air laut sehingga mencapai ketinggian 15 cm dari dasar akuarium dan diberi aerasi menggunakan
“high pressure blower”.
stabil yaitu 28‰, suhu berkisar antara 20-25oC, pH berkisar antara 7-8, dan kandungan oksigen terlarut berkisar antara 2-5 mg/l.
E. Teknik Pengumpulan Data
Pengambilan contoh untuk keperluan pengumpulan data kelimpahan diatom perifitik dilakukan dua kali dalam seminggu selama satu bulan. Pada semua perlakuan, setiap ulangan dilakukan pengambilan dua buah substrat secara acak menggunakan pinset steril. Setelah substrat diambil, dilakukan pengerikan terhadap permukaan substrat dengan menggunakan kuas steril. Hasil kerikan dimasukkan ke dalam botol contoh yang berisi akuades, dengan volume tertentu, dan diawetkan dengan larutan Lugol 1%. Kemudian contoh diamati dengan menggunakan mikroskop. Setiap blok diukur luasannya untuk dimasukkan ke dalam perhitungan data kelimpahan diatom perifitik.
Pengambilan contoh untuk keperluan pengumpulan data biomassa diatom perifitik dilakukan bersamaan dengan waktu pengambilan contoh untuk keperluan pengumpulan data kelimpahan diatom perifitik. Dalam setiap ulangan dilakukan pengambilan dua buah substrat secara acak terhadap seluruh perlakuan. Pada setiap perlakuan dilakukan penga mbilan sampel sebanyak tiga ulangan. Kemudian substrat tersebut dimasukkan ke dalam botol sampel yang telah diisi dengan 10 ml aseton 90%. Setelah itu botol sampel tersebut dimasukkan ke dalam lemari pendingin selama 24 jam. Setelah 24 jam substrat zeocrete
dikeluarkan kemudian dilakukan pengukuran terhadap luasan substrat zeocrete
tempat menempel diatom perifitik. Sampel di dalam botol sampel digerus menggunakan alat bernama tissue-grinder dengan kecepatan 22,5 rpm selama ± 1 menit. Setelah digerus, sampel disentrifuse dengan menggunakan alat bernama
total konsentrasi pigmen, produk pigmen turunan harus dihitung, dan aseton biasanya digunaka n sebagai pelarut dalam proses ekstraksi klorofil (Wetzel dan Likens, 1991).
Air contoh untuk keperluan analisis kandungan unsur hara dalam air diambil dari akuarium dan dimasukkan ke dalam botol yang telah disiapkan lalu dianalisis di laboratorium. Pengumpulan data kandungan unsur hara dalam air dan kualitas air dilakukan setiap dua kali dalam seminggu selama satu bulan bersamaan dengan waktu pengambilan contoh diatom perifitik.
F. Perhitungan Diatom Perifitik
1. Kelimpahan Diatom Perifitik
Penentuan kelimpahan alga perifitik dihitung dengan menggunakan alat
Haemacytometer (metode sensus) dengan rumus sebagai berikut :
p
K = Jumlah total diatom perifitik (sel/cm2)
n
= Jumlah rata -rata diatom perifitik yang diamati (sel)s
V = Volume sampel yang ada di botol contoh (ml)
p
A = Luas petak substrat tempat menempelnya diatom perifitik (cm2)
2. Biomassa Diatom Perifitik
Penentuan biomassa diatom perifitik dihitung dengan menggunakan rumus klorofil-a dan phaeopigmen (Lorenzen 1967, in Wetzel dan Likens, 1991) sebagai berikut :
k = Koefisien penyerapan klorofil-a (11.0)
F = Faktor koreksi (2.43)
ijk
665 = Nilai klorofil-a pada panjang gelombang 665 sebelum ditambahkan HCl
a
665 = Nilai klorofil-a pada panjang gelombang 665 setelah ditambahkan HCl
G. Analisis Data
1. Analisis Deskriptif
Analisis deskriptif dilakukan dengan menjelaskan data-data dari semua parameter-parameter yang diukur dalam bentuk tabel dan grafik. Analisis secara deskriptif digunakan untuk mendapa tkan informasi mengenai kelimpahan dan biomassa diatom perifitik yang tumbuh pada substrat zeocrete.
2. Uji Statistik
Untuk melihat pengaruh perbedaan konsentrasi P pada substrat zeocrete
terhadap biomassa total diatom perifitik digunakan Rancangan Petak Terpisah
(Split Plot in time ) (Steel dan Torrie, 1989). Model Rancangan Petak Terpisah
(Split Plot in time ) sebagai berikut:
Keterangan :
ijk
Y = Nilai pengamatan dari kelompok ke -i dari suatu rancangan kelompok
teracak, pada perlakuan petak utama ke -j dengan perlakuan anak petak ke-k.
Untuk melihat pengaruh perbedaan konsentrasi P pada substrat zeocrete
terhadap biomassa total diatom perifitik perlu dilakukan uji Ftabel pada taraf nyata
Plot in time) (Tabel 2) dihitung berdasarkan Steel dan Torrie (1989) sebagai berikut :
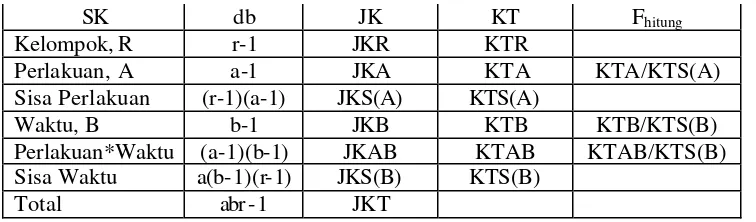
Tabel 2. Tabel sidik ragam dari rancangan petak terpisah (Split Plot in times)
SK db JK KT Fhitung
Kelompok, R r-1 JKR KTR
Perlakuan, A a-1 JKA KTA KTA/KTS(A)
Sisa Perlakuan (r-1)(a-1) JKS(A) KTS(A)
Waktu, B b-1 JKB KTB KTB/KTS(B)
Perlakuan*Waktu (a-1)(b-1) JKAB KTAB KTAB/KTS(B) Sisa Waktu a(b-1)(r-1) JKS(B) KTS(B)
Total abr -1 JKT
Hipotesis dari kaidah uji yang digunakan dalam uji ini adalah :
Pengaruh utama konsentrasi P :
H0 : á1 = ... = áa = 0 (konsentrasi P tidak berpengaruh)
H1 : paling sedikit ada satu i dimana ái 0
Pengaruh utama waktu :
H0 : â1 = ... = âb = 0 (waktu tidak berpengaruh)
H1 : paling sedikit ada satu j dimana âj 0
Kaidah keputusan :
Pengaruh konsentrasi P :
Jika Fhitung < Ftabel , maka tidak terdapat perbedaan yang nyata antar konsentrasi P
Jika Fhitung > Ftabel , maka terdapat perbedaan yang nyata antar konsentrasi P
Pengaruh waktu :
Jika Fhitung < Ftabel , maka tidak terdapat perbedaan yang nyata antar waktu
Jika Fhitung > Ftabel , maka terdapat perbedaan yang nyata antar waktu
IV. HASIL DAN PEMBAHASAN
A. Hasil
1. Kelimpahan dan Biomassa Diatom Perifitik
Kelimpahan dan biomassa diatom perifitik pada masing-masing perlakuan diamati selama 27 hari. Hasil pengamatan kelimpahan dan biomassa diatom perifitik diuraikan sebagai berikut :
1.1. Kelimpahan Diatom Perifitik
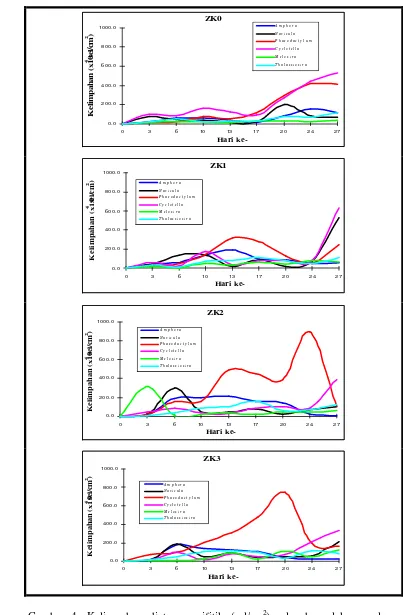
Kelimpahan diatom perifitik sangat berkaitan dengan lepasan unsur hara dari substrat zeocrete sehingga mempengaruhi pola kelimpahan dari tiap jenis diatom perifitik pada masing-masing perlakuan (Gambar 4). Semua jenis diatom perifitik yang dikembangkan mampu bertahan hidup dan berkembang dengan baik dari awal hingga penelitian berakhir. Akan tetapi ada beberapa jenis diatom ya ng mampu mendominasi substrat selama penelitian berlangsung. Hal ini diduga terjadi karena perbedaan kemampuan setiap jenis diatom perifitik dalam penyerapan unsur hara.
Kelimpahan diatom perifitik selama penelitian pada ZK0 dapat dilihat pada Gambar 4 dan Lampiran 5. Cyclotella memiliki kelimpahan tertinggi pada hari ke-27 mencapai 526,0 x 104 sel/cm2 selama penelitian. Kemudian diikuti oleh tingginya kelimpahan Phaeodactylum pada hari ke-24. Pada hari terakhir terjadi pendominasian substrat oleh Cyclotella dan Phaeodactylum. Pola harian kelimpahan semua diatom perifitik pada ZK0 cenderung meningkat hingga akhir penelitian.
Pada ZK1, diatom yang memiliki kelimpahan paling tinggi yaitu
Cyclotella (hari ke -24) mencapai 634,9 x 104 sel/cm2. Pada hari ke-13 Amphora
dan Phaeodactylum mengalami peningkatan kelimpahan tercepat yaitu berturut-turut sebesar 195,7 x 104 sel/cm2 dan 318,0 x 104 sel/cm2. Kelimpahan Navicula
Kelimpahan tertinggi diatom perifitik pada ZK2 dimiliki ole h genus
Phaeodactylum sebesar 893,37 x 104 sel/cm2 pada hari ke-24. Dapat dilihat bahwa Phaeodactylum relatif lama mendominasi substrat yaitu dari hari ke -13 hingga hari ke -24. Pada hari ke-3 juga terjadi pendominasian oleh Melosira
mencapai 312,49 x 104 sel/cm2. Kelimpahan Cyclotella meningkat mencapai 386,52 x 104 sel/cm2 pada saat penelitian berakhir. Pola harian kelimpahan semua diatom perifitik pada ZK2 yaitu cenderung meningkat di pertengahan penelitian lalu menurun di hari terakhir (Gambar 4 dan Lampiran 7).
Kelimpahan tertinggi diatom perifitik pada ZK3 dimiliki oleh
Phaeodactylum sebesar 745,63 x 104 sel/cm2 pada hari ke-20. Phaeodactylum
mendominasi substrat dari hari ke-13 hingga hari ke-20. Kelimpahan Cyclotella
mengalami peningkatan di akhir penelitian mencapai 332,51 x 104 sel/cm2. Pola kelimpahan diatom perifitik pada ZK3 yaitu meningkat hingga hari ke-20 kemudian menurun hingga hari terakhir, kecuali Phaeodactylum yang lama mendominasi substrat (Gambar 4 dan Lampiran 8).
1.2. Biomassa diatom perifitik
ZK0
selang kepercayaan 80% perbedaan konsentrasi P memberikan pengaruh sebesar 70,6% kepada biomassa total diatom perifitik semua perlakuan. Perbedaan konsentrasi P tidak memberikan perbedaan yang nyata terhadap biomassa total diatom perifitik antar perlakuan namun memberikan perbedaan yang nyata terhadap biomassa total diatom perifitik antar hari pengambilan contoh. Biomassa total rata-rata tertinggi dimiliki oleh ZK2 dan biomassa total terendah dimiliki oleh ZK3. Hasil uji lanjutan BNT yang dilakukan terhadap hari penelitian memberikan kesimpulan bahwa biomassa total rata -rata diatom perifitik meningkat dari hari ke -0 hingga hari ke-6 dan menurun pada hari ke-10 hingga hari ke -17. Kemudian biomassa total rata-rata diatom perifitik mengalami peningkatan hingga hari ke-27.
0.00
Gambar 5. Biomassa total diatom perifitik (ìg/cm2) seluruh perlakuan selama penelitian.
2. Kandungan Unsur Hara
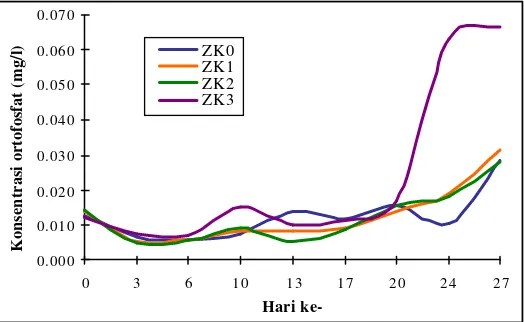
Fraksi unsur hara yang diukur dalam penelitian ini adalah ammonia, nitrat, ortofosfat dan silika yang akan disajikan dalam uraian berikut. Hasil pengukuran ortofosfat pada media setiap perlakuan disajikan pada Lampiran 11. Konsentrasi ortofosfat selama penelitian berkisar antara 0,005-0,067 mg/l. Pada hari ke-27 media ZK3 memiliki konsentrasi ortofosfat tertinggi sebesar 0,067 mg/l. Sedangkan konsentrasi ortofosfat terendah terjadi pada awal penelit ian di media ZK1 dan ZK2 sebesar 0,005 mg/l. Konsentrasi ortofosfat terendah juga dialami oleh ZK2 pada hari ke -13. Pola harian konsentrasi ortofosfat untuk semua perlakuan selama penelitian kurang lebih sama, yaitu cenderung meningkat di akhir penelitian (Gambar 6).
0.000
Gambar 6. Kandungan ortofosfat media pada seluruh perlakuan selama penelitian.
Konsentrasi ammonia tertinggi sebesar 0,395 mg/l terjadi pada media ZK3 di hari ke-17. Media ZK0 memiliki konsentrasi ammonia terendah yaitu sebesar 0,002 mg/l pada hari ke-6 (Lampiran 12). Konsentrasi ammonia rata-rata memiliki pola harian yang cenderung meningkat sampai hari ke -17 dan menurun hingga akhir penelitian (Gambar 7).
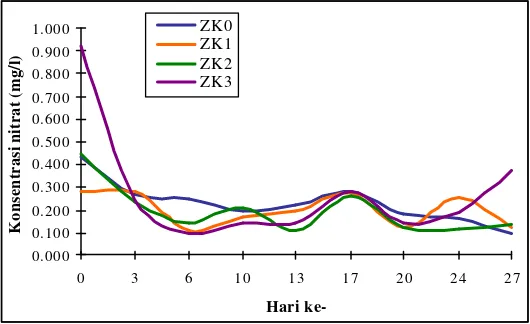
menurun hingga hari ke-27 kecuali pada media ZK3 kandungan nitrat meningkat tajam pada pengambilan contoh terakhir (Gambar 8).
0.000
Gambar 7. Kandungan ammonia media pada seluruh perlakuan selama penelitian.
Gambar 8. Kandungan nitrat media pada seluruh perlakuan selama penelitian.
0.00
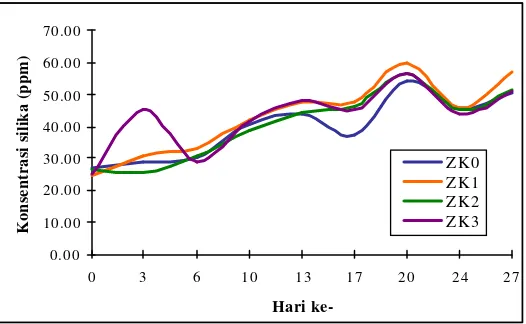
Gambar 9. Kandungan silika media pada seluruh perlakuan selama penelitian.
B. Pembahasan
1. Kelimpahan dan Biomassa Diatom Perifitik
Biomassa diatom perifitik berkaitan erat dengan kelimpahan diatom perifitik. Berikut ini diuraikan mengenai perkembangan kelimpahan diatom perifitik dan perannya dalam mendukung besarnya biomassa total diatom perifitik selama waktu pengamatan.
1.1. Kelimpahan Diatom Perifitik
Gambar 4 memperlihatkan dominasi dari setiap jenis pada masing-masing perlakuan. Berikut ini diuraikan mengenai waktu pencapaian kelimpahan tertinggi dari jenis-jenis diatom tertentu berdasarkan hasil uji statistik antar waktu pengamatan. Pada hari ke-0 semua perlakuan memiliki kelimpahan total diatom perifitik yang sama. ZK2 didominasi oleh Melosira dengan laju tercepat dibanding perlakuan lain yaitu pada hari ke -3. Pendominasian Melosira ini diiringi oleh turunnya kandungan ortofosfat, ammonia, nitrat, dan silika dalam media dari hari ke-0 hingga hari ke-3. Melosira mampu mendominasi substrat diduga karena Melosira menduduki tingkat teratas dalam hal volume sel yaitu sebesar 80,7% dari total volume sel rata -rata yang dimiliki enam jenis diatom perifitik yang digunakan, sehingga dapat menguasai luasan substrat dibandingkan diatom lain (Lampiran 15). Pada hari ke-6 perlakuan ZK2 kembali memiliki kelimpahan total tertinggi. Tingginya kelimpahan pada perlakuan tersebut diduga karena hampir semua jenis diatom perifitik memiliki kelimpahan yang hampir sama. Meningkatnya kelimpahan diatom perifitik pada ZK2 ini diikuti oleh turunnya kandungan ammonia dan nitrat pada media. Lalu pada hari ke-10 perlakuan yang memiliki kelimpahan total yang paling tinggi adalah ZK1. Hal ini didukung oleh tingginya kelimpahan dari beberapa jenis diatom perifitik, namun tidak ada jenis diatom yang mendominasi substrat pada perlakuan ini. ZK2 memiliki kelimpahan total tertinggi dibandingkan perlakuan lain dari hari ke-13 hingga hari ke -17. Tingginya kelimpahan total pada perlakuan ini diduga karena adanya pendominasian substrat oleh Phaeodactylum. Pendominasian ini disebabkan oleh Phaeodactylum memiliki kemampuan yang sangat besar dalam hal penyerapan unsur hara yang ada. Pada hari ke-20 perlakuan yang memiliki kelimpahan total tertinggi dibandingkan perlakuan lain adalah ZK3. Tingginya kelimpahan pada perlakuan ini didukung oleh adanya dominasi oleh
Phaeodactylum. Diduga Phaeodactylum mempunyai kemampuan yang lebih
perlakuan lain. Hal ini didukung oleh adanya dominasi Cyclotella dan Navicula. Laju peningkatan kelimpahan pada perlakuan ini seiring dengan laju penurunan kandungan ammonia dan nitrat pada media.
Dari hasil pengamatan terhadap diatom perifitik yang menempel pada substrat, dalam setiap perlakuan terdapat jenis-jenis diatom tertentu yang mampu mendominasi substrat. Jenis-jenis diatom yang mendominasi ZK0 yaitu
Cyclotella dan Phaeodactylum. ZK1 didominasi oleh Cyclotella dan Navicula.
Phaeodactylum dan Melosira mendominasi ZK2. Sedangkan ZK3 hanya
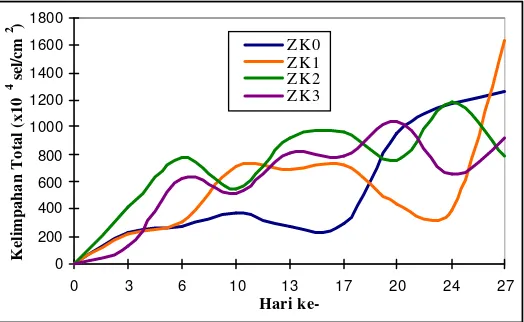
didominasi oleh Phaeodactylum. Jenis -jenis diatom perifitik yang mendominasi substrat ini adalah jenis-jenis diatom perifitik yang memiliki ukuran sel yang relatif kecil kecuali Melosira. Jenis-jenis diatom perifitik yang memiliki ukuran sel yang kecil lebih mampu berkembang dengan baik dibandingkan dengan jenis diatom perifitik yang memiliki ukuran sel yang besar, hal ini disebabkan oleh kemampuan jenis diatom perifitik ukuran kecil dalam hal laju penyerapan unsur hara lebih besar dibandingkan jenis diatom perifitik yang memiliki ukuran sel yang besar. Berdasarkan Gambar 9 perlakuan ZK2 dan ZK3 memiliki angka kelimpahan yang stabil, dinamis dan cenderung meningkat dari awal penelitian hingga akhir penelitian sehingga diduga perlakuan ini lebih mampu menyediakan cadangan biologis yang baik untuk pertumbuhan diatom perifitik dibandingkan perlakuan lainnya. ZK2 memiliki kelimpahan total rata -rata tertinggi dibandingkan perlakuan lain. Meskipun ZK0 dan ZK1 memiliki puncak kelimpahan yang lebih tinggi daripada perlakuan ZK2 dan ZK3, namun angka kelimpahannya tidak stabil dari waktu ke waktu sehingga diduga kurang mampu menyediakan cadangan biologis yang baik bagi pertumbuhan diatom perifitik.
1.2. Biomassa Diatom Perifitik
biomassa total diatom perifitik atau total pigmen diatom perifitik merupakan akumulasi dari konsentrasi klorofil-a dan phaeopigmen. Konsentrasi phaeopigmen diatom perifitik sering melebihi 50% dari total pigmen. Sel-sel diatom perifitik yang berwarna coklat mengalami kerusakan apabila diasamkan dan klorofil akan muncul mengakibatkan warna sel berubah menjadi hijau. Komponen yang paling nyata dari protoplasma adalah plastid (kroma tofor), dimana biasanya berwarna coklat akibat pigmen-pigmen karotenoid (terutama â-karoten, diatoxanthin, diadinoxanthin, dan fucoxanthin) menutupi warna dari klorofil (a, c2, dan c1 atau c3). Sel-sel yang rusak, atau sel-sel yang mengalami
kerusakan akibat pengasaman, berubah menjadi hijau seperti karoten-karoten yang rusak dan klorofil tidak tertutupi (Round et al., 1990).
Berikut ini diuraikan mengenai pola perkembangan biomassa total diatom perifitik selama waktu pengamatan. Nilai biomassa total diatom perifitik menurun dari hari ke-0 hingga hari ke -3 pada semua perlakuan kecuali ZK2. Hal ini diduga karena diatom perifitik masih berada dalam masa adaptasi. Akan tetapi ZK2 meningkat secara tajam pada hari ke -3, peningkatan ini didukung oleh tingginya kelimpahan total diatom perifitik pada hari tersebut. Melosira merupakan jenis yang sangat berperan dalam mendukung tingginya biomassa pada hari tersebut.
Melosira berada pada tingkat teratas dalam hal volume sel dibandingkan jenis diatom perifitik yang lain. Lalu biomassa total pada ZK2 tetap bertahan pada hari ke-6 dan perlakua n yang lain meningkat secara drastis dari hari ke-3 hingga hari ke-6. Peningkatan biomassa secara drastis ini diduga karena diatom perifitik memanfaatkan lepasan unsur hara dari substrat zeocrete. Pada awal penelitian substrat zeocrete mengadakan lepasan unsur hara dalam jumlah yang relatif besar akibat ketidakseimbangan antara konsentrasi unsur hara pada media dan konsentrasi unsur hara pada substrat zeocrete. Dari hari ke-6 hingga hari ke-10 biomassa total diatom perifitik pada semua perlakuan mengalami penurunan yang drastis. Hal ini diduga karena kandungan unsur hara pada media telah berkurang akibat pemanfaatan oleh diatom perifitik. Kemudian substrat zeocrete
penelitian nilai biomassa total diatom perifitik pada semua perlakuan cenderung meningkat dengan perubahan yang relatif kecil. Hal ini diduga karena substrat
zeocrete memiliki sifat soft release, yaitu melepaskan unsur hara secara perlahan. Dengan demikian diatom perifitik juga memanfaatkan unsur hara yang dilepaskan oleh substrat zeocrete secara perlahan. Akibatnya mempengaruhi perkembangan biomassa diatom perifitik. Puncak tertinggi biomassa total dari semua perlakuan selama penelitian justru terjadi pada substrat zeocrete tak bernutrien (ZK0) di hari ke-6, dimana perlakuan yang lain juga memiliki biomassa yang sangat tinggi pada hari tersebut. Tingginya biomassa pada ZK0 di hari tersebut disebabkan oleh tingginya konsentrasi klorofil. Akan tetapi puncak biomassa total pada perlakuan ZK0 ini tidak jauh berbeda dengan puncak biomassa total perlakuan lainnya pada hari tersebut.
Gambar 10. Kelimpahan total diatom perifitik (sel/cm2) seluruh perlakuan selama penelitian.
berpengaruh terhadap biomassa diatom perifitik diduga karena tingkat penyerapan diatom perifitik yang tetap sama pada semua perlakuan.
2. Kandungan Unsur Hara
diserap secara maksimum pada konsentrasi N yang rendah. Sementara berubahnya proses pengikatan dan pelepasan P dari dan ke kolom air akan mengakibatkan adanya perubahan sediaan biologis unsur P (Boyd, 1990). Peningkatan kandungan ortofosfat juga disebabkan oleh algae yang memiliki sifat bioturbasi yaitu mampu memicu pelepasan ortofosfat ke media, sehingga zeolit terus melepaskan ortofosfat hingga hari terakhir dan menyebabkan kandungan ortofosfat pada media terus meningkat.
N organik + O2 → NH3-N + O2
Peningkatan secara tajam pada kandungan ammonia ini juga disebabkan oleh banyaknya lepasan urea (CO2(NH2)2) yang terkandung di dalam substrat ke media
melalui proses hidrolisa dengan persamaan reaksi sebagai berikut : (CO2(NH2)2) + H2O → (NH4)2CO3
(NH4)2CO3 → 2NH3 + CO2 + H2O
Kandungan ammonia semua perlakuan mengalami penurunan pada akhir penelitian. Hal ini diduga bahwa diatom perifitik yang hidup pada media itu memanfaatkan ammonia untuk pertumbuhannya hingga akhir penelitian. Terbukti dari adanya peningkatan kelimpahan beberapa jenis diatom perifitik pada hari terakhir.
Nitrat merupakan nutrien utama bagi pertumbuhan tanaman dan algae. Nitrat sangat mudah larut dalam air dan bersifat stabil, dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan (Effendi, 2003). Kandungan nitrat pada air laut yang dimasukkan ke dalam akuarium di awal penelitian pada semua perlakuan adalah 0,029 mg/l. Sedangkan kandungan nitrat media semua perlakuan pada hari ke-0 lebih dari 0,029 mg/l. Hal ini membuktikan bahwa adanya lepasan nitrat dari substrat ke media. Kandungan nitrat media semua perlakuan menurun dari hari ke-0 hingga hari ke-3, hal ini diduga karena adanya pemanfaatan oleh diatom per ifitik yang baru ditebarkan pada hari ke -0, terbukti dari meningkatnya angka kelimpahan semua jenis diatom dan biomassa diatom pada hari ke -3. Kadar nitrat yang dibutuhkan untuk pertumbuhan optimal fitoplankton berkisar antara 0,900-3,500 mg/l. Bila kandungan nitrat kurang dari 0,144 mg/l maka nitrat akan menjadi faktor pembatas (Mackenthum, 1969 in
hara jika kadar unsur hara tersebut berkurang pada media dan sebaliknya, maka meskipun sebagian nilai berada di bawah 0,144 mg/l kandungan nitrat tidak akan berstatus faktor pembatas, sebab nitrat masih bisa disuplai oleh zeolit ke media dengan harus menjalani proses nitrifikasi terlebih dahulu. Suton (1974) in Galugu (1997) menyatakan bahwa konsentrasi nitrat dalam perairan terbentuk dalam proses nitrifikasi yaitu proses oksidasi senyawa ammonia dalam kondisi aerob oleh bakteri autotrof menjadi nitrat melalui senyawa tengah nitrit. Kandungan nitrat dari awal penelitian hingga akhir penelitian mengalami perubahan. Kandungan nitrat pada perlakuan ZK0, ZK1, dan ZK2 mengalami penurunan pada akhir penelitian. Hal ini disebabkan oleh pemanfaatan nitrat oleh diatom perifitik untuk pertumbuhannya. Akan tetapi pada ZK3 kandungan nitrat meningkat pada akhir penelitian. Bukan berarti pada media ini diatom perifitik tidak memanfaatkan nitrat dalam pertumbuhannya, tetapi diduga karena meningkatnya laju nitrifikasi dari hari ke -20 hingga hari terakhir.
zeolit yang menyusun substrat zeocrete termasuk ke dalam golongan tektosilikat. Sebelum substrat dibentuk, zeolit mengalami aktivasi terlebih dahulu. Dalam proses aktivasi dengan penambahan HCl, zeolit kehilangan beberapa kandungan Al sehingga meningkatkan rasio Si/Al. Silika yang berada di dalam zeolit terus melepas hingga hari terakhir karena belum tercapainya keseimbangan antara konsentrasi silika pada media dengan konsentrasi silika yang ada di dalam substrat.
Dari hasil pengukuran semua kandungan unsur hara pada media semua perlakuan selama penelitian, didapatkan bahwa substrat zeocrete mampu menyediakan unsur hara bagi pertumbuhan diatom perifitik. Selain itu substrat
zeocrete mampu menstabilkan kandungan unsur hara di dalam media dengan sifat khasnya yaitu mampu mengikat dan melepaskan unsur hara ke media apabila terjadi ketidakseimbangan antara kandungan unsur hara pada media dan kandungan unsur hara pada substrat.
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian terhadap pertumbuhan dan perkembangan diatom perifitik pada substrat zeocrete, dapat ditarik kesimpulan sebagai berikut : 1. Semua jenis diatom perifitik yang digunakan dalam penelitian ini dapat
tumbuh dan berkembang pada substrat zeocrete.
2. Perbedaan konsentrasi P tidak memberikan perbedaan yang nyata terhadap biomassa total diatom perifitik antar perlakuan namun memberikan perbedaan yang nyata terhadap biomassa total diatom perifitik antar hari pengambilan contoh.
3. Biomassa total diatom perifitik maksimum setelah dua minggu pemeliharaan dicapai pada hari ke-20 oleh substrat zeocrete denga n konsentrasi P 2 ppm dan pada hari ke-24 oleh substrat zeocrete dengan konsentrasi P 0,2 ppm. Perlakuan substrat zeocrete dengan konsentrasi P 0,2 ppm dan substrat
zeocrete dengan konsentrasi P 2 ppm memiliki pola kelimpahan total yang bersifat stabil dan dinamis dibandingkan perlakuan lain.
B. Saran
1. Perlu dilakukan penelitian lanjutan dengan melibatkan kelompok perifiton lain untuk mengetahui biomassanya apabila didukung oleh adanya substrat
zeocrete.
DAFTAR PUSTAKA
Aminot dan Rey, 2000. ICES Techniques in Marine Environment Sciences. Standars Procedure for Determination of Chloriphyll-a by Spectroscopic
Methods. International Council for the Exploration of the Sea.
Copenhagen.
Andarias, I. 1991. Pengaruh Pupuk UREA dan TSP Terhadap Produksi Klekap. Disertasi. Program Pascasarjana. IPB. Bogor.
APHA (American Public Healt h Association). 1989. Standard Methods for the Examination of Water and Waste Water. 17th ed. American Public Health Association. Water Pollution Control Federation. Port City Press. Baltimore, Maryland.
Barnes, H dan W. Green. 1972. The Estuarine Environment. John Willey and Sons. New York.
Basmi, J. 1988. Plankton sebagai Makanan Ikan Kultur. Program Pasca Sarjana. IPB. Bogor.
Boyd, C.E. 1990. Water Quality in Ponds for Aquaculture. Alabama Agricultural Experiment Station, Auburn University. Birmingham Publishing Co. Alabama.
Dwikorawati, S.S. 1994. Telaah Kandungan Nitrogen dan Fosfor di Perairan Situ Cikaret Kecamatan Cibinong-Kabupaten Bogor. Tesis Pasca Sarjana Institut Pertanian Bogor (Tidak dipublikasikan). Bogor.
Effendi, H. 2003. Telaah Kualitas Air bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Penerbit Kanisius. Yogyakarta.
Fleming, W.M. 1975. A Model of The Phosphorus Cycle and Phytoplankton Growth in Shaha Lake, British. Columbia. Canada.
Fogg, G.E. 1965. Algae Culture and Phytoplankton Ecology. The University of Wisconsin Press. Madison.
Fogg, G.E. 1975. Algae Culture and Phytoplankton ecology. 2nd ed. The University of Wisconsin Press. Madison.
Galugu, M.B. 1997. Analisa Kualitas Lingkungan Perairan Teluk Jakarta Sehubungan dengan Beban Pencemar Bahan Organik. Skripsi. Fakultas Perikanan dan Ilmu Kelautan. IPB. (tidak dipublikasikan). Bogor.
Garcia, W.U dan R. Garcia. 1985. Prawn Farming Made Simple with Fertilex. 1st ed. Manila.
Grahame, J. 1987. Plankton and Fisheries. Edward Arnold Publishers Ltd. London.
Hutagalung, H.P. dan A. Rozak. 1997. Metode Analisis Air Laut, Sedimen dan Biota. Buku 2. LIPI. Jakarta.
Krisanti, M. 2003. Peran Zeolit sebagai Substrat dan Penyedia Unsur Hara bagi Mikroalga. Tesis. Program Pasca Sarjana. IPB. Bogor.
Kurniastuty dan Isnansetyo. A. 1995. Teknik Kultur Phytoplankton dan Zooplankton. Penerbit Kanisius. Yogyakarta.
Lee, R. E. 1980. Phycology. 2n d ed. Biology Department, Shiraz University, Shiraz. Cambridge University Press. Persia.
Lestari, Y.T. 2003. Hubungan Kemelimpahan Fitoplankton dengan Kualitas Air di Tambak Bersubstrat Pasir. Skripsi. Program Studi Manajemen Sumberdaya Perairan FPIK. IPB. Bogor.
Lind, O.T. 1979. Handbook of Common Methods in Limnology. 2nd ed. Kendall/Hunt Publishing Company. Dubuque. 199 hlm.
Millero, F.S. dan M.L. Sohn. 1991. Chemical Oceanography. CRC Press. London.
Novotny, N. dan H. Olem. 1994. Water Quality : Prevention, Identification, and Management of Diffuse Pollution. Van Nostrand Reinhold. New York.
Nybakken, J.W. 1992. Biologi Laut Suatu Pendekatan Ekologis. Alih Bahasa H. M. Eidman, Koesoebiono, D.G. Bengen, M. Hutomo dan S. Sukardjo. PT Gramedia. Jakarta.
Odum, E.P. 1971. Fundamen tals of Ecology. 3rd ed. W.B. Saunders Company. Philadelphia. 574p.
Parsons, T.R., M. Takashi, dan B. Hargrave. 1997. Biological Oceanographic Processes. 2n d ed. Pergamon Press. Oxford.
Pennak, R.W. 1964. Collegiate Dictionary of Zoology. The Ronald Press Company. New York. 566p.
Pratiwi, N.T.M. 1997. Kepekaan Komunitas Fitoplankton terhadap Perubahan Unsur Hara di Tambak Bersubstrat Pasir. Tesis. Pasca sarjana IPB. Bogor.
Reynolds, C.S. 1984. The Ecology of Freshwater Phytoplankton. Cambridge University Press. London. 384p.
Reynolds, C.S. 1990. The Ecology of Freshwater Phytoplankton. Cambridge University Press. London. 384p.
Round, R.E., R.M. Crawford, dan D.G. Mann. 1990. The Diatoms. Cambridge University Press. Cambridge.
Ruttner , F. 1973. Fundamentals of Limnology. 3rd ed. University of Toronto Press. Toronto. 267p.
Sellers, B.H. dan H.R. Markland. 1987. Decaying Lakes : The Origin and Control of Eutrophycation. John Willey and Sons. Chicester. 244p.
Steel, R.G.D. dan J.H. Torrie. 1989. Prinsip dan Prosedur Statistika Suatu Pendekatan Biometrik. PT Gramedia. Jakarta.
Sumich, J.L. 1992. An Introduction to The Biology of Marine Life. 5th ed. WCB,
WM. C. Brown Publishers. USA.
Supriyanti, S. 2001. Struktur Komunitas Perifiton pada Substrat Kaca di Lokasi Pemeliharaan Kerang Hijau (Perna viridis l.), Perairan Muara Kamal, Teluk Jakarta. Fakultas Perikanan dan Ilmu Kelautan. IPB. (Tidak dipublik asikan). Bogor. 54 hlm.
Suyartono. 1986. Peranan Kapur dan Zeolit dalam Pertanian. Ditjen Pertambangan Umum. PPTM. Bandung.
Tobing, S.M.U. 1999. Efektivitas Campuran Bahan Humik dengan Zeolit terhadap Pertumbuhan dan Ketersediaan Unsur Hara Tanaman. Skripsi. Fakultas Pertanian. IPB. Bogor.
Wardoyo, S.T.H. 1981. Kriteria Kualitas Air untuk Pertanian dan Perikanan. Training Analisa Dampak Lingkungan. PPLH-UNDIP, PUSDI. PSL. IPB. Bogor.
Weitzel, R.L. 1979. Methods and Measurements of Periphyton Communities: A Review. ASTM Special Technical Publication 690. Philadelphia. 183p.
Welch, E.B. 1980. Ecology Effects of Wastewater. Cambridge University Press. London. 337p.
Wetzel, R.G. and G.E. Likens. 1991. Limnological Analyses. 2nd ed. Springer-Verlag New York Inc. New York.
Lampiran 1. Bahan-bahan Yang Digunakan Dalam Pengambilan Data
Parameter Unit Bahan
Biologi
Perifiton sel/cm2
Lugol 1 % (pengawet)
Kimia
Nitrat mg/l Brucine, H2SO4, Larutan standar nitrat
Ortofosfat mg/l Amonium molybdate, Asorbic acid, Larutan standar fosfat
Silika mg/l HCl, Amonium molybdate, Asam oksalat, Larutan standar silika
Amonia Total
Lampiran 2. Tahap - tahap aktivasi zeolit
Zeolit yang berupa bongkahan ditumbuk untuk mendapatkan ukuran yang lebih kecil. Zeolit kemudian disaring dengan menggunakan saringan bertingkat dengan ukuran 0,425 mm dan 1 mm. Ukuran zeolit yang diinginkan adalah ukuran dia ntara kedua saringan diatas. Butiran zeolit dicuci sebanyak 3 kali menggunakan air destilasi. Pencucian ini bertujuan untuk menghilangkan debu-debu dan serbuk-serbuk zeolit yang lebih kecil. Setelah zeolit bersih kemudian dikeringkan dan akan dilakukan proses aktivasi.
Lampiran 3. Perhitungan Pupuk
1. Pupuk TSP yang digunakan mengandung 32% P2O5 maka untuk 1000 mg TSP
= 320 mg P2O5. Sehingga jika akan dibuat pupuk induk TSP dengan
konsentrasi 1000 ppm P2O5 dibutuhkan pupuk TSP sebesar :
mgTSP
2. Pupuk Urea yang digunakan mengandung 46% N maka untuk 10000 mg Urea = 4600 mg N. Sehingga jika akan dibuat pupuk induk Urea dengan konsentrasi 10000 ppm N dibutuhkan pupuk Urea sebesar :
mgUrea
3. Pupuk Sodium Metasilika yang digunakan mengandung 34% Si(OH)2 maka
untuk 1000 mg Sodium Metasilika = 340 mg Si(OH) 2. Sehingga jika akan
dibuat pupuk induk Sodium Metasilika dengan konsentrasi 1000 ppm Si(OH) 2
dibutuhkan pupuk Sodium Metasilika sebesar :
tasilika
= 2941 mg Sodium Metasilika
Lampiran 4. Diatom perifitik yang diamati selama penelitian
Amphora (40x10) Cyclotella (40x10)
Melosira (40x10) Thalassiosira (40x10)
Navicula (40x10) Phaeodactylum (40x10)
= 5 µm
= 2 µm = 5 µm
= 20 µm
= 5 µm
Lampiran 5. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete
tanpa penambahan nutrien selama penelitian
Hari ke-
Lampiran 6. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete
dengan konsentrasi P 0,02 ppm selama penelitian
Hari ke-
Lampiran 7. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete
dengan konsentrasi P 0,2 ppm selama penelitian
Hari ke-
Lampiran 8. Kelimpahan diatom perifitik (x 104 sel/cm2) pada substrat zeocrete
dengan konsentrasi P 2 ppm selama penelitian
Lampiran 9. Biomassa total diatom perifitik (x 102 ìg/cm2) seluruh perlakuan
Lampiran 10. Uji sidik ragam biomassa total diatom perifitik
R square = 0,706 C.V = 5,9834
Tabel sidik ragam biomassa total diatom perifitik pada semua perlakuan
SK db JK KT F hit F tabel
Kelompok, R 2 0,15472099 0,0773605 - - Perlakuan, A 3 0,70466861 0,23488954 1,86311 2,11259 Sisa Perlakuan 6 0,7564417 0,12607362 - - Waktu, B 8 13,99198321 1,7489979 14,2494 1,43346 Perlakuan*Waktu 24 3,26823586 0,13617649 - - Sisa Waktu 64 7,8554672 0,12274168 - -
Total 107 26,73151758 - - -
Uji lanjutan Beda Nyata Terkecil (BNT) terhadap hari penelitian
Lampiran 11. Kandungan ortofosfat (mg/l) media pada semua perlakuan selama
Lampiran 12. Kandungan ammonia (mg/l) media pada semua perlakuan selama penelitian
Lampiran 14. Kandungan silika (mg/l) media pada semua perlakuan selama penelitian
Hari ke- ZK0 ZK1 ZK2 ZK3
0 26,91 24,55 26,51 24,84
3 29,08 30,53 25,22 45,26
6 30,32 33,15 30,51 28,76
10 40,53 41,87 38,68 41,74
13 43,71 47,71 44,15 48,32
17 37,35 47,87 46,42 45,21
20 54,21 59,97 56,35 56,24
24 46,01 46,07 45,26 43,58
27 50,21 56,84 51,10 50,74
Lampiran 15. Ukuran rata -rata volume sel diatom perifitik
Diatom perifitik Volume sel Persentase (%)
Melosira 6839,51 80,66572864
Thalassiosira 1216,96 14,35292369
Navicula 198,7 2,343483712
Cyclotella 129,49 1,527215429
Phaeodactylum 56,27 0,663652886
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 17 Maret 1982 dari pasangan bapak : Sigit Damiri dan ibu : Suhartini. Penulis merupakan putri sulung dari empat bersaudara.
Tahun 2000 penulis lulus dari SMU YKPP I Plaju, Palembang dan pada tahun yang sama lulus masuk Universitas Sriwijaya Jurusan Administrasi Negara, Fakultas Ilmu Sosial dan Ilmu Politik melalui jalur Penyaluran Minat dan Keterampilan (PMDK). Pada tahun 2001 penulis pindah dan lulus seleksi masuk IPB melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN). Penulis memilih Program Studi Pengelolaan Sumberdaya Lingkungan dan Perairan, Jurusan Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis aktif sebagai Organizing Committee (OC) masa perkenalan FPIK mahasiswa baru tahun 2003 dan masa perkenalan Departemen MSP mahasiswa baru tahun 2003 serta sebagai peserta pada beberapa seminar yang diselenggarakan di lingkungan Institut Pertanian Bogor. Penulis juga aktif sebagai asisten mata kuliah Ikhtiologi pada tahun ajaran 2003/2004, asisten luar biasa mata kuliah Planktonologi pada tahun ajaran 2004/2005, dan asisten luar biasa mata kuliah Biota Air pada tahun ajaran 2004/2005. Penulis melaksanakan kegiatan magang di Balai Budidaya Air Payau Situbondo, Jawa Timur pada tahun 2004.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana pada Fakultas Perikanan dan Ilmu Kelautan, IPB, penulis menyusun skripsi dengan judul
”Biomassa Diatom Perifitik pada Substrat Zeocrete dengan Konsentrasi P