KAJIAN PROSES PEMBEKUAN DAN DAYA SIMPAN
KULTUR BAKTERI LAKTAT ASAL DADlH UNTUK
PRODUKSI
KULTUR STARTER
Oleh
:
Darti
Nurani
PROGRAM PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABSTRACT
STUDIES ON FREEZING AND FROZEN STORAGE OF
LACTIC
BACTERIA ISOLATEDFROM
DADIH FOR PRODUCINGSTARTER
CULTURE
Supervised by Tun Tedja, Ani Suyani dan Ingrid S. Surono
Dadih is a traditional fermented milk of West Sumatra
-
Indocesia, fermented in bamboo tube. Some srains of lactic acid bacteria isolated fiom Dadih possessprobiotic properties; hence, it is important to study the effect of preservation of the lactic acid culture on their viability and biochemical properties during fiozen storage. Four strains of lactic acid bacteria isolated from Dadih which have good antimutagenic properties are
Lactococcus Iactis
subsplactis
R-22,Leuconostoc
pmamesenteroides
R-5 1,Lactobacillus casei
subspcasei
R-52and
Leuconostoc
paramesenteroides
R-62. The lactic culture were preserved by fieezing at -20°C by different freezing methods, fiozenin
deep freezer (slow fieezing) and frozen in dry ice-ethanol mixture (fast freezing). Glycerol lo%, dimethylsulfoxide @MSO) 10% and skim milk 10% wereused
as cryoprotectantwith
phosphat buffer pH 7,Oas
control. The cultures were stored in deep freezer at -20°C
as
well as -70°C. Theaddition of glicerol 10% in Lactobacillus cmei subsp. casei R-52 culture frozen by
fast freezing showed relatively stable viability and capability of lactic acid production
as
an indicator of a good starter culture. There were no significantly different in viability and capability of lactic acid production during 8 weeks fiozen storage at -20°C and -70°C. However, fiozen storageat
-70°C could maintain proteoliticSURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
KAJIAN PROSES PEMBEKUAN DAN DAYA SIMPAN
KULTUR BAKTERI LAKTAT ASAL DADIH UNTUK PRODUKSI
KULTUR STARTER
Judul Tesis : KAJIAN PROSES PEMBEKUAN DAN DAYA SIMPAN KULTUR BAKTERI LAKTAT ASAL DADlH UNTUK PRODUKSI KULTUR STARTER
Nama mahasiswa : DART1 NURANI
Nomor pokok : 97333
Menyetujui
1. Komisi Pembimbing
\
/Dr. Ir. Tun Tedia Irawadi, MS)
Ketua
/Dr. lr! ~ d ~ u d a n i . DEA) /Dr. Ir. lnarid S. Surono. MScl
MXV'jta Anggota
2. Ketua Program Studi
&&
-'
(Dr. Ir. lrawadi Jamaran) Manuwoto, MSc.)
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 21 Juli 1961 di Magelang dari pasangan
Sunaryo dan Sriwiyati. Pada tahun 1980 penulis lulus dari SMA Negeri I
Magelang. Penulis memperoleh gelar Sarjana dalam bidang Pengolahan Hasil
Pertanian pada Fakultas Teknologi Pertanian, Universitas Gajah Mada, Jogyakarta
pada tahun 1986. Tahun 1991, penulis menikah dengan Heri Suryanto serta
dikaruniai dua orang anak, Niken Kinanti Suryanto (10 iahun) dan Kenan
Armyansyah Suryanto (8 tahun).
Tahun 1987 sampai sekarang penulis adalah staf pengajar di Jurusan
Teknologi Industri Pertanian, Institut Teknologi Indonesia, Serpong. Tahun 1997,
penulis terdaftar sebagai mahasiswa Pascasarjanti IPB dan mengambil Program
PRAKATA
Puji syukur kehadirat Allah SWT atas perkenan dan ridhoNya penulis
mampu menyelesaikan tesis ini. Pada kesempatan ini penulis ingin menyampailcan
rasa terima kasih yang sebesar-besarnya kepada mereka yang telah terlibat
langsung atau tidak langsung dalam penyusunan tesis :
1. Dr. Ir. Tun Tedja Irawadi, MS, sebagai Ketua Komisi Pembimbing atas kesabarannya dalam membimbing, nlengarahkan dan memberikan
dukungan moril dalam rangkaian penyusunan tesis ini.
2. Dr. Ani Suryani, DEA, sebagai anggota Komisi Pembimbing dan Kepala
Laboratorium Rekayasa Bioproses
-
Pusat Antar Universitas Bioteknologiwaktu itu atas bimbingan, saran,
dan
diperkenankannya penulis menggunakan fasilitas laboratorium untuk melakukan penelitian dalamrangka penyusunan tesis ini.
3. Dr. Ir. Ingrid S. Surono, MSc, sebagai anggota Komisi Pembimbing yang telah memberikan bimbingan, saran, semangat, kesempatan
dan
kepercayam kepada p u l i s untuk mengerjakan sebagian ProjectUniversity Research for Graduate Education
(URGE),
The YoungAcademic Program, Batch
III
tahun 1998/2000, serta yang telahmengenalkan penulis dengan bakteri
asam
laktat sehingga penulis dapat mengenal lebih dekat dan dapat turut mengagumi keunggulan bakteri4. Dekan Fakultas Teknologi Pertanian
-
Institut Teknologi Indonesia, Ketuadan Staff Jurusan Teknologi Industri Pertanian, IT1 yang telah memberi
kesempatan kepada penulis untuk melanjutkan studi di Program
Pascasarjana, IPB dan memberikan dukungan moril sehingga penulis
dapat menyelesaikan tesis ini.
5. Rekan-rekan seperjuangan di Laboratorium di lingkungan PAU-
Bioteknologi, IPB periode 1999-2000, baik teknisi, mahasiswa S1, S2 dan
S3 yang tidak dapat penulis sebutkan satu persatu atas kerjasamanya
selama penulis melaksanakan penelitian.
6. IShusus untuk suami Heri Suryanto dan anak-anak tercinta Niken Kinanti Suryanto dan Kenan Armyansyah Suryanto atas dukungan
dan
pengertiannya yang rnendalam serta keleluasaan waktu yang diberikansehingga penulis dapat melaksanakan penelitian dan menyusun tesis ini
dengan tenang.
Akhirnya penulis memohon maaf atas segala bentuk kekurangan dan
ketabatasan yang ada, namun penulis berharap semoga hasil penelitian ini dapat
bermanfmt bagi yang memerlukannya.
DAFTAR IS1
...
Kata Pengantar
iv
...
Daftar Isi
vi
...
...
Daftar Tabel
vlil...
Daftar Garnbar
ix
...
Daftar Lampiran
xPENDAHULUAN
...
1...
...
Latar Belakang
.
.
.
1...
Tujuan Penelitian
2
Ruang Lingkup
...
:
...
2...
TINJAUAN PUSTAKA
4
Isolat Bakteri Asam Lalctat asal Dadih
...
4
...
Presewasi dan Penyimpanan Mikroba
6
...
Pembekuan Kultur Bakteri
8...
Cryoprotectant
12
Media Kultur Starter Bakteri Asam Laktat
...
14
...
METODOLOGI PENELITIAN
16
...
Metode
17
a .
DAFTAR
TABEL
1. Pengaruh metoda pembekuan pada viabilitas kultur bakteri asam laktat selama penyimpanan beku
...
2. Pengaruh jenis cryoprotectant pada aktivitas proteolitik kultur bakteri asam laktat selama penyimpanan beku..
...
. 3 : Pengaruh metoda pembekuan pada kemampuan pembentukan asam laktat kultur bakteri asam laktat selama penyimpanan beku ...
4. Pengaruh metoda pembekuan pada aktivitas proteolitik kultur bakteri asam laktat selama peyimpanan beku
...
5 . Pengaruh jenis cryoprotectant pada aktivitas proteolitik kultur bakteri asam laktat selama peyimpanan beku
...
6 Pengaruh suhu penyimpanan pada aktivitas proteolitik kultur bakteri
asam laktat selama peyimpanan beku
...
7. Hasil pengamatan rata-rata perubahan viabilitas (log cfidml) kultur starter bakteri asam laktat selama inhbasi pada media yang berbeda
8. . Hasil pengamatan rata-rata perubahan total
asam
(%) kultur starterDAFTAR GAMBAR
Viabilitas Lactobacillus casei subsp 'casei
R-52
setelah pembekuan dengan variasi metoda pembekuan selama penyimpanan beku...
Viabilitas Lactobacillus casei subsp casei
R-52
setelah pembekuan...
dengan variasi jenis cryoprotectant selama penyimpanan beku
Kemampuan produksi asam laktat oleh kultur
Lactobacillus carrei
subsp.Casei
R-52
setelah pembekuan dengan variasi metoda pembekuan selama penyimpanan beku...
Aktivitas proteolitik pada kultur Lactobacillus casei subsp. Casei
R-
52
setelah pembekuan dengan variasi metoda pembekuan selama penyimpanan beku...
Aktivitas proteolitik pada kultur Lactobacillus casei subsp. Casei
R-
52
setelah pembekuan dengan variasi jeniscryoprotectant
selama penyimpananbeku
...
Aktivitas proteolitikLactobacillus casei
subsp.Casei
R-52
setelah...
pembekuan dan disimpan pada suhu yang berbeda
Kurva perubahan viabilitas kultur starter Lactobacillus u w i subsp.
Casei
R-52
selama inkubasi pada media yang berbeda...
Kurva perubahan viabilitas kultur starterLeuconostoc
...
paramesenteroides
R-62
selama inkubasi pada media yang berbedaKurva perubahan kadar asam total
kultur
starter
Lactobacillus casei
subsp. CaseiR-52
selama inkubasi pada media yangberbeda
...
DAFTAR LAMPIRAN
Diagram Alir Rancangan Percobaan
.
. . .
. .
. .
. .
.
. . . .
. . .
.
. .
. . .
. .
Kultivasi Sel Bakteri Asam Laktat (To and Etzel, 1997)
. . .
.
. . .
.
. .
.
. ...
Penyiapan Suspensi Pembekuan (To
and
Etzel, 1997)-. . . .
.
. . .
..Penentuan Viabilitas Sel (To and Etzel, 1997)
. . .
.
. . .
.
.. . . .
. .
.
.
.
.
. . . .
.. .
Analisis Pembentukan Asam Laktat (Metode Mann's Acid Test)
. . .
Analisis Aktivitas Proteolitik (Metode Bergmeyer dan Grassl, 1983).
.
Viabilitas Kultur Bakteri Asam Laktat Sebelum maupun Sesudah Pembekuan dan Penyimpanan
.
.
.
. .
. .
. . . .
. .
.
. . .
. . .
.
. .
. . . .
.
.
.
.
..
.. . .
. .
.
.. . .
.
Niai Total
Asam (%) Kultur Bakteri Asam Laktat Sebelum maupun Sesudah Pembekuan dan Penyimpanan.
.
.
.
. . .
. .
. .
.
. . .
. .
. .
. .
. . . .
. .
. . . ..
Aktivitas
Proteolitik(UA)
Kultur
Bakteri
Asam
Laktat Sebelum maupun Sesudah Pembekuan dan Penyimpanan. . .
.
.
.
. .
.
. . .
. .
.
. . . .
. . .
Perbandingan Antar
Pengaruh
Metoda Pembehan, Cryoprotectant,suhu
danWaktu
Penyimpananuntuk
Setiapstrain
terhadap ViabilitasPerbandingan
Antar
Pengaruh Metoda Pembekuan, Cryoprotecctmrt, suhu danWaktu
Penyimpanan untuk Setiapstrain
terhadap Total Asam.
.
.
. .
.
.
. . .
. .
. .
. . .
.
.
.
. . . .
. . .
. .
. . . .
. .
. .
.
. . .
. .
. . . .
.
. .
.
. . .
. . .
.
. . .
9.
. . .
PENDAHULUAN
Latar Belakang
Di Indonesia, susu fermentasi sudah cukup dikenal. Dadih add$ salah satu produk susu fermentasi tradisional Indonesia yang berasal dari Sumatra Barat. Dadih serupa yogurt merupakan hasil fermentasi darniah; yang dilakukan dengan menyimpan susu kerbau dalam tabung bambu selama semdam, dan ditutup dengan daun pisang. Selma ini dadih hanya dikenal di daerah asalnya.
Berdasarkan hasil penelitian terdahulu diperoleh bahwa 36 strain bakteri asam laktat asal dadih telah berhasil diisolasi dan diidentifikasi (Surono, et al.,
2
total 0,3 persen yang terus meningkat hingga 0,6 persan selama 24 jam fermentasi, sehingga berpotensi untuk digunakan sebagai starter susu fermentasi
.
Proses presemasi merupakan salah satu tahapan penting dalam upaya mempertahankan keunggulan suatu isolat yang berpotensi. Selama penyimpanan sangat dimungkmkan terjadinya p e n m a n viabilitas akibat kernatian sel, perubahan sifat genetik bahkan kemungkinan hilangnya s&t-sifat yang potensial. Oleh karena itu metoda presemasi dan penyimpanan yang akau digunakan h a m sesuai dengan karakter isolat, sehingga dapat memhimalii penufunm viabilitas dan potensi yang dimilikinya selama penyimpanan. Pembekuan merupakan salah satu alternatif presemasi kultur bakteri asam laktat.
Tujuan Penditian
Penelitian ini bertujuan untuk mendapatkan kondisi terbaik proses pembekuan dan penyimpanan beku bakteri asam laktat asal dadih dalam mempertahankan viabilitas dan aktivitas biokimiawinya yang meliputi aktivitas enzim proteolitik dan kemampuan mernproduksi asam laktat. Disamping
itu
dari penelitian ini diharapkan dapat diperoleh hasil formulasi media terbaik dalarn penyediaan kultur starter bakteri asam laktat asal dadih.Ruang Lingiarp
3
pembekuan terdiri dari dua macam, yaitu metoda pembekuan dan jenis
cryoprotectant.
Penyimpanan dilakukan terhadap empat strain bakteri asam laktat yang telah dibekukan dengan dua macam perlakuan. Penyimpanan beku
. dikelompokkan dalam dua kondisi suhu yang berbeda di dalam deepfieezer.
Dari hasil pembekuan dan penyimpanan beku akan diperoleh strain bakteri asam laktat yang paling stabil selama pembekuan dan penyimpanan beku. Terhadap strain yang terpilih tersebut, selanjutnya dibuat formulasi media kultur starter dengan variasi tiga macam formula media
TINJAUAN PUSTAKA
Isolat bakteri asam laktat asal dadih
Bakteri asam laktat adalah kelompok bakteri yang metabolisme karbohidratnya membentuk
asam
laktat, baik sebagai satu-satunya produk atau sebagai produk utama Bakteri ini tergolong bakteri Gram positif, tidak berspora, anaerob tetapi aerotoleran dan toleran terhadapasam
(Salminen dan Atte von Wright, 1993).Bakteri asam laktat dapat berasal dari saluran pencemaan manwia, produk-produk susu dan secara alarniah terdapat pada permukaan tanaman tertentu. Beberapa spesies bakteri asam laktat digudcan secara komersial untuk memproduksi susu fennentasi dan produk-produk daging. Bakteri
asam
laktat mdiputi genus, Lactowccuss Enterowccuss Lactobacillus, Leucon~stoc, dan Pediococcus (Salminen dan Atte von Wright, 1993).Dalam produk pangan umumnya bakteri asam laktat tidak berbahaya dan memenuhi status GRAS (Generally Rewgnized As Safe). Di Amerilca, bahkan memberikan efek berxnadaat bagi manusia, karena kornponen metabolit yang dihasilkannya dapat menghambat bakteri anterik patogm, mengatasi lactose intolerance, menurunkan kadar kolesterol, antimutagenik dan antikarsinogenik, serta memperbaiki sistem kekebalan tubuh (Surono, 1 998).
Dadih adalah produk susu fermentasi serupa yogurt dari Surnatera Barat, yaitu hasil fermentasi alarniah yang dilakukan dengan menyimpan susu dalam tabung bambu selama semalam, dan ditutup dengan daun pisang dan bambu. Bakteri asam laktat terdapat dominan dalam dadih dan 36 strain bakteri asam laktat telah berhasil diisolasi dan diidentifikasi (Surono, et al., -1983; Hosono, et al., 1989).
Menurut Azria (1986), kandungan mikroba dalam tabung bambu adalah 2,5x1
o2
sampai 1 ,ox1o3
koloni per cm2, yang didominasi oleh bakteri pembentuk asam dan bersifat proteolitik. Sedang Hosono, et al. (1989) melaporkan bahwa total bakteri pada dadih segar berasal dari Bukittinggi sebesar 3,s sampai 4,3x108 koloni per gram, didominasi oleh bakteri asam laktat, dan Leuconostoc paramesenteroides mendominasi populasi bakteri asam laktat pada dadih, yaitu 50 persen dari populasi, sedang Lactobacillus casei subsp casei sebesar 11 persen.Lactobacillus casei subsp casei, Leuconostoc paramesenteroides, Enterococcus faecalis subsp liquefaciens, Lactococcus lactis subsp lactis asal
dadih menunjukkan aktivitas antimutagenik dan marnpu menurunkan kadar kolesterol darah secara in vitro maupun in vivo, serta daya pengikatan sel bakteri asam laktat terhadap senyawa mutagenik dan mampu menurunkan kadar kolesterol darah secara in vitro sebesar 34 persen (Surono dan Hosono, 1996; Hosono dan Tono-oka, 1995).
6
typhymuriwn, Escherichia coli dan Shigella sp (Surono, 2000). Menurut Surono (1997), sifat antimikroba patogen yang dimiliki oleh bakteri asaml laktat disebabkan oleh sif-ya yang cocok dengan nutrisi yang tersedia, sehingga lebih unggul dalam kompetisinya dengan mikroba patogen. Disamping itu, bakteri asam laktat juga memproduksi metabolit seperti asam organ&,
Hz&
dan bakteriosin, serta menstirnulir sistim kekebalan tubuh.Hasil penelitian selanjutnya menyatakan bahwa Lactobacillus casei subsp casei R-52 mempunyai daya gumpal yang halus dan tinggi setelah 12 jam inkubasi dengan total asam 0,s persen yang terus meningkat hingga 0,6 persen selama 24 jam fermentasi, sehingga berpotensi
untuk
digunakan sebagai starter susu fermentasi (Surono, dkk, 1997).Preservasi dan Penyimpanan Mikroba
Pada dasamya, preservasi dan penyimpanan rnikroba memiiiki berbagai tujuan: (1) tujuan taksonomi, mikroba diperlukan
untuk
'perpustakaan' strain dengan karakteristik yang spesifik, baikuntuk
tujuan identifikasi maupun pengajaran; (2) tujuan penelitian, mikroba diperlukan para penelitiuntuk
mdakukan penelitian-penditian di berbagai bidang, baik di bidang pangan, pertanian maupun kesehatan; (3) tujuan industri, berbagai mikroba mempunyai potensiuntuk
dimanfaatkan di bidang industri danuntuk
menjaga agar potensi ini tetap stabil, diperlukan penyimpanan yang baik; (4) tujuan lain, misalnya di bidang kedokteran, mikroba diperlukanuntuk
pagujian atau referensi.dikehendaki hilang atau terdesak oleh kontaminan sehingga perlu dilakukan isolasi kembali dan purifikasi; (2) sfrain mati, apabila strain tidak lagi dapat ditumbuhkan, maka harus d~lakukan isolasi kembali yang kemungkman tidak sama dengan aslinya, atau kalau strain tersebut diperoleh dari koleksi kultur tertentu rnaka perlu pengiriman kembali; (3) perubahan sifat, strain yang mengalami transfer berkali-kali, dapat mengalami perubahan sifat genetik bahkan kemunglunan hilangnya (berkurangnya) sifat-sifat yang potensial.
Berbagai teknik telah dikembangkan untuk penyimpanan rnikroba dm memilih teknik penyimpanan yang tepat untuk suatu jenis mikroba adalah hal yang tidak mudah. Masing-masing metoda mempunyai keuntungan maupun kerugian. UIltuk memilih metoda penyimpanan perlu diperhatikan beberapa faktor, yaitu jumlah kultur, nilai kultur, fiekuensi penggunaan kultur, fasilitas yang dimiliki (peralatan d m sumber daya manusia) d m biaya Namun demikian, penyimpanan yang diterapkan harus tetap dapat mernpertahmkan mikroba agar tidak mati, tidak terkontaminasi, tidak mengalami perubahan populasi melalui seleksi, dan tidak mengalami perubahan genetik.
Yang perlu diketahui bahwa tidak ada satu metodapun yang dapat digunakan untuk menyimpan semua jenis mikroba, bahkan strain yang berbeda di dalarn satu spesiespun memiliki perbeciaan respon terhadap stress akibat dari metoda penyimpanan yang dilakukan.
8
Preservasi dengan metoda continous growth, adalah preservasi yang dilakukan dengan menurnbuhkan mikroba secara periodik dari medium lama ke dalam medium baru untuk memperoleh kondisi pertumbuhan optimum. Cara ini biasanya diikuti dengan penyimpanan dalam repigerator atau peezer (-10°C sampai -20°C), dan khususnya untuk biakan jamur dapat disimpan dengan perendaman dalam minyak mineral (oil storage) atau penyimpanan dengan perendaman dalam air steril (water storage).
Metode pengeringan umurnnya digunakan untuk mikroba dalam keadaan fase istirahat, rnisalnya kondisi mikroba dalam bentuk spora. Bentuk kapang dapat dikeringkan dengan udara kering dan dapat dikeringkan di dalam atau di atas silica gel.
Metabolisme tersuspensi adalah preservasi dengan cara menurunkan kandungan cairan sel melalui dehidrasi peeze-drying) atau pembekuan. Produk
Peeze-drying membutuhkan kondisi penyimpanan vakum atau kondisi tekanan atmosfir dalam gas inert. Sedang, untuk proses pembekuan diperlukan penurunan suhu sampai di bawah -70°C yang diikuti dengan penyirnpanan pada suhu di bawah
-139°C. Penyimpanan dapat dilakukan dalam Peezer, pencelupan dalam cairan nitrogen atau menempatkan di atas cairan nitrogen.
Pembekuan Kultur Bakteri
disebabkan oleh perbedaan tekanan osmosis akibat pembentukan kristal es dan kenaikan konsentrasi bahan terlarut di luar sel (ATCC, 1997).
Menurut Ray dan Speck (1973), proses pembekuan akan menyebabkan berbagai perubahan fisik, kimiawi maupun biokimiawi sel bakteri. Pada penurunan suhu 20°C sampai 10°C akan t e r j d perubahan konsentrasi larutan, perubahan pH dan kenaikan kelarutan gas. Pada penurunan suhu 0°C sampai
-
10°C, pembekuan &an terjadi; yang dimulai dari bagian medium di luar sel\
dengan terbentuknya kristal es. Suhu awal terjadinya pembekuan sangat tergantung pada sifat dan konsentrasi zat terlarut di dalam suspensi medium. Jlka cairan sel dapat mempertahankan kondisi tersebut sampai mencapai suhu -10°C sampai -15"C, maka pembekuan di atas suhu tersebut, hanya akan terjadi di luar sel.
Pembekuan selanjutnya &an berlangsung melalui dua kemungkinan, yaitu dengan mengeluarkan air dari dalam sel dan membekukannya di luar sel (dehidrasi) atau dengan membekukan cairan sel secara intraseluler. Hal ini tergantung pada kecepatan pembekuan dan permeabilitas membran sel terhadap air. Jika kecepatan pembekuan lambat atau permeabilitas membran tinggi, sel akan membeku melalui pembentukan kristal es secara ekstraseluler. Tetapi jika kecepatan pembekuan tinggi atau permeabilitas sel rendah, maka sel akan membeku melalui pembentukan kristal es secara intraseluler.
maupun tinggi. Disamping itu, perubahan pH akan menyebabkan pula terjadinya denaturasi makromolekul. Konsentrasi elektrolit yang meningkat akan mempengaruhi membran lipida yang akan dapat mengakibatkan kebocoran sel. Kenaikan konsentrasi ion dapat menurunkan kekuatan ikatan hdrofobik, sehingga konfigurasi makromolekul akan terganggu (Ray dan Speck, 1973).
Selama proses pembekuan kemungkinan kerusakan sel dapat terjadi karena perbedaan sensitivitas untuk setiap jenis rnikroba terhadap pembekuan. Menurut Mazur (1966), kerusakan sel selama pembekuan dapat terjadi &bat terbentuknya kristal es baik intraseluler maupun ekstraseluler dan terkonsentrasinya zat terlarut baik ekstraseluler maupun intraseluler.
Kerusakan yang terjadi selama pembekuan dapat mengakibatkan: (1) perubahan morfologi sel, (2) perubahan struktur sel, (3) perubahan fungsi sel atau (4) perubahan stabilitas genetik sel (Ray dan Speck, 1973).
Beberapa faktor dapat mempengaruhi ketahanan sel selama proses pembekuan, yaitu: (1) ukuran dan tipe sel, (2) urnur sel, (3) perrrieabilitas membran sel, (4) pemakaian ciyQprotectant, (5) metode pembekuan, (6) metode penyimpanan dan (7) metode thawing.
11
Faktor permeabilitas sel, menurut
ATCC
(1997) berpengaruh .terhadap sensitivitas sel selarna pembekuan. Sel yang berasal dari kultur cair yang diaerasi akan memiliki permeabilitas yang baik dan akan memiliki toleransi yang tinggi terhadap proses pembekuan cepat. Dikemukakan oleh Ray dan Speck (1973),bahwa membran sel yang tersusun oleh sejumlah besar asam lemak tidak jenuh akan bersifat lebih elastis dan merniliki permeabilitas yang baik terhadap air; biasanya terdapat pada sel yang ditumbuhkan pada kondisi yang tepat.
Untuk membantu memperkecil kemungkinan terjadinya kerusakan sel selama pembekuan, maka komponen bahan kimia dapat ditarnbahkan ke dalam suspensi sel. Bahan kimia tersebut dikenal sebagai cryoprotectant, yang merniliki sifat-sifat tertentu sehingga dapat berfungsi sebagai pelindung sel selama pembekuan. Bahan tambahan yang sering digunakan untuk pembekuan sebagian sel di
ATCC
adalah gliserol dan dimethylsu2fobide (DMSO) pada konsentrasi 5 sampai 10 persen (vlv).Pengaruh metoda pembekuan terhadap ketahanan sel berkaitan dengan suhu dan laju pembekuan yang digunakan, serta jenis sel yang dibekukan. Suhu dan kecepatan pembekuan sangat menentukan apakah cairan sel akan dibekukan secara internal atau ekstemal. Apabila laju pembekuan cepat, cairan sel akan membeku secara internal. Apabila laju pembekuan lambat, cairan sel akan dikeluarkan dan dibekukan secara ekstemal.
viabilitasnya. Kecepatan pembekuan yang tidak terlalu cepat untuk menghindari kristalisasi secara internal dan tidak terlalu lambat untuk menghmdari kontak zat terlarut dengan komponen sel yang dapat mengakibatkan kerusakan (Ray dan Speck, 1973).
Dalarn ha1 pengaruh faktor metode penyimpanan terhadap ketahanan sel, menurut Srnione dan Brown (1991), suhu penyimpanan beku berpengaruh terhadap ketahanan hidup sel selama penyimpanan, yang disebabkan oleh pembentukan kristal es yang masih dapat terus berlangsung
pads
suhu di bawah suhu proses pembekuan.Cryoprotedant
Cryoprotectant adalah komponen bahan kirnia yang dapat melindungi sel dari kerusakan selarna proses pembekuan dan penyimpanan beku. Pada umumnya komponen tersebut mengandung gugus OH dan NH2 dan gugus lainnya yang memiliki kecenderungan untuk membentuk ikatan lvdrogen yang kuat diantara komp~nen tersebut, dengan makromolekd di permukaan sel atau dengan air (Ray
dan Speck, 1973).
Sedang, Morichi et al. (1963) mengemukakan bahwa ciri struktural sehingga suatu komponen dapat dipilih sebagai pelindung sel selama pembekuan adalah: (1) memiliki gugus fungsional dengan elektronegativitas yang tinggi pada atom a-carbon, (2) lcelompok two acid (a dan y-COOH), (3) mendekati bentuk
-
NJ& dan -COOH.metode pembekuan tersebut berbeda. Namun pada dasarnya kemampuan komponen tersebut untuk membentuk ikatan hidrogen dengan air maupun dengan struktur sel dapat mencegah kematian sel &bat pembentukan kristal es intraseluler maupun terkonsentrasinya zat terlarut.
Mekanisme perlindungan cryoprotectant,
di
dalam ATCC (1997) disebutkan bahwa cryoprotectant dapat mengurangi ukuran, jumlah dan kecepatan pertumbuhan kristal es. Disamping itu cryoprotectant juga dapat m e m b d a n efek koligatif, membantu berlangsungnya dehidrasi secara osmotik sibelurn pembekuan, dapat m e n d a n titik beku sel, menstabilkan membran, meningkatkan permeabilitas sel dan dapat bersifat bufer untuk mengimbangi adapya perubahan pH selama pembekuan.Cryoprotectant dapat dikelompokkan menjadi dua, yaitu cryoprotectant dengan bobot molekul (BM) rendah dan cryoprotectant dengan bobot molekul tinggi. Masing-masing kelompok dapat membantu mencegah kerusakan sel selarna pembekuan, namun dengan mekanisme perlindungan yang berbeda.
Cryoprotectant BM tinggi tidak dapat menembus sel, tetapi berperan untuk melindungi membran yang sensitif terhadap denaturasi &bat terkonsentrasinya gararn selama pembekuan (Meryman, 1966). Beberapa komponen kimia BM tinggi tersebut antara lain gelatin, mucin, albumin,
polyviniZpyrolidone
(PW)
dan dekstran. Dilaporkan oleh Moss dan Speck (1963) bahwa skim milk dapat mempertahankan viabilitas Streptococcus lactis sebesar 98persen.
Media Kultur Starter Bakteri Asam Laktat
Formulasi media kultur starter susu fermentasi dapat dioptimumkan untuk mendapatkan starter susu fermentasi yang dapat mernfermentasi susu dengan cepat dan efisien. Berbagai media yang baik untuk pertumbuhan bakteri asam laktat adalah susu skim, susu kedelai dan air kelapa, masing-masing mempunyai keunggulan faktor yang mendukung pertumbuhan bakteri laktat.
Penggunaan susu kedelai sebagai media pada pembuatan minuman fermentasi sudah lazim dilakukan disamping susu skim. Susu kedelai memiliki keunggulan nilai nutrisinya untuk kepentingan kesehatan, karena tidak mengandung kolesterol, laktosa dan juga hanya mengandung sedikit asam lemak jenuh. Disamping itu harganyapun lebih murah. Menurut Mac Lwd dan Ames (1988), beberapa jenis gula yang terpenting dalarn susu kedelai adalah sukrosa, raffinosa dan melobiosa.
gula maksimum 4 persen (rata-rata 2 persen) yang terdiri dari sukrosa, glukosa
METODOLOGI
Bahan dan Alat
Kultur bakteri. Bakteri asam laktat yang akan digunakan dalarn penelitian ini sejumlah empat strain yang merupakan isolat dari dadih asal Bukittinggi, yang terdiri dari: Lactococcus Iactis subsp. lactis R-22, Leuconostoc paramesenteroides R-51, Lnctobacillus subsp casei R-52, dan Leuconostoc paramesenteroides R-62.
Bahan kirnia. Bahan yang digunakan terdiri dari: (I) media untuk pertumbuhan mikroba: MRS Broth, Nutrien Broth, Bacto-agar; (2)
cryoprotectant: gliserol, dimethylsulfoxide (DMSO); (3) larutan bufer: Na&P04, NaOH, HCI ; (4) bahan kirnia untuk analisis : kasein, CaC12, tirosin,
trichloroacetat (TCA), Na2C03, pereaksi folin, lyzozim, o-phenil-PD-galactoside (ONPG), fenol-ftaline
0 ,
asam asetat glasial.Alat. Peralatan yang digunakan dalarn penelitian ini terdiri dali : (1) peralatan kultivasi sel: laminar air flow, inkubator, sentrifus ; (2) peralatan pembekuan dan penyimpanan: cryotube, deepfreezer, (3) peralatan analisis: water bath, spektrofotometer, buret, colony counter, pH meter ; (4) peralatan lain: test tube, tabung sentrifus, tabung eppendor$ cawan petri, rnikropipet, autoklaf, oven,
Metode
Penelitian ini secara garis besar terdiri atas tiga tahap, yaitu: (1) tahap pembekuan, (2) tahap penyimpanan dan (3) tahap formulasi kultur starter. Bagan tahapan penelitian disajikan pada Lampiran 1.
Pembekuan dilakukan terhadap empat strain bakteri asam laktat yang merupakan isolat dari dadih asal Bukittinggi, yang pada penelitian sebelumnya diketahui memiliki sifat antimutagenik yang batk. Empat strain tersebut adalah
Lactococcus lactis subsp lactis R-22, Leuconostoc paramesenteroides R-51,
Lactobacillus casei subsp casei R-52 dan Leuconostoc paramesenteroides R-62.
Kultivasi sel terhadap masing-masing strain dilakukan sebelum pembekuan yang prosedumya dapat dilihat pada Lampiran 2.
pembentukan asam laktat ( prosedur analisisnya dapat dillhat pada Lampiran 4, 5
dan 6 ).
Penyimpanan dilakukan terhadap keempat strain bakteri asam laktat yang masing-masing telah lbekukan dengan perlakuan dua metoda pembekuan dan empat jenis cryoprotectant yang berbeda. Percobaan tahap penyimpanan ini bertujuan untuk mengetahui pengaruh metoda pembekuan dan jenis
cryoprotectant terhadap viabilitas, aktivitas proteolitik dan kemampuan pembentukan asam laktat. Penyimpanan dikelompokkan m e n j d dua kondisi suhu penyimpanan yaitu yaitu -20°C dan -70°C dalam deep fleezer. Pengamatan dilakukan setiap dua rninggu selama delapan minggu. Data yang diperoleh dianalisis dengan menggunakan andisis sidik ragam, bila terdapat perbedaan diantara perlakuan dilanjutkan dengan uji Duncan Multiple Test.
Rancangan Percobaan
Penelitian ini akan dilakukan dalam tiga tahap yaitu tahap pembekuan, tahap penyimpanan dan tahap formulasi media kultur starter. Data hasil penelitian tahap pertarna dan kedua dianalisis secara statistik, sedang data hasil penelitian tahap ketiga akan dianalisis dengan mempertimbangkan kecepatan tercapainya akhir fase logaritmik bakteri asarn laktat tersebut selama waktu inkubasi.
Pengaruh metoda pembekuan dan jenis cryoprotectant terhadap daya simpan kultur bakteri asam laktat pada suhu penyimpanan yang berbeda
Rancangan percobaan yang digunakan yaitu Rancangan Acak Lengkap Pola Faktorial.
Rumus : Y i j ~ = p +
K;
+
Aj +Bk
+
CI+ ABjk
+
ACjl+
BC ld+
ABCjld+
EijklYijkl = respon percobaan karena pengaruh bersama taraf ke-j dari faktor A, taraf ke-k dari faktor B, taraf 1 dari faktor C, yang terdapat pada kelompok ke-i
C1 = pengaruh rata-rata yang sebenarnya
Ki = pengaruh taraf ke-i, kelompok K (i=1,2) Aj = pengaruh taraf ke-j, faktor A (i= 1,2)
Bk
= pengaruh taraf ke-k, faktor B (k=1,2,3,4)CI = pengaruh tarafke-1, faktor C (1=1,2,3,4)
(AB)jk = pengaruh interaksi antara taraf ke-j faktor A, dan taraf ke-k faktor B (AC)jl = pengaruh interaksi antara taraf ke-j faktor A, dan taraf ke-1 faktor C (BC)kl = pengaruh interaksi antara taraf ke-k faktor B, dan taraf ke-1 faktor C (ABC)j~= pengaruh interaksi antara taraf ke-j faktor A, taraf ke-k faktor B dan
taraf ke-1 faktor C
Eiu = pengaruh dari unit percobaan ke-i dalam kombinasi perlakuan (ijk), i= 1,2
Perlakuan. Perlakuan pada penelitian ini terdiri dari tiga faktor, yaitu : (1) Metode pembekuan (Faktor A), terdiri dari dua tar& yaitu :
a2 = metode pembekuan lambat (dalam deepfreezer pada suhu -20°C)
(2) Jenis cryoprotectant (Faktor B), terdiri dari empat tar&, yaitu : bl = bufer fosfat, pH 7 (kontrol)
b2 = gliserol 10 persen
b3 = dimethylsulfoxzide (DMSO) 10 persen
bh = skim 10 persen
Kelompok. Kelompok pada tahap kedua penelitian ini terdiri dari dua
taraf, yaitu : 1 = penyimpanan pada suhu -20°C
2 = penyimpanan pada suhu -70°C
Pengamatan. Pengamatan akan dilakukan terhadap sampel-sampel berikut :
(1) sampel sebelum pembekuan
(2) sampel beku setelah penyimpanan 0,2,4,6,8 rninggu
Analisis. Parameter yang dianalisis dalam penelitian ini meliputi : (I) Uji viabilitas (To dan Etzel, 1997)
(2) Uji produksi asam laktat (Metoda Mann 's Acid Test)
HASIL DAN PEMBAHASAN
Pembekuan dan Penyimpanan Beku Kultur Bakteri Asam Laktat
Kultur bakteri asam laktat dibekukan dengan perlakuan dua metoda
pembehan dan empat jenis cryoprotectant. Metoda pembehan terdiri dari
pembekuan cepat dan pembekuan lambat, jenis cryoprotectant terdiri dari gliserol
10 persen, DMSO 10 persen dan susu skim 10 persen dengan bufer fosfat pH 7
sebagai kontrol. Dari hasil pembekuan tersebut, selanjutnya kultur disimpan pada
dua kondisi suhu yang berbeda yaitu -20°C dan -70°C dalam deeppeezer.
Hasil pengamatan viabilitas, total asam dan aktivitas proteolitik kultur
bakteri asam laktat sebelum dan sesudah penyimpanan serta selama penyimpanan
8 minggu, dapat dilihat pada Lampiran 7, 8 dan 9.
Viabilitas kultur bakteri asam laktat selama penyimpanan beku
Hasil analisis ragam viabilitas kultur bakteri asam laktat selama
penyimpanan beku dapat dilihat pada Lampiran 10. Dari hasil analisis tersebut
diperoleh bahwa metoda pembekuan dan jenis cryoprotectant masing-masing
berpengaruh terhadap viabilitas kultur bakteri asam laktat. Tetapi tidak demikian
halnya untuk interaksinya. Faktor suhu penyimpanan juga tidak berpengaruh pada
viabilitas kultur bakteri asam laktat. Hasil uji Duncan pengaruh metoda
pembekuan dan jenis cryoprotectant masing-masing terhadap viabilitas kultur
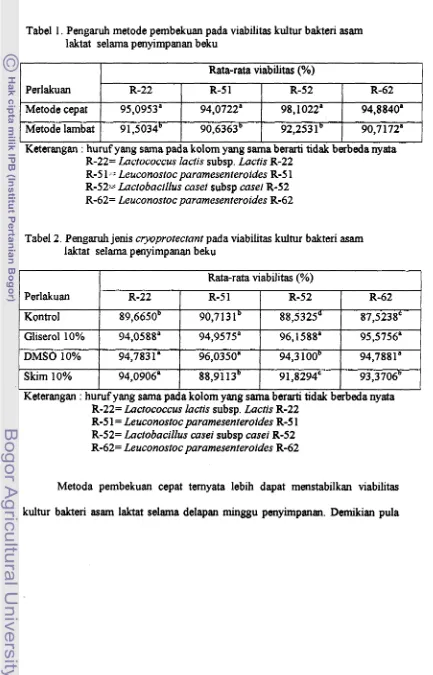
bakteri asam laktat selama penyimpanan beku dapat dilihat pada Tabel 1 dan 2. Berdasarkan Tabel 1 dan 2, terlihat bahwa. kultur bakteri laktat strain
pembekuan cepat dan pada penambahan gliserol 10 persen. Hal ini apabila dibandingkan dengan viabilitas ketiga strain yang lain.
Tabel 1. Pengaruh metode pembekuan pada viabilitas kultur bakteri asam laktat selama penyimpanan beku
I
Rata-rata viabilitas (%)Tabel 2. Pengaruh jenis cryoprotectant pada viabilitas kultur bakteri asam laktat selama penyimpanan beku
Perlakuan Metode cepat Metode lambat
Rata-rata viabilitas (%)
Keterangan : huruf yang sama pada kolom yang sama berarti tidak berbeda nyata R-22= Lactococcus lactis subsp. Lactis R-22
R-5 1 = Leuconostoc paramesenteroides R-5 1 R-52= Lactobacillus casei subsp casei R-52 R-62= Leuconostoc paramesenteroides R-62
R-22 95,0953' 91 ,5034b
Metoda pembekuan cepat temyata lebih dapat menstabilkan viabilitas Perlakuan
Kontrol Gliserol 10% DMSO 10% Skim 10%
kultur bakteri asarn laktat selama delapan minggu penyimpanan. Demikian pula R-5 1
94,0722' 90,6363~
Keterangan : huruf yang sama pada kolom yang sama berarti tidak berbeda nyata R-22= Lactococcus lactis subsp. Lactis R-22
R-5 1 = Leuconostoc paramesenteroides R-5 1 R-52= Lactobacillus casei subsp casei R-52 R-62= Leuconostoc paramesenteroides R-62
23
pemakaian gliserol 10 persen ternyata juga lebih dapat menstabilkan viabilitasnya. Hal ini akan lebih jelas terlihat pada Garnbar 1 dan 2.
Fast = pembekuan cepat Slow= pembekuan lambat
0 2 4 8
Lama penyimpanan (minggu)
Garnbar 1. Viabilitas Lactobacillus casei subsp casei R-52 setelah pembekuan dengan variasi metoda pembekuan selarna penyimpanan beku
Meto da pembekuan cepat dapat mempertahankan viabilitas selama penyimpanan, karena pada proses pembekuan cepat cairan sel dapat segera membeku, sehingga dehidrasi cairan sel dapat dihindari. Terbentuknya kristal es intraseluler sebenarnya dapat memacu kerusakan struktural sel yang akan menyebabkan kematian sel. Dengan penarnbahan gliserol 10 persen, terbentuknya knstal es tersebut dapat dirninirnalkan. Karena gliserol adalah jenis cryoprotectant
Keterangan :
K = kontrol, tanpa
G
= gliserol 10 persen D =DMSO
10 persen [image:125.564.75.489.76.819.2]S
= susu skim 10 persenGambar 2. Viabilitas Lactobacillus casei sub sp casei R-52
setelah pembekuan dengan variasi jenis cryoprotectant
selama penyimpanan beku
Pembentukan asam laktat kultur bakteri asam laktat selama penyimpanan beku
Hasil analisis ragam pembentukan asam laktat kultur bakteri asam laktat
selama penyimpanan beku dapat dilihat pada Lampiran 11. Dari hasil analisis tersebut diperoleh bahwa hanya metoda pembekuan yang berpengaruh terhadap
pembentukan asam laktat kultur bakteri asam laktat. Sedang, jenis cryoprotectant
tidak mempengaruhi kemampuan pembentukan asam laktat selama 8 minggu penyimpanan beku. Faktor suhu penyimpanan juga tidak berpengaruh pada
kemampuan pembentukan asam laktat kultur bakteri asam laktat. Hasil uji Duncan
pengaruh metoda pembekuan terhadap kemampuan pembentukan asam laktat
kultur bakteri asam laktat selama penyimpanan beku dapat dilihat pada Tabel 3. Berdasarkan Tabel 3, terlihat bahwa kultur bakteri laktat strain
pembekuan lambat. Hal ini apabila dibandingkan dengan kemampuan pembentukan asam laktat dari ketiga strain yang lain pada kondisi yang sama
Tabel 3. Pengaruh metode pembekuan pada kemampuan pembentukan asam laktat kultur bakteri asam laktat selama penyimpanan beku
I
Rata-rata total asam (%)I
I I I I I
Keterangan : huruf yang sama pada kolom yang sama berarti tidak berbeda nyata
R-22= Lactococcus lactis subsp. Iactis 8-22
Perlakuan Metode cepat Metode lambat
R-5 1 = Leuconostoc paramesenteroides R-5 1 R-52= Lactobacillus casei subsp casei 8 - 5 2 R-62= Leuconostoc paramesenteroides R-62
Hasil uji Duncan terhadap rata-rata hasil perhitungan juga memperlihatkan bahwa metode pembekuan lambat cenderung lebih dapat memacu kemampuan
R-62
l , O O l b
1,336'
kultur bakteri asarn laktat untuk membentuk asam laktat selama 8 minggu
R-52
1, 12gb
1 ,42ga R-22
0 , 8 3 3 ~
1,425"
penyimpanan beku. Hal ini akan lebih jelas terllhat pada Gambar 3, untuk strain
R-5 1
1 , 0 5 7 ~
. 1,351a
Lactobacillus casei subsp casei R-52.
keluarnya sebagian enzim 8-galaktosidase yang tetap aktif sehingga lebih mengaktifkan pembentukan asam laktat, sekalipun selnya telah rnati.
0.2 0
0 2 4 8
Lama penyirnpanan (rninggu)
Keteranaan :
Fast = pembekuan cepat Slow=pembekuan lambat
Gambar 3. Kemampuan pembentukan asam laktat kultur Lactobacillus casei subsp casei R-52 setelah pembekuan dengan variasi metoda pembekuan selama penyimpanan beku
Di dalam Surono (2000) dilaporkan bahwa aktivitas D-galaktosidase dari kultur LactobaciIIus casei subsp casei R-52 leblh stabil pada pembekuan dan penyimpanan dalam larutan nitrogen selama 30 hari dibandingkan dengan pembekuan dalam larutan dry-ice aceton pada kondisi penyimpanan yang sama. Namun aktivitas D-galaktosidase selama penyimpanan tersebut lebih dipengardu oleh tingkat viabilitas yang tinggi dari hail pembekuan cepat dalam larutan nitrogen.
Dengan dernikian tingkat kernampuan pembentukan asam laktat selama penyimpanan lebih disebabkan oleh tersedianya Bgalaktosidase yang mash H
Aktivitas proteolitik kultur bakteri asam laktat selama penyimpanan beku
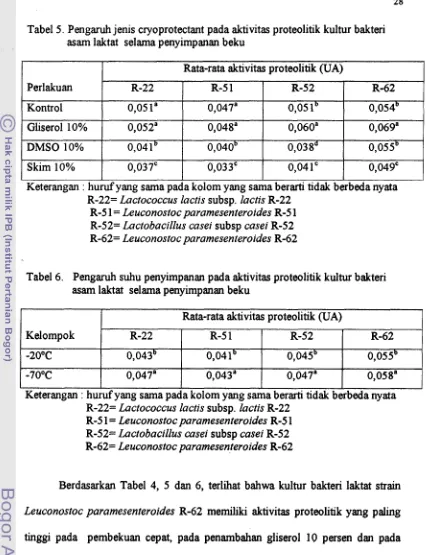
Hasil analisis ragam aktivitas proteolitik kultur bakteri asam laktat selama penyimpanan beku dapat dilihat pada Lampiran 12. Dari hasil analisis tersebut diperoleh bahwa metoda pembekuan dan jenis cryoprotectant masing-masing berpengaruh terhadap aktivitas proteolitik kultur bakteri asam laktat. Tetapi tidak demikian halnya untuk interaksinya. Faktor suhu penyimpanan berpengaruh pada aktivitas proteolitik kultur bakteri asam laktat. Hasil uji Duncan pengaruh metoda pembekuan, jenis cryoprotectant dan suhu penyimpanan masing-masing terhadap aktivitas proteolitik kultur bakteri asam laktat selama penyimpanan beku dapat dilihat pada Tabel 4, 5 dan 6.
Tabel 4. Pengaruh metode pembekuan pada aktivitas proteolitik kultur bakteri asam laktat selama penyimpanan beku
Keterangan : huruf yang sama pada kolom yang sama berarti tidak berbeda nyata R-22= Lactococcus lactis subsp. lactzs R-22
R-5 1 = Leuconostoc paramesenteroides R-5 1
R-52= Lactobacillus casei subsp casei R-52 R-62= Leuconostoc paramesenteroides R-62 Perlakuan
Metode cepat Metode lambat
Tabel 5. Pengaruh jenis cryoprotectant pada aktivitas proteolitik kultur bakteri
. . asam laktat selama penyimpanan beku
Rata-rata aktivitas proteolitik (UA)
Tabel 6. Pengaruh suhu penyimpanan pada aktivitas proteolitik kultur bakteri asam laktat selama penyimpanan beku
Perlakuan Kontrol Gliserol 10% DMSO 10% Skim 10%
Berdasarkan Tabel 4, 5 dan 6, terlihat bahwa kultur bakteri laktat strain Keterangan : huruf yang sama pada kolom yang sama berarti tidak berbeda nyata
R-22= Lactococcus Iactis subsp. lactis R-22 R-5 1 = Leuconostoc paramesenteroides R-5 1 R-52= LactobaciIIus casei subsp casei R-52 R-62= Leuconostoc paramesenteroides R-62
R-22 0,05 la 0,052a 0,041" 0,037' Kelompok -20°C -70°C
Leuconostoc paramesenteroides R-62 memiliki aktivitas proteolitik yang paling tinggi pada pembekuan cepat, pada penambahan gliserol 10 persen dan pada penyimpanan suhu -70°C.
H
a
l
ini apabila dibandingkan dengan aktivitas proteolitik ketiga strain ymg lain pada kondisi yang sama.R-5 1 0,047a 0,048a 0,040~ 0,033C
Keterangan : huruf yang sama pada kolom yang sama berarti tidak berbeda nyata R-22= Lactococcus Iactis subsp. Iactis R-22
R-5 1 = Leuconostoc paramesenteroides R-5 1 R-52= LactobaciIIus casei subsp casei R-52 R-62= Leuconostoc paramesenteroides R-62
Rata-rata aktivitas proteolitik (UA)
R-22 0,043~ 0,047a
R-52 0,05 lb
29
Hasil uji Duncan terhadap rata-rata perhitungan memperlihatkan bahwa metode pembekuan cepat dan pemakaian gliserol 10 persen masing-masing secara terpisah cenderung lebih dapat mempertahankan aktivitas proteolitik kultur bakteri asam laktat selama 8 rninggu penyimpanan. Demikian pula suhu penyimpanan -70°C lebih dapat mempertahankan aktivitas proteolitik kultur bakteri asam laktat dibandingkan dengan suhu penyimpanan -20°C. Hal ini juga dapat lebih jelas terlihat pada Gambar 4, 5 dan 6, untuk strain Lactobacillus casei
subsp casei R-52.
Keterangan :
Fast = pembekuan cepat
Slow= pembekuan lambat
Lama penyimpanan (rninggu)
- , Gambar 4. Aktivitas proteolitik kultur Lactobacillus casei subsp casei R-52
0
0 2 4 8
Lama penyimpanan (minggu)
keterannan :
K = kontro1,tanpa cryoprotectant
G = gliserol 10 persen D = DMSO 10 persen
S
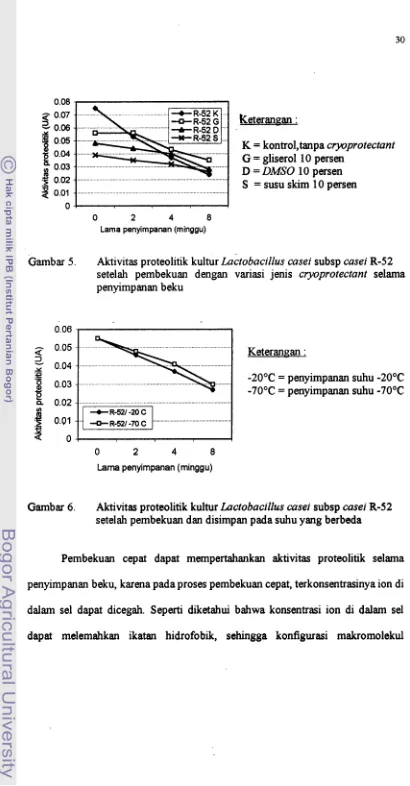
= susu skim 10 persen. -bar 5 . Aktivitas proteolitik kultur Lactobacillus casei subsp casei R-52 setelah pembekuan dengan variasi jenis cryoprotectant selama penyimpanan beku
-20°C = penyimpanan suhu -20°C
-70°C = penyimpanan suhu -70°C
[image:131.561.77.487.45.831.2]Lama penyimpanan (minggu)
Gambar 6. Aktivitas proteolitik kultur Lactobacillus casei subsp casei R-52 setelah pembekuan dan disimpan pada suhu yang berbeda
menjadi berubah; keadaan demikian dapat mengurangi aktivitas yang ,dimiliki makromolekul tersebut, termasuk dalam hal ini enzim proteolitik. Dengan pembekuan cepat, keadaan demikian dapat dihindari sehingga selama penyimpananpun aktivitas proteolitiknya lebih stabil dibandingkan dengan kultur bakteri asam laktat hasil pembekuan lambat.
Gambar 5 juga memperlihatkan bahwa gliserol 10 persen dapat mempertahankan aktivitas proteolitik kultur bakteri asam laktat yang paling baik dibandingkan dengan DMSO 10 persen maupun susu skim 10 persen selama penyimpanan 8 minggu; baik pada suhu -20°C maupun -70°C. Sedang, perlakuan tanpa cryoprotectant memperlihatkan hasil yang kurang memuaskan. Hal ini ditunjukkan dengan penurunan aktivitas proteolitik yang cukup tajam selama penyimpanan 8 minggu.
Gliserol dan
DMSO
termasuk cryoprotectant yang bersifat permeabel terhadap membran sel, sehingga dapat melindungi sel dari penurunan tekanan osmosis cairan sel akibat terkonsentrasinya zat terlarut di luar sel selama pembekuan (Meryman, 1966).Menurut Ray dan Speck (1973), sebagian air di dalam sel akan tenkat secara kirniawi dengan gliserol atau DMSO, Disamping itu gliserol atau DMSO dapat berikatan pula dengan sebagian makrornolekul di dalarn sel, di antaranya dengan enzim. Keadaan demikian diduga dapat mempertahankan aktivitasnya, termasuk aktivitas enzim proteolitik.
lebih hidrofilik dibandingkan dengan DMSO. Sedang, susu skim terrnasuk
cryoprotectant dari jenis "non-penetrating polymers" yang cenderung melindungi membran sel dari adanya perubahan tekanan osmosis selama pembekuan ( Ray dan Speck, 1973).
Formulasi Media Kultur Starter Bakteri Asam Laktat
Diantara empat strain yang digunakan dalam penelitian ini, terpilih
Lactobacillus casei subsp casei R-52 dan Leuconostoc paramesenteroides R-62 yang teruji memiliki daya tahan yang baik selama pembekuan dan penyimpanan beku untuk pembuatan kultur starter dengan beberapa fonnulasi media
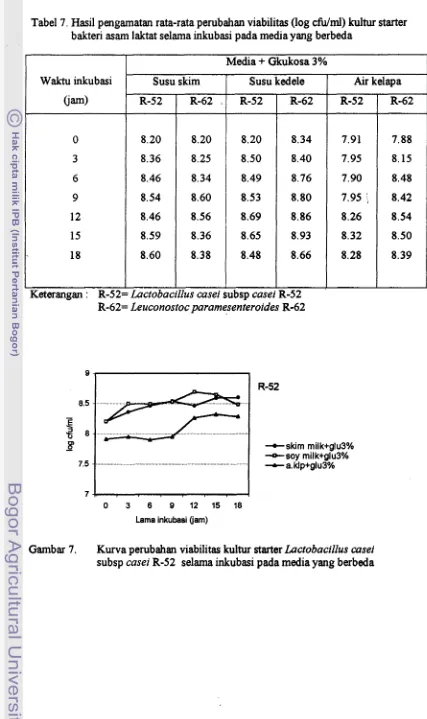
Tabel 7. Hasil pengamatan rata-rata perubahan viabilitas (log cfu/ml) kultur starter bakteri asarn laktat selarna inkubasi pada media yang berbeda
7
0 3 6 9 12 15 18
Lama inkubasi (jam)
Waktu inkubasi
(jam) 0 3 6 9 12 15 18
&skim milk+glu3%
-o- soy milk+glu3% +a. klp+glu3%
Gambar 7. Kurva perubahan viabilitas
kultur
starter Lactobacillus caseisubsp casei R-52 selama inkubasi pada media yang berbeda Keterangan : R-52= Lactobacillus casei subsp casei R-52
R-62= Leuconostoc paramesenteroides R-62 Media + Gkukosa 3%
Susu skim Air kelapa
R-52 8.20 8.36 8.46 8.54 8.46 8.59 8.60 Susu kedele R-52 7.91 7.95 7.90
7.95 ',
8.26
8.32
8.28 R-62
.
Gambar 7 dan 8 memperlihatkan bahwa formulasi media menggunakan susu kedele+glukosa 3% terhadap Lactobacillus casei subsp casei R-52 maupun
Leuconostoc paramesenteroides R-62 dapat mempersingkat waktu inkubasi dengan dicapainya aWllr fase logaritrnik setelah tiga jam inkubasi; hal ini apabila dibandingkan dengan dengan formulasi media menggunakan susu skim+glukosa
3% maupun air kelapa+glukosa 3%.
Di dalam susu kedele disinyalir mengandung gula jenis sukrosa, rafinosa, melibiosa dan fruktosa; sukrosa terdapat dominan di antara jenis gula lainnya (Mac Leon dan Ames, 1988). Beberapa jenis gula tersebut tidak terdapat di dalam susu skim. Berdasarkan hasil identifikasi isolat bakteri asam laktat asal dadih oleh Hosono et al. (1989), baik Lactobacillus casei subsp casel R-52 maupun
Leuconostoc paramesenteroides R-62 keduanya marnpu mengkonsumsi gula sukrosa sebagai sumber karbon untuk pertumbuhannya
Menurut Poch dan Bezkorovaing (1988), di dalam susu sapi tidak tersedia faktor pertumbuhan esensial seperti ~dcet~l-D-glucosamine, transgalactosyl oligosaccharide atau lactulose seperti yang terdapat pada kedele. Roy et al. (1990) melaporkan bahwa kelompok bakteri Bifidobakteria hanya dapat ditumbuhkan dengan baik dalam media susu kedele.
Berdasarkan Garnbar 8, terlihat bahwa pertumbuhan Leuconostoc paramesenteroides R-62 pada media susu kedele
+
glukosa 3 persen lebih badc dibandingkan dengan fonnulasi media menggunakan susu skim+
glukosa 3a-galaktosidase yang mampu menghidrolisis ikatan a-galaktosid yang terdapat pada jenis gula tertentu seperti rafinosa dan melibiosa; seperti halnya kemampuan yang dimiliki oleh beberapa strain kelompok Bifidobakteria pada media susu kedele (Roy, et al., 1991).
Hal ini didukung pula oleh hasil identifikasi isolat bakteri asam laktat asal dadih oleh Hosono et al. (1989), strain Leuconostoc paramesenteroides R-62 mampu memfermentasi gula jenis sukrosa, rafinosa, melibiosa dan fiuktosa. Ketiga jenis gula yang pertama banyak terkandung dalarn susu kedele (MacLeon
' '
dan Ames, 1988). Sedang, sukrosa dan fruktosa banyak terkandung dalam air kelapa (Woodroof, 1979).
7
0 3 6 9 12 15 18
Lama inkubasi (jam)
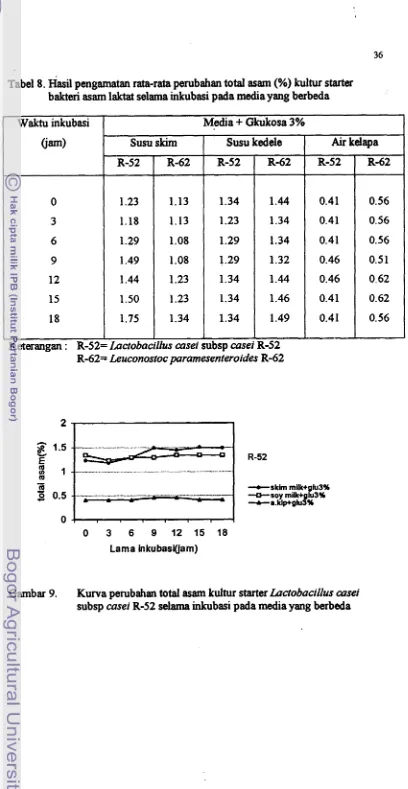
Tabel 8. Hasil pengamatan rata-rata perubahan total asam (%) kultur starter bakteri asam laktat selama inkubasi pada media yang berbeda
0
0 3 6 9 12 15 18
Lama inkubasi(jam)
Waktu inkubasi
tiam)
0 3
I
6I
9 12 15 18-skim milk+glu3%
--o-- soy milk+glu3% -a.klp+gb3%
Gambar 9. Kurva perubahan total asam kultur starter Lactobacillus case1
subsp casei R-52 selama inkubasi pada media yang berbeda Keterangan : R-52= Lactobacillus cwsei subsp casei R-52
R-62= Leuconostoc paramesenteroides R-62
Media
+
Gkukosa 3% [image:137.570.73.481.29.818.2]0
0 3 6 9 12 15 18
Lama inkubasi (jam)
Gambar 10. Kurva perubahan total asam kultur starter Leuconostoc paramesenteroides R-62 selama inkubasi pada media yang berbeda
Metode pembekuan cepat dan pemakaian gliserol 10 persen ke dalam suspensi pembekuan dapat mempertahankan viabilitas 94,05
-
98,lO persen dan aktivitas proteolitik 0,046-
0,069 UA kultur bakteri asam laktat selama penyimpanan beku 8 rninggu. Namun pembekuan lambat lebih' dapat mempertahankan kemampuan pembentukan asam laktat sebesar 1,336-
1,429persen. Untuk keperluan penyediaan kultur starter, maka pertimbangan viabilitas yang tinggi dari kultur bakteri asam laktat yang lebih diutarnakan.
Tidak ada perbedaan yang berarti penyimpanan kultur bakteri asarn laktat pada suhu -20°C maupun -70°C terhadap viabilitas dan kemampuan pembentukan asam laktatnya. Tetapi suhu -70°C lebih dapat mempertahankan aktivitas proteolitiknya dibandingkan dengan penyimpanan pada suhu -20°C.
Strain Lactobacillus casei subsp. casei R-52 memiliki viabilitas (96,15
-
98,lO persen) dan kemampuan menghasilkan asam laktat (1,128-
1,429 persen) yang relatif stabil selama pembekuan dan penyimpanan beku serta pertumbuhannya cukup baik pada media kultur starter.SARAN
Perlu dilakukan penelitian lebih lanjut untuk menentukan formulasi media
kultur starter yang lebih baik dengan mengkombinasikan potensi susu kedele dan
DAFTAR
PUSTAKA
ATCC, 1997. Materi "Workshop on Freezing and Freeze Drying of Microorganisms ", October, 27-30 1997.
AzriqD., 1986. Mikrobiologi dalam Pembuatan Dadih Susu Fermentasi. Skripsi Sarjana, Fakultas Teknologi Pertanian, IPB.
, Hosono,A., R.Wardojo dan H. Otani, 1989. Microbial in Dadih, A naditional
fi'ermented Milk in Indonesia. Lebensm-Wiss. Technol. 22:20-24. Hosono,A, dan T. Tono-oka, 1995. Binding of Cholesterol with Lactic Acid
Bacteria Cells. Milchwissenschaft 50(10):556-560.
Kawase,M. dan A.Hosono, 1995. Binding Stability of Lactic Acid Bacteria Cells with Mutagenic Tryptophan Pyrolysat. Animal Sci.Technol.(Jpn) 66:430- 435.
Imai,K., M.Tekeuchi, T. Sakane dan LGanjar, 1987. Bacterial Flora in Dadih. Ik0
Research Communication 13: 13- 16.
MacLeon,G. san Ames J., 1988. Soy Flavor and Its Improvement. CRC Critical Review Food Sci.Nutr. 27:219.
Meryman, Harold T., 1966. Cryobiology. Academic Press London and New York. Mitsuoka,T., 1990. A Profile ofIntestina1 Bacteria. Yakult Honsa Co.Ltd.
Ray, B. dan Speck, Marvin L., 1 973. Freeze Injury in Bacteria. CRC Critical Review in Clinical Laboratory Sciences.
Salminen, Seppo dan Atte von Wright, 1993. Lactic Acid Bacteria. Marcel Dekker, Inc. New York. Bussel. Hongkong.
Simione, F.P. dan E.M.Brown (Eds), 1991. ATCC Preservation Methods :
Freezing and Freeze-Drying. ATCC, Maryland.
Surono,I. S., 1997. Bakteri Probiotik: Upaya Terapi Alami. Jurnal IPTEK-Institut Teknologi Indonesia, Feb 1997, No VI.
Surono,I.S., 1998. Peranan Bakteri Asam Laktat asal Indonesia sebagai
Surono,I.S., 1999. The Effect of Freezing Methods and Frozen Storage on Viability and a-galactosidase Activity of Lactic Cultures Isolatedfiom Dadih.
Surono, I.S., 2000. Performance of Dadih Cultures in FluidMilk Application at Low Temperature Storage.
Surono,I. S, dan A.Hosono, 1996. Antimutagenicity ofMilk Cultured with Lactic Acid Bacteria Isolated
Porn
Dadih. Milchwissenschafi 5 1 (1 9):493 -497. Surono,I. S., D.Nurani, A. A. A. Dharmawati, 1997. Seleksi Bakteri Asam Luktatasal Dadih sebagai Starter Susu Fermentasi. Jurnal IPTEK-Institut Teknologi Indonesia, No VII Ags 1 997, ha1 39-43.
Surono,I. S., J.K.D. Saono, A. Tomatsu, A.Matsuyama dan A.Hosono, 1983.
Traditional Milk Product M a d e j i ~ m Buflalo Milk by Use of Higher Plant as Coagulant in Indonesia. Jpn. J.Dairy and Food Sci., 32:A103-A110. Woodroof, J. G., 1 979. Coconut: Production, Processing, Product. AVI Publ. Inc.
LAMPIRAN 1. Bagan tahapan penelitian
I
I
Kultivasi sel1
pengamatan
I
Penyiapan suspensipembekuan
I
Perlakuan (Jen is cryoprotectant)
Glise ol 10% DMSO1l 090
Perla kuan (Metoda pembekuan)
I
Lambat,-20°C Cepat -20°C
(deep freezer) (dry-ice ethanol)
I
1
Penyimpanan
&
1
7B AL
(daya tahan terbaik) Ket:
Formulasi
-
43
LAMPIRAN 2. Kultivasi sel bakteri asam laktat (To and Etzel, 1997)
1. Sebanyak 0,5 ml suspensi bakteri ditumbuhkan dalam 50 ml media MRS steril selama 12 jam, pada suhu 32°C dengan pH 6,O.
2. Kemudian dicampurkan ke dalarnnya 50 ml Non Fat Dry Milk (IVFDM) 1 1
-
15% (diperoleh subkultur bakteri asam laktat), dan disiinpan pada -7S°C.3. Sebanyak 1 1111 suspensi bakteri beku yang telah dithawing, ditumbuhkan ke
dalam 100 ml media MRS Broth selama selnalam (diperoleh inokulum 1%). 4. Kultur ditumbuhkan dalain spinner flask dengan pengadukan tetaptpada suhu
32OC, pH 6,0 sampai tercapai fase stasioner.