PENGARUH PEMBERIAN EKSTRAK ETANOL BIJI JENGKOL (Pithecellobium lobatum Benth.)
TERHADAP KADAR HDL TIKUS PUTIH
(Rattus norvegicus) JANTAN GALUR SPRAGUE DAWLEY YANG DIINDUKSI ALOKSAN
Oleh
MIA FEBRIANI PUTRI NASRUDDIN
Skripsi
Sebagai Salah Satu Syarat untuk Memperoleh Gelar SARJANA KEDOKTERAN
Pada
Program Studi Pendidikan Dokter Fakultas Kedokteran Universitas Lampung
FAKULTAS KEDOKTERAN UNIVERSITAS LAMPUNG
ABSTRACT
EFFECT OF ETHANOL EXTRACT OF JENGKOL SEED (Pithecellobium lobatum Benth.) ON HDL LEVELS OF WHITE RAT (Rattus norvegicus)
MALE SPRAGUE DAWLEY STRAINS INDUCED ALLOXAN
By
Mia Febriani Putri Nasruddin
Diabetes Mellitus (DM) is a metabolic disease characterized by high level of blood glucose. Untreated DM can cause the decrease of High Density Lipoprotein (HDL) levels. Synthetic drugs to prevent dislipidemia can induce several side effects. The negative effects can be minimalized by using traditional medicine such as Jengkol (Pithecellobium lobatum Benth.).
The purpose of this research is to determine the influence of ethanol extract jengkol seed (Pithecellobium lobatum Benth.) on HDL levels in blood of the diabetic white rat. This is experimental research with Post Test Only With Control Group Design, using 25 male Sprague dawley rats, and were randomized into 3 groups. The negative control group (K-) was given the standard diet. Positive control group (K+) was given the standard diet and induced by 150 mg/kg alloxan. Treatment group 1 (P1) is given a standard diet and induced by 150 mg/kg alloxan and 600 mg/kg of ethanolic extracts of Jengkol seed (EEJS). Treatment group 2 (P2) was given a standard diet and induced by 150 mg/kg alloxan and 900mg/kg of EEJS. Treatment group 3 (P3) was given standard diet and induced by 150 mg/kg of alloxan and 1200mg/kg EEJS. Blood samples were taken through the heart at the end of the 14th days.
The results of this study showed that the average HDL levels were K-(40,40); K (42.80); P1 (41,00); P2 (43,60); P3 (45.00). Kruskal Walis statistical tests, there are no significant difference between group (p = 0,915), concluded is extract of Jengkol seed has no effect on HDL levels in male sprague dawley rat induced by alloxan.
ABSTRAK
PENGARUH PEMBERIAN EKSTRAK ETANOL BIJI JENGKOL (Pithecellobium lobatum Benth.) TERHADAP KADAR HDL TIKUS PUTIH (Rattus norvegicus)
JANTAN GALUR SPRAGUE DAWLEY YANG DIINDUKSI ALOKSAN.
Oleh
Mia Febriani Putri Nasruddin
Diabetes Mellitus (DM) merupakan penyakit dengan kenaikan kadar glukosa dalam darah dan menjadi penyebab dislipidemia. Dislipidemia ditandai dengan kelainan metabolisme lipid yaitu penurunan High Density Lipoprotein (HDL). Upaya pengobatan saat ini masih banyak menimbulkan efek samping. Dampak negatif dapat diminimalisir dengan obat tradisional yaitu Jengkol (Pithecellobium lobatum Benth.) memiliki kandungan flavonoid, saponin dan tanin untuk meningkatkan kadar HDL.
Tujuan dari penelitian ini untuk mengetahui pengaruh pemberian ekstrak etanol biji jengkol (Pithecellobium lobatum Benth.) terhadap kadar HDL dalam darah tikus putih diabetes. Metode Penelitian ini penelitian eksperimental dengan Post Test Only With Control Group Design, menggunakan 25 ekor tikus putih jantan sprague dawley, diacak kedalam 5 kelompok. Kelompok kontrol negatif (K-) diberikan pakan standar. Kelompok kontrol positif (K+) diberikan pakan standar dan diinduksi aloksan 150 mg/kgbb. Kelompok perlakuan 1 (P1) diberikan pakan standar dan diinduksi aloksan 150 mg/ kgbb dan ekstrak etanol biji jengkol (EEBJ) dosis 600mg/kg bb/hari. Kelompok perlakuan 2 (P2) diberikan pakan standar dan diinduksi aloksan 150 mg/kgbb dan EEBJ dosis 900mg/kg bb/hari. Kelompok perlakuan 3 (P3) diberikan pakan standar dan diinduksi aloksan 150 mg/kgbb dan EEBJ dosis 1200mg/kg bb/hari. Darah tikus diambil melalui jantung di akhir minggu ke-14.
Hasil penelitian rerata kadar HDL K- (40,40); K+ (42,80); P1 (41,00); P2 (43,60); P3 (45,00). Dengan menggunakan uji statistik Kruskal Walis didapatkan perbedaan yang tidak bermakna (p=0,915)
DAFTAR ISI
Halaman DAFTAR TABEL...
DAFTAR GAMBAR...
I. PENDAHULUAN
A. Latar Belakang... B. Perumusan Masalah... C. Tujuan Penelitian... D. Manfaat Penelitian... E. Kerangka Pemikiran ...
1. Kerangka teori... 2. Kerangka konsep... F. Hipotesis...
II. TINJAUAN PUSTAKA
A. Diabetes Mellitus... 1. Definisi... 2. Klasifikasi... 3. Patofisiologi... 4. Diagnosis... 5. Terapi dan Pencegahan...
B. Metabolisme Lemak pada DM...
C. HDL... 1. Pengertian... 2. Struktur dan fungsi... 3. Metabolisme... D. Dislipidemia dan Pengobatannya...
1. Dislipidemia... 2. Pengobatan... E. Jengkol... 1. Definisi... 2. Klasifikasi... 3. Kandungan... 4. Kandungan dan Manfaat lain... F. Aloksan... G. Tikus Putih (Rattus norvegicus) Jantan galur Sprague dawley ...
III. METODOLOGI PENELITIAN
A. Desain Penelitian... B. Tempat dan Waktu... C. Populasi dan Sampel...
1. Populasi penelitian... 2. Sampel penelitian... D. Kriteria Inklusi dan Eksklusi...
1. Kriteria Inklusi... 2. Kriteria Eklusi... E. Bahan dan Alat Penelitian...
1. Alat Penelitian... 2. Bahan Penelitian... F. Prosedur Penelitian... 1. Prosedur Penelitian Ekstrak Etanol Biji Jengkol ...
x
2. Prosedur Penelitian... G. Identifikasi Variabel dan Definisi Operasional Variabel...
1. Identifikasi Variabel... 2. Definisi Operasional... H. Analisis Data... I. Etika Penelitian...
IV. HASIL DAN PEMBAHASAN
A. Hasil ... 1. Kadar HDL Darah Tikus Jantan ... 2. Hasil Uji Analisis ... B. Pembahasan...
1. Kadar HDL pada kelompok kontrol negatif... 2. Pengaruh pemberian aloksan terhadap kadar HDL pada kontrol
positif... 3. Pengaruh Aloksan dan EEBJ... C. Keterbatasan Penelitian...
V. SIMPULAN DAN SARAN
DAFTAR TABEL
Tabel Halaman
1. Hasil Skrining Fitokimia Simplisia Biji Jengkol... 2. Cara Pengukuran Kadar HDL Prosedur 1... 3. Cara Pengukuran Kadar HDL Prosedur 2... 4. Definisi Operasional... 5. Kadar HDL Darah Tikus... 6. Hasil Uji Shapiro- Wilk Kadar HDL darah tkus...
xi
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka Teori ... 2. Kerangka Konsep... 3. Jalur Transverse Cholesterol Transport ... 4. Jengkol (Pithecellobium lobatum Benth.)... 5. Tikus... 6. Alur Penelitian... 7. Grafik Kadar HDL Darah Tikus...
1. PENDAHULUAN
A. Latar Belakang
Diabetes Mellitus (DM) merupakan salah satu Penyakit Tidak Menular (PTM)
yang menyita perhatian dan menjadi masalah kesehatan masyarakat lokal dan
global. Merupakan penyakit metabolik dengan karakteristik hiperglikemia
(peningkatan konsentrasi glukosa dalam darah) yang terjadi karena kelainan
sekresi insulin, kerja insulin, atau kedua–duanya (American Diabetes
Association, 2010).
Insidens dan prevalensi DM setiap tahunnya meningkat, lebih dari 371 juta
orang di dunia menderita DM (IDF, 2013). Indonesia menempati urutan ke–4
dengan jumlah penderita 8,4 juta terbesar didunia setelah India, Cina dan
Amerika Serikat (WHO, 2004). Insidens dan prevalensi DM diperkirakan akan
meningkat diseluruh dunia pada tahun 2030 menjadi 552 juta penderita (IDF,
2013). Dinas Kesehatan Provinsi Lampung mencatat bahwa pada tahun 2005–
2006 jumlah penderita DM mengalami peningkatan 12% dari periode
2
Dalam perkembangannya DM dapat menjadi penyebab dislipidemia (Suwirta,
2006). Dislipidemia ditandai kelainan metabolisme lipid dengan peningkatan
kadar Trigliserida (TG), penurunan High Density Lipoprotein (HDL),
peningkatan small denseLow Density Lipoprotein (LDL) meskipun total LDL
kadang normal (ADA, 2004).
Penatalaksanaan untuk menurunkan kadar kolesterol darah yang tinggi dengan
terapi non farmakologi (diet rendah kolesterol, olah raga teratur, pengendalian
berat badan) dan terapi farmakologi (obat hipolipidemia). Terapi farmakologi
yang tersedia masih menimbulkan banyak efek samping seperti miopati, rash,
eksem, dispepsia, nyeri ulu hati, hepatotoksik, dan teratogenik (Suyatna, 2007).
World Health Organization merekomendasi penggunaan obat tradisional
termasuk obat herbal dalam pemeliharaan kesehatan masyarakat, pencegahan,
dan pengobatan penyakit. Obat herbal digunakan 65 % di negara maju dan 80
% di negara berkembang (Heinrich dkk., 2004). Salah satu tumbuhan yang
digunakan secara empiris oleh masyarakat untuk pengobatan diabetes yang
belum dimanfaatkan secara optimal dan belum diketahui manfaatnya secara
luas yaitu tumbuhan jengkol (Pithecellobium lobatum Benth) (Widowati dkk.,
1997).
Jengkol dapat mencegah diabetes dan bersifat diuretik serta baik untuk
kesehatan jantung (Roswaty, 2010). Kandungan senyawa kimia pada biji, kulit
Flavonoid dan tanin merupakan senyawa yang berfungsi sebagai antioksidan
yang efektif (Fessenden, 1994). Karena kandungan zat-zat tersebut di atas,
maka jengkol memberikan petunjuk dan peluang sebagai bahan obat, seperti
yang telah dimanfaatkan orang pada masa lalu (Pitojo, 1994).
Antioksidan adalah zat yang melindungi tubuh dari efek radikal bebas yang
merusak sel-sel tubuh (Astuti, 2009). Antioksidan dapat melawan kolesterol
jahat (LDL), yang berpotensi menyumbat pembuluh darah dan meningkatkan
kolesterol baik (HDL), yang bermanfaat untuk mencegah penyakit jantung dan
pembuluh darah dan yang termasuk antioksidan adalah flavonoid (Gsianturi,
2003). Elysa (2011) melaporkan bahwa Golongan senyawa kimia yang terdapat
dalam ekstrak etanol biji jengkol dari hasil skrining fitokimia menunjukkan
adanya saponin, tanin, alkaloid, flavonoid, glikosida dan steroid/triterpenoid.
Selain itu, ekstrak etanol biji jengkol (Pithecellobium lobatum Benth.)
mempunyai efek menurunkan glukosa darah tikus diabetes yang diinduksi
aloksan pada dosis 600 mg/kg bb.
Berdasarkan latar belakang di atas, maka peneliti tertarik untuk melakukan
pengkajian mengenai pengaruh pemberian ekstrak etanol biji jengkol
(Pithecellobium lobatum Benth.) terhadap peningkatan kadar HDL dalam darah
4
B. Rumusan Masalah
Berdasarkan latar belakang di atas, dapat dirumuskan masalah sebagai berikut :
Apakah ada pengaruh pemberian ekstrak etanol biji jengkol (Pithecellobium
lobatum Benth.) terhadap peningkatan kadar HDL dalam darah tikus diabetes?
C. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui pengaruh pemberian
ekstrak etanol biji jengkol (Pithecellobium lobatum Benth.) terhadap kadar
HDL dalam darah tikus diabetes.
D.Manfaat penelitian
Penelitian ini diharapkan dapat memberikan manfaat bagi semua pihak terkait
antara lain :
1. Bagi penulis, dapat mengetahui pengaruh pemberian ekstrak etanol biji
jengkol terhadap peningkatan kadarHDL pada darah tikus diabetes.
2. Bagi peneliti lain, hasil penelitian ini diharapkan dapat dijadikan referensi
untuk penelitian selanjutnya.
3. Bagi pembaca, dapat memberikan informasi mengenai peranan biji jengkol
E. Kerangka Pemikiran 1. Kerangka teori
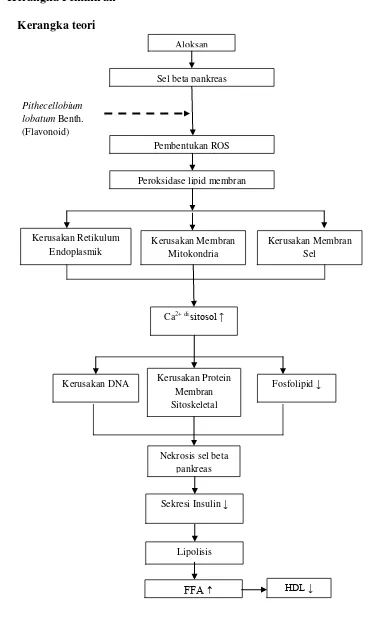
Gambar 1. Kerangka Teori (Lanzen, 2007). Aloksan
Sel beta pankreas
Pembentukan ROS
Peroksidase lipid membran
Kerusakan Retikulum Endoplasmik
Kerusakan DNA
Sekresi Insulin ↓ Ca2+ di sitosol ↑
Nekrosis sel beta pankreas Kerusakan Membran
Mitokondria
Kerusakan Membran Sel
Kerusakan Protein Membran Sitoskeletal
Fosfolipid ↓
Lipolisis
FFA ↑ HDL ↓
6
2. Kerangka Konsep
Gamb
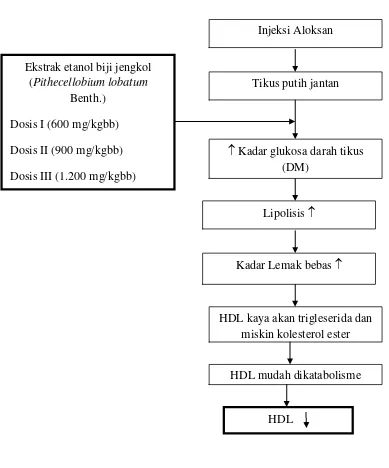
Gambar 2. Kerangka konsep Injeksi Aloksan
Tikus putih jantan
Kadar glukosa darah tikus (DM)
Lipolisis
HDL Ekstrak etanol biji jengkol
(Pithecellobium lobatum Benth.)
Dosis I (600 mg/kgbb) Dosis II (900 mg/kgbb) Dosis III (1.200 mg/kgbb)
Kadar Lemak bebas
HDL kaya akan trigleserida dan miskin kolesterol ester
F. Hipotesis
Ho : Tidak terdapat peningkatan kadar HDL dalam darah tikus putih (Rattus
norvegicus) jantan galur Sprague Dawley yang diinduksi aloksan pada
pemberian estrak etanol biji jengkol (Pithecellobium lobatum Benth.)
Ha : Terdapat peningkatan kadar HDL dalam darah tikus putih (Rattus
norvegicus) jantan galur Sprague Dawley yang diinduksi aloksan pada
II.TINJAUAN PUSTAKA
A. Diabetes Mellitus
1. Definisi
Diabetes Mellitus merupakan suatu kelompok penyakit metabolik dengan
karakteristik hiperglikemia yang terjadi karena kelainan sekresi insulin,
kerja insulin, atau kedua-duanya. Hiperglikemia didefinisikan sebagai kadar
glukosa puasa yang lebih tinggi dari 110 mg/dL. Kadar glukosa serum puasa
normal adalah 70 sampai 110 mg/dL. Glukosa difiltrasi oleh glomerulus dan
hampir semuanya difiltrasi oleh tubulus ginjal selama kadar glukosa dalam
plasma tidak melebihi 160-180 mg/dL (ADA, 2010).
2. Klasifikasi
Klasifikasi DM yang dianjurkan oleh American Diabetes Association
(ADA) dalam Standards of Medical Care in Diabetes (2009) adalah :
1. Diabetes Mellitus tipe 1 merupakan destruksi sel beta, biasanya menjurus
ke defisiensi insulin absolut, sepeti : Autoimun (immune mediated) dan
2. Diabetes Mellitus tipe 2 merupakan resistensi insulin yang predominan
dengan defisiensi insulin relatif menuju ke defek sekresi insulin yang
predominan dengan resistensi insulin.
3. Diabetes Mellitus tipe lain (Defek genetik fungsi sel beta, defek genetik
kerja insulin, penyakit eksokrin, endokrinopati, infeksi, imunologi).
4. Diabetes Mellitus kehamilan merupakan kondisi diabetes atau intoleransi
glukosa yang didapati selama masa kehamilan, biasanya pada trimester
kedua atau ketiga (Sudoyo, 2010).
3. Patofisiologi
Diabetes Mellitus merupakan suatu keadaan hiperglikemia yang bersifat
kronik yang dapat mempengaruhi metabolisme karbohidrat, protein dan
lemak. DM disebabkan oleh ketidakseimbangan persediaaan insulin atau tak
sempurna nya respon seluler terhadap insulin, ditandai dengan tidak
teraturnya metabolisme. Orang dengan metabolisme yang normal mampu
mempertahankan kadar glukosa darah antara 80-140 mg/dl dalam kondisi
asupan makanan yang berbeda–beda pada orang non diabetik kadar glukosa
darah dapat meningkat antara 120–140 mg/dl setelah makan namun keadaan
ini akan kembali menjadi normal dengan cepat. Sedangkan kelebihan
glukosa darah diambil dari darah dan disimpan sebagai glikogen dalam hati
dan sel–sel otot (glikogenesis). Kadar glukosa darah normal dipertahankan
selama keadaan puasa, karena glukosa dilepaskan dari cadangan tubuh
(glikogenolisis) dan glukosa yang baru dibentuk dari trigliserida
10
meningkat kemudian terjadi proses pembentukan keton (ketogenensis)
terjadi peningkatan keton didalam plasma akan menyebabkan ketonuria
(keton didalam urin) dan kadar natrium serta PH serum menurun yang
menyebabkan asidosis (Price, 2006).
Resistensi sel terhadap insulin menyebabkan gangguan glukosa oleh sel
menjadi menurun sehingga kadar glukosa darah dalam plasma tinggi
(hiperglikemia). Jika hiperglikemianya melebihi ambang ginjal maka
timbul glikosuria. Glikosuria ini menyebabkan diuresis osmotik yang
meningkatkan pengeluaran kemih (poliuri) dan timbul rasa haus (polidipsi)
sehingga terjadi dehidrasi, Glukosuria menyebabkan keseimbangan kalori
negatif sehingga menimbulkan rasa lapar (polifagi), polifagi juga
disebabkan oleh starvasi (kelaparan sel). Pada pasien DM penggunaan
glukosa oleh sel juga menurun mengakibatkan penggunaaan glukosa oleh
sel juga menurun mengakibatkan produksi metabolisme energi menjadi
menururn sehingga tubuh menjadi lemah (Price, 2006).
5. Diagnosis
Kriteria diagnosis DM, yaitu bila kadar glukosa darah sewaktu > 200 mg
/dl, kadar glukosa darah puasa > 126 mg/dl, kadar glukosa darah 2 jam
setelah makan > 200 mg/dl, Gula Darah Puasa (GDP) terganggu bila GDP
6. Terapi dan Pencegahan
Terapi dasar adalah kendalikan kadar gula darah, kendalikan tekanan darah
dan kendalikan lemak darah dan mengubah gaya hidup seperti pengaturan
diet, menurunkan berat badan bila berlebih, latihan fisik, menghentikan
kebiasaan merokok, juga tindakan preventif terhadap penyakit
kardiovaskular (Suwitra, 2006).
1. Pengendalian Kadar Gula Darah
Kadar gula darah preprandial 90-130 mg/dl, post-prandial <180 mg/dl
(Suwitra, 2006).
2. Pengendalian Tekanan Darah
Pengendalian tekanan darah <130/90 mmHg. Memberi efek baik
terhadap ginjal dan organ kardiovaskular (Suwitra, 2006).
3. Pengaturan Diet
Pasien DM cenderung mangalami keadaan dislipidemia. Keadaan ini
diatasi dengan diet dan obat. Dislipidemia diatasi dengan target LDL
kolesterol <100 mg/dl pada pasien DM dan <70 mg/dl bila sudah ada
kelainan kardiovaskular (Suwitra, 2006).
B. Metabolisme Lemak pada DM
Kelainan utama metabolisme lemak pada DM adalah peningkatan katabolisme
lipid, dengan peningkatan pembentukan benda-benda keton, dan penurunan
12
demikian menonjol sehingga DM merupakan suatu penyakit metabolisme
lemak (Ganong, 2002).
Ciri spesifik dislipidemia pada resistensi insulin adalah peningkatan
trigleserida (TG), penururnan HDL, peningkatan small dense LDL meskipun
total LDL keadaan normal. Dislipidemia diduga berhubungan dengan
hiperinsulinemia. Pada resistensi insulin terjadi peningkatan lipolisis, sehingga
terjadi peningkatan asam lemak bebas dalam plasma yang selanjutnya akan
meningkatkan uptake asam lemak bebas kedalam liver. Disamping itu terjadi
peningkatan sintesis TG de novo di liver karena hiperinsulinemia merangsang
ekspresi sterol regulation element binding protein (SREBPIc), protein ini
berfungsi sebagai faktor transkripsi yang mengaktifasi gen yang terlibat
lipogenesis di liver. Protein kolesterol ester transferase dan hepatic lipase juga
meningkat, yang melibatkan penignkatan VLDL 1 yang kemudian menjadi
small dense LDL. Peningkatan kadar VLDL1 ini menyebabkan peningkatan
katabolisme HDL sehingga HDL menjadi rendah. Beberapa mekanisme diatas
menerangkan bahwa rendahnya HDL, tinginya TG dan small dense LDL pada
pola dislipidemi disebut diabetic dyslipidemia yang berhubungan dengan
C. HDL
1. Pengertian
High Density Lipoprotein (HDL) adalah lipoprotein berdensitas tinggi,
terutama mengandung protein. HDL diproduksi di hati dan usus halus. HDL
mengambil kolesterol dan phosfolipid yang ada di dalam darah dan
menyerahkannya ke lipoprotein lain untuk diangkut kembali atau
dikeluarkan dari tubuh (Muray, 2009). Untuk menilai tinggi rendahnya
HDL, Menurut (National cholesterol Education Program, Adult Panel
Treatment) NCEP ATP III yaitu kadar HDL rendah < 40 mg/dl dan kadar HDL tinggi ≥ 60 mg/dl. Peranan HDL adalah melindungi lipoprotein dari
oksidasi dan menghambat oksidasi LDL. HDL merupakan lipoprotein yang
berperan pada Jalur Reverse Cholester Transport yang merupakan proses
yang membawa kolesterol dari jaringan kembali ke hepar (Murray, 2003).
High Density Lipoprotein (HDL) merupakan molekul lipoprotein yang
paling kecil dengan diameter 75-100 A°, HDL adalah lipoprotein yang
mempunyai kepadatan yang tinggi. Densitas lipoprotein akan meningkat
apabila kadar proteinnya naik dan kadar lemaknya berkurang. HDL
disintesis dan disekresi oleh hati dan usus. HDL berfungsi sebagai
pengangkut kolesterol dalam darah dari jaringan tubuh ke hati, jadi
kebalikan dari fungsi LDL (Tirtawinata , 2006).
High Density Lipoprotein (HDL) kolesterol adalah lipoprotein yang
14
vacuum cleaner yang menghisap sebanyak mungkin kolesterol berlebih.
HDL memungut kolesterol ekstra dari sel-sel dan jaringan-jaringan untuk
kemudian dibawa ke hati, dan menggunakannya untuk membuat cairan
empedu atau mendaurulangnya (Mason et al., 2008).
2. Struktur dan Fungsi
High Density Lipoprotein (HDL) adalah partikel lipoprotein yang terkecil,
memiliki densitas yang paling tinggi karena lebih banyak mengandung
protein daripada kolesterol. HDL mempunyai berat jenis paling tinggi dan
kandungan protein serta fosfolipid paling besar. Ada tiga mcam HDL yaitu,
HDL1, HDL2 dan HDL3. High Density Lipoprotein (HDL) disebut juga α
-lipoprotein mengandung 30% protein dan 48% lemak. HDL dikatakan
kolesterol baik karena berperan membawa kelebihan kolesterol di jaringan
kembali ke hati untuk diedarkan kembali atau dikeluarkan dari tubuh. HDL
ini mencegah terjadinya penumpukkan kolesterol di jaringan, terutama di
pembuluh darah. Kadar HDL menurun biasanya terlihat pada pria, obesitas,
Diabetes Mellitus, hipertrigliseridemia, dan lipoproteinemia sedangkan
peningkatan HDL terjadi pada wanita, penurunan berat badan, olahraga
teratur, dan berhenti merokok (Murray, 2009).
Hati mensintesis lipoprotein sebagai kompleks dari apolipoprotein fan
fosfolipif yang membentuk partikel kolesterol bebas, kompleks ini mampu
mengambil kolesterol yang dibawa secara internal dari sel melalui interaksi
dengan ATP-binding cassette transporter AI (ABCA1). Suatu enzim plasma
kolesterol bebas menjadi kolesteril ester (bentuk yang lebih hidrofobik dari
kolesterol), yang kemudian tersekuestrasi kedalam inti dari partikel
lipoprotein akhirnya menyebabkan HDL yang baru disintesis berbentuk
bulat (Muray, 2009).
High Density Lipoprotein (HDL) mengangkut kolesterol sebagian besar ke
hati atau organ steroidogenik seperti adrenal, ovarium, dan testis oleh kedua
jalur langsung dan tidak langsung. Pada manusia, mungkin jalur yang paling
relevan adalah yang tidak langsung, yang dimediasi oleh Cholesterol Ester
Transfer Protein (CETP). Protein ini merubah trigliserida dari Very Low
Density Lipoprotein (VLDL) terhadap ester kolesterol HDL. Sebagai
hasilnya, VLDL diproses untuk LDL, yang dibuang dari sirkulasi oleh
reseptor LDL jalur. Trigliserida tidak stabil dalam HDL, tetapi terdegradasi
oleh hepatik lipase sehingga, akhirnya, partikel HDL kecil yang tersisa,
yang akan memulai kembali penyerapan kolesterol dari sel (Muray, 2009).
Kolesterol yang ditranspor ke hati akan dieksresikan ke empedu usus baik
secara langsung maupun tidak langsung setelah konversi menjadi asam
empedu. Pengiriman kolesterol HDL ke adrenal, ovarium, dan testis penting
untuk sintesis hormon steroid (Murray, 2009). HDL membawa banyak
lemak dan protein, beberapa di antaranya memiliki konsentrasi yang sangat
rendah, tetapi secara biologis sangat aktif. HDL dan protein dan lipid
membantu untuk menghambat oksidasi, peradangan, aktivasi endothelium,
16
kemampuan HDL untuk melindungi dari aterosklerosis, dan belum
diketahui mana yang paling penting (Daniil et al., 2011).
High Density Lipoprotein (HDL) juga memiliki efek antioksidan dan
antiinflamasi dimana salah satu atau semua fungsi-fungsi transportasi
nonlipid HDL berkontribusi pada perlindungan terhadap aterosklerosis
(Daniil dkk., 2011). HDL berperan sebagai antioksidan dan antitrombosis
selain perannya dalam transpor lipid dalam darah. HDL juga penting untuk
memelihara kondisi normal endotel pembuluh darah, menghambat
apoptosis sel dan berperan dalam perbaikan endotel yang rusak (Barter,
2004).
High Density Lipoprotein (HDL) diduga memiliki efek antiaterogenik,
antara lain menghambat oksidasi LDL, menghambat inflamasi endotel,
meningkatkan produksi nitrit oksida endotel, meningkatkan bioavailabilitas
prostasiklin, dan menghambat koagulasi dan agregasi platelet. Namun,
mekanisme molecular terhadap masing-masing efek tersebut belum dapat
dijelaskan (Daniil, 2011). HDL cenderung membawa kolesterol menjauhi
arteri dan kembali ke hati, menyingkirkan kolesterol yang berlebihan di plak
ateroma dan menghambat perkembangan plak selama proses aterogenesis
3. Metabolisme
High Density Lipoprotein (HDL) dilepaskan sebagai partikel kecil
miskin kolesterol yang mengandung apoliprotein (apo) A, C, dan E: dan
disebut HDLnascent. HDL nascent berasal dari usus halus dan hati,
mempunyai bentuk gepeng dan mengandung apoliprotein A1. HDL nascent
akan mendekati makrofag untuk mengambil kolesterol yang tersimpan di
makrofag. Setelah mengambil kolesterol dari makrofag. HDL nascent
berubah menjadi HDL dewasa yang berbentuk bulat. Agar dapat diambil
oleh HDL nescent , kolesterol (kolesterol bebas) dibagian dalam dari
makrofag harus dibawa kepermukaan membran sel mekrofag oleh suatu
transporter yang disebut adenosine triphosphate-binding cassette
transporter-1 atau disingkat ABC-1 (Adam, 2006).
Setelah mengambil kolesterol bebas dari sel makrofag, kolesterol bebas
akan diesterfikasi menjadi kolesterol ester enzim lecithin cholestrol
acyltransferase (LCAT). Selanjutnya sebagian kolesterol ester yang dibawa
oleh HDL akan mengambil dua jalur. Jalur pertama ialah ke hati dan
ditangkap oleh scavenger receptor class B type 1 dikenal dengan SR-B1.
Jalur kedua dari VLDL dan Intermediate Density Lipoprotein (IDL) dengan
bantuan cholesterol ester transfer protein (CETP). Dengan demikian
fungsi HDL sebagai “penyiap” kolesterol dari makrofag mempunyai dua
jalur yaitu langsung ke hati dan jalur tidak langsung melalui VLDL dan IDL
18
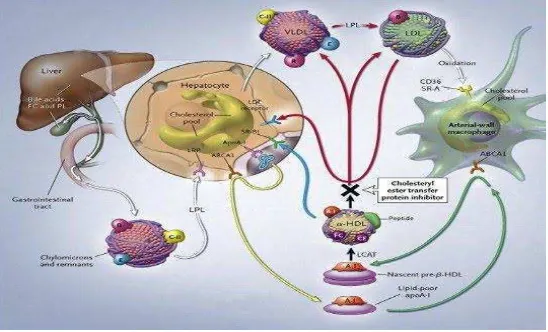
Gambar 3. Jalur reverse cholesterol transport Sumber : (Sudoyo, 2006).
D. Dislipidemia dan Pengobatannya
1. Dislipidemia
Dislipidemia adalah kelainan dari metabolisme lipoprotein yaitu
overproduksi atau defisiensi dari lipoprotein tertentu. Dislipidemia dapat
bermanifestasi dengan peningkatan konsentrasi kolesterol total, LDL dan
trigliserida serta penurunan HDL dalam darah. Kebanyakan dislipidemia
yang terjadi adalah peningkatan lipid darah, berkaitan dengan pola makan
dan gaya hidup santai, makanan yang kaya akan kolesterol dan asam lemak
jenuh dapat menekan pembentukan reseptor LDL, sehingga meningkatkan
kolesterol di dalam darah (Grundy et al., 2004).
Dislipidemia dalam jangka waktu panjang menyebakan terjadinya
atheroskeloris yang berdampak sebagai penyakit kardiovaskular (Grundy et
al., 2004). Total kolesterol yang tinggi merupakan faktor risiko yang sangat
1. Pengobatan Dislipidemia
Pengobatan Dislipidemia lebih baik ditekankan pada non farmakologi (diet
rendah lemak dan kolesterol, karena dengan menurunkan berat badan dapat
mengontrol dislipidemia) dan farmakologi (obat antilipidemik diberikan
hanya sebagai penunjang pengobatan) (Kumalasari, 2005).
A. Upaya non farmakologis
1. Terapi diet
Menilai pola makan pasien, kepatuhan penderita terhadap diet
merupakan salah satu usaha untuk tercapainya tujuan pengobatan.
Pada pasien dislipidemia, apabila penderita tidak mampu mengontrol
makanannya maka dapat menyebabkan terjadinya jantung koroner
(Sitorus, 2006).
2. Latihan jasmani
Latihan fisik dapat meningkatkan kadar HDL, menurunkan
trigliserida, menurunkan LDL dan menurunkan berat badan.
B. Farmakologis
Tujuan dari pengelolaan dislipidemia jangka pendek adalah untuk
mengontrol kadar LDL dan HDL dalam darah, dan menghilangkan
keluhan maupun gejala yang terjadi pada penderita dislipidemia. Tujuan
jangka panjang untuk mencegah terjadinya jantung koroner. Cara
penanganannya dengan menormalkan kadar kolesterol LDL dan HDL
20
Mekanisme kerja obat antilipidemik antara lain (Kumalasari, 2005). :
a) Menghambat biosintesis kolesterol atau prekursornya
b) Menurunkan tingkat lipoprotein dan pra-lipoprotein
c) Menghilangkan lemak
d) Mempercepat ekstrak lipid dan menghambat penyerapan kolesterol.
Modifikasi pola makan dan gaya hidup dapat membantu meningkatkan
HDL-C yang rendah, selain itu merokok juga dapat menurunkan kadar
HDL-C, latihan aerobik dan latihan kekuatan dapat meningkatkan kadar
HDL-C, penurunan berat badan pada orang yang kelebihan berat badan juga
meningkatkan kadar HDL-C. Kumalasari (2005) menyatakan, beberapa
jenis obat diketahui menyekat pembentukan kolesterol pada berbagai tahap
di dalam lintasan biosintesis. Terapi farmakologi yang tersedia masih
menimbulkan banyak efek samping seperti miopati, rash, eksem, dispepsia,
nyeri ulu hati, hepatotoksik, dan teratogenik (Suyatna, 2007).
E. Jengkol
1. Definisi Jengkol
Jengkol adalah tumbuhan khas di wilayah Asia Tenggara. Bijinya banyak
digemari di Malaysia, Thailand, dan Indonesia sebagai bahan pangan.
Tumbuhan ini merupakan pohon di bagian barat Nusantara, tingginya
sampai 26 m, dibudidayakan secara umum oleh penduduk di Jawa dan di
Biji berbentuk bulat pipih, berkeping dua, dan berwarna putih kekuningan
(Hutapea, 1994). Tumbuhan ini memiliki akar tunggang, buahnya berwarna
coklat kotor, batang tegak, bulat, berkayu, banyak percabangan. Salah satu
tumbuhan yang dapat digunakan sebagai obat yaitu tumbuhan jengkol
(Pithecellobium lobatum Benth.) (Tjitrosoepomo, 2004). Kulit buahnya
dapat digunakan untuk obat borok, luka bakar dan pembasmi serangga,
daunnya berkhasiat sebagai obat eksim, kudis, luka dan bisul, sedangkan
kulit batangnya sebagai penurun kadar gula darah (Ellysa, 2011). Biji, kulit
batang dan daun jengkol mengandung saponin, flavonoid dan tanin
(Hutapea, 1994). Ekstrak air dari kulit buah jengkol mengandung senyawa
[image:31.595.171.480.416.583.2]alkaloid, tanin, saponin dan flavonoid (Ellysa, 2011).
22
2. Klasifikasi (Pandey, 2003) :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Fabales
Suku : Mimosaceae
Marga : Pithecellobium
Spesies : Pithecellobium lobatum Benth.
Sinonim dari tumbuhan jengkol, antara lain: Zygia jiringa (Jack) Kosterm.,
Pithecellobium jiringa (Jack) Prain ex King.
3. Kandungan
Biji, kulit batang dan daun jengkol mengandung saponin, flavonoid dan
tanin (Depkes RI, 1995). Buah jengkol mengandung karbohidrat, protein,
vitamin A, vitamin B, vitamin C, fosfor, kalsium, zat besi, alkaloid, steroid,
glikosida, tanin, flavonoid dan saponin (Eka, A, 2007).
a. Saponin menghambat absorpsi glukosa sehingga dapat berguna sebagai
agen terapi diabetes mellitus sebagai agen preventif diabetes (Mikito et
al., 1995).
b. Flavonoids sebagai antioksidan, dapat melindungi kerusakan progresif sel β pankreas oleh karena stress oksidatif, sehingga dapat menurunkan
kejadian diabetes mellitus (Song et al., 2005). Flavonoid mempunyai
antivirus, sitotoksik, antiinflamasi, antihipertensi, analgetik, antialergi
(Asih et al., 2009). Flavonoid dapat mencegah oksidasi LDL 20 kali
lebih kuat daripada vitamin E. Flavonoid terbukti mempunyai efek
biologis yang sangat kuat sebagai antioksidan, menghambat
penggumpalan 23 keping-keping sel darah, merangsang produksi
oksidasi nitrit yang dapat melebarkan pembuluh darah, dan juga
menghambat pertumbuhan sel kanker (Winarsi, 2007).
c. Tanin, senyawa ini diketahui memacu uptake glukosa dengan
meningkatkan sensitivitas jaringan terhadap insulin dan mencegah
adipogenesis (Muthusamy et al., 2008) sehingga timbunan kedua sumber
kalori ini dalam darah dapat dihindari.
Berdasarkan percobaan analisis fitokimia oleh Elysa pada tahun 2011,
didapatkan bahwa terdapat kandungan senyawa saponin, flavonoids dan
24
Tabel 1. Hasil Skrining Fitokimia Simplisia Biji Jengkol
No Skrining Hasil
1. Alkaloid +
2. Flavonoid +
3. Glikosida +
4. Saponin +
5. Tanin +
6. Triterpenoid/ steroid +
Keterangan : + = mengandung golongan senyawa
- = tidak mengandung golongan senyawa
Sumber : (Elysa, 2011).
4. Kandungan dan Manfaat Lainnya
Hasil penelitian menunjukkan bahwa tanaman jengkol banyak mengandung
zat, antara lain adalah sebagai berikut: protein, kalsium, fosfor, asam
jengkolat, vitamin A dan B1, karbohidrat, minyak atsiri, saponin, alkaloid,
terpenoid, steroid, tanin, dan glikosida. Karena kandungan zat-zat tersebut
di atas, maka jengkol memberikan petunjuk dan peluang sebagai bahan
obat, seperti yang telah dimanfaatkan orang pada masa lalu (Pitojo, 1994).
F. Aloksan Untuk Induksi Diabetes
Aloksan adalah senyawa kimia tidak stabil dan senyawa hidrofilik. Waktu
merupakan bahan kimia yang digunakan untuk menginduksi binatang
percobaan untuk menghasilkan kondisi diabetik eksperimental
(hiperglikemik) secara cepat. Aloksan dapat diberikan secara intravena,
intraperitoneal, atau subkutan pada binatang percobaan. Tikus hiperglikemik
dapat dihasilkan dengan menginjeksikan 120-150 mg/kgbb (Yuriska, 2009).
Aloksan dapat menyebabkan Diabetes Mellitus tergantung insulin pada
binatang tersebut (aloksan diabetes) (Filipponi et al., 2008). Kemampuan
aloksan untuk dapat menimbulkan diabetes juga tergantung pada jalur
penginduksian, dosis, hewan percobaan dan stats gizinya (Amma, 2009).
Mekanisme kerja aloksan diawali dengan ambilan aloksan ke dalam sel-sel β
pankreas dan kecepatan ambilan ini akan menentukan sifat diabetogenik
aloksan. Ambilan ini juga dapat terjadi pada hati atau jaringan lain, tetapi
jaringan tersebut relatif lebih resisten dibanding pada sel-sel β pankreas. Sifat
inilah yang melindungi jaringan terhadap toksisitas aloksan (Amma, 2009).
Aloksan bereaksi dengan merusak substansi esensial didalam sel beta
pankreas sehingga menyebabkan berkurangnya granula-granula pembawa
insulin di dalam sel beta pankreas. Aloksan meningkatkan pelepasan insulin
dan protein dari sel beta pankreas tetapi tidak berpengaruh pada sekresi
glukagon. Efek ini spesifik untuk sel beta pankreas sehingga aloksan dengan
konsentrasi tinggi tidak berpengaruh terhadap jaringan lain. Aloksan mungkin
mendesak efek diabetogenik oleh kerusakan membran sel beta dengan
26
Toksisitas yang disebabkan oleh aloksan dimulai dengan terbentuknya radikal
bebas dari reaksi redoks. Radikal hidroksil inilah yang memiliki peran
penting pada kerusakan sel beta pankreas. Sel beta pankreas memiliki
kemampuan antioksidan yang sangat rendah dibanding hati, sehingga dengan
mudah terjadi nekrosis yang membuat menurunnya kemampuan untuk
mensekresikan insulin. Aloksan juga secara selektif menghambat sekresi
insulin pada sel beta pankreas melalui penghambatan pada glukokinase, yang
merupakan sensor adanya glukosa pada sel beta pankreas, melalui oksidasi
thiol pada enzim sehingga merusak metabolisme oksidatif dan fungsi sensor
glukosa pada sel beta pankreas (Lenzen, 2007).
G. Tikus (Rattus novergicus)
Tikus putih (Rattus norvegicus) merupakan hewan pengerat dan sering
digunakan sering sebagai hewan percobaan atau digunakan untuk penelitian
dikarenakan tikus merupakan hewan yang mewakili dari kelas mamalia, yang
mana manusia juga merupakan dari golongan mamalia sehingga
homogenisitas, kelengkapan organ, kebutuhan nutrisi, metabolisme biokimia,
sistem reproduksi, pernafasan, peredaran darah, gen serta ekskresi
menyerupai manusia (Demetrius, 2005).
Tikus putih (Rattus norvegicus) juga memiliki beberapa sifat menguntungkan
seperti: cepat berkembang biak, mudah dipelihara dalam jumlah banyak, lebih
ciri-ciri albino, kepala kecil, dan ekor yang lebih panjang dibandingkan
badanya, pertumbuhanya cepat, tempramennya baik, kemampuan laktasi
tinggi, dan tahan terhadap perlakuan. Keuntungan utama tikus putih (Rattus
norvegicus) galur Sprague Dawley adalah ketenangan dan kemudahan
penanganannya (Isroi, 2010).
Tikus (Rattus novergicus) diklasifikasikan sebagai berikut (Myers, 2004).
Kingdom : Animalia
Phylum : Chordata
Sub Phylum : Vertebrata
Class : Mammalia
Sub Class : Theria
Ordo : Rodentia
Sub Ordo : Myomorpha
Family : Muridae
Sub Family : Murinae
Genus : Rattus
Spesies : Rattus novergicus
Galur : Sprague Dawley
Berat badan tikus laboratorium lebih ringan dibandingkan dengan berat badan
tikus liar. Biasanya pada umur empat minggu beratnya 35-40 gram, dan berat
dewasa rata-rata 200-250 gram (FKH UGM, 2006), hidung tumpul dengan
panjang 18-25 cm, kepala dan badan lebih pendek dari ekornya, serta telinga
28
Tikus yang digunakan dalam penelitian adalah galur Sprague Dawley
berjenis kelamin jantan berumur 3–4 bulan. Tikus Sprague Dawley dengan
jenis kelamin betina tidak digunakan karena kondisi hormonal yang sangat
berfluktuasi pada saat mulai beranjak dewasa, sehingga dikhawatirkan akan
memberikan respon yang berbeda dan dapat mempengaruhi hasil penelitian
[image:38.595.157.470.276.485.2](Harkness dan Wagner, 1983).
III. METODE PENELITIAN
A. Desain Penelitian
Penelitian yang dilakukan ini merupakan suatu penelitian eksperimental
dengan rancangan Post Test Only Control Group Design. Pengambilan data
dilakukan setelah akhir penelitian sesudah dilakukannya perlakuan dengan
membandingkan hasil pada kelompok kontrol negatif dengan kontrol positif
dan membandingkan hasil pada kelompok kontrol positif dengan kelompok
perlakuan.
B. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan November sampai Desember 2013
selama 24 hari. Perawatan dan perlakuan sampel bertempat di
Laboratorium Farmakologi, Laboratorium Biokimia dan Laboratorium
30
C. Populasi dan Sampel
1. Populasi Penelitian
Populasi penelitian ini adalah adalah tikus putih (Rattus norvegicus) jantan
galur Sprague Dawley berumur 3-4 bulan dengan berat badan 200-250
gram, yang diperoleh dari Institut Pertanian Bogor (IPB) .
2. Sampel Penelitian
Sampel penelitian dipilih secara acak berjumlah 25 ekor yang dibagi
menjadi 5 kelompok dengan pengulangan sebanyak 5 kali, sesuai dengan
rumus Frederer (Supranto, 2007).
Rumus Frederer :
(n-1) x (t- 1) > 15
Keterangan :
n = jumlah sampel setiap kelompok dan t = jumlah kelompok perlakuan.
Penelitian ini menggunakan 5 kelompok perlakuan sehingga perhitungan
sampel menjadi :
n > 1 + 15 / (t-1)
n > 1 + 15 / (5-1)
n > 1 + 15 / 4
n > 4,75
Jadi sampel yang akan digunakan tiap kelompok percobaan sebanyak 5
ekor dan jumlah kelompok yang digunakan adalah 5 kelompok sehingga
penelitian ini menggunakan 25 ekor tikus dari populasi yang ada.
Untuk mengantisipasi hilangnya eksperimen maka dilakukan koreksi
dengan :
N = n / (1-f)
Keterangan :
N = Besar sampel koreksi
n = Besar sampel awal
f = Perkiraan proporsi drop out sebesar 10 %
Sehingga,
N = n / (1-f)
N = 5 / (1-10%)
N = 5 / (1-0,1)
N = 5 / 0,9
N = 5,55
N = 6
Jadi, sampel yang digunakan tiap kelompok percobaan sebanyak 6 ekor.
Oleh karena itu, penelitian kali ini menggunakan 30 ekor tikus yang dibagi
32
D. Kriteria Inklusi dan Eksklusi
1. Kriteria Inklusi
a. Tikus putih (Rattus norvegicus) jantan galur Sprague dawley.
b. Sehat (Aktif bergerak).
c. Memiliki berat badan antara 200-250 gram.
d. Berusia sekitar 3-4bulan.
2. Kriteria Eksklusi
a. Terlihat sakit pada masa adaptasi (Penampakan rambut kusam, rontok
atau botak dan aktivitas kurang atau tidak aktif, keluarnya eksudat
yang tidak normal dari mata, mulut, anus atau genital).
b. Terdapat penurunan berat badan lebih dari 10% setelah masa adaptasi
di laboratorium.
c. Mati selama pemberian perlakuan.
E. Alat dan Bahan Penelitian
1. Alat penelitian
a. Alat yang digunakan dalam penelitian ini adalah sebagai berikut:
1) Kandang tikus.
2) Botol minum untuk tikus.
3) Timbangan analitik, untuk menimbang berat tikus.
4) Glukometer dan strip Glukotest untuk mengukur kadar gula darah.
6) Vacutainer red top, untuk menyimpan darah tikus.
7) Hemmatocrit tube, untuk mengambil darah tikus dari jantung.
8) Handschoen, kapas dan alkohol.
9) Tabung reaksi.
b. Alat pembuat ekstrak
Alat yang digunakan membuat ekstrak etanol biji jengkol adalah :
1) Neraca digital / micro analytical balance, dengan ketelitian 0,001
mg untuk menimbang biji jengkol.
2) Mortar dan stamper, untuk menumbuk dan menghaluskan biji
jengkol.
3) Termometer.
4) Mikropipet.
5) Panci penangas, untuk merebus ekstrak.
6) Hot plate.
7) Baker glass.
8) Kertas saring, untuk menyaring ekstrak.
9) Rotary Evaporator, untuk memekatkan ekstrak.
10) Corong Buchner, untuk menyaring hasil maserasi.
2. Bahan penelitian
a. Hewan coba berupa tikus putih jantan (Rattus novergicus) galur
Sprague Dawley berasal dari IPB dan memenuhi kriteria inklusi.
34
b. Ekstrak etanol 96% biji jengkol (Pithecellobium lobatum Benth.).
c. Aloksan monohidrat.
F. Prosedur Penelitian
1. Prosedur Pembuatan Ekstrak etanol biji jengkol (Pithecellobium lobatum Benth.)
a. Cara pembuatan ekstrak etanol biji jengkol
Biji jengkol yang digunakan pada penelitian ini adalah biji jengkol tua
yang masih segar (kulit dan bijinya masi dapat digunakan) dan
dikumpulkan, pada bagian yang tidak diperlukan dapat dibuang (sortasi
basah), dicuci bersih dan ditiriskan. Untuk mempermudah ekstrasi maka
biji jengkol selanjutnya dirajang kecil-kecil dan dikeringkan di bawah
matahari hingga kering, untuk benda-benda asing atau
pengotoran-pengotoran lain yang masih tertinggal pada simplisia kering (sortasi
kering) dapat dibuang, agar menjadi halus, maka diblender dan disimpan
ditempat yang bersih. Serbuk biji jengkol (simplisia) ditimbang dengan
seksama dan selanjutnya dilakukan ekstraksi (Candra, 2012). Metode
perkolasi adalah metode untuk pembuatan ekstrak etanol biji jengkol.
Perkolasi adalah penarikan memakai alat yang disebut perkolator dimana
simplisia terendam dalam cairan penyari, zat-zat akan terlarut dan larutan
tersebut akan menetes secara beraturan (Syamsuni, 2006). Serbuk
simplisia direndam dengan etanol 96%, selanjutnya dipindahkan tersebut
sedikit demi sedikit ke dalam perkolator, campurkan etanol 96%
secukupnya hingga simplisia terendam dan terdapat cairan penyari di
24 jam. Kemudian kran perkolator dibuka dan dibiarkan cairan ekstrak
menetes dengan kecepatan 1 ml per menit dan ditambahkan etanol 96%
berulang-ulang dan secukupnya dan diatur kecepatan penetesan cairan
penyari sama dengan kecepatan tetesan perkolat, sehingga selalu terdapat
selapis cairan penyari di atas simplisia. Perkolasi dihentikan jika perkolat
yang keluar terakhir diuapkan, tidak meninggalkan sisa. Perkolat
kemudian disuling dan diuapkan dengan tekanan rendah pada suhu tidak
lebih dari 500C menggunakan rotary evaporator, kemudian dipekatkan
dengan bantuan alat freeze dryer sehingga diperoleh ekstrak kental
(Depkes, 2000).
2. Prosedur Penelitian
a. Sebelum penelitian berlangsung 25 ekor tikus diadaptasikan dahulu
selama 7 hari dengan diberikan pakan standar dan air minum ad
libitum. Kemudian tikus sebanyak 25 ekor, dibagi menjadi 5
kelompok, dengan masing-masing kelompok berjumlah 5 ekor. Grup-1
adalah kontrol negatif (-) dimana tidak diberikan aloksan. Grup ke-2
adalah kontol positif (+) dimana grup ini diberikan aloksan secara
intraperitoneal. Berdasarkan penelitian (ellysa, 2011) bahwa dosis 600
mg/kgbb ekstrak etanol biji jengkol merupakan dosis efektif
menurunkan kadar glukosa darah. Grup ke-3 adalah grup I dengan
pemberian dosis I (600mg/kg bb) ekstrak etanol biji jengkol dengan
pemberian aloksan intraperitoneal selama 14 hari. Grup ke-4 adalah
grup dengan pemberian dosis II (900mg/kgbb) ekstrak etanol biji
ke-36
5 adalah grup dengan pemberian dosis III (1200mg/kgbb) ekstrak
etanol biji jengkol dan diberikan aloksan 150 mg/kgbb secara
intraperitoneal selama 14 hari.
b. Mengukur kadar glukosa darah puasa tikus sebelum perlakuan.
c. Pemberian aloksan monohidrat secara intraperitoneal. Setelah
diinduksi dan tikus tetap diberikan makanan dan minuman ad libitum,
tunggu dalam 3 hari, dan ukur kadar glukosa darahnya. Tikus dianggap diabetes apabila kadar glukosa darah ≥ 200 mg/dl (Triplitt et al., 2008)
dan telah dapat digunakan untuk pengujian. Selanjutnya disebut
sebagai tikus diabetes.
d. Tikus dipuasakan selama 12 jam, kemudian menguukur kadar glukosa
darah tikus.
e. tikus diberikan ekstrak etanol biji jengkol selama 14 hari, satu kali
setiap hari dan tetap tikus diberikan makan ad libitum.
f. Mengukur kadar HDL darah tiku setelah 14 hari pemberian ekstrak
etanol biji jengkol.
g. Pada akhir hari ke-14 sampel dipuasakan terlebih dahulu selama 12
jam dan pengambilan sampel darah dilakukan, Tikus dikeluarkan dari
kandang untuk mengurangi penderitaan pada tikus akibat aktivitas.
Setelah itu, tikus dianestesi dengan Ketamine-xylazine 75-100 mg/kg
+ 5-10 mg/kg secara intraperitoneal, kemudian tikus di euthanasia
menggunakan metode cervical dislocation dengan cara ibu jari dan jari
telunjuk ditempatkan dikedua sisi leher di dasar tengkorak atau batang
atau kaki belakang dengan cepat ditarik sehingga menyebabkan
pemisahan antara tulang leher dan tengkorak (AVMA, 2013). Setelah
tikus dipastikan mati, darah di ambil melalui jantung dengan
menggunakan spuit sebanyak ±2 cc untuk pemeriksaan kadar HDL,
kemudian langsung dimasukkan ke dalam vacutainer red top.
h. Pengukuran kadar HDL
Pada penelitian ini untuk mendapatkan hasil kadar HDL dilakukan
dengan dengan metode ezimatik CHOD-PAP. Sampel darah yang
sudah didapat dimasukan kedalam tabung vacutainer dan didiamkan
terlebih dahulu selama 10-15 menit. Kemudian di sentrifus selama 10
menit dengan kecepatan 4000 rpm. Serum yang dihasilkan dari proses
[image:47.595.197.478.509.622.2]sentrifus diletakan di tabung dan dicampurkan :
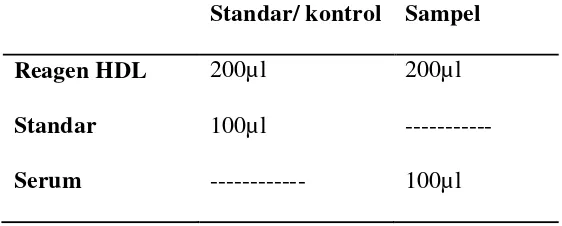
Tabel 2. Cara pengukuran kadar HDL prosedur 1
Dicampurkan100 μl ditambah 200 μl reagen presipitan dimasukkan ke
dalam sentrifuge, mencampurnya baik-baik, kemudian disentrifugasi
dengan kecepatan 4000 rpm selama 10 menit. Filtrat dipakai untuk Standar/ kontrol Sampel
Reagen HDL Standar Serum
200µl
100µl
---
200µl
---
38
pemeriksaan kadar kolesterol-HDL. Kemudian didiamkan pada suhu
kamar selama 10 menit atau pada suhu 37°C selama 5 menit pada
panjang gelombang 500 nm. Pengukuran menggunakan alat
[image:48.595.170.539.224.327.2]Spektofotometer :
Tabel 3. Cara pengukuran kadar HDL prosedur 2
Blanko Standar/ control Sampel
Reagen kerja
Standar
Serum
1000µl
---
---
1000µl
50µl
---
1000µl
---
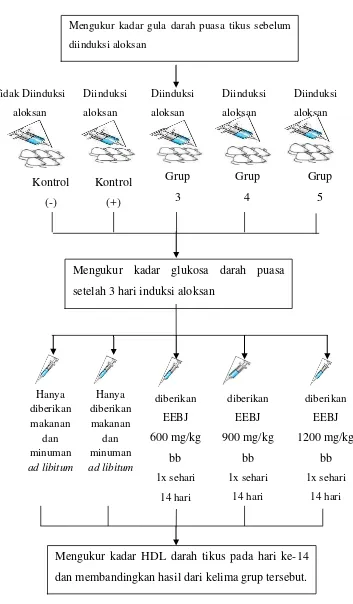
Diinduksi aloksan Diinduksi aloksan Diinduksi aloksan Diinduksi aloksan diberikan EEBJ 1200 mg/kg bb 1x sehari 14 hari diberikan EEBJ 900 mg/kg bb 1x sehari 14 hari diberikan EEBJ 600 mg/kg bb 1x sehari 14 hari Tidak Diinduksi aloksan Hanya diberikan makanan dan minuman ad libitum Hanya diberikan makanan dan minuman ad libitum i. Alur Prosedur Penelitian
Gambar 6. Ilustrasi prosedur penelitian. Mengukur kadar gula darah puasa tikus sebelum
diinduksi aloksan Grup 3 Grup 5 Grup 4 Kontrol (+) Kontrol (-)
Mengukur kadar glukosa darah puasa setelah 3 hari induksi aloksan
40
G. Identifikasi Variabel dan Definisi Operasional Variabel
1.Identifikasi Variabel
a. Variabel Bebas (Independent Variable)
Variabel bebas dalam penelitian ini adalah pemberian ekstrak etanol
biji jengkol (Pithecellobium lobatum Benth.).
b. Variabel Terikat (Dependent Variable)
Variabel terikat dalam penelitian ini adalah kadar HDL dalam darah
tikus.
[image:50.595.144.568.453.721.2]2. Defenisi Operasional Variabel
Tabel 4. Definisi Operasional
Variabel Definisi Alat Ukur Skala Jenis
Variabel Ektrak
Etanol
biji
jengkol
Ekstrak Etanol Biji Jengkol (EEBJ)
diberikan pada tikus berupa suspensi
dengan dosis 600 mg/kg bb (dosis I), 900
mg/kg bb (dosis II), dan 1.200 mg/kg bb
(dosis III).
Timbangan mg/kgbb Numerik
Kadar
HDL
Kadar HDL darah tikus putih jantan galur
Sprague Dawley yang diukur setelah 14
hari pemberian EEBJ
Metode
enzimatik
CHODPAP
H. Analisis Data
Data yang diperoleh dari hasil penelitian diuji analisis statistik menggunakan
program SPSS versi 22.0 Analisis data penelitian diproses dengan program
pengolahan data dengan tingkat signifikansi p=0.05. Data yang diperoleh
diuji normalitasnya dengan uji Saphiro-Wilk dan uji homogenitas Levene.
Analisis data menggunakan uji parameteik One Way ANOVA untuk melihat
perbedaan ketiga kelompok perlakuan dengan syarat data berdistribusi normal
dan homogen (p>0,01). Tetapi, jika distribusi data tidak normal (hasilnya
p<0.05) maka digunakan uji alternatif yaitu uji Kruskal-Wallis dan hasilnya
bermakna dan untuk mengetahui perbedaan kelompok yang bermakna
dilanjutkan dengan uji Mann-Whitney.
I. Etika Penelitian
Penelitian ini telah mendapatkan Keterangan Lolos Kaji Etik dari Komisi Etik
Penelitian Kesehatan Fakultas Kedokteran Universitas Lampung dengan
menerapkan prinsip 3R dalam protokol penelitian, yaitu:
1. Replacement, adalah untuk memanfaatkan hewan percobaan sudah
diperhitungkan secara seksama, sesuai pengalaman terdahulu maupun
literatur yang ada untuk menjadi bahan pertimbangan penelitian, sehinga
tidak dapat digantikan oleh makhluk hidup lain seperti sel atau biakan
42
2. Reduction, adalah pemanfaatan hewan dalam penelitian sesedikit
mungkin, tetapi tetap mendapatkan hasil yang optimal.
3. Refinement, adalah cara memperlakukan hewan percobaan secara dengan
prinsip dasar membebaskan hewan coba dalam kondisi tidak nyaman.
a. Bebas dari rasa lapar dan haus, pada penelitian ini hewan coba
diberikan pakan standar dan minum secara ad libitum.
b. Animal house berada jauh dari gangguan bising dan aktivitas manusia
serta kandang dijaga kebersihannya sehingga, mengurangi stress pada
hewan coba. Pada penelitian hewan coba ditempatkan di animal
house dengan suhu terjaga 20-25°C, kemudian hewan coba terbagi
menjadi 2-4 ekor tiap kandang.
c. Bebas dari nyeri dan penyakit, pada penelitian hewan coba diberikan
perlakuan dengan menggunakan sonde lambung dilakukan dengan
mengurangi rasa nyeri sesedikit mungkin, dosis perlakuan diberikan
berdasarkan pengalaman terdahulu maupun literatur yang telah ada.
Prosedur pengambilan sampel darah kadar HDL pada akhir penelitian
dengan mempertimbangkan tindakan manusiawi dan anesthesia serta
euthanasia dengan metode yang manusiawi oleh orang yang terlatih
untuk meminimalisasi atau bahkan meniadakan penderitaan hewan
V. SIMPULAN DAN SARAN
A. Simpulan
Simpulan yang didapat setelah dilakukan penelitian mengenai pengaruh
pemberian ekstrak etanol biji jengkol (Pithecellobium lobatum Benth.) terhadap
kadar HDL tikus putih (Rattus norvegicus) jantan galur Sprague dawley yang
diinduksi aloksan, adalah :
1. Tidak terdapat pengaruh pemberian ekstrak etanol biji jengkol
(Pithecellobium lobatum Bent.) terhadap peningkatan kadar HDL dalam
darah tikus diabetes.
B. Saran
1. Penelitian lain diharapkan menggunakan metode induksi hiperlipidemia.
2. Penelitian lain melakukan penelitian lebih lanjut agar dapat mengetahui
efek samping pemberian ekstrak etanol biji jengkol (Pithecellobium
Lobatum Benth).
3. Peneliti lain dapat melakukan penelitian dengan jangka waktu yang lebih
lama agar efek ekstrak etanol biji jengkol (Pithecellobium Lobatum
Benth.) terhadap kadar HDL darah tikus putih (Rattus norvegicus) terlihat
DAFTAR PUSTAKA
Abro, A. K. and Bukhari, M. H. 2009. Comparison of serum cholesterol fractions levels in albino rats on monounsaturated (Olive Oil) fat diet. Annals 15(4): 161-4.
Adam John MF. 2006. Dislipidemia.Dalam : Sudoyo Aru W, Setiyohadi Bambang, Alwi Idrus dkk. Buku Ajar Ilmu Penyakit Dalam Jilid III, Edisi IV, Jakarta : FK-UI, 2006.h 1926-28.
American Diabetes Association. 2004. Diagnosis dan Classification of Diabetes Mellitus. Diabetes Care, Volume 27, Supplement 1.
American Diabetes Association. 2010. Diagnosis and Classification of Diabetes Mellitus. Diabetes Care, volume 33, supplement 1.
Anwar, T. Bahri. 2004. Dislipidemia sebagai faktor resiko penyakit jantung koroner. Repository USU. Medan : Fakultas Kedokteran Universitas Sumatra Utara.
Asih, I.A.R.A. dan Setiawan I.M.A. 2008. Senyawa Golongan Flavonoid pada Bandung: Penerbit Yrama Widya.
Astuti, S., Muctadi, D., Astawan, M., Purwantara, B., Wresdiaty, T. 2009. Pengaruh Pemberian Tepung Kedelai Kaya Isoflavon Terhadap Kadar Manoladehid (MDA) Aktifitas Superoksida Dismute (SOD) Testis dan Profil Cu, Zn- SOD Tubulus Seminiferi Testis Tikus Jantan. Jurnal Teknologi dan Pangan. Bandar Lampung: Fakultas Pertanian Universitas Lampung.
Bahaudin, A. 2008. Profil lemak darah dan respon fisiologis tikus putih yang diberi pakan gulai daging domba dengan penambahan jeroan (Skripsi). IPB. Bogor.
Barter Philip J , Nicholls Stephen, Rye Kerry-Anne, G.M. Anantharamaiah G.M, Navab Mohamad, Fogelman Alan M. 2004. Antiinflammatory Properties of HDL. The Heart Research Institute. Sydney.
Candra, R. A. 2012. Isolasi dan Uji Aktivitas Antioksidan Senyawa Alkaloid dari Ekstrak Daun Phoebe declinataNees. Skripsi. Depok : Universitas Indonesia.
Dai, M., Astuti, N.Y., Utami. W. 2009. Uji Aktivitas Penangkap Radikal DPPH Oleh Analog Kurkumin Monoketon dan Heteroalifatik Monoketon. Jurnal Farmasi Indonesia. Surakarta : Universitas Muhammadiyah Surakarta.
Daniil, Georgios, Alexia A.P. Phenodos, Adriaan G. Holleboom, Mohammad Mahdi Motazacker, Letta Argyri, Jan Albert Kuivenhoven, Angeliki Chroni. 2011. Characterization of antioxidant/anti-inflamatory properties and ApoA-I-containing subpopulations of HDL from family subjects with monogenic low HDL disorders. National Center for Scientific Research Demokritos. Yunani.
Depkes RI. 1995. Farmakope Indonesia. Edisi V. Jakarta : Depkes RI.
Depkes. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan Republik Indonesia.
Dubey, A. K., Devi, A., Kutty, G., Shankar, R. P. 2005. Hypolipidemic activity of Ginkgo biloba Extract, EGb 761 in hypercholesterolemic Wistar Rats. Iranian Journal of Pharmacology & Therapeutics 4(1): 9-12.
Ekstrak n-Butanol Kulit Batang Bungur (Lagerstroemia speciosa Pers.). Jurnal Kimia. Bukit Jimbaran : Fakultas Matematika dan Ilmu Pengetahuan Alam Univesitas Udayana.
Elysa. 2011. Uji Efek Ekstrak Etanol Biji Jengkol (Pithecellobium Lobatum Benth.) terhadap Penurunan Kadar Glukosa Darah Tikus Putih Jantan Galur Wistar yang diinduksi Aloksan. (Skripsi). Medan : Fakultas Farmasi Universitas Sumatera Utara.
Fatmawati E., 2008. Pengaruh Lama Pemberian Ekstrak Daun Sambiloto (Andrographis paniculata Ness.) Terhadap Kadar Kolesterol, LDL, HDL dan Trigleserida Darah Tikus (Rattus norvegicus) Diabetes. (Skripsi). Malang : Fakultas Sains dan Teknologi Universitas Islam Negri Malang.
Fessenden, R. J., dan Fessenden, R. S., 1994. Kimia Organik Jilid 2 Edisi III. Penertbit Erlangga : Jakarta.
Filipponi P, Gregorio F, Cristallini S, Ferrandina C, Nicoletti I, Santeusanio F. 2008. Selective impairment of pancreatic A cell suppreession by glucose during acute alloxan – induced insulinopenia: in vitro study on isolated perfused rat pancreas.
59
Grundy SM, Brewer HB, Jr., Cleeman JI, Smith SC Jr, Lenfant C.2004. Definition of metabolic syndrome: Report of the National Heart, Lung, and Blood Institute/ American Heart Association conference on scientific issues related to definition. The Clinical Boichemistry Review.
Guyton & Hall. 2008. Buku ajar fisiologi kedokteran. Jakarta: Penerbit Buku kedokteran EGC. Hal. 7, 854
Harkness J. E., Wagner J. E 1983. Biology and Medicine of Rabbits and Rodents.
Philadelphia: Lea and Fabriger.
Helal, O., Berrougui, H., Loued, S., Khalil, A., 2013. Extra-Virgin olive oil consumption improves the capacity of HDL to mediate cholesterol efflux and increases ABCA1 dan ABCGIexpression in human macrophages. 109 (10):1844-55
Hartoyo, A., Dahrulsyah, N. Sripalupi dan P. Nugroho. 2008. Pengaruh Fraksi Karbohidrat Kacang Komak (Lablab Purpureus (L) Sweet). Jurnal teknologi dan industri pangan, 19: 25-31
Heinrich, M., Barnes, J., Gibbons, S., dan Williamson, E.M. (2004). Fundamentals of Pharmacognosy and phytotherapy. United Kingdom: Churchill Livingstone. Halaman 288.
Hutapea, J.R. (1994). Inventaris Tanaman Obat Indonesia. Edisi III. Jakarta: Depkes RI. Halaman 219-220.
Hutapea, J.R. (1994). Inventaris Tanaman Obat Indonesia. Edisi III. Jakarta: Depkes RI. Jung, Chang H, dkk. 2006. Antihyperglycemic Activity of Herb Extracts on Streptozotocin-Induced Diabetic rats. Biosci, Biotechnol, Biochem, (10) 70 : 2556-2559.
International Diabetes Federation. IDF Clinical Guidelines Task Force. Global Guideline for type 2 diabetes. Brussels, 2005.
Kayamori, F. and Igarashi, K. 2000. Effect of dietary nasunin on the serum cholesterol level in rats. Am. Biosci. Biotech. Biochem. 58: 1570-1.
Kumalasari, N.D. 2005. Pengaruh Berbagai Dosis Filtrat Daun Putri Malu (Mimosa pudica) terhadap Kadar Glukosa Darah pada Tikus (Rattus norvegicus). Skripsi Tidak Diterbitkan. Malang: Program Studi Pendidikan Biologi Jurusan MIPA FKIP U MM.
Lenzen, S. 2007. The mechanisms of alloxan and streptozotocin-induced. Diabetologia. Hannover Instittute of Clinic al Biochemistry of Hannover medival school.
Mikito, A., Yamashita, C., Iwasaki, Y. 1995. A Triterpenoid Saponin Extraction there of and use to Treat or Prevent Diabetes Mellitus. European Patent Application.
Murray, R.K. dkk. 2009. Biokimia Harper Edisi 27th. Jakarta: EGC
Murray, Robbert K. dkk. 2000. Harper’s Biochemistry,(Terj.) : Hartono, A., Biokimia Harper. Edisi 25. Jakarta : Penerbit Buku Kedokteran EGC.
Musunuru, Kiran. 2010. Atherogenic Dyslipidemia: Cardiovascular Risk and Dietary Intervention. Cardiovascular Research Center and Center for Human Genetic Research. Boston.
Muthusamy, S., Kanagarajan, S., dan Ponnusamy, S. 2008. Efficiency of RAPD and ISSR Marker System in Accessing Genetic Variation of Rice Bean (Vigna umbellata) Landraces. Electronic Journal of Biotechnology 11 (3) : 1 – 8.
Muthusamy, V. S., Anand, S., Sangeetha, K. N., Sujatha, S., Balakrishnan, A., Lakshmi, B. S. 2008. Tannins present in Cichorium intybus enhance glucose uptake and inhibit adipogenesis in 3T3-L1 adipocytes through PTP1B inhibition. Chemico-Biological Interactions, Volume 174, Issue 1.
Notoatmodjo, S. 2002. Metodologi Penelitian Kesehatan. Jakarta: PT Rineka Cipta.
Notoatmodjo, S. 2012. Metodologi Penelitian Kesehatan. Jakarta : Rineka Cipta
Pandey, B.P. 2003. A Text Book of Botany. Angiosperms: Taxonomy, Anatomy, Embryologi. Ram Nagar: S.Chand & Company Ltd.
Perkumpulan Endokrinologi Indonesia. Konsensus Pengelolaan dan Pencegahan Diabetes Melitus Tipe 2 di Indonesia 2006. PB PERKENI, Jakarta 2006 : 1-47.
Pitojo, S., 1992. Jengkol, Budidaya dan Pemanfaatannya. Kanisius. Yogyakarta. Povey, Robert. 1994. How to Keep Your Cholesterol in check (terj):
Wulandari,Powers, A.C.. 2008. Harrison’s Principle of Internal Medicine 17th ed. United States of America.
61
Putri, H. P., Pudjadi., Kartikawati, Henny., 2010. Pengaruh Pemberian Ekstrak Bawang Merah (Allium ascalobicum) Terhadap Kadar Kolesterol HDL Serum Tikus Wistar Hiperlipidemia. Semarang : Universitas Diponegoro.
Rohman, M. S. 2007. Patogenensis dan Terapi Sindrom Metabolik. Jurnal Kardiologi Indonesia. Jakarta.
Roswaty, A. 2010. All About Jengkol & Petai. Jakarta: PT Gramedia Pustaka Utama. Halaman 4.
Ridwan E. 2013. Etika Pemanfaatan Hewan Percobaan dalam Penelitian Kesehatan. J indon Med Assoc. 63 (3): 112-6.
Rukmanasari, R. 2010. Efek Ekstrak Kulit Terong Ungu (Solanum melongena L. ) Terhadap Kadar LDL dan HDL Darah Tikus Putih. (skripsi). Surakarta : Universitas Sebelas Maret.
Sharrma, R. K., Singh, V. N., Reddy. H. K. 2009. Low HDL Cholesterol (Hypoalphalipoproteinemia). Vascular Health and Risk Management. South Arkansas: Medical center Of Arkansas
Sirois, M. 2005. Laboratory Animal Medicine : Principles and Procedure. Untied States Of America: Mosby, Inc.
Sitorus, Ronald H.. 2006. Tiga Jenis Penyakit Pembunuh Utama Manusia.
Song, Y., JoAnn E. M., Julie E. B., Howard D. S., Simin L. 2005. Associations of Dietary Flavonoids with Risk of Type 2 Diabetes, and Markers of Insulin Resistance and Systemic Inflammation in Women : A Prospective Study and Cross-Sectional Analysis. Journal of the American College of Nutrition, Volume 24, Issue 5.
Sudoyo, A.W., Setiyohadi B., Alwi I., Simadibrata K.M., dan Setiati S. 2007. Buku Ajar Ilmu Penyakit Dalam. Edisi keempat. Jilid ketiga. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia.
Suwitra. K. (2006). Penyakit Ginjal Kronik. Dalam Sudoyo, A.W., dkk., Editor. Buku Ajar Ilmu Penyakit Dalam. Jilid I. Edisi keempat. Penerbit Depertemen Ilmu Penyakit Dalam FK-UI. Jakarta. Hal. 570-572.
Suyatna, F.D. 2007. Hipolipidemik. Di dalam: Gunawan SG, editor. Farmakologi dan Terapi. Ed. 5. Departemen Farmakologi dan Terape-tik Fakultas Kedokteran Universitas Indonesia. Jakarta. Hal. 373 – 87.
Suyono, Slamet. 2006. Buku Ajar Ilmu Penyakit Dalam. Edisi keempat. Jilid ketiga. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia.
Tien Tirtawinata. 2006. Makanan dalam Prespektif Alquran dan Ilmu Gizi. FKUI:Jakarta
Tjitrosoepomo, G. 2000. Taksonomi Tumbuhan (Spermatophyta). Yogyakarta: Gadjah Mada University Press. Hal. 192-206.
Widowati, L., Dzulkarnain, B., dan Sa’roni. 1997. Tanaman Obat untuk Diabetes Mellitus. Cermin Dunia Kedokteran.
Wild S, Sicree R, Roglic G, King H, Green A. 2004. Global prevalence of diabetes: estimates for the year 200 and projections for 2030. Diabetes Care ; 27: 1047-53.
Winarsi, H. 2007. Antioksidan Alami dan Radikal Bebas. Yogyakarta : Penerbit Kanisius. 185 hlm.
World Health Organization. 2005. Diabetes Mellitus : Report of a WHO Study Group. Geneva, WHO