ABSTRACT
KENYO PALUPI. Effect of Corticosteroid on Limfoid Organ of Broiler. Under direction of SRI ESTUNINGSIH and WIWIN WINARSIH.
Corticosteroid is an anti-inflammatory agent which have been used for poultry industry widely. The aim of this research was to study the effect of corticosteroid on lymphoid organ of broiler by histopathological analysis. Thirty commercial DOC (Day Old Chick) were divided into 2 groups. First group was control and second group was treated by corticosteroid (3 mg/Kg) orally. Each group was divided into 5 subgroups according to their sacrifice day at age from 2 week until 6 week. This treatment done for 6 weeks, broilers then were necropsied. The bursa of Fabricius, thymus, and spleen were collected as histopathological samples. Samples were processed routinely to prepared histopathology slide stained with Haematoxylin Eosin. The parameters observed include to measured the number of lymphoid follicle of bursa Fabricius and spleen, the number of lymphocyte of bursa, thymus and spleen, and width of bursa’s plica and cortex and medulla of thymus. Quantitative data were analyzed with T-student test. The observation results was corticosteroid caused immunossupression that showed by decrease of lymphocyte and lymphoid follicle numbers which are significant (p<0.05) compared to the control group. There were significant (p<0.05) compare to the control group on the number of small and large lymphoid follicles, high and wide of plica of bursa of Fabricius, width of medulla of thymus, and the number of lymphoid follicles of spleen.
ABSTRAK
KENYO PALUPI. Pengaruh Pemberian Kortikosteroid Terhadap Gambaran Histopatologi Organ Limfoid Ayam Broiler. Dibimbing oleh SRI ESTUNINGSIH dan WIWIN WINARSIH.
Kortikosteroid merupakan senyawa anti-inflamasi yang digunakan secara luas khususnya dalam dunia peternakan. Tujuan dari penelitian ini adalah mempelajari efek kortikosteroid yaitu Prednisone pada organ limfoid ayam broiler. Sebanyak 30 ekor DOC dibagi menjadi 2 kelompok. Kelompok pertama adalah kontrol dan kelompok kedua adalah perlakuan (diberikan Prednisone 3 mg/kg BB per oral). Masing-masing kelompok dibagi menjadi 5 kelompok sesuai umur perlakuan, mulai dari umur 2 minggu sampai 6 minggu. Perlakuan ini berlangsung selama 6 minggu setelah itu ayam dinekropsi. Organ limfoid yang disampling adalah bursa Fabricius, timus, dan limpa yang selanjutnya dibuat preparat histopatologi menggunakan pewarnaan Haematoxylin Eosin dan diamati. Parameter yang diamati antara lain, jumlah limfosit, jumlah folikel limfoid, tinggi dan lebar plika bursa Fabricius, jumlah limfosit dan luas organ timus, serta jumlah limfosit dan folikel limfoid pada limpa. Data dianalisis secara kuantitatif dengan uji lanjut T-student. Hasil dari penelitian ini adalah kortikosteroid memberikan efek imunosupresi yang ditunjukkan menurunnya jumlah limfosit dan jumlah folikel limfoid organ limpa. Jumlah limfosit Bursa Fabricius, timus, dan limpa menunjukkan hasil yang berbeda nyata (P<0.05). Jumlah folikel limfoid besar dan kecil, tinggi dan lebar plika bursa Fabricius, luas medulla timus, dan jumlah folikel limfoid limpa menunjukkan hasil berbeda nyata (P<0.05). Kortikosteroid memberikan efek yang signifikan terhadap organ limfoid ayam broiler.
PENGARUH PEMBERIAN KORTIKOSTEROID TERHADAP
GAMBARAN HISTOPATOLOGI ORGAN LIMFOID
AYAM BROILER
KENYO PALUPI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Pengaruh Pemberian Kortikosteroid Terhadap Gambaran Histopatologi Organ Limfoid Ayam Broiler adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, April 2012
Kenyo Palupi
ABSTRAK
KENYO PALUPI. Pengaruh Pemberian Kortikosteroid Terhadap Gambaran Histopatologi Organ Limfoid Ayam Broiler. Dibimbing oleh SRI ESTUNINGSIH dan WIWIN WINARSIH.
Kortikosteroid merupakan senyawa anti-inflamasi yang digunakan secara luas khususnya dalam dunia peternakan. Tujuan dari penelitian ini adalah mempelajari efek kortikosteroid yaitu Prednisone pada organ limfoid ayam broiler. Sebanyak 30 ekor DOC dibagi menjadi 2 kelompok. Kelompok pertama adalah kontrol dan kelompok kedua adalah perlakuan (diberikan Prednisone 3 mg/kg BB per oral). Masing-masing kelompok dibagi menjadi 5 kelompok sesuai umur perlakuan, mulai dari umur 2 minggu sampai 6 minggu. Perlakuan ini berlangsung selama 6 minggu setelah itu ayam dinekropsi. Organ limfoid yang disampling adalah bursa Fabricius, timus, dan limpa yang selanjutnya dibuat preparat histopatologi menggunakan pewarnaan Haematoxylin Eosin dan diamati. Parameter yang diamati antara lain, jumlah limfosit, jumlah folikel limfoid, tinggi dan lebar plika bursa Fabricius, jumlah limfosit dan luas organ timus, serta jumlah limfosit dan folikel limfoid pada limpa. Data dianalisis secara kuantitatif dengan uji lanjut T-student. Hasil dari penelitian ini adalah kortikosteroid memberikan efek imunosupresi yang ditunjukkan menurunnya jumlah limfosit dan jumlah folikel limfoid organ limpa. Jumlah limfosit Bursa Fabricius, timus, dan limpa menunjukkan hasil yang berbeda nyata (P<0.05). Jumlah folikel limfoid besar dan kecil, tinggi dan lebar plika bursa Fabricius, luas medulla timus, dan jumlah folikel limfoid limpa menunjukkan hasil berbeda nyata (P<0.05). Kortikosteroid memberikan efek yang signifikan terhadap organ limfoid ayam broiler.
ABSTRACT
KENYO PALUPI. Effect of Corticosteroid on Limfoid Organ of Broiler. Under direction of SRI ESTUNINGSIH and WIWIN WINARSIH.
Corticosteroid is an anti-inflammatory agent which have been used for poultry industry widely. The aim of this research was to study the effect of corticosteroid on lymphoid organ of broiler by histopathological analysis. Thirty commercial DOC (Day Old Chick) were divided into 2 groups. First group was control and second group was treated by corticosteroid (3 mg/Kg) orally. Each group was divided into 5 subgroups according to their sacrifice day at age from 2 week until 6 week. This treatment done for 6 weeks, broilers then were necropsied. The bursa of Fabricius, thymus, and spleen were collected as histopathological samples. Samples were processed routinely to prepared histopathology slide stained with Haematoxylin Eosin. The parameters observed include to measured the number of lymphoid follicle of bursa Fabricius and spleen, the number of lymphocyte of bursa, thymus and spleen, and width of bursa’s plica and cortex and medulla of thymus. Quantitative data were analyzed with T-student test. The observation results was corticosteroid caused immunossupression that showed by decrease of lymphocyte and lymphoid follicle numbers which are significant (p<0.05) compared to the control group. There were significant (p<0.05) compare to the control group on the number of small and large lymphoid follicles, high and wide of plica of bursa of Fabricius, width of medulla of thymus, and the number of lymphoid follicles of spleen.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
PENGARUH PEMBERIAN KORTIKOSTEROID TERHADAP
GAMBARAN HISTOPATOLOGI ORGAN LIMFOID
AYAM BROILER
KENYO PALUPI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN
Judul Penelitian : Pengaruh Pemberian Kortikosteroid Terhadap Gambaran Histopatologi Organ Limfoid Ayam Broiler
Nama Mahasiswa : Kenyo Palupi
NRP : B 04070097
Program Studi : Kedokteran Hewan
Fakultas Kedokteran Hewan Institut Pertanian Bogor
Mengetahui, Komisi Pembimbing
Dr. drh. Sri Estuningsih, M.Si, APVet. Dr. Drh. Wiwin Winarsih, MS, APVet.
Pembimbing I Pembimbing II
Menyetujui,
drh. Agus Setiyono, MS, Ph.D, APvet. Wakil Dekan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga skripsi yang berjudul “Pengaruh Pemberian Kortikosteroid Terhadap Gambaran Histopatologi Organ Limfoid Ayam Broiler” telah diselesaikan. Skripsi ini disusun sebagai salah satu syarat memperoleh gelar Sarjana Kedokteran Hewan Institut Pertanian Bogor.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya penulis ucapkan kepada:
1. Keluarga tercinta, Ibu, Bapak, dan Riris, adik tersayang atas cinta, kasih sayang, dukungan dan doa yang tiada henti tercurah kepada penulis.
2. Dr. drh. Sri Estuningsih, M.Si, APVet dan Dr. drh. Wiwin Winarsih, MS. APVet selaku dosen pembimbing tugas akhir atas ilmu, waktu, pelajaran hidup, kesabaran dan dukungan serta motivasi yang diberikan kepada penulis.
3. Drh. Faisal Jamin, M.Si yang senantiasa membantu dan mengarahkan penulis selama penelitian berlangsung.
4. Dr. drh. Chusnul Chaliq, MS, MM selaku dosen pembimbing akademik atas bimbingannya sampai penulis meraih gelar sarjana.
5. Dr. drh. Eko Sugeng Pribadi, MS atas ilmu berorganisasinya.
6. drh. Dewi Ratih Agungpriyono, Phd, APVet atas segala masukan dalam seminar hasil penelitian.
7. Dr. drh. Hera Maheswari M.Si dan Dr. drh. Umi Cahyaningsih, M.Si atas segala masukan serta nasihat dalam ujian akhir sarjana.
8. Dosen dan Staf Laboratorium Patologi (Mas Bangkit, Mba Kiki, Pak Kasnadi, Pak Sholeh, dan Pak Endang) yang selalu bersedia membantu penulis.
9. Cholillurrahman yang selalu setia menampung air mata dan memberikan senyum kepada penulis.
10. Teman-teman Yayasan Patologi Bisa: Niken, Nova, Inez, Dara, Dian, Endah, Abas, Agung, Griv dan Nisa atas dukungan, semangat, dan kerjasamanya.
11. Teman-teman Wisma Geulis: Uji, Eka, Nyitong, Moy, Archi, Uwen, Rifki, Emil, Titi, Milah, Pitri, dan Sari yang selalu ada saat penulis dalam keadaan suka dan duka.
12. Teman-teman Polar Bear dan Smeki: Madu, Kiki, Rio, Darjat, Fahri, Wamen, Rissar, Pea, Andi, Binturong, Joko, Danang, Edi, Ganjar, dan Sukron atas keceriaan dan kesediaannya menjadi penari-penari FKH. 13. Komunitas seni Steril atas pengalaman dan masa-masa indah yang
diberikan kepada penulis.
14. Keluarga besar Gianuzzi FKH 44 yang akan selalu ada di hati penulis. Semoga skripsi ini dapat bermanfaat bagi pembaca.
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 26 Agustus 1989 di Yogyakarta. Penulis adalah anak pertama dari dua bersaudara dari pasangan Bapak Heddy Julistiono dan Ibu Sri Rejeki Retno Wahyuningsih.
Penulis dibesarkan di Bogor dan menempuh sekolah taman kanak-kanak di TK Mesra. Penulis mengawali sekolah dasar pada tahun 1995 di SD Negeri Bangka 3 Bogor, lalu melanjutkan pendidikan di SMP Negeri 2 Bogor pada tahun 2001. Setelah itu, penulis melanjutkan pendidikan di SMA Negeri 3 Bogor pada tahun 2004 dan diselesaikan pada tahun 2007.
DAFTAR ISI
Halaman
DAFTAR ISI ... ii
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
1. PENDAHULUAN 1.1Latar Belakang ... 1
1.2Tujuan Penelitian ... 2
1.3Manfaat Penelitian ... 2
1.4Hipotesa ... 2
2. TINJAUAN PUSTAKA 2.1Ayam Broiler ... 3
2.2Program Vaksinasi ... 4
2.3Respon Kekebalan Unggas ... 5
2.3.1 Bursa Fabricius ... 6
2.3.2 Timus ... 8
2.3.3 Limpa ... 10
2.4Kortikosteroid ... 12
2.4.1 Terapi Kortikosteroid dan Efeknya ... 15
2.4.2 Residu Steroid pada Manusia ... 16
3. METODOLOGI 3.1Waktu dan Tempat penelitian ... 19
3.2Alat dan Bahan Penelitian ... 19
3.3Metode Penelitian ... 20
3.3.1 Tahap Persiapan Kandang ... 20
3.3.2 Pengelompokkan Ayam Penelitian ... 20
3.3.3 Nekropsi dan Pengumpulan Sampel Organ ... 21
3.3.4 Pembuatan Preparat Histopatologi ... 21
3.3.5 Pengamatan Preparat Histopatologi ... 22
3.3.6 Pengolahan Data... 23
4. HASIL DAN PEMBAHASAN 4.1 Perubahan Histopatologis pada Bursa Fabricius Akibat Pemberian Kortikosteroid ... 24
4.2 Perubahan Histopatologis pada Timus Akibat Pemberian Kortikosteroid ... 32
4.3 Perubahan Histopatologis pada Limpa Akibat Pemberian Kortikosteroid ... 37
5. KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 43
5.2 Saran ... 43
6. DAFTAR PUSTAKA ... 44
DAFTAR TABEL
Tabel Halaman
1. Parameter Penelitian ... 23 2. Perbandingan Tinggi dan Lebar Plika Bursa Fabricius Kontrol
(CC0) dan Pemberian Kortikosteroid (CC2) ... 25 3. Perbandingan Jumlah Folikel Limfoid Besar dan Kecil Bursa
Fabricius Kontrol (CC0) dan Pemberian Kortikosteroid (CC2) .... 26 4. Perbandingan Jumlah Total Folikel Limfoid Bursa Fabricius
Kontrol (CC0) dan Pemberian Kortikosteroid (CC2) ... 28 5. Perbandingan Jumlah Limfosit Bursa Fabricius Kontrol
(CC0) dan Pemberian Kortikosteroid (CC2) ... 30 6. Perbandingan Luas Medula dan Korteks Timus Kontrol (CC0)
dan Pemberian Kortikosteroid ... 32 7. Perbandingan Luas Timus Kontrol (CC0) dan Pemberian
Kortikosteroid (CC2) ... 34 8. Perbandingan Jumlah Limfosit Timus Kontrol (CC0) dan
Pemberian Kortikosteroid (CC2) ... 35 9. Perbandingan Jumlah Folikel Limfoid (pulpa putih) Limpa Kontrol
(CC0) dan Pemberian Kortikosteroid (CC2) ... 37 10. Perbandingan Jumlah Limfosit Limpa Kontrol (CC0) dan
DAFTAR GAMBAR
Gambar Halaman
1. Ayam Broiler ... 3
2. Bursa Fabricius ... 8
3. Timus ... 10
4. Limpa Ayam ... 12
5. Konfigurasi Dasar Kortikosteroid... 13
6. Mekanisme Apoptosis Akibat Glukokortikoid ... 14
7. Gambaran Histopatologi Bursa Fabricius Kontrol dan Perlakuan Perbesaran 4x dan 10x ... 29
8. Gambaran Histopatologi Bursa Fabricius Kontrol dan Perlakuan Perbesaran 40x ... 31
9. Gambaran Histopatologi Timus Perbesaran Kontrol dan Perlakuan 4x ... 35
10. Gambaran Histopatologi Timus Perbesaran Kontrol dan Perlakuan 40x ... 36
11. Gambaran Histopatologi Limpa Perbesaran Kontrol dan Perlakuan 4x ... 38
1.
PENDAHULUAN
1.1 Latar belakang
Ternak ayam memiliki peran yang sangat penting dalam pemenuhan kebutuhan nutrisi. Mulai dari telur sampai daging ayam dikonsumsi masyarakat sebagai sumber protein hewani. Seiring dengan perkembangan zaman maka usaha ternak ayam broiler atau broiler yang pada mulanya hanya berkisar pada kegiatan atau usaha rakyat kemudian berkembang dengan pesat demi memenuhi permintaan daging dari masyarakat. Pemenuhan akan daging ayam tidak terlepas dari peternakan ayam bibit. Peternakan ayam bibit ini nantinya akan menghasilkan anak ayam atau Day Old Chick (DOC) komersial. DOC ini akan dipelihara oleh peternak untuk dibesarkan menjadi ayam broiler komersial. Ayam broiler merupakan jenis unggas dengan daya produktivitas tinggi yaitu dapat dipanen pada usia minggu ke-6 sampai minggu ke-7 dan bobot yang bertambah pesat yaitu sekitar 40 – 50 kali lipat dari bobot awalnya (± 1.5 kg). Hal ini yang membuat usaha ternak ayam dinilai sangat menguntungkan.
Pemeliharaan secara intensif harus dilakukan dalam usaha ternak ayam komersial. Pemeliharaan intensif dilakukan dengan fasilitas pemeliharaan dari segi perkandangan dan segi pakan yang diberikan untuk memenuhi sasaran pada tujuan produksi. Salah satu faktor pemeliharaan yang paling penting adalah manajemen kesehatan karena kesehatan merupakan landasan utama penentu kualitas dari sebuah peternakan. Manajemen kesehatan dilakukan dengan tindakan preventif dan tindakan kuratif. Tindakan preventif dilakukan untuk mencegah ternak terserang agen penyakit misalnya dengan pemberian vaksin. Sedangkan tindakakan kuratif merupakan tindakan pengobatan untuk menghilangkan agen penyakit.
besar yang sebenarnya diperlukan pada berbagai pengobatan inflamasi (Harmanto 2007).
Kortikosteroid yang digunakan pada ayam penelitian ini adalah Prednisone. Menurut Wissman (2006), Prednisone merupakan obat golongan kortikosteroid yang berfungsi sebagai anti-inflamasi dan bersifat imunosupresif, sedangkan pada unggas dapat mengatasi aspergillosis serta infeksi fungal lainnya. Pengawasan ketat diperlukan dalam penggunaan obat ini baik secara oral, topikal maupun parenteral. Namun kortikosteroid juga dapat menekan fungsi immunnologis dan mengaktifasi infeksi laten sehingga pada beberapa kasus kortikosteroid memberikan efek immunosupressi.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui efek dari kortikosteroid terhadap organ limfoid, yaitu timus, limpa, dan bursa Fabricius pada ayam broiler.
1.3 Manfaat Penelitian
Melalui penelitian ini diharapkan dapat diketahui efek dari pemberian kortikosteroid terhadap sistem immunitas ayam broiler.
1.4 Hipotesis
H0 : Tidak terdapat perbedaan gambaran histopatologi organ limfoid antara ayam
broiler yang diberikan perlakuan (kortikosteroid) dengan ayam broiler kontrol negatif (tidak diberi kortikosteroid).
H1 : Terdapat perbedaan gambaran histopatologi organ limfoid antara ayam
2. TINJAUAN PUSTAKA
2.1 Ayam Broiler
Ayam broiler adalah jenis unggas yang memiliki laju pertumbuhan yang berbeda, pertambahan berat badan tiap minggu yang berbeda serta memiliki besar konsumsi pakan yang terus meningkat seiring dengan meningkatnya berat badan (North et al. 1990). Ayam broiler yang baik adalah ayam broiler yang pertumbuhanya cepat, warna bulu putih, tidak terdapat bulu-bulu berwarna gelap, serta memiliki ukuran dan bentuk tubuh yang seragam (Mountney 1978). Ayam broiler dipasarkan pada bobot hidup antara 1.3-1.6 kg per ekor ayam yang dilakukan pada umur ayam 5-6 minggu karena ayam broiler yang terlalu berat akan sulit dipasarkan. Bahkan bila dipelihara sampai 8 bulan beratnya dapat mencapai 2 kg (Rasyaf 2008).
Pertambahan bobot badan merupakan salah satu ukuran yang digunakan untuk mengukur pertumbuhan. Menurut Rose (1997), pertumbuhan meliputi peningkatan ukuran sel-sel tubuh akan peningkatan sel-sel individual dimana pertumbuhan itu mencakup empat komponen utama yaitu adanya peningkatan ukuran otot, peningkatan total lemak tubuh dalam jaringan adiposa dan peningkatan ukuran bulu, kulit dan organ dalam. Ciri dari ayam broiler ini adalah ukuran badan relatif besar, padat, kompak, dan berdaging penuh. Jumlah telur sedikit, bergerak lambat, tenang, dan lebih lambat mengalami dewasa kelamin. Adapun jenis ayam broiler ini antara lain Brahma Putra, Cochin China, Cornish dan Sussex (Sudaryani dan Santosa 2002).
2.2 Program Vaksinasi
Penyakit merupakan masalah besar yang cukup potensial yang telah mengubah industri peternakan ayam untuk mengembangkan vaksin. Industri vaksin berperan dalam pemeliharaan dan pengawasan kesehatan ayam. Program vaksinasi termasuk usaha pencegahan masuknya infeksi penyakit, selain itu jika dilihat dari kesehatan manusia, manusia akan terhindar dari residu obat yang terdapat dalam daging ayam yang pernah diberi obat akibat terpapar penyakit (Appleby2004).
Menurut Leeson dan Summers (2000) vaksin berfungsi untuk menstimulasi sistem imun unggas tanpa menyebabkan tanda-tanda penyakit yang jelas. Banyak diantaranya berfungsi untuk melindungi unggas dari infeksi virus, beberapa jenis vaksin lainnya telah dikembangkan untuk perlindungan terhadap cekaman bakteri tertentu (lebih sering disebut bakterin dibanding vaksin) dan juga untuk koksidiosis. Program vaksinasi bagi peternak bertujuan untuk melindungi unggas muda dan dewasa dari infeksi, selain itu vaksinasi juga bertujuan untuk mengoptimumkan antibodi maternal pada anak ayam broiler. Pada saat sejumlah dosis vaksin diberikan, unggas akan memproduksi antibodi yang dilepaskan oleh bursa Fabricius tergantung usia dari unggas tersebut.
Vaksin yang digunakan pada unggas dibedakan menjadi 2 tipe, yaitu vaksin hidup dan vaksin inaktif. Vaksin inaktif terdiri dari antigen yang dipekatkan dikombinasikan dengan minyak emulsi atau adjuvant alumunium hidroksida. Vaksin jenis ini memberikan ketahanan tubuh yang lebih lama, terutama jika dikombinasikan dengan vaksin hidup. Vaksin ini dapat berisi dua atau tiga jenis antigen dan diberikan secara parenteral. Sedangkan vaksin hidup biasanya hanya berisi satu jenis antigen dan diaplikasikan secara aerosol, melalui air minum, dan dalam beberapa kasus dapat diberikan secara injeksi. Antigen dapat berupa penyakit yang telah dilemahkan sehingga tingkat virulensinya rendah (Jordan 1994).
program vaksinasi sedangkan imunosupresi dapat merusak organ kekebalan sehingga menghambat program vaksinasi.
Program vaksin yang umum diberikan untuk ayam broiler antara lain vaksin Marek’s disease yang diberikan kepada ayam umur 18 hari masa embrio secara in-ovo. Vaksin Newcastle disease dan Infectious Bronchitis yang diberikan pada ayam umur 1 hari atau setelah menetas dengan rute spray cabinet. Vaksin ND dan IB kembali diberikan pada usia 14 hari melalui minuman. Faktor-faktor yang perlu diperhatikan dalam pemberian vaksin adalah kejadian penyakit di daerah tersebut, ketersediaan vaksin, periode stres, kondisi iklim, dan faktor lain yang mempengaruhi program vaksinasi (North et al. 1990).
2.3 Respon Kekebalan Unggas
Tubuh melindungi dirinya sendiri melawan benda asing, seperti bakteri dan virus, melalui aksi sistem kekebalan tubuh. Masuknya virus dan bakteri merangsang aksi dari limfosit (sel darah putih) dan makrofag (scavangers) dalam tubuh. Limfosit diproduksi dan diatur oleh bursa (sel B) dan timus (sel T). Sel B bermigrasi ke limpa dan limfonodus, tempat antigen menstimulasi antibodi, akivitas ini merujuk pada kekebalan humoral. Timus yang ditemukan di leher ayam memproduksi sel T dibawah perintah hormon. Dewasa kelamin sangat menentukan produksi sel T. Sel T bekerja sama dengan makrofag untuk memusnahkan bakteri, virus dan benda asing lainnya. Aksi sel T tersebut merujuk pada kekebalan seluler (Leeson dan Summers 2000).
antigen yang berikutnya akan mengaktivasi sel-sel tersebut untuk tahap proses kekebalan (Leeson dan Summers 2000).
Bangsa burung memproduksi tiga jenis antibodi, yaitu IgM, IgG, dan IgA. Respon antibodi primer dimulai dengan perkembangan antibodi IgM. Setelah itu IgG dan IgA diproduksi. Walaupun IgG unggas dan mamalia memiliki fungsi biologi yang mirip, namun IgG unggas memiliki pasangan yang lebih panjang dibandingkan milik mamalia dan tidak memiliki engsel molekul yang dikodekan. Sehingga IgG unggas lebih sering disebut dengan IgY. IgA berperan dalam kekebalan lokal di saluran respirasi dan pencernaan. Pada unggas IgA diangkut ke hati kemudian disimpan di empedu (Schultz 1999).
Jaringan limfomieloid berkembang dari epitelial kubus sebaris (bursa Fabricius dan timus) atau mesenkim (limpa, limfonodus, dan sumsum tulang) yang didiami oleh sel-sel haematopoietik. Pada organ limfoid pusat, sel stem haematopoietik memasuki bursa atau timus dan berkembang menjadi sel imunokompeten B dan T. Sel-sel imun yang telah dewasa memasuki sirkulasi dan mendiami organ limfoid perifer, diantaranya limpa, limfonodus, dan usus, bronkhus dan jaringan limfoid yang bergabung dengan kulit (Davison 2003). Menurut Aughey dan Frye (2001), sistem limfoid Aves terdiri dari limpa, timus, nodul lokal di dinding pembuluh dan mukosa limfatik serta bursa Fabricius
2.3.1 Bursa Fabricius
Glick (2000) menyebutkan bahwa pertumbuhan bursa Fabricius dapat dipelajari dalam tiga bentuk. Pertama pertumbuhan yang cepat dari ayam baru menetas sampai tiga atau empat minggu. Kedua, periode plateu selama lima atau enam minggu berikutnya. Ketiga, regresi yang terjadi sebelum pematangan seksual.
Pertumbuhan maksimum bursa Fabricius dicapai saat ayam berumur 4-12 minggu dan mengalami regresi secara lengkap pada waktu mencapai kematangan seksual yaitu pada umur 14 – 20 minggu. Pada tahap ini bursa akan mengkerut, terjadi pembentukan jaringan ikat lebih intensif, deretan epitel menjadi berlipat-lipat, parenkimnya digantikan dengan jaringan lemak dan sel-sel limfoid di dalam folikel limfoid digantikan oleh kista (Riddel 1987).
Riddel kembali mengungkapkan struktur bursa Fabricius adalah permukaan dalamnya terdiri dari lipatan longitudinal (plika) besar dan kecil. Lipatan yang besar mencapai keseluruhan dari panjang lumen bursa sedangkan lipatan yang kecil tidak mencapai lumen. Lipatan-lipatan ini terdiri dari folikel bursa dan di bawahnya terdapat matriks jaringan ikat, dari lipatan bursa melalui lumen untuk tiap folikel yang disebut lumen bursa. Jumlah total lipatan mukosa pada bursa yang matang atau dewasa sekitar 10-15 plika (Cross 1987).
Menurut Tizard (1987) bursa adalah organ limfoid primer yang fungsinya sebagai tempat pendewasaan dan diferensiasi bagi sel dari pembentuk antibodi. Karena itu sel ini disebut sel B. Di samping itu, bursa juga berfungsi sebagai organ limfoid sekunder yaitu, dapat menangkap antigen dan membentuk antibodi. Bursa juga mengandung sebuah pusat kecil sel T tepat di belakang lubang salurannya.
oleh makrofag dan sel raksasa. Infeksi jamur jarang ditemukan. Peradangan gabungan heterofil, limfosit, sel plasma, makrofag, dan sel raksasa dapat ditemukan pada infeksi jamur. Sedangkan infeksi protozoa akan menyebabkan bursa Fabricius edema. Paparan toxin dapat menyebabkan deplesi limfositik dan limfositolisis. Malnutrisi dan kekurangan vitamin A menyebabkan atropi bursa. Neoplasma atau limfosarkoma pada unggas diinduksi oleh retrovirus (Schmidt 2003).
Gambar 2 Bursa Fabricius: (1) lumen, (2) pseudostratified columnar epitelial, (3) folikel, dan (4) muskularis (sumber: Nassar 2008).
2.3.2 Timus
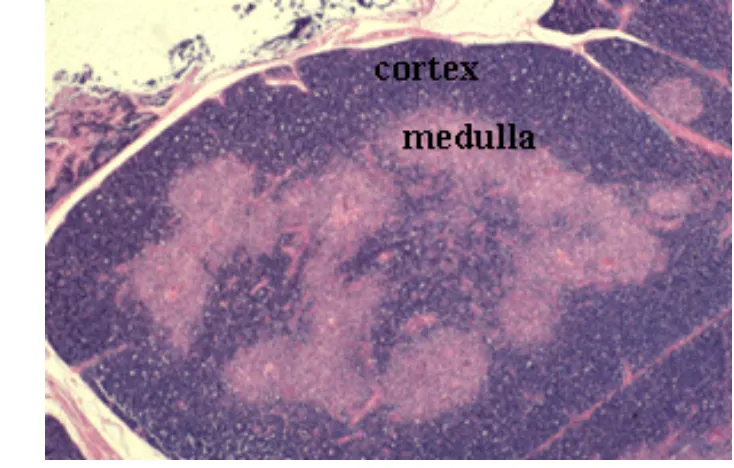
Tizard (1987) mengungkapkan bahwa timus tediri dari kortex dan medula. Korteks terdiri dari limfosit dan epitel retikulum. Limfosit T (thymocytes) yang telah meninggalkan sumsum tulang di bagian organ imunitas yang kompeten telah bermigrasi dan menempati korteks. Pada titik ini, limfosit T telah terbagi menjadi sel imun yang jauh lebih kompeten. Pada beberapa bagian lobus akan tampak kegelapan akibat populasi dari sel-sel ini. Sedangkan di dalam medula terdapat benda bulat yang dikenal sebagai badan timus (korpuskulus Hassal) yang fungsinya tidak diketahui. Benda ini mengandung keratin dan mungkin sebagai petunjuk adanya kegagalan keratinisasi oleh sel epitelial. Penyediaan darah ke timus berasal dari arteri yang masuk melalui jaringan ikat pembatas dan menjulur sebagai arteriol sepanjang pertemuan pertemuan kortiko-medula. Kapiler yang terjadi dari arteriol ini memasuki korteks dan melingkar kembali ke medula.
Pada hewan umur muda, timus bersifat sangat aktif yang secara normal mengalami involusi menjelang pubertas dan bertambahnya umur. Proses involusi ditandai dengan berkurangnya secara bertahap limfosit terutama di daerah korteks, pembesaran dari sel-sel epitel retikuler dan parenkim diganti oleh sel lemak. Pada hewan dewasa, timus terdiri dari jalur-jalur tipis parenkim di mana banyak sel-sel epitel retikuler membesar yang dikelilingi jaringan lemak (Dellman 1989).
Gambar 3 Organ timus terdiri medula dan korteks yang dibungkus oleh kapsula. Setiap lobus timus dihubungkan oleh trabekula (sumber: Bellham 2011).
2.3.3 Limpa
Limpa bangsa burung berbentuk bulat, berstruktur merah kecoklatan yang berada di lambung bagian kanan. Perbedaan dengan limpa mamalia adalah dari struktur anatomi dan fungsinya. Limpa pada ayam memiliki kapsul jaringan ikat yang tebal dan kerangka yang tersusun atas sel retikular. Pulpa merah dan pulpa putih melapisi bagian limpa dengan jumlah yang sama. Pulpa mengisi 80-90% bagian limpa dan sisanya merupakan jaringan penghubung. Pulpa putih membaur dan tidak tampak jelas batas-batasnya. Pulpa putih terdiri dari sel limfoid yang berakumulasi di ujung cabang arteri limpa. Pulpa merah termasuk sinus venosus dan jaringan spons terdiri dari limfosit, sel retikular, makrofag, sel plasma, dan sel darah merah. Perbedaan pulpa merah dan pulpa putih pada ayam kurang jelas jika dibandingkan dengan mamalia. Fungsi dari limpa pada unggas adalah (a) memfagositosis sel darah merah oleh makrofag di pulpa merah, (b) limfositpoiesis di pulpa putih, dan (c) menyerap antigen serta memproduksi antibodi oleh sel limfoid di pulpa merah dan putih. Hal ini dapat dikatakan limpa sebagai gudang penyimpanan darah (Herenda 1996).
ekstraseluler limpa sangat kompleks, dengan setiap bagian memiliki bagian spesifik yang berkontribusi dalam proses adhesi dan migrasi sel-sel leukosit. Sel limfoid dan sel non-limfoid dapat dikenali oleh pulpa merah. Terdapat banyak makrofag pada pulpa merah. Sedangkan sel-sel non-limfoid seperti heterofil tersebar di sinus pulpa merah. Sturkie (2000) berpendapat pulpa putih terdiri atas 3 daerah, yaitu PALS (periarteoral lymphatic sheath), pusat germinal, dan daerah periellipsoid white pulp (PWP). Arteri pusat yang masuk ke PWP menjadi penicilliform capillary (PC). Daerah PC dikelilingi capillary sleeve (CS). CS disulam oleh ellipsoid-associated cell (EAC) yang mengikat beragam substansi yang memasuki CS melalui stomata oleh sel endothelial dari daerah PC. Pada unggas daerah limpa terdiri dari CS yang diselaputi EAC beserta sel B dan makrofag.
Limpa memiliki reaksi dengan antigen. Antigen yang masuk secara intravena akan dijerat paling tidak sebagian, di dalam limpa yang diambil oleh makrofag baik yang terdapat di zona pembatas maupun yang membatasi sinusoid pulpa merah. Sel ini membawa antigen ke folikel primer dalam pulpa putih, setelah itu sel penghasil antibodi akan bermigrasi. Sel penghasil antibodi ini menempati zona pembatas dan pulpa merah, dan di daerah inilah produksi antibodi ini pertama kali ditemukan. Pembentukan pusat germinal juga terjadi dalam folikel primer dalam beberapa hari, walaupun hal ini tidak langsung berkaitan dengan produksi antibodi. Pada hewan yang sudah memiliki antibodi yang bersirkulasi, penjeratan antigen oleh sel dendrit dalam folikel sekunder menjadi penting. Seperti halnya pada tanggap kebal primer, sel penghasil antibodi berpindah dari folikel ini menuju ke pulpa merah dan zona pembatas, tempat sebagian besar produksi antibodi berlangsung, walaupun sebagian antibodi bisa juga diproduksi di dalam folikel sekunder yang hiperplastik (Tizard 1987).
anemia hemolitik dengan eritrosit yang mengalami retensi dalam pulpa merah. Pembesaran limpa dengan berbagai alasan cenderung berakibat thrombosis dan infark. Adanya diskret pada nodul yang muncul saat permukaan limpa diinsisi merupakan indikasi dari hiperplasia limfoid benign nodular (Carlton dan McGavin 1995).
Menurut Schimidt et al. (2003) penyakit viral yang sering menyerang organ limpa unggas adalah Avian Polyomavirus, Herpesvirus, dan Avipoxvirus. Akibat agen ini, limpa unggas mengalami pembesaran atau splenomegali. Ayam merupakan reservoir terbesar Salmonella khususnya Salmonella thypimurium yang menyebabkan splenomegali dan infiltrasi limfosit, makrofag, dan heterofil. Penyakit degeneratif yang biasa menyerang limpa adalah amiloidosis. Hal ini disebabkan substansi protein yang bersifat patologis dan menjadi deposit di jaringan serta organ. Umumnya limpa akan tampak pucat dan padat jika diinsisi. Sedangkan karsinoma metastatik jarang ditemukan pada organ ini.
Gambar 4 Limpa ayam: (1) kapsula, (2) pulpa merah, (3) pulpa putih, (4) arteri, dan (5) nodul limfatik (sumber: Nassar 2008).
2.4 Kortikosteroid
dan tingkah laku. Glukokortikoid dan mineralkortikoid merupakan jenis dari kortikosteroid. Glukokortikoid contohnya kortisol berfungsi untuk mengatur metabolisme karbohidrat, lemak, dan protein. Selain itu, kortisol juga berperan sebagai anti inflamasi dengan mencegah pelepasan phospholipid, mengurangi kerja eosinofil dan beberapa mekanisme lainnya. Sedangkan mineralkortikoid contohnya aldosteron yang mengatur kadar air dengan menaikkan sodium di ginjal (Kansky et al. 2000).
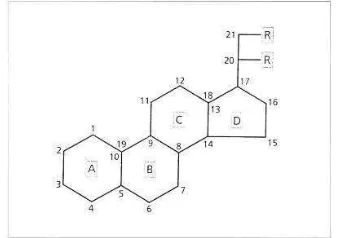
Kansky juga mengungkapkan struktur dasar kortikosteroid terdiri dari 21 cincin atom-karbon sterol. Aktivitas dari kortikosteroid meningkat dengan adanya ikatan tak jenuh antara dua atom karbon pertama. Kortikosteroid yang pertama kali dibuat untuk kepentingan klinis tidak mengandung halogen. Halogenisasi dari struktur dasar steroid posisi 9 alpha tidak hanya dapat meningkatkan aktivitas tapi juga meningkatkan efek samping.
Menurut Suherman (1987) kortikosteroid bekerja dengan mempengaruhi kecepatan sintesis protein. Molekul hormon memasuki sel jaringan yang responsif melalui membran plasma secara difusi pasif, kemudian bereaksi dengan reseptor-steroid. Kompleks ini mengalami perubahan konformasi, lalu bergerak menuju nukleus dan berikatan dengan kromatin. Ikatan ini menstimulasi transkripsi RNA dan sisntesis protein spesifik. Induksi sintesis protein ini merupakan perantara efek fisiologis steroid.
Gambar 5 Konfigurasi dasar kortikosteroid (sumber: Kansky 2000)
anterior untuk memproduksi ACTH, yang kemudian merangsang korteks adrenal untuk menseksresikan hormon glukokortikoid. Glukokortikoid dalam tubuh diantaranya akan mempengaruhi organ hati, otot, lemak dan limfosit (Bowen 2006).
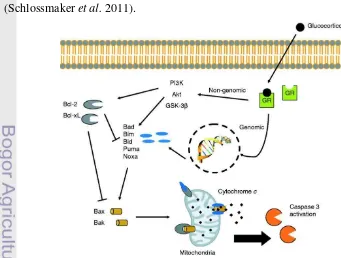
Glukokortikoid menyebabkan deplesi limfosit melalui mekanisme apoptosis (programme cell death). Prinsip dari mekanisme ini adalah reseptor glukokortikoid yang terdapat pada sitoplasma sel akan aktif saat menempel dengan ligan. Saat berikatan, dalam sel akan terjadi peristiwa beruntun yang melibatkan beberapa senyawa protein yang akhirnya akan menyebabkan sel mengalami apoptosis. Peristiwa ini disebut cascade. Reseptor yang berikatan dengan ligan akan menempuh 2 jalan, yakni genomik dan non-genomik. Genomik terjadi saat ikatan reseptor-ligan merangsang gen dalam sel untuk memproduksi senyawa pro-apoptosis yang kemudian akan bereaksi dalam membran mitokondria. Sitokrom akan keluar dari mitokondria dan mengaktivasi enzim caspase yang akan menginduksi apoptosis. Sedangkan jalur non-genomik terjadi tanpa ada rangsangan perubahan gen. Namun pada mekanisme ini diketahui terdapat protein Bcl-2 dan Bcl-xL yang merupakan senyawa anti-apoptosis yang dalam keadaan tertentu akan menghambat kerja protein pro-apoptosis (Schlossmaker et al. 2011).
2.4.1 Terapi Kortikosteroid dan Efeknya
Kortikosteroid merupakan derivat dari kolesterol, termasuk Prednisone, Prednisolone, dan Methylprednisolone. Agen inflamasi poten ini menimbulkan efek yang bervariasi yaitu mereduksi jumlah dan aktivitas dari sel-sel sistem imun. Senyawa kortikosteroid digunakan untuk terapi anti-inflamasi (Kuby 1992).
Suherman (1987) berpendapat bahwa penggunaan klinik kortikosteroid sebagai anti inflamasi merupakan terapi paliatif, dalam hal ini penyebab penyakit tetap ada hanya gejalanya yang dihambat. Sebenarnya hal inilah yang menyebabkan obat ini banyak digunakan untuk berbagai penyakit, bahkan sering disebut life saving drug, tetapi juga kadang-kadang dapat menimbulkan reaksi yang tidak diinginkan. Karena gejala inflamasi ini sering digunakan sebagai dasar evaluasi terapi inflamasi, maka pada penggunaan glukokortikoid kadang-kadang terjadi masking effect, dari luar penyakit nampak sudah sembuh tetapi infeksi di dalam dapat terus menjalar.
Salah satu indikasi klinis utama dari kortikosteroid adalah efek anti inflamasinya. Kortikosteroid memiliki kemampuan untuk memblok enzim phospolipase, yang menimbulkan reaksi pembentukan prostaglandin, mediator utama dari respon imun. Kortikosteroid juga menjaga sel dari trauma inflamasi dengan beberapa mekanisme, diantaranya menstabilkan membran sel untuk mencegah perombakan, menstabilkan membran lisosom sehingga tidak melepaskan enzim rasa sakit, menghentikan sintesis histamin, menghambat sintesis interleukin, dan mengurangi proses eksudasi (Wanamaker dan Massey 2004).
Efek samping lokal penggunaan kortikosteroid, antara lain atropi kulit, eritema persisten, teleangiektasia, papula, dan pustula, steroid acne, gluteal granuloma, hipertrichosis, perubahan pigmentasi, dan alergi. Sedangkan efek samping sistemiknya adalah ketidakseimbangan elektrolit, diabetes steroid, peningkatan katabolisme protein, hipertensi arteri, dan osteoporosis (Kansky 2000).
berikatan pada reseptor dalam sitosol. Kortikosteroid juga dapat mereduksi kemampuan makrofag dan netrofil untuk memfagositosis benda asing. Efek inilah yang memberikan kontribusi dalam aksi anti-inflamasi kortikosteroid. Selain itu, kortikosteroid juga mereduksi kemotaksis, hal inilah yang membuat beberapa sel inflamasi tertarik oleh aktivasi sel TH. Ekspresi dari molekul MHC II dan IL-1
yang diproduksi oleh makrofag otomatis juga akan tereduksi. Akhirnya kortikosteroid juga akan menstabilisasi membran lisosom dari leukosit, sehingga terjadi penurunan level dari enzim lisosom dilepaskan pada situs inflamasi (Kuby 1992).
Forbes dan Altman (1998) berpendapat bahwa pada unggas kortikosteroid dapat menjadi terapi untuk lesio polifolikuler. Lesi ini mengakibatkan pruritus. Pemberian kortikosteroid atau NSAID, agen inflamasi dapat menghilangkan pruritus. Sedangkan Tully (2000) berpendapat pemberian obat topikal pada unggas harus diwaspadai dan tidak boleh terlalu banyak pemberiannya. Obat ini dapat melekat di bulu dan akan termakan oleh unggas saat unggas melicinkan bulunya dengan paruh sehingga berdampak toksisitas. Kortikosteroid topikal perlu diwaspadai penggunaannya. Banyak dilaporkan terjadi kematian setelah penggunaan kortikosteroid.
Prednisolone, salah satu golongan kortikosteroid yang digunakan untuk penyakit rematik. Dosis rendah Prednisolone dapat menyebabkan kerusakan persendian. Efek paling serius paparan kortikostreoid adalah penekanan pitutari-adrenal. Kelenjar adrenal akan mengalami atropi lalu kehilangan kemampuan untuk memproduksi kortikosteroid alami. Tubuh tidak akan dapat bertahan menghadapi stres sehingga tubuh akan selalu berada di bawah cekaman. Anti-inflamasi kortikosteroid menurunkan fungsi imun. Respon infeksi akan meningkat seiring dengan berkurangnya jumlah limfosit. Berbagai infeksi seperti tuberkulosis akan mudah menyebar bahkan sebelum terdiagnosa (Thorp 2008).
2.4.2 Residu Hormon Steroid pada Manusia
eksogenus). Steroid eksogenus mengandung ester dari steroid endogenus, contohnya estradiol benzoat dan testosteron propionat. Senyawa-senyawa ini akan masuk ke tubuh manusia melalui makanan. Steroid yang terkonsumsi manusia memiliki kecenderungan akan menganggu produksi endokrin. Mengkonsumsi daging yang terpapar senyawa ini meningkatkan level hormon dalam tubuh manusia. Akumulasi steroid eksogenus dalam tubuh akan berselisih dengan steroid endogenus dalam 3 cara. Pertama, aktivitas biologis steroid eksogenus akan lebih kuat dibanding steroid endogenus. Kedua, steroid eksogenus dimetabolis secara berbeda, dan ketiga, steroid eksogenus akan memberikan efek berbeda dibanding steroid endogenus (Zeliger 2011).
Hormon steroid diberikan pada ayam dengan tujuan mempercepat pertumbuhan dan perkembangan tubuh. Selain itu hormon ini juga dapat meningkatkan massa otot ayam sebelum disembelih. Hal ini membantu peternak untuk meningkatkan keuntungan dan mempercepat panen ayam broiler tanpa mengeluarkan banyak biaya. Namun kandungan hormon steroid tersebut masih terdapat pada daging ayam bahkan setelah proses pemasakan, artinya saat mengkonsumsi, manusia akan terpapar oleh hormon ini dan menimbulkan efek negatif pada tubuh konsumen (Ankeny 2011).
Berdasarkan Undang-undang Republik Indonesia nomor 18 tahun 2009 tentang peternakan dan kesehatan hewan Pasal 58 ayat 1 menyebutkan bahwa dalam rangka menjamin produk hewan yang aman, sehat, utuh, dan halal, Pemerintah dan Pemerintah Daerah sesuai kewenangannya melaksanakan pengawasan, pemeriksaan, pengujian, standardisasi, sertifikasi, dan registrasi produk hewan.
3. METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Fasilitas Kandang Percobaan FKH IPB, Laboratorium Histopatologi, dan Laboratorium Photo, Bagian Patologi Departemen Klinik, Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Waktu penelitian berlangsung dari bulan September 2009 sampai dengan bulan Februari 2010.
3.2 Alat dan Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah sebagai berikut: 1. 30 ekor ayam broiler berumur 1 hari (DOC).
2. Bahan imunosupressan kortikosteroid yaitu Prednisone (3 mg/Kg BB) (Jamin 2011).
3. Vaksin Newcastle Disease (ND) strain La-Sota dan vaksin Gumboro (IBD) yang merupakan vaksin aktif
4. Vitamin, antibiotik, dan ransum dari produk komersil serta air yang diberikan secara ad libitum
5. Kebutuhan sanitasi kandang, diantaranya air bersih isi ulang, deterjen, insektisida, formalin 10%, dan enilconalone 15 % konsentrasi (150 g/L) sebagai fungisida.
6. Sekam
7. Bahan nekropsi dan pembuatan preparat histopatologi, yaitu larutan buffer netral formalin (BNF) 10%, alkohol dengan konsentrasi bertingkat (70%, 80%, 90%, alkohol 95%, dan alkohol absolut), larutan penjernih (xylol), parafin granul histoplast dengan titik leleh 56-57 0C, pewarna Meyer’s Hematoksilin, Eosin dan lithium karbonat.
Peralatan yang digunakan dalam penelitian ini adalah sebagai berikut: 1. Alat pemeliharaan ayam seperti kandang, timbangan, dan syringe
3. Alat pembuatan preparat histopatologi Autotechnic Tissue Processor, mikrotom, paraffin embedding console, tissue cassette, waterbath, pisau mikrotom, gelas objek, gelas penutup, inkubator, spidol dan label.
4. Mikroskop cahaya untuk mengamati preparat histopatologi, digital eye piece camera beserta seperangkat komputer untuk mengambil gambar jaringan
5. Software Image J® for Microsoft Windows® untuk menghitung dan mengukur jaringan.
3.3 Metode Penelitian
3.3.1 Tahap Persiapan Kandang
Langkah-langkah persiapan kandang sebelum dimulai penelitian, adalah: 1. Kandang disemprot dengan menggunakan air bersih dan dibersihkan dari
limbah ternak sebelumnya. Kegiatan ini dilakukan sebanyak 2 kali agar kandang benar-benar bersih.
2. Kandang disemprot deterjen dan insektisida dengan komposisi 200 l air ditambah insektisida 500 ml dan 1 kg deterjen.
3. Kandang disemprot formalin 10% dengan komposisi 180 l air ditambah 20 l formalin teknis.
4. Pengapuran lantai dan dinding kandang selama 3-5 hari.
5. Sekam ditaburkan dengan ketebalan 7-12 cm kemudian disemprot fungisida enilconalone 15% dengan konsentrasi 150g/L untuk mencegah penyimpangan hasil penelitian akibat infeksi penyakit sebelum ayam dimasukkan.
3.3.2 Pengelompokan Ayam Penelitian
diberikan pakan komersil dan minum secara ad libitum yang diganti setiap pagi dan sore hari.
Ayam broiler berjumlah 30 ekor dibagi menjadi 2 kelompok perlakuan, yaitu kelompok kontrol (CC0) dan kelompok perlakuan (CC2) yang diberikan Prednisone 3 mg/kg BB secara per oral (Jamin 2011) setiap hari mulai dari umur ayam 2 minggu. Setiap kelompok terdiri dari 15 ekor ayam. Mulai dari umur 1 minggu sampai 6 minggu, sebanyak 3 ekor dari masing-masing kelompok dinekropsi setiap minggunya.
3.3.3 Nekropsi dan Pengumpulan Sampel Organ
Mulai dari minggu kedua sampai minggu keenam sebanyak 3 ekor ayam diambil dari kandang secara acak menurut kelompok per minggunya. Sebelum dinekropsi, ayam dikorbankan dengan cara disembelih. Nekropsi dilakukan untuk mengamati perubahan patologi (PA) dan mengambil organ untuk selanjutnya diamati secara histopatologi (HP). Organ yang diambil adalah timus, limpa, dan bursa Fabricius. Organ-organ tersebut dimasukkan ke dalam pot plastik yang berisi larutan BNF 10% dan diberi label. Setelah organ terfiksasi sempurna di dalam larutan BNF 10% selama 24 jam maka organ siap dijadikan preparat histopatologi.
3.3.4 Pembuatan Preparat Histopatologi
Organ timus, limpa, dan bursa Fabricius yang telah difiksasi dalam larutan BNF 10% dipotong setebal 0.5 cm lalu dimasukkan ke dalam tissue cassette kemudian direndam kembali ke dalam larutan BNF 10%. Proses selanjutnya adalah dehidrasi dengan cara merendam organ berturut-turut ke dalam alkohol bertingkat 70%, 80%, 90%, alkohol absolut I dan alkohol absolut II. Tahapan selanjutnya adalah clearing atau penjernihan dengan xylol kemudian organ direndam dalam paraffin I dan paraffin II. Proses tersebut berjalan secara otomatis dalam alat Sakura® tissue processor.
yang sudah mulai mengeras kembali ditambahkan paraffin cair hingga penuh dan dibiarkan sampai beku kemudian dilepaskan dari cetakan. Selanjutnya dilakukan pemotongan jaringan (sectioning) setebal 5µm dengan menggunakan mikrotom. Hasil potongan berupa pita (ribbon) kemudian diletakkan di atas permukaan air pada waterbath dengan suhu 45°C agar lipatan paraffin hilang. Sediaan diangkat dengan menggunakan object glass yang telah diberikan albumin agar organ merekat sempurna. Sediaan diletakkan dalam inkubator bersuhu 60°C selama satu malam.
Sediaan yang sudah berada dalam inkubator selama semalam selanjutnya dideparafinisasi dalam xylol sebanyak dua kali. Proses selanjutnya adalah rehidrasi dengan merendam sediaan dalam alkohol bertingkat mulai dari alkohol absolut sampai dengan alkohol 80% yang lamanya masing-masing 2 menit. Selanjutnya sediaan dibilas dengan air bersih lalu dikeringkan. Setelah kering maka sediaan siap memasuki proses pewarnaan. Sediaan organ timus, limpa dan bursa Fabricius dilakukan pewarnaan Hematoksilin Eosin (HE).
Pewarnaan HE dimulai dengan merendam sediaan dalam Mayer’s Haematoxylin selama delapan menit, sediaan dibersihkan dengan air mengalir selama 30 detik. Sediaan direndam dalam lithium karbonat selama 15-30 detik, dibersihkan kembali dengan air mengalir. Selanjutnya direndam dalam larutan Eosin selama 2 menit lalu dibersihkan dengan air mengalir hingga akhirnya dikeringkan. Setelah kering, sediaan dicelupkan ke dalam alkohol 95% dan alkohol absolut I masing-masing sebanyak 10 kali, direndam dalam alkohol absolut II selama 2 menit, xylol I selama 1 menit dan xylol II selama 2 menit. Sediaan ditutup dengan cover glass yang sudah diberikan perekat permount. Preparat didiamkan sampai perekat mengering.
3.3.5 Pengamatan Preparat Histopatologi
Pengamatan perubahan histopatologi atau respon organ limfoid dilakukan dengan cara:
yaitu Prednisone 3 mg/Kg BB dan korelasinya dengan pertambahan umur ayam.
2. Pembuatan foto mikrograf digital eye piece camera terhadap perubahan histopatologi pada organ limfoid. Pengamatan pada foto dilakukan dengan luas 2909.09 x 2327.27 µm2.
3. Pengamatan dilakukan dengan menyesuaikan pembesaran okuler dan objektif. Hal ini dilakukan dengan cara seperti yang tercantum pada tabel 2 dibawah ini.
4. Perhitungan jumlah sel dan pengukuran organ dilakukan dengan menggunakan software Image J® for Microsoft Windows®.
Tabel 1 Parameter Penelitian
No Organ Pembesaran Objektif Objek Pengamatan
1 Timus 4x Luas Korteks
Luas Medula
40x
Luas Total Timus Jumlah Limfosit 2 Bursa Fabricius 4x Panjang Plika Bursa
Lebar Plika Bursa 10x Jumlah Folikel Limfoid 40x Jumlah Limfosit
3 Limpa 10x
40x
Jumlah Pulpa Putih Jumlah Limfosit
3.3.6 Pengolahan Data
4. HASIL DAN PEMBAHASAN
Organ limfoid primer unggas terdiri dari timus dan bursa Fabricius sedangkan pada mamalia terdiri dari sumsum tulang. Limpa, limfonodus dan MALT (Mucosa-associated Lymphoid Tissue) termasuk dalam organ limfoid sekunder. Limfosit B mengalami pematangan di bursa Fabricius sedangkan limfosit T mengalami pendewasaan di timus. Limfosit dihasikan oleh organ limfoid primer segera memasuki peredaran darah lalu dikirim ke organ limfoid sekunder. Pada organ limfoid sekunder ini limfosit dijaga tetap hidup dan siap beradaptasi saat antigen datang (Elgert 2009).
Beberapa faktor diyakini dapat menghambat dan menurunkan sistem kekebalan tubuh. Saat sistem ini turun maka tubuh akan mudah terserang penyakit. Salah satunya adalah stres. Menurut Shini (2010) stres (sering digunakan untuk menyebut stresor atau respon stres) merupakan suatu kondisi tubuh dalam merespon infeksi akut maupun kronis. Stresor adalah faktor yang menimbulkan respon tersebut. Respon stres adalah mekanisme yang kompleks, dan mekanisme ini mempengaruhi perilaku, psikologis, metabolisme, dan reaksi imunologis tubuh demi beradaptasi dan bertahan pada lingkungan. Stresor yang digunakan dalam penelitian ini adalah kortikosteroid. Ayam broiler diberikan kortikosteroid untuk mengetahui status respon imun selama pertumbuhan.
4.1Perubahan Histopatologi pada Bursa Fabricius Akibat Pemberian Kortikosteroid
Hasil uji statistik T-student terhadap perbandingan tinggi dan lebar plika bursa Fabricius dapat dilihat pada Tabel 2.
Tabel 2 Perbandingan tinggi dan lebar plika bursa Fabricius (µm) antara kelompok kontrol (CC0) dengan perlakuan (CC2) (dalam luas 2909.09 x 2327.27 µm2).
Umur Ayam (minggu)
Tinggi Plika (µm) Lebar Plika (µm)
CC0 CC2 CC0 CC2
2 3025.87±1153.00a 2981.33±1074.40a 2214.40±332.89a 1376.20±321.90b 3 3235.74±630.36a 2238.11±339.51b 1680.00±272.55a 1216.00±292.42b 4 2961.81±958.61a 3623.33± 674.90a 1754.20±332.37a 1542.60±486.80a 5 3691.77±1276.00a 2961.44±705.56a 3691.77±1276.04a 1334.20±433.20b 6 2347.05±1476.00a 2788.78±990.14a 1528.50± 395.02a 1295.20± 295.00a
Keterangan: huruf superscript pada baris yang sama menunjukkan hasil yang berbeda nyata (P<0.05).
Hail uji statistik menunjukkan bahwa terdapat perbedaan nyata (P<0.05) antara tinggi plika kelompok kontrol dengan kelompok perlakuan setelah diberikan kortikosteroid selama 3 minggu. Sedangkan penghitungan lebar plika terdapat perbedaan yang nyata (P<0.05) antara kelompok kontrol dengan kelompok perlakuan pada umur 2, 3, dan 5 minggu. Kortikosteroid dapat menekan perkembangan bursa Fabricius, sehingga plika memendek. Plika bursa Fabricius pada kelompok yang diberikan kortikosteroid (CC2) dari umur 2, 3, 4, 5, dan 6 minggu memiliki lebar yang lebih kecil daripada kelompok kontrol (CC0). Pada kelompok perlakuan (CC2) tampak lebar plika cenderung mengecil sejalan dengan waktu pemberian kortikosteroid. Namun tinggi plika kelompok perlakuan (CC2) pada umur 4 minggu lebih tinggi dibandingkan kelompok kontrol (CC0) yang menunjukkan terdapat respon yang variatif. Variasi respon pada tinggi dan lebar plika dapat terjadi karena beberapa faktor yang mempengaruhi perkembangan ayam sehingga ayam tidak 100% seragam. Menurut Pastoret et al. (1998), faktor yang mempengaruhi perkembangan dan ukuran bursa Fabricius diantaranya genetik, agen infeksius, nutrisi, lingkungan, dan reseptor hormon.
plika yang lebih pendek daripada kelompok kontrol. Hal ini dapat disebabkan faktor bobot badan yang tidak sama antar kelompok. Semakin besar bobot badan ayam maka semakin besar pula ukuran bursa Fabriciusnya. Selain itu faktor umur dapat mempengaruhi perkembangan bursa Fabricius. Bursa Fabricius pada ayam yang berumur 3 minggu mengalami perkembangan yang pesat, umur 4-8 bursa Fabricius dalam kondisi statis, dan umur ayam di atas 8 minggu perkembangannya menurun. Oleh karena itu, kortikosteroid tidak mempengaruhi tinggi plika bursa Fabricius. Penelitian yang dilakukan Glick pada tahun 1957 dalam Taylor dan McCorkle (2009) menunjukkan bahwa terdapat hubungan antara perkembangan bursa dengan level hormon. Pemberian baik kortikosteroid maupun hormon androgen dapat menyebabkan regresi bursa Fabricius.
Parameter lain yang diamati adalah penghitungan jumlah folikel limfoid besar dan limfoid kecil bursa Fabricius. Withers et al. (2006) menyatakan terdapat dua macam folikel yang terbentuk, yakni folikel besar dan kolikel kecil setelah terjadi infeksi IBDV (Infectious Bursal Disease Virus) pada ayam muda. Folikel kecil memiliki batas korteks dan medula yang belum jelas sedangkan folikel besar berperan aktif dalam proliferasi limfosit B. Hasil uji satistik T-student terhadap jumlah folikel limfoid dapat dilihat pada Tabel 3 dan jumlah folikel keseluruhan pada bursa Fabricius dapat dilihat pada Tabel 4.
Tabel 3 Perbandingan jumlah folikel limfoid besar dan kecil bursa Fabricius kelompok kontrol (CC0) dengan perlakuan (CC2) (dalam satu plika). Umur
(minggu)
Jumlah Folikel Besar Jumlah Folikel Kecil
CC0 CC2 CC0 CC2
2 9.87±6.81a 11.67±5.52a 11.67±6.67a 18.70±10.37b
3 11.70±3.97a 11.30±4.15a 7.67±2.61a 11.33±4.70b
4 11.00±4.5a 9.53±3.31a 12.00±4.29a 19.10±7.87b
5 9.40±5.45a 7.80±2.18b 12.80±6.99a 19.73±15.74a
6 8.20±5.29a 9.00±2.73b 14.73±8.71a 12.73±7.38a
Keterangan: huruf superscript yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata (P<0.05).
yang disertai pemberian hormon steroid mengakibatkan peningkatan berat bursa Fabricius sebesar 50%. Hormon steroid dan imunisasi tersebut dapat merangsang pembentukan folikel limfoid sekunder (folikel besar). Kelompok kontrol ayam umur 5 dan 6 minggu menunjukkan hasil yang berbeda nyata dengan kelompok perlakuan. Namun jumlah folikel limfoid besar pada kelompok ayam umur tersebut lebih banyak daripada kelompok perlakuan. Hal ini menunjukkan bahwa kortikosteroid tidak memberikan pengaruh pada ayam umur 5 dan 6 minggu.
Penghitungan jumlah folikel limfoid besar menunjukkan hasil yang berbeda dengan jumlah folikel limfoid kecil. Hasil uji statistik menunjukkan bahwa terdapat perbedaan nyata (P<0.05) jumlah folikel limfoid kecil pada ayam kelompok kontrol dengan kelompok perlakuan umur 2, 3, dan 4 minggu. Sedangkan ayam umur 5 dan 6 minggu tidak memiliki perbedaan nyata antara kelompok kontrol dengan kelompok perlakuannya. Ayam umur 2, 3, dan 4 minggu kelompok perlakuan memiliki folikel limfoid kecil lebih banyak daripada kelompok perlakuan. Perkembangan folikel limfoid bursa Fabricius dimulai pada saat embrio memasuki umur 10 hari. Prekursor limfosit memasuki jaringan epitel lalu menembus membran yang kemudian akan berploriferasi di medula lalu memasuki korteks. Kumpulan prekursor limfosit tersebut membentuk folikel limfoid primer (kecil). Folikel limfoid ini akan terus tumbuh dan berkembang sampai ayam mencapai pertumbuhan optimum pada umur 7-13 minggu, yakni saat ayam mencapai dewasa kelamin (Klein dan Horejsi 1997). Jumlah folikel limfoid kecil kelompok kontrol yang lebih besar daripada kelompok perlakuan dapat mengindikasikan bahwa kortikosteroid tidak mempengaruhi jumlah folikel limfoid kecil pada ayam umur 2, 3, dan 4 minggu. Hal ini disebabkan pertumbuhan folikel limfoid saat umur tersebut dalam kondisi optimum.
Pemberian imunisasi (vaksin IBDV) saat umur ayam 11 hari menyebabkan timbulnya respon imun dari folikel limfoid primer yang semakin aktif untuk berubah menjadi folikel sekunder. Selain itu karena adanya pengaruh kortikosteroid yang dapat merangsang pembentukan folikel limfoid sekunder mengakibatkan jumlah folikel limfoid keseluruhan pada kelompok perlakuan lebih banyak daripada kelompok kontrol. Pemberian kortikosteroid pada ayam mengakibatkan peningkatan berat bursa Fabricius sebesar 50% (Graczyk 2003). Namun kelompok perlakuan (CC2) ayam umur 6 minggu jumlah folikel limfoid keseluruhan lebih kecil dibandingkan dengan kelompok kontrol (CC0) karena pada ayam umur ini secara alami perkembangannya mulai menurun (Taylor dan McCorkle 2009).
Tabel 4 Perbandingan jumlah folikel limfoid keseluruhan bursa Fabricius antara kelompok kontrol (CC0) dengan perlakuan(CC2) (dalam satu plika).
Umur (minggu) CC0 CC2
2 21.50±12.66a 30.33±14.55a
3 19.40±5.10a 22.60±6.35a
4 23.00±80a 28.60±8.07a
5 22.40±11.10a 27.50±14.53a
6 22.93±12.82a 21.73±8.25a
Keterangan: huruf superscript yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata (P<0.05).
Folikel limfoid primer ditemukan pada DOC namun folikel limfoid sekunder baru dapat dilihat pada ayam berumur 7 hari. Jumlah minimal folikel limfoid keseluruhan yang dapat ditemukan pada saat ayam baru menetas adalah 205±10.8 dan jumlah maksimal pada umur 17 minggu adalah 535±21.15 (Albogoghobeish 2003). Jumlah folikel limfoid keseluruhan pada bursa Fabricius dalam penelitian baik kelompok kontrol (CC0) maupun perlakuan (CC2) umur 2, 3, 4, 5, dan 6 minggu berkisar 194−303 folikel. Jumlah ini masih normal dalam perkembangan bursa Fabricius pada ayam umur 2. 3, 4, 5, dan 6 minggu.
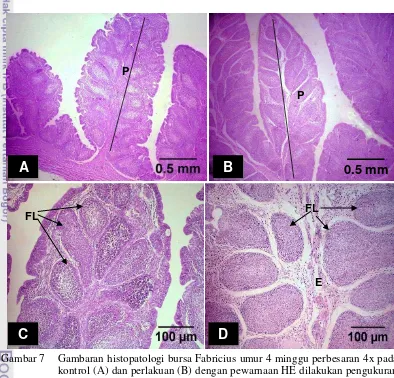
keseluruhan. Jumlah follikel limfoid keseluruhan kelompok perlakuan (D) cenderung lebih banyak daripada kelompok kontrol (C). Plika bursa yang diamati dengan perbesaran objektif 10x pada kelompok kontrol (C) menunjukkan jaringan muskularis yang lebih padat dibandingkan plika bursa kelompok perlakuan (D). Gambar histopatologi kelompok perlakuan (D) menunjukkan adanya edema atau akumulasi cairan pada jaringan interlobulernya sehingga membuat kepadatan jaringan intertisium bursa Fabricius berkurang.
Gambar 7 Gambaran histopatologi bursa Fabricius umur 4 minggu perbesaran 4x pada kontrol (A) dan perlakuan (B) dengan pewarnaan HE dilakukan pengukuran panjang dan lebar plika (P). Perhitungan jumlah folikel limfoid (FL) pada kontrol (C) dan perlakuan (D) dilakukan dengan perbesaran 10x. Edema (E) tampak pada kelompok perlakuan.
Parameter lain yang dapat diamati dari organ bursa Fabricius adalah jumlah limfosit. Limfosit B dihasilkan dan mengalami pematangan dalam folikel limfoid bursa Fabricius. Limfosit B berproliferasi di bagian korteks folikel limfoid. Limfosit B muda akan bermigrasi ke medula jika mendeteksi adanya antigen. Adanya antigen akan memicu pembentukan, pendewasaan limfosit B, dan
P
FL FL
E
A
B
C
D
0.5 mm
[image:43.595.112.506.231.609.2]produksi imunoglobulin (Williams 2011). Menurut Cheville (2006), edema merupakan akumulasi cairan di jaringan intertisial. Edema disebabkan 2 mekanisme, yaitu meningkatnya tekanan hidrostatis dalam darah atau menurunnya tekanan osmotik koloid dalam plasma darah. Edema biasanya ditemukan pada peradangan yang disertai meningkatnya jumlah sel radang dan kerusakan jaringan. Edema akibat proses homeostasis tubuh tidak disertai sel-sel radang dan kerusakan jaringan. Glukokortikoid dalam tubuh menyebabkan ekstravasasi cairan ke jaringan intertisial, sedangkan mineralkortikoid menyebabkan retensi cairan. Akumulasi cairan atau edema dapat terjadi akibat kerja hormon tersebut. Hasil uji statistik T-student terhadap perbandingan jumlah limfosit bursa Fabricius kelompok kontrol (CC0) dan perlakuan (CC2) dapat dilihat pada Tabel 5.
Tabel 5 Perbandingan jumlah limfosit bursa Fabricius kelompok kontrol (CC0) dengan perlakuan (CC2) (dalam luas 2909.09 x 2327.27 µm2).
Umur
(minggu) CC0 CC2
2 1164.30±148.95a 1111.20±163.11a
3 1058.80±132.54a 729.80±112.33b
4 1125.40±187.05a 762.80±159.96b
5 1403.90±213.56a 888.30±103.41b
6 1431.70±141.52a 903.10±178.25b
Keterangan: huruf superscript yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata (P<0.05).
Hasil uji statistik menunjukkan bahwa jumlah limfosit bursa Fabricius kelompok kontrol berbeda nyata (P<0.05) dengan kelompok perlakuan saat ayam berumur 3, 4, 5, dan 6 minggu. Saat ayam umur 2 minggu kelompok kontrol tidak berbeda nyata dengan kelompok perlakuan (P>0.05) namun kelompok kontrol tetap memiliki jumlah limfosit yang lebih banyak daripada kelompok perlakuan sama seperti ayam umur 3, 4, 5, dan 6 minggu. Limfosit B sangat dibutuhkan sebagai mekanisme pertahanan tubuh ayam usia muda karena ayam usia muda sangat rentan terhadap agen penyakit. Rendahnya jumlah limfosit B mengakibatkan antibodi tidak dapat diproduksi secara optimum. Steroid dapat menghambat perkembangan dan pendewasaan limfosit B (Male et al. 2006).
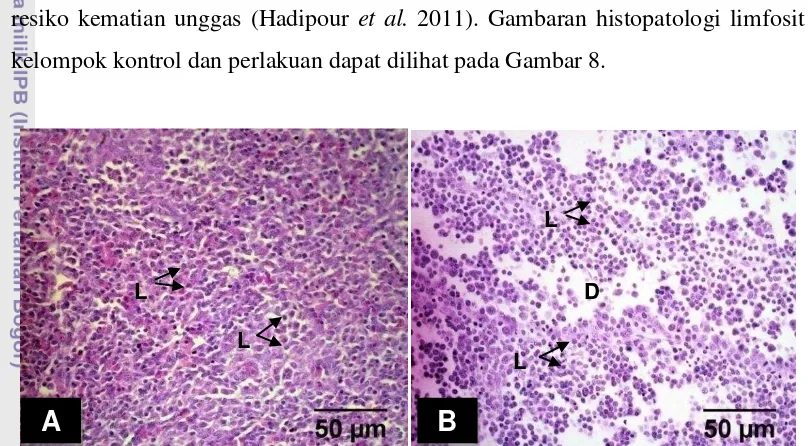
steroid juga dapat menghambat perlekatan interleukin pada limfosit B. Hal ini mengakibatkan limfosit B sulit menghasilkan antibodi (Roitt et al. 2001). Oleh karena itu kelompok ayam yang diberi kortikosteroid memiliki jumlah limfosit yang lebih sedikit daripada kelompok kontrol. Sekresi glukokortikoid akan mengakibatkan kematian limfosit. Lesio histopatologi akibat kematian limfosit tersebut akan berdampak pada bursa Fabricius. Bursa Fabricius akan mengalami imunosupresi sehingga limfosit dan folikel limfoid mengalami deplesi. Selain itu, efek stres dari glukokortikoid dapat menyebabkan atrofi organ limfoid. Kondisi imunosupresi tersebut membuat unggas mudah terpapar bakteri dan meningkatkan resiko kematian unggas (Hadipour et al. 2011). Gambaran histopatologi limfosit kelompok kontrol dan perlakuan dapat dilihat pada Gambar 8.
Gambar 8 Gambaran histopatologi bursa Fabricius umur 4 minggu perbesaran 40x pada kontrol (A) dan perlakuan (B) dengan pewarnaan HE menunjukkan adanya deplesi (D) limfosit (L) pada organ yang diberi kortikosteroid.
Gambar 7 menunjukkan kepadatan limfosit yang berbeda antara bursa Fabricius kelompok kontrol (CC0) dengan kelompok perlakuan (CC2). Limfosit bursa Fabricius kelompok kontrol (A) lebih padat daripada kelompok yang diberi kortikosteroid (B). Kortikosteroid menyebabkan deplesi pada limfosit bursa Fabricius. Beberapa faktor yang dapat menyebabkan deplesi limfosit adalah pemberian steroid, penyakit akut dan kronis akibat paparan virus, bakteri, jamur, infeksi parasit, bahan-bahan kimia yang mengandung toksin, malnutrisi, hipovitaminosis A, dan stres akibat manajemen kandang yang tidak baik (Doneley 2010).
A
B
L
L
L
L
[image:45.595.108.512.269.492.2]4.2Perubahan Histopatologi pada Timus Akibat Pemberian Kortikosteroid Pengamatan luas timus termasuk medula dan korteks dilakukan untuk mengetahui efek imunosupresi dari kortikosteroid. Hasil uji statistik T-student terhadap perbandingan luas medula dan korteks timus pada kelompok kontrol (CC0) dan perlakuan (CC2) dapat dilihat pada Tabel 6. Luas medula pada ayam umur 2 minggu kelompok kontrol memiliki perbedaan nyata dengan kelompok perlakuan (P<0.05). Ayam kelompok kontrol memiliki medula yang lebih luas daripada kelompok perlakuan. Namun pada ayam umur 3, 4, 5, dan 6 minggu luas medula kelompok kontrol tidak berbeda nyata dengan kelompok perlakuan. Secara umum medula kelompok perlakuan (CC2) lebih luas dibandingkan koelompok kontrol kecuali pada ayam umur 2 minggu.
Tabel 6 Perbandingan luas medula dan korteks timus (µm2) kelompok kontrol (CC0) dengan perlakuan (CC2) (dalam luas 2909.09 x 2327.27 µm2). Umur
(minggu)
Luas Medula (x1000µm2) Luas Korteks (x1000µm2)
CC0 CC2 CC0 CC2
2 26700± 249.37a 189.79± 30.11b 1199.36± 299.16a 688.96± 257.66a
3 283.62± 96.78a 545.86± 431.74a 1108.93± 389.13a 1559.99± 794.04a 4 488.99± 203.34a 793.47± 626.86a 1484.97± 482.34a 1887.77± 223.00a
5 390.2± 327.16a 722.26± 453.27a 1383.83± 784.69a 1725.03± 62.68a
6 353.51± 295.78a 537.26± 231.48a 1283.78± 754.31a 1438.2± 485.09a
Keterangan: huruf superscript yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata (P<0.05).
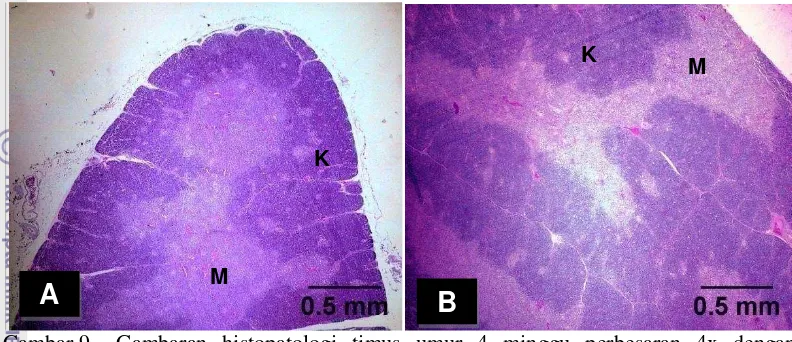
Menurut Dellman (2006), struktur medula hanya mengandung sedikit limfosit dan didominasi limfosit kecil sehingga warnanya lebih terang dibandingkan dengan korteks timus. Sedangkan korteks timus memiliki warna lebih gelap karena berisi banyak limfosit dan proses pematangan limfosit T terjadi di dalamnya.
Timus merupakan organ limfoid yang memiliki respon terbesar terhadap fluktuasi hormon. Reduksi limfosit akibat steroid pada bagian medula timus dapat menyebabkan sel-sel epitel menjadi tampak lebih jelas. Sel-sel epitel juga akan mengalami pertambahan jumlah dan ukuran. Namun hiperplasia tersebut harus dibedakan dengan neoplasia (Elmore 2006). Hal inilah yang menyebabkan ukuran medula pada timus kelompok perlakuan (CC2) lebih luas dibandingkan timus kelompok kontrol (CC0).
Penghitungan luas korteks antara kelompok kontrol dengan kelompok perlakuan tidak berbeda nyata (P>0.05). Saat ayam umur 2 minggu, kelompok kontrol memiliki korteks yang lebih luas daripada kelompok perlakuan. Namun saat ayam berumur 3, 4, 5, dan 6 minggu kelompok perlakuan memiliki korteks yang lebih luas daripada kelompok kontrol. Hal ini mengindikasikan bahwa pemberian kortikosteroid berpengaruh pada ayam umur 2 minggu yang menyebabkan korteks timus menjadi sempit namun tidak pada ayam umur 3, 4, 5, dan 6 minggu. Korteks kelompok perlakuan (CC2) memiliki luas yang lebih besar dibandingkan kelompok kontrol (CC0) disebabkan respon korteks yang besar terhadap hormon steroid. Elmore (2006) menyatakan reseptor hormon steroid pada korteks timus lebih banyak dibandingkan medula.
Penyempitan korteks timus pada kelompok perlakuan (CC2) umur 2 minggu dapat berpengaruh terhadap jadwal vaksinasi yang diberikan pada hari ke-11. Menurut Woodland dan Kohlmeier (2009), setelah timus merespon vaksin maka antigen spesifik sel T memori akan didistribusi ke perifer. Sel-sel tersebut akan menjadi pertahanan baris pertama terhadap infeksi sekunder patogen.
Tabel 7 Perbandingan luas timus (µm2
) kelompok kontrol (CC0) dengan perlakuan (CC2) (dalam luas 2909.09 x 2327.27 µm2).
Umur (minggu) Luas CC0 (µm2) Luas CC2 (µm2)
2 1466.37± 529.53a 878.75± 273.28a
3 1392.59± 483.25a 2105.86± 1225.31a 4 1973.97± 656.58a 2681.24± 796.63a 5 1774.04± 1095.59a 2447.29± 511.59a 6 1637.30± 934.96a 1975.22± 714.51a Keterangan: huruf superscript yang berbeda pada baris yang sama menunjukkan hasil
yang berbeda nyata (P<0.05).
Luas timus antara kontrol (CC0) dan kelompok perlakuan (CC2) tidak menunjukkan perbedaan yang nyata (P>0.05). Kelompok kontrol ayam umur 2 minggu memiliki timus yang lebih luas daripada kelompok perlakuan (CC2). Namun pada umur 3, 4, 5, dan 6 minggu kelompok perlakuan (CC2) memiliki timus yang lebih luas daripada kelompok kontrol (CC0). Perkembangan timus secara umum pada unggas mencapai maksimum pada umur 16 minggu. Selama masa embrionik sampai sebelum pubertas, timus akan tumbuh dan berkembang dengan pesat (Schalm et al. 2000). Luas timus pada kelompok perlakuan (CC2) lebih kecil dibandingkan kelompok kontrol pada umur 2 minggu.
Timus merupakan organ limfoid yang paling peka terhadap steroid. Steroid menyebabkan penekanan terhadap timus sehingga dapat terjadi imunosupresi (Elmore 2006). Penekanan organ pada umur 2 minggu dapat memberikan pengaruh buruk pada pemberian vaksin yang dilakukan pada hari ke-11 (memasuki umur 2 mimggu). Menurut (Zimmerman 2012), jika vaksin diberikan dalam kondisi hewan imunosupresi maka vaksin tidak akan mampu menstimuli tubuh untuk memproduksi antibodi. Hasilnya adalah tubuh akan rentan terhadap penyakit. Hal ini disebut kegagalan vaksin. Gambar histopatologi timus ayam dapat di