RESPON TUNAS GAHARU (Aquilaria malaccensis)
SECARA IN VITRO TERHADAP
PEMBERIAN ZPT
SKRIPSI
Oleh :
ESRY NINTA SIPAYUNG 051202009
DEPARTEMEN KEHUTANAN FAKULTAS PERTANIAN UNIVERSITAS SUMATERA UTARA
RESPON TUNAS GAHARU (Aquilaria malaccensis)
SECARA IN VITRO TERHADAP
PEMBERIAN ZPT
SKRIPSI
Oleh :
ESRY NINTA SIPAYUNG 051202009/BUDIDAYA HUTAN
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Kehutanan Pada Jurusan Kehutanan Fakultas Pertanian
Universitas Sumatera Utara
DEPARTEMEN KEHUTANAN FAKULTAS PERTANIAN UNIVERSITAS SUMATERA UTARA
Judul Skripsi : Respon Tunas Gaharu ( Aquilaria malacensis) secara In Vitro terhadap Pemberian ZPT
Nama : Esry Ninta Sipayung Nim : 051202009
Departemen : Kehutanan Program Studi : Budidaya Hutan
Disetujui oleh Komisi Pembimbing
Dr. Ir. Edy Batara Mulya Siregar, M. S Nelly Anna S.Hut, M.Si Ketua Anggota
Mengetahui,
RINGKASAN
ESRY NINTA SIPAYUNG; Respon Tunas Gaharu (Aquilaria malaccensis) secara In vitro terhadap Pemberian ZPT. Dibawah bimbingan EDY BATARA MULYA SIREGAR dan NELLY ANNA
Gaharu merupakan salah satu hasil hutan nonn kayu yang dihasilkan oleh tanaman Aquilaria malaccensis. Perbanyakan gaharu hingga saat ini masih menggunakan teknik konvensional. Secara generatif perbanyakan gaharu masih bergantung pada biji yang tersedia di alam, sedangkan cara vegetatif ( in vitro, stek pucuk dan stek batang dll) masih belum memberikan hasil yang maksimal. Sehingga dilakukan penelitian untuk mengetahui pengaruh pemberian hormon BAP pada media ½ MS terhadap induksi tunas A. malaccensis. Serta untuk mengetahui pengaruh kombinasim IAA dan GA terhadap perpanjangan tunas dan induksi akar A. malaccensis.
Hasil penelitian menunjukkan bahwa pemberian hormon BAP dengan konsentrasi rendah (1 ppm) berpengaruh nyata terhadap panjang tunas A. malaccensis. Pada pengamatan 14 hari setelah tanam diperoleh panjang tunas gaharu 11.9 mm. Pada pemebrian IAA dan GA berpengaruh nyata terhadap pertambahan pajang tunas gaharu, dimana tunas tertinggi terdapat pada perlakuan GA (0 ppm) dan IAA (0.5 ppm) dengan nilai 18.33 yang diperoleh dari pengamatan 7 hari setelah tanam. Pemberian IAA dan GA pada setiap perlakuan tidak dihasilkan adanya akar.
ABSTRACT
ESRY NINTA SIPAYUNG: Response of Gaharu (Aquilaria malaccensis) in in vitro ways to giving ZPT. Under of Guidance of EDY BATARA MULYA SIREGAR and NELLY ANNA
Gaharu is one of non wood crops which is originally of Aquilaria malaccensis plant family. At this time, extension of gaharustill use conventional technic. In generatife ways extension of gaharu still depends on natural available seeds. Whaile in vegetatife way ( in vitro, slip of leaf tip, slip of stalk) still didn’t give maximum result. Until research was done to know the effect of giving hormone BAP on media ½ MS to A. malaccensisbud induction, and to know the effect of hormone GA anad IAA combination to bud prolongation and root induction of A. malaccensis.
The result of research showed that by giving low concentration BAP (1 ppm) gave real effect to the high of gaharu bud. The observation of 14 hst, it was known that the length of gaharu bud become 11.9 mm. On 7 hst observation the effect of increasing A. malaccensis bud high, which is the highest bud by giving IAA and GA was found at GA (o ppm) and IAA 90.5 ppm), value 18.33mm. Giving IAA and GA on each treatment didn’t give effect to root induction.
Key words : Gaharu, bud induction, IAA, GA and BAP hormone
RIWAYAT HIDUP
Penulis dilahirkan di Sembahe pada tanggal 16 November 1986. Putri dari Ayahanda K. Sipayung dan Ibunda G br Tarigan merupakan anak ke dua dari lima bersaudara.
Pada tahun 2005 penulis lulus dari SMU N I, Sidikalang dan pada tahun yang sama masuk ke FAkultas Pertanian USU melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru). Penulis memilih program studi Budidaya Hutan, Departemen Kehutanan.
Selama dibangku perkuliahan, penulis merupakan anggota Himpunan Sylva (HIMAS). Penulis juga aktif dalam Unit Kegiatan Mahasiswa Kebaktian Mahasiswa Kristen (UKM KMK USU), sebagai asisten praktikum pemuliaan tanaman.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas berkat karunia-Nya skripsi ini dapat diselesaikan. Adapun judul skripsi ini adalah “ Respon Tunas Gaharu (Aquilaria malaccensis) secara In Vitro terhadap Pemberian ZPT ”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Edy Batara Mulya Siregar, MS dan Ibu Nelly Anna, S.Hut, M.Si selaku ketua dan anggota komisi pembimbing yang telah membimbing dan memberikan masukan kepada penulis hingga skripsi ini dapat diselesaikan dengan baik. Ungkapan terima kasih juga saya sampaikan kepada ayah, ibu, serta seluruh keluarga atas segala doa dan dukungannya baik secara moril maupun materi. Serta kepada kak Herawati Pane SP di Laboratorium Kultur Jaringan Dinas Pertanian Provinsi Sumatera Utara, Medan yang telah membantu penulis dalam mengarjakan penelitian.
DAFTAR ISI
Manfaat Penelitian... ... 5
KESIMPULAN DAN SARAN
Kesimpulan ... .. 34 Saran ... .. 34 DAFTAR PUSTAKA
DAFTAR TABEL
No Hal.
1. Persentase pertumbuhan tunas gaharu pada media ½ MS+BAP ... 29
2. Respon tunas terhadap panjang tunas gaharu pada media ½ MS+BAP ... 31
3. Rataan tinggi tunas gaharu pada media ½ MS + BAP ... 32
DAFTAR GAMBAR
DAFTAR LAMPIRAN
No. Hal.
1.Komposisi Media Murashige and Skoog
2. Komposisi dan Cara Pembuatan Larutan Stok 3. Bagan Penelitian
4. Data Pembentukan Tunas (Hari) pada Media ½ MS+BAP 5. Data Panjang Tunas (mm) pada Media ½ MS+BAP 6. Sidik Ragam Panjang Tunas pada Media ½ MS+BAP
RINGKASAN
ESRY NINTA SIPAYUNG; Respon Tunas Gaharu (Aquilaria malaccensis) secara In vitro terhadap Pemberian ZPT. Dibawah bimbingan EDY BATARA MULYA SIREGAR dan NELLY ANNA
Gaharu merupakan salah satu hasil hutan nonn kayu yang dihasilkan oleh tanaman Aquilaria malaccensis. Perbanyakan gaharu hingga saat ini masih menggunakan teknik konvensional. Secara generatif perbanyakan gaharu masih bergantung pada biji yang tersedia di alam, sedangkan cara vegetatif ( in vitro, stek pucuk dan stek batang dll) masih belum memberikan hasil yang maksimal. Sehingga dilakukan penelitian untuk mengetahui pengaruh pemberian hormon BAP pada media ½ MS terhadap induksi tunas A. malaccensis. Serta untuk mengetahui pengaruh kombinasim IAA dan GA terhadap perpanjangan tunas dan induksi akar A. malaccensis.
Hasil penelitian menunjukkan bahwa pemberian hormon BAP dengan konsentrasi rendah (1 ppm) berpengaruh nyata terhadap panjang tunas A. malaccensis. Pada pengamatan 14 hari setelah tanam diperoleh panjang tunas gaharu 11.9 mm. Pada pemebrian IAA dan GA berpengaruh nyata terhadap pertambahan pajang tunas gaharu, dimana tunas tertinggi terdapat pada perlakuan GA (0 ppm) dan IAA (0.5 ppm) dengan nilai 18.33 yang diperoleh dari pengamatan 7 hari setelah tanam. Pemberian IAA dan GA pada setiap perlakuan tidak dihasilkan adanya akar.
ABSTRACT
ESRY NINTA SIPAYUNG: Response of Gaharu (Aquilaria malaccensis) in in vitro ways to giving ZPT. Under of Guidance of EDY BATARA MULYA SIREGAR and NELLY ANNA
Gaharu is one of non wood crops which is originally of Aquilaria malaccensis plant family. At this time, extension of gaharustill use conventional technic. In generatife ways extension of gaharu still depends on natural available seeds. Whaile in vegetatife way ( in vitro, slip of leaf tip, slip of stalk) still didn’t give maximum result. Until research was done to know the effect of giving hormone BAP on media ½ MS to A. malaccensisbud induction, and to know the effect of hormone GA anad IAA combination to bud prolongation and root induction of A. malaccensis.
The result of research showed that by giving low concentration BAP (1 ppm) gave real effect to the high of gaharu bud. The observation of 14 hst, it was known that the length of gaharu bud become 11.9 mm. On 7 hst observation the effect of increasing A. malaccensis bud high, which is the highest bud by giving IAA and GA was found at GA (o ppm) and IAA 90.5 ppm), value 18.33mm. Giving IAA and GA on each treatment didn’t give effect to root induction.
PENDAHULUAN
Latar Belakang
Gaharu merupakan produk Hasil Hutan Bukan Kayu dalam bentuk gumpalan, serpihan atau bubuk yang memiliki aroma keharuman khas yang bersumber dari kandungan bahan kimia berupa resin (α-β oleoresin). Gaharu terbentuk dalam jaringan
kayu, akibat pohon terinfeksi penyakit cendawan (fungi) yang masuk melalui luka batang (patah cabang). Gaharu yang pertama dikenal adalah berbentuk gubal ditemukan di Assam, India dari pohon jenis Aquilaria agaloccha Rottb pada abad ke-7 (SNI, 1999).
Komoditas gaharu telah cukup lama dikenal masyarakat secara umum. Beberapa jenis tanaman gaharu yang dikenal antara lain Aquilaria malaccensis (A. malaccensis), A. filaria, A. hirta, A. agalloccha, A. macrophylum dan beberapa puluh jenis lainnya.
Dari puluhan jenis tanaman yang berpotensi tersebut, A. malaccensis adalah tanaman penghasil gaharu berkualitas terbaik dengan nilai jual yang sangat tinggi. Jenis ini juga merupakan jenis yang paling banyak ditemukan di Sumatera Utara (Yusnita, 2009).
A. malaccensis sangat terkenal karena memiliki aroma yang sangat khas yang pada
umumnya banyak dimanfaatkan untuk bahan wewangian dan kosmetik serta pewangi ruangan. Selain itu, secara klinis juga dapat bermanfaat sebagai obat-obatan, antara lain obat penghilang stress, gangguan ginjal, hepatitis, sirosis, pembengkakan liver dan ginjal, TBC, reumatik, kanker, malaria dan radang lambung. Beragamnya pemanfaatan A. malaccensis berdampak terhadap harga dari gaharu yang terus meningkat. Data terakhir
menyebutkan bahwa saat ini harga A. malaccensis kelas super king adalah Rp 60 juta/kg sedangkan untuk kelas biasa Rp 2 juta/kg. Semakin tingginya tingkat permintaan akan A. malaccensis menyebabkan terjadinya eksploitasi A. malaccensis secara besar-besaran
sesuai dengan hasil penelitian dari CITES yang memasukkan tanaman A. malaccensis kedalam jenis tanaman terancam punah (Apendix II) (Sumarna, 2005).
Untuk menjawab masalah yang sedang terjadi maka perlu diadakan perbaikan budidaya terhadap tanaman ini. Perbanyakan tanaman A. malaccensis hingga saat ini masih dilakukan secara generatif. Namun hal tersebut tidak menjawab permasalahan yang ada. Sulitnya dilakukan budidaya secara generatif disebabkan karena ketersediaan gaharu dialam yang hanya tersedia pada musim tertentu saja. Sedangkan secara vegetatif hingga saat ini masih jarang dilakukan karena dalam pelaksanaannya biasanya membutuhkan waktu yang lama dan membutuhkan tempat yang sangat luas. Oleh sebab itu di beberapa negara maju telah dikembangkan sistem perbanyakan tanaman secara vegetatif yang lebih cepat dan hasil yang lebih banyak. Sistem perbanyakan ini dikenal dengan sistem kultur jaringan atau dapat juga disebut dengan perbanyakan tanaman secara vegetatif modern.
Teknik In vitro telah banyak dimanfaatkan dan memberikan harapan untuk mengatasi kesulitan dalam penyediaan bibit A. malaccensis. Aplikasi teknologi ini dibidang pertanian juga dimanfaatkan untuk perbanyakan serta konservasi dan perbaikan tanaman. Pemanfaatan teknik in vitro terutama metode mikropropagasi dan embriogenesis somatic menjadi alternatif utama dalam pengembangan dan konservasi
gaharu (Kosmiati, 2005).
fisiologi dan morfologi yang sama persis dengan induknya dan untuk budidayanya tidak dipengaruhi oleh keadaan musim. Tunas hipokotil atau bagian meristem yang ditanam pada media yang mengandung nutrisi atau zat pengatur tumbuh (ZPT) yang tepat akan menghasilkan tanaman baru dalam waktu singkat dan jumlah yang banyak (Hendaryono dan Wijayani, 1994).
Teknik kultur jaringan ini memiliki beberapa keuntungan, diperolehnya bibit yang seragam dalam jumlah besar dan sifat yang sama persis dengan induknya. Teknik ini sangat bermanfaat untuk tanaman yang diperbanyak secara vegatatif. Adapun tanaman yang telah berhasil diperbanyak antara lain tanaman hias (misal: anggrek dan mawar), tanaman obat (misal: purwoceng dan bidara upas), tanaman berkayu (misal: jati dan cendana), serta tanaman buah-buahan (misal: pisang dan manggis) ( Dinyunita, 2007).
Namun demikian ada kendala teknik yang sering ditemukan sebagai penghambat keberhasilan teknik kultur jaringan yaitu kurangnya sterilisasi bahan tanaman sehingga sering terjadi kontaminasi pada biakan serta diperlukan tenaga kerja yang intensif, terdidik serta mempunyai keterampilan khusus (Mariska dan Sukmadjaja, 2003).
Walau demikian hal ini tidak mengurangi tingkat keberhasilan pembudidayaan tanaman dengan kultur jaringan. Beberapa peneliti telah berhasil melakukan perbanyakan tanaman dengan cara kultur jaringan seperti kultur jaringan manggis oleh Mariska dkk, perbanyakan tanaman gaharu secara in vitro oleh Mariska dkk, kultur ramin oleh Hardi dkk, kultur cendana oleh Sukmadjaya dll.
berbeda serta ZPT yang berbeda pula. Dan dari penelitian tersebut diketahui bahwa A. malaccensis sangat baik tumbuh apabila dikulturkan pada media ½ MS tanpa
penambahan vitamin dengan ZPT Benzyl amino purin (BAP) dengan konsentrasi 1 ppm. Berdasarkan uraian diatas penulis tertarik untuk melakukan penelitian lanjutan. Dimana peneliti tertarik untuk mengkulturkan tanaman A. malaccensis pada media ½ MS dengan penambahan BAP (1,2 dan 3 ppm) serta menginduksikan akar dan perpanjangan tunas dengan Giberelin (GA) (0, 0.5 dan 1 ppm) serta Indol Asam Asetat (IAA) (0, 0.5 dan 1 ppm).
Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi BAP pada media
½ MS terhadap induksi tunas A. malaccensis, dan untuk mengetahui pengaruh pemberian GA dan IAA terhadap pertumbuhan tunas dan induksi akar gaharu A. malaccensis.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang alternatif perbanyakan tunas A. malaccensis secara In vitro.
Hipotesis Penelitian
Adapun hipotesis dari penelitian ini adalah :
1. Pemberian BAP berpengaruh nyata terhadap pertumbuhan tunas A. malaccensis
TINJAUAN PUSTAKA
Botani Tanaman Gaharu
Gaharu adalah sejenis resin tapi bukan resin yang dihasilkan oleh pohon gaharu, melainkan resin yang terbentuk karena adanya infeksi pada pohon tersebut. Infeksi ini mengakibatkan sumbatan pada pengaturan makanan, sehingga menghasilkan suatu zat phytalyosin sebagai reaksi dari infeksi tersebut. Infeksi didapat dari hasil perlukaan yang
disebabkan oleh alam (serangan hama dan penyakit seperti serangga, jamur, bakteri) atau karena sengaja dilukai oleh manusia. Zat phytalyosin inilah yang merupakan resin gubal gaharu di dalam pohon karas dari jenis Aquilaria spp. Zat yang berbau wangi jika dibakar ini tidak keluar dari batang gubalnya, tetapi mengendap menjadi satu dalam batang. Hal ini terjadi pada tanaman yang sakit dan tidak pada pohon yang sehat. Proses inilah yang menyebabkan terbentuknya gaharu dalam batang. Gubal gaharu adalah bagian gubal gaharu yang mengandung damar wangi dengan konsentrasi yang lebih rendah (Wulandari, 2000).
Gaharu diperoleh dari sejenis tumbuhan famili Thymeliaceae dan bermarga Aquilaria yaitu Aquilaria agaloccha Rox, namun gaharu dapat juga diperoleh dari family
lain yaitu Leguminoceae dan Euphorbiaceae. Saat ini
A. Malaccensis merupakan jenis yang paling baik dalam menghasilkan minyak gaharu
(Tarigan, 2004).
A. malaccensis merupakan salah satu tanaman kehutanan yang telah
A. hirta, A. macrophylum dll. Dan yang paling tinggi hasil gaharunya adalah jenis A.
malaccensis (Sumarna, 2005).
A. malaccensis memiliki morfologi atau ciri-ciri fisiologi yang sangat unik,
dimana tinggi pohon ini mencapai 40 meter dengan diameter 60 cm. Pohon ini memiliki permukaan batang licin, warna keputihan, kadang beralur dan kayunya agak keras. Tanaman ini memiliki bentuk daun lonjong agak memanjang, panjang 6-8 cm, lebar 3-4 cm, bagian ujung meruncing. Daun yang kering berwarna abu-abu kehijaun, agak bergelombang, melengkung, permukaan daun atas-bawah licin dan mengkilap, tulang daun sekunder 12-16 pasang. Tanaman ini memiliki bunga yang terdapat diujung ranting, ketiak daun, kadang-kadang di bawah ketiak daun. Berbentuk lancip, panjang sampai 5 mm. Dan buahnya berbentuk bulat telor, tertutup rapat oleh rambut-rambut yang berwarna merah. Biasanya memiliki panjang hingga 4 cm lebar 2,5 cm (Tarigan, 2004).
A. malaccensis sesuai ditanam di antara kawasan dataran rendah hingga ke
pergunungan pada ketinggian 0 – 750 meter dari permukaan laut dengan curah hujan kurang dari 2000 mm/Thn. Suhu yang sesuai adalah antara 27°C hingga 32°C dengan kadar cahaya matahari sebanyak 70%. Kesesuaian tanah adalah jenis lembut dan liat berpasir dengan pH tanah antara 4.0 hingga 6.0 (Sumarna, 2005).
Biji yang berkualitas baik amat penting untuk tujuan pembenihan. Buah A. malaccensis berbentuk kapsul, dengan panjang 3.5 cm hingga 5 cm, ovoid dan berwarna
coklat. Kulitnya agak keras dan berbaldu. Mengandung 3 hingga 4 biji benih bagi setiap buah (Sumarna, 2005).
gaharu di daerah penghasil utama gaharu adalah Sumatera 26%, Kalimantan 27% Nusa Tenggara 5%, Sulawesi 4%, Maluku 6% dan Papua 37% (Tarigan, 2004).
Sampai saat ini sistem produksi gaharu masih sangat tradisional. Biasanya hanya mengandalkan keberadaan gaharu di hutan secara alami. Sehingga masih dapat dikategorikan kedalam sistem pertanian ekstraktif, yang artinya tanpa ada perlakuan budidaya hanya melakukan pengambilan hasil saja (Sumarna, 2005).
Sistem perbanyakan gaharu masih dikerjakan dengan 2 cara yaitu secara generatif dan secara vegetatif. Perbanyakan tanaman secara generatif masih dilakukan dengan cara penyemaian biji dan pengambilan anakan atau cabutan langsung dari alam atau hutan. Namun cara ini kurang dapat menjadi solusi bagi kelangkaan gaharu. Hal ini disebabkaan karena ketersediaan biji dilapangan yang terbatas. Sedangkan untuk perbanyakan tanaman secara vegetatif dapat dilakukan dengan teknik stek batang, stek pucuk, cangkok batang dan kultur jaringan (Tarigan, 2004).
Manfaat Gaharu
Pemanfaatan gaharu hingga saat ini masih dalam bentuk produk bahan baku, yaitu bentuk kayu bulat, cacahan, bubuk atau fosil kayu yang sudah terkubur. Setiap produk yang dihasilkan memiliki sifat dan warna yang berbeda. Kayu gaharu memiliki manfaat yang besar dalam industri perkayuaan di mana kayunya digunakan dalam industri pembuatan kotak pembungkus, papan lapis, cenderamata, perabot, sepatu, sarung senjata, chopstick dll. Selain itu gaharu banyak juga digunakan dalam upacara keagamaan Cina,
Selain itu secara klinis gaharu juga dapat digunakan sebagai obat tradisional oleh masyarakatnya. Seperti obat untuk penyakit ginjal, sakit perut, asma, hepatitis, sironis, pembengkakan lever, limpa bahan antibiotik untuk TBC, reumatik, kangker, malaria radang lambung dll. Selain itu gaharu juga sudah dimanfaatkan bukan hanya gubalnya akan tetapi bagian daun, batang, kulit batang dan akarnya juga sudah dimanfaatkan sebagai bahan untuk merawat wajah dan menghaluskan kulit (Tarigan, 2004).
Kandungan yang Terdapat pada Gaharu
Dari analisis kandungan kimia yang telah dilakukan gaharu memiliki enam komponen utama berupa furanoid sesquiterpen diantaranya a-agarofuran,b-agarofuran dan agarospirol. Selain itu gaharu juga mengandung minyak berupa chromone. Chromone biasanya dapat menyebabkan bau harum dari gaharu ketika dibakar.
Sementara kandungan minyak atsiri yang banyak dikandung gaharu adalah sequiterpenoida, cudesmana dan paleman (Sumarna, 2005).
Kultur Jaringan
Kultur jaringan / cultur In Vitro / Tissue Culture adalah suatu teknik untuk mengisolasi, sel, protoplasma, jaringan, dan organ dan menumbuhkan bagian tersebut pada nutrisi yang mengandung zat pengatur tumbuh tanaman pada kondisi aseptik, sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman sempurna kembali (Trisetyagunadi, 2008).
a. Mengetahui teori totipotensi sel yang dikemukakan oleh Schleiden dan Schwann yaitu sel mempunyai kemampuan autonom, bahkan mempunyai kemampuan totipotensial. Totipotensial adalah kemampuan setiap sel, yang dimbil dari suatu tempat dan apabila diletakkan pada tempat yang lain dapat tumbuh menjadi tanaman yang sempurna .
b. Memahami konsep Skoog dan Miller yang menyatakan bahwa regenerasi tunas dan akar in vitro dikontrol secara hormonal oleh ZPT sitokinin dan auksin. Organogenesis adalah proses terbentuknya organ seperti tunas atau akar baik
secara langsung dari permukaan eksplan atau secara tidak langsung melalui pembentukan kalus terlebih dahulu.
c. Memahami sifat kompeten, diferensiasi dan determinasi dimana suatu sel akan dikatakan kompeten apabila sel atau jaringan tersebut mampu memberikan tanggapan terhadap signal lingkungan atau signal hormonal.
d. Memahami tata cara perbanyakan tanaman secara kultur jaringan
Dalam melakukan kultur jaringan pekerjaan yang dilakukan meliputi: pemilihan dan penyiapan tanaman induk sumber eksplan, inisiasi kultur, persiapan media, isolasi bahan tanam (eksplan), sterilisasi eksplan, inokulasi eksplan, aklimatisasi dan usaha pemindahan tanaman hasil kultur jaringan ke lapang. Pelaksana harus bekerja dengan teliti dan serius, karena setiap tahapan pekerjaan tersebut memerlukan penanganan tersendiri dengan dasar pengetahuan tersendiri (Dinyunita, 2007).
sangat bermanfaat untuk tanaman-tanaman yang diperbanyak secara vegetatif. Adapun tanaman yang telah berhasil diperbanyak antara lain tanaman hias (anggrek dan mawar), tanaman obat (purwoceng dan bidara upas), tanaman berkayu (jati dan cendana), serta tanaman buah-buahan (pisang dan manggis) (Dinyunita, 2007).
Namun demikian ada beberapa kendala teknik yang sering ditemukan, sebagai penghambat keberhasilan teknik kultur jaringan ini antara lain, adanya mutasi pada bibit yang dihasilkan sehingga tidak sama dengan pohon induknya, tingkat keberhasilan induksi perakaran dari tunas yang telah dibentuk secara in vitro sedikit, aklimatisasi (adaptasi tanaman hasil kultur jaringan pada lingkungan yang baru di luar botol kultur) sering gagal, tingkat keanekaragamannya di setiap generasi turun terutama apabila sering dilakukan subkultur, kurang sterilisasi bahan tanaman sehingga sering terjadi kontaminasi pada biakan serta diperlukan tenaga kerja yang intensif, terdidik serta mempunyai keterampilan khusus (Mariska dan Sukmadjaja, 2003).
Teknik kultur akan berhasil dengan baik apabila syarat yang diperlukan telah terpenuhi dengan baik. Syarat-syarat tersebut meliputi pemilihan eksplan sebagai bahan dasar untuk pembentukan kalus, penggunaan medium yang sesuai, keadaan yang aseptik dan pengaturan udara yang baik. Untuk eksplan tanaman yang baik digunakan adalah bagian tanaman yang masih muda yaitu bagian meristemnya (Harahap, 2005).
Menurut Hendaryono dan Wijayani (1994) terdapat beberapa teknik kultur jaringan tanaman yaitu:
2. Kultur antera yaitu budidaya jaringan dengan menggunakan serbuksari dari tanaman tersebut
3. Kultur embrio yaitu memisahkan embrio tanaman yang belum dewasa dan menumbuhkannya secara kultur jaringan untuk mendapatkan tanaman yang viabel 4. Kultur protoplasma yaitu budidaya jaringan dengan menggunakan eksplan dari
protoplasma. Dimana protoplasma adalah sel hidup yang telah dihilangkan selnya. Teknik kultur akan berhasil dengan baik apabila syarat yang diperlukan telah terpenuhi dengan baik. Syarat-syarat tersebut meliputi pemilihan eksplan sebagai bahan dasar untuk pembentukan kalus, penggunaan medium yang sesuai, keadaan yang aseptik dan pengaturan udara yang baik. Untuk eksplan tanaman yang baik digunakan adalah bagian tanaman yang masih muda yaitu bagian meristemnya (Harahap, 2005).
Menurut Santoso dan Nursandi (2004) ada beberapa faktor yang dapat mempengaruhi keberhasilan kultur jaringan yaitu:
1. Genotipe
Pada beberapa jenis tumbuhan embrio mudah tumbuh akan tetapi pada beberapa jenis tumbuhan lain sukar untuk tumbuh. Hal ini disebabkan oleh perbedaan kultivar dari jaringan yang sama
2. Komposisi media makanan
Media untuk pertumbuhanembrio harus mengandung unsur hara makro, unsur hara mikro dan gula. Faktor penting lainnya yang tidak boleh diabaikan adalah adanya ion ammonium dan potassium.
Suplai oksigen yang cukup sangat menentukan laju multiplikasi tunas dalam usaha perbanyakan secara In vitro.
4. Cahaya
Kadang-kadang untuk perkembangan embrio membutuhkan tempat gelap kira-kira selama 7-14 hari. Baru dipindah ke tempat terang untuk pembentukan klorofil.
5. Temperatur
Temperatur optimum yang dibutuhkan umumnya tergantung dari jenis tumbuhan yang digunakan.Secara normal temperatur yang digunakan adalah antara 220-280 C.
6. Lingkungan yang aseptik
Kondisi lingkungan sangat menentukan terhadap tingkat keberhasilan pembiakan tanaman dengan kultur jaringan
Perbanyakan melalui kultur jaringan dikatakan berhasil apabila memenuhi beberapa kriteria, menurut Mariska dan Sukmadjaja (2003) kriteria yang harus dimiliki adalah:
1. Tidak merubah sifat genetik tanaman induk apabila dilakukan perbanyakan secara klonal.
2. Seleksi yang kuat pada bahan tanaman yang bebas penyakit.
3. Pemindahan tanaman / bibit hasil kultur jaringan ke dalam tanah tidak sukar. 4. Teknik perbanyakannya tidak terlalu rumit.
Media Kultur Jaringan
Pada awalnya media kultur jaringan memiliki komposisi yang didasarkan pada bahan-bahan yang digunakan untuk kegiatan hydroponic yang berkembang sebelumnya. Biasanya dalam kultur jaringan unsur hara diberikan dalam bentuk garam organik. Pada perkembangan selanjutnya para peneliti mulai menambahkan vitamin, senyawa kompleks dan zat pengatur tumbuh (Santoso dan Nursandy, 2004).
Menurut Hendaryono dan Wijayati (1994) menyatakan bahwa dalam kultur jaringan ada beberapa jenis media yang umum digunakan yaitu:
1. Medium dasar B5 atau Gamborg biasanya digunakan unttuk kultur suspensi sel kedelai, a alfafa, legume dll
2. Medium dasar White biasanya digunakan untuk kultur akar. Medium ini merupakan medium dasar dengan konsentrasi garam-garam mineral yang sangat rendah
3. Medium VW biasanya digunakan khusus untuk media anggrek 4. Media WPM biasanya digunakan untuk tanaman berkayu
5. Media MS adalah media yang paling banyak digunakan. Media ini merupakan media yang sangat lengkap kandungan unsur hara nya dan biasanya diperkaya juga oleh adanya vitamin dan hormon. Namun untuk berbagai jenis tanaman biasanya media ini masih tetap digunakan sebagai media dasar, yang berbeda adalah kombinasi maupun konsentrasi dari media tersebut.
Zat Pengatur Tumbuh ( ZPT)
translokasi serta penyerapan hara. ZPT sangat dibutuhkan sebagai komponen media bagi pertumbuhan dan diferensiasi. Tanpa penambahan ZPT dalam medium biasanya pertumbuhan tanaman akan sangat lambat. Pembentukan kalus dan organ-organ tanaman ditentukan oleh penggunaan yang tepat dari ZPT tersebut (Santoso dan Nursandi, 2005).
Auksin digunakan secara luas dalam kultur jaringan untuk merangsang kalus, suspensi sel dan organ. Golongan auksin yang sering ditambahkan dalam medium adalah 2,4-D (2,4-Dikhloro fenoksiasetat), IAA (Indol Asam Asetat), NAA (Naftalen Asam Asetat) dan IBA (Indol Buterik Asetat). Dalam kultur jaringan ada sel-sel yang dapat tumbuh dan berkembang tanpa auksin.
Sedangkan golongan sitokinin yang sering ditambahkan dalam medium antara lain Kinetin, Zeatin, dan Benzilaminopurin(BAP). Golongan ini merupakan turunan dari adenin. Sitokinin ini sangat penting peranannya dalam pembelahan sel dan morfogenesis. Menurut Hendaryono (1994) ada beberapa fungsi sitokonin yang sangat penting bagi tanaman yaitu:
1. Memacu terbentuknya organogenesis dan morfogenesis 2. Memacu terjadinya pembelahan sel
3. kombinasi antara auksin dan sitokinin akan memacu pertumbuhan kalus.
Pada umumnya Giberelin terutama GA3 menghambat perakaran. Secara umum
fungsi Giberelin adalah: 1. Mematahkan dormansi 2. Memicu perkecambahan
3. memacu terjadinya proses imbibisi
IAA, NAA dan IBA biasanya digunakan dengan konsentrasi 0.01-10 mg/l. Untuk percobaan eksplorasi, biasanya konsentrasi yang digunakan 0.01mg/l, 0.1 mg/l dan 1 mg/l dan 10 mg/l. Selain auksin, sitokinin juga sangat dibutuhkan dalam kultur jaringan. Sitokinin biasanya sangat berpengaruh terutama pada proses pembelahan sel. Biasanya kedua hormon ini digunakan secara bersama-sama sehingga dihasilkan interaksi terhadap diferensiasi jaringan tanaman (Mariska, 2002).
Kondisi Lingkungan
Menurut Yusnita (2003) menyatakan bahwa dalam kultur jaringan ada beberapa faktor yang harus diperhatikan yang berhubungan dengan kondisi lingkungan yaitu:
1) pH (Keasaman) dimana sel-sel yang dikembangkan dengan kutur jaringan memiliki toleransi pH yang relatif sempit dan tidak normal antara 5-6. Bila eksplan sudah tumbuh biasanya pH dalam media umumnya akan naik
2) Kelembaban dimana biasanya mendekati 100%. Kelembaban sangat berpengaru pada pola pengembangannya.
optimum untuk tanaman pada kultur jaringan 0-1000 lux (inisiasi), 1000-10000 (multiplikasi), 10000-30000 (pengakaran) dan 30000 ke atas untuk aklimatisai. 4) Temperatur atau suhu juga berpengaruh terhadap kesehatan tanaman yang
dikulturkan. Suhu yang umum digunakan untuk pengkulturan berbagai jenis tanaman adalah 26±20C. Untuk kebanyakan tanaman suhu yang terlalu rendah dapat menghambat pertumbuhan tanaman dan suhu yang terlaalu tinggi dapat membuat tanaman merana.
Masalah dalam Kultur Jaringan
Dalam kegiatan kultur jaringan, tidak sedikit masalah yang dapat terjadi yang menyebabkan kegagalan dalam kultur jaringan. Permasalahan yang dihadapi biasanya ada yang dapat diprediksi sebelumnya dan ada yang sulit dipredikasi. Masalah yang biasa timbul dalam kegiatan kultur jaringan adalah :
a.Kontaminasi
kontaminasi adalah gangguan yang paling sering terjadi dalam kegiatan kultur jaringan. Kontaminasi biasanya dapat kita lihat dari jenis kontaminannya seperti bakteri, jamur, virus dll. Selain itu dapat juga berdasarkan waktunya yaitu ada yang dalam hitungan jam, ada yang dalam hitungan hari dan ada juga yang dalam hitungan bulan atau minggu, serta berdasarkan apa yang terkontaminasi seperti media atau eksplan.
b. Browning
Browning/pencoklatan adalah suatu karakter yang muncul yang sering
perubahan aditif dari eksplan yang disebabkan oleh pengaruh fisik maupun biokimia (memar, luka, atau serangan penyakit).
c. Vitrifikasi
Vitrifikasi umunya terjadi akibat kegagalan pada proses pembentukan daging sel
METODE PENELITIAN
Tempat dan Waktu Penelitian
Eksplan dimbil dari desa Bahorok, Kabupaten Langkat Provinsi Sumatera Utara. Penelitian dilakukan di Laboratorium Kultur Jaringan Dinas Pertanian Propinsi Sumatera Utara, Medan. Penelitian ini dilaksanakan bulan Februari – Juni 2010.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tunas yang berasal dari anakan A.malaccensis yang berumur 2 bulan. Alumumium foil, alkohol 70 %, aquades, bahan
kimia media MS, zat pengatur tumbuh (BAP, IAA dan GA), deterjen, kloroks, plastik, karet, label nama, kertas saring, tissu, kapas, anti septik dan fungisida.
Sedangkan alat yang digunakan adalah timbangan analitik, petridis, sendok, pipet tetes, PH meter, stirer, hotplate, beaker glass, erlenmeyer, gelas ukur, botol kultur, autoklaf, bunsen, pinset, laminar air flow (LAF), lampu neon 10 watt, cutter, sprayer, air conditioner dan rak kultur.
Prosedur Penelitian
Penelitian ini terdiri dari dua tahap percobaan yaitu: 1. Induksi tunas
1. Induksi Tunas
Induksi tunas dilakukan dengan menanam bagian pucuk gaharu kedalam media ½ MS yang telah ditambahkan ZPT (BAP) sebagai hormon pemicu pertumbuhan tunas. Penggunaan BAP dilakukan dengan konsentrasi yang berbeda yaitu 1 ppm, 2 ppm dan 3 ppm.
Tiap konsentrasi dilakukan sebanyak 10 ulangan hingga diperoleh percobaan sebanyak 30 satuan percobaan yaitu:
NB0 sebanyak 10 ulangan
NB1 sebanyak 10 ulangan
NB2 sebanyak 10 ulangan.
Dimana Nadalah media ½ MS B0 adalah BAP 1 ppm
B1 adalah BAP 2 ppm
B2 adalah BAP 3 ppm
Untuk menganalisis data yang diperoleh dari percobaan I ini dapat dilakukan dengan menggunakan rancangan acak lengkap non faktorial dengan model matematis sebagai berikut:
Yij = µ + ti + ∑ij
i = 1,2,3 j = 1,2,3
Dimana :
Yij= Data yang disebabkan pengaruh perlakuan pada taraf ke i dan ulangan ke j
µ = Nilai tengah umum/ rataan
Ti =Efek yang sebenarnya dari perlakuan pada taraf ke i
∑ij = Pengaruh error dari perlakuan ke i dan ulangan ke j
Apabila hasil analisis sidik ragam berbeda nyata maka dilakukan uji Duncan pada taraf 5% (Bangun, 2008).
2. Induksi Akar dan Perpanjangan Tunas
Tahap ini merupakan lanjutan dari percobaan pertama. Tunas gaharu yang digunakan adalah tunas yang tumbuh paling baik pada media ½ MS dengan konsentrasi BAP tertentu. Kemudian tunas ditanam kembali pada media ½ MS dengan ZPT (GA dan IAA) dengan konsentrasi yang berbeda.
Pada tahap ini ada 2 faktor perlakuan yang digunakan yaitu: Faktor 1. GA (Giberelin)
G0 = 0.0 ppm
G1 = 0.5 ppm
G2 = 1.0 ppm
Faktor 2: IAA (Indoel Asam Acid) I0 = 0.0 ppm
I1 = 0.5 ppm
Masing-masing kombinasi dibuat dengan 3 ulangan sehingga terdapat 27 satuan percobaan.
GoIo G0I1 G0I2
G1Io G1I1 GII2
G2Io G2I1 G2I2
Untuk menganalisis data yang diperoleh dari percobaan tersebut dapat dilakukan dengan menggunakan rancangan acak lengkap faktorial dengan model matematis sebagai berikut:
Yijk = µ + αi + βj + ( αβ)ij + ∑ijk
i = 1,2,3 j = 1,2,3 k = 1,2,3 Dimana :
Yijk = Respon tanaman yang diamati
µ = Nilai tengah umum
αi = Pengaruh taraf ke i dari faktor ZPT IAA dan BA
βj = Pengaruh taraf ke j dari faktor media MS
(α β)ij = Pengaruh interaksi taraf ke i dari faktor ZPT IAA dan BA dan taraf ke j dari
faktor media ½ MS
∑ijk = Pengaruh sisa percobaan taraf ke i dari faktor ZPT IAA dan BA dan taraf ke j
dari faktor media MS pada ulangan ke k
Pelaksanaan Penelitian
1. Sterilisasi Alat dan Bahan
Semua alat yang akan digunakan terlebih dahulu dicuci dan dikeringkan, kemudian dibungkus dengan kertas koran dan disterilkan dengan autoklaf pada tekanan 17.5 Psi (121-1260C) selama 30 menit. Dikeluarkan dan didinginkan, kemudian botol kultur diberi label nama untuk berbagai perlakuan. Bahan-bahan yang akan kita gunakan juga harus disterilkan dalam autoklaf dengan tekanan yang sama selama 15 menit.
2. Pengambilan Sampel
Sampel yang digunakan adalah tunas yang diambil dari anakan gaharu yang berumur 2 bulan. Pengambilan sampel dilakukan pada tanaman yang bebas dari penyakit serta yang memiliki pucuk yang sehat.
3. Pembuatan Media
Media dibuat dengan menuang stok AB (NH4NO3 dan KNO3) sebanyak 20 ml,
stok C (CaCl2H2O) sebanyak 5 ml, stok D (MgSO47H2O dan KH2PO4) sebanyak 5 ml,
stok E (FeSO4.7H2O dan Na2EDTA) sebanyak 5 ml, stok hara mikro (MnSO4.4H2O,
ZnSO4.7H2O, H3BO3) sebanyak 5 ml, stok mio inositol sebanyak 1 ml kedalam
ditutup kembali dengan alumunium foil hingga rapat. Botol kultur dimasukkan ke dalam autoklaf untuk sterilisasi, biarkan selama 1 jam botol disusun pada rak kultur.
4. Sterilisasi Eksplan
Proses sterilisasi eksplan dilaksanakan dengan 2 tahapan yaitu di luar LAF dan di dalam LAF.
a. Sterilisasi di luar LAF
Pengambilan pucuk dilapangan dilakukan dengan menggunakan cutter yang steril. Pucuk yang diambil berukuran 3 cm atau 2 daun dari pucuk. Dicuci sebanyak 3 kali dengan air mengalir hingga pucuk beserta daunnya bersih dari debu dan kotoran.
Pucuk yang telah dibersihkan dicuci kembali dengan deterjen, bilas dengan air mengalir sebanyak 3 kali hingga pucuk benar-benar bersih . Pucuk yang sudah bersih direndam dengan fungisida selama 1 jam, bilas dengan air mengalir sebanyak 3 kali hingga tidak ada sisa fungisida yang menempel pada pucuk gaharu.
Dilarutan HgCl2 konsentrasi 0,01 sebanyak 500 ml kedalam beaker glass. Rendam
pucuk selama 15 menit. Cuci dengan aquades hingga bersih. Semprot atau lumuri pucuk dengan alkohol 90% bilas dengan aquades hingga bersih.
b. Sterilisasi di dalam LAF
5. Induksi Tunas
Tunas yang sudah steril k dipotong atau dibuang bagian daunnya hingga panjang tunas yang tersisa 1 cm. Tanam pucuk yang sudah steril pada media yang telah disiapkan. Bagian pangkal tunas ditanam pada media. Tunas ditanam dengan posisi tegak lurus. Botol ditutup dengan alumunium foil, plastik dan karet agar udara tidak masuk ke dalam botol.
6. Pemeliharaan
Eksplan yang telah ditanam pada botol kultur disusun pada rak kultur yang telah dibersihkan terlebih dahulu. Diatur suhu dan kelembaban dari ruang kultur. Suhu ruang kultur adalah 210C. Setiap hari botol disemprot dengan alkohol untuk mencegah adanya virus atau bakteri dan jamur yang dapat menyebabkan kontaminasi. Setiap melakukan pengamatan rak kultur harus disemprot terlebih dahulu dengan alkohol.
7. Induksi Akar dan Perpanjangan Tunas
8. Parameter Pengamatan
Parameter yang akan diamati dalam penelitian ini adalah :
1. Konsentrasi BAP berpengaruh terhadap pembentukan tunas A. Malaccensis (hari) 2. Panjang tunas (mm) pengukuran dilakukan dari pangkal tunas hingga ujung tunas
dengan menggunakan kertas milimeter pada pengamatan terakhir
HASIL DAN PEMBAHASAN
.Pada penelitian ini eksplan yang digunakan adalah pucuk anakan gaharu berumur 2 bulan yang sehat dan bebas dari serangan hama dan penyakit. Pucuk yang digunakan adalah berukuran seragam yaitu 1 cm untuk masing-masing perlakuan. Sebelumnya pucuk yang diunakan telah mengalami proses sterilisasi terlebih dahulu. Untuk eksplan yang digunakan kondisi sumber eksplan dialam juga berpengaruh terhadap tingkat keberhasilan kultur jaringan yang kita lakukan.
Tanaman A. malaccensis merupakan tanaman tahunan berkayu yang memiliki daya multiplikasi relatif lambat (rendah). Ini bukan hanya terjadi pada gaharu saja akan tetapi terjadi juga pada tanaman berkayu lainnya, seperti manggis, cendana, ramin dll.Hal ini terlihat pula dari data yang telah diperoleh dimana gaharu yang ditanam dari pucuk memiliki masa inisiasi tunas yang lambat. Umumnya tanaman tahunan terinduksi kepada perpanjangan tunas, tidak seperti tanaman semusim yang memiliki daya multiplikasi yang lebih cepat.
Induksi Tunas
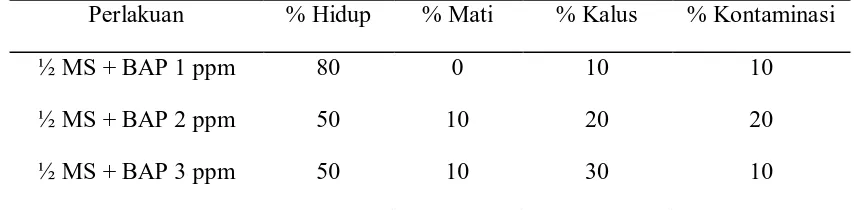
kalus terbesr terdapat pada media dengan BAP 3 pppm dengan nilai 30% sedangkan untuk tingkat kontaminasi terbesar terdapat pada media dengan BAP 2 ppm dengan nilai 20%. Untuk persen tumbuh terkecil terdapat pada media dengan BAP 2 dan 3 ppm dengan nilai 50%. Untuk lebih jelas data persentase tumbuh tunas dapat dilihat pada Tabel 1.
Tabel 1. Persentase pertumbuhan tunas A. malacensis pada media ½ MS + BAP Perlakuan % Hidup % Mati % Kalus % Kontaminasi
½ MS + BAP 1 ppm 80 0 10 10
½ MS + BAP 2 ppm 50 10 20 20
½ MS + BAP 3 ppm 50 10 30 10
Tingginya persen hidup pada BAP 1 ppm ini diduga disebabkan karena konsentrasi BAP yang diberikan. Dimana menurut Mariska dkk (2003) bahwa konsentrasi BAP yang baik untuk diberikan pada tahap induksi tunas adalah sedikit yaitu antara 0.01-1.00 ppm, apabila konsentrasi yang diberikan lebih tinggi maka tingkat kematian tunas juga semakin tinggi. Dimana pemberian BAP dengan konsentrasi tinggi dapat memicu peningkatan fenol pada tanaman sehingga dapat menyebabkan kematian pada jaringan pucuk sebelum terbentuk tunas. Selain kematian jaringan pemberian BAP dalam jumlah besar juga dapat menyebabkan terbentuknya kalus.
tunas adalah BAP dengan konsentrasi rendah yaitu antara 0-1 ppm. Ini telah dibuktikan pada beberapa tanaman tahunan berkayu seperti Gaharu (Kosmiati dkk), Tabat Barito (Kristina), Manggis (Kosmiati dkk) dll.
Pemberian BAP dengan konsentrasi tinggi dapat mempercepat terjadinya kalus, hal ini disebabkan karena sifat yang dimiliki oleh hormon ini yang sama dengan kinetin yang memiliki aktifitas kimia yang rendah sehingga jaringan tanaman tidak dapat langsung membentuk organ (tunas). Hal ini sesuai dengan pernyataan Wattimena (1992) bahwa BAP dan adenin merupakan 2 jenis sitokinin yang memiki aktifitas kimia yang sangat rendah. BAP merupakan salah satu hormon yang tidak memiliki gugus substitusi sehingga pada konsentrasi tinggi dapat menghambat pertumbuhan atau pembentukan tunas tanaman.
Jumlah tunas yang dihasilkan dipengaruhi oleh kondisi eksplan atau fisiologi eksplan yang digunakan. Pada awalnya A. malaccensis merupakan tanaman yang dibudidayakan secara vegetatif yaitu dengan teknik stek batang, stek pucuk, cangkok batang dan kultur jaringan. Semakin mudah eksplan dibudidaya secara vegetatif dapat mempengaruhi terbentuknya tunas. Hal ini sesuai dengan pernyataan Yusnita (2003) yang menyatakan bahwa kemampuan tumbuh suatu tanaman yang diperbanyak secara in vitro dipengaruhi oleh kondisi tumbuhan dihabitatnya. Secara umum tanaman yang
mudah diperbanyak secara konvensional akan mudah diperbanyak secara in vitro. Tabel 2. Respon tunas A. malaccensis 2 bulan setelah kultur pada media ½ MS + BAP
Perlakuan Jumlah Tunas (buah) Waktu Pembentukan Tunas (hari)
½ MS+ BAP 1 ppm 1 15.7
½ MS+ BAP 2 ppm 1 16.8
Pemberian BAP dengan konsentrasi rendah sangat berpengaruh selain untuk waktu bertunas juga berpengaruh terhadap panjang tunas yang dihasilkan. Dari pengamatan yang telah dilakukan diperoleh bahwa tunas terpanjang setelah pengamatan 2 bulan adalah pada media ½ MS + BAP 1 ppm. Dan tunas terendah pada media ½ MS + BAP 2 ppm. dapat dilihat pada Tabel 3.
Gambar 1. Penampilan tunas A. malaccensis pada media ½ MS + BAP Tabel 3. Rataan tinggi tunas A. malaccensis pada media ½ MS + BAP
Konsentrasi ZPT Rataan Tinggi Tunas (mm)
½ MS+ BAP 1 ppm 11.9b
½ MS+ BAP 2 ppm 5.1a
½ MS+ BAP 3 ppm 3.75a
Catatatn a tidak berpengaruh dan b berpengaruh
Perpanjangan Tunas
Induksi tunas yang telah dilakukan didapat bahwa tunas lebih cepat terinduksi pada BAP 1 ppm dan yang terpanjang terdapat pada BAP 1 ppm. Untuk meningkatkan pertumbuhan (panjang) tunas serta induksi akar, maka dilakukan penginduksian pada media lain dengan menggunakan kombinasi hormon Auksin dan Giberelin.
Menurut Wattimena (1992) pemberian kombinasi auksin secara bersama-sama pada media dapat memicu perpanjangan tunas. GA memiliki fungsi yang sangat baik dalam pembelahan sel dan pembentukan organ, sedangkan hormon IAA memiliki fungsi yang sangat baik dalam memicu pembentukan sel baru sehingga jika kedua hormon dipadukan akan ada interaksi yang dapat memicu pertumbuhan pada bagian meristematik tunas tersebut.
Hal ini didukung pula oleh pernyataan Mariska (2000) yang menyatakan bahwa hormon yang biasa digunakan untuk percobaan eksplorasi, adalah pemberian auksin dan sitokinin yang sangat dibutuhkan dalam kultur jaringan. Biasanya kedua hormon ini digunakan secara bersama-sama sehingga dihasilkan interaksi terhadap diferensiasi jaringan tanaman (Mariska, 2002).
kadar IAA yang diberikan maka tunas yang terbentuk semakin baik, sedangkan semakin rendah konsentrasi auksin yang diberikan maka pembentukan tunas juga semakin lambat.
Pada media dengan IAA rendah, ruas yang terbentuk pendek-pendek, tumbuh kurang baik dan terbentuk kalus pada pangkal batang (Gambar 2). Terbentuknya kalus pada pangkal tunas gaharu diduga karena konsentrasi zat pengatur tumbuh IAA yang diberikan terlalu tinggi.
Gambar 2. Penampilan tunas gaharu pada konsentrasi IAA 1 ppm
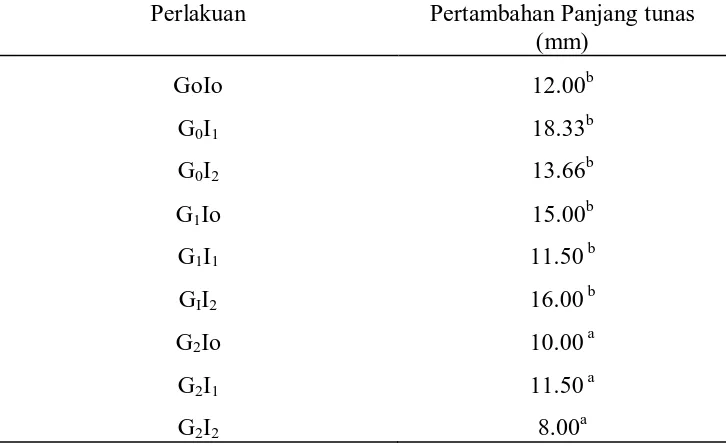
Tabel 3. Rataan tinggi Tunas A. malaccensis (mm) pada Perlakuan Kombinasi ZPT pada Media ½ MS
Perlakuan Pertambahan Panjang tunas (mm)
GoIo 12.00b
G0I1 18.33b
G0I2 13.66b
G1Io 15.00b
G1I1 11.50 b
GII2 16.00 b
G2Io 10.00 a
G2I1 11.50 a
G2I2 8.00a
Pada Tabel 3 diketahui bahwa tunas terpanjang dari perlakuan kombinasi ZPT pada media ½ MS terdapat pada perlakuan G0I1 dengan nilai 18.33 mm, sedangkan untuk
tunas terendah (terpendek) pada perlakuan ini terdapat pada perlakuan G2I2 dengan nilai
8.00 mm. Dari data diatas dapat dilihat bahwa pemberian auksin pada media berpengaruh terhadap pembentukan tunas gaharu pada media.
Ketidakseragaman hasil yang diperoleh disebabkan karena faktor eksplan yang digunakan tidak seragam, dimana sebelum ditanam tinggi awal tunas tidak diukur. Selain itu faktor konsentrasi IAA dan GA juga sangat mempengaruhi terhadap pembentukan tunas.
Data diatas menunjukkan bahwa IAA tinggi (1 ppm) berpengaruh terhadap perpanjangan tunas apabila dikombinasikan dengan GA yang rendah (0,5 ppm), sedangkan IAA yang rendah berpengaruh terhadap tinggi apabila dikombinasikan dengan GA yang rendah. Untuk kontrol ( IAA 0 dan GA 0) pertumbuhan tunas terlihat normal dengan nilai 12.00 mm. Dari data ini dapat dilihat bahwa pada media ½ MS tanpa penambahan zpt tunas gaharu dapat tumbuh normal dengan kecepatan waktu rata-rata 11.6 hari.
Kedua hormon ini mampu merangsang pembentukan sel yang mengarah kepada perpanjangan tunas, maka kombinasi kedua hormon ini menyebabkan terjadinya keseimbangan hormon dalam jaringan tanaman sehingga tunas yang terbentuk semakin bertambah panjang. Tunas yang terbentuk pada media dengan kombinasi IAA dan GA dapat dilihat pada Gambar 3.
Gambar 3. Penampilan Tunas A. malacensis pada media ½ MS + IAA dan GA
Induksi Akar (hari)
Menurut Rostiana (2007) bahwa tingginya konsentrasi auksin yang diberikan, berpengaruh terhadap induksi akar dimana kelebihan auksin akan meningkatkan produksi etilen sehingga pertumbuhan akar dapat terhambat. Etilen pada konsentrasi tertentu menyebabkan hambatan dalam pembentukan akar.
Setelah dilakukan pengamatan selama ± 1 bulan (30 hari) pada tunas belum ditemukan adanya pengaruh pemberian hormon IAA dan GA terhadap pembentukan akar dari tunas gaharu. Diduga hal ini dipengaruhi konsentrasi ZPT yang diberikan. Dimana konsentrasi auksin sangat mempengaruhi terhadap pembentukan akar.
KESIMPULAN DAN SARAN
Kesimpulan
Dari penelitian yang telah dilaksanakan dapat disimpulkan bahwa:
1. Pemberian hormon BAP sebesar 1 ppm berpengaruh nyata terhadap panjang tunas gaharu, tunas terpanjang yaitu 11.9 mm yang diperoleh pada pengamatan 14 hst 2. Pemberian IAA dengan konsentrasi 0.5 ppm tanpa GA memebrikan pengaruh
nyata terhadap pertambahan panjang tunas gaharu yaitu 18.33 mm yang diperoleh pada pengamatan 7 hst
3. Pemberian IAA dan GA pada setiap konsentrasi tidak menghasilkan akar..
Saran
DAFTAR PUSTAKA
Bangun, MK. 2008. Perancangan Percobaan. Fakultas Pertanian Universitas Sumatera Utara, Medan.
Dephut. 2008. Mempercepat Produksi Gaharu dengan Teknologi Inokulasi.
http:/www.dephut.go.id/index.php?q=id/node/3947. [ 12 Desermber 2008] Dinyunita, 2005. Kultur Jaringan Tanaman.
http:/www.indobiogen.or.id/terbitan/agrobiogen/abstrak/agrobiogen_voli_no2_2 005_62-67.php [27 Juni 2010]
Gomez,K.A dan A.A.Gomez.1995. Prosedur Statistika Untuk Penelitian Pertanian. Universitas Indonesia Press. Jakarta.
Harahap, 2005. Respon Kultur Embrio Kemenyan Toba dan Kemenyan Durame pada Media MS dengan Berbagai konsentrasi ZPT. Skripsi. Universitas Sumatera Utara. Medan.
Hendaryono dan Wijayani. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman Secara Vegetatif Modern. Kanisius. Yogyakarta.
Kosmiatin, M. Husni, .A. dan Mariska,.I. 2005. Perkecambahan dan Perbanyakan Gaharu secara In Vitro. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor .
Mariska, I. 2002. Perkembangan Penelitian Kultur in vitro pada Tanaman Industri,
Pangan, dan Hortikultura. Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
Rostiana. 2007. Pengaruh indole butyric acid dan naphtaleine acetic acid terhadap induksi perakaran tunas piretrum [chrysanthemum cinerariifolium (trevir.)Vis.] Klon prau 6 secara in vitro. Balai Penelitian Tanaman.Obat. Jakrta
Santoso, U. dan Nursandy, F..2004. Kultur Jaringan Tanaman. Edisi II. Universitas Muhamadyah Malang Press. Malang.
Standar Nasional Indonesia. 1999. Gaharu. Jakarta. Diakses dari http://www.bpdas musi.net/_userdata/BkGaharu.pdf. [24 Novemeber 2008]
Tambuan, P.P. 2005. Pengaruh Kombinasi NAA dan BA Terhadap Regenerasi Hipokotil Mahoni ( Swietenia mahagoni) Secara In Vitro. Universitas Sumatera Utara. Medan.
Tarigan, K. 2004. Profil Pengusahaan (Budidaya) Gaharu. Departemen Kehutanan, Pusat Bina Penyuluhan Kehutanan. Jakarta.
Trisetyagunadi. 2008. Jamur. Trisetiagunas Blog. Jakarta. Diakses dari www. Situs Hijau.co.id. [01 Desember 2008]
Wulandari, Y.F. 2000. Gaharu. http:/www.Manggala.or.id. [24 Oktober 2008].
Lampiran 1.Komposisi media Murashige dan skoog (MS) Tabel 1 komposisi
Bahan Kimia Jumlah (mg/l)
NH4NO3 (Natrium Nitrat)
KNO3 (Kalium Nitrat)
CaCl22H2O (Calcium Chloride Dihydrate)
MgSO47H2O (Magnesium Sulfat
Heptahydrate)
KH2PO4(Kalium Pospat)
FeSO4..7H2O( Ferrous Sulfate Heptahydrate)
Na2EDTA( Sodium Ethylene Diamine Tetra
Acetic)
MnSo4.4H2O (Manganese Sulfate
Tetrahydrate)
Zn So47H2O( Zinc Sulfate Heptahydrate)
H3BO3 ( Boric Acid)
Kl (Potasium iodide)
Na2MOO42H2O( Molybdic Acid Sodium
Dihydrate)
CuSO45H2O( Cupric Sulfate Pentahydrate)
CoCl26 H2O (Cobalt Chloride Hexahydrate)
Lampiran 2
Komposisi dan cara pembuatan Larutan stok
1. Ditimbang semua bahan dengan berat NH4NO3 (6.60 gr), KNO3(7.6 gr),
CaCl22H2O(1.76 gr), MgSO47H2O(1.48 gr), KH2PO4(0.68 gr) Myo
inositol(0.4gr),Gula(120gr) dan agar-agar (32 gr). 2. Pembuatan Stok
a. stok A (NH4NO3 ) diperoleh dengan melarutkan bahan kedalam gelas piala yang
berisi air aquades sebanyak 300 ml. Bahan kimia dilarutkan hingga tidak terjadi pengendapan, lalu ditambah lagi air aquades hingga volume menjadi 500 ml. Kemudian disimpan dan diberi label.
b. Stok B KNO3 diperoleh dengan melarutkan bahan kedalam gelas piala yang berisi
air aquades sebanyak 300 ml. Bahan kimia dilarutkan hingga tidak terjadi pengendapan, lalu ditambah lagi air aquades hingga volume menjadi 500 ml. Kemudian disimpan dan diberi label
c. Stok C CaCl22H2O diperoleh dengan melarutkan bahan kedalam gelas piala yang
berisi air aquades sebanyak 300 ml. Bahan kimia dilarutkan hingga tidak terjadi pengendapan, lalu ditambah lagi air aquades hingga volume menjadi 500 ml. Kemudian disimpan dan diberi label
d. Stok D MgSO47H2O dan KH2PO4 diperoleh dengan melarutkan bahan kedalam
gelas piala yang berisi air aquades sebanyak 300 ml. Bahan kimia dilarutkan hingga tidak terjadi pengendapan, lalu ditambah lagi air aquades hingga volume menjadi 500 ml. Kemudian disimpan dan diberi label
e. Stok E FeSO4..7H2O dan Na2EDTA diperoleh dengan melarutkan bahan kedalam
gelas piala yang berisi air aquades sebanyak 300 ml. Bahan kimia dilarutkan hingga tidak terjadi pengendapan, lalu ditambah lagi air aquades hingga volume menjadi 500 ml. Kemudian disimpan dan diberi label
f. Stok F Hara Mikro seperti MnSo4.4H2O , Zn So47H2O , H3BO3 dll diperoleh
dengan melarutkan bahan kedalam gelas piala yang berisi air aquades sebanyak 300 ml. Bahan kimia dilarutkan hingga tidak terjadi pengendapan, lalu ditambah lagi air aquades hingga volume menjadi 500 ml. Kemudian disimpan dan diberi label
g. Stok G Myo inositol larutan ini diperoleh dengan melarutkannya pada air suling sebanyak 100 ml.
h. Stok ZPT . zpt yang digunakan adalah auksin dan sitokini.
i. auksin ditimbang 10 mg ( 0.1 gr) IAA, dilarutkan kedalam 20 ml aquades sambil diaduk dengan stirer hot plate. Ditetesi pelarut NAOH 1 N satu tetes atau dapat juga menggunakan alkohol 96%. Kemudian ditepatkan volume larutan hingga 100 ml. Stok 1000 ppm.
Lampiran 4.
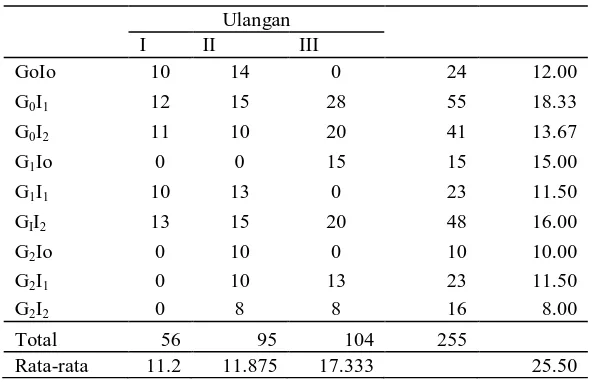
Data pertumbuhan tunas gaharu (hari) pada media 1/2 MS + BAP
Perlakuan Ulangan
Data panjang tunas gaharu (mm) pada media 1/2MS + BAP
Data panjang tunas gaharu pada media ½ MS + BAP
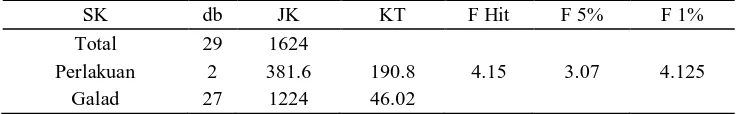
SK db JK KT F Hit F 5% F 1%
Total 29 1624
Perlakuan 2 381.6 190.8 4.15 3.07 4.125
Lampiran 5
Data pertumbuhan tunas gaharu (hari) pada media ½ MS+ IAA dan GA
Data pertambahan tunas A .malaccensis pada media ½ MS + IAA dan GA