Lampiran 1.
Data pengamatan rendemen
Perlakuan Ulangan Total Rataan
Lampiran 2.
Data pengamatan kadar air (%)
Perlakuan Ulangan Total Rataan
I II
Daftar analisis sidik ragam kadar air
Lampiran 3.
Data pengamatan kadar abu (%)
Perlakuan Ulangan Total Rataan I II
Daftar analisis sidik ragam kadar abu (%)
Lampiran 4.
Data pengamatan berat ekivalen
Perlakuan Ulangan Total Rataan
I II
Daftar analisis sidik ragam berat ekivalen
Lampiran 5.
Data pengamatan kandungan metoksil
Perlakuan Ulangan Total Rataan
I II
Daftar analisis sidik ragam kadar metoksil
Lampiran 6.
Data pengamatan kadar galakturonat
Perlakuan Ulangan Total Rataan
I II
Daftar analisis sidik ragam kadar galakturonat
Lampiran 7.
Proses ekstraksi pektin dari kulit durian
DAFTAR PUSTAKA
Adryansah, A., H. Novendri, Prasetyo dan M. Fahrurrozi. 2006. Ekstraksi Pektin dari Limbah Kulit Buah Coklat. JBPTITBCHE/2006-11-08/14;23;03. Agricenter. 2013. Budidaya Durian. www.agricenter,jogjaprov.go.id
Baker, R. A. 1994. Pectin. Carbohydrate Polymer. 12: 133-138. Dalam Fitriani, V. 2002. Ekstraksi dan Karakter isasi Pektin dari Kulit Jeruk Lemon (Citrus medica var Lemon). Skripsi. Departemen Teknologi Industri Pertanian. Fakultas Teknologi Pert anian. Institut Pertanian. Bogor.
Bangun, M.K. 1991. Rancangan Percobaan Untuk Menganalisis Data. Bagian Biometri. Fakultas Pertanian USU, Medan.
Belitz, H. F and Grosch. 1987. Food Chemistry. Spinger Verlag. Berlin, Germany.
BPS. 2013. Statistik Perdagangan Ekspor Impor Indonesia, diolah Pusdatin Perdagangan, Kementerian Perdangangan, Jakarta.
Bravermen, J.B.S. 1949. Citrus Products Chemical Composition and Chemical
Technology. Interscience Publiser Inc, New York. Dalam Budiyanto, A
dan Yulianingsih, 2008. Pengaruh Suhu dan Waktu Ekstraksi terhadap Karakter Pektin dari Ampas Jeruk Siam (Citrus nobilis L.). J. Pasca Pan. Budiyanto, A dan Yulianingsih. 2008. Pengaruh Suhu dan Waktu Ekstraksi
characterization of Pectins from Sunflower head residue. Can. Inst. Food
Technol 57:1439-1445. Dalam Budiyanto, A dan Yulianingsih, 2008. Pengaruh Suhu dan Waktu Ekstraksi terhadap Karakter Pektin dari Ampas Jeruk Siam (Citrus nobilis L.). J. Pasca Pan.
Desrosier, N.W. 1988. Teknologi Pengawetan Pangan. Terjemahan M. Muljohardjo. UI-Press, Jakarta.
Diperta. 2012. Produksi Durian.Diperta@jabarprov.go.id. (19 April 2013). Direktorat Gizi Depkes RI. 1996. Daftar Komposisi Bahan Makanan. Bhratara
Karya Aksara, Jakarta. Dalam Nugraha, D. E., 2013. Kandungan Kimia Durian. http://www.dheunicorn.com. (20 April 2013).
Ditjen POM. 1994. Farmakope Indonesia. Edisi IV. Departemen Kesehatan RI, Jakarta. Hal 654-655.
Fennema. 1996. Food Chemistry. Edisi 3. Marcel Dekker. Inc., New York. Dalam Budiyanto, A dan Yulianingsih, 2008. Pengaruh Suhu dan Waktu
Ekstraksi terhadap Karakter Pektin dari Ampas Jeruk Siam (Citrus nobilis L.). J. Pasca Pan 5(2): 37-44.
Fessenden, R. J dan J. S, Fessenden. 1996. Fundamental of Organic Chemistry Harper Collins Publisher. Montana.
Food Chemical Codex. 1996. Preparation of Soy Hull Pectins. Food Chemistry 65(4) : 416-467. http://arjournals.annualreviews.org. Dalam Hariyati., 2006. Ekstraksi dan Karakteristik Pektin dan Limbah Proses Pengolahan Jeruk Pontianak. Skripsi IPB, Bogor.
Fitriani, V. 2003. Ekstraksi dan Karakter isasi Pektin dari Kulit Jeruk Lemon (Citrus medica var Lemon). Skripsi. Departemen Teknologi Industri Pertanian. Fakultas Teknologi Pertanian. IPB, Bogor.
Goycoolea, F.M. dan Adriana Cardenas. 2003. Pectins from Opuntia Spp. : A
Short Review. J.PACD. 17-29.
Guichard, E. S., A, Issanchou., Descovieres dan P. Etievant. 1991. Pectin
Concentration, Molekular Weight and De gree of Esterification. Influence on Volatile Composition and Sensory Caracteristic of Strawberry Jam.
J. Food Sci, 56:1621. Dalam Hariyati., 2006. Ekstraksi dan Karakteristik Pektin dan Limbah Proses Pengolahan Jeruk Pontianak. Skripsi IPB, Bogor.
Hanifah, N. 2002. Kajian Sifat Fisik Kimia dan Organoleptik Pektin Kulit Pisang dari beberapa Varietas dan Tingkat Kematangan. J. Sains dan Tek. Indonesia V5.N5, hal 151-155/Humas-BPPT, Jakarta.
Hanum, F., M. D. K., Irza, dan A. T. Martha. 2012. Ekstraksi Pektin dari Kulit Buh pisang Raja. J. Tek. Kim.USU, Vol 1, No.2. USU, Medan.
Hart, H. Craine, L. E and Hart, D. J. 2003. Kimia Organik. Penerjemah: Achmadi S. S. Edisi Kesebelas. Erlangga, Jakarta. Hal. 511.
Herbstreith, K and G. Fox. 2005. Pectin. http://www.herbstreith fox. (22 April 2013)
Herfiyanti. 2010. Kulit Durian Pengental Cendol. FMIPA-UNTAN, Pontianak.
http://www.borneotribune.com. (19 April 2013).
Hoejgaard, S. 2004. Pectin Chemistry, Funcionality, and Applications.
http://www.cpkelco.com/Ptalk/ptalk.htm. (22 April 2013)
Hulme, A. S. 1971. The Biochemistry of Fruits and Their Products. Vol 2. Academic-Press, London. Dalam Fitriani, V. 2003. Ekstraksi dan Karakter isasi Pektin dari Kulit Jeruk Lemon (Citrus medica var Lemon). Skripsi. Departemen Teknologi Industri Pertanian. Fakultas Teknologi Pertanian. IPB, Bogor.
Kirby, K.W and R. L. Whistler. 1977. Encyclopadia of Science and Technology. Vol 9. Mc.Graw Hill Book Company, New York.
Kirk and Othmer. 1967. Dalam Betty dan Soebrata., 2011. Encyclopedia of
Chemistry technology. Second Edition. Volume 14. Jhon Wiley and Serc
Inc, New York. Hal 635.
Lubis, M. A. 2003. Pengaruh Jumlah Pengendap dan Alat Pengering pada Proses Pembuatan Pektin Berbahan Baku Kulit Jeruk Manis. Skripsi. IPB, Bogor. Maulidina. 2012. Manfaat Kulit Durian. Http://id.wikipedia.org. (19 April 2013). Napitupulu, R. M. 2010. Bertanam Durian Unggul.Penebar Swadaya, Bogor.
Nugraha, D. E. 2013. Kandungan Kimia Durian. http://www.dheunicorn.com. (20 April 2013).
Potter, N.N. 1986. Food Science. Van Nostrand Reinhold, New York.
Santoso, P. J. 2012. Balai Penelitian Tanaman Buah Tropika.
Balitby@litbang.deptan.go.id. (22 April 2013).
Smith, C.J.B and E.F. Bryant. 1967. Properties of Pectin Fractions Seperated On
Diethylaminoetyl Cellulosa Columns. J. Food Sci. 32:197.
Sofiana, H., K, Triaswuri., S. B, Sasongko. 2012. Pengambilan Pektin dari Kulit Pepaya Dengan Cara Ekstraksi. J. Teknologi Kim Ind. Vol 1, No 1. Tahun 2012. Hal 482-486.
Untung, O. 2008. Durian Untuk Kebun Komersial dan Hobi. Penebar Swadaya, Jakarta.
Widarto, H. 2009. Uji Aktifitas Minyak Atsiri Kulit Durian sebagai Obat Nyamuk Elektrik. Skripsi. UMS, Yogyakarta.
Wijayanti, M. 2011. Uji Vitamin C dan Organoleptik Terhadap Jelly dari Buah Apel Hijau dengan Penambahan Gula Pasir dan Pektin dari Albedo Kulit Durian. Skripsi. UMS, Surakarta. Wikipedia, 2012. Durian.
http://id.wikipedia.org (20 April 2013).
Wikipedia, 2011. Kulit Durian. http://id.wikipedia.org (20 April 2013). Wikipedia, 2012. Durian. http://id.wikipedia.org (20 April 2013).
Willats, W.G.T., J. P. Knox and J. D. Mikhelsen. 2006. Pectin : New Insights Into An Old Polymer Are Starting To Gel. Trends in Food Science & Technology. 17: 97-104.
Winarno, F. G. 2007. Kimia Pangan dan Gizi. Gramedia Pustaka Utama. Jakarta. Wong, W.W., Abbas F. M. A., Liong, M.T., Azhar, M.E. 2008. Modification of
Durian Rind Pectin for Improving Biosorbent Ability International Food Research Journal 15(3), 363-365.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Mei 2013 – Juli 2013 di Laboratorium Teknologi Pangan Fakultas Pertanian Universitas Sumatera Utara, Medan.
Bahan Penelitian
Bahan utama yang digunakan dalam penelitian ini adalah kulit durian dengan varietas gantal mas yang diperoleh dari pedagang durian di Medan.
Reagensia
Bahan-bahan kimia yang digunakan adalah alkohol, asam asetat, HCl, akuades, NaCl, NaOH, dan phenolptalein.
Alat Penelitian
Peralatan yang digunakan dalam penelitian ini antara lain alat-alat kaca, pH universal, termometer, oven, desikator, cawan alumunium, cawan porselin, tanur, timbangan analitik, dan penjepit.
Metode Penelitian (Bangun, 1991)
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap (RAL) yang terdiri dari dua faktor, yaitu :
Faktor I : Konsentrasi pengendap, terdiri dari 4 taraf, yaitu : P1 = Etanol 65%
Faktor II : Lama pengendapan, terdiri dari 4 taraf, yaitu : Q1 = 14 jam
Q2 = 16 jam Q3 = 18 jam Q4 = 20 jam
Banyaknya kombinasi perlakuan atau Treatment Combination (Tc) adalah 4 x 4 = 16, maka jumlah ulangan (n) minimum adalah sebagai berikut :
Tc (n-1) ≥ 15 16 (n-1) ≥ 15 16 n ≥ 31
n ≥ 1,93 ... dibulatkan menjadi 2
Jadi, untuk ketelitian dalam penelitian ini dilakukan ulangan sebanyak 2 kali.
Model Rancangan (Bangun, 1991)
Penelitian ini dilakukan dengan model rancangan acak lengkap (RAL) dua faktorial dengan model sebagai berikut :
ijk= µ + αi+ βj+ (αβ)ij+ εijk dimana :
ijk : Hasil pengamatan dari faktor P pada taraf ke-i dan faktor Q pada taraf ke-j dalam ulangan ke-k
µ : Efek nilai tengah
αi : Efek faktor P pada taraf ke-i βj : Efek faktor Q pada taraf ke-j
(αβ)ij : Efek interaksi faktor P pada taraf ke-i dan faktor Q pada taraf ke-j
Apabila diperoleh hasil yang berbeda nyata dan sangat nyata maka uji dilanjutkan dengan uji beda rataan, menggunakan uji Least Significant Range (LSR).
Pelaksanaan Penelitian
Kegiatan yang dilakukan dalam penelitian ini terdiri dari 2 tahap, yaitu : Tahap 1 : Pembuatan Larutan
a. Larutan asam asetat glasial
Penggunaan larutan pengestrak tergantung pada kemampuan dan daya serap bahan terhadap air karena berpengaruh terhadap sifat pektin, warna dan flavor yang dihasilkan. Ada yang menggunakan asam pekat dan juga asam encer seperti ekstraksi pektin dari kulit jeruk (Fitriani, 2003). Untuk penelitian ini digunakan asam asetat pekat.
b. Larutan NaOH 0,1 N
Dilarutkan NaOH sebanyak 5,4 g dengan akuades sampai batas tera labu ukur 1000 ml.
c. Larutan NaOH 0,25 N
Dilarutkan NaOH sebanyak 13,5 g dengan akuades sampai batas tera labu ukur 1000 ml.
d. Larutan HCl 0,25 N
Diencerkan larutan HCl 37% (12,063N) sebanyak 20,72 ml dalam labu ukur 1000 ml dan ditambahkan akuades sampai batas tera.
e. Preparasi sampel
mengiris kulit bagian terluar. Kemudian bagian dalam kulit tersebut dicuci bersih dari kotoran menggunakan air.
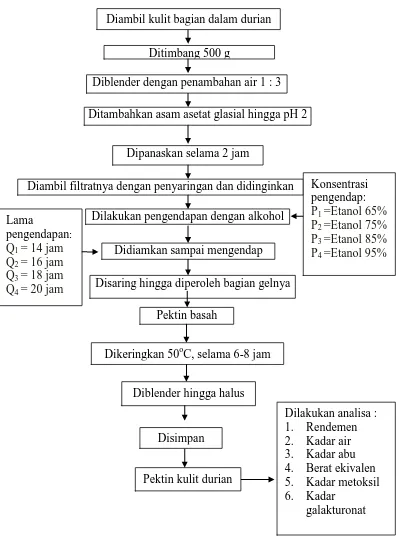
Tahap 2 : Ekstraksi Pektin a. Ekstraksi
Kulit durian bagian dalam ditimbang 500 g dan ditambahkan air 1 : 3 untuk mempermudah dalam pemblenderan. Dihaluskan bahan dengan blender, kemudian ditambahkan dengan larutan asam asetat hingga pH 2, kemudian dipanaskan selama 2 jam. Selanjutnya disaring menggunakan kain saring. Filtratnya diambil dan didinginkan pada suhu ruang.
b. Pengendapan
Pengendapan dilakukan dengan penambahan pengendap alkohol dengan menggunakan 4 taraf konsentrasi berbeda, yaitu alkohol 65%, alkohol 75%, alkohol 85%, alkohol 95% masing-masing 1 : 1 dari filtrat yang diambil dan didiamkan dengan 4 taraf waktu yang berbeda, yaitu 14 jam, 16 jam, 18 jam, 20 jam. Kemudian disaring menggunakan kain saring sehingga diperoleh bagian gelnya.
c. Pengeringan
Setelah didapat pektin basah (bagian gel), dikeringkan pada suhu 50oC selama 6-8 jam. Kemudian pektin kering diblender hingga diperoleh pektin halus.
Pengamatan dan pengukuran data
Rendemen (Ranganna, 1977 di dalam Fitriani, 2003)
Pektin yang telah dihaluskan ditimbang beratnya sebagai berat pektin (akhir) kemudian dihitung rendemennya dimana berat awal bahan yaitu 500 gr.
berat akhir
Rendemen (%) = x 100 % berat awal
Kadar air (Ranganna, 1977 di dalam Fitriani, 2003)
Sebanyak dua gram pektin dikeringkan di dalam oven pada suhu 60oC selama 1 jam kemudian dinaikkan suhunya 105oC selama 4 jam. Selanjutnya didinginkan dalam desikator dan ditimbang sampaidiperoleh bobot yang tetap.
berat awal - berat akhir
Kadar air (% bb) = x 100 % berat awal
Kadar abu (Ranganna, 1977 di dalam Fitriani, 2003)
Cawan porselin dikeringkan di dalam oven pada suhu 100oC, kemudian didinginkan di dalam desikator dan ditimbang sebagai wadah. Satu gram pektin ditimbang di dalam cawan porselin yang telah diketahui bobotnya. Pengabuan dilakukan dalam tanur pada suhu 600oC selama 3–4 jam. Abu yang telah diperoleh didinginkan di dalam desikator dan ditimbang sampai diperoleh bobot konstan.
Berat abu (g)
Berat ekivalen (Ranganna, 1977 di dalam Fitriani, 2003)
Berat ekivalen merupakan ukuran terhadap kandungan gugus asam galakturonat polimer tidak teresterkan. Pektin sebanyak 0,5 g dibasahi dengan 5 ml etanol dan dilarutkan dalam 100 ml air suling bebas karbonat yang berisi satu gram NaCl. Larutan hasil campuran tersebut dititrasi perlahan-lahan dengan 0,1N NaOH memakai indikator fenolptalein sampai terjadi perubahan menjadi merah kekuningan yang bertahan sedikitnya 30 detik.
berat pektin (mg) Berat ekivalen (BE) =
ml NaOH x N NaOH
Kadar metoksil (Ranganna, 1977 di dalam Fitriani, 2003)
Kadar metoksil merupakan jumlah mol metanol yang terdapat di dalam 100 mol asam galakturonat. Larutan netral dari penentuan berat ekivalen (BE) ditambah 25 ml larutan 0,25 N NaOH, dikocok dan dibiarkan selama 30 menit pada suhu kamar dalam keadaan tertutup. Selanjutnya ditambahkan 25 ml larutan 0,25 N HCl dan dititrasi dengan larutan 0,1 N NaOH dengan indikator fenol merah sampai titik akhir seperti pada penentuan BE.
ml NaOH x 31 x N NaOH
Kadar metoksil (%) = x 100 %
Berat contoh (mg)
Kadar galakturonat (McCready, 1965 di dalam Fitriani, 2003)
Kadar galakturonat merupakan jumlah asam galakturonat polimer yang ada dalam bahan. Kadar galakturonat dihitung dari mek (miliekivalen) NaOH yang diperoleh dari penentuan BE dan kadar metoksil.
mek (BE + metoksil) x 176
Kadar galakturonat (%) = x 100 % Berat contoh (mg)
Gambar 6. Skema ekstraksi pektin dari kulit durian Dipanaskan selama 2 jam
Diambil filtratnya dengan penyaringan dan didinginkan Ditimbang 500 g
Diblender dengan penambahan air 1 : 3 Ditambahkan asam asetat glasial hingga pH 2
Dilakukan pengendapan dengan alkohol
Disaring hingga diperoleh bagian gelnya Didiamkan sampai mengendap
Dikeringkan 50oC, selama 6-8 jam
HASIL DAN PEMBAHASAN
Pengaruh Konsentrasi Pengendap Terhadap Parameter yang Diamati
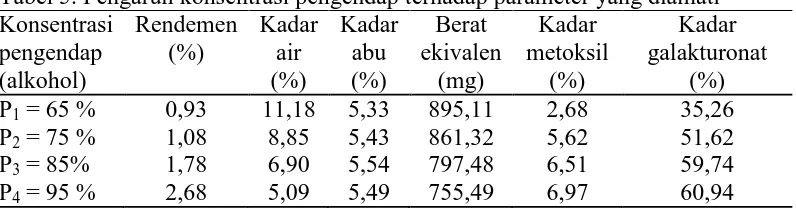
Secara umum hasil penelitian yang dilakukan menunjukkan bahwa penambahan konsentrasi pengendap memberikan pengaruh terhadap rendemen, kadar air, kadar abu, berat ekivalen, kandungan metoksil, dan kadar galakturonat seperti Tabel 5. berikut ini.
Tabel 5. Pengaruh konsentrasi pengendap terhadap parameter yang diamati Konsentrasi
(alkohol 65%) yaitu sebesar 2,68%. Kadar galakturonat tertinggi terdapat pada perlakuan P4 (alkohol 95%) yaitu sebesar 60,94% dan yang terendah terdapat pada perlakuan P1 (alkohol 65%) yaitu sebesar 35,26%.
Pengaruh Lama Pengendapan Terhadap Parameter yang Diamati
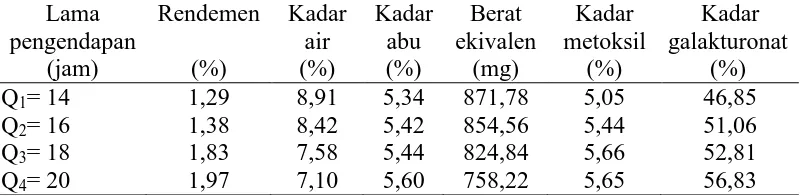
Secara umum hasil penelitian yang dilakukan menunjukkan bahwa lama pengendapan memberikan pengaruh terhadap rendemen, kadar air, kadar abu, berat ekivalen, kandungan metoksil, dan kadar galakturonat seperti Tabel 6. berikut ini.
Tabel 6. Pengaruh lama pengendapan terhadap parameter yang diamati
Dari Tabel 6 dapat dilihat bahwa lama pengendapan memberikan pengaruh terhadap parameter yang diuji. Rendemen tertinggi terdapat pada perlakuan Q4 (20 jam) yaitu sebesar 1,97% dan terendah terdapat pada perlakuan Q1 (14 jam) yaitu sebesar 1,29%. Persen kadar air tertinggi diperoleh pada perlakuan Q1 (14 jam) yaitu sebesar 8,91% dan yang terendah diperoleh pada perlakuan Q4 (20 jam) yaitu sebesar 7,10%. Persen kadar abu tertinggi terdapat pada perlakuan Q4 (20 jam) yaitu sebesar 5,60% dan yang terendah terdapat pada perlakuan Q1 (14 jam) yaitu sebesar 5,34%. Berat ekivalen tertinggi terdapat pada perlakuan Q1 (14 jam) yaitu sebesar 871,78 mg dan yang terendah terdapat pada perlakuan Q4 (20 jam) yaitu sebesar 758,22 mg. Kadar metoksil tertinggi terdapat pada perlakuan Q3 (18 jam) yaitu sebesar 5,66% dan yang terendah perlakuan Q1
(14 jam) yaitu sebesar 5,05%. Kadar galakturonat tertinggi terdapat pada perlakuan Q4 (20 jam) yaitu sebesar 56,83% dan yang terendah terdapat pada perlakuan Q1 (14 jam) yaitu sebesar 46,85%.
Rendemen (%)
Pengaruh konsentrasi pengendap terhadap rendemen
Dari daftar sidik ragam (Lampiran 1) dapat dilihat bahwa konsentrasi pengendap memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap rendemen pektin kulit durian yang dihasilkan. Untuk melihat pengaruh konsentrasi pengendap yang ditambahkan telah dilakukan uji LSR seperti pada Tabel 7.
Tabel 7. Uji LSR efek utama pengaruh konsentrasi pengendap terhadap rendemen Jarak LSR Konsentrasi pengendap Rataan Notasi
0,05 0,01 0,05 0,01
- - - P1 = Alkohol 65% 0,93 c C
2 0,126 0,173 P2 = Alkohol 75% 1,08 c C 3 0,132 0,182 P3 = Alkohol 85% 1,78 b B 4 0,136 0,187 P4 = Alkohol 95% 2,68 a A Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5%
(huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
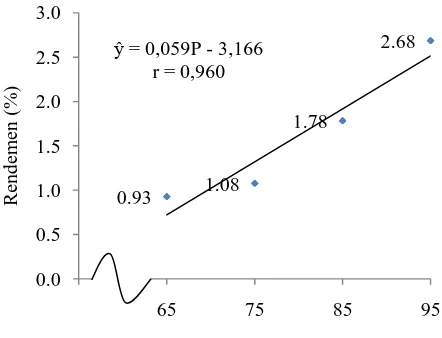
Dari Tabel 7 dapat dilihat bahwa perlakuan P1 berbeda tidak nyata dengan P2 dan berbeda sangat nyata dengan P3 dan P4. Perlakuan P2 berbeda sangat nyata dengan P3 dan P4. Perlakuan P3 berbeda sangat nyata dengan P4. Rendemen tertinggi terdapat pada perlakuan P4 (alkohol 95%) yaitu sebesar 2,68% dan terendah terdapat pada P1 (alkohol 65%) yaitu sebesar 0,93%.
sehingga mengganggu stabilitas larutan koloidalnya dan akibatnya pektin akan terkoagulasi (Rouse, 1977). Dewan Ilmu Pengetahuan, Teknologi dan Industri Sumatera Barat (2004) menyatakan bahwa mengendapkan pektin dengan menggunakan etanol 95% menghasilkan rendemen yang lebih banyak daripada menggunakan etanol 80%.
Gambar 7. Grafik hubungan konsentrasi pengendap dengan rendemen
Pengaruh lama pengendapan terhadap rendemen
Dari daftar sidik ragam (Lampiran 1) dapat dilihat bahwa lama pengendapan memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap rendemen pektin kulit durian yang dihasilkan. Untuk melihat pengaruh lama pengendapan telah dilakukan uji LSR seperti pada Tabel 8.
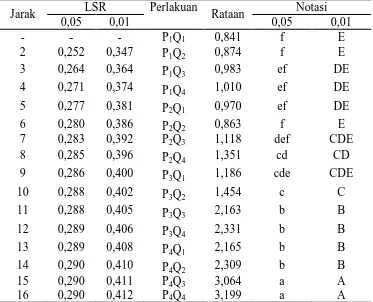
Tabel 8. Uji LSR efek utama pengaruh lama pengendapan terhadap rendemen
Jarak LSR Lama pengendapan Rataan Notasi
0,05 0,01 0,05 0,01
- - - Q1 = 14 jam 1,29 c B
2 0,126 0,173 Q2 = 16 jam 1,38 c B
3 0,132 0,182 Q3 = 18 jam 1,83 b A
4 0,136 0,187 Q4 = 20 jam 1,97 a A
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
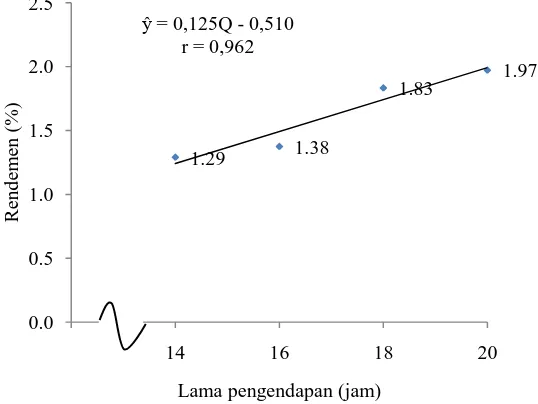
Dari Tabel 8 dapat dilihat bahwa perlakuan Q1 berbeda tidak nyata dengan Q2 dan berbeda sangat nyata dengan Q3 dan Q4. Perlakuan Q2 berbeda sangat nyata dengan Q3 dan Q4. Perlakuan Q3 berbeda nyata dengan Q4. Rendemen tertinggi terdapat pada perlakuan Q4 (20 jam) yaitu sebesar 1,97 % dan terendah terdapat pada Q1 (14 jam) yaitu sebesar 1,29%. Hubungan antara lama pengendapan dengan rendemen dapat dilihat pada Gambar 8.
Gambar 8. Grafik hubungan lama pengendapan dengan rendemen
antara rantai-rantai pektin yang menghasilkan jaringan kompleks molekul polisakarida. Sebagian dari molekul ini berikatan melalui ikatan hidrogen, disela-sela jaringan ini molekul air dan molekul terlarut terperangkap (pektin) dan meningkatnya difusi larutan ke dalam sel jaringan bahan, selanjutnya dapat meningkatkan banyaknya pektin yang terlarut atau terlepas. Dewan Ilmu Pengetahuan, Teknologi dan Industri Sumatera Barat (2004) yang menyatakan bahwa mengendapkan pektin dengan menggunakan etanol 95% selama 22 jam menghasilkan rendemen yang lebih banyak daripada menggunakan etanol 80%. Lama pengendapan yang optimal adalah 18-22 jam untuk menghasilkan rendemen yang maksimal.
Pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan terhadap rendemen
Dari hasil sidik ragam (Lampiran 1) dapat dilihat bahwa interaksi antara konsentrasi pengendap dan lama pengendapan memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap rendemen pektin kulit durian yang dihasilkan. Untuk melihat pengaruh interaksi keduanya telah dilakukan uji LSR seperti pada Tabel 9.
air oleh molekul terlarut yang mengakibatkan kontak yang lebih luas antara rantai-rantai pektin yang menghasilkan jaringan kompleks molekul polisakarida. Sebagian dari molekul ini berikatan melalui ikatan hidrogen, disela-sela jaringan ini molekul air dan molekul terlarut terperangkap (pektin) dan meningkatnya difusi larutan ke dalam sel jaringan bahan, selanjutnya dapat meningkatkan banyaknya pektin yang terlarut atau terlepas.
Tabel 9. Uji LSR pengaruh interaksi antara konsentrasi pengendap dan lama
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Gambar 9. Grafik hubungan interaksi konsentrasi pengendap dan lama pengendapan dengan rendemen
Kadar Air (%)
Pengaruh konsentrasi pengendap terhadap kadar air
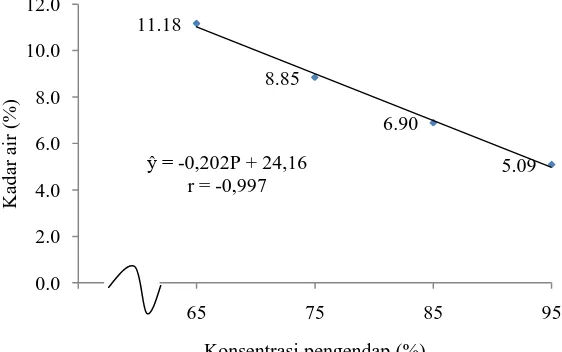
Dari daftar sidik ragam (Lampiran 2) dapat dilihat bahwa konsentrasi pengendap memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap kadar air pektin kulit durian yang dihasilkan. Untuk melihat pengaruh konsentrasi pengendap yang ditambahkan telah dilakukan uji LSR seperti pada Tabel 10. Tabel 10. Uji LSR efek utama pengaruh konsentrasi pengendap terhadap kadar air
Jarak LSR Konsentrasi pengendap Rataan Notasi
0,05 0,01 0,05 0,01
- - - P1= Alkohol 65% 11,18 a A
2 0,35 0,48 P2= Alkohol 75% 8,85 b B 3 0,37 0,51 P3= Alkohol 85% 6,90 c C 4 0,38 0,52 P4= Alkohol 95% 5,09 d D
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Perlakuan P3 berbeda sangat nyata dengan P4. Kadar air tertinggi terdapat pada perlakuan P1 (alkohol 65%) yaitu sebesar 11,18% dan terendah terdapat pada P4 (alkohol 95%) yaitu sebesar 5,09%. Hubungan antara konsentrasi pengendap (alkohol) dengan kadar air dapat dilihat pada Gambar 10.
Gambar 10. Grafik hubungan konsentrasi pengendap dengan kadar air Semakin tinggi konsentrasi pengendap (alkohol) yang digunakan maka kadar air yang diperoleh pada ekstraksi pektin kulit durian semakin menurun. Hal ini sesuai dengan Hariyati (2006) yang menyatakan semakin tinggi konsentrasi pengendap akan meningkatkan jumlah air yang menguap selama pengendapan sehingga mempermudah proses pengeringan yang berakibat semakin rendahnya kadar air pektin. Konsentrasi pengendap yang tinggi mampu menghidrolisis polimer pektin sehingga rantai molekulnya menjadi lebih pendek dan semakin pendek rantai polimer pektin akan semakin mempermudah pengeringan karena kandungan air terperangkap didalamnya semakin sedikit.
Pengaruh lama pengendapan terhadap kadar air
Dari daftar sidik ragam (Lampiran 2) dapat dilihat bahwa lama pengendapan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap kadar air pektin kulit durian yang dihasilkan. Untuk melihat pengaruh lama pengendapan yang digunakan telah dilakukan uji LSR seperti pada Tabel 11. Tabel 11. Uji LSR efek utama pengaruh lama pengendapan terhadap kadar air
Jarak LSR Lama pengendapan Rataan Notasi
0,05 0,01 0,05 0,01
- - - Q1 = 14 jam 8,91 a A
2 0,35 0,48 Q2 = 16 jam 8,42 b A
3 0,37 0,51 Q3 = 18 jam 7,58 c B
4 0,38 0,52 Q4 = 20 jam 7,10 d B
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Dari Tabel 11 dapat dilihat bahwa perlakuan Q1 berbeda nyata dengan Q2, dan berbeda sangat nyata dengan Q3 dan Q4. Perlakuan Q2 berbeda sangat nyata dengan Q3 dan Q4. Perlakuan Q3 berbeda nyata dengan Q4. Kadar air tertinggi terdapat pada perlakuan Q1 (14 jam) yaitu sebesar 8,91% dan terendah terdapat pada Q4 (20 jam) yaitu sebesar 7,10%.
semakin menurun. Dari data tersebut dapat dilihat bahwa kadar air hasil penelitian tersebut masih dibawah batas maksimum kadar air yang diperbolehkan yaitu maksimum 12% (Hariyati, 2006). Kadar air pektin tersebut dipengaruhi oleh derajat pengeringan pektin basah dan kondisi penyimpanan. Kadar air yang tinggi dapat menyebabkan tepung pektin mudah menyerap air sehingga mudah rusak karena lembab.
Gambar 11. Grafik hubungan lama pengendapan dengan kadar air
Pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan terhadap kadar air
Dari daftar sidik ragam (Lampiran 2) dapat dilihat bahwa interaksi konsentrasi pengendap dan lama pengendapan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap kadar air pektin hasil ekstraksi dari kulit durian yang dihasilkan. Sehingga uji LSR tidak dilanjutkan.
Kadar Abu (%)
Pengaruh konsentrasi pengendap terhadap kadar abu
Dari daftar sidik ragam (Lampiran 3) dapat dilihat bahwa konsentrasi pengendap memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap kadar abu pektin hasil ekstraksi dari kulit durian yang dihasilkan. Sehingga uji LSR tidak dilanjutkan.
Pengaruh lama pengendapan terhadap kadar abu
Dari daftar sidik ragam (Lampiran 3) dapat dilihat bahwa lama pengendapan memberikan pengaruh yang berbeda tidak nyata (P>0,05) terhadap kadar abu pektin hasil ekstraksi dari kulit durian yang dihasilkan. Sehingga uji LSR tidak dilanjutkan.
Pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan
terhadap kadar abu
Dari daftar sidik ragam (Lampiran 3) dapat dilihat bahwa interaksi konsentrasi pengendap dan lama pengendapan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap kadar abu pektin hasil ekstraksi dari kulit durian yang dihasilkan. Sehingga uji LSR tidak dilanjutkan.
Berat ekivalen
Pengaruh konsentrasi pengendap terhadap berat ekivalen
Tabel 12. Uji LSR efek utama pengaruh konsentrasi pengendap terhadap berat ekivalen
Jarak LSR Konsentrasi pengendap Rataan Notasi
0,05 0,01 0,05 0,01
- - - P1 = Alkohol 65% 895,11 a A 2 29,26 40,28 P2 = Alkohol 75% 861,32 b A 3 30,72 42,33 P3 = Alkohol 85% 797,48 c B 4 31,50 43,40 P4 = Alkohol 95% 755,49 d C
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Dari data Tabel 12 dapat dilihat bahwa pada perlakuan P1 berbeda nyata dengan P2, dan sangat nyata terhadap perlakuan P3 dan P4. Perlakuan P2 berbeda sangat nyata dengan P3 dan P4. Perlakuan P3 berbeda sangat nyata dengan P4. Berat ekivalen tertinggi diperoleh pada perlakuan P1 (Alkohol 65%) yaitu sebesar 895,11 mg dan yang terendah diperoleh pada perlakuan P4 (Alkohol 95%) yaitu sebesar 755,49 mg. Hubungan antara konsentrasi pengendap dengan berat ekivalen dapat dilihat pada Gambar 12.
Gambar 12. Grafik hubungan konsentrasi pengendap dengan berat ekivalen Semakin tinggi konsentrasi pengendap yang digunakan maka akan semakin menurun berat ekivalen pektin yang dihasilkan. Hal ini disebabkan oleh
konsentrasi alkohol yang berbeda-beda pada saat pengendapan membuat karakteristik gel dan bobot molekul akan menurun dengan meningkatnya konsentrasi alkohol. Hal itu kemungkinan akan menyebabkan terjadinya depolimerisasi pektin sehingga memiliki nilai berat ekivalen yang rendah. Budiyanto dan Yulianingsih (2008) menyatakan bahwa menurunnya berat ekivalen disebabkan oleh kadar air dari pektin yang dihasilkan. Semakin rendah kadar air pektin maka berat ekivalennya juga akan semakin rendah. Selain itu pada saat ekstraksi dengan suhu tinggi dapat menyebabkan proses deesterifikasi pektin menjadi asam pektat. Proses deesterifikasi tersebut akan meningkatkan jumlah gugus asam bebas. Peningkatan jumlah gugus asam bebas tersebut dapat menyebabkan berat ekivalen menurun.
Pengaruh lama pengendapan terhadap berat ekivalen
Dari daftar sidik ragam (Lampiran 4) dapat dilihat bahwa lama pengendapan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap berat ekivalen pektin kulit durian yang dihasilkan. Untuk melihat pengaruh lama pengendapan yang digunakan telah dilakukan uji LSR seperti pada Tabel 13.
Tabel 13. Uji LSR efek utama pengaruh lama pengendapan terhadap berat ekivalen
Jarak LSR Lama pengendapan Rataan Notasi
0,05 0,01 0,05 0,01
- - - Q1 = 14 jam 871,78 a A
2 29,26 40,28 Q2 = 16 jam 854,56 ab AB
3 30,72 42,33 Q3 = 18 jam 824,84 b B
4 31,50 43,40 Q4 = 20 jam 758,22 c C
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Hubungan antara lama pengendapan dengan berat ekivalen dapat dilihat pada Gambar 13.
Gambar 13. Grafik hubungan lama pengendapan dengan berat ekivalen Menurunnya berat ekivalen disebabkan oleh lama pengendapan yang semakin meningkat. Berat ekivalen juga menurun karena kadar air dari pektin yang dihasilkan. Semakin rendah kadar air pektin maka berat ekivalennya juga akan semakin rendah. Selain itu pada saat ekstraksi dengan suhu tinggi dapat menyebabkan proses deesterifikasi pektin menjadi asam pektat. Proses deesterifikasi tersebut akan meningkatkan jumlah gugus asam bebas. Peningkatan
jumlah gugus asam bebas tersebut dapat menyebabkan berat ekivalen menurun (Yulianingsih dan Budiyanto.,2008). Hal ini juga sesuai dengan Standar mutu pektin berdasarkan standar mutu IPPA (Hanum, dkk., 2012) yang menyatakan berat ekivalen pektin 600-800 mg.
Pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan
terhadap berat ekivalen
Dari daftar sidik ragam (Lampiran 4) dapat dilihat bahwa interaksi konsentrasi pengendap dan lama pengendapan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap berat ekivalen pektin hasil ekstraksi dari kulit durian yang dihasilkan. Sehingga uji LSR tidak dilanjutkan.
Kandungan Metoksil (%)
Pengaruh konsentrasi pengendap terhadap kandungan metoksil
Dari daftar sidik ragam (Lampiran 5) dapat dilihat bahwa konsentrasi pengendap memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap kandungan metoksil pektin hasil ekstraksi dari kulit durian yang dihasilkan. Untuk melihat pengaruh konsentrasi pengendap yang ditambahkan telah dilakukan uji LSR seperti pada Tabel 14.
Tabel 14. Uji LSR efek utama pengaruh konsentrasi pengendap terhadap kandungan metoksil
Jarak LSR Konsentrasi pengendap Rataan Notasi
0,05 0,01 0,05 0,01
- - - P1 = Alkohol 65% 2,68 d D 2 0,28 0,38 P2 = Alkohol 75% 5,62 c C 3 0,29 0,40 P3 = Alkohol 85% 6,51 b B 4 0,30 0,41 P4 = Alkohol 95% 6,97 a A
Dari data Tabel 14 dapat dilihat bahwa pada perlakuan P1 berbeda sangat nyata dengan P2, P3 dan P4. Perlakuan P2 berbeda sangat nyata dengan P3 dan P4. Perlakuan P3 berbeda sangat nyata dengan P4. Kandungan metoksil tertinggi diperoleh pada perlakuan P4 (alkohol 95%) yaitu sebesar 6,97% dan yang terendah diperoleh pada perlakuan P1 ( alkohol 65%) yaitu sebesar 2,68%. Hubungan antara konsentrasi pengendap dengan kandungan metoksil dapat dilihat pada Gambar 14.
Gambar 14. Grafik hubungan konsentrasi pengendap dengan kandungan metoksil Semakin tinggi konsentrasi pengendap maka kandungan metoksil pektin hasil ekstraksi dari kulit durian semakin tinggi. Hal ini dikarenakan kekuatan asam yang dimiliki oleh pengendap alkohol. Menurut Fessenden dan Fessenden (1996) di dalam Yunianta dan Wachida (2013) menyatakan bahwa hidrogen etanol (pKa = 50) memiliki kadar asam yang rendah sehingga tidak bisa menurunkan kandungan metoksil karena tidak bereaksi dan disebabkan oleh adanya penurunan senyawa non pektat pada dinding sel yang ikut terlarut selama
proses pengendapan sehingga kadar metoksilnya tinggi. Senyawa ini dapat berupa selulosa dan polisakarida yang tidak mempunyai gugus metoksil.
Pengaruh lama pengendapan terhadap kandungan metoksil
Dari daftar sidik ragam (Lampiran 5) dapat dilihat bahwa lama pengendapan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap kandungan metoksil pektin hasil ekstraksi dari kulit durian yang dihasilkan. Untuk melihat pengaruh lama pengendapan yang dilakukan telah dilakukan uji LSR seperti pada Tabel 15.
Tabel 15. Uji LSR efek utama pengaruh lama pengendapan terhadap kandungan metoksil
Jarak LSR Lama pengendapan Rataan Notasi
0,05 0,01 0,05 0,01
- - - Q1 = 14 jam 5,05 b B
2 0,28 0,38 Q2 = 16 jam 5,44 a A
3 0,29 0,40 Q3 = 18 jam 5,66 a A
4 0,30 0,41 Q4 = 20 jam 5,65 a A
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Dari data Tabel 15 dapat dilihat bahwa pada perlakuan Q1 berbeda sangat nyata dengan Q2, Q3, dan Q4. Perlakuan Q2 berbeda tidak nyata dengan Q3 dan Q4. Perlakuan Q3 berbeda tidak nyata dengan Q4. Kandungan metoksil tertinggi diperoleh pada perlakuan Q3 (18 jam) yaitu sebesar 5,66% dan yang terendah diperoleh pada perlakuan Q1 (14 jam) yaitu sebesar 5,05%.
Gambar 15. Grafik hubungan lama pengendapan dengan kandungan metoksil Dari grafik tersebut dapat di lihat bahwa semakin lama waktu pengendapan maka kandungan metoksilnya akan semakin meningkat. Hal ini dapat disebabkan karena gugus karboksil bebas yang teresterifikasi semakin meningkat (Budiyanto dan Yulianingsih, 2008). Hal ini juga dikarenakan semakin lama pengendapan maka asam yang terkandung akan semakin berkurang sehingga kadar metoksilnya akan semakin meningkat, karena kandungan metoksil dipengaruhi oleh asam, gula, dan pH dalam pembentukan gel selama pengendapan (Lubis, 2003).
Pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan terhadap kandungan metoksil
Tabel 16. Uji LSR efek utama pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan terhadap kandungan metoksil
Jarak LSR Perlakuan Rataan Notasi
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Kandungan metoksil tertinggi terdapat pada kombinasi perlakuan P4Q4 yaitu sebesar 7,74% dan terendah terdapat pada kombinasi perlakuan P1Q1 yaitu sebesar 1,82%. Hal ini terjadi karena sebagian gugus karboksil pada polimer pektin telah mengalami esterifikasi dengan metil menjadi gugus metoksil. Hal ini juga dikarenakan proses demetilasi dan deesterifikasi (hidrolisa gugus ester) pada pektin yang dapat meningkatkan kadar metoksil yang dihasilkan. Semakin banyak oksigen yang terlarut dalam larutan akan mempercepat reaksi, dengan demikian bila pengendapan yang lama akan mengakibatkan proses demetilasi. Proses demetilasi akan memindahkan gugus metil yang terekstraksi sehingga mengakibatkan banyak gugus metil yang dilepaskan (Hanifah, 2002).
Gambar 16. Grafik hubungan interaksi antara konsentrasi pengendap dan lama pengendapan terhadap kandungan metoksil
Kadar Galakturonat (%)
Pengaruh konsentrasi pengendap terhadap kadar galakturonat
Dari daftar sidik ragam (Lampiran 6) dapat dilihat bahwa konsentrasi pengendap memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap kadar galakturonat pektin hasil ekstraksi dari kulit durian yang dihasilkan. Untuk melihat pengaruh konsentrasi pengendap yang ditambahkan telah dilakukan uji LSR seperti pada Tabel 17.
Dari data Tabel 17 dapat dilihat bahwa pada perlakuan P1 berbeda sangat nyata dengan perlakuan P2, P3 dan P4. Perlakuan P2 berbeda sangat nyata dengan P3 dan P4. Perlakuan P3 berbeda tidak nyata dengan P4. Kadar galakturonat tertinggi diperoleh pada perlakuan P4 (Alkohol 95%) yaitu sebesar 60,94% dan yang terendah diperoleh pada perlakuan P1 ( Alkohol 65%) yaitu sebesar 35,26%.
Tabel 17. Uji LSR efek utama pengaruh konsentrasi pengendap terhadap kadar galakturonat
Jarak LSR Konsentrasi pengendap Rataan Notasi
0,05 0,01 0,05 0,01
- - - P1 = Alkohol 65% 35,26 c C 2 2,48 3,42 P2 = Alkohol 75% 51,62 b B 3 2,61 3,59 P3 = Alkohol 85% 59,74 a A 4 2,67 3,68 P4 = Alkohol 95% 60,94 a A Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada
taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Hubungan antara konsentrasi pengendap dengan kadar galakturonat dapat dilihat pada Gambar 17.
Gambar 17. Grafik hubungan konsentrasi pengendap dengan kadar galakturonat Dari data tersebut dapat kita simpulkan bahwa semakin tinggi konsentrasi pengendap maka semakin tinggi kadar galakturonat pektin hasil ekstraksi kulit
durian. Hal ini terjadi karena adanya senyawa nonuronat (D-galaktosa, L-arabinosa dan L-rhamnosa) yang terikut pada proses pengendapan pektin oleh
alkohol dan hal ini juga disebabkan karena etanol bersifat lebih polar sehingga dapat mengendapkan lebih banyak pektin (Willats, dkk., 2006).
Pengaruh lama pengendapan terhadap kadar galakturonat
Dari daftar sidik ragam (Lampiran 6) dapat dilihat bahwa lama pengendapan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap kadar galakturonat pektin hasil ekstraksi dari kulit durian yang dihasilkan.
Untuk melihat pengaruh lama pengendapan yang dilakukan telah dibuat uji LSR seperti pada Tabel 18.
Tabel 18. Uji LSR efek utama pengaruh lama pengendapan terhadap kadar galakturonat
Jarak LSR Lama pengendapan Rataan Notasi
0,05 0,01 0,05 0,01
- - - Q1 = 14 jam 46,85 a A
2 2,48 3,42 Q2 = 16 jam 51,06 b B
3 2,61 3,59 Q3 = 18 jam 52,81 b B
4 2,67 3,68 Q4 = 20 jam 56,83 c C
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
Dari data Tabel 18 dapat dilihat bahwa pada perlakuan Q1 berbeda sangat nyata dengan Q2, Q3 dan Q4. Perlakuan Q2 berbeda tidak nyata dengan Q3 dan berbeda sangat nyata dengan Q4. Perlakuan Q3 berbeda sangat nyata dengan Q4. Kadar galakturonat tertinggi diperoleh pada perlakuan Q4 (20 jam) yaitu sebesar 56,83% dan yang terendah diperoleh pada perlakuan Q1 (14 jam) yaitu sebesar 46,85%.
(Hariyati, 2006). Hubungan antara lama pengendapan dengan kadar galakturonat dapat dilihat pada Gambar 18.
Gambar 18. Grafik hubungan lama pengendapan dengan kadar galakturonat
Pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan terhadap kadar galakturonat
Tabel 19. Uji LSR efek utama pengaruh interaksi antara konsentrasi pengendap dan lama pengendapan terhadap kadar galakturonat
Jarak LSR Perlakuan Rataan Notasi
Keterangan : Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata 1% (huruf besar).
semakin lama sehingga kadar galakturonat yang dihasilkan juga semakin meningkat (Hariyati, 2006).
Hubungan interaksi antara konsentrasi pengendap dan lama pengendapan terhadap kadar galakturonatdapat dilihat pada Gambar 19.
Gambar 19. Grafik hubungan interaksi antara konsentrasi pengendap dan lama pengendapan dengan kadar galakturonat
Uji Coba Perlakuan (Selai Kuini)
KESIMPULAN DAN SARAN
Kesimpulan
Dari hasil penelitian pengaruh konsentrasi pengendap dan lama pengendapan terhadap parameter yang diamati dapat diambil kesimpulan :
1. Konsentrasi pengendap (alkohol) memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap rendemen, kadar air, berat ekivalen, kandungan metoksil, dan kadar galakturonat dan berbeda tidak nyata (P>0,05) terhadap kadar abu. 2. Lama pengendapan memberikan pengaruh berbeda sangat nyata (P<0,01)
terhadap rendemen, kadar air, berat ekivalen, kandungan metoksil dan kadar galakturonat dan berbeda tidak nyata (P>0,05) terhadap kadar abu.
3. Interaksi antara konsentrasi pengendap (alkohol) dan lama pengendapan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap rendemen, kandungan metoksil dan kadar galakturonat dan berbeda tidak nyata (P>0,05) terhadap kadar air, kadar abu dan berat ekivalen.
Saran
1. Perlu dilakukan penelitian lebih lanjut untuk mengetahui kekuatan gel atau
jelly grade pektin hasil ekstraksi kulit durian tersebut.
2. Perlu dilakukan penelitian lebih lanjut dengan pencucian gel hasil pengendapan agar tidak menimbulkan bau asam yang menyengat.
TINJAUAN PUSTAKA
Durian
Durian ( Durio zibethinus ) termasuk buah terpopuler di negara-negara anggota ASEAN, terutama di Thailand, Malaysia, dan Indonesia. Masyarakat sudah akrab dengan aroma, rasa, dan bentuk buah yang berduri. Buah khas daerah tropis ini termasuk ordo Malvaceae, family bombacaceae, dan genus durio. Durian bisa disebut buah termahal, karena bagian yang bisa dimakan hanya 19-32% dari total bobot buah keseluruhannya, selain kulit dan biji yang juga dimanfaatkan sebagai kompos dan olahan lainnya (Untung, 2008).
Pada musim buah durian, berbagai varietas dan tipe diperdagangkan di berbagai pasar dalam negeri. Untuk pasar luar negeri, penyuluhan hasil rekomendasi varietas unggul serta promosi masih perlu ditingkatkan sesuai permintaan pasar. Demikian pula peningkatan dan aplikasi teknologi budidaya durian di sentra produksi dalam upaya peningkatan mutu buah. Pesaing Indonesia sebagai penghasil buah durian adalah Thailand dan Malaysia. Sentra produksi durian di Indonesia adalah Sumatera Utara, Riau, Jambi, Jawa Barat, Jawa Tengah, DI Yogyakarta, Jawa Timur, dan Kalimantan Barat (Diperta, 2012).
untuk aroma permen, es krim, susu, dan beberapa jenis minuman penyegar lainnya (Agricenter, 2013).
Kandungan Gizi Durian
Durian adalah buah yang kontroversial, meskipun banyak orang yang menyukainya, namun sebagian yang lain malah tidak suka dengan aromanya. Sebutan populernya adalah "raja dari segala buah" (King of fruit). Daging buah durian dalam 100 gram memiliki kandungan gizi seperti disajikan pada Tabel 2. Tabel 2. Kandungan gizi buah durian per 100 g bahan
Kandungan Gizi Satuan Jumlah
Energi kal 134,0
Protein g 2,4
Lemak g 3,0
Karbohidrat g 28,0
Kalsium mg 7,4
Fosfor mg 44,0
Zat besi (Fe) mg 1,3
Vitamin A SI 175,0
Vitamin B1 mg 0,1
Vitamin C mg 53,0
Air g 65,0
Bagian dapat dimakan % 22,0
Sumber : Direktorat Gizi Depkes RI (1996) dalam Nugraha (2013).
Manfaat Durian
Durian sangat kaya akan sumber gizi yang bermanfaat untuk kesehatan kita diantaranya:
Mencegah anemia (kurang darah) : dengan kadar besi tinggi, durian dapat merangsang produksi hemoglobin dalam darah sehingga membantu penderita anemia.
Menurunkan tekanan darah : durian mengandung kalium sangat tinggi tetapi kadar garam yang rendah, membuat durian sempurna untuk menurunkan tekanan darah dengan jumlah durian < 6 biji. Sehingga US Food and Drug
Administration telah mengizinkan industri durian untuk mengajukan
pengakuan resmi terhadap kemampuan durian mengurangi resiko dari tekanan darah tinggi dan stroke.
Melancarkan BAB : karena mengandung serat tinggi, menambahkan durian dalam menu harian dapat membantu menormalkan proses pencernaan dan melancarkan BAB.
Meredakan nyeri lambung : durian memiliki efek antacid alamiah pada tubuh, apabila anda mengalami nyeri perut.
Memperbaiki sistem syaraf : durian mengandung vitamin B yang tinggi yang dapat membantu memperbaiki sistem syaraf.
Mengontrol diet bagi orang kegemukan : studi di the Institute of Psychology di Austria menunjukkan bahwa tekanan pekerjaan mendorong orang banyak mengkonsumsi makanan ringan dan untuk mengontrolnya kita perlu makan makanan berkadar karbohidrat tinggi setiap 2 jam untuk menjaga kestabilan. Durian merupakan buah berkadar karbohidrat 20% hingga 39%.
kronis. Durian juga menetralisir kelebihan asam dan mengurangi iritasi dengan melapisi dinding perut.
Membantu berhenti merokok : durian dapat juga membantu orang yang berusaha berhenti merokok, karena mengandung vitamin B6, B12, kalium, dan magnesium yang membantu tubuh bertahan dari efek ketagihan nikotin. Mencegah stress : kalium adalah salah satu mineral vital yang membantu menormalkan denyut jantung, mengirim oksigen ke otak, dan meregulasi keseimbangan air dalam tubuh. Ketika kita stress, metabolisme kita meningkat sehingga mengurangi kadar kalium. Hal ini dapat diseimbangkan kembali dengan makan durian yang mengandung kalium tinggi.
(Santoso, 2012).
Kulit Durian
Kulit durian merupakan limbah yang mengandung minyak atsiri, flavonoid, saponin, selulosa, lignin, serta kandungan pati. Kandungan dalam kulit durian tersebut mempunyai bau yang sangat menyengat dan tidak disukai oleh nyamuk, sebab efek kandungan tersebut bisa mempengaruhi syaraf pada nyamuk dan akibat yang ditimbulkan adalah nyamuk mengalami kelabilan dan akhirnya mati. Kulit durian dalam jumlah besar dapat digunakan sebagai obat dalam dunia farmasi karena kandungan kimianya, perekat kayu dalam olahan kayu dan dari turunan karbohidratnya yang dapat diolah untuk menghasilkan pektin yang merupakan bahan perekat dan pengental yang sangat dibutuhkan dalam jumlah besar oleh industri-industri olahan makanan (Widarto, 2009).
pektin yang dapat digunakan sebagai bahan baku pembuatan selai. Selai durian dibuat dari bahan-bahan sebagai berikut : kulit durian, gula pasir, asam sitrat, natrium benzoate, garam dapur, vanili, air, dan essens durian. Proses pengolahan meliputi tahapan sebagai berikut : pencucian kulit buah, perebusan, pendiaman, penambahan bahan, pemasakan, penambahan bahan, dan pengemasan (Wikipedia, 2011).
Komposisi Kimia Kulit Durian
Kulit durian secara proporsional mengandung unsur selulose yang tinggi (50-60%) dan kandungan lignin (5%) serta kandungan pati yang rendah (5%) sehingga dapat diindikasikan bahan tersebut bisa digunakan sebagai campuran bahan baku papan olahan serta produk lainnya yang dimampatkan. Kandungan kimia kulit durian yang dapat dimanfaatkan adalah pektin. Pektin merupakan senyawa yang baik digunakan sebagai pengental dalam makanan, sehingga pektin yang diperoleh dari kulit durian dapat dimanfaatkan sebagai pengental dalam pembuatan cendol (Wikipedia, 2011).
Limbah kulit durian mengandung berbagai vitamin dan juga mengandung karbohidrat, lemak, protein, serat, kalsium, fosfor, asam folat, magnesium, potasium atau kalium (K), zat besi (Fe), zink, mangan (Mn), tembaga (Cu), karoten, thiamin, niasin, dan riboflavin (Nugraha, 2013).
Jelly durian tidak hanya dapat dibuat dari daging buah yang mahal, tetapi
Manfaat Kulit Durian
Kulit durian dapat dikeringkan dan digunakan sebagai bahan bakar, terutama untuk mengasapi ikan. Selain itu, kulit juga dapat dimanfaatkan sebagai abu gosok yang bagus. Caranya dengan mengeringkannya dan membakarnya sampai hancur (Napitupulu, 2010).
Adapun kandungan kimia kulit durian yang dapat dimanfaatkan adalah
senyawa pektin. Secara kimia, pektin merupakan polimer dari asam D-galakturonat yang dihubungkan oleh ikatan ß -1,4 glikosidik. Sebagian gugus
karboksil pada polimer pektin telah mengalami esterifikasi dengan metil menjadi gugus metoksil. Senyawa ini termasuk karbohidrat golongan polisakarida. Secara biokimia, karbohidrat adalah senyawa yang menghasilkan polihidroksil aldehida, polihidroksil keton bila dihidrolisis. Karbohidrat mengandung gugus fungsi karbonil dan banyak gugus hidroksil (Herfiyanti, 2010).
Pektin
Dalam SNI disebutkan bahwa pektin merupakan zat berbentuk serbuk kasar hingga halus yang berwarna putih kekuningan, tidak berbau, dan memiliki rasa seperti lendir. Pektin kering yang telah dimurnikan berupa kristal yang berwarna putih dengan kelarutan yang berbeda-beda sesuai dengan kandungan metoksilnya. Pektin yang mempunyai kadar metoksil tinggi, larut dalam air dingin sedangkan pektin bermetoksil rendah, larut dalam alkali dan asam oksalat. Pektin tidak larut dalam aseton dan alkohol (Kirk dan Othmer, 1967 di dalam Betty M. Soebrata, 2011).
Pektin merupakan polisakarida diperoleh dari buah-buahan dan biasanya digunakan dalam pembuatan jeli dan sebagai bahan tambahan untuk pengental dalam makanan. Pektin ialah polimer linier dari asam D-galakturonat yang berikatan dengan ikatan 1,4-α-glikosidik. Asam D-galakturonat memiliki struktur yang sama seperti struktur D-galaktosa, perbedaannya terletak pada gugus alkohol primer C6 yang memiliki gugus karboksilat (Hart, dkk., 2003).
Kandungan pektin dalam buah-buahan dipengaruhi oleh tingkat kematangan buah, semakin matang buah maka kandungan pektin yang tidak larut akan menurun, sedangkan kandungan pektin yang larut dalam air akan meningkat, dimana jumlah pektin secara keseluruhan akan menurun (Belitz dan Grosch, 1987 di dalam Fitriani., 2003).
tersebut tidak berbahaya karena pada proses pemisahannya jumlah asam yang ditambahkan telah dicuci menggunakan alkohol yang kemudian dinetralkan hingga layak untuk dikonsumsi (Wong, dkk., 2008).
Pektin berasal dari bahasa latin “pectos” yang berarti pengental atau yang membuat sesuatu menjadi padat atau keras. Pektin merupakan turunan dari gula yang biasanya terdapat pada tanaman dalam jumlah yang sangat kecil dibandingkan karbohidrat lainnya. Pektin dibentuk oleh satuan-satuan gula dan asam galakturonat, dimana jumlah asam galakturonat ini lebih banyak dari pada gula sederhana. Pektin biasanya terdapat pada buah-buahan dan pada sayur-sayuran. Pektin larut air terutama air panas, sedangkan dalam bentuk larutan koloidal akan membentuk pasta. Bila pektin di dalam larutan ditambahkan gula dan asam maka akan terbentuk gel dan prinsip ini digunakan sebagai dasar pembuatan selai dan jeli. Pektin dan gum dapat ditambahkan ke dalam makanan sebagai pengikat dan penstabil (Potter, 1986).
Sumber Pektin
Pektin secara umum terdapat di dalam dinding sel primer tanaman, khususnya disela-sela antara selulosa dan hemiselulosa. Senyawa-senyawa pektin juga berfungsi sebagai bahan perekat antara dinding sel yang satu dengan yang lainnya. Bagian antara dua dinding sel yang berdekatan tersebut disebut lamela tengah (middle lamella). Senyawa-senyawa pektin merupakan polimer dari asam D-galakturonat yang dihubungkan dengan ikatan α (1,4)-glukosida, asam
Berikut adalah gambar pektin dalam jaringan tanaman (Hariyati, 2006).
Gambar 1. Struktur pektin dalam jaringan tanaman
Pada buah-buahan, kira-kira 80% dari gugus karboksil terdapat pada pektin dan kira-kira 20% lebih sudah termetilasi. Banyaknya gugus karboksil yang termetilasi akan mempengaruhi daya larut serta kemampuan untuk membentuk jelly. Pektin mengandung gugus metil yang berguna dalam pembuatan gel. Berdasarkan kandungan gugus metil, maka pektin dan asam pektinat mempunyai derajat metilisasi yang tinggi, sehingga dapat membentuk
jelly (Hulme, 1971, di dalam Fitriani., 2003).
Struktur dan Komposisi Kimia Pektin
Pektin tersusun atas molekul asam galakturonat yang berikatan dengan ikatan α-(1-4)-glikosida sehingga membentuk asam poligalakturonat. Gugus karboksil sebagian teresterifikasi dengan methanol dan sebagian gugus alkohol sekunder terasetilasi (Herbstreith dan Fox, 2005). Dibawah ini merupakan gambar
Gambar 2. Struktur kimia asam α-galakturonat
Menurut Hoejgaard (2004), pektin merupakan asam poligalakturonat yang mengandung metil ester. Pektin diekstraksi secara komersial dari kulit buah jeruk dan apel dalam kondisi asam. Masing-masing cincin merupakan suatu molekul dari asam poligalakturonat dan ada 300–1000 cincin seperti itu dalam suatu tipikal molekul pektin yang dihubungkan dengan suatu rantai linier. Berikut adalah gambar struktur kimia asam poligalakturonat.
Gambar 3. Struktur kimia asam poligalakturonat
Jenis-jenis Pektin
Berdasarkan banyaknya gugus karboksil yang mengalami esterifikasi, maka pektin dapat dibedakan menjadi dua bagian, yaitu :
- High Methoxy Pectin (HMP), yaitu pektin yang mengandung gugus metoksil
sekurang-kurangnya 7-8%. HMP dapat membentuk gel dengan gula dan asam pada kadar gula 60-65%.
- Low Methoxy Pectin (LMP), yaitu pektin yang mengandung gugus metoksil
kurang dari 7% (biasanya 3-5%). LMP dapat membentuk gel pada kadar gula 10-20% (Lubis, 2003).
Pektin dapat digolongkan menjadi dua kelompok utama, yaitu :
- Pektin berester tinggi, yaitu pektin yang mempunyai lebih besar 50% gugus karboksil yang teresterkan. Kandungan metoksil dari pektin yang berester tinggi adalah 8%.
- Pektin berester rendah, yaitu pektin yang mempunyai lebih kecil 50% gugus karboksil yang teresterkan. Pektin berester rendah mengandung lebih kecil dari 6% metoksil, biasanya 3-5%. Pektin berester rendah dibedakan dari pektin
berester tinggi berdasarkan kemampuan membentuk gel dengan atau tanpa gula (Kirby dan Whistler, 1977).
Sifat-sifat pektin
metoksilnya. Sifat fisik pektin tergantung dari karakteristik kimia pektin (Guichard, dkk, 1991, di dalam Hariyati., 2006).
Pektin dengan kadar metoksil lebih rendah dari 7% dapat membentuk gel. Pembentukan gel dari pektin dengan derajat metilasi tinggi dipengaruhi juga oleh konsentrasi pektin, persentase gula, dan pH. Pembentukan gel pektin metoksil tinggi terjadi melalui ikatan hidrogen diantara gugus karboksil bebas dan antara gugus hidroksil. Faktor yang mempengaruhi pembentukan gel dengan tingkat kekenyalan dan kekuatan tertentu meliputi pH, konsentrasi pektin, suhu, ion kalsium, dan gula (Chang dan Miyamoto, 1992, di dalam Budiyanto dan Yulianingsih, 2008).
Proses Produksi Pektin Persiapan bahan
Menurut Bravermen (1949) di Budiyanto dan Yulianingsih (2008), pada tahap persiapan bahan ini dilakukan perlakuan pendahuluan untuk menghindari kotoran, senyawa gula, dan bahan padat terlarut lainnya. Selain itu proses ini bertujuan untuk proses inaktivasi enzim pektin esterase yang dapat menghidrolisis pektin menjadi pektat. Kemudian dilakukan pencucian dengan air dingin dan harus diganti berulang-ulang agar pencucian berlangsung dengan baik. Jika pencucian tidak baik maka senyawa gula akan tinggal yang mengakibatkan terbentuknya jelly. Proses ini juga dimaksudkan untuk menghilangkan pigmen, senyawa gula dan kotoran-kotoran.
Ekstraksi pektin
dalam larutan asam encer yang berfungsi untuk menghidrolisis protopektin menjadi pektin. Ekstraksi ini dapat dilakukan dengan asam mineral seperti asam klorida atau asam sulfat. Makin tinggi suhu ekstraksi, makin singkat waktu yang dibutuhkan untuk mendapatkan hasil yang maksimum. Dalam hal ini, faktor keasaman yang digunakan tidak bisa diabaikan. Kisaran pH yang direkomendasikan 1,5–3,0 tetapi pH kisaran pada pH 2,6–2,8 lebih sering dipakai (Kirk dan Othmer, 1967).
Pengendapan
Presipitasi adalah proses pemisahan pektin dari larutannya dengan cara mengendapkan senyawa pektin tersebut. Cara presipitasi koloid (memberikan muatan yang berlawanan dengan muatan pektin). Pengendapan merupakan proses pemisahan pektin dari larutan dengan cara pengendapan senyawa pektinnya. Biasanya dilakukan dengan spray drying, salting out, dan dengan penambahan bahan pelarut organik seperti alkohol dan aseton. Spray drying jarang dilakukan karena mahal. Pengendapan dengan salting out juga tidak banyak dilakukan karena kesulitan untuk memisahkan pektin yang dihasilkan dan garam yang digunakan (Smith dan Bryant, 1967).
Industri Sumatra Barat (2004) mengendapkan pektin dengan menggunakan etanol 95% yang mengandung 2 ml asam klorida pekat setiap satu liter etanol sebanyak 1,5 kali volume filtrat selama 22 jam menghasilkan rendemen yang lebih banyak daripada menggunakan etanol 80%.
Etanol mempunyai titik didih yang rendah dan cenderung aman. Etanol juga tidak beracun dan berbahaya. Kelemahan penggunaan pelarut etanol adalah etanol larut dalam air dan juga melarutkan komponen lain seperti karbohidrat, resin, dan gum. Larutnya komponen ini mengakibatkan berkurangnya tingkat kemurnian oleoresin. Keuntungan menggunakan pelarut etanol dibandingkan dengan aseton yaitu etanol mempunyai kepolaran lebih tinggi sehingga mudah untuk melarutkan senyawa resin, lemak, minyak, asam lemak, karbohidrat, dan senyawa organik lainnya (Ramadhan dan Haries, 2010).
Pemurnian dan pengeringan
Pemurnian dilakukan dengan cara pencucian endapan atau presipitasi pektin tersebut dengan larutan etanol 95%. Kemudian hasil presipitasi yang dimurnikan tersebut dikeringkan dengan pengeringan oven pada suhu 40oC selama 5 jam. Pektin yang dikeringkan dihaluskan dan diayak untuk menghasilkan pektin yang seragam (Smith dan Bryant, 1967).
Mutu Pektin
minyak dalam air, obat pencuci perut, penstabil minuman atau es krim (Fennema, 1996, di dalam Budiyanto dan Yulianingsih., 2008).
Penambahan pektin pada makanan akan mempengaruhi proses metabolisme dan pencernaan khususnya padaadsorpsi glukosa dan kolesterol. Dalam industri makanan dan minuman, pektin dapat digunakan sebagai bahan pemberi tekstur yang baik pada roti dan keju, bahan pengental, dan stabilizer pada minuman sari buah (Baker, 1994 di dalam Fitriani., 2003).
Berdasarkan Food Chemical Codex spesifikasi mutu pektin adalah sebagai berikut :
Tabel 3. Spesifikasi mutu pektin komersial
Karakteristik Nilai Sumber : Food Chemical Codex, 1996, dalam Hariyati., 2006.
Menurut International Pectin Producers Association (IPPA) standar mutu pektin ditampilkan pada Tabel 4.
Tabel 4. Standar mutu pektin berdasarkan standar mutu IPPA
Gel Pektin
Gel merupakan suatu struktur semi padat dengan cairan yang terperangkap didalamnya. Pembentukan gel substansi pektat merupakan proses kompleks. Ada dua tipe gel substansi pektat, yaitu : gel pektin gula-asam-air dan gel-asam pektat atau asam pektinat yang gugus metil esternya rendah (Desrosier, 1988). Berikut adalah gambar struktur kimia dari pektin berkadar metoksil tinggi.
Gambar 4. Struktur kimia pektin berkadar metoksil tinggi
Sifat penting lainnya dari pektin adalah kemampuannya membentuk gel. Pada pektin bermetoksil tinggi diperkirakan sebagai suatu mekanisme dimana rantai pektin yang dihidrasi dengan kuat oleh molekul-molekul air sehingga kurang terhidrasi dengan cara penggantian molekul air oleh molekul terlarut, akibatnya terjadi kontak yang lebih luas antara rantai-rantai pektin yang menghasilkan jaringan kompleks molekul polisakarida (Canteri, dkk., 2005). Berikut ini adalah gambar struktur kimia pektin berkadar metoksil rendah.
PENDAHULUAN
Latar Belakang
Indonesia adalah negara yang kaya akan berbagai jenis buah, yang merupakan sumber penunjang gizi, sumber pendapatan, berperan dalam kelestarian lingkungan, mengurangi polusi, mencegah erosi serta sumber tenaga kerja bila diusahakan secara intensif. Misalnya adalah buah durian yang saat ini sangat populer di Indonesia, khususnya di Sumatera. Durian merupakan salah satu komoditi utama dari Sumatera yang memiliki nilai ekonomis yang cukup baik, karena selain dimakan dalam keadaan segar juga dapat diolah menjadi produk-produk yang lebih ekonomis lagi.
Produksi durian di Indonesia menurut Badan Pusat Statistika (BPS) tahun 2013 mencapai sekitar 1.818.949 ton. Bobot total buah terdiri dari tiga bagian diantaranya daging buah sekitar 20-35%, biji 5-15% dan sisanya adalah bagian kulit mencapai 60-75%. Hal ini menyatakan bahwa masyarakat hanya mengkonsumsi bagian daging buah saja, sisanya sekitar 65-80% dibuang.
Limbah merupakan salah satu masalah terbesar dalam pengolahan pangan karena dapat mencemari lingkungan baik dari segi penglihatan dan penciuman, selain itu dapat menimbulkan bibit-bibit penyakit seperti diare. Pemanfaatan dan pengolahan kembali limbah pangan sangat penting untuk meminimalkan produksi limbah di industri pangan. Pada saat puncaknya limbah kulit durian mencapai 100 ton per hari. Kandungan kimia kulit durian yang dapat dimanfaatkan adalah pektin. Hal ini dapat dijadikan parameter untuk pemanfaatan dan pengolahan limbah pangan yang masih memiliki nilai ekonomis ditinjau dari kandungan gizi dan kimia limbah tersebut. Pektin merupakan senyawa yang baik digunakan sebagai pengental dalam makanan. Kebutuhan pektin di Indonesia dapat dilihat pada Tabel 1.
Tabel 1. Kebutuhan pektin di Indonesia
No. Tahun Jumlah Impor (kg/tahun) Sumber : BPS (diolah Pusdatin Perdagangan, Kementerian Perdagangan)., 2013.
Tetapi kendalanya Indonesia belum mempunyai pabrik pengolahan pektin dan masih mengimpor pektin dari negara lain sementara sumber pektin di Indonesia tersedia begitu banyak bahkan limbah dari pengolahan buah-buahan atau sayuran itu sendiri dapat kita manfaatkan dan olah menjadi pektin. Jumlah impor pektin per tahun seperti yang terlihat pada Tabel 1 cukup besar hampir 100 ton per tahunnya, hal ini juga berpengaruh dalam pengurangan devisa negara yang cukup besar. Sumber pektin biasanya diperoleh dari kulit jeruk dan apel, sementara hampir semua buah dan sayuran mengandung senyawa pektin seperti kulit durian yang sering hanya digunakan sebagai bahan bakar atau pakan ternak ternyata kulitnya mengandung pektin.
Secara kimia pektin merupakan polimer dari asam D-galakturonat yang
dihubungkan oleh ikatan β -1,4 glikosidik. Sebagian gugus karboksil pada polimer pektin mengalami esterifikasi dengan metil (metilasi) menjadi gugus metoksil. Senyawa ini termasuk karbohidrat golongan polisakarida. Nilai ekonomi yang
dimiliki pektin cukup tinggi, harga eceran tepung pektin berkisar antara Rp 200.000 – Rp 300.000/kg. Pemakaian pektin dibidang industri telah dikenal
luas dan diizinkan di semua negara. Industri-industri di Indonesia selama ini mengimpor pektin dari luar negeri untuk memenuhi kebutuhannya karena belum adanya industri pektin di dalam negeri (Sofiana, dkk., 2012).
Dalam pengolahan pektin perlu diperhatikan sifat fisik dari sumber atau bahan yang akan diolah karena beberapa hal yang sangat mempengaruhi rendemen serta mutu pektin, antara lain bahan baku yang akan diekstrak, jenis asam yang digunakan (biasanya HCl, asam asetat, asam sitrat, asam nitrat, asam sulfat), suhu dan lama ekstraksi, pH, jenis pengendap yang digunakan (aseton, alkohol, garam metal, kalium sulfat, dan alumunium sulfat) biasanya untuk pengendapan secara komersial digunakan alkohol 96% untuk mendapatkan penggumpalan.
Penggumpalan pektin terjadi karena gangguan terhadap kestabilan dispersi koloidalnya. Pektin termasuk koloidal hidrofilik yang bermuatan negatif. Seperti koloid hidrofilik pada umumnya, pektin distabilkan terutama oleh hidrasi daripada muatannya. Penambahan zat pendehidrasi seperti alkohol dapat mengurangi stabilitas dispersi pektin karena efek dehidrasi mengganggu keseimbangan air dan pektin sehingga pektin akan menggumpal (Rouse, 1977).
Penggunaan alkohol sebagai pengendap merupakan cara yang paling tepat karena murah dan dapat membentuk endapan yang tegar, dibandingkan penggunaan spray drying dan salting out yang mahal dan sulit untuk memisahkan pektin yang dihasilkan dan garam yang digunakan. Tetapi ada juga bahan pelarut organik yaitu aseton yang dapat membentuk endapan yang tegar tetapi jarang digunakan karena mahal. Selain itu penggunaan alkohol sebagai pengendap juga lebih aman karena tidak beracun dan berbahaya.