KARAKTERISASI KIMIAWI, AKTIVITAS ANTIPROLIFERASI
SEL LESTARI TUMOR DAN AKTIVITAS FAGOSITOSIS SECARA
IN-VITRO
DARI FRAKSI BIOAKTIF RIMPANG TEMU PUTIH
[
Curcuma zedoaria
(Christm) Roscoe]
ROS SUMARNY
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI DISERTASI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Karakterisasi Kimiawi, Aktivitas Antiproliferasi Sel Lestari Tumor dan Aktivitas Fagositosis secara In-vitro dari Fraksi Bioaktif Rimpang Temu Putih [Curcuma zedoaria (Christm)
Roscoe] adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2006
ABSTRAK
ROS SUMARNY. Karakterisasi Kimiawi, Aktivitas Antiproliferasi Sel Lestari Tumor dan Aktivitas Fagositosis secara In-Vitro dari Fraksi Bioaktif Rimpang Temu putih [Curcuma zedoaria (Christm) Roscoe]. Dibimbing oleh BAMBANG PONTJO PRIOSOERYANTO, LATIFAH K. DARUSMAN, CHAIRUL dan IETJE WIENTARSIH.
Tujuan penelitian ini adalah mengevaluasi aktivitas antiproliferasi sel lestari tumor dan fagositosis secara in-vitro dari fraksi bioaktif yang diisolasi dari rimpang temu putih (Curcuma zedoaria). Serbuk rimpang temu putih diekstraksi dengan pelarut organik (n-heksana, metanol dan etil asetat). Lima fraksi (A-E) dari ekstrak etil asetat diperoleh dengan teknik kromatografi menggunakan SiO2 gel 60 dan fase gerak n-heksana/etil asetat (0-100%). Fraksi bioaktif (B dan C) dimurnikan dengan kromatografi cair kinerja tinggi (KCKT) dan diperoleh 1 fraksi (B-1) dari fraksi B dan 3 fraksi (C-1,C-2 dan C-3) dari fraksi C. Karakterisasi kimia dilakukan pada fraksi B-1 dan C-1 meliputi spektroskopi UV-Vis, infra merah dan massa. Pengujian bioaktivitas yang dilakukan adalah uji toksisitas terhadap la rva udang (Artemia salina), uji antiproliferasi terhadap sel lestari tumor (sel HeLa, K-562, WEHI 164), aktivitas fagositosis terhadap Staphyllococcus epidermidis, analisis jumlah kromosom sel tumor dan perubahan morfologi dari sel lestari tumor.
Data spektrum ultraviolet-cahaya tampak dan infra merah dari fraksi B-1 mengindikasikan adanya gugus karbonil terkonyugasi dengan etilenik, lakton tak jenuh, poli-ene terkonyugasi sedangkan dari spektrum massa diperoleh berat molekul sebesar 228 (rumus molekul C15H16O2). Berdasarkan data spektroskopi dan hasil penelusuran pustaka maka diperoleh struktur dugaan (plausible structure) senyawa fraksi B-1 adalah 1(10),5,7,(11)8,Guaiantetraen-12,8-olide dengan sinonim gweikurkulakton. Pada fraksi C-1 masih terdapat 4 senyawa yang belum terpisah sempurna dan diidentifikasi sebagai analog senyawa seskuiterpen, diterpen dan triterpen. Fraksi B dan C (15 bpj) memberikan persentase penghambatan pertumbuhan (PP) paling tinggi terhadap sel HeLa (25 dan 32%), K 562 (53 dan 55%) dan WEHI 164 (43 dan 50%). Kadar hambat median atau IC50 (Inhibition Consentration 50) fraksi B-1 terhadap sel K 562 sebesar 1,64 bpj dan fraksi C-1 terhadap sel HeLa sebesar 1,55 bpj. Pemberian fraksi B-1 (1,5 bpj) memperbaiki abnormalitas jumlah kromosom sel lestari tumor dan memperlihatkan adanya aktivitas apoptotik dengan gambaran karakteristik berupa pengkerutan membran sel dan kondensasi kromatin sel lestari tumor. Dari hasil uji fagositosis diperoleh senyawa fraksi B-1 (100 bpj) mengaktivasi makrofag melalui stimulasi sel fagosit aktif (39%) dan indeks fagosit (20%). Kesimpulan penelitian ini adalah: 1). struktur dugaan senyawa fraksi B-1 adalah gweikurkulakton (seskuiterpen lakton), termasuk kelompok senyawa aktif sebagai antiproliferasi sel lestar i tumor 2). membunuh sel tumor diduga dengan melalui mekanisme apoptosis dan 3). meningkatkan aktivitas fagositosis.
ABSTRACT
ROS SUMARNY. Chemical Characterisation, Antiproliferation Activity Against Tumor Cell Lines and Phagocytosis Activity In-vitro of the Bioactive Fraction of
Curcuma zedoaria (Christm) Roscoe. Under the direction of BAMBANG PONTJO PRIOSOERYANTO, LATIFAH K. DARUSMAN, CHAIRUL and IETJE WIENTARSIH.
The aim of this research was to evaluate the in vitro antiproliferation and phagocytic activities of the bioactive fractions isolated from Curcuma zedoaria (temu putih) rhizome. The powder of rhizome was extracted by using organic solvents (n -hexane, MeOH and EtOAc). Five fractions (A-E) of EtOAc extract were obtained by chromatography technique on SiO2 gel 60 and gradient mobile phase n-hexane/EtOAc (0-100%). The bioactive fractions (B and C) were purified using high performance liquid chromatography, one fraction (B-1) was obtained from fraction B and three fractions (C-1,C-2, C-3) from fraction C. Chemical characterization of fraction B-1 and C-1 were done by using spectrometry of ultraviolet, infra red and mass. Bioactivity tests consisted of cytotoxicity assay on Artemia salina, antiproliferation assay on HeLa, K 562 and WEHI 164 cell lines, phagocytosis assay on Staphylococcus epidermidis, chromosome number analysis and morphological observation of tumor cell lines
Spectrum data UV-Vis and IR indicated the existences of conjugated carbonyl group with ethylenic, unsaturated lacton and conjugated poliene, while mass spectrum analysis indicated the mass of fraction B-1 was 228 (molecular formula C15H16O2). Based on spectroscopy data and references, the structure of fraction B-1 was estimated as 1(10),5,7,(11)8,Guaiantetraen-12,8-olide or gweicurculactone. The C-1 fraction still contain four compounds which not yet separated absolutely and was estimated as analog of sesquiterpenoid, diterpenoid and triterpenoid. The results showed that fraction B and C (15 µg/mL) had the highest growth inhibition activity against HeLa cells (25 and 32 %), K 562 cells (53 and 55%) and WEHI 164 cells (43 and 50%). The IC50 value of fraction B-1 on K-562 cells was 1.64 µg/mL and fraction C-1 on HeLa cells was 1.55 µg/mL. Administering fractions B-1 and C-1 (1.5 µg/mL) to tumor cell lines showed that there was a repairing activity on the abnormality of chromosome numbers as well as apoptotic activity characterize by cell shrinkage and chromatin condensation. B-1 fraction (100 µg/mL) increased the performance of phagocytic activity of the macrophage as for 39% and phagocytic index was 20%. Conclusions of the present research are: 1) the plausible structure of fraction B-1 was gweicurculactone (sesquiterpen lactone), includes the active compound groups as tumor cell antiproliferation, 2). the mechanisms of tumor cell killing effect was predicted through apoptotic mechanism and 3) increasing the phagocytic activity
KARAKTERISASI KIMIAWI, AKTIVITAS ANTIPROLIFERASI
SEL LESTARI TUMOR DAN AKTIVITAS FAGOSITOSIS SECARA
IN-VITRO
DARI FRAKSI BIOAKTIF RIMPANG TEMU PUTIH
[
Curcuma zedoaria
(Christm) Roscoe]
ROS SUMARNY
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Disertasi : Karak terisasi Kimiawi, Aktivitas Antiproliferasi Sel Lestari Tumor dan Aktivitas Fagositosis secara In-vitro dari Fraksi B ioaktif Rimpang Temu Putih [Curcuma zedoaria (Christm)
Roscoe]
Nama : Ros Sumarny
NIM : B046010051
Disetujui Komisi Pembimbing
Dr. Drh. Bambang P. Priosoeryanto,MS Prof. Dr.Ir.Latifah K.Darusman, MS Ketua Anggota
Dr. Chairul,Apt,MSc, APU Dr.Ietje Wientarsih,Apt,MSc Anggota Anggota
Diketahui,
Ketua Program Studi Sains Veteriner Dekan Sekolah Pascasarjana
Dr. Drh. Bambang P. Priosoeryanto,MS Dr.Ir.Khairil Anwar Notodiputro,MS
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Maha Kuasa, atas Rahmat dan KaruniaNya, penulis dapat menyelesaikan penyusunan disertasi sebagai tugas akhir untuk menyelesaikan pendidikan program doktor di Program Studi Sains Veteriner pada Sekolah Pascasarjana IPB. Penelitian ini berjudul “ Karakterisasi Kimiawi, Aktivitas Antiproliferasi Sel Lestari Tumor dan Aktivitas Fagositosis secara In-vitro dari Fraksi Bioaktif Rimpang Temu Putih [Curcuma zedoaria (Christm) Roscoe]” .
Penulis menyampaikan penghargaan dan hormat serta terima kasih yang tulus kepada komisi pembimbing, yaitu Bapak Dr. Drh. Bambang P. Priosoeryanto, MS, Ibu Prof. Dr.Ir.Latifah K.Darusman, MS, Bapak Dr. Chairul, Apt, MSc, APU dan Ibu Dr. Ietje Wientarsih, Apt, MSc yang telah membantu, membimbing, memberikan pengarahan dan semangat kepada penulis dalam persiapan dan pelaksanaan penelitian hingga penyusunan disertasi ini.
Ucapan terima kasih juga penulis sampaikan kepada Pimpinan Proyek BPPS DIKTI, Departemen Pendidikan Nasional RI ya ng telah memberikan beasiswa kepada penulis selama mengikuti pendidikan.Terima kasih kepada Rektor Universitas Pancasila Bapak Edie Toet Hendratno SH, MSi, Dr. S. Broto Sutaryo, Apt (mantan Dekan) dan Drs. I.Wayan Redja, M.Chem, Apt (Dekan FFUP) yang mengizinkan penulis untuk menempuh pendidikan program doktor di Sekolah Pascasarjana IPB.
Terima kasih penulis sampaikan kepada Ibu Prof. Dr. Ir. Fransiska R. Zakaria, MSc selaku Penguji luar komisi pada ujian tertutup, Bapak Prof. Dr. Drh. Dondin Sayuthi, MST dan Bapak Dr. Wahono Sumaryono, Apt, APU selaku Penguji luar komisi pada ujian terbuka atas kesediaan dan sarannya.
Ucapan terima kasih penulis kepada Bapak Dr. Drh. Bambang P. Priosoeryanto, MS atas bantuan biaya penelitian dan sarana melalui HIBAH BERSAING PERGURUAN TINGGI XI Tahap I tahun 2003. Terima kasih penulis sampaikan kepada Dr. Ir. Praptiwi selaku Pimpinan Kelompok Fitokimia Bidang Botani Puslitbang Biologi LIPI Bogor, Bapak Dr. Drh. I Wayan Teguh Wibawan, MS, Bapak Drh. Ketut Mudite,MSV, Ibu Dra. Diah Widowati, MS, Apt, Bapak Drs. Thamrin Wikanta,MS atas segala bantuan sarana dan kesempatan menggunakan fasilitas laboratorium. Demikian juga kepada teman-teman staf pengajar FFUP khususnya di laboratorium Farmakologi penulis menyampaikan terima kasih atas segala dukungan, perhatian dan pengertiannya selama penulis menjalani tugas belajar ini.
Terima kasih pada Ayah Martinus Ali (alm) dan Ibu Maria Goretti Molek (alm) yang tercinta atas bimbingan dan kasih sayangnya yang merupakan inspirasi bagi penulis untuk selalu tekun dan semangat menyelesaikan tugas dengan baik. Ucapan terima kasih penulis sampaikan kepada keluarga besar Martinus Ali atas doa, bantuan moril maupun materil, semoga segala kebaikan hati dan bantuan yang diberikan selama penulis menjalani tugas belajar ini, semoga mendapat berkat dari Bapa yang Maha Baik.
Akhir kata pada semua pihak yang tidak dapat disebutkan satu persatu, penulis mengucapkan banyak terima kasih. Semoga Tuhan Yang Maha Kuasa membalas budi baik bapak dan ibu sekalian.
Bogor, Agustus 2006
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 22 Maret 1951 di Padang-Sumatera Barat sebagai anak ke tiga dari sembilan bersaudara dari pasangan Martinus Ali (alm) dan Maria Goretti Molek (alm). Pendidikan sarjana dan profesi farmasis ditempuh di Jurusan Farmasi Fakultas Matematika dan Ilmu Alam Universitas Andalas Padang, lulus tahun 1981.
Pada tahun 1986, penulis memperoleh kesempatan melanjutkan pendidikan program magister di Program Studi Farmas i pada Fakultas Pascasarjana ITB dan menyelesaikannya pada tahun 1988. Pada tahun 2001, penulis memperoleh kesempatan melanjutkan pendidikan program doktor pada Program Studi Sains Veteriner pada Sekolah Pascasarjana Institut Pertanian Bogor. Selama mengik uti pendidikan program pascasarjana penulis mendapat Beasiswa Pendidikan Pascasarjana (BPPS) dari Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional dan bantuan biaya penelitian dari Fakultas Farmasi Universitas Pancasila.
Sejak tahun 1982, penulis mengabdikan diri sebagai staf pengajar Kopertis Wilayah III DKI yang dipekerjakan pada Fakultas Farmasi Universitas Pancasila Jakarta hingga sekarang.
Pada bulan Mei-Juni dan Oktober -Nopember tahun 1990-1991, penulis mendapat kesempatan mengikuti “ Lectures and practical training of the Mid Career Training in Pharmacochemistry course” at the Faculty of Pharmacy, Gajah Mada University, in
the M.C.T.P. project between the Faculty of Pharmacy, Gajah Mada University
DAFTAR ISI
Halaman
DAFTAR TABEL... i
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN... iii
I. PENDAHULUAN A. Latar Belakang ... ... 1
B. Perumusan Masalah... 3
C. Maksud dan TujuanPenelitian... 4
D. Manfaat Penelitian... 4
E. Hipotesis ... 4
II. TINJAUAN PUSTAKA A. Temu Putih ... 5
B. Pertumbuhan dan Perkembangan Sel ... 9
C. Tumor (neoplasma) ... 11
D. Imunomodulator ... . 15
III. METODE PENELITIAN A. Tempat dan Waktu ... 18
B. Bahan dan Alat Penelitian ... 18
C. Metode Penelitian ... 19
1. Ekstraksi, Fraksinasi, Pemurnian dan Karakterisasi Kimia ... 19
a.. Pembuatan Ekstrak... 19
b. Fraksinasi Ekstrak Etil Asetat ... 22
c. Pemurnian Fraksi Etil Asetat... 23
d. Karakterisasi Kimia ... 23
2. Uji Aktivitas Biologik ... 24
a. Uji Kematian Larva Udang (Brine Shrimp Lethality Test) ... 24
b. Uji Antiproliferasi Sel Lestari Tumor Secara In-vitro... 26
c. Uji Fagositosis Makrofag Secara In-vitro... 28
d. Analisis Jumlah Kromosom ... 30
e. Pewarnaan Sel Lestari Tumor dengan Pewarna Fluoresens. ... 31
IV. HASIL DAN PEMBAHASAN
A. Ekstraksi, Fraksinasi, Pemurnian dan Karakterisasi Kimia ... 33
1. Ekstrak Rimpang Temu putih ... 33
2. Hasil Fraksinasi Ekstrak Etil Asetat... 34
3. Hasil Pemurnian Fraksi Etil Asetat ... 36
4. Karakterisasi Kimia ... 38
B. Uji Aktivitas Biologik. ... 45
1. Uji Kematian Larva Udang (Brine Shrimp Lethality Test) ... 45
2. Uji Aktivitas Antiproliferasi ... 45
3. Uji Fagositosis... 54
4. Analisis Jumlah Kromosom Sel Lestari Tumor ... 58
5. Pewarnaan sel Lestari Tumor dengan Pereaksi Fluoresens ... 61
V. SIMPULAN DAN SARAN... 65
VI. DAFTAR PUSTAKA ... 66
LAMPIRAN... 72
DAFTAR TABEL
Halaman
1. Hasil penapisan fitokimia ... 34
2. Hasil fraksinasi ekstrak EtOAc dengan kromatografi kolom ... 35
3. Data spektroskopi UV fraksi B -1 dan C-1 ... 38
4. Data spektroskopi IM fraksi B-1 dan C-1 ... 38
5. Perbandingan data spektroskopi senyawa fraksi B-1, zedoalactone A dan kurzeon ... 42
6. Kadar hambat median (IC50) fraksi bioaktif ... 48
7. Perolehan hasil ekstraksi dan hasil uji anti-proliferasi ekstrak/fraksi uji... 50
DAFTAR GAMBAR
Halaman
1. Siklus sel (Katzung 2001) ... 10
2. Kariotipe kromosom pasien CML (A) dan Kromosom Philadelphia (B) (Tannock dan Hill 1998) ... 12
3. Bagan alur ekstraksi dan uji bioaktivitas... 20
4. Bagan alur uji kematian larva udang (BSLT)... 25
5. Bagan alur uji antiproliferasi ... 27
6. Bagan alur uji fagositosis ... 29
7. Bagan alur analisis jumlah kromosom ... 31
8. Bagan alur pewarnaan sel tumor dengan pereaksi fluoresens ... 32
9. Rimpang temu putih (A), Irisan rimpang (B) Serbuk (C) dan Ekstrak (D) ... 33
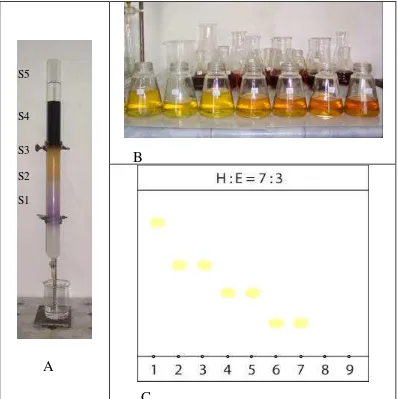
10. Kolom cair preparatif (A), Fraksi efluen (B) dan Pola bercak KLT (C)... 35
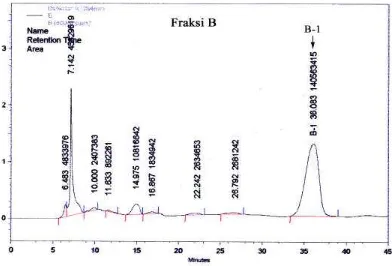
11. Kromatogram fraksi B (atas) dan C (bawah) dengan KCKT ... 37
12A. Spektrum serapan UV-Vis fraksi B-1 dengan detektor Photo Diode Array .. 39
12B. Spektrum serapan UV-Vis fraksi B-1 (atas) dan C-1 (bawah) dengan detektor UV-Vis ... 39
13. Spektrum serapan inframerah fraksi B-1 (atas) dan C-1 (bawah) ... 40
14. Kromatogram fraksi B-1 dengan KCKT ... 41
15. Spektrum massa fraksi B-1 ... 41
16. Struktur kimia gweikurkulakton (1), zedoalactone A (2) dan kurzeon(3) ... 42
17. Kromatogram fraksi C-1 dengan KCKT ... 44
18. Spektrum massa fraksi C-1 ... 44
19. Sel WEHI 164 dengan perwarnaan biru tripan pada kamar hitung ... hemositometer. Sel mati (panah besar) dan sel hidup (panah kecil) ... 46
20. Persentase penghambatan pertumbuhan sel tumor oleh fraksi EtOAc ... 46
21. Persentase penghambatan pertumbuhan sel tumor oleh fraksi bioaktif ... 49
22. Reaksi adisi nukleofilik dengan elektrofilik karbonil α, β tidak jenuh... (McMurry 1984) ... 52
23. Dugaan mekanisme reaksi senyawa B-1 dengan gugus sulfhidril ... 52
DAFTAR LAMPIRAN
Halaman
12. Hasil Determinasi Tumbuhan... 72
13. Rangkuman hasil eks traksi, fraksinasi dan pemurnian ... Rimpang temu putih (C. zedoaria )... 73
14. Warna dan harga Rf dari pemisahan secara KLT ... 74
15. Kromatogram dengan KLT dan KCKT fraksi B -1 dan C-1 ... 75
16. Data uji kematian larva udang (BSLT) dan nilai LC50... 77
17. Jumlah sel tumor pasca perlakuan fraksi EtOAc dan analisis statistik ... 79
18. Jumlah sel tumor pasca perlakuan fraksi bioaktif dan analisis statistik ... 81
19. Nilai kadar hambat median (IC50) fraksi bioaktif dan analisis statistik ... 86
20. Sel fagosit aktif dan indeks fagosit pasca perlakuan fraksi EtOAc... 87
21. Sel fagosit aktif dan indeks fagosit pasca perlakuan fraksi bioaktif ... 89
I. PENDAHULUAN
A. Latar Belakang
Tumor atau neoplasma adalah pertumbuhan sel yang berlebihan dan tidak terkontrol, dapat diikuti dengan metastasis pada satu atau lebih jaringan. Kanker adalah istilah umum untuk semua tumor ganas (malignant tumor) yaitu tumor yang menyebar dan ganas, sedangkan tumor yang tidak menyebar dan tidak ganas disebut tumor jinak (benign tumor). Tumor menempati peringkat ke lima penyebab utama kematian di Indonesia, disamping penyakit kardiovaskular, infeksi, pernapasan dan pencernaan (Tim Surkesnas 2002). Di negara berkembang, penyakit infeksi dan parasit masih merupakan masalah kesehatan terutama pada usia balita. Di negara maju, tumor adalah penyebab kematian nomor dua setelah penyakit kardiovaskular. Peningkatan kesadaran masyarakat mengenai faktor resiko penyakit jantung yang diikuti perubahan pola hidup dan perkembangan obat kardiovaskular berperanan mengurangi angka kematian akibat penyakit jantung (Gibbs 2000). Tumor adalah penyakit yang kompleks dengan berbagai akumulasi mutasi genetik, manifestasi penyakit memerlukan waktu lama, keterbatasan efektivitas kemoterapi tumor; fenomena ini akan menambah jumlah angka kematian akibat tumor. Usaha yang dilakukan untuk pencegahan penyakit kardiovaskular secara tidak langsung juga mencegah penyakit degeneratif lain seperti penyakit kanker, diabetes, glaukoma (Flora dan Ferguson 2005).
Berbagai komponen bioaktif yang terdapat dalam bahan pangan seperti genistein, dialil sulfida, alisin, resveratrol, kapsaisin, kurkumin, gingerol, anetol mempunyai kemampuan menekan proses transformasi, hiperproliferasi dan inflamasi yang berperanan pada inisiasi karsinogenesis. Masyarakat Asia dengan pola konsumsi yang kaya dengan sayuran, buahan dan tumbuhan rempah mempunyai resiko lebih rendah menderita kanker kolon, gastrointestinal, payudara, prostat dibandingkan masyarakat Barat (Dorai dan Aggarwal 2004).
seperti efedrin, atropin, kinin, vinkristin atau masih digunakan dalam bentuk ramuan beberapa simplisia tumbuhan yang dikenal dengan istilah jamu. Sampai saat ini pemakaian jamu masih populer di masyarakat sebagai pemelihara kesehatan dan menjaga kebugaran (promotif), pencegah penyakit (preventif), penyembuh penyakit (kuratif) atau pendamping penggunaan obat jadi, pengurang rasa sakit (simtomatis) dan pemulihan kesehatan (rehabilitatif). Pemakaian obat tradisional oleh masyarakat terutama dalam pengobatan tumor dilakukan dengan alasan yang bersifat sosial ekonomi. Pada kanker stadium lanjut, obat tradisional jelas tidak bermakna memperpanjang umur penderita tetapi ber manfaat meningkatkan kualitas hidup penderita. Pengobatan tumor dengan obat yang berasal dari tumbuhan dimaksudkan sebagai usaha pencegahan (kemopreventif) perkembangan tumor atau terapi tambahan. Tumbuhan obat yang populer digunakan untuk pengobatan tumor antara lain
Cathranthus roseus / Vinca rosea, Sonchus arvensis, Dioscorea bulbifera, Gynura procumbens, Kaempferia rotunda, Curcuma zedoaria. Di antara tumbuhan tersebut ada yang berkhasiat sebagai sitostatika, imunomodulator, anti-inflamasi, hepatoprotektor dan analgesik (Saputra et al. 2000). Komponen bioaktif tumbuhan obat mempunyai banyak molekul target dan memberikan efek beragam terhadap fisiologi tubuh (Inalci et al. 2005), di antara komponen bioaktif tersebut mungkin saling memberikan efek yang bersifat sinergis, aditif atau saling meniadakan efek samping komponen bioaktif (Briskin 2000).
Hasil penelitian Murakami et al. (1998) pada uji saring secara in vitro ekstrak etanol dari 107 jenis tanaman dari 48 famili tanaman terhadap sel Raji dan uji tumor
promoter 12 -O-hexadecanoylphorbol-13-acetas (HPA) dengan Epstein -Barr (EB) virus activation, diperoleh hasil sebanyak 71% ekstrak etanol tumbuhan menghambat sekitar 30% aktivasi virus EB pada kadar 200 mg/mL. Diantara jenis tumbuhan tersebut yang terbanyak bersifat anti-tumor berasal dari suku Zingiberaceae dan Apiaceae. Sirait (2001) melaporkan sebanyak 80% tumbuhan obat di dalam jamu berasal dari famili Zingiberaceae, Piperaceae dan Apiaceae.
dan golongan lain (Tang dan Eisenbrand 1992). Sebagai obat tradisional, rimpang temu putih digunakan sebagai stimulans, karminativum, diuretik, antiemetik, antipir etik, antidiare, memperbaiki gangguan pencernaan, mengobati ulser, luka dan penyakit kulit lainnya (De Padua et al. 1999). Penggunaan rimpang temu putih untuk mengobati tumor sering digabung dengan bahan lain seperti temu mangga atau kunir putih, temu lawak, benalu teh, delima putih, pulosari, sambung nyawa, beluntas dan lainnya sesuai dengan tujuan pengobatan (Syukur 2002, Suharmiati et al. 2002).
Beberapa penelitian melaporkan sediaan rimpang temu putih mampu menghambat pertumbuhan sel mieloma, sel karsinoma (Priosoeryanto et al. 2001), menghambat pertumbuhan tumor paru pada mencit yang diinduksi dengan benzo(a)piren (Murwanti et al. 2004). Penelitian komponen bioaktif rimpang temu putih antara lain analisis komponen minyak atsiri (Sudibyo 2000), aktivitas anti bakteri minyak atisri (Sunardi et al. 2002, Wilson et al. 2005), aktivitas analgetik dan anti inflamasi kurkumenol (Navarro et al. 2005, Jang et al. 2004), aktivitas antiproliferasi sel OVCAR-3 dari komponen kurkuminoid (Syu et al. 1998).
B. Perumusan Masalah
(fibroblas). Penelitian ini ditujukan untuk menggali potensi aktivitas biologik komponen bioaktif rimpang temu putih sebagai antiproliferasi maupun sebagai imunomodulator. Untuk memperoleh senyawa bioaktif tersebut maka dilakukan fraksinasi yang berpedoman hasil uji bioaktivitas (bioassay-guided fractionation).
C. Maksud dan Tujuan
Maksud dan tujuan dari penelitian ini adalah :
1. Mengekstraksi, fraksinasi dan memurnikan fraksi bioaktif rimpang temu putih 2. Melakukan karakterisasi kimia fraksi bioaktif terpilih
3. Menguji secara in vitro aktivitas antiproliferasi pada sel lestari tumor (HeLa, K-562 dan WEHI-164) serta aktivitas fagositosis dari fraksi bioaktif
4. Menelaah pengaruh fraksi bioaktif terpilih terhadap jumlah kromosom dan perubahan morfologi sel lestari tumor (HeLa, K-562 da n WEHI-164)
5. Menjelaskan kemungkinan mekanisme kerja komponen bioaktif sebagai substansi antiproliferasi
D. Manfaat
Penelitian ini diharapkan menambah informasi ilmiah mengenai komponen bioaktif rimpang temu putih yang berpotensi sebagai antiproliferasi dan imunomodulator (peningkatan fagositosis), kajian hubungan struktur dengan aktivitas (Structure Activity Relationship/SAR) dan bahan pertimbangan untuk pengembangan pengujian pada tingkat molekuler.
E. Hipotesis
I. TINJAUAN PUSTAKA
A. Temu putih [Curcuma zedoaria (Christm) Roscoe]
Tumbuhan Curcuma zedoaria (Zingiberaceae) dikenal dengan nama daerah: temu putih, koneng bodas (Sunda) dan kunir putih (Jawa). Nama lain (sinonim) adalah:
Curcuma pallida, Curcuma zerumbet, Amomum zedoaria, Costus luteus dan Roscua lutea (De Padua et al. 1999; Dalimarta 2003). Di Indonesia, temu putih banyak ditemukan sebagai tumbuhan liar di kawasan Jawa Tengah dan Jawa Barat pada ketinggian 1000 m dpl. Tumbuhan berupa semak, batang semu dengan 6-8 helai pelepah daun yang berpadu, tumbuh tegak lurus, tinggi mencapai 2 m. Daun berbentuk lanset memanjang berwarna merah lembayung di sepanjang tulang tengahnya. Bunga majemuk, tipe bulir, keluar langsung dari umbi berbentuk bulat panjang dengan mahkota bunga berwarna ungu atau merah dan bagian bawah be rwarna hijau muda atau keputihan. Rimpang bercabang-cabang dengan warna putih atau kuning muda; daging rimpang berwarna kuning muda, sedikit beraroma kunyit dan rasanya pahit. Rimpang dipanen pada saat tumbuhan berumur 9-12 bulan (Syukur dan Hernani 1999).
Sebagai obat tradisional, rimpang temu putih digunakan sebagai stimulans, karminativum, diuretik, antiemetik, antipiretik, antidiare, memperbaiki gangguan pencernaan, mengobati ulser, luka dan penyakit kulit lainnya (De Padua et al.1999). Pada pengobatan tradisional di Cina, temu putih (C. zedoaria) telah digunakan di klinik untuk pengobatan kanker serviks (Syu et al. 1998). Menurut laporan Laboratorium Penelitian dan Pengembangan Pelayanan Obat Tradisional (LP4OT) Surabaya penggunaan selama 14 hari, ramuan utama kunir putih (Curcuma mangga) dan benalu teh sebagai bahan utama, mengurangi keluhan penderita pada kasus tumor payudara dan tumor kandungan (Suharmiati et al. 2002).
periode panen, kadar kurkuminoida tertinggi terdapat pada jenis C. longa (kunyit) sebesar 3,97% (Lin et al. 2001).
Aktivitas biologis temu putih (C. zedoaria) secara in-vitro dan in-vivo
1. Aktivitas anti bakteri
Sunardi et al. (2002) melaporkan minyak atsiri rimpang temu putih (10 µL/kertas cakram) menghambat pertumbuhan bakteri S. aureus, B. subtilis, E coli, P.aeruginosaS. typhi, S. typhymurium, S. paratyphi B dan C, tetapi tidak memberikan penghambatan terhadap pertumbuhan fungi (Trichophyton sp, Microsporum gypsum dan Aspergillus niger). Penelitian uji anti mikroba yang dilakukan oleh Wilson et al. (2005) terhadap 6 jenis ekstrak (polar, semi polar dan nonpolar) dari C. zedoaria dan C. malabrarica
terhadap bakteri Gram positif (B. subtilis, S. aureus, M.luteus), Gram negatif (E.coli, P.mirabilis, K.pneumonia) dan fungi (A.niger dan C.albicans) memberikan hasil yang mendukung pemakaian ekstrak non polar C. zedoaria sebagai obat tradisional untuk mengatasi infeksi bakteri dan jamur.
2. Aktivitas anti inflamasi
Inflamasi atau radang adalah reaksi jaringan (selular dan vaskular) terhadap cedera, dengan melepaskan mediator kimia seperti faktor kemotaksis, bradikinin, histamin, leukotrien prostaglandin, sitokin (IL-1; interleukin-1, TNF; tumor necrosis factor), faktor pengaktif trombosit (PAF; platelet activating factor). Tanda - tanda utama inflamasi adalah rubor (redness), tumor (swelling), calor (heat), dolor (pain) dan kehilangan fungsi (functio laesa) (Cotran dan Collins 1999). Mekanisme aksi metabolit sekunder tumbuhan sebagai anti inflamasi adalah dengan interaksi langsung atau tidak langsung dengan berbagai: 1) mediator inflamasi (metabolit asam arakidonat, peptida, sitokin), 2) produksi atau fungsi second messenger (cGMP, cAMP, berbagai protein kinase), 3) ekspresi faktor transkripsi (Ap-1; activator protein-1, NF-κB; nuclear factor kappa B) dan 4) proto onkogen ( c-jun, c-fos dan c-myc) dan 5) ekspresi molekul pro-inflamasi seperti inducible NO synthase (iNOS),Cycylooxygenase (COX-2), sitokin (IL-1ß), TNF-a , neuropetida dan protease (Calixto et al. 2003).
katalase sintesis prostanoid) dan enzim 5-lipoksigenase (enzim katalase sintesis leuokotrien) (Surh et al. 2001). Prostaglandin dan leukotrie n, sekarang dikenal dengan eikosanoid adalah mediator inflamasi. Pada uji efek anti inflamasi dengan metode induksi udem (karagen) pada tikus, dilaporkan kombinasi minyak atsiri C. domestica,
C. xanthorrhiza dan kurkuminoid memberikan efek anti inflamasi yang setara dengan piroksikam (Liang 1992).
Nitrit oksida (NO) adalah mediator intraselular endotel vaskular dan memegang peranan penting pada proses inflamasi dengan mengurangi agregasi platelet, adesi dan mediator sel mast (Cotran dan Collins 1999). Senyawa kurkuminoid (diaril heptanoid) dan seskuiterpenoid (prokurkumenol dan epikurkumenol) yang diisolasi dari C. zedoaria memperlihatkan efek inhibitor iNOS (inducible nitric oxide synthase) sel makrofag yang diaktivasi dengan LPS (lipopolisakarida) (Jang et al. 2004).
3. Aktivitas analgetik
Keadaaan panas, merah dan bengkak pada inflamasi akut disebabkan oleh peningkatan dilatasi dan permeabilitas pembuluh darah. Penyebab rasa nyeri adalah tekanan pada ujung saraf sensorik oleh cairan eksudat dan pe nurunan nilai ambang rasa nyeri oleh prostaglandin (Coltran dan Collins 1999).
Senyawa kurkumenol (seskuiterpen), diperoleh dari rimpang C. zedoaria (dosis 29 µmol/kg bb, intra-peritoneal) memberikan efek analgesik yang setara dengan diklofenak (dosis 34,5 µmol/kg bb; ip) yang diuji dengan metode udem (formalin) pada mencit. Potensi efek penghambatan respons writhing (geliat) mencit yang diinduksi dengan asam asetat diperoleh 2 sampai 7 kali lebih kuat dibandingkan senyawa pembanding yaitu diklofenak dan dipiron (Navarro et al. 2002).
4. Aktivitas hepatoprotektor
Hati adalah organ metabolisme utama yang bertugas mengubah senyawa asal menjadi metabolit dan berkonyugasi dengan asam glukoronat, sulfat, glutation sehingga lebih mudah dikeluarkan dari dalam tubuh. Parasetamol adalah obat analgesik yang yang mengalami detoksifikasi di hati melalui reaksi konyugasi dengan glutation. Pada dosis tinggi akan terbentuk metabolit reaktif parasetamol yang berikatan secara kovalen dengan makromolekul dan menyebabkan nekrosis sel hati (Cotran dan Collins 1999).
kontrol negatif dengan model hepatoksin parasetamol (dosis 2,5 g/kg bb). Senyawa polifenol turunan kurkumin mempunyai sifat anti oksidan sebagai penangkap radikal bebas N-asetil benzokuinonimin (metabolit aktif parasetamol).
5 . Aktivitas antioksidan
Oksigen reaktif merupakan radikal yang dihasilkan dalam sistim biologi melalui proses fisiologi, patologi dan sumber eksogen dari komponen makanan, radiasi ultraviolet maupun polusi. Contoh oksigen reaktif (bentuk radikal) ialah radikal hidroksil (OH•) dan superoksid (O2•); oksigen reaktif non radikal ialah oksigen tunggal (1O2) dan hidrogen peroksida (H2O2). Radikal bebas adalah molekul yang relatif tidak stabil dengan satu atau lebih elektron yang tidak berpasangan pada orbit terluarnya. Sel yang rusak karena radikal bebas akan menghasilkan radikal bebas dan selanjutnya akan mengoksidasi lipid maupun protein yang letaknya berdekatan sehingga terbentuk lebih banyak lagi radikal bebas. Di samping mempunyai sifat merusak sel; oksigen reaktif memberikan efek perlindungan terhadap tubuh yaitu memerangi peradangan, membunuh bakteri dan mengembalikan tonus otot polos pembuluh darah (Coltran dan Collins 1999).
Antioksidan membantu melindungi tubuh terhadap kerusakan yang ditimbulkan oleh radikal bebas. Dalam tubuh terdapat antioksidan endogen (enzim katalase, glutation dan SOD;sulfodismutase) yang menjaga keseimbangan antara prooksidan dan antioksidan. Akumulasi radikal bebas dalam tubuh dapat menimbulkan stres oksidatif yang diimplikasikan berperan dalam penuaan dini dan penyakit degeneratif (Cotran dan Collins 1999). Komponen tumbuhan yang bersifat sebagai antioksidan adalah flavonoid, polifenol, tokoferol, asam askorbat, karotenoid dan senyawa yang mengandung sulfur. Serbuk rimpang C. domestica (tumerik) digunakan secara luas untuk bumbu masak, pewarna dan obat tradisional; senyawa kurkumin dan turunannya yaitu kurkumin demetoksilat mempunyai aktivitas antioksidan.
juga diperoleh potensi antioksidan ekstrak EtOH C. zedoaria (IC50=99,19 bpj) lebih besar dibandingkan C. mangga (IC50=233,39 bpj) (Sumarny et al. 2006).
6. Aktivitas anti tumor
Tirosin kinase adalah enzim yang mengkatalisis pemindahan gugus fosfat dari ATP ke asam amino tirosin dalam suatu protein substrat (Cotran dan Collins 1999). Reseptor tirosin kinase merupakan target aksi obat yang banyak dikembangkan dalam penemuan obat baru. Ekstrak kloroform C. zedoaria dan ekstrak metanol C.mangga
(300 bpj) menghambat pertumbuhan pertumbuhan S cerevisae (penghasil tirosin kinase) pada hari ke 3 yang merupaka n pertumbuhan optimum S cerevisae (Iswantini et al.
2002).
Pemberian fraksi polisakarida dari rimpang C. zedoaria (CZ-I-III) pada takaran 6,25 mg/kg/hari telah dilaporkan menghambat pertumbuhan tumor padat pada mencit yang ditransplantasi dengan sel sarkoma 180 sebesar 50% dan mencegah mutasi kromosom (Kim et al. 2000). Hasil penelitian Murwanti et al. (2004) melaporkan pemberian ekstrak etanol rimpang temu putih (750 mg/kg BB; selama 12 minggu) mampu menghambat pertumbuhan tumor paru pada mencit betina yang diinduksi dengan senyawa benzo(a)piren) sebesar 78 %.
Pengujian antiproliferasi terhadap sel OVCAR-3 (sel kanker ovarium manusia). dari kurkuminoid yang diisolasi dari ekstrak etanol rimpang temu putih C. zedoaria.
dilaporkan oleh Syu et al. (1998).
B. Pertumbuhan dan perkembangan sel
pembelahan inti sel (kariokinesis) dan diikuti oleh pembelahan sitoplasma (sitokinesis). Fase mitosis (M phase) terdiri dari 5 subfase yaitu profase, prometafase, metafase, anafase dan telofase (Campbell et al. 2000).
Gambar 1. Siklus sel (Katzung 2001)
C. Tumor (neoplasma)
Secara umum istilah tumor berarti pembengkakan yang disebabkan oleh inflamasi (radang) sedangkan neoplasma juga menimbulkan pembengkakan. Menurut onkologis Willis di dalam Cotran dan Collins 1999), pengertian neoplasma adalah pertumbuhan sel yang berlebihan dan tidak terkontrol yang dapat diikuti dengan penyebaran (metastasis) pada satu/lebih jaringan. Kanker adalah istilah umum untuk semua tumor ganas (malignant tumor) yaitu tumor yang menyebar dan ganas sedangkan tumor yang tidak menyebar dan tidak ganas disebut tumor jinak (benign tumor). Walaupun penyebab pasti belum diketahui, tetapi telah teridentifikasi faktor resiko berbagai jenis tumor meliputi; 1) faktor endogen: turunan (genetik), imunitas (kekebalan), hormonal, jenis kelamin dan umur dan 2) faktor eksogen: bahan karsinogenik (pengawet, pewarna, asap rokok), fisika (sinar matahari, radiasi radioaktif) dan biologik (virus, bakteri, parasit, jamur aflatoksin). Beberapa gaya hidup (life style) berkaitan erat dengan prevalensi tumor tertentu seperti: kebiasaan minum alkohol (tumor hati), pola makan (tumor pencernaan), kebiasaan merokok (tumor paru), perilaku seks bebas (tumor leher rahim) (Tannock dan Hill 1998).
Tumor adalah penyakit genetik, hal ini berkaitan dengan fenomena bahwa proses terjadinya tumor didahului oleh perubahan genetik (mutasi berulang) secara bertahap sampai suatu saat perubahan tersebut mampu menyebabkan proliferasi yang tidak terkendali (fenotip keganasan). Perubahan genetik yang mengarah pada proses keganasan dapat terjadi apabila terdapat gangguan pada 4 golongan gen pengatur pertumbuhan normal, yaitu: 1). proto-onkogen atau gen pencetus pertumbuhan, 2).
tumor supresor gen atau gen penghambat pertumbuhan (anti-onkogen), 3).gen pengatur kematian sel terpogram (apoptosis) dan 4). gen pengendali perbaikan DNA.
1. Abnormalitas kromosom sel tumor
Kromosom adalah struktur pembawa gen yang mirip benang terdapat di dalam nukleus. Sel somatik manusia mengandung 46 kromosom (2n=46) terdiri atas 44 kromosom somatik (autosom) dan 2 kromosom seks (X dan Y). Sifat sel lestari tumor (continous cell lines) adalah aneuploidi (jumlah kromosom bukan perkalian pasti dari perangkat haploid/n) bervariasi antara diploid (2n) dan tetraploid (4n), memiliki heterogenisitas fenotipe dan instabilitas genetik, kehilangan sebagian sifat diferensiasi dan bersifat tumorigenik in-vivo (MacDonad 1998). Abnormalitas kromosom meliputi abnormalitas jumlah kromosom (aneuploidi atau poliploidi) dan abnormalitas struktur kromosom meliputi perpindahan (translokasi), kehilangan (delesi), penyisipan (insersi), penambahan (adisi) (Tannock dan Hill 1998).
Gambar 2. Kariotipe kromosom pasien CML (A) dan Kromosom Philadelphia (B) (Tannock dan Hill 1998).
Kromosom Philadelphia [t(9;22)(q34;q11)] adalah contoh kelainan kromosom pada leukemia kronik mieloid (CML;Chronic myelogenous leukemia), di mana terdapat translokasi bolak balik antara kromosom 9 dan 22 dengan break points pada q 34 kromosom 9 dan q11 pada kromosom 22 (Gambar 2 B).
kronik dan 17-25 % leukemia limfositik akut (Kresno 2001). Kajian abnormalitas jumlah kromosom dilakukan dengan pembuatan karyotyping yaitu pemetaaan foto kromosom menurut panjang kromosom dan letak sentromer yang disusun berdasarkan sistim Denver-London. Analisis kromosom bermanfaat untuk mengetahui jenis kelamin dan asal usul sel spesies (Campbell et al. 2000) maupun kelainan dalam jumlah atau struktur kromosom (MacDonald 1998).
Stabilitas genetik adalah prasyarat untuk pertum buhan sel normal, sebaliknya instabilitas genetik adalah salah satu sifat sel tumor. Penyebab instabilitas genetik antara lain: mismatch repair, segregasi kromosom yang tidak tepat, rearrangement kromosom dan aktivasi abnormal telomerase. Telomer adalah suatu kompleks DNA dengan protein yang menutup dan melindungi ujung kromosom, sedangkan telomerase adalah enzim protein–RNA yang memperpanjang telomer setiap kali pembelahan sel. Pada sel eukariota, telomer akan memendek (kehilangan 50-100 pasangan basa) setiap terjadi replikasi, kecuali apabila sel mengandung telomerase yang dapat mempertahankan panjang telomer (Kresno 2001). Enzim telomerase pada mamalia (termasuk manusia) hanya aktif pada sel embrio dini atau pada sel yang akan menghasilkan sel benih (germ cells) (Cotran dan Collins 1999). Telomerase dianggap penanda ganas baru yang merupakan indikator prognosis dan sasaran terapi pada tumor (McKenzie et al. 1999).
2. Apoptosis (Programmed cell death =PCD)
Adalah bentuk kematian sel yang terencana pada kondisi fisiologis atau patologis, terjadi pada sel-sel tua atau tidak diperlukan lagi, sel yang rusak oleh toksin atau bahan infeksius (Cotran dan Collins 1999). Apoptosis yang berlebihan adalah penyebab penyakit degeneratif saraf seperti Alzheimer (Vinc ent et al. 2003), autoimun dan AIDS (Aquired Imunne Deficiency Syndrome) (Kresno 2001). Sel tumor mempunyai kemampuan menghindar dari proses apoptosis (Tannock dan Hill 1998), kondisi ini sering berkorelasi dengan agresivitas maupun resistensi sel tumor te rhadap terapi konvensional (Denicourt dan Dowdy 2004).
kerusakan tersebut tidak dapat diperbaiki, maka p53 akan memicu apoptosis (back -up mechanism). Ekspresi berlebihan gen Bcl-2 pada limfoma limfosit akan menghalangi proses apoptosis dan meningkatkan sifat tumorigenesis (Campbell et al 2000).
Apoptosis adalah endpoint kaskade molekul tergantung energi yang diawali dengan a) berbagai stimulus apoptosis seperti interaksi ligan-reseptor, gangguan faktor pertumbuhan/hormon, cedera akibat radiasi atau stimulus oleh sel T sitotoksik, b) pengontrolan da n pengaturan kelompok protein BCl-2 (penghambat atau penginduksi kaspase) atau melibatkan mitokondria (sitokrom c), c) aktivasi kaspase eksekusi (endonuklease dan protease) yang akan mendegradasi sitoskeletal dan protein nukleus, d) pembentukan badan apopt otik yang mengandung berbagai organel intrasel dan komponen sitosol (Cotran dan Collins 1999).
Tipe kematian sel (nekrosis atau apoptosis) tergantung pada intensitas dan lama stimulus, perkembangan proses kematian, dan keparahan pengosongan ATP yang dialami oleh sel. Perubahan morfologi pada sel apoptosis adalah dinding sel mengkerut (shrinkage), kondensasi dan fragmentasi kromatin diikuti pembentukan tunas
sitoplasma (sitoplasma budding) dan fagositosis badan apoptotik oleh sel fagositik. Morfologi sel nekrosis koagulasi adalah kromatin menggumpal (chromatin clumping), pembengkakan organel, kerusakan membran sel dan keluarnya isi sel yang akan mengundang reaksi inflamasi (Cotran dan Collins 1999). Perbedaan yang jelas antara kedua bentuk kematian sel di atas yaitu sel apoptosis tidak kehilangan kandungan internal sel dan tidak menyebabkan respon inflamasi (Tannock dan Hill 1998).
3. Obat Anti tumor
toksisitas selektif terhadap fase tertentu dari siklus sel disebut cell cycle specific (CSS), misalnya vinblastin, vinkristin, merkaptopurin, hidroksiurea, metotreksat dan asparginase. Zat CSS terbukti efektif untuk tumor yang berproliferasi tinggi seperti tumor darah, 2) Cell cycle– nonspesific, misalnya zat alkilator, antibiotika-antikanker (daktinomisin,daunorobisin,doksorubisin, plikamisin, mitomisin), sisplatin, prokarbazin dan nitrosourea (Nafrialdi dan Ganiswara 1995). Pada umumnya zat pengalkil (siklofosfamid, prokarbazin, mitomisin C) efektif pada fase G1 lambat atau fase S, sehingga menghalangi sel memasuki fase G2 dan menyebabkan kegagalan pembelahan sel. Jika sel tumor dapat memperbaiki kerusakan DNA sebelum pembelahan sel, maka sel tumor tersebut relatif resisten terhadap zat pengalkil (Katzung 2001).
4. Sel lestari tumor (cell lines)
Sel lestari (cell lines) adalah sel yang berasal dari tumor (kultur primer) yang telah dibiakkan (pasase) secara berkala, ditumbuhkembangkan, dipelihara dan disimpan dalam nitrogen cair. Salah satu keistimewaan dari sel lestari adalah bersifat im-mortal, sel ini masih dapat hidup dalam kondisi media seminimal mungkin (Freshney 1992). Kultur yang berasal dari sel tumor akan menghasilkan continous cell lines (CCL) yang dapat bertahan tanpa batas, tumbuh lebih cepat serta mudah dilakukan clone, tetapi secara genetik tidak stabil. Penggunaan sel lestari yang dimaksudkan dalam penelitian ini untuk memperoleh sel dalam jumlah besar dan homogen. Sel akan tumbuh dan berkembang (proliferasi) dengan cepat dalam media yang spesifik dan akan mencapai konfluen dalam waktu 3-4 hari tergantung pada jenis sel.
Sel lestari tumor yang digunakan pada penelitian ini terdiri dari:
a). Sel HeLa, diisolasi dari epitel karsinoma serviks seorang wanita negro (31 tahun) pada tahun 1951. Merupakan sel monolayer, aneuploidi dan sudah dipasase lebih kurang 76-88 kali.
b). Sel K-562, merupakan sel meiloid leukemia kronik seorang wanita (53 tahun). Populasi sel dikarakterisasikan sebagai highly undifferentiated dan dari seri granulosit.
c). Sel WEHI-164, adalah sel fibrosarkoma mencit Balb/c, tumor diinduksi dengan injeksi subkutan senyawa 3-metilkolantren pada mencit Balb/c.
D. Imunomodulator
terganggu (imunorestorasi), 2)memperbaiki fungsi sistem imun (imunostimulasi) dan 3)menekan respons imun (imunosupresi). Imunorestorasi dan imunostimulasi disebut imunopotensiasi atau up regulation, sedangkan imunosupresi disebut juga down regulation. Tumor terjadi lebih sering pada orang dengan supresi sistem imun, prevalensi tumor pada orang yang mendapat radiasi 100 kali lebih besar dibanding orang normal (Baratawidjaja, 2001). Faktor dari tubuh pejamu (host) yang berperanan menekan pertumbuhan tumor diantaranya adalah: faktor genetik, respon imun non spesifik dan spesifik. Perondaan imunologik atau immune surveillance adalah peran fungsi protektif sistem imun dengan mengenal dan menghancurkan sel-sel abnormal sebelum berkembang menjadi tumor atau membunuhnya kalau tumor itu sudah tumbuh. Alternatif lain untuk pengobatan tumor yaitu memperbaiki sistem imun melalui pemberian bahan biologi (limfokin, interferon, antibodi monoklonal, bahan asal bakteri atau jamur) dan senyawa sintetik (levamisol, isoprinosil, muramil dipeptida) (Baratawidjaja 2001). Bahan alam yang mempunyai sifat imunomodulator dikelompokkan berdasarkan berat molekul rendah dan besar atau golongan senyawa seperti: karbohidrat, terpen, steroid, polifenol, kumarin, asam amino, peptida, protein, glikoprotein, alkaloida dan senyawa nitrogen organik lain (Colegate dan Molyneux 1993). Polisakarida glukan me mpunyai efek anti tumor, menghambat karsinogenesis, meningkatkan respons host terhadap serangan bakteri, virus, jamur, dan parasit serta meningkatkan fungsi fagosit dan aktivitas proliferasi sistem retikuloendotel (Wong 1997). Fujiwa berhasil mengisolasi peptida FK -156 dari metabolit Streptomyces sp yang dilaporkan mempunyai aktivitas anti tumor terhadap sel leukemia murin (P 388), sedangkan senyawa analog FK-156 yaitu tripeptida sintetis (FK-565) mengaktivasi fungsi fagosit makrofag dengan menginduksi pelepasan IL-6 dan GM-CSF (granulocyte macrophage colony-stimulating factor) dari makrofag peritoneal yang distimulasi dengan lipopolisakarida (LPS) (Shu 1998).
1. Fagositosis
secara cepat pada lokasi infeksi karena ditarik oleh bahan kemotaktik yang meningkat selama proses inflamasi.
Sel fagositik mampu melakukan kemotaksi ke tempat mikro-organisme sebagai respon terhadap berbagai produk bakteri dan faktor biokimiawi yang dilepas pada aktivasi komplemen, sehingga terjadi perlekatan bakteri yang telah diopsonisasi pada membran fagosit. Sel fagositik membentuk pseudopodia untuk membungkus bakteri, fusi ini membentuk kawah atau fagosom. Lisosom yang mengandung enzim hidrolitik dan substansi bakterisidal lain bermigrasi ke arah fagosom dan berfusi dengan membrannya untuk membentuk suatu fagolisosom sehingga terjadi ingesti. Pembunuhan intraseluler terhadap bakteri yang diingesti dapat terjadi beberapa menit walaupun degradasi sel bakteri dapat menghabiskan waktu dalam beberapa jam (Kresno 2001, Baratawidjaja 2001).
2. Makrofag
Makrofag adalah sel fagositik yang berperanan pada sistim imun non spesifik untuk memproses antigen, memakan organisme penyerang, melakukan penghancuran bakteri, virus atau sel tumor secara intraseluler melalui aksi enzim lisozim. Makrofag berasal dari promonosit sumsum tulang dan dibawa sebagai monosit di dalam pembuluh darah, yang berperan sebagai “makrofag bebas” (di dalam alveoli paru, peritoneum dan granuloma radang) atau sebagai “makrofag terikat” (dalam limfa node, limfa, hati disebut sel Kupfer, CNS disebut mikroglia dan jaringan ikat disebut histiosit) (Baratawidjaja 2001). Makrofag mempunyai reseptor terhadap fragmen Fc IgG1, IgG3, IgE, menghasilkan beberapa sitokin yang penting antara lain interleukin-1 (IL-1) dan
tumor necrosis factor (TNF) yang dapat berperan sebagai mediator radang dan menyebabkan demam. Makrofag memproses antigen bakteri dan membawanya ke limfosit (antigen presenting cells, APC) untuk merangsang respon imun spesifik dan juga memainkan peranan penting pada imunitas berperantara sel (Kresno 2001)
III. METODE PENELITIAN
A. Tempat Dan Waktu
Penelitian dilaksanakan di Laboratorium Fitokimia Bidang Botani Pusat Penelitian Biologi LIPI Bogor, Laboratorium Kultur Jaringan, Laboratorium Histologi dan Laboratorium Bakteriologi Fakultas Kedokteran Hewan IPB serta Laboratorium Penelitian Fakultas Farmasi Universitas Pancasila; mulai bulan Mei 2003 sampai Juli 2005.
B. Bahan dan Alat Penelitian
Bahan penelitian adalah rimpang temu putih diperoleh dari BALITTRO Bogor, dikumpulkan dari tumbuhan yang berumur 10 bulan dan dideterminasi di Herbarium Bogoriense LIPI Bogor. Bahan kimiawi yang digunakan pada pembuatan ekstrak, fraksinasi, pemurnian dan karakterisasi kimia adalah pelarut teknik dan pro analisis antara lain n-heksana, etil asetat (EtOAc), metanol (MeOH), kloroform, amonia, asam klorida, silika gel kiesel 60 (Merck), celite, pereaksi Dragendorf, Meyer, Lieberman-Bouchard, Stiasny, FeCl3, penampak bercak anisaldehid-H2SO4-metanol (5:2:93). Adapun alat yang digunakan antara lain perangkat alat ekstraksi, penangas air, neraca analitik, sonikator, lempeng KLT silika gel 60 GF 254 (Merck), lampu UV (Camag), kromatografi kolom dari kaca (75 cm x 4,5 cm), penguap putar (vacum rotavapor) Buchi, spektrofotometer UV-Vis (Shimadzu UV 1601), spektrofotometer FT-IR (Shimadzu FTIR -8400S), kromatografi cair kinerja tinggi (KCKT) (Shimadzu LC 6 AD dan 10 AT VP), kolom silika (SHIM Pack CLC Sil; 4,6 mm x15cm), LCMS Shimadzu LCMS 2010 A, kolom C18 (Princeton Omni; 2,0 mm x15 cm).
Bahan kimia untuk uji bioaktivitas adalah air laut sintetis, media pertumbuhan sel
Dubelcco’s Modified Essential Medium (DMEM) (Gibco-BRL,USA), Fetal Bovine Serum (FBS), Phosphate Buffer Saline (PBS), 2mM EDTA, dimethylsulphoxide
(DMSO), tripsin (0,2%), penisilin, streptomisin, fungizon, kolkisin, larutan KCl (0,075M), metanol-asam asetat, pewarna biru tripan, Giemsa, pewarna fluorosens;
fluorochrome bis-benzimide trihydrochloride (Hoechst 33342), media perbenihan bakteri Todd-Hewitt Broth (THB) (Gibco) dan larutan Mc Farland. Alat yang digunakan pada uji bioaktivitas antara lain: alat alat gelas, tabung reaksi, vial, mikropipet, stirer,
vortex, membran filter (0,22 µm), lampu, micro-plate dengan 24 sumur, cawan petri, ultra sentrifus, timbangan mikrobalans, sterilisator, tangki nitrogen cair, laminar air flow, refrigerator, inkubator CO2, hemositometer (Neubauer). mikroskop fase kontras, mikroskop cahaya, mikroskop fluoresens.
C. Metode Penelitian
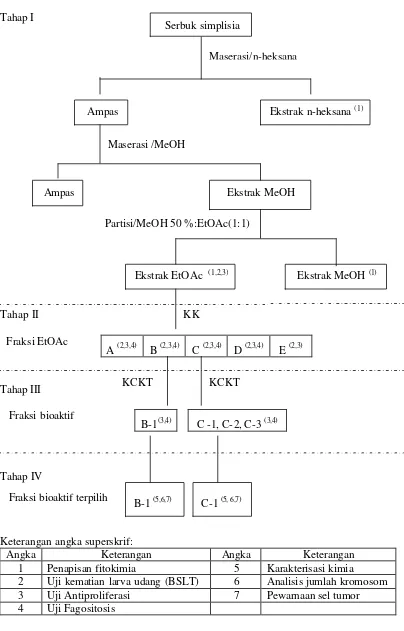
Penelitian ini terdiri atas 1) Ekstraksi, fraksinasi, pemurnian dan karakterisasi kimia dan 2) Pengujian bioaktivitas sebagai antiproliferasi sel lestari tumor dan uji fagositosis. Kegiatan penelitian dilakukan dalam 4 tahap dan dilaksanakan secara berkelanjutan sesuai bagan alur pada Gambar 3.
1. Ekstraksi, Fraksinasi, Pemurnian dan Karakterisasi Kimia a. Pembuatan Ekstrak
Tahap I
Tahap II
A (2,3,4) B (2,3,4) C (2,3,4) D (2,3,4) E (2,3)
Tahap III
B-1(3,4) C -1, C-2, C-3 (3,4)
Tahap IV
Keterangan angka superskrif:
Angka Keterangan Angka Keterangan
1 Penapisan fitokimia 5 Karakterisasi kimia
2 Uji kematian larva udang (BSLT) 6 Analisis jumlah kromosom 3 Uji Antiproliferasi 7 Pewarnaan sel tumor 4 Uji Fagositosis
Gambar 3. Bagan alur ekstraksi dan uji bioaktivitas Maserasi/n-heksana
Maserasi /MeOH
Serbuk simplisia
Ampas Ekstrak n-heksana (1)
Ekstrak MeOH (1) Ampas
Partisi/MeOH 50 %:EtOAc(1:1)
Ekstrak MeOH
Ekstrak EtOAc (1,2,3)
KK
KCKT KCKT
Fraksi bioaktif Fraksi EtOAc
Penapisan Fitokimia
Penapisan fitokimia dilakukan terhadap serbuk rimpang temu putih dan ketiga jenis ekstrak (selanjutnya disebut contoh) untuk memeriksa golongan senyawa kimia alkaloid, flavonoid, saponin, tanin, steroid -terpenoid dan minyak atsiri menurut prosedur pemeriksaan yang diuraikan oleh Fransworth 1986.
1). Identifikasi Golongan Alkaloid
Sebanyak 5 g contoh ditambah 5 mL amoniak 25%, 20 mL kloroform dilakukan penggerusan dalam mortir dan disaring. Filtrat berupa larutan organik untuk percobaan berikutnya. Sebagian larutan diteteskan pada kertas saring yang telah ditetesi Dragendorf LP, bila terbentuk warna merah atau jingga menunjukkan adanya alkaloid. Sisa larutan diekstrasi 2 kali dengan HCl (1:5 v/v) dan dimasukkan ke dalam 2 tabung reaksi. Pada masing-masing tabung ditambahkan beberapa tetes larutan pereaksi Dragendorf dan Mayer. Bila terbentuk endapan merah dengan pereaks i Dragendorf atau endapan putih dengan pereaksi Mayer membuktikan adanya alkaloid.
2). Identifikasi Golongan Flavonoid
Sebanyak 10 g contoh dididihkan dengan 100 mL air panas selama 5 menit dan disaring. Ke dalam 5 mL filtrat ditambahkan serbuk magnesium, 1 mL HCl p dan 2 mL amil alkohol, dilakukan pengocokan dan biarkan memisah. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol membuktikan adanya golongan flavonoid.
3). Identifikasi Golongan Saponin
Sebanyak 10 mL larutan percobaan pada identifikasi flavonoid dinasukkan dalam tabung reaksi kemudian tabung dikocok kuat secara vertikal selama 10 detik. Bila terbentuk busa setinggi 1-10 cm yang stabil dalam waktu 10 menit dan tidak hilang pada penambahan 1 tetes HCl 2N menunjukkan adanya saponin.
4). Identifikasi Golongan Tanin
adanya tanin katekuat. Selanjutnya endapan disaring dan filtrat dijernihkan dengan natrium asetat dan ditambahkan beberapa tetes larutan FeCl3 1%, bila terbentuk warna biru menunjukkan adanya tanin galat.
5). Identifikasi Golongan Steroid dan Terpenoid
Sebanyak 5 g contoh dimaserasi dalam wadah tertutup rapat dengan 20 mL eter selama 2 jam kemudian disaring. Sebanyak 5 mL filtrat diuapkan dalam cawan penguap hingga diperoleh residu. Ke dalam residu ditambahkan 2 tetes larutan asam asetat anhidrat dan 1 tetes asam sulfat pekat. Terbentuknya warna hijau menunjukkan adanya steroid dan warna ungu menunjukkan adanya terpenoid. 6). Identifikasi Golongan Minyak Atsiri
Sebanyak 3 g contoh dimasukkan ke dalam tabung reaksi dan ditambahkan 10 mL eter minyak tanah lalu ditutup dengan corong berisi kapas basah. Dipanaskan selama 10-15 menit di atas penangas air, kemudian didinginkan dan disaring. Filtrat diuapkan dalam cawan penguap selanjutnya residu dilarutkan dengan 5 mL etanol 95% dan disaring. Filtrat diuapkan perlahan-lahan dalam cawan penguap. Bila residu berbau aromatik menunjukkan adanya minyak atsiri.
b. Fraksinasi Ekstrak Etil Asetat
Fraksinasi ekstrak EtOAc dilakukan dengan kromatografi kolom (75 x 4,5 cm) dengan fase diam; silika gel G-60 da n fase gerak pelarut landaian n -heksana-EtOAc
Pembuatan fase diam (penjerap) kolom kromatografi
perlu, tambahkan lagi pelarut hingga batas permukaan atas ekstrak-celite; dinding kolom diketuk perlahan-lahan dengan sumbat karet sampai permukaan ekstrak-celite
merata. Tambahkan pelarut dengan pipet melalui dinding tabung sampai permukaan pelarut berada sekitar 5 cm di atas permukaan ekstrak-celite. Sistim pelarut yang digunakan adalah fase gerak landaian dimulai dengan heksana 2,5 L n-heksana:EtOAc dengan perbandingan 9:1, 8:2, 7:3, 6:4 dan 5:5 masing-masing 1 L dan EtOAc 2,5 L. Tetesan eluat diatur 5 mL/menit dan eluat ditampung dalam wadah botol atau tabung. Eluat dikelompokkan berdasarkan pola bercak kromatografi lapis tipis (KLT), dikeringkan dengan penguap putar. Selanjutnya dilakukan uji bioaktivitas yaitu uji kematian larva udang (BSLT), uji antiproliferasi sel lestari tumor dan uji fagositosis dengan fraksi EtOAc
c. Pemurnian Fraksi Etil Asetat
Fraksi EtOAc yang dimurnikan adalah fraksi EtOAc yang memberikan nilai penghambatan pertumbuhan (PP) yang tertinggi terhadap sel HeLa, K-562 dan WEHI 164. Pemurnian fraksi EtOAc dilakukan dengan KCKT fase normal menggunakan instrumen Shimadzu LC 6 AD dan 10 AT VP dengan kolom SHIM Pack CLC Sil (4,6 mm x 15 cm), fase gerak n-heksana/EtOAc, detektor UV (λ 254 nm) dan laju alir 1 mL/menit. Sejumlah tertentu dari fraksi fraksi B dan C hasil fraksinasi kolom ekstrak EtOAc dilarutkan dalam 10 mL EtOAc dan sebanyak 20 µL larutan contoh disuntikkan pada setiap periode pemisahan KCKT. Penampungan eluat dilakukan secara manual berdasarkan pemunculan puncak yang diperhatikan (interes) pada layar monitor. Eluat yang diperoleh kemudian dikeringkan selanjutnya dilakukan uji bioaktivitas sebagai antiproliferasi dan fagositosis untuk memperoleh fraksi bioaktif.
d. Karakterisasi Kimia
Karakterisasi kimia ditentukan berdasarkan data spektroskopi UV, IM dan massa sebagai bahan kajian untuk mengungkapkan struktur kimia fraksi bioaktif terpilih. Karakterisasi kimia yang dilakukan meliputi:
1). Spektrometri UV
terhadap serapan elektronik seperti C=C, C=O, NO2 yang terdapat dalam suatu senyawa (Silverstein dan Wester 1995).
Serbuk fraksi B-1 dan C-1 dilarutkan dalam metanol, selanjutnya diukur spektrum serapan maksimum pada panjang gelombang 200 sampai 500 nm.
2). Spektrometri Infra merah (Fourier Transform Infra Red)
Data spektrum infra merah bemanfaat untuk mengetahui jenis gugus fungsi yang ada dalam molekul senyawa (Williams dan Fleming 1985).
Sebanyak 1 mg serbuk fraksi B-1 dan C-1 digerus dengan 200 mg kalium bromida sampai homogen. Selanjutnya serbuk yang telah homogen dimasukkan ke dalam sample pan untuk dibuatreka man spektrum infra merah pada bilangan gelombang 4000 - 500 cm-1.
3). Spektrum Massa
Di dalam spektrometer massa, molekul senyawa ditembak dengan berkas elektron (electron impact) sebesar 70 ev. Senyawa akan menghasilkan ion molekul dan fragmentasinya yang dipilah berdasarkan nisbah massa terhadap muatan (m/z). Dari data spektrum massa suatu senyawa dapat diketahui bobot molekul suatu senyawa (Silverstein dan Wester 1995). Pengukuran massa senyawa fraksi bioaktif dilakukan dengan instrumen Shimadzu LCMS 2010A yaitu instrumen tandem (pasangan) Liquid Chromatography (LC) dan Mass Spectrometer (MS). Pada sistem instrumen ini diterapkan sistim kromatografi fase terbalik dengan fase diam yaitu kolom C18 (Princeton Omni; 2,0 mm x 15 cm) bersifat non polar dibandingkan fase gerak yaitu metanol/asam formiat (1:1). Kromatograf ini dilengkapi dengan detektor Photo Diode Array (PDA) yang dapat memonitor pada panjang gelombang 100-800 nm dan oven. Volume penyuntikkan larutan contoh adalah 5 µL dan laju alir fase gerak sebesar 0,2 ml/menit.
2. Uji Aktivitas Biologik
a. Uji Kematian Larva Udang (Brine Shrimp Lethality Test, BSLT)
McLaughlin dan Rogers (1998) untuk menilai ketoksikan bahan uji terhadap larva udang A. salina dengan bagan alur pada Gambar 4. Telur A.salina ditaburkan dalam bejana penetas yang berisi air laut sintetis dilengkapi aerator dan ditaruh di bawah lampu baca. Setelah 24 jam, telur yang sudah menetas menjadi naupli dipindahkan ke tempat lain dan 24 jam kemudian naupli tersebut siap digunakan untuk pengujian.
Pengujian ekstrak EtOAc dan fraksi A,B,C,D dan E dilakukan pada 4 tingkat kadar yaitu: 1,10,100,1000 bpj dengan 3 kali pengulangan untuk setiap kadar uji. Pada setiap vial dimasukkan masing-masing larutan uji dengan kadar tertentu dan air laut sintetik yang berisi 10 ekor larva udang, kemudian vial diletakkan di bawah sinar lampu. Setelah 24 jam, dihitung jumlah naupli yang hidup dan mati.
Data yang diperoleh yaitu mortalitas naupli (%) dan kadar larutan uji diolah dengan analisis probit atau metode Finney untuk menghitung nilai Lethal Cconcentration 50 (LC50) (McLaughlin dan Rogers 1998). LC50 adalah kosentrasi yang menyebabkan kematian 50 % dari larva udang yang diuji.
Gambar 4. Bagan alur uji kematian larva udang (BSLT)
24 jam
24 jam
Ekstrak EtOAc, Fraksi A,B,C,D,E masing-masing
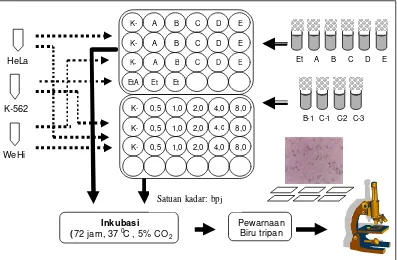
b. Uji Antiproliferasi Sel Lestari Tumor Secara In-vitro
Uji antiproliferasi sel tumor lestari (HeLa, K -562 dan WEHI 164) secara in-vitro
dilakukan menurut metode yang diuraikan oleh Priosoeryanto et al. 1995 seperti yang tertera pada bagan alur Gambar 5.
1). Persiapan media dan kultur sel tumor
Media yang digunakan untuk pertumbuhan kultur sel tumor adalah media DMEM (Dubelcco’sMinimal Essential Media). Bubuk media dilarutkan dalam 50 mL akuabides steril dengan bantuan stirer sampai semua media terlarut. Selanjutnya ditambahkan 2,438 g NaHCO3 sambil terus diaduk dengan stirer. Volume media ditepatkan sampai 1000 mL dan disterilkan dengan menggunakan filter membran 0,2 µm. Media ini digunakan untuk membuat larutan stok contoh maupun media pencuci sedangkan media lengkap untuk pertumbuhan kultur sel ditambahkan dengan 10% FBS (Fetal Bovine Serum), 100 IU/mL antibiotika penisilin -streptomisin dan 0,01 % anti jamur fungison.
Pada penyimpanan jangka panjang sel lestari tumor disimpan dalam tabung nitrogen cair pada suhu minus 1900C. Untuk mengkultur kembali sel beku dari tabung nitogen cair, vial yang berisi sel lestari tumor ditiriskan (thawing) terlebih dahulu pada suhu 370C sampai sebagian media sel meleleh. Bagian luar vial dibersihkan dengan alkohol 70% untuk menghindari kontaminasi kemudian pindahkan isi vial ke dalam tabung sentrifus 15 mL secara aseptik di dalam laminar air flow. Tambahkan media pencuci ke dalam vial untuk membilas sel yang masih tertinggal dan volume suspensi sel ditepatkan sampai 10 mL. Sentrifus suspensi sel dengan kecepatan 1000 rpm pada suhu 40C selama 5-10 menit. Supernatan dibuang kemudian pada pelet sel ditambah media pencuci sampai 10 mL dan ulangi sentrifus dengan kecepatan dan waktu yang sama. Supernatan kembali dibuang dan pelet sel dilarutkan dalam 5 mL media lengkap dan diaduk perlahan agar suspensi sel homogen. Untuk menghitung jumlah sel awal (viabilitas sel), maka sebanyak 10 µL suspensi sel dicampur secara merata dengan 10 µL biru tripan, sebanyak 10 µL campuran ini ditetesi pada celah hemositometer kemudian ditutup dengan gelas penutup dan hitung jumlah sel dengan mikroskop cahaya perbesaran 100 kali dalam 25 kotak pada bagian tengah kamar hitung. Sel mati akan menyerap warna biru tripan sedangkan sel hidup tidak menyerap warna dan kelihatan bening.
Faktor pengenceran = 2; diperoleh dari 10 µL suspensi sel + 10 µL biru tripan . Faktor konversi untuk hemositometer Neubauer (tinggi celah 0,1 mm) = 10 4
Pemeliharaan sel dilakukan dalam media lengkap yaitu dengan mengganti dan mencuci kultur sel setiap 3 hari atau bila warna media telah berubah dari merah menjadi oranye/kuning yang menandakan terjadinya penurunan pH; beberapa sel akan mati bila terjadi penurunan pH sampai 6,0 (Freshney 1992).
Gambar 5. Bagan alur uji antiproliferasi
2). Pengujian antiproliferasi
3). Perhitungan sel lestari tumor pasca perlakuan.
Pada kultur sel monolayer (sel HeLa dan WEHI 164) dilakukan tripisinasi untuk melepaskan sel yang menempel pada dasar sumur. Medium penumbuh pada masing-masing sumur dibuang terlebih dahulu kemudian ditambahkan 40 µL tripsin 0,2 % dan diinkubasi selama 8 menit. Pada masing-masing sumur dimasukkan 960 µL mediu m penumbuh dan dikocok perlahan dengan mikropipet hingga homogen. Sebanyak 90 µL kultur sel dan 10 µL biru tripan dikocok hingga homogen di dalam sumur microplate
(96 lubang) selanjutnya 10 µL campuran tadi, diteteskan pada celah hemositometer Neubauer untuk menghitung jumlah sel (hidup dan mati) yang ada dalam 25 kotak pada bagian tengah kamar hitung. Pada setiap ulangan dibuat 2 preparat untuk dilakukan pembacaan sebanyak 3 kali. Kultur sel K-562 bersifat suspensi sehingga tidak perlu dilakukan tripisinisasi, kultur sel dikocok homogen dengan mikropipet selanjutnya dibuat pewarnaan dengan prosedur yang sama seperti pada sel HeLa. Parameter yang dihitung adalah persentase penghambatan pertumbuhan (%PP) berdasarkan perbandingan jumlah total sel dalam sumur microplate kontrol dan perlakuan serta kadar hambat median (IC50) dari masing-masing fraksi uji.
Penghambatan pertumbuhan (PP) sel tumor dihitung dengan rumus : Rataan jumlah sel (K) – Rataan jumlah sel (P)
% PP = --- X 100 % Rataan jumlah sel (K)
Keterangan:
K = kelompok kontrol ; P = kelompok perlakuan
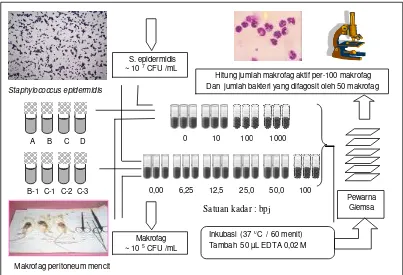
c. Uji Fagositosis Makrofag Secara In-vitro
Dilakukan sesuai dengan metode Wagner dan Jurcic (1991) yang telah dimodifikasi bertujuan untuk menilai pengaruh pemberian larutan contoh pada beberapa tingkat kadar terhadap kemampuan fagositosis sel makrofag; sesuai bagan alur kerja pada Gambar 6.
1). Preparasi makrofag peritoneal mencit
disuntikkan ke dalam rongga peritoneal. Usap perlahan-lahan abdomen dengan tangan selama 2-3 menit selanjutnya sedot kembali cairan peritoneal dan masukkan ke dalam tabung steril. Hitung jumlah makrofag yang diperoleh dari cairan peritoneal tersebut dengan menggunakan hemositometer dan disetarakan sampai diperoleh 105 sel makrofag/mL.
Gambar 6. Bagan alur uji fagositosis 2). Pembuatan suspensi bakteri Staphyloccocus epidermidis.
Bakteri ditumbuhkan dalam 10 mL THB selama semalam pada suhu 37 0C kemudian disentrifus 3000 rpm selama 30 menit. Pelet yang diperoleh disuspensikan dalam 10 mL PBS dan kekeruhannya disetarakan dengan larutan Mc Farland no.2 yaitu 109 colony forming unit (CFU)/mL. Suspensi ini kemudian diencerkan secara bertingkat sebanyak 2 kali hingga setara dengan 107 CFU/mL.
3). Pengujian fagositosis
Ke dalam tabung reaksi masukkan sebanyak 200 µL PBS (kontrol) atau 200 µL larutan contoh dengan kadar tertentu, 200 µL suspensi makrofag (105/mL) dan 200 µl
Staphylococcus epidermidis
Makrofag peritoneum mencit
Hitung jumlah makrofag aktif per-100 makrofag Dan jumlah bakteri yang difagosit oleh 50 makrofag
suspensi bakteri S. epidermidis (107 CFU/mL), campuran tersebut diaduk homogen dan diinkubasi selama 60 menit pada suhu 370C. Untuk mengakhiri fagositosis ditambahkan larutan 50 µL EDTA 0,02 M. Sebanyak 100 µL campuran inkubasi diteteskan pada kaca preparat untuk dibuat preparat ulas. Preparat difiksasi dengan metanol selama 15 menit kemudian diwarnai dengan pewarna Giemsa dan dikeringkan selama 30 menit, pengamatan dilakukan dengan mikroskop cahaya (10x100). Parameter yang diamati adalah sel fagosit aktif (SFA) yaitu jumlah sel makrofag yang aktif melakukan fagositosis per-100 makrofag dan indeks fagosit (IF) yaitu jumlah rata-rata bakteri yang ditelan oleh satu makrofag aktif; dihitung dari jumlah total bakteri yang ditelan oleh 50 sel makrofag aktif (Wagner dan Jurcic 1991; Ichinose et al. 1998).
SFA kelompok Perlakuan – SFA kelompok Kontrol
Stimulasi SFA (%) = --- X 100 % SFA kelompok Kontrol
IF kelompok Perlakuan – IF kelompok Kontrol
Stimulasi IF (%) = --- X 100 % IF kelompok Kontrol
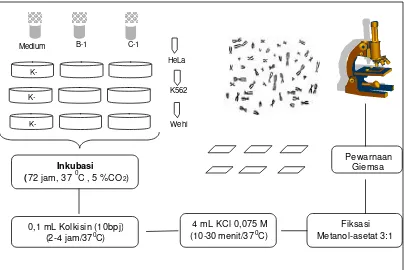
d. Analisis Jumlah Kromosom
Analisis jumlah kromosom sel lestari tumor dilakukan mengikuti metode MacDonald (1998) dengan bagan alur kerja tertera pada Gambar 7.
Gambar 7. Bagan alur analisis jumlah kromosom
e. Pewarnaan Sel lestari tumor dengan Pewarna Fluoresens.
Pewarnaan sel lestari tumor dilakukan mengikuti metode Baehrecke dan Mehmet (2003) dengan bagan alur kerja tertera pada Gambar 8.
yang Ke dalam biakan sel yang ditumbuhkan dalam cawan petri ditambahkan larutan fraksi B-1 dan C-1, masing-masing dengan kadar 1,5 bpj dan diinkubasi (37 0C, 5% CO2)selama 48 jam. Pada akhir masa inkubasi (48 jam), media diambil dan pe let sel difiksasi dengan formalin 3,7% /PBS dalam suasana dingin. Kemudian ditambahkan pewarna fluoresens Hoechst 33342 (fluorochrome bis-benzimide trihydrochloride) di ruangan gelap. Setelah 15 menit, pengamatan perubahan morfologidinding dan inti sel dilakukan dengan menggunakan mikroksop fluoresens.
Inkubasi (72 jam, 37 0C , 5 %CO2)
Pewarnaan Giemsa
0,1 mL Kolkisin (10bpj) (2-4 jam/370C)
4 mL KCl 0,075 M (10-30 menit/370C)
Fiksasi Metanol-asetat 3:1
C-1 B-1
Medium
Wehi K562 HeLa
Gambar 8. Bagan alur pewarnaan sel tumor dengan pewarna fluoresens
3. Analisis Data
Data kuantitatif yang diperoleh pada penelitian ini dianalisis dengan uji sidik ragam, apabila terdapat perbedaan yang nyata, dilanjutkan dengan uji jarak berganda Duncan untuk mengetahui perbedaan antara perlakuan (Mattjik dan Sumertajaya 2002). Analisis ragam dilakukan dengan menggunakan program statistik SPSS for Windows release 11.5. Jumlah kromosom dan perubahan morfologi sel lestari tumor dianalisis secara deskriptif.
Inkubasi
(24-36 jam, 37 0C , 5 %CO2)
Pewarnaan Hoeschst 33342
Cuci dengan PBS Fiksasi
Formalin 3,7 %/PBS
Mikroskop Fluoresens
Cuci dengan PBS Simpan dalam es
C-1 B-1
Medium
WEHI K562 HeLa
IV. HASIL DAN PEMBAHASAN
A. Ekstraksi, Fraksinasi, Pemurnian dan Karakerisasi Kimia 1. Ekstrak Rimpang Te mu Putih
Rimpang temu putih (Gambar 9 A) diperoleh dari BALITTRO Bogor dibersihkan, dicuci, diiris tipis (Gambar 9 B) dikeringkan di dalam oven (40 0C) dan dibuat serbuk (Gambar 9 C). Dari 1 kg serbuk simplisia rimpang temu putih yang diekstraksi; diperoleh rendemen ekstrak n -heksana; 10,4 %, ekstrak EtOAc; 7,2 % dan ekstrak MeOH; 5,5 % (Gambar 9 D). Rendemen ekstrak n-heksana lebih besar dibandingkan yang lain, kenyataan ini sesuai dengan besarnya komponen utama familia Zingiberaceae yaitu minyak atsiri; pada C. longa sebesar 3-4 %, C. xanthorrhiza
sebesar 8-10% (Liang 1992), sedangkan C. zedoaria sebesar 1-2,5% (Dalimartha 2003).
Gambar 9. Rimpang temu putih (A), Irisan rimpang (B), Serbuk (C) dan Ekstrak (D)
Komponen kimia penyusun minyak atsiri C. zedoaria adalah monoterpen (a -pinen, D-kamfen, D-borneol, D-kamfor, sineol) dan seskuiterpen (bisabolan, eleman,