xxv
IDENTIFIKASI KERAGAMAN GEN FSH SUB-UNIT BETA
GEN FSH RESEPTOR DAN GEN GH PADA SAPI BALI
JANTAN SEBAGAI PENANDA KUALITAS SPERMA
ANDI BASO LOMPENGENG ISHAK
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
xxvi
Dengan ini saya menyatakan bahwa disertasi Identifikasi Keragaman Gen FSH Sub-unit Beta, Gen FSHR dan Gen GH pada Sapi Bali sebagai Penanda Kualitas Sperma adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir disertasi ini.
Bogor, Januari 2012
Andi Baso Lompengeng Ishak
i
ANDI BASO LOMPENGENG ISHAK. Identification of Polymorphism of Follicle-Stimulating Hormone Sub-beta Unit Gene, Follicle-Stimulating Hormone Receptor and Growth Hormon Gene for Sperm Abnormalities Marker in Bali Cattle. Under supervision of CECE SUMANTRI, RONNY RACHMAN NOOR and IIS ARIFIANTINI.
ii
abnormalities indicate lower abnormality in AB genotype when compared to BB and AA genotypes.
iii
RINGKASAN
ANDI BASO LOMPENGENG ISHAK. Identifikasi Keragaman Gen FSH sub-unit beta, Gen FSH Reseptor dan Gen GH pada Sapi Bali Jantan Sebagai Penanda Kualitas Sperma. Dibimbing oleh : CECE SUMANTRI, RONNY RACHMAN NOOR dan IIS ARIFIANTINI.
iv
FKH IPB. Penentuan keragaman gen, digunakan analisis frekuensi gen, nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas harapan (He) serta nilai
Polymorphic Informative Content (PIC). Keseimbangan frekuensi gen dalam populasi diuji dengan uji 2 (chi-square), sekuens gen FSH sub-unit beta dilakukan untuk melihat perubahan runutan nukleotida spesifik terutama pada situs enzim restriksi yang digunakan.
Hasil analisis gen FSH sub-unit beta dengan metode PCR-RFLP menggunakan sepasang primer F : 5`CTTCCAGACTACTGTAACTCATC‘3 dan R : 5`GTAGGCAGTCAAAGCATCCG‘3, menggunakan enzim restriksi PstI dan suhu annealing 63oC. Variasi hanya pada sapi FH, Brahman, Limousin dan Simmental atau polimorfik, sedang pada sapi Bali tidak ada variasi atau monomorfik. Frekunsi alel A ditemukan tertinggi pada sapi FH (0.891) dan terendah pada sapi Bali (0.000). Frekuensi alel B ditemukan tertinggi pada sapi Bali (1.000), terendah pada sapi FH (0.109). Heterozigositas pengamatan tertinggi ditemukan pada sapi Limousin (0.318), heterozigositas harapan tertinggi pada sapi Simmental (0.420). Nilai 2 berpengaruh nyata pada sapi Brahman, FH, dan Simmental. Abnormalitas sperma paling rendah ditemukan pada sapi yang bergenotipe AB dibanding dengan sapi yang bergenotipe AA dan BB.
Berdasakan amplifikasi gen FSH sub-unit beta metode PCR-SSCP tidak ditemukan variasi alel dan genotipe pada sapi Bali atau monomorfik sedang variasi alel dan genotipe ditemukan pada sapi FH, Brahman, Limousin dan Simmental atau polimorfik. Frekuensi alel A ditemukan tertinggi pada sapi FH (0.645), terendah pada sapi Bali (0.000). Frekuensi alel B ditemukan tertinggi pada sapi Bali (1.000), terendah ditemukan pada sapi FH (0.355). Heterozigositas pengamatan tertinggi ditemukan pada sapi Simmental (0.372), heterozigositas harapan tertinggi ditemukan pada sapi Limousin (0.498). Nilai 2 berpengaruh nyata pada sapi Brahman, FH, dan Limousin. Abnormalitas sperma paling rendah pada sapi yang bergenotipe AB dibanding dengan sapi yang bergenotipe AA dan BB.
Hasil analisa gen FSH reseptor metode RFLP menggunakan sepasang primer F: 5`CTGCCTCCCTCAAGGTGCCCCTC‘3 dan R : 5`AGTTCTTGGTC AAATGTCTTAGGGGG‘3 menggunakan enzim restriksi AluI dengan suhu annealing 60oC, menunjukkan bahwa polimorfisme pada semua bangsa sapi yang dianalisis (Bali, Brahman, FH, Limousin dan Simmental). Frekuensi alel C yang tertinggi ditemukan pada sapi FH (0.891), terendah ditemukan pada sapi Bali (0.049). Frekuensi alel G tertinggi ditemukan pada sapi Bali (0.951), terendah ditemukan pada sapi FH (0.126). Heterozigositas pengamatan tertinggi ditemukan pada sapi Brahman (0.356), heterozigositas harapan tertinggi pada sapi Brahman dan Simmental (0.500. Nilai 2 berpengaruh nyata pada semua sapi yang dianalisis kecuali sapi Bali. Abnormalitas sperma lebih rendah ditemukan pada sapi yang bergenotipe CC dibandingkan dengan sapi yang bergenotipe CG dan GG.
v
menunjukkan bahwa pada sapi Brahman, FH, Limousin dan Simmental terdapat variasi, namun pada sapi Bali tidak terdapat variasi atau monomorfik. Frekuensi alel A +/+ tertinggi pada sapi Brahman (0.746), terendah pada sapi Bali (0.000). Frekuensi alel B -/- tertinggi pada sapi Bali (1.000) terendah pada sapi Brahman (0.254). Heterozigositas pengamatan tertinggi pada sapi Simmental (0.500), heterozigositas harapan tertinggi pada sapi FH (0.481). Nilai 2 berpengaruh nyata pada sapi FH. Abnormalitas sperma paling rendah pada sapi yang bergenotipe AB dibanding dengan sapi yang bergenotipe AA dan BB.
Kata kunci : Sapi Bali, Gen FSH beta-sub unit, gen FSH receptor, gen GH,
vii
©Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian,penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan masalah; dan pengutipan tersebut tidak merugikan kepentingan wajar IPB.
ix
IDENTIFIKASI KERAGAMAN GEN FSH SUB-UNIT BETA,
GEN FSHR DAN GEN GH PADA SAPI BALI JANTAN
SEBAGAI PENANDA KUALITAS SPERMA
ANDI BASO LOMPENGENG ISHAK
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
xi
Judul Disertasi : Identifikasi Keragaman Gen FSH sub-unit beta, Gen FSH Reseptor dan Gen GH pada Sapi Bali Jantan Sebagai Penanda Kualitas Sperma.
Nama : Andi Baso Lompengeng Ishak
NRP : D161080081
Program Studi / Mayor : Ilmu Produksi dan Teknologi Peternakan / ITP
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Cece Sumantri, M. Agr.Sc Ketua
Prof. Dr. Ir. Ronny R. Noor. M. Rur.Sc Prof. Dr. Dra. R. Iis Arifiantini, M.Si
Anggota Anggota
Mengetahui
Ketua Program Studi / Mayor Dekan Sekolah Pascasarjana Ilmu Produksi dan Teknologi Peternakan
Dr. Ir. Rarah R. A. Maheswari, DEA Dr. Ir. Dahrul Syah, M.Sc.Agr
xiii
RIWAYAT HIDUP
Penulis dilahirkan di Cabbenge, Soppeng, Sulawesi Selatan pada tanggal
29 Oktober 1969, sebagai anak ke 8 dari pasangan Kapten (Purn) TNI AD
Mochtar Saleh Andi Ishak dan Hj Andi Tasi. Pendidikan sarjana ditempuh di
Jurusan Nutrisi dan Makanan Ternak Fakultas Peternakan Universitas
Hasanuddin, lulus pada tahun 1993. Pada tahun 1994 diangkat sebagai Pegawai
Negeri Sipil sebagai staf peneliti di Balai Pengkajian Teknologi Pertanian (BPTP)
Sulawesi Tenggara. Melanjutkan pendidikan Magister dengan beasiswa Badan
Litbang Pertanian tahun 1999 di Program Pascasarjana Universitas Gadjah Mada
selesai pada tahun 2001.
Menikah pada tahun 2003 dengan Andi Barirah Agus dan telah dikaruniahi
putra Andi Pottobune Lompengeng Ishak. Pada tahun 2006 diangkat sebagai
kepala unit kebun percobaan Gowa di Balai Pengkajian Teknologi Pertanian
Sulawesi Selatan. Melanjutkan program Doktor di Sekolah Pascasarjana Institut
Pertanian Bogor pada tahun 2008 dengan beasiswa Badan Litbang Pertanian tahun
xv DAFTAR SINGKATAN
SNP = Single Nucleotide Polymorphism
DNA = Deoxyribosa Nuclaet Acid
MAS = Marker Assited Selection
PCR = Polymerase Chain Reaction
RFLP = Restriction Fragment Length Polymorphism
SSCP = Single Strand Comformation Polymorphism
FSH = Follicle-stimulating Hormone
FSHR = Follicle-stimulating Hormone Receptor
GH = Growth Hormone
Abaxial = Pergeseran posisi penempelan ekor pada kepala spermatozoa
Macrocephalus = Bentuk / ukuran kepala spermatozoa lebih besar dari ukuran normal
Microcephalus = Bentuk / ukuran kepala spermatozoa lebih kecil dari ukuran normal
Round Head = Bentuk spermatozoa yang bundar sehingga bagian post acrosomal tidak jelas
Knobbed Acrosome Defect = Kerusakan akrosom pada spermatozoa, terjadi lekukan ke dalam atau keluar pada kepala spermatozoa
xvii
Mekanisme FSH Sub-Unit Beta pada Spermatogenesis ... 12
Gen FSH Sub-Unit Beta ... 12
Gen FSH Reseptor ... 15
Gen Hormon Pertumbuhan (Growth Hormone gene) ... 19
Mekanisme Gen Hormon Pertumbuhan pada Spermatogenesis ... 21
Penciri molekuler DNA Restriction Fragmen Length Polymorphism (RFLP)... 22 Penciri molekuler DNA Single-Strand Comformation Polymorphism (SSCP) ... 23
Penentuan Genotipe dengan Pedekatan PCR-RFLP ... 27
Penentuan Genotipe dengan Pedekatan PCR-SSCP ... 28
Pembuatan Preparat Ulas Semen Segar ... 28
xviii
A. Keragaman Gen FSH Sub-unit Beta Sapi Bali Metode PCR-RFLP
Amplifikasi Ruas Gen FSH Sub-Unit Beta ... 31
Frekuensi Alel dan Genotipe Gen FSH Sub-Unit Beta ... 32
Nilai Heterozigositas ... 33
Analisis Sekuens Gen FSH sub-unit beta ... 34
Tingkat Abnormalitas Sperma pada Genotipe yang Berbeda ... 35
B. Keragaman Gen FSH Sub-unit Beta Pada Sapi Bali Metode PCR-SSCP Amplifikasi Ruas Gen FSH Sub-Unit Beta ... 37
Frekuensi Alel dan Genotipe Gen FSH Sub-Unit Beta ... 39
Nilai Heterozigositas ... 40
Tingkat Abnormalitas Sperma pada Genotipe yang Berbeda ... 41
C. Keragaman Gen FSH Reseptor Pada Sapi Bali Metode PCR-RFLP Amplifikasi Ruas Gen FSH reseptor ... 43
Frekuensi Alel dan Genotipe Gen FSH reseptor ... 44
Nilai Heterozigositas ... 45
Tingkat Abnormalitas Sperma pada Genotipe yang Berbeda ... 46
D. Keragaman Gen GH Pada Sapi Bali Metode PCR-RFLP Amplifikasi Ruas Gen GH ... 48
Frekuensi Alel dan Genotipe Gen GH ... 50
Nilai Heterozigositas ... 51
Tingkat Abnormalitas Sperma pada Genotipe yang Berbeda ... 52
PEMBAHASAN UMUM ... 53
SIMPULAN DAN SARAN ... 59
Simpulan ... 59
Saran ... 59
DAFTAR PUSTAKA ... 61
xix
DAFTAR TABEL
Halaman
1 Jumlah sampel yang digunakan ... 25
2 Sekuens primer yang digunakan ... 27
3 Frekuensi alel dan genotipe gen FSH Sub-Unit Beta PCR-RFLP ... 33
4 Nilai heterozigositas gen FSH Sub-Unit Beta ... 34
5 Frekuensi alel dan genotipe gen FSH sub-unit beta PCR-SSCP... 39
6 Nilai heterozigositas gen FSH Sub-Unit Beta ... 41
7 Frekuensi alel dan genotipe gen FSH reseptor PCR-RFLP ... 45
8 Nilai heterzigositas gen FSH reseptor ... 46
9 Frekuensi alel dan genotipe gen GH ... 50
xxi
DAFTAR GAMBAR
Halaman
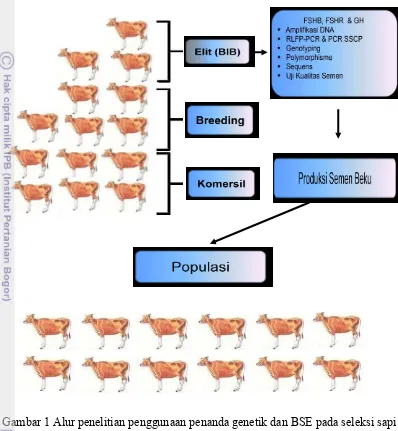
1 Alur penelitian ... 5
2 Peta pola penyebaran sapi di dunia ... 8
3 Posisi sapi Bali berdasarkan analisa mtDNA dan kromoson Y .... 9
4 Tahapan perubahan sel pada spermatogenesis ... 10
5 Mekanisme FSH pada Spermatogenesis ... 13
6 Gen FSH sub-unit beta pada kromosom 15 ... 14
7 Gen FSH sub-unit beta ... 14
8 Situs mutasi pada gen FSH sub-unit beta pada sapi ... 15
9 Gen FSH Reseptor ... 17
10 Aksi hormon domain ekstraseluler ... 18
11 Aksi hormon domain intraseluler ... 18
12 Gen GH (hormon pertumbuhan) ... 20
13 Skema mekanisme kerja GH dan IGF1 pada spermatogenesis .... 21
14 Fragmen gen FSH sub-unit beta didasarkan GenBank ... 27
15 Fragmen gen FSH reseptor didasarkan GenBank ... 27
16 Fragmen gen GH didasarkan GenBank ... 27
17 Produk PCR gen FSH sub-unit beta ... 31
18 Visualisasi hasil RFLP ruas gen FSH sub-unit beta ... 32
19 Hasil sekuens gen FSH sub-unit beta ... 35
20 Grafik persentase abnormalitas sperma pada genotipe yang
berbeda gen FSH sub-unit beta PCR-RFLP ... 36
21 Grafik persentase abnormalitas sperma berdasarkan bangsa sapi
yang berbeda gen FSH sub-unit beta PCR-RFLP ... 37
22 Produk PCR gen FSH sub-unit beta ... 37
23 Visualisasi SSCP ruas gen FSH sub-unit beta ... 38
24 Grafik persentase sperma pada genotipe gen FSH sub-unit beta
yang berbeda metode PCR-SSCP ... 42
25 Grafik persentase abnormalitas sperma berdasarkan bangsa sapi
xxii
28 Grafik persentase sperma pada genotipe gen FSH reseptor yang
berbeda metode PCR-RFLP... 47
29 Grafik persentase sperma pada bangsa sapi yang berbeda FSH
Reseptor ... 48 30
Produk PCR gen GH ... 49
31 Visualisasi hasil RFLP ruas gen GH ... 49
32 Grafik persentase sperma pada genotipe gen GH yang berbeda
metode PCR-RFLP ... 52
33 Grafik persentase sperma pada bangsa sapi yang berbeda gen GH 53
xxiii
DAFTAR LAMPIRAN
Halaman
1 Sekuens DNA gen FSH sub-unit beta ... 77
2 Sekuens gen FSH reseptor ... 80
3 Sekuens DNA Gen GH ... 83
4 Hasil analisa data gen FSH sub-unit beta PCR-RFLP ... 87
5 Hasil analisa data gen FSH sub-unit beta PCR-SSCP ... 88
6 Hasil analisa data gen FSH reseptor PCR-RFLP ... 89
7 Hasil analisa data gen GH PCR-RFLP ... 90
8 Foto abnormalitas sperma ... 91
PENDAHULUAN
Latar Belakang
Indonesia dikenal sebagai negara kaya akan keanekaragaman hayati dan salah satunya adalah kekayaan berbagai macam ternak, termasuk sapi. Beberapa bangsa sapi lokal yang dimiliki Indonesia antara adalah sapi Bali, sapi Madura, sapi Aceh, sapi Pesisir, dan sapi yang sudah beradaptasi di Indonesia yaitu sapi PO (Peranakan Ongole) dan Brahman. Kekayaan hayati berupa ternak lokal harus dijaga kelestariannya karena merupakan pilar utama ketahanan pangan masyarakat Indonesia, juga merupakan kekayaan sumber daya genetik yang sangat spesifik. Salah satu sapi lokal yang sampai saat ini dijaga kemurniannya dan telah teridentifikasi dengan baik adalah Sapi Bali dan Madura. Food Agricultural Organization (FAO) salah satu badan Perserikatan Bangsa-bangsa mendirikan Global Strategy for the Management of Farm Animal Genetic Resources untuk membantu pengaturan dan pemanfaatan serta konservasi keanekaragaman genetik ternak lokal di negara-negara anggotanya (Wolliams et al. 2008; GTZ 2001).
Pada beberapa dekade terakhir ini telah terjadi kecenderungan menurunnya populasi ternak lokal di Indonesia termasuk sapi Bali. Secara pasti faktor penyebabnya belum diketahui, namun dari beberapa hasil penelitian menyebutkan penurunan populasi ternak lokal disebabkan antara lain akibat perubahan lingkungan berupa pergeseran fungsi lahan pertanian menjadi
pemukiman sehingga ruang untuk memelihara sapi semakin sempit, penurunan tingkat reproduktivitas, tingkat pemotongan ternak yang tinggi akibat meningkatnya permintaan daging dan kualitas genetik ternak lokal semakin menurun.
Upaya yang harus dilakukan untuk mengantisipasi hal tersebut adalah meningkatan produktivitas dan kapasitas reproduksi sapi lokal yang ada di
Indonesia melalui perbaikan mutu genetik (Sudjana 2009). Perbaikan mutu genetik diupayakan melalui seleksi terhadap sifat produksi. Namun, seleksi memerlukan waktu yang lama dan biaya tinggi serta recording sapi di tingkat peternak hampir tidak ada, sehingga pemanfaatan teknologi biologi molekuler untuk menemukan penanda seleksi diharapkan dapat membantu.
Percepatan peningkatan populasi sapi di Indonesia juga dilakukan melalui teknologi inseminasi buatan (IB). Teknologi ini dimulai di Indonesia pada awal era tahun 68, namun keberhasilannya tidak menyeluruh dan hanya pada bangsa sapi tertentu. Keberhasilan teknologi IB dipengaruhi oleh berbagai faktor, diantaranya faktor sumber daya manusia (peternak dan inseminator), faktor betina (umur produktif dan bersiklus normal) dan kualitas semen yang diinseminasikan. Saat ini IB dilakukan dengan menggunakan semen beku, sehingga manajemen container sangat penting karena berhubungan dengan daya tahan hidup spermatozoa. Fertilitas spermatozoa dari semen beku dipengaruhi oleh persentase motilitas spermatozoa, konsentrasi (jumlah sel per straw) dan morfologi (normalitas dan abnormalitas) spermatozoanya (Barth & Oko 1989; Toelihere 1993; Rath et al. 2008). Morfologi spermatozoa yang abnormal terbagi ke dalam abnormalitas primer (terjadi pada bagian kepala) dan abnormalitas sekunder (terjadi pada bagian ekor). Abnormalitas pada kepala sebagian disebabkan oleh
faktor genetik (Chenoweth 2005).
gerakan massa dan kualitas akrosom (Al-Makhzoomi et al. 2008; Fitzpatrick et al. 2002; Hoflack et al. 2006).
Kemajuan teknologi DNA memberikan peluang pemanfaatan gen menjadi penanda seleksi atau penciri genetik (genetic marker) pada sifat-sifat tertentu terutama yang bernilai ekonomi (Beuzen et al. 2000). Penggunaan penciri demikian dalam program perbaikan genetik terutama untuk seleksi disebut marker assisted selection (MAS). Lechniak et al. (1999); Dai et al. (2009); Gorbani et al. (2009a); Afshar et al. (2011) dan Chenoweth (2011) mengembangkan penanda molekuler untuk kualitas sperma pada program IB.
Penelitian mengenai penanda molekuler untuk fertilitas sapi jantan unggul untuk produksi dan kualitas sperma di Indonesia belum dilakukan. Menegassi et al. (2011) menyatakan bahwa pengujian pejantan secara rutin dengan metode BSE berdampak ekonomi secara nyata pada program IB. Hal ini sangat penting dilakukan untuk membantu proses seleksi, sehingga pejantan yang terpilih sebagai sumber semen dalam produksi semen beku di Balai Inseminasi Buatan (BIB) maupun Unit Pelaksana Teknis Daerah (UPTD) IB di seluruh wilayah Indonesia merupakan pejantan unggul yang mempunyai potensi genetik yang dapat dipertanggungjawabkan.
Peraturan pemerintah melalui Direktorat Jendral Peternakan (2007) tentang petunjuk teknis pengawasan dan sertifikasi pejantan dilakukan dengan
progeny test, yaitu penilaian performans pejantan berdasarkan penampilan
tetuanya. Namun cara ini hanya memberikan informasi secara fenotip termasuk fertilitas, yaitu pemeriksaan dan pengujian sperma sebagai seleksi, yang membutuhkan biaya besar dan waktu lama. Penampilan sapi unggul secara fenotip tidak menjamin jantan tersebut unggul dalam hal reproduksi, sehingga penggunaan penanda molekuler sebagai kriteria seleksi terhadap fertilitas sperma diharapkan dapat meningkatkan akurasi dan mempersingkat waktu seleksi. Secara umum sifat-sifat reproduksi termasuk produksi dan fertilitas sperma pada sapi heritabilitasnya adalah 0.14 dan proses seleksinya sangat lama (Chandler & Adkinson 1990; Cammack et al. 2009).
penciri genetik berupa kandidat gen yang mengontrol sifat reproduksi sangat dibutuhkan.
Tujuan Penelitian
1. Mendeteksi keragaman gen FSH sub-unit beta, gen FSH reseptor dan hormon pertumbuhan (GH) pada sapi Bali sebagai penanda kualitas sperma.
2. Membuat model seleksi sapi Bali jantan untuk pejantan unggul dengan menggunakan teknologi biomolekuler.
Manfaat Penelitian
Hasil penelitian ini diharapkan menjadi acuan dasar untuk membantu proses seleksi sapi jantan yang akan digunakan BIB dan UPTD-IB sebagai sumber penghasil semen yang akan diproduksi menjadi semen beku dan didistribusikan ke peternak dalam upaya peningkatan populasi ternak sapi.
Kerangka Pemikiran Penelitian
Undang undang No 22 tahun 2000 mengenai otonomi daerah dan kebijakan pemerintah mengenai swasembada daging sapi 2014 (Ditjennak 2010b) yang telah dicanangkan memberikan peluang kepada Pemerintah Provinsi untuk membangun BIB di daerah. Peluang tersebut juga dapat dimanfaatkan untuk pengembangan sapi lokal melalui seleksi sapi jantan untuk dijadikan pejantan (bull). Pejantan yang akan ditempatkan di BIB masuk kategori jantan elite dari populasi dan telah melalui serangkaian pengujian seperti progeny test, BSE dan
akan dikembangkan akibat perbedaan kondisi lingkungan, pakan dan karakteristik reproduksi.
TINJAUAN PUSTAKA
Sapi Bali
Sapi Bali merupakan salah satu sapi asli Indonesia dengan populasi yang cukup besar. Populasi sapi Bali di Indonesia pernah dicatat dua kali yaitu pada tahun 1984 dan 1988, pencatatan jumlah sapi Bali setelah itu tidak pernah dilakukan lagi, sehingga jumlahnya saat ini tidak diketahui dengan pasti. Hasil
sensus tersebut mencatat sebanyak 2.632.125 ekor atau sekitar 26.9% (Martojo 2012) dari total sapi potong. Pada tahun 2010 total populasi sapi potong di Indonesia adalah 13.633.158 ekor (Ditjennak 2009), dari populasi tersebut 660.000 ekor sapi Bali yang terdiri atas 200.000 ekor betina induk produktif. Hal ini menunjukkan bahwa posisi sapi Bali dalam pemenuhan kebutuhan daging nasional sangat strategis, sehingga upaya peningkatan populasi dan peningkatan mutu genetik tetap harus diupayakan.
Pada berbagai lingkungan pemeliharaan di Indonesia, sapi Bali memperlihatkan kemampuan untuk berkembang biak dengan baik. Keunggulan sapi Bali dibandingkan dengan sapi lain adalah memiliki daya adaptasi sangat baik terhadap lingkungan yang kurang baik (Masudana 1990), dapat memanfaatkan pakan berkualitas rendah (Sastradipradja 1990), mempunyai fertilitas dan conception rate (CR) yang sangat baik (Oka & Darmadja 1996), persentase karkas yang tinggi yaitu antara 52 % sampai dengan 57.7%, memiliki daging berkualitas baik dengan kadar lemak rendah (kurang lebih 4%), serta tahan terhadap parasit internal maupun eksternal (Payne & Hodges 1997).
Sapi Bali (Bos javanicus) berasal dari hasil domestikasi banteng liar (Bibos banteng). Menurut Rollinson (1984) proses domestikasi sapi Bali terjadi sebelum 3.500 tahun SM di Indonesia atau Indochina. Banteng liar saat ini dapat
hutan Kalimantan Timur, Laos, Vietnam dan di semenanjung Coubourgh di Australia Utara (Scherf 1995).
Penyebaran sapi Bali di Indonesia dimulai pada tahun 1890 dengan adanya pengiriman ke Sulawesi, pengiriman dilanjutkan pada tahun 1920 dan 1927. Pada tahun 1927 sapi Bali dimasukkan ke Sulawesi Selatan (Rampi) sebanyak 5 ekor dan pada tahun 1940 jumlahnya telah mencapai 80 ekor. Pada tahun 1947 sapi Bali disebarkan ke provinsi ini secara besar besaran. Sapi-sapi inilah bersama dengan pendahulunya menjadi cikal bakal sapi Bali di Sulawesi Selatan yang telah berkembang menjadi provinsi dengan jumlah sapi Bali terbanyak di Indonesia. Pada tahun 1964 di Bali terjadi musibah penyakit jembrana secara besar-besaran yang menyebabkan sapi Bali tidak boleh dikeluarkan lagi dari pulau Bali sebagai ternak bibit. Mulai periode inilah sumber bibit sapi Bali bagi daerah lain di Indonesia digantikan oleh NTT, Sulawesi Selatan dan NTB (Talib 2002).
Pada Gambar 2, menunjukkan pola penyebaran sapi di dunia. Peta warna kuning menunjukkan wilayah utama penyebaran sapi Eropa (Bos taurus), warna
merah menunjukkan wilayah utama penyebaran sapi berpunuk (Bos indicus), warna orange menunjukkan wilayah utama penyebaran sapi persilangan (Bos taurus dan Bos indicus) dan warna hijau menunjukkan wilayah utama penyebaran sapi (Bos bibos) atau Banteng yang merupakan tetua sapi Bali (Payne & Rollinson 1973).
Penelitian mengenai sapi Bali telah banyak dilakukan diantaranya adalah potensi dan keragaman genetik sapi Bali (Noor et al. 2001; Sukmasari et al. 2002; Handiwirawan & Soebandrio 2004). Sapi Bali merupakan tipe sapi yang kecil namun peluang pengembangannya sangat potensial karena dapat dipelihara pada padang penggembalaan ekstensif dengan kualitas rumput rendah, tetapi kemampuan reproduksi dan adaptasi yang tinggi (Talib 2002). Rataan bobot lahir sapi Bali secara umum 18.4 ± 1.6 kg, namun ada variasi kisaran bobot jantan dan betina yaitu pada jantan 10.5 sampai 22 kg rataan 18.9 ± 1.4 sementara betina bobot lahir 13 sampai 26 kg rataan 17.9 ± 1.6 dengan lama kebuntingan 284.4 ± 5.7 (Prasojo et al. 2010). Bobot sapih 60 - 70 kg, bobot badan jantan dewasa adalah 300 - 384 kg tinggi pundak 128 cm dengan lingkar dada 188 cm, sapi Bali betina mempunyai berat 300 kg, tinggi pundak 110 cm, serta lingkar dada 163 cm (Talib et al. 2002).
Dibidang genetika molekuler, Handiwirawan et al. (2003), meneliti
keragaman mikrosatelit sebagai penciri khas sapi Bali. Mohamad et al. (2009) menyimpulkan bahwa berdasarkan analisis sequens mtDNA, kromosom Y, ditemukan bahwa sapi Bali mempunyai posisi yang spesifik dari sapi Indonesia lainnya Gambar 3.
Spermatogenesis
Spermatogenesis atau pembentukan sel spermatozoa merupakan fungsi
utama dari testis, yang merupakan rangkaian dari diferensiasi sel yang dibedakan menjadi tiga fase utama yaitu: regenerasi dan proliferasi spermatogonia, meiosis, dan spermiogenesis. Proses ini melibatkan pembelahan sel, diferensiasi, dan interaksi antar sel di dalam tubulus seminiferus. Krawetz et al. (2009) menyatakan bahwa spermatogenesis adalah suatu rangkaian proses yang panjang dari stem cell spermatogonia (SSCs) di lapisan dasar tubulus seminiferus. Prosesnya terbagi menjadi mitosis yaitu fase pertumbuhan dari sel germinatif untuk memproduksi spermatosit primer. Selanjutnya proses ini berlanjut menjadi meosis untuk memproduksi spermatid haploid, selanjutnya metamorfosis spermatozoa dilepaskan dalam proses spermiasi dan ke dalam lumen tubulus seminiferus.
Bedasarkan sudut pandang genetik, spermatogenesis dapat dibedakan menjadi dua bagian, yaitu fase diploid dan fase haploid. Selama fase diploid terjadi dua kali pembelahan meiosis menghasilkan spermatid yang haploid. Selama fase haploid terjadi proses yang disebut spermiogenesis, perubahan morfologi dan karakteristik fungsi spermatozoa (Clermont et al. 1993).
Gambar 4 Tahapan perubahan sel pada spermatogenesis (Hess & Franca 2008)
satu tipe sel somatis yang ditemukan yaitu sel sertoli, namun setelah ditemukan tahapan seluler oleh Leblond dan Clermon dinyatakan bahwa ditemukan
perbedaan tipe sel germinatif (Hess & Franca 2008). Perbedaan tipe sel germinatif tersebut menyebabkan para peneliti membagi tahapan proses spermatogenesis menjadi permulaan (early), pertengahan (midle) dan akhir (late) (Gambar 4).
Morfologi Spermatozoa
Morfologi spermatozoa adalah indikator refleksi normalitas dari tubulus seminiferus dan beberapa bagian dari epididymis (Holroyd et al. 2002). Morfologi spermatozoa sangat berperan pada fertilitas dan kualitas spermatozoa. Di Indonesia morfologi spermatozoa merupakan parameter pengujian semen yang jarang dilakukan, padahal di negara-negara Eropa dan Amerika sudah menjadi faktor penentu, sebelum pengenceran untuk pembuatan semen beku (Arifiantini et al. 2006)a. Morfologi spermatozoa adalah sesuatu yang unik dan terdiri atas tiga bagian yang dapat diketahui yaitu kepala (head), bagian tengah (mid piece), dan ekor (tail), dengan pewarnaan (Sun et al. 2006). Beberapa peneliti telah
mengevaluasi morfologi spermatozoa menggunakan teknik pewarnaan
diantaranya adalah pewarna eosin-negrosin (Barth & Oko 1989) dan pewarnaan
carbofluchsin (Al-Makhzoomi et al. 2008) serta menggunakan teknologi yang sangat maju sehingga morfologi dan abnormalitasnya dapat diketahui (Morrell et al. 2008). Berdasarkan pewarnaan tersebut abnormalitas dibagi pada bagian
kepala meliputi pearshaped (pyriform), narrow at the base (tapered), abnormal countour, undeveloped, narrow heads, variable size (macrocephalus,
microcephalus), double head, serta abnormalitas bagian ekor meliputi abaxial, coiled tails (simple bent, under the head, double folded) dan abnormal midpiece
(Barth & Oko 1989).
Morfometri Spermatozoa
Morfometri merupakan ukuran dari spermatozoa yang masih jarang
dilaporkan. Pengkajian terhadap morfometri spermatozoa perlu dilakukan untuk mengetahui karakteristik ukuran-ukuran spermatozoa pada berbagai hewan. Selain itu pengetahuan terhadap morfometri spermatozoa diperlukan untuk pengkajian pengaruh kriopreservasi semen mengingat terdapat perbedaan yang signifikan terhadap ukuran spermatozoa semen segar dengan semen yang telah mengalami kriopreservasi (Arruda et al. 2002).
Mekanisme FSHsub-unit beta padaSpermatogenesis
Regulasi hormonal spermatogenesis terjadi melalui kontrol closedloop feed back melibatkan hipotalamus, lobus anterior dari kelenjar hipofisa dan testis. Hipotalamus memproduksi gonadotrophin realeasing hormone (GnRH) yang akan menginduksi sekresi (FSH) follicle stimulating hormone dan luteinizing hormone (LH) dari kelenjar hipofisa. Luteinizing hormone berikatan dengan reseptor yang berlokasi di sel Leydig dan menstimulasi produksi testosteron. Sedangkan, FSH berikatan dengan reseptor yang berlokasi di sel-sel Sertoli dan menstimulasi produksi androgen-binding protein (ABP). Testosteron berikatan ke ABP dan selanjutnya mampu melewati ikatan kompleks sertoli, kemudian sel- sel sertoli akan mensekresikan inhibin dan aktivin yang berperan masing-masing secara negatif dan positif feedback pada kedua produksi GnRH oleh hipotalamus dan sekresi LH/FSH oleh kelenjar hipofisa (O’Donnel et al. 2006).
Gen FSH sub-unit beta
Follicle stimulating hormone (FSH) adalah hormon glikoprotein yang disekresi oleh kelenjar hipofisa dan berfungsi mengontrol aktivitas reproduksi pada mamalia (Ulloa-Aguirre et al.1995; Grigorova et al. 2007). Pada jantan FSH dan testosteron merupakan hormon yang penting untuk mengatur fungsi sel-sel sertoli yaitu dibutuhkan untuk inisiasi, proliferasi, perkembangan sel sperma baik secara kuantitas maupun kualitas pada proses spermatogenesis (Heckert & Griswold 2002).
memproduksi steroid terutama testosteron (T) dan untuk aromatase estradiol (E2). Pada saat itu pula T dan E2 mempunyai pengaruh pada spermatogenesis, dan
steroid mempunyai pengaruh negatif pada hypothalamus untuk mengontrol sekresi GnRH yang berpengaruh ke pituitary untuk membatasi sekresi LH dan FSH. FSH menstimulasi sel sel Sertoli untuk inisiasi spermatozon. Epitelium seminiferus memproduksi inhibin B untuk menekan produksi FSH.
Gambar 5 Mekanisme FSH pada Spermatogenesis (O’Donnel et al. 2006)
Kumar et al. (1997) melaporkan pada tikus, terjadi penurunan 75 % jumlah spermatozoa dan 40%motilitas sebagai akibat tidak disekresinya FSH, hal ini merupakan bukti bahwa FSH sangat penting dalam spermatogenesis. Lin et al.
(2006) melaporkan bahwa pada babi jantan, FSH bereaksi di sel kecambah dalam testis (tubulus seminiferus) bertanggungjawab pada spermatogenesis khususnya mendorong pertumbuhan spermatosit sekunder, kemudian androgen dan testosteron dari testis akan mensupport spermatogenesis sampai pada proses akhir. Hafez dan Hafez (2000), Maekawa et al. (1995), Zanella et al. (1999) dan Li et al. (2000) menyatakan hormon FSH juga mengatur fungsi dan bentuk testis serta tingkah laku seksual pada babi jantan.
seperti Amerika (sapi pedaging) dan Eropa (sapi perah) hampir 80% menggunakan teknologi ini. Status pejantan yang digunakan telah melalui uji
yang panjang (progeny test) akan tetapi memerlukan waktu yang lama sehingga penggunaan penanda molekuler genetik untuk fertilitas jantan termasuk pemeriksaan gen yang terekspresi pada spermatogenesisdan gen yang terekspresi pada spermatozoa dapat meningkatkan akurasi hasil uji pejantan (Peddinti et al.
2008).
Gen FSH sub-unit beta telah dieksplorasi selama 30 tahun terakhir dan diketahui bahwa FSH terletak pada kromosom 15 mempunyai 2 heterodimer yaitu alfa (FSH- ) dan beta (FSH- ) disebut juga FSHB (Gambar 6). Konservasi gen ini sangat tinggi, terdiri dari 3 exon (1 non coding exon dan 2 exon translated) dan 2 intron. Sequens originalnya 1547 bp dan sequens lengkapnya pada sapi Bos taurus 6601 bp : GenBank No:M83753 (Gambar 7). Pada manusia ditemukan 5 SNP (Single nucleotide polymorphism) yang berhubungan dengan reproduksi sedang pada sapi Bos taurus ditemukan 13 SNP yang berhubungan dengan fertilitas jantan (Grigorova et al. 2007; Dai et al. 2009; Lamminen et al. 2005)
Gambar 6 Gen FSH sub-unit beta pada kromosom 15 (Hediger et al. 1991)
Keterangan :
Exon 1 = 1878-1940 = 62 bp Intron 1 = 1941-2572 = 631 bp Exon 2 = 2573-2737 = 164 bp Intron 2 = 2738-4305 = 1567 bp Exon 3 = 4036-5828 = 1792 bp
Keterangan : Subtitusi asam amino digambar pada huruf kapital yang digaris bawahi, 4453 A C to Ser 103 Arg
Gambar 8 Situs mutasi pada gen FSH sub-unit beta pada sapi (Dai et al. 2009)
Dai et al. (2009) melakukan penelitian mengenai keragaman gen FSH sub-unit beta terhadap fertilitas sapi jantan, hasil penelitian tersebut menemukan alel A, B, dan C (Gambar 8), dari hasil penelitian tersebut dilaporkan bahwa runutan nukleotida pada ekson 3 yang diindikasikan terdapat keragaman. Dijelaskan pula bahwa keragaman gen FSH sub-unit beta pada sapi jantan (Limousin, Hereford, dan FH) berpengaruh pada volume, kualitas dan motilitas semen cair maupun semen beku. Pada gen ini terjadi mutasi pada ujung intron 2 dan ekson 3 yaitu pada 313 bp. Situs pemotongan enzim 5'... C T G C A G ... 3' menggunakan enzim restriksi Pstl (ctacag). Penelitian tersebut menggunakan SNP pada gen FSH sub-unit beta sebagai marker fertilitas sapi jantan
Liu et al. (2009) melaporkan bahwa gen FSH sub-unit beta terdiri dari tiga exon seperti yang terdapat pada babi, sapi dan manusia, selanjutnya Shi et al.
(2006) dan Yaofeng et al. (1998) melaporkan bahwa pada babi litter size sangat dipengaruhi oleh polimorfisme gen ini pada ekson 1, dan pada sapi Dai et al.(2009) melaporkan bahwa polimorfisme gen ini signifkan terhadap fertilitas, kualitas semen (Charolais, Simmental dan Limousin) pada ekson 2 dan 3.
Gen FSH Reseptor
reseptor spesifik yang disebut FSH reseptor (Simoni et al. 1997), FSH dikontrol oleh gen FSH reseptor yang terletak di kromosom 11. Houde et al. (1994)
melaporkan bahwa pada sapi Bos taurus gen FSH reseptor terdiri dari 10 ekson dan 11 intron (Gambar 9), dimana pada ekson 1 - 9 melampirkan ekstraselular domain dan ekson 10 melampirkan domain transmembran atau intraseluler. Polimorfisme gen FSH reseptor pada sapi telah dibuktikan oleh Rahal et al. (2000), Marson et al, (2008), dan Cruz et al. (2009). Perubahan struktur molekul gen FSH reseptor menyebabkan peningkatan sensitivitas FSH reseptor pada membran sel dan efisiensi transmisi signal pada mekanisme kerja hormon.
Tombasco et al. (2000), Vasconcellos et al. (2003) dan Allan et al. (2007) melaporkan bahwa terdapat keragaman gen FSH reseptor pada sapi Nelore yang berhubungan dengan produktivitas dan reproduktifitas. Selanjutnya Rahal et al. (2000) menemukan dua situs mutasi gen FSH reseptor pada sapi yang berhubungan pada sifat reproduksi. FSH reseptor hanya terekspresi pada sel-sel granulosa di ovarium dan sel-sel sertoli di testis, level FSH reseptor pada sel-sel sertoli sangat penting untuk merespon hormon FSH ditestis (Leslie et al. 1998), Grover et al. (2005) menyatakan bahwa FSH receptor dibutuhkan pada trans membran sel-sel sertoli di dalam testis untuk perkembangan proses spermatogenesis. FSH reseptor mengontrol mekanisme FSH dan testosteron. Hal ini telah dibuktikan oleh (Leslie & Griswold 2002) yang meneliti kultur sel-sel sertoli pada tikus percobaan umur 10 – 30 hari. Pada penelitian tersebut terlihat
adanya peningkatan respon hormon FSH akibat meningkatnya cAMP, diikuti peningkatan sintesa protein dan produksi estradiol.
Domain ekstraseluler FSH reseptor terdiri atas 349 asam amino dan domain transmembran terdiri atas 264 asam amino (Meduri et al. 2008).
Selanjutnya Houde et al. (1994) melaporkan bahwa domain ekstraseluler FSH reseptor memiliki gugus karboksil yang relatif pendek terdiri atas 65 asam amino. Homologi antara beberapa spesies mencapai 90 persen pada domain transmembran, sedang pada domain ekstraseluler tingkat homolog antar spesies adalah 85 persen.
Gambar 9 Gen FSH Reseptor (Leslie & Griswold, 2002)
Struktur domain ekstraseluler FSH reseptor mempunyai sekuens asam amino leusine yang banyak LRR (leucine rich repeat) pada protein yang terlibat dalam perlekatan sel yang spesifik dan fenomena ini hampir ditemukan pada semua mamalia. Pola LRR sangat conserve pada ekson 2 – 8, hal sebaliknya terjadi di ekson 9. Ekson 1 dan terminal C dari domain ekstraseluler FSH reseptor tidak memiliki pola LRR. Eksperimen binding menunjukkan bahwa FSH secara spesifik terikat pada reseptor yang terletak pada membran sel-sel sertoli (Simoni
et al. 2002). Hasil hibridisasi in situ juga membuktikan bahwa hanya sel-sel sertoli yang mengekspresikan FSH reseptor pada testis. Hasil yang sama juga ditemukan pada penelitian yang menggunakan 38 jenis jaringan yang berbeda pada monyet. Hal ini menunjukkan FSH reseptor bersifat gonad dan spesifik
terhadap sel (Simoni et al. 1997; Leslie et al. 2002) = Ekson = Intron
1 2 3 4
Domain ekstraseluler Domain intraseluler / transmembran
5 6 7 8 9 10
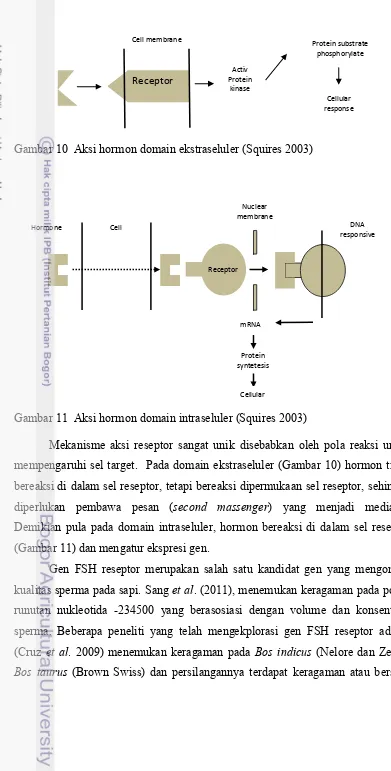
Gambar 10 Aksi hormon domain ekstraseluler (Squires 2003)
Gambar 11 Aksi hormon domain intraseluler (Squires 2003)
Mekanisme aksi reseptor sangat unik disebabkan oleh pola reaksi untuk
mempengaruhi sel target. Pada domain ekstraseluler (Gambar 10) hormon tidak bereaksi di dalam sel reseptor, tetapi bereaksi dipermukaan sel reseptor, sehingga diperlukan pembawa pesan (second massenger) yang menjadi mediator. Demikian pula pada domain intraseluler, hormon bereaksi di dalam sel reseptor (Gambar 11) dan mengatur ekspresi gen.
Gen FSH reseptor merupakan salah satu kandidat gen yang mengontrol kualitas sperma pada sapi. Sang et al. (2011), menemukan keragaman pada posisi runutan nukleotida -234500 yang berasosiasi dengan volume dan konsentrasi sperma. Beberapa peneliti yang telah mengekplorasi gen FSH reseptor adalah (Cruz et al. 2009) menemukan keragaman pada Bos indicus (Nelore dan Zebu),
Bos taurus (Brown Swiss) dan persilangannya terdapat keragaman atau bersifat
polimorfik. Selanjutnya Rahal et al. (2000) menemukan keragaman pada sapi Nelore menggunakan metode PCR-SSCP. Keragaman gen FSH reseptor juga
ditemukan pada babi yang berhubungan dengan jumlah anak sekelahiran (Wang et al. 2006) dan berat lahir (Chansomboon et al. 2009). Motilitas, jumlah dan morfologi sperma pada tikus (Grover et al. 2005) dan jarak beranak pada kerbau (Ahmed et al. 2011).
Gen Hormon Pertumbuhan (Growth Hormone gene)
Growth hormone (GH) atau gen hormon pertumbuhan telah dieksplorasi
pertama kali oleh Evan’s sejak tahun 1921, dan pada tahun 1944 diekstraksi dari
hipofisa anterior sapi (bovine pituitary). Pada penelitian tersebut GH digunakan untuk merangsang pertumbuhan dan kematangan gonad pada hewan percobaan. Penelitian mengenai GH semakin maju dan penamaannya berdasarkan pada obyek yang diteliti seperti human growth hormone, bovine growth hormone
(Burton et al. 1994, Chowen & Frago, 2005). Selanjutnya Reis et al. (2001) melaporkan bahwa hormon pertumbuhan adalah hormon peptida (protein) /cytokine peptides yang dihasilkan oleh sel hipofisa acidophilic yang terletak di kelenjar hipofisa anterior. Pada sapi, hormon pertumbuhan berukuran 22 kilo Dalton (kDA) disusun oleh 190 – 191 asam amino sebagai produk dari gen pertumbuhan pada sapi (Dybus 2002; Tatsuda et al. 2007), terletak pada kromosom 19 memiliki panjang sekuens 2856 bp dengan bagian open reading frame-nya 1800 bp. Gen ini terdiri dari 5 ekson dan 4 intron (Gambar 12)
(Gordon et al. 1983; Zakizadeh et al. 2006) dengan panjang sekuens nukleotida yang berbeda pada setiap ekson dan intronnya. Secara umum, gen mempunyai bagian yang mengkode asam amino dan menghasilkan protein disebut daerah penyandi coding sequens(CDS) dan daerah pengapit (5’UTR, 3’UTR).
Keterangan :
Gen hormon pertumbuhan merupakan gen yang masuk kategori kandidat
gen untuk seleksi atau Marker Assited Selection (MAS) (Burton et al. 1994). Lucy et al. (1993) dan Curi et al. (2006) menggunakan metode PCR-RFLP dengan enzim AluI pada ekson lima menemukan keragaman yaitu terjadi mutasi runutan pada nukleotida dari sitosin (C) menjadi guanin (G) pada posisi 127 bp menyebabkan perubahan sintesis asam amino leusin menjadi valin. Keragaman gen GH juga telah diteliti oleh (Zakisadeh et al. 2006; Yardibi et al. 2009; Mohammadabadi et al. 2010) ketiganya menyimpulkan bahwa terdapat hubungan keragaman gen GH terhadap komposisi dan kualitas susu, Bartke (2000) menemukan keragaman yang berasosiasi dengan konsumsi pakan, pertumbuhan / kondisi tubuh. Thomas et al. (2007) menemukan keragaman gen GH berasosiasi dengan pertumbuhan dan kualitas karkas pada sapi. Gen GH juga telah diteliti oleh Jakaria et al. (2005) pada sapi lokal Indonesia yaitu sapi Pesisir, pada penelitian tersebut ditemukan keragaman gen GH menggunakan PCR-RFLP di intron 3 dan ekson 4 dengan enzim MspI. Gen GH telah digunakan secara luas Charolais, Piemontese, Hereford dan Angus. Gorbani et al. (2009a) dan Afshar et
al. (2011) meneliti keragaman gen GH pada sapi FH di Iran. Unanian et al. (2002), menyatakan terdapat keragaman gen GH terhadap lingkar scrotum dan
profil testoteron pada sapi Nelore umur 10 sampai 16 bulan. Sauerwein et al. (2000) melaporkan bahwa injeksi bGH pada sapi Simmental berpengaruh nyata terhadap peningkatan kualitas semen (volume, konsentrasi, dan motilitas). Lebih lanjut dilaporkan bahwa terjadi peningkatan fertilitas penggunaan sperma dari pejantan yang diinjeksi bGH yang diamati pada nilai Non Return Rate (NRR).
Mekanisme Gen Hormon Pertumbuhan pada Spermatogenesis
Gen hormon pertumbuhan juga berpengaruh pada sistem reproduksi sapi jantan (Bartke 2000; Hull & Harvey 2000; Holdcraft & Braun 2004). Sel Leydig dan sel Sertoli merupakan target dari ekspresi gen GH bekerjasama dengan gen IGF1 karena kedua sel tersebut mempunyai GH reseptor maupun IGF1 reseptor. Pada Gambar 13 dijelaskan bahwa pada sel-sel Leydig terekspresi IGF dan reseptornya distimulasi oleh GH. Sel-sel Sertoli dan sel kecambah pada jantan merupakan target potensial aksi GH secara langsung dan tidak langsung. Pada sel-sel Sertoli terdapat reseptor GH dan IGF-I dan produksi IGF-I (Lobie 1990). Pada tikus kecil ukuran testis akan tereduksi akibat kekurangan GH, hal ini menunjukkan bahwa pada spesies ini GH diperlukan untuk proliferasi sel Sertoli selama perkembangannya (Bartke 2000).
Penciri molekuler DNA restriction fragmen length polymorphism (RFLP)
Sejak ditemukannya struktur molekul DNA oleh Watson dan Crick pada
tahun 1953 maka berkembang pula teknologi pemanfaatan DNA sebagai penciri genetik (genetik marker) berdasarkan variasi dari runutan nukleotida penyusun DNA. Theophillus dan Rafley (2002); Bartlett dan Stirling (2004) dan Dale dan Schanzt (2002), menyatakan bahwa dengan berkembangnya teknologi perbanyakan DNA secara in vitro menggunakan mesin thermo cycler metode reaksi polimerase berantai atau polymerase chain reaction (PCR), maka PCR semakin berkembang sehingga lahir teknik PCR untuk menganalisis variasi runutan nukleotida pada suatu bagian/fragmen DNA. Pada tahun 1974 (Botstein et al. 1980) memperkenalkan teknologi penciri genetik Restriction Fragment Length Polymorphism (RFLP). Target utama dari penciri ini adalah variasi runutan nukleotida pada fragmen DNA yang didasarkan pada enzim pemotong yang mampu memotong runutan nukleotida DNA spesifik. Bagian DNA spesifik yang mampu dipotong oleh enzim tertentu mempunyai polimorfisme yang tinggi dan telah digunakan secara luas di bidang genetika molekuler terutama pada gen pengontrol sifat penting seperti sifat produksi yang bernilai ekonomi. Pada metode RFLP, terpotong atau tidaknya suatu bagian atau fragmen DNA oleh enzim dapat tervisualisasi melalui teknik elektroforesis.
Ge et al. (2003) menggunakan RFLP untuk melihat polimorfisme gen GH yang berhubungan dengan pertumbuhan pada sapi, selanjutnya Jakaria et al.
(2005); Jakaria et al. (2007); Zulkarnaim et al. 2010) menggunakan RFLP untuk meneliti polimorfisme gen GH dan GHR pada sapi lokal di Indonesia. Teknik ini juga digunakan untuk melihat polimorfisme gen untuk produksi susu sapi (Zhou
restriksi. Perbedaan performa dari hasil pemotongan diamati untuk menentukan keragamannya.
Penciri molekuler DNA Single- strand comformation polymorphism (SSCP)
Salah satu metode penciri DNA yang telah dikembangkan menjadi penciri genetik dalam genetika molekuler adalah PCR-SSCP (Hayasi 1992; Nallou & Wagener 1997; Hidayat & Pancoro 2010). Teknik SSCP merupakan rangkaian analisis lanjutan produk PCR. Prinsip utama dalam metode ini adalah panjang fragmen dan karakteristik sequens DNA mempunyai laju yang berbeda pada elektroforesis menggunakan poliakrilamida nondenaturasi (Fujita & Silver 1994; Barosso et al. 1999). Perbedaan tersebut dapat diamati pada pewarnaan perak (silver staining). Pada awalnya metode ini menggunakan radio aktif untuk menandai DNA target, namun dengan kemajuan teknologi penggunaan radio aktif dihentikan dengan alasan teknologi harus memperhatikan unsur ramah lingkungan (Hoffman 2012). Beberapa faktor yang menentukan keberhasilan penggunaan metode PCR-SSCP menurut Zhu et al. (2008) adalah : 1) hasil amplifikasi DNA atau produk PCR; 2) non denaturasi produk PCR; 3) kondisi gel (persentase akrilamida dan bis- akrilamida); 4) penggunaan gliserol; 5) suhu elektroforesis; 6) kondisi buffer; 7) proses pewarnaan (silver staining).
Pengembangan metode PCR-SSCP telah digunakan oleh Bonifacio et al. (2001), Bastos et al. (2001) dan Marques et al. (2003) melihat keragaman gen casein menggunakan metode PCR-SSCP untuk menganalisis keragaman gen GH
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan bulan Januari 2010 sampai Oktober 2011 yang dibagi dalam dua tahap pertama yaitu tahap pertama berupa pengambilan sampel darah dan sampel semen untuk ekstraksi DNA. Sampel berasal dari BIB / BIBD sebanyak 195 dan 301 sampel berasal dari populasi berasal dari Propinsi Bali, Sulawesi Selatan, Sulawesi Tenggara, Nusa Tenggara Timur dan Nusa Tenggara Barat. Penelitan tahap kedua dilakukan untuk analisis DNA di laboratorium genetika molekuler bagian pemuliaan Fakultas Peternakan IPB, dan analisis sperma di laboratorium Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan IPB.
Sampel Penelitian
Pada penelitian ini menggunakan beberapa bangsa sapi seperti yang disajikan pada Tabel 1.
Tabel 1 Jumlah dan asal sampel yang digunakan
No. Bangsa Sapi Jumlah Asal
selama 5 menit, kemudian sentrifus 6800 rpm selama 5 menit, supernatan dibuang. Ditambahkan DW 1000 µl, dikocok menggunakan vortex, didiamkan
selama 5 menit, disentrifus kembali 6800 rpm selama 5 menit, supernatan dibuang. Kemudian ditambahkan 200 µl 1 X STE, 20 µl proteinase-K dan 40 µl SDS 10 %. Campuran diinkubasi 55oC selama dua jam sambil dikocok pelan. Molekul DNA dimurnikan dengan metode fenol-kloroform, yaitu dengan menambahkan 40 µl 5 M NaCl dan 400 µl larutan fenol dan kloroform iso amil alkohol (CIAA) kemudian dikocok pada suhu ruang selama dua jam. Molekul DNA yang larut dalam fase air dipisahkan dari fase fenol dengan sentrifus 7000 rpm selama 5 menit, kemudian dipindahkan ke tabung baru dengan volume terukur dan ditambahkan 1/10 X vol DNA 5 M NaCl dan 2 X vol DNA ethanol absolut, molekul DNA diinkubasikan ±12 jam atau minimal 3 jam pada suhu – 20oC. Endapan yang dihasilkan dilakukan pencucian dengan menambahkan 400 µl ethanol 70 % kemudian disentrifus 12000 rpm selama 5 menit, sisa ethanol dibuang dan diendapkan dalam ruang vakum. Endapan DNA disuspensikan dalam 180 µl buffer TE 80 %. Setelah DNA hasil isolasi dimurnikan dan diketahui konsentrasinya, maka dipreparasikan untuk cetakan (template) pada reaksi PCR
Polymerase Chain Reaction
DNA genom sapi digunakan sebagai cetakan (template) dalam reaksi amplifikasi DNA (reaksi PCR), primer sekuens nukleotida gen FSH sub-unit beta
(Forward dan Reverse). Primer yang digunakan untuk FSH sub-unit beta sebagai
gen pengontrol produksi / kualitas sperma, merupakan primer yang dirancang dan telah diaplikasikan pada bangsa sapi Bos Indicus dan Bos Taurus (Dai et al.
2009). Total volume reaksi PCR 25 l : campuran larutan yang terdiri dari DNA
Taq Polimerase dan 10X buffer Taq Polimerase (100 mM tris-Cl, pH 8,3; 500mM KCL; 15mM MgCl2; 0,01 % gelatin); dNTP’S mix (dGTO, dATP, dTTP dan dCTV) (Pharmacia); dan dH2O steril. Sedangkan kondisi reaksi PCR dalam mesin thermocycler dirancang dengan suhu pra-denaturasi 94oC, denaturasi 94oC, annealing 55-64oC, perpanjangan 72oC dan pasca PCR 4oC. Untuk perbanyakan, siklus diulang sebanyak 35 kali.
Tabel 2 Sekuens primer yang digunakan
Primer Sequence An
FSH sub-unit beta 1 F : 5`CTTCCAGACTACTGTAACTCATC‘3 63 R : 5`GTAGGCAGTCAAAGCATCCG‘3
FSH reseptor 2 F : 5`CTGCCTCCCTCAAGGTGCCCCTC‘3 60
R : 5`AGTTCTTGGTCAAATGTCTTAGGGGG‘3
GH 3 F : 5`CCCAGCGGCAAGAATGAGGC‘3 62
R : 5`TGAGGAACTGCAGGGGCCCA‘3
Ket : An = suhu annealing, 1(Dai et al. 2009), 2(Hernandez et al. 2009), 3(Gordon et al. 1983)
4201 agagcgagca gtattcaatc cctgtctcac tttgattaag ctaaacagaa acttccagac
4261 tactgtaact catctgtctc tctctctgtc tcctaaacca ctcaggactt ggtatacagg 4321 gacccagcaa ggcccaatat ccagaaaacg tgtaccttca aggagctggt ctacgagacg 4381 gtgaaagtgc ctggctgtgc tcaccatgca gactccctgt acacgtaccc agtagccact 4441 gaatgtcact gcagcaagtg cgacagcgac agcactgact gcaccgtgag aggcctgggg 4501 cccagctact gctccttcag ggaaatcaaa gaataaagag cagcggatgc tttgagctgc
4561 ctacccttat
Gambar 14 Fragmen gen FSH sub-unit beta didasarkan GenBank (Dai et al. 2009)
1 ctgcctccct caaggtgccc ctcatcactg tgtccaagtc aaagatcctc ctggtcctgt 61 tctaccccat caactcctgt gccaacccct tcctctatgc catcttcacc aagaacttcc 121 gcagggattt cttcattctg ctgagcaagt ttggctgcta tgaagtgcaa gcccagacct 181 ataggtcaga aacctcatcc actgcccaca actttcatcc aaggaatggc cactgccccc 241 cagctcccag ggttactaat ggttccaatt acacccttat ccccctaaga catttagcca
301 agaact
Gambar 15 Fragmen gen FSH reseptor didasarkan GenBank (Hernandez et al. 2009)
1441 cccacgggca agaatgaggc ccagcagaaa tcagtgagtg gcaacctcgg accgagga 1501 gcaggggacc tccttcatcc taagtaggct gccccagctc ccgcaccggc ctggggcggc 1561 cttctccccg aggtggcgga ggttgttgga tggcagtgga ggatgatggt gggcggtggt 1621 ggcaggaggt cctcgggcag aggccgacct tgcagggctg ccccagaccc gcggcaccca 1681 ccgaccaccc acctgccagc aggacttgga gctgcttcgc atctcactgc tcctcatcca 1741 gtcgtggctt gggcccctgc agttcctca
Gambar 16 Fragmen gen GH didasarkan GenBank (Gordon et al. 1983)
Penentuan Genotipe dengan Pendekatan PCR-RFLP
Produk PCR yang diperoleh sebanyak 5 l dicampur dengan 0,5 l enzim
Penentuan Genotipe dengan Pendekatan PCR-SSCP
Produk PCR yang diperoleh dianalisis dengan metode SSCP, kemudian
diidentifikasi konformasi DNA untai tunggal (single strand conformational), 12
l produk PCR dicampur dengan 12 l loading dye (98% formamide, 10 mM EDTA, 0.025% bromophenol blue, 0.025% xylene-cyanol). Denaturasi pada suhu 95oC selama 5 menit, sampel langsung didinginkan dengan es batu selama 3 menit dan diloading pada gel poliacryalmide 8%. Elektroforesis menggunakan Protean II xi cells (Bio-Rad) pada kondisi 200-300 V pada suhu 5oC selama 18 jam pada larutan buffer 0,5x TBE. Setelah elektroforesis, diwarnai dengan metode silver staining (Byun et al. 2009) dan Tegelstrom (1986).
Pembuatan Preparat Ulas Semen Segar
Semen segar yang dikoleksi di balai IB dilarutkan dengan NaCl fisiologis satu banding empat, lalu dibuat preparat ulas tipis pada gelas objek dan dikeringudarakan, disimpan pada boks preparat. Prerapat ulas difiksasi diatas api bunsen, selanjutnya dicuci dalam alkohol absolute selama 4 menit dan dikeringudarakan. Preparat dimasukkan kedalam larutan 0,5% chloramin selama 1-2 menit, untuk menghilangkan mukus dan ulasan terlihat jernih preparat dimasukkan berulang kali. Dicuci dalam distilled water, selanjutnya dalam alkohol 95% dan diwarnai dengan larutan carbofluchin selama 10 menit, kemudian dicuci pada air mengalir dan dikeringkan.
Analisis Sperma
Analisis Data
a. frekuensi alel: Frekuensi alel dihitung berdasarkan Nei (1987)
Keterangan :
xi = Frekuensi alel,
nii = Jumlah genotipe dari alel ke-i, nij = Jumlah alel ke-i terpaut alel ke-j (j≠i)
b. Frekuensi Heterozigositas Pengamatan
Keragaman genetik (genetic variability) dilakukan melalui estimasi frekuensi heterozigositas pengamatan (Ho), heterozigositas harapan (He) dan standar eror heterozigositas harapan (Weir 1996) :
Keterangan :
Ho = frekuensi heterozigositas pengamatan,
N1ij = jumlah individu heterozigositas pada lokus ke-1, N = jumlah individu yang dianalisis
c. Frekuensi Heterozigositas Harapan
Frekuensi heterozigositas harapan dihitung berdasarkan Nei (1987)
Keterangan :
Ho = frekuensi heterozigositas harapan
P1i = frekuensi alel ke-I pada lokus 1
n = jumlah alel pada lokus ke-1
Ragam heterosigositas harapan dihitung berdasarkan Nei (1987)
Keterangan :
Vsl (He) = ragam heterozigositas harapan
xi = frekuensi gen ke-1
Ragam (SE) heterosigositas harapan diperoleh dari =
e. Keseimbangan Hardy-Weinberg diuji dengan Chi-Kuadrat menurut
(Hartl & Clark 1997).
Keterangan :
² = uji Chi-kuadrat
obs = jumlah pengamatan genotipe ke-i
exp = jumlah harapan genotipe ke-i
f. Polymorphic Informative Content (PIC)
Tingkat polimorfisme suatu alel dihitung menggunakan pendekatan nilai
Polymorphic Informative Content (PIC) (Botstein et al 1980) :
Keterangan :
Pi = frekuensi alel ke-i
n = jumlah alel per penciri (marker)
Derajat bebas dihitung berdasarkanAllendorf dan Luikart (2007) : Jumlah genotipe –i
Jumlah alel –j
g. Sekuensing DNA
Sequensing fragmen gen FSH sub-unit beta, gen FSH reseptor dan gen GH dilakukan dengan purifikasi fragmen DNA. Sampel yang disequensing berdasarkan genotipe.
h. Abnormalitas sperma :
HASIL DAN PEMBAHASAN
A. Keragaman Gen FSH Sub-unit Beta Sapi Bali Metode PCR-RFLP
Amplifikasi Ruas Gen FSH sub-unit beta
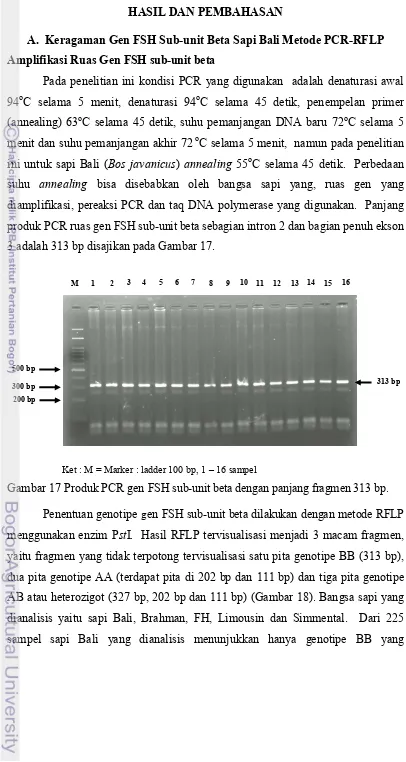
Pada penelitian ini kondisi PCR yang digunakan adalah denaturasi awal 94oC selama 5 menit, denaturasi 94oC selama 45 detik, penempelan primer (annealing) 63oC selama 45 detik, suhu pemanjangan DNA baru 72oC selama 5 menit dan suhu pemanjangan akhir 72 oC selama 5 menit, namun pada penelitian ini untuk sapi Bali (Bos javanicus) annealing 55oC selama 45 detik. Perbedaan suhu annealing bisa disebabkan oleh bangsa sapi yang, ruas gen yang diamplifikasi, pereaksi PCR dan taq DNA polymerase yang digunakan. Panjang produk PCR ruas gen FSH sub-unit beta sebagian intron 2 dan bagian penuh ekson 3 adalah 313 bp disajikan pada Gambar 17.
Ket : M = Marker : ladder 100 bp, 1 – 16 sampel
Gambar 17 Produk PCR gen FSH sub-unit beta dengan panjang fragmen 313 bp.
Penentuan genotipe gen FSH sub-unit beta dilakukan dengan metode RFLP menggunakan enzim PstI. Hasil RFLP tervisualisasi menjadi 3 macam fragmen, yaitu fragmen yang tidak terpotong tervisualisasi satu pita genotipe BB (313 bp), dua pita genotipe AA (terdapat pita di 202 bp dan 111 bp) dan tiga pita genotipe AB atau heterozigot (327 bp, 202 bp dan 111 bp) (Gambar 18). Bangsa sapi yang dianalisis yaitu sapi Bali, Brahman, FH, Limousin dan Simmental. Dari 225 sampel sapi Bali yang dianalisis menunjukkan hanya genotipe BB yang
313 bp 300 bp
500 bp
200 bp
ditemukan, berbeda pada sapi Brahman, FH, limosin dan Simmental ditemukan 3
Frekuensi Alel dan Genotipe Gen FSH sub-unit beta
Frekuensi alel A tertinggi berturut-turut pada sapi FH, Limousin, Simmental, Brahman. Amplifikasi fragmen gen FSH sub-unit beta pada ekson 3
(313 bp) pada sapi Bali tidak ditemukan adanya alel A, selanjutnya alel B tertinggi berturut-turut pada sapi Bali, Brahman, Simmental Limousin dan FH. Dari penelitian ini menunjukkan bahwa pada sapi Bali, gen FSH sub-unit beta bersifat monomorfik. Schlee et al. (1994) meneliti gen FSH sub-unit beta pada bagian ekson 3 menemukan kondisi yang sama yaitu monomorfik pada sapi Gelbvieh, kerbau Murrah dan sapi FH German. Hoffmann (2011) melaporkan bahwa pada ternak lokal dan populasi yang tertutup cenderung monomorfik seperti sapi Bali.
Dai et al. (2009) telah meneliti ruas gen FSH sub-unit betapada sapi jantan di berbagai pusat inseminasi buatan di Amerika menemukan variasi gen pada sebagian intron 2 dan bagian penuh ekson 3 yang diasosiasikan dengan kualitas sperma cair dan sperma beku, ditemukan 3 alel yaitu alel A, B dan C, 3 genotipe ditemukan AB, BB dan BC. Genotipe AA dan BB berasosiasi dengan kualitas sperma cair dan sperma beku lebih baik dibandingkan dengan genotipe BC. Pada
penelitian ini hanya ditemukan alel A dan B, dan genotipe AA, AB dan BB. Frekuensi alel dan genotipe gen FSH sub-unit beta disajikan pada Tabel 3.
Tabel 3 Frekuensi alel dan genotipe gen FSH sub-unit beta PCR-RFLP
Populasi
Nei (1987) melaporkan bahwa untuk mengetahui variasi genetik dapat dilihat dari nilai heterozigositas. Pada Tabel 4 pengamatan heterozigositas menunjukkan ketidakseimbangan Hardy-Weinberg pada sapi Brahman, FH dan Simmental. Hal ini berarti terjadi perubahan frekuensi gen di suatu populasi pada generasi ke generasi lainnya yang mungkin disebabkan oleh adanya seleksi, migrasi, mutasi dan genetic drift (Noor 2008).
Nilai heterozigositas pengamatan (Ho) tertinggi pada sapi Limousin (0,318) dan nilai heterozigositas harapan (He) tertinggi pada sapi Simmental (0.420). Nei dan Kumar (2000) mengatakan bahwa heterozigositas merupakan
Jika melihat historis dari Bos taurus, dalam proses domestikasinya sudah banyak mengalami seleksi maupun mutasi, demikian pula dengan Bos indicus walaupun
berasal dari iklim sub tropis juga telah banyak mengalami seleksi, terutama yang berada di Indonesia merupakan sapi yang bermigrasi dari India. Berbeda dengan
Bos javanicus mempunyai sifat adaptasi yang didapat dari seleksi alam di daerah tropis.
Tabel 4 Heterozigositas pengamatan dan harapan gen FSH sub-unit beta
Populasi Gen FSH sub-unit beta
Hasil analisis sekuens gen FSH sub-unit beta sebagian intron 2 dan bagian penuh ekson 3 sepanjang 313 bp disajikan pada Gambar 19. Sampel yang mewakili masing-masing genotipe disekuens untuk melihat perbedaan karakteristik runutan nukleotidanya. Berdasarkan hasil sekuens perbedaan genotipe disebabkan karena adanya mutasi di posisi basa ke 201 dan 202. Pada genotipe AA basa ke 201 dan 202 adalah CA, sedang pada genotipe BB basa ke 201 dan 202 adalah TG. Hasil sekuens nukleotida gen FSH sub-unit beta sesuai dengan Dai et al. (2009) bahwa pada bagian intron 2 dan bagian penuh ekson 3 (FSHB-3) terdapat beberapa mutasi atau multiple SNP yaitu pada posisi basa (4338T>C, 4341C>T, 4350G>A, 4452C>T, 4453A>C, 4461C>T, 4489A>C) (No.Akses GenBank : M83753). Terjadinya mutasi pada bagian tersebut berhubungan dengan kadar hormon FSH di dalam darah, kualitas semen cair dan semen beku. Keragaman gen FSH sub-unit beta bagian ekson 3 berpengaruh terhadap jumlah dan kualitas oosit pada kambing
keragaman yang berpengaruh terhadap liiter size pada kambing Boer dan kambing Saanen (Xiao-peng et al. 2010).
10 20 30 40 50 60 ....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
Homzigot AA CTTCCAGACT ACTGTAACTC ATCTGTCTCT CTCTCTGTCT CCTAAACCAC TCAGGACTTG Heterozigot AB ... ... ... ... ... ... Homozigot BB ... ... ... ... ... ...
70 80 90 100 110 120 ....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
Homzigot AA GTGTACAGGG ACCCAGCAAG GCCCAATATC CAGAAAACGT GTACCTTCAA GGAGCTGGTC Heterozigot AB ... ... ...C..T ...A. ... ... Homozigot BB ... ... ...C..T ...A. ... ...
130 140 150 160 170 180 ....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
Homzigot AA TACGAGACGG TGAAAGTGCC TGGCTGTGCT CACCATGCAG ACTCCCTGTA CACGTACCCA Heterozigot AB ... ... ... ... ... ... Homozigot BB ... ... ... ... ... ...
190 200 210 220 230 240 ....|....| ....|....| ....|....| ....|....| ....|....| ....|....|
Homzigot AA GTAGCCACTG AATGTCACTG CAGCAAGTGC GACAGCGACA GCACTGACTG CACCGTGAGA Heterozigot AB ... ... YR...T ... ... ...C.. Homozigot BB ... ... TG...T ... ... ...C..
250 260 270 280 290 300 ....|....| ....|....| ....|....| ....|....| ....|....| ....|....| Homzigot AA GGCCTGGGGC CCAGCTACTG CTCCTTCAGG GAAATCAAAG AATAAAGAGC AGCGGATGCT Heterozigot AB ... ... ... ... ... ... Homozigot BB ... ... ... ... ... ...
Gambar 19 Hasil sekuens gen FSH sub-unit beta (313 bp)
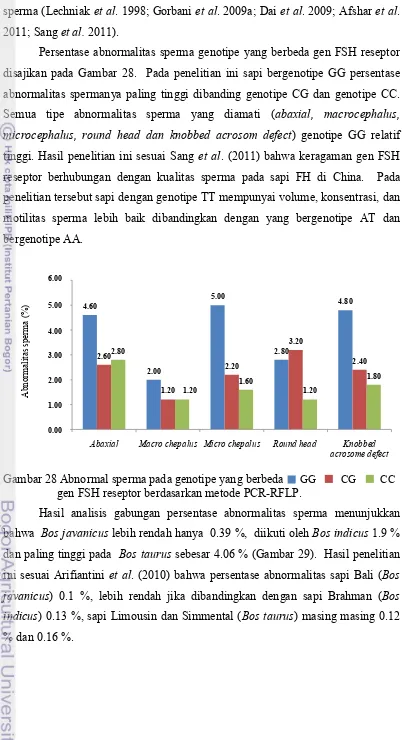
Tingkat Abnormalitas Sperma pada Genotipe yang Berbeda
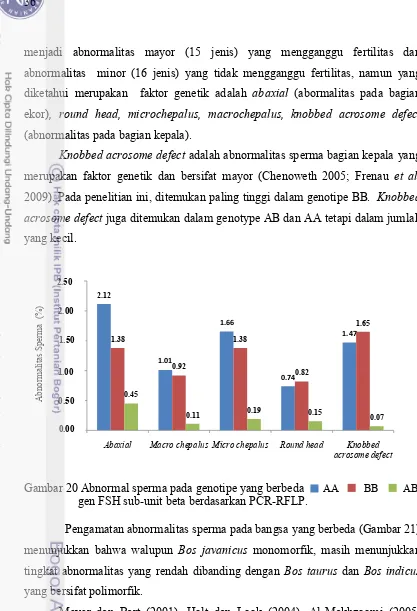
Pengamatan abnormalitas sperma pada genotipe FSH sub-unit beta yang berbeda menujukkan bahwa pada genotipe AA persentase tipe abaxial paling tinggi, kemudian, microchepalus, knobbed acrosome defect, macrochepalus dan
round head. Pada genotipe BB persentase paling tinggi pada tipe knobbed acrosome defect, paling rendah tipe round head, sedang pada genotipe AB persentase paling tinggi tipe abaxial dan paling rendah tipe knobbed acrosome defect. Namun secara keseluruhan persentasi abnormalitas sperma paling rendah genotipe AB dibanding dengan genotipe BB dan AA (Gambar 20).
menjadi abnormalitas mayor (15 jenis) yang mengganggu fertilitas dan abnormalitas minor (16 jenis) yang tidak mengganggu fertilitas, namun yang
diketahui merupakan faktor genetik adalah abaxial (abormalitas pada bagian ekor), round head, microchepalus, macrochepalus, knobbed acrosome defect
(abnormalitas pada bagian kepala).
Knobbed acrosome defect adalah abnormalitas sperma bagian kepala yang merupakan faktor genetik dan bersifat mayor (Chenoweth 2005; Frenau et al. 2009). Pada penelitian ini, ditemukan paling tinggi dalam genotipe BB. Knobbed acrosome defect juga ditemukan dalam genotype AB dan AA tetapi dalam jumlah yang kecil.
Gambar 20 Abnormal sperma pada genotipe yang berbeda gen FSH sub-unit beta berdasarkan PCR-RFLP.
Pengamatan abnormalitas sperma pada bangsa yang berbeda (Gambar 21) menunjukkan bahwa walupun Bos javanicus monomorfik, masih menunjukkan tingkat abnormalitas yang rendah dibanding dengan Bos taurus dan Bos indicus
yang bersifat polimorfik.
Meyer dan Bart (2001), Holt dan Look (2004), Al-Makhzoomi (2005) melaporkan bahwa abnormalitas sperma yang tinggi berakibat pada kegagalan fertilisasi. Selanjutnya Meyer dan Bart (2001), melaporkan bahwa abnormalitas spermatozoa bagian kepala menyebabkan rendahnya kemampuan sperma untuk menembus zona pellucida dan abnormalitas bagian ekor akan mengurangi
2.12
kemampuan melewati saluran reproduksi. Kegagalan fertilisasi, kematian embrio fase awal sebagai salah satu akibat dari tingginya persentase abnormalitas sperma
(Enciso et al. 2011).
Gambar 21 Abnormalitas sperma berdasarkan bangsa sapi yang berbeda gen FSH sub-unit beta.
B. Keragaman Gen FSH Sub-unit Beta Pada Sapi Bali Metode PCR-SSCP
Amplifikasi Ruas Gen FSH sub-unit beta
Panjang produk amplifikasi ruas gen FSH sub-unit beta sebagian intron 2 dan bagian penuh ekson 3 adalah 313 bp Gambar 22.
Ket : M = Marker : ladder 100 bp, 1 – 16 = sampel
Gambar 22. Produk PCR gen FSH sub-unit beta dengan panjang fragmen 313 bp.
300 bp
Bos javanicus Bos indicus Bos taurus
0.39
0.94
2.97