UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTI INFLAMASI EKSTRAK
ETANOL 70% BUAH PARIJOTO (
Medinilla speciosa
Blume) SECARA
IN VITRO
DENGAN METODE
STABILISASI MEMBRAN HRBC (
HUMAN RED
BLOOD CELL
)
SKRIPSI
ASKANDARI
1111102000089
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTI INFLAMASI EKSTRAK
ETANOL 70% BUAH PARIJOTO (
Medinilla speciosa
Blume) SECARA
IN VITRO
DENGAN METODE
STABILISASI MEMBRAN HRBC (
HUMAN RED
BLOOD CELL
)
SKRIPSI
Diajukan sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi
ASKANDARI
1111102000089
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
Nama : Askandari Program Studi : Farmasi
Judul : Uji Aktivitas Anti Inflamasi Ekstrak Etanol 70% Buah Parijoto (Medinilla speciosa Blume) secara In Vitro dengan Metode Stabilisasi Membran HRBC (Human Red Blood Cell)
Parijoto (Medinilla speciosa Blume) adalah tumbuhan liar yang sering tumbuh di lereng-lereng gunung atau di hutan-hutan dan kadang dibudidayakan sebagai tanaman hias. Parijoto merupakan tanaman tropis yang memiliki buah dengan warna merah muda keunguan. Buah parijoto secara tradisional digunakan sebagai anti inflamasi, anti kolestrol dan anti bakteri. Berdasarkan penelitian buah parijoto mengandung metabolit sekunder flavonoid, tanin, saponin, dan glikosida. Buah parijoto juga telah terbukti memiliki aktivitas sebagai anti oksidan dan anti bakteri. Tujuan dari penelitian ini adalah untuk mengetahui aktivitas anti inflamasi dari buah parijoto yang diekstraksi menggunakan etanol 70% dengan metode stabilisasi membran HRBC (Human Red Blood Cell/Sel Darah Merah Manusia). Kontrol positif yang digunakan adalah natrium diklofenak dengan konsentrasi 100 ppm yang merupakan NSAID. Hasil persentase stabilitas membran sel darah merah manusia ekstrak etanol 70% buah parijoto pada konsentrasi 50 ppm (10,63%), 100 ppm (18,32%), 500 ppm (33,08%), dan 1000 ppm (60,78%), serta kontrol positif yaitu natrium diklofenak (59,87%). Hal ini menunjukkan bahwa ekstrak dengan konsentrasi 1000 ppm memiliki aktivitas sebagai anti inflamasi karena memiliki persentase stabilitas membran sel darah merah identik dengan kontrol positif. Hasil tersebut didukung dengan hasil analisa statistik ANOVA yang menunjukkan bahwa ekstrak dengan konsentrasi 1000 ppm identik atau tidak berbeda secara bermakna dengan natrium diklofenak. Hal ini menunjukkan bahwa buah parijoto memiliki potensi sebagai anti inflamasi.
Name : Askandari Study Program : Pharmacy
Title : Anti-Inflammatory Activity Test of Ethanol 70% Extract Parijoto Fruit (Medinilla speciosa Blume) In Vitro using the Membrane Stabilization HRBC (Human Red Blood Cell) Method
Parijoto (Medinilla speciosa Blume) is a wild plant that often grows on mountain slopes or in forests and sometimes it is cultivated as an ornamental plant. Parijoto is a tropical plant that has a fruit with a purplish pink color. Parijoto fruit is traditionally used as an anti-inflammatory, anti-cholesterol and anti-bacterial agent. Based on research, parijoto fruit contains secondary metabolites such as flavonoids, tannins, saponins, and glycosides. Parijoto fruit has also been shown activity as an anti-oxidant and anti-bacterial agent. The purpose of this study was to determine the anti-inflammatory activity of parijoto fruit that has been extracted using 70% ethanol using the membrane stabilization HRBC (Human Red Blood Cell) method. Diclofenac sodium which is a NSAID has been used as a control positive with the 100 ppm consentration. The stability percentage result of a human red blood cell membrane using ethanol 70% extract of parijoto fruit at the 50 ppm consentration (10.63%), 100 ppm (18.32%), 500 ppm (33.08%), and 1000 ppm (60.78 %), and the positive control which was diclofenac sodium (59.87%). This showed that the extract with the 1000 ppm consentration has anti-inflammatory activity because the red blood cell membrane stability percentage was identical to the positive control. These results were supported by the ANOVA statistical analysis result that showed the extract with the 1000 ppm consentration was identical or do not differ significantly to diclofenac sodium. This indicates that the parijoto fruit has potential as an anti-inflammatory.
Segala puji dan syukur bagi Allah SWT atas segala rahmat dan karunia-Nya
sehingga saya dapat menyelesaikan penelitian dan penulisan skripsi ini. Shalawat
dan salam untuk baginda Nabi Muhammad SAW yang telah membawa petunjuk
bagi umat manusia. Skripsi dengan judul “Uji Aktivitas Anti Inflamasi Ekstrak
Etanol 70% Buah Parijoto secara In Vitro dengan Metode Stabilisasi Membran
HRBC (Human Red Blood Cell)” ini disusun untuk memenuhi salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
Saya menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak,
dari masa perkuliahan hingga penyusunan skripsi ini terasa sangat sulit bagi saya
untuk menyelesaikan skripsi ini. Oleh karena itu, penulis mengucapkan terima
kasih kepada :
1. Bapak Yardi, Ph.D., Apt selaku pembimbing pertama dan Ibu Prof. Dr. Atiek
Soemiati, M.Si., Apt selaku pembimbing kedua, yang memiliki andil besar
dalam proses penelitian dan penyelesaian skripsi saya ini, semoga segala
bantuan dan bimbingan bapak dan Ibu mendapat imbalan yang lebih baik di
sisi-Nya.
2. Bapak Dr.H. Arif Sumantri, SKM, M.Kes selaku Dekan Fakultas Kedokteran
dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Bapak Yardi, Ph.D., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
4. Bapak dan Ibu dosen yang telah memberikan bimbingan dan bantuan selama
saya menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran
dan Ilmu Kesehatan Universitar Islam Negerri Syarif Hidayatullah Jakarta.
5. Kepada Kak Eris, Mbak Rani, Kak Lisna, Kak Tiwi, dan Kak Rahmadi yang
telah memberikan banyak bantuan kepada penulis selama penelitian di
6. Kepada kedua orang tua penulis Bapak Yoliot Cori (Almarhum) dan Ibu
Elisabil, serta keluarga besar penulis yang selalu memberikan dukungan
moril, materil, dan spiritual hingga selesainya skripsi ini.
7. Untuk sahabat-sahabat “Pojokers” yang selalu mendukung, memberi masukan, dukungan doa, dan semangat. Tidak lupa juga untuk Fitri, Sutar,
Aziz, Dini, Mbak Ani, Elsa, dan Ipul.
8. Teman-teman seperjuangan “Beng-beng” dan seluruh Farmasi angkatan 2011 yang sama-sama berjuang selama 4 tahun untuk menyelesaikan pendidikan
ini.
9. Serta semua pihak yang tidak dapat disebutkan satu persatu yang turut
membantu menyelesaikan skripsi ini.
Penulis menyadari bahwa dalam penyusunan skripsi ini masih terdapat
kekurangan, dan masih jauh dari kesempurnaan karena terbatasnya ilmu dan
kemampuan penulis. Oleh karena itu, penulis mengharapkan kritik dan saran yang
membangun guna perbaikan ke masa mendatang.
Akhir kata dengan segala kerendahan hati penulis mengucapkan semoga
segala bantuan yang telah diberikan penulis akan mendapat balasan, rahmat dan
ridho dari Allah SWT, serta dapat bermanfaat bagi penyusun khususnya, dan para
pembaca umumnya, Aamiin.
Wassalamu’alaikum Waromatullahi Wabarokatuh
Jakarta, Juni 2015
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.6 Uji Anti Inflamasi Metode Stabilisasi Membran Eritrosit ... 25
2.7 Spektrofotometer UV-Vis ... 26
BAB 3. METODE PENELITIAN ... 30
3.1 Waktu dan Tempat Penelitian ... 30
3.2 Bahan dan Alat ... 30
3.3 Prosedur Kerja ... 31
3.3.1 Determinasi ... 31
3.3.2 Penyiapan Bahan ... 31
3.3.4 Penapisan Fitokimia... 31
3.3.5 Pengamatan Organoleptis ... 33
3.3.6 Uji Kadar Air ... 33
3.3.7 Uji Aktivitas Anti Inflamasi Metode Stabilisasi Membran Eritrosit ... 33
3.3.8 Analisis Data ... 36
BAB 4. HASIL DAN PEMBAHASAN ... 37
4.1 Hasil Penelitian ... 37
4.1.1 Hasil Determinasi ... 37
4.1.2 Hasil Ekstraksi ... 37
4.1.3 Hasil Uji Penapisan Fitokimia ... 37
4.1.4 Hasil Pengamatan Organoleptis ... 38
4.1.5 Hasil Uji Kadar Air ... 38
4.1.6 Hasil Uji Efek Stabilisasi Membran Sel Darah Merah Ekstrak Kasar Buah Parijoto ... 38
4.1.7 Hasil Analisa Statistik... 40
4.2 Pembahasan ... 41
4.2.1 Ekstraksi dan Penapisan Fitokimia ... 41
4.2.2 Stabilisasi Membran Sel Darah Merah ... 44
BAB 5. KESIMPULAN DAN SARAN ... 50
5.1 Kesimpulan ... 50
5.2 Saran ... 50
DAFTAR PUSTAKA ... 51
Tabel 1. Hasil Uji Penapisan Fitokimia Ekstrak Buah Parijoto ... 40
Tabel 2. Nilai absorbansi dan persentase stabilitas membran sel darah merah dari larutan uji, kontrol positif, dan kontrol negatif ... 41
Gambar 1. Buah Parijoto (Medinilla speciosa Blume) ... 5
Gambar 2. Reaksi Uji Mayer ... 6
Gambar 3. Reaksi Uji Dragendorff ... 7
Gambar 4. Mekanisme Reaksi Pembentukan Garam Flavilium ... 7
Gambar 5. Reaksi Hidrolisis Saponin dalam Air ... 8
Gambar 6. Skema Mekanisme Inflamasi Akut ... 18
Gambar 7. Efek Utama yang Ditimbulkan oleh IL-1 dan TNF pada Inflamasi .... 23
Gambar 8. Pelepasan Mediator Inflamasi oleh Sel Mast ... 24
Gambar 9. Skema Instrumentasi Spektrofotometer UV-VIS ... 27
COX : Cyclooxygenase
Hb : Hemoglobin
HRBC : Human Red Blood Cell
Ig : Imunoglobulin
IL : Interleukin
Jejas : Lecet (tergores, luka sedikit, dsb) pd kulit
LT : Leukotrien
OAINS : Obat Anti Inflamasi Non Steroid
PAF : Platelet Activating Factor
PGE : Prostaglandin
PGI : Prostasiklin
ROS : Reactive Oxygen Species
SRS-A : Slow Reacting Substance of Anaphilaxis
TNF : Tumor Necrosis Factor
Lampiran 1. Hasil Determinasi Buah Parijoto (Medinilla speciosa Blume) ... 57
Lampiran 2. Alur Penelitian ... 58
Lampiran 3. Skema Uji Aktivitas Anti Inflamasi ... 59
Lampiran 4. Pembuatan Larutan Uji dan Standar ... 60
Lampiran 5. Perhitungan Pembuatan Larutan Dapar Posfat dan Pengenceran Larutan Uji dan Standar... 61
Lampiran 6. Data Absorbansi dan Persentase Stabilitas Membran Sel Darah Merah dengan Optimasi Menggunakan Suhu Inkubasi 370C ... 63
Lampiran 7. Nilai Absorbansi Larutan Uji Ekstrak Etanol 70% Buah Parijoto dan Kontrol Positif ... 65
Lampiran 8. Nilai Absorbansi Kontrol Larutan Uji Ekstrak Etanol 70% Buah Parijoto, Kontrol Positif dan Kontrol Negatif ... 66
Lampiran 9. Penentuan Stabilitas Membran Sel Darah Merah terhadap Ekstrak Etanol 70% dan Na Diklofenak sebagai Kontrol Positif ... 67
Lampiran 10. Hasil Uji Statistik Persentase Stabilitas Ekstrak Etanol 70% Buah Parijoto dan Na Diklofenak Kontrol Positif ... 69
Lampiran 11. Foto – foto Alat dan Bahan Penelitian... 74
Lampiran 12. Foto Proses Pengujian Aktivitas ... 75
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara kepulauan yang memiliki beribu-ribu
pulau dengan luas kawasan hutan mencapai 130,78 juta hektar. Indonesia
sendiri memiliki 30.000 jenis tumbuhan dari total 40.000 jenis tumbuhan di
dunia, dimana 940 jenis diantaranya merupakan tumbuhan berkhasiat obat
(jumlah ini merupakan 90% dari jumlah tanaman obat yang ada di kawasan
Asia) (Nugroho, 2010). Kekayaan alam yang dimiliki oleh Indonesia
menjadikannya negara terbesar kedua di dunia setelah Brazil yang memiliki
keanekaragaman hayati (Farida et al., 2012).
Penggunaan obat tradisional sudah menjadi kebiasaan yang dilakukan
oleh hampir semua negara di dunia. Selama dekade terakhir, penggunaan
obat tradisional telah berkembang pesat. Pengembangan obat tradisional ini
terus dilakukan sebagai perawatan kesehatan bagi masyarakat miskin di
negara-negara berkembang. Obat tradisional juga sering digunakan dalam
perawatan kesehatan secara nasional (Karamian et al., 2013).
Masyarakat Indonesia telah lama mengenal dan menggunakan
tanaman berkhasiat obat sebagai salah satu upaya dalam pencegahan
penyakit (preventif), meningkatkan kesehatan (promotif), memulihkan
kesehatan (rehabilitatif), dan penyembuhan (kuratif). Pengetahuan tentang
tanaman khasiat obat berdasar pada pengalaman dan keterampilan secara
turun-menurun telah diwariskan dari satu generasi ke generasi berikutnya
(Sari, 2006). Masyarakat jawa khususnya masyarakat yang hidup di lereng
Gunung Merapi memanfaatkan daun dan buah parijoto (Medinilla speciosa
Blume) secara turun-menurun sebagai obat. Daun dan buah parijoto
dimanfaatkan sebagai anti bakteri, obat sariawan, anti radang dan obat
kolestrol.
Kandungan kimia yang terdapat dalam daun dan buah parijoto
(Medinilla speciosa Blume) adalah saponin dan kardenolin, disamping itu
buahnya juga mengandung falvonoid dan daunnya mengandung tanin
menunjukkan bahwa terdapat kandungan metabolit sekunder dari buah
parijoto (Medinilla speciosa Blume) yaitu saponin, glikosida, flavonoid dan
tanin, serta memiliki aktivitas sebagai anti oksidan. Penelitian lain yang
telah dilakukan oleh Kumar et al., 2012 dilaporkan bahwa tanaman Skimmia
anquetilia yang mengandung flavonoid, saponin, glikosida, steroid dan tanin
serta penelitian yang dilakukan oleh Saleem et al., 2011 bahwa tanaman
Gendarussa vulgaris Nees yang mengandung saponin, glikosida, steroid,
flavonoid dan tanin keduanya memiliki aktivitas sebagai anti inflamasi.
Inflamasi atau radang merupakan proses respon tubuh terhadap
rangsangan merugikan yang ditimbulkan oleh berbagai agen berbahaya
seperti infeksi, antibodi ataupun luka fisik (Goodman dan Gilman, 2006).
Mediator-mediator kimia juga berperan sebagai pemberi respon terjadinya
inflamasi, mediator tersebut dapat berikatan pada reseptor yang spesifik
pada sel target dan dapat meningkatkan permeabilitas pembuluh darah dan
kemotaksis neutrofil, merangsang kontraksi otot polos, memiliki aktivitas
enzimatik secara langsung, menginduksi rasa nyeri atau stres oksidatif
(Kumar et al., 2010). Stres oksidatif ini telah terbukti berkaitan dengan jalur
patogenesis beberapa penyakit seperti aterosklerosis, kanker, kerusakan hati,
rematoid artritis dan gangguan syaraf (Kumar, 2011). Efek anti inflamasi
telah diamati pada flavonoid dan tanin. Flavonoid seperti quercetin
diketahui efektif dalam mengurangi peradangan akut. Flavonoid tertentu
memiliki aktivitas penghambatan ampuh terhadap berbagai enzim seperti
protein kinase C, tirosin kinase protein, fosfolipase A2, fosfodiesterase dan
lainnya (Kumar et al., 2012).
Sel darah merah (eritrosit) manusia telah banyak digunakan sebagai
model studi interaksi obat dengan membran. Seperti obat yang memiliki
efek anestesi dan obat anti inflamasi non steroid (OAINS) dapat mencegah
lepasnya hemoglobin (Hb) dari sel darah merah (eritrosit) ketika terjadi
kondisi hipotonik. Teori ini digunakan sebagai metode yang sangat berguna
untuk menilai aktivitas anti inflamasi dari bermacam-macam senyawa
secara in vitro (Kumar, 2011). Chowdhuryet al., 2014 dalam penelitiannya
ekstrak Gardenia coronaria Leaves. Penelitian yang dilakukan oleh
Prakatindih 2014 juga menggunakan metode ini untuk menguji aktivitas anti
inflamasi kitosan yang telah diiradiasi. Melihat metode ini cukup efektif
untuk melihat efek anti inflamasi secara in vitro serta potensi yang dimiliki
oleh tanaman parijoto (Medinilla speciosa Blume) khususnya bagian buah
sebagai anti inflamasi, maka pada penelitian ini akan dilakukan uji aktivitas
anti inflamasi ekstrak etanol 70% buah parijoto secara in vitro dengan
metode stabilisasi membran HRBC (Human Red Blood Cell).
1.2 Rumusan Masalah dan Ruang Lingkup
Masalah yang diteliti dalam penelitian ini adalah apakah ekstrak
etanol 70% buah parijoto (Medinilla speciosa Blume) memiliki efek anti
inflamasi ditinjau dari jumlah hemoglobin (Hb) yang dilepaskan oleh sel
darah merah. Ruang lingkup penelitian ini adalah fitokimia dan farmakologi
eksperimental.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efek anti inflamasi dari ekstrak
etanol 70% buah parijoto (Medinilla speciosa Blume) ditinjau dari jumlah
hemoglobin (Hb) yang dilepaskan oleh sel darah merah.
1.4 Manfaat Penelitian
Manfaat yang dapat diambil dari penelitian ini adalah menambah
khasanah ilmu pengetahuan tentang anti inflamasi serta referensi bagi
penelitian selanjutnya. Penelitian ini juga dapat memberikan informasi
mengenai potensi buah parijoto (Medinilla speciosa Blume) sebagai anti
BAB 2
TINJAUAN PUSTAKA
2.1 Medinilla speciosa Blume 2.1.1 Taksonomi
Klasifikasi tanaman parijoto adalah sebagai berikut :
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh)
Super Divisi : Spermatophyta (Menghasilkan biji)
Divisi : Magnoliophyta (Tumbuhan berbunga)
Kelas : Magnoliopsida (berkeping dua / dikotil)
Sub Kelas : Rosidae
Ordo : Myrtales
Famili : Melastomataceae
Genus : Medinilla
Spesies : Medinilla speciosa Blume
(www.plantamor.com)
2.1.2 Deskripsi
Habitus : Perdu, tegak, tinggi l – 2 m.
Batang : Bulat, kulit dengan lapisan gabus jika tua, bergerigi, kasar,
putih kecoklatan.
Daun : Tunggal, bersilang berhadapan, tangkai pendek, bulat,
lunak, warna ungu kemerahan, helaian daun bentuk
lonjong, pangkal dan ujung runcing, tepi rata, panjang
10-20 cm, lebar 5-15 cm, pertulangan melengkung, permukaan
alas licin, berwarna hijau, permukaan bawah kasar, warna
hijau kelabu.
Bunga : Majemuk, di ketiak daun, sempurna, berkelamin ganda,
kelopak 5 helai, ujung runcing, pangkal berlekatan,
panjang 3-8 mm, warna ungu tua, benang sari 2 kali lipat
(Anonim, 2013).
Gambar 1. Buah Parijoto (Medinilla speciosa Blume) [ Sumber : Koleksi Pribadi ]
2.1.3 Tempat Tumbuh
Merupakan tumbuhan liar di lereng-lereng gunung atau di
hutan-hutan dan kadang dibudidayakan sebagai tanaman hias. Tumbuh baik pada
tanah yang berhumus tinggi dan lembab, pada ketinggian 800 m sampai
2.300 m di atas permukaan laut. Berbunga pada bulan November - Januari
dan waktu panen yang tepat bulan Maret - Mei (Anonim, 2013).
2.1.4 Kandungan Kimia
Buah parijoto mengandung metabolit sekunder berupa saponin,
glikosida, flavonoid dan tanin (Wachidah, 2014).
2.1.5 Khasiat
Secara tradisional buah Medinilla speciosa digunakan sebagai obat warna merah keunguan, kepala putik duduk di atas bakal
buah, kepala putik bulat, ungu, mahkota lepas, 5 helai,
bentuk kuku, panjang 5-8 mm, warna merah muda.
Buah : Buni, bulat, bagian ujung berbenjol bekas pelekatan
kelopak, diameter 5-8 mm, warna merah keunguan.
Biji : Bulat, jumlah banyak, kecil, putih.
sariawan, antiradang dan antibakteri (Anonim, 2013). Parijoto dipercaya
oleh masyarakat di daerah Gunung Merapi dapat meningkatkan kesehatan
ibu dan janin (Anggana, 2011). Sedangkan masyarakat Desa Colo
Kabupaten Kudus memiliki keyakinan jika ibu hamil mengkonsumsi
parijoto, kalau anaknya laki-laki maka akan terlihat cakap, kalau
perempuan terlihat cantik (Wibowo et al., 2012).
2.2 Penapisan Fitokimia
Tujuan utama dari penapisan fitokimia adalah menganalisis
tumbuhan untuk mengetahui kandungan bioaktif yang berguna untuk
pengobatan. Pendekatan secara penapisan fitokimia meliputi analisa
kualitatif kandungan dalam tumbuhan atau bagian tumbuhan (akar, batang,
daun, bunga, buah dan biji) terutama kandungan metabolit sekunder yang
merupakan senyawa bioaktif seperti alkaloid, flavonoid, saponin, tanin,
terpenoid dan glikosida.
a. Alkaloid
Alkaloid adalah senyawa nitrogen (N) yang merupakan hasil
metabolit sekunder pada tumbuh-tumbuhan. Umumnya alkaloid
menunjukkan efek fisiologik yang menarik, sehingga banyak digunakan sebagai obat-obatan (Guevera, 1985).
Hasil positif alkaloid pada Uji Mayer ditandai dengan terbentuknya
endapan putih. Diperkirakan endapan tersebut adalah kompleks
kalium-alkaloid. Pada uji alkaloid dengan pereaksi Mayer, diperkirakan nitrogen
pada alkaloid akan bereaksi dengan ion logam K+ dari kalium
tetraiodomerkurat (II) membentuk kompleks kalium-alkaloid yang
mengendap. Perkiraan reaksi yang terjadi pada Uji Mayer :
Hasil positif alkaloid pada Uji Dragendorff juga ditandai dengan
terbentuknya endapan coklat muda sampai kuning. Endapan tersebut
adalah kalium - alkaloid.
Gambar 3. Reaksi Uji Dragendorff [ Sumber : Marliana, 2005 ]
b. Flavonoid
Flavonoid adalah senyawa polifenol yang mengandung C15
terdiri atas dua inti fenolat yang dihubungkan dengan tiga satuan karbon.
Struktur umum flavonoid juga digambarkan sebagai deretan senyawa
C6-C3-C6 (Guevera, 1985).
Pendeteksian adanya senyawa flavonoid dapat dilakukan dengan
metode Wilstater sianidin. Uji Wilstater sianidin biasa digunakan
untuk mendeteksi senyawa yang mempunyai inti alfa-benzopiron.
Warna merah yang terbentuk pada pada Uji Wilstater disebabkan
karena terbentuknya garam flavilium (Achmad, 1986).
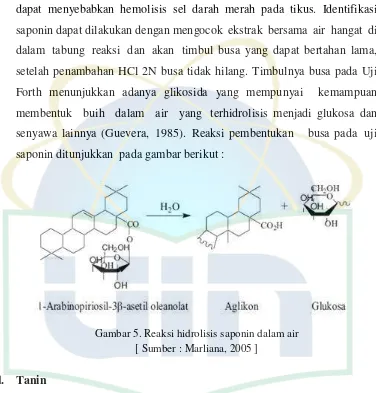
c. Saponin
Saponin adalah senyawa aktif permukaan yang kuat, dapat
menimbulkan busa jika dikocok dengan air dan pada konsentrasi rendah
dapat menyebabkan hemolisis sel darah merah pada tikus. Identifikasi
saponin dapat dilakukan dengan mengocok ekstrak bersama air hangat di
dalam tabung reaksi dan akan timbul busa yang dapat bertahan lama,
setelah penambahan HCl 2N busa tidak hilang. Timbulnya busa pada Uji
Forth menunjukkan adanya glikosida yang mempunyai kemampuan
membentuk buih dalam air yang terhidrolisis menjadi glukosa dan
senyawa lainnya (Guevera, 1985). Reaksi pembentukan busa pada uji
saponin ditunjukkan pada gambar berikut :
Gambar 5. Reaksi hidrolisis saponin dalam air [ Sumber : Marliana, 2005 ]
d. Tanin
Istilah “tanin” pertama kalinya digunakan untuk bahan dari tumbuhan yang mempunyai kemampuan untuk menggumpalkan protein
hewan pada proses penyamakan kulit. Saat ini tanin mempunyai nilai
penting sebagai sitotoksik, antikanker dan antitumor. Tanin terdiri dari 2
kelompok berdasarkan hasil hidrolisanya. Tipe pertama dikenal sebagai
pirogalol tanin yaitu, senyawa- senyawa fenolik yang mempunyai ikatan
ester dengan gula. Tipe kedua adalah tanin terkondensasi yang
kadang-kadang disebut katekol tanin dan merupakan polimer dari senyawa-
senyawa-senyawa berwarna merah yang tidak larut disebut dengan
phlobaphene atau merah tanin (Guevera, 1985). Tanin pada ekstrak
tumbuh-tumbuhan diidentifikasi dengan uji gelatin dengan prinsip
pengendap protein dari gelatin oleh tanin (Fransworth, 1996). Dan hasil
positif juga diberikan oleh pereaksi ferri klorida (FeCl3), dimana tanin
terhidrolisa memberikan warna biru atau biru-hitam, sedangkan
kondensasi tanin menberikan warna biru-hijau. Senyawa-senyawa
polifenol juga memberikan reaksi warna spesifik dengan FeCl3, tetapi
tidak memberikan endapan dengan gelatin.
e. Antrakuinon
Antrakuinon mungkin dijumpai baik dalam bentuk glikosida dengan
ikatan O- atau C-glikosida maupun aglikonnya. Biasanya digunakan
sebagai zat warna dan katartiks (purgatives). Turunan antrakuinon
biasanya merupakan senyawa berwarna merah jingga yang larut dalam air
panas dan alkohol encer. Identifikasinya dilakukan dengan cara Uji Borntrager’s, tetapi kadang-kadang uji ini memberikan hasil negatif pada antrakuinon yang sangat stabil atau turunan antranol, untuk itu identifikasi
dilakukan modifikasi Uji Borntrager’s. Antrakuinon memberikan warna yang spesifik dengan basa seperti, merah, violet dan hijau. Secara
spektrofotometri antrakuinon memberikan pita resapan yang berbeda
dengan senyawa kuinon lainnya, dimana memberikan 4 atau 5 pita
resapannya pada daerah UV dan sinar tampak. Paling tidak 3 dari pita
resapan berkisar antara 215 dan 300 nm, dan lainnya diatas 430 nm
(Guevera, 1985).
f. Glikosida
Glikosida merupakan senyawa alami yang terdapat pada berbagai
jenis tumbuh-tumbuhan tinggi dan memberikan pengaruh fisiologis.
Senyawa ini terbentuk dari gugus non-gula (aglikon) dan gugus gula
(glikon). Gugus aglikonnya sangat bervariasi tergantung dari jenis
triterpenoida dan lain sebagainya (Guevera, 1985). Untuk pemeriksaan
atau uji glikosida dapat dilakukan selain berdasarkan aglikonnya, juga
dapat dilakukan terhadap gugus gulanya karena gugus aglikon yang sangat
bervariasi, maka dapat dilakukan terhadap gugus gulanya dengan pereaksi
Keller-Kiliani (Chairul, 2003).
2.3 Metode Ekstraksi
Menurut Ketut Ristiasa dalam Parameter Standar Umum Ekstrak
Tumbuhan Obat (2000) yang dimaksud dengan ekstraksi adalah proses
penarikan kandungan senyawa kimia dari simplisia nabati atau simplisia
hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir
semua pelarut diuapkan dengan menggunakan alat yang sesuai.
Berikut adalah beberapa cara ekstraksi dengan menggunakan
pelarut.
2.3.1 Cara Dingin a. Maserasi
Maserasi merupakan cara penyarian sederhana. Maserasi dilakukan
dengan cara merendam serbuk simplisisa dalam cairan penyari dengan
beberapa kali pengocokan atau pengadukan pada temperatur ruang
(kamar). Cairan penyari akan menembus dinding sel atau masuk ke
dalam rongga sel yang mengandung zat aktif, zat aktif tersebut akan
larut karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam
sel dengan yang di luar sel. Larutan yang lebih pekat (di dalam sel)
didesak keluar sel, masuk ke dalam larutan di luar sel. Peristiwa
tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan
di luar sel dan di dalam sel. Keuntungan cara penyarian dengan maserasi
adalah cara pengerjaan dan peralatan yang digunakan sederhana dan
mudah diusahakan (Ristiasa, 2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru
temperatur ruangan. Prinsip perkolasi adalah serbuk simplisisa
ditempatkan dalam suatu bejana silinder yang bagian bawahnya diberi
sekat berpori. Cairan penyari dialirkan dari atas ke bawah melalui
serbuk tersebut, kemudian melarutkan zat aktif dari sel-sel yang dilalui
sampai mencapai keadaan jenuh (Ristiasa, 2000).
2.3.2 Cara Panas a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif
konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan
proses pada residu pertama sampai 3-5 kali sehingga dapat termasuk
proses ekstraksi sempurna (Ristiasa, 2000).
b. Soklet
Sokletasi merupakan ekstraksi menggunakan pelarut yang selalu
baru umumnya dilakukan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik
(Ristiasa, 2000).
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara
umum dilakukan pada temperatur 40-500C (Ristiasa, 2000).
d. Infusa
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas
air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur
96-980C) selama waktu tertentu (15-20 menit). Infus pada umumnya
digunakan untuk menarik atau mengekstraksi zat aktif yang larut dalam air
dan bahan-bahan nabati. Hasil dari ekstrak ini menghasilkan zat aktif yang
yang diperoleh dengan infus tidak boleh disimpan lebih dari 4 jam
(Ristiasa, 2000).
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (> 30 menit) dan
temperatur sampai titik didih air (Ristiasa, 2000).
2.4 Inflamasi 2.5.1 Defenisi
Inflamasi atau radang merupakan proses respon tubuh terhadap
rangsangan yang merugikan yang ditimbulkan oleh agen berbahaya seperti
infeksi, antibodi, ataupun luka fisik (Goodman & Gilman, 2006). Pada
reaksi inflamasi akan terjadi pelepasan histamin, bradikinin, prostaglandin,
ekstravasasi cairan, migrasi sel, kerusakan jaringan dan perbaikannya yang
ditujukan sebagai upaya pertahanan tubuh dan biasanya respon ini terjadi
pada beberapa kondisi penyakit yang serius, seperti kardiovaskular,
gangguan inflamasi dan autoimun, kondisi neurodegeneratif, infeksi dan
kanker (Kumar et al., 2010 ; Chippada et al., 2011).
Ada lima tanda klinis terjadinya inflamasi yaitu rubor (kemerahan),
tumor (pembengkakan), kalor (panas), dolor (rasa nyeri), dan functio laesa
(kehilangan fungsi). Kemerahan terjadi pada tahap pertama dari inflamasi.
Darah berkumpul pada daerah cedera jaringan akibat pelepasan mediator
kimia tubuh (kinin, prostaglandin, dan histamin). Pelepasan histamin
menyebabkan dilatasi arteriol. Pembengkakan merupakan tahap kedua dari
inflamasi, dimana plasma masuk kedalam jaringan interstitial pada tempat
cedera. Kinin mendilatasi arteriol dan meningkatkan permeabilitas kapiler.
Rasa panas pada tempat inflamasi disebabkan oleh bertambahnya
pengumpulan darah dan mungkin juga dapat disebabkan oleh pirogen
(substansi yang menyebabkan demam) yang mengganggu pusat pengatur
panas pada hipotalamus. Adanya pembengkakan serta pelepasan
penumpukan cairan pada tempat cedera jaringan dapat menyebabkan
gangguan mobilitas pada daerah yang terkena (Kee & Hayes, 1993).
2.5.2 Mekanisme Inflamasi
Kerusakan atau perubahan yang terjadi pada sel dan jaringan akibat
adanya noksi (pengaruh merusak) akan membebaskan berbagai mediator
dan substansi radang. Asam arakidonat mulanya merupakan komponen
normal yang disimpan pada sel dalam bentuk fosfolipida, dibebaskan dari
sel penyimpan lipid oleh asil hidrolase sebagai respons adanya noksi.
Asam arakidonat ini kemudian mengalami metabolisme menjadi dua alur.
Alur siklooksigenase yang membebaskan prostaglandin, prostasiklin,
tromboksan; alur lipoksigenase yang membebaskan leukotrien dan
berbagai substansi seperti 5-HPETE, 5-HETE dan sebagainya (Mansjoer,
2003).
Respons kardiovaskular pada proses radang tergantung dari
karakteristik dan distribusi noksi. Dilatasi dan peningkatan permeabilitas
kapiler di sekitar jaringan yang mengalami pengaruh-pengaruh merusak
pada fase akut berlangsung cepat dimulai 1 sampai 30 menit sejak terjadi
perubahan-perubahan pada jaringan dan berakhir 15 sampai 30 menit dan
kadang-kadang sampai 60 menit (lnsel, 1991; Melmon dan Morreli, 1978;
Robins, 1974). Volume darah yang membawa leukosit ke daerah radang
bertambah, dengan gejala klinis di sekitar jaringan berupa rasa panas dan
warna kemerah-merahan (PGE2 dan PGI2). Aliran darah menjadi lebih
lambat, leukosit beragregasi di sepanjang dinding pembuluh darah
menyebabkan pembuluh darah kehilangan tekstur. Peningkatan
permeabilitas kapiler disebabkan kontraksi sel-sel endotel sehingga
menimbulkan celah-celah bermembran. Permeabilitas kapiler ditingkatkan
oleh histamin, serotonin, bradikinin, sistim pembekuan dan komplemen
dibawah pengaruh faktor Hageman dan SRS-A. Larutan mediator dapat
mencapai jaringan karena meningkatnya permeabilitas kapiler dengan
Fase radang sub-akut berlangsung lambat, mulai dari beberapa jam
sampai beberapa hari misalnya karena pengaruh noksi bakteri.
Vasodilatasi dan peningkatan permeabilitas kapiler masih berlangsung.
Karakteristik paling menonjol adalah infiltrasi fagosit yaitu sel
polimorfonuklir dan monosit ke jaringan. Selain itu aliran darah lambat,
pendarahan dan terjadi kerusakan jaringan yang ekstensif. Proses fagosit
mencapai daerah peradangan dinamakan kemotaktik. Migrasi fagosit
diaktivasi oleh salah satu fragmen dari komponen komplemen, untuk
leukosit polimorfonuklir yaitu C3a. Selain itu LTB4 dan PAF ikut
berperanan. Fagosit bergerak pada permukaan sel endotel, pada ujung
depan mengecil dan memanjang sehingga dapat memasuki antar sel
endotel kemudian melarutkan membran (diapedesis). Fagosit melepaskan
diri dari antar sel, masuk ke jaringan dan berakumulasi (Insel, 1991;
Melmon dan Morreli, 1978; Roitt et al, 1985). Fagosit yang mula-mula ke
luar dari dinding pembuluh darah adalah leukosit polimorfonuklir yang
menyerang dan mencerna bakteri dengan cara fagositosis. Disusul
datangnya monosit (makrofag) sebagai petugas pembersih, mencerna
leukosit polimorfonuklir dan sel jaringan yang telah mati akibat toksin
bakteri. Pada radang kronik makrofag juga ikut mencerna bakteri (Boyd,
1971).
Plasma darah setelah melewati dinding pembuluh darah yang
permeabel sifatnya berubah disebut limfe radang. Leukosit dan limfe
radang secara bersama membentuk eksudat radang yang menimbulkan
pembengkakan pada jaringan. Rasa sakit disebabkan tertekannya serabut
syaraf akibat pembengkakan jaringan. Selain itu rasa sakit disebabkan
bradikinin dan PG. Kerusakan jaringan disebabkan fagositosis, enzim
lisosomal dan radikal oksigen. Deman oleh pirogen endogen yang
dihasilkan adalah karena kerusakan sel (Korolkovas, 1988; Boyd, 1971).
Berdasarkan fasenya, ada dua fase yang terjadi dalam mekanisme
inflamasi yaitu fase perubahan vaskular dan fase reaksi selular. Fase
perubahan vaskular terjadi pada pembuluh darah. Mula-mula akan terjadi
darah kecil (arteriol). Proses dapat berlangsung beberapa detik sampai
beberapa menit tergantung pada kerasnya jejas (luka). Kemudian akan
terjadi vasodilatasi yang dimulai dari pembuluh arteriol yang tadinya
menyempit lalu diikuti oleh bagian lain pembuluh darah itu. Akibat
dilatasi ini, maka aliran darah akan bertambah sehingga pembuluh darah
akan penuh terisi darah dan tekanan hidrostatiknya meningkat, yang
selanjutnya dapat menyebabkan keluarnya cairan plasma dari pembuluh
darah itu. Setelah itu, aliran darah melambat karena permeabilitas kapiler
juga bertambah. Sehingga cairan darah dan protein akan keluar dari
pembuluh darah dan mengakibatkan darah menjadi kental. Proses tersebut
dikenal dengan proses eksudasi. Keseluruhan proses ini terjadi akibat
adanya zat kimia yang menyerupai histamin dan protaglandin
(Pringgoutomo, 2002).
Setelah fase vaskuler selesai, terjadi reaksi seluler pada daerah yang
mengalami inflamasi. Fase ini dimulai setelah sel darah putih dalam darah
berpindah ke tempat cedera atau infeksi. Sel-sel darah putih dan trombosit
tertarik ke daerah tersebut oleh zat-zat kimia yang dihasilkan dari sel yang
cedera, sel mast, melalui pengaktifan komplemen, dan pembentukan
sitokin yang terjadi setelah antibodi berikatan dengan antigen. Tertariknya
sel darah putih ke area cedera disebut kemotaksis. Ketika berada di area
tersebut, berbagai stimulan menyebabkan sel endotel kapiler dan sel darah
putih, terutama neutrofil dan monosit menghasilkan molekul adhesif
komplementer. Neutrofil merupakan sel pertama yang tiba di daerah yang
mengalami inflamasi. Neutrofil bekerja dengan memfagositosis,
mendegradasi sel debris, serta membunuh mikroba. Neutrofil dapat
membunuh mikroorganisme melalui dua cara yaitu menggunakan enzim
lisosomal pencernaan dan memproduksi oksigen bebas radikal (Corwin &
Elizabeth, 2008).
Urutan proses yang terjadi pada leukosit terdiri atas penepian
(marginasi), pelekatan (sticking), diapedesis (emigrasi), dan fagositosis.
Proses marginasi adalah proses ketika sel darah putih melekat pada sel
2.5.3 Penyebab Inflamasi
Pengaruh-pengaruh merusak (noksi) dapat berupa noksi fisika,
kimia, bakteri, parasit dan sebagainya. Noksi fisika misalnya suhu tinggi,
cahaya, sinar X dan radium, juga termasuk benda-benda asing yang
tertanam pada jaringan atau sebab lain yang menimbulkan pengaruh
merusak. Asam kuat, basa kuat dan racun termasuk noksi kimia. Bakteri
patogen antara lain Streptococcus, Staphylococcus dan Pneumococcus
(Boyd, 1971).
Penyebab paling umum dari proses peradangan antara lain :
1. Infeksi mikrobial (bakteri pirogenik, virus)
2. Agen fisik (trauma, radiasi pengion, panas, dan dingin)
3. Cedera kimiawi (korosif, asam, basa, agen pereduksi, dan toksin
bakteri)
4. Jaringan nekrosis misalnya infark iskemik
5. Reaksi hipersensitivitas misalnya parasit dan basil tuberkulosis
(Underwood, 1999).
2.5.4 Tipe Inflamasi
Berdasarkan waktu terjadinya inflamasi diklasifikasikan menjadi:
1. Inflamasi akut, adalah inflamasi yang terjadi dalam waktu yang segera
dan hanya dalam waktu yang tidak lama terhadap cedera jaringan.
Karakteristik utamanya adalah adanya eksudasi cairan (edema) dan
emigrasi dan polimorfonuklear (neutrofil).
2. Inflamasi kronis, adalah inflamasi yang terjadi dalam waktu dan
durasi yang lebih lama dengan melibatkan limfosit serta makrofag dan
menimbulkan poliferasi pembuluh darah serta pembentukan jaringan
parut.
Berdasarkan pada karakteristik utama inflamasi kronik dan akut,
dapat dibedakan menurut jenis eksudat dan variabel morfologi :
1. Inflamasi serosa
Inflamasi serosa dicerminkan oleh akumulasi cairan dalam jaringan
peritoneum, pleura, dan perikardium keadaan ini dinamakan efusi,
namun dapat juga ditemukan ditempat lain (mialnya lepuh karena luka
bakar pada kulit).
2. Inflamasi fibrinosa
Inflamasi fibrinosa merupakan keadaan meningkatnya permeabilitas
vaskular yang lebih nyata, disertai eksudat yang mengandung
fibrinogen dalam jumlah besar. Fibrinogen tersebut akan diubah
mejadi fibrin melalui sistem koagulasi. Keterlibatan permukaan serosa
(misalnya perikardium atau pleura) disebut dengan istilah perikarditis
fibrinosa atau pleuritis fibrinosa.
3. Inflamasi supuratif atau purulen
Pola ini ditandai oleh eksudat purulen (pus/nanah) yang terdiri atas
leukosit dan sel-sel nekrotik. Istilah abses mengacu kepada kumpulan
inflamasi purulen setempat yang disertai dengan nekrosis likuefaksi
(misalnya abses stafilokokus)
4. Ulkus
Ulkus merupakan erosi lokal pada permukaan epitel yang ditimbulkan
oleh jaringan nekrotik yang mengelupas atau mengalami inflamasi
(misalnya ulkus lambung) (Richard et al., 2006).
2.5.5 Mediator Inflamasi
Kerusakan sel akibat adanya noksi akan membebaskan berbagai
mediator atau substansi radang antara lain histamin, bradikinin, kalidin,
serotonin, prostaglandin, leukotrien dan sebagainya. Histamin terdapat
pada semua jaringan juga pada leukosit basofil. Di dalam jaringan,
histamin disimpan dalam sel mast dan dibebaskan sebagai hasil interaksi
antigen dengan antibodi IgE pada permukaan sel mast, berperan pada
reaksi hipersensitif dan alergi. Substansi tersebut merupakan mediator
dalam beberapa detik. Reseptor-reseptor histamin adalah H1 dan H2.
Stimulasi pada kedua reseptor ini menyebabkan vasodilatasi pada arterial
dan pembuluh darah koronaria, merendahkan resistensi kapiler dan
menurunkan tekanan darah sistemik. Pada reaksi radang permeabilitas
kapiler meningkat karena dibebaskannya histamin (Mutschler, 1991;
Garrison, 1991).
Prazat kalikrein ialah kalikreinogen yang tidak aktif terdapat dalam
pankreas, mukosa usus dan plasma darah. Kalikreinogen diaktivasi oleh
faktor Hageman, melalui penguraian enzimatik dihasilkan kinin aktif yaitu
bradikinin dan kalidin, keduanya autakoid. Sebagai mediator radang
bradikinin dan kalidin bereaksi lokal, menimbulkan rasa sakit,
vasodilatasi, meningkatkan permeabilitas kapiler dan berperan
meningkatkan potensi prostaglandin (Mutschler, 1991; Garrison, 1991).
Serotonin (5-hidroksitriptamin, 5-Hf), dalam konsentrasi tinggi
terdapat pada platelet darah, perifer mukosa usus dan di beberapa bagian
otak. Salah satu reseptor 5-Hf yang terdapat pada membran platelet ialah
5-Hf 2, jika distimulasi akan meningkatkan agregasi platelet (Garrison,
1991).
Mediator eikosanoid berasal dari dua famili berbeda, dari alur
siklooksigenase dihasilkan prostaglandin dan dari alur lipoksigenase
dihasilkan leukotrien, termasuk semua senyawa yang masih berhubungan
dengan keduanya. Sebagai prazat adalah asam arakidonat. Prostaglandin
(PG) sebenarnya bukan sebagai mediator radang, lebih tepat dikatakan
sebagai modulator dari reaksi radang. Sebagai penyebab radang, PG
bekerja lemah, berpotensi kuat setelah berkombinasi dengan mediator atau
substansi lain yang dibebaskan secara lokal, autakoid seperti histamin,
serotonin, PG lain dan leukotrien. Prostaglandin paling sensibel pada
reseptor rasa sakit di daerah perifer. Prostaglandin merupakan vasodilator
potensial, dilatasi terjadi pada arteriol, prekapiler, pembuluh sfingter dan
postkapiler venula. Walaupun PG merupakan vasodilator potensial tetapi
bukan sebagai vasodilator universal (Hirschelmann, 1991; Campbell,
Tromboksan A2 berkemampuan menginduksi agregasi platelet maupun
reaksi pembebasan platelet (Campbell, 1991).
Dari alur lipoksigenase dihasilkan mediator leukotrien (LT) dan
hidroksi asam lemak. Mediator LTB4 potensial untuk kemotaktik leukosit
polimorfonuklir, eosinofil dan monosit. Pada konsentrasi lebih tinggi LTB4
menstimulasi agregasi leukosit polimorfonuklir. Mediator LTB4
mengakibatkan hiperalgesia. Efek terhadap mikrovaskulatur diinduksi oleh
LTC4 clan LTD4, beraksi di sepanjang endotel dari postkapiler venula yang
menyebabkan eksudasi plasma. Pada konsentrasi tinggi LTC4 dan LTD4
mempersempit arteriol dan mengurangi eksudasi. Kombinasi LTC4 dan
LTD4 merupakan mediator baru, dinamakan slow reacting substance of
anaphylaxis (SRS-A) yang dapat menyebabkan peradangan, reaksi
anafilaksi, reaksi alergi dan asma (Campbell, 1991).
Platelet-activating factor (PAF) disimpan di dalam sel dalam bentuk
prazat. PAF disintesis oleh platelet, neutrofil, monosit, sel mast, eosinofil
dan sel mesangial ginjal. PAF merupakan stimulator agregasi platelet,
agregasi leukosit polimorfonuklir dan monosit, meningkatkan potensi LT,
pembebasan enzim lisosomal dan superoksida, juga merupakan faktor
kemotaktik eosinofil, neutrofil dan monosit (Campbell, 1991).
Selama berlangsung proses inflamasi banyak mediator kimia yang
dilepaskan dari plasma, sel atau jaringan rusak. Mediator inflamasi dibagi
dalam beberapa kelompok :
1. Amin vasoaktif : histamin dan serotonin
2. Protein plasma : komplemen kinin, dan sistem pembekuan
3. Metabolit asam arakidonat : prostaglandin, leukotrien, dan lipoksin
4. Platelet-Activating Factor (PAF)
5. Sitokin dan kemokin
6. Nitrogen oksida
7. Konstituen lisosom pada leukosit
8. Radikal bebas yang berasal dari oksigen
Beberapa mediator inflamasi yang penting antara lain :
a) Histamin dan serotonin
Histamin dan serotonin merupakan dua dari beberapa mediator
pertama dalam proses inflamasi. Pelepasan histamin dan serotonin
menyebabkan vasodilatasi dan peningkatan permeabilitas vaskular.
Kedua mediator ini berasal dari sel mast, basofil, dan trombosit.
Beberapa faktor yang mnyebabkan pelepasan amin dari sel mast
adalah sebagai berikut :
1) Adanya agen fisik (trauma atau panas)
2) Reaksi imun yang melibatkan Ig E
3) Fragmen komplemen C3a serta C5a (anafilatoksin)
4) Sitokin (IL 1 dan IL 8)
5) Faktor – faktor pelepasan histamin yang berasal dari leukosit
b) Komplemen C3a dan C5a
C3a dan C5a disebut juga sebagai anafilatoksin. Anfilatoksin
mampu memicu degranulasi pada sel endotelial, mastosit, dan fagosit
yang lebih lanjut memicu respon peradangan. C3a dan C5a merupakan
polipeptida yang berfungsi layaknya sitokin yang hanya dilepaskan
pada area peradangan. C3a dan C5a akan menstimulasi pelepasan
histamin dari sel mast dan dengan demikian terjadi peningkatan
permeabilitas vaskular dan vasodilatasi. C5a juga mengaktifkan
metabolisme arakidonat sehingga terjadi pelepasan mediator inflamasi
tambahan.
c) Bradikinin
Pelepasan bradikinin menyebabkan timbulnya rasa nyeri,
vasodilatasi dan edema / pembengkakan yang terjadi dalam proses
inflamasi. Bradikinin bukan merupakan zat kemotaksis. Bradikinin
dihasilkan dari pemecahan protein plasma kininogen oleh enzim
protease spesifik (kalikrein). Kalikrein juga memiliki aktivitas
d) Prostaglandin
Prostaglandin merupakan golongan asam lemak rantai panjang
turunan dari asam arakidonat dan disintesis oleh berbagai jenis sel.
Prostaglandin dihasilkan melalui jalur siklooksigenase. Terdapat
beberapa jenis prostaglandin antara lain I2 (prostasiklin) dan
prostaglandin E2 yang menyebabkan vasodilatasi. Selain itu
prostaglandin E2 juga dapat meningkatkan sensitivitas terhadap
ransangan nyeri dan dapat memediasi demam (Richard et al., 2006).
Prostaglandin memiliki sejumlah efek fisiologi dan farmakologi
luas, antara lain terhadap otot polos (dinding pembuluh, rahim,
bronchi, dan lambung – usus), agregasi trombosit, produksi hormon, lipolisis di depot lemak dan SSP. Senyawa ini terbentuk bila membran
sel mengalami kerusakan oleh suatu rangsangan kimiawi, fisik atau
mekanis, maka enzim fosfolipase diaktifkan untuk mengubah
fosfolipida yang terdapat di daerah tersebut menjadi asam arakidonat
yang kemudian sebagiannya diubah oleh enzim siklooksigenase
menjadi asam enderoperoksida dan seterusnya menjadi zat – zat prostaglandin. Bagian lain dari arakidonat diubah oleh enzim
lipoksigenase menjadi zat – zat leukotrien (Tjay dan Rahardja, 2007).
e) TNF dan IL-1
TNF dan IL-1 merupakan sitokin utama yang memediasi
inflamasi. Kedua sitokin ini terutama diproduksi oleh sel – sel makrofag aktif. Kerjanya yang paling penting dalam proses inflamasi
meliputi efek pada endotelium, leukosit, dan induksi reaksi sitemik
fase akut. Sekresi TNF dan IL-1 distimulasi oleh endotoksin,
kompleks imun, toksin, jejas fisik, dan berbagai produk inflamasi.
TNF dan IL-1 menginduksi aktivasi endotel yang meliputi induksi
molekul adhesi endotel dan mediator kimia (sitokin lainnya seperti
IL-6, IL-8, faktor pembunuhan, PGI2 PAF, dan nitrit oksida). Kedua
IL-1 dan TNF menginduksi respon fase akut sistemik yang
menyertai infeksi atau jejas seperti demam, anoreksia, letargi,
neutrofilia, pelepasan kortikotropin, serta kortikosteroid, dan efek
hemodinamik akibat oleh syok septik-hipotensi, penurunan resitensi
vaskular, peningkatan frekuensi jantung serta asidosis.
Gambar 7. Berbagai efek utama yang ditimbulkan oleh IL-1 dan TNF pada inflamasi [ Sumber : Richard, 2006 ]
Produk bakteri, kompleks imun, toksin, jejas fisik, sitokin
lainnya
AKTIVASI MAKROFAG
(dan sel lainnya)
IL-1 / TNF
Reaksi Fase Akut
Demam, tidur, selera makan, protein fase akut meningkat, efek hemodinamik (syok), neutrofilia
Efek Endotelial
Daya rekat leukosit, sintesis PGI, aktivitas prokoagulan
meningkat, aktivitas
antikoagulan menurun, 1, IL-8, IL-16, PDGF meningkat
Efek Fibroblas
Poliferasi, sintesis kolagen, kolagenase, protease, sintesis PGE meningkat
Efek Leukosit
Gambar 8. Pelepasan mediator inflamasi oleh sel mast [ Sumber : Elsevier, 2002 ]
2.5 Obat Anti Inflamasi
2.6.1 Obat Anti Inflamasi Steroid
Kortikosteroid seperti deksametason, prednison, prednisolon
seringkali digunakan sebagai obat anti inflamasi. Kelompok obat ini dapat
mengendalikan anti inflamasi dengan menekan atau mencegah banyak
komponen dari proses inflamasi pada tempat cedera. Kortikosteroid
disintesis secara alami di korteks adrenal dan merupakan hasil biosintesis
dari kolestrol. Mekanisme kerja anti inflamasi steroid adalah menghambat
2.6.2 Obat Anti Inflamasi Non Steroid
Obat – obat yang termasuk dalam ini adalah indometasin, asam mefenanmat, asam salisilat, ibuprofen, diklofenak, dan fenilbutazon
(Gilman, 2008). Kerja utama kebanyakan non steroidal anti inflammatory
drugs (NSAID) adalah sebagai penghambat sintesis prostaglandin, dimana
enzim-enzim seperti siklooksigenase dapat merubah asam arakidonat
menjadi prostaglandin dan tromboksan.
2.6 Uji Anti Inflamasi Metode Stabilisasi Membran Eritrosit
Berbagai metode dapat digunakan untuk menguji aktivitas anti
inflamasi dari suatu obat, kandungan kimia, maupun herbal. Metode yang
dapat dilakukan secara in vivo antara lain pembentukan edema buatan,
eritema, iritasi dengan panas, pembentukan kantung granuloma, iritasi
pleura, dan penumpukan kristal sinovitis (Vogel, 2002 & Turner, 1965).
Selain itu, metode in vitro juga dapat dilakukan untuk menguji aktivitas
anti inflamasi, antara lain pelepasan fosforilasi oksidatif (ATP),
menghambat denaturasi protein, stabilisasi membran eritrosit, stabilisasi
membran lisosomal, pengujian fibrinolitik, dan agregasi platelet (Oyedapo
et al., 2010).
Sel darah merah manusia (eritrosit) telah digunakan sebagai suatu
model untuk mempelajari interaksi antara obat dan membran. Obat–obatan seperti anastetik transquiliser dan obat anti inflamasi non steroid dapat
menstabilkan eritrosit untuk melawan terjadinya haemolisis hipotonik pada
konsentrasi rendah. Ketika sel darah merah mengalami stress hipotonik,
pelepasan hemoglobin (Hb) dari sel darah merah dapat dicegah oleh agen
anti inflamasi (Kumar, 2011).
Membran sel darah merah merupakan analog dari membran
lisosomal. Enzim lisosomal yang dilepaskan selama inflamasi
menyebabkan berbagai gangguan pada jaringan, kerusakan makromolekul,
dan peroksidasi lipid yang dianggap dapat bertanggung jawab pada kondisi
artritis, dan lain – lain. Aktivitas ekstraseluler dari enzim ini dianggap berhubungan pada inflamasi akut dan kronik (Chippada et al., 2011).
Stabilisasi dari membran lisosomal merupakan hal yang sangat
penting pada respon inflamasi dengan menghambat pelepasan konstituen
lisosomal dari aktivasi neutrofil seperti enzim bakterisidal dan protease
yang dapat menyebabkan peradangan pada jaringan dan kerusakan selama
extra celluler release (Kumar et al., 2011).
Kerusakan pada membran lisosomal biasanya memicu pelepasan
fosfolipase A2 yang menyebabkan hidrolisis fosfolipid untuk
memproduksi mediator inflamasi. Stabilisasi pada membran sel ini
menghambat lisis dan pelepasan isi dari sitoplasma yang ikut membatasi
kerusakan jaringan dan eksaserbasi dari respon inflamasi. Oleh karena itu,
diharapkan senyawa dengan aktivitas penstabil membran dapat
memberikan perlindungan secara signifikan pada membran sel dalam
melawan pelepasan zat – zat penyebab luka (Karunanithi, 2012).
2.7 Spektrofotometer UV-Vis
Spektrofotometer UV-VIS yang terdiri dari dua komponen utama
yaitu spektrometer dan fotometer. Spektrometer menghasilkan spektra
panjang gelombang tertentu, sedangkan fotometer merupakan alat
pengukur intensitas cahaya yang ditransmisikan atau diabsorpsi.
Spektrofotometer UV-VIS digunakan untuk mengukur energi secara relatif
bila energi tersebut ditransmisikan, direfleksikan, atau diemisikan sebagai
fungsi dari panjang gelombang. Sedangkan spektrofotometri adalah suatu
metode yang didasarkan pada pengukuran energi cahaya tampak (visibel)
atau cahaya untraviolet (UV) oleh suatu senyawa sebagai fungsi panjang
gelombang (Day & Underwood, 2002).
2.8.1 Prinsip Dasar
dipancarkan sebanding dengan bertambahnya tebal dan kepekatan media
(Day & Underwood, 2002).
Keterangan: A = Absorbansi sampel
a = Absorbtivitas molar
b = Tebal kuvet
c = Konsentrasi sampel
2.8.2 Instrumentasi
Spektrofotometer UV-VIS pada umumnya tersusun dari dua
komponen, yaitu spektrometer (mengukur dan menghasilkan spektra
dengan panjang gelombang tertentu atau sinar monokromatis) dan
fotometer (pengukur daya kuat sinar monokromatis yang ditransmisikan
atau diabsorpsi) (Day & Underwood, 2002).
Berikut ini skema instrumentasi Spektrofotometer UV-VIS :
Gambar 9. Skema Instrumentasi Spektrofotometer UV-VIS [ Sumber : Day & Underwood, 2002 ]
a. Sumber Cahaya
Sumber cahaya mempunyai fungsi untuk memberikan energi pada
daerah panjang gelombang yang tepat untuk pengukuran dan
mempertahankan intensitas cahaya yang tetap selama pengukuran.
diatas 375 nm, sedangkan spektrofotometer UV menggunakan lampu
deuterium (D2) memiliki λ dibawah 375 nm. Sumber cahaya pada spektrofotometer dibagi menjadi tiga bagian :
Sumber cahaya visibel dengan lampu Wolfram atau lampu Tungsten
Sumber cahaya UV dengan lampu deuterium (D2) atau lampu
hidrogen
Sumber cahaya inframerah dengan lampu Nernst atau lampu
Glowen (Day & Underwood, 2002).
b. Monokromator
Monokromator adalah suatu alat yang berfungsi untuk mengubah
cahaya polikromatik menjadi cahaya monokromatik yang kemudian
dilewatkan pada celah sempit atau slit agar memungkinkan pemisahan
panjang gelombang yang diukur. Beberapa monokromator yang biasa
digunakan adalah prisma dan grating (Willard et al., 1988).
c. Kuvet
Kuvet adalah tempat disimpannya larutan contoh yang akan diukur
serapannya yang diletakkan pada jalan cahaya dari minokromator. Pada
saat cahaya monokromatis melalui kuvet, terjadi penyerapan sejumlah
tertentu cahaya, sedangkan sebagian lainnya diteruskan ke detektor (Day
& Underwood, 2002). Kuvet visibel dan UV yang khas mempunyai
panjang lintasan 1 cm, ada juga yang mempunyai ketebalan 0,1 cm
sampai 10 cm atau bahkan lebih (Willard et al., 1988).
d. Detektor
Detektor berfungsi untuk mengubah energi cahaya yang
ditransmisikan atau diteruskan oleh kuvet, yang jatuh mengenainya
menjadi suatu besaran yang terukur. Detektor yang ideal harus mempunyai
kepekaan tinggi, dan responnya stabil pada daerah panjang gelombang
e. Rekorder
Rekorder merupakan bagian akhir dalam alat ini. Sinyal listrik yang
dihasilkan pada detektor dapat dibaca pada rekorder dengan
mengkonversikannya ke dalam besaran absorban atau %T (Day &
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai Bulan Maret hingga Bulan Mei 2015
di Laboratorium Penelitian I, Laboratorium Penelitian II, Laboratorium
Farmakognosi dan Fitokimia, Laboratorium Kimia Obat dan Laboratorium
Formulasi Sediaan Steril FKIK UIN Syarif Hidayatullah Jakarta.
3.2 Bahan dan Alat 3.2.1 Bahan Uji
Bahan uji yang digunakan adalah buah parijoto (Medinilla speciosa
Blume) dengan spesifikasi warna merah muda keunguan dan rasa asam
sepat yang berasal dari Desa Colo, Kabupaten Kudus, Jawa Tengah. Bahan
selanjutnya yang digunakan adalah sel darah merah yang diisolasi dari
whole blood (darah lengkap) yang masih segar dengan batas kadaluarsa 30
hari. Darah yang digunakan adalah golongan darah B dan diperoleh dari
PMI (Palang Merah Indonesia) DKI Jakarta. Sel darah merah yang
dibutuhkan untuk uji ini adalah sel darah yang belum mengalami lisis.
3.2.2 Bahan Kimia
Etanol 70%, kloroform, asam sulfat (H2SO4), pereaksi Dragendorff,
pereaksi Mayer, asam klorida (HCl), aquades, natrium klorida (NaCl), feri
klorida (FeCl3), amoniak (NH3), dinatrium hydrogen posfat dihidrat
(Na2HPO4. 2H2O), natrium dihidrogen posfat monohidrat (NaH2PO4.
H2O), natrium hidroksida (NaOH), natrium diklofenak (PT. Indofarma).
3.2.3 Alat
Alat yang digunakan dalam penelitian ini terdiri dari peralatan gelas
standar, tabung gelap, mikropipet Mettler Toledo 200 µL, mikropipet
Mettler Toledo 1000 µL, neraca analitik, vacuum rotary evaporator,
sentrifugator, tabung sentrifus, autoklaf, spuit, pH meter, vortex,
mikrotips, dan termometer.
3.3 Prosedur Kerja 3.3.1 Determinasi
Buah parijoto (Medinilla speciosa Blume) yang digunakan pada
penelitian ini dilakukan determinasi terlebih dahulu di Herbarium
Bogoriense LIPI Bogor untuk menentukan apakah buah yang digunakan
pada penelitian ini benar jenis Medinilla speciosa Blume, suku
Melastomaceae, Parijoto.
3.3.2 Penyiapan Bahan
Buah parijoto (Medinilla speciosa Blume) yang digunakan pada
penelitian ini diambil pada Bulan Desember 2014 dari Desa Colo,
Kabupaten Kudus, Jawa Tengah. Buah parijoto disortasi untuk dipisahkan
dari kotoran-kotoran atau bahan-bahan asing sehingga dapat mengurangi
jumlah pengotor yang ikut terbawa dalam bahan uji, kemudian dicuci
dengan air mengalir dan dikering anginkan hingga tidak terdapat sisa air.
Buah segar yang telah didapatkan kemudian dihaluskan dengan blender
dan dilakukan ekstraksi.
3.3.3 Pembuatan Ekstrak
Buah segar parijoto (Medinilla speciosa Blume) yang telah
dihaluskan dimaserasi dengan etanol 70% selama 48 jam, dan dilakukan
secara terus menerus hingga hasil maserasi atau maserat yang diperoleh
hampir jernih. Hasil maserasi kemudian diuapkan dengan menggunakan
alat vacuum rotary evaporator pada suhu 400C hingga didapatkan ekstrak
kental dengan kadar air kurang dari 10% yang merupakan ekstrak kasar.
3.3.4 Penapisan Fitokimia
Penapisan fitokimia dilakukan terhadap ekstrak kasar yang telah
flavonoid, saponin, tanin, glikosida, dan terpenoid. Berikut prosedur
masing-masing pengujian.
I. Identifikasi senyawa alkaloid
Ekstrak ditimbang 10 mg, lalu ditambahkan 10 mL kloroform diaduk
rata. Campuran disaring dan dimasukkan kedalam tabung reaksi,
kemudian ditambahkan 0,5 mL H2SO4 1 M dan dikocok baik-baik,
dibiarkan beberapa saat. Lapisan atas yang jernih dipipet kedalam 2
tabung reaksi kecil. Salah satunya diberikan pereaksi Dragendorff dan
tabung lainnya pereaksi Mayer 2-3 tetes. Reaksi positif apabila
menunjukkan endapan kuning jingga (orange) dengan pereaksi
Drogendorf dan endapan putih dengan pereaksi Mayer (Guevara, 1985
dalam Wachidah, 2013).
II. Identifikasi Senyawa Flavonoid
Ekstrak parijoto ditetesi dengan larutan NaOH. Adanya perubahan
menjadi warna kuning dan ketika ditambahkan larutan asam warna
menjadi pudar menunjukkan hasil positif adanya flavonoid (Tiwari et al.,
2011).
III. Identifikasi Senyawa Saponin
Uji Forth
Ekstrak ditimbang 10 mg, lalu ditambahkan 10 ml air panas.
Selanjutnya dikocok kuat selama 10 detik, akan terbentuk buih yang
mantap setinggi 1-10 cm selama 10 menit. Kemudian ditambahkan 1 tetes
HCl 2N dan diamati (Guevera, 1985 dalam Wachidah, 2013).
IV. Identifikasi Senyawa Tanin
0,5 g ekstrak direbus dalam 10 mL air dalam tabung reaksi dan
disaring, kemudian ditambahkan beberapa tetes FeCl3 0,1% dan diamati,
positif jika terbentuk warna hijau kecoklatan atau biru kehitaman (Ayoola
V. Identifikasi Senyawa Glikosida
Metode Keller-Killiani
Ekstrak sebanyak 10 mg ditambahkan 3 ml pereaksi FeCl3 kemudian
diaduk dan dipindahkan ke dalam tabung reaksi. Diteteskan 1 ml larutan
asam sulfat pekat melalui dinding tabung reaksi. Biarkan campuran
beberapa lama sehingga terbentuk warna merah kecoklatan, yang mungkin
berubah menjadi biru atau lembayung. Perubahan tersebut menunjukkan
reaksi positif terhadap 2-deoksi-gula (Guevera, 1985 dalam Wachidah,
2013).
VI. Identifikasi Terpenoid
Sebanyak 0,5 g ekstrak ditimbang kemudian ditambahkan 2 ml
kloroform. Sebanyak 3 ml H2SO4 ditambahkan dengan hati-hati untuk
membentuk lapisan. Perubahan warna menjadi coklat kemerahan yang
terdapat pada antar lapisan mengindikasikan adanya terpenoid (Ayoola et
al., 2008).
3.3.5 Pengamatan Organoleptis
Organoleptis ekstrak dinyatakan melalui pengamatan dengan panca
indera, mendeskripsikan bentuk, warna, bau, dan rasa ekstrak (Departemen
Kesehatan Republik Indonesia, 2000).
3.3.6 Uji Kadar Air
Parameter non spesifik kadar air dilakukan terhadap ekstrak kasar.
Ekstrak ditimbang sebanyak 1 gram dalam wadah yang telah ditara.
Kemudian dikeringkan pada suhu 1050C selama lima jam dan ditimbang.
Pengeringan dilanjutkan dan ditimbang pada jarak satu jam sampai
3.3.7 Uji Aktivitas Anti Inflamasi Metode Stabilisasi Membran Eritrosit 3.3.7.1 Pembuatan Larutan yang Dibutuhkan
a. Pembuatan Dapar Posfat (0,15 M pH 7,4)
Sebanyak 2,67 gram dinatrium hidrogen posfat dihidrat (Na2HPO4.
2H2O) dilarutkan dalam 100 mL aquades. Kemudian sebanyak 2,07 gram
natrium dihidrogen posfat monohidrat (NaH2PO4. H2O) dilarutkan dalam
100 mL aquades. Kemudian 81 mL larutan Na2HPO4. 2H2O (0,15 M)
dicampurkan dengan 19 mL NaH2PO4. H2O (0,15 M) pada suhu ruang
(Ruzin, 1999). Kemudian disterilisasi menggunakan autoklaf 1210C.
b. Pembuatan Larutan Isosalin
Sebanyak 0,85 gram NaCl dilarutkan dalam dapar posfat 0,15 M pH
7,4 kemudian di add hingga volumenya 100 mL (Kumar et al., 2011 dan
Oyedapo et al., 2010). Kemudian disterilisasi menggunakan autoklaf
1210C selama 15 menit.
c. Pembuatan Larutan Hiposalin
Sebanyak 0,25 gram NaCl dilarutkan dalam dapar posfat 0,15 M pH
7,4 kemudian di add hingga volumenya 100 mL (Kumar et al., 2011 dan
Oyedapo et al., 2010). Kemudian disterilisasi menggunakan autoklaf
1210C selama 15 menit.
d. Penyiapan Konsentrasi Sampel Uji dan Natrium Diklofenak
Sebanyak 500 mg ekstrak dilarutkan dalam 5 mL etanol 70% lalu
diencerkan dengan isosalin sampai 50 mL (10000 ppm) pada suhu ruang,
selanjutnya encerkan larutan tersebut menjadi 50, 100, 500, dan 1000 ppm,
masing – masing seri konsentrasi dibuat triplo. Kemudian 5 mg natrium diklofenak dilarutkan dalam 1 mL etanol 70% lalu diencerkan dengan



![Gambar 2. Reaksi Uji Mayer [ Sumber : Marliana, 2005 ]](https://thumb-ap.123doks.com/thumbv2/123dok/774439.460682/22.595.123.514.76.522/gambar-reaksi-uji-mayer-sumber-marliana.webp)
![Gambar 3. Reaksi Uji Dragendorff [ Sumber : Marliana, 2005 ]](https://thumb-ap.123doks.com/thumbv2/123dok/774439.460682/23.595.132.513.178.675/gambar-reaksi-uji-dragendorff-sumber-marliana.webp)
![Gambar 7. Berbagai efek utama yang ditimbulkan oleh IL-1 dan TNF pada inflamasi [ Sumber : Richard, 2006 ]](https://thumb-ap.123doks.com/thumbv2/123dok/774439.460682/39.595.131.508.191.605/gambar-berbagai-efek-utama-ditimbulkan-inflamasi-sumber-richard.webp)
![Gambar 8. Pelepasan mediator inflamasi oleh sel mast [ Sumber : Elsevier, 2002 ]](https://thumb-ap.123doks.com/thumbv2/123dok/774439.460682/40.595.98.528.108.548/gambar-pelepasan-mediator-inflamasi-oleh-mast-sumber-elsevier.webp)
![Gambar 9. Skema Instrumentasi Spektrofotometer UV-VIS [ Sumber : Day & Underwood, 2002 ]](https://thumb-ap.123doks.com/thumbv2/123dok/774439.460682/43.595.120.509.135.598/gambar-skema-instrumentasi-spektrofotometer-vis-sumber-day-underwood.webp)
