SELEKSI BAKTERI KITINOLITIK ASAL TANAH
JAMBI SEBAGAI BIOKONTROL
Colletotrichum capsici
GABY MAULIDA NURDIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Seleksi Bakteri Kitinolitik Asal Tanah Jambi sebagai Biokontrol Colletotrichum capsici adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor
Bogor, September 2015
Gaby Maulida Nurdin
RINGKASAN
GABY MAULIDA NURDIN. Seleksi Bakteri Kitinolitik Asal Tanah Jambi sebagai Biokontrol Colletotrichum capsici. Dibimbing oleh NISA RACHMANIA MUBARIK dan LISDAR I SUDIRMAN.
Colletotrichum capsici merupakan salah satu cendawan patogen penyebab antraknosa pada cabai. Infeksi antraknosa dapat menyebabkan kerugian hasil panen sekitar 50-100%. Salah satu alternatif yang dapat digunakan untuk menghambat pertumbuhan C. capsici ialah dengan menggunakan bakteri kitinolitik. Kitin yang terdapat pada dinding sel cendawan dapat dihidrolisis oleh enzim kitinase yang berasal dari bakteri kitinolitik. Kitinase menghidrolisa polimer kitin pada cendawan menjadi monomer N-asetilglukosamin. Tujuan penelitian ini adalah menseleksi bakteri kitinolitik asal tanah Jambi berdasarkan indeks kitinolitik dan kemampuannya menghambat pertumbuhan C. capsici.
Sebagai tambahan dilakukan identifikasi secara molekuler dari isolat kitinolitik terpilih dan karakterisasi kitinase ekstraseluler. Enzim kitinase dari bakteri terpilih selanjutnya digunakan untuk menghambat pertumbuhan C. capsici.
Berdasarkan hasil penyeleksian diperoleh dua isolat terbaik berdasarkan kemampuannya mendegradasi kitin dan penghambatannya terhadap C. capsici.
Isolat KAHN 15.12 teridentifikasi sebagai Serratia marcescens dan SAHA 12.12 sebagai Bacillus thuringiensis berdasarkan gen 16S rRNA. Aktivitas spesifik kitinase tertinggi isolat KAHN 15.12 sebesar 52.03 U/mg pada jam ke-36 inkubasi dan SAHA 12.12 sebesar 45.67 U/mg pada jam ke-24 inkubasi. Pemekatan kedua isolat dilakukan dengan menggunakan amonium sulfat (b/v). Aktivitas kitinase hasil pengendapan memiliki aktivitas yang lebih tinggi dari kitinase ekstrak kasar. Hasil pemekatan menunjukkan bahwa kitinase KAHN 15.12 mengendap pada konsentrasi 40% dengan kemurnian enzimnya meningkat sebesar 1.92 kali dibandingkan aktivitas enzim kasarnya dengan perolehan sebesar 1.47 %. Isolat SAHA 12.12 mengendap pada konsentrasi 60% dan kemurnian enzim sebesar 3.14 kali dengan perolehan sebesar 1.47 %.
Kitinase KAHN 15.12 hasil pengendapan memiliki aktivitas optimum pada pH 7 dan pada suhu 60 oC. Kitinase SAHA 12.12 hasil pengendapan memiliki aktivitas optimum pada pH 8 dan pada suhu 40 oC. Kitinase ini stabil pada suhu optimum selama 180 menit. Hasil pemisahan protein dengan SDS-PAGE menunjukkan bahwa bobot molekul dari hasil pengendapan SAHA 12.12 ialah 109.13, 75.99, 61.79, 52.91, dan 43.03 kDa. Analisis zimogram menunjukkan satu protein yang memiliki aktivitas kitinase dengan bobot molekul sebesar 52.91 kDa. Enzim hasil pengendapan SAHA 12.12 memiliki 2 pita dengan bobot molekul 80.02 dan 68.51 kDa. Kedua bobot molekul tersebut
memiliki aktivitas kitinase. Hasil uji penghambatan secara in vitro terhadap
C. capsici menunjukkan bahwa enzim ekstrak kasar dan hasil pengendapan kedua isolat memiliki efektivitas penghambatan terhadap C. capsici. Hasil tersebut mengindikasikan bahwa kitinase isolat tersebut dapat digunakan sebagai agens biokontrol untuk pengendalian antraknosa pada cabai.
SUMMARY
GABY MAULIDA NURDIN. Selection of Chitinolityc Bacteria from Jambi Soil as Biological Control of Colletotrichum capsici. Supervised by NISA RACHMANIA MUBARIK and LISDAR I SUDIRMAN.
Colletotrichum capsici is one of fungi that cause anthracnose in chilli plants.
Anthracnose infection was reported cause of yield losses of up to 50% and 100%. One alternative is to use biological control derived from chitinolytic bacteria. Chitin is found in the cell walls of fungi can be hydrolyzed by the enzyme chitinase derived from chitinolytic bacteria. Chitinase hydrolyze the polymer of chitin into monomers of N-acetylglucosamine. The objectives of this study were to screen chitinolytic bacteria isolated from soil of Taman Nasional Bukit Duabelas, Jambi, Indonesia. Isolates were selected based on chitinolytic index and antagonism activity of C. capsici. In addition, some steps were done, i.e. molecular identification of selected isolates and characterization. Chitinase enzyme from selected isolates investigated for its growth inhibition of C. capsici.
Two chitinolytic bacteria were selected based on their ability to degrade colloidal chitin and inhibit of the growth of C. capsici. Those isolates were KAHN 15.12 and SAHA 12.12, identified as Serratia marcescens and Bacillus thuringiensis respectively based on 16S rRNA gene. The chitinase maximum specific activity of isolate KAHN 15.12 was 52.03 U/mg after 36 hours of incubation and SAHA 12.12 was 45.67 U/mg after 24 hours of incubation. The enzyme was precipitated by ammonium sulfate (w/v). The activity of precipitated chitinase was higher than activity of crude extract of chitinase. The results showed that the concentration of chitinase KAHN 15.12 was precipitated in 40% ammonium sulfate increase 1.92 fold higher than the specific activity with a yield of 1.47%. Isolate SAHA 12.12 was precipitated in 60% ammonium sulfate and the activity increase up to 3.14 fold with a yield of 1.47%.
The optimum pH and temperature of precipitate KAHN 15.12 were pH 7.0 and 60 ° C. Precipitate SAHA 12.12 showed optimum activity at pH 8.0 with optimum temperature at 40 ⁰C. Both chitinases were relatively stable at maximum pH and temperature up to 180 min of incubation. The result of SDS-PAGE showed S. marcescens KAHN 15.12 was estimated 109.13, 75.99, 61.79, 52.91 and 43.03 kDa respectively. Zymogram analysis showed one protein molecule which had chitinase activity with molecular weight of 52.91 kDa. Precipitate SAHA 12.12 was detected with molecular mass of 80.02 and 68.51 kDa moreover the both molecular mass have chitinase activity. The results of inhibition against
C. capsici via in vitro showed the crude enzyme and chitinases were effective as biocontrol of C. capsici. So, the enzyme was effective as biological control for anthracnose in chilli.
Keywords: Biological control, Chitinase, Chitinolytic bacteria, Colletotrichum capsici
©
Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
GABY MAULIDA NURDIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2014 hingga Mei 2015 ini ialah Seleksi Bakteri Kitinolitik Asal Tanah Jambi sebagai Biokontrol
Colletotrichum capsici.
Terima kasih penulis ucapkan kepada Ibu Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Prof Dr Lisdar I Sudirman selaku anggota komisi pembimbing yang telah memberikan bimbingan, petunjuk, motivasi dan arahan dalam penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Suryani, MSc dan Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Terima kasih kepada DIKTI melalui Beasiswa BPPDN (Beasiswa Program Pascasarjana Dalam Negeri) 2013/2014 atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB.
Ungkapan terima kasih juga disampaikan kepada ayahanda Nurdin Nonci, SPd, ibunda Fathia, SPdi, kakanda Erpi Nurdin, SSi, MKes, adinda Mar’ie Muh. Nurdin, dan Fathul Muh. Nurdin serta seluruh keluargaku atas segala doa, dukungan, dan kasih sayangnya. Penulis juga mengucapkan terima kasih kepada Dr Widodo, MSi dan pihak IPBCC yang telah memberikan bantuan berupa isolat kepada penulis, Ibu Heni dan Bapak Jaka selaku teknisi Laboratorium Mikrobiologi IPB, Ibu Ika, Mas Asril, Mas Sipriadi, Azizah, Nisalicious 2013, Susi, Putri, Daya, Meryani, Ayu, Phika, Gita, serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih juga penulis ucapkan kepada seluruh dosen dan staf Departemen Biologi IPB, terkhusus program studi Mikrobiologi atas ilmu, arahan, dan semangat yang diberikan selama menempuh pendidikan Magister. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
Gaby Maulida Nurdin
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
Bakteri Kitinolitik 2
Enzim Kitinase 3
Kitin 4
Colletotrichum capsici 4
3 METODE 5
Kerangka Penelitian 5
Bahan 7
Waktu dan Tempat Penelitian 7
Peremajaan Bakteri dan Colletotrichum capsici 7
Seleksi Bakteri Kitinolitik 7
Identifikasi Molekuler Bakteri Terpilih 8
Patogenisitas dan Identifikasi Colletotrichum capsici 8 Pertumbuhan Sel Bakteri dan Produksi Enzim Kitinase 9 Pengukuran Aktivitas Enzim Kitinase dari Isolat Bakteri Terpilih 9
Penentuan Kadar Protein 9
Pemekatan dan Karakterisasi Enzim Kitinase 10
SDS-PAGE dan Zimogram 10
Pengaruh Kitinase terhadap Colletotrichum capsici 11
Lisis Dinding Sel dengan Enzim Kitinase 11
4 HASIL DAN PEMBAHASAN 12
Hasil 12
Seleksi Bakteri Kitinolitik dan Indeks Kitinolitiknya 12
Identifikasi Molekuler Isolat SAHA 12.12 13
Patogenisitas dan Identifikasi Colletotrichum capsici 13 Pertumbuhan Sel Bakteri dan Aktivitas Kitinase dari Isolat KAHN
15.12 dan SAHA 12.12 14
Kitinase Hasil Pemekatan 15
Karakterisasi Enzim Kitinase 16
SDS-PAGE dan Zimogram 17
Pengaruh Kitinase terhadap Colletotrichum capsici 18
Lisis Dinding Sel dengan Enzim Kitinase 19
Pembahasan 20
DAFTAR PUSTAKA 23
LAMPIRAN 28
DAFTAR TABEL
1 Seleksi bakteri dari 5 isolat asal tanah perkebunan di Taman Nasional
Bukit Duabelas, Jambi, Indonesia 12
2 Hasil pengendapan protein kitinase KAHN 15.12 dan SAHA 12.12 16
DAFTAR GAMBAR
1 Jalur degrdadasi kitin secara enzimatik 3
2 Struktur kitin 4
3 Morfologi cendawan Colletotrichum capsici 5
4 Diagram alir penelitian 6
5 Hasil pewarnaan Gram Isolat KAHN 15.12 dan SAHA 12.12 12 6 Hasil elektroforesis amplifikasi gen 16S rRNA isolat SAHA 12.12 13 7 Konstruksi pohon filogenetik SAHA 12.12 berdasarkan gen 16S rRNA 13 8 Pengamatan makroskopis Colletotrichum capsici 14 9 Pengamatan mikroskopis Colletotrichum capsici 14 10 Pertumbuhan sel dan aktivitas kitinase pada media NB yang dimodifikasi
dengan koloidal kitin 0.3% 15
11 Pengaruh penambahan konsentrasi amonium sulfat terhadap pengendapan
kitinase 15
12 Karakterisasi enzim ekstrak kasar dan hasil pengendapan enzim isolat
KAHN 15.12 dan SAHA 12.12 berdasarkan pH dan suhu 16 13 Stabilitas enzim pada suhu dan pH optimum selama 180 menit isolat
KAHN 15.12 dan SAHA 12.12 17
14 SDS PAGE dan zimogram kitinase KAHN 15.12 dan SAHA 12.12 18 15 Efektivitas penghambatan kitinase KAHN 15.12 dan SAHA 12.12
terhadap Colletotrichum capsici pada media PDA setelah 7 hari inkubasi 18 16 Persentase penghambatan kitinase KAHN 15.12 dan SAHA 12.12
terhadap Colletotrichum capsici pada media PDA setelah 7 hari inkubasi 19 17 Kadar NAG yang dibebaskan selama terjadinya lisis dinding sel
Colletotrichum capsici setelah penambahan enzim kitinase 20
DAFTAR LAMPIRAN
1 Seleksi bakteri kitinolitik asal tanah perkebunan Jambi berdasarkan indeks kitinolitik dan penghambatan terhadap Colletotrichum capsici 28 2 Urutan nukleotida hasil sekuen gen 16S rRNA isolat SAHA 12.12 29 3 Hasil BLAST-N sekuen gen 16S rRNA dengan data GenBank isolat
SAHA 12.12 29
4 Metode pengujian aktivitas kitinase (Toharisman et al. 2005 dengan
modifikasi) 32
6 Kurva standar isolat KAHN 15.12 dan SAHA 12.12 34 7 Penghitungan bobot molekul kitinase KAHN 15.12 dan SAHA 12.12 35 8 Kurva standar N-asetilglukosamin (NAG) yang direaksikan dengan
reagens dinitrosalycilic acid (DNS) 36
1
PENDAHULUAN
Latar Belakang
Kitin adalah polimer linier yang tersusun oleh monomer -1.4-N-asetil-D-glukosamin (GlcNac) yang merupakan salah satu senyawa paling melimpah di alam setelah selulosa. Kitin memiliki distribusi spektrum yang luas seperti kulit crustaseae, eksoskeleton serangga (25-58%), dan dinding sel cendawan sekitar 22-40% (Gohel et al. 2006; Mukherjee dan Sen 2006). Degradasi kitin oleh enzim kitinase terjadi melalui dua tahapan, yaitu endokitinase (EC 3.2.1.14) menghidrolisis secara acak dengan memutuskan ikatan -1.4-glikosida, dan eksokitinase (EC 3.2.1.52) menghidrolisis kitin dari ujung nonreduksi (Toharisman et al. 2005). Kitinase dilaporkan memainkan peran protektif terhadap cendawan patogen karena kemampuan untuk menyerang dinding sel cendawan secara langsung. Kitinase melepaskan oligo-N-asetilglukosamin yang berfungsi sebagai elisitor untuk aktivasi respon pertahanan pada sel inang (Gohel et al.
2006).
Colletotrichum capsici merupakan salah satu jenis cendawan penyebab antraknosa pada tanaman cabai (Amusa et al. 2004). Cendawan ini dilaporkan menyerang berbagai jenis tanaman dan dapat menginfeksi cabang, ranting, daun, dan buah di lapangan maupun setelah panen (Shenoy et al. 2007). Gejala antraknosa dapat ditemukan adanya bercak konsentris dengan bintik-bintik hitam yang merupakan aservulus di permukaan buah, dan adanya jaringan nekrotik pada batang, daun, dan buah (Shenoy et al. 2007; Than et al. 2008). Antraknosa merupakan masalah pada produksi tanaman perkebunan di sebagian besar wilayah yang menyebabkan kehilangan hasil yang cukup besar hingga 50 % (Pakdeevaraporn et al. 2004). Infeksi antraknosa dilaporkan di India, Amerika Utara dan Afrika tropis yang menyebabkan penurunan buah cabai sebesar 50%
dan 100 % (Amusa et al. 2004), sedangkan di Indonesia dapat mencapai 10% - 80% di musim hujan dan 2% - 35% di musim kemarau (Widodo 2007).
Upaya pengendalian terhadap penyakit antraknosa hingga saat ini masih menggunakan pestisida sintetis. Tetapi pengendalian tersebut dapat menyebabkan beberapa masalah, antara lain terjadinya polusi terhadap lingkungan, perkembangan resistensi dan berbahaya untuk organisme (Chang et al. 2003; Gohel et al. 2006). Salah satu alternatif yang dapat digunakan sebagai pengendali penyakit tanaman ialah dengan menggunakan agens biologi yang berasal dari bakteri kitinolitik. Bakteri tersebut merupakan bakteri yang dapat mendegradasi kitin yang terdapat pada dinding sel cendawan karena kemampuannya memproduksi enzim kitinase (Merzendorfer 2013; Han et al. 2014). Beberapa genus bakteri kitinolitik berasal dari Bacillus, Aeromonas, Vibrio, Enterobacter, Serratia, dan Pseudomonas (Thompson et al. 2001).
Seleksi isolat merupakan tahap awal pemilihan biokontrol. Beberapa antagonis dari bakteri kitinolitik telah banyak dilaporkan aktivitas penghambatannya terhadap beberapa cendawan patogen (Zarei et al. 2011; Asril
2
penyeleksian bakteri kitinolitik asal tanah perkebunan Jambi yang telah diisolasi oleh Haryanto (2013) dan memiliki aktivitas penghambatan terhadap cendawan patogen lain. Kitinase yang diperoleh dari bakteri terpilih itulah yang dikarakterisasi dengan harapan dapat meningkatkan aktivitas penghambatannya dan dapat diaplikasikan sebagai agens biokontrol.
Tujuan Penelitian
Tujuan penelitian ini yaitu menyeleksi bakteri kitinolitik asal tanah perkebunan Jambi berdasarkan kemampuannya menghambat pertumbuhan cendawan Colletotrichum capsici. Sebagai tambahan, dilakukan identifikasi secara molekuler dari isolat terpilih, dan karakterisasi enzim kitinase untuk meningkatkan penghambatan terhadap C. capsici.
Manfaat Penelitian
Manfaat dari hasil penelitian ini yaitu dapat memberikan informasi mengenai potensi isolat kitinolotik asal tanah perkebunan Jambi sebagai agens biokontrol untuk menghambat pertumbuhan Colletotrichum capsici penyebab penyakit antraknosa pada tanaman cabai.
2
TINJAUAN PUSTAKA
Bakteri Kitinolitik
Enzim kitinase pada bakteri merupakan enzim ekstraseluler untuk pengambilan nutrisi dan parasitisme. Bakteri memproduksi enzim kitinase untuk mendegradasi kitin sehingga memperoleh N-asetilglukosamin sebagai sumber nutrisi berupa karbon dan nitrogen untuk proses metabolisme bakteri hingga menghasilkan energi, CO2, H2O, dan NH3 (Thompson et al. 2001). Bakteri
kitinolitik sudah diketahui secara luas dapat digunakan sebagai penghambat pertumbuhan cendawan dan lebih dari itu, digunakan untuk mengontrol penyakit tanaman yang disebabkan oleh cendawan. Enzim yang dapat mendegradasi kitin adalah kitinase atau enzim kitinolitik. Organisme yang dapat mendegradasi kitin tersebar luas di alam, termasuk organisme yang tidak memiliki kitin seperti bakteri, virus, tumbuhan tingkat tinggi, dan hewan yang memiliki peran penting dalam fisiologi dan ekologi. Mikrob mendegradasi kitin dengan mensekresikan enzim yang memiliki spesifitas tertentu untuk menghidrolisis kitin menjadi monomer N-asetilglukosamin (Matsumoto 2006).
Beberapa genus bakteri yang mampu menghasilkan enzim kitinolitik menurut Thompson et al. (2001) ialah Aeromonas, Bacillus, Enterobacter, Pseudomonas, dan Serratia. Beberapa bakteri lain yang diketahui mampu
menghasilkan enzim kitinolitik ialah Chromobacterium violaceum (Chernin
3
Paenibacillus (Han et al. 2014), Clostridium aminovalericum (Simunek et al.
2004), dan Xanthomonas (Gohel et al. 2006). Bakteri kitinolitik digunakan sebagai bioinsektisida dan biofungisida yang dapat menghambat pertumbuhan cendawan patogen, seperti yang dilaporkan oleh Vivekanathan et al. (2003) bahwa Pseudomonas dan Bacillus dapat menekan secara efektif penyakit antraknosa yang disebabkan Colletotrichum pada mangga dengan menginduksi enzim kitinase dan beberapa enzim hidrolitik lainnya.
Enzim Kitinase
Kitinase (EC 3.2.1.14) merupakan enzim yang mampu menghidrolisa polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin yang terjadi secara sinergis dan berurutan (Patil et al. 2000). Enzim ini dihasilkan oleh bakteri, fungi, tanaman, dan hewan. Berdasarkan cara kerjanya, kitinase dibedakan menjadi 2 kelompok utama, yaitu endokitinase dan eksokitinase. Endokitinase memotong polimer kitin secara acak menghasilkan dimer, trimer, tetramer atau oligomer kitin. Eksokitinase memotong kitin hanya dari ujung non reduksi. Bila hasil potongan berupa monomer maka enzim tersebut dinamakan N-asetilheksosaminidase, namun bila potongan yang dihasilkan berupa dimer maka enzim tersebut disebut sitobiosidase (Cohen dan Chet 1998).
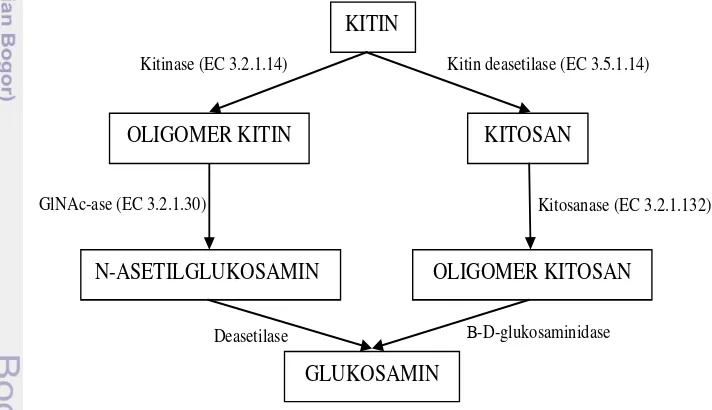
Gambar 1 Jalur degradasi kitin secara enzimatik (Gooday 1994)
Jalur degradasi kitin di alam terdiri atas 2 jalur yaitu jalur pertama diawali dengan hidrolisis ikatan -1.4 glikosida. Ikatan tersebut diputus oleh enzim endokitinase sehingga terbentuk oligomer kitin. Selanjutnya oligomer kitin dipecah menjadi N-asetilglukosamin (kitibiosa) oleh kitobiosidase hingga dihasilkan monomer N-asetilglukosamin (GlcNAc) oleh N-asetilglukosaminidase (kitibiosa). Monomer GlcNAc kemudian mengalami deasetilasi menjadi glukosamin oleh enzim N-asetilglukosamin-deasetilase. Jalur degradasi kitin lainnya adalah deasetilasi kitin menjadi kitosan oleh enzim kitin-deasetilase.
KITIN
KITOSAN
N-ASETILGLUKOSAMIN OLIGOMER KITIN
GLUKOSAMIN
OLIGOMER KITOSAN
Kitinase (EC 3.2.1.14) Kitin deasetilase (EC 3.5.1.14)
GlNAc-ase (EC 3.2.1.30) Kitosanase (EC 3.2.1.132)
4
Kitosanase akan mendegradasi kitosan menjadi oligomer kitosan. Oligomer kitosan selanjutnya akan didegradasi menjadi glukosamin oleh glukosaminidase (Gooday 1994).
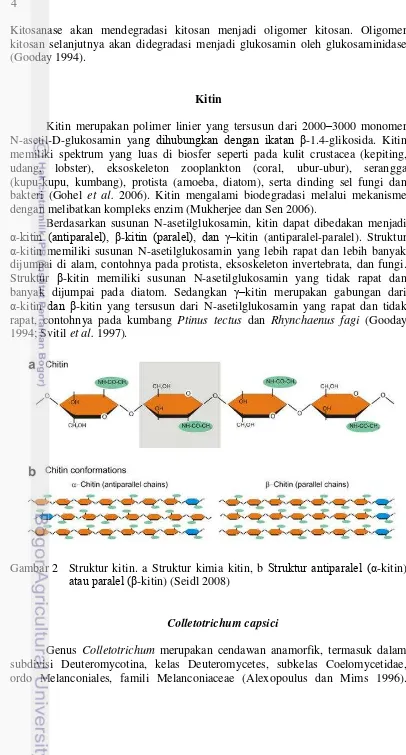
Kitin
Kitin merupakan polimer linier yang tersusun dari 2000–3000 monomer N-asetil-D-glukosamin yang dihubungkan dengan ikatan -1.4-glikosida. Kitin memiliki spektrum yang luas di biosfer seperti pada kulit crustacea (kepiting,
udang, lobster), eksoskeleton zooplankton (coral, ubur-ubur), serangga (kupu-kupu, kumbang), protista (amoeba, diatom), serta dinding sel fungi dan
bakteri (Gohel et al. 2006). Kitin mengalami biodegradasi melalui mekanisme dengan melibatkan kompleks enzim (Mukherjee dan Sen 2006).
Berdasarkan susunan N-asetilglukosamin, kitin dapat dibedakan menjadi α-kitin (antiparalel), -kitin (paralel), dan –kitin (antiparalel-paralel). Struktur α-kitin memiliki susunan N-asetilglukosamin yang lebih rapat dan lebih banyak dijumpai di alam, contohnya pada protista, eksoskeleton invertebrata, dan fungi. Struktur -kitin memiliki susunan N-asetilglukosamin yang tidak rapat dan
banyak dijumpai pada diatom. Sedangkan –kitin merupakan gabungan dari α-kitin dan -kitin yang tersusun dari N-asetilglukosamin yang rapat dan tidak
rapat, contohnya pada kumbang Ptinus tectus dan Rhynchaenus fagi (Gooday 1994; Svitil et al. 1997).
Gambar 2 Struktur kitin. a Struktur kimia kitin, b Struktur antiparalel (α-kitin) atau paralel ( -kitin) (Seidl 2008)
Colletotrichum capsici
5 Beberapa spesies dari Colletotrichum dapat menyebabkan penyakit antraknosa pada tanaman cabai antara lain C. gloeosporioides, C. acutatum, C. dematium, dan C. capsici yang dapat menyebabkan kerugian sekitar 50 - 100% (Amusa et al.
2004; Pakdeevaraporn et al. 2004). Lebih dari 90% antraknosa yang menginfeksi cabai diakibatkan oleh C. capsici (Syukur 2007).
Cendawan Colletotrichum dapat menyerang tanaman terutama pada musim hujan dengan kelembaban udara yang tinggi. Pada cuaca yang lembab cendawan memproduksi banyak konidia untuk perkecambahan pada permukaan tanaman. Cendawan Colletotrichum dapat bertahan hidup pada inangnya yang terinfeksi ataupun di dalam tanah (Bergstrom dan Nicholson 1999). Gejala antraknosa diawali berupa bintik-bintik kecil yang berwarna kehitaman dan sedikit melekuk. Serangan yang lebih lanjut mengakibatkan buah mengerut, kering, membusuk dan jatuh. Pertumbuhan awal cendawan C. capsici membentuk koloni miselium yang berwarna coklat keabu-abuan dengan miselium yang timbul di permukaan menyerupai kapas (Shenoy et al. 2007). Kemudian secara perlahan-lahan berubah menjadi hitam dan akhirnya membentuk aservulus yang merupakan massa konidia. Secara morfologi C. capsici memiliki aservulus berwarna coklat kehitaman, berdiameter 198-486 µm dengan rata-rata 278.5 µm. Seta berwarna cokelat tua, bersepta, silindris dan berukuran 70.0-120.3 x 2.5-5.1 µm. Konidia hialin, berbentuk bengkok seperti sabit, bersel tunggal, tidak bersekat, dan rata-rata panjang dan lebar konidia bervariasi berkisar 22.5-35.0 µm x 2.5-3.75 µm.
Apresoria berbentuk bulat, berwarna kecoklatan dengan ukuran 9-14 µm x 6.5-11.5 µm (Sangdee et al. 2011; Chai et al. 2014).
Gambar 3 Morfologi cendawan Colletotrichum capsici. (a) Gejala antraknosa pada buah cabai, (b) koloni C. capsici pada media PDA berumur 7 hari, (c) aservulus dengan seta, (d) konidia (Nayaka et al. 2009; Amalia 2013)
3
METODE
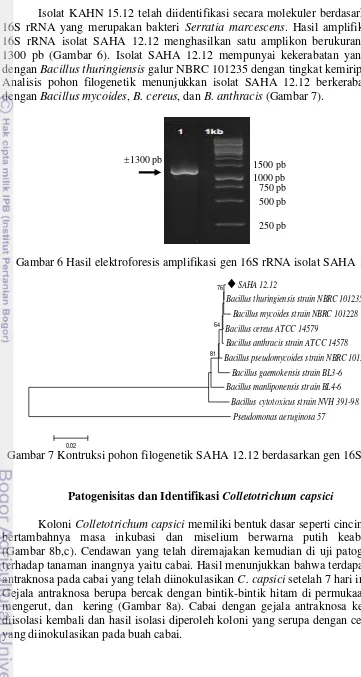
Kerangka Penelitian
Kerangka penelitian meliputi seleksi bakteri kitinolitik berdasarkan indeks kitinolitik dan aktivitas penghambatannya terhadap Colletotrichum capsici. Isolat yang telah diseleksi kemudian digunakan untuk identifikasi secara molekuler, isolasi, pengendapan enzim dengan ammonium sulfat, dan karakterisasi kitinase
ekstraseluler yang selanjutnya akan diuji kembali penghambatannya terhadap
C. capsici (Gambar 4).
(b)
6
Gambar 4 Diagram alir penelitian Identifikasi Molekuler
gen 16S rRNA
Uji Antagonis terhadap
Colletotrichum capsici
Peremajaan dan Seleksi Isolat Kitinolitik
Indeks Kitinolik
Pertumbuhan Sel Bakteri
Penentuan pH dan Suhu Optimum serta
Stabilitasnya
Pemekatan Enzim dengan Amonium
Sulfat
Elektroforesis SDS-PAGE dan Zimogram
Hasil Pengendapan
Lisis Dinding Sel Cendawan menggunakan kitinase
Uji Patogenesitas
dan Identifikasi
C. capsici
isolat yang digunakan
Isolat Terpilih
Produksi Enzim
Kurva Tumbuh Bakteri
ENZIM EKSTRAK KASAR
Uji Penghambatan terhadap C. capsici
Penentuan pH dan Suhu Optimum serta Stabilitasnya
Uji Penghambatan terhadap
7 Bahan
Bahan yang digunakan ialah 30 isolat bakteri yang sebelumnya diisolasi dari tanah perkebunan sawit dan karet di Taman Nasional Bukit Duabelas, Jambi, Indonesia (Haryanto 2013), serta cendawan patogen Colletotrichum capsici KMP 1533 penyebab antraknosa (koleksi Dr Widodo, MSi , Bagian Hama dan Penyakit Tanaman, Fakultas Pertanian, Institut Pertanian Bogor).
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2014 sampai Mei 2015 di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB).
Peremajaan Bakteri dan Colletotrichum capsici
Media yang digunakan untuk penyegaran kultur bakteri kitinolitik asal tanah perkebunan Jambi yaitu media kitin agar 0.3%. Satu ose biakan bakteri diinokulasikan kedalam media kitin agar (K2HPO4 0.1%, MgSO4.7H2O 0.01%,
NaCl 0.1%, koloidal kitin 0.3%, ekstrak yeast 0.1%, agar-agar 1.5%) kemudian diinkubasi pada suhu 37 °C selama 24 – 48 jam. Cendawan patogen C. capsici
diremajakan pada media Potato Dextrose Agar (PDA) dan diinkubasi selama 7 hari hingga tumbuh miselium pada permukaan PDA.
Seleksi Bakteri Kitinolitik
Sebanyak 30 isolat bakteri kitinolitik asal tanah perkebunan Jambi yang telah diremajakan, kemudian diseleksi berdasarkan indeks kitinolitik dan aktivitas penghambatannya terhadap cendawan patogen C. capsici. Bakteri yang telah diseleksi, kemudian dilakukan pengamatan morfologi dan pewarnaan Gram maupun endospora untuk bakteri Gram positif.
Penghitungan Indeks Kitinolitik
Penghitungan aktivitas kitinase menggunakan metode Tahtamouni et al.
(2006) dengan modifikasi. Isolat bakteri ditumbuhkan pada media Nutrient Broth
(NB) dengan penambahan koloidal kitin 1%. Sebanyak 25 µl dari masing-masing kultur bakteri diteteskan pada media kitin agar. Pengujian untuk setiap isolat dilakukan tiga ulangan dan diinkubasi pada suhu 37 °C selama 4 hari. Lebar zona bening menunjukan indeks kitinolitik dari masing-masing isolat. Penghitungan berdasarkan persamaan ∆Y=Y2-Y1/Y1 x 100% (∆Y= besarnya indeks kitinolitik,
Y2= diameter zona bening, dan Y1= diameter koloni).
Uji Antagonis terhadap Cendawan Colletotrichum capsici
8
Colletrothicum capsici. Potongan agar C. capsici yang berdiameter 10 mm dipindahkan ke dalam media PDA dengan jarak 3 cm dari tepi cawan petri (Fokkema 1973) dan diinkubasi selama 3 hari. Bakteri antagonis kemudian digores ke cawan petri yang sudah mengandung miselium dan diinkubasi kembali. Sisi miselium tanpa inokulasi bakteri dianggap sebagai kontrol negatif, dan sisi yang terdapat antagonis dianggap sebagai perlakuan. Persentase penghambatan
C.capsici dapat dikur dengan menggunakan rumus [100% x (r1-r2)/r1], dengan r1
ialah panjang pertumbuhan miselium ke arah pinggir petri tanpa inokulasi bakteri (3 cm) dan r2 ialah panjang miselium ke arah bakteri antagonis.
Identifikasi Molekuler Bakteri Terpilih
Isolasi DNA genom untuk identifikasi molekuler dilakukan dengan metode Cetyl Trimethylammonium Bromide (CTAB). DNA genom yang diperoleh digunakan untuk mengamplifikasi gen 16S rRNA dengan menggunakan mesin
Polymerase Chain Reaction (PCR). Primer yang digunakan ialah primer spesifik untuk prokariot, 6γf (5’-CAG GCC TAA CAC ATG CAA GTC-γ’) dan 1γ87r (5’-GGG CGG WGT GTA CAA GGC-γ’) (Marchesi et al. 1998). Komposisi reaksi PCR terdiri atas dengan total volume reaksi 50 µl yang mengandung 25 µl
Go Taq Green Master Mix 2X, 0.8 µl DNA templat, 0.5 µl primer forward (10 pmol), 0.5 µl primer reverse (10 pmol) dan 23.2 µl nuclease free water.
Kondisi PCR yang digunakan yaitu predenaturasi (94 °C, 5 menit), denaturasi (94 °C, 1 menit), annealing (55 °C, 1 menit), elongation (72 °C, 1 menit), dan
post elongation (72 °C, 7 menit) sebanyak 30 siklus. Pemisahan DNA produk PCR dilakukan pada mesin Elektroforesis mini-gel menggunakan agarosa 1% pada tegangan listrik 80 Volt selama 45 menit. Visualisasi DNA dilakukan di atas UV transluminator menggunakan pewarna Etidium Bromida (EtBr). DNA hasil amplifikasi disekuen untuk mengetahui urutan basa nukleotidanya. Urutan basa nukleotida hasil sekuen kemudian disejajarkan dengan data GeneBank menggunakan program BLASTN (Basic Local Alignment Search Tool-Nucleotida) dari situs NCBI (National Center for Biotechnology Information). Analisis filogenetik dilakukan menggunakan program MEGA 6.0 dengan metode
Neighbour Joining (NJ) dengan bootstrap 1000x.
Patogenisitas dan Identifikasi Colletotrichum capsici
9 cabai dan dinyatakan negatif jika koloni yang diperoleh tidak serupa dengan cendawan patogen yang diinokulasikan (Sangdee et al. 2011).
Pertumbuhan Sel Bakteri dan Produksi Enzim Kitinase
Sebanyak 1-2 lup bakteri diinokulasikan ke dalam 50 mL NB yang mengandung koloidal kitin 0.3% dan diinkubasi selama 9 jam pada suhu ruang. Kultur digoyang pada mesin penggoyang dengan kecepatan 120 rpm pada suhu ruang dan diukur hingga mencapai OD 0.6-0.8. Selanjutnya, sebanyak 1 mL inokulum dimasukkan ke dalam medium 100 mL NB yang mengandung koloidal kitin 0.3%, hasil pertumbuhan diukur berdasarkan nilai OD dengan menggunakan spektrofotometer pada panjang gelombang 600 nm setiap 3 jam sampai 72 jam hingga mencapai fase stasioner. Kultur kemudian disentrifugasi pada 8000 rpm (Eppendorf MiniSpin dengan rotor jenis F-45-12-11) selama 15 menit untuk mendapatkan ekstrak enzim kasar secara ekstraseluler yang digunakan untuk pengujian aktivitas enzim dan uji antagonis kembali terhadap cendawan
Colletotrichum capsici. Supernatan yang mengandung ekstrak enzim kasar disaring dengan millipore ukuran 0.22 µm untuk memperoleh kitinase kasar yang steril dan bebas dari sel. Konsentrasi kitinase maksimum yang digunakan dalam uji penghambatan secara in vitro sebesar 60 ppm.
Pengukuran Aktivitas Enzim Kitinase dari Isolat Bakteri Terpilih
Analisis aktivitas kitinase menggunakan substrat koloidal kitin 0.3% berdasarkan metode modifikasi Toharisman et al. (2005) dengan 2 ulangan.
Sebanyak 300 µl koloidal kitin 0.3% ditambahkan 150 µl bufer pH 7 dalam 150 µl ekstrak kasar dan diinkubasi 60 °C selama 30 menit, kemudian
dimasukkan ke dalam air mendidih selama 10 menit. Kontrol dibuat tanpa adanya penambahan substrat koloid kitin, kemudian disentrifugasi 8400 rpm (Eppendorf
MiniSpin dengan rotor jenis F-45-12-11) selama 5 menit. Jumlah N-asetilglukosamin ditentukan dengan mencampurkan 200 µl supernatan
ditambahkan 500 µl akuades dan 1000 µl pereaksi schales (K-Ferrisianida dan Na-Karbonat 0.5 M). Campuran kemudian diukur absorbansinya dengan panjang gelombang 420 nm. Konsentrasi N-asetilglukosamin dihitung berdasarkan kurva standar N-asetilglukosamin (Lampiran 4). Satu unit aktivitas enzim kitinase didefinisikan sebagai jumlah enzim yang dihasilkan oleh 1 µmol produk NAG (N-asetilglukosamin) per menit (Green et al. 2005).
Penentuan Kadar Protein
Kandungan protein pada enzim ekstrak kasar merupakan gambaran kuantitas enzim yang terkandung. Protein terlarut ditetapkan berdasarkan kurva standar bovin serum albumin (Lampiran 5). Kurva standar dibuat dengan metode
10
absorbansi dibaca pada panjang gelombang 595 nm. Sampel diukur dengan cara yang sama dengan mengganti bovin serum albumin dengan ekstrak kasar bakteri yang akan diukur. Kadar protein dapat diketahui berdasarkan kurva standar protein (Bradford 1976).
Pemekatan dan Karakterisasi Enzim Kitinase
Pemekatan enzim dilakukan dengan menggunakan amonium sulfat. Enzim
ekstrak kasar yang diperoleh diendapkan dengan konsentrasi amonium sulfat 10-80% (Scopes 1994). Larutan kemudian disimpan pada suhu 4 °C selama 24
jam dan disentrifugasi pada 10000 rpm (Centrifuge Hermle dengan rotor 220.97)
selama 20 menit pada 4 °C. Protein pelet ditambahkan dengan bufer fosfat (0.1 M) pH 7. Ekstrak enzim kasar dan hasil pengendapan dikarakterisasi pada
kondisi optimum, seperti suhu, pH, dan stabilitas enzim. Penentuan pH optimum
untuk aktivitas kitinase ditentukan oleh pengukuran pada pH yang berbeda (4.0-10.0) menggunakan koloidal kitin sebagai substrat dalam kondisi pengujian
standar. Bufer yang digunakan adalah sebagai berikut: 0.1 M bufer sitrat (pH 4.0-6.0), 0.1 M bufer fosfat (pH 7.0-8.0), dan 0.1 M bufer glisin-NaOH (pH 9.0-10.0). Suhu optimum ditentukan dengan menginkubasi campuran reaksi
pada rentang suhu yang berbeda dari kisaran 20 °C sampai 90 °C dengan interval 10 °C. Selanjutnya dilakukan pengukuran absorbansi aktivitas enzim kitinase pada spektrofotometer dengan panjang gelombang 420 nm. Stabilitas kitinase dilakukan dengan menginkubasi enzim dengan pH dan suhu optimum (Zarei
et al. 2011).
SDS – PAGE dan Zimogram
Sodium Dodecyl Sulfate-Polyacrilamide Gel Elektroforesis (SDS-PAGE) dilakukan dengan metode standar Laemmli (1970). Elektroforesis menggunakan gel poliakrilamid konsentrasi 10% gel pemisah dan 4% gel pengumpul (Lampiran 10). Elektroforesis dilakukan pada 110 V, 50 mA selama 35 menit. Hasil elektroforesis diwarnai oleh Coomasie Brilliant Blue G-250 (CBB G-250)
dan kelebihan warna dihilangkan dengan larutan metanol dan asam asetat (Zarei et al. 2011).
11 Persamaan linier protein penanda diperoleh dengan membuat kurva antara Rf (mobilitas relatif) dan log bobot molekul protein penanda (Lampiran 7).
Pengaruh Kitinase terhadap Colletotrichum capsici
Pengaruh enzim kitinase terhadap Colletotrichum capsici dapat diamati dengan melakukan uji penghambatan secara in vitro dengan metode kultur ganda yang dimodifikasi (Sessitsch et al. 2004). Aktivitas penghambatan diuji dengan
menggunakan enzim ekstrak kasar dan hasil pengendapan enzim. Isolat murni
C. capsici yang berumur 10 hari dipotong dengan diameter 10 mm dan ditumbuhkan pada medium PDA yang telah dicampur dengan enzim pada konsentrasi 20 ppm, 40 ppm, dan 60 ppm secara terpisah. Kontrol yang digunakan yaitu kontrol positif (Kp) berupa isolat yang ditumbuhkan pada medium PDA yang telah dicampur fungisida mankozeb dengan konsentrasi 0.02% (v/v), dan kontrol negatif (Kn) yaitu isolat yang ditumbuhkan pada medium PDA tanpa perlakuan. Tiap perlakuan masing-masing diulang 2 kali. Pengamatan dilakukan setiap hari dengan mengukur pertumbuhan diameter koloni C. capsici
menggunakan penggaris sampai pertumbuhan koloni C. capsici pada kontrol menutup seluruh permukaan media tumbuh. Persentase penghambatan terhadap
cendawan patogen dapat dikur dengan menggunakan persamaan [θkontrol-θperlakuan/θkontrol x 100] (Calvo et al. 2007).
Lisis Dinding Sel dengan Enzim Kitinase
Lisis dinding sel Colletotrichum capsici dilakukan dengan menambahkan larutan enzim kitinase berdasarkan metode Singh et al. (1999). C. capsici
ditumbuhkan pada media Potato Dextrose Broth (PDB) dan diinkubasi pada suhu 30 °C selama 5-7 hari. Miselium yang tumbuh kemudian dihaluskan dengan blender kecepatan rendah selama 5 detik. Miselium yang telah halus selanjutnya disentrifus 5000 rpm (Centrifuge Hermle dengan rotor 220.97) selama 10 menit. Pelet dicuci dengan akuades steril dan ditambahkan dengan 10 mM bufer fosfat (pH 6.8). Larutan dinding sel cendawan ditambahkan dengan larutan enzim kitinase dengan perbandingan 1:1 dan diinkubasi pada suhu 37 °C. Kontrol dilakukan dengan mengganti larutan enzim menjadi akuades steril. Pengukuran
kadar N-asetilglukosamin (NAG) dilakukan setiap 2 jam selama 16 jam. Jumlah N-asetilglukosamin ditentukan dengan pereaksi dinitrosalycilic acid (DNS) dan
diukur absorbansinya dengan panjang gelombang 540 nm (Monreal dan Reese
12
4 HASIL DAN PEMBAHASAN
Hasil
Seleksi Bakteri Kitinolitik dan Indeks Kitinolitiknya
Isolat kitinolitik yang digunakan pada penelitian ini diseleksi berdasarkan aktivitas kitinolitik dan kemampuan penghambatan terhadap cendawan patogen
Colletotrichum capsici. Isolat kitinolitik yang diseleksi berjumlah 30 isolat dan hanya 5 isolat yang mampu menghambat pertumbuhan C. capsici (Lampiran 1). Isolat yang diperoleh, selanjutnya diseleksi kembali aktivitasnya dengan menghitung persentase penghambatan terhadap C. capsici (Tabel 1).
Tabel 1 Seleksi bakteri dari 5 isolat asal tanah perkebunan di Taman Nasional
Berdasarkan hasil penyeleksian diperoleh dua isolat terbaik dengan kode isolat KAHN 15.12 dan SAHA 12.12 yang memiliki aktivitas kitinolitik dan penghambatan yang lebih tinggi dibandingkan dengan isolat lainnya (Tabel 1). Isolat KAHN 15.12 merupakan bakteri Gram negatif dengan bentuk batang pendek, sedangkan SAHA 12.12 merupakan bakteri Gram positif dengan bentuk batang penghasil endospora (Gambar 5).
Isolat KAHN 15.12 menunjukkan indeks kitinolitik tertinggi yaitu dengan indeks kitinolitik (IK) 1.5. Nilai indeks yang terbentuk relatif berbeda dengan SAHA 12.12 yang memiliki indeks kitinolitik sebesar 0.22. Namun, SAHA 12.12 memiliki kemampuan penghambatan terhadap Colletotrichum capsici yang jauh lebih tinggi dibandingkan dengan KAHN 15.12.
Gambar 5 Hasil perwanaan Gram. (a) KAHN 15.12, (b) SAHA 12.12, dan (c) pewarnaan endospora SAHA 12.12 dengan perbesaran 1000x
1 µm 4 µm 4 µm
13 Identifikasi Molekuler Isolat SAHA 12.12
Isolat KAHN 15.12 telah diidentifikasi secara molekuler berdasarkan gen 16S rRNA yang merupakan bakteri Serratia marcescens. Hasil amplifikasi gen 16S rRNA isolat SAHA 12.12 menghasilkan satu amplikon berukuran sekitar 1300 pb (Gambar 6). Isolat SAHA 12.12 mempunyai kekerabatan yang dekat dengan Bacillus thuringiensis galur NBRC 101235 dengan tingkat kemiripan 99%. Analisis pohon filogenetik menunjukkan isolat SAHA 12.12 berkerabat dekat dengan Bacillus mycoides, B.cereus, dan B. anthracis (Gambar 7).
Gambar 6 Hasil elektroforesis amplifikasi gen 16S rRNA isolat SAHA 12.12
Gambar 7 Kontruksi pohon filogenetik SAHA 12.12 berdasarkan gen 16S rRNA
Patogenisitas dan Identifikasi Colletotrichum capsici
Koloni Colletotrichum capsici memiliki bentuk dasar seperti cincin seiring bertambahnya masa inkubasi dan miselium berwarna putih keabu-abuan (Gambar 8b,c). Cendawan yang telah diremajakan kemudian di uji patogenisitas terhadap tanaman inangnya yaitu cabai. Hasil menunjukkan bahwa terdapat gejala antraknosa pada cabai yang telah diinokulasikan C. capsici setelah 7 hari inkubasi. Gejala antraknosa berupa bercak dengan bintik-bintik hitam di permukaan buah, mengerut, dan kering (Gambar 8a). Cabai dengan gejala antraknosa kemudian diisolasi kembali dan hasil isolasi diperoleh koloni yang serupa dengan cendawan yang diinokulasikan pada buah cabai.
1500 pb 1000 pb 750 pb 500 pb
250 pb
SAHA 12.12
Bacillus thuringiensis strain NBRC 101235
Bacillus mycoides strain NBRC 101228
Bacillus cereus ATCC 14579
Bacillus anthracis strain ATCC 14578
Bacillus pseudomycoides strain NBRC 101232
Bacillus gaemokensis strain BL3-6
Bacillus manliponensis strain BL4-6
Bacillus cytotoxicus strain NVH 391-98
Pseudomonas aeruginosa 57
81 64
76
0.02
14
Gambar 8 Pengamatan makroskopis C. capsici. (a) gejala antraknosa pada buah cabai, (b) koloni C. capsici pada media PDA berumur 10 hari bagian permukaan atas, dan (c) permukaan bawah
Pengamatan mikroskopis C. capsici menunjukkan adanya aservulus dengan banyak seta yang berwarna coklat kehitaman, kaku, panjang dan meruncing keatas (Gambar 9b). C. capsici memiliki hifa yang bersepta (Gambar 9c) dan konidia hialin, runcing, berbentuk seperti bulan sabit (lunata), amerospora (tidak memiliki septa), berukuran sekitar 27-30 µm, bersel tunggal, serta mengelompok (Gambar 9d). Hasil tersebut sesuai dengan yang dilaporkan Shenoy
et al. (2007) dan Sangdee et al. (2011) bahwa cendawan C. capsici memiliki konidia hialin, lunata, bersel tunggal, dan bersekat dengan rata-rata panjang dan lebar bervariasi yaitu masing-masing antara 23.5-35.0 µm dan 2.5-3.75 µm.
Gambar 9 Pengamatan mikroskopis C. capsici. (a) seta, (b) aservulus (tanda panah), (c) hifa, dan (d) konidia dengan perbesaran 1000x
Pertumbuhan Sel Bakteri dan Aktivitas Kitinase dari Isolat KAHN 15.12 dan SAHA 12.12
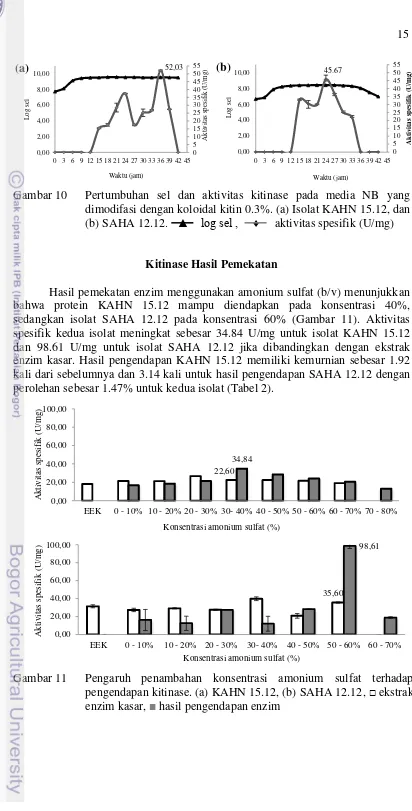
Pengukuran pertumbuhan isolat dan pengujian aktivitas kitinase dilakukan setiap 3 jam selama 42 jam. Isolat diuji pada media NB yang dimodifikasi dengan koloidal kitin 0.3% yang diinkubasi pada suhu 37 °C. Pertumbuhan isolat KAHN 15.12 memiliki jumlah sel tertinggi pada jam ke-9 dengan aktivitas spesifik kitinase tertinggi pada jam ke-36 sebesar 52.03 U/mg dan pertumbuhannya relatif stabil hingga 42 jam setelah inkubasi (Gambar 10). Pertumbuhan isolat SAHA 12.12 mulai meningkat pada 3-12 jam dan relatif stabil hingga 42 jam setelah inkubasi. Aktivitas spesifik kitinase mulai terdeteksi pada 12-36 jam dan aktivitas tertinggi diperoleh pada jam ke-24 inkubasi dengan aktivitas spesifik kitinase sebesar 45.67 U/mg. Setelah 36 jam tidak ditemukan kembali aktivitas kitinase (Gambar 10).
(a) (b) (c) (d)
30 µm
15 dimodifasi dengan koloidal kitin 0.3%. (a) Isolat KAHN 15.12, dan (b) SAHA 12.12. ▲ log sel , ♦ aktivitas spesifik (U/mg)
Kitinase Hasil Pemekatan
Hasil pemekatan enzim menggunakan amonium sulfat (b/v) menunjukkan bahwa protein KAHN 15.12 mampu diendapkan pada konsentrasi 40%, sedangkan isolat SAHA 12.12 pada konsentrasi 60% (Gambar 11). Aktivitas spesifik kedua isolat meningkat sebesar 34.84 U/mg untuk isolat KAHN 15.12 dan 98.61 U/mg untuk isolat SAHA 12.12 jika dibandingkan dengan ekstrak enzim kasar. Hasil pengendapan KAHN 15.12 memiliki kemurnian sebesar 1.92 kali dari sebelumnya dan 3.14 kali untuk hasil pengendapan SAHA 12.12 dengan perolehan sebesar 1.47% untuk kedua isolat (Tabel 2).
Gambar 11 Pengaruh penambahan konsentrasi amonium sulfat terhadap pengendapan kitinase. (a) KAHN 15.12, (b) SAHA 12.12, □ ekstrak enzim kasar, ■hasil pengendapan enzim
16 Tabel 2 Hasil pengendapan protein kitinase KAHN 15.12 dan SAHA 12.12
Kode SAHA 12.12 dikarakterisasi berdasarkan pH, suhu, dan stabilitas enzim terhadap
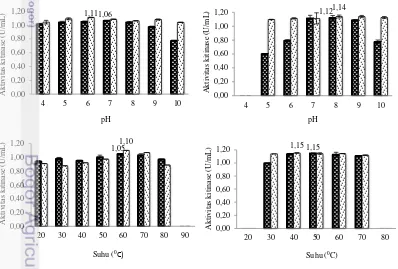
suhu optimumnya. Enzim ekstrak kasar isolat KAHN 15.12 memiliki kisaran pH yang luas antara 4-10 dengan pH optimum pada pH 7 dengan nilai aktivitas sebesar 1.06 U/mL. Kisaran pH pada hasil pengendapan enzim juga tidak berbeda dengan ekstrak enzim kasar dengan pH optimum 6 yang nilai aktivitas enzimnya meningkat sebesar 1.11 U/mL (Gambar 12).
Gambar 12 Karakterisasi enzim ekstrak kasar dan hasil pengendapan enzim Isolat KAHN 15.12 (kiri) dan SAHA 12.12 (kanan) berdasarkan pH (atas) dan suhu (bawah). Keterangan: ■ enzim ekstrak kasar, □ hasil pengendapan enzim
17 Aktivitas kitinase enzim ekstrak kasar dan hasil pengendapan isolat SAHA 12.12 pada kisaran pH 6-9 dengan pH optimum pada pH 8 dengan nilai aktivitas kitinase masing-masing sebesar 1.12 U/mL dan 1.14 U/mL (Gambar 12). Suhu optimum dari kitinase enzim ekstrak kasar memiliki suhu optimum 50 °C yang kemudian terjadi perubahan suhu optimum menjadi 40 °C dengan aktivitas kitinase sebesar 1.15 U/mL setelah pengendapan enzim. Aktivitas kitinase enzim ekstrak kasar dan hasil pengendapan dari isolat KAHN 15.12 memiliki aktivitas optimum yang sama pada suhu 60 °C dengan nilai aktivitas kitinase masing-masing 1.05 U/mL dan 1.10 U/mL (Gambar 12). Enzim kitinase yang diproduksi
oleh kedua isolat ini relatif stabil pada suhu optimumnya selama 180
Hasil pemisahan protein dengan SDS-PAGE menunjukkan bahwa bobot
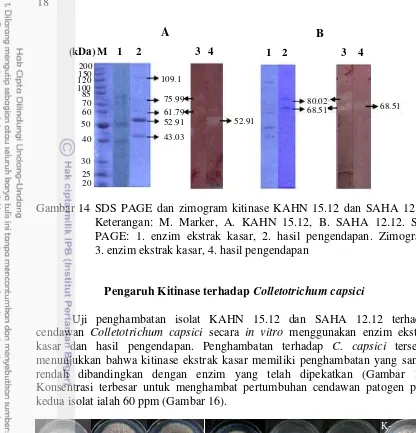
molekul dari enzim ekstrak kasar dan hasil pengendapan bervariasi antara 43 kDa hingga sekitar 109 kDa (Gambar 14). Enzim ekstrak kasar memiliki pita
yang lebih banyak dibandingkan dengan jumlah pita hasil pengendapan. Kitinase KAHN 15.12 dengan pengendapan 40% amonium sulfat memperlihatkan adanya 5 pita dengan bobot molekul yang bervariasi masing-masing sebesar 109.13 kDa, 75.99 kDa, 61.79 kDa, 52.91 kDa, dan 43.03 kDa. Pita dengan ukuran 52.91 kDa memiliki pita yang lebih tebal dibandingkan dengan ukuran pita yang lainnya. Semakin tebal pita hasil elektroforesis menunjukkan bahwa konsentrasi protein semakin tinggi. Sedangkan hasil pengendapan enzim dari isolat SAHA 12.12 memiliki 2 pita dengan bobot molekul 80.02 kDa, dan 68.51 kDa (Gambar 14). Analisis zimogram menunjukkan bahwa hasil pengendapan isolat KAHN 15.12 dan SAHA 12.12 memperlihatkan adanya satu pita yang memiliki aktivitas kitinase yaitu masing-masing sebesar 52.91 kDa dan 68.51 kDa.
18
Gambar 14 SDS PAGE dan zimogram kitinase KAHN 15.12 dan SAHA 12.12. Keterangan: M. Marker, A. KAHN 15.12, B. SAHA 12.12. SDS
PAGE: 1. enzim ekstrak kasar, 2. hasil pengendapan. Zimogram: 3. enzim ekstrak kasar, 4. hasil pengendapan
Pengaruh Kitinase terhadap Colletotrichum capsici
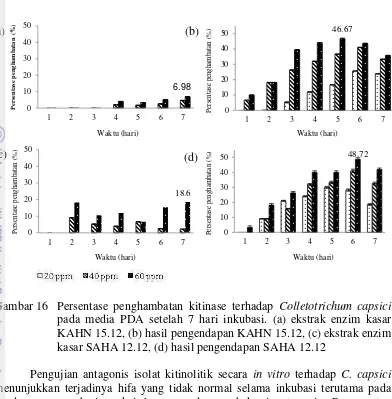
Uji penghambatan isolat KAHN 15.12 dan SAHA 12.12 terhadap cendawan Colletotrichum capsici secara in vitro menggunakan enzim ekstrak kasar dan hasil pengendapan. Penghambatan terhadap C. capsici tersebut menunjukkan bahwa kitinase ekstrak kasar memiliki penghambatan yang sangat rendah dibandingkan dengan enzim yang telah dipekatkan (Gambar 15). Konsentrasi terbesar untuk menghambat pertumbuhan cendawan patogen pada kedua isolat ialah 60 ppm (Gambar 16).
Gambar 15 Efektivitas penghambatan kitinase terhadap Colletotrichum capsici
pada media PDA setelah 7 hari inkubasi. Kitinase KAHN 15.12 (atas) dan kitinase SAHA 12.12 (bawah). Keterangan: A. enzim ekstrak kasar, B. hasil pengendapan, dan C. kontrol
19
Gambar 16 Persentase penghambatan kitinase terhadap Colletotrichum capsici
pada media PDA setelah 7 hari inkubasi. (a) ekstrak enzim kasar KAHN 15.12, (b) hasil pengendapan KAHN 15.12, (c) ekstrak enzim kasar SAHA 12.12, (d) hasil pengendapan SAHA 12.12
Pengujian antagonis isolat kitinolitik secara in vitro terhadap C. capsici
menunjukkan terjadinya hifa yang tidak normal selama inkubasi terutama pada cendawan yang berinteraksi langsung dengan bakteri antagonis. Pengamatan mikroskopis dilakukan untuk melihat perubahan morfologi yang terjadi pada hifa. Hifa yang tidak normal ditandai dengan adanya litik setelah di inokulasikan dengan bakteri. Gejala yang terlihat secara mikroskopis ialah hifa menjadi berkerut, kecil, dan ukurannya menjadi tidak seragam jika dibandingkan dengan kontrol (Lampiran 9).
Lisis Dinding Sel dengan Enzim Kitinase
Peningkatan N-asetilglukosamin (NAG) mengindikasikan kerja dari enzim kitinase terhadap substratnya, yaitu kitin. Enzim kitinase akan memutuskan ikatan -1.4-glikosida yang berikatan dengan N-asetilglukosamin menjadi NAG yang bebas. Lisis pada dinding sel Colletotrichum capsici ditandai dengan meningkatnya jumlah NAG (µg/mL) pada medium. Peningkatan NAG terjadi setelah 2 jam inkubasi pada media yang mengandung miselium C. capsici yang telah ditambahkan kitinase KAHN 15.12 dan SAHA 12.12. Peningkatan NAG tertinggi pada KAHN 15.12 terjadi pada jam ke-8 inkubasi sebanyak 183.5 µg/mL dan SAHA 12.12 terjadi pada jam ke-6 inkubasi sebesar 273 µg/mL, kemudian mengalami penurunan hingga jam ke-16 inkubasi (Gambar 17). Hasil ini sangat
(a) (b)
20
berbeda jika dibandingkan dengan kontrol negatif yang peningkatan NAG-nya yang tidak signifikan. Peningkatan kadar NAG yang dibebaskan cukup membuktikan kerja dari kitinase yang menghidrolisis dinding sel cendawan.
Gambar 17 Kadar N-asetilglukosamin (NAG) yang dibebaskan selama terjadinya lisis dinding sel Colletotrichum capsici setelah penambahan enzim kitinase. Keterangan : kitinase KAHN 15.12, kitinase SAHA 12.12, kontrol negatif
Pembahasan
Seleksi isolat merupakan tahap awal pemilihan biokontrol. Pemilihan dua isolat terpilih dilakukan berdasarkan aktivitas kitinasenya dan penghambatannya terhadap cendawan patogen Colletotrichum capsici. Dari proses penyeleksian terpilih 2 isolat terbaik dengan kode isolat KAHN 15.12 dan SAHA 12.12 yang memiliki aktivitas kitinolitik dan penghambatan terhadap C. capsici yang lebih tinggi dibandingkan dengan isolat lainnya (Tabel 1). Isolat KAHN 15.12 dan SAHA 12.12 memperlihatkan adanya zona bening di sekitar koloni yang mengindikasikan bahwa kedua isolat tersebut mampu memproduksi enzim kitinase (Han et al. 2014). Berdasarkan hasil pengukuran kitinolitik, isolat KAHN 15.12 menunjukkan indeks kitinolitik tertinggi diantara isolat lain yaitu dengan nilai 1.5 yang relatif tinggi dibandingkan dengan isolat SAHA 12.12 yang memiliki indeks kitinolitik sebesar 0.22. Meskipun SAHA 12.12 memiliki indeks kitinolitik yang kecil, namun kemampuan penghambatan terhadap C. capsici jauh lebih besar yaitu 37.5% dibandingkan dengan KAHN 15.12 yang hanya 25%. Ketidaksesuaian zona hambat kitinolitik dengan persentase penghambatan terhadap cendawan patogen membuktikan keduanya tidak saling berhubungan. Aktivitas kitinase yang tinggi tidak selalu berkorelasi dengan kemampuan menghambat pertumbuhan cendawan patogen. Hal ini dapat disebabkan perbedaan struktur pada substrat yang digunakan dan adanya metabolit anticendawan lain yang dapat meningkatkan persentase penghambatan. Struktur kitin pada dinding sel cendawan lebih kompleks dibandingkan dengan koloidal kitin yang digunakan sebagai sumber karbon pada uji aktivitas kitinase, sehingga
21 koloidal kitin yang digunakan sebagai substrat dapat lebih mudah dihidrolisis dibandingkan dengan kitin yang terdapat pada dinding sel cendawan.
Isolat KAHN 15.12 telah diidentifikasi secara molekuler berdasarkan gen 16S rRNA yang merupakan bakteri Serratia marcescens. Hasil amplifikasi gen 16S rRNA isolat SAHA 12.12 mempunyai kekerabatan yang dekat dengan
Baccillus thuringiensis dengan tingkat kemiripan 99% (Gambar 7). Berbagai laporan telah dilaporkan tentang bakteri yang mampu menghasilkan enzim kitinase antara lain Aeromonas, Vibrio, Streptomyces, Bacillus, Enterobacter, Pseudomonas, dan Serratia (Thompson et al. 2001). Analisis gen 16S rRNA dengan sekuen oligonukleotida adalah cara yang efektif untuk mengetahui taksonomi prokariot termasuk bakteri genus Bacillus dan Serratia dan dapat dihubungkan secara langsung dengan data dari pohon filogenetik (Fox et al. 1977).
Isolat KAHN 15.12 dan SAHA 12.12 diukur pertumbuhan sel dan produksi enzim kitinasenya setiap 3 jam selama 42 jam. Peningkatan jumlah sel isolat KAHN 15.12 terjadi dari jam ke-6 hingga jam ke-12 yang tidak diikuti dengan peningkatan produksi enzim kitinase. Aktivitas spesifik kitinase mulai terlihat pada fase stasioner yaitu pada jam ke- 15 hingga jam ke -39 ketika jumlah sel cenderung menurun. Aktivitas spesifik kitinase tertinggi pada isolat KAHN 15.12 terjadi pada jam ke-36 inkubasi dan tidak memiliki aktivitas kitinase setelah 42 jam inkubasi. Produksi enzim kitinase pada fase stasioner juga ditunjukkan oleh isolat SAHA 12.12 yang memproduksi enzim kitinase tertinggi pada jam ke-24 inkubasi dan cenderung menurun seiring bertambahnya masa inkubasi hingga fase kematian (Gambar 10). Peningkatan aktivitas kitinase pada fase stasioner disebabkan oleh menurunnya nutrisi pada media, sehingga kitinase disekresikan dalam jumlah yang tinggi. Fase stasioner yang terbentuk relatif stabil dan panjang. Berbagai laporan menunjukkan bahwa aktivitas kitinase diperoleh pada fase stasioner dengan waktu inkubasi 24 hingga 72 jam (Mubarik et al. 2010; Asril et al. 2014, Han et al. 2014) Menurut Patil et al. (2000), bakteri menghasilkan enzim kitinase secara ekstraseluler untuk pengambilan nutrisi dengan mendegradasi koloidal kitin pada media yang dijadikan sebagai sumber karbon dan nitrogen. Hasil degradasi koloidal kitin oleh enzim kitinase menjadi monomernya berupa GlcNAc akan digunakan oleh bakteri untuk metabolisme lebih lanjut dan hasil metabolismenya tersebut digunakan untuk memacu pertumbuhan bakteri (Thompson et al. 2001).
Enzim ekstrak kasar yang diperoleh dari produksi enzim tertinggi dapat diendapkan dengan menggunakan amonium sulfat (b/v). Larutan yang mengandung konsentrasi garam tinggi, jumlah molekul air dalam larutan akan berkurang sehingga molekul garam yang masih bebas akan menarik air yang berikatan dengan gugus non polar protein enzim. Hal tersebut menyebabkan terbukanya struktur protein sehingga gugus-gugus nonpolar protein akan berkumpul dan mengendap, akibatnya terjadi penurunan kelarutan protein dalam larutan (Scopes 1994). Konsentrasi optimum amonium sulfat yang ditambahkan untuk mengendapkan kitinase dari S. marcescens KAHN 15.12 adalah 40% (b/v) yang mampu meningkatkan kemurnian sebesar 1.92 kali. Sedangkan kitinase dari
22
memiliki tingkat kejenuhan pada kisaran 40% - 80% dan memiliki tingkat optimum pada konsentrasi 60%. Hasil yang diperoleh berbeda dengan penelitian Nawani dan Kapadnis (2001) yaitu tingkat kejenuhan 75% (b/v) amonium sulfat dari S. marcescens NK1. Konsentrasi amonium sulfat pada Bacillus memiliki tingkat konsentrasi yang bervariasi. Kitinase dari B. licheniformis mampu terendapkan dengan penambahan amonium sulfat sebesar 75% (b/v) (Xiao et al.
2009) dan kitinase dari B. brevis diendapkan pada konsentrasi amonium sulfat 50% (b/v) (Sheng et al. 2002).
Karakterisasi kitinase KAHN 15.12 dan SAHA 12.12 memiliki kisaran pH dan suhu yang luas. Aktivitas enzim masing-masing isolat mulai menurun seiring dengan peningkatan rentang pH. Perubahan pH akan menyebabkan ionisasi pada molekul protein berubah. Perubahan ini akan mengakibatkan struktur tiga dimensi protein berubah sehingga fungsi katalitiknya terganggu (Girindra 1993). Selain pH, perubahan suhu juga sangat berpengaruh terhadap aktivitas enzim. Bertambahnya suhu akan mengakibatkan peningkatan aktivitas enzim, tetapi setelah suhu optimum tercapai kenaikan suhu akan menyebabkan aktivitas enzim menurun. Hal ini karena terjadinya denaturasi protein enzim yang dapat membuat enzim menjadi rusak dan terjadi perubahan struktur sisi aktif enzim. Hasil karakteristik yang sama juga dilaporkan pada kitinase dari S. marcescens NK1 yang memiliki kisaran pH dari asam hingga basa dengan pH optimum pada pH 6 dengan suhu optimum kisaran 40-60 oC (Nawani dan Kapadnis 2001), sedangkan untuk Bacillus memiliki kisaran pH 5-8 dan suhu 40-80 oC (Chang et al. 2003).
Analisis bobot molekul protein ekstrak enzim kasar dan hasil pengendapan amonium sulfat dilakukan dengan SDS PAGE. Prinsip dasar metode ini ialah pergerakan molekul protein pada media yang dialiri arus listrik. Molekul protein akan bergerak dari katoda ke anoda, pergerakan molekul protein dipengaruhi oleh ukuran, bentuk, dan muatan elektrik protein tersebut (Koolman dan Roehm 2005). Selain analisis bobot molekul dari protein, dengan dilakukannya analisis SDS PAGE juga dapat menunjukkan tingkat kemurnian protein yang dihasilkan (Barker 1998). Hasil SDS-PAGE dari enzim ekstrak kasar dan hasil pengendapan kitinase S. marcescens KAHN 15.12 dan B. thuringiensis SAHA 12.12 menunjukkan bobot molekul protein yang berada pada kisaran yang luas. Ekstrak enzim kasar memiliki pita yang lebih banyak dibandingkan dengan jumlah pita hasil pengendapan. Hal ini disebabkan masih banyaknya pengotor berupa protein lain pada ekstrak enzim kasar. Perbedaan jumlah pita protein pada hasil analisis SDS PAGE ini menandakan tingkat kemurnian masing-masing protein yang juga
berbeda. Berbagai laporan penelitian menunjukkan bahwa bobot molekul
S. marcescens yang kemudian di konfirmasi dengan zimogram menunjukkan bahwa enzim kitinase S. marcescens memiliki bobot molekul sebesar 22, 35, 52,
54, 58 kDa (Gal et al. 2002) dan 62 kDa (Babashpour et al. 2012), sedangkan
B. thuriengiensis memiliki bobot molekul protein sebesar 32, 47, 60, dan 66 kDa (Thamthiankul et al. 2001). Analisis zimogram pada hasil pengendapan enzim menunjukkan satu pita protein yang mengindikasikan adanya aktivitas kitinase pada kedua isolat.
23 amonium sulfat terjadi peningkatan persentase hambat C. capsici pada konsentrasi 60 ppm. Rendahnya persentase penghambatan pada enzim kasar disebabkan karena enzim yang digunakan belum murni, perbedaan aktivitas kitinase bakteri, komposisi kitin dari dinding sel cendawan yang tidak sesuai dengan kitinase dari bakteri, dan kespesifikan spesies (Liu et al. 2010). Dinding sel cendawan pada umumnya tidak hanya tersusun atas kitin tetapi juga tersusun oleh polisakarida lain, misalnya ß-1.3 glukan yang berikatan dengan kitin sehingga strukturnya lebih kompleks untuk didegradasi (Adams 2004; Gohel et al. 2006). Adanya peningkatan kadar NAG yang dibebaskan setelah penambahan kitinase pada media yang mengandung miselia cendawan, membuktikan kerja kitinase yang dapat menghidrolisis dinding sel cendawan. Hal yang sama dibuktikan oleh Singh
et al. (1999) dan Yurnaliza (2011), dengan menambahkan enzim kitinase dari
Streptomyces sp. pada miselium Fusarium oxysporum juga menyebabkan terjadi peningkatan kadar NAG.
5 SIMPULAN
Isolat Serratia marcescens KAHN 15.12 dan Bacillus thuringiensis SAHA 12.12 berhasil diseleksi berdasarkan indeks kitinolitik dan kemampuannya menghambat pertumbuhan cendawan Colletotrichum capsici. Kitinase KAHN 15.12 dan SAHA 12.12 memiliki kisaran pH dan suhu yang luas, serta stabil pada suhu optimum. Sel maupun kitinase dari kedua isolat berpotensi untuk diaplikasikan sebagai agens biokontrol C. capsici penyebab antraknosa pada cabai.
DAFTAR PUSTAKA
Adams DJ. 2004. Fungal cell wall chitinases and glucanases. Microbiology.
150:2029-2035.doi:10.1099/mic.0.26980-0.
Alexopoulus CJ, Mims CW. 1996. Introductory Micology. Edisi ke-4. New York (US): John Wiley & Son. Inc.
Amalia R. 2013. Keefektifan kitosan dan aktinomiset dalam pencegahan busuk antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby) buah cabai merah [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Amusa NA, Kehinde IA, Adegbite AA. 2004. Pepper fruit anthracnose in the
humid forest region of south-western Nigeria. Nutr Food Sci. 34(3): 130-134.doi:10.1108/00346650410536755.
Asril M, Mubarik NR, Wahyudi AT. 2014. Partial purification of bacterial chitinase as biocontrol of leaf blight disease on oil palm. Res J Microbiol.
9(6):265-277.doi:10.3923/jm.2014.265.277.
Babashpour S, Aminzadeh S, Forrukhi N, Karkhane A, Haghbeen K. 2012. Characterization of chitinase (Chit62) from Serratia marcescens B4A and its efficacy as a bioshield against plant fungal pathogen. Biochem Genet.
50:722-735.doi:10.007/s10528-012-9515-3.
24
Bergstrom GC, Nicholson RL. 1999. The biology of corn anthracnose. Plant Dis.
83(7):596-608.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. J Anal Chem. 72:248-254.
Calvo J, CalventeV, Orellano ME, Benuzzi D, Tosetti MIS. 2007. Biological control of postharvest spoilage caused by Penicillium expansum and
Botrytis cinerea in apple by using the bacterium Rahnella aquatilis. Food Microbiol. 113:251-257.doi:10.1016/j.ijfoodmicro.2006.07.003.
Chai AL, Zhao YJ, Shi YX, Xie XW, Li BJ. 2014. Identification of
Colletotrichum capsici (Syd.) Butler causing anthracnose on pumpkin in China. Can J Plant Pathol. 36(1):121-124.doi:10.1080/ 07060661.2013.878881.
Chang WT, Chen CS, Wang SL. 2003. An antifungal chitinase produced by
Bacillus cereus with shrimp and crab shell powder as a carbon source.
Curr Microbiol. 47:102-108.doi: 10.1007/s00284-002-3955-7.
Chernin L, Ismailov Z, Haran S, Chet I. 1995. Chitinolytic Enterobacter agglomerans antagonistic to fungal plant pathogens. Appl Environ Microbiol. 61(5):1720-1726.doi:0099-2240/95/$04.0010.
Cohen KR, Chet I. 1998. The molecular biology of chitin digestion. Curr Opin Biotechnol. 9:270-277.doi:0958166900900270.
Fokkema NJ. 1973. The role of saprophytic fungi in antagonism against
Drechslera sorokiniana (Helminthosporium sativum) on agar plates and on rye leaves with pollen. Phys Plant Pathol. 3(2):195-205.
Fox GE, Pechan KR, Woese CR. 1977. Comparative cataloging of 16s ribosomal ribonucleic acid.: molecular approach to prokaryotic systematics. J Syst Bacteriol. 27:4-57.
Gal SW, Lee SW, Choi YJ. 2002. Molecular cloning and characterization of 58 kDa chitinase gene from Serratia marcescens KCTC 2172. Biotechnol Bioproc Eng. 7:38-42.
Girindra A. 1993. Biokimia I. Jakarta (ID): PT Gramedia Pustaka.
Gohel V, Singh A, Vimal M, Ashwini P, Chatpar HS. 2006. Bioprospecting and
antifungal potential of chitinolytic microorganisms. Afr J Biotechnol. 5:54-72.ISSN: 1684–5315.
Gooday GW. 1994. Physiology of microbial degradation of chitin and chitosan. Di dalam: Ratledge C, editor. Biochemistry of Microbial Degradation.
Dordrecht (NL): Kluwer Academic Publ. hlm 279-312.
Green AT, Healy MG, Healy A. 2005. Production of chitinolytic by Serratia marcascens QMB1466 using various chitinous substrates. J Chem Technol Biotechnol. 80(1):28-34.doi:10.1002/jctb.1145.
HanKI, Patnaik BB,Cho AR, Lim HK, Lee JM, Jang YG, Jeong YS, YooTK, Lee GS, Han MD. 2014. Characterization of chitinase-producing Serratia and
Bacillus strains isolated from insects. Entomol Res. 44:109-120. doi:10.1111/1748-5967.12056.
25 Koolman J, Roehm KH. 2005. Atlas of Biochemistry. Edisi ke-2. New York (US):
Thieme.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227:680–685.
Liu ZH, Yang CP, Qi XT, Xiu LL, Wang YC. 2010. Cloning, heterologous expression, and functional characterization of a chitinase gene, Lbchi32, from Limonium bicolor. Biochem Genet. 48:669– 679.doi:10.1007/s10528-010-9348-x.
Marchesi JR, Sato T, Weigtman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Design and evaluation of usefull bacteria spesific PCR primers that amplify genes coding for bacteria 16S rRNA. Appl Environ Microbiol. 64(2):795-799.doi: 0099-2240/98/$04.00+0.
Matsumoto KS. 2006. Fungal chitinases. Advences in agricultural and food biotecnology. Res Singpost. 2:289-304.
Merzendorfer H. 2013. Insect-derived chitinases. Adv Biochem Eng Biotechnol. 136:19–50.doi:10.1007/10_2013_207.
Monreal J, Reese ET. 1968. The chitinase of Serratia mercescens. J Microbiol.
15:689-696.
Mubarik NR, Mahagiani I, Anindyaputri A, Santoso S, Rusmana I. 2010. Chitinolytic bacteria isolated from chilli rhizosphere: chitinase characterization and its application as biocontrol for whitefly (Bemisia tabaci Genn.). Am J Agric Biol Sci. 5(4):430-435.
Mukherjee G, Sen SK. 2006. Purification, characterization, and antifungal activity of chitinase from Streptomyces venezuelae P10. Curr Microbiol. 53:265– 269.doi:10.1007/s00284-005-0412-4.
Nawani NN, Kapadnis BP. 2001. One-step purification of chitinase from Serratia mercescens NK1, a soil isolate. J Appl Microbiol. 90: 803-808.
Nayaka SC, Shankar ACU, Niranjana SR, Prakash HS, Mortenses CN. 2009.
Antrachnose disease of chilli pepper [bibliografi]. Karnataka (IN): AsSHC.
Pakdeevaraporn P, Wasee S, Taylor PWJ, Mongkolporn O. 2004. Inheritance of resistance to anthracnose caused by Colletotrichum capsici in capsicum.
Plant Breeding. 124:206-208.
Patil RS, Ghormade V, Deshpande MV. 2000. Chitinolytic enzymes: an exploration. Enzyme Microbiol Technol. 26:473-483.
Sangdee A, Sachan S, Khankhum S. 2011. Morphological, pathological andmolecular variability of Colletotrichum capsici causing anthracnose of chilliin the North-east of Thailand. Afr J Microbiol Res. 5(25):4368-4372. doi:10.5897/AJMR11.476.
Scopes RK. 1994. Protein Purification, Principles and Practice. Edisi ke-3. New York (US): Springer-Verlag.
Seidl V. 2008 Chitinases of filamentous fungi: a large group of diverse proteins with multiple physiological functions. Fungal Biol Rev. 22(1):36–42. doi:10.1016/j.fbr.2008.03.002.