EKSTRAKSI, KARAKTERISASI, DAN UJI AKTIVITAS
FOTOPROTEKTOR PIGMEN KAPANG ENDOFIT ASAL
TUMBUHAN PESISIR SARANG SEMUT
MADA TRIANDALA SIBERO
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Ekstraksi, Karakterisasi, dan Uji Aktivitas Fotoprotektor Pigmen Kapang Endofit Asal Tumbuhan Pesisir Sarang Semut adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
ABSTRAK
MADA TRIANDALA SIBERO. Ekstraksi, Karakterisasi dan Uji Aktivitas Fotoprotektor Pigmen Kapang Endofit Asal Tumbuhan Pesisir Sarang Semut. Dibimbing oleh KUSTIARIYAH TARMAN dan NOVRIYANDI HANIF.
Kapang endofit RS3 diisolasi dari tumbuhan epifit sarang semut (Hydnophytum formicarum) menghasilkan metabolit sekunder berupa pigmen ekstraseluler berwarna hitam. Penelitian ini bertujuan mengekstrak, mengkarakterisasi dan mengetahui aktivitas fotoprotektor yang dimiliki pigmen ekstraseluler kapang RS3. Penelitian ini terdiri atas beberapa tahap, yakni penentuan larutan pengendap yang tepat untuk pengendapan, ekstraksi, analisis kualitatif dan karakterisasi melanin, analisis nilai Sun Protection Factor (SPF) dan toksisitas menggunakan metode Brine Shrimp Lethality Test (BSLT). Hasil menunjukkan bahwa pigmen dapat diendapkan menggunakan pelarut asam pada pH ≤ 2,5 dan menunjukkan hasil yang sesuai pada analisis kualitatif melanin. Berdasarkan analisis FTIR dan UV-Vis, pigmen yang dihasilkan oleh RS3 diduga adalah eumelanin memiliki spektra UV pada panjang gelombang UV-A (367,8 nm dan 350,0 nm), UV-B (317,2 nm) dan UV-C (271,6 nm; 266,8 nm; 264,0 nm; 260,8 nm; 223,6 nm) serta memiliki gugus fungsi seperti hidroksi, cincin aromatik, gugus fenol, dan amina. Toksisitas pigmen ekstraseluler kapang RS3 sebesar 557,95 µg/mL. Hasil analisis fotoprotektor menggunakan metode SPF menunjukkan nilai 11,33.
Kata kunci: endofit, eumelanin, pigmen, SPF, toksisitas
ABSTRACT
MADA TRIANDALA SIBERO. Extraction, Characterization, and Photoprotector
Activity Analysis of Endophytic Mold’s Pigment from Coastal Plant Sarang Semut. Supervised by KUSTIARIYAH TARMAN and NOVRIYANDI HANIF.
Endophytic fungus RS3 isolated from epiphytic plant sarang semut (Hydnophytumformicarum) produced extracellular black pigment as a secondary metabolite. The research aimed to extract melanin pigment from RS3, characterize and analyze SPF activity of the pigment. This research consisted of several steps that were determination of precipitation solvent, extraction, qualitative analysis, and melanin characterization, SPF analysis, phytochemistry analysis and toxicity analysis using Brine Shrimp Lethality Test (BSLT) method. The result showed that the pigment could be extracted in the acid solvent with pH ≤ 2.5 and showed positive in melanin qualitative analysis. According to FTIR and UV-Vis analyses, pigment from RS3 was proposed to be eumelanin possessing UV-Vis spectrum at UV-A (367.8 nm and 350.0 nm), UV-B (317.2 nm) and UV-C (271.6 nm; 266.8 nm; 264.0 nm; 260.8 nm; 223.6 nm). It has also several functional groups such as hydroxy, aromatic, phenol, and amine. The level of toxicity was 557.951 µg/mL. The fotoprotector value using SPF method was 11.33.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
EKSTRAKSI, KARAKTERISASI DAN UJI AKTIVITAS
FOTOPROTEKTOR PIGMEN KAPANG ENDOFIT ASAL
TUMBUHAN PESISIR SARANG SEMUT
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Ekstraksi, Karakterisasi dan Uji Aktivitas Fotoprotektor Pigmen Kapang Endofit Asal Tumbuhan Pesisir Sarang Semut
Nama : Mada Triandala Sibero
NIM : C34110007
Disetujui oleh
Dr Kustiariyah Tarman SPi MSi Pembimbing I
Novriyandi Hanif SSi MSc DSc Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2014 ini ialah Ekstraksi, Karakterisasi dan Uji Aktivitas Fotoprotektor Pigmen Kapang Endofit Asal Tumbuhan Pesisir Sarang Semut.
Terima kasih penulis ucapkan kepada Ibu Dr Kustiariyah Tarman, S.Pi, M.Si dan Bapak Novriyandi Hanif, S.Si, M.Sc, D.Sc selaku pembimbing yang memberikan banyak bantuan serta pengarahan selama proses penelitian dan penulisan. Terima kasih juga diucapkan kepada Ibu Prof. Dr. Ir. Linawati Hardjito selaku penguji yang memberikan masukan kepada penulis. Ungkapan terima kasih juga disampaikan kepada Bapak, Mamak Br. Sembiring (Almh.) dan Mamak Br. Peranginangin, Abang Ronny Pramadala Sibero dan Abang Dian Dala Sibero serta seluruh keluarga, atas segala doa dan kasih sayangnya. Penulis juga berterima kasih kepada Fadila Maula Hafsah sebagai pemberi motivasi dan semangat selama penelitian, teman-teman seperjuangan di laboratorium Adila, Ayumi, Konita dan Siti Zuriah serta keluarga THP 48 khususnya Iman Darmawan dan Wekson Bagariang sebagai teman-teman yang mendukung dalam penulisan karya ilmiah ini
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Pengendapan dan ekstraksi pigmen ... 4
Analisis kualitatif melanin ... 5
Rendemen Ekstrak Kasar Pigmen ... 8
Karakteristik Ekstrak Pigmen ... 10
Komponen Aktif Pigmen Kapang RS3 ... 13
KemampuanFotoprotektor Ekstrak Pigmen ... 13
DAFTAR TABEL
1 Konstanta EE () × I () ... 7
2 Pelarut dalam proses pengendapan pigmen ... 9
3 Kelarutan dan warna melanin ... 10
4 Serapan panjang gelombang pigmen ekstraseluler kapang RS3 ... 11
5 Senyawa aktif pigmen ekstraseluler kapang RS3 ... 13
6 Nilai SPF UV-B ekstrak pigmen ekstraseluler kapang RS3 ... 14
7 Toksisitas ekstrak kasar melanin ... 15
DAFTAR GAMBAR
1 Diagram alir penelitian ... 42 Kapang RS3 pada media PDA usia 14 hari ... 8
3 Kurva pertumbuhan kapang RS3 selama 27 hari ... 9
4 Pengaruh penambahan HCl terhadap perubahan pH ... 10
5 Spektrum UV-Vis pigmen kapang RS3 ... 11
6 Gugus fungsional pigmen ekstraseluler kapang RS3 ... 12
7 Struktur eumelanin... 12
DAFTAR LAMPIRAN
1 Pengaruh penambahan HCl 0,1 N terhadap perubahan pH ... 232 Hasil uji kelarutan melanin ... 23
3 Hasil fitokimia ... 24
4 Pengendapan melanin dengan berbagai pelarut ... 25
5 Bobot miseliua pertumbuhan kapang RS3 ... 26
PENDAHULUAN
Latar Belakang
Kapang endofit adalah fungi mikroskopis yang hidup di jaringan tumbuhan tanpa menyebabkan penyakit pada tumbuhan inangnya. Biodiversitas kapang endofit sangat tinggi dan dapat diisolasi dari berbagai tumbuhan. Hutan mangrove merupakan salah satu ekosistem pesisir yang menyimpan biodiversitas kapang endofit yang sangat tinggi (Karuna et al. 2009). Kapang endofit berhasil diisolasi dari tumbuhan pesisir serta akuatik asal Indonesia seperti sarang semut dan rumput laut. Sahara (2013) mengisolasi beberapa jenis kapang endofit dari tumbuhan pesisir sarang semut yang memproduksi berbagai warna pada media tumbuhnya, serta metabolit sekunder yang mempunyai aktivitas sebagai inhibitor
ɑ-glukosidase sehingga memiliki potensi sebagai antidiabetes. Kapang endofit diketahui menghasilkan komponen aktif yang sama seperti tanaman inangnya dan telah dibuktikan bahwa isolat kapang endofit dari tanaman Taxus brevifolia penghasil senyawa antikanker taksol juga menghasilkan senyawa yang sama sehingga kapang endofit berpotensi pada industri farmasautikal (Visalakchi dan Muthumary 2010).
Pigmen merupakan salah satu metabolit sekunder yang dihasilkan oleh kapang endofit dengan warna yang sangat beragam. Warna yang dihasilkan oleh kapang berupa pigmen intraseluler yang terdapat di dalam miselia serta pigmen ekstraseluler yang dilepaskan ke lingkungan tumbuhnya (Velmurugan et al. 2010). Penelitian Mugesh et al. (2014) menunjukkan beberapa kapang endofit yang diisolasi dari tumbuhan Clerodendrumviscosum L. menghasilkan zat warna kuning kemerahan dan merah gelap sedangkan Rajagopal et al. (2011) berhasil mengekstrak dan mengkarakterisasi pigmen hitam yang dihasilkan kapang endofit Phomopsis sp. dan teridentifikasi sebagai melanin. Kapang strain RS3 merupakan salah satu jenis kapang endofit yang diisolasi dari tumbuhan pesisir sarang semut. Kapang RS3 menghasilkan pigmen ekstraseluler berwarna hitam (Sahara 2013). Pigmen hitam yang dihasilkan diduga sebagai melanin. Melanin adalah pigmen yang bersifat hidrofobik, berwarna hitam dengan berat molekul yang tinggi, disusun oleh polimerisasi komponen fenolik dan atau indolik yang dihasilkan oleh makroorganisme dan mikroorganisme (Sansinenea dan Aurelio 2014). Penelitian membuktikan bahwa melanin memiliki aktivitas antioksidan (Tu et al. 2009). Makhluk hidup menghasilkan melanin untuk melindungi diri dari paparan sinar matahari karena melanin memiliki kemampuan fotoprotektor yang mampu menyerap spektrum dan mencegah kerusakan akibat paparan sinar UV (Nosanchuk dan Casadevall 2003).
2
penelitian mengenai cara ekstraksi, karakteristik serta kemampuan fotoprotektor melanin yang dihasilkan oleh melanin kapang laut.
Perumusan Masalah
Kosmetik yang dijual di pasaran umumnya mengandung senyawa kimia sintetis yang memberikan dampak negatif bagi kesehatan. Senyawa aktif yang berfungsi sebagai fotoprotektor pada kosmetik dapat menyebabkan berbagai masalah kulit seperti gatal-gatal, kulit memerah, iritasi hingga kanker kulit. Pencarian bahan alami menjadi salah satu jalan keluar atas masalah ini. Sumberdaya laut menyimpan berbagai organisme yang potensial sebagai penghasil bahan fotoprotektor. Kapang laut diketahui mampu menghasilkan melanin yang memiliki kemampuan sebagai fotoprotektor. Aktivitas fotoprotektor dari pigmen kapang laut dapat menjadi jalan keluar atas masalah ini.
Tujuan Penelitian
Penelitian ini mengekstrak, mengkarakterisasi melanin dan melakukan analisis aktivitas fotoprotektor dan toksisitas melanin asal kapang RS3.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai pemanfaatan kapang laut sebagai sumber pigmen fotoprotektor dan kemungkinannya dijadikan bahan aktif pada produk kosmetik.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini terdiri atas beberapa tahap yakni penentuan larutan pengendap yang tepat dalam ekstraksi melanin, analisis kualitatif dan karakterisasi melanin, analisis Sun Protection Factor (SPF) serta toksisitas melanin menggunakan metode Brine Shrimp Lethality Test (BSLT).
METODE
3
SPF dilakukan di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, sedangkan analisis FTIR, Fitokimia dan BSLT dilakukan di Laboratorium Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah kapang endofit isolat RS3 yang diisolasi menggunakan teknik sterilisasi permukaan dari tanaman pesisir sarang semut (Hydnophytum formicarum) yang diperoleh dari Sorong, Papua. Tumbuhan sarang semut diketahui sebagai tumbuhan epifit pada tanaman pesisir Api-api (Avicenia sp.). Bahan yang digunakan untuk kultivasi kapang endofit adalah media padat Potato Dextrose Agar (PDA), media cair Potato Dextrose Broth (PDB) dan kloramfenikol sebagai antibakteri. Bahan yang digunakan selama proses ekstraksi melanin adalah HCl 0,1 N, akuades, n-heksana, etil asetat, kloroform, dan metanol. Bahan yang digunakan dalam karakterisasi adalah akuades, HCl, NaOH dan etanol. Bahan yang digunakan dalam uji BSLT adalah Artemia salina dan air laut steril.
Alat
Alat yang digunakan selama penelitian adalah alumunium foil, aerator, cawan petri, corong pisah, labu Erlenmeyer, lampu neon, spektrofotometer infra merah (FTIR), gelas ukur, pipet mikro, saringan, sentrifugasi HIMAC CR21G, Spektrofotometer UV-Vis Shimadzu UV-1700, tabung reaksi dan vorteks.
Prosedur Penelitian
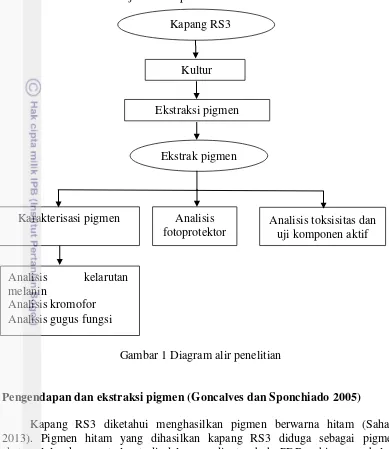
Penelitian ini diawali dengan kultur kapang RS3 yang diisolasi dari tumbuhan sarang semut (H. formicarum). Kultur dilakukan dalam media PDA selama 7 hari kemudian dikultur pada media PDB hingga warna media menjadi hitam secara keseluruhan. Ekstraksi pigmen diawali dengan penentuan pelarut yang tepat untuk mengendapkan pigmen. Pigmen yang telah diperoleh selanjutnya dianalisis secara kualitatif dan dikarakterisasi menggunakan FTIR dan SpektrofotometerUV-Vis. Analisis fotoprotektor pigmen dilakukan menggunakan nilai SPF sedangkan toksisitasnya diuji dengan metode BSLT. Diagram alir prosedur penelitian dapat dilihat pada Gambar 1.
Kultur kapang RS3
4
Erlenmeyer volume 250 mL berisi media PDB sebanyak 100 mL lalu diberikan 5 inokulan kapang RS3 dengan ukuran ±1 cm2. Kapang selanjutnya dikultur hingga warna media berubah menjadi hitam pekat.
Gambar 1 Diagram alir penelitian
Pengendapan dan ekstraksi pigmen (Goncalves dan Sponchiado 2005)
Kapang RS3 diketahui menghasilkan pigmen berwarna hitam (Sahara 2013). Pigmen hitam yang dihasilkan kapang RS3 diduga sebagai pigmen ekstraseluler karena terlarut di dalam media tumbuh PDB sehingga sebelum diekstrak dibutuhkan proses pemisahan menggunakan metode presipitasi. Sebanyak 1 mL media kultur PDB ditambahkan ke dalam 9 mL larutan yang terdiri atas akuades, metanol, etil asetat, n-heksana, kloroform dan HCl 0,1 N selanjutnya dihomogenkan menggunakan vorteks dan disimpan di dalam lemari pendingin selama 15 menit. Hasil pengamatan memperlihatkan bahwa hanya HCl 0,1 N yang dapat mengendapkan pigmen kapang RS3 sehingga dibutuhkan informasi pengaruh perbedaan pH terhadap pengendapan pigmen kapang RS3 dengan model matematis sebagai berikut:
Yij = µ + P (i) + ɛij dimana:
Kapang RS3
Kultur
Ekstraksi pigmen
Analisis fotoprotektor
Analisis kelarutan melanin
Analisis kromofor Analisis gugus fungsi
Analisis toksisitas dan uji komponen aktif Karakterisasi pigmen
5
Yij : hasil pengamatan endapan ke-j dengan perlakuan ke-i
i : perbedaan pH (4,0; 3,5;, 3,0; 2,5) j : ulangan dari setiap perlakuan (dua kali) µ : nilai tengah umum
P (i) : pengaruh perlakuan ke-i ɛij : pengaruh galat
Hipotesis yang digunakan pada penentuan larutan pengendap yang tepat untuk pemisahan pigmen adalah sebagai berikut:
H0 : penurunan pH tidak berpengaruh terhadap pengendapan pigmen kapang RS3
H1 : penurunan pH memberikan pengaruh terhadap pengendapan pigmen kapang RS3
Ekstraksi dilanjutkan dengan pemisahan endapan dengan sentrifugasi pada suhu 4oC selama 30 menit dengan kecepatan 5000 g. Pelet diambil dan digunakan untuk analisis kualitatif melanin, karakterisasi, dan uji SPF.
Analisis kualitatif melanin (Tu et al. 2011)
Analisis kualitatif melanin dilakukan dengan melihat warna dan kelarutannya berdasarkan Tu et al. (2009) dengan beberapa modifikasi.Sebanyak 1 mL pigmen kasar ditambahkan ke dalam 9 mL pelarut akuades, HCl 0,1 N, etanol dan NaOH 0,1 M selanjutnya dihomogenkan menggunakan vortex selama 10 detik lalu didiamkan di dalam lemari pendingin dan diamati kelarutannya.
Karakterisasi melanin (Rajagopal et al. 2011)
Melanin dikarakterisasi dengan melihat serapan maksimal sinar UV menggunakan instrumen spektrofotometer UV-Vis sedangkan karakterisasi gugus fungsionalnya menggunakan instrumen FTIR. Sebanyak 50 µL ekstrak kasar dilarutkan di dalam 10.000 µL NaOH 0,1 M dengan pH 10 selanjutnya dihomogenkan menggunakan vorteks selama sepuluh detik dan dilakukan pemindaian pada panjang gelombang 200-400 nm. Karakterisasi menggunakan FTIR dimulai dengan ekstrak melanin dikeringkan menggunakan pengering beku selanjutnya dibentuk menjadi disk dengan suasana vakum lalu dianalisis pada bilangan gelombang 500 hingga 4000 cm-1.
Uji Fitokimia(Harborne 1987)
6
1 Uji alkaloid
Sebanyak 0,5 mL sampel dilarutkan dalam 10 tetes asam sulfat 2 N kemudian disaring dan diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff. Prinsip dari metode analisis ini adalah reaksi pengendapan yang terjadi karena adanya penggantian ligan. Atom nitrogen yang mempunyai pasangan elektron bebas pada alkaloid dapat mengganti ion iodo dalam pereaksi-pereaksi tersebut. Pereaksi Meyer mengandung merkuri klorida dan kalium iodida. Pereaksi Dragendorff mengandung kalium iodida dan bismuth subnitrat dalam asam asetat glasial. Pereaksi Wagner mengandung iod dan kalium iodida. Dalam pengujian ini yang terbentuk endapan adalah dengan pereaksi Dragendorff. Diduga hal ini disebabkan oleh karena kandungan senyawa alkaloid yang sedikit pada sampel sehingga hanya satu pereaksi yang sensitif bereaksi terhadap sampel.
2 Uji flavonoid
Sebanyak 0,5 mL sampel ditambahkan serbuk magnesium 0,10 mg dan 0,40 mL amil alkohol dan 4 mL alkohol kemudian campuran dikocok. Warna merah, kuning atau jingga yang terbentuk pada lapisan amil alkohol menunjukkan adanya flavonoid. Penambahan serbuk magnesium dan asam klorida pada pengujian flavonoid akan menyebabkan tereduksinya senyawa flavonoid yang ada sehingga menimbulkan reaksi warna merah yang merupakan ciri adanya flavonoid pada sampel.
3 Uji saponin
Saponin dideteksi dengan uji busa pada 0,5 mL ekstrak dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang setelah ditambahkan 1 tetes HCl 2 N menunjukkan adanya saponin.
4 Uji tanin
Sebanyak 1 mL ekstrak ditambahkan ke dalam 100 mL air panas kemudian dididihkan selama 5 menit dan disaring. Sebanyak 5 mL filtrat ditambah FeCl3 1%. Hasil positif ditandai dengan munculnya warna hijau kehitaman.
Uji toksisitas BSLT(Meyer et al. 1982)
7
empat kelompok perlakuan yang berisi larutan 10; 100; 500; 1000 dengan tiga kali pengulangan lalu didiamkan selama 48 jam kemudian dihitung jumlah larva yang mati. Nilai LC50 diperoleh dengan cara menghitung menggunakan Statistical
Product and Service Solutions (SPSS).
Uji fotoprotektor (Mokodompit et al. 2013)
Uji fotoprotektor dilakukan secara in vitro menggunakan instrumen spektrofotometer UV-Vis. Kemampuan fotoprotektor dinyatakan dalam nilai SPF. Uji SPF dilakukan untuk melihat aktivitasnya sebagai fotoprotektor UV-B. Spektrofotometer dikalibrasi menggunakan 5 mL NaOH 0,1. Selanjutnya larutan pigmen diencerkan menjadi 1% dengan cara sebanyak 100 µL ekstrak kasar dilarutkan dalam 10.000 µL KOH 0,1 M selanjutnya dihomogenkan menggunakan vorteks selama 10 detik dan dilakukan pemindaian pada panjang gelombang 290-400 nm. Pengukuran nilai SPF UV-B dilakukan berdasarkan persamaan Mansur et al. (1986) yaitu:
�� = � × ∑ �
HASIL DAN PEMBAHASAN
Rendemen Ekstrak Kasar Pigmen
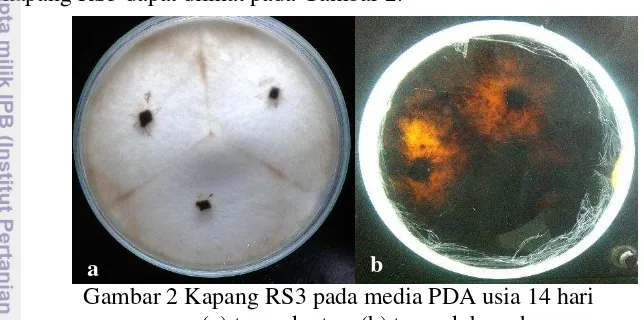
Kapang RS3 merupakan jenis kapang endofit yang diisolasi dari tumbuhan sarang semut (H. formicarum) yang hidup menempel pada tumbuhan pesisir api-api (Avicennia sp.) yang dapat ditemukan di Sorong, Papua. Kapang ini diketahui memiliki ciri-ciri miselia seperti kapas yang berwarna putih dengan tepian rata, konidiofor bersepta pendek dan konidia berbentuk bulat serta menghasilkan pigmen berwarna cokelat kehitaman di dalam media tumbuhnya (Sahara 2013). Profil kapang RS3 dapat dilihat pada Gambar 2.
Gambar 2 Kapang RS3 pada media PDA usia 14 hari (a) tampak atas, (b) tampak bawah
Metabolit sekunder dihasilkan oleh kapang pada akhir fase eksponensial atau pada awal fase stasioner hingga akhir fase kematian. Keterbatasan unsur-unsur pertumbuhan pada kapang seperti sumber karbon dan protein akan menyebabkan terjadinya pelepasan zat-zat hasil proses katabolisme yang merupakan metabolit sekunder (Srikandace et al. 2007). Pigmen merupakan salah satu jenis metabolit sekunder yang dihasilkan oleh kapang endofit (Mugesh et al. 2014). Jenis pigmen berdasarkan cara memproduksinya terbagi atas pigmen intraseluler dan pigmen ekstraseluler. Pigmen intraseluler merupakan zat warna yang dihasilkan oleh organisme dan memberikan warna pada sel ataupun jaringan sedangkan pigmen ektraseluler merupakan zat warna yang dihasilkan organisme dan dilepaskan ke lingkungan tumbuhnya.
Kapang RS3 menghasilkan pigmen berwarna hitam pada media cair PDB. Perubahan warna media menjadi cokelat tua terlihat pada hari ke-15 sedangkan pigmen hitam pekat dihasilkan pada umur kultur ke-21 ketika seluruh permukaan media telah ditutupi oleh hifa kapang (Sahara 2013). Umur tumbuh ke-21 hari merupakan fase pertumbuhan kapang RS3 yang dapat dilihat pada Gambar 3.
Penelitian yang dilakukan menunjukkan hasil yang berbeda, yaitu pigmen kapang RS3 baru menghasilkan warna cokelat pada umur kultur ke-30 dan warna hitam pada hari ke-60. Hal ini diduga karena kapang RS3 yang dikultur tidak tumbuh pada permukaan media namun tumbuh di dalam media sehingga hifa kapang tidak menutupi seluruh permukaan media. Kapang tumbuh di dalam media akibat perlakuan pengadukan sebelum ditumbuhkan secara statis.
9
Gambar 3 Kurva pertumbuhan kapang RS3 selama 27 hari
Sumber: Sahara (2013)
Kapang RS3 yang dikultur pada media cair PDB menghasilkan pigmen ekstraseluler berwarna hitam yang larut pada media yang diduga sebagai melanin. Hifa kapang yang tua diketahui akan menebal serta menghasilkan senyawa melanin (Gandjar et al. 2006). Melanin yang dihasilkan oleh kapang dapat berupa pigmen intraseluler dan pigmen ekstraseluler. Kapang RS3 menghasilkan melanin sebagai pigmen ekstraseluler karena menyebabkan perubahan warna pada media kultur. Pigmen yang larut di dalam media kultur harus dipisahkan dengan cara pengendapan. Pengendapan dilakukan dengan menggunakan larutan tertentu yang mampu memisahkan pigmen dari media kultur kapang. Hasil penentuan pelarut yang digunakan untuk mengendapkan pigmen dari media PDB dapat dilihat pada Tabel 2.
Tabel 2 Pelarut dalam proses pengendapan pigmen
No Jenis larutan Mengendap/Tidak mengendap
1 Akuades Tidak
Tabel 2 menunjukkan bahwa hanya larutan asam klorida (HCl) yang mampu mengendapkan pigmen ekstraseluler kapang RS3 yang terlarut di dalam media PDB. Hal tersebut diduga karena pigmen ekstraseluler kapang RS3 mengandung gugus amina dan gugus karboksil. Suasana asam akibat penambahan HCl akan membuat ion H+ bereaksi dengan kedua gugus tersebut dan mengakibatkan kelarutan pigmen di dalam air berkurang dan membuatnya dapat mengendap. Pengamatan secara visual menunjukkan bahwa pelarut organik dan akuades tidak
10
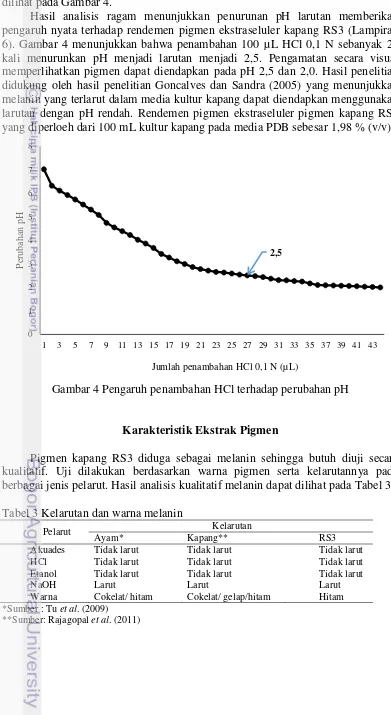
dapat mengendapkan pigmen ekstraseluler kapang RS3 (Lampiran 4). Pengaruh penambahan HCl terhadap pengendapan pigmen ekstraseluler kapang RS3 dapat dilihat pada Gambar 4.
Hasil analisis ragam menunjukkan penurunan pH larutan memberikan pengaruh nyata terhadap rendemen pigmen ekstraseluler kapang RS3 (Lampiran 6). Gambar 4 menunjukkan bahwa penambahan 100 µL HCl 0,1 N sebanyak 27 kali menurunkan pH menjadi larutan menjadi 2,5. Pengamatan secara visual memperlihatkan pigmen dapat diendapkan pada pH 2,5 dan 2,0. Hasil penelitian didukung oleh hasil penelitian Goncalves dan Sandra (2005) yang menunjukkan melanin yang terlarut dalam media kultur kapang dapat diendapkan menggunakan larutan dengan pH rendah. Rendemen pigmen ekstraseluler pigmen kapang RS3 yang diperloeh dari 100 mL kultur kapang pada media PDB sebesar 1,98 % (v/v).
Gambar 4 Pengaruh penambahan HCl terhadap perubahan pH
Karakteristik Ekstrak Pigmen
Pigmen kapang RS3 diduga sebagai melanin sehingga butuh diuji secara kualitatif. Uji dilakukan berdasarkan warna pigmen serta kelarutannya pada berbagai jenis pelarut. Hasil analisis kualitatif melanin dapat dilihat pada Tabel 3. Tabel 3 Kelarutan dan warna melanin
Pelarut Kelarutan
Ayam* Kapang** RS3 Akuades Tidak larut Tidak larut Tidak larut HCl Tidak larut Tidak larut Tidak larut Etanol Tidak larut Tidak larut Tidak larut NaOH Larut Larut Larut Warna Cokelat/ hitam Cokelat/ gelap/hitam Hitam *Sumber : Tu et al. (2009)
**Sumber: Rajagopal et al. (2011)
11
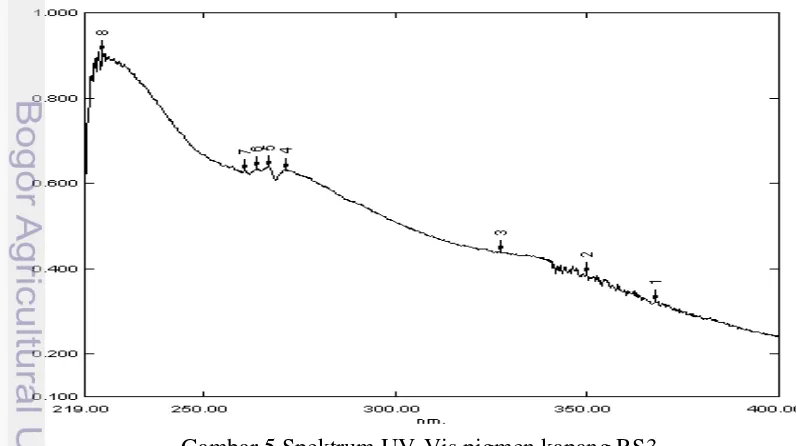
Tabel 3 menunjukkan pigmen yang dihasilkan oleh RS3 sesuai dengan hasil penelitian Tu et al. (2009) dan Rajagopal et al. (2011) yang menyatakan bahwa melanin memiliki karakteristik yang tidak larut pada akuades, asam klorida (HCl) dan pelarut organik umumnya seperti metanol, etano, etil asetat, kloroform dan heksana namun larut pada natrium hidroksida (NaOH) dengan warna hitam sehingga diduga kuat bahwa pigmen ekstraseluler kapang RS3 adalah melanin.Melanin diketahui dapat dilarutkan menggunakan berbagai pelarut basa seperti NaOH dan KOH. Ekstraksi melanin dari miselium umumnya menggunakan kalium hidroksida (KOH) (Goncalves et al. 2012). Penelitian ini menggunakan natrium hidroksida (NaOH) untuk melarutkan melanin. Karakteristik serapan UV pigmen ekstraseluler kapang RS3 dapat dilihat pada Gambar 5. Hasil identifikasi panjang gelombang pigmen ekstraseluler kapang RS3 dapat dilihat pada Tabel 4.
Tabel 4 Serapan panjang gelombang pigmen ekstraseluler kapang RS3 Peak ke- Serapan panjang gelombang (nm) Kategori UV 1 367,8 UV-A 2 350,0 UV-A 3 317,2 UV-B 4 271,6 UV-C 5 266,8 UV-C 6 264,0 UV-C 7 260,8 UV-C 8 223,6 UV-C
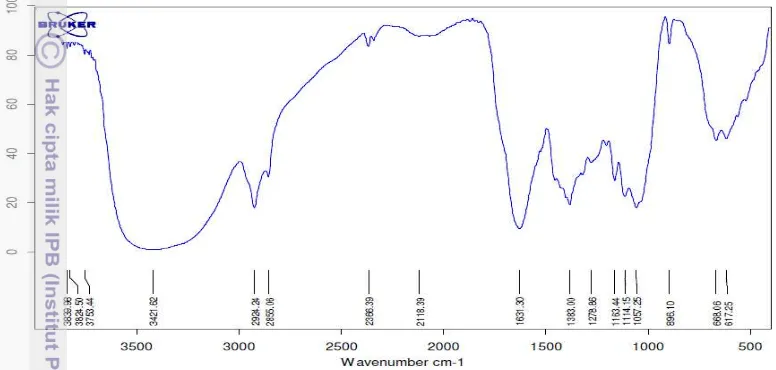
Sinar UV diserap pada panjang gelombang 223,6 nm karena keberadaan cincin aromatik. Melanin diketahui memiliki kerangka aromatik pada strukturnya (Wakamatsu dan Ito 2002). Serapan UV pigmen kapang RS3 memiliki puncak ketiga kategori UV yakni UV-C yang memiliki skala panjang gelombang 100-290 nm, UV-B dengan skala 290-320 nm dan UV-A dengan skala 320-400 nm. Panjang gelombang 223,6 nm merupakan panjang gelombang yang khas untuk gugus aromatik (Supratman 2010). Hasil analisis menggunakan spektrofotometer didukung oleh data yang diperoleh dari analisis FTIR. Hasil analisis gugus fungsional melanin menggunakan FTIR dapat dilihat pada Gambar 6.
12
Hasil analisis FTIR menunjukkan ulur gugus –OH dan –NH pada bilangan gelombang 3421,62 cm-1, ulur –C=C aromatik dan tekuk gugus –NH ditemukan pada bilangan gelombang 1631,30 cm-1. Gugus fungsional –CO yang terdeteksi pada bilangan gelombang 1290-1000 cm-1 digunakan untuk menentukan jenis alkohol. Bilangan gelombang 1278,86 cm-1 menandakan adanya fenil alkohol (fenol) pada ekstrak yang pigmen sedangkan bilangan gelombang 1057,25 cm-1 menunjukkan adanya alkohol (Kukulyanskaya et al. 2002; Supratman 2010).
Gambar 6 Gugus fungsional pigmen ekstraseluler kapang RS3
Melanin dapat digolongkan ke dalam tiga kelompok besar, yaitu allomelanin yang berwarna hitam, eumelanin yang berwarna cokelat kehitaman dan pheomelanin yang berwarna merah hingga kuning. Allomelanin umumnya tidak mengandung senyawa nitrogen maupun sulfur, eumelanin mengandung senyawa nitrogen sedangkan pheomelanin mengandung sulfur akibat interaksinya dengan asam amino sistein dalam proses pembentukannya (Plonka dan Grabacka 2006). Keberadaan gugus amina yang menyatakan adanya atom nitrogen pada melanin menandakan bahwa jenis melanin yang dihasilkan oleh kapang RS3 diduga adalah eumelanin. Kukulyanaskaya et al. (2002) membuktikan bahwa kapang yang diambil dari alam kemudian pigmen melaninnya langsung diekstrak akan menghasilkan melanin berjenis allomelanin namun ketika kapang tersebut dikultur di media maka jenis melanin yang diproduksinya adalah eumelanin.
Gugus fenol yang teridentifikasi menggunakan instrumen FTIR membuktikan bahwa melanin disusun melalui proses polimerasi senyawa fenol dan atau indola (Sansinenea dan Aurelio 2014). Hasil identifikasi gugus fungsional sesuai dengan gambaran struktuk pigmen eumelanin yang digambarkan oleh Magarelli (2011) yang terdiri atas hidroksil, karboksi, fenol dan amina (Gambar 7).
Gambar 7 Struktur eumelanin
13
Komponen Aktif Pigmen Kapang RS3
Mahluk hidup diketahui menghasilkan senyawa aktif yang digunakan untuk bertahan hidup. Uji fitokimia merupakan salah satu uji yang dapat digunakan untuk mengetahui senyawa aktif yang dihasilkan oleh suatu organisme (Harborne 1987). Kandungan senyawa aktif yang dimiliki oleh kapang RS3 akan mempengaruhi aktivitasnya sebagai agen fotoprotektor. Senyawa aktif yang terkandung dalam ekstrak pigmen ektraseluler kapang RS3 dapat dilihat pada Tabel 5.
Tabel 5 Senyawa aktif pigmen ekstraseluler kapang RS3
Uji Fitokimia Hasil Parameter Alkaloid
Flavonoid + Lapisan berwarna jingga Tanin - Hijau kehitaman Saponin - Terbentuk busa Keterangan: (+) = terdeteksi; (-) = tidak terdeteksi
Hasil uji fitokimia menunjukkan ekstrak pigmen ekstraseluler mengandung senyawa aktif flavonid yang ditandai dengan terbentuknya lapisan amil alkohol berwarna jingga. Senyawa fenol juga merupakan jenis senyawa aktif yang terdeteksi menggunakan instrumen FTIR pada bilangan gelombang 1278,86 cm-1. Hasil ini didukung oleh penelitian Sahara (2013) menunjukkan bahwa kapang RS3 memiliki komponen aktif berupa fenol dan flavonoid.
Senyawa fenol dan flavonoid diketahui sebagai komponen aktif yang memiliki aktivitas sebagai antioksidan (Nurjanah et al. 2012). Senyawa fenol dari organisme laut diketahui digunakan sebagai senyawa aktif yang memiliki aktivitas sebagai agen fotoprotektor yang dapat menghambat kerusakan akibat sinar UV-B (Kim 2012). Flavonoid dapat dikelompokkan menjadi 9 kelas yakni antosianin, proantosianidin, flavonol, flavon, glikoflavon, biflavon, calakon dan aurona, flavanon serta isoflavon (Harborne 1987). Hasil penelitian Jiang et al. (1997) menunjukkan bahwa mikroorganisme laut mampu menghasilkan senyawa flavonoid yang memiliki aktivitas fotoprotektor.
KemampuanFotoprotektor Ekstrak Pigmen
14
Sinar matahari mengandung tiga jenis spektrum UV yakni UV-C, UV-B, dan UV-A dimana hanya UV-A dan UV-B yang mampu mencapai bumi. Dampak buruk akibat UV-B pada kulit berupa terbakar suryaakut, mutasi DNA dan kanker karena diserap dan terakumulasi pada epidermis sedangkan sinar UV-A terpenetrasi lebih dalam yang mengakibatkan kulit menghitam dan keriput (Rastogi et al. 2010). Penelitian yang dilakukan kebanyakan mencari bahan fotoprotektor UV-B karena mengakibatkan kulit terbakar hingga kanker kulit. Pengukuran nilai SPF dapat dilakukan dengan pengujian baik secara in vitro dan secara in vivo. Pengujian secara in vitro dilakukan dengan menggunakan instrumen spektrofotometer UV sedangkan secara in vivo dilakukan dengan mengujinya langsung ke manusia lalu mengamati eritema (kemerahan) yang terjadi akibat proses inflamasi yang disebabkan oleh paparan sinar matahari dan dibandingkan dengan kontrol. Eritema (kemerahan) disebabkan oleh proses inflamasi akibat paparan sinar matahari (UV) dan terjadi apabila volume darah dalam pembuluh darah dermis meningkat hingga 38% di atas volume normal (Tahir et al. 2002).
Penelitian ini melihat aktivitas pigmen sebagai fotoprotektor UV-B yang dihasilkan oleh 1% ekstrak pigmen ekstraseluler kapang RS3. Konsentrasi 1% dipilih karena mayoritas kosmetik menggunakan bahan aktif sebesar ≤1. Hasil analisis SPF sebagai fotoprotektor UV-B dapat dilihat pada Tabel 6.
Tabel 6 Nilai SPF UV-B ekstrak pigmen ekstraseluler kapang RS3
(nm) (EE) x (I) Absorbansi SPF
Hasil penelitian menunjukkan bahwa ekstrak pigmen ekstraseluler kapang RS3 sebanyak 1% memiliki nilai SPF UV-B sebesar 11,33. Nilai SPF dikategorikan ke dalam beberapa tipe proteksi yakni proteksi minimal (SPF 1-4), proteksi sedang (4-6), proteksi ekstra (6-8), proteksi maksimal (8-15) dan proteksi ultra (SPF>15) (Gonzales et al. 2008). Hasil penelitian ini menunjukkan bahwa pigmen ekstraseluler kapang RS3 memiliki aktivitas SPF UV-B termasuk ke dalam kategori proteksi maksimal. Nilai SPF 11,33 berarti bahwa ekstrak pigmen ektraseluler kapang RS3 yang diaplikasikan ke kulit mampu menghambat efek MED 11,33 kali lebih lama dibandingkan kulit tanpa dilindungi oleh pigmen. Banyak faktor yang mempengaruhi hasil penentuan nilai SPF yang dilakukan secara in vitro pada sediaan tabir surya seperti jenis pelarut yang digunakan untuk melarutkan, kombinasi senyawa, tipe emulsi, interaksi antar senyawa, emulsifier yang digunakan dan pH (Kaur dan Saraf 2010).
15
gugus aromatik yang dikonjugasikan dengan gugus karbonil sehingga mampu menyerap sinar UV dan melepaskannya dengan keluaran energi yang lebih rendah sehingga mencegah kerusakan kulit dari efek UV-A dan UV-B (Rai et al. 2012).
Flavonoid merupakan jenis fenolik yang dihasilkan oleh tumbuhan bertujuan untuk melindungi diri dari paparan sinar UV-B (Bruchard et al. 2000). Fakta lain menunjukkan bahwa flavonoid mampu mengurangi dampak buruk oksidasi yang diakibatkan oleh sinar dengan panjang gelombang yang pendek dan mampu menurunkan resiko kerusakan akibat ROS dengan cara mengurangi penetrasi radiasi UV-B (Agati et al. 2009). Hasil penelitian Stevanato et al. (2014) menunjukkan berbagai jenis flavonoid memiliki SPF untuk UV-A dan UV-B. Flavonol dan antosianin yang merupakan jenis flavonoid diketahui sebagai antioksidan kuat yang bertugas sebagai antiradikal bebas karena kehadiran cincin B-katekol. Penelitian membuktikan bahwa flavonol efektif sebagai fotoprotektor UV-B (Carletti et al. 2014).
Kemampuan melanin sebagai antioksidan sudah dibuktikan dari berbagai penelitian. Melanin diketahui memiliki kemampuan menangkap OH radikal, DPPH dan O2 yang mengindikasikan bahwa melanin dapat digunakan sebagai komponen antioksidan yang potensial (Ye et al. 2011). Melanin juga diketahui mampu menghambat peroksidasi lemak (Tu et al. 2009).
Toksisitas Ekstrak Pigmen
Uji toksisitas pada penelitian ini menggunakan BSLT yang menggunakan A. salina yang diberikan larutan ekstrak pigmen selama 48 jam. Metode ini dipilih karena memiliki keunggulan seperti cepat, mudah, murah, dapat dipercaya dengan hasil yang representatif (Meyer et al. 1982). Hasil uji toksisitas dapat dilihat pada Tabel 7.
Tabel 7 Toksisitas ekstrak kasar melanin
Pengekstrak
Hasil uji toksisitas menunjukkan bahwa ekstrak kasar melanin memiliki toksisitas (LC50) pada konsentrasi 557,95 µg/mL. Penggolongan toksisitas berdasarkan McLaughlin et al. (1998) adalah sangat toksik (LC50 ≤ 30 µg/mL), toksik (LC50 31-200 µg/mL), toksik rendah (LC50 201-1000 µg/mL) dan tidak toksik (LC50 > 1000 µg/mL). Ekstrak melanin tergolong pada kategori toksisitas rendah. Toksisitas berhubungan dengan jenis pelarut yang digunakan dalam ekstraksi dan komponen aktif yang dimiliki oleh ekstrak (Irawan et al. 2014).
Nilai toksisitas yang tergolong kedalam kategori toksisitas rendah tidak berarti bahwa pigmen ekstraseluler kapang RS3 aman dan langsung dapat digunakan dalam formulasi tabir surya namun harus tetap melalui uji dermatologis seperti uji alergi dan uji iritasi (Wih et al. 2009). Serpone et al. (2007) menunjukkan bahwa melanin sudah digunakan sebagai bahan aktif sebagai agen fotoprotektor pada produk tabir surya komersial.
16
melindungi sitoplasma dari radasi sinar unltraviolet (UV) serta dari enzim-enzim yang bersifat lisis yang dihasilkan oleh organisme lain (Gadjar et al. 2006). Mikroorganisme umumnya mensintesis melanin melalui berbagai jenis fenol-oksidase (seperti enzim tirosinase, lakkase, atau katakolase). Kuinonina pada melanin bertugas sebagai redoks pigmen dengan kemampuan mereduksi dan mengoksidasi oksigen radikal dan komponen kimia lainnya dalam sistem redoks. Kuinona mampu mengikat logam yang mampu menghasilkan hidroksil radikal atau reactive oxygen species (ROS) (Carletti et al. 2014).
Secara umum pembentukan melanin dimulai dengan penghidrolisisan asam amino fenilalanindengan bantuan enzim fenilalaninhidroksilase (PH) menjadi L-tirosina kemudian diubah menjadi L-DOPA menggunakan enzim L-tirosinase (TRY). Senyawa L-DOPA kembali diubah menjadi kuinona-DOPA menggunakan enzim tirosinase (TRY) kemudian diubah menjadi korm-DOPA melaui reaksi siklisisasi. Krom-DOPA selanjutnya diubah menjadi 5,6-dihidroksiindola (DHI-) dan asam indola 5,6-kuinona karboksilat (DHICA-) menggunakan enzim Krom-DOPA tautomerase (DCT). Senyawa dan DHICA diubah menjadi DHI-melanin dan DHICA-DHI-melanin yang merupakan jenis euDHI-melanin dengan bantuan enzim yang berhubungan dengan tirosinase.
Warna kulit umumnya ditentukan dari percampuran karotenoid, oksi-/deoksi-hemoglobin, dan jenis melanin serta jumlah yang didistribusikan oleh melanosom. (Stamatas et al. 2004). Pigmen melanin juga diproduksi oleh manusia di beberapa bagian tubuh seperti kulit dan rambut (Sinaga et al. 2012). Melanosit merupakan sel tubuh yang berperan dalam proses pigmentasi karena mampu menghasilkan dan mendistribusikan melanin. Pigmentasi yang terjadi melibatkan melanosit, melanosom, melanin, enzim tirosinase dan proses melanogenesis. Tubuh memproduksi melanin sebagai reaksi atas paparan sinar UV yang mengaktifkan sel melanosit untuk menghasilkan enzim fenilalanin hidrosilase yang akan mengubah asam amino fenilalanin menjadi L-tirosin yang merupakan bahan awal dalam pembentukan melanin pada kulit. Warna kulit ditentukan oleh jumlah melanin yang dihasilkan, semakin banyak melanin yang diproduksi oleh kulit maka akan semakin gelap warna kulit yang dimiliki.
Kulit manusia umumnya menghasilkan dua jenis melanin yakni eumelanin dan pheomelanin sedangkan mata hanya memiliki jenis eumelanin (Mamoto et al. 2009). Organ tubuh lain yang mengandung melanin adalah mata yang hanya mengandung eumelanin (Herrling et al. 2007). Melanin memiliki berbagai manfaat bagi tubuh manusia diantaranya sebagai agen fotoprotektor karena dapat berperan sebagai antioksidan. Keberadaan melanin (khususnya eumelanin) di kulit berhubungan erat dalam pencegahan kerusakan akibat radikal bebas yang diakibatkan oleh paparan sinar UV. Hasil penelitian menunjukkan bahwa melanin mampu melindungi kulit dari radikal bebas yang dihasilkan oleh sinar UV-B (Herrling et al. 2007). Melanin juga diketahui mampu mencegah kerusakan DNA yang diakibatkan oleh paparan sinar UV-A dan UV-B serta mampu mencegah timbulnya kanker kulit. Efek fotoprotektif yang dimiliki melanin dipengaruhi jumlah dan distribusinya di kulit (Brenner dan Hearing 2008).
17
formulasi dengan berbagai komponen aktif lain yang memiliki efek sinergis dengan melanin. Hasil penelitian Serpone et al. (2007) menunjukkan bahwa melanin digunakan dalam sediaan tabir surya sebagai agen fotoprotektor dengan formulasi berbagai bahan aktif lain yang memiliki efek sinergis seperti titanium dioksida (TiO2). Senyawa titanium dioksida (TiO2) merupakan agen fotoprotektor yang diketahui mampu menahan paparan sinar UV-A dan UV-B sehingga umum digunakan dalam produk tabir surya. Senyawa lain yang juga umum digunakan pada produk tabir surya adalah zink oksida (ZnO). Badan Pengawasan Obat dan Makanan (BPOM) memberikan peraturan batasan maksimum penggunaan TiO2 sebesar 25% sedangkan ZnO sebesar 20% (BPOM 2011).
KESIMPULAN DAN SARAN
Kesimpulan
Pigmen hitam yang dihasilkan kapang RS3 diduga sebagai melanin karena hanya dapat diekstrak menggunakan HCl 0,1 N dengan pH di bawah 2,5 dan dipisahkan menggunakan metode presipitasi. Rendemen melanin yang dihasilkan sebesar 1,98%. Ekstrak melanin memiliki serapan UV pada kisaran sinar UV-A (367,8 nm dan 350,0 nm), UV-B (317,2 nm) dan UV-C (271,6 nm; 266,8 nm; 264,0 nm; 260,8 nm; 223,6 nm) serta memiliki gugus fungsi hidroksi, cincin aromatik, gugus fenolik, dan amina yang diduga sebagai penciri melanin berjenis eumelanin. Nilai SPF ekstrak melanin sebesar 11,33 dan tergolong dalam kategori proteksi maksimum. Pigmen memiliki toksisitas LC50 577,950 µg/mL.
Saran
DAFTAR PUSTAKA
Ardhiansyah A. 2011. Pembakuan nama pulau di Indonesia sebagai upaya untuk menjaga kedaulatan negara republik Indonesia. Jurnal Ilmu Hukum Pandecta 6(1): 3-35.
Agati C, Stefano S, Tattini M. 2009. Mesophyll distribution of antioxidant flavonoids in Ligustrum vulgare leaves under contrasting sunlight irradiance. Ann.Bot. 104: 853-861
[BPOM] Badan Pengawas Obat dan Makanan. 2011. Persyaratan Teknis Bahan Kosmetika. Jakarta (ID): Kepala Badan Pengawas Obat dan Makanan. Brenner M, Hearing VJ. 2008. The protective role of melanin against UV damage
in human skin. Photochem Photobiol 84(3): 539-549.
Bruchard P, Bilger W, Weissenbock G. 2000. Contribution of hydroxycinnamates and flavonoids to epidermal shielding of UV-A and UV-B radiation in developing rye primary leaves as assessed by ultraviolet-induced chlorophyll fluorescene measurements. Plant, Cell and Environment. 23: 373-380
Carletti G, Nervo G, Cattivelli L. 2014. Flavonoids and melanins: a common strategy across twi kingdoms. International Journal of Biological Sciences 10(10): 1159-1170.
[Depkes] Departemen Kesehatan RI. 1985. Cara Pembuatan Simplisa. Jakarta (ID): Direktorat Jenderal Pengawasan Obat dan Makanan.
Etika SB, Suryelita. 2014. Isolasi steroid dari daun mengkudu (Morinda citrifolia L.). Eksakta 1(15): 60-65.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Obor Indonesia. Hal: 11.
Goncalves RCR, Sponchiado SRP. 2005. Antioxidant activity of the melanin pigment from Aspergillusnidulans. Biology Pharmacy Bulletin 28(6): 1129-1131.
Goncalves RCR, Lisboa HCF, Sponchiado SRP. 2012. Characterization of melanin pigment produced by Aspergillus nidulans. World Journal Microbiology Biotechnol 28: 1467-1474.
Gonzales S, Manuel FL, Yolanda GC. 2008. The lates on skin photoprotection. Clinic in Dermatology 26: 614-626.
Harborne. 1987. Metode Fitokimia, Penentuan Cara Modern Menganalisis Tumbuhan. Padmawinata K, Sudiro I, penerjemah. Bandung (ID): Penerbit ITB. Terjemahan dari: Phytochemical Methods.
Herrling T, Jung K, Fuchs J. 2007. The important role of melanin as protector against free radicals in skin. SOFW-Journal 133 (9): 26-32.
Irawan O, Efendi E, Ali M. 2014. Efek pelarut yang berbeda terhadap toksisitas ekstrak akar tuba (Derris elliptica). E-Journal Rekayasa dan Teknologi Budidaya Perairan 2(2): 259-266.
Karuna C, Bapuji M, Rath CC, Murthy YLN. 2009. Isolation of mangrove fungi from Godavari and Khrishna Deltas of Andhara Pradesh, India. Journal Ecobiology 24(1): 91-96.
19
Kawai M, Hirano T, Higa S, Arimitsu J, Maruta M, Kuwahara Y, Ohkawara T, Hagihara K, Yamadori T, Shima Y, Ogata A, Kawase I, Tanaka T. 2007. Flavonoids and related compounds as anti-allergic substances. Allergology International 56: 113-123.
Kim SK. 2012. Marine cosmeceuticals: Trends and Prospect. New York (US): CRC Press.
Kukulyanskaya TA, Kurchenko NV, Kurchenko VP, Babitskaya VG. 2002. Physicochemical properties of melanin produced by the sterile form of Inonotus obligatus (“Changi”) in natural and cultivated fungus. Applied Biochemistry and Microbiology 38(1): 58-61.
Madhusudhan DN, Bi BZM, Syed GD, Dayanand A. 2014. Production and cytotoxic of extracellular insoluble and droplets of soluble melanin by Streptomyces lusitanus DMZ-3. BioMedicine Research International 20(14): 1-11.
Magarelli M. 2011. Purification, characterization and photodegredation studies of modified sepia melanin (Sepia officinalis). Determination of eumelanin content in fibers from Alpaca (Vicuguna pacos). Camerino (IT): University of Camerino. Hal: 20.
Mamoto NFE, Kalangi SJR, Karundeng R. 2009. Peran melanokortin pada melanosit. Jurnal Biomedik 1(1): 1-11
Mansur JS, Breder MVR, Mansur MCA, Azulay RD. 1986. Determinacao do fator de protecao solar por espectrofotometria. An Bras Dermatology 61:121-124.
Martin SA, Orejarena S, Gallardo C, Silva M, Becerra J, Reinoso R, Chamy MC, Vergara K, Rovirosa J. 2008. Steroids from the marine fungus Geotrichum sp. J. Chil. Chem. Soc. 53(1): 1388-1389.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin JL. 1982. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Medica 45: 31-34.
Mugesh S, Thangavel A, Maruthamuthu M. 2014. Chemical stimulation of biopigment production in endophytic fungi isolated from Clerodendrum viscosum L. Chemical Science Review and Letters 3(10): 280-287.
Nichols JA, Katiyar SK. 2010. Skin photoprotection by natural polyphenols: anti-inflammatory, antioxidant and DNA repair mechanisms. Archives Dermatology Research 302: 71-83.
Nosanchuk JD, Casadevall A. 2003. The contribution of melanin to microbial pathogenesis. Cellular Microbiology 5: 203-223.
Nurjanah, Azka A, Abdullah A. 2012. Aktivitas antioksidan dan komponen bioaktif semangi air (Marsiela crenata). Jurnal Inovasi dan Kewirausahaan 1(3): 152-158.
Plonka PM, Grabacka M. 2006. Melanin synthesis in microorganisms-biotechnological and medical aspects. Acta Biochimica Polonica 53(3): 429-445.
Rahayu WTA. 2013. Ekstraksi sarang semut (Hydnophytum formicarum) dan potensinya sebagai antihiperglikemik [skripsi]. Bogor (ID): Institut Pertanian Bogor.
20
Rajagopal K, Kathiravan G, Karthikeyan S. 2011. Extraction and characterization of melanin from Phomopsis: A phellophytic fungi isolated from Azadirachta indica A. Juss. African Journal of Microbiology Research 5(7):762-766. Sahara R. 2013. Kapang endofit dari tumbuhan pesisir sarang semut
(Hydnophytum formicarum) dan potensinya sebagai antihiperglikemik [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sansinenea E, Aurelio O. 2014. Melanin: A solution for photoprotection of Bacillus thuringiensis based biopesticides. Biochemistry and Pharmacology: Open Access 3:3.
Sharma GN, Dubey SK, Sati N, Jyotsana S. 2011. Anti-inflammatory activity and total flavonoid content of Aegle marmelos seeds. International Journal of Pharmaceutical Sciences and Drug Research 3(3): 214-218.
Sinaga R, Wangko S, Kaseke M. Peran melanosit pada proses uban. Jurnal Biomedik 4(3): 4-12.
Srikandace Y, Hapsari Y, Simanjuntak P. 2007. Seleksi mikroba endofit Cureuma zedoaria dalam memproduksi senyawa kimia antimikroba. Jurnal Ilmu Kefarmasian Indonesia 5(2): 77-84.
Stamatas GN, Zmudzka BZ, Kollias N, Beer JZ. 2004. Non-invasive measurements of skin pigmentation in situ. Pigment Cellular Research 17: 618-626.
Steenbergen JN, Casadevall A. 2003. The origin and maintenance of virulence for the human pathogenic fungus Cryptococcus neoformans. Microbes Infect 5: 667-675
Stevanato R, Bertelle M, Fibris S. 2014. Photoprotective characteristic of natural antioxidant polyphenols. Regulatory Toxicology and Pharmacology 69: 71-77.
Sumihe G, Max RJR, Johnly AR. 2014. Analisis fitokimia dan penentuan nilai LC50 ekstrak metanol daun liwas. Jurnal Ilmiah Sains 14(2): 125-128. Supratman U. 2010. Elusidasi Struktur Senyawa Organik. Bandung (ID): Widya
Padjadjaran. Hal: 25-45.
Susanti M, Dachriyanus, Putra DP. 2012. Aktivitas perlindungan sinar UV kulit buas Gracinia mangostana Linn. Secara in vitro. Jurnal Farmasi Indonesia Pharmacon 13(2): 61-64.
Tahir I, Jumina, Yuliastuti I. 2002. Analisis aktivitas perlindungan sinar UV secara in vitro dan in vivo dari beberapa senyawa ester sinamat produk reaksi kondensasi denzaldehida tersubstitusi dan alkil asetat [makalah]. Yogyakarta (ID): Seminar Nasional Kimia XI.
Tarman K, Gottfriend JP, Andrea P, Kurt M, Norbert A, Ludger AW, Martin U, Ulrike L. 2012. Helicascolidae C, a new lactone from an Indonesian marine algicolous strain of Daldinia eschcholzii (Xylariaceae, Ascomycota). Phytochemistry Letters 5: 83-86.
Tarangini K, Susmita M. 2013. Production, characterization and analysis of melanin from isolated marine Pseudomonas sp. using vegetable waste. Research Journal of Engineering Sciences 2(5): 40-46.
21
Velmurugan P, Yong HL, Chidambaram KV, Perumalsamy L, Jong CC, Byung TO. 2010. Effect of light on growth, intracellular and exracellular pigment production by five pigment-producing filamentous fungi in synthetic medium. Journal of Bioscience and Bioengineering 109(4): 346-350.
Visalakchi S, Muthumary J. 2010. Taxol (anticancer drug) producing endophytic fungi: an overview. International Journal Pharmaceutical Bioscience 1: 1-9.
Wakamatsu K, Ito S. 2002. Advanced chemical methods in melanin determination. Pigment Cellular Research 15: 174-183.
23
Lampiran 1 Pengaruh penambahan HCl 0,1 N terhadap perubahan pH
Lampiran 2 Hasil uji kelarutan melanin
Pelarut Hasil
Asam klorida Tidak terlarut
24
Pelarut Hasil
Natrium hidroksida (NaOH)
Larut
Akuades Tidak larut
Lampiran 3 Hasil fitokimia
Flavonoid
Lapisan berwarna jingga (+)
Tanin Warna hijau tua (-)
Saponin Busa yang stabil (-)
25
Lampiran 4 Pengendapan melanin dengan berbagai pelarut
No Jenis larutan Gambar
1 Akuades
2 Etil asetat
3 n-heksana
4 Kloroform
26
No. Jenis pelarut Gambar
6 Asam klorida (HCl)
Lampiran 5 Bobot miselia pertumbuhan kapang RS3 Hari ke Biomasa
0 0,0635
3 0,089
6 0,161
9 0,177
12 0,202
15 0,333
18 0,342
21 0,507
24 0,478
27 0,418
Sumber: Sahara 2013
Lampiran 6 Analisis ragam pengaruh pH terhadap pengendapan
pH 4 3,5 3 2,5 2
Ulangan 1 0 0 0 0,15 0,14
Ulangan 2 0 0 0 0,17 0,12
SK JK dB KT Fhit P-value Ftabel
Between Groups 0,05136 4 0,01284 160,5 1,83x10-5 5,192168 Within Groups 0,0004 5 8x10-5
27
Uji lanjut DMRT (Duncan’s Multiple Range Test)
Nilai pH N Rata-rata Notasi
4,0 2 0,00 A
3,5 2 0,00 A
3,0 2 0,00 A
2,5 2 0,16 C
2,0 2 0,13 B
Histogram
0 0 0
0,16
0,13
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16 0,18
4 3,5 3 2,5 2
Re
nde
me
n
pH
a a a
c
28