PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Profil Protein Larut Air dan Histamin serta Identifikasi Bakteri Penghasil Histidin Dekarboksilase pada Tuna Mata Besar (Thunnus obesus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2015
Stevy Imelda Murniati Wodi
RINGKASAN
STEVY IMELDA MURNIATI WODI. Profil Protein Larut Air dan Histamin serta Identifikasi Bakteri Penghasil Histidin Dekarboksilase pada Tuna Mata Besar (Thunnus obesus). Dibimbing oleh WINI TRILAKSANI dan MALA NURILMALA
Tuna sebagai salah satu sumber protein hewani yang memiliki nilai ekonomis tinggi dan merupakan komoditas ekspor Indonesia terbesar kedua setelah udang masih menghadapi berbagai permasalahan mutu dan keamanan pangan (fish quality and fish safety), diantaranya tingginya kandungan histamin yang mengindikasikan menurunnya mutu dan berkaitan dengan perubahan protein pada dagingnya. Permasalahan ini perlu dikaji lebih dalam untuk dijadikan dasar dalam memanaj risiko berkembangnya histamin dan perubahan protein serta memenuhi tuntutan konsumen akan produk yang bermutu prima dan aman.
Penelitian ini bertujuan menentukan profil protein larut air, kadar histamin, total bakteri dan total bakteri penghasil histidin dekarboksilase, serta mengidentifikasi bakteri penghasil histidin dekarboksilase tuna mata besar pada penyimpanan suhu chilling (0-4 °C) selama 9 hari. Penelitian ini terdiri dari preparasi dan penyimpanan sampel serta analisis kimia dan mikrobiologi yang meliputi analisis kandungan mioglobin, profil protein larut air, histamin dan pH, serta analisis mikrobiologi, total bakteri, total bakteri penghasil histidin dekarboksilase dan identifikasi jenis bakteri penghasil histidin dekarboksilase.
Perbedaan bagian daging dan lama waktu penyimpanan berpengaruh nyata terhadap proporsi dan penurunan kandungan mioglobin tuna (fast muscle) yaitu dari 148,20 mg/100g turun hingga 31,34 mg/100g, begitu juga pada daging gelap (dark muscle) lama waktu penyimpanan menurunkan kandungan mioglobin dari 446,21 mg/100g menjadi 58,34 mg/100g. Hasil elektroforesis secara umum mengindikasikan protein larut air dengan kisaran 10-180 kDa. Protein utama adalah protein dengan berat molekul antara 14-72 kDa. Protein yang terdeteksi antara berat molekul 14-15,4 kDa diduga sebagai protein mioglobin yang larut air
Selama penyimpanan terjadi peningkatan kadar histamin, jumlah TPC, dan jumlah bakteri penghasil histidin dekarboksilase secara nyata, baik pada bagian perut, punggung maupun ekor. Kandungan histamin daging tuna di semua bagian (perut, punggung, ekor) yang disimpan pada 0, 3, dan 6 hari tidak melebihi 50 ppm, namun pada penyimpanan hari ke-9 daging tuna pada semua bagian mengalami peningkatan dan telah melebihi batas standar yang telah ditetapkan FDA yaitu 50 ppm. Hasil identifikasi menunjukkan bahwa Bacillus subtilis dengan persentase identifikasi 99% merupakan bakteri penghasil histidin dekarboksilase pada tuna mata besar.
SUMMARY
STEVY IMELDA MURNIATI WODI. Profiles of Water Soluble Protein and Histamine and Identification of Histidine Decarboxylase Producing Bacteria on Big Eye Tuna (Thunnusobesus). Supervised by WINI TRILAKSANI and MALA NURILMALA.
Tuna as one of protein sources which has high economic value and play an important role as export commodities along with shrimp still have obstacle of fish quality and safety, for example high content of histamine indicating changes in quality, which correlated with the changes of protein in tuna meat. This problem need to be comprehensively analyzed in order to manajed the risk of histamine, protein changes and to ensure high quality and safety product as well.
This study aimed to determine the profiles of water-soluble protein, histamine level, total bacteria and histidine decarboxylase producing bacteria, as well as to identify bacterial species of histidine decarboxylase producing bacteria in big eye tuna at chilling temperature storage (0-4 °C) for 9 days.
Tuna meat location and the storage time had effect to lower the content of its myoglobin (fast muscle) from 148.20 mg /100g to 31.34 mg/100g, as well as the dark muscle from 446.21 mg/100g to 58.34 mg/100g. Analysis of SDS-PAGE showed water-soluble proteins in the range of 10-180 kDa. The main proteins were a protein with 14-72 kDa of molecular weight. Protein detected in the range of 14 to 15.4 kDa molecular weight was indicated as myoglobin protein.
The histamine level, TPC, and total of histidine decarboxylase bacteria during of storage significantly increased in all tuna meat (the abdomen, back and tail). Histamine content in all portion of tuna which stored at 0, 3, and 6 days was lower than 50 ppm, although it increased at 9th over standard of FDA (50 ppm). The identification of bacterial species showed the Bacillus subtilis was the histidine decarboxylase-producing bacteria with the 99% of identity.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PROFIL PROTEIN LARUT AIR DAN HISTAMIN SERTA
IDENTIFIKASI BAKTERI PENGHASIL HISTIDIN
DEKARBOKSILASE PADA TUNA MATA BESAR
(
Thunnus obesus
)
STEVY IMELDA MURNIATI WODI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Profil Protein Larut Air dan Histamin serta Identifikasi Bakteri Penghasil Histidin Dekarboksilase pada Tuna Mata Besar (Thunnus obesus)
Nama : Stevy Imelda Murniati Wodi
NIM : C351120011
Disetujui oleh
Komisi Pembimbing
Dr Ir Wini Trilaksani, MSc Ketua
Dr Mala Nurilmala, SPi MSi Anggota
Diketahui oleh
Ketua Program Studi Teknologi Hasil Perairan
Dr Ir Wini Trilaksani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas limpahan karunia dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini dengan judul “Profil Protein Larut Air dan Histamin serta Identifikasi Bakteri Penghasil Histidin Dekarboksilase pada Tuna Mata Besar (Thunnus obesus)”. Tesis ini merupakan salah satu syarat untuk mendapatkan gelar Magister Sains di Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Insitut Pertanian Bogor.
Penulisan tesis ini tak lepas dari bantuan berbagai pihak. Penulis mengucapkan terima kasih kepada:
1. Dr Ir Wini Trilaksani, MSc selaku Ketua komisi pembimbing serta Ketua Program Studi Teknologi Hasil Perairan dan Dr Mala Nurilmala, Spi MSi sebagai anggota komisi pembimbing yang telah banyak mencurahkan waktu dan kesabarannya dalam membimbing penulis selama penelitian dan penulisan tesis ini.
2. Prof Dr Ir Joko Santoso, MSi sebagai Ketua Departemen Teknologi Hasil Perairan yang telah memberikan arahan, masukan dan motivasi selama penulis menempuh studi di Program Studi Teknologi Hasil Perairan IPB. 3. Dr Ir Agoes M. Jacoeb, Dipl-Biol sebagai dosen penguji luar komisi yang
telah memberikan banyak masukan dalam melengkapi penulisan tesis. 4. Kedua orang tua tercinta Papi dan Mami, Cici, Bobby, Irma, Leon, Chello
dan Aidil atas doa, semangat, motivasi dan kasih sayang yang selalu diberikan selama ini.
5. Dosen dan Staf pegawai Program Studi Teknologi Hasil Perairan FPIK IPB yang telah memberikan ilmu maupun pengalaman berharga bagi penulis selama menempuh pendidikan.
6. Keluarga besar Politeknik Negeri Nusa Utara atas doa, semangat dan motivasi yang selalu diberikan.
7. Pimpinan dan karyawan PT. Nutrindo Fresfood Internasional baik yang ada di Bitung maupun di Jakarta atas bantuan dan kerjasamanya.
8. Kementrian Pendidikan Tinggi dan Kebudayaan yang telah memberikan beasiswa BPPS selama penulis menempuh pendidikan.
9. Teman-teman seperjuangan S2 THP 2010, 2011, 2012 dan 2013 atas semangat, kerjasama dan kebersamaan yang terjalin erat.
Penulis menyadari bahwa tesis ini masih memiliki kekurangan, walau demikian sangat diharapkan tesis ini dapat memberi manfaat untuk pengembangan penelitian selanjutnya.
Bogor, Maret 2015
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
2 METODE 4
Lokasi dan Waktu Penelitian 4
Bahan dan Alat 4
Pelaksanaan Penelitian 5
Analisis Mioglobin 6
Analisis Protein Larut Air dengan Metode SDS-PAGE 6
Analisis Kadar Histamin 7
Analisis Total Plate Count (TPC) 8
Analisis Total Bakteri Penghasil Histidin Dekarboksilase (Hdc) 9 Identifikasi Bakteri Penghasil Hisitidin Dekarboksilase (Hdc) 11
Rancangan Percobaan dan Analisis Data 13
3 HASIL DAN PEMBAHASAN 14
Proses Pengambilan dan Preparasi Sampel 14
Kandungan Mioglobin 15
Profil Protein Larut Air 18
Kadar Histamin 20
Nilai pH 22
Nilai Total Plate Count (TPC) 24
Total Bakteri Penghasil Histidin Dekarboksilase 25
Isolasi dan Identifikasi Bakteri Penghasil Histidin Dekarboksilase 27
4 SIMPULAN DAN SARAN 29
Simpulan 29
Saran 29
DAFTAR PUSTAKA 30
LAMPIRAN 37
DAFTAR TABEL
1 2 3
Rata-rata nilai log TPC dalam satuan CFU/g
Rata-rata nilai log bakteri penghasil Hdc dalam satuan CFU/g Hasil analisis BLAST
Ikan tuna mata besar (Thunnus obesus)
Bagian daging perut, daging punggung dan daging Ekor
Kandungan mioglobin daging tuna (a) fast muscle); (b) dark muscle Perubahan warna daging bagian perut
Perubahan warna daging bagian punggung Perubahan warna daging bagian ekor
Profil protein larut air daging tuna 0, 3 dan 6 hari Profil protein larut air hari ke-9
Kadar histamin tuna mata besar Nilai pH daging tuna
Media niven agar dan media yang ditumbuhi bakteri Hdc Elektroforegram hasil PCR DNA
DAFTAR LAMPIRAN
Uji normalitas menggunakan one sample uji Kolmogorov-Smirnov Tabel sidik ragam TPC tuna mata besar
Uji lanjut Duncan TPC tuna mata besar Tabel sidik ragam BPH tuna mata besar Uji lanjut Duncan BPH tuna mata besar Tabel sidik ragam histamin tuna mata besar Uji lanjut Duncan histamin tuna mata besar
Tabel analisis ragam mioglobin daging terang tuna mata besar Uji lanjut Duncan mioglobin daging terang tuna mata besar Tabel analisis ragam mioglobin daging gelap tuna mata besar Uji lanjut Duncan mioglobin daging gelap tuna mata besar Tabel sidik ragam pH tuna mata besar
Uji lanjut Duncan nilai pH tuna mata besar Interaksi daging dan waktu TPC tuna mata besar Interaksi daging dan waktu BPH tuna mata besar Interaksi daging dan waktu histamin tuna mata besar Interaksi mioglobin daging terang daging dan waktu Interaksi mioglobin daging gelap daging dan waktu Interaksi nilai pH daging dan waktu
Tabel perhitungan berat molekul protein tuna mata besar Kurva standar marker 0, 3, dan 6 hari
Kurva standar marker hari ke-9 Data awal bahan baku
Data suhu penyimpanan 0-6 hari Data suhu penyimpanan 9 hari
Kromatogram sequence gen 16S rRNA
Hasil pencarian homolog dengan BLAST primer 27F Hasil pencarian homolog dengan BLAST primer 1494R Termocouple
Data logger
Penyimpanan dalam styrofoam
Koloni bakteri penghasil histidin dekarboksilase pada Niven agar
1 PENDAHULUAN
Latar Belakang
Ikan tuna merupakan spesies ikan yang penting karena berperan meningkatkan sumber protein hewani, memiliki nilai ekonomis yang tinggi dalam dunia perdagangan, dan merupakan komoditas ekspor kedua terbesar setelah udang. Nilai ekspor ikan tuna tiap tahun umumnya meningkat. Pada tahun 2012 total volume ekspor ikan tuna madidihang (T.albacares) 3,770,828 ton, albakor (T. alalunga) 2,493,167 ton, tuna mata besar (T. obesus) 2,306,384 ton, tuna sirip biru (T. maccoyii) 69,740 ton. Negara yang menduduki peringkat atas sebagai tujuan ekspor tuna Indonesia adalah Jepang, Amerika Serikat dan Uni Eropa (KKP 2013).
Tuna mata besar merupakan spesies tuna yang memiliki nilai jual tinggi, hidup di perairan tropis hingga subtropis yaitu Samudera Atlantik dan Samudera Hindia pada kedalaman 20-250 meter termasuk di wilayah Selatan Jawa dan pantai utara Jawa. Jumlah produksi tuna mata besar di Indonesia merupakan produksi terbesar setelah tuna madidihang (Syarief et al. 2010). Permasalahan pokok pada perdagangan tuna seperti halnya produk perikanan lainnya, yang sangat penting untuk diperhatikan adalah mutu dan keamanan pangan ikan (fish quality and fish safety). Mutu daging tuna dipengaruhi oleh banyak faktor, antara lain: faktor alami, biologis, cara penangkapan dan penanganan setelah ikan mati. Setelah ikan ditangkap dan mati berbagai proses perubahan fisik, kimia dan organoleptik terjadi dengan cepat yang diakibatkan oleh enzim dan mikroba. Warna daging tuna dijadikan indikator dalam penentuan kesegaran ikan tuna terutama bila digunakan sebagai konsumsi sashimi dan sushi. Selama proses penyimpanan, daging merah pada tuna akan mengalami perubahan warna, dari warna merah menjadi coklat. Perubahan warna terjadi akibat oksidasi mioglobin menjadi metmioglobin. Perubahan ini juga bisa menjadi indeks mutu kesegaran ikan (Chow et al. 1989).
Mioglobin merupakan salah satu protein larut air yang terdapat pada daging yang berfungsi menyimpan oksigen yang terikat dan mentransportkannya ke mitokondria yang mempergunakan oksigen selama oksidasi nutrien sel. Mioglobin mempunyai rantai polipeptida tunggal yang mengandung 147 residu asam amino pada teleostei dengan berat molekul berkisar 14.000 - 17.000 Da dan gugus “heme” yang mengandung zat besi (Chow et al. 2009). Daging ikan tuna lebih banyak mengandung mioglobin dibanding ikan lainnya (Zapata et al. 2011). Kandungan mioglobin pada daging gelap (dark muscle) ikan tuna dapat lebih dari 3.500 mg/100 g. Kestabilan struktur mioglobin tuna berbeda satu dengan yang lain (Ochiai et al. 2009). Selain itu akibat proses autooksidasi juga timbul bau dan rasa tengik serta terjadi perubahan kelarutan protein (Ochiai 2010). Perubahan juga terjadi pada salah satu asam amino yaitu histidin yang terdegradasi menjadi histamin.
menyebabkan efek keracunan pada manusia. Histamin adalah senyawa amina biogenik yang terbentuk dari asam amino histidin akibat reaksi dekarboksilase oleh enzim histidin dekarboksilase dengan suhu optimum reaksi adalah 25 °C (Kim et al. 1999). Gejala keracunan ditandai oleh muntah, diare, kejang perut, berkeringat terus menerus, timbul tanda kemerahan, sakit kepala dan rasa terbakar pada daerah mulut. Keracunan histamin terjadi dalam beberapa menit sampai beberapa jam setelah mengkonsumsi ikan yang mengandung histamin tinggi (Taylor 1983).
Data laporan Food and Drug Administration (FDA) menunjukkan, dari tahun 2001-2005 terdapat 350 penolakan pada produk tuna Indonesia, karena kasus histamin dan logam berat. Pada bulan Mei tahun 2004, komisi kesehatan perlindungan konsumen Uni Eropa melarang impor sementara ikan tuna segar dari 16 perusahaan Indonesia, karena mengalami pembusukan, kadar histamin melebihi batas standar yang ditetapkan. Tahun 2007 Rapid Alert System for Feed and Food (RASFF) melaporkan terdapat 17 kasus impor tuna, dan data FDA juga menunjukkan catatan penolakan produk tuna Indonesia dari 8 perusahaan karena kasus histamin sepanjang tahun 2009, 6 kasus tahun 2010, 4 kasus tahun 2011 dan 1 kasus tahun 2012 (FDA 2010; 2012).
Pembentukan histamin sering disebabkan oleh penyimpanan suhu tinggi dan kesalahan penanganan yang dipengaruhi oleh kombinasi waktu dan suhu (Silva et al.1998). Suhu optimum, batas suhu terendah, jenis bakteri pembentuk histamin dan jumlah kandungan histamin bervariasi tergantung lingkungan perairan (Lopez et al. 1996). Tingginya kandungan histamin di tiap bagian daging ikan dipengaruhi oleh jumlah bakteri penghasil histidin dekarboksilase. Hasil penelitian Frank et al. (1981) menunjukkan pada suhu 37 °C histamin ikan mencapai 213 mg/100g pada bagian punggung dan 31,7 mg/100g di bagian ekor pada penyimpanan hari ke-18, hari ke-24 meningkat menjadi 481 mg/100g bagian punggung dan 289 mg/100g bagian ekor. Hasil penelitian Trilaksani et al. (2009) rata-rata kadar histamin tuna yang terbentuk pada proses pembongkaran ikan tuna di transit 14 Muara Baru – Jakarta Utara, ikan tuna grade A 2,02±0,85 ppm, grade B 2,94±0,28 ppm, grade C 3,43±0,49 ppm, dan grade D 4,42±0,47 ppm, dengan jumlah bakteri penghasil histidin dekarboksilase 2/3 dari jumlah total bakteri (TPC) dan tersebar di kulit, insang dan di usus. Satuan kadar histamin dalam daging ikan dapat dinyatakan dalam mg/100g atau ppm (mg/kg). Histamin tetap menjadi salah satu kendala dalam ekspor tuna dari daerah tropis dan sub tropis ke pasar dunia. The Food and Drug Administration (FDA, 1998) menetapkan batas standar keamanan histamin adalah 5 mg/100 g (50 ppm), sedangkan Uni Eropa menetapkan bahwa kandungan rata-rata histamin dalam ikan tidak boleh lebih dari 10 mg/100 g (100 ppm).
ornithinolytica merupakan bakteri pembentuk histamin pada tuna. Bacillus amyloliquefaciens, Bacillus subtilis dan B. Megaterium yang diisolasi dari miso; Bacillus pumilus, Bacillus sp. yang diisolasi dari anggur merupakan bakteri penghasil histamin (Kung et al. 2007; Chang et al. 2009).
Banyak faktor yang menentukan kecepatan penurunan kesegaran ikan. Suhu penyimpanan merupakan faktor utama yang mempunyai peranan penting pada ikan setelah mati. Perbedaan kesegaran ikan tuna juga dipengaruhi oleh perbedaan waktu penangkapan, kematian ikan, cara kematian, aktivitas penanganan ikan tuna di kapal, sanitasi kapal, serta efektivitas penerapan rantai dingin di palka kapal (Trilaksani et al. 2009). Penggunaan suhu rendah 0 °C setelah ikan mati dapat memperpanjang rigormortis, menekan kegiatan enzimatis, bakterial, kimiawi dan perubahan fisik sehingga dapat memperpanjang daya awet ikan. Suhu mempunyai pengaruh besar terhadap jenis bakteri pembusuk. Pertumbuhan bakteri pembusuk tertahan pada suhu -1 sampai 5 °C. Dengan demikian penurunan suhu tubuh ikan bisa mencegah penguraian bakteri secara efektif (Suwetja 2013).
Penanganan adalah kunci utama dalam menghambat terbentuknya histamin, perubahan warna, kelarutan protein, dan pertumbuhan mikroba pada tuna. Penanganan ikan dimaksudkan untuk mempertahankan kesegaran, dalam arti masih memenuhi syarat untuk bisa dikonsumsi manusia dengan jalan menghambat terjadinya pembusukan ikan. Untuk menghambat kemunduran mutu ikan, dapat dilakukan upaya pengawetan dengan teknik suhu rendah, meliputi pendinginan dan pembekuan. Pendinginan dan pembekuan yang cepat segera setelah ikan mati serta lama waktu penyimpanan merupakan tindakan yang sangat penting dalam upaya mencegah proses kemunduran mutu ikan tuna. Uni Eropa melalui European Commission (EC) menentukan bahwa suhu lebur es (melting ice), yakni (0-1) °C merupakan suhu yang tepat dalam penanganan tuna (EC 2004), sedangkan Food and Drug Administration (FDA) menetapkan batas kritis suhu untuk perkembangan histamin pada tubuh ikan yaitu 4,4 °C (FDA 2011).
Permasalahan mutu tuna tersebut di atas, sangat perlu untuk dikaji secara mendalam. Konsumen domestik maupun konsumen luar negeri saat ini, semakin menuntut produk perikanan, termasuk tuna dengan mutu prima dan aman, bebas patogen, bebas bau, dan tetap mempertahankan warna alami dari tuna. Kajian ini meliputi analisis profil protein yang larut air, mioglobin, kadar histamin, nilai pH, jumlah total bakteri dan total bakteri penghasil histidin dekarboksilase, serta jenis bakteri penghasil histidin dekarboksilase ikan tuna dalam hal ini ikan tuna mata besar.
Tujuan Penelitian
2
METODE
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Maret 2014 sampai dengan Agustus 2014. Bertempat di Laboratorium Balai Besar Pengujian Penerapan Hasil Perikanan (BBP2HP), Laboratorium Bahan Baku Hasil Perairan dan Bioteknologi II, Departemen Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Bioteknologi Hewan, Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor dan Laboratorium Center of Excellence Indigenous Biological Resources-Genome Studies (IBR-GS) FMIPA Universitas Indonesia.
Bahan dan Alat
Bahan baku yang digunakan dalam penelitian ini adalah ikan tuna mata besar. Bahan kimia yang digunakan untuk pengujian protein larut air meliputi larutan 0,5 M Tris-HCl pH 6,8, 1,5 M Tris-HCl pH 8,8, larutan acrylamide/Bis 30%, larutan SDS 10%, larutan sampel buffer (SDS reducing buffer), larutan running buffer 10x, pH 8,3, larutan APS 10%, larutan TEMED, larutan CBB staining, larutan destaining. Bahan untuk pengujian mioglobin meliputi potassium buffer, NaNO3, KCN. Bahan untuk pengujian kadar histamin meliputi metanol,
glass wool, HCl 1 N, NaOH 1 N, HCl 0,1 N, orto-ptalatdikarbosildehid (OPT) 0,1%, H3PO4 3,57 N, resin penukar ion, dan histamin dihidroklorida. Bahan untuk
analisis angka lempeng total (ALT) diantaranya plate count agar dan larutan
butterfield’s phosphate buffered. Analisis jumlah bakteri histamin membutuhkan
butterfield’s phosphate buffered dan larutan agar Niven yang terdiri dari: 0,5% trypton, 0,5% yeast exstract, 2,7% L-histidin, 0,1% CaCO3, 0,5% NaCl, 2,0%
agar, dan 0,006% phenol red. Bahan untuk isolasi bakteri berupa media Niven, Trypticase Soy Agar (TSA) dan Trypticase Soy Broth Histidine (TSBH). Karakterisasi bakteri, yakni pewarnaan Gram membutuhkan kristal violet, iodin, safranin, minyak imersi, alkohol 95%; Uji motilitas membutuhkan agar semi solid; Uji oksidase membutuhkan kertas oxidase test strip; Uji katalase membutuhkan 3% H2O2.
Pelaksanaan Penelitian
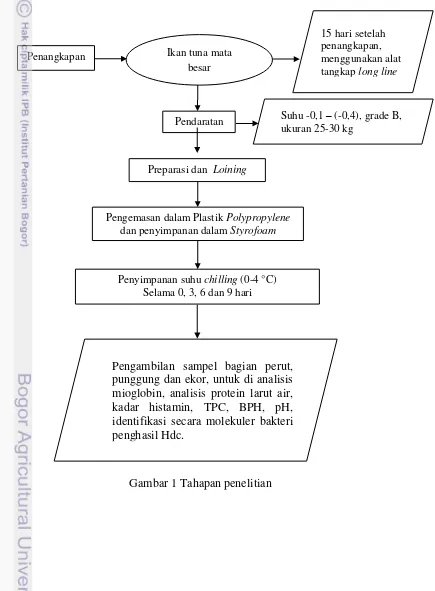
Penelitian ini terdiri dari: Preparasi dan penyimpanan sampel, serta analisis kimia dan mikrobiologi yang meliputi analisis perubahan kandungan mioglobin, profil protein larut air dengan metode SDS PAGE, analisis kadar histamin, analisis pH, analisis Total Plate Count (TPC) dan total bakteri penghasil histidin dekarboksilase (Hdc) serta isolasi, karakterisasi dan identifikasi bakteri penghasil histidin dekarboksilase. Tahapan penelitian dapat dilihat pada Gambar 1.
Gambar 1 Tahapan penelitian
Penangkapan
15 hari setelah penangkapan, menggunakan alat tangkap long line
Pendaratan Suhu -0,1 – (-0,4), grade B, ukuran 25-30 kg
Preparasi dan Loining
Pengemasan dalam Plastik Polypropylene
dan penyimpanan dalam Styrofoam
Penyimpanan suhu chilling (0-4 °C) Selama 0, 3, 6 dan 9 hari
Ikan tuna mata besar
Analisis Mioglobin (Chow et al. 2009)
Sampel diblender hingga homogen, kemudian ditimbang 1 g dalam tabung sentrifuse 50 mL dan ditambah 7 mL akuabidest dingin. Tabung beserta isinya disentrifuse pada kecepatan 3000 G selama 15 menit, dan disaring dengan menggunakan kertas saring 0,2 µm. 1 mL ekstrak dipipet, kemudian ditambah 0,5 mL potasium bufer (25 µm pH 7), divortex, ditambah 25µL larutan NaNo3 5%,
divortex kembali dan selanjutnya ditambah 25 µ L KCN 1%, divortex dan didiamkan selama 1 menit. Larutan yang diperoleh diukur serapannya dengan spektrofotometer UV pada panjang gelombang 540 nm.
Perhitungan konsentrasi mioglobin diukur berdasarkan koefisien extinction (11300) dan berat molekul (16000) dengan rumus :
Analisis Protein Larut Air dengan Metode SDS-PAGE (Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis) (Laemmli 1970)
Teknik pemisahan protein dengan elektroforesis dilakukan dalam tiga tahap, yaitu ekstraksi protein dari sampel, pembuatan gel dengan menggunakan sodium dodecyl sulfat-polyacrilamide gel electrophoresis (SDS-PAGE) dan pendeteksian pita-pita atau fraksi-fraksi protein yang terbentuk.
Pembuatan sampel buffer
Preparasi sampel menggunakan sampel buffer yang terdiri dari 4 mL dH2O;
1 mL larutan 0,5 M Tris - HCl pH 6,8; 0,8 mL gliserol; 1,6 mL larutan SDS 10%; 0,4 mL larutan β-mercaptoethanol; 0,2 mL larutan bromophenol blue 0,05%. Supernatannya diambil 20 µL lalu ditambah lemle 20 µL dengan perbandingan 1:1. Setelah itu supernatan tercampur dengan lemle dipanaskan pada suhu 100 °C selama 5 menit. Tujuannya agar terjadi denaturasi protein. Setelah dingin baru dimasukkan kedalam sumur 20 µL, kemudian dianalisis pola-pola atau pita-pitanya menggunakan SDS-PAGE.
Pembuatan gel pemisah
Pembuatan gel pemisah (separating gel) konsentrasi 12% (resolving gel/lapisan bawah) terdiri dari 3.200 µL dH2O ditambah 2.500 µ L larutan 1,5 M
Tris -HCL pH 8,8; 100 µL larutan SDS 10%; 4.050 µL larutan akrilamid 30%; 50 µL larutan APS 10%; 16 µ L TEMED) dan 4% stacking gel (lapisan atas) terdiri dari 3.050 µL dH2O ditambahkan 1.250 µL larutan 0,5 M Tris – HCL pH 6,8; 50
Elektroforesis
Proses pemisahan protein menggunakan buffer pemisah (running buffer) yang terdiri dari Tris HCL 9 g; glycine 43,2 g; SDS 10% 3 g dan H2O 600 mL.
Sampel lalu dimasukkan ke dalam sumur dengan menggunakan pipet mikro 10-20 μL, tergantung tebal tipisnya pita protein yang diinginkan. Perangkat elektroforesis dijalankan pada suhu rendah dengan tegangan 100 volt dan arus 125 mA selama 1-1,5 jam hingga bromphenol blue mencapai 1 cm dari batas bawah gel. Setelah elektroforesis selesai, gel difiksasi dengan larutan Commassie brilian blue R-250 (larutan 0,05% commassie blue 0,50 gram yang dilarutkan dalam 45% methanol 225 mL dan 10% acetic acid 50 mL dalam 45% dH2O), kemudian gel
dipucatkan dengan larutan destain yang terdiri dari campuran 50% dH2O 250 mL;
10% acetic acid 50 mL; 40% methanol 200 mL, gel direndam dengan pewarnaan biru konasi (sambil digoyang-goyang) selama 24 jam. Setelah itu gel dipucatkan dengan larutan peluntur dan digoyang-goyangkan sampai terlihat pita-pita protein (Laemmli 1970). Pita-pita protein yang muncul dan hasil SDS-PAGE dihitung retardation faktor (Rf) dengan menggunakan rumus : Rf = Jarak pergerakan pita protein dari tempat awal/Jarak pergerakan warna pelacak dari tempat awal.
Berdasarkan nilai Rf berat molekul dihitung dengan persamaan regresi logaritma dengan rumus : Y =( a x Ln(X)) + b. Persamaan ini diperoleh dari grafik antar Log BM sebagai ordinat dan Rf sebagai absis. Berdasarkan kurva kalibrasi maka dapat dihitung BM masing-masing pita protein.
Keterangan : Y = berat molekul X = nilai Rf sampel a = nilai koefisien b = nilai konstanta
Analisis Kadar Histamin (SNI 2354.10:2009)
Prinsip penentuan histamin adalah zat histamin dalam contoh dikonversikan ke dalam bentuk –OH, kemudian diisolasi dengan resin penukar ion dan diubah ke bentuk derivatnya dengan ortoptalatdikarboksilaldehida (OPT) dan diukur secara fluorometer. Hasil yang diperoleh dalam ekivalen histamin level. Prosedur kerja analisis histamin terdiri atas tiga tahap yaitu 1) Tahap ekstraksi, 2) Tahap clean up atau elusi, dan 3) Tahap pembentukan.
Tahap ekstraksi
Tahap clean up atau tahap elusi
Glass wool yang telah diberi aquades dimasukkan ke dalam kolom resin setinggi 1,5 cm. Resin netral dalam medium air dimasukkan ke kolom resin setinggi 8 cm dengan volume air di atas resin setinggi 1 cm. Labu takar 50 mL yang berisi 5 mL HCl 1 N diletakkan di bawah kolom resin untuk menampung elusi contoh yang dilewatkan pada kolom resin.
Filtrat contoh 1 mL dipipet ke dalam kolom resin, kran kolom resin dalam posisi terbuka dan hasil elusi dibiarkan menetes lalu ditampung dalam labu takar 50 mL. Aquades ditambahkan pada saat tinggi cairan 1 cm di atas resin dan cairan dibiarkan terelusi. Prosedur tersebut diulangi hingga hasil elusi dalam labu takar tepat 50 mL. Hasil elusi dapat disimpan dalam refrigerator.
Tahap pembentukan
Tiga tabung reaksi 50 mL disiapkan untuk sampel, standar, dan blanko. Filtrat sampel, larutan standar kerja, dan blanko (HCl 0,1 N) dipipet masing-masing 5 mL ke dalam tabung reaksi tersebut berturut-turut ditambahkan 10 mL HCl 0,1 N dan diaduk; 3 mL NaOH 1 N dan diaduk, kemudian didiamkan selama 5 menit; 1 mL OPT 0,1% lalu diaduk dan didiamkan selama 4 menit; 3 mL H3PO4
3,57 N dan diaduk. Pengukuran flourescene dilakukan terhadap sampel, standar, dan blanko sesegera mungkin dengan alat spektroflorometri pada panjang gelombang eksitasi 350 nm dan emisi 444 nm dalam waktu 90 menit.
Analisis Total Plate Count (TPC) (SNI 01-2332.3-2006)
Pengujian ini bertujuan untuk mengetahui jumlah total mikroba pada sampel. Sampel ditimbang secara aseptik 25 g dan ditambah 225 mL larutan
butterfield’s phospate buffered, kemudian dihomogenkan selama 1 menit.
Homogenat ini merupakan larutan pengenceran 10-1. Dengan menggunakan pipet steril, diambil 1 mL homogenat dan masukkan ke dalam botol berisi 9 mL larutan
butterfield’s phospate buffered sehingga diperoleh sampel dengan pengenceran
Analisis Total Bakteri Penghasil Histidin Dekarboksilase (Hdc) (Niven et al. 1981)
Analisis bakteri pembentuk histamin dilakukan untuk mengetahui jenis bakteri yang berperan dalam pembentukan histamin. Prinsip dari analisis bakteri pembentuk histamin adalah Enterobactericeae akan mengubah histidin menjadi histamin melalui proses dekarboksilasi yang akan menaikkan pH dan mengubah warna pada media (Niven et al. 1981).
Media Niven agar dipersiapkan dengan cara 0,5% trypton, 0,5% yeast extract, 2,7% L-histidin, 0,1% CaCO3, 0,5% NaCl, 2,0% agar, dan 0,006% phenol
red dicampurkan, kemudian dimasukkan ke dalam erlenmeyer dan diencerkan menggunakan akuades pada pH 5,3. Selanjutnya dipanaskan hingga mendidih dan disterilisasi menggunakan autoklaf pada suhu 121 °C selama 15 menit.
Sampel 25 gram dimasukkan ke dalam botol yang berisi 225 mL larutan
butterfield’s phospate buffered steril, kemudian diblender hingga larutan
homogen. Homogenat ini merupakan larutan pengenceran 10-1. Dari campuran tersebut kemudian diambil 1 mL dan dimasukkan ke dalam botol berisi 9 mL larutan butterfield’s phospate buffered sehingga diperoleh contoh dengan pengenceran 10-2, kemudian dikocok hingga homogen. Pengenceran dilakukan hingga 10-4. Satu mL larutan sampel di setiap pengenceran dimasukkan ke dalam cawan petri, lalu 12-15 mL media Niven bersuhu 45 °C dituangkan ke dalam cawan berisi sampel. Setelah media Niven memadat, cawan petri dimasukkan dalam inkubator dengan posisi terbalik selama 48 jam pada suhu 35 °C. Pengamatan dilakukan dengan menghitung jumlah koloni berwarna merah muda dengan halo pink hingga purpe halo yang merupakan koloni bakteri pembentuk histamin pada latar belakang berwarna kuning.
Isolasi Bakteri (Niven et al. 1981; Kung et al. 2009; Hwang et al. 2010)
Isolasi dan pemurnian bakteri bertujuan memperoleh isolat bakteri murni dari sampel, sehingga dapat dilakukan karakterisasi dan identifikasi bakteri yang diperoleh. Isolasi bakteri yang dilakukan menggunakan metode gores kuadran, yaitu menggoreskan larutan sampel beberapa kali menggunakan lup inokulasi di permukaan media kultur.
Larutan sampel dari setiap pengenceran untuk analisis jumlah bakteri pembentuk histamin atau ALT dipipet 0,1 mL dan dituang ke media Niven lalu diinkubasi selama 4 hari pada suhu 35 ºC. Koloni berwarna biru atau ungu digoreskan pada media trypticase soy agar (TSA) untuk memperoleh kultur murni. Penggoresan yang sempurna akan menghasilkan koloni yang terpisah. Isolat bakteri digolongkan murni jika diperoleh bentuk sel dan morfologi koloni yang seragam.
Karakterisasi Bakteri (Niven et al. 1981)
histamin. Pengujian tersebut bertujuan untuk meyakinkan bahwa isolat bakteri yang dimiliki merupakan BPH.
Kultur murni ditumbuhkan dalam 10 mL trypticase soy broth (TSB) yang ditambahkan 1% L-histidin atau disebut sebagai media trypticase soy broth histidine (TSBH), kemudian diinkubasi pada suhu 35 °C selama 24 jam. Biakan tersebut digunakan untuk pengujian kadar histamin yang dihasilkan bakteri sesuai BSN (2009a).
Morfologi koloni
Pengamatan morfologi koloni bertujuan mengetahui bentuk koloni dari atas, bentuk tepi, bentuk elevasi, dan warna koloni secara visual.
Morfologi sel
Pengamatan morfologi sel meliputi pewarnaan Gram dan uji motilitas. Pewarnaan Gram merupakan metode yang sangat bermanfaat untuk mengidentifikasi bakteri berdasarkan perbedaan warna karena perbedaan komposisi kimia dan fisika dinding sel bakteri.
Pewarnaan gram diawali dengan mengolesi inokulum yang berumur 24 jam pada kaca obyek dan difiksasi di atas api hingga kering. Kaca objek ditetesi larutan kristal violet dan didiamkan selama 1 menit. Larutan kristal violet dibuang dengan memiringkan kaca obyek dan dibilas dengan akuades lalu dikeringkan dengan tisu. Selanjutnya kaca obyek digenangi dengan larutan iodin selama 1 menit dan dibilas dengan alkohol 95% selama 15 detik, kemudian ditetesi dengan safranin selama 45 detik dan dibilas dengan akuades serta dikeringkan dengan tisu. Saat pengamatan dengan mikroskop, kaca objek ditetesi minyak imersi. Mikroskop di-setting memiliki perbesaran lensa objek 100 kali dan perbesaran lensa okuler 10 kali. Bila terbentuk warna merah muda, menandakan bakteri Gram negatif, sedangkan bila terbentuk warna ungu, menandakan bakteri Gram positif.
Bentuk sel dari preparat bakteri juga dapat diamati melalui pewarnaan gram. Sel bakteri yang berbentuk seperti bola atau elips dinamakan kokus. Sel bakteri yang berbentuk silindris atau batang dinamakan basilus. Bakteri berbentuk spiral atau spirilum terurtama dijumpai sebagai individu sel yang tidak saling melekat.
Uji motilitas dilakukan dengan cara menusukkan isolat bakteri ke dalam media semi solid agar dengan jarum ose tusuk steril, kemudian diinkubasi selama semalam pada suhu 37 ºC. Bila pertumbuhan bakteri menyebar, maka bakteri tersebut motil dan bila pertumbuhan bakteri tidak menyebar atau hanya berupa segaris mengikuti arah tusukan, maka bakteri bersifat non-motil.
Uji sifat fisiologis
bakteri dinyatakan katalase positif. Bakteri aerob memberikan reaksi positif, sebaliknya pada bakteri anaerob.
Identifikasi Bakteri Penghasil Histidin Dekarboksilase (Kuhnert et al. 1996; 2000)
Identifikasi bakteri dilakukan dengan berdasarkan data sekuen gen 16S Ribosomal RNA dengan tahapan sebagai berikut:
Peremajaan isolat bakteri
Satu ose biakan bakteri diinokulasikan ke dalam cawan petri yang berisi medium Nutrient Agar (NA). Biakan diinkubasi selama dua hari pada suhu ruang (28 °C).
Isolasi DNA
Isolasi DNA bakteri menggunakan PrepMan®Ultra (Applied Biosystems). Satu ose koloni yang diperoleh pada tahap sebelumnya (butir 1), dipindahkan ke dalam microtube berukuran 1,5 mL yang berisi 200 µL akuades steril untuk isolasi DNA. Sel disuspensikan secara homogen dengan vortex. Selanjutnya suspensi sel disentrifugasi pada kecepatan 13.300 rpm selama 1 menit, supernatan dibuang. Tambahkan 100 µL PrepMan®Ultra untuk melarutkan pelet sel, kemudian suspensi sel divorteks selama 2 menit. Selanjutnya suspensi sel diinkubasi pada suhu 95 °C selama 10 menit, kemudian disentrifugasi pada 13.300 rpm selama 2 menit. 50 µL supernatan dipindahkan ke dalam tabung baru steril, selanjutnya supernatan digunakan sebagai DNA template untuk reaksi PCR.
Amplifikasi gen 16S rRNA
Setelah DNA diperoleh, selanjutnya dilakukan menggunakan Go Taq® PCR Core System I (Promega). Gen 16S rRNA dengan panjang basa kurang lebih 1500
bp diamplifikasi dengan primer universal 27F (5’
-AGAGTTTGATCATGGCTCGA-3’) dan primer 1494R (5’
-GGCTACCTTGTTACGACTT-3’).
Volume cocktail PCR 20 µL disiapkan dengan komposisi sebagai berikut: 1 µL hasil isolasi DNA, 12,5 µL dH2O, 2 µL 10x polymerase buffer, 2 µ L of 25
mM MgCl2, 1 µL primer 27F (10 M), dan 1 µ L primer 1494R (10 M), 0.5 µL of
(10mM) dNTP, dan 1 µL 1U/ µL Taq polymerase.
Kondisi PCR adalah sebagai berikut: 95 °C selama 5 menit diikuti dengan 35 siklus pada 95 oC selama 1 menit, 55 °C selama 1 menit dan 72 °C selama 2 menit dengan satu siklus ekstensi final pada 72 °C selama 10 menit.
Gel elektroforesis hasil amplifikasi gen 16S rRNA
Purifikasi produk PCR
Purifikasi produk PCR dilakukan setelah hasil elektroforesis menunjukkan adanya pita DNA target PCR. Seluruh produk PCR dimasukkan ke dalam microtube berukuran 1,5 mL yang berisi 2 µL larutan sodium asetat 3 M, kemudian ditambahkan 50 µL ETOH absolut dan microtube diketuk-ketuk dengan jari hingga larutan menjadi putih. Selanjutnya microtube disimpan di dalam freezer (-20 °C) selama 30 menit, kemudian disentrifugasi pada 13.000 rpm selama 15 menit. Supernatan dibuang secara hati-hati dengan micropipette. Pelet kemudian dikeringkan dengan vacuum concentrator selama 30 menit. Selanjutnya DNA dilarutkan dengan nuclease free water (NFW) 13 µL, kemudian disimpan di freezer (-20 °C).
Cycle sequencing
Reaksi PCR Cycle sequencing dilakukan setelah purifikasi produk PCR. Reaksi yang dilakukan hampir mirip dengan PCR, tapi dengan menggunakan 1 primer untuk masing-masing reaksi. Untuk memperoleh sequence dari gen 16S rRNA, digunakan 2 primer. Primer yang digunakan adalah primer 27F dan primer 1494R. Komposisi cocktail PCR yang digunakan untuk setiap tabung adalah 0,5 µL primer 10 pmol, 4 µ L DNA hasil purifikasi, 1 µ L Big Dye Terminator ver. 3.1 (Applied Biosystems), 4 µL sequencing buffer, dan 0,5 µL nuclease free water sampai volume 10 µ L. Pada tahap PCR Cycle sequencing, masing-masing primer direaksikan dalam tabung yang terpisah.
PCR Cycle sequencing dilakukan dengan kondisi sebagai berikut: pemanasan pertama pada suhu 96 ºC selama 1 menit, diikuti dengan 30 siklus yang terdiri dari denaturasi 10 detik pada suhu 96 °C, annealing 5 detik pada suhu 50 °C dan 1,5 menit ekstensi pada suhu 60 °C.
Pemurnian produk PCR Cycle-sequencing
Sequencing
Sampel 13 µL dipindahkan ke dalam tabung sampel sequencing berukuran 0,5 mL. Tabung kemudian ditutup dengan septa dan diberi label. Tabung diletakkan pada sample tray dalam ABI 310 automated DNA sequencer. Sequencing dilakukan menggunakan kapiler dengan panjang 61 cm dan polymer POP-6 (Performance Optimized Polymer) (Applied Biosystems). Waktu sequencing setiap sampel adalah 120 menit. Analisis DNA untuk identifikasi menggunakan program Basic Local Alignment Search Tool (BLAST) pada database Bank gen National Center for Biotechnology Information (NCBI). Sampel yang memiliki homologi sequence 16S rDNA ≥ 99% terhadap spesies terdekat dari hasil BLAST, diidentifikasi sebagai anggota dari spesies yang sama.
Rancangan Percobaan dan Analisis Data
Data yang diperoleh dari hasil penelitian dianalisis menggunakan rancangan acak lengkap faktorial dengan 2 faktor. Faktor pertama adalah lokasi daging yang terdiri dari 3 taraf (perut, punggung dan ekor). Faktor kedua adalah waktu penyimpanan, terdiri dari 4 taraf (0, 3, 6 dan 9 hari). Masing-masing perlakuan diulang 3 kali. Pengaruh perlakuan terhadap faktor respon dianalisis menggunakan Analysis of variance (ANOVA) (Steel dan Torrie 1993).
Yijk = μ + αi+ βj + (αβ)ij +
ε
ijkDimana :
Yijk = Nilai pengamatan pada satuan percobaan ke-k yang memperoleh
kombinasi perlakuan faktor α taraf ke-i dan faktor β taraf ke-j µ = Nilai tengah umum
αi = Pengaruh lokasi daging faktor α taraf ke-i ( i = 1,2,3)
βj = Pengaruh waktu penyimpanan faktor β taraf ke-j ( j=1,2,3,4)
(αβ)ij = Pengaruh faktor interaksi pengaruh lokasi daging taraf ke-i dan lama
penyimpanan taraf ke-j €ijk = galat percobaan
Sebelum dilakukan analisis ragam dilakukan terlebih dahulu uji kenormalan data dengan uji distribusi normal. Uji kenormalan yang digunakan adalah uji Kolmogorov-Smirnov.
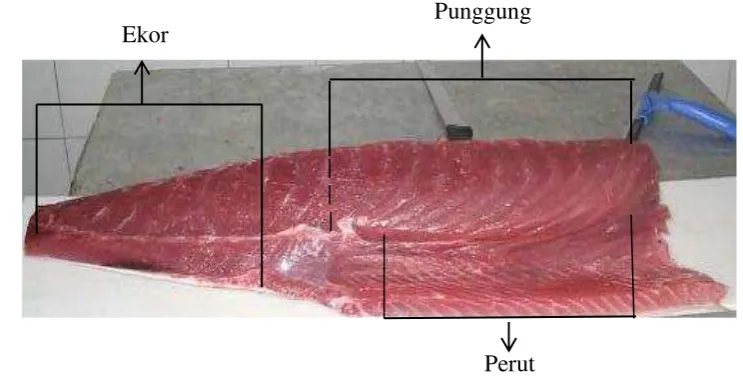
Bahan baku yang digunakan dalam penelitian ini berasal dari penangkapan berkisar hari ke-15. Bahan baku yang diperoleh selanjutnya dicuci dan dipotong dalam bentuk loin dan dimasukkan dalam plastik polypropylene, selanjutnya sampel segera dibawa ke Laboratorium BBP2HP Cilangkap dengan menggunakan styrofoam yang diberi es curai. Sampel yang sudah tersimpan baik dalam styrofoam, disimpan dengan beberapa perlakuan waktu penyimpanan yaitu 0, 3, 6 dan 9 hari (perlakuan waktu penyimpanan dihitung sejak bahan baku diterima oleh peneliti) dengan suhu penyimpanan dikontrol dengan menggunakan termometer dan alat perekam suhu (data logger) (Lampiran 24 dan 25). Suhu ruang penyimpanan yang digunakan adalah suhu chilling (0-4 °C). Pengambilan sampel dilakukan di tiga lokasi daging yaitu daging perut, punggung dan ekor dari setiap waktu penyimpanan untuk dianalisis. Lokasi pengambilan daging loin tuna mata besar ditunjukkan pada Gambar 3.
Gambar 3 Bagian daging perut, daging punggung dan daging ekor loin tuna
Kandungan Mioglobin
Ikan tuna memiliki kebiasaan untuk bermigrasi sepanjang hidupnya sehingga dapat ditemukan di beberapa perairan, bahkan spesies tertentu dapat ditemukan hampir diseluruh perairan dunia. Daging ikan tuna lebih banyak mengandung mioglobin dari pada ikan lainnya. Konsentrasi mioglobin lebih tinggi terdapat pada daging gelap (dark muscle). Mioglobin ini berfungsi menyimpan oksigen dan mentransportkannya ke mitokondria. Mitokondria berperan dalam proses resiprasi aerobik. Mitokondria mempunyai enzim yang dapat mengubah energi potensial dari makanan kemudian disimpan dalam bentuk ATP. Sel-sel yang banyak terdapat pada mitokondria adalah sel yang banyak melakukan aktivitas, misalnya otot, jantung, hati dan ginjal karena bagian tersebut paling aktif melakukan kerja dan menghasilkan energi (Subowo 2007). Analisis kandungan mioglobin tuna mata besar dilakukan di dua bagian daging yaitu daging terang (fast muscle) dan daging gelap (dark muscle). Hal ini dimaksudkan untuk membandingkan hasil analisis kandungan mioglobin yang ada pada daging
Ekor
0
terang dan pada daging gelap. Hasil analisis kandungan mioglobin dapat dilihat pada Gambar 4.
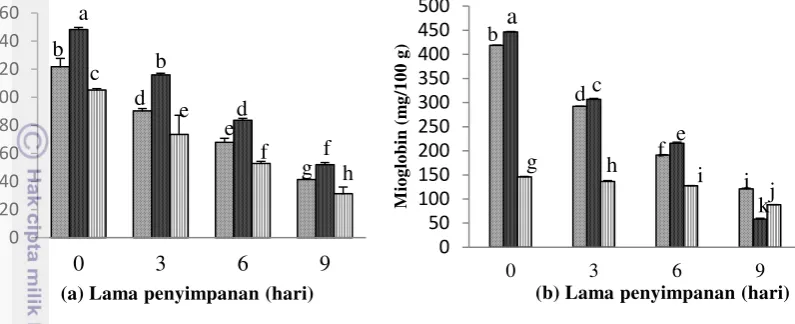
Nilai dengan huruf berbeda menunjukan berbeda nyata (p<0,05)
Gambar 4 Kandungan mioglobin daging tuna (a) fast muscle; (b) dark muscle ( perut, punggung, ekor)
Hasil analisis ragam menunjukkan perbedaan lokasi daging (perut, punggung dan ekor) serta lama penyimpanan (0, 3, 6, 9 hari) memberikan pengaruh yang berbeda nyata terhadap penurunan kandungan mioglobin daging terang (fast muscle) dan daging gelap (dark muscle) tuna mata besar (p<0,05). Interaksi perlakuan lokasi daging dan lama penyimpanan tidak berpengaruh nyata terhadap kandungan mioglobin pada daging terang (Lampiran 8), namun interaksi perlakuan lokasi daging dan lama penyimpanan memberikan pengaruh yang nyata terhadap kandungan mioglobin daging gelap tuna mata besar (Lampiran 10). Perbedaan bagian daging dan lama penyimpanan terbukti menurunkan kandungan mioglobin daging terang semua bagian yaitu dari kisaran 148,20 mg/100 g turun hingga 31,34 mg/100 g, begitu juga pada daging gelap lama penyimpanan menurunkan kandungan mioglobin dari 446,21 mg/100 g menjadi 58,34 mg/100 g. Berdasarkan uji lanjut Duncan lokasi daging (perut, punggung dan ekor) serta lama penyimpanan (0, 3, 6 dan 9 hari) menunjukkan hasil yang berbeda nyata terhadap penurunan kandungan mioglobin tuna mata besar (Lampiran 9). Pada daging gelap (dark muscle), uji lanjut Duncan menunjukkan antara daging perut dan punggung menunjukkan hasil yang tidak berbeda nyata, namun berbeda nyata pada daging ekor begitu pun dengan lama penyimpanan (Lampiran 11).
Daging gelap tuna mata besar mengandung mioglobin lebih besar dibanding daging terang. Chaijan (2005) menyatakan bahwa kandungan mioglobin daging terang sarden dan makarel masing-masing adalah 9,60 mg/100 g dan 9,40 mg/100 g sedangkan daging gelap sarden dan makarel adalah 55,6 mg/100 g dan 38,74 mg/100 g. Hasil penelitian Brown (1961) menunjukkan kadar mioglobin tuna sirip kuning daging terang adalah 92 mg/100 g dan daging gelap adalah 1360 mg/100g. Mioglobin kehilangan elektron besi karena autooksidasi sehingga menyebabkan perubahan warna merah menjadi coklat yang tidak disukai konsumen.
0 hari 3 hari 6 hari 9 hari
0 hari 3 hari 6 hari 9 hari
lebih besar terjadi pada ikan yang berkualitas rendah. Hal ini sejalan dengan hasil penelitian Nurilmala (2013) bahwa konsentrasi mioglobin dari yellowfin tuna Grade A, B, C dan D masing-masing 219,8; 145,7; 133,2; dan 90,6 mg/100 g. Perbedaan kesegaran, metode penangkapan, waktu penangkapan, kondisi penyimpanan dan cara penanganan memegang peranan penting terhadap kualitas daging ikan.
Adanya perbedaan laju penurunan bagian daging dipengaruhi oleh waktu penyimpanan, ketersediaan oksigen, penurunan pH dan peningkatan suhu (Bekhit dan Faustman 2005). Chen (2003) menyatakan bahwa kandungan mioglobin bandeng menurun seiring dengan lamanya waktu penyimpanan pada suhu chilling. Terjadi penurunan kandungan mioglobin setelah penyimpanan hari ke-15 sarden daging terang 24%, daging gelap 60%. Untuk makarel daging terang terjadi penurunan 18% dan daging gelap 60% (Chaijan 2005). Matthews (1983) menerangkan bahwa ikan tuna yang disimpan 12 hari pada suhu chilling telah mengalami perubahan warna dan membuat ikan tuna tidak dapat diterima. Penurunan kandungan mioglobin daging gelap lebih besar dibandingkan dengan daging terang selama penyimpanan, hal ini karena daging gelap memiliki kandungan mioglobin lebih tinggi dibandingkan dengan daging terang (Brown 2006). Perbedaan warna secara visual selama penyimpanan dapat dilihat pada Gambar 5, 6 dan 7.
Gambar 5 Perubahan warna daging tuna bagian perut
Gambar 6 Perubahan warna daging tuna bagian punggung
Gambar 7 Perubahan warna daging tuna bagian ekor
Perubahan warna daging tuna mata besar semua bagian pada penyimpanan sembilan hari berlangsung lebih cepat dibandingkan dengan penyimpanan 6, 3 dan 0 hari. Adanya perubahan warna daging dari warna merah menjadi kecoklatan terjadi karena adanya autooksidasi oksimioglobin menjadi metmioglobin.
Pembentukan metmioglobin terjadi pada pH 5,6 (Nurilmala 2013). Mioglobin mengandung satu rantai polipeptida yang terdiri dari 147 residu asam amino dan satu forifirin besi atau gugus “heme”. Gugus “heme” ini yang menyebabkan warna merah menjadi coklat pada mioglobin dan hemoglobin (Lehninger 1993). Eskin (1990) menyatakan bahwa perubahan mioglobin menjadi metmioglobin terjadi pada kisaran pH 5-7 diiringi dengan hilangnya elektron pada molekul besi (Fe) yang menyebabkan perubahan ferrous (Fe2+) menjadi ferric (Fe3+). Kandungan zat besi (heme) menurun dengan meningkatnya waktu penyimpanan (Chaijan 2005).
Brown (2006) juga menyatakan bahwa penguraian pigmen mioglobin daging ikan terjadi paling cepat pada bagian dekat kulit, dan semakin perlahan pada daging yang lebih dalam ke arah pusat tubuh ikan. Daging pada bagian ekor lebih cepat penguraian pigmen mioglobinnya dibandingkan dengan daging bagian punggung, dan daging bagian punggung lebih cepat daripada daging dekat kepala, karena disebabkan perbedaan ketebalan daging (Matthews 1983).
Profil Protein Larut Air
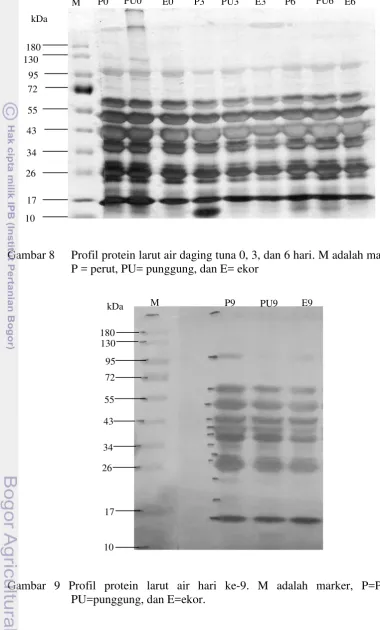
Gambar 8 Profil protein larut air daging tuna 0, 3, dan 6 hari. M adalah marker, P = perut, PU= punggung, dan E= ekor
Gambar 9 Profil protein larut air hari ke-9. M adalah marker, P=Perut, PU=punggung, dan E=ekor.
M P0 PU0 E0 P3 PU3 E3 P6 PU6 E6
kDa
95 180
72
55
43
34
26
17
10 130
kDa M P9 PU9 E9
26
17
Hasil elektroforesis secara umum didapatkan protein larut air dengan kisaran 10-180 kDa. Protein utama adalah protein dengan berat molekul antara 14-72 kDa. Protein yang terdeteksi antara berat molekul 14-15,4 kDa diduga sebagai protein mioglobin yang larut air. Pada saat elektroforesis berlangsung, protein akan bergerak dari elektroda negatif menuju ke elektroda positif sampai jarak tertentu pada gel poliakrilamida yang tergantung pada berat molekulnya. Semakin rendah berat molekulnya, semakin jauh protein bergerak (mobilitas tinggi), Sebaliknya protein dengan berat molekul lebih besar akan bergerak pada jarak yang lebih pendek (mobilitas rendah). Protein dengan mobilitas tinggi akan berhenti bergerak pada bagian gel yang lebih bawah, sedangkan protein dengan mobilitas rendah berhenti bergerak pada bagian atas gel (Fatchiyah et al. 2011).
Thiansilakul et al. (2012) menyatakan bahwa berat molekul mioglobin ikan mas yang di simpan selama sembilan hari pada pH 6,0 adalah 16 kDa. Fosmire dan Brown (1976) menambahkan bahwa berat molekul sardin 14,6 kDa, tuna ekor kuning dan tuna mata besar 16,2 kDa, sedangkan BM bandeng 15,9 kDa (Chen dan Chow 2001). Gandotra et al. (2012) menjelaskan bahwa ikan yang disimpan pada suhu 4 °C selama penyimpanan 21 hari mengalami penurunan protein 54,30%. Adanya penurunan kelarutan protein merupakan tanda telah terjadi denaturasi pada struktur protein. Gugus amino dan karboksil yang tidak terlibat pada ikatan peptida dapat memiliki muatan elektrostatik di dalam larutan sehingga gugus ini terlibat dalam interaksi protein dan air melalui ikatan lemah hidrogen (protein larut dalam air). Pada saat interaksi protein dan air meningkat, maka interaksi hidrofobik protein menjadi berkurang dan mengakibatkan protein menjadi semakin polar (bermuatan) sehingga protein menjadi larut air (Gehring et al. 2009).
Penurunan pH ikan dan lama penyimpanan mengakibatkan penurunan kelarutan protein yang cukup besar. Protein mengalami kekeruhan terbesar pada saat mencapai pH isoelektrik yaitu pH dimana protein memiliki muatan positif dan negatif yang sama.
Kadar Histamin
0
cakalang 1192 mg/100 g, tuna ekor kuning 740 mg/100 g, kembung 600 mg/100 g, dan albakor yang tertinggi sampai 2 g/100 g. Hanya ikan yang mengandung histidin bebas di atas 100 mg/100 g yang mampu menghasilkan histamin (Mangunwardoyo et al. 2007). Hasil analisis kadar histamin ikan tuna mata besar selama perlakuan penyimpanan suhu chilling disajikan pada Gambar 10.
Nilai dengan huruf berbeda menunjukkan berbeda nyata (p<0,05)
Gambar 10 Kadar histamin tuna mata besar ( perut, punggung, ekor).
Hasil analisis ragam menunjukkan bahwa bagian daging (perut, punggung dan ekor) serta waktu penyimpanan memberikan pengaruh yang berbeda nyata terhadap peningkatan kadar histamin (p<0,05). Selain itu interaksi antara lokasi daging dan waktu penyimpanan juga memberikan pengaruh yang berbeda nyata terhadap peningkatan kadar histamin tuna mata besar (Lampiran 6). Perbedaan bagian daging dan waktu penyimpanan terbukti meningkatkan kadar histamin semua bagian yaitu dari kisaran 3,05 ppm meningkat menjadi 131,10 ppm. Kadar histamin semakin meningkat dengan semakin lamanya waktu penyimpanan. Daging tuna di semua bagian (perut, punggung, ekor) yang disimpan pada 0, 3, dan 6 hari tidak melebihi 50 ppm, namun pada penyimpanan hari ke-9 daging tuna pada semua bagian mengalami peningkatan dan telah melebihi batas standar yang telah ditetapkan FDA yaitu 50 ppm (FDA 2011). Berdasarkan uji lanjut Duncan perbedaan lokasi daging (perut, punggung dan ekor) serta waktu penyimpanan (0, 3, 6 dan 9 hari) menunjukkan hasil yang berbeda nyata terhadap peningkatan kadar histamin tuna mata besar (Lampiran 7). Hal ini menunjukkan bahwa lokasi daging dan waktu penyimpanan merupakan faktor yang menentukan pembentukan kadar histamin dalam daging ikan.
menunjukkan kadar histamin tertinggi pada bagian punggung 481 mg/100 g, diikuti bagian ekor 289 mg/100 g pada penyimpanan 24 jam suhu 37 °C.
Batas yang ditentukan oleh Uni Eropa untuk histamin adalah 100 ppm. Seluruh negara memiliki persyaratan teknis histamin lebih ketat dari uni Eropa, kecuali Indonesia dan Codex Alimentarius Commission. Alasan ilmiah yang mendasari penetapan persyaratan teknis histamin Amerika Serikat dan Kanada ialah distribusi histamin yang tidak merata dalam daging ikan sehingga kemungkinan adanya bagian lain dari tuna dengan kadar histamin 500 ppm jika ditemukan kadar histamin 50 ppm pada salah satu bagian daging lainnya. Jepang menetapkan batas histamin 50 ppm karena konsumsi tuna lebih banyak ditujukan untuk konsumsi mentah (sashimi dan sushi) sehingga membutuhkan kualitas tuna yang prima. Uni Eropa tidak menekankan secara khusus pembahasan secara ilmiah penetapan batas maksimal histamin karena standar yang digunakan mengacu pada standar Codex Alimentarius Commission (Trilaksani 2011).
Guizani et al. (2005) menyatakan kadar histamin meningkat dengan bertambahnya waktu penyimpanan. Walaupun Hasil penelitian Du et al. (2002) menunjukkan bahwa pada suhu 4 °C dengan lama penyimpanan 9 hari tercatat telah terbentuk histamin 68,8 ppm dengan Log ALT mendekati 7,5 CFU/g dan Log BPH 5,2 CFU/g. Hal ini membuktikan bahwa, meskipun penyimpanan pada suhu dingin tidak benar-benar mencegah pertumbuhan mikroorganisme yang memiliki aktivitas histidin dekarboksilase.
Selama histidin masih tersedia pada daging, enzim histidin dekarboksilase akan terus bekerja membentuk histamin. Alsalvar et al. (2011) menyampaikan bahwa kandungan asam amino histidin pada ikan tuna adalah 82-90 mg/g protein. Silva et al. (1998) menambahkan bahwa hingga penyimpanan hari ke-12, kadar histidin pada ikan tuna masih tersedia 300 mg/g. Menurut Torido et al. (2012), histamin dalam daging ikan terakumulasi dimulai pada penyimpanan hari ke-5 dimana hasil penelitiannya menyatakan pada suhu 4 °C terdeteksi kadar histamin 300 ppm pada penyimpanan hari ke-5 dan 800 ppm penyimpanan hari ke-7. Peningkatan kadar histamin terutama pada hari ke-9 diduga disebabkan oleh aktivitas yang intensif dari bakteri-bakteri penghasil histidin dekarboksilase.
Histamin merupakan penyebab utama keracunan scombrotoksin. Akan tetapi, histamin bukan indikator satu-satunya dalam penentuan scombrotoksin karena biogenik amin lainnya juga mempengaruhi aktivitas histamin dalam tubuh. Putresin dan kadaverin memulai aktivitas histamin sebagai racun dalam tubuh dengan cara menghambat enzim diamine oksidase (DAO) dan histamine methyl transferase (HMT). Enzim tersebut diproduksi secara alami di saluran pencernaan yang berfungsi menyerap serta menghentikan aktivitas histamin dalam tubuh (Lehane dan Olley 2000).
Nilai pH
5.40
ekstrim. Hal tersebut dapat disebabkan oleh nilai pH yang ekstrim dapat merusak protein yang merupakan komponen penyusun enzim (Rahman et al. 2004). Selama penyimpanan ikan tuna mata besar terjadi penurunan pH pada tiap-tiap bagian. Penurunan pH terjadi akibat penimbunan asam laktat hasil penguraian glikogen yang terdapat dalam daging. Hasil analisis pH ikan tuna mata besar disajikan pada Gambar 12.
Nilai dengan huruf berbeda menunjukkan berbeda nyata (p<0,05)
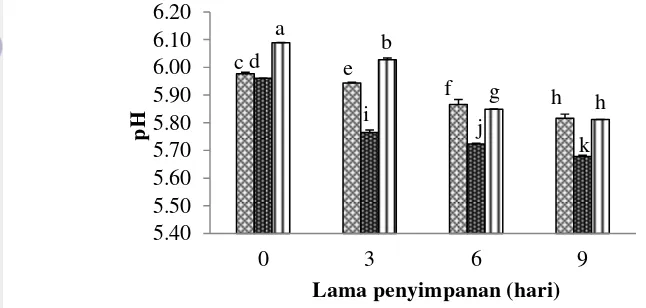
Gambar 11 Nilai pH daging tuna ( perut, punggung, ekor).
Hasil analisis ragam menunjukkan bahwa perbedaan daging dan lama penyimpanan memberikan pengaruh nyata terhadap nilai pH tuna mata besar (p<0,05). Interaksi kedua perlakuan juga memberikan pengaruh yang nyata terhadap nilai pH tuna mata besar. Nilai pH akan semakin menurun seiring semakin banyaknya asam laktat yang terbentuk dan penurunan ATP. Nilai pH daging tuna mata besar pada daging bagian perut pH tetap konstan sampai pada hari ke-3 dan mengalami penurunan pada hari ke-6 dan hari ke-9. Bagian punggung hari ke-3 dan ke-6 pH konstan, tetapi masuk hari ke-9 terjadi penurunan pH sedangkan pada bagian ekor pH menurun tajam pada penyimpanan hari ke-9. Nilai pH daging ikan tuna mata besar pada penelitian ini mengalami penurunan pada penyimpanan hari ke-9. Hasil uji lanjut Duncan menunjukkan perbedaan daging dan lama waktu penyimpanan memberikan hasil yang berbeda nyata terhadap nilai pH tuna mata besar. Perbedaan derajat keasaman yang dinyatakan dengan pH pada ikan yang telah mati secara umum disebabkan oleh adanya perbedaan kandungan glikogen serta perbedaan ketebalan daging antara tiga bagian daging ikan.
Penggunaan suhu rendah mempengaruhi fluktuasi nilai pH pada tuna mata besar. Semakin rendah suhu yang digunakan maka aktivitas enzim semakin terhambat. Penurunan pH disebabkan oleh terbentuknya asam laktat hasil reaksi pemecahan glukosa oleh enzim yang terdapat dalam daging. Suhu rendah menyebabkan akumulasi asam laktat berjalan lambat sehingga penurunan pH ikan juga berlangsung lambat (Brown 2006). Terjadinya penurunan nilai pH disebabkan proses aktivitas enzim dalam menguraikan protein dalam daging ikan dari protein kompleks menjadi pepton dan asam-asam amino sehingga menyebabkan terjadinya perubahan tekstur daging ikan, perubahan flavor, serta perubahan warna daging. pH rendah juga meningkatkan autooksidasi dari daging ikan sehingga mempengaruhi kelarutan protein (Thiansilakul et al. 2012).
Nilai Total Plate Count (TPC)
Mikroba merupakan salah satu penyebab utama gangguan kesehatan pada bahan pangan. Tuna merupakan bahan pangan yang memiliki rantai penanganan yang panjang dan lama. Penanganan mulai dari penangkapan, penyimpanan, pengolahan hingga distribusi. Waktu penanganan yang lama dan perlakuan yang berbeda dapat meningkatkan potensi kontaminasi mikroba ke bahan pangan. Analisis total TPC bertujuan untuk menentukan secara kuantitatif jumlah koloni mikroorganisme yang tumbuh pada produk secara umum. Adanya pertumbuhan mikroba dalam bahan pangan dapat menyebabkan kerusakan dan kemunduran yang ditandai adanya perubahan-perubahan penampakan, bau, rasa, tekstur dan terbentuknya komponen-komponen yang bersifat racun. Kerusakan bahan pangan oleh mikroba menyebabkan bahan pangan menjadi tidak layak untuk dikonsumsi dan berbahaya bagi kesehatan (Hidayat et al. 2006). Ikan tuna merupakan bahan pangan yang memiliki kandungan air bebas relatif tinggi. Ikan tuna juga memiliki rantai penanganan yang panjang dan lama. Penanganan dimulai dari penangkapan, penyimpanan, pengolahan hingga distribusi. Waktu penanganan yang lama dan perlakuan yang berbeda dapat meningkatkan potensi kontaminasi mikroba ke bahan pangan. Hasil analisis TPC ikan tuna dengan lama penyimpanan yang berbeda dapat lihat pada Tabel 1.
Tabel 1 Rata-rata nilai log TPC dalam satuan CFU/g Lama
Penyimpanan (hari)
Lokasi daging
Perut Punggung Ekor
0 3,76 ± 0,62ab 3,41 ± 0,42a 3,35 ± 0,41a
3 4,42 ± 0,54bcd 3,73 ± 0,57ab 3,70 ± 0,05ab
6 5,04 ± 0,17de 4,85 ± 0,04cde 3,85 ± 0,10ab
9 5,08 ± 0,98de 5,38 ± 0,65e 4,02 ± 0,01abc
Nilai dengan huruf yang berbeda pada kolom yang sama menunjukkan berbeda nyata (p<0,05)
Hasil analisis ragam menunjukkan bahwa perbedaan lokasi daging dan waktu penyimpanan memberikan pengaruh yang berbeda nyata terhadap peningkatan jumlah TPC tuna mata besar (p<0,05), namun interkasi perlakuan yang di berikan tidak memberikan pengaruh yang nyata (Lampiran 2). Pada penyimpanan 0 hari daging tuna memiliki nilai log TPC sekitar 3,35 – 3,76 CFU/g. Nilai log TPC terus meningkat ketika memasuki penyimpanan hari ke-9 yaitu sekitar 4,02 – 5,38 CFU/g. Berdasarkan uji lanjut Duncan pertumbuhan jumlah TPC antara daging perut dan punggung tidak berbeda nyata, namun berbeda nyata pada daging ekor. Penyimpanan 0 hari dan 3 hari menunjukkan hasil yang tidak berbeda nyata, namun berbeda nyata pada penyimpanan 6 hari dan 9 hari.
– Utara rata-rata log TPC ikan tuna grade A 4,23±0,11 CFU/g (1,7 x 104 CFU/g), grade B 4,43±0,03 CFU/g (2,7x104 CFU/g), grade C 4,68±0,11 CFU/g (4,8x104 CFU/g), dan grade D 4,84±0,10 CFU/g (6,9x104 CFU/g). Menurut Silva et al. (1998), pada suhu 0 ºC nilai log bakteri yang tumbuh pada ikan tuna segar pada penyimpanan 2 hari dan 7 hari berturut-turut 3,2 CFU/g dan 4 CFU/g. Jumlah bakteri pada ikan terus mengalami peningkatan seiring dengan lamanya penyimpanan
Pertumbuhan mikroba pada bahan pangan dipengaruhi oleh beberapa faktor yaitu ketersediaan nutrisi, aw, jumlah oksigen, temperatur dan nilai pH. Semakin
menurun mutu ikan tuna selama proses penyimpanan, maka kandungan bakteri pembusuk dalam daging ikan tersebut semakin besar. Pada permukaan kulit, bakteri bergerak ke seluruh tubuh dan selama penyimpanan, bakteri menyerang daging dan bergerak diantara serat otot (Trilaksani et al. 2009).
Total Bakteri Penghasil Histidin Dekarboksilase
Selama proses kemunduran mutu, bakteri memproduksi enzim dekarboksilase yang akan merubah histidin bebas dan asam amino lain pada daging ikan menjadi histamin dan amin biogenik lain misalnya putresin (dari ornithin), kadaverin (dari lysin), dan spermindin dan spermin (dari arginin). Bakteri pendegradasi histidin pada umumnya berasal dari famili Enterobacteriaceae dan Bacillaceae. Bakteri yang paling potensial memproduksi enzim histidin dekarboksilase adalah Morganella morganii, Klebsiella pneumonia, Hafnia alvei dan Proteus morganii. Bakteri ini tumbuh baik pada suhu 37 °C, 25 °C, dan 10 °C tetapi juga dapat tumbuh pada suhu 5 °C. Uni Eropa melalui European Commission (EC) menentukan bahwa suhu lebur es (melting ice) yakni 0-1 °C merupakan suhu yang tepat dalam penanganan tuna, sedangkan Food and Drug Administration (FDA) menetapkan batas kritis suhu untuk perkembangan histamin pada tubuh ikan yaitu 4,4 °C (FDA 2001). Secara umum jumlah bakteri penghasil histidin dekarboksilase yang dapat diterima atau layak untuk konsumsi sama dengan ketentuan jumlah bakteri dengan TPC yaitu tidak melebihi 5x105 CFU/g (BSN 2006c). Jumlah bakteri pembentuk histidin dekarboksilase pada ikan tuna mata besar dapat dilihat pada Tabel 2.
Tabel 2 Rata-rata nilai log bakteri penghasil Hdc dalam satuan CFU/g Lama
Penyimpanan (hari)
Lokasi daging
Perut Punggung Ekor
0 1,3 ± 0,78ab 1,8 ± 0,14abc 0,9 ± 0,17a
3 1,8 ± 0,20abc 2,2 ± 0,92bcd 2,0 ± 0,16abcd
6 3,3 ± 0,21def 2,9 ± 0,42cde 2,8 ± 0,09cde
9 4,1 ± 0,59ef 4,4 ± 1,18f 3,3 ± 0,14def
Nilai dengan huruf yang berbeda pada kolom yang sama menunjukkan berbeda nyata (p<0,05)
4,4 CFU/g. Pada penyimpanan 0 hari, semua bagian memiliki jumlah bakteri penghasil Hdc cukup rendah dibandingkan dengan penyimpanan hari ke-9. Hal ini sejalan dengan hasil analisis kadar histamin dan nilai TPC semua bagian ikan tuna mata besar. Kadar histamin dan nilai TPC pada penyimpanan 0, 3 dan 6 hari lebih rendah dibandingkan pada penyimpanan 9 hari. Berdasarkan hasil analisis ragam, bahwa perbedaan daging (perut, punggung dan ekor) tidak memberikan pengaruh yang nyata terhadap peningkatan jumlah bakteri penghasil Hdc (p>0,05), namun perbedaan lama waktu penyimpanan memberikan pengaruh nyata terhadap peningkatan jumlah total bakteri pengahsil Hdc. Interaksi antara kedua perlakuan menunjukkan hasil yang tidak berbeda nyata (Lampiran 4). Pada umumnya bakteri penghasil histidin dekarboksilase merupakan golongan bakteri Gram negatif jenis mesofilik (Butler et al. 2010). Du et al. (2002) menyatakan bahwa bakteri penghasil histidin dekarboksilase ditemukan pada fillet tuna yang disimpan pada suhu 0 °C, 4 °C, 10 °C, dan 22 °C. Berdasarkan uji lanjut Duncan menunjukkan perbedaan waktu penyimpanan 0, 3, 6 dan 9 hari menunjukkan hasil yang berbeda nyata (Lampiran 5).
Trilaksani et al (2009) melaporkan bahwa jumlah bakteri pembentuk histamin (BPH) pada proses pembongkaran ikan tuna di transit 14 Muara Baru Jakarta dengan rata-rata log BPH ikan tuna grade A 2,78±0,52 CFU/g (0,6x103 CFU/g), grade B 2,95±0,46 CFU/g (0,9x103 CFU/g), grade C 3,04±0,41 CFU/g (1,1x103 CFU/g), dan grade D 3,20±0,50 (1,6x103 CFU/g). Jumlah bakteri pembentuk histamin lebih rendah dari jumlah total bakteri (TPC). Hal ini karena tidak semua bakteri mampu menghasilkan enzim Hdc yang merupakan syarat sebagai pembentuk histamin. Kehadiran bakteri penghasil Hdc dalam jumlah tinggi tidak selalu berhubungan dengan kadar histamin yang tinggi dalam sampel. Hal ini disebabkan oleh respon dan isolat bakteri sampel bervariasi dalam kecepatan dan kemampuan memproduksi histamin. Beberapa kondisi lain yang mempengaruhi kecepatan produksi histamin dan biogenik amin lainnya adalah ketersediaan asam amino histidin bebas (Allen 2004).