KONSTRUKSI DAN ANALISIS KUALITAS PUSTAKA
GENOM KENTANG (Solanum tuberosum L.) UNTUK
SEKUENSING GENOM TOTAL
YULIANA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Konstruksi dan Analisis Kualitas Pustaka Genom Kentang (Solanum tuberosum L.) untuk Sekuensing Genom Total adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
YULIANA. Konstruksi dan Analisis Kualitas Pustaka Genom Kentang (Solanum tuberosum L.) untuk Sekuensing Genom Total. Dibimbing oleh I MADE ARTIKA dan I MADE TASMA.
Salah satu usaha untuk meningkatkan produktivitas kentang yaitu melalui informasi genetik kentang. Tujuan penelitian yaitu mengkonstruksi pustaka genom dari empat genotipe kentang di Indonesia (CIP 392781, PT 29, Amudera dan Margahayu) dan menganalisis kualitas pustaka genom untuk sekuensing genom total. Konstruksi pustaka genom dilakukan secara in vitro dengan menempelkan adaptor pada ujung fragmen DNA. Pustaka genom selanjutnya diklasterisasi dan disekuensing menggunakan cBOT cluster generation dan NGS HiSeq 2000. Pustaka genom yang berhasil dikonstruksi berukuran 300-600 bp dengan konsentrasi 13.08-60.14 nM. Pustaka genom yang dikonstruksi telah memenuhi persyaratan untuk sekuensing genom total. Jumlah basa yang dihasilkan dari proses sekuensing yaitu sebanyak 287.2 x 109bp. Klaster pustaka genom dengan nilai Q scores di atas 30 yang dihasilkan lebih besar dari 88.6%. Tingkat kesalahan pembacaan basa selama proses sekuensing sebesar 0.28-1.01%%. Secara keseluruhan hasil sekuensing genom termasuk ke dalam kategori ideal.
Kata kunci : Kentang, Next Generation Sequencing, Pustaka genom, Sekuensing genom total.
ABSTRACT
YULIANA. Construction and Quality Analysis of Potato (Solanum tuberosum L.) Genomic Library for Whole Genome Sequencing. Under the direction of I MADE ARTIKA and I MADE TASMA.
One of the efforts to improve productivity of the potato with the genetic information. The purpose of this study was to construct genomic libraries of four potato genotypes of Indonesia (CIP 392781, PT 29, Amudera and Margahayu) and analyze the quality of genomic library for total genomic sequencing. Genomic library construction was performed in vitro by attaching the adapter to the ends of DNA fragments. This was followed by, clustering and sequencing of genomic library using the cBOT claster Generation and NGS HiSeq2000. Genomic libraries were successfully constructed with a size of 300-600 bp and concentration of 13.08 – 60.14 nM. The genomic libraries have met the requirements for total genome sequencing. The amount of base generated from the sequencing process was 287.2 x 109 bp. Cluster of genomic library produced with the value of Q scores above 30 was more than 88.6%. Base reading error rate during the sequencing process was 0.28-1.01%. Over all result from this genomic sequencing was belong to the ideal category.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
KONSTRUKSI DAN ANALISIS KUALITAS PUSTAKA
GENOM KENTANG (Solanum tuberosum L.) UNTUK
SEKUENSING GENOM TOTAL
YULIANA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala yang telah memberikan rahmat dan karunia-Nya. Shalawat dan salam semoga selalu tercurah kepada Nabi Muhammad SAW beserta seluruh keluarga, sahabat dan para pengikutnya sampai akhir zaman sehingga karya ilmiah ini sebagai salah satu syarat memperoleh gelar Sarjana Sains pada Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2013 hingga Juni 2014 ini ialah biologi molekuler, dengan judul Konstruksi dan Analisis Kualitas Pustaka Genom Kentang (Solanum tuberosum L.) untuk Sekuensing Genom Total.
Ucapan terimakasih penulis haturkan kepada kedua pembimbing penelitian yaitu Dr I Made Artika MApp Sc dan Dr I Made Tasma MSc atas semua ilmu, saran dan dukungan yang diberikan selama penyusunan karya ilmiah ini. Terima kasih juga penulis ucapkan kepada Mbak Ida Rosdianti SSi, Bapak Dani Satyawan MSi, Bapak Habib Rijzaani MSi dan Kak Ihsan yang telah banyak membantu dalam teknis pelaksanaan penelitian, kepada kedua orang tua dan seluruh keluarga yang selalu menginspirasi penulis untuk selalu berjuang keras dan menjadi lebih baik.
Penulis juga menyampaikan terima kasih kepada Syahdan, Asep, Mbak Titin, rekan-rekan Biokimia 47 dan penghuni 4S kostan atas dukungan, kritik, bantuan dan sarannya selama penelitian dan penyusunan karya ilmiah ini. Semoga karya ilmiah ini dapat bermanfaat bagi penulis dan untuk perkembangan ilmu pengetahuan umumnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
METODE ... 2
Bahan dan Alat ... 2
Prosedur Penelitian ... 3
HASIL ... 8
PEMBAHASAN ... 15
SIMPULAN DAN SARAN ... 26
Simpulan ... 26
Saran ... 26
DAFTAR PUSTAKA ... 26
LAMPIRAN ... 29
DAFTAR TABEL
Halaman 1 Kuantitas dan kemurnian DNA genom total kentang. 8 2 Konsentrasi double stranded DNA hasil isolasi 9
3 Kuantitas dan kemurnian DNA 10
4 Kuantitas dan kemurnian DNA setelah tahapan adenilasi ujung 3’ 10
5 Kuantitas dan kemurnian DNA 11
6 Kualitas dan kuantitas pustaka 12
7 Kuantitas pustaka genom kentang diukur menggunakan qPCR 13 8 Jumlah basa dan kualitas klaster pustaka genom 13 9 Densitas dan kualitas pustaka genom hasil sekuensing 14
10Tingkat kesalahan (error rate) 15
DAFTAR GAMBAR
1 Elektroforegram DNA genom hasil isolasi 8
2 Elektroforegram DNA genom kentang hasil fragmentasi 9
3 Elektroforegram DNA hasil purifikasi 10
4 Elektroforegram DNA genom kentang hasil amplifikasi 11 5 Elektroforegram pustaka genom kentang dengan analisis bioanalyzer 12 6 Kualitas pustaka genom kentang menggunakan photocap_MW 12
7 Histogram jumlah klaster 14
DAFTAR LAMPIRAN
1 Strategi penelitian 29
2 Hasil pengukuran kuantitas pustaka genom 30
3 Grafik intensitas persentase hasil sekuensing pustaka genom 31
4 Proses klasterisasi di dalam cBOT 31
PENDAHULUAN
Kentang (Solanum tuberosum L.) merupakan salah satu komoditas sayuran penting yang termasuk dalam subsektor hortikultura di Indonesia. Kentang termasuk sayuran semusim, berumur pendek, dan berbentuk perdu dan merupakan tanaman semusim karena hanya satu kali berproduksi dan setelah itu mati (Samadi 2007). Kentang merupakan salah satu pangan utama dunia sesudah padi, gandum dan jagung yang punya asam amino lengkap dibandingkan padi dan gandum yang kekurangan asam amino lisin dan jagung yang kekurangan asam amino triptofan. Kentang juga memiliki nutrisi yang tinggi diantaranya karbohidrat, protein, mineral, asam nukleat, beberapa vitamin C, vitamin B kompleks serta vitamin A. kJ (Wagih dan Wiersena 1994 ; Wattimena 1996).
Produktivitas kentang di Indonesia masih tergolong rendah karena area pertanamannya hanya di daerah tertentu saja. Menurut data Badan Pusat Statistik (2014), produktivitas kentang di Indonesia pada tahun 2012 adalah sebesar 16.58 ton/Ha dengan jumlah produksi sebesar 1.094.240 ton pada luas areal lahan 65.989 Ha dan data sementara BPS untuk tahun 2013 produktivitas kentang mengalami penurunan menjadi sebesar 16.27 ton/Ha dengan produksi kentang sebesar 1.023.381 ton pada luas lahan panen 62.900 Ha. Data ini menunjukkan penurunan terhadap kentang baik dari segi lahan maupun hasil produksi panen kentang ini sendiri.
Menurut Listanto (2010), rendahnya produktivitas kentang disebabkan oleh beberapa faktor antara lain : tidak tersedianya varietas super, mutu benih yang rendah, serangan hama dan penyakit serta teknik budidaya maupun penanganan pasca panen yang kurang tepat. Usaha-usaha untuk meningkatkan produktivitas kentang telah banyak dilakukan. Perbaikan tanaman dan peningkatan produksi lebih lanjut menurut Puspita (2002), dapat dicapai dengan pemanfaatan sumber plasma nutfah, baik melalui pemuliaan tanaman secara konvensional maupun rekayasa genetika. Produksi pangan pada masa mendatang akan lebih banyak bergantung pada penerapan teknologi daripada peningkatan luas lahan pertanian. Teknik yang banyak berkembang sekarang diantaranya adalah teknik rekayasa genetika.
2
Tahapan sekuensing genom total kentang diawali dengan mengkonstruksi pustaka genom kentang. Konstruksi pustaka genom menggunakan Low Throughput Protocol dari illumina dan disekuensing menggunakan NGS Illumina Hiseq 2000. Konstruksi pustaka ini relatif sangat mudah dan singkat karena tidak membutuhkan vektor untuk menyisipkan fragmen DNA dan juga tidak membutuhkan ruangan khusus untuk penyimpanan. Konstruksi ini juga tidak membutuhkan DNA dalam jumlah banyak hanya membutuhkan double stranded DNA (dsDNA) dengan konsentrasi rendah (20 ng/uL).
Penelitian ini bertujuan mengkonstruksi dan menganalisis kualitas pustaka genom total untuk mengetahui karakteristik genom kentang empat genotipe kentang yang diteliti. Hipotesis penelitian ini adalah dapat mengkonstruksi pustaka genom kentang dan kemudian disekuensing menggunakan NGS Hiseq 2000. Manfaat yang diperoleh dari penelitian ini yaitu diperoleh informasi dan studi keseluruhan tentang genom kentang. Manfaat lain yaitu urutan DNA yang dihasilkan diharapkan mampu untuk menunjang program perbaikan genetika tanaman untuk menunjang program pemuliaan tanaman kentang.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan untuk isolasi DNA adalah daun kentang yang diambil dari Balai Penelitian Sayuran di Lembang dan yang ditanam di BB Biogen dengan empat genotipe kentang (CIP 392781, PT 29, Amudra dan Margahayu), es batu, etanol teknis, bufer ekstraksi CTAB (Cetil Trimetil Amonium Bromida), NaOAc (natrium asetat), chisam (kloroform : isoamil alkohol) dengan perbandingan 24 : 1, isopropanol, bufer TE, etanol absolut dan etanol 70%, natrium bisulfit, dan 2% polivinilpirolidon. Bahan-bahan yang digunakan untuk fragmentasi DNA adalah DNA hasil isolasi dan resuspension buffer.
Bahan-bahan yang digunakan untuk modifikasi ujung fragmen DNA adalah end repair control, end repair mix, AMPure XP Beads, etanol 80%, dan resuspension buffer. Bahan-bahan yang digunakan untuk adenilasi ujung 3’OH DNA adalah A-tailing control dan A-tailing mix. Bahan-bahan yang digunakan untuk ligasi adapter adalah ligase control, DNA ligase mix, DNA adapter index, stop ligase buffer, AMPure XP Beads, etanol 80%, dan resuspension buffer. Bahan-bahan yang digunakan untuk pemurnian DNA hasil ligasi adalah serbuk agarosa, buffer TAE 1X, SyBr Gold, loading dye, DNA ladder, dan nuclease free water. Bahan-bahan yang digunakan untuk perbanyakan DNA adalah PCR Primer Cocktail, PCR Master Mix, AMPure XP Beads, etanol 80%, dan Resuspension Buffer. Bahan-bahan yang digunakan untuk klasterisasi dan sekuensing genom kentang adalah 2 N NaOH, 1 N NaOH, 0.1 N NaOH, bufer hibridisasi (HT1), Tris-Cl, 10 nM, PhiX library, akuades, EtOH 70 %, buffer library, TruSeq SR Cluster Kit v3- HS (cBot), Truseq SBS Kit-HS (200 cycle).
tungsten bead, batang magnet, vortex, mikropipet, nanodrop thermoscientific 2000 spectrophotometer, instrument Covaris M220, tabung AFA Covaris snap_cap dan srew_cap, microwave, mikrosentrifus, kotak es, sarung tangan karet, neraca analitik, sudip, tabung Durant, parafilm, Vortex Maxi Mix II, power supply, perangkat elektroforesis, instrument Agilent 2100 bionalyzer, High sensitivity DNA chip Agilent Technologies, Qubit 2.0 Fluorometer invitrogen, realtime PCR 2000 Sequence detection system ABI PRISM, thermocycler Biometra, IKA MS 3 Vortexer, UV transilluminator High Performance 2UV, mesin pendingin, alat pengering Thermoscientific Savant DNA 120 spedvac evaporator, cBot Cluster Generation, Illumina Hiseq 2000.
Prosedur Penelitian
Isolasi DNA Genom Kentang (Modifikasi Metode Doyle dan Doyle 1987) Daun kentang yang masih muda dan segar ditimbang sebanyak 50 mg dan kemudian ke dalam tabung berisi daun ditambahkan buffer ekstraksi (CTAB 2%, Na-bisulfid dan PVP 2%) sebanyak 400 µL. Dua butir tungsten bead dimasukkan ke dalam tabung berisi sampel dan kemudian digerus menggukan tissue lyser dengan frekuensi 25/5 selama 30 detik dan kemudian diulangi lagi dengan posisi sebaliknya. Inkubasi sampel pada 650C selama 30 menit dan dibolak-balik secara berkala (10 menit). Kemudian, ke dalam sampel yang telah dipanaskan tersebut ditambahkan CHISAM (24:1) sebanyak 750 µ L dikocok bolak-balik selama 5 menit. Campuran larutan kemudian disentrifugasi pada kecepatan 12000 rpm selama 15 menit pada suhu 250C dan supernatan dipindahkan ke dalam tabung baru (lebih kurang 600µ L supernatan). Selanjutnya ke dalam supernatan tersebut ditambahkan 60µL Na-asetat 3M dan dibolak balik kemudian tambahkan 600 µL isopropanol dingin dan disimpan di dalam pendingin -20 0C selama 1 jam dan setelahnya dibolak balik perlahan kemudian didinginkan lagi selama 15 menit.
Setelah dikeluarkan dari pendingin, larutan kemudian disentrifugasi 12000 rpm selama 15 menit pada suhu 40C. Supernatan hasil sentrifugasi dibuang dan pelet yang dihasilkan kemudian dicuci dengan menambahkan 200 µL etanol 70% dingin dan disentrifugasi kembali dengan kecepatan 12000 rpm selama 5 menit pada suhu 40C. Cairan kemudian dibuang dan pelet dikeringkan menggunakan vakum evaporator selama 15 menit. Endapan hasil pengeringan kemudian dilarutkan dengan 50 µL buffer TE pH 8.0 hingga larut atau dengan dipanaskan pada 650C selama 15 menit. Enzim RNAse kemudian ditambahkan 1/50 kali volume DNA atau sebanyak 1µL untuk menghilangkan RNA dan kemudian diinkubasi kembali selama 37oC selama 30 menit. Tahap selanjutnya adalah uji kualitas dengan menggunakan gel agarose 1%,, uji kuantitas untuk konsentrasi asam nukleat menggunakan nanodrop spektrofotometer DNA dan uji double stranded DNA dengan menggunakan fluorometer Qubit ds DNA BR.
Uji Kualitatif DNA Genom Kentang
4
dalam 110 mL larutan TAE 1X. Larutan kemudian dipanaskan hingga larut dan didinginkan pada suhu kamar hingga hangat dan dituang ke dalam cetakan gel elektroforesis yang telah dipasangi sisir (cetakan sumur) hingga gel memadat. Gel yang sudah padat dipindahkan ke dalam bak elektroforesis yang berisi TAE 1X. Selanjutnya dibuat loading buffer dengan campuran blue juice 6x sebanyak 2 μL, SyBr Gold 100x 0.5 µL, molecular water 7.5 µL. Sampel yang akan dielektroforesis pada penelitian ini sebanyak 2 µL sampel DNA pada parafilm. Setelah tercampur maka campuran sampel diinjeksi ke dalam sumur gel agarosa. Marker yang digunakan adalah 100 bp plus DNA ladder sebanyak 5.5 μL ditambah 0.5 µL SyBr Gold 100x. Setelah semua sampel selesai diinjeksi maka alat elektroforesis dihubungkan pada power supply yang dialiri tegangan listrik 100 volt selama 30 menit. Hasil elektroforesis diamati dengan bantuan lampu UV dalam trasnsilluminator dan didokumentasikan.
Uji Kuantitatif DNA Genom Kentang (Invitrogen 2010)
Uji kuantitatif untuk konsentrasi dan kemurnian asam nukleat dilakukan dengan menggunakan spektrofotometer nanodrop thermoscientific, USA dengan blanko yang digunakan adalah larutan TE pH 8.0. Sebelum digunakan lubang optik dibersihkan terlebih dahulu dengan menggunakan nuclease free water. Sebanyak 1 ul Larutan TE dimasukkan ke dalam lubang optik nanodrop thermoscientific ditutup dan kemudian dipilih menu measure blank pada komputer. Kemudian, lubang optik dibersihkan kembali dan sampel DNA sebanyak 1 μL dimasukkan ke dalam lubang optik. Setelah itu, hasil pengukuran akan muncul dalam konsentrasi ng/μL dan kemurnian DNA dapat dilihat langsung dalam A280 dan A260. Uji kuantitas DNA dilakukan untuk mengetahui konsentrasi dan kemurnian DNA dengan perbandingan A260/280 yang baik sekitar 1.8 hingga 2.0.
Uji double stranded DNA (dsDNA) dilakukan dengan menggunakan fluorometer Qubit ds DNA BR. Pengenceran larutan Qubit disiapkan dengan perbandingan reagen 1: 200 dalam buffer Qubit. Beberapa tabung khusus disiapkan dengan campuran larutan reagen dan buffer Qubit total 198 µL dan ke dalamnya ditambahkan 2 µL DNA. Semua tabung yang sudah diisi dengan larutan di vortex selama ± 3 detik dan kemudian diinkubasi pada suhu ruang selama 2 menit. Setelah diinkubasi, tabung kemudian dimasukkan pada alat Qubit 2.0 fluorometer dan konsentrasi dsDNA dapat dilihat pada layar dan dihitung menggunakan rumus.
Konstruksi Pustaka Genom Kentang (TruSeq DNA low throughput protocol
(Illumina 2010a) )
sensor alat ini sangat sensitif. Hasil dari fragmentasi Covaris dipindahkan ke dalam tabung PCR sebanyak 50 µL (berat DNA 1 ug).
Modifikasi Ujung Fragmen DNA. Modifikasi diawali dengan pembuatan Insert Modification Plate (IMP). Sebanyak 10 µL End repair control dan 40 µ L End Repair Mix ditambahkan ke dalam tabung yang mengandung 50 µL DNA hasil fragmentasi. Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Tabung yang berisi sampel ditutup dan diinkubasi dalam thermalcycler selama 30 menit pada suhu 300C.
Langkah selanjutnya yaitu pemurnian IMP yang diawali dengan penambahan 160 µL AMPure XP Beads yang telah divorteks ke dalam sampel.. Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Campuran sampel dan AMPure XP Beads diinkubasi selama 15 menit pada suhu ruang. Tabung yang berisi sampel kemudian dipindahkan keatas batang magnet pada suhu ruang selama 15 menit. Sebanyak 127.5 µL supernatan dibuang dengan hati-hati jangan sampai mengenai pelet yang terletak pada dinding tabung. Tahapan sebelumnya diulangi kembali untuk menghilangkan supernatan yang masih tersisa. Pada proses pencucian pelet, sebanyak 200 µL etanol 80% ditambahkan dan diinkubasi selama 30 detik. Selanjutnya, etanol 80% yang telah ditambahkan dibuang dan dilakukan sebanyak 2 kali ulangan. Pelet kemudian dikeringkan selama 15 menit pada suhu ruang dan dipindahkan dari batang magnet. Resuspension buffer sebanyak 17.5 µL ditambahkan ke dalam tabung yang berisi pelet dan sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Selanjutnya, tabung berisi sampel diinkubasi selama 2 menit pada suhu ruang. Tabung yang berisi sampel kemudian dipindahkan ke atas batang magnet pada suhu ruang selama 5 menit untuk memisahkan supernatan dengan pelet. Sebanyak 15 µL supernatan dipindahkan ke dalam tabung yang baru dan disimpan dalam mesin pendingin. Tahapan selanjutnya yang bisa dilakukan adalah pengukuran kuantitas dan kualitas hasil modifikasi ujung jika supernatant di dalam tabung masih tersisa. Tahapan pemurnian menggunakan AMPure XP Beads juga dilakukan pada proses tahapan penempelan adaptor dan proses perbanyakan fragmen DNA.
Adenilasi Ujung 3’ DNA. A-tailing control 2.5 µL dan A-tailing mix 12.5
µL ditambahkan ke dalam tabung yang berisi sampel. Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Tabung yang berisi sampel ditutup dan diinkubasi dalam thermalcycler selama 30 menit pada suhu 370C dan setelahnya langsung dilanjutkan dengan tahapan penempelan adaptor.
Penempelan Adaptor. Sebanyak 2.5 ulLigase control, 2.5 µL DNA Ligase Mix dan 2.5 µL dan DNA Adapter Index ditambahkan ke dalam tabung yang berisi sampel. Sampel dicampurkan menggunakan pipet dengan cara dinaik turunkan sebanyak 10 kali. Tabung yang berisi sampel ditutup dan diinkubasi dalam thermalcycler selama 10 menit pada suhu 300C. Sebanyak 5 µL Stop Ligase Mix ditambahkan ke dalam tabung yang berisi sampel. Kemudian sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali.
6
diinkubasi pada suhu ruang. Sebanyak 20 µL supernatan dipindahkan ke dalam tabung yang baru dan disimpan dalam mesin pendingin. Tahapan selanjutnya yang dilakukan adalah pengukuran kuantitas dan kualitas hasil adenilasi dan penempelan adaptor jika supernatan di dalam tabung masih tersisa.
Pemurnian DNA Hasil Ligasi. Pemurnian hasil ligasi terdiri dari dua tahap yaitu pemisahan ukuran fragmen DNA melalui elektroforesis dan ekstraksi gel. Pemisahan ukuran fragmen DNA diawali dengan pembuatan gel agarosa 2%. Sebanyak 1.2 gram bubuk agarosa ditimbang dan ditambahkan larutan TAE 1x sebanyak 60 mL. Larutan kemudian dipanaskan dalam microwave sampai semua agarosa larut. Setelah suhu larutan hangat, kemudian tambahkan 6 uL pewarna SyBr Gold dan kocok hingga homogen. Kemudian larutan dituang ke dalam cetakan yang telah disiapkan.
Elektroforesis diawali dengan disiapkannya seperangkat bak elektroforesis, kemudian larutan TAE 1x dituangkan ke dalam bak hingga gel terendam bagian bawahnya. Selanjutnya, ditempat terpisah sebanyak 4 ul loading dye 6x ditambahkan ke dalam tabung berisi 20 ul sampel hasil ligasi. Sebanyak 12 ul penanda DNA ladder 100 bp diinjeksikan pada sumur gel yang tersedia. Sampel kemudian dimasukkan ke dalam sumur gel yang tersedia. Cetakan agarosa di buat dengan 2 kolom dimana pada kolom ke dua berisi nuclease free water sebanyak 25 ul. Sampel kemudian di elektroforesis pada kuat arus 100 volt selama 60 menit. Hasil elektroforesis dilihat di atas lampu UV transiluminator dan didokumentasikan. Saat telah mendekati ukuran 400 bp, nuclease free water yang berada pada kolom kedua dipipet dan dimasukkan ke dalam tabung baru (20 ul). Ukuran fragmen DNA 300 bp, 400 bp dan 500 bp diiris dari gel agarosa dan disimpan dalam tabung untuk digunakan pada tahapan selanjutnya yaitu ekstraksi gel jika hasil validasi pustaka tidak mencukupi untuk konsentrasi minimum yang dibutuhkan untuk proses sekuensing.
Perbanyakan fragmen DNA. Perbanyakan DNA diawali dengan penambahan 5 µL PCR Primer Cocktail dan 25 µL PCR Master Mix ke dalam tabung yang berisi sampel. Sampel dicampurkan menggunakan pipet mikro dengan cara dinaik turunkan sebanyak 10 kali. Tabung kemudian disimpan dalam mesin PCR untuk proses perbanyakan yang terdiri dari 10 siklus selama 20 menit dengan rincian reaksi predenaturasi pada suhu 98°C selama 30 detik, denaturasi pada suhu 98°C selama 10 detik, annealing pada suhu 60°C selama 30 detik, extension pada suhu 72°C selama 30 detik, dan pasca pemanjangan primer pada suhu 72°C selama 5 menit.
Tahapan selanjutnya yaitu pemurnian hasil PCR yang diawali dengan penambahan 50 µL AMPure XP Beads dengan mengikuti prosedur pemurnian yang sama dengan sebelumnya sebanyak 32.5 µL resuspension buffer ditambahkan ke dalam tabung yang berisi pelet dan dicampurkan menggunakan. Sebanyak 30 µL supernatan dipindahkan ke dalam tabung yang baru dan disimpan dalam mesin pendingin. Tahapan selanjutnya yang bisa dilakukan adalah validasi terhadap kualitas dan kuantitas pustaka genom yang telah berhasil dikonstruksi.
dibuka kemudian ke dalam lubang lain yang berlabel G ditambahkan 9 ul dye mix dan marker pada masing-masing lubang kecuali lubang ladder, kemudian ke dalam lubang ladder ditambahkan 1 ul HS DNA ladder. Sebanyak 1 ul sampel juga kemudian dimasukkan ke dalam lubang sampel. Cip kemudian di vortex selama 1 menit dan kemudian di running pada alat agilent 2100 bioanalyser yang terhubung dengan computer. Kualitas ukuran pustaka juga di ukur dengan menggunakan software bioinformatika photocap MW.
Validasi kuantitas pustaka genom. Sampel dibuat sebanyak 3 kali ulangan dan setiap ulangan dibuat pengenceran 1:1000, 1:2000 dan 1:4000 menggunakan buffer qPCR. Setiap sampel yang telah diencerkan ini kemudian diambil sebanyak 4 ul dan ditambahkan 16 ul reagen qPCR dan dimasukkan ke dalam tabung PCR. Standar larutan juga dibuat sebanyak 3 ulangan dengan jumlah standar sebanyak 6. Tabung PCR kemudian di masukkan ke dalam alat qPCR dan di running selama 2 jam. Hasil yang diperoleh akan digunakan untuk perhitungan klasterisasi pustaka genom. Sebelum klasterisasi pustaka terlebih dahulu dihitung konsentrasi pustaka genom yang dibutuhkan yaitu sebanyak 2 nM yang diencerkan ke dalam buffer library (Tris-Cl 10 mM pH 8.5 dan 0.1 % tween 20).
Klasterisasi Pustaka Genom Kentang (cBot cluster generation protocol (Illumina 2010b)
Klasterisasi DNA diawali dari preparasi sampel yang terdiri dari dua tahapan, yaitu denaturasi dan pelarutan DNA. Denaturasi diawali dengan penambahan 0.1 N NaOH ke dalam sampel DNA sehingga diperoleh konsentrasi DNA pustaka akhir 13 pM. Campuran dinaik turunkan menggunakan pipet hingga homogen. Sampel diinkubasi selama 5 menit pada suhu ruang untuk mendenaturasi utas ganda DNA menjadi utas tunggal. DNA yang telah didenaturasi disimpan dalam mesin pendingin sampai proses pelarutan DNA akan dilakukan.
Tahapan preparasi sampel selanjutnya yaitu pelarutan DNA dalam buffer hibridisasi. Sebanyak 987 uL buffer hibridisasi ditambahkan ke dalam template DNA yang telah didenaturasi sebelumnya sehingga diperoleh konsentrasi akhir 13 pM. Sebanyak 120 µL DNA yang telah dilarutkan ditambahkan ke dalam 1% PhiX control (1.2 ul) di dalam tabung PCR. Posisi sampel pada tabung dicatat dan kemudian tabung dimasukkan ke dalam alat cBOT Cluster Generation untuk dilakukan klasterisasi di dalam suatu flow cell.
Sekuensing Pustaka Genom Kentang (HiSeq 2000 protocol 2011)
8
output folder,confirm first base, keep intensity files, existing recipe, save image dan align lanes. Tahapan selanjutnya yaitu pemasangan flow cell yang telah diklasterisasi melalui cBot cluster generation pada flow cell stage. Sekuensing dilakukan selama sekitar 11 hari dengan panjang pembacaan DNA 2 x 101 siklus. Tahapan terakhir setelah proses sekuensing selesai dilakukan yaitu dengan dipindahkannya flow cell dari flow cell stage dan dilakukannya post-run sequencing yaitu maintenance wash. Tahapan maintenance wash terdiri dari pembilasan dengan menggunakan air dan NaOH.
HASIL
Hasil DNA Genom Kentang
Isolasi DNA genom kentang dari empat genotipe yaitu CIP 392781, PT 29, Amudera dan Margahayu dilakukan dengan metode Doyle & Doyle (1987) yang dimodifikasi. Analisis kualitas pustaka genom kentang dilakukan menggunakan gel agarosa 1%. DNA genom kentang berhasil diisolasi dengan baik yang ditunjukkan dengan ukuran pita-pita DNA yang semakin tinggi dari marker dan semakin mendekati ke sumur gel. Marker DNA yang digunakan adalah 100 bp (Gambar 1).
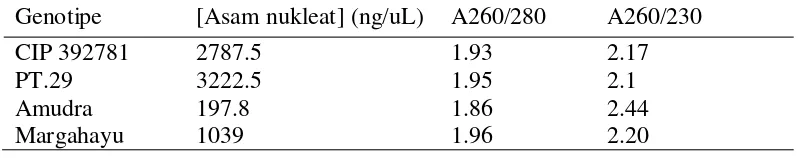
Analisis kuantitatif DNA genom kentang diukur menggunakan nanodrop spektrofotometer. Pengukuran dilakukan untuk melihat kemurnian DNA genom kentang dari kontaminasi polisakarida (A260/230) dan protein (A260/280). Tabel 1 menunjukkan masing-masing genotipe kentang menghasilkan DNA dengan konsentrasi yang tinggi (1039 ng/uL – 3222.5 ng/uL) dan hanya genotipe Amudera yang memiliki konsentrasi DNA yang rendah yaitu 197.8 ng/uL. Kemurnian dari masing-masing genotipe kentang sangat murni yang dapat diketahui dari nilai rasio yang masih berada pada rentang ukuran 1.8-2.0.
Gambar 1 Elektroforegram DNA genom hasil isolasi kentang genotipe 1. CIP 392781, 2. PT 29, 3. Amudera dan 4. Margahayu
Tabel 1 Kuantitas dan kemurnian DNA genom total kentang.
Genotipe [Asam nukleat] (ng/uL) A260/280 A260/230
CIP 392781 2787.5 1.93 2.17
PT.29 3222.5 1.95 2.1
Amudra 197.8 1.86 2.44
Analisis kuantitatif DNA genom kentang selanjutnya yaitu DNA double stranded (dsDNA) ditunjukkan oleh Tabel 2. Pengukuran dsDNA dilakukan menggunakan fluorometer. Hasil pengukuran dsDNA menunjukkan konsentrasi dsDNA yang terdapat pada masing-masing genotipe memenuhi untuk tahapan fragmentasi. Perhitungan bobot dsDNA untuk konstruksi pustaka genom ini diperoleh dengan perhitungan :
Tabel 2 Konsentrasi double stranded DNA hasil isolasi
Genotipe [Qubit] (ug/mL)
Faktor
pengenceran [ds DNA] (ng/uL)
CIP 392781 2.31 100 231
PT.29 1.43 100 143
Amudra 0.482 200 96.4
Margahayu 0.353 200 70.6
Konstruksi Pustaka Genom DNA Kentang Fragmentasi DNA Genom Kentang
Pita-pita DNA hasil dari fragmentasi DNA menggunakan prinsip sonikasi dapat dilihat pada gambar 2. Pita-pita DNA yang smear menunjukkan bahwa DNA tersebut telah berhasil difragmentasi pada ukuran yang diharapkan (300-400 bp) dengan intensitas yang lebih terang yang berarti bahwa konsentrasi DNA tinggi terpotong pada ukuran 300-400 bp. Ukuran 300-400 bp dipilih karena ukuran optimal yang disarankan Illumina untuk proses sekuensing yaitu <800 bp.
Modifikasi Ujung Fragmen DNA
Pengukuran terhadap konsentrasi DNA genom kentang hasil modifikasi ujung fragmen DNA diukur menggunakan nanodrop spektrofotometer dapat dilihat pada Tabel 3. Konsentrasi DNA yang diukur mengalami pengurangan pada setiap tahapannya. Kemurnian DNA genom kentang 4 genotipe cukup murni dari kontaminasi protein dan polisakarida yang ditunjukkan oleh nilai rasio A260/280 dan A260/230 yang masih dalam rentang kualitas yang baik (1.8-2.0).
10
Adenilasi Ujung 3’OH dan Ligasi Adaptor
Pengukuran terhadap kuantitas dan kemurnian DNA setelah adenilasi ujung 3’OH dan ligasi adaptor diukur menggunakan nanodrop spektrofotometer. Hasil pengukuran pada Tabel 4 menunjukkan konsentrasi DNA yang semakin berkurang dari tahapan sebelumnya. Kemurnian DNA yang diperoleh sudah murni sementara untuk genotipe CIP 392781 tidak diukur karena DNA yang tersisa telah terkontaminasi oleh manik-manik paramagnetik.
Pemurnian DNA Setelah Ligasi Adaptor
Elektroforegram dari 2 genotipe kentang hasil pemurnian produk ligasi yaitu genotipe Amudera dan Margahayu dapat dilihat pada Gambar 3. Pemurnian DNA dilakukan dengan menggunakan gel agarosa 2% dan berhasil memisahkan DNA hasil ligasi adaptor yang berukuran 400-500 bp. Pemisahan dapat diketahui dari pita-pita DNA yang smear dan pada ukuran yang diharapkan DNA ditampung di dalam suatu lubang yang sejajar dengan marker DNA 400 bp. Marker DNA yang digunakan adalah marker DNA 400 bp.
Tabel 3 Kuantitas dan kemurnian DNA setelah tahapan purifikasi modifikasi ujung fragmen DNA
Genotipe [Asam nukleat] (ng/uL) A260/280 A260/230
CIP 392781 54.7 2.33 1.35
PT.29 107.1 1.99 2.29
Amudra 91.4 2.04 2.45
Margahayu 83.2 2.09 2.34
Tabel 4 Kuantitas dan kemurnian DNA setelah tahapan adenilasi ujung 3’ dan ligasi adaptor
Genotipe [Asam nukleat] (ng/uL) A260/280 A260/230
CIP 392781 Td Td Td
PT.29 44.6 2.02 2.19
Amudra 47.5 1.97 2.01
Margahayu 40.9 2.0 2.03
Ket : Td = tidak diukur
Perbanyakan DNA Setelah Pemurnian DNA Fragmen
Kuantitas dan kemurnian DNA setelah tahapan pemurnian produk ligasi dan perbanyakan fragmen DNA menggunakan perbanyakan PCR menunjukkan jumlah kuantitas asam nukleat yang diukur semakin berkurang dari tahapan sebelumnya dan terdapat kontaminasi pada beberapa genotipe. Berkurangnya konsentrasi pada setiap tahapannya dikarenakan seleksi-seleksi yang telah dilakukan oleh pereaksi untuk menghasilkan pustaka yang ideal. Kontaminasi yang terjadi juga diakibatkan oleh manik-manik paramagnetik yang masih tertinggal di dalam larutan DNA hasil pemurnian. Kentang genotipe CIP 392781 dan Amudera mengalami kontaminasi oleh protein dengan nilai A260/280 sebesar 1.78 dan 1.53 (Tabel 5) dimana nilai tersebut berada di bawah rentang yang ideal (1.8-2.0). Kentang genotipe CIP 392781 dan Margahayu juga mengalami kontaminasi oleh polisakarida dengan nilai A260/230 masing-masing sebesar 1.62 dan 1.33 (Tabel 5).
Perbanyakan dilakukan pada pustaka DNA hasil pemurnian produk ligasi yang telah berhasil menyeleksi pustaka berukuran 400-500 bp dan selanjutnya dilakukan uji kualitas untuk mengetahui ukuran pustaka yang diseleksi. Uji kualitas menggunakan gel agarosa 2% menunjukkan bahwa pustaka DNA pada ukuran yang diharapkan (400-500 bp) telah berhasil diperbanyak (Gambar 4). Pita-pita DNA pada ukuran tersebut disejajarkan dengan marker 100 bp dan hasil yang terlihat yaitu pita-pita DNA yang berukuran 400-500 bp.
Validasi Kualitas dan Kuantitas Pustaka Genom Kentang
Kualitas dan kuantitas pustaka genom kentang divalidasi dengan menggunakan bioanalyzer untuk uji kualitas dan qPCR untuk uji kuantitas. Pengujian kualitas juga dilakukan dengan menggunakan softwarephotocap_MW. Ukuran fragmen pustaka yang diukur menggunakan bionalyzer yaitu kentang genotipe CIP 392781 dan PT 29 dengan ukuran masing-masing 324 bp dan 360
Tabel 5 Kuantitas dan kemurnian DNA setelah tahapan pemurnian setelah tahapan purifikasi produk ligasi dan perbanyakan fragmen DNA Genotipe [Asam nukleat] (ng/uL) A260/280 A260/230
CIP 392781 17.7 1.78 1.62
PT.29 10.8 1.95 4.47
Amudra 3 1.53 2
Margahayu 3.8 2.67 1.33
12
bp. Kentang genotipe Amudera dan Margahayu dianalisis ukuran fragmennya menggunakan software dan hasil yang diperoleh kentang genotipe Amudera dan Margahayu masing-masing berukuran 568 bp dan 471 bp terlihat pada Tabel 6. Pita-pita pustaka genom yang telah dikonstruksi juga dapat terlihat dengan jelas pada alat bioanalyzer (Gambar 4).
Sebelum dianalisis menggunakan software photocap_MW terlebih dahulu pustaka genom kentang yang telah dikonstruksi dielektroforesis pada gel agarosa 2% dan gambar ditangkap menggunakan UV transilluminator dan selanjutnya dianalisis dimana hasil analisis dapat dilihat pada Gambar 6.
Hasil analisis kuantitas dari pustaka genom kentang yang telah berhasil dikonstruksi dilakukan dengan menggunakan quantitatif PCR dapat dilihat pada Tabel 7. Hasil pengukuran selanjutnya akan digunakan untuk menghitung
Tabel 6 Kualitas dan kuantitas pustaka genom kentang menggunakan bioanalyzer dan software photocap_MW
Genotipe Ukuran Fragmen [ Pustaka ] pg/ul
CIP 392781 324 5578
PT.29 360 4452
Amudra 568 -
Margahayu 471 -
Gambar 5 Elektroforegram pustaka genom kentang dengan analisis bioanalyzer
kebutuhan pustaka genom yang ideal untuk tahapan selanjutnya yaitu klasterisasi dan sekuensing DNA. Minimal jumlah pustaka DNA genom kentang yang diperlukan untuk sekuensing yaitu 2 nM. Hasil kuantitas pengukuran qPCR yang diperoleh masing-masing genotipe kentang yaitu CIP 392781, PT 29, Amudera dan Margahayu yaitu masing-masing sebesar 60.14 nM, 34.64 nM, 17.76 nM dan 13.08 Nm (Tabel 7). Hasil pengukuran rata-rata masing-masing kentang diperoleh dari perhitungan:
Rerata kuantitas dapat dilihat pada lampiran 2.
Klasterisasi dan Sekuensing Pustaka Genom Kentang Jumlah Basa dan Kualitas Klaster Pustaka Genom secara Umum
Hasil sekuensing pengukuran jumlah basa dan kualitas klaster pustaka genom secara umum yang disekuensing menggunakan alat sekuensing Illumina Hiseq 2000 yang menggunakan prinsip sekuensing oleh sintesis dilihat pada Tabel 8. Sebelum sekuensing terlebih dahulu pustaka genom dimasukkan ke dalam suatu flow cell dan diklasterisasi dengan alat yang bernama cBOT cluster generation. Tipe pembacaan sekuensing yang dipilih pada pustaka sekuensing pustaka genom ini adalah tipe pembacaan paired end dengan 2 x 100 siklus. Secara umum jumlah basa dan kualitas pustaka genom kentang menghasilkan nilai yield total dan projected total yield yang sama yaitu 287.2 Gbp (Tabel 8). Artinya, total jumlah basa yang dihasilkan sama dengan jumlah basa yang diprediksi sebelumnya.
Densitas dan Kualitas Pustaka Genom Kentang pada Lajur dalam Flow Cell
Pengukuran kualitas klaster dari empat genotipe kentang dilakukan untuk menghitung kerapatan klaster di dalam suatu lajur pada flow cell. Hasil sekuensing menunjukkan bahwa densitas klaster pustaka genom yang dihasilkan
Tabel 7 Kuantitas pustaka genom kentang diukur menggunakan qPCR
Genotipe [Ukuran rata-rata] (nM)
CIP 392781 60.14
PT.29 34.64
Amudra 17.76
Margahayu 13.08
14
tinggi (Tabel 9). Densitas klaster pustaka genom termasuk kategori ideal jika klaster pustaka genom memilki densitas berkisar dari 400-600 K/mm2.
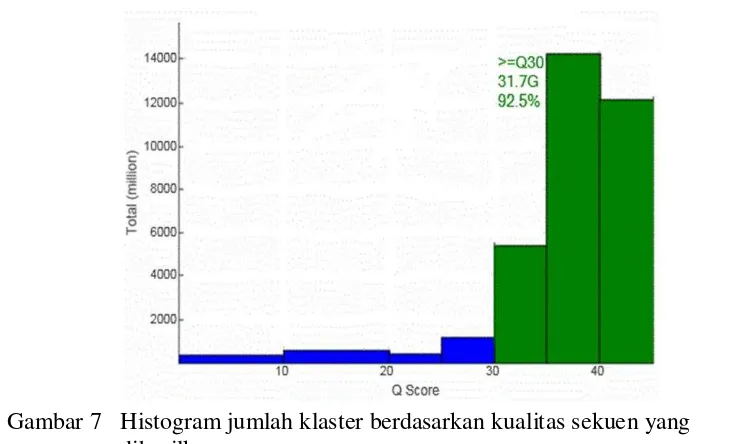
Salah satu contoh histogram jumlah klaster pada lajur dapat dilihat pada Gambar 7. Contoh yang digunakan adalah kentang genotipe Amudera pada lajur 1. Berdasarkan kualitas sekuen yang dihasilkan yaitu diperoleh nilai Q scores 92.5% dengan jumlah basa yang dibaca sebanyak 31.7 Gbp (Gambar 7).
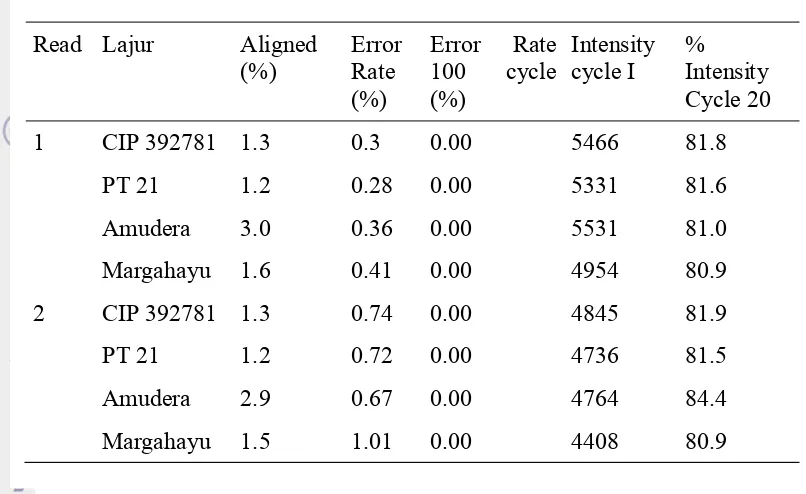
Tingkat Kesalahan (Error Rate), Nilai Penyejajaran (Aligned) dan Intensitas Basa Hasil Sekuensing
Pengukuran yang dilakukan selanjutnya adalah analisis terhadap tingkat kesalahan (error rate), nilai penyejajaran (aligned) dan intensitas basa hasil sekuensing. Masing-masing pustaka genom mengalami dua kali pembacaan (Read 1 dan read 2). Setiap pembacaan mengukur hal yang sama dan menghasilkan hasil yang berbeda untuk intensitas siklus I dan % intensitas siklus 20 (Tabel 10). Rerata error pada siklus 100 yaitu sebesar 0.00 % yang menunjukkan sekuensing berjalan dengan sangat baik dan tidak ada kesalahan. Intensitas siklus yang dihasilkan juga tergolong ideal (nilai intensitas ideal 1000) dimana
masing-Tabel 9 Densitas dan kualitas pustaka genom hasil sekuensing
Lajur (K/mmDensitas 2) Klaster PF (%) Phasing (%)
Pre phasing
(%)
Reads (M)
Reads PF (M)
% >= Q30
CIP 392781 779 93.1 0.173 0.287 215.4 199.8 94
PT 29 766 93.1 0.178 0.285 211.9 196.6 94.1
Amudra 633 95 0.182 0.302 174.87 165.8 92.75
Margahayu 881 89.3 0.174 0.277 243.68 216.9 88.4
masing nilai baik pada pembacaan 1 maupun 2 berada pada nilai 4736 hingga 5531.
PEMBAHASAN
Hasil Isolasi DNA Genom Kentang
DNA genom merupakan seluruh materi genetik yang dimiliki oleh suatu organisme termasuk didalamnya DNA yang berinteraksi dengan protein dan RNA (Weaver & Hedrick 1997). Isolasi DNA adalah pemisahan molekul DNA dari molekul lain seperti dinding sel, membran sel, dan membran inti sehingga strukturnya dapat terlihat dengan jelas. Tujuannya adalah mengidentifikasi dan mengkarakterisasi DNA yang dibutuhkan untuk proses analisis molekuler lainnya. Berbagai teknis analisis dalam pemuliaan tanaman dan biologi molekuler berdasarkan pada hibridisasi molekuler dan polymerase chain reaction (PCR) membutuhkan DNA dalam jumlah dan kualitas yang baik. Kandungan senyawa sekunder dalam sel tanaman berbeda beda maka setiap tanaman membutuhkan prosedur isolasi yang optimum agar diperoleh DNA genom yang dapat digunakan untuk proses analisis biomolekuler lainnya (Prahaditya 2013).
Metode isolasi DNA genom pada penelitian ini menggunakan metode Doyle & Doyle (1987) yang dimodifikasi. Ekstraksi DNA menggunakan prosedur ini pada prinsipnya menggunakan cetil trimetil ammonium bromide (CTAB) yang berfungsi untuk mendegradasi senyawa metabolit sekunder yang terdapat pada tanaman. Modifikasi yang dilakukan terdapat pada penambahan natrium disulfida dan polivinilpirolidon 2% ke dalam buffer CTAB 2% yang berguna sebagai antioksidan pencegah warna coklat polifenol saat penggerusan. Pengendapan
Tabel 10 Tingkat kesalahan (error rate), nilai penyejajaran (aligned) dan intensitas basa hasil sekuensing
1 CIP 392781 1.3 0.3 0.00 5466 81.8
PT 21 1.2 0.28 0.00 5331 81.6
Amudera 3.0 0.36 0.00 5531 81.0
Margahayu 1.6 0.41 0.00 4954 80.9
2 CIP 392781 1.3 0.74 0.00 4845 81.9
PT 21 1.2 0.72 0.00 4736 81.5
Amudera 2.9 0.67 0.00 4764 84.4
16
menggunakan isopropanol pada metode Doyle & Doyle dilakukan pada suhu ruang selama satu malam, namun pada penelitian ini pengendapan isopropanol dilakukan selama 1 jam pada suhu -20oC dan juga untuk pengeringan hanya membutuhkan waktu 15 menit menggunakan vakum evaporator.
Uji terhadap kualitas DNA hasil isolasi dapat diketahui dengan teknik elektroforesis. Elektroforesis merupakan suatu cara untuk memisahkan fraksi-fraksi campuran berdasarkan pergerakan partikel-partikel koloid bermuatan yang dipengaruhi medan listrik. Elektroforesis umumnya digunakan untuk menentukan berat molekul, mendeteksi kemurnian, dan kerusakan protein atau asam nukleat, menetapkan titik isolistrik serta memisahkan spesies-spesies yang berbeda secara kualitatif dan kuantitatif. Oleh karena itu, metode elektroforesis banyak digunakan untuk analisis asam nukleat, virus, enzim dan protein (Bintang 2010).
DNA genom kentang dari 4 genotipe telah berhasil diisolasi dengan baik yang ditandai dengan terbentuknya pita-pita DNA pada elektroforegram. Elektroforegram merupakan hasil uji kualitatif terhadap DNA yang telah diisolasi. DNA hasil isolasi dielektroforesis pada gel agarosa 1% dan menggunakan marker DNA 100 bp. Keberhasilan atau kualitas DNA yang telah diisolasi merupakan pita DNA yang dihasilkan akan semakin dekat dengan sumur gel (Brown 2007).
Kuantitas hasil isolasi DNA genom kentang dapat diukur dengan menggunakan spektrofotometer nanodrop thermoscientific pada panjang gelombang 230 nm, 260 nm dan 280 nm. Uji kuantitas bertujuan untuk mengetahui konsentrasi dan kemurnian dari DNA genom hasil isolasi. Panjang gelombang 230 nm merupakan serapan maksimum untuk polisakarida, panjang gelombang 260 merupakan panjang serapan maksimum untuk asam nukleat dan panjang gelombang 280 nm merupakan serapan maksimum untuk protein. Kemurnian DNA ditentukan melalui rasio perbandingan nilai absorbansi asam nukleat (260 nm) dengan nilai absorbansi polisakarida (230 nm) untuk menunjukkan kemurnian terhadap polisakarida dan perbandingan dengan nilai absorbansi protein (280 nm) untuk menunjukkan kemurnian terhadap protein.
Hasil uji kuantitas DNA genom kentang memiliki konsentrasi asam nukleat sebesar 2224.8 ng/uL – 11672.7 ng/uL dengan rasio A260/280 sebesar 1.86 – 1.96 dan rasio A260/230 sebesar 2.1 – 2.44 (Tabel 1). Terdapat satu genotipe yang memiliki konsentrasi yang rendah yaitu sebesar 197.8 ng/uL dikarenakan sampel DNA adalah sampel yang telah diisolasi dan disimpan dalam waktu yang cukup lama. Sampel DNA genom kentang yang diisolasi dapat dikatakan sangat murni dari kontaminasi baik dari protein maupun polisakarida karena masih berada pada rentang ukuran 1.8-2.0. Yuwono (2005), menyatakan bahwa nilai kemurnian yang kurang dari 1.8 menunjukkan bahwa sampel mengandung kontaminasi protein dan polisakarida.
menghitung molekul target seperti double standed DNA saja. Keuntungan penggunaan fluorometer ini adalah akurasinya baik dan sangat teliti sehingga mampu mendeteksi konsentrasi yang terendah sekalipun. Double stranded DNA atau dsDNA biasanya digunakan untuk sampel yang akan disekuensing, sampel DNA genom dan percobaan penelitian lainnya (Invitrogen 2010). Alat ini juga dapat diaplikasikan untuk mengukur konsentrasi single standed DNA dan protein target.
Pengukuran konsentrasi dsDNA dilakukan dengan pengenceran 100 dan 200 kali. Hasil yang diperoleh yaitu dalam setiap 1 ul DNA hasil isolasi terdapat dsDNA dengan konsentrasi 70.6 ng/uL hingga 231 ng/uL (Tabel 2). Konsentrasi dsDNA yang telah diukur ini akan sangat memudahkan untuk tahapan konstruksi pustaka selanjutnya. Berat dsDNA yang dibutuhkan untuk tahapan awal konstruksi pustaka awal yaitu saat fragmentasi adalah 1 ug jika volume DNA yang tersedia sedikit dan 2.6 ug jika volume DNA yang tersedia banyak atau dapat dikatakan konsentrasi dsDNA yang dibutuhkan hanya 20 ng/uL yang diencerkan ke dalam 130 uL atau 55 uL buffer resuspensi. Volume DNA yang harus diencerkan diperoleh dengan perhitungan yaitu 20 ng/uL x 130 ul dan kemudian dibagi dengan konsentrasi dsDNA yang telah diukur.
Konstruksi Pustaka Genom DNA Kentang
Pustaka genom adalah sekumpulan klon yang mengandung DNA genom total dari suatu organisme. Pustaka genom seharusnya mengandung seluruh sekuen DNA dari suatu organisme (Lodish et al. 2000). Selain sebagai bahan genetik, pustaka genom juga sangat bermanfaat untuk mengisolasi gen utuh yang mengandung promoter, terminator dan intron untuk mengetahui regulasi ekspresi gen. Peta fisik suatu genom juga membutuhkan pustaka genom, sehingga pustaka genom merupakan bagian yang sangat penting dalam perbaikan genetika tanaman, baik melalui teknologi DNA rekombinan maupun melalui pemuliaan konvensional (Suharsono 2002).
Konstruksi pustaka genom kentang pada penelitian ini mengikuti protokol TruSeq DNA low troughput protocol dari Illumina yang dimodifikasi pada beberapa tahapannya. Tujuan dari protokol ini yaitu menambahkan sekuen adaptor ke dalam ujung fragmen DNA untuk menghasilkan pembacaan ganda atau sekuen ujung pasangan pustaka. Tahapan awal konstruksi pustaka genom kentang ini setalah isolasi DNA genom utuh dari kentang yaitu dilakukannya pemotongan DNA kentang pada panjang tertentu yang diharapkan potongan tersebut telah dapat mewakilkan gen-gen penyandi genom kentang, modifikasi ujung DNA, adenilasi ujung 3’OH dan ligasi adaptor, pemurnian produk ligasi dan perbanyakan fragmen DNA secara invitro atau menggunakan PCR. Hasil konstruksi dari pustaka genom nantinya dapat divalidasi agar dapat dilanjutkan ke tahap berikutnya.
Hasil Fragmentasi DNA Genom Kentang
18
DNA pada 300-400 bp karena ukuran ideal pustaka genom yang disarankan oleh illumina adalah < 800 bp karena pustaka yang berukuran sangat panjang ataupun sangat pendek dapat mempengaruhi keakuratan data yang dihasilkan pada saat proses sekuensing berlangsung. Alat Covaris ini dilengkapi dengan tabung Covaris yang didesain secara khusus untuk pemotongan DNA. Alat ini tidak membutuhkan DNA dalam jumlah besar untuk melakukan pemotongan. Covaris akan memotong dan menghasilkan fragmen dsDNA dengan ujung 3’ atau 5’ overhang. Konsentrasi dsDNA yang dibutuhkan yaitu 20 ng/uL yang dilarutkan ke dalam buffer resuspensi dengan berat akhir DNA 1 ug dan 2.6 ug. Buffer resuspensi ini akan tetap menjaga DNA dalam kondisi yang baik dan stabil dan juga dapat melarutkan kembali DNA setelah DNA berinteraksi dengan banyak pereaksi yang digunakan. Kelebihan pemotongan dengan menggunakan covaris ini adalah konsentrasi DNA yang dibutuhkan untuk pemotongan tidak banyak namun harus benar-benar dsDNA dan juga dapat meminimalisir terbuangnya DNA secara percuma. Sampel DNA dengan bobot DNA dari 50 ng- 2 ug pertabungnya dapat dipotong dengan menggunakan M220 (Covaris 2012).
Fragmentasi DNA merupakan suatu proses yang mendeskripsikan cara memperoleh fragmen DNA genom optimal yang mengandung pustaka akhir pada rerata panjang ukuran 300-400 bp dan merupakan tahapan yang paling kritis. Illumina menyarankan untuk hasil optimal potongan DNA pada 300-400 bp, sedangkan untuk perbanyakan eksom bisa pada ukuran 200-300 bp (Illumina 2010a). Hasil fragmentasi DNA kemudian dapat diperiksa dengan dielektroforesis pada gel agarosa 2% selama 40 menit. Gambar 3 merupakan elektroforegram fragmen DNA genom yang sudah difragmentasi menggunakan Covaris. Elektroforegram ini memperlihatkan pita hasil DNA genom yang smear pada ukuran 200 hingga 1200 bp, ukuran yang nantinya akan dipilih adalah DNA yang berukuran 300-400 bp. DNA yang berukuran lebih besar ataupun lebih kecil dari ukuran yang diharapkan nantinya akan diseleksi pada tahapan-tahapan konstruksi pustaka selanjutnya dengan menggunakan pereaksi-pereaksi yang spesifik.
Hasil Modifikasi Ujung Fragmen DNA
Pengukuran konsentrasi hasil modifikasi ujung DNA dapat diukur dengan menggunakan nanodrop untuk mengetahui konsentrasi dan kemurniannya dan hal ini bisa dilakukan jika supernatan yang digunakan masih tersisa di dalam tabung dan tidak mengurangi jumlah larutan DNA untuk tahapan selanjutnya. Tabel 3 merupakan jumlah konsentrasi dan kemurnian DNA setelah tahapan pembersihan ujung fragmen DNA. Konsentrasi asam nukleat yang dihasilkan sebesar 54.7 ng/uL hingga 107.1 ng/uL dengan tingkat kemurnian A260/280 sebesar 1.99-2.33 dan rasio A260/230 sebesar 1.35 – 2.45 (Tabel 3). Hal ini dapat menunjukkan DNA yang telah dimodifikasi murni dari kontaminasi protein karena nilai yang ditunjukkan tidak terlalu berbeda dengan rentang nilai yang seharusnya, dan kemurnian dari polisakarida untuk sampel dengan genotipe CIP 392781 kurang (<1.8) tapi tidak terlalu mempengaruhi terhadap kualitas pustaka modifikasi ujung fragmen DNA karena DNA yang digunakan pada pengukuran ini adalah DNA yang tersisa dan mungkin diakibatkan tidak teliti dalam penggunaan mikropipet. Hasil dari modifikasi ujung fragmen DNA kemudian dapat dilanjutkan ke tahapan adenilasi ujung 3’OH dan ligasi adaptor.
Hasil Adenilasi Ujung 3’OH dan Ligasi Adaptor
Adenilasi bertujuan mencegah ligasi antar fragmen DNA dan menyiapkan DNA sebelum ligasi adaptor. Sebuah nukleotida adenin ditambahkan ke ujung 3’ dari fragmen tumpul untuk mencegah DNA saling berligasi satu sama lain selama reaksi ligasi adaptor. Kecocokan nukleotida tunggal T pada ujung 3’ akan menyediakan adaptor untuk melengkapi overhang untuk ligasi adaptor pada fragmen. Strategi ini memastikan rendahnya kecepatan terbentuknya chimera (jalinan-jalinan template) (Illumina 2010a). A tailing mix dalam adenilasi akan membuat fragmen DNA menjadi kompatibel dengan adaptor dan mencegah ligasi sendiri (self ligation) dengan penambahan adenin tersebut pada 3’overhang.
Ligasi adaptor merupakan proses yang akan melekatkan indeks atau adaptor penunjuk pada ujung fragmen DNA dan menyiapkan pengikatan pustaka untuk hibridisasi di atas suatu flow cell. Proses ligasi adaptor menggunakan adaptor indeks nomor 2 (AD002) yang berisi sekuen nukleotida CGATGT (A) dan DNA ligation mix yang menghubungkan adaptor untuk disisipkan (Illumina 2010a). Stop ligation buffer ditambahkan secepatnya ke dalam tabung setelah proses inkubasi untuk menghentikan proses ligasi. Karena proses ligasi yang terjadi terus menerus tanpa dihentikan dengan cepat dapat mengakibatkan saling terjalinnya nukleotida sehingga tidak menghasilkan pustaka yang sesuai ataupun dapat mengakibatkan adaptor saling menempel satu sama lain.
20
Kesalahan pengukuran atau penggunaan pipet dalam hal ini sangat diperhatikan agar hasil yang diperoleh optimal. Supernatan yang tidak tersisa mungkin disebabkan oleh kesalahan dalam proses penggunaan pipet.
Hasil Pemurnian DNA setelah Ligasi Adaptor
Pemurnian produk hasil ligasi adaptor dilakukan dengan menggunakan gel agarosa 2%. Proses pemurnian reaksi produk ligasi dilakukan pada sebuah gel dan akan mengangkat adaptor-adaptor yang tidak menempel, adaptor yang terligasi baik satu sama lainnya, dan melakukan seleksi ukuran dari sekuensing pustaka untuk menghasilkan kelompok (cluster) yang cocok (Illumina 2010a). Tahapan pemurnian ini mengalami sedikit modifikasi dari protokolnya yaitu saat dielektroforesis pada gel elektroforesis selama 60 menit dengan 100 volt sementara aturan prosedur yaitu 120 volt dan 120 menit. Optimasi telah dilakukan sebelumnya oleh Satyawan (2014), dimana ke dalam tabung yang berisi DNA hasil ligasi langsung ditambahkan blue juice sebagai pemberat dan pemberi warna DNA sedangkan pewarna SyBr Gold langsung dicampurkan ke dalam gel agarosa 2% untuk deteksi yang lebih akurat.
Gambar 4 merupakan perwakilan dari beberapa genotipe kentang hasil pemurnian setelah ligasi adaptor. Genotipe yang mewakili yaitu Amudera dan Margahayu. Pita-pita DNA yang smear ditunjukkan berada pada ukuran yang diharapkan yaitu 300-400 bp dengan marker 100 bp. Pita DNA yang smear ini menunjukkan ukuran-ukuran terpotongnya DNA dimana pada ukuran 300-400 bp intensitas DNA sedikit tinggi sehingga DNA dapat dipotong pada ukuran tersebut. Pemotongan tersebut dilakukan dengan cara mengiris gel pada ukuran DNA 300-400 bp dan kemudian gel yang telah diiris dimasukkan ke dalam tabung untuk kemudian disimpan dan digunakan pada tahapan selanjutnya. Ukuran-ukuran ini diseleksi sesuai dengan ukuran pustaka yang dibutuhkan (<800 bp) untuk sekuensing menggunakan NGS. Tahapan terakhir dari konstruksi pustaka genom yang dilakukan adalah perbanyakan DNA hasil pemurnian ligasi adaptor yaitu perbanyakan DNA yang berukuran 300-400 bp.
Hasil Perbanyakan DNA setelah Pemurnian DNA Fragmen
Konsentrasi dan kemurnian DNA setelah tahapan perbanyakan fragmen DNA dapat diukur dengan menggunakan nanodrop sedangkan uji kualitas hasil perbanyakan dapat diketahui dengan elektroforesis DNA pada gel agarosa 2%. Supernatan yang tersisa pada tabung dapat digunakan untuk pengukuran setelah proses pembersihan perbanyakan fragmen DNA. Kuantitas atau konsentrasi asam nukleat yang diperoleh yaitu sebesar 3 ng/uL hingga 17.7 ng/uL dengan tingkat kemurnian A260/280 yang diperoleh sebesar 1.53 hingga 2.67 dan kemurnian terhadap polisakarida A260/230 yang diperoleh sebesar 1.62 hingga 4.47 (Tabel 5). Kemurnian yang kecil yaitu <1.8 dan yang melebihi nilai 2 mungkin disebabkan pada saat pengukuran masih terkontaminasi oleh manik-manik paramagnetik. Kualitas pustaka hasil perbanyakan fragmen DNA ditunjukkan oleh elektroforegram pada gambar 5 yang menunjukkan bahwa pita-pita DNA berada pada ukuran yang diharapkan yaitu 400-500 bp dan ukuran ini masih berada pada rentang ukuran ideal dari pustaka genom.
Hasil Validasi Kualitas Dan Kuantitas Pustaka Genom Kentang
Pustaka genom kentang yang telah berhasil dikonstruksi dapat diukur kualitas dan kuantitasnya untuk memudahkan pada tahap klasterisasi dan sekuensing DNA. Kualitas pustaka genom kentang yang telah berhasil dikonstruksi dapat diukur ukuran fragmennya dengan menggunakan instrumen bioanalyzer dan analisis menggunakan software photocap_MW. Analisis terhadap kuantitas pustaka genom hasil konstruksi dapat dilakukan dengan menggunakan quantitative PCR (qPCR). Analisis ini masing-masing hanya menggunakan DNA hasil pustaka yang sedikit (±2 ul) sehingga jumlah pustaka DNA yang nantinya akan digunakan untuk klasterisasi dan sekuensing masih terpenuhi. Terdapat perbedaan antara bionalyzer dan qPCR selain masing-masingnya untuk analisis kualitatif dan kuantitatif. Instrumen bioanalyzer selain digunakan untuk analisis kualitas juga dapat mengukur kuantitas pustaka DNA namun instrumen ini akan membaca semua pustaka berdasarkan potongannya. Sementara itu, qPCR hanya akan mengukur pustaka yang memiliki fragmen yang ditempeli adaptor pada kedua ujungnya dan juga menggunakan 2 primer sehingga data kuantitas lebih akurat.
22
Bionalyzer terdiri dari sebuah alat yang terhubung dengan sebuah komputer dan software didalamnya dan chip atau lempeng yang kompatibel yang menghasilkan pita-pita DNA saat pembacaannya. Chip agilent ini dapat digunakan untuk mengukur DNA, RNA dan protein dengan prinsip pengujian yang sama. Prinsip pengujian elektroforesis yang didasarkan pada prinsip gel elektroforesis yang dipindahkan ke dalam bentuk lempengan. Bentuk lempengan akan mengurangi penggunaan waktu dan penggunaan sampel. Pengujian kuantitas DNA dan protein dapat diselesaikan dengan bantuan “upper marker”. Peak sampel berada dibawah daerah upper marker dan karena konsentrasi upper marker telah diketahui maka konsentrasi tiap sampel juga dapat dihitung (Agilent Technologies 2003). Hasil pengukuran dengan bioanalyzer juga dapat menghasilkan data berupa gambar elektroforegram dengan pita-pita yang tajam dan ukuran yang sangat spesifik (Gambar 5).
Metode deteksi dengan qPCR merupakan sebuah proses dimana reaksi PCR ini mengandung enzim dNTPs, buffer dan SyBr Green I, primer dan template. SyBr Green I tidak memiliki fluororescen yang signifikan terhadap kehadiran single stranded DNA (ssDNA). Proses selanjutnya yaitu produk dsDNA akan berinteraksi dengan SyBr Green I dan menjadi sebuah produk yang bersinar. Ketika produk sudah cukup terakumulasi maka fluororescen akan meningkat lebih tinggi dibanding sebelumnya dan ini dinamakan dengan siklus ambang batas (Ct). Nilai Ct kemudian digunakan untuk mengukur kuantitas jumlah template saat dimulainya reaksi (Sigma 2008). Berdasarkan proses inilah maka konsentrasi pustaka akhir yang dihasilkan dapat diketahui.
Nilai kuantitas pustaka genom kentang diukur menggunakan qPCR dengan tiga kali pengenceran (1000, 2000 dan 4000) (Lampiran 2) pada genotipenya menghasilkan kuantitas pustaka genom kentang dengan ukuran rata-rata sebesar 13.08 nM hingga 60.14 nM (Tabel 7) yang selanjutnya dapat digunakan untuk perhitungan pustaka yang dibutuhkan untuk klasterisasi. Konsentrasi pustaka genom kentang yang dibutuhkan untuk klasterisasi yaitu minimal 2 nM yang diencerkan ke dalam Tris-Cl 10 mM pH 8.5 dan 0.1% Tween 20 untuk mencegah absorbsi template ke tabung saat siklus karena dapat menurunkan jumlah klasterisasi. Proses klasterisasi sendiri menggunakan pustaka DNA genom dengan konsentrasi 13 pM, hasil ini diperoleh dari pengenceran stok pustaka DNA 2 nM.
Klasterisasi dan Sekuensing Pustaka Genom Kentang Jumlah Basa dan Kualitas Klaster Pustaka Genom secara Umum
Proses atau alur penghasilan klaster di dalam cBOT terdiri dari imobilisasi dan ekstensi 3’, bridge amplification, linearisasi, dan hibridisasi (Lampiran 4). Penambahan NaOH untuk denaturasi DNA ditambahkan diawal dan netralisasi reaksi dilakukan dengan menambahkan HT1 buffer hibridisasi (Subtelny 2014). Klaster yang telah dihasilkan diatas flow cell ini selanjutnya dapat digunakan untuk proses sekuensing DNA genom kentang pada alat NGS Hiseq 2000. Sekuensing ini juga dapat digunakan untuk menganalisis kualitas dari pustaka genom yang telah dikonstruksi dan diklasterisasi sebelumnya. Proses analisis ini dilakukan dengan melihat hasil pencitraan terhadap klaster pustaka genom saat proses sekuensing berlangsung (Illumina 2011).
Secara total jumlah basa hasil sekuensing (yield total) diperoleh sebanyak 287.2 x 109 bp atau 287.2 Gbp dan hasil ini memiliki kesamaan dengan jumlah basa yang diprediksi akan diperoleh selama proses sekuensing berlangsung (projected total yield). Jumlah basa total dari hasil sekuensing ini sebenarnya merupakan jumlah basa total dari beberapa sampel yaitu kentang, jagung dan kakao yang saat proses sekuensing dilakukan pada saat bersamaan di dalam suatu flow cell. Nilai projected total yield bergantung pada tipe pembacaan yang dipilih selama proses sekuensing dimana NGS Hiseq 2000 memiliki empat tipe pembacaan yaitu single read, paired end, multiplexed single read dan multiplexed paired end. Penelitian ini menggunakan tipe pembacaan sekuensing adalah paired end dengan jumlah siklus sebanyak 200 siklus.
Sekuenser sistem Hiseq ini mengadopsi teknologi sekuensing dengan sintesis. Pustaka dengan adaptor yang sesuai didenaturasi menjadi untas tunggal dan dicangkokan ke atas flow cell, diikuti dengan perbanyakan jembatan ke setiap klaster yang mengandung klon fragmen DNA. Sebelum disekuensing, pustaka disambung ke dalam utas tunggal dengan bantuan enzim linearisasi dan kemudian empat jenis nukleotida (ddATP, ddGTP, ddCTP, dan ddTTP) yang mengandung pewarna fluororescen berbeda dan menghilangkan kelompok penghambat yang berkomplemen dengan template basa satu kali dan sinyal akan ditangkap oleh CCD (alat pengisi sambungan) (Liu et al. 2012).
Yield perfect yang diperoleh selama proses sekuensing yaitu sebesar 5.1 Gbp (tabel 8). Menurut Kosasih (2012), nilai yang diperoleh tersebut merupakan nilai yield pada lajur kontrol (lajur PhiX) sehingga nilainya hanya seperdelapan dari nilai yield total. Nilai yield perfect menunjukkan jumlah basa yang akurat melewati passing filter. Passing filter adalah sejenis algoritma yang dipakai oleh komputer untuk menentukan keakuratan pembacaan basa saat sekuensing. Passing filter yang digunakan berdasarkan data sekuen PhiX yang berperan sebagai kontrol pada tahapan sekuensing menggunakan NGS Hiseq 2000.
24
Nilai yield <=3 errors, %perfect dan %<=3 errors menunjukkan tingkat kesalahan selama proses sekuensing. Yield <=3 errors menunjukkan jumah basa pada lajur kontrol yang memiliki tingkat kesalahan di bawah 3 basa. Nilai yield <=3 errors dan yield perfect yang dihasilkan juga dapat menunjukkan bahwa jumlah basa pada lajur kontrol memiliki tingkat kesalahan antara 1-3 basa. Nilai %perfect yang dihasilkan selama proses sekuensing menunjukkan persentase tingkat kesamaan antara basa yang dihasilkan dengan sekuen PhiX dalam 99 siklus. Nilai %<=3 errors menunjukkan persentase jumlah basa yang memiliki tingkat kesalahan kurang dari 3 basa. Nilai yield <=3 errors, %perfect dan %<=3 errors dapat dilihat pada tabel 8 dengan nilai masing-masing 6.1 Gbp, 82 % dari 99 siklus dan 97.55 % untuk 99 siklus.
Densitas dan Kualitas Pustaka Genom Kentang pada Lajur dalam Flow Cell
Hasil konstruksi dari pustaka genom dialirkan pada setiap lajur dari flow cell untuk menghasilkan klaster pustaka genom. Klaster di dalam flow cell yang telah klasterisasi ini selanjutkan akan diukur kualitas dan kuantitasnya di dalam sekuensing. Pengukuran kuantitas klaster dilakukan untuk menghitung densitas (kerapatan klaster) di dalam suatu lajur pada flow cell. Hasil sekuensing menunjukkan bahwa densitas klaster pustaka genom yang dihasilkan berkisar 633 K/mm2 -881 K/mm2 (Tabel 9). Kualitas klaster pustaka genom dapat dilihat dari gambar yang ditangkap kamera dengan sebaran yang tidak terlalu rapat ataupun tidak terlalu jarang. Densitas klaster pustaka genom termasuk kategor ideal jika klaster pustaka genom memiliki densitas berkisar dari 400-600 K/mm2.
Lajur flow cell dari masing-masing pustaka genom kentang yang dihasilkan memiliki densitas yang tinggi dengan nilai densitas klaster >600 K/mm2. Densitas klaster yang tinggi dapat disebabkan karena konsentrasi pustaka genom yang digunakan dalam proses klasterisasi lebih tinggi dari seharusnya (>13 pM). Hal ini juga mungkin terjadi karena kesalahan dalam pengukuran konsentrasi pustaka genom sebelum klasterisasi (Quail et al. 2008). Kesalahan pengukuran konsentrasi mungkin juga disebabkan oleh kesalahan perhitungan atau pengukuran saat validasi pustaka genom kentang dan juga kesalahan dalam penggunaan mikropipet.
Persentase klaster pustaka genom kentang yang melewati passing filter juga dihitung. Persentase klaster passing filter (PF) yang dihasilkan selama proses sekuensing memiliki nilai lebih dari 80% (Tabel 9). Hasil tersebut menunjukkan bahwa nilai klaster PF termasuk ke dalam kategori ideal. Illumina (2009) menyatakan bahwa nilai persen klaster PF yang ideal memiliki nilai lebih dari 70%. Rendahnya nilai persen klaster PF dapat disebabkan oleh beberapa hal diantaranya densitas klaster yang terlalu tinggi, ukuran pustaka genom yang terlalu panjang dan tingginya persen dephasing (pashing dan prephasing) selama proses sekuensing (Kosasih 2012).
Phasing dan prephasing dipengaruhi oleh efisiensi aliran fluida reagen sekuensing dan reaksi kimia yang terjadi selama proses sekuensing (Illumina 2009). Phasing dan prephasing menggambarkan hilangnya sinkronisasi dalam pembacaan basa dari urutan salinan klaster. Hal tersebut mengakibatkan dalam pembacaan basa hasil sintesis selama proses sekuensing ada yang dibaca terlalu cepat (prephasing) dan ada yang terlalu lambat (phasing). Kircher et al. (2011) menyatakan bahwa phasing disebabkan tidak sempurnanya pemutusan ikatan kimia penanda flourorescen pada proses terminasi gugus 3’OH dalam suatu klaster. Efek phasing menyebabkan pada siklus selanjutnya tidak ada penempelan basa pada klaster tersebut sehingga pendaran flourorescen yang terbaca bukan berasal dari siklus sintesis basa yang baru melainkan berasal dari pendaran flouroresen hasil sintesis basa sebelumnya. Berbeda dengan phasing, prephasing disebabkan tidak efektifnya proses pemblokiran saat penempelan basa pada gugus 3’OH yang menyebabkan terjadinya penempelan dua basa sekaligus dalam waktu yang bersamaan.
Nilai reads menunjukkan hasil pembacaan urutan basa dalam setiap klaster pustaka genom. Sedangkan, nilai reads PF menunjukkan hasil pembacaan urutan basa dalam klaster yang melewati passing filter (Kosasih 2012). Jumlah keseluruhan nilai reads PF yang dihasilkan dari semua klaster pustaka genom dan kontrol PhiX mempresentasikan nilai yield total. Nilai reads dan reads PF dapat dilihat pada tabel 9 dimana nilainya sebesar 174.87 hingga 243.68 M untuk reads dan 165.82 hingga 216.87 untuk nilai reads PF.
Nilai Q scores atau angka kualitas didefinisikan sebagai hubungan logaritmik antara proses base calling selama sekuensing dengan kemungkinan tingkat kesalahan yang dihasilkan dalam proses tersebut (Minoche et al. 2011). Base calling diartikan sebagai proses konversi data hasil pencitraan pendaran flourorescen selama proses sekuensing menjadi basa-basa yang berurutan. Nilai Q scores pada penelitian ini diambil nilai Q score 30 yang artinya penghitungan 1 kesalahan pembacaan didalam 1000 basa atau dapat juga dikatakan P=0.001 % kesalahan (Minoche et al. 2011). Secara keseluruhan nilai Q scores yang dihasilkan selama proses sekuensing yaitu 88.4 hingga 92.75 % (Tabel 9) dan gambar 7 merupakan salah satu contoh dari histogram jumlah klaster pada lajur 1 (Genotipe Amudera) berdasarkan kualitas sekuen yang dihasilkan yaitu nilai Q scores 92.5% dengan jumlah basa yang dibaca sebanyak 31.7 Gb.
Tingkat Kesalahan (Error Rate), Nilai Penyejajaran (Aligned) dan Intensitas Basa Hasil Sekuensing