UJI DISSOLUSI PREDNISON PADA SEDIAAN TABLET
TUGAS AKHIR
Oleh:
IIN LESTARI SITORUS NIM 072410014
PROGRAM DIPLOMA III ANALIS FARMASI DAN MAKANAN FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
KATA PENGANTAR
Segala puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa yang telah mencurahkan berkat dan kasih-Nya serta menganugerahkan pengetahuan dan kesempatan sehingga penulis dapat menyelesaikan tugas akhir ini. Tugas akhir
yang berjudul “UJI DISOLUSI PREDNISON PADA SEDIAAN TABLET ”. Yang bertujuan untuk memenuhi persyaratan dalam menyelesaikan pendidikan Diploma III
Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara Medan. Selama penulisan tugas akhir ini penulis banyak menerima bimbingan dan dukungan dari berbagai pihak, teristimewa dari kedua orang tua tercinta, Ayahanda
Yohannes Sitorus dan Ibunda Arifah Nahampun yang telah memberikan kasih sayang dan doa yang tiada pernah henti untuk dukungan moril dan materil selama
ini, pada kesempatan ini juga penulis ingin mengucapkan terima kasih kepada:
1. Bapak Drs. Syafruddin, MS., Apt., sebagai dosen pembimbing yang telah memberikan arahan dan bimbingan dengan penuh perhatian hingga tugas
akhir ini selesai.
2. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., sebagai Dekan Fakultas
Farmasi Universitas Sumatera Utara Medan.
3. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., sebagai Koordinator Program Diploma III Analis Farmasi dan Makanan.
4. Dosen dan Pegawai Fakultas Farmasi Program Diploma III Analis Farmasi dan Makanan yang berupaya mendukung kemajuan mahasiswa Analis
5. Ibu Zakiah Kurniati, S. Farm., Apt., selaku Koordinator Pembimbing PKL di Balai Besar POM di Medan.
6. Bapak dan Ibu dosen beserta seluruh staf Program Studi Diploma III Analis Farmasi dan Makanan Universitas Sumatera Utara.
7. Seluruh rekan-rekan mahasiswa Analis Farmasi dan Makanan Angkatan 2007
yang telah memberikan saran dan dukungan dalam menyelesaikan tugas akhir ini.
8. Untuk saudara ku Boy, Ricky, Endu, lita, Hardi, yuyun, Nata serta keluarga dengan doa dan motivasi dan dorongan yang diberikan terhadap penulis sehingga tugas akhir ini selesai.
Penulis menyadari bahwa masih banyak terdapat kekurangan dalam penulisan tugas ini, baik dari susunan kata-kata maupun isinya. Oleh karena itu penulis
mengharapkan kritik dan saran yang membangun untuk kesempurnaan tugas akhir ini. Akhir kata penulis berharap tugas akhir ini dapat bermanfaat bagi semua pihak yang membaca.
Medan, Mei 2010 Penulis,
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ... v
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 3
1.2 Tujuan dan Manfaat ... 3
1.2.1 Tujuan ... 3
1.2.1 Manfaat ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Prednison ... 4
2.1.1 Sifat Fisika Kimia Prednison ... 4
2.1.2 Tentang Prednison ... 5
2.2 Tablet ... 6
2.2.1 Evaluasi Tablet ... 8
2.3 Uji Dissolusi ... 11
2.3.1 Faktor yang Mempengaruhi Pengujian Disolussi ... 13
2.3.1.1 Faktor Lingkungan selama Uji Disolussi ... 13
2.3.1.2 Faktor Terkait komposisi dan Metode Tablet ... 13
2.3.1.3 Formulasi Medium Dissolusi ... 14
2.4 Spektrofotometri ... 14
2.4.1 Definisi ... 14
BAB III METODE PERCOBAAN ... 17
3.1 Sampel yang diperiksa ... 17
3.2 Alat dan Bahan ... 17
3.2.1 Alat-alat ... 17
3.2.2 Bahan-bahan ... 17
3.2.3 Prosedur ... 17
3.2.3.1 Larutan Uji ... 17
3.2.3.2 Larutan Baku ... 18
3.2.3.3 Cara Penetapan ... 18
BAB IV HASIL DAN PEMBAHASAN ... 19
4.1 Hasil ... 19
4.2 Pembahasan ... 21
BAB V KESIMPULAN DAN SARAN ... 22
5.1 Kesimpulan ... 22
5.2 Saran ... 22
BAB I PENDAHULUAN
1.1 Latar Belakang
Obat adalah semua zat baik yang bersifat kimia, hewani, maupun
nabati yang dalam dosis layak dapat menyembuhkan atau mencegah penyakit berikut gejalanya. Obat juga dapat didefinisikan sebagai suatu zat yang dimaksudkan untuk
dipakai dalam diagnosis, mengurangi rasa sakit, mengobati atau mencegah penyakit pada manusia atau hewan (Ansel, 1989).
Obat memiliki cakupan makna yang cukup luas, bukan hanya terbatas pada
zat-zat yang digunakan untuk menyembuhkan seseorang dari sakit. Zat-zat yang berfungsi untuk menetapkan diagnosa (mengetahui penyakit), mencegah,
mengurangi, menghilangkan penyakit atau gejala penyakit, luka atau kelainan, baik jasmani maupun rohani pada manusia dan hewan juga disebut obat (Widodo, 2004).
Tablet adalah sediaan padat, dibuat secara kempa-cetak berbentuk rata atau
cembung rangkap, umumnya bulat, mengandung satu jenis obat atau lebih dengan atau tanpa zat tambahan (Anief, 1999).
Senyawa teroid adalah senyawa golongan lipid yang memiliki stuktur kimia
tertentu yang memiliki tiga cincin sikloheksana dan satu cincin siklopentana. Suatu molekul steroid yang dihasilkan secara alami oleh korteks adrenal tubuh dikenal
dengan nama senyawa kortikosteroid (Darmansjah, 2005).
Reseptor glukokortikoid adalah protein yang sebagian besar berada di dalam
yang bersifat lipofilik. Obat golongan glukortikoid (lebih sering disebut obat-obat kortikosteroid) seperti prednison hingga saat ini masih menjadi obat utama dalam
pengatasan penyakit-penyakit dan gangguan sistem (Ikawati, 2006).
Salah satu parameter uji yang dilakukan untuk pengujian sediaan tablet adalah dilakukan uji disolusi. Uji ini dilakukan untuk menentukan kesesuaian dengan
persyaratan disolusi yang tertera dalam masing-masing monografi untuk sediaan tablet dan kapsul, kecuali pada etiket dinyatakan bahwa tablet harus dikunyah.
Persyaratan disolusi tidak berlaku untuk kapsul gelatin lunak kecuali bila dinyatakan lain dalam monografi. Pengujian disolusi sangat bermanfaat dalam mengidentifikasi artikel-artikel ini. Pengujian disolusi menjadi sangat penting, jika disolusi merupakan
faktor pembatas dalam absorbsi obat. Pengujian disolusi digunakan untuk membuktikan kesesuaian dengan spesifikasi kompendial dan dapat merupakan
persyaratan dalam registrasi obat. Pada tablet prednison toleransi dalam waktu 30 menit harus larut tidak kurang dari 80% dari jumlah yang tertera pada etiket (Depkes RI. 1994).
Uji disolusi merupakan komponen penting untuk penilaian kualitas sediaan oral padat. Prosedur yang menjadi dasar uji disolusi dari sediaan oral padat ini
selanjutnya diperluas pada sistem penghantaran trans dermal. Kecepatan pelepasan untuk sediaan dengan pelepasan dimodifikasi oral diberlakukan pula belakangan untuk menetapkan kriteria penerimaan (Syukri, 2002).
Spektroskopi memerlukan peralatan berbiaya murah sampai sedang dan mempunyai kepekaan analisis cukup tinggi. Karena luasnya ragam bahan farmasi
ini banyak dipakai dalam analisis farmasi dan analisis klinik. Hubungan antara kadar analit dan jumlah cahaya terserap merupakan dasar kebanyakan penerapan
spektroskopi. Spektro Ultraviolet pada tablet prednison dengan etanol – 240 nm (A¦ = 420a) (Munson, 1995).
1.2 Tujuan dan Manfaat 1.2.1 Tujuan
Tujuan tugas akhir ini adalah untuk mengetahui jumlah zat aktif yang terlarut
dalam media cair dengan volume, waktu, absorbsi dan alat uji disolusi tipe dayung toleransi dalam waktu 30 menit harus larut tidak kurang dari 80% dari jumlah yang tertera pada etiket, menggunakan metode spektrofotometri. Apakah memenuhi
syarat seperti yang tertera pada Farmakope Indonesia edisi IV (Dirjen POM, 1995). 1.2.2 Manfaat
Untuk mengetahui berapa % jumlah zat berkhasiat yang terlepas pada setiap interval waktu tertentu dan untuk mengetahui laju pelarutan zat aktif dari sediaan, karena absorbsi dan kemampuan obat berada dalam tubuh sangat tergantung pada
BAB II
TINJAUAN PUSTAKA
2.1 Prednison
2.1.1 Sifat fisika kimia (Dirjen POM, 1995)
Rumus bangun :
Nama kimia : 17,21-Dihidroksipregna-1,4-diena-3,11,20-trion
Sinonim : Prednisonum
Rumus molekul : C21H26O5
Berat molekul : 358,43
Pemerian :Serbuk hablur putih atau praktis putih, tidak berbau;
melebur pada suhu 230°C disertai peruraian
Susut pengeringan : Tidak lebih dari 1,0%, lakukan pengeringan pada suhu 105°C
selama 3 jam
Kelarutan : Sangat sukar larut dalam air, sukar larut dalam etanol, dalam
kloroform, dalam dioksan dan dalam metanol.
Toleransi dalam dalam 30 menit harus larut tidak kurang dari 80% (Q) C21H26O5
dari jumlah yang tertera pada etiket (Dirjen POM, 1995).
2.1.2 Tentang prednison
Senyawa teroid adalah senyawa golongan lipid yang memiliki stuktur kimia tertentu yang memiliki tiga cincin sikloheksana dan satu cincin siklopentana. Suatu
molekul steroid yang dihasilkan secara alami oleh korteks adrenal tubuh dikenal dengan nama senyawa kortikosteroid. Kortikosteroid sendiri digolongkan menjadi
dua berdasarkan aktifitasnya, yaitu glukokortikoid dan mineralokortikoid. Glukokortikoid memiliki peranan pada metabolisme glukosa, sedangkan mineralokortikosteroid memiliki retensi garam. Pada manusia, glukortikoid alami
yang utama adalah kortisol atau hidrokortison, sedangkan mineralokortikoid utama adalah aldosteron. Selain steroid alami, telah banyak disintetis glukokortikoid
sintetik, yang termasuk golongan obat yang penting karena secara luas digunakan terutama untuk pengobatan penyakit-penyakit inflasi. Contoh antara lain adalah deksametason, prednison, metil prednisolon, triamsinolon dan betametason
(Ikawati, 2006).
Kortikosteroid bekerja dengan mempengaruhi kecepatan sintetis protein.
Molekul hormon memasuki sel melewati membran plasma secara difusi pasif. Hanya di jaringan target hormon ini bereaksi dengan reseptor protein yang spesifik dalam sitoplasma sel dan membentuk kompleks reseptor-steroid. Kompleks ini mengalami
Induksi sintetis protein ini yang akan menghasilkan efek fisiologik steroid (Darmansjah, 2005).
Menurut Theodorus (1994) tentang indikasi, kontra indikasi, interaksi obat, efek samping dari penggunaan prednison yaitu:
Indikasi :Insufisiensi adrenal, nefrotik sindrom, penyakit kolagen, asma
bronchial, penyakit jantung, reumatik, leukemia limfositik, limfoma, edema serebral, konjungtifitis alergika, otitis
eksterna, penyakit kulit.
Kontra indikasi :Infeksi jamur sistemik, hipersensitifitas, hati-hati pemberian
pada penderita colitis ulserasif, insufisiensi ginjal, hipertensi,
infeksi pirogenik
Interaksi obat :Fenitan, fenobarbital, efedrin, rifampin, meningkatkan
bersihan obat ini. Merubah respon anti koagulan bila diberi bersama, kejadian hiperkakemia meningkat bila diberi bersama diuretika hemat kalsium.
Efek samping :Mual, penurun berat badan, jerawat, lemah, menipisnya tulang,
retensi cairan, ulkus reptikum, bingung.
2.2 Tablet
Tablet adalah sediaan padat yang kompak, dibuat secara kempa-cetak berbentuk pipih dengan kedua permukaan rata atau cembung, dan mengandung satu
Menurut Ansel (1989) zat tambahan yang digunakan dapat berfungsi sebagai:
a. Zat pengisi, yaitu untuk memperbesar volume tablet. Biasanya yang digunakan
amilum manihot, kalsium fosfat, kalsium karbonat dan zat lain yang cocok.
b. Zat pengikat, yaitu agar tablet tidak pecah atau retak, dapat merekat. Biasanya
yang digunakan adalah musilago 10-20%, larutan metil cellulosum 5%.
c. Zat penghancur, yaitu agar tablet dapat hancur dalam saluran pencernaan.
Biasanya yang digunakan amilum manihot kering, gelatin, natrium alginat.
d. Zat pelicin, yaitu agar tablet tidak melekat pada cetakan. Biasanya yang
digunakan talkum 5%, magnesium stearat, asam stearat.
Menurut Ansel, (1989) berdasarkan penggunaannya tablet diklasifikasikan
sebagai berikut:
a. Tablet Kunyah
Tablet ini harus lembut (segera hancur ketika dikunyah) atau mudah melarut dalam untuk garam-garam logam yang digunakan dalam tablet antasida. Tablet kunyah diberikan pada pasien yang mengalami gangguan menelan tablet. Tablet ini
digunakan dalam formulasi tablet untuk anak-anak 6 (dalam sediaan multivitamin). Sediaan ini juga memungkinkan untuk digunakan ditempat yang tidak tersedia air
contoh: Acitral, Vitacimin, Promag.
b. Tablet Sublingual
Tablet yang disisipkan dibawah lidah. Biasanya berbentuk datar, ditujukan
saluran pencernaan. Tablet ini dibuat segera melarut untuk memberikan efek yang cepat.
c. Tablet Bukal
Tablet yang disisipkan di pipi. Tablet ini dibuat agar hancur dan melarut
perlahan-lahan.
d. Tablet Triturat
Tablet ini bentuknya kecil dan biasanya silinder. Tablet triturat harus cepat
dan mudah larut seutuhnya didalam air contoh: Supradyn, Bevitram.
e. Tablet Hipodermik
Tablet ini digunakan melalui bawah kulit, dibuat dari bahan yang mudah larut
contoh: Andantol, Sagalon, Confortin.
f. Tablet Efervesen
Tablet yang menghasilkan gas, dibuat dengan cara kompresi granul yang
mengandung garam efervesen atau bahan-bahan lain yang mampu menghasilkan gas ketika bercampur dengan air. Misalnya penggabungan logam karbonat atau
bikarbonat dengan tatrat menghasilkan gas CO2 di dalam air. Tablet bentuk ini
mempercepat pelarutan sediaan dan meningkatkan rasa contoh: tablet CDR,
Redoxon.
2.2.1 Evaluasi tablet
Untuk menjamin mutu tablet maka dilakukan beberapa pengujian yaitu
sebagai berikut:
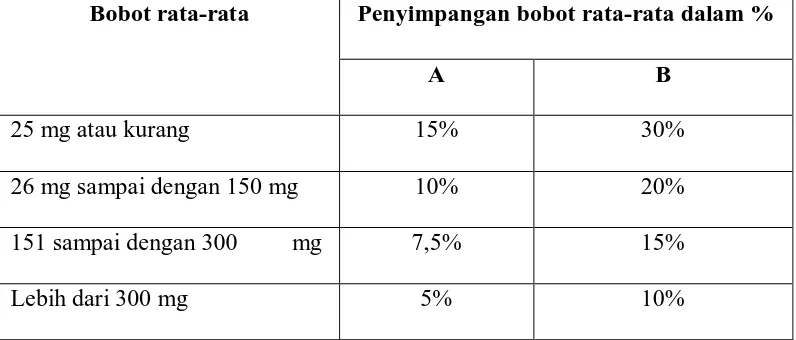
Tablet harus memenuhi uji keseragaman bobot. Keseragaman bobot ini ditetapkan untuk menjamin keseragaman bobot tiap tablet yang dibuat. Tablet-tablet
yang bobotnya seragam diharapkan akan memiliki kandungan bahan obat yang sama, sehingga akan mempunyai efek terapi yang sama. Keseragaman bobot dapat ditetapkan sebagai berikut: ditimbang 20 tablet, lalu dihitung bobot rata-rata tiap
tablet. Kemudian timbang tablet satu persatu, tidak boleh lebih dari 2 tablet bobotnya menyimpang dari bobot rata-rata lebih besar dari yang ditetapkan pada
kolom A dan tidak boleh satu tablet pun bobotnya menyimpang dari rata-rata lebih besar dari yang ditetapkan pada kolom B. jika perlu gunakan 10 tablet yang lain dan tidak satu tablet yang bobotnya menyimpang lebih besar dari bobot rata-rata yang
[image:14.595.94.492.445.615.2]ditetapkan dalam kolom A maupu n kolom B (Dirjen POM, 1984). Tabel 1 : Penyimpangan bobot rata-rata
Bobot rata-rata Penyimpangan bobot rata-rata dalam %
A B
25 mg atau kurang 15% 30%
26 mg sampai dengan 150 mg 10% 20%
151 sampai dengan 300 mg 7,5% 15%
Lebih dari 300 mg 5% 10%
b. Uji kekerasan
Kekerasan tablet dan ketebalannya berhubungan dengan isi die dan gaya
menentukan kekerasan tablet. Umumnya kekuatan tablet berkisar 4 - 8 kg, bobot tersebut dianggap sebagai batas minimum untuk menghasilkan tablet yang
memuaskan. Alat yang digunakan untuk uji ini adalah hardness tester, alat ini diharapkan dapat mengukur berat yang diperlukan untuk memecahkan tablet (Lachman, 1994).
c. Uji keregasan
Cara lain untuk menentukan kekuatan tablet ialah dengan mengukur
keregasannya. Gesekan dan goncangan merupakan penyebab tablet menjadi hancur. Untuk menguji keregasan tablet digunakan alat Roche friabilator. Sebelum tablet dimasukkan ke alat friabilator, tablet ditimbang terlebih dahulu. Kemudian tablet
dimasukkan kedalam alat, lalu alat dioperasikan selama empat menit atau 100 kali putaran. Tablet ditimbang kembali dan dibandingkan dengan berat mula-mula.
Selisih berat dihitung sebagai keregasan tablet. Persyaratan keregasan harus lebih kecil dari 0,8% (Ansel, 1989).
d. Uji waktu hancur
Peralatan uji waktu hancur terdiri dari rak keranjang yang mempunyai enam lubang yang terletak vertikal diatas ayakan mesh nomor 10 selama percobaan, tablet
diletakkan pada tiap lubang keranjang. Kemudian keranjang tersebut bergerak naik turun pada larutan transparan dengan kecepatan 29 – 32 putaran permenit. Interval waktu hancur adalah 5 – 30 menit. Tablet dikatakan hancur bila bentuk sisa tablet
e. Uji penetapan kadar zat berkhasiat
Uji penetapan kadar berkhasiat dilakukan untuk mengetahui apakah tablet tersebut
memenuhi syarat sesuai dengan etiket. Bila kadar obat tersebut tidak memenuhi syarat maka obat tersebut tidak memiliki efek terapi yang baik dan tidak layak dikonsumsi. Uji penetapan kadar dilakukan dengan menggunakan cara-cara yang
sesuai pada masing-masing monografi antara lain di farmakope Indonesia. Seperti
tablet prednison mengandung prednison, C21H26O5 tidak kurang dari dari 90% dan
tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. f. Uji disolusi
Obat yang telah memenuhi persyaratan kekerasan, waktu hancur, keregasan,
keseragaman bobot, dan penetapan kadar, belum dapat menjamin bahwa suatu obat memenuhi efek terapi, karena itu uji disolusi harus dilakukan pada setiap produksi
tablet. Disolusi adalah proses pemindahan molekul obat dari bentuk padat kadalam larutan pada suatu medium. Dissolusi menunjukan jumlah bahan obat yang terlarut dalam waktu tertentu. Dissolusi menggambarkan efek obat secara invitro, jika
disolusi memenuhi syarat maka diharapkan obat akan memberikan khasiat secara invitro (Syukri, 2002).
2.3 Uji Dissolusi
Laju disolusi atau waktu yang diperlukan bagi obat untuk melarutkan dalam cairan pada tempat absorpsi, merupakan tahap yang menentukan laju proses absorbsi.
respons, serta kontrol bioavailaibilitas obat tersebut keseluruhan dari bentuk sediaannya (Ansel, 1989).
Uji ini digunakan untuk menentukan kesesuaian dengan persyaratan disolusi yang tertera dalam masing-masing monografi untuk sediaan tablet dan kapsul, kecuali pada etiket dinyatakan bahwa tablet harus dikunyah. Persyaratan disolusi
tidak berlaku untuk kapsul gelatin lunak kecuali bila dinyatakan dalam masing-masing monografi. Dari jenis alat penggunaannya dari salah satu sesuai dengan yang
tertera dalam masing-masing monografi yaitu:
a. Tipe keranjang
Alat terdiri dari sebuah wadah bertutup yang terbuat dari kaca atau bahan
transparan lain yang inert, suatu motor, suatu batang logam yang digerakkan oleh motor dan keranjang berbentuk silinder. Wadah tercelup sebagian di dalam suatu
tangas air yang sesuai berukuran sedemikian sehingga dapat mempertahankan suhu dalam wadah pada 37° ± 0,5°C selama pengujian berlangsung dan menjaga agar gerakan air dalam tangas air halus dan tetap.
b. Tipe dayung
Bedanya pada alat ini digunakan dayung yang terdiri dari dari daun dan
batang sebagai pengaduk. Batang berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm pada setiap titik dari sumbu vertikal wadah dan berputar dengan halus tanpa goyangan yang berarti. Daun melewati diameter batang sehingga
dasar daun dan batang rata. Dayung memenuhi spesifikasi. Jarak 25 mm ± 2 mm antara daun dan bagian dalam dasar wadah dipertahankan selama pengujian
dengan salut dengan suatu penyalut inert yang sesuai. Sediaan dibiarkan tenggelam ke dasar wadah sebelum dayung mulai berputar. Sepotong kecil bahan yang tidak
bereaksi seperti gulungan kawat berbentuk spiral dapat digunakan untuk mencegah mengapungnya sediaan.
Waktu bila dalam spesifikasi hanya terdapat satu waktu, pengujian dapat
diakhiri dalam waktu yang lebih singkat bila persyaratan jumlah minimum yang terlarut telah dipenuhi. Bila dinyatakan dua waktu atau lebih, cuplikan dapat diambil
hanya pada waktu yang ditentukan dengan toleransi ± 2% (Dirjen POM, 1994). Faktor-faktor yang mempengaruhi laju disolusi dari bentuk sediaan biasanya diklasifikasikan atas tiga kategori yaitu faktor yang berkaitan dengan sifat
fisikokimia obat, yang berkaitan dengan formulasi sediaan, dan faktor yang berkaitan dengan alat uji disolusi dan parameter uji (Syukri, 2002).
2.3.1 Faktor yang mempengaruhi pengujian disolusi 2.3.1.1 Faktor Lingkungan Selama Uji Dissolusi
- Intesitas pengadukan, kecepan dan tipe aliran cairan, serta faktor geometri.
- Gradien konsentrasi (perbedaan konsentrasi antara kelarutan obat dalam
medium disolusi dan konsentrasi rata-rata dalam ruahan cairan)
- Komposisi medium disolusi, pH, kekuatan ion, viskositas, tegangan
permukaan, dan sebagainya. Semua penting dan memerlukan komposisi medium.
2.3.1.2 Faktor Terkait Komposisi dan Metode Manufaktur Tablet
- Jumlah dan tipe eksipien atau pengisi dan bahan tambahan lain, seperti garam
netral.
- Tipe manufaktor tablet yang digunakan
- Jumlah dan tipe penghancur serta metode untuk inkorporasinya.
- Jumlah dan tipe surfaktan (kalau ditambahkan) serta metode inkorporasinya.
- Forsa pengempaan dan kecepatan pengempaan.
2.3.1.3 Formulasi Medium Disolusi
Idealnya, medium diisolusi diformulasi sedekat mungkin dengan pH in vivo yang diantisipasi. Sebagai contoh, medium disolusi yang didasarkan pada 0,1 N HCl
digunakan untuk menurunkan pH mendekati pH lambung. Hal ini disebabkan pH lambung manusia berada disekitar nilai 1-3. Cairan disolusi lambung dapat pula
digunakan. Makanan dapat meningkatkan pH lambung sampai 3-5 (Syukri, 2002). 2.4 Spektrofotometri
2.4.1 Definisi
Spektrofotometer sesuai dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan
panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi. Jadi, spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan atau
terseleksi dan diperoleh dengan alat penguat seperti prisma ataupun celah optis (Khopkar, 1990).
2.4.2 Instrumen
Menurut Munson (1991), alat utama spektrofotometri terdiri dari sumber cahaya, perangkat pemilah panjang gelombang, detektor, perangkat baca:
1. Sumber cahaya
Dalam spektrofotometer serapan UV-Vis tertdapat tiga jenis utama sumber
cahaya: lampu peluah, lampu benang pijar dan laser bertala. Lampu luah hydrogen memancarkan radiasi malar dari 200 sampai 360 nm sehingga sebagai sumber UV. lampu benang pijar dipakai pada sumber spectrum daerah sinar
tampak. Laser adalah penguatan cahaya dengan pancaran atau radiasi terangsang.
2. Perangkat pemilah panjang gelombang
Sebagai ditunjukkan namanya, penapis berfungsi memilah jangka panjang gelombang tertentu dengan cara menapiskan cahaya yang tak dikehendaki. Ada dua jenis utama penapis penimbrung dan penapis serapan. Penapis penimbrung
terdiri dari suatu lapisan tipis medium dielektrik bening yang tebalnya dikendalikan dengan cermat.
3. Detektor
Pada awal spektroskopi, tengara optik yang berasal dari terokan sering dievaluasi dengan mengenakannya pada lempeng fotografik, lalu lempeng dicuci.
Analisis kualitatif dilakukan dengan menebarkan tengara (biasanya dengan prisma) sehingga berbagai panjang gelombang cahaya menabrak lempeng
kenyataan bahwa kegelapan noda pada lempeng sebanding dengan intensitas cahaya yang mengenai lempeng pada noda tersebut. Metode penyidikan
spektroskopiserapan UV-Vis seperti ini sekarang sudah kuno. Sekarang detektor yang paling umum adalah transduser optik yang mengalih-ragamkan tengara cahaya manjadi tengara listrik yang dapat dipantau dengan mudah oleh beragam
perangkat baca.
4. Perangkat baca
Perangkat baca adalah sebuah peralatan listrik yang menampilkan arus dari detektor dalam satuan yang bertalian (misalnya daya serap dan atau persentase transmitans pada spektrofotometer UV-Vis). Perangkat baca yang paling lugas
adalah meter analog, yang berbijak pada galvanometer. Arus besar dari detektor menghasilkan penyimpangan yang besar dari jarum meter, sehingga intensitas
BAB III METODOLOGI
3.1 Sampel yang diperiksa
Nama Dagang : Prednison
Komposisi : Prednison tablet 5 mg
No. batch : 79858
No.Reg : GKL 0506504304 A1
Kadaluarsa : Jan 2013
Nama Industri : PT. ERRITA Farma, Tbk Jakarta-indonesia
3.2 Alat dan Bahan yang digunakan 3.2.1 Alat-alat
Alat-alat yang digunakan yaitu alat disolusi (alat disolusi) tipe dayung, beaker glass, labu ukur, gelas ukur 1000 ml, pipet volum 5 ml, bola karet, erlenmeyer 50 ml, spatula.
3.2.2 Bahan-bahan
Bahan-bahan yang digunakan yaitu aquadest, etanol, tablet prednison 3.2.3 Prosedur
3.2.3.1 Larutan Uji
Masukkan 500 ml air kedalam 6 vessel, Hidupkan alat, air dipanaskan
dissolusi selama 30 menit, kemudian filtrat larutan uji diambil dan di ukur serapannya pada panjang gelombang 242 nm.
3.2.3.2 Larutan Baku
Ditimbang saksama Prednison BPFI sebanyak 2,924 mg, dimasukkan kedalam labu tentukur 25 ml, dilarutkan dengan etanol sebanyak 1,25 ml (tidak lebih
dari 5% volume total baku), disonikasi selama 15 menit, addkan dengan aquabidest hingga garis tanda.
3.2.3.3 Cara Penetapan
Larutan uji diukur pada panjang gelombang 242 nm menggunakan alat
BAB I
HASIL DAN PEMBAHASAN
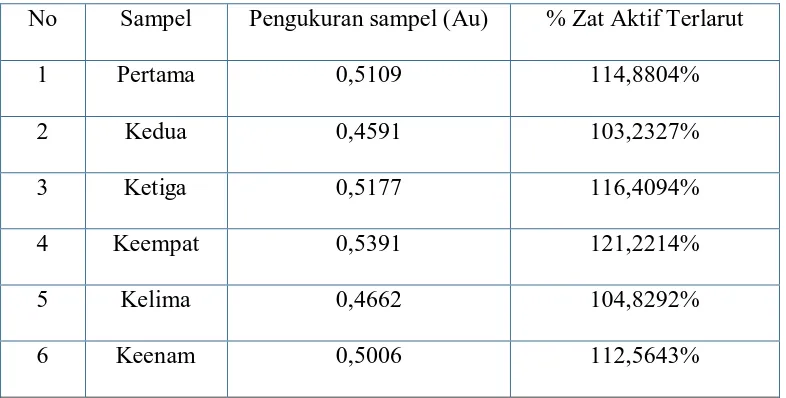
[image:24.595.99.492.277.476.2]4.1 Hasil
Tabel hasil uji dissolusi tablet prednison selam 30 menit yang sudah larut tidak kurang dari 80% dan dilakukan secara spektrofotometri.
No Sampel Pengukuran sampel (Au) % Zat Aktif Terlarut
1 Pertama 0,5109 114,8804%
2 Kedua 0,4591 103,2327%
3 Ketiga 0,5177 116,4094%
4 Keempat 0,5391 121,2214%
5 Kelima 0,4662 104,8292%
6 Keenam 0,5006 112,5643%
% zat aktif terlarut prednison dalam 30 menit diperoleh dari:
% Zat aktif terlarut (Dx) : Fk x Au Dx = % zat aktif terlarut
Fk = Faktor perkalian
Au = Hasil pengukuran sampel Faktor perkalian terdiri dari:
1. Dengan pengenceran (Fu)
2. Tanpa pengenceran (Fu) dengan rumus
Dimana: V : Volume media disolusi = 500 ml
Bb : Bobot baku yang ditimbang = 2,924 mg
Kb : Kemurnian baku = 99,76%
Fb : Faktor pengenceran larutan baku = 250 ml
Ab : Hasil pengukuran baku pembanding = 0,5189 mcg/ml Kc : Kandungan Prednison yang tertera pada etiket = 5 mg
Pengujian yang dilakukan adalah tanpa pengenceran dan memiliki hasil sebagai
berikut:
Fk = 224,8589%
Hasil % zat aktif terlarut (Dx) pada:
1. Tablet pertama
Dx = 224,8589 x 0,5109 = 114,8804%
2. Tablet kedua
3. Tablet ketiga
Dx = 224,8589 x 0,5177
= 116,4094%
4. Tablet keempat
Dx = 224,8589 x 0,5391
= 121,2214%
5. Tablet kelima
Dx = 224,8589 x 0,4662 = 104,8292%
6. Tablet keenam
Dx = 224,8589 x 0,5006 = 112,5643%
4.2 Pembahasan
Dari hasil uji disolusi Tablet Prednison 5 mg yang dilakukan pada uji disolusi
secara spektrofotometri yang dilakukan terhadap 6 (enam) tablet diperoleh kadar
yaitu 114,8804%, 103,2327%, 116,4094%, 121,221%, 104,8292%, dan 112,5643%. Kadar zat aktif yang terlarut tersebut sesuai dengan persyaratan yang ditetapkan
dalam Farmakakope Indonesia edisi IV, dimana jumlah keenam sampel yang diuji memenuhi persyaratan yaitu Toleransi dalam 30 menit harus larut tidak kurang dari
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil yang diperoleh pada uji disolusi menggunakan alat disolusion tester
dengan tipe dayung, menggunakan media air selama 30 menit sudah larut tidak kurang dari jumlah yang tertera dalam etiket, sehingga dapat digunakan dengan
penentuan panjang gelombang yang dapat digunakan secara spektrofotometri. 5.2 Saran
Diharapkan peralatan laboratorium pada BPOM Medan diperbaiki agar hasil
DAFTAR PUSTAKA
Ansel, H. C. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi IV. Jakarta: Universitas Indonesia Press. Hal. 154, 399-405.
Darmansjah, I. (1995). Farmakologi dan Terapi. Edisi IV. Jakarta: Departemen Farmakologi dan terepeutik FK UI. Hal. 501-502.
Dirjen POM Departemen Kesehatan Republik Indonesia. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Hal. 697-698, 1083-1085.
Ikawati, S. (2006). Pengantar Farmakologi Molekuler. Jakarta: Universitas Gajah Mada Press. Hal. 156.
Nanizar, Z dan Joenoes. (1990). Resep yang Rasional. Surabaya: Universitas Airlangga Press. Hal. 142.
Lachman, L dan Lieberman, A. H. (1994). Teori dan Praktek Farmasi Industri II. Edisi II. Jakarta: Universitas Indonesia Press. Hal. 1091-1092.
Munson, J. W. (1991). Analisis Farmasi Metode Modern Parwa B. Surabaya: Airlangga University Press. Hal. 369-378.
Syukri, Y. ( 2002). Biofarmasetika. Edisi I. Yogyakarta: Universitas Indonesia Press. Hal. 379-381.
Theodorus. (1994). Penuntun praktis peresapan obat. Palembang: Kedokteran EGC. Hal. 38.