UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN UJI AKTIVITAS ANTIBAKTERI DARI
KAPANG ENDOFIT DAUN TANAMAN LEUNCA
(
Solanum nigrum
)
SKRIPSI
AMBAR KHAERINNISA
NIM : 1111102000090
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN UJI AKTIVITAS ANTIBAKTERI DARI
KAPANG ENDOFIT DAUN TANAMAN LEUNCA
(
Solanum nigrum
)
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar
Sarjana Farmasi
AMBAR KHAERINNISA
NIM : 1111102000090
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
iii
Skripsi ini adalah hasil karya sendiri, dan semua sumber yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Ambar Khaerinnisa
NIM : 1111102000090
Tanda tangan :
vi
Nama : Ambar Khaerinnisa
Jurusan : Farmasi
Judul : Isolasi dan Uji Aktivitas Antibakteri dari Isolat Kapang
Endofit Daun Tanaman Leunca (Solanum nigrum)
Kapang endofit merupakan mikroorganisme menguntungkan yang berinteraksi dengan tanaman inang tanpa menyebabkan gangguan atau kerusakan pada
tanaman inang. Leunca (Solanum nigrum) merupakan salah satu tanaman lokal
yang biasa digunakan untuk tanaman herbal. Tujuan dari penelitian ini adalah
untuk mengisolasi dan menyeleksi kapang endofit dari daun leunca (Solanum
nigrum) yang memiliki kemampuan memproduksi senyawa antibakteri terhadap
bakteri Shigella dysenteriae ATCC 13313, Salmonella typhimurium ATCC
14028, Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538 dan
Helicobacter pylori ATCC 43504 dengan menggunakan metode difusi cakram.
Isolat kapang endofit terlebih dahulu difermentasi shaker selama 14 hari dengan
medium PDY (Potato Dextrose Yeast) dan supernatannya digunakan sebagai
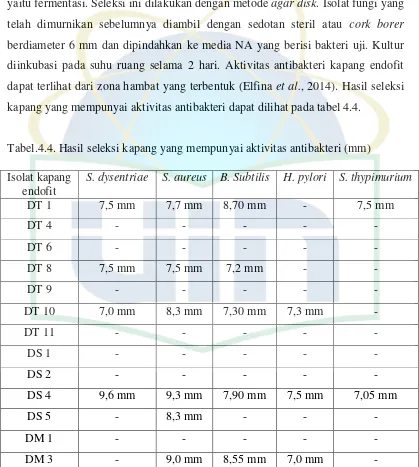
larutan uji. Lima dari empat belas isolat kapang endofit yang berhasil diisolasi
dari daun tanaman leunca (Solanum nigrum) memiliki aktivitas antibakteri
terhadap Shigella dysenteriae, Bacillus subtilis, Staphylococcus aureus dan
Helicobacter pylori, namun tidak menunjukkan aktivitas antibakteri terhadap
Salmonella enterica sv thypimurium. Aktivitas antibakteri paling tinggi ditunjukkan oleh supernatan kapang DT 10 dengan diameter zona hambat 8,85
mm terhadap bakteri S. dysentriae , 7,76 mm terhadap bakteri S.aureus, 8,8 mm
terhadap B.subtilis, dan 8,8 mm terhadap bakteri H.pylori.
vii
Name : Ambar Khaerinnisa
Department : Pharmacy
Title : Isolation and Evaluation on Antibacterial Activities of Endophytic
Fungi from Black Nightshade Leaves (Solanum ningrum)
Endophytic fungi is beneficial microorganism that interacts with plant without
causing any harm to the host. Black Nightshade (Solanum ningrum) is one of the
local plants commonly used as a medicinal herb. The research purpose was to
isolate and selected endophytic fungi from black nightshade (Solanum nigrum)
leaves that has ability to producing antibacterial compound against Shigella
dysenteriae ATCC 13313, Salmonella enterica sv thypimurium ATCC 14028,
Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538, and
Helicobacter pylori ATCC 43504 through disc diffusion method. The isolated endophytic fungi were firstly fermented in a shaker for 14 days using potato dextrose-yeast (PDY) media, while the supernatant liquid test was carried out. Five out of fourteen endophytic fungi that were successfully isolated from black
nightshade leaves (Solanum nigrum) possess anti-bacterial activity against
Shigella dysenteriae, Bacillus subtilis, Staphylococcus aureus, and Helicobacter pylori; however, they did not show the anti-bacterial activity against Salmonella enterica sv thypimurium. The highest anti-bacterial activities were showed by
supernatant DT 10 with the inhibition zone of 8.85 mm againstS. dysentriae; 7.76
mm against S.aureus; 8.8 mm against B.subtilis; and 8.8 mm against H.pylori.
Key words: Black nightshade (Solanum nigrum), endophytic fungi, anti-bacteria
viii
Bismillahirrahmanirrahim.
Alhamdulillah, puji syukur kehadirat Allah SWT atas segala rahmat dan anugerah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Shalawat serta salam ditunjukkan kepada junjungan besar Nabi Muhamad SAW yang telah memberikan petunjuk kebenaran sebagai rahmat sekalian alam.
Skripsi dengan judul “Isolasi dan Uji Aktivitas Antibakteri dari Kapang
Endofit Daun Tanaman Leunca (Solanum nigrum)” ini disusun untuk
memenuhi salah satu syarat memperoleh gelar sarjana farmasi di Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa tanpa adanya bantuan dan bimbingan dari banyak pihak, penelitian dan penyelesaian penulisan skripsi ini akan mengalami banyak hambatan. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Prof Dr. Atiek Soemiati,M.Sc,Apt dan Ibu Puteri Amelia., M.Farm., Apt
selaku pembimbing yang telah meluangkan banyak waktu untuk memberikan bimbingan, motivasi, petunjuk, serta dorongan bagi penulis dari awal hingga skripsi ini dapat terselesaikan.
2. Bapak Saiful Bahri., M.Si selaku dosen mikrobiologi yang telah
memberikan saran serta masukan kepada penulis.
3. Untuk ayahanda Doddy Nurhasan dan ibunda Ria Diana yang tiada
hentinya memberikan bantuan materil, non materil, motivasi dan juga doa kepada penulis untuk menyelesaikan skripsi ini.
4. Kakak dan Adikku tercinta Amalia Putri dan Aini Tiara yang selalu
memberikan semangat dan dukungan kepada penulis.
5. Bapak Dr. H. Arif Soemantri., S.KM., M.Kes Selaku Dekan Fakultas
ix
7. Bapak dan Ibu staf pengajar Prodi Farmasi dan tata usaha di lingkungan
Fakultas Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah Jakarta yang telah memberikan berbagai ilmu pengetahuan dan informasi kepada penulis.
8. Sahabat Ati Maryanti, Rian Destiyani Putri, Faradhila Nur Saraswati,
Khairunisa, Niekha Zoelienna, Ana Yuliana, dan Miyadah Samiyah yang tidak pernah berhenti memberikan semangat, bantuan dan motivasi kepada penulis dalam menyelesaikan skripsi ini.
9. Teman-teman di Laboratorium Mikrobiologi Meri, Puput, Rachma, Arini,
Brasti, Karimah, Sumiati, Bahtiar, Adit, Fitri, Mozer, dan Syaima yang menemani dan mengisi waktu penelitian menjadi menyenangkan.
10. Seluruh sahabat dan teman Program Studi Farmasi angkatan 2011 sebagai teman seperjuangan yang telah memberikan dukungan dan semangat. 11. Semua laboran Mba Rani, Kak Eris, Ka Tiwi, Ka Lisna, Ka Rahmadi yang
telah memberikan pengetahuan dan informasi tentang teknis pengerjaan di laboratorium kepada penulis.
Semoga amal baik dan bantuannya mendapat ganjaran dari Allah SWT dan laporan ini bermanfaat bagi penulis dan pembaca umumnya.
Tidak ada manusia yang luput dari sesalahan dan kekhilafan, demikian pula dengan penulisan skripsi ini. Oleh karena itu, penulis mengharapkan saran dan kritik yang dapat membangun dari semua pihak pembaca. Semoga dalam penulisan skripsi ini, bermanfaat bagi semua pihak khususnya dalam dunia kefarmasian.
Jakarta, Juni 2015
x
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Ambar Khaerinnisa
NIM : 1111102000090
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis Karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul :
ISOLASI DAN UJI AKTIVITAS ANTIBAKTERI DARI KAPANG
ENDOFIT DAUN TANAMAN LEUNCA (Solanum nigrum)
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta. Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : ...
Pada Tanggal : ...
Yang menyatakan,
xi
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACK ... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... x
xii
3.3.5 Bahan Untuk Identifikasi Kapang ... 24
3.4 Cara Kerja ... 24
3.4.1 Persiapan Alat ... 24
3.4.2 Pembuatan Medium Isolasi, Peremajaan, dan Pemeliharaan ... 25
3.4.3 Pembuatan Mediuim Perbanyakan ... 25
3.4.4 Pembuatan Medium Fermentasi ... 26
3.4.5 Pembuatan Medium Pengujian ... 26
3.4.6 Isolasi Kapang Endofit ... 26
3.4.7 Seleksi Kapang yang Berpotensi sebagai Antibakteri dengan Metode Agar Disk ... 27
3.4.8 Fermentasi ... 28
3.4.9 Uji Aktivitas Antibakteri ... 28
3.4.10 Karakteristik Kapang Endofit yang Mempunyai Aktivitas Antibakteri ... 30
BAB IV HASIL DAN PEMBAHASAN ... 31
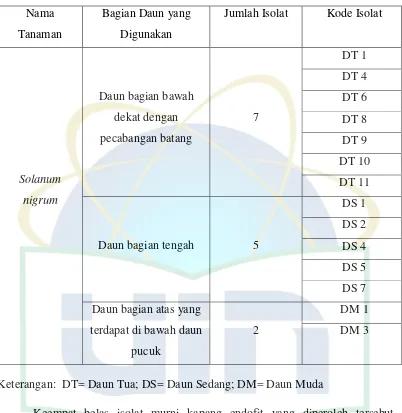
4.1 Isolat Kapang Endofit ... 33
4.2 Identifikasi Bakteri Patogen ... 34
4.3 Pembuatan Kurva Tumbuh ... 36
4.4 Seleksi Kapang yang Berpotensi sebagai Antibakteri dengan Metode Agar disk... 38
4.5 Uji Aktivitas Antibakteri ... 40
xiii
xiv
Gambar 2.1 Tanaman Leunca (Solanum nigrum) ... 11
Gambar 4.1 Kurva Pertumbuhan Bakteri Uji ... 37
Gambar 1. Tanaman Solanum nigrum ... 54
Gambar 2. Contoh Kultur Kapang Endofit Majemuk daun DS ... 54
Gambar 3. Contoh Kultur Kapang Endofit Majemuk daun DM ... 54
Gambar 4. Contoh Kultur Kapang Endofit Majemuk daun DT ... 55
Gambar 5. Hasil Isolat Kapang Endofit Daun Tanaman Leunca (Solanum nigrum) ... 55
Gambar 6. Hasil Isolat Kapang Endofit Daun Tanaman Leunca (Solanum nigrum) ... 56
Gambar 7. Pengamatan Mikroskopik Bakteri Uji ... 57
Gambar 8. Hasil Seleksi Isolat Kapang Endofit terhadap S.dysentriae ... 58
Gambar 9. Hasil Seleksi Isolat Kapang Endofit terhadap S.aureus ... 58
Gambar 10. Hasil Seleksi Isolat Kapang Endofit terhadap B.subtilis ... 59
Gambar 11. Hasil Seleksi Isolat Kapang Endofit terhadap H.pylori ... 60
Gambar 12. Hasil Seleksi Isolat Kapang Endofit terhadap S.enterica sv thypimurium ... 60
Gambar 13. Hasil Uji Aktivitas Antibakteri Supernatan Isolat Kapang Endofit DT 1, DT 10 dan DM 3 Terhadap S.dysentriae ... 61
Gambar 14. Hasil Uji Aktivitas Antibakteri Supernatan Isolat Kapang Endofit DT 8, DS 4, dan DS 5 Terhadap S.dysentriae ... 61
Gambar 15. Hasil Uji Aktivitas Antibakteri Supernatan Isolat Kapang Endofit DT1, DT 10 dan DM 3 Terhadap S.aureus ... 62
Gambar 16. Hasil Uji Aktivitas Antibakteri Supernatan Isolat Kapang Endofit DT 8, DS 4, dan DS 5 Terhadap S.aureus ... 62
Gambar 17. Hasil Uji Aktivitas Antibakteri Supernatan Isolat Kapang Endofit DT1, DT 10 dan DM 3 Terhadap B.subtilis ... 63
Gambar 18. Hasil Uji Aktivitas Antibakteri Supernatan Isolat Kapang Endofit DT 8, DS 4, dan DS 5 Terhadap B.subtilis ... 63
Gambar 19. Hasil Uji Aktivitas Antibakteri Supernatan Isolat Kapang Endofit DT 1, DT 10 dan DM 3 Terhadap H.pylori ... 64
xv
DT 8, DS 4, dan DS 5 Terhadap S.enterica sv thypimurium. ... 65
Gambar 23. Pengamatan Makroskopik Isolat DT 1 yang diisolasi dari Daun Tanaman Solanum nigrum ... 66
Gambar 24. Pengamatan Mikroskopik Isolat DT 1 yang diisolasi dari Daun
Tanaman Solanum nigrum ... 66 Gambar 25. Pengamatan Makroskopik Isolat DT 10 yang diisolasi dari Daun Tanaman Solanum nigrum ... 67
Gambar 26. Pengamatan Mikroskopik Isolat DT 10 yang diisolasi dari Daun
Tanaman Solanum nigrum ... 67
Gambar 27. Pengamatan Makroskopik Isolat DS 4 yang diisolasi dari Daun
Tanaman Solanum nigrum ... 68
Gambar 28. Pengamatan Mikroskopik Isolat DS 4 yang diisolasi dari Daun
Tanaman Solanum nigrum ... 68
Gambar 29. Pengamatan Makroskopik Isolat DS 5 yang diisolasi dari Daun
Tanaman Solanum nigrum ... 69
Gambar 30. Pengamatan Mikroskopik Isolat DS 5 yang diisolasi dari Daun
Tanaman Solanum nigrum ... 69
Gambar 31. Pengamatan Makroskopik Isolat DM 3 yang diisolasi dari Daun
Tanaman Solanum nigrum ... 70
Gambar 32. Pengamatan Mikroskopik Isolat DM 3 yang diisolasi dari Daun
xvi
Tabel 4.1 Daftar Isolat Kapang Endofit Daun Tanaman Solanum nigrum 34
Tabel 4.2 Hasil Identifikasi Bakteri Uji ... 35
Tabel 4.3 Hasil Kurva Pertumbuhan Bakteri Uji ... 37
Tabel 4.4 Hasil Seleksi Kapang yang Mempunyai Aktivitas Antibakteri . 38
Tabel 4.5 Diameter Zona Hambat yang Terbentuk pada Uji Aktivitas
Antibakteri ... 41
Tabel 4.6 Karakteristik Kapang Endofit yang Memiliki Aktivitas Antibakteri
xvii
Lampiran 1. Bagan Tahapan Penelitian. ... 71
Lampiran 2. Surat Hasil Determinasi Tanaman Leunca (Solanum nigrum) .. 72
Lampiran 3. Bagan Tahapan Isolasi Kapang Endofit. ... 73
Lampiran 4. Tahapan Pemurnian. ... 74
Lampiran 5. Tahapan Identifikasi Bakteri Uji ... 75
Lampiran 6. Tahapan Pembuatan Kurva Pertumbuhan Bakteri. ... 76
Lampiran 7. Tahapan Seleksi Kapang yang Berpotensi sebagai Antibakteri dengan Metode Agar Disk ... 77
Lampiran 8. Bagan Cara Kerja Fermentasi ... 78
Lampiran 9. Tahapan Uji Aktivitas Antibakteri ... 79
1 1.1Latar Belakang
Penggunaan antibiotik di dunia menunjukkan kecenderungan meningkat dari tahun ke tahun. Tidak kurang dari 3000 ton antibiotik digunakan dalam bidang kesehatan pertahunnya ( Izza, 2011). Pada bidang industri pangan, pakan, pertanian, kesehatan, biokimia, genetika, dan biologi molekuler penggunaan antibiotik lebih dari 40.000 ton per tahunnya. Penggunaan antibiotik yang besar di masyarakat dan rumah sakit telah memicu resisten antibakteri (Neu, 1992). Oleh karena itu, langkah-langkah mendapatkan jenis antibiotik baru masih sangat diperlukan baik lewat sintesis kimia, biokimia baru atau penemuan isolat mikroba baru (Kaitu, 2013).
Tanaman merupakan salah satu sumber daya yang sangat penting dalam upaya pengobatan dan upaya mempertahankan kesehatan masyarakat. Bahkan sampai saat inipun menurut perkiraan badan kesehatan dunia (WHO), 80% penduduk dunia masih bergantung pada pengobatan tradisional termasuk penggunaan obat yang berasal dari tanaman (Izza, 2011). Sampai saat ini seperempat dari obat-obat modern yang beredar di dunia berasal dari bahan aktif yang diisolasi dan dikembangkan dari tanaman. Salah satu contohnya yaitu aspirin
yang merupakan analgesik paling populer yang diisolasi dari tanaman Salix dan
Spiraea, demikian pula paclitaxel dan vinblastin merupakan obat antikanker yang sangat potensial yang berasal dari tanaman (Radji, 2005).
Indonesia mempunyai keanekaragaman hayati terbesar kedua setelah Brazil, sehingga menjadikan Indonesia sebagai negara yang potensial dalam mengembangkan obat herbal yang berbasis pada tanaman obat yang terdapat di Indonesia. Lebih dari 1000 spesies tumbuhan dapat dimanfaatkan sebagai bahan baku obat. Tumbuhan tersebut menghasilkan metabolit sekunder dengan struktur molekul dan aktivitas yang beraneka ragam, memiliki potensi yang sangat baik untuk dikembangkan menjadi obat berbagai penyakit (Radji, 2005).
UIN Syarif Hidayatullah Jakarta tumbuhan pada periode tertentu dan mampu membentuk koloni dalam jaringan tumbuhan tanpa membahayakan inangnya, bahkan seringkali bersimbiosis secara mutualistis (Tan RX, Zou WX, 2001 dalam Sinaga, 2013).
Mikroba endofit dapat berupa bakteri atau jamur, tetapi saat ini yang lebih banyak dieksplorasi adalah jamur-jamur endofit. Mikroba endofit mempunyai kemampuan untuk memproduksi senyawa-senyawa bioaktif, baik yang sama dengan inangnya ataupun tidak sama, tetapi seringkali memiliki aktivitas biologis yang serupa dengan senyawa bioaktif yang diproduksi inangnya (Sinaga, 2013). Menurut literatur, senyawa yang dihasilkan oleh mikroba endofit seringkali memiliki aktivitas yang lebih besar dibandingkan aktivitas senyawa tumbuhan inangnya (Strobel, 2003). Beberapa endofit mampu memberikan proteksi kepada tanaman inangnya untuk melawan beberapa nematoda, mamalia, herbivora insekta maupun bakteri dan fungi patogen. Endofit lainnya, mampu meningkatkan efek alelopati pada tanaman inangnya terhadap spesies lain yang tumbuh di dekatnya, biasanya menjadi kompetitor untuk nutrisi dan tempat untuk hidup. Hal ini dapat menjadi alasan kenapa beberapa tanaman dengan endofit tertentu biasanya cukup kompetitif untuk menjadi spesies yang dominan di dalam lingkungannya (Tan RX dan Zou WX, 2001).
Senyawa bioaktif yang dihasilkan dari biomassa membutuhkan sumber tanaman yang sangat banyak. Untuk mengefisiensikan cara memperoleh senyawa bioaktif tersebut, maka digunakan mikroba endofit spesifik yang diperoleh dari bagian dalam tanaman yang diharapkan mampu menghasilkan sejumlah senyawa bioaktif yang dibutuhkan tanpa harus mengekstrak dari tanamannya (Sinamarta, 2003).
Menurut Stierle et al., (1995) dalam Fatiqin (2009), bahwa pemanfaatan
mikroba endofit dalam memproduksi senyawa aktif memiliki beberapa kelebihan, antara lain senyawa yang dihasilkan lebih cepat dengan mutu yang seragam, dapat diproduksi dalam skala besar dan kemungkinan diperoleh komponen bioaktif baru dengan memberikan kondisi yang berbeda.
Leunca (Solanum nigrum) memiliki efek farmakologis yang berkhasiat
sebagai obat. Leunca (Solanum nigrum) digunakan secara tradisional untuk
UIN Syarif Hidayatullah Jakarta enterik, dan diuretik. Leunca memiliki banyak senyawa yang bertanggung jawab untuk aktivitas farmakologi. Komponen aktifnya adalah glikoalkaloid, glikoprotein, polisakarida, senyawa polifenol seperti asam gallat, katekin, asam
protokatekuat, asam kafeat, epikatekin, rutin, dan naringenin (Chauhan et al.,
2012).
Beberapa penelitian sebelumnya tentang Solanum nigrum menunjukkan
bahwa Solanum nigrum memiliki aktivitas antibakteri. Subashini et al. (2013)
meneliti bahwa ekstrak metanol dari biji Solanum nigrum menunjukkan aktivitas
antibakteri terhadap bakteri S.thypi, B.subtilis, S.aureus, dan V.cholera. Sementara
penelitian Matasyoh et al. (2014) menunjukkan bahwa ekstrak etanol dari berbagai
macam jenis Solanum nigrum menunjukkan aktivitas antibakteri terhadap S.aureus,
B.subtilis, P.syringe, B.mirabilis, E.coli, S.thypi, Shigella spp, dan P.acne.
Penelitian Sridhar et al. (2011) menunjukkan bahwa ekstrak daun, biji dan akar dari
Solanum nigrum dengan menggunakan pelarut organik (etanol, metanol, etil asetat, dietil eter, kloroform dan heksan) menunjukkan aktivitas antibakteri pada bakteri
B.subtilis, B.megaterium, S.aureus, K.pneumonia, E.coli, P.vulgaris dan P.putrida.
Sejauh ini, belum ditemukan adanya studi yang terfokus pada aktivitas antibakteri yang terdapat dalam kapang endofit dari tanaman leunca. Oleh karena itu, penelitian ini bertujuan untuk melakukan uji aktivitas antibakteri dari isolat
kapang endofit daun tanaman leunca (Solanum nigrum).
1.2Rumusan Masalah
Dari uraian di atas, tanaman leunca banyak ditemui di Indonesia. Leunca (Solanum nigrum) digunakan secara tradisional untuk mengobati berbagai penyakit seperti rasa sakit, peradangan, penyakit demam enterik, dan diuretik. Tanaman leunca banyak mengandung glikoalkaloid, glikoprotein, polisakarida, senyawa polifenol seperti asam gallat, katekin, asam protokatekuat, asam kafeat, epikatekin, rutin, dan naringenin.
UIN Syarif Hidayatullah Jakarta 1.3Tujuan Penelitian
1.3.1 Tujuan Umum
Untuk mengetahui aktivitas antibakteri kapang endofit yang diperoleh dari
isolat daun tanaman leunca (Solanum nigrum).
1.3.2 Tujuan Khusus
1. Untuk memperoleh isolat kapang endofit dari daun tanaman leunca
(Solanum nigrum).
2. Untuk memperoleh isolat kapang endofit daun tanaman leunca (Solanum
nigrum) yang mempunyai aktivitas antibakteri terhadap Staphylococcus aureus, Shigella dysentriae, Salmonella enterica sv thypimurium, Helicobacter pylori, dan Bacillus subtilis.
1.4Manfaat Penelitian 1.4.1 Secara teoritis
Secara teoritis penelitian ini akan menambah khasanah ilmu pengetahun tentang aktivitas antibakteri dari kapang endofit yang diisolasi dari daun tanaman
leunca (Solanum nigrum) yang nantinya akan memberikan manfaat terhadap
pembuatan obat baru.
1.4.2 Secara metodologi
Secara metodologi penelitian ini mengangkat kapang sebagai agen antibakteri dan dapat digunakan pada penelitian selanjutnya untuk uji aktivitas
lainnya dari kapang endofit yang diisolasi dari daun tanaman leunca (Solanum
nigrum).
1.4.3 Secara aplikatif
5 2.1 Mikroba Endofit
2.1.1 Definisi
Mikroba endofit adalah mikroba yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai akibat koevolusi atau transfer
genetik (genetic recombination) dari tanaman inangnya ke dalam mikroba endofit
(Tan RX dan Zou WX, 2001).
Mikroba endofit yang terdapat dalam jaringan tumbuhan ada beberapa bentuk yaitu: fungi (kapang dan khamir), bakteria, mycoplasma, archaebakteria. Diantara keempat bentuk organisme tersebut, fungi adalah bentuk mikroorganisme yang paling banyak ditemukan sebagai endofit (Strobel, 2003).
Fungi endofit dapat membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya Hubungan yang terjadi antara inang dan fungi endofit bukan merupakan hubungan patogenitas. Fungi endofit yang terdapat dalam tanaman memacu perkecambahan, untuk bertahan dalam kondisi yang kurang menguntungkan, mempercepat pertumbuhan, ketahanan terhadap patogen lemah, dan beberapa kasus yang dapat meningkatkan ketahanan tanaman
terhadap tekanan lingkungan (Rante et al., 2013).
Kemampuan mikroba endofit memproduksi senyawa metabolit sekunder sesuai dengan tanaman inangnya merupakan peluang yang sangat besar dan dapat diandalkan untuk memproduksi metabolit sekunder dari mikroba endofit yang diisolasi dari tanaman inangnya tersebut. Sekitar 300.000 jenis tanaman yang tersebar di muka bumi ini, masing-masing tanaman mengandung satu atau lebih
mikroba endofit yang terdiri dari bakteri dan kapang (Strobel, 2003). Sehingga
UIN Syarif Hidayatullah Jakarta yang lebih tinggi, sehingga tidak perlu menebang tanaman aslinya untuk diambil sebagai simplisia (Radji, 2005).
Berbagai jenis endofit telah berhasil diisolasi dari tanaman inangnya, dan telah berhasil dibiakkan dalam media perbenihan yang sesuai. Metabolit sekunder yang diproduksi oleh mikroba endofit tersebut telah berhasil diisolasi dan dimurnikan serta telah dielusidasi struktur molekulnya. Beberapa mikroba endofit yang menghasilkan antibiotika diantaranya adalah:
1. Cryptocandin
Merupakan antifungi yang dihasilkan oleh mikroba endofit
Cryptosporiopsis quercina yang berhasil diisolasi dari tanaman obat Tripterigeum wilfordii, dan berhasiat sebagai antijamur yang patogen terhadap manusia yaitu
Candida albicans dan Trichopyton spp. (Strobel et al., 1999 dalam Radji, 2005).
2. Ecomycyn
Ecomycin diproduksi oleh Pseudomonas viridiflava juga aktif terhadap
Cryptococcus neoformans dan Candida albicans. Ecomycin merupakan lipopeptida yang disamping terdiri dari molekul asam amino yang umum juga mengandung
homoserin dan beta hidroksi asam aspartat (Miller et al., 1998 dalam Radji, 2005).
3. Pseudomycin
Senyawa kimia yang diproduksi oleh mikroba endofit Pseudomonas
Syringae berhasiat sebagai anti jamur adalah pseudomycin, yang dapat menghambat
pertumbuhan Candida albicans dan Cryptococcus neoformans (Harrison et al.,
1991 dalam Radji, 2005).
4. Munumbicin
Antibiotika berspektrum luas yang disebut munumbicin, dihasilkan oleh
endofit Streptomyces spp. strain NRRL 30562 yang merupakan endofit yang
diisolasi dari tanaman Kennedia nigriscans, dapat menghambat pertumbuhan
Bacillus anthracis, dan Mycobacterium tuberculosis yang multiresisten terhadap
berbagai obat anti TBC (Castillo et al., 2002).
5. Kakadumycin
Jenis endofit lainnya yang juga menghasilkan antibiotika berspektrum luas
adalah mikroba endofit yang diisolasi dari tanaman Grevillea pteridifolia. Endofit
UIN Syarif Hidayatullah Jakarta
munumbicin D, dan kakadumycin ini juga berkhasiat sebagai anti malaria (Castillo
et al., 2003 dalam Radji, 2005).
2.1.2 Metode Isolasi Kapang Endofit
Isolasi kapang endofit dilakukan dengan metode direct seed planting.
Tanaman sampel bisa diisolasi langsung dari tanaman hidup atau tanaman yang diawetkan. Apabila tanaman diawetkan, sedikit dari jaringan tanaman dipotong dari tanaman dan ditaruh dalam plastik bersegel. Plastik tempat menyimpan tanaman harus bebas dari udara lembab (Strobel, 2003). Sebelum dilakukan sterilisasi permukaan, tanaman sampel yang langsung diperoleh dari alam (tidak diawetkan) dialiri dengan air mengalir selama 10 menit hingga bersih dari pengotor seperti debu dan tanah (Wahyudi P, 1998).
Sterilisasi permukaan bertujuan untuk mengeliminasi mikroba yang terkandung pada permukaan tanaman. Sterilisasi permukaan dapat dilakukan dengan beberapa cara antara lain dibakar, dicelupkan dalam alkohol 70-75%, dan dicelupkan di larutan NaOCl (Strobel, 2003). Langkah selanjutnya setelah dilakukan sterilisasi permukaan, jaringan bagian luar dihilangkan dengan pisau steril. Jaringan bagian dalam lalu diiris membujur dan diletakkan dengan hati-hati pada permukaan media agar. Potongan tanaman pada media isolasi diinkubasi selama 5-21 hari (Strobel, 2003 ; Wahyudi P, 1988 dalam Atika, 2007).
Pada umumnya kapang yang telah diperoleh sebagai kultur murni dapat langsung dimanfaatkan dengan fermentasi atau dilakukan uji ketahanan dulu. Uji ketahanan dapat dilakukan dengan menumbuhkan kapang pada berbagai media dan kondisi. Untuk memperoleh metabolit dari kapang endofit dapat dilakukan dengan fermentasi lalu senyawa bioaktif diekstraksi (Strobel, 2003 dalam Atika, 2007).
Beberapa media yang biasa digunakan sebagai media isolasi yaitu:
Granulated Agar, Corn Meal Malt (CMM) Agar, Potato Dextrose Agar (PDA). Dapat dilakukan modifikasi media dengan melakukan pengurangan nutrisi media sehingga nutrisi yang terdapat dalam media hanya 10% dari konsentrasi nutrisi penuh. Media tersebut kerap disebut media miskin. Media sederhana yang biasa
UIN Syarif Hidayatullah Jakarta
sederhana ini untuk menghambat kapang non-endofit yang bersifat fast grower
sehingga pertumbuhan kapang endofit yang bersifat slow grower tidak terganggu.
Untuk menghindari kontaminasi bakteri dapat ditambahkan antibiotik seperti: kloramfenikol, tetrasiklin, dan ampisilin (Atika, 2007). Media yang digunakan sebagai media permurnian biasanya merupakan media yang lebih kaya dan lebih mudah dicerna dari media isolasi. Media yang sering digunakan sebagai media pemurnian adalah PDA sedangkan, media yang digunakan untuk fermentasi
yaitu: Potato Dextrose Broth (PDB). PDB seringkali dikombinasi dengan Yeast
Extract, kombinasi ini dikenal sebagai media PDY (Potato Dextrose Yeast) (Strobel, 2003 dalam Atika, 2007).
2.2 Fermentasi
Fermentasi berasal dari kata fervere (Latin), yang berarti mendidih,
menggambarkan aksi ragi pada ekstrak buah selama pembuatan minuman beralkohol. Pengertian fermentasi agak berbeda antara ahli mikrobiologi dan ahli biokimia. Pengertian fermentasi dikembangkan oleh ahli biokimia yaitu proses yang menghasilkan energi dengan perombakan senyawa organik. Ahli mikrobiologi industri memperluas pengertian fermentasi menjadi segala proses untuk menghasilkan suatu produk dari kultur mikroorganisme (Walker & Gingold, 1993 dalam Sulistyaningrum, 2008).
Fermentasi juga dapat diartikan sebagai suatu disimilasi senyawa-senyawa organik yang disebabkan oleh aktivitas mikroorganisme. Disimilasi merupakan reaksi kimia yang membebaskan energi melalui perombakan nutrien. Pada proses disimilasi, senyawa substrat yang merupakan sumber energi diubah menjadi senyawa yang lebih sederhana atau tingkat energinya lebih rendah. Reaksi disimilasi merupakan aktivitas katabolik sel (Smith,1990 ; Pelczar 1986 dalam Sulistyaningrum, 2008).
UIN Syarif Hidayatullah Jakarta Secara umum ada empat kelompok fermentasi yang penting secara ekonomi (Stanburry, 1984 dalam Sulistyaningrum 2008) :
1. Fermentasi yang memproduksi sel mikroba (biomass)
Produksi komersial dari biomass dapat dibedakan menjadi produksi yeast
untuk industri roti, dan produksi sel mikroba untuk digunakan sebagai makanan manusia dan hewan.
2. Fermentasi yang menghasilkan enzim dari mikroba
Secara komersial, enzim dapat diproduksi oleh tanaman, hewan, dan mikroba, namun enzim yang diproduksi oleh mikroba memiliki beberapa keunggulan yaitu, mampu dihasilkan dalam jumlah besar dan mudah untuk meningkatkan produktivitas bila dibandingkan dengan tanaman atau hewan.
3. Fermentasi yang menghasilkan metabolit mikroba
Metabolit mikroba dapat dibedakan menjadi metabolit primer dan metabolit sekunder. Produk metabolisme primer yang dianggap penting contohnya etanol, asam sitrat, polisakarida, aseton, butanol, dan vitamin. Sedangkan metabolit sekunder yang dihasilkan mikroba contohnya antibiotik, pemacu pertumbuhan inhibitor enzim, dan lain-lain.
4. Proses transformasi
Sel mikroba dapat digunakan untuk mengubah suatu senyawa menjadi senyawa lain yang masih memiliki kemiripan struktur namun memiliki nilai komersial yang lebih tinggi. Proses transformasi dengan menggunakan mikroba ini lebih baik bila dibandingkan dengan proses kimia, berkaitan dengan penggunaan reagen kimia yang lebih sedikit. Selain itu proses dapat berlangsung pada suhu rendah tanpa membutuhkan katalis logam berat yang berpotensi menimbulkan potensi.
Fermentasi dapat dilakukan dengan metode kultur permukaan dan kultur
terendam (submerged). Medium kultur permukaan dapat berupa medium padat,
semi padat atau cair. Sedangkan kultur terendam dilakukan dalam medium cair menggunakan bioreaktor yang dapat berupa labu yang diberi aerasi, labu yang
digoyang dengan shaker atau fermentor (Ansori, 1992 dalam Sulistyaningrum,
UIN Syarif Hidayatullah Jakarta Dibandingkan dengan medium padat, medium cair mempunyai beberapa kelebihan, yaitu jenis dan konsentrasi komponen-komponen medium dapat diatur sesuai dengan yang diinginkan, dapat memberikan kondisi yang optimum untuk pertumbuhan, dan pemakaian medium lebih efisien (Ansori, 1992 dalam
Sulistyaningrum 2008).
Fermentasi permukaan medium cair merupakan cara fermentasi yang telah sejak lama dipraktekkan untuk memproduksi berbagai produk fermentasi, misalnya produksi asam asetat secara tradisional. Fermentasi permukaan medium cair ini mulai ditinggalkan sejak fermentasi terendam terbukti lebih efisien, khususnya dalam memproduksi produk-produk fermentasi yang bernilai ekonomis tinggi dan menghendaki sterilitas yang tinggi, seperti misalnya produksi antibiotika (Ansori,
1992 dalam Sulistyaningrum, 2008).Beberapa hal yang perlu diperhatikan dalam
proses fermentasi adalah:
a. Kecepatan aerasi sering tidak sesuai dengan jumlah oksigen yang
dibutuhkan dan oksigen yang terlarut dalam media. Hal ini dapat diatasi dengan penggunaan detektor untuk mengontrol oksigen yang terlarut.
b. Jumlah sumber karbon dan nutrisi lain harus sesuai baik dalam jumlah dan
komposisi dengan mikroba dan produk yang diinginkan.
c. Toksin yang terakumulasi dan dapat menghambat pertumbuhan.
d. Perubahan pH selama proses fermentasi. Hal ini dapat diatasi dengan
melakukan titrasi pH selama fermentasi berlangsung.
e. Busa yang mungkin timbul. Busa dapat disebabkan oleh : kandungan garam,
pH, suhu, komposisi media, aliran udara, agitasi, dan penambahan antibusa yang berlebihan. Anti busa yang ditambahkan dalam media fermentasi dapat mengurangi jumlah oksigen yang terlarut media (McNeil and Harvey, 2008 dalam Purwanto, 2011).
2.3 Tanaman Leunca (Solanum nigrum)
Leunca adalah tanaman obat dari keluarga Solanaceae. Nama umumnya
adalah Makoi dan blacknight shade. Dua varietas Solanum nigrum dapat berupa
UIN Syarif Hidayatullah Jakarta buah warna hitam beracun. Seluruh tanaman digunakan untuk bidang kesehatan
(Chauhan et al., 2012).
2.3.1 Taksonomi Tanaman
Berdasarkan taksonominya, tanaman Solanum nigrum diklasifikasikan
sebagai berikut:
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Orde : Solanales
Famili : Solanaceae
Genus : Solanum
Spesies : Solanum nigrum
(Prima, 2012)
Gambar 2.1 Tanaman Leunca (Solanum nigrum)
[koleksi pribadi]
2.3.2 Deskripsi
Tinggi leunca adalah 25-100 cm, merupakan tanaman tahunan. Batangnya tegak, bulat, lunak, hijau. Buah berwarna hitam, bulat, 8- 10 mm. Daun bulat telur,
UIN Syarif Hidayatullah Jakarta berbentuk cangkir, mahkota putih, lobus bulat telur-lonjong, Siliata menyebar. Filamen barukuran 1-1,5 mm; anter berukuran 2.5- 3,5 mm. Biji berbentuk bulat pipih, kecil berwarna putih. Akar tunggang, berwarna putih kecoklatan (Chauchan
et al., 2012; Depkes RI, 1994).
2.3.3 Kandungan Kimia
Solanum nigrum memiliki banyak senyawa yang bertanggung jawab untuk aktivitas farmakologi. Komponen aktifnya adalah glikoalkaloid, glikoprotein, dan polisakarida, senyawa polifenol seperti asam galat, katekin, asam protokatekuat,
asam kafeat, epikatekin, rutin, dan naringenin (Chauhan et al., 2012).
2.3.4 Penggunaan secara Tradisional
Solanum nigrum telah digunakan secara tradisional untuk mengobati berbagai penyakit seperti rasa sakit, peradangan dan penyakit demam enterik.
Solanum nigrum memiliki banyak aktivitas seperti antitumorigenik, antioksidan, anti-inflamasi, hepatoprotektor, diuretik, agen antipiretik, antibakteri, antimikotika,
sitotoksisitas, antikonvulsan, anti ulcerogenik. Solanum nigrum juga digunakan
terhadap penyakit menular seksual (Chauhan et al., 2012).
2.4 Bakteri Patogen
Bakteri uji yang digunakan untuk penelitian ini ada lima jenis, yaitu
Staphylococcus aureus, Shigella dysentriae, Salmonella enterica sv thypimurium,
Helicobacter pylori, dan Bacillus subtilis.
2.4.1 Staphylococcus aureus 2.4.1.1 Morfologi
UIN Syarif Hidayatullah Jakarta
dari 90% isolat klinik menghasilkan Staphylococcus aureus yang mempunyai
kapsul polisakarida atau selaput tipis yang berperan dalam virulensi bakteri (Jawetz
et al., 1995 ; Novick et al., 2000 dalam Kusuma, 2009).
Spesies : Stapylococcus aureus (Rosenbach, 1884)
2.4.1.3 Sifat Kultur
Stapylococcus aureus tumbuh dengan baik pada berbagai media bakteriologik dibawah suasana aerobik atau mikro-aerobik. Tumbuh dengan cepat
pada temperatur 37℃, namun pembentukan pigmen yang terbaik adalah pada
temperatur kamar (20-35℃). Koloni pada media yang padat akan berbentuk bulat,
halus, menonjol, dan berkilau-kilau, membentuk berbagai pigmen berwarna kuning
keemasan (Jawetz et al., 2005 dalam Kusuma, 2009).
2.4.1.4 Patogenesis dan patologi
Sebagian bakteri Stapylococcus merupakan flora normal pada kulit, saluran
pernafasan, dan saluran pencernaan makanan pada manusia. Bakteri ini juga
ditemukan di udara dan lingkungan sekitar. Stapylococcus aureus yang bersifat
invasif, menyebabkan hemolisis, membentuk koagulase, dan mampu meragikan manitol (Warsa, 1994 dalam Kusuma, 2009).
Infeksi oleh Stapylococcus aureus ditandai dengan kerusakan jaringan yang
disertai abses bernanah. Beberapa penyakit infeksi yang disebabkan oleh
UIN Syarif Hidayatullah Jakarta
saluran kemih, osteomielitis, dan endokarditis. Stapylococcus aureus juga
merupakan penyebab utama infeksi nosokomial, keracunan makanan, dan sindroma
syok toksik (Ryan et al., 1994 ; Warsa, 1994 dalam Kusuma, 2009).
2.4.2 Shigella dysenteriae 2.4.2.1 Morfologi
Shigella dysenteriae adalah bakteri Gram negatif yang memiliki morfologi batang ramping, tidak berkapsul, tidak bergerak, tidak membentuk spora, bersifat
fakultatif anaerob tetapi paling baik tumbuh secara aerobik. Bentuk koloni Shigella
dysenteriae konveks, bulat, transparan dengan pinggir-pinggir utuh mencapai diameter kira-kira 2 mm dalam 24 jam. Bakteri ini sering ditemukan pada
perbenihan diferensial karena ketidakmampuannya meragikan laktosa (Jawetz et
al., 2005). Shigella sp mempunyai susunan antigen yang kompleks. Terdapat
banyak tumpang tindih dalam sifat serologik berbagai spesies dan sebagian besar bakteri ini mempunyai antigen O yang juga dimiliki oleh bakteri enterik lainnya.
Antigen somatik O dari Shigella sp adalah lipopolisakarida. Kekhususan
serologiknya tergantung pada polisakarida dan terdapat lebih dari 40 serotipe.
Klasifikasi Shigella sp didasarkan pada sifat-sifat biokimia dan antigeniknya
(Jawetz et al., 2005).
2.4.2.2 Klasifikasi
Kingdom : Bacteria
Filum : Proteobacteria
Kelas : Gamma Proteobacteria
Ordo : Enterobacteriales
Famili : Enterobacteriaceae
Genus : Shigella
Spesies : Shigella dysentriae (Jawetz et al., 2005)
2.4.2.3 Patogenesis dan patologi
UIN Syarif Hidayatullah Jakarta disertai nyeri perut , dan buang air besar yang sering mengandung darah dan mukus. Habitat alamiah bakteri disentri adalah usus besar manusia, tempat bakteri tersebut
dapat menyebabkan disentri basiler. Infeksi Shigella dysenteriae praktis selalu
terbatas pada saluran pencernaan, dan invasi bakteri ke dalam darah sangat jarang.
Shigella dysenteriae menimbulkan penyakit yang sangat menular dengan dosis
infektif dari bakteri Shigella dysenteriae adalah kurang dari 10 organisme dan
merupakan golongan Shigella sp yang cenderung resisten terhadap antibiotik
(Jawetz et al., 2005).
Shigella dysenteriae dapat menyebabkan 3 bentuk diare:
Disentri klasik dengan tinja yang konsisten lembek disertai darah dan mukus
Diare berair (Watery diarrhea)
Kombinasi antara disentri klasik dengan tinja yang konsisten lembek disertai
darah, mukus, ditambah dengan diare berair (Jawetz et al., 2005).
2.4.3 Bacilllus subtilis 2.4.3.1Morfologi
Bacillus subtilis adalah bakteri aerobik gram positif, mempunyai ciri-ciri sel
berbentuk batang pendek (rods), sendiri-sendiri, jarang membentuk rantai, motil
dengan flagella peritrich, permukaan spora terwarnai pucat dan membentuk
endospora berukuran 0,8 x 1,5-1,8 µm. Pada spora yang berkecambah, dinding spora pecah secara melintang (Jauhari, 2010).
Koloni bakteri pada medium agar berbentuk bundar, tepi tidak teratur,
permukaan tidak mengkilap, menjadi tebal dan keruh (opaque), kadang-kadang
mengkerut dan berwarna krem atau kecoklatan. Bentuk koloni agak bervariasi pada media yang berbeda. Koloni meluas pesat pada medium yang berpermukaan lembab (Jauhari, 2010).
2.4.3.2Klasifikasi
Klasifikasi B. subtilis ini adalah sebagai berikut:
Kingdom : Bacteria
Filum : Firmicutes
UIN Syarif Hidayatullah Jakarta
Ordo : Bacillales
Famili : Bacillaceae
Genus : Bacillus
Spesies : Bacillus subtilis (Madigan, 2005)
2.4.4 Salmonella enterica sv thypimurium 2.4.4.1 Morfologi
Salmonella sp. adalah bakteri batang lurus, gram negatif, tidak berspora,
bergerak dengan flagel peritrik, berukuran 2-4 µm x 0.5-0,8 µm. Salmonella sp.
tumbuh cepat dalam media yang sederhana (Jawetz et al., 2005), hampir tidak
pernah memfermentasi laktosa dan sukrosa, membentuk asam dan kadang gas dari glukosa dan manosa, biasanya memporoduksi hidrogen sulfida atau H2S, pada biakan agar koloninya besar bergaris tengah 2-8 mm, bulat agak cembung,
jernih, pada media BAP tidak menyebabkan hemolisis, pada media Mac Concey
koloni Salmonella sp. Tidak memfermentasi laktosa (NLF), konsistensinya smooth
(WHO, 2003).
2.4.4.2 Klasifikasi
Salmonella enterica sv thypimurium adalah bakteri Gram negatif dengan klasifikasi sebagai berikut :
Famili : Enterobacteriaceae
Genus : Salmonella
Spesies : Salmonella enterica sv thypimurium
(Syahruchrahman et al., 1993 ; Bryan et al., 1963)
2.4.4.3 Patogenesis dan Patologi
Bakteri Salmonella enterica sv thypimurium ditularkan melalui makanan
dan minuman yang terkontaminas oleh kotoran atau tinja dari seorang penderita
demam typoid. Bakteri ini akan masuk melalui mulut bersama makanan dan
UIN Syarif Hidayatullah Jakarta berhasil mencapai usus halus. Kemudian bakteri berusaha masuk ke dalam tubuh dan akhirnya merangsang sel darah putih untuk menghasilkan interleukin yang merangsang terjadinya gejala demam, perasaan lemah, sakit kepala, nafsu makan berkurang, sakit perut, gangguan buang air besar serta gejala lainnya (Darmawati dan Sri Sinto, 2008).
2.4.5 Helicobacter pylori 2.4.5.1Morfologi
Helicobacter pylori adalah bakteri gram negatif berbentuk batang atau
kokoid (beberapa kepustakaan menyebutnya spiral atau seperti huruf “S”),
mempunyai flagel yang memungkinkan bakteri ini memiliki daya motilitas tinggi, dan bersifat mikroaerofilik. Tempat yang sesuai didalam tubuh manusia adalah
antrum. H.pylori dapat berkonversi dari bentuk batang ke bentuk kokoid. Bentuk
batang lebih virulen dibanding bentuk kokoid, sedangkan bentuk kokoid sendiri dikatakan berperan terhadap kekambuhan infeksi (Tehuteru, 2004).
2.4.5.2Klasifikasi
Domain : Eubacteria
Kingdom : Bacteria
Filum : Proteobacteria
Kelas : Epsilonproteobacteria
Ordo : Campylobacterales
Famili : Helicobacteraceae
Genus : Helicobacter
Spesies : Helicobacter pylori (bioweb.uwlax.edu)
2.4.5.3Patogenesis dan Patologi
Infeksi H.pylori seringkali ditemui pada anak-anak. Terdapat tiga kelainan
yang dapat ditemukan sebagai akibat infeksi H.pylori pada anak. Pertama, infeksi
UIN Syarif Hidayatullah Jakarta
sedangkan pada infeksi kronis, H.pylori akan terus merangsang produksi asam
lambung. Mekanisme terjadinya keadaan tersebut belum diketahui secara pasti.
Kelainan kedua yang ditemukan adalah inflamasi lambung. Infeksi H.pylori dapat
menginduksi respon humoral sistemik dan mukosa, namun antibodi yang terbentuk tidak dapat mengeradikasi kuman. Hal ini diduga disebabkan adanya mukus
lambung yang melindungi H.pylori, sehingga tidak dapat ditembus oleh antibodi
spesifik. Kolonisasi H.pylori di lambung biasanya disertai proses inflamasi
sehingga dapat ditemukan sel neutrofil, sel T, sel plasma, dan makrofag secara bersamaan dengan berbagai derajat degenerasi dan kerusakan sel epitel. Ulserasi merupakan kemungkinan kelainan ketiga yang tergantung dari virulensi strain
H.pylori. Masing-masing strain H.pylori mempunyai tingkat virulensi yang berbeda (Tehuteru, 2004).
Gastritis atrofi, ulkus duodenum, dan karsinoma lambung lebih banyak
dijumpai pada pasien yang terinfeksi oleh H.pylori yang memproduksi CagA
(Tehuteru, 2004).
2.5 Faktor-Faktor yang Mempengaruhi Pertumbuhan Bakteri
Secara umum ada dua faktor yang dapat mempengaruhi pertumbuhan bakteri yaitu faktor lingkungan dan zat hara sebagai nutrien yang sesuai untuk pertumbuhan optimum. Termasuk dalam faktor lingkungan adalah suhu, pH, oksigen dan tekanan osmotik (Lay dan Hastowo, 1992 dalam Silaban, 2011).
a. Suhu
Pada umumnya bakteri tumbuh pada suhu 37℃, untuk setiap spesies ada
batasan suhu maksimum dan minimum untuk pertumbuhan. Beberapa kelompok bakteri menurut suhu optimum yaitu psikrofil (Bakteri dapat tumbuh
pada suhu 5-30℃ mesofil (bakteri tumbuh pada suhu 15-50℃ dan termofil
(bakteri dapat tumbuh pada suhu 50℃-60℃).
b. pH
UIN Syarif Hidayatullah Jakarta
c. Oksigen
Bakteri dibagi dalam 3 kelompok menurut keperluannya akan oksigen yaitu aerob obligat (bakteri yang memerlukan oksigen untuk pertumbuhannya), anaerob obligat (bakteri yang hanya dapat tumbuh bila tidak ada oksigen) dan fakultatif anaerob (bakteri yang dapat tumbuh dalam keadaan dengan atau tanpa oksigen).
d. Tekanan Osmotik
Bakteri pada umumnya dapat tumbuh dalam kisaran tekanan osmotik yang cukup besar. Bakteri yang membutuhkan tekanan osmotik yang disebut osmofilik. Bakteri yang membutuhkan konsentrasi garam yang tinggi disebut halofilik. Pada beberapa bakteri memerlukan konsentrasi garam yang tinggi untuk pertumbuhannya. Akan tetapi bila konsentrasi garam sangat tinggi maka air akan keluar dari sel sehingga pertumbuhan akan berhenti.
2.6 Fase Pertumbuhan Bakteri
Bakteri mengalami pertumbuhan yang dapat dibagi dalam 4 fase menurut (Pratiwi, 2008; Dwidjoseputro, 1994) yaitu:
1. Fase lag
Pada saat dipindahkan ke media yang baru, bakteri tidak langsung tumbuh dan membelah, meskipun kondisi media sangat mendukung untuk pertumbuhan. Bakteri biasanya akan mengalami masa penyesuaian untuk menyeimbangkan pertumbuhan.
2. Fase log
Selama fase ini, populasi meningkat dua kali pada interval waktu yang teratur. Jumlah koloni bakteri akan terus bertambah seiring lajunya aktivitas metabolisme sel.
3. Fase tetap
UIN Syarif Hidayatullah Jakarta
4. Fase kematian
Pada fase ini, sel bakteri akan mati lebih cepat daripada terbentuknya sel baru. Laju kematian mengalami percepatan yang eksponensial.
2.7 Antibakteri
Antibakteri didefinisikan sebagai zat aktif yang bersifat toksisitas selektif yaitu membunuh bakteri yang merugikan manusia tanpa menimbulkan toksisitas terhadap manusia. Zat semacam ini juga sering disebut zat kemoterapeutik yaitu zat kimia yang digunakan untuk mengobati penyakit menular (kemoterapi) atau mencegah penyakit (kemoprofilaksis). Antibiotik didefinisikan sebagai zat yang dihasilkan suatu mikroorganisme (terutama fungi) baik langsung maupun analog dan sintesisnya yang dalam jumlah amat kecil bersifat merusak atau menghambat mikroorganisme lain (Atika, 2007).
Menurut Pelczar dan Chan (1988) cara kerja zat antibakteri dalam melakukan efeknya terhadap mikroorgaisme adalah sebagai berikut:
Antibakteri yang menghambat metabolisme sel
Bakteri patogen mensintesis sendiri asam folat untuk kelangsungan hidupnya dari asam para amino benzoat (PABA). Antibakteri golongan ini bersaing dengan PABA untuk diikutsertakan dalam pembentukan asam folat, maka terbentuk analog asam folat yang nonfungsional. Akibatnya kehidupan bakteri akan terganggu. Efek yang ditimbulkan oleh antibakteri golongan ini yaitu bakteriostatik. Obat yang memiliki mekanisme kerja seperti ini yaitu obat-obat golongan sulfonamida dan trimetoprim.
Antibakteri yang menghambat sintesis dinding sel
Antibakteri jenis ini menghambat pembentukan komponen dinding sel bakteri yaitu polipeptidoglikan yaitu suatu kompleks polimer mukopeptida (glikopeptida). Antibakteri ini akan menghambat reaksi paling dini dalam proses sintesis dinding sel dan reaksi terakhir (transpeptidasi) dalam rangkaian reaksi tersebut. Akibatnya tekanan osmotik di dalam sel akan lebih tinggi dibandingkan di luar sehingga terjadi lisis dinding sel. Obat yang termasuk golongan ini secara
kimia digolongkan sebagai turunan β-laktam yaitu penisilin dan sefalosporin serta
UIN Syarif Hidayatullah Jakarta
Antibakteri yang menganggu permeabilitas membran sel
Antibakteri yang termasuk golongan ini yaitu polimiksin. Polimiksin sebagai senyawa amonium-kuartener dapat merusak membran sel setelah bereaksi dengan fosfat pada fosfolipid membran sel bakteri. Polimiksin tidak efektif terhadap kuman Gram-positif karena jumlah fosfor bakteri ini rendah. Kerusakan membran sel menyebabkan keluarnya berbagai komponen penting dari dalam sel bakteri yaitu protein, asam nukleat, nukleotida, dan lain-lain.
Antibakteri yang menghambat sintesis asam nukleat sel
Antibakteri yang masuk golongan ini yaitu rifampisin dan golongan kuinolon. Rifampisin menghambat sintesis RNA dan DNA dengan berikatan dengan enzim polimerase-RNA. Sedangkan golongan kuinolon menghambat enzim DNA girase. DNA girase ini berfungsi menata kromosom yang sangat panjang menjadi bentuk spiral sehingga bisa muat dalam sel kuman yang kecil.
Antibakteri yang menghambat sintesis protein
Untuk keperluan hidupnya, sel bakteri perlu mensintesis berbagai protein. Sintesis protein bakteri berlangsung di ribosom yang terdiri dari dua sub unit yaitu ribosom 30S dan ribosom 50S. Obat yang masuk golongan ini menghambat sintesis protein dengan beberapa cara yang melibatkan pengikatan ribosom. Pengikatan ribosom 30S menyebabkan kode pada mRNA salah dibaca oleh tRNA pada waktu sintesis protein. Akibatnya terbentuk protein yang abnormal dan nonfungsional bagi sel mikroba. Pengikatan pada ribosom 50S menyebabkan terjadinya translokasi kompleks tRNA-peptida dari lokasi asam amino tidak dapat menerima kompleks tRNA-asam amino yang baru. Obat yang termasuk dalam golongan ini secara kimia dikenal sebagai turunan aminoglikosida, makrolida, linkosamida (linkomisin), tetrasiklin, dan amfenikol (kloramfenikol dan tiamfenikol).
2.7.1 Uji Aktivitas Antibakteri
UIN Syarif Hidayatullah Jakarta suatu sistem pengobatan yang efektif dan efisien. Terdapat bermacam-macam metode uji antibakteri, yaitu metode difusi dan dilusi (Pratiwi, 2008).
Metode difusi
Metode yang paling sering digunakan adalah metode difusi agar. Menggunakan cakram kertas saring yang berisi sejumlah tertentu obat yang ditempatkan pada permukaan medium padat yang sebelumnya telah diinokulasi bakteri uji pada permukaan medianya. Setelah inkubasi, diameter zona hambatan sekitar cakram dipergunakan mengukur kekuatan hambatan obat terhadap orgaisme
uji (Jawetz et al., 1996).
Menurut Davis dan Stout (1971), kekuatan daya hambat bakteri dikategorikan dibagi atas: sangat kuat (zona bening >20mm), kuat (zona bening 10-20mm), sedang (zona bening 5-10mm), dan lemah (<5mm).
Metode dilusi
Metode ini menggunakan antibakteri dengan kadar yang menurun secara bertahap, baik dengan media cair atau padat. Kemudian media diinokulasi bakteri uji dan diinkubasi. Tahap akhir dilarutkan antibakteri dengan kadar yang menghambat atau mematikan. Uji kepekaan cara dilusi agar memakan waktu dan penggunaanya dibatasi pada keadaan tertentu saja. Uji kepekaan cara dilusi cair menggunakan tabung reaksi, tidak praktis dan jarang dipakai selain itu juga dapat
menggunakan microdilution plate. Keuntungan uji mikrodilusi cair adalah bahwa
23 3.1 Tempat dan Waktu
Penelitian ini dilakukan di Lab Mikrobiologi, Laboratorium Farmakogosi dan Fitokimia, UIN Syarif Hidayatullah, Jakarta. Program Studi Farmasi, Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri, Syarif Hidayatullah, Jakarta. Waktu pelaksanaan penelitian dimulai pada bulan Januari hingga bulai Mei 2015.
3.2Alat
Laminar Air Flow (minihelix II), cawan petri bulat (normax), kertas saring,
tabung reaksi (pyrex), inkubator (france etuves), shaker, alat sentrifus, blank disc
(oxoid), vortex mixer, timbangan analitik, mikroskop cahaya (shimadzu), autoklaf
digital, micro pipet dan tip, jarum ose, ose bulat, beaker glass (schott duran), gelas
ukur, pinset, hot plate, water bath, , bunsen, glass object, cover glass, jangka sorong
(tricle brand), magnetic stirrer, kaca arloji, batang pengaduk, spatula, labu Erlenmeyer (pyrex), spektrofotometri (hitachi), oven (memmert) dan alat-alat lainnya yang umum digunakan di Laboratorium Mikrobiologi.
3.3Bahan
3.3.1 Tanaman Uji
Sampel tumbuhan yang digunakan dalam penelitian ini adalah bagian daun
dari Tanaman Leunca (Solanum nigrum) yang didapat Balittro, Bogor yang diambil
pada tanggal 20 Februari 2015. Kemudian bagian dari tanaman ini telah dideterminasi di Herbarium Bogoriense, LIPI, Cibinong, Bogor.
UIN Syarif Hidayatullah Jakarta 3.3.2 Bahan Kimia Sterilisasi Permukaan
Larutan natrium hipoklorit (NaOCl) 5,25%, etanol 70%, akuades steril
3.3.3 Media Pertumbuhan Mikroba
a. Media yang digunakan untuk isolasi kapang endofit yaitu: Potato Dextrose
Agar (PDA)
b. Media yang digunakan untuk seleksi kapang yang berpotensi sebagai
antibakteri: Nutrient Agar (NA)
c. Media yang digunakan untuk fermentasi kapang endofit: Potato Dextrose
Broth (PDB), Yeast Extract
d. Media yang digunakan untuk uji aktvitas antibakteri yaitu: Nutrient Agar
(NA).
3.3.4 Bahan Uji Aktivitas Antibakteri
a) Bakteri uji : Staphylococcus aureus ATCC 6538, Shigella dysentria ATCC
13313, Bacillus subtilis ATCC 6633, Salmonella enterica sv thypimurium
ATCC 14028, dan Helicobacter pylori ATCC 43504 yang diperoleh dari
Labotarorium Mikrobiologi Farmasi Fakultas Farmasi UI.
b) Bahan Pengenceran inokulum: NaCl fisiologis 0,9% (Otsuka), akuades
steril (otsuka)
c) Bahan pewarnaan Gram: Karbol Kristal Ungu 0,5%, cairan Lugol, etanol
96%, Safranin 0,5%.
3.3.5 Bahan untuk identifikasi kapang: pewarna Methylen blue
3.4. Cara Kerja 3.4.1 Persiapan Alat
Semua alat dan bahan yang digunakan dalam keadaan bersih dan steril. Sterilisasi dengan melewatkan alat di atas api bunsen sampai berpijar digunakan untuk mesterilkan peralatan seperti ose, jarum, dan spatula. Sterilisasi dengan oven
dilakukan dengan suhu 170 °C selama 2 jam. Alat-alat yang disterilisasi dengan
UIN Syarif Hidayatullah Jakarta
Sterilisasi dengan cara autoklaf dilakukan pada suhu 121oC selama 15 menit.
Alat-alat yang disterilisasi dengan autoklaf adalah Alat-alat-Alat-alat presisi (gelas ukur, pipet volumetri) (Volk, 1988).
3.4.2 Pembuatan Medium Isolasi, Medium Peremajaan, dan Medium Pemeliharaan
3.4.2.1 Potato Dextrose Agar (PDA) plate
Sesuai denganpetunjuk penggunaan yang tercantum pada label PDA merek
Merck, ditimbang Potato Dextrose Agar 39 gram dan ditakar 1 liter aquades. Bahan
dicampurkan dan diaduk dalam magnetik stirer. Disterilisasi dengan autoklaf selama 15 menit dengan suhu 121°C. Dituang ke dalam cawan petri, masing-masing 10 mL, biarkan media memadat (Yulia, 2005).
3.4.2.2 Potato Dextrose Agar (PDA) slant
Sesuai denganpetunjuk penggunaan yang tercantum pada label PDA merek
Merck, ditimbang Potato Dextrose Agar 39 gram, dan takar 1 liter aquades. Bahan
dicampurkan dan diaduk dengan pengaduk magnetik. Bahan dimasukkan ke dalam tabung slant masing-masing 10 mL. Disterilisasi dengan autoklaf selama 15 menit
dengan suhu 121°C. Media diletakkan dalam tabung dengan posisi miring ± 45°
dan biarkan media memadat (Yulia, 2005).
3.4.3 Pembuatan Medium Perbanyakan
3.4.3.1. Pembuatan Potato Dextrose Broth (PDB)
Media PDB dibuat dengan cara sejumlah kentang dikupas dan dipotong menjadi dadu dan kemudian dicuci. Potongan kentang ditimbang 200 g masukkan dalam erlenmeyer dan didihkan dengan 1000 mL akuades. Diamkan hingga suhu
40oC kemudian disaring.
3.4.3.1 Pembuatan Nutrient Broth (NB)
Sesuai dengan petunjuk penggunaan yang tercantum pada label NB merek
UIN Syarif Hidayatullah Jakarta dicampurkan dan diaduk dengan pengaduk magnetik. Media disterilisasi dengan autoklaf selama 15 menit dengan suhu 121°C.
3.4.4 Pembuatan medium fermentasi
3.4.4.1 Potato Dextrose Yeast (PDY)
Disiapkan 1000 mL medium PDB; Yeast Extract 2 gram; dan kalsium
karbonat 5 gram (CaCO3). Bahan dihomogenkan kecuali CaCO3, aduk dengan
pengaduk magnetik ukur pH sampai 6,0. Tambahkan CaCO3, kemudian diaduk.
Media diterilkan dengan autoklaf 15 menit, pada suhu 121℃. Media dimasukkan
masing-masing 200 mL ke dalam botol kaca steril (Atika, 2007).
3.4.5 Pembuatan Medium Pengujian
3.4.5.1 Nutrient Agar (NA)
Sesuai dengan petunjuk penggunaan yang tercantum pada label NA merek
Merck, Ditimbang 20 gram Nutrient Agar dan 1000 mL aquades. Bahan dicampur
dan diaduk dengan magnetik stirer. Media disterilisasi dengan autoklaf selama 15 menit dengan suhu 121°C. Media dituang ke dalam cawan petri, masing-masing 10 mL, dan dibiarkan memadat (Yulia, 2005).
3.4.6 Isolasi Kapang Endofit 3.4.6.1 Sampling Tanaman
Tanaman diambil bagian daun yang masih segar. Dalam penelitian ini, sampel tanaman diambil dari daerah Balittro, Bogor. Tanaman tersebut kemudian dideterminasi di Lembaga Penelitian Biologi atau Herbarium Bogoriense. Tanaman yang masih segar tersebut diberi kode menurut bagian daun yang digunakan.
3.4.6.2 Sterilisasi Permukaan dan Penanaman Simplisia
Bagian daun yang telah dicuci dengan air mengalir lalu disterilkan secara bertingkat dengan mencelupkan ke dalam alkohol 70% selama 1 menit kemudian dicelupkan pada larutan NaOCl 5,25% selama 5 menit lalu terakhir dicelupkan lagi dalam alkohol 70% selama 30 detik menggunakan pinset yang sebelumnya telah
UIN Syarif Hidayatullah Jakarta
menjadi ukuran ± 1 cm (Atika, 2007). Sampel ditanam di dalam media agar PDA.
Cawan petri yang sudah mengandung sampel tanaman kemudian diinkubasi pada suhu kamar selama 14 hari (Atika, 2007 dengan modifikasi).
3.4.6.3 Pemurnian Kapang Endofit
Kapang endofit yang tumbuh pada media isolasi selanjutnya dimurnikan pada media PDA cawan petri dan PDA agar miring. Hifa kapang diambil sedikit menggunakan ose, kemudian dipindahkan ke dalam cawan petri yang berisi PDA, kemudian kapang endofit diinkubasi pada suhu kamar selama 7 hari. Isolat kapang
yang telah murni ditransfer ke agar miring PDA baru untuk dijadikan working
culture dan stock culture (Atika, 2007). Proses pemurnian ini dilakukan secara duplo.
3.4.7 Seleksi Kapang yang Berpotensi sebagai Antibakteri dengan Metode Agar Disk
Seleksi kapang endofit yang berpotensi sebagai antibakteri dilakukan
dengan metode difusi agar padat (Diffusion Agar Plate Method). Bakteri uji yang
digunakan yaitu Staphylococcus aureus, Escherichia coli, Bacillus subtilis,
Helicobacter pylori, dan Salmonella enterica sv thypimurium. Bakteri uji dibuat suspensinya dengan cara memasukkan 100 µL suspensi bakteri ke dalam 10 mL
media NB kemudian di shaker dengan waktu yang sesuai dengan fase log
pertumbuhan bakteri. Langkah selanjutnya, suspensi bakteri di pipet sebanyak 1 mL ke dalam media agar NA dan dicampur dengan media NA kemudian digoyang goyang sehingga suspensi dan agar tercampur merata.
Isolat fungi endofit yang telah dimurnikan ke dalam medium PDA diambil
dengan sedotan steril atau cork borer berdiameter 6 mm dan dipindahkan ke media
NA yang berisi bakteri uji. Satu cawan petri media NA yang telah berisi bakteri uji dapat ditanami potongan isolat murni fungi endofit ±8 isolat. Kultur di inkubasi pada suhu ruang (27-29ºC) selama 4 hari. Aktivitas antibakteri fungi endofit dilihat
UIN Syarif Hidayatullah Jakarta 3.4.8 Fermentasi
Fermentasi kapang endofit dilakukan dengan menggunakan media PDY (Potatoes Dextrose Yeast), yang bertujuan untuk memperoleh ekstrak yang mengandung senyawa metabolit sekunder dari isolat kapang endofit. Koloni murni kapang endofit pada cawan petri PDA yang telah diinkubasi selama 7
hari, kemudian dengan menggunakan cork borer diambil 3 potongan berukuran
1 x 1 cm. Potongan kapang tersebut kemudian diinokulasikan ke dalam media fermentasi cair PDY sebanyak 200 mL dalam botol kaca steril berukuran 500 mL.
Kapang endofit kemudian difermentasi goyang menggunakan rotary shaker
dengan kecepatan 130 rpm, dilakukan pada suhu 37℃ selama 14 hari. Setelah itu
medium cair hasil fermentasi tersebut dimasukkan ke dalam tabung sentrifus ukuran 15 mL yang sebelumnya telah disterilisasi terlebih dahulu, kemudian disentrifugasi dengan kecepatan 3000 rpm selama 20 menit. Supernatan hasil sentrifugasi diambil.Supernatan ini kemudian digunakan untuk uji aktivitas antibakteri sebagai larutan uji (Sinaga, 2009 ; Kumala, 2006 dengan modifikasi).
3.4.9 Uji Aktivitas Antibakteri 3.4.9.1 Identifikasi Bakteri Uji
Identifikasi bakteri uji dilakukan secara makroskopik dan mikroskopik pada bakteri uji yang berusia 18-24 jam. Identifikasi makroskopik dilakukan dengan mengamati morfologi dan pertumbuhan koloni.
UIN Syarif Hidayatullah Jakarta Safranin diteteskan di atas preparat, kemudian dibiarkan selama 1-2 menit, cuci dengan air dan keringkan. Tetesi minyak immersi diatas sediaan, amati dengan mikroskop (Atika, 2007).
3.4.9.2 Pembuatan Kurva tumbuh bakteri
Bakteri S.dysentriae, S.aureus, B.subtilis, S.enterica sv thypimurium, dan
H.pylori diremajakan masing-masing sebanyak dua biakan, pertama sebagai biakan stok dan kedua sebagai biakan suspensi. Satu ose diambil dari kultur bakteri yang akan diremajakan kemudian digoreskan ke agar miring. Biakan tersebut
ditumbuhkan pada agar miring NA selama 24 jam pada suhu 37℃.
Biakan yang telah tumbuh pada agar miring NA, ditambahkan dengan 5mL NaCl 0,9% (w/v) steril. Sebanyak 2 mL suspensi bakteri diinokulasikan ke dalam
erlenmeyer 250 mL yang berisi 200 mL NB (Nutrient Broth), dikocok dan NB steril
tanpa suspensi bakteri sebagai kontrol. Spektrofotometer visible diatur dengan
panjang gelombang 600 nm, kuvet dibersihkan kemudian diukur absorbansi awal
NB steril sebagai kontrol dan NB yang mengandung bakteri pada menit ke-0 (t0).
Setelah absorbansi awal ditentukan, media NB diinkubasi pada pengocokan 120
rpm dengan temperature 37℃. Setiap interval 30 menit dilakukan pengukuran
absorban untuk mendapatkan kurva tumbuh. Kurva pertumbuhan diakhiri setelah melewati fase stasioner (Utami, 2009).
3.4.9.3 Uji Aktivitas Antibakteri dengan Metode Cakram
Suspensi bakteri 1 mL dimasukkan secara aseptis ke dalam cawan petri steril kemudian ditambahkan media agar yang telah dibuat untuk masing-masing bakteri uji sejumlah 10mL. Suspensi kuman yang telah diberi agar dalam cawan petri digoyangkan perlahan untuk memperoleh suspensi kuman yang tersebar merata pada media agar (Rachmayani, 2008).
UIN Syarif Hidayatullah Jakarta Kontrol positif yang digunakan pada uji aktivitas antibakteri yaitu cakram kloramfenikol. Cakram diletakkan pada permukaan media uji lalu diinkubasi. Kontrol negatif yaitu pelarut pada proses fermentasi, yaitu akuades steril. Sebanyak 20 µl larutan kontrol negatif diserapkan ke cakram steril. Cakram yang sudah diresapi larutan kontrol negatif diletakkan pada permukaan media uji kemudian diinkubasi (Atika, 2007).
Bakteri uji diinkubasi selama 18-24 jam pada suhu 37,5℃. Diamati zona
hambatan yang terbentuk setelah inkubasi. Diameter zona hambat diukur dengan jangka sorong (Atika, 2007).
3.4.10 Karakteristik Kapang Endofit yang Mempunyai Aktivitas Antibakteri Pengamatan morfologi kapang secara makroskopik dilakukan dengan mengamati karakteristik koloni suatu biakan, antara lain meliputi: warna dan struktur permukaan koloni; ada atau tidaknya tetes eksudat; dan ada atau tidaknya lingkatan kosentris. Pengamatan koloni dilakukan sejak awal penanaman hingga beberapa waktu tertentu, dan segala macam perubahan yang terjadi harus dicatat
(Gandjar et al., 1999).
Karakteristik mikroskopik kapang endofit menggunakan metode slide
culture, yaitu kertas saring diletakkan pada dasar cawan petri steril kemudian dibasahi dengan aquadest steril. Kaca objek dimasukkan ke dalam cawan petri tersebut dan cover glass diletakkan disamping kaca objek, setelah itu cawan petri tersebut ditutup. Media PDA steril diteteskan di atas kaca objek dengan menggunakan pipet steril, kemudian bagian atasnya diinokulasikan kapang endofit. Kaca penutup objek diletakkan di atas potongan agar, kemudian cawan petri ditutup.
Isolat diinkubasi pada suhu 27℃ selama 7 hari. Hasil inkubasi diamati di