FRAKSINASI DAN UJI AKTIVITAS ANTIBAKTERI
ISOLAT KAPANG ENDOFIT DARI DAUN TANAMAN
ILER (
Coleus atropurpureus
Benth.)
TERHADAP BAKTERI
Staphylococcus aureus
DAN
Pseudomonas aeruginosa
SKRIPSI
WIDA HUSNIYAH
NIM: 1112102000022
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
FRAKSINASI DAN UJI AKTIVITAS ANTIBAKTERI
ISOLAT KAPANG ENDOFIT DARI DAUN TANAMAN
ILER (
Coleus atropurpureus
Benth.)
TERHADAP BAKTERI
Staphylococcus aureus
DAN
Pseudomonas aeruginosa
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
WIDA HUSNIYAH
NIM: 1112102000022
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
Nama : Wida Husniyah
Program Studi : Farmasi
Judul : Fraksinasi dan Uji Aktivitas Antibakteri Isolat Kapang Endofit dari
Daun Tanaman Iler (Coleus atropurpureus Benth.) terhadap Bakteri
Staphylococcus aureus dan Pseudomonas aeruginosa.
Tanaman merupakan salah satu bentuk kekayaan alam yang memiliki peran
sangat penting dalam berbagai bidang, terutama dalam bidang kesehatan dapat
berperan sebagai obat. Tanaman yang berkhasiat obat, sudah dikenal, dan
digunakan oleh masyarakat Indonesia yaitu tanaman Iler (Coleus atropurpureus
Benth.) dari suku Lamiaceae. Pada jaringan tanaman terdapat mikroba endofit yang
mampu memproduksi senyawa bioaktif. Penelitian ini bertujuan untuk mengisolasi
kapang endofit dari daun tanaman Iler (Coleus atropurpureus Benth.) dan
mengetahui kemampuan zat antibakteri yang dihasilkan dari ekstrak kapang endofit.
Hasil ekstrak berbagai fraksi dari isolat kapang endofit yang diperoleh diujikan
terhadap bakteri Staphylococcus aureus (Gram positif) dan Pseudomonas
aeruginosa (Gram negatif) menggunakan metode difusi agar. Hasil dari penelitian
diperoleh 6 isolat yaitu isolat DIM1A, DIS1A, DIS2A, DIT1A, DIT1B, dan DIT3A.
Dari 6 isolat hanya 5 isolat yang aktif yaitu DIM1A, DIS1A, DIS2A, DIT1A, dan
DIT3A. Fraksi ekstrak kapang endofit yang menunjukkan aktivitas antibakteri
terhadap bakteri Staphylococcus aureus adalah Fraksi B (n-heksan) isolat DIT3A.
Dan kapang endofit yang menunjukkan aktivitas antibakteri terhadap bakteri
Pseudomonas aeruginosa adalah fraksi A (air) dari 5 isolat aktif, fraksi B (n-heksan)
isolat DIS1A dan DIT1A, fraksi C (etil asetat) isolat DIM1A, DIS1A, DIT1A, dan
DIT3A, Fraksi D (metanol) dari 5 isolat aktif.
Kata kunci: Aktivitas Antibakteri, Daun Tanaman Iler (Coleus atropurpureus
Nama : Wida Husniyah
Major : Pharmacy
Title : Fractionation and Antibacterial Activity of Isolates Endophytic
Fungus from Iler leaf plants (Coleus atropurpureus Benth.) Against
Bacteria Staphylococcus aureus and Pseudomonas aeruginosa.
Plant is one of the natural wealth that has a very important role in various
fields, especially in the health sector can act as a drug. Medicinal plants, has been
known and used by the people of Indonesia is Iler (Coleus atropurpureus Benth.)
From Lamiaceae. Tissues of plant there are endophytic microbes capable of
producing bioactive compounds. This study aims to isolate endophytic fungi from
Iler leaf plants (Coleus atropurpureus Benth.) to determine the ability of
antibacterial substances produced from extracts of endophytic fungi. Results extract
various fractions of endophytic fungi obtained isolates against Staphylococcus
aureus (Gram positive) and Pseudomonas aeruginosa (Gram negative) using the
agar diffusion method. The results of this study showed that 6 isolates, there are
isolates DIM1A, DIS1A, DIS2A, DIT1A, DIT1B and DIT3A. Of the 6 isolates only
5 active isolates including isolates DIM1A, DIS1A, DIS2A, DIT1A, and DIT3A.
Fraction of endophytic fungi extracts showed antibacterial activity against
Staphylococcus aureus, fraction B (n-hexane) isolates DIT3A. And the bacteria
Pseudomonas aeruginosa are the fraction A (water) there 5 isolates active, fraction
B (n-hexane) isolates DIS1A and DIT1A, fraction C (ethyl acetate) isolates
DIM1A, DIS1A, DIT1A and DIT3A, fraction D (methanol) there are 5 isolates
active.
Alhamdulillahirabbil’alamin, segala puji dan syukur bagi Allah SWT yang telah melimpahkan rahmat dan ridho-Nya, tak lupa shalawat serta salam terlimpah
kepada Nabi Muhammad SAW sehingga penulis dapat menyelesaikan penyusunan
skripsi ini hingga selesai.
Skripsi yang berjudul “Fraksinasi dan Uji Aktivitas Antibakteri Isolat Kapang Endofit dari Daun Tanaman Iler (Coleus atropurpureus Benth.) terhadap Bakteri
Staphylococcus aureus dan Pseudomonas aeruginosa” disusun dalam rangka memenuhi persyaratan untuk memperoleh gelar Sarjana Farmasi pada Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
Pada kesempatan ini penulis ingin mengucapakan terimakasih dan
penghargaan sebesar-besarnya kepada:
1. Dr. Arief Sumantri, S.KM., M.KM, selaku Dekan Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Dr. Nurmeilis M.Si, Apt, selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
3. Prof. Atiek Soemiati, selaku pembimbing I dan Ibu Lina M.Si, Apt, selaku
pembimbing II yang telah tulus ikhlas serta sabar dalam membimbing,
memberikan nasehat serta ilmu kepada penulis sehingga penelitian ini dapat
terselesaikan.
4. Bapak dan Ibu dosen Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri Syarif Hidayatullah Jakarta, yang selalu memberikan
ilmu dan nasehat yang bermanfaat bagi penulis.
5. Kedua orang tua dan mertua tercinta yang selalu senantiasa mendukung penulis
untuk terus belajar dan menyelesaikan penelitian ini
6. Suamiku tercinta Ibnu Harish yang senantiasa menemani dalam suka dan duka
dalam menyusun skripsi, serta selalu memberikan motivasi untuk
7. Anakku Candrawangsa Zeroun El-Nesij yang sekarang berusia 18 bulan selalu
menjadi penghibur pikiran dikala lelah dan letih, sehingga mengembalikan
semangat penulis untuk menyelesaikan penelitian ini.
8. Adik-adik tercinta, yang selalu menjadi tempat sharing bagi penulis.
9. Teman-teman seperjuangan Farmasi angkatan 2012 yang senantiasa saling
membantu dan saling memberi semangat sampai skripsi ini dapat selesai.
10. Dan pihak-pihak lain yang tidak dapat disebutkan satu persatu, yang telah
memberikan dukungan hingga terwujudnya skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun
penulis berharap hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan khususnya pada bidang farmasi.
Jakarta, 19 Agustus 2016
Halaman
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
HALAMAN PERSETUJUAN PUBLIKASI ILMIAH ... ix
DAFTAR ISI ... x
BAB II. TINJAUAN PUSTAKA ... 5
2.1 Tanaman Iler (Coleus atropurpureus Benth.) ... 5
2.1.1 Taksonomi Tumbuhan ... 5
2.2.1 Definisi dan Perkembangan Mikroba Endofit ... 7
2.2.2 Kapang Endofit ... 7
2.2.3 Mekanisme Kerja Kapang Endofit ... 8
2.3 Bakteri Gram Positif dan Gram Negatif ... 8
2.3.1 Teknik Pewarnaan Gram ... 9
2.4 Bakteri Uji ... 10
2.4.1 Staphylococcus aureus ...10
2.4.2 Pseudomonas aeruginosa ... 11
2.5 Mekanisme Antibakteri ... 11
2.6 Uji Aktivitas Antibakteri ... 12
2.6.1 Metode Difusi ... 12
2.6.1.1 Disc Diffusion Methode (Test Kirby Bauer) ... 12
2.6.2 Metode Dilusi ... 13
2.7 Antibakteri Pembanding ... 13
BAB III. METODOLOGI PENELITIAN ... 15
3.1 Waktu dan Tempat Penelitian... 15
3.2 Alat dan Bahan ... 15
3.2.1 Alat ... 15
3.2.2 Bahan ... 15
3.2.2.1 Sampel Tanaman ... 15
3.2.2.2 Media Pertumbuhan Mikroba ... 16
3.2.2.3 Bahan untuk Sterilisasi Permukaan ... 16
3.2.2.4 Bahan Uji Aktivitas Antibakteri ... 16
3.3 Prosedur Penelitian ... 16
3.3.1 Sterilisasi Alat dan Bahan ... 16
3.3.2 Pembuatan Media ... 16
3.3.2.1 Potato Dextrose Agar (PDA) ... 17
3.3.2.2 Potato Dextrose Agar (PDA) Agar Miring ... 17
3.3.2.3 Nutrient Agar (NA) ... 17
3.3.2.4 Nutrient Agar (NA) Agar Miring ... 17
3.3.2.5 Potato Dextrose Yeast (PDY) ... 18
3.3.2.6 Mueller Hinton Agar (MHA) ... 18
3.3.3 Sterilisasi Permukaan dan Isolasi Kapang Endofit ... 18
3.3.4 Pemurnian Isolat Kapang Endofit ... 19
3.3.6 Peremajaan Bakteri Uji ... 20
3.3.7 Identifikasi Bakteri Uji ... 20
3.3.7.1 Identifikasi Makroskopik ... 20
3.3.7.2 Identifikasi Mikroskopik ... 20
3.3.8 Seleksi Isolat Kapang Endofit Penghasil Antibakteri ... 21
3.3.9 Kultivasi Isolat Kapang Endofit ... 21
3.3.10 Fermentasi Isolat Kapang Endofit ... 22
3.3.11 Ekstraksi Hasil Fermentasi Kapang Endofit ... 22
3.3.12 Pembuatan Suspensi Bakteri Uji ... 23
3.3.13 Uji Aktivitas Antibakteri ... 23
BAB IV. HASIL DAN PEMBAHASAN ... 25
4.1 Determinasi Tanaman Iler ... 25
4.2 Isolasi dan Pemurnian Kapang Endofit ... 25
4.3 Identifikasi Bakteri Uji ... 27
4.4 Seleksi Isolat Kapang Endofit Penghasil Antibakteri ... 29
4.5 Identifikasi Isolat Kapang Endofit Hasil Seleksi ... 31
4.5.1 Isolat DIM1A... 32
4.5.2 Isolat DIS1A ... 33
4.5.3 Isolat DIS2A ... 34
4.5.4 Isolat DIT1A ... 35
4.5.5 Isolat DIT3A ... 36
4.6 Kultivasi Isolat Kapang Endofit ... 37
4.7 Fermentasi Isolat Kapang Endofit Hasil Seleksi ... 41
4.8 Ekstraksi Senyawa Bioaktif Kapang Endofit ... 42
4.9 Uji Aktivitas Antibakteri Ektrak Kapang Endofit ... 43
BAB V. KESIMPULAN DAN SARAN ... 50
5.1 Kesimpulan ... 50
5.2 Saran ... 50
DAFTAR PUSTAKA ... 51
Halaman
Gambar 2.1.2 Daun Iler (Coleus atropurpureus Benth.) ... 5
Gambar 2.7 Rumus Bangun Kloramfenikol ... 13
Gambar 4.3 Hasil Pengamatan secara Mikroskopik dengan perbesaran 100x...28
Gambar 4.5.1 Isolat DIM1A secara Makroskopik dan Mikroskopik... 32
Gambar 4.5.2 Isolat DIS1A secara Makroskopik dan Mikroskopik ... 33
Gambar 4.5.3 Isolat DIS2A secara Makroskopik dan Mikroskopik ... 34
Gambar 4.5.4 Isolat DIT1A secara Makroskopik dan Mikroskopik ... 35
Gambar 4.5.5 Isolat DIT3A secara Makroskopik dan Mikroskopik ... 36
Gambar 4.6a Grafik Kurva Pertumbuhan Kapang Endofit Isolat DIM1A ... 37
Gambar 4.6b Grafik Kurva Pertumbuhan Kapang Endofit Isolat DIS1A ... 38
Gambar 4.6c Grafik Kurva Pertumbuhan Kapang Endofit Isolat DIS2A ... 38
Gambar 4.6d Grafik Kurva Pertumbuhan Kapang Endofit Isolat DIT1A ... 38
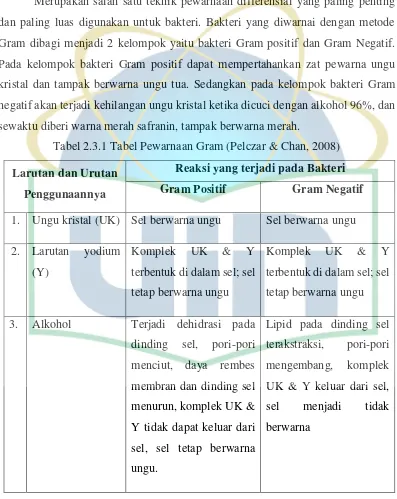
Halaman Tabel 2.3.1 Tabel Pewarnaan Gram (Pelczar & Chan, 2008) ... 9
Tabel 4.3 Hasil Uji Identifikasi Bakteri Uji ... 27
Tabel 4.4 Hasil Uji Seleksi Kapang Endofit ... 29
Tabel 4.6 Data Kurva Pertumbuhan Isolat Kapang Endofit dalam Media
PDY Cair ... 37
Tabel 4.9a Hasil Uji Aktivitas Antibakteri Senyawa Ekstrak Kapang Endofit
terhadap Bakteri Staphylococcus aureus ATCC 25923 ... 45
Tabel 4.9b Hasil Uji Aktivitas Antibakteri Senyawa Ekstrak Kapang Endofit
Halaman
Lampiran 1. Determinasi Tanaman. ... 57
Lampiran 2. Skema Cara Kerja Penelitian secara Umum ... 58
Lampiran 3. Skema Cara Kerja Sterilisasi Permukaan dan Isolasi Kapang Endofit ... 59
Lampiran 4. Skema Cara Kerja Pemurnian Kapang Endofit ... 60
Lampiran 5. Skema Cara Kerja Identifikasi Kapang Endofit secara Mikroskopik ... 61
Lampiran 6. Skema Cara Kerja Identifikasi Bakteri Uji ... 62
Lampiran 7. Skema Cara Kerja Seleksi Kapang Endofit ... 63
Lampiran 8. Skema Cara Kerja Kultivasi Kapang Endofit ... 64
Lampiran 9. Skema Cara Kerja Fermentasi Kapang Endofit ... 65
Lampiran 10. Skema Cara Kerja Ekstraksi Senyawa Metabolit Sekunder Kapang Endofit ... 66
Lampiran 11. Skema Cara Kerja Pembuatan Suspensi Bakteri ... 67
Lampiran 12. Skema Cara Kerja Uji Aktivitas Antibakteri ... 68
Lampiran 13. Gambar Hasil Isolasi Kapang Endofit ... 69
Lampiran 14. Hasil Seleksi Isolat Kapang Endofit ... 72
Lampiran 15. Gambar Hasil Fermentasi Kapang Endofit ... 74
Lampiran 16. Hasil Ekstrak Kental Kapang Endofit ... 76
BAB I PENDAHULUAN
1.1Latar Belakang
Indonesia dikenal sebagai negara dengan tingkat keanekaragaman tanaman
yang tinggi. Jumlah tanaman berkhasiat obat di Indonesia diperkirakan sekitar
1.260 jenis tanaman (Yuhernita dkk., 2011). Tanaman merupakan salah satu bentuk
kekayaan alam yang memiliki peran sangat penting dalam berbagai bidang, seperti
bidang pangan, kesehatan, dan lain sebagainya. Tanaman dapat berupa jenis
buah-buahan, sayur-sayuran, tanaman pangan, rempah-rempah maupun tanaman liar
yang tumbuh di sekitar kita (Tari R dkk., 2013(. Oleh karena itu, mengembangkan
tanaman dalam bidang kesehatan sebagai obat sangat signifikan untuk dikaji lebih
lanjut.
Salah satu tanaman yang berkhasiat obat, sudah dikenal, dan digunakan oleh
masyarakat Indonesia yaitu tanaman Iler (Coleus atropurpureus Benth.) dari suku
Lamiaceae. Tanaman genus Coleus asli Indonesia ini mempunyai khasiat untuk
meredakan rasa nyeri, sebagai agen antiinflamasi, antioksidan, antibakteri, dan
mempercepat penyembuhan luka (Tari R dkk., 2013). Tipikal metabolit sekunder
suku Lamiaceae meliputi terpenoid khususnya mono-, sesqui-, di-, dan tri-terpen,
senyawa fenolik khususnya asam fenolat seperti asam rosmarinik, dan kandungan
flavonoid yang melimpah (Lenny dkk., 2013).
Penelitian yang dilakukan Shatty (1997) membuktikan bahwa khasiat
antiinflamasi dan antioksidan dimiliki oleh tanaman (Coleus blumai Benth.) yang
memiliki genus sama dengan tanaman Iler (Coleus atropurpureus Benth.),
sementara itu khasiat sebagai antibakteri dan mempercepat penyembuhan luka telah
dibuktikan secara empiris oleh masyarakat Indonesia (khususnya di wilayah pulau
Jawa dan Sulawesi) terdapat pada tanaman Iler (Coleus atropurpureus Benth.)
(Ariyanti dkk., 2007).
Daun Iler (Coleus atropurpureus Benth.) atau mayana memiliki warna merah
kehitaman yang sangat berkhasiat. Bagian daunnya mengandung minyak atsiri,
saponin, flavonoid dan polivenol, zat-zat alkaloida, mineral serta sedikit lendir
tumbuhan. Senyawa ini merupakan kimia alami yang berguna bagi tumbuhan
sendiri dan bagi lingkungannya, termasuk memiliki khasiat obat untuk manusia
(Supriyatna dkk., 2015). Tanaman yang menghasilkan metabolit sekunder
berpotensi sebagai antioksidan, zat perwarna, penambah aroma makanan, parfum,
insektisida dan obat (Yuhernita dkk., 2011).
Jika dilihat lebih lanjut tingkat kasus infeksi yang terjadi di Indonesia
terbilang masih tinggi. Berdasarkan Pusat Data dan Informasi Kementerian
Kesehatan RI tahun 2012 mencantumkan bahwa Indonesia merupakan negara
berkembang dengan kejadian penyakit infeksi masih menjadi masalah ditandai
dengan masih sering terjadi KLB (Kejadian Luar Biasa) beberapa penyakit infeksi
tertentu, munculnya kembali beberapa penyakit infeksi lama (re-emerging
diseases), serta munculnya penyakit-penyakit infeksi baru (new-emerging
diseases). Salah satu penyebab penyakit infeksi adalah bakteri. Bakteri merupakan
mikroorganisme yang tidak dapat dilihat dengan mata telanjang, tetapi hanya dapat
dilihat dengan bantuan mikroskop (Djide dan Sartini, 2008). Bakteri patogen dan
berbahaya dapat menyebabkan infeksi baik secara sporadik maupun endemik,
diantaranya adalah bakteri Staphylococcus aureus, Escherichia coli dan
Pseudomonas aeruginosa (Mpila dkk., 2012).
Bakteri Staphylococcus aureus merupakan salah satu bakteri Gram positif
penyebab infeksi tersering di dunia (Afifurrahman, 2014). Tingkat keparahan yang
terjadi bervariasi mulai dari infeksi minor di kulit (impetigo) sampai dengan infeksi
pada mata dan Central Nervous System (CNS). Selain itu, Staphylococcus aureus
memiliki kemampuan adaptasi yang luar biasa sehingga resisten pada banyak
antibiotik (Multi Drug Resistance) (Oliveira DC dkk., 2002). Bakteri Pseudomonas
aeruginosa merupakan bakteri Gram negatif dan salah satu spesies dari genus
pseudomonas yang dapat menimbulkan penyakit pada manusia (Handayani, 2015).
Pada jaringan tanaman terdapat mikroorganisme yang diperkirakan memiliki
kemampuan sama dalam memproduksi bahan aktif yang dihasilkan oleh tanaman
induknya yang disebut dengan mikroba endofit. Sementara itu, mikroba endofit
yang terdapat dalam jaringan tanaman umumnya berupa bakteri, kapang, dan
khamir. Kapang adalah organisme yang paling sering ditemukan sebagai endofit
batang dan daun menurut (Noverita dkk., 2009 dalam Hafsari & Asterina, 2012).
Kapang endofit juga dapat diisolasi dari bagian organ tumbuhan yang masih segar
dan telah dilakukan sterilisasi permukaan (Agusta, 2009). Kemampuan kapang
endofit dalam memproduksi senyawa metabolit sekunder sesuai dengan tanaman
inangnya merupakan peluang yang besar dan dapat diandalkan sebagai cara
alternatif untuk memproduksi senyawa bioaktif yang berkhasiat.
Selain menjadi alternatif untuk memproduksi senyawa bioaktif yang
berkhasiat, pertimbangan dalam menjaga produksi obat dengan bahan baku herbal
yang terbatas juga diperlukan, agar proses produksi tetap berkelanjutan dan
berkesinambungan. Upaya ini dilakukan untuk mencegah musnahnya sumber daya
hayati dan menjaga stabilitas kelestarian alam karena sumber daya hayati terlalu
banyak dieksploitasi dalam jumlah banyak namun proses pemulihan membutuhkan
waktu yang sangat lama dan terkendala dalam hal budidaya (Hafsari & Asterina,
2012).
Oleh karena itu, peneliti tertarik untuk melakukan penelitian mengenai isolasi
mikroba endofit yang berupa kapang endofit dari daun tanaman Iler (Coleus
atropurpureus Benth.) yang berpotensi sebagai obat antibakteri secara tradisional
dan melakukan uji aktivitas antibakteri senyawa metabolit sekunder yang diperoleh
dari ekstrak kapang endofit yang difraksinasi menggunakan pelarut organik
terhadap bakteri patogen Staphylococcus aureus (Gram positif) dan Pseudomonas
aeruginosa (Gram negatif).
1.2Rumusan Masalah
Berdasarkan penelusuran pustaka, belum diketahui kapang endofit apa saja
yang terkandung dalam daun tanaman Iler (Coleus atropurpureus Benth.) dan
aktivitas antibakteri yang dihasilkan dari ekstrak kapang endofit yang telah
difraksinasi menggunakan pelarut organik.
1.3 Tujuan Penelitian
1. Mendapatkan isolat kapang endofit dari daun tanaman Iler (Coleus
atropurpureus Benth.).
2. Mengetahui kemampuan zat antibakteri yang diperoleh dari ekstrak kapang
aeruginosa.
1.4 Manfaat Penelitian
1. Memberikan informasi mengenai aktivitas antibakteri senyawa metabolit
sekunder dari isolat kapang endofit daun tanaman Iler (Coleus atropurpureus
Benth.) asli Indonesia terhadap bakteri patogen Staphylococcus aureus dan
Pseudomonas aeruginosa.
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Iler (Coleus atropurpureus Benth.) 2.1.1 Taksonomi Tumbuhan
Taksonomi tanaman Iler (Coleus atropurpureus Benth.) dikelompokkan
dalam klasifikasi:
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Ordo : Lamiales
Famili : Lamiaceae
Genus : Coleus
Spesies : Coleus atropurpureus Benth. (Kandowangko dkk., 2011)
2.1.2 Deskripsi Tanaman
Tanaman Iler merupakan tumbuhan terna, tumbuh tegak atau berbaring pada
pangkalnya, bagian yang menyentuh tanah mengeluarkan akar, tinggi 0,5 – 1, 5 m,
jika seluruh bagian diremas akan mengeluarkan bau harum. Batang bersegi empat
dengan alur yang agak dalam pada masing-masing sisinya, berambut, percabangan
banyak, berwarna ungu kemerahan. Daun tunggal, panjang tangkai 3-4 cm. Helaian
daun berbentuk bulat, tulang daun menyirip jelas, permukaan daun agak mengkilap,
berambut halus, berwarna ungu kecoklatan sampai ungu kehitaman (Kandowangko
dkk., 2011).
Gambar 2.1.2 Daun Iler (Coleus atropurpureus Benth.)
Tanaman yang dikenal sebagai “Kentangan” (Jawa) atau “Si Gresing” (Batak) atau “Jawer kotok” (Sunda), dan “Polohungo moyitomo” (Sulawesi) banyak dimanfaatkan sebagai tanaman hias karena memiliki daun dengan warna
yang cerah dan menarik, oleh sebab itulah tanaman ini sering disebut sebagai “Painted Nettle” atau “Rainbow Plant” (Vikayanti, 2015).
2.1.3 Tempat Tumbuh
Tanaman Iler (Coleus atropurpureus Benth.) merupakan salah satu tumbuhan
alam yang berbatang basah dan banyak tersebar, antara lain di wilayah pulau
Sumatera, Jawa, dan Sulawesi.
2.1.4 Kandungan Kimia
Daun Iler memiliki warna merah kehitaman yang sangat berkhasiat. Bagian
daun mengandung minyak atsiri, saponin, flavonoid, dan polivenol, zat-zat
alkaloida, mineral serta sedikit lendir. Zat yang terkandung dalam minyak atsiri
antara lain adalah kalvakrol, eugenol dan etil salisilat (Syamsuhidayat dan Hutapea,
1991 dalam Aryanti dkk., 2007). Keberadaan senyawa aktif dalam tanaman yang
memberi efek sebagai obat dapat dimengerti mengingat tumbuhan pada tahap awal
melakukan proses fotosintesis menghasilkan glukosa, yang selanjutnya melalui
proses biokimia menghasilkan metabolit primer karbohidrat, protein, lemak, dan
asam nukleat. Metabolit primer memiliki sifat genetik masing-masing dan dengan
bantuan enzim dapat menghasilkan ratusan hingga ribuan macam senyawa kimia
alami yang disebut dengan metabolit sekunder. Senyawa metabolit sekunder
berguna bagi tanaman sendiri dan bagi lingkungannya (termasuk khasiat sebagai
obat untuk manusia) (Supriyatna dkk., 2015).
2.1.5 Khasiat
Berdasarkan pengalaman empiris tanaman Iler dapat digunakan sebagai obat
luka dengan cara membubuhkan ulekan daun Iler pada luka tersebut (Tari dkk.,
2013).Penelitian yang dilakukan (Mpila dkk., 2012) mengenai aktivitas antibakteri
ekstrak etanol 96% daun Mayana/Iler (Coleus atropurpureus Benth.) terhadap
bakteri Staphylococcus aureus dan Pseudomonas aeruginosa secara in-vitro
diperoleh konsentrasi efektif untuk menghambat bakteri Staphylococcus aureus
10.67 mm, 11.17 mm, dan 12,33 mm, sementara itu pada bakteri Pseudomonas
aeruginosa ATCC 9027 pada konsentrasi ekstrak 40% dan 80% dengan zona
hambat 11.00 mm, dan 11.83 mm. Peningkatan konsentrasi ekstrak daun mayana
menunjukkan semakin besar diameter zona hambat pertumbuhan bakteri.
2.2 Mikroba Endofit
2.2.1 Definisi dan Perkembangan Mikroba Endofit
Endofit berasal dari bahasa Yunani, ‘endo’ berarti di dalam dan ‘fit’ (pyte)
berarti tumbuhan. Mikroba endofit adalah mikroba yang hidup di dalam jaringan
tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam
jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi
dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa
biologi atau metabolit sekunder yang diduga sebagai akibat koevolusi atau transfer
genetik (genetic recombination) dari tanaman inangnya ke dalam mikroba endofit
(Tan dkk., 2001). Mikroba endofit yang terdapat dalam jaringan tanaman
umumnya berupa bakteri, kapang, dan khamir. Kapang adalah organisme yang
paling sering ditemukan sebagai endofit (Strobel GA & Daisy B, 2003).
2.2.2 Kapang Endofit
Kapang adalah organisme heterotrof yang memerlukan senyawa organik
untuk nutrisinya (sumber karbon dan energi). Kapang merupakan fungi yang
berfilamen dan multiseluler. Identifikasi kapang didasarkan pada kenampakan fisik
(morfologi), termasuk karakteristik koloni dan spora reproduktif (Pratiwi, 2008).
Pada tahun 1992, Hirsch dan Braun mengemukakan pendapatnya mengenai
definisi kapang endofit, yaitu koloni kapang pada jaringan hidup tumbuhan tanpa
menimbulkan efek negatif dalam waktu dekat. Definisi tersebut ternyata tidak
cukup untuk menunjukkan seluruh organisme hidup selain kapang yang juga
berperan sebagai endofit. Namun, untuk konteks kapang endofit, definisi yang
diberikan oleh Hirsch dan Braun sudah cukup mewakili. Kapang endofit sejati (true
endophytic fungi) kemungkinan besar tidak akan menimbulkan efek negatif
2.2.3 Mekanisme Kerja Kapang Endofit
Endofit dapat berperan sebagai perangsang pertumbuhan tanaman dan
meningkatkan hasil melalui produksi fitohormon dan penyedia hara, sebagai
penetral kontaminan tanah sehingga meningkatkan fitoremediasi, dan agen
pengendali hayati. Kapang endofit dapat mengurangi infeksi nematoda,
meningkatkan ketahanan tanaman, memproduksi metabolit sekunder seperti
alkaloid, paxiline, lolitrems dan steroid (Yulianti, 2012).
2.2.4 Isolasi Kapang Endofit
Kapang endofit umumnya diisolasi dari jaringan tumbuhan dan telah
disterilkan permukaannya. Sterilisasi permukaan organ tumbuhan yang umum
digunakan adalah desinfektan dalam jangka waktu tertentu yaitu berupa Alkohol
pada konsentrasi 70-95%. Kemampuan alkohol untuk mensterilkan permukaan
organ tumbuhan dapat meningkat ketika dikombinasikan dengan bahan kimia
lainnya. Bahan yang digunakan sebagai kombinasi biasanya adalah natrium
hipoklorit (NaOCl) digunakan konsentrasi 2-10% untuk sterilisasi permukaan
(Zang dkk., 2006). Sterilisasi permukaan dilakukan untuk mengeliminasi
kontaminasi mikroba epifit atau mikroba yang berada di permukaan tanaman.
Medium yang digunakan pada proses isolasi kapang adalah yang berpengaruh
terhadap jumlah dan jenis kapang yang diisolasi (Agusta, 2009). Medium isolasi
yang digunakan untuk kapang adalah Corn Meal Malt Agar (CMMA), MEA (Malt
Extract Agar), Water Agar (WA), dan PDA (Potato Dextrose Agar) (Margino,
2008; Noverita dkk., 2003; Pawle, 2014).
2.3 Bakteri Gram Positif dan Gram Negatif
Bakteri merupakan sel prokariot yang khas, uniseluler dan tidak mengandung
struktur yang membatasi membran di dalam sitoplasmanya. Reproduksi utama
dengan pembelahan biner sederhana yaitu suatu proses aseksual. Morfologi bakteri
terdiri dari tiga bentuk, yaitu sferis (kokus), batang (basil) dan spiral. Ukuran
bakteri bervariasi tetapi pada umumnya berdiameter sekitar 0.5-1.0 μm dan panjang
1.5 - 2.5 μm (Pelczar & Chan, 2008).
Berdasarkan komposisi dinding selnya, bakteri dibagi menjadi dua golongan:
mengandung lipid dengan konsentrasi rendah yaitu 1-4%, sementara itu pada
bakteri gram negatif dinding sel mengandung lipid sengan konsentrasi tinggi yaitu
11 – 22%, selain itu bakteri gram negatif mengandung lipoprotein, membran luar
fosfolipid, dan lipopilisakarida (Pelczar & Chan, 1986).
2.3.1 Teknik Pewarnaan Gram
Merupakan salah satu teknik pewarnaan differensial yang paling penting
dan paling luas digunakan untuk bakteri. Bakteri yang diwarnai dengan metode
Gram dibagi menjadi 2 kelompok yaitu bakteri Gram positif dan Gram Negatif.
Pada kelompok bakteri Gram positif dapat mempertahankan zat pewarna ungu
kristal dan tampak berwarna ungu tua. Sedangkan pada kelompok bakteri Gram
negatif akan terjadi kehilangan ungu kristal ketika dicuci dengan alkohol 96%, dan
sewaktu diberi warna merah safranin, tampak berwarna merah.
Tabel 2.3.1Tabel Pewarnaan Gram (Pelczar & Chan, 2008)
Larutan dan Urutan Penggunaannya
Reaksi yang terjadi pada Bakteri
Gram Positif Gram Negatif
1. Ungu kristal (UK) Sel berwarna ungu Sel berwarna ungu
Lanjutan Tabel 2.3.1
Klasifikasi Staphylococcus aureus adalah sebagai berikut:
Kingdom : Prokaryota
Spesies : Staphylococcus aureus (Handayani, 2015)
Staphylococcus merupakan bakteri kokus Gram positif, berdiameter 1 µm
(Pratiwi, 2008). Kokusnya tersusun tidak teratur. Bentuk seperti anggur yang tidak
teratur ini tampak bila bakteri ditumbuhkan pada medium padat, tetapi biasanya
terlihat seperti rantai pendek yang terdiri dari tiga atau empat sel (Parija, 2009).
Bakteri Staphylococcus aureus merupakan salah satu bakteri yang cukup kebal
diantara mikroorganisme lainnya, dan tahan pemanasan 60ºC selama 30 menit.
Bakteri ini memproduksi enteretoksin yang bersifat stabil terhadap pemanasan dan
tahan terhadap aktivitas pemecahan oleh enzim- enzim pencernaan. Selain
enterotoksin, bakteri ini juga memproduksi hemolisin, yaitu toksin yang dapat
merusak dan memecah sel-sel darah merah (Pratiwi, 2008). Suhu pertumbuhan
optimumnya adalah 35⁰C dengan pH optimum 7,4. Pertumbuhan terbaik pada
suasana aerob fakultatif (Ayunda R., 2015).
Bakteri S. aureus dapat menyerang seluruh tubuh. Bentuk klinisnya
Shock Syndrom (suatu keadaan yang ditandai dengan panas mendadak, diare, dan
shock), keracunan makanan, ensefalitis, endokarditis dan septisemia (Tim
Mikrobiologi, 2003).
2.4.2 Pseudomonas aeruginosa
Klasifikasi Pseudomonas aeruginosa adalah sebagai berikut:
Kingdom : Bacteria
Phylum : Proteobacteria
Class : Gamma Proteobacteria
Ordo : Pseudomonadales
Famili : Pseudomonadaceae
Genus : Pseudomonas
Spesies : Pseudomonas aeruginosa (Handayani, 2015)
Pseudomonas aeruginosa termasuk ke dalam kelompok bakteri Gram negatif,
berbentuk tungkai, berflagel, dapat tumbuh pada suhu antara 35-42ºC dan
merupakan salah satu spesies dari genus Pseudomonas yang dapat menimbulkan
penyakit pada manusia. Dinding selnya tersusun dari lipopolisakarida (LPS) yang
terdiri atas 2-keto-3-dioksi-asam oktanat (KDO) dan lipid (Tim Mikrobiologi,
2003). Infeksi bakteri Pseudomonas aeruginosa terjadi pada seseorang yang
mengalami gangguan pada sistem pertahanan tubuh. Oleh karena itu P. aeruginosa
disebut patogen oportunistik yaitu memanfaatkan kerusakan pada mekanisme
pertahanan inang untuk memulai suatu infeksi. Kelainan klinis yang ditimbulkan
antara lain: infeksi pada luka bakar, infeksi saluran kemih, endokarditis,
gastroenteritis, pneumonia dan lain-lain (Tim Mikrobiologi, 2003).
2.5 Mekanisme Antibakteri
Antibakteri adalah zat aktif yang memiliki efek menghambat atau mematikan
bakteri. Obat yang digunakan untuk antibakteri harus memiliki toksisitas selektif
setinggi mungkin, yaitu obat tersebut harus bersifat sangat toksik untuk mikroba
tetapi relatif tidak toksik pada hospes (Setiabudi, 2007). Berdasarkan mekanisme
kerjanya antibakteri dibagi ke dalam 5 kelompok (Setiabudi, 2007) yaitu:
Obat antibakteri seperti sulfonamida, trimetoprim, asam p-aminosalisilat
(PAS) dan sulfon merupakan antibakteri yang memiliki mekanisme kerja
mengganggu metabolisme bakteri.
b. Antibakteri yang menghambat sintesis dinding sel bakteri
Obat antibakteri yang termasuk ke dalam kelompok ini adalah penisilin,
sefalosporin, basitrasin, vankomisin dan sikloserin memiliki mekanisme kerja
menghambat sintesis dinding sel bakteri dengan cara menghambat reaksi
paling dini dalam proses dinding sel yang terdiri dari peptidoglikan dan
menghambat reaksi terakhir (transpeptidasi) dalam rangkaian reaksi tersebut.
c. Antibakteri yang mengganggu keutuhan membran sel bakteri
Kerusakan membran sel menyebabkan keluarnya berbagai komponen penting
dari dalam sel bakteri yaitu protein, asam nukleat, nukleotida dan lain-lain.
Obat yang termasuk ke dalam kelompok ini adalah polimiksin, golongan
polien, serta berbagai antibakteri kemoterapeutik.
d. Antibakteri yang menghambat proses sintesis protein sel bakteri
Golongan obatnya adalah golongan aminoglikosida, makrolida, linkosamida,
tertasiklin dan kloramfenikol. Sistesis protein berlangsung di ribosom dengan
bantuan tRNA dan mRNA. Pada bakteri ribosom terdiri dari dua unit
(30S-50S).
e. Antibakteri yang menghambat sintesis asam nukleat sel bakteri
Antibakeri akan berikatan dengan enzim polimerase RNA (pada sub unit)
sehingga menghambat sintesis RNA dan DNA oleh enzim tersebut. Antibakteri
yang termasuk dalam kelompok ini adalah rifampisin dan golongan kuinolon.
2.6 Uji Aktivitas Antibakteri (Pratiwi, 2008) 2.6.1 Metode Difusi
Metode difusi sering digunakan untuk uji antimikroba yang rentan terhadap
senyawa murni, senyawa polar ataupun non polar.
2.6.1.1 Disc Diffusion Methode (Tes Kirby & Bauer)
Metode ini untuk menentukan aktivitas agen antimikroba. Piringan yang
berisi agen antimikroba diletakkan pada media agar yang telah ditanami
mengindikasikan adanya hambatan pertumbuhan mikroorganisme oleh agen
antimikroba pada permukaan media agar.
2.6.2 Metode Dilusi
Metode ini memiliki kemampuan untuk mengukur Konsentrasi Hambat
Minimum (KHM) dan Konsentrasi Bunuh Minimum (KBM) (Pratiwi, 2008).
Terdapat dua jenis metode dilusi yaitu agar dan pengenceran tabung (Choma dan
Grzelak, 2010). Membedakan metode dilusi cair (serial dilution) dan dilusi padat
yaitu pada dilusi cair, dibuat seri pengenceran agen antimikroba pada medium cair
yang ditambahkan dengan mikroba uji. Larutan uji agen antimikroba pada kadar
terkecil yang terlihat jernih tanpa adanya pertumbuhan mikroba uji ditetapkan
sebagai KHM. Larutan yang ditetapkan sebagai KHM dikultur ulang tanpa
penambahan mikroba uji ataupun agen antimikroba, dan diinkubasi selama 18-24
jam. Medium cair yang terlihat tetap jernih setelah diinkubasi ditetapkan sebagai
(KBM) (Pratiwi, 2008). Metode dilusi padat serupa dengan metode dilusi cair tapi
menggunakan medium padat (solid). Keuntungan metode ini adalah satu
konsentrasi agen antimikroba yang diuji dapat digunakan untuk menguji beberapa
mikroba uji (Pratiwi, 2008).
2.7Antibakteri Pembanding
Karakteristik kloramfenikol digunakan sebagai antibakteri pembanding
adalah sebagai berikut (Farmakope Indonesia, 1995) :
1. Rumus bangun
Gambar 2.7 Rumus Bangun Kloramfenikol
Sumber: (Tjahjono DH dkk., 2004)
2. Rumus kimia: C12H12Cl2N2O5
3. Pemerian: hablur halus berbentuk jarum atau lempeng memanjang; putih
hingga putih kelabu atau putih kekuningan; larutan praktis netral terhadap
4. Kelarutan: sukar larut dalam air; mudah larut dalam etanol, dalam propilen
glikol, dalam aseton dan dalam etil asetat.
5. Penyimpanan : dalam wadah tertutup rapat.
Kloramfenikol merupakan sediaan bakteriostatik alamiah berspektrum luas
golongan amphenicol, yang berasal dari jamur Streptomyces venezuelae dan
sekarang telah dapat dibuat secara sintetik di laboratorium. Kloramfenikol bersifat
bakteriostatik terhadap hampir semua bakteri Gram positif dan sejumlah bakteri
Gram negatif, namun pada konsentrasi tinggi dapat bersifat bakterisidal terhadap
bakteri-bakteri tertentu (Ganiswarna, 1995). Kloramfenikol dipakai untuk
pengobatan demam tifoid, infeksi Salmonella atau infeksi lain, dan meningitis yang
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Januari sampai bulan Juli 2016 di
Laboratorium Farmakognosi & Fitokimia dan Laboratorium Steril, UIN Syarif
Hidayatullah Jakarta.
3.2 Alat dan Bahan 3.2.1 Alat
Alat-alat yang digunakan dalam penelitian ini antara lain : Laminar Air Flow
(minihelix II), cawan petri bulat (pyrex), gelas ukur (Pyrex), labu Erlenmeyer
(Pyrex), beaker glass (Pyrex),tabung reaksi (Pyrex), jarum ose, pinset, pipet mikro
(Socorex), tip biru, tip kuning, tip putih, spatula, jangka sorong (Tricle), kaca objek,
cover glass, kertas label, paper disk 6 mm (Oxoid), autoklaf digital (ALP), vortex
(Thermolyne), hot plate (Thermo Scientific), magnetik stirrer (Heidolph),
mikroskop(Olympus), inkubator (Memmert), oven (Memmert), sentrifugasi
(Peqlab), spektrofotometer UV-VIS, pembakar spiritus, timbangan analitik (AND),
alumunium foil, plastic wrap dan alat-alat lain yang biasa digunakan di
laboratorium mikrobiologi.
3.2.2 Bahan
3.2.2.1 Sampel Tanaman
Bahan yang digunakan dalam penelitian adalah daun tanaman Iler (Coleus
atropurpureus Benth.) yang dipetik bagian ujung batang (daun muda) diberi kode
DIM, bagian tengah batang (daun sedang) diberi kode DIS, dan bagian pangkal
batang (daun tua) diberi kode DIT. Tanaman Iler diperoleh dari Balittro, Bogor dan
telah dilakukan determinasi di Pusat Konservasi Tumbuhan Kebun Raya, LIPI
3.2.2.2 Media Pertumbuhan Mikroba
a. Medium yang digunakan untuk isolasi dan pemurnian isolat kapang endofit
yaitu: Potato Dextrose Agar (PDA) (Merck).
b. Medium yang digunakan untuk kultivasi dan fermentasi isolat kapang endofit
yaitu: Potato Dextrose Yeast (PDY).
c. Medium yang digunakan untuk kultur dan pertumbuhan bakteri yaitu: Nutrient
Agar (NA) (Merck).
d. Medium yang digunakan untuk seleksi kapang endofit dan yaitu: uji aktivitas
antibakteri yaitu: Mueller Hinton Agar (MHA) (Oxoid).
3.2.2.3 Bahan untuk Sterilisasi Permukaan
Air mengalir, larutan natrium hipoklorit (NaOCl) 5,25% (Baycline), etanol
70%, dan akuades steril.
3.2.2.4Bahan Uji Aktivitas Antibakteri
a. Bakteri uji: Bakteri Staphylococcus aureus ATCC 25923 (Gram positif) dan
Pseudomonas aeruginosa ATCC 27853(Gram negatif).
b. Bahan pewarnaan Gram : Kristal Violet 0,5%, cairan lugol, etanol 96%,
safranin.
c. Antibiotik: Kloramfenikol.
d. Bahan pengenceran inokulum: NaCl 0,9%.
3.3 Prosedur Penelitian
3.3.1 Sterilisasi Alat dan Bahan (Kharisma, 2012)
Alat-alat yang tidak tahan pemanasan dengan suhu tinggi seperti erlenmeyer,
tabung reaksi bertutup, gelas ukur dan media pertumbuhan dilakukan sterilisasi
dengan menggunakan autoklaf pada suhu 121°C selama 15 menit. Alat-alat yang
terbuat dari gelas seperti cawan petri, beaker glass dan alat gelas lainnya yang tidak
presisi disterilkan menggunakan oven pada suhu 160°C-170°C selama 1-2 jam,
sementara itu alat-alat logam dapat disterilkan dengan cara dipijarkan
menggunakan api spirtus (Kumar, 2012).
3.3.2.1 Potato Dextrose Agar (PDA)
Berdasarkan prosedur yang tertera pada kemasan media PDA (Merck),
ditimbang PDA sebanyak 39 g kemudian ditambahkan 1000 mL akuades, lalu
dihomogenkan dengan menggunakan magnetik stirer dan dipanaskan diatas hot
plate. Media disterilisasi dalam autoklaf selama 15 menit dengan suhu 121°C,
tekanan 1 atm. Media dituang secara aseptis ke dalam cawan petri steril
masing-masing cawan ± 10 mL dan dibiarkan hingga memadat.
3.3.2.2 Potato Dextrose Agar (PDA)Agar Miring
Media PDA agar miring dibuat dengan cara timbang sebanyak 39 g PDA
(Merck) kemudian ditambahkan 1000 mL akuades, lalu dihomogenkan dengan
menggunakan magnetik stirer dan dipanaskan diatas hot plate. Campuran media
tersebut dimasukkan secara aseptis ke dalam tabung reaksi masing-masing
sebanyak 5 mL lalu disterilisasi dalam autoklaf pada suhu 121°C, tekanan 1 atm
selama 15 menit, tabung reaksi tersebut diletakkan dalam posisi miring ± 45° dan
agar dibiarkan hingga memadat (Jauhari, 2010).
3.3.2.3. Nutrient Agar (NA)
Berdasarkan prosedur yang tertera pada kemasan media NA (Merck) dibuat
dengan cara bubuk NA sebanyak 20 g dilarutkan dengan 1000 mL akuades. Media
tersebut dicampur hingga homogen dengan cara pengadukan dan pemanasan
dengan hot plate dan stirer. Campuran media tersebut disterilisasi dalam autoklaf
pada suhu 121°C, tekanan 1 atm selama 15 menit. Media dituang secara aseptis ke
dalam cawan petri steril masing-masing 10 mL dan biarkan hingga memadat.
3.3.2.4 Nutrient Agar (NA) Agar Miring
Media NA agar miring dibuat dengan cara timbang sebanyak 20 g NA (Merck)
dilarutkan dengan 1000 mL akuades. Media tersebut dicampur hingga homogen
menggunakan magnetic stirer dan pemanasan di atas hot plate. Campuran media
dimasukkan secara aseptis ke dalam tabung reaksi masing-masing sebanyak 5 mL
lalu disterilisasi dalam autoklaf pada suhu 121°C, tekanan 1 atm selama 15 menit,
tabung reaksi tersebut diletakkan dalam posisi miring ± 45° dan dibiarkan hingga
3.3.2.5 Potato Dextrose Yeast (PDY)
Media PDY dibuat dengan cara ditimbang sebanyak 200 g kentang yang telah
dikupas dan dibersihkan, ditambahkan 500 mL akuades, kemudian dipanaskan
hingga mendidih sekitar 15 menit. Ekstrak kentang disaring, kemudian
ditambahkan Dextrose sebanyak 22 g dan Yeast Extract 4,4 g, campuran diaduk
hingga homogen. Setelah larutan dingin ditambahkan akuades sampai 1000 mL.
Selanjutnya media PDY dimasukkan ke dalam botol fermentasi sebanyak 250 mL
kemudian disterilisasi dengan autoklaf pada suhu 121ºC selama 15 menit
(Maryanti, 2015).
3.3.2.6 Mueller Hinton Agar (MHA)
Pembuatan media MHA (Oxoid) dibuat dengan cara ditimbang sebanyak 37
g bubuk MHA, ditambahkan 1000 mL akuades, kemudian dihomogenkan dengan
menggunakan magnetik stirer dan dipanaskan di atas hot plate. Media disterilisasi
menggunakan autoklaf pada suhu 121ºC selama 15 menit (Suciatmih, 2008).
3.3.3 Sterilisasi Permukaan dan Isolasi Kapang Endofit
Sterilisasi permukaan dilakukan denagn cara daun tanaman Iler (Coleus
atropurpureus Benth.) diambil pada bagian tertentu, yaitu bagian daun yang
terletak pada ujung batang (daun muda) dengan kode DIM, tengah batang (daun
sedang) dengan kode DIS, dan pangkal batang (daun tua) dengan kode DIT dicuci
bersih menggunakan air mengalir, selanjutnya direndam dalam etanol 70% selama
1 menit dilanjutkan dalam larutan natrium hipoklorit 5.25% selama 5 menit dan
direndam kembali dengan etanol 70% selama 30 detik, dan sampel daun dibilas
menggunakan akuades steril selama 1 menit untuk menghilangkan sisa agen
sterilisasi permukaan. Daun Iler yang sudah disterilisasi kemudian diletakkan di
atas kertas saring steril hingga kering (Kalyanasundaram dkk, 2015). Daun
Selanjutnya dipotong dengan ukuran 1x1 cm2 menggunakan gunting steril
(Wahyudi P. & Hendriana M., 2003). Proses isolasi kapang endofit dilakukan
dengan cara potongan daun dengan ukuran 1x1 cm2 yang sudah steril ditanam di
atas permukaan media PDA steril di dalam cawan petri. Media yang telah ditanami
dengan sampel daun selanjutnya diinkubasi pada suhu ruang (27-29⁰C) selama 5
yang diberi kapur barus untuk menghindari kontaminasi serangga kecil. Skema cara
kerja sterilisasi permukaan dan isolasi kapang endofit dapat dilihat pada lampiran
3.
3.3.4 Pemurnian Isolat Kapang Endofit
Pemurnian dilakukan berdasarkan penampakan morfologi secara
makroskopis yang meliputi warna dan bentuk koloni (Ariyono, 2014). Kapang
endofit yang tumbuh pada medium PDA hasil isolasi kemudian dimurnikan dengan
cara kapang diinokulasikan dengan menggunakan ose dan diletakan pada medium
PDA yang baru. Isolat kapang endofit selanjutnya diinkubasi pada suhu ruang
(27-29⁰C) selama 5-7 (Noverita dkk., 2009). Pemurnian isolat kapang endofit dibuat
duplo pada agar miring sebagai stock culture dan working culture (Handayani,
2015). Skema cara kerja pemurnian kapang endofit dapat dilihat pada lampiran 4.
3.3.5 Identifikasi Isolat Kapang Endofit
Karakteristik morfologi isolat kapang endofit dilakukan dengan cara isolat
kapang endofit diremajakan pada media PDA, selanjutnya diinkubasi pada suhu
ruang selama 7 hari. Isolat kapang endofit kemudian diamati secara makroskopis
untuk mengetahui karakteristik morfologi isolat kapang endofit yang meliputi;
diameter, permukaan koloni, terbentuknya zonasi, dan warna miselium (Srikandace
dkk, 2007).
Pengamatan morfologi secara mikroskopis pada kapang endofit dilakukan
dengan cara membuat preparat terlebih dahulu untuk dilakukan pengamatan
menggunakan mikroskop cahaya. Cara pembuatan preparat sebagai berikut:
1. Inokulum kapang pada media agar diambil dari cawan petri dengan
menggunakan jarum ose.
2. Inokulum kapang tersebut diletakkan di atas kaca objek steril yang sudah
diteteskan dengan media PDA.
3. Kaca objek ditutup dengan cover glass kemudian ditekan secara perlahan.
4. Preparat ditetesi dengan alkohol 96%, lalu ditetesi dengan methylene blue
sebanyak 1 tetes. Morfologi kapang yang diamati meliputi; bentuk hifa, konidia,
5. Isolat kapang diamati dengan menggunakan mikroskop cahaya dengan
perbesaran 100x, 200x, dan 400x (Hafsari & Asterina, 2012). Skema cara kerja
identifikasi isolat kapang endofit secara mikroskopik dapat dilihat pada lampiran
5.
3.3.6 Peremajaan Bakteri Uji
Peremajaan bakteri uji dilakukan dengan mengambil bakteri dari stok bakteri
dalam media agar miring NA (Nutrient Agar) lalu diremajakan kembali pada media
agar miring NA yang baru dengan cara menggoreskan masing-masing bakteri uji
menggunakan ose yang telah disterilkan dengan cara ose dipijarkan pada api
bunsen. Bakteri yang sudah digoreskan pada media agar miring NA yang baru
kemudian diinkubasi pada suhu 37ºC selama 24 jam (Atikah, 2013). Pengerjaan
dilakukan secara steril di dalam Laminar Air Flow (Jauhari, 2010).
3.3.7Identifikasi Bakteri Uji
Identifikasi bakteri uji dilakukan secara makroskopik dan mikroskopik pada
bakteri uji yang berusia 24 jam (Atikah, 2013).
3.3.7.1 Identifikasi Makroskopik
Identifikasi makroskopik dilakukan dengan cara mengamati morfologi dan
pertumbuhan koloni yang meliputi; warna koloni, bentuk koloni, dan permukaan
koloni (Rustanti, 2007).
3.3.7.2 Identifikasi Mikroskopik
Identifikasi Mikroskopik dilakukan dengan pewarnaan Gram. Bakteri uji
diambil sebanyak satu ose kemudian diletakkan di atas kaca objek yang telah
ditetesi sedikit dengan NaCl 0,9%. Bakteri disebar pada kaca objek dengan
menggunakan ose bulat kemudian difiksasi dengan cara melewatkan preparat
tersebut di atas api bunsen. Larutan kristal violet diteteskan di atas preparat dan
biarkan 1 menit, kemudian preparat dibilas dengan air mengalir. preparat kemudian
ditetesi dengan cairan lugol dan dibiarkan selama 45-60 detik, kemudian dibilas
dengan air mengalir. Preparat selanjutnya diteteskan dengan alkohol 96% dan
digoyang-goyangkan selama 30 detik dan dibilas menggunakan air mengalir.
Preparat dibilas kembali menggunakan air mengalir dan dilakukan pengamatan
dibawah mikroskop dengan perbesaran 100 kali (Rachmayani, 2008).
3.3.8 Seleksi Isolat Kapang Endofit Penghasil Antibakteri
Seleksi kapang endofit yang berpotensi sebagai antibakteri dilakukan
dengan metode difusi agar padat (Diffusion Agar Plate Methode). Isolat murni
kapang endofit yang telah dimurnikan pada media Potato Dextrose Agar (PDA)
usia 14 hari diambil dengan sedotan steril atau Cork borer berdiameter 6 mm dan
dipindahkan ke media MHA yang telah berisi bakteri uji. Bakteri uji yang digunakan
yaitu Staphylococcus aureus ATCC 25923 dan Pseudomonas aeruginosa ATCC
27853. Satu cawan petri media MHA yang berisi bakteri uji dapat ditanami
potongan isolat murni kapang endofit sebanyak 6 isolat. Kultur di inkubasi pada
suhu 37⁰C selama 2 hari. Aktivitas antibakteri kapang endofit dilihat dari zona
hambat yang terbentuk (Elfina dkk., 2014). Isolat yang menunjukkan zona hambat
dipilih sebagai isolat untuk proses tahap selanjutnya yaitu kultivasi isolat kapang
endofit dan fermentasi isolat kapang Endofit. Skema cara kerja seleksi kapang
endofit dapat dilihat pada lampiran 7.
3.3.9 Kultivasi Isolat Kapang Endofit
Kultivasi dilakukan terhadap isolat kapang endofit yang berpotensi sebagai
antibakteri. Isolat kapang yang terpilih yang telah dikultur dalam medium PDA
selama 7 hari diambil menggunakan sedotan steril atau cork borer dengan diameter
6 mm sebanyak tiga potongan bentuk bulat, selanjutnya bulatan agar yang
mengandung isolat kapang endofit diambil menggunakan jarum ose dan
dimasukkan ke dalam 250 mL media PDY cair pada labu erlenmeyer 1000 mL
dengan kultur diam (statis) pada suhu ruang (27-29⁰C) selama 26 hari. Kultur dalam
media PDY dilakukan pencuplikan bagian media sebanyak 7 mL setiap 2 hari sekali
dan dilakukan pengocokan secara manual setiap akan dicuplik. Volume yang
dicuplik diganti dengan medium baru dalam jumlah yang sama, selanjutnya volume
yang dicuplik nilai absorbansinya diukur menggunakan Spekrofotometer UV-VIS
pada panjang gelombang 620 nm untuk mengetahui pertumbuhan isolat kapang
endofit (Srikandace dkk., 2007 dengan modifikasi; Jauhari, 2010). Data yang
absorbansi terhadap waktu pengambilan sampel sehingga diketahui fase stasioner
masing-masing isolat kapang endofit. Skema cara kerja kultivasi kapang endofit
dapat dilihat pada lampiran 8.
3.3.10 Fermentasi Isolat Kapang Endofit
Metabolit sekunder yang dihasilkan oleh kapang endofit dapat diperoleh
melalui suatu proses fermentasi, menggunakan media Potato Dextrose Yeast (PDY)
cair. Koloni kapang endofit yang telah dikultur dalam media PDA selama 7 hari,
diambil menggunakan sedotan steril atau cork borer dengan diameter 6 mm
sebanyak tiga potongan bentuk bulat, selanjutnya bulatan agar yang mengandung
isolat kapang endofit diambil menggunakan jarum ose dan diinokulasikan ke dalam
250 mL media PDY cair dalam botol kaca. Kultur tersebut diinkubasi dengan
metode statis (Kumala dkk., 2006b dengan modifikasi) selama 26 hari pada suhu
ruang (27-29⁰C) dan metabolit sekunder siap dipanen. Skema cara kerja proses
fermentasi dapat dilihat pada lampiran 9.
3.3.11 Ekstraksi Hasil Fermentasi Kapang Endofit
Hasil fermentasi kapang endofit dipisahkan menjadi dua bagian yaitu
biomassa dan supernatan untuk diekstraksi secara terpisah. Supernatan dan
biomassa dipisahkan dengan cara disaring menggunakan kertas saring. Bagian
supernatan yang telah diperoleh dibagi menjadi dua bagian yaitu bagian A dan
bagian B. Bagian A (sebagai fase air) dan bagian B diekstraksi menggunakan
pelarut n-heksan dengan perbandingan 1:1 (Kharismaya, 2010) kemudian dipartisi
dalam corong pisah. Campuran tersebut didiamkan hingga terbentuk dua lapisan
(lapisan atas dan lapisan bawah). Lapisan atas (n-heksan) diambil sebagai fraksi B
(n-heksan) dan dipekatkan menggunakan rotary evaporator pada suhu 40-50⁰C
sampai terbentuk ekstrak kental. Lapisan bawah selanjutnya dipartisi kembali
menggunakan pelarut etil asetat dengan perbandingan 1:1 di dalam corong pisah.
Campuran tersebut didiamkan hingga terbentuk dua lapisan. Lapisan atas (etil
asetat) diambil sebagai fraksi C dan dipekatkan menggunakan rotary evaporator
pada suhu 40-50⁰C sampai terbentuk ekstrak kental (Nurhayati, 2012 dengan
Bagian Biomassa dihancurkan menggunakan lumpang dan alu yang
disemprotkan alkohol 70% terlebih dahulu, kemudian diekstraksi menggunakan
pelarut metanol. Penambahan metanol pada biomassa cukup hingga biomassa
terendam. Lalu diamkan kurang lebih selama 24 jam, rendaman biomassa
selanjutnya disaring untuk mendapatkan filtrat. Filtrat yang diperoleh sebagai fraksi
D. Jika filtrat yang diperoleh masih keruh dilakukan perendaman biomasaa kembali
menggunakan metanol sampai diperoleh filtrat yang bening. Fraksi D selanjutnya
diuapkan menggunakan rotary avaporator dengan suhu 40-50⁰C hingga diperoleh
ekstrak kental (Mpila dkk., 2012). Skema cara kerja ekstraksi senyawa metabolit
sekunder kapang endofit dapat dilihat pada lampiran 10.
3.3.12 Pembuatan Suspensi Bakteri Uji
Bakteri uji yang telah diremajakan diambil dengan kawat ose steril lalu
disuspensikan ke dalam tabung yang berisi 2 mL larutan NaCl 0,9% hingga
diperoleh kekeruhan yang sama dengan standar kekeruhan Mc. Farland 3 (10-9)
(Mpila dkk., 2012). Suspensi bakteri dengan standar kekeruhan (10-9) selanjutnya
diencerkan dengan cara diambil sebanyak 1 mL dan dimasukkan pada tabung reaksi
yang berisi 9 mL NaCl 0,9% steril. Pengenceran suspensi bakteri dilakukan sampai
diperoleh standar kekeruhan bakteri (10-6). Skema cara kerja pembuatan suspensi
bakteri dapat dilihat pada lampiran 11.
3.3.13 Uji Aktivitas Antibakteri
Uji aktivitas antibakteri dilakukan menggunakan metode difusi cakram.
Suspensi bakteri uji diambil sebanyak 1 mL, lalu tuang pada permukaan cawan petri
steril setelah itu tuangkan media MHA yang masih cair dengan suhu 45-50⁰C
(metode pour plate). Campuran antara media dengan suspensi bakteri uji
digoyangkan dengan cara diputar ke kanan dan ke kiri dengan tujuan diperoleh
biakan bakteri yang merata pada agar. Kultur didiamkan sampai memadat.
Ekstrak uji kapang endofit dari masing-masing fraksi dibuat konsentrasi 1000
ppm. Konsentrasi dibuat dengan cara ekstrak kapang endofit masing-masing isolat
ditimbang sebanyak 50 mg, selanjutnya dilarutkan dengan pelarut dari
masing-masing fraksi sebanyak 5 mL dan diperoleh konsentrasi 10.000 ppm (larutan
cara diambil sebanyak 0,5 mL lalu dimasukkan pada vial kosong dengan volume
6-7 mL, kemudian tambahkan pelarut masing-masing hingga mencapai volume 5 mL.
Pemambahan larutan dilakaukan menggunakan mikropipet. Larutan uji konsentrasi
1000 ppm masing-masing isolat diserapkan sebanyak 20 µL pada kertas cakram
kosong steril. Kontrol positif yang digunakan adalah cakram kloramfenikol dan
kontrol negatifnya adalah pelarut dari fraksi ekstrak yang digunakan. Cakram
didiamkan sampai kering, selanjutnya kertas cakram diletakkan pada permukaan
media uji yang sudah mengandung bakteri. Tahap selanjutnya cawan petri yang
sudah berisi larutan uji, kontrol positif, dan kontrol negatif diinkubasi selama 24
jam pada suhu 37⁰C. Dilakukan mengamatan zona hambat yang terbentuk dan
dilanjutkan dengan mengukur diameter zona hambat yang terbentuk menggunakan
jangka sorong (Atika, 2007). Skema cara kerja uji aktivitas antibakteri dapat dilihat
BAB IV
HASIL DAN PEMBAHASAN
4.1 Determinasi Tanaman Iler
Dalam penelitian ini dilakukan determinasi tanaman yang digunakan untuk
penelitian isolasi kapang endofit. Determinasi tanaman bertujuan untuk
memastikan kebenaran tanaman yang digunakan untuk penelitian. Hasil identifikasi
terhadap tanaman Iler (Coleus atropurpureus Benth.) yang dilakukan di Pusat
Konservasi Tumbuhan Kebun Raya, LIPI Bogor, pada tanggal 16 Desember 2015
menunjukkan bahwa sampel yang digunakan adalah tanaman Iler (Coleus
atropurpureus Benth.). Hasil determinasi dapat dilihat pada lampiran 1.
4.2 Isolasi dan Pemurnian Kapang Endofit
Sampel yang digunakan sebagai sumber isolat kapang endofit berasal dari
bagian daun tanaman Iler yang diperoleh dari Balittro, Bogor. Daun Iler yang
digunakan yaitu daun muda (DIM), sedang (DIS), dan daun tua (DIT). Pemilihan
berdasarkan letak daun yang diambil, yaitu daun yang berada diujung batang (daun
muda), daun yang berada di bagian tengah batang (daun sedang), dan daun yang
berada di pangkal batang (daun tua). Daun yang telah dipetik dicuci dengan air
mengalir hingga bersih untuk menghilangkan kotoran yang menempel pada
permukaan daun, lalu dilakukan sterilisasi permukaan untuk menghindari
kontaminan atau adanya pertumbuhan dari kapang lain yang bukan berasal dari
daun tanaman Iler, sehingga diperoleh isolat kapang endofit yang berasal dari daun
tanaman Iler.
Sterilisasi permukaan dilakukan dengan cara bagian daun dari tanaman Iler
(Coleus atropurpureus Benth.) dicuci bersih menggunakan air mengalir,
selanjutnya direndam dalam etanol 70% selama 1 menit dilanjutkan dengan larutan
natrium hipoklorit 5.25% selama 5 menit dan direndam kembali dengan etanol 70%
selama 30 detik, dan yang terakhir sampel dibilas menggunakan akuades steril
selama 1 menit untuk menghilangkan sisa agen sterilisasi permukaan. Daun
kemudian diletakkan di atas kertas saring steril hingga kering (Kalyanasundaram
Alkohol 70% memiliki mekanisme kerja mendenaturasi protein dan
melarutkan lemak pada membran protein mikroba sehingga dapat merusak sel
mikroba, dan natrium hipoklorit merupakan zat kimia yang termasuk golongan
halogen yang akan melepaskan klor yang mampu merusak membran dan protein
mikroba (Pratiwi, 2008). Alkohol 70% dan Natrium hipoklorit 5.25% yang
digunakan bertujuan untuk dekontaminasi permukaan daun dan merupakan
kombinasi yang sesuai karena alkohol 70% mempunyai spektrum afinitas yang
relatif sempit sehingga perlu ditambahkan dengan natrium hipoklorit 5.25%.
Setelah proses dekontaminasi daun dilakukan pembilasan dengan menggunakan
akuades steril. Hal ini bertujuan untuk menghilangkan sisa alkohol 70% dan
Natrium hipoklorit 5.25% yang masih menempel pada daun Iler yang dapat
mengganggu pertumbuhan kapang endofit.
Daun yang sudah steril selanjutnya dipotong dengan ukuran 1x1 cm2
menggunakan pisau bedah steril, setiap 1 cawan petri yang berisi media PDA
ditanami dua potongan daun dengan posisi bersebrangan. Kultur kemudian
diinkubasi pada suhu ruang (27-29⁰C) selama 5-21 hari (Rustanti, 2007).
Media PDA merupakan media umum yang digunakan untuk menumbuhkan
kapang endofit sebagai media isolasi, dan media pemurnian kapang endofit. Media
PDA juga kaya akan nutrisi yang mudah dicerna sehingga memudahkan
pertumbuhan kapang endofit (Ariyono dkk., 2014). Kontrol yang digunakan adalah
akuades steril dari bilasan terakhir proses sterilisasi permukaan. Adanya kontrol
diperlukan untuk menguji keefektifan sterilisasi permukaan, jika tidak terdapat
pertumbuhan mikroba pada kontrol maka proses sterilisasi berlangsung sempurna
dan kapang yang diisolasi merupakan kapang endofit yang berasal dari tanaman Iler
(Coleus atropurpureus Benth.).
Setelah proses inkubasi, kapang endofit yang tumbuh pada sekitar daun
dimurnikan dengan menggunakan metode streak plate pada media PDA yang baru
untuk memperoleh biakan kapang endofit yang murni. Biakan kapang endofit
kemudian diinokulasikan ke media PDA miring di dalam tabung reaksi yang
digunakan sebagai stock culture dan working culture. Hasil isolasi diperoleh
DIS2A, DIT1A, DIT1B, dan DIT3A. Hasil isolasi kapang endofit dapat dilihat pada
lampiran 13.
4.3 Identifikasi Bakteri Uji
Bakteri uji yang digunakan pada penelitian diperoleh dari Laboratorium
Mikrobiologi IPB, Bogor. Untuk mengetahui kemurnian bakteri uji yang digunakan
setelah proses peremajaan kembali, maka dilakukan identifikasi secara
makroskopik dan mikroskopik. Identifikasi secara makroskopik dilakukan dengan
cara pengamatan warna koloni dan permukaan koloni bakteri. Identifikasi secara
mikroskopik dilakukan dengan pewarnaan Gram, pengamatan dilakukan di bawah
mikroskop dengan perbesaran 100x.
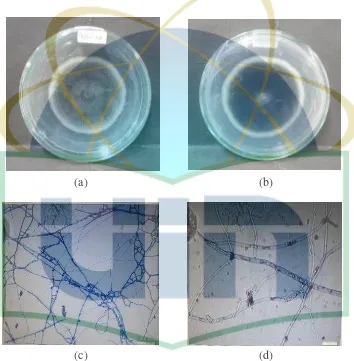
Tabel 4.3 Hasil Identifikasi Bakteri uji secara Makroskopik dan Mikroskopik
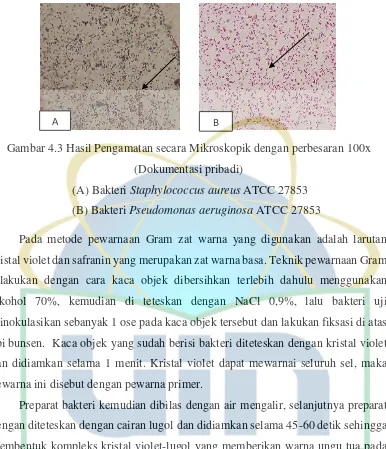
Gambar 4.3 Hasil Pengamatan secara Mikroskopik dengan perbesaran 100x
(Dokumentasi pribadi)
(A) Bakteri Staphylococcus aureus ATCC 27853
(B) Bakteri Pseudomonas aeruginosa ATCC 27853
Pada metode pewarnaan Gram zat warna yang digunakan adalah larutan
kristal violet dan safranin yang merupakan zat warna basa. Teknik pewarnaan Gram
dilakukan dengan cara kaca objek dibersihkan terlebih dahulu menggunakan
alkohol 70%, kemudian di teteskan dengan NaCl 0,9%, lalu bakteri uji
diinokulasikan sebanyak 1 ose pada kaca objek tersebut dan lakukan fiksasi di atas
api bunsen. Kaca objek yang sudah berisi bakteri diteteskan dengan kristal violet
dan didiamkan selama 1 menit. Kristal violet dapat mewarnai seluruh sel, maka
pewarna ini disebut dengan pewarna primer.
Preparat bakteri kemudian dibilas dengan air mengalir, selanjutnya preparat
dengan diteteskan dengan cairan lugol dan didiamkan selama 45-60 detik sehingga
membentuk kompleks kristal violet-lugol yang memberikan warna ungu tua pada
sel bakteri. Preparat selanjutnya dibilas kembali menggunakan air mengalir,
kemudian preparat ditetesi dengan alkohol 96% yang memiliki fungsi sebagai
decolorizing agent (senyawa peluntur warna) dan didiamkan selama 30 detik.
Alkohol 96% dapat menyebabkan pori-pori sel bakteri Gram positif menciut
sehingga ikatan komplek antara kristal violet-lugol yang terbentuk sebelumnya
tidak dapat keluar dari sel dan sel bakteri tetap berwarna ungu tua, Sedangkan pada
bakteri Gram negatif lapisan lipid pada dinding sel akan terekstraksi yang
menyebabkan kompleks kristal violet-lugol dapat keluar dari sel dan warna ungu
tua pada sel memudar. Preparat selanjutnya dibilas kembali menggunakan air
mengalir.
Preparat kemudian diwarnai dengan safranin dan didiamkan selama 1-2 menit
(Pelczar and Chan, 1986). Sel bakteri yang tetap berwarna ungu digolongkan ke
dalam bakteri Gram positif, dan sel bakteri yang berwarna merah digolongkan ke
dalam bakteri Gram negatif (Pratiwi, 2008).
Media NA merupakan media yang digunakan untuk membiakkan bakteri uji.
Media NA adalah media yang umum digunakan untuk membiakkan nonfastidious
mikroorganisme, yaitu mikroorganisme yang tidak membutuhkan nutrisi dan
kondisi khusus untuk tumbuh (Arulanantham dkk., 2012). Media NA mengandung
pepton, ekstrak daging, dan agar. Pepton merupakan sumber nitrogen organik
utama dan ekstrak daging mengandung sebstansi jaringan hewan yang dapat terlarut
dalam air (Pelczar and Chan, 1986), kedua komponen ini merupakan nutrisi untuk
pertumbuhan bakteri.
4.4 Seleksi Isolat Kapang Endofit Penghasil Antibakteri
Pada uji ini dilakukan skrining isolat kapang endofit yang memiliki aktivitas
antibakteri terhadap bakteri uji Staphylococcus aureus ATCC 27853 dan
Pseudomonas aeruginosa ATCC 27853. Data hasil uji seleksi kapang endofit dapat
dilihat pada tabel 4.4.
Tabel 4.4 Hasil Uji Seleksi Kapang Endofit