UIN SYARIF HIDAYATULLAH JAKARTA
ISOLASI DAN UJI AKTIVITAS ANTIBAKTERI
KAPANG ENDOFIT DARI DAUN TANAMAN BAKUNG
PUTIH (
Crinum asiaticum
L) TERHADAP
Staphylococcus
aureus, Bacillus subtilis, Escherichia coli
dan
Pseudomonas aeruginosa
SKRIPSI
O K I N
NIM : 1112102000107
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIBAKTERI ISOLAT KAPANG
ENDOFIT DARI DAUN TANAMAN BAKUNG PUTIH
(
Crinum asiaticum
L) TERHADAP
Staphylococcus aureus,
Bacillus subtilis, Escherichia coli
dan
Pseudomonas aeruginosa
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
O K I N
NIM : 1112102000107
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
Nama
Uji Aktivitas Antibakteri Isolat Kapang Endofit dari Daun Tanaman Bakung Putih (Crinum asiaticum L) terhadap Staphylococcus aureus, Bacillus subtilis, Escherichia coli
dan Pseudomonas aeruginosa
Crinum asiaticum L adalah kelompok tanaman tropis dan subtropis yang tersebar
di beberapa bagian negara di dunia, terutama di Afrika, Asia, Australia, Amerika dan Indonesia yang diikenal dengan Bakung putih. Berdasarkan hasil penelitian sebelumnya ekstrak etanol daun tanaman Crinum asiaticum L memiliki aktivitas antibakteri terhadap beberapa bakteri penyebab jerawat diantaranya
Propionibacterium acnes, Staphylococcus aureus dan Staphylococcus
epidermidis. Metode yang digunakan dalam penelitian ini adalah isolasi kapang
endofit, pemurnian kapang endofit, seleksi kapang endofit, karakterisasi kapang endofit, identifikasi bakteri uji, fermentasi kapang endofit dan uji aktivitas ekstrak kapang endofit sebagai antibakteri. Kapang endofit berhasil diisolasi sebanyak 7 (tujuh) isolat. Fermentasi dilakukan selama 21 hari pada suhu ruang dengan metode statis. Bakteri uji yang digunakan yaitu bakteri Gram negatif (Escherichia
coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853) dan bakteri Gram
positif (Staphylococcus aureus ATCC 25923, Bacillus subtilis ATCC 6633). Aktivitas antibakteri ekstrak kapang endofit (1 mg/ml) diuji terhadap empat bakteri standar dengan metode difusi cakram menggunakan Kloramfenikol (30 ug/cakram) sebagai kontrol positif. Hasil uji aktivitas antibakteri menunjukkan ekstrak kapang endofit dari daun tanaman C. asiaticum aktif sebagai antibakteri. Aktivitas antibakteri paling tinggi ditunjukkan oleh ekstrak DU.3B.2 dan DU.2B.1 terhadap S. aureus dengan diameter zona hambat masing-masing 9,20 mm dan 9,10 mm.
Name
Antibacterial Activity Test Isolates from Endophytic Fungus Plant Leaves Crinum Lily (Crinum asiaticum L) against Staphylococcus aureus, Bacillus subtilis,
Escherichia coli and Pseudomonas aeruginosa
Crinum asiaticum L is a group of tropical and subtropical plants are scattered in
many parts of the world, especially in Africa, Asia, Australia, America and Indonesia, known as Bakung putih. Based on the results of previous studies
Crinum asiaticum ethanol extract has antibacterial activity against several bacteria
that cause acne including Propionibacterium acnes, Staphylococcus aureus and
Staphylococcus epidermidis. The method used in this experiment were isolation,
purification, selection, characterization and examine their antibacterial activity of endophytic fungi. A total of 7 isolates of endophytic fungi were obtained from
Crinum asiaticum leaf. Fermentation of endophytic fungi have done for 21 days
with static methods. Gram-negative organisms (Escherichia coli ATCC 25922,
Pseudomonas aeruginosa ATCC 27853) and Gram-positive organisms
Staphylococcus aureus ATCC 25923, Bacillus subtilis ATCC 6633) were used as
test organisms. The antibacterial activity of the extract (1mg/ml) was tested four standard strains of microorganisms by disc diffusion method and Chloramphenicol (30 µg/disc) as standard antibiotic disc. Antibacterial potentials was investigated by measuring the zone of inhibition produced after incubation at
Mueller Hinton Agar (MHA). The highest antibacterial activities were showed by
isolate DU.3B.2 and DU.2B.1 against bacteria Staphylococcus aureus that is respectively 9.20 mm and 9.10 mm.
Keywords: Endophytic fungi,disc diffusion, Crinum asiaticum L, antibacteria
Bismillahirrohmaanirrohiim
Alhamdulillah, puja dan puji syukur saya panjatkan atas kehadirat Allah SWT., yang senantiasa memberikan Rahmat dan Karunia-Nya kepada penulis sehingga penulis dapat menjalankan proses penelitian ini dengan judul Uji Aktivitas Antibakteri Isolat Kapang Endofit dari Daun Tanaman Bakung
Putih (Crinum asiaticum L) terhadap Staphylococcus aureus, Bacillus subtilis,
Escherichia coli, dan Pseudomonas aeruginosa. Serta sholawat dan salam senantiasa tercurah kepada junjungan kita, Nabi Agung, makhluk paling mulia di muka bumi, Muhammad SAW. Penulisan Skripsi ini disusun dan dibuat dengan maksud sebagai salah satu persyaratan untuk menyelesaikan program Sarjana pada Program Studi Farmasi Fakultas Kedokteran Dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta dengan harapan mendapatkan hasil yang baik dan dapat digunakan sebagaimana mestinya berupa referensi yang sah dan valid.
Proses penulisan Skripsi ini tidak terlepas dari berbagai pihak, khususnya para dosen yang sejak awal telah memberikan ilmu tanpa kata bosan kepada seluruh mahasiswa khususnya penulis sehingga pada saat penelitian dan penulisan sudah memiliki modal yang cukup baik. Untuk itu, dalam kesempatan ini penulis mengucapkan terima kasih kepada:
1. Kedua orang tuaku tercinta, Ibu Nurwasi’ah dan Azuar (alm), terima kasih atas nasihat, bimbingan, kasih sayang yang sejak kecil merawat dan membimbingku semoga aku bisa menjadi anak shaleh.
2. Prof. Dr. Arief Sumantri, SKM, M.Kes., selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Dr. Nurmeilis, M.Si., Apt selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
5. Kakak-kakak dan adik-adikku yang kusayang, Anang Parwin, Nopi, Lilis dan
Nursahim yang senantiasa mendo’akan dan selalu memberikan semangat
kepada penulis.
6. Seseorang yang tidak dapat saya tuliskan namanya yang memberikan kasih
sayang, dukungan dan do’a, semoga Allah SWT membalas kebaikannya.
7. Keluarga tercinta Asshof Santri Jadi Dokter Musi Banyuasin dan Kontrakan
Ceria “Brendi, Santo, Thantowi, Ghilman, Galih, Adia, Gunawan, Boy,
Irham, Ivan” yang memberikan semangat, kegembiraan dan kebersamaan kepada penulis dalam menuntut ilmu di tanah rantau.
8. Sahabat-sahabat seperjuangan penelitian kapang endofit 2012 Eha, Lilis, Dimut, Vano, Fadil, Wida, bung Adia-Gun, mba Zul atas bantuan, dukungan dan masukan kepada penulis selama melakukan berbagai tahap penelitian. 9. Serta semua pihak yang tidak dapat saya sebutkan satu persatu, semoga Allah
SWT membalas atas semua kebaikan dan dukungan kepada penulis. Dengan harapan semoga penelitian ini dapat bermanfaat bagi semua kalangan akademisi dan khususnya bagi mahasiswa Farmasi.
Penulis menyadari, sebagai manusia memiliki banyak keterbatasan kemampuan dan masih perlu banyak belajar dalam melakukan penelitian dan penulisan ini. Oleh sebab itu, penulis sangat mengharapkan adanya kritik, saran, dan masukan yang positif dan bersifat membangun dari berbagai pihak.
Jakarta, 18 Agustus 2016
DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
1.5 Hipotesis ... 3
BAB 2 TINJAUAN PUSTAKA 2.1 Crinum asiaticum L ... 4
2.1.1 Klasifikasi ... 4
2.1.2 Nama Daerah dan Nama Asing ... 5
2.1.3 Bagian Tanaman yang Dipakai... 5
2.1.4 Kandungan Kimia ... 5
2.1.5 Penyebaran... 7
2.1.6 Efek Farmakologis ... 8
2.1.7 Aktivitas Antimikroba ... 8
2.2 Mikroba ... 9
2.3.2 Karakterisasi Kapang ... 16
2.4 Metabolit Sekunder Kapang Endofit... 16
2.5 Pertumbuhan Bakteri ... 16
2.6 Mikroba Endofit ... 18
2.6.1 Definisi ... 18
2.6.2 Manfaat Mikroba Endofit ... 19
2.7 Bakteri Uji ... 20
2.7.1 Bakteri Gram Positif ... 20
2.7.2 Bakteri Gram Negatif ... 21
2.8 Antibakteri ... 22
2.8.1 Definisi ... 22
2.8.2 Aktivitas dan Efek Antibakteri ... 23
2.8.3 Mekanisme Kerja ... 24
2.9 Fermentasi ... 24
2.10 Uji Aktivitas Antibakteri ... 25
2.10.1 Metode Difusi Cakram ... 25
2.10.2 Metode Dilusi ... 25
BAB 3 METODE PENELITIAN 3.1 Waktu dan Lokasi Penelitian ... 27
3.2 Alat ... 27
3.3 Bahan ... 27
3.3.1 Tanaman Uji ... 27
3.3.2 Bahan Penelitian ... 27
3.3.3 Medium ... 28
3.3.4 Bakteri Uji ... 28
3.4 Sterilisasi Alat ... 28
3.5 Prosedur Penelitian ... 28
3.5.1 Pembuatan Media Pertumbuhan Mikroba ... 28
1. Pembuatan Media PDA (Potato Dextrose Agar) ... 28
2. Pembuatan Media PDA Miring ... 29
3. Pembuatan Media NA (Nutrient Agar) ... 29
4. Pembuatan Media NA Miring ... 29
5. Pembuatan Media NB (Nutrient Broth) ... 29
6. Pembuatan Media MHA (Mueller Hinton Agar) ... 30
7. Pembuatan Media PDY Broth (Potato Dextrose Yeast Broth)... 30
3.5.2 Isolasi Kapang Endofit ... 30
3.5.2.1 Sterilisasi Permukaan ... 30
3.5.2.2 Pemurnian Kapang Endofit ... 31
3.5.4 Kurva Pertumbuhan Kapang ... 32
3.5.5 Fermentasi ... 33
3.5.6 Ekstraksi Hasil Fermentasi ... 33
3.5.7 Peremajaan Bakteri Uji ... 34
3.5.8 Pembuatan Suspensi Bakteri Uji ... 34
3.5.9 Uji Aktivitas Antibakteri ... 35
BAB 4 HASIL DAN PEMBAHASAN 4.1Determinasi Tanaman ... 36
4.2Isolasi dan Pemurnian Kapang Endofit ... 36
4.2.1 Isolasi Kapang Endofit ... 36
4.2.2 Karakterisasi Isolat Kapang Endofit ... 38
4.3Seleksi Kapang Endofit yang Berpotensi sebagai Antibakteri ... 45
4.4Kurva Pertumbuhan Kapang Endofit ... 47
4.5Fermentasi dan Ekstraksi Kapang Endofit ... 49
4.5.1 Fermentasi ... 49
4.5.2 Ekstraksi Hasil Fermentasi ... 50
4.6Karakterisasi Bakteri Uji ... 51
4.7Uji Aktivitas Antibakteri ... 53
BAB 5 KESIMPULAN DAN SARAN 5.1Kesimpulan ... 57
5.2Saran ... 57
DAFTAR PUSTAKA ... 58
DAFTAR GAMBAR
Halaman
Gambar 1. Tanaman Crinum asiaticum L ... 5
Gambar 2. Struktur Senyawa Hasil Identifikas Ekstrak Etanol... Crinum asiaticum L ... 6
Gambar 3. Struktur Senyawa Crinamin ... 7
Gambar 4. Bentuk Morfologi dari Bakteri ... 10
Gambar 5. Bagian-bagian Tubuh Bakteri ... 11
Gambar 6. Kurva Pertumbuhan Bakteri ... 18
Gambar 7. Bagian Daun Crinum asiaticum L yang diambil ... 37
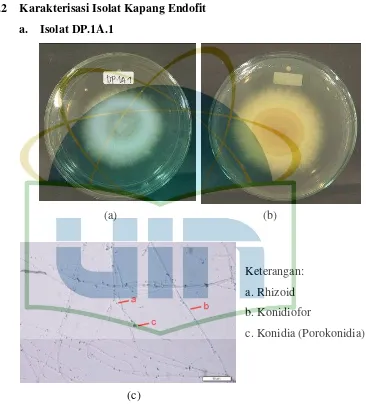
Gambar 8. Pengamatan Makroskopik dan Mikroskopik Isolat DP.1A.1 ... 38
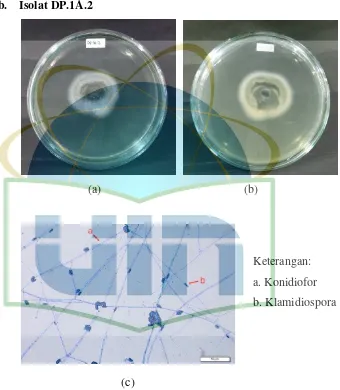
Gambar 9. Pengamatan Makroskopik dan Mikroskopik Isolat DP.1A.2 ... 39
Gambar 10. Pengamatan Makroskopik dan Mikroskopik Isolat DU.2B.1 ... 40
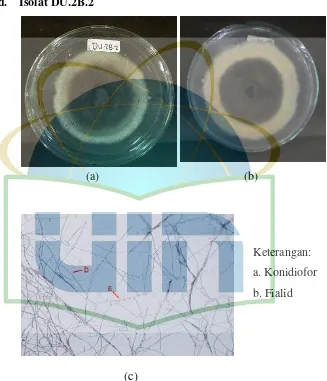
Gambar 11. Pengamatan Makroskopik dan Mikroskopik Isolat DU.2B.2 ... 41
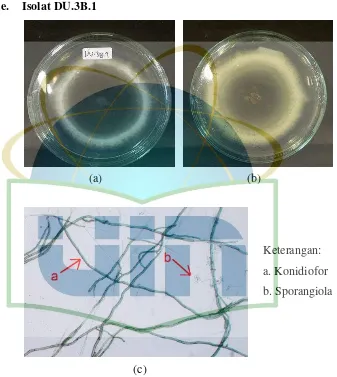
Gambar 12. Pengamatan Makroskopik dan Mikroskopik Isolat DU.3B.1 ... 42
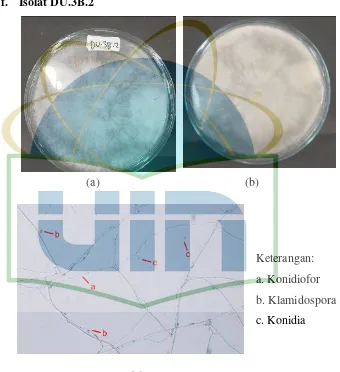
Gambar 13. Pengamatan Makroskopik dan Mikroskopik Isolat DU.3B.2 ... 43
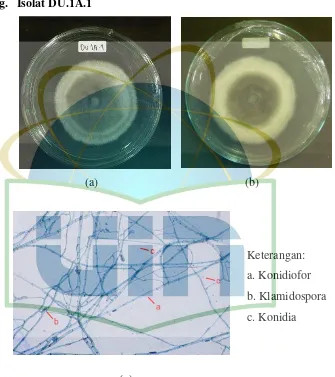
Gambar 14. Pengamatan Makroskopik dan Mikroskopik Isolat DU.1A.1 ... 44
DAFTAR TABEL
Tabel Halaman
Tabel 2.1. Aktivitas antimikroba ekstrak etanol daun C. asiaticum L ... 8
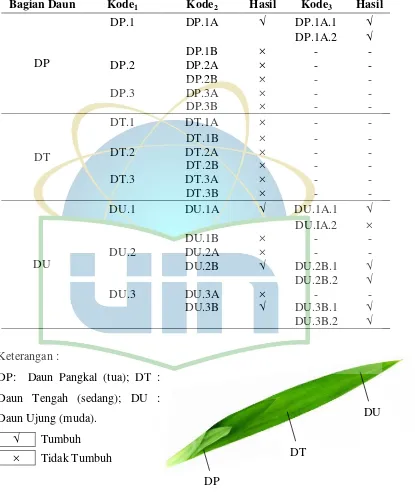
Tabel 4.1. Daftar Isolat Kapang Endofit Daun Tanaman C. asiaticum L ... 37
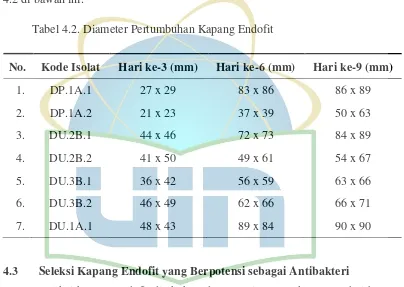
Tabel 4.2. Diameter Pertumbuhan Kapang Endofit ... 45
Tabel 4.3. Diameter Hambat Hasil Seleksi Kapang Endofit ... 46
Tabel 4.4. Perolehan Berat Ekstrak Isolat Kapang Endofit ... 51
Tabel 4.5. Hasil Karakterisasi Bakteri Uji ... 52
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Alur Penelitian ... 64
Lampiran 2. Surat Hasil Determinasi Tanaman Crinum asiaticum L ... 65
Lampiran 3. Bagan Tahapan Isolasi Kapang Endofit ... 66
Lampiran 4. Bagan Tahapan Pemurnian Kapang Endofit ... 67
Lampiran 5. Bagan Tahapan Karakterisasi Mikroskopis Kapang Endofit ... 68
Lampiran 6. Tahapan Seleksi Kapang yang Berpotensi sebagai Antibakteri ... 69
Lampiran 7. Bagan Tahapan Fermentasi dan Ekstraksi ... 70
Lampiran 8. Bagan Tahapan Pembuatan Suspensi Bakteri Uji ... 71
Lampiran 9. Daun Tanaman Bakung putih Crinum asiaticum L ... 72
Lampiran 10. Hasil Isolat Kapang Endofit ... 74
Lampiran 11. Hasil Karakterisasi Mikroskopik bakteri Uji ... 75
Lampiran 12. Hasil Seleksi Kapang Endofit ... 76
Lampiran 13. Proses Fermentasi Kapang Endofit... 79
DAFTAR ISTILAH
Eksudat : Tetes-tetesan yang diekskresi oleh miselium Fialid : Sel pembentuk konidia
Hialin : Transparan, tanpa pigmen
Hifa : Filamen dari miselium, dapat bersekat (monocytic
hypha), dapat tidak (coenocyte hypha)
Klamidospora : Spora aseksual yang berdinding tebal, terletak terminal atau interkalar, mampu bertahan hidup dalam lingkungan yang kurang menguntungkan
Konidiofor : Hifa khusus, tunggal dan bercabang, yang membentuk sel-sel pembentuk konidia
Miselium : Massa hifa
Rhizoid : Struktur menyerupai akar, berfungsi untuk menyerap nutrien dan mengokohkan fungsi pada substrat
Septum : Suatu sekat yang merupakan bagian dari dinding sel, letaknya transversal
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara yang memiliki area hutan hujan tropis yang luas. Hutan hujan tropis merupakan sumber tumbuh-tumbuhan yang mengandung senyawa bioaktif yang potensial. Lebih dari 1000 spesies tumbuhan dapat dimanfaatkan sebagai bahan baku obat. Tumbuhan tersebut menghasilkan metabolit sekunder dengan struktur molekul dan aktivitas biologis yang beraneka ragam, memiliki potensi yang sangat baik untuk dikembangkan menjadi obat.
Tumbuhan merupakan salah satu sumber daya yang sangat penting dalam upaya pengobatan dan mempertahankan kesehatan masyarakat. Bahkan sampai saat ini menurut World Health Organization (WHO), bahwa 80% penduduk di dunia masih menggantungkan dirinya pada pengobatan tradisional termasuk penggunaan obat yang berasal dari tanaman. Hingga saat ini seperempat dari obat-obat modern yang beredar di dunia berasal dari bahan aktif yang diisolasi dan dikembangkan dari tanaman. Sebagai contoh misalnya aspirin merupakan golongan obat analgesik yang paling popular yang diisolasi dari tanaman Salix
dan Spiraea. Selain itu, paclitaxel dan vinblastine juga merupakan obat antikanker
sangat potensial yang juga berasal dari tanaman (Pezzuto J, 1996 dalam Innovative Horticulture, 2008).
Salah satu sumber senyawa bioaktif yang berasal dari mikroba adalah mikroba endofit. Mikroba endofit merupakan mikroba yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Mikroba endofit memiliki potensi yang besar dalam pencarian sumber-sumber obat baru. Hal ini karena mikroba merupakan organisme yang mudah ditumbuhkan, memiliki siklus hidup yang singkat dan dapat menghasilkan jumlah senyawa bioaktif dalam jumlah besar melalui proses fermentasi.
terdapat beberapa spesies bakteri endofit baik Gram positif maupun Gram negatif sedangkan jamur endofit umumnya memiliki inang yang spesifik (Kobayashi dan Palumbo, 2000). Salah satu tanaman yang memiliki aktivitas antibakteri adalah
Crinum asiaticum L. Genus Crinum adalah kelompok tanaman tropis dan
subtropis yang tersebar di beberapa bagian negara di dunia, terutama di Afrika, Asia, Australia, Amerika dan Indonesia yang diikenal dengan bakung putih (Rizzo et al., 1997)
Penelitian sebelumnya mengenai uji aktivitas antibakteri ekstrak etanol daun dan umbi bakung putih (Crinum asiaticum L) terhadap beberapa bakteri penyebab jerawat diantaranya Propionibacterium acnes, Staphylococcus aureus
dan Staphylococcus epidermidis terlihat mempunyai aktivitas yang cukup besar.
Ekstrak etanol daun dan umbi bakung putih mempunyai aktivitas terhadap semua bakteri yang diuji. Penentuan nilai Konsentrasi Hambat Minimum (KHM) dan nilai Konsentrasi Bunuh Minimum (KBM) menggunakan metode dilusi. Nilai KHM dan KBM ekstrak etanol daun untuk P. acnes (1,25 dan 2,5 mg/ml), S.
aureus (5 dan 10 mg/ml) dan S. Epidermidis (2,5 dan 5 mg/ml). Nilai KHM dan
KBM ekstrak etanol umbi untuk P. acnes (7,5 dan 15 mg/ml), S. aureus (7,5 dan 15 mg/ml) dan S. Epidermidis (3,75 dan 7,5 mg/ml) (Syaikhul Aziz., 2010).
Kondisi inilah yang mendorong penulis untuk melakukan penelitian lebih lanjut mengenai isolasi kapang endofit dan uji aktivitasnya sebagai antibakteri. Sampel tanaman yang diambil yaitu padabagian daun tanaman bakung putih
(Crinum asiaticum L) yang saat ini banyak ditemukan di beberapa daerah di
Indonesia khususnya daerah Peneliti (Kabupaten Musi Banyuasin, Sumatera Selatan) yang secara luas digunakan oleh masyarakat untuk pengobatan tradisional dalam penanganan inflamasi, memar dan abses yaitu dengan cara bagian daun bakung dipanaskan di atas api atau lampu lalu dipijatkan pada lokasi tubuh yang mengalami cedera atau terkena abses tersebut.
1.2 Rumusan Masalah
Adanya potensi aktivitas antibakteri berdasarkan penelitian sebelumnya dari ekstrak etanol daun tanaman Crinum asiaticum L terhadap beberapa bakteri patogen Staphylococcus aureus, Bacillus subtilis, Escherichia coli,
dan Pseudomonas aeruginosa, namun belum adanya penelitian lebih lanjut
mengenai isolasi kapang endofit dan uji aktivitasnya sebagai antibakteri.
1.3 Tujuan Penelitian
1) Melakukan isolasi kapang endofit dari daun tanaman bakung putih
(Crinum asiaticum L).
2) Melakukan uji aktivitas antibakteri isolat kapang endofit dari daun tanaman Crinum asiaticum L terhadap bakteri patogen Staphylococcus
aureus, Bacillus subtilis, Escherichia coli, dan Pseudomonas
aeruginosa.
1.4 Manfaat Penelitian
1.4.1 Manfaat Teoritik
Diharapkan dapat memberikan informasi dan pengetahuan baru mengenai ilmu mikrobiologi khususnya kapang endofit.
1.4.2 Manfaat Metodologik
Pengujian aktivitas antibakteri dengan menggunakan isolat kapang endofit merupakan cara yang lebih efektif dan efisien tanpa harus memerlukan bahan baku atau sampel yang banyak.
1.4.3 Manfaat Aplikatif
Diharapkan dapat menjadi bahan informasi baru bagi para peneliti untuk melakukan penelitian lebih lanjut mengenai aktivitas dari isolat kapang endofit.
1.5 Hipotesis
BAB 2
TINJAUAN PUSTAKA
2.1 Crinum asiaticum L
Tanaman Bakung berasal dari Asia Tenggara yang kemudian menyebar ke kawasan tropis lainnya dan bahkan ke daerah-daerah subtropis. Banyak ditemukan di dataran rendah sampai 700 m di atas permukaan laut, khususnya di tempat-tempat yang tanahnya lembab dan banyak humusnya, di tepi sungai, gundukan di pantai dan sekitar danau juga di tepi hutan. Bakung biasa digunakan sebagai tanaman hias yang biasa ditanam di halaman rumah dan juga bisa dimanfaatkan sebagai tanaman obat untuk mengobati berbagai penyakit yang berhubungan dengan peradangan.
Pengembangbiakan tanaman dapat dilakukan dengan umbi atau bijinya. Tanaman bakung tergolong ke dalam tumbuhan monokotil. Herba tahunan dengan tinggi 0,5-1,3 m, mempunyai umbi lapis yang besar dengan diameter 5-10 cm. Pada ujung umbi ada batang semu dengan tunas samping yang tingginya 9-75 cm. Daunduduk, berbentuk pita atau lanset, panjang 3-120 cm, lebar 3-18 cm, urat-urat daun sejajar tampak jelas. Bunga tersusun dalam bentuk payung, terdiri atas 10-40 bunga yang berwarna putih dan berbentuk corong. Buahnya berupa buah kotak yang mempunyai kulit tipis, bentuknya bulat telur terbalik, merekah menjadi dua rongga bila masak, berbiji 1-5. Bijinya besar dan berbentuk bulat gepeng serta kulit bijinya berlapis lendir (Wijayakusuma, 2000).
2.1.1 Klasifikasi
Kingdom : Plantae Subkingdom : Tracheobionta Division : Magnoliophyta Sub Division : Angiospermae Class : Liliopsida Ordo : Liliales
Family : Amaryllidaceae Genus : Crinum
Gambar 2.1: Crinum asiaticum L [Sumber : Koleksi pribadi]
2.1.2 Nama Daerah dan Nama Asing
a. Nama Daerah. Sumatera : bakung (Melayu), bawang hutan, bawang tembaga, kajang-kajang (Palembang), bahong (Batak), semur (Bangka), bakueng (Minang Kabau). Jawa : bakung (Sunda, Jawa), bawang brojol (Jawa), bhakong (Madura). Sulawesi : bakung (Makasar, Bugis). Maluku : dausa, nopu ribusa, takaosa, tapeusa, tekabal (Ambon), rebut (Buru), pete (Halmahera Utara), fete-fete (Ternate).
b. Nama Asing. Wen chu lan (Tionghoa), lelie (Belanda), crinum lily,
spider lily, seashore crinum (Inggris), plub-plueng (Thailand), krinum
bakung (Malaysia).
2.1.3 Bagian Tanaman yang Dipakai
Beberapa bagian dari tanaman bakung putih yang biasa digunakan untuk terapi adalah bagian daun, akar, umbi dan bunga. Masing-masing dapat digunakan dalam bentuk kering (simplisia) ataupun masih dalam keadaan segar.
2.1.4 Kandungan Kimia
senyawa alkaloid, empat senyawa amida, lima senyawa fenolik dan tiga senyawa flavonoid.
Alkaloid : crinum aquin (3), lycorine (4), hippacine (5), hippadine (6), ungeremine (7), 11-O-methylcrinamine (8), 3-O-acetylhamayne (9), crinamine (10), criwelline.
Amida : N-4-trans-coumaroyltyramine, N-4trans-caffeoyltyramine, 4-hydrox-ystyryolamine, 4-aminobenzaldehyde.
Flavonoid : (2S)-3’,7-dihydroxy-4’-methoxflavan, 7-hydoxyflavanone, 4’,7 -dihydroxyflavone.
Fenolik : trans-caffeic acid, coumatic acid, hydroxybenzoic acid, ethyl 4-hydroxybenzoate, 2-(3,4-dihydroxyphenyl)1,3-benzodioxole-5 car-boxaldehyde.
[Sumber : Natural Product Research: Formerly Natural Product Letters]
Dari semua senyawa yang terkandung dalam C. asiaticum L telah diketahui yang memiliki aktivitas sebagai antibakteri yaitu golongan alkaloid jenis
crinamine dan lycorine. Crinamin yang diisolasi dari tanaman bakung putih
menunjukkan aktivitas yang kuat terhadap Staphylococcus aureus dan Candida
albicans. Lycorin menunjukkan efek yang lemah dalam menghambat
pertumbuhan S. aureus, E. Coli dan P. aeruginosa akan tetapi menunjukkan aktivitas antijamur yang baik terhadap C. albicans (Evidente, et al., 2004 dalam Lanello, et al., 2014). Crinamin merupakan salah satu senyawa golongan alkaloid yaitu senyawa yang bersifat basa (dengan adanya atom N), biasanya mengandung satu atom N atau lebih, dan umumnya dalam gabungan, sebagai bagian dari sistim siklik atau heterosiklik. Crinamin (C17H19NO4) memiliki satu atom N dalam bentuk amina tersier seperti pada gambar 2.3 di bawah ini.
Gambar 2.3. Struktur senyawa crinamin [Sumber : https://pubchem.ncbi.nlm.nih/gov/compound/258957]
2.1.5 Penyebaran
Crinum asiaticum (Syn: Crinum amabile) secara lokal dikenal sebagai
2.1.6 Efek Farmakologis
Bakung putih memiliki aktivitas farmakologi untuk pengobatan nyeri, bisul, sakit telinga, arthritis, penyakit kulit (kusta), batuk dan pilek, muntah, obat cacing (antihelmentik), disuria, poliuria, gangguan usus, gangguan tenggorokan, sakit perut, diskrasia, flatulensi, dan demam (Zia Uddin et al., 2012). Bakung putih digunakan juga secara tradisional untuk berbagai keperluan seperti: daun dan akar untuk penanganan muntah, meningkatkan ekskresi keringat (diaforetika) dan pencahar. Umbi bakung putih untuk pemulihan awal terhadap luka (Talha bin Emran et al., 2012). Daun bakung putih dihangatkan dan dioleskan dengan minyak jarak yang berguna untuk menghambat memar dan inflamasi atau peradangan pada ujung jari tangan dan jari kaki. Untuk keluhan sakit telinga, dibuat dalam bentuk jus hangat dari daunnya serta dicampur dengan sedikit garam (Talha bin Emran et al., 2012).
Di belahan timur dan utara Kepulauan Solomon, daun tanaman Crinum
asiaticum L juga digunakan secara tradisional untuk pengobatan inflamasi (Wiart,
2000). Penyakit kulit dan beberapa peradangan lainnya, aktivitas antibakteri (Ilavenil et al., 2010). Untuk pengobatan ulkus peptik dan pembengkakan (Goeltenboth et al., 1991). Selain itu biji dari buahnya digunakan sebagai obat pencahar (purgative) dan bagian serat pada batang digunakan untuk penyakit Gonorea atau kencing nanah (Ilavenil, et al., 2010).
2.1.7 Aktivitas Antimikroba
[Sumber : Ilavenil, et.al.,Research Article Evaluation of Antibacterial Activity and
Phytochemical Analysis of Crinum asiaticum L., 2010 Diakses pada tanggal 08 Oktober
2015.]
2.2 Mikroba
2.2.1 Definisi
Mikroba merupakan organisme berukuran mikroskopis yang antara lain terdiri dari bakteri, fungi dan virus (Waluyo, 2009). Bakteri merupakan mikroba prokariotik yang rata-rata selnya berukuran 0,5-1 x 2-5 μm, berbentuk elips, bola, batang atau spiral (Brooks, et al., 2005).
Fungi adalah organisme eukariotik, bersifat heterotrof, dinding selnya mengandung kitin, tidak berfotosintesis, mensekresikan enzim ekstraseluler ke lingkungan dan memperoleh nutrien dengan cara absorpsi (Gandjar, 2006). Berdasarkan penampakannya, fungi dikelompokkan ke dalam kapang (mold), khamir (yeast), dan cendawan (mushroom). Cendawan merupakan fungi yang berukuran makroskopis, sedangkan kapang dan yeast adalah fungi yang berukuran mikroskopis. Menurut Rachmawan (2001), rata-rata sel kapang berukuran 1-5 x
5-30 μm dan yeast berukuran 1-5 x 1-10 μm. Kapang adalah fungi multiseluler berfilamen dengan susunan hifa yang menyerupai benang (Brock et al., 2006).
Yeast merupakan fungi uniselular. Pada yeast tertentu yang bersifat
patogenik seperti Candida sp., mengalami dua fase (dimorfisme) dalam siklus hidupnya, yaitu fase yeast (membentuk sel tunggal) dan fase miselium untuk penetrasi ke jaringan inangnya (Bambang, 2009).
2.2.2 Jenis
2.2.2.1 Bakteri
a. Morfologi Sel bakteri
Terdapat berbagai berbagai bentuk dari bakteri, antara lain : batang atau silinder, bulat, dan spiral atau melilit yaitu berbentuk melengkung atau melingkar (Pratiwi, 2008)
1) Batang
Monobacil : batang tunggal. Contoh : Salmonella typhi
2) Bulat
Monococcus : bola tunggal. Contoh : Neisseria gonorrhoea.
Diplococcus : bola bergandengan. Contoh : Diplococcus pneumoniae. Sarkina : seperti kubus.
Streptococcus : bulat tersusun seperti rantai. Contoh : Streptococcus pyogenes.
Staphyilococcus : seperti buah anggur. Contoh : Staphylococcus aureus. 3) Spiral
Spiral : berupa lengkungan yang kaku. Contoh : Spirillum minor Vibrio atau koma. Contoh : Vibrio comma
Spirochaeta : Spiral yang lentur. Contoh : Treponema Ukuran bakteri pada umumnya mempunyai ukuran : Panjang : 1,0 – 5,0 µm
Tebal : 0,2 – 1,5 µm
Contoh : Clostridium tetani : panjang 2,0 – 4,0 µm dan tebal 0,3 - 0,5 µm.
Gambar 2.4. Bentuk morfologi dari bakteri [Sumber : Mikrobiologi kedokteran. Alih Bahasa.
b. Struktur Sel Bakteri
Gambar 2.5. Bagian-bagian tubuh bakteri
[Sumber: http://www.yourarticlelibrary.com/biology/electron-microscopic-structure- of-a-typical-bacterial-cell/23010/]. Diakses 20 Agustus 2016. Telah dimodifikasi.
1) Dinding sel, yang berfungsi untuk memberi bentuk sel dan melindungi
isi sel. Komposisi senyawa dinding sel didominasi oleh karbohidrat, yaitu sekitar 80% atau lebih. Karbohidrat dapat terdiri dari beberapa macam
polisakarida. Jumlah dan perbandingan dari macam-macam polisakarida
tersebut dalam tiap species bisa berbeda-beda. Polisakarida utama yang
terdapat dalam dinding sel fungi adalah khitin yaitu polisakarida yang
dibangun oleh monomer berupa N-actylglukosamin. Disamping itu bisa
ditemui polisakarida lain yaitu chitosan (monomernya d-glukosamin),
selulosa (monomer D-glukosa), glukan (monomernya D-glukosa) dan
manan (monomer D-manosa).
2) Membran sel, memberan sel berfungsi melindungi sitoplasma, mengatur
pemasukan dan pengeluaran zat, memfasilitasi sintesis dinding sel dan
memfasilitasi sintesis kapsul. Membran sel mengandung beberapa macam
fosfolipid dengan jumlah relatif bervariasi untuk setiap species. Fosfolipid
yang paling banyak dijumpai adalah fosfatidilkolin, fosfatidiletanolamin.
Sedangkan yang dijumpai dalam jumlah sedikit adalah fosfatidilserin,
3) Sitoplasma, sel fungi, baik ragi maupun kapang sering mengandung lebih
dari satu inti. Keseluruhan suatu hifa dapat dianggap selalu mempunyai inti
sel lebih dari satu atau multinukleat, dimana selalu terjadi kesinambungan
dari sitoplasma yang ada dalam tiap-tiap sel yang membangun hifa
tersebut. Hal ini disebabkan oleh dinding pemisah atau septa yang
memisahkan tiap-tiap sel tersebut mempunyai pori.
4) Kapsul, beberapa species fungi selnya dapat menghasilkan lapisan pembungkus luar yang berlendir atau lapisan yang lebih kompak berupa kapsul. Kapsul atau lapisan luar berlendir tersebut sebagian besar dibangun dari polisakarida yang bersifat cair dan dapat menyebabkan pelekatan dan pengumpulan sel-sel yang berada saling berdekatan. Polisakarida pembentuk kapsul dari spcies yang berbeda dapat berbeda-beda dalam jumlah, komposisi kimia, sifat antigenik, viskositas maupun kelarutannya.
5) Flagel, merupakan filamen protein uliran (helical) dengan panjang dan diameter yang sama, dimiliki oleh beberapa bakteri patogen untuk bergerak bebas dan cepat. Flagela disusun oleh tiga bagian: filamen, hook (sudut), dan basal body (bagian dasar). Fungsi utama flagela pada bakteri adalah sebagai alat untuk pergerakan.
2.2.2.2 Kapang
a. Morfologi Kapang
dan Watkinson, 1994). Pembentukan miselium merupakan sifat yang membedakan grup-grup di dalam fungi. Hifa dapat dibedakan menjadi dua macam yaitu hifa vegetatif atau hifa tumbuh dan hifa fertil yang membentuk bagian reproduksi.Pada kebanyakan kapang hifa fertil tumbuh di atas permukaan, tetapi pada beberapa kapang mungkin terendam. Penyerapan nutrien terjadi pada permukaan miselium. Hifa-hifa yang sudah menjalin suatu jaringan miselium yang makin lama makin tebal akan membentuk suatu koloni yang dapat dilihat dengan kasat mata (Gandjar, et al. 2006). Berdasarkan morfologi hifa secara mikroskopis, kita dapat membedakan hifa yang mempunyai septum (plural: septa) dan yang tidak.
Sifat-sifat kapang baik penampakan makroskopik ataupun mikros-kopik digunakan untuk identifikasi dan klasifikasi kapang. Kapang dapat dibedakan menjadi dua kelompok berdasarkan struktur hifa yaitu hifa tidak bersekat atau nonseptat dan hifa bersekat atau septat yang membagi hifa dalam ruangan-ruangan, dimana setiap ruangan mempunyai satu atau lebih inti sel (nukleus). Dinding penyekat yang disebut septum tidak tertutup rapat sehingga sitoplasma masih bebas bergerak dari suatu ruangan ke ruangan lainnya.
b. Reproduksi Kapang
Reproduksi kapang dilakukan secara seksual dan aseksual. Secara aseksual dilakukan dengan :
Ada beberapa macam spora aseksual yaitu :
b) Spora yang terjadi karena ujung suatu hifa berbelah-belah seperti tasbih disebut konidiospora. Sporanya disebut konidia sedangkan tangkai terdapatnya konidia disebutkonidiofor.
c) Pada beberapa bagian-bagian miselium dapat membesar serta berdinding tebal, bagian ini merupakan alat perkembangbiakan yang disebut klamidiospora.
d) Bila bagian miselium tidak menjadi besar seperti aslinya, maka bagian ini disebut artospora, oidiospora atau oidia saja.
c. Fisiologi Kapang
1) Kebutuhan Air
Pada umumnya kebutuhan air untuk pertumbuhan kapang lebih rendah dibandingkan dengan khamir dan bakteri. Kadar air bahan pangan kurang dari 14-15%, misalnya pada beras dan serealia, dapat menghambat atau memperlambat pertumbuhan kebanyakan khamir.
2) Suhu Pertumbuhan
Kebanyakan kapang bersifat mesofilik yaitu tumbuh baik pada suhu kamar. Suhu optimum pertumbuhan untuk kebanyakan kapang adalah sekitar 25-30oC tetapi beberapa dapat tumbuh pada suhu 35-37oC atau pada suhu yang lebih tinggi. Beberapa kapang bersifat psikrotrofik dan beberapa bersifat termofilik.
3) Kebutuhan Oksigen dan pH
Semua kapang bersifat aerobik, yaitu membutuhkan oksigen untuk pertumbuhannya. Kebanyakan kapang dapat pada kisaran pH 2-8,5 tetapi biasanya pertumbuhannya akan lebih baik pada kondisi asam atau pH rendah.
4) Makanan
5) Komponen Penghambat
Beberapa kapang mengeluarkan komponen yang dapat menghambat organisme lainnya. Komponen itu disebut antibiotik, misalnya penisilin yang diproduksi oleh Penicillium chrysogenum dan clavasin yang diproduksi oleh Aspergillus clavatus. Pertumbuhan kapang biasanya berjalan lambat bila dibandingkan dengan pertumbuhan khamir dan bakteri. Oleh karena itu jika kondisi pertumbuhan memungkinkan semua mikroorganisme untuk tumbuh, kapang biasanya kalah dalam kompetisi dengan khamir dan bakteri. Tetapi sekali kapang dapat mulai tumbuh, pertumbuhan yang ditandai dengan pembentukan miselium dapat berlangsung dengan cepat.
2.3 Karakterisasi
2.3.1 Karakterisasi Bakteri
Salah satu cara yang dilakukan untuk melakukan karakterisasi terhadap bakteri yaitu dengan teknik pewarnaan. Saat ini banyak senyawa organik yang sering digunakan untuk pemeriksaan secara mikroskopis. Tujuan dari pengembangan prosedur pewarnaan tersebut adalah :
a. Mengamati dengan lebih baik bentuk morfologi mikroorganisme secara kasar b. Mengidentifikasi bagian-bagian struktural sel mikroorganisme
c. Membantu mengidentifikasi dan membedakan mikroorganisme yang serupa (Pleczar, 1986).
Adapun langkah-langkah utama dalam mempersiapkan spesimen mikroba yang diwarnai untuk pemeriksaan mikroskopis antara lain :
a. Penempatan olesan, atau lapisan tipis spesimen pada kaca objek
b. Fiksasi olesan itu pada kaca objek, biasanya dengan pemanasan, menyebabkan mikroorganisme itu melekat pada kaca objek.
2.3.2 Karakterisasi Kapang
Melakukan karakterisasi kapang yaitu dengan mengamati morfologi secara makroskopis dengan melihat karakteristik koloni suatu biakan, meliputi : warna dan struktur permukaan koloni yaitu ada atau tidaknya tetes eksudat (exudate
drops) dan melihat ada atau tidaknya lingkaran konsentris (zonasi). Pengamatan
koloni dilakukan dimulai dari awal penanaman hingga pada waktu tertentu dan mencatat semua perubahan yang terjadi (Gandjar et.al., 1999).
2.4 Metabolit Sekunder Kapang Endofit
Sebagian besar komponen kimia yang berasal dari tamanan yang digunakan sebagai obat atau bahan obat adalah merupakan metobolit sekunder. Secara in vitro produksi metabolit sekunder ini dapat dilakukan dengan teknik kultur jaringan (Gandjar, et al., 1999).
Produksi metabolit sekunder beberapa tanaman obat melalui kultur jaringan telah banyak dilakukan. Beberapa diantaranya adalah produksi Solasodine yang diisolasi dari kultur callus Solanum eleagnifolium dan alkaloid pyrrolidine dari kultur akar tanaman Senecio spp (Levin et al., 1988). Untuk tujuan komersial, saat ini telah dilakukan pengembangan produksi metabolit sekunder yang berasal dari tanaman obat dengan sistem bioreaktor. Sistem bioreaktor ini dapat digunakan untuk kultur embryogenic ataupun organogenic dari berbagai spesies tanaman (Levin R., et al., 1988, Preil W. et al., 1988).
Berbagai jenis endofit telah berhasil diisolasi dari tanaman inangnya, dan telah berhasil dibiakkan dalam media perbenihan yang sesuai. Demikian juga metabolit sekunder yang diproduksi oleh mikroba endofit telah berhasil diisolasi dan dimurnikan serta telah dielusidasi struktur molekulnya. Metabolit sekunder yang dihasilkan dari mikroba endofit memiliki bioaktivitas yang bermanfaat baik dalam dunia farmasi maupun pertanian (Radji, M, 2005).
2.5 Pertumbuhan Bakteri
irreversibel atau tidak dapat kembali ke volume semula. Untuk melihat pertumbuhannya, bisa dilihat apabila kandida atau spora fungi ditanam pada media agar dalam cawan Petri, maka setelah 2-3 hari baru terlihat sesuatu pada permukaan berupa tetesan kental (khamir) dan berupa benang-benang (kapang) (Gandjar, et al., 2006).
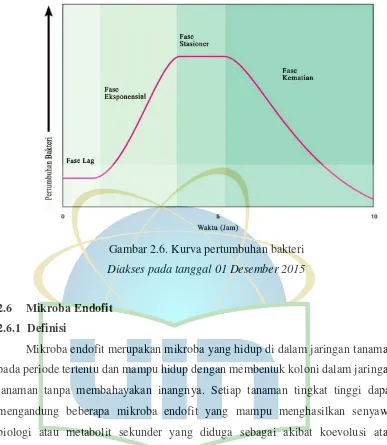
Pengukuran pertumbuhan bakteri dapat diketahui dari kurva pertumbuhan. Kurva pertumbuhan bakteri terbagi menjadi beberapa fase, yaitu :
a. Fase Lag
Pada fase ini sel-sel yang kekurangan metabolit dan enzim sebagai akibat keadaan yang tidak menguntungkan dalam pembiakan sebelumnya, menyesuaikan diri dengan lingkungan yang baru. Pada fase ini, terlihat mulai bertambah besarnya ukuran sel.
b. Fase Eksponensial
Pada fase ini, sel-sel mulai mengalami perubahan bentuk dan jumlahnya meningkat sehingga terlihat pada kurva meningkat secara signifikan. Aktivitas metabolismenya tinggi dan lebih peka terhadap antibiotik. Pada fase ini dipengaruhi oleh bentuk dan sifat mikroba terhadap lingkungan, kandungan nutrient dalam medium, temperatur, kadar oksigen, cahaya dan lain-lain.
c. Fase Stasioner
Fase stasioner merupakan saat laju pertumbuhan bakteri sama dengan laju kematiannya, sehingga jumlah bakteri keseluruhan akan tetap. Keseimbangan jumlah keseluruhan bakteri ini terjadi karena adanya pengurangan derajat pembelahan sel.
d. Fase Kematian
Gambar 2.6. Kurva pertumbuhan bakteri Diakses pada tanggal 01 Desember 2015
2.6 Mikroba Endofit
2.6.1 Definisi
Mikroba endofit merupakan mikroba yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang diduga sebagai akibat koevolusi atau transfer genetik (genetic recombination) dari tanaman inangnya ke dalam mikroba endofit (Tan RX et al., 2001 dalam Radji, M, 2005).
2.6.2 Manfaat Mikroba Endofit
Sebagian besar metabolit sekunder yang diproduksi oleh mikroba endofit telah berhasil diisolasi dan dimurnikan serta telah dielusidasi struktur molekulnya. Beberapa diantaranya adalah :
a. Mikroba endofit yang menghasilkan antibiotika
Cryptocandin adalah antifungi yang dihasilkan oleh mikroba endofit
Cryptosporiopsis quercina yang berhasil diisolasi dari tanaman obat
Tripterigeum wilfordii, yang mempunyai aktivitas sebagai antijamur yang
patogen terhadap manusia yaitu Candida albicans dan Trichopyton spp (Strobel GA.,et.al. 1999).
b. Mikroba endofit yang memproduksi antivirus
Jamur endofit Cytonaema sp. Dapat menghasilkan metabolit cytonic acid A dan B, yang struktur malekulnya merupakan isomer p-tridepside, berhasiat sebagai anti virus. Cytonic acid A dan B ini merupakan protease inhibitor dan dapat menghambat pertumbuhan cytomegalovirus manusia (Guo B.e .al., 2000).
c. Mikroba endofit yang menghasilkan metabolit sebagai antikanker
Paclitaxel dan derivatnya merupakan zat yang berkhasiat sebagai antikanker
yang pertama kali ditemukan yang diproduksi oleh mikroba endofit (Strobel
GA. Et al., 2002 dalam Joseph. B. 2011).
d. Mikroba endofit penghasil zat anti malaria
Colletotrichum sp. merupakan endofit yang diisolasi dari tanaman Artemisia
annua, menghasilkan metabolit artemisinin yang sangat potensial sebagai anti
malaria (Lu H., et.al. 2000).
e. Endofit yang memproduksi antioksidan Pestacin dan isopestacin merupakan metabolit sekunder yang dihasilkan oleh endofit P. microspora. Endofit ini berhasil diisolasi dari tanaman Terminalia morobensis, yang tumbuh di Papua New Guinea. Baik pestacin ataupun isopestacin berhasiat sebagai antioksidan, aktivitas ini diduga karena struktur molekulnya mirip dengan flavonoid (Strobel GA., et.al. 2002 dalam Joseph. B. 2011).
Endofit Pseudomassaria sp yang diisolasi dari hutan lindung, menghasilkan metabolit sekunder yang bekerja seperti insulin. Senyawa ini sangat menjanjikan karena tidak sebagaimana insulin, senyawa ini tidak rusak jika diberikan secara oral. Dalam uji praklinik terhadap hewan percobaan membuktikan bahwa aktivitasnya sangat baik dalam menurunkan glukosa darah tikus yang diabetes (Zhang B. et al.1999).
g. Endofit yang memproduksi senyawa imunosupresif
Obat-obat imunospresif merupakan obat yang digunakan untuk pasien yang akan dilakukan tindakan transplantasi juga dapat digunakan untukmengatasi penyakit autoimum seperti rematoid artritis dan insulin dependent diabetes. Senyawa subglutinol A dan B yang dihasilkan oleh endofit Fusarium
subglutinans yang diisolasi dari tanaman T. wilfordii, merupakan senyawa
imunosupresif yang sangat poten (Lee,J., et.al. 1995 dalam Joseph. B, 2011).
2.7 Bakteri Uji
Pada penelitian ini digunakan empat jenis bakteri uji standar yaitu
Staphylococcus aureus ATCC 25923, Bacillus subtilis ATCC 6633, Escherichia
coli ATCC 25922, dan Pseudomonas aeruginosa ATCC 27853.
2.7.1 Bakteri Gram Positif
Staphylococcus aureus (Brooks et.al., 2005 dalam Jawetz, 2001) Klasifikasi bakteri Staphylococcus aureus adalah sebagai berikut: Divisio : Protophyta
Subdivisio : Schizomycetes Classis : Scizomycetes Ordo : Eubacteriales Familia : Micrococcaceae Genus : Staphylococcus
Spesies : Staphylococcus aureus.
Staphylococcus aureus merupakan bakteri patogen yang bersifat invasif,
Staphylococcus aureus bersifat aerob atau anaerob fakultatif, dan berbentuk sferis serta memiliki diameternya antara 0,8 - 1,0 mikron.
Bacillus subtilis (Jauhari, 2010 dalam Khaerinnisa. A, 2015)
Klasifikasi bakteri Bacillus subtilis adalah sebagai berikut: Kingdom : Bacteria
Bakteri ini memiliki beberapa karakteristik, diantaranya: merupakan spesies basili yang dapat bergerak (motile), menghasilkan enzim katalase, berbentuk batang, berukuran 1 x 3-4 µm. Bakteri Bacillus subtilis menyebabkan infeksi pada manusia dan hewan. Bakteri ini berasal dari famili bacilliaceae yang dapat menyebabkan infeksi pada manusia dan hewan (Jawetz, 2002). Bakteri ini tidak dapat membuat toksin apapun, namun kadang dapat membuat hemolisis yang larut. Bakteri ini bersifat patogen, menyebabkan infeksi pada telur dan dapat mencemari botol transfuse darah sehingga dapat menyebabkan sel darah lisis (Singelton, 1981 dalam Fauzana, 2011).
2.7.2 Bakteri Gram Negatif
Eschericia coli (Jauhari, 2010)
Eschericia coli merupakan bakteri enterik utama, bersifat patogen serta
sebagai bakteri yang menguntungkan. Dapat menyebabkan berbagai penyakit seperti diare, infeksi pada saluran urin.
Klasifikasi bakteri Eschericia coli adalah sebagai berikut: Divisio : Bacteria
Genus : Escherichia Spesies : Escherichia coli
Eschericia coli memiliki beberapa karakteristik antara lain berukuran basil
berkisar 0,4-0,7 x 1-3 µm. Basil tersusun secara tunggal ataupun berpasangan. Tumbuh pada rentang suhu 10-40oC (suhu optimum 37oC dan pH 7,2). Eschericia coli dapat tumbuh pada berbagai medium Blood Agar, Nutrient Agar, Mueller
Hinton Agar dan Mac Conkey Agar. Isolasi utama dapat ditemukan pada medium
Nutrient Agar dan Blood Agar (Parija, 2009).
Pseudomonas aeruginosa
Klasifikasi bakteri Pseudomonas aeruginosa adalah sebagai berikut: Kingdom : Bacteria
Phylum : Proteobacteria
Class : Gamma Proteobacteria Order : Pseudomonadales Family : Pseudomonadaceae Genus : Pseudomonas
Species : Pseudomonas aeruginosa
Pseudomonas aeruginosa merupakan bakteri Gram negatif aerob obligat,
berkapsul, mempunyai flagella polar sehingga bakteri ini bersifat motil, berukuran sekitar 0,5-1,0 µm. Bakteri ini bersifat patogen oportunistik dan merupakan penyebab utama infeksi pneumonia nosokomial.
2.8 Antibakteri
2.8.1 Definisi
Antibakteri adalah suatu senyawa yang memiliki struktur kimia tertentu yang dapat menghambat pertumbuhan bakteri (bakteriostatik) ataupun membunuh bakteri (bakterisidal) (Spicer, 2008 dalam Lusiyana. V, 2013).
membasmi mikroorganisme pada inang yang terinfeksi, dan mencegah pembusukan serta perusakan bahan oleh mikroorganisme (Sulistyo, 1971).
Resistensi antimikroba hingga saat ini mengalami peningkatan, sehingga kemampuannya dalam mengobati beberapa penyakit infeksi yang menyebabkan sebagian besar kematian semakin terancam. Penyakit seperti tuberculosis (TB), yang harus dikontrol terus menerus, efektifitas obat menjadi semakin menurun. Sekitar 45% penyebab kematian di negara berpenghasilan rendah dan satu dari dua kematian prematur di seluruh dunia disebabkan karena infeksi. Dan sebagian besar kematian tersebut (sekitar 90%) adalah disebabkan oleh beberapa penyakit: infeksi saluran pernapasan akut (terutama pneumonia), penyakit diare, HIV/ AIDS, TB, malaria dan campak (WHO, 2000).
2.8.2 Aktivitas dan Efek Antibakteri
Aktivitas antibakteri dibagi menjadi 2 macam yaitu aktivitas bakteriostatik (menghambat pertumbuhan tetapi tidak membunuh patogen) dan aktivitas bakterisidal (dapat membunuh patogen dalam kisaran luas) (Brooks et.al., 2005).
Menurut Madigan, dkk (2000), berdasarkan sifat toksisitas selektifnya, mempunyai 3 macam efek terhadap pertumbuhan mikrobia yaitu:
a. Bakteriostatik memberikan efek dengan cara menghambat pertumbuhan tetapi tidak membunuh. Senyawa bakterostatik seringkali menghambat sintesis protein atau mengikat ribosom.
b. Bakterisidal memberikan efek dengan cara membunuh sel tetapi tidak terjadi lisis sel atau pecah sel. Hal ini ditunjukkan dengan penambahan antimikroba pada kultur mikrobia yang berada pada fase logaritmik. Setelah penambahan zat antimikroba pada fase logaritmik didapatkan jumlah sel total tetap sedangkan jumlah sel hidup menurun.
2.8.3 Mekanisme Kerja
Mekanisme penghambatan terhadap pertumbuhan bakteri oleh senyawa antibakteri dapat berupa perusakan dinding sel dengan cara menghambat pembentukannya atau mengubahnya setelah selesai terbentuk, perubahan permeabilitas membran sitoplasma sehingga menyebabkan keluarnya bahan makanan dari dalam sel, perubahan molekul protein dan asam nukleat, penghambatan kerja enzim, dan penghambatan sintesis asam nukleat dan protein. a. Penghambatan sintesis dinding sel, dengan cara menghambat pembentukan
peptidoglikan sehingga menimbulkan lisis pada sel. Contohnya sefalosporin, penisilin, dan ß-laktam.
b. Merusak membran sel sehingga makromolekul dan ion keluar dari sel, kemudian sel rusak atau terjadi kematian. Contohnya polimiksin B dan daptomisin.
c. Penghambatan sintesis protein pada ribosom bakteri. Contohnya aminoglikosida, tetrasiklin, kloramfenikol, makrolida.
d. Penghambatan sistesis asam nukleat dengan penghambatan proses transkripsi dan replikasi. Contohnya rifampisin & kuinolon.
e. Mengganggu jalur metabolisme bakteri. Contohnya sulfonamid dan trimetoprim (Nester et al., 2012).
2.9 Fermentasi
Fermentasi merupakan suatu proses untuk mengubah bahan dasar menjadi produk yang dikehendaki dalam kultur mikroba tertentu. Menurut Purwanto, 2011., dari proses fermentasi yang dilakukan dapat menghasilkan beberapa produk di antaranya :
a. Biomassa Sel, misalnya protein sel tunggal. b. Enzim, seperti enzim amilase dan protease.
c. Metabolit, merupakan senyawa hasil reaksi metabolisme dari kapang endofit, seperti metabolit primer (misalnya polisakarida, protein, asam nukleat), serta metabolit sekunder (yaitu senyawa antibiotika).
e. Biokonversi, konversi asam asetat dari etanol sorbitol dan produk steroid, aseton dari propanol, antibiotika dan prostaglandin).
2.10 Uji Aktivitas Antibakteri
Uji aktivitas antibakteri dapat dilakukan dengan metode difusi cakram dan metode pengenceran. Disc diffusion test atau uji difusi cakram dilakukan dengan mengukur diameter zona bening (clear zone) yang merupakan petunjuk adanya respon penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri (Hermawan dkk., 2007).
2.10.1 Metode Difusi Cakram
Metode difusi cakram merupakan metode yang paling umum digunakan untuk melakukan uji zat terhadap mikroorganisme. Metoda ini menghasilkan kategori sensitivitas berdasarkan difusi antibakteri dari kertas cakram di dalam media yang sudah mengandung inokulat. Kertas cakram uji diresapi zat uji kemudian kertas cakram tersebut diletakkan pada permukaan media agar yang sudah mengandung inokulat uji, selanjutnya diinkubasi. Setelah dilakukan inkubasi, pertumbuhan bakteri diamati untuk melihat ada tidaknya zona hambat atau zona bening di sekeliling cakram (Kusmayati dan Agustini, 2007). Hal tersebut terjadi karena selama masa inkubasi zat uji yang berada dalam kertas cakram meresap ke media agar. Zona hambat ini dapat menjadi parameter untuk menentukan tingkat sensitivitasnya apakah sensitif, parsial, atau resisten.
Metode ini dipengaruhi oleh beberapa faktor fisika dan kimia, selain faktor antara obat dan organisme misalnya sifat medium dan kemampuan difusi, ukuran molekular dan stabilitas obat (Jawetz et al., 2005).
2.10.2 Metode Dilusi
antibakteri diencerkan hingga diperoleh beberapa macam konsentrasi, kemudian masing-masing konsentrasi ditambahkan suspensi bakteri uji dalam media cair. Perlakuan tersebut akan diinkubasi dan diamati ada atau tidaknya pertumbuhan bakteri, yang ditandai dengan terjadinya kekeruhan. Larutan uji senyawa antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan bakteri uji, ditetapkan sebagai KHM.
Larutan yang ditetapkan sebagai KHM tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan bakteri uji ataupun senyawa antibakteri, dan diinkubasi selama 18-24 jam. Media cair yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai Kadar Bunuh Minimal (KBM) atau Minimal Bactericidal
BAB 3
METODE PENELITIAN
3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilakukan pada bulan September 2015 sampai bulan Juni 2016 di Laboratorium Penelitian 1 dan Laboratorium Mikrobiologi Farmasi Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
3.2 Alat
Alat-alat yang digunakan selama melakukan penelitian ini antara lain: Cawan petri, laminar air flow (Minihelic), bunsen dan pemantik api, jarum ose,
autoclave (ALP Ogawa Seiki), hot plate (Cimarec), oven (Memmert), neraca
analitik (AND GH-202), Vaccum Rotary Evaporator (Eyela), spektrofotometer UV-Vis (Hitachi U-2910), pinset, inkubator (C 3000), mikroskop cahaya (Shimadzu), labu ukur (Pyrex), batang pengaduk, pipet tetes, botol kaca, spatula,
hot platestirrer dan Stirrer bar (Velp), water bath (Eyela), vial, bunsen, plastik
wrap, plastik tahan panas, sentrifugasi (Hettich-Eba 20), vortex mixer (Wiggen Hauser), mikropipet (Thermoscientific), beaker glass (Pyrex), erlenmeyer (Schott Duran), dan alat gelas lainnya yang akan digunakan di laboratorium.
3.3 Bahan
3.3.1 Tanaman Uji
Bahan tanaman yang akan digunakan yaitu bagian daun tanaman bakung putih (Crinum asiaticum L) yang diperoleh dari Kota Sekayu, Kabupaten Musi Banyuasin Provinsi Sumatera Selatan pada bulan September 2015 yang telah dideterminasi di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Kebun Raya, Bogor.
3.3.2 Bahan Penelitian
violet, lugol, NaCl 0,9%, etil asetat, n-heksan, paper disc 6 mm, kertas perkamen,
aluminium foil, tissue steril, kapas, kain kasa, dan kertas saring.
3.3.3 Medium
Beberapa medium yang digunakan yaitu Nutrient Agar (Merck), Potato
Dextrose Agar (Merck), Mueller Hinton Agar (Merck), Nutrient Broth (Merck),
Potato Dextrose Broth, dan Yeast Extract (Merck).
3.3.4 Bakteri Uji
Pada penelitian ini menggunakan empat jenis bakteri standar yang berasal dari Institut Pertanian Bogor Culture Collection (IPBCC), diantaranya:
Bakteri Gram Positif : Staphylococcus aureus ATCC 25923
Bacillus subtilis ATCC 6633
Bakteri Gram Negatif : Escherichia coli ATCC 25922
Pseudomonas aeruginosa ATCC 27853
3.4 Sterilisasi Alat
Alat yang akan digunakan dicuci terlebih dahulu menggunakan air mengalir dan dikeringkan. Selanjutnya alat dibungkus dengan kertas lalu dilakukan sterilisasi. Proses sterilisasi dilakukan dengan menggunakan autoclave pada suhu 121oC selama 15 menit.
3.5 Prosedur Penelitian
3.5.1 Pembuatan Media Pertumbuhan Mikroba
1. Pembuatan Media PDA (Potato Dextrose Agar)
2. Pembuatan Media PDA Miring
Media PDA miring digunakan untuk melakukan pemurnian kapang endofit. Sebanyak 39 gram Potato Dextrose Agar dan ditambahkan dengan 1 liter akuades. Kemudian dipanaskan di atas hot plate hingga mendidih sambil dihomogenkan menggunakan magnetic stirrer. Selanjutnya media dituang ke dalam tabung masing-masing ±5 mL. Dilakukan sterilisasi menggunakan
autoclave selama 15 menit pada suhu 121oC. Tabung diletakkan dengan posisi
miring ± 45o, biarkan media memadat di Laminar Air Flow (Rustanti, 2007).
3. Pembuatan Media NA (Nutrient Agar)
Media NA digunakan untuk seleksi kapang endofit yang memiliki potensi sebagai antibakteri. Sebanyak 20 gram Nutrient Agar dan dimasukkan ke dalam labu yang sudah berisi 1 liter akuades. Kemudian dipanaskan di atas hot plate hingga mendidih sambil dihomogenkan menggunakan magnetic stirrer. Dilakukan sterilisasi menggunakan autoclave selama 15 menit pada suhu 1210C. Media dituang secara aseptis ke dalam cawan petri sebanyak masing-masing ±10 mL di Laminar Air Flow dan biarkan sampai memadat (Rustanti, 2007).
4. Pembuatan Media NA Miring
Media NA miring dibuat dengan tujuan untuk melakukan peremajaan bakteri uji. Sebanyak 20 gram Nutrient Agar ditambahkan dengan 1 liter akuades. Kemudian dipanaskan di atas hot plate hingga mendidih sambil dihomogenkan menggunakan magnetic stirrer. Selanjutnya media dituang ke dalam tabung masing-masing ±5 mL. Dilakukan sterilisasi menggunakan autoclave selama 15 menit pada suhu 121oC. Tabung diletakkan dengan posisi miring ± 45o, biarkan media memadat di Laminar Air Flow (Rustanti, 2007).
5. Pembuatan Media NB (Nutrient Broth)
menggunakan magnetic stirrer. Kemudian dilakukan sterilisasi menggunakan
autoclave selama 15 menit dengan susu 121oC di dalam Laminar Air Flow
(Himedia Laboratories, 2011).
6. Pembuatan Media MHA (Mueller Hinton Agar)
Pembuatan media MHA dilakukan untuk melakukan pengujian aktivitas antibakteri. Sebanyak 38 gram Mueller Hinton Agar kemudian dimasukkan ke dalam labu erlenmeyer yang sudah berisi 1 liter akuades. Kemudian dipanaskan di atas hot plate hingga mendidih dan dihomogenkan dengan menggunakan
magnetic stirrer. Selanjutnya dilakukan sterilisasi menggunakan autoclave selama
15 menit pada suhu 121oC.Lalu media dituang ke dalam cawan petri sebanyak masing-masing ±10 mL di Laminar Air Flow dan biarkan sampai memadat (Conda Laboratories, 2014).
7. Pembuatan Media PDY Broth (Potato Dextrose Yeast Broth)
Media PDY digunakan untuk fermentasi kapang endofit. Sebanyak 24 gram Potato Dextrose Broth, 2 gram Yeast Extract dan 5 gram kalsium karbonat (CaCO3), ditambahkan dengan 1 liter akuades kemudian dipanaskan seperti perlakuan media sebelumnya hingga homogen. Penambahan kalsium karbonat sedikit demi sedikit ke dalam larutan media tersebut hingga dicapai pH 6-7. Selanjutnya media disterilisasi dengan autoclave pada suhu 121oC selama 15 menit (Ramadhan, 2011). Pada proses sterilisasi berlangsung suhu dan tekanan tinggi akan memperbesar penetrasi uap air ke dalam sel-sel mikroba yang menyebabkan koagulasi protein-protein protoplasma dan mempercepat kematian mikrobia, sehingga diharapkan didapatkan media yang steril, terbebas dari mikroorganisme lain.
3.5.2 Isolasi Kapang Endofit
Isolasi kapang endofit dilakukan secara triplo. 3.5.2.1Sterilisasi Permukaan
selanjutnya daun dipotong berukuran 1 x 1 cm2, direndam ke dalam etanol 70% selama 3 menit, kemudian dipindahkan ke dalam larutan NaOCl (Sodium Hipoklorit) 5,25% selama 5 menit. Lalu dikeringkan dengan tisu steril dan terakhir dicuci dengan etanol 70% selama ± 30 detik diikuti dengan akuades sterilselama 3 menit. Lalu potongan daun dikeringkan di atas kertas saring steril (Ariyono, et.al., 2014 & Wahyudi, 1998). Untuk mengisolasi kapang endofit dari daun bakung ini potongan daun dibuat 2 bagian selanjutnya secara hati-hati potongan daun diletakkan secara berhadapan pada media isolasi PDA yang sudah dipadatkan. Media PDA diinkubasi pada suhu ruang selama 14 hari. Proses sterilisasi hingga proses pengeringan semuanya harus dilakukan secara aseptis di ruang Laminar Air Flow Cabinet (Strobel, et.al., 2003).
3.5.2.2Pemurnian Kapang Endofit
Kapang endofit yang tumbuh pada media isolasi kemudian dimurnikan ke dalam media PDA yang lain menggunakan metode cawan gores (Spread Plate) untuk mendapatkan koloni yang benar-benar terpisah dari koloni yang lain. Proses ini dilakukan dengan cara isolat kapang yang telah murni dipindahkan ke dalam media PDA yang lain dengan menggunakan jarum ose steril untuk digunakan sebagai kultur kerja (working culture) dan media agar miring PDA sebagai kultur stok (stock culture). Working culture kapang endofit diinkubasi pada suhu ruang (25oC) selama 7-9 hari selanjutnya Stock culture diinkubasi pada suhu ruang selama 5-7 hari kemudian disimpan pada suhu 4oC dalam lemari pendingin (Kumala dan Endro, 2007).
3.5.3 Karakterisasi Kapang Endofit
Untuk karakterisasi mikroskopis dilakukan dengan pembuatan preparat
(Slide culture methode). Terlebih dahulu cawan petri yang berisi tissue, kaca
objek dan kaca penutup dibungkus menggunakan kertas perkamen, selanjutnya cawan petri disterilkan pada suhu 121oC selama 15 menit. Setelah proses sterilisasi selesai, pada kaca objek ditetesi medium PDA steril, dibiarkan sampai membeku Kemudian ambil sedikit miselium kapang endofit dengan menggunakan jarum ose setril, diletakkan pada media agar PDA yang diteteskan pada kaca objek secara aseptis. Selanjutnya diinkubasi selama 7 hari pada suhu ruang. Setelah proses inkubasi selesai, kaca penutup dilepaskan, lalu 1 tetes etanol 96% dan 1 tetes Methylene blue kemudian ditutup kembali dengan menggunakan
cover glass, ditunggu sampai mengering lalu kemudian diamati di bawah
mikroskop pada perbesaran 100 kali, 200 kali, dan 400 kali. Pengamatan yang dilakukan meliputi ada atau tidaknya sekat pada hifa, pertumbuhan hifa, bentuk dan warna konidia (Atlas, et al,. 2006; Ramadhan, 2011).
3.5.4 Kurva Pertumbuhan Kapang
Kapang sama dengan makhluk hidup lainnya, memerlukan suplai nutrisi sebagai sumber energi dan pertumbuhan selnya. Unsur-unsur dasar tersebut antara
lain adalah karbon, nitrogen, hidrogen, oksigen, sulfur, fosfor, zat besi dan sejumlah
kecil logam lainnya. Kekurangan atau tidak adanya sumber-sumber nutrisi ini dapat
mempengaruhi pertumbuhan suatu mikroba hingga pada akhirnya dapat
menyebabkan kematian (Anonymous, 2006).
3.5.5 Fermentasi
Istilah fermentation berasal dari bahasa Latin Fevere yang berarti mendidih. Penampakan mendidih tersebut disebabkan produksi gas CO2 karena aktivitas katabolisme anaerob dari mikroba pada gula-gula di dalam ekstrak (Stanburry, et,al., 1995). Fermentasi dilakukan bertujuan untuk memperoleh sel kapang endofit dalam jumlah yang banyak sehingga senyawa metabolit yang dihasilkan dapat optimal (Ramadhan, 2011). Proses ini dilakukan pada saat koloni berumur 2-3 minggu, koloni kapang endofit murni diambil sebanyak 3 bulatan kira-kira 1x1 cm2 terdiri dari hifa dan medium agar kemudian diinokulasikan ke dalam wadah botol bening yang telah berisi 250 mL media PDY. Selanjutnya diinkubasi selama 21 hari pada suhu ruangan dalam kondisi statis (Rahmawati, 2006 dan Phongpaichit et al., 2006 dengan modifikasi).
3.5.6 Ekstraksi Hasil Fermentasi
Ekstraksi dilakukan dengan cara pertama dipisahkan antara medium fermentasi dan biomassa. Selanjutnya medium fermentasi dilakukan filtrasi menggunakan corong yang telah dilapisi kapas dan diikuti penyaringan menggunakan kertas saring. Filtrat jernih dilakukan dengan cara partisi menggunakan pelarut n-heksan dan etil asetat dengan perbandingan volume medium dan pelarut adalah (1:1). Sementara biomassa dihaluskan terlebih dahulu menggunakan lumpang dan alu steril. Kemudian dilakukan ekstraksi dengan metode maserasi menggunakan metanol selama 24 jam dengan tujuan untuk menarik semua komponen senyawa yang terkandung di dalamnya. Setelah itu, dilakukan filtrasi hingga terdapat filtrat jernih (Yulia, 2004 dengan modifikasi).
Sehingga didapatkan ekstrak n-heksan (En), ekstrak etil asetat (Ee), dan ekstrak metanol (Em). Setelah itu ekstrak yang sudah didapat diuapkan menggunakan
Vaccum Rotary Evaporator untuk mendapatkan ekstrak kental. Ekstrak kental
kemudian dimasukkan ke dalam vial yang sebelumnya telah ditimbang untuk dijadikan sebagai ekstrak uji.
3.5.7 Peremajaan Bakteri Uji
Peremajaan bakteri Staphylococcus aureus, Bacillus subtilis, Escherichia
coli, dan Pseudomonas aeruginosa diinokulasi sebanyak satu ose ke media agar
NA miring yang selanjutnya diinkubasikan pada suhu 35oC selama 18 - 24 jam (Radji, 2006).
3.5.8 Pembuatan Suspensi Bakteri Uji
Pembuatan suspensi bakteri uji dilakukan dengan cara masing-masing bakteri hasil peremajaan dibuat menjadi suspensi mikroba 109 sesuai dengan kekeruhan Mc Farland III dengan cara satu ose biakan bakteri, dimasukkan secara aseptis ke dalam tabung reaksi yang telah diisi larutan NaCl 0,9% kemudian dihomogenkan dengan menggunakan vortex. Kekeruhan suspensi bakteri yang dibuat dibandingkan dengan kekeruhan standar Mc Farland III. Apabila kekeruhan belum sama, biakan bakteri diinokulasi kembali ke dalam suspensi yang dibuat sehingga diperoleh kekeruhan yang sama dengan standar (Radji, 2006).
3.5.9 Uji Aktivitas Antibakteri
Uji aktivitas antibakteri dilakukan secara In Vitro dengan metode difusi cakram (Disc Diffusion). Sebanyak 1 mL suspensi bakteri 106 diambil menggunakan mikropipet dan dimasukkan ke dalam cawan petri steril. Medium MHA (Mueller Hinton Agar) dalam bentuk cair dituangkan ke dalam cawan petri yang berisi suspensi bakteri. Cawan petri digoyang secara merata agar suspensi bakteri dan medium dapat tercampur homogen dan dibiarkan sampai medium memadat. Semua proses dilakukan secara aseptis di dalam LAF (Laminar Air Flow). Setiap ekstrak uji Eh, Ee dan Em masing-masing dibuat dengan konsentrasi 1000 ppm. Selanjutnya sebanyak 20 µL ekstrak uji diserapkan pada kertas cakram kosong steril. Semua kertas cakram yang sudah mengandung ekstrak uji diletakkan pada permukaan media uji MHA yang sudah dipadatkan lalu diinkubasi pada suhu 37oC selama 18-24 jam.