AKUMULASI SUBKRONIS ARSEN ANORGANIK PADA TIKUS SPRAGUE DAWLEY
DEWI SULANJARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Akumulasi Subkronis Arsen Anorganik pada Tikus Sprague Dawley adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DEWI SULANJARI. Akumulasi Subkronis Arsen Anorganik pada Tikus Sprague Dawley. Dibimbing oleh EKOWATI HANDHARYANI dan AGUS SETIYONO.
Toksisitas arsen merupakan masalah kesehatan global yang mempengaruhi jutaan orang. Arsen diketahui mampu menyebabkan keracunan karena kehadirannya di dalam air minum yang dikonsumsi manusia secara terus menerus. Tujuan penelitian ini adalah mengetahui efek paparan arsen anorganik terhadap aktivitas enzim sebagai indikator adanya kerusakan sel hati, mengetahui besarnya konsentrasi arsen anorganik setelah paparan subkronis dan mempelajari perubahan patologi yang terjadi pada organ interna tikus Sprague Dawley.
Tikus secara random dibagi dalam 4 kelompok perlakuan masing-masing terdiri dari 4 ekor. Kelompok perlakuan tersebut antara lain : (i) kontrol, diberikan aquadestilata steril, (ii) arsenic acid diberikan dengan dosis 2,5 mg/kg bobot badan, (iii) arsenic acid diberikan dengan dosis 5 mg/kg bobot badan, dan (iv) arsenic acid diberikan dengan dosis 10 mg/kg bobot badan. Perlakuan diberikan secara oral menggunakan sonde tikus setiap hari selama 28 hari. Setelah masa perlakuan berakhir, tikus diterminasi dengan menggunakan gas CO2. Darah diambil melalui jantung untuk pemeriksaan biokimia darah. Organ hati dan otak dikoleksi, sebagian untuk pemeriksaan dengan metode inductively coupled plasma-mass spectrometry (ICP-MS) dan sebagian difiksasi dalam 10% buffered neutral formalin (BNF). Evaluasi histopatologi jaringan dilakukan dengan mengamati preparat jaringan yang telah diwarnai dengan pewarnaan hematoksilin-eosin (HE).
Hasil menunjukkan bahwa paparan arsenic acid selama 28 hari mampu mengakibatkan peningkatan aktivitas enzim aspartate amino transferase (AST) dan alanine amino transferase (ALT) secara signifikan jika dibandingkan dengan kelompok kontrol. Selain itu, pada organ hati menunjukkan akumulasi arsen anorganik yang lebih tinggi secara signifikan jika dibandingkan dengan otak. Akumulasi arsen anorganik pada organ hati maupun otak memperlihatkan respon yang semakin meningkat seiring dengan penambahan dosis. Lesio histopatologi pada hati menunjukkan infiltrasi sel-sel mononuklear di daerah portal disertai degenerasi dan nekrosis hepatosit. Perubahan pada hipokampus ditandai dengan infiltrasi sel-sel radang dan nekrosis sel neuron. Dapat disimpulkan bahwa dalam penelitian ini paparan arsenic acid selama 28 hari sudah mampu menimbulkan kerusakan pada organ hati maupun otak dari tikus Sprague Dawley.
SUMMARY
DEWI SULANJARI. Subcronic accumulation of inorganic arsenic in Sprague Dawley rats. Supervised by EKOWATI HANDHARYANI and AGUS SETIYONO.
Arsenic toxicity is a global health problem affecting millions of people. It is said that arsenic is capable to cause toxicity because of its presence in water consumed by people continously. The aims of this research are to find out the effect of anorganic exposure towards enzyme activity as an indicator that there is a liver cell damage, to find out the amount of anorganic arsenic concentration after sub cronic exposure and to study patology changes found in the internal organ of rat Sprague Dawley.
The rat was randomly grouped into four groups of treatment in which each treatment consisted of four rats. The groups of treatment were : (i) control, it was given sterile aquadestile, (ii) arsenic acid was given in 2,5 mg/kg dosage of body weight, (iii) arsenic acid was given in 5 mg/kg dosage of body weight, and (iv) arsenic acid was given in 10 mg/kg dosage of body weight. The treatment was given orally by using rat sonde every day during 28 days. After the period of treament had ended, the rats were determined by using CO2 gas. The blood was taken through the heart for examining the blood biochemical. Organ of liver and brain was collected, some of which were for examination with the method of inductively coupled plasma-mass spectrometry (ICP-MS) and the other was fixed in 10% buffered neutral formalin (BNF). The evaluation of tissue histopatology was conducted by observing the tissue preparat that had been colored with hematoksilin-eosin (HE).
The result showed that arsenic acid exposure during 28 days could cause the increase of the activity enzim of aspartate amino transferase (AST) and alanine amino transferase (ALT) significantly if compared to control group. In addition, the liver showed significantly higher anorganic accumulation compared to brain. Accumulation of anorganic arsenic in the liver and brain showed a more increasing response in line with the dosage rise. Lesio histopatology in liver show mononuclear cell infiltration in the area of portal accompanied by degeneration and necrosis of hepatocyt. The change in hipocampus was marked by infiltration of inflammation cell and neuron cell necrosis. It can be concluded that in this research the exposure of arsenic acid during 28 days have been able to cause damage in liver and brain of the rat, Sprague Dawley.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Biomedis Hewan
AKUMULASI SUBKRONIS ARSEN ANORGANIK PADA TIKUS SPRAGUE DAWLEY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari samapai Mei 2015 ini ialah toksisitas subkronis logam berat arsen, dengan judul Akumulasi Subkronis Arsen Anorganik pada Tikus Sprague Dawley.
Terima kasih penulis ucapkan kepada Ibu Prof Drh Ekowati Handharyani, MSi PhD dan Bapak Drh Agus Setiyono, MS PhD selaku pembimbing, Ibu Dr Drh Anita Esfandiari, MSi selaku penguji luar komisi serta Suyanto, SP MSi yang telah banyak memberikan bantuan dan saran selama penelitian dan penyelesaian tesis ini. Di samping itu, penghargaan penulis sampaikan kepada Kepala Badan Pengawas Obat dan Makanan RI yang telah memberikan kesempatan kepada penulis untuk melanjutkan pendidikan pada jenjang magister ini melalui fasilitas beasiswa yang telah diberikan. Penghargaan juga disampaikan kepada Ibu Dra Anny Sulistiowaty Apt selaku Kepala Pusat Pengujian Obat dan Makanan Nasional, Ibu Dra Kusmiaty MPharm, Ibu Dra Wiwik Ambarwati MEpid, Ibu Drh Eniek Suwarni, Bapak Monides Sagala, Drh Mawar Subangkit, MSi serta seluruh staf Laboratorium Patologi FKH IPB. Ungkapan terimakasih juga disampaikan untuk Bapak, Ibu, suami tercinta Prasanto Januar Adhiarto, ST, Ananda Hanif Arsa Nararya, Ananda Affan Raka Aryasetia, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat bagi ilmu pengetahuan dan masyarakat.
DAFTAR ISI
DAFTAR GAMBAR i
DAFTAR LAMPIRAN ii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 3
Arsen 3
Sumber Arsen 4
Paparan Arsen 5
Absorpsi 5
Distribusi 5
Metabolisme dan Ekskresi 6
Analisis Akumulasi Arsen dengan Metode ICP-MC 6
Deteksi Enzim terhadapGangguan Fungsi Hati 7
METODE PENELITIAN 8
Waktu dan Tempat 8
Hewan Percobaan 8
Bahan dan Alat 9
Metode 9
HASIL DAN PEMBAHASAN 11
Analisis Kimia Darah 11
Analisis Arsen Anorganik dengan Metode ICP-MS 13
Pembacaan Lesio Histopatologi 15
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 18
DAFTAR PUSTAKA 18
DAFTAR GAMBAR
1 Struktur kimia dari beberapa unsur arsen 3
2 Metabolisme arsen anorganik 6
3 Reaksi enzimatis pada enzim aspartate amino transferase (AST) dan alanine amino transferase (ALT)
8 4 Pengaruh dosis arsen anorganik terhadap kadar enzim AST dan ALT 12 5 Konsentrasi arsen anorganik pada hati dan otak (A), Pengaruh organ
dan dosis terhadap konsentrasi arsen anorganik (B) 14
6 Lesio histopatologi hati 16
7 Lesio histopatologi otak 17
DAFTAR LAMPIRAN
1 Skema Pemberian Subkronis Arsen Anorganik 23 2 Analisis Biokimia Darah : Enzim AST dan ALT dengan metode
IFCC tanpa PP 24
3 Skema Analisis Arsen Anorganik dengan metode ICP-MS 25
PENDAHULUAN
Latar Belakang
Toksisitas arsen merupakan masalah kesehatan global yang mempengaruhi jutaan orang. Kontaminasi arsen berasal dari sumber geologi alam menembus akuifer sehingga mencemari air tanah dan dapat juga terjadi dari hasil proses pertambangan dan industri lainnya. Arsen diketahui mampu menyebabkan keracunan karena kehadirannya di dalam air minum dan spesies arsen yang paling umum adalah arsenat [HAsO2-4; As (V)] dan arsenit [H3AsO3; As (III)]. Arsen III memiliki potensi 60 kali lebih toksik dibandingkan dengan arsen V. Arsen organik bersifat kurang toksik sedangkan arsen anorganik bersifat toksik (Ratnaike 2003). Hal ini disebabkan karena arsen organik yang masuk ke dalam tubuh tidak mudah diserap masuk ke dalam sel dan mengalami metabolisme yang terbatas (Cohen et al. 2006).
Toksisitas kronis akibat kontaminasi arsen dalam air minum telah dilaporkan lebih dari tiga puluh negara di dunia (Chakraborti et al. 2002). Sebanyak 79,9 juta penduduk Banglades dan 42,7 juta penduduk Bengal Barat di India terdeteksi arsen pada air tanah dengan konsentrasi melebihi ambang batas yang dipersyaratkan oleh WHO yaitu 10 ppb (Chowdhury et al. 2000). Beberapa negara bagian di USA dan China, terdeteksi arsen dalam air minum yang dikonsumsi penduduk dengan konsentrasi lebih dari 1ppm (Vishwajeet et al. 2014). Pencemaran arsen dipandang cukup serius karena tingkat toksisitasnya yang sangat tinggi terhadap organisme hidup. Paparan arsen melalui air minum telah dilaporkan menyebabkan kanker pada kulit dan beberapa organ dalam serta terjadinya hiperkeratosis, perubahan pigmentasi, efek pada sistem sirkulasi dan sistem syaraf (Flora et al. 2007).
Studi eksperimental pada hewan model yang terpapar arsen dalam air minum menunjukkan adanya peningkatan aktivitas enzim pada organ hati. Hati merupakan bagian penting dalam proses metilasi, setelah arsen tertelan masuk akan terserap pertama kali di dalam hati dan paparan arsen mampu menyebabkan gangguan pada hati (Devaraju et al. 2010; Vishwajeet et al. 2014). Arsen juga diketahui mampu menembus plasenta dan uterus, serta bagian otak dengan melewati blood brain barrier sehingga mempengaruhi kerja sistem saraf pusat (Tolins et al. 2014).
Beberapa teknik telah banyak digunakan untuk mendeteksi keberadaan senyawa arsen, salah satunya adalah dengan metode inductively coupled plasma-mass spectrometry (ICP-MS). Metode ini mempunyai sensitifitas yang tinggi dengan konsentrasi hingga part-per-trillion (ppt), mampu mendeteksi sampel yang berupa cairan dan ekstrak cairan dari sampel biologis maupun lingkungan (Francesconi dan Kuehnelt 2004). Selain itu metode ini dapat digunakan untuk analisis secara kualitatif dan kuantitatif. Arsen organik dan anorganik akan dapat dipisahkan dari total arsen menggunakan cation exchange chromatography yang merupakan bagian dari metode ICP-MS (Sloth et al. 2005).
2
492/Menkes/Per/IV/2010 tanggal 29 April 2010 menetapkan kadar maksimum arsen yang diperbolehkan dalam sumber air minum adalah 10 µg/L (ppb). Peraturan pemerintah tersebut berlaku untuk total arsen saja, sedangkan unsur arsen anorganik merupakan unsur yang lebih toksik dibandingkan dengan arsen organik. Kebijakan terkait batasan kadar arsen anorganik yang diperbolehkan dalam air minum sangat penting untuk menjamin keamanan dan kesehatan masyarakat seperti yang telah ditetapkan di beberapa negara lain.
Mengingat beberapa kasus kontaminasi arsen anorganik di dalam air minum dapat menyebabkan gangguan serius pada organ tubuh, diperlukan suatu studi akumulasi arsen anorganik setelah paparan subkronis pada hewan model. Penelitian ini melakukan analisis biokimia darah terhadap enzim aminotransferase sebagai indikator adanya kerusakan sel hati. Studi pada hewan model mencit akibat paparan arsen anorganik valensi tiga secara akut (Vishwajeet et al. 2014) maupun subkronis (Yasmin et al. 2011) menunjukkan peningkatan aktivitas dari enzim aminotransferase . Penelitian ini juga dilakukan analisis konsentrasi arsen anorganik di hati dan otak secara kuantitatif menggunakan metode inductively coupled plasma-mass spectrometry (ICP-MS). Hal yang hampir sama dilakukan oleh Bashir et al. (2006) dengan mengukur konsentrasi arsen total dalam hati dan otak setelah pemberian arsen anorganik valensi tiga secara akut. Studi histopatologi menunjukkan adanya kerusakan sel pada organ interna akibat paparan arsen anorganik (Bashir et al. 2006 dan Ferzand et al. 2008).
Perumusan Masalah
Kontaminasi arsen anorganik dalam air minum menimbulkan gangguan kesehatan yang serius karena tingkat toksisitasnya yang sangat tinggi terhadap organisme hidup. Sampai saat ini penelitian mengenai akumulasi arsen anorganik pada hewan model setelah paparan subkronis masih jarang dilakukan. Adanya kerusakan pada sel hati dari adanya paparan bahan toksik dapat diketahui dari aktivitas enzim aspartate amino transferase (AST) dan alanine amino transferase (ALT) yang cenderung meningkat dibandingkan nilai normalnya.
Analisis konsentrasi arsen anorganik dilakukan dengan metode yang mutakhir yaitu inductively coupled plasma-mass spectrometry (ICP-MS). ICP-MS menggunakan plasma sebagai sumber ionisasi dan MS mampu menganalisis serta mendeteksi produksi ion. Unsur yang mengandung atom dapat dibelokkan oleh medan magnet dengan kondisi atom tersebut diubah lebih dahulu menjadi bentuk ion. Partikel-partikel yang bermuatan positif akan dibelokkan oleh medan magnet, sedangkan partikel yang tidak bermuatan atau netral tidak akan dibelokkan, dengan polymeric cation exchange solid phase extraction, ion yang terdapat dalam senyawa arsen dapat dipisahkan dalam bentuk arsen anorganik.
Kerusakan sel pada jaringan atau organ dapat diketahui dari gambaran histopatologinya, dengan teknik pewarnaan pada preparat histopatologi mampu menjelaskan perubahan yang terjadi dan distribusinya dalam organ tersebut.
Tujuan Penelitian
3 besarnya konsentrasi arsen anorganik setelah paparan subkronis dan mempelajari perubahan patologi yang terjadi pada organ interna tikus Sprague Dawley.
Manfaat Penelitian
Penelitian ini memberikan manfaat yaitu menambah informasi mengenai toksisitas arsen anorganik setelah paparan subkronis dan pengaruhnya terhadap aktivitas enzim AST dan ALT sebagai indikator kerusakan hati serta gambaran perubahan patologi pada organ hati dan otak. Secara spesifik penelitian ini menambah pengetahuan dan ketrampilan dalam penggunaan teknik Inductively Coupled Plasma-Mass Spectrometry (ICP-MS) untuk menganalisis unsur-unsur organik maupun anorganik seperti logam arsen. Informasi ini dapat dimanfaatkan oleh pemerintah sebagai basis data dan acuan dalam menetapkan kebijakan terkait dengan batasan kadar arsen anorganik yang diperbolehkan dalam minuman yang dikonsumsi masyarakat di Indonesia.
TINJAUAN PUSTAKA
Arsen
Arsen dikenal dengan simbol As, memiliki nomor atom 33, merupakan unsur yang terdapat di berbagai tempat dan terbentuk secara alami di dalam lapisan bumi. Keberadaan arsen di alam sangat berlimpah, menduduki peringkat ke-20 di dalam lapisan kerak bumi, peringkat ke-14 di air laut dan ke 12 dalam tubuh manusia (Mandal dan Suzuki 2002). Arsen terjadi dalam bentuk organik maupun anorganik, memiliki perbedaan valensi meliputi +5 (arsenate), +3 (arsenite) dan -3 (arsine). Arsen yang bergabung dengan elemen lain seperti oksigen, sulfur dan klorida akan membentuk arsen anorganik, sedangkan arsen yang bergabung dengan elemen hidrogen dan karbon akan terbentuk arsen organik (Orloff et al. 2009).
4
arsenide. Arsen trioksida disebut juga arsen putih (As2O3) adalah senyawa yang tidak berwarna, tidak berbau dan merupakan bentuk komersial dari arsen sebagai bahan dasar untuk berbagai produk sintetis. Arsen pentaoksida merupakan bentuk arsen valensi +5 dan disebut juga arsenate (As2O5) (WHO 2001). Arsen dalam
bentuk organik bersifat kurang toksik sedangkan bentuk anorganik bersifat toksik. Bentuk arsenite (+3) memiliki potensi enam puluh kali lebih toksik dibandingkan dengan arsenate (+5) (Ratnaike 2003).
Arsen sangat jarang ditemukan di alam dalam bentuk elemen murni, namun arsen organik sebagai arsenobetain banyak terdapat pada mikrobiota, tumbuhan dan sistem biologi lain. Bentuk tereduksi dari arsen (arsenate maupun arsenite) sering dijumpai dalam produk-produk industri, limbah pertanian dan di permukaan air (Mashkoor et al. 2013). Jutaan manusia di dunia terpapar arsen anorganik akibat konsumsi dari air minum dan makanan yang terkontaminasi arsen (Silbergeld et al. 2008).
Arsen merupakan golongan logam dalam bentuk organik maupun anorganik ditemukan dalam air dan tanah di seluruh dunia khususnya di Bangladesh, India dan beberapa negara di Asia Tenggara (Bhattacharya et al. 2009). Sebanyak 79,9 juta penduduk Banglades dan 42,7 juta penduduk Bengal Barat di India terdeteksi arsen pada air tanah dengan konsentrasi melebihi ambang batas yang dipersyaratkan oleh WHO yaitu 10 ppb (Chowdhury et al. 2000). Beberapa negara bagian di USA dan China, terdeteksi arsen dalam air minum yang dikonsumsi penduduk dengan konsentrasi lebih dari 1 ppm (Vishwajeet et al. 2014).Pencemaran arsen dipandang cukup serius karena tingkat toksisitasnya yang sangat tinggi terhadap organisme hidup. Paparan arsen melalui air minum telah dilaporkan menyebabkan kanker pada kulit dan beberapa organ dalam serta terjadinya hiperkeratosis, perubahan pigmentasi, efek pada sistem sirkulasi dan sistem syaraf (Flora et al. 2007).
Sumber arsen
Manusia dapat terpapar oleh arsen dari sumber alami maupun antropogenik. Jauh sebelum aktivitas manusia berpengaruh terhadap keseimbangan alam, unsur arsen terdistribusi di seluruh lapisan kerak bumi, tanah, sedimen, air, udara dan organisme hidup (Mandal dan Suzuki 2002). Emisi vulkanik merupakan sumber alami terpenting dari paparan arsen. Sumber anthropogenik arsen dapat ditemukan dalam produk herbisida, pupuk, pestisida, produk perawatan kulit, kapas, pengawetan kayu dan obat-obatan (Tseng 2007). Sumber lain pencemaran arsen termasuk proses pembakaran batubara, menghirup udara dalam ruangan yang mengandung polutan dari pembakaran batu bara dan asap rokok (Kapaj et al. 2006).
5 Belum lama telah dilaporkan bahwa pengobatan tradisional Cina menggunakan produk herbal yang mengandung arsen untuk tujuan terapeutik. Hal ini dapat menimbulkan bahaya kesehatan yang serius (Martena et al. 2010). Pigmen pewarna yang digunakan dalam industri kosmetik seperti eye‐shadow seringkali mengandung unsur beracun termasuk arsen (Sainio et al. 2000). Kulit di bagian kelopak mata bersifat sangat halus dan pemakaian eye‐shadow dapat menimbulkan eczema. Selain itu, partikel arsen dapat larut dalam air dan mengalami penyerapan secara perkutan melalui kulit yang basah. Ketika arsen masuk sistem peredaran darah akan terserap kulit, dan pada konsentrasi arsen yang tinggi dapat berpotensi memicu terjadinya karsinogenesis (Jomova et al. 2011).
Paparan arsen
Paparan arsen terjadi melalui proses inhalasi, absorpsi pada kulit, ingesti atau oral dan secara parenteral. Sebagian besar manusia di seluruh dunia terkontaminasi arsen secara kronis. Paparan arsen juga dapat terjadi pada pekerja di perkebunan anggur, pabrik keramik, pembuatan kaca, peleburan dan penyulingan biji besi, proses produksi untuk produk pertanian seperti pestisida dan herbisida (Tchounwou 2004).
Arsen berada di air, tanah ataupun makanan, sehingga arsen yang tertelan akan dengan cepat masuk ke dalam tubuh manusia. Debu di udara yang mengandung arsen dengan mudah terhirup dan sebagian besar partikel debu tersebut melekat pada selaput dalam paru-paru. Paparan arsen ke dalam tubuh melalui kulit sangat jarang terjadi sehingga risiko keracunan arsen yang ditimbulkan oleh rute ini sangat kecil (Chen et al. 1992).
Arsen diketahui mampu menembus plasenta dan hasil penelitian juga menunjukkan bahwa paparan melalui uterus dapat terjadi baik pada manusia maupun hewan percobaan. Sebuah penelitian menggunakan arsen yang dilabel arsenat dan arsenit pada mencit bunting, dengan menggunakan autoradiografi dan gamma counting terlihat bahwa arsen mampu menembus plasenta induk masuk ke sirkulasi darah fetus (Lindgren et al. 1984).
Absorpsi
Absorpsi senyawa arsen tergantung dari bentuk kimianya. Arsen dengan bentuk yang sukar larut seperti arsenic sulphide dan lead arsenate memiliki kecepatan absorpsi yang lebih rendah jika dibandingkan dengan bentuk arsen yang mudah larut, baik melalui rute oral ataupun inhalasi. Lokasi utama absorpsi arsen terjadi di dalam saluran pencernaan khususnya usus halus melalui proses elektrogenik yang melibatkan gradient proton (H+). Arsen jenis AsIII, AsV,
monomethylarsonous acid (MMA) dan dimethylarsinous acid (DMA) pada manusia secara oral akan terabsorpsi lebih dari 80 persen (Ratnaike 2003).
6
(GSH) sebagai essential co-factor. Hasil proses metilasi arsen diperoleh bentuk MMA dan DMA sebagai metabolit akhir (Mandal dan Suzuki 2002).
Arsen juga dapat terabsorpsi melalui rute inhalasi. Pasien dengan kondisi kanker paru-paru akibat paparan arsen melalui asap rokok, terdeposit kurang lebih 40 persen dan yang terabsorpsi sebesar kurang lebih 75 hingga 85 persen. Absorpsi melalui kulit persentasenya relatif lebih rendah dibandingkan rute absorpsi yang lain (WHO 2001).
Distribusi
Setelah proses absorpsi, arsen akan terdistribusi di dalam tubuh dalam plasma darah dan eritrosit, serta sebagian akan diikat oleh hemoglobin. Distribusi dalam plasma darah dan eritrosit tergantung pada valensi dan dosis pemberian arsen serta spesies hewan. Sebagian besar spesies hewan setelah paparan arsen menunjukkan konsentrasi terbesar ditemukan di dalam organ hati, ginjal, limpa dan paru-paru, beberapa minggu kemudian arsen akan terakumulasi di dalam jaringan ektodermal seperti rambut dan kuku akibat akumulasi arsen dengan konsentrasi tinggi akan terikat oleh protein yang mengandung sulfur dalam jaringan tersebut (Eisler 2004).
Metabolisme dan Ekskresi
Arsen yang terabsorpsi akan mengalami biometilasi hepatik membentuk
monomethylarsonic acid (MMA) yang bersifat sedikit toksik. Sekitar 50 persen dari dosis yang tertelan akan tereliminasi melewati urin dalam tiga hingga lima hari. Dimethylarsinic acid (DMA) merupakan metabolit utama di dalam urin yaitu sebesar 60 hingga 70 persen jika dibandingkan dengan MMA. Sedikit dari arsen anorganik yang diekresikan dalam bentuk tidak berubah (Ratnaike 2003).
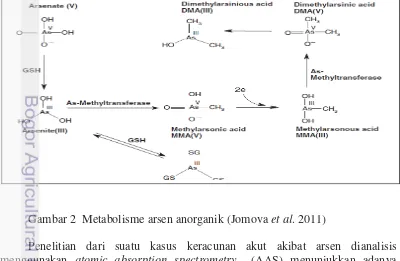
Gambar 2 Metabolisme arsen anorganik (Jomova et al. 2011)
7
konsentrasi tertinggi dari arsen di dalam ginjal dan hati. Paparan arsen secara kronis menunjukkan akumulasi arsen di dalam hati, ginjal, jantung, paru-paru dan konsentrasi kecil di dalam muskulus, sistem syaraf, saluran pencernaan dan limpa. Setelah dua minggu, arsen akan terdeposit di dalam rambut dan kuku (Benramdane 1999).
Analisis akumulasi arsen dengan teknik ICP-MS
Metode yang biasa digunakan untuk mendeteksi adanya senyawa arsen dalam suatu sampel antara lain atomic absorption spectrometry (AAS), atomic fluorescence spectrometry (AFS), inductively coupled plasma-mass spectrometry (ICP-MS), high performance liquid chromatography- inductively coupled plasma-mass spectrometry (HPLC-ICP-MS), hydride generation (HG), gas chromatrography (GC) (Francesconi dan Kuehnelt 2004).
Teknik yang sering digunakan untuk menentukan spesiasi arsen adalah dengan inductively coupled plasma-mass spectrometry (ICP-MS). Arsen organik dan anorganik akan dapat dipisahkan dari total arsen menggunakan cation exchange chromatography yang merupakan bagian dari metode ICP-MS (Sloth et al. 2005). Teknik ini memiliki keunggulan yaitu merupakan metode yang tangguh dengan sensitifitas yang tinggi, mampu digunakan untuk sampel berupa cairan dan ekstrak cairan dari sampel biologis maupun lingkungan, mampu mendeteksi spesies arsen secara kuantitatif, adanya gangguan spektrum yang sering muncul akan dengan cepat diatasi dengan adanya kromatografi atau menggunakan collision cell technology atau analisis massa resolusi tinggi (Francesconi dan Kuehnelt 2004).
Deteksi Enzim Hati
Transaminase adalah enzim penting untuk proses metabolisme pada hewan dan berhubungan erat dengan sintesis asam amino. Termasuk dalam kelompok enzim transaminase ini adalah aspartate amino transferase (AST) dan alanine amino transferase (ALT) (Devaraju et al. 2010). Enzim AST dan ALT banyak ditemukan terutama di organ hati, tetapi juga dapat ditemukan dalam eritosit, jaringan otot dan organ lain seperti pankreas dan ginjal. Enzim AST sebelumnya dikenal dengan istilah serum glutamat oksaloasetat transaminase (GOT), sedangkan enzim ALT dikenal sebagai serum glutamic piruvat transaminase (GPT).
8
lainnya. adanya gangguan pada otot jantung. Kedua enzim transaminase berperan penting dalam diagnosa adanya kerusakan sel hati(Viswajeet et al. 2014).
Gambar 3 Reaksi enzimatis pada enzim aspartate amino transferase (AST) dan alanine amino transferase (ALT) (Huang et al. 2006)
Beberapa metode untuk mendeteksi enzim AST dan ALT sesuai dengan International Federation of Clinical Chemistry (IFCC) dan The Scandinavian Committee on Enzymes (SCE) meliputi metode kolorimetrik, spektrofotometri, chemiluminescen, kromatografi, fluoresen and absorbansi ultra violet, radiokimia dan teknik elektrokimia (Huang et al. 2006).
METODE PENELITIAN
Waktu dan Tempat
9 Hewan Percobaan
Penelitian ini menggunakan hewan coba tikus jantan galur Sprague Dawley, sejumlah 16 ekor, umur 7-8 minggu dengan bobot badan 180±20 gram yang diperoleh dari Laboratorium Hewan Percobaan, Pusat Pengujian Obat dan Makanan Nasional (BPOM RI Jakarta).
Bahan dan Alat
Bahan dan peralatan yang dibutuhkan antara lain : Arsenic acid (H3AsO4, diperoleh dari PT. Merck tbk, Jakarta, Indonesia), Solid Phase Extraction (SPE), methanol, H2O 18,2 MΩ, HCl 0,5 N, Nitric acid 10%, buffered neutral formaline (BNF) 10%, alkohol, xylol, pewarna Meyer’s hematoksilin dan eosin, sonde tikus, botol spesimen, microtube, gunting, scalpel, pisau, tissue processor, embedding center, microtome, waterbath, oven, seperangkat alat inductively coupled plasma-mass spectrometry (ICP-MS), mikroskop yang dilengkapi dengan kamera digital dan monitor, dan lain-lain.
Metode
Seluruh metode yang dilakukan dalam penelitian ini sudah mendapatkan persetujuan atas perlakuan etik dari Komisi Etik Hewan Institut Pertanian Bogor No. 05/RSH IPB/2015 . Penelitian ini menggunakan enam belas ekor tikus yang dibagi menjadi empat kelompok perlakuan. Keempat kelompok perlakuan diberikan arsenic acid dengan dosis bertingkat yaitu 0 (kontrol); 2,5; 5,0 dan 10,0 mg/kg bobot badan. Kelompok kontrol diberikan aquades dan diperlakukan sama dengan kelompok perlakuan yang diberikan arsenic acid. Hari ke 29 setelah periode perlakuan, tikus dieuthanasi menggunakan gas CO2. Organ hati dan otak dikeluarkan. Sebagian organ tersebut difiksasi dalam larutan Buffer Netral Formalin 10% untuk pembuatan preparat histopatologi dan sebagian lagi disimpan di dalam freezer untuk analisis kadar arsen anorganik menggunakan metode ICP-MS.
Analisis Darah
Pengambilan darah dilakukan segera setelah hewan dieuthanasi. Darah diambil melalui jantung untuk pemeriksaan biokimia darah meliputi aktivitas enzim aspartate amino transferase (AST) dan alanine amino transferase (ALT). Pengukuran AST dan ALT menggunakan metode reaksi kinetik enzimatik sesuai International Federation of Clinical Chemistry and Laboratory Medicine (IFCC).
Analisis Arsen Anorganik dengan Teknik ICP-MS
10
disentrifugasi 4000 rpm selama 10 menit. Supernatan diambil sebanyak 0,5 mL kemudian dimasukkan ke dalam kolom solid phase extraction (SPE) yang sebelumnya telah mengalami prakondisi dengan 3,0 mL methanol dan 3,0 mL air 18,2 MΩ. Analit selanjutnya dielusi menggunakan 3,0 mL HCl 0,5 N dan 2,0 mL air 18,2 MΩ dengan laju alir 1 tetes per detik (sebagai Larutan A).
Tahap ke dua adalah pembuatan larutan baku terdiri dari Larutan Baku Induk arsenic acid dengan konsentrasi 1000 mg/L. Larutan Baku Antara I berisi sejumlah 1,0 mL Larutan Baku Induk dipipet dan dimasukkan ke dalam labu ukur 100 mL kemudian diencerkan dengan HCl 0,5 N hingga tanda batas 100. Larutan Baku Antara II berisi sejumlah 1,0 mL Larutan Baku Antara I dipipet dan dimasukkan ke dalam labu ukur 100 mL kemudian diencerkan dengan HCl 0,5 N hingga tanda batas 100. Larutan Baku Kerja dengan konsentrasi masing-masing 0; 2; 4; 6; 8; 10; 12; 14 ng/L dibuat dengan cara memipet Larutan Baku Antara II masing-masing 0; 1; 2; 3; 4; 5; 6; 7 mL,dimasukkan ke dalam labu ukur 50 mL, kemudian diencerkan dengan HCl 0,5 N hingga tanda 50 (sebagai Larutan B).
Tahap ke tiga adalah pembuatan larutan blangko dengan cara yang sama seperti larutan uji tanpa sampel organ (sebagai Larutan C). Prosedur Penetapan arsen anorganik adalah mengukur larutan A, B dan C menggunakan alat ICP-MS. Kadar arsen anorganik dalam sampel dihitung dengan menggunakan rumus sebagai berikut :
Csp adalah kadar arsen anorganik yang diperoleh dari perhitungan menggunakan kurva kalibrasi (ng/mL), V adalah volume larutan sampel uji (mL) dan F adalah faktor pengenceran.
Pembuatan Preparat Histopatologi
Organ hati dan otak yang telah difiksasi dalam larutan buffer netral formalin 10% selama ± 48 jam, dipotong dengan ketebalan ±3 mm kemudian dimasukkan ke dalam tissue casset. Selanjutnya casset dimasukkan ke dalam Automatic Tissue Processor yang berisi larutan dengan urutan alkohol 70%, 80%, 90%, 96%, alkohol absolut (I, II dan III), xylol (I dan II), paraffin (I dan II). Proses tersebut membutuhkan waktu kurang lebih selama 24 jam dengan tujuan dehidrasi, clearing dan impregnansi jaringan. Tahap selanjutnya adalah pencetakan (embedding) ke dalam alat pencetak yang berisi paraffin cair. Cetakan yang telah berisi organ dan paraffin cair kemudian dikeringkan dengan mendinginkan di atas alat frozen tissue embedding machine. Jaringan dipotong dengan ketebalan 3-5µm menggunakan rotary microtome. Irisan jaringan diapungkan dalam waterbath dan diambil secara hati-hati dengan gelas obyek, selanjutnya dilakukan pengeringan dan dimasukkan ke dalam incubator selama semalam pada suhu 50-60 oC.
Pewarnaan Hematoksilin Eosin
Preparat histopatologi diwarnai dengan pewarnaan rutin Hematoksilin dan Eosin untuk melihat kemungkinan adanya perubahan morfologi pada organ secara
11 umum dan perubahan yang mengarah terhadap adanya arsenikosis. Prosedur pewarnaan HE meliputi proses deparafinisasi dan rehidrasi dengan merendam preparat histopatologi ke dalam larutan xylol (I dan II) masing-masing selama 2 menit, dilanjutkan dengan perendaman alkohol 96%, 80% dan aquades selama 1 menit. Proses berikutnya adalah merendam ke dalam larutan warna Meyer’s hematoksilin selama 8 menit kemudian dicuci dengan air mengalir selama 30 detik. Jaringan yang telah diwarnai dengan hematoksilin selanjutnya dicuci dengan air mengalir selama 2 menit. Proses pewarnaan berikutnya adalah perendaman pada larutan eosin selama 2-3 menit kemudian dibilas dengan air mengalir selama 30-60 detik. Untuk proses dehidrasi, jaringan selanjutnya dimasukkan dalam larutan alkohol bertingkat 70%, 80% 96% dan alkohol absolut masing-masing 10 kali celupan. Dilanjutkan dengan proses clearing menggunakan larutan xylol (I, II dan III) masing-masing selama 2 menit. Jaringan yang sudah terwarnai selanjutnya di mounting dan ditutup dengan cover glass dan siap untuk diamati menggunakan mikroskop.
Analisis Data
Analisis data yang digunakan dalam penelitian ini adalah rancangan percobaan dengan bentuk rancangan acak lengkap (RAL) untuk mengetahui pengaruh organ interna tikus dan dosis terhadap akumulasi arsen anorganik, serta pengaruh akumulasi arsen anorganik terhadap kadar enzim. Jika analisis menunjukkan adanya pengaruh yang signifikan maka pengujian dilanjutkan dengan Uji Duncan. Data dianalisis menggunakan software SPSS 22. Analisis secara deskriptif juga dilakukan terhadap perubahan patologi organ hati dan otak.
HASIL DAN PEMBAHASAN
Hasil Analisis Darah
Analisis enzim aspartate amino transferase (AST) dan alanine amino transferase (ALT) digunakan sebagai salah satu parameter adanya kerusakan terhadap organ hati. Pengaruh pemberian arsen anorganik dengan dosis yang berbeda terhadap kadar enzim AST di dalam hati menunjukkan adanya perbedaan yang nyata antara kelompok perlakuan dengan kontrol. Hasil analisis pada kelompok perlakuan terjadi peningkatan aktivitas enzim AST yang lebih tinggi dibandingkan dengan kelompok kontrol. Hal yang sama juga terjadi pada hasil pengukuran aktivitas enzim ALT terlihat adanya perbedaan yang nyata antara kelompok perlakuan dengan kontrol. Tikus yang diberikan perlakuan arsen anorganik menunjukkan aktivitas enzim ALT yang lebih tinggi bila dibandingkan dengan kelompok kontrol.
12
kebocoran dari enzim tersebut dari sitosol hati masuk ke dalam aliran darah, yang memberikan indikasi terhadap efek hepatotoksik dari senyawa arsen.
Gambar 4 Pengaruh dosis arsen anorganik terhadap aktivitas enzim AST dan ALT
AST dan ALT merupakan dua enzim penting yang bekerja sebagai perantara utama dalam metabolisme karbohidrat dan protein. Hasil reaksi kedua enzim menghasilkan asam-asam keto untuk berlangsungnya siklus Krebs dan menghasilkan energi. Arsenat (As V) dan arsenit (As III) dapat mengganggu produksi energi dari sel melalui mekanisme yang berbeda. Arsenat memiliki kesamaan struktur dengan fosfat sehingga proses glikolisis akan terganggu dan akhirnya menurunkan produksi ATP. Arsenit menghambat enzim dalam siklus asam sitrat mitokondria sehingga mengakibatkan penurunan produksi energi (Aphosian 1989).
Aktivitas enzim transferase mengalami perubahan dalam jaringan sebagai akibat beberapa kondisi patologis. Aktivitas enzim AST dan ALT dalam kondisi fisiologis berada dalam batasan normal, tetapi apabila organ hati atau jantung mengalami gangguan maka kedua enzim transaminase tersebut akan dilepaskan ke dalam aliran darah sehingga menyebabkan peningkatan kadar enzim dalam darah. Oleh karena itu kadar AST dan ALT dalam darah berkaitan secara langsung dengan tingkat kerusakan suatu jaringan maupun organ. Rasio AST terhadap ALT dapat membantu menentukan tingkat kerusakan suatu organ (Huang et al.2006).
Enzim AST berfungsi mengkatalisis pemindahan secara reversibel dari asam aspartat dan asam α-ketoglutarat menjadi asam oksaloasetat dan asam glutamat. Sedangkan enzim ALT berfungsi mengkatalisis pemindahan secara reversibel dari alanin dan asam α-ketoglutarat menjadi asam piruvat dan asam glutamat. Enzim glutamat dehidrogenase (GDH) berperan dalam jalur katabolisme asam amino.Enzim tesebut mengkatalisis secara reversibel pada proses deaminasi oksidatif dari glutamat menjadi α-ketoglutarat dan amonia dengan nukleotida piridin (NAD atau NADH) sebagai koenzim. Semua fungsi dari enzim-enzim tersebut sebagai perantara dalam metabolisme protein dan karbohidrat . Produk
13 akhir dari reaksi enzim tersebut adalah penggabungan dari asam-asam keto untuk selanjutnya masuk ke dalam siklus TCA atau siklus Krebs (Devaraju et al. 2010).
Hasil Analisis Arsen Anorganik dengan Metode ICP-MS
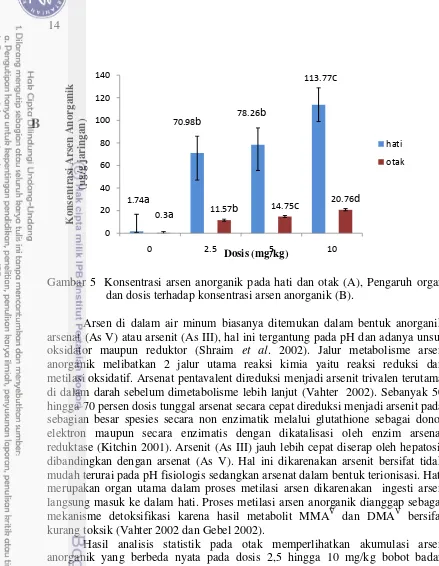
Organ interna tikus Sprague dawley yang diambil untuk pengukuran konsentrasi arsen anorganik dalam penelitian ini adalah hati dan otak. Hasil analisis statistik, memperlihatkan bahwa organ hati dan otak berpengaruh terhadap akumulasi arsen anorganik. Tikus yang diberikan perlakuan arsen anorganik menunjukkan akumulasi pada otak, tetapi akumulasi logam berat tersebut terlihat lebih besar ditemukan di hati (Gambar 5A). Hal ini sejalan dengan hasil penelitian pada tikus yang diberikan arsen anorganik secara akut (Bashir et al. 2006) dan pada mencit dengan pemberian secara kronis (Carmignani et al. 1983).
Data pada Gambar 5B menunjukkan bahwa rerata konsentrasi arsen anorganik di hati tertinggi pada dosis 10 mg/kg bobot badan, sedangkan pada pemberian dosis 2,5 dan 5 mg/kg selama 28 hari tidak berbeda secara nyata, namun ketiga dosis perlakuan tersebut jika dibandingkan dengan kelompok kontrol menunjukkan perbedaan yang signifikan. Hasil penelitian ini menunjukkan bahwa pemberian secara subkronis dari arsenic acid dosis 2,5 hingga 10 mg/kg bobot badan pada tikus memberikan respon akumulasi yang semakin meningkat di dalam organ hati.
Hati merupakan organ penting dalam berbagai proses metabolisme dan pengaruh dari masuknya bahan kimia maupun xenobiotik ke dalam tubuh akan terdeteksi pertama kali di dalam hati. Proses metabolisme arsen terjadi di dalam hati yang merupakan tempat utama untuk metilasi arsen di dalam tubuh (Vishwajeet et al. 2014). Hughes dan Thompson (1996) melakukan studi terhadap arsen anorganik dengan pemberian secara tunggal dan penelitian lanjutan oleh Hughes et al. (1999) yaitu pemberian berulang subkronik dari arsen anorganik melalui air minum dengan dosis 0,014 – 1,4 mg/L pada mencit, menunjukkan bahwa kapasitas metilasi dan ekskresi pada arsen tidak berbeda secara nyata.
14
Gambar 5 Konsentrasi arsen anorganik pada hati dan otak (A), Pengaruh organ dan dosis terhadap konsentrasi arsen anorganik (B).
Arsen di dalam air minum biasanya ditemukan dalam bentuk anorganik arsenat (As V) atau arsenit (As III), hal ini tergantung pada pH dan adanya unsur oksidator maupun reduktor (Shraim et al. 2002). Jalur metabolisme arsen anorganik melibatkan 2 jalur utama reaksi kimia yaitu reaksi reduksi dan metilasi oksidatif. Arsenat pentavalent direduksi menjadi arsenit trivalen terutama di dalam darah sebelum dimetabolisme lebih lanjut (Vahter 2002). Sebanyak 50 hingga 70 persen dosis tunggal arsenat secara cepat direduksi menjadi arsenit pada sebagian besar spesies secara non enzimatik melalui glutathione sebagai donor elektron maupun secara enzimatis dengan dikatalisasi oleh enzim arsenat reduktase (Kitchin 2001). Arsenit (As III) jauh lebih cepat diserap oleh hepatosit dibandingkan dengan arsenat (As V). Hal ini dikarenakan arsenit bersifat tidak mudah terurai pada pH fisiologis sedangkan arsenat dalam bentuk terionisasi. Hati merupakan organ utama dalam proses metilasi arsen dikarenakan ingesti arsen langsung masuk ke dalam hati. Proses metilasi arsen anorganik dianggap sebagai mekanisme detoksifikasi karena hasil metabolit MMAV dan DMAV bersifat kurang toksik (Vahter 2002 dan Gebel 2002).
15 Blood-brain barrier merupakan struktur bagian dari otak yang membentuk persimpangan diantara kapiler sel endotel otak dengan sel-sel epitel dalam pleksus koroid yang berperan khusus mencegah protein dan molekul yang lebih kecil bercampur dengan cairan cerebrospinal (Barret et al. 2012). Efek neurotoksisitas dari suatu bahan toksik dipengaruhi oleh permeabilitas dari blood brain barrier terhadap bahan toksik tersebut (Rai et al. 2010). Penelitian pada hewan percobaan dengan pemberian arsen melalui air minum menunjukkan bahwa adanya hubungan antara dosis dan respon dari arsen pada otak. Hal ini membuktikan bahwa blood brain barrier tidak mampu menghalangi masuknya arsen ke dalam sistem saraf pusat dan dilaporkan bahwa arsen berdampak toksik melalui peningkatan permeabilitas dari blood brain barrier (Rai et al.2010 dan Xi et al. 2010).
Paparan arsen anorganik mengakibatkan akumulasi di daerah hipokampus otak yang berperan dalam fungsi kognitif dan memori. Menurut Wasserman et al. (2014) berpendapat bahwa berkurangnya fungsi kognitif yang ditandai dengan penurunan kecerdasan, koefisien verbal dan gangguan proses belajar serta memori berhubungan dengan terjadinya paparan kronis dari logam berat seperti arsen. Gangguan kognitif dan sistem syaraf tergantung pada besarnya konsentrasi, waktu dan durasi terhadap paparan arsen (Tyler dan Allan 2014). Ahmed et al. (2011) menyatakan bahwa logam berat arsen memiliki potensi sebagai teratogen yang mampu menembus plasenta selama tahap perkembangan dengan konsentrasi yang tinggi, hal ini menyebabkan gangguan pertumbuhan dan defek sistem saraf.
Hasil Pembacaan Lesio Histopatologi
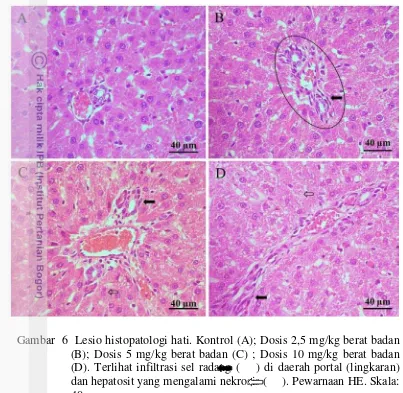
Deskripsi lesio yang ditemukan pada organ hati dengan pewarnaan HE antara lain adalah kelompok kontrol secara umum hepatosit tidak terlihat perubahan, hanya ada sedikit kongesti yang umum terjadi pada waktu proses euthanasia. Dosis 2,5 mg/kg menunjukkan mulai terjadi perubahan di daerah portal dengan adanya infiltrasi sel-sel radang dan beberapa sel mengalami degenerasi. Dosis 5 mg/kg terlihat perubahan yang hampir sama dengan dosis 2,5 mg/kg, namun daerah yang mengalami degenerasi terjadi perluasan dengan ditandai adanya inti yang mengecil dan hilang, di daerah portal terjadi edema disertai infiltrasi sel-sel radang. Dosis 10 mg/kg tampak jelas kerusakannya dengan adanya degenerasi dan nekrosis yang meluas disertai infiltrasi sel-sel radang yang semakin banyak (Gambar 6).
Das et al. (2010) dan Somia et al. (2006) menyatakan bahwa adanya perubahan degenerasi dan nekrosis pada hati dapat disebabkan oleh peroksidasi lipid yang dihasilkan oleh reactive oxygen species (ROS). Toksisitas arsen dimediasi oleh produk metabolitnya (Yamanaka et al. 2000). Menurut Liu et al. 2001, arsen dapat menyebabkan toksik melalui oksidatif stress sehingga dihasilkan reactive oxygen species. Radikal bebas terdeteksi pada sel yang diinduksi dengan arsen.
16
empedu bisa disebabkan oleh produksi IL-33, IL-1α dan produksi molekul intra dan ekstraseluler yang rusak dari sel-sel nekrotik di hati. Sel yang mengalami nekrosis dikenali oleh makrofag dan dihasilkan sitokin untuk proses regenerasi (Mashkoor et al. 2013).
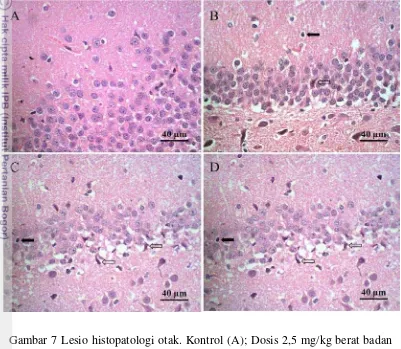
Pemeriksaan histopatologi pada otak yang dievaluasi adalah di bagian hipokampus karena di daerah ini sangat berperan penting dalam proses penerimaan informasi, penyimpanan memori baru dan pengungkapan memori lama (Kumar et al. 2005). Lesio histopatologi yang terjadi pada otak disajikan pada Gambar 7. Perubahan yang terlihat antara lain ; untuk kelompok kontrol secara umum tidak ada perubahan. Pada dosis 2,5 mg/kg terlihat adanya infiltrasi sel-sel radang. Dosis 5 dan 10 mg/kg tampak jelas nekrosis sel-sel neuron yang cukup banyak, hampir 40 persen terlihat kematian dari neuron, diduga sebagai akibat dari arsen anorganik yang mampu menembus blood-brain barrier dan terakumulasi di dalam otak. Kerusakan jaringan yang terlihat dengan pewarnaan HE ini sejalan dengan hasil analisis menggunakan ICP-MS yang menunjukkan rerata konsentrasi arsen anorganik yang semakin tinggi dengan pemberian dosis yang semakin meningkat.
17 Paparan arsen pada hewan model diketahui mampu menyebabkan perubahan secara seluler pada otak. Adanya arsen menyebabkan terjadinya peningkatan apoptosis pada astrosit, penurunan proses astrositik, penurunan ekspresi astrositik dari glial fibrillary acidic protein yang memelihara keutuhan dari astrosit. Astrosit berperan penting dalam menjaga integritas dari blood brain barrier, penyokong dalam proses biokimia dalam jaringan saraf dan berperan penting dalam pembentukan memori jangka panjang (Rai et al. 2010).
Chavez et al. (2003) menyatakan bahwa paparan arsen menunjukkan peningkatan yang signifikan dari formasi radikal hidroksi pada otak. Dalam penelitiannya juga membuktikan bahwa reactive oxygen species secara langsung dapat mengakibatkan kerusakan oksidatif terhadap lipid, protein dan DNA di dalam sel yang terpapar oleh arsen, yang pada akhirnya memicu terjadinya kematian sel. Studi yang dilakukan oleh Wei et al. (2002) dan Liu et al. (2002) bahwa arsen anorganik mampu menginduksi kerusakan jaringan dengan terjadinya nekrosis.
18
SIMPULAN DAN SARAN
Simpulan
Paparan arsen anorganik (Arsenic acid) pada tikus selama 28 hari mampu mengakibatkan kerusakan organ hati, ditandai dengan peningkatan aktivitas enzim aspartate amino transferase (AST) dan alanine amino transferase (ALT). Akumulasi arsen anorganik pada hati lebih tinggi dibandingkan pada otak. Lesio histopatologi pada hati menunjukkan infiltrasi sel-sel mononuklear di daerah portal disertai degenerasi dan nekrosis hepatosit. Perubahan pada hipokampus ditandai dengan infiltrasi sel-sel radang dan nekrosis sel neuron.
Saran
Perlu dilakukan studi yang lebih luas untuk mempelajari spesiasi arsenic acid di dalam hati dan otak tikus sehingga diperoleh informasi potensi toksik dari metabolit yang terbentuk. Begitu juga dengan dosis pemberian arsenic acid dalam rentang dosis yang pendek sehingga diperoleh informasi yang lebih detail terkait perubahan histopatologi dari arsenic acid yang tidak menunjukkan kerusakan sel, sehingga dapat dijadikan acuan dosis aman dari logam berat ini.
DAFTAR PUSTAKA
Ahmed S, Mahabbat KS, Rekha RS, Gardner RM, Ameer SS, Moore S, Ekstrom EC, Vahter M, Raqib R. 2011. Arsenic-associated oxidative stress, inflammation and immune disruption in human placenta and cord blood.
Environ Health Perspect. 119(2):258–64.
Aposhian HV. 1989. Biochemical toxicology of arsenic. Rev Biochem Toxicol. 10: 265–99.
Barrett KE, Barman SM, Boitano S, Brooks HL. 2012. Circulation through special regions. In: Barrett KE, Barman SM, Boitano S, Brooks HL, eds. Ganong’s Review of Medical Physiology. 24th ed. New York: McGraw-Hill.
Bashir S, Sharma Y, Irshad M, Gupta SD, Dogra TD. 2006. Arsenic-Induced Cell Death in Liver and Brain of Experimental Rats. Bsic & Clin Pharmacol and Toxicol. 98 :38–43.
Beckett WS, Moore JL, Keogh JP, Blecker ML. 1986. Acute encephalopathy due to occupational exposure to arsenic. Br J Indust Med. 43 : 66-67.
19 Bhattacharya P, Hasan MA, Sracek O, Smith E, Ahmed KM, Bromssen M, Haq SM, Naidu R. 2009. Groundwater chemistry and arsenic mobilization in the Holocene flood plains in south-central Bangladesh. Environ Geochem Health. 31(1):1-8.
Carmignani M, Boscolo P, Iannaccone A. 1983. Effects of chronic exposure to arsenate on the cardiovascular function of rats. Br J Indust Med. 40:280-284.
Chakraborti D, Rahman MM, Paul K, Sengupta MK, Chowdhury UK, Lodh D. 2002. Arsenic Calamity in India and Bangladesh Sub-Continent-Whom to Blame. Talanta. 58: 3-22.
Chavez G E, Santamaria A, Barriga FD, Mandeville P, Juarez BI and Capdeville MEJ. 2003. Arsenite-induced formation of hydroxyl radical in the striatum of awake rats. Brain Res. 976: 82–89.
Chowdhury UK, Biswas BK, Chowdhury TR. 2000. Groundwater Arsenic Contamination in Bangladesh and West Bengal, India. Environ Hlth Persp. 108:393–7.
Chen CJ, Chen CW, Wu MM, Kuo TL. 1992. Cancer Potential in Liver, Lung, Bladder and Kidney due to Ingested Inorganic Arsenic In Drinking Water. Br J Cancer. 66:888-892.
Cohen SM, Arnold LL, Eldan M, Lewis AS, Beck BD. 2006. Methylated arsenicals: the implication of metabolism and carcinogenicity studies in rodents to human risk assessment. Crit Rev Toxicol. 36: 99-133.
Das AK, Dewanjee S, Sahu R, Dua TK, Gangopadhyay M, Sinha KM. 2010. Protective effect of Corchorus olitorius leaves against arsenic-induced oxidative stress in rat brain. Environ Toxicol Pharmacol. 29:64-69.
Devaraju T, Sujatha K, Rao SM and Rao KJ. 2010. Impact Of Sodium Arsenate On Selected Enzymes And Histopathological Studies In Albino Mice. Inter J Pharm and Bio Sci.1.
Eisler R. 2004. Arsenic Hazards to Humans, Plants and Animals from Gold Mining. Rev Environ Contam Toxicol. 180: 133-165.
Ferzand R, Gadahi JA, Saleha S, Ali Q. 2008. Histological and Haematological Disturbance Caused by Arsenic Toxicity in Mice Model. Pak J Biol Sci. 11 (11): 1405-1413.
Flora SJS, Bhadauria S, Kannan GM, Nutan Singh. 2007. Arsenic Induced Oxidative Stress and the Role of Antioxidant Supplementation During Chelation: A review. J Environ Biol. 28(2):333-347.
Francesconi K, Kuehnelt D. 2004. Determination of Arsenic Species: A Critical Review of Methods and Applications 2000–2003. Analyst.129: 373-395. Gebel TW. 2002. Arsenic methylation is a process of detoxification through
accelerated excretion. Int J Hyg Environ Hlth. 205, 505-508.
Han B, Jeng W.L, Chen R.Y. 1998. Estimation of Target Hazard Quotients and Potential Health Risks for Metals by Consumption of Seafood in Taiwan. Arch Environ Contam Toxicol. 35:711–20.
20
Hughes MF, Thompson DJ. 1996. Subchronic disposition and toxicological effects of arsenate administered in drinking water to mice. Toxicol Environ Hlth 49, 177–196.
Hughes MF, Kenyon EM, Edwards BC, Mitchell CT, Thomas DJ. 1999. Strain-dependent disposition of inorganic arsenic in the mouse. Toxicol.137: 95– 108.
Hughes MF, Beck BD, Chen Y, Lewis AS,Thomas DJ. 2011. Arsenic Exposure and Toxicology: A Historical Perspective. Toxicol Sci. 123(2): 305–332. Jones FT. 2007. A broad view of arsenic. Poultry Sci. 86: 2–14.
Jomova K,Jenisova Z,Feszterova M,Baros S,Liska J,Hudecova D,Rhodesd CJ and ValkoM. 2011. Arsenic: toxicity, oxidative stress and human disease. J Appl Toxicol. 31: 95–107
Kapaj S, Peterson H, Liber K, Bhattacharya P. 2006. Human Health Effects from Chronic Arsenic Poisoning. A Review. J Environ Sci Health. 41:2399-2428.
Kitchin KT. 2001. Recent advances in arsenic carcinogenesis: Modes of action, animal model systems, and methylated arsenic metabolites. Toxicol Appl Pharmacol. 172, 249-261.
Kumar V, Abbas AK, Fausto N. 2005. Robbins and Cotran Pathologic Basic of Diseases. 7th edition. Elsevier Saunders
Lindgren A, Danielsson B.R, Dencker L, Vahter M. 1984. Embryotoxicity of Arsenite and Arsenate: Distribution in Pregnant Mice and Monkeys and Effects on Embryonic Cells in Vitro. Acta Pharmacol Toxicol. 54: 311-320.
Liu SX, Athar M, Lippai I, Waldren C, Hei TK. 2001. Induction of oxyradicals by arsenic: implication for mechanism of genotoxicity. Proc Natl Acad Sci.
98: 1643–1648.
Liu J, Liu Y, Powell DA, Waalkes MP, Klaassen CD. 2002. Multidrug-resistance mdr1a/1b double knockout mice are more sensitive than wild type mice to acute arsenic toxicity with higher arsenic accumulation in tissues. Tox. 170: 55–62.
Mandal BK, Suzuki KT. 2002. Arsenic round the world: a review. Tal. 58: 201– 235.
Martena MJ, Van Der Wielen JC, Rietjens IM, Klerx WN, De Groot HN, Konings EJ. 2010. Monitoring of mercury, arsenic, and lead in traditional Asian herbal preparations on the Dutch market and estimation of associated risks. Food Addit Contam Part A Chem Anal Control Expos Risk Assess. 27: 190–205.
Mashkoor J, Khan A, Khan, Abbas RZ, Saleemi MK and Mahmood F. 2013. Arsenic Induced Clinico-Hemato-Pathological Alterations In Broilers And Its Attenuation By Vitamin E And Selenium. Pak J Agri Sci. 50(1): 131-138.
21 Navarro CM, Montilla PM, Martin A, Jimenez J, Utrilla PM. 1993. Free radicals scavenger and antihepatotoxic activity of Rosmarinus. Plant Med 59: 312-314.
Nepusz T, Petroczi A, Naughton DP. 2009. Food alert patterns for metal contamination analyses in seafoods: longitudinal and geographical perspectives. Environ Int. 35: 1030–1033.
Orloff K, Mistry K, Metcalf S. 2009. Biomonitoring for environmental exposures to arsenic. J Toxicol Environ Health B. 12: 509–524.
Petroczi A, Naughton DP. 2009. Mercury, cadmium and lead contamination in seafood: a comparative study to evaluate the usefulness of Target Hazard Quotients. Food Chem Toxicol. 47: 298–302.
Rai A, Maurya S, Khare P, Srivastava A, Bandyopadhyay S. 2010. Characterization of developmental neurotoxicity of As, Cd, and Pb mixture: synergistic action of metal mixture in glial and neuronal functions. Toxicol Sci.118: 586-601.
Ratnaike RN. 2003. Acute and Chronic Arsenic Toxicity. Post Med J.79: 391-396. Sainio EL, Jolanki R, Hakala E,Kanerva L. 2000. Metals and arsenic in eye
shadows. Contact Dermatitis.42(1): 5-10.
Shraim, A., N.C. Sekaran, C.D. Anuradha and S. Hirano. 2002. Speciation of arsenic in tube-well water samples collected from West Bengal, India, by highperformance liquid chromatography-inductively coupled plasma mass spectrometry. Appl Organomet Chem. 16: 1-8.
Silbergeld, E.K., J. Graham and L.B. Price. 2008. Industrial food animal production, antimicrobial resistance, and human health. Annu Rev Public Health. 29:151-169.
Sing S, Rana SVS. 2007. Amelioration of arsenic toxicity by L-Ascorbic acid in laboratory rat. J Environ Biol. 28(2): 377-384.
Sloth J.J, Julshamn K. dan Lundebye A.K. 2005. Total Arsenic and Total Inorganic Arsenic Content in Norwegian Fish Feed Products. Aquaculture Nutrition 11:61-66.
Smedley PL and Kinniburgh DG. 2002. A review of the source, behavior and distribution of arsenic in natural waters. Appl Geochem. 17: 517–568. Somia B, Sharma Y, Irshad M, Gupta S, Dogral TD. 2006. Arsenic induced cell
death in liver and brain of experimentalrats. Bsc Clin Pharmacol Toxicol. 98(1):38-43.
Tseng CH. 2007. Metabolism of inorganic arsenic and non-cancerous health hazards associated with chronic exposure in humans. J Environ Biol. 28(2): 349-357
Tchounwou P.B, Centeno J.A, Patlolla A.K. 2004. Arsenic Toxicity, Mutagenesis and Carcinogenesis. A Health Risk Assessment and Management Approach. Mol Cell Biochem. 255: 47-55
Tchounwou, P. B, Wilson B. A, Ishaque A. 1999. Important Considerations in The Development of Public Health Advisories for Arsenic and Arsenic Containing Compounds in Drinking Water. Rev. Environ. Hlth. 14: 1-19. Tolins M, Ruchirawat M, Landrigan P. 2014. The Developmental Neurotoxicity
22
Tyler CR, Allan AM. 2014. The effects of arsenic exposure on neurological and cognitive dysfunction in human and rodent studies: a review. Curr Environ Health Rep. 1: 132–147.
Vahter M. 2002. Mechanisms of arsenic biotransformation. Tox.181-182, 211-217.
Vishwajeet, Nath A, Yogesh BJ, Bharathi S, Sekar KV. 2014. Acute Toxicity Study of Arsenic (Sodium Arsenite) on Liver Mice Model. Inter J Comp Res in Biol Sci. 1 (1): 13-18.
Wasserman GA, Liu X, Loiacono NJ, Kline J, Litvak P, Geen A. 2014. Across-sectional study of well water arsenic and child IQ in Maine school children. Environ Health. 13:23.
Wei Q, Bortner CD, Sakurai T, Hobson MJ, Waalkes MP. 2002. Acquisition of apoptotic resistance in arsenic induced malignant transformation: role of the JNK signal transduction pathway. Carcinogen. 23: 151–159.
WHO (World Health Organization). 2001. Arsenic and Arsenic Compounds. Environmental Health Criteria 224. Second edition. Geneva.
Xi S, Guo L, Sun W, Jin Y, Sun G. 2010. Prenatal and early life arsenic exposure induced oxidative damage and altered activities and mRNA expressions of neurotransmitter metabolic enzymes in offspring rat brain. J Biochem Mol Toxicol 24: 6.
Yamanaka K, Katsumata K, Ikuma K, Hasegawa A, Nakano M,Okada S. 2000. The role of orally administered dimethylarsinic acid, a main metabolite of inorganic arsenics, in the promotion and progression of UVB-induced skin tumorigenesis in hairless mice. Cancer Lett. 152: 79–85.
23
Lampiran 1 Skema Pemberian Subkronis Arsen Anorganik
24
Lampiran 2 Analisis Biokimia Darah : Aktivitas Enzim AST dan ALT dengan metode International Federation of Clinical Chemistry and Laboratory Medicine tanpa Pyridoxal Phosphate (IFCC without PP)
1. Dicampurkan empat bagian reagen 1 dengan satu bagian reagen 2 (monoreagen).
2. Diambil 1 mL dari monoreagen kemudian dimasukkan ke dalam tabung reaksi dan diinkubasi pada suhu 37oC minimal 1 jam.
3. Ditambahkan sampel sebanyak 0,1 mL.
4. Dikocok dan selanjutnya diinkubasi pada suhu 37oC selama 1 menit. 5. Dibaca absorban sampel dengan photometer pada panjang gelombang 340
nm.
25 Lampiran 3 Skema Analisis Arsen Anorganik dengan teknik inductively coupled
plasma-mass spectrometry (ICP-MS)
Pembuatan Larutan Uji alir 1 tetes per detik
Larutan A
sama seperti larutan uji, tanpa sampel organ
Kadar arsen (ng/g) = Csp x V x F w
Prosedur Penetapan
Csp : kadar arsen anorganik yang diperoleh dari perhitungan menggunakan kurva kalibrasi (ng/mL)
26
27
RIWAYAT HIDUP
Penulis dilahirkan di Kutoarjo, Kabupaten Purworejo, Jawa Tengah pada Tanggal 10 Juni 1979, merupakan anak ke tiga dari tiga bersaudara dari pasangan Ayahanda Agus Riyadi (Alm) dan Ibunda Suyatmi (Alm). Penulis menyelesaikan pendidikan SLTA di SMA Negeri Kutoarjo Tahun 1996, pendidikan sarjana di Fakultas Kedokteran Hewan UGM Tahun 2002, dan Program Pendidikan Dokter Hewan, FKH UGM Tahun 2004.