PERBAIKAN PROFIL LIPID DAN KAPASITAS
ANTIOKSIDAN RESPONDEN DIABETES MELITUS TIPE 2
MELALUI INTERVENSI TAHU KEDELAI HITAM KAYA
SERAT
NANDA TRIANDITA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Perbaikan Profil Lipid dan Kapasitas Antioksidan Responden Diabetes Melitus Tipe 2 melalui Intervensi Tahu Kedelai Hitam Kaya Serat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NANDA TRIANDITA. Perbaikan Profil Lipid dan Kapasitas Antioksidan Responden Diabetes Melitus Tipe 2 melalui Intervensi Tahu Kedelai Hitam Kaya Serat. Dibimbing oleh FRANSISKA R ZAKARIA dan ENDANG PRANGDIMURTI.
Diabetes melitus (DM) merupakan kondisi kronis yang ditandai dengan peningkatan kadar glukosa darah. Tingginya glukosa darah dapat disebabkan karena tubuh tidak dapat memproduksi insulin dalam jumlah yang cukup atau karena sel-sel tubuh tidak bisa merespon secara baik insulin yang dihasilkan oleh sel β-pankreas. Non alcoholic fatty liver disease (NAFLD) berhubungan dengan keadaan hiperglikemik, hiperlipidemia, obesitas dan resistensi insulin pada responden DM. Kesehatan hati dapat dipantau dengan analisis dalam plasma, salah satunya dinyatakan dengan konsentrasi enzim aspartate transaminase (AST) dan alanine transaminase (ALT). Produk pangan yang baik diperlukan untuk memperbaiki keadaan dislipidemia dan kapasitas antioksidan plasma penderita diabetes melitus tipe 2. Tahu kedelai hitam merupakan produk olahan sari kedelai hitam yang diekstrak proteinnya dengan koagulan berupa kalsium sulfat. Tahu kedelai hitam kaya serat sangat baik untuk penderita diabetes karena memiliki IG yang rendah, protein yang tinggi, mengandung antioksidan dan serat pangan yang tinggi. Tujuan penelitian ini adalah melihat pengaruh intervensi tahu kedelai hitam kaya serat terhadap profil lipid darah yang ditandai dengan penurunan kadar kolesterol, trigliserida, LDL dan meningkatnya HDL darah. Selain itu, meningkatnya kapasitas antioksidan yang ditandai dengan penurunan MDA plasma, dan meningkatnya status kesehatan hati.
Penelitian dilakukan dalam 5 tahap, yaitu seleksi responden, pembuatan produk tahu kedelai hitam kaya serat, intervensi responden, pengambilan darah, dan analisis plasma darah. Penelitian dilakukan selama 30 hari pada 18 responden DM tipe 2, yaitu sebanyak 9 responden untuk kelompok intervensi yang diberikan tahu sebanyak 80 g dan 9 orang untuk kelompok kontrol. Hasil penelitian menunjukkan bahwa intervensi tahu kedelai hitam kaya serat memiliki pengaruh terhadap perbaikan metabolisme lipid dibandingkan dengan kelompok kontrol dengan terjadinya penurunan kadar kolesterol total (p=0.10) dan penurunan LDL-cholesterol (p=0.009). Intervensi tahu kedelai hitam kaya serat juga meningkatkan kapasitas antioksidan dibandingkan dengan kelompok kontrol dengan terjadi peningkatan kapasitas antioksidan (p=0.01), penurunan kadar enzim ALT (p=0.65). Perbaikan profil lipid disebabkan oleh kemampuan serat pangan tahu dalam menurunkan kolesterol total. Peningkatan kapasitas antioksidan plasma disebabkan oleh komponen fenolik dalam menurunkan radikal bebas. Perbaikan parameter uji pada responden yang diintervensi produk tahu dalam diet menunjukkan bahwa tahu kedelai hitam kaya serat memiliki potensi dalam memperbaiki sindrom metabolik penyakit DM tipe 2.
SUMMARY
NANDA TRIANDITA. Plasma Lipid Improvement and Antioxidant Capacity of Type 2 Diabetes Mellitus Subjects with Dietary Fiber-Rich Tofu from Black Soybean Intervention. Supervised by FRANSISKA R ZAKARIA and ENDANG PRANGDIMURTI.
Type 2 diabetes mellitus (T2DM) is a chronic condition that is characterized by blood glucose rise or hyperglycemia. Hyperglycemia is caused by unability of pancreas in producing enough insulin, or unresponsiveness of muscle cells to insulin. Non alcoholic fatty liver disease (NAFLD) is related with hyperglycemia, hyperlipidemia, obesity, and insulin resistance in T2DM subjects. Health of liver can be monitored with plasma analysis, such as aspartate transaminase (AST) and alanine transaminase (ALT) analysis. Healthy food is needed to improve dislipidemia status and plasma antioxidant of T2DM subjects. Black soybean tofu is a coagulated protein product by calcium sulfate. Dietary fiber-rich black soybean tofu has low glycemic index, high protein, antioxidant activity and high dietary fiber. The purpose of this research were to analyze the effect of dietary fiber-rich black soybean tofu in improving plasma lipid level (cholesterol total, triglyserida, HDL, and LDL), decreasing malonaldehyda (MDA) plasma level, and increasing of healthy liver (reducing AST/ALT).
The research was carried out in 5 steps, which were subjects selection, dietary fiber-rich tofu producing, subjects intervention, bloods collection from subjects, and plasma analysis. Subjects were divided into 2 groups, they were intervention group and control group. Intervention group (n=9) was given 80 g dietary fiber-rich tofu for 30 days and control group (n=9) was not given dietary fiber-rich tofu. The result showed intervention of dietary fiber-rich tofu from black soybean could improved plasma lipid level by decreasing the total cholesterol (p=0.10) and decreasing the LDL-cholesterol level (p=0.09). Consumption of dietary fiber-rich tofu from black soybean could increased the plasma antioxidant capacity (p=0.01), and decreased of ALT (p=0.65) enzyme level. The improvement of lipid profile was caused by the ability of dietary fiber-rich tofu in reducing total cholesterol. The increasing of antioxidant capacity of plasma was caused by phenolic compound in reducing free radical. We concluded that the consumption of dietary fiber-rich tofu from black soybean may contribute to improvement in overall health of diabetic subjects and serve as important preventive food.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
PERBAIKAN PROFIL LIPID DAN KAPASITAS
ANTIOKSIDAN RESPONDEN DIABETES MELITUS TIPE 2
MELALUI INTERVENSI TAHU KEDELAI HITAM KAYA
SERAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2015 ini ialah Diabetes, dengan judul Perbaikan Profil Lipid dan Kapasitas Antioksidan Responden Diabetes Melitus Tipe 2 melalui Intervensi Tahu Kedelai Hitam Kaya Serat.
Terima kasih penulis ucapkan kepada Ibu Prof Dr Ir Fransiska R Zakaria, MSc dan Ibu Dr Endang Prangdimurti selaku pembimbing, serta Ibu Dr Dra Suliantari MS yang telah banyak memberi saran. Ungkapan terima kasih juga disampaikan kepada papa, mama serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis Penelitian 2
2 TINJAUAN PUSTAKA 3
Diabetes Melitus 3
Kedelai 4
Tahu Kedelai Hitam 5
Profil Lipid 6
3 METODE 7 Bahan 7 Alat 7 Metode Penelitian 8 Seleksi responden 8
Pembuatan tahu kedelai hitam kaya serat 9
Intervensi tahu kedelai hitam kaya serat 10
Pengambilan darah responden 10
Prosedur Analisis 10 Analisis komponen bioaktif kedelai hitam dan tahu 10
Analisis plasma darah 12
Prosedur analisis data 15
4 HASIL DAN PEMBAHASAN 15 Komponen Bioaktif Kedelai Hitam dan Tahu Kedelai Hitam Kaya Serat 15
Karakteristik Responden DM tipe 2 16 Profil Lipid 17 Total kolesterol 17
Trigliserida 18
HDL-cholesterol 18
LDL-cholesterol 19
Kapasitas Antioksidan 19
Kapasitas antioksidan plasma terhadap radikal DPPH 20
Kadar malonaldehida 21
5 SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 24
LAMPIRAN 29
DAFTAR TABEL
1 Komposisi kimia kedelai hitam dan kuning 4
2 Komponen bioaktif kedelai hitam Detam 1 dan tahu kedelai hitam
kaya serat 15
3 Karakteristik responden DM tipe 2 16
4 Profil lipid responden DM tipe 2 kelompok intervensi dan
kontrol 17
5 Rata-rata kapasitas antioksidan, kadar MDA, kadar enzim AST
dan ALT responden DM tipe 2 kelompok intervensi dan kontrol 18
DAFTAR GAMBAR
1 Mekanisme dislipidemia pada DM 7
2 Diagram alir pembuatan tahu kedelai hitam kaya serat 11
DAFTAR LAMPIRAN
1 Food Recall 30
2 Informed consent 35
3 Ethical clearance 38
1
PENDAHULUAN
Latar Belakang
Diabetes melitus (DM) merupakan kondisi kronis yang ditandai dengan peningkatan kadar glukosa darah. Tingginya glukosa darah dapat disebabkan karena tubuh tidak dapat memproduksi insulin dalam jumlah yang cukup atau karena sel-sel tubuh tidak bisa merespon secara baik insulin yang dihasilkan oleh sel β-pankreas. Keadaan hiperglikemia jangka panjang pada penderita diabetes dapat mempengaruhi sistem pembuluh darah, baik pembuluh darah kecil pada mata, ginjal, dan saraf, serta arteri yang lebih besar yang mengarah pada percepatan terjadinya aterosklerosis. Menurut ADA (2015), 21 juta jiwa warga Amerika terdiagnosa menderita diabetes. Kementerian Kesehatan Republik Indonesia memprediksi diabetes melitus di Indonesia mencapai 21.3 juta orang pada tahun 2030.
DM berhubungan erat dengan tingkat obesitas, dislipidemia, hipertensi, dan penyakit jantung koroner. Terbentuknya penyakit ini secara bersamaan pada responden DM dikenal dengan sindrom metabolik. Keadaan dislipidemia pada penderita diabetes tipe 2 ditandai dengan peningkatan kadar total kolesterol, trigliserida, kolesterol LDL dan penurunan kolesterol HDL (Bilous dan Donelly 2015). Keadaan dislipidemia yang semakin parah pada penderita diabetes dapat menyebabkan aterosklerosis yang merupakan penyebab jantung koroner. Manajemen penyakti
Non alcoholic fatty liver disease (NAFLD) berhubungan dengan keadaan hiperglikemik, hiperlipidemia, obesitas dan resistensi insulin pada responden DM. Kesehatan hati dapat dipantau dengan analisis dalam plasma, salah satunya dinyatakan dengan konsentrasi enzim aspartate transaminase (AST) dan alanine transaminase (ALT). AST/ALT merupakan parameter umum secara medis untuk mengetahui tingkat kesehatan hati. Meningkatnya konsentrasi enzim ALT lebih spesifik menunjukkan status kesehatan hati (kronis) dibandingkan konsentrasi AST yang kurang spesifik menunjukkan kesehatan hati (Velu et al. 2011). Selain itu, oksidasi lipid yang terjadi pada penderita diabetes dapat ditentukan dengan kadar malonaldehida plasma. Oksidasi lipid yang berlebihan dapat membentuk senyawa radikal. Sehingga diperlukan senyawa antioksidan untuk meredam terbentuknya senyawa radikal bebas pada oksidasi lipid ini.
Kedelai merupakan salah satu bahan pangan sumber protein nabati yang dikonsumsi oleh masyarakat Indonesia. Kedelai hitam merupakan salah satu budidaya petani Indonesia yang memiliki kadar protein sebesar 39% dan kadar lemak sebesar 14%. Selain itu, kedelai hitam kaya antioksidan yaitu antosianin yang tidak dimiliki pada kedelai kuning dan juga kandungan isoflavon (daidzein dan genistein) yang lebih tinggi dibandingkan dengan kedelai kuning (Nurrahman 2015).
2
hitam kaya serat sangat baik untuk penderita diabetes karena memiliki IG yang rendah, protein yanng tinggi, memiliki efek kenyang, mengandung antioksidan dan serat pangan yang tinggi.
Tahu kedelai hitam dengan penambahan serat (ampas kedelai) berpotensi menurunkan kadar total kolesterol, trigliserida, kolesterol LDL dan meningkatkan kolesterol HDL penderita diabetes. Antioksidan yang tinggi di dalam tahu diharapkan dapat menekan terbentuknya radikal bebas pada penderita diabetes dan memperbaiki status kesehatan hati yang ditandai dengan menurunnya kadar enzim AST dan ALT plasma.
Perumusan Masalah
Responden DM tipe 2 ditandai dengan keadaan tingginya kadar glukosa darah akibat disfungsi insulin. Keadaan tersebut juga ditandai dengan kelainan lipid darah yang dapat menyebabkan keparahan penyakit pada responden DM tipe 2. Konsumsi pangan sehat dengan karbohidrat kompleks, rendah pati, tinggi protein, dan tinggi antioksidan sangat diperlukan untuk memperbaiki keadaan DM tipe 2. Tahu kedelai hitam kaya serat merupakan salah satu produk pangan yang dapat dijadikan pangan sehat untuk responden DM tipe 2. Pada penelitian ini akan dilihat pengaruh intervensi tahu kedelai hitam terhadap perbaikan profil lipid dan kapasitas antioksidan pada responden DM tipe 2.
Tujuan Penelitian
Penelitian ini bertujuan untuk melihat pengaruh intervensi tahu kedelai hitam kaya serat terhadap profil lipid darah yang ditandai dengan penurunan kadar kolesterol, trigliserida, LDL dan meningkatnya HDL darah. Selain itu, meningkatnya kapasitas antioksidan yang ditandai dengan penurunan MDA plasma dan meningkatnya status kesehatan hati.
Manfaat Penelitian
Hasil penelitian ini dapat menambah informasi ilmiah tentang manfaat mengonsumsi tahu kedelai hitam kaya serat bagi penderita diabetes. Selain itu kegiatan ini juga dapat bermanfaat bagi responden penderita diabetes karena adanya pemeriksaan darah sebagai upaya pengendalian penyakit diabetesnya.
Hipotesis Penelitian
a. Konsumsi tahu kedelai hitam kaya serat dapat menormalkan kadar kolesterol, trigliserida, LDL, HDL plasma darah pada penderita DM tipe 2 b. Konsumsi tahu kedelai hitam kaya serat dapat meningkatkan kapasitas
3 c. Konsumsi tahu kedelai hitam kaya serat dapat menurunkan kadar MDA
penderita DM tipe 2
d. Konsumsi tahu kedelai hitam kaya serat dapat menurunkan kadar enzim hati (AST/ALT) penderita DM tipe 2
2
TINJAUAN PUSTAKA
Diabetes Melitus
Diabetes Melitus (DM) didefinisikan sebagai suatu penyakit atau gangguan metabolisme yang ditandai dengan tingginya kadar gula darah disertai dengan gangguan metabolisme karbohidrat, lipid, dan protein sebagai akibat kekurangan fungsi insulin. Hal ini dapat disebabkan oleh gangguan produksi insulin oleh sel-sel beta Langerhans kelenjar pankreas atau disebabkan kurangnya respon sel-sel-sel-sel tubuh terhadap insulin (Bilous dan Donelly 2015). Adanya gangguan tersebut dapat berakibat lebih fatal seperti komplikasi penyakit lainnya akibat rendahnya kontrol diabetes. Berbagai komplikasi dapat diakibatkan oleh rendahnya kontrol diabetes. Komplikasi tersebut antara lain berupa penyakit vaskular sistemik (percepatan aterosklerosis), penyakit jantung, penyakit mikrovaskular pada mata sebagai penyebab kebutaan dan degenerasi retina (retinopati diabetik), katarak, kerusakan ginjal sebagai penyebab gagal ginjal serta kerusakan saraf tepi (neuropati diabetik) (Setiawan dan Suhartono 2005).
Berdasarkan jenisnya, DM digolongkan dalan 2 tipe yaitu diabetes tipe 1 (insulin dependent diabetes melitus/IDDM) dan tipe 2 (Non Insulin Dependent Diabetes Melitus/NIDDM) (Skyler 2004). Pada penderita IDDM sel beta pankreas mengalami kerusakan oleh autoimun sehingga berpengaruh pada sekresi insulin bahkan bisa tidak menghasilkan insulin jika kerusakannya terlampau parah (Pardede 2008). Untuk menjaga homeostasis glukosa darah penderita DM tipe 1 harus diterapi dengan insulin tambahan. NIDDM atau diabetes tipe 2 dipengaruhi oleh beberapa faktor seperti genetik, lingkungan, dan gaya hidup termasuk pola makan. NIDDM sel beta pankreas masih mampu mesekresikan insulin tetapi insulin tersebut resisten atau tidak mampu memasukkan glukosa ke dalam sel lemak atau sel otot. NIDDM sering dijumpai pada usia dewasa atau di atas 40 tahun (Pardede 2008).
Keadaan dislipidemia pada pasien diabetes tipe 2 ditandai dengan peningkatan kadar trigliserida dan penurunan kolesterol HDL, sedangkan kolesterol total dan LDL tidak berbeda dengan pasien non diabetes. Selain itu, terjadi peningkatan terbentuknya asam lemak bebas serta meningkatnya proporsi partikel LDL padat dan kecil yang sangat aterogenik (Bilous dan Donelly 2015). Menurut Abdel-Aal et al (2008), keadaan dislipidemia pada penderita diabetes ditandai dengan kadar LDL yang tinggi dan trigliserida yang tinggi. Sehingga diperlukan manajemen yang baik pada pola makan, konsumsi obat serta edukasi.
4
menyebabkan autooksidasi glukosa, glikasi protein, dan aktivasi jalur metabolisme poliol yang selanjutnya mempercepat pembentukan senyawa oksigen reaktif (Ceriello dan Motz, 2004). Untuk meredam kerusakan oksidatif tersebut diperlukan antioksidan. Ikatan ganda terkonjugasi yang kaya karotenoid dapat mengikat radikal peroksil yang merupakan antioksidan kuat yang dapat memberikan perlindungan terhadap perkembangan DM tipe 2 (Ceriello dan Motz, 2004). Peningkatan suplai antioksidan yang cukup dapat membantu pencegahan komplikasi klinis diabetes mellitus tipe 2 meskipun data penelitian belum konsisten (Ceriello dan Motz, 2004). Menurut Turk et al. (2002), tingginya tingkat TBARS pada pasien diabetes (n=64) adalah 4.53 µmol/L dibandingkan dengan kontrol sehat (n=36) adalah 1.36 µmol/L.
Kedelai
Bahan dengan sumber zat gizi berupa protein dengan kualitas dan jumlah yang cukup besar serta mengandung senyawa fungsional seperti asam fenolik dan isoflavon dapat dijumpai pada kedelai (Glycine max L. Merrill) (Zhang et al. 2003). Komponen fenolik secara alami terdapat dalam bentuk fenol sederhana, asam fenolat, flavonoid, tannin dan sebagainya. Komponen fenolik telah diketahui dapat meminimalisasi dan mengurangi inisiasi atau peningkatan berbagai jenis penyakit manusia (Zhang et al. 2003). Menurut penelitian sebelumnya (Anderson et al. 1999), makanan dari kedelai efektif mengurangi resiko penyakit jantung dan beberapa jenis kanker. Selanjutnya makanan dari protein kedelai atau isoflavon kedelai dapat mengurangi tekanan darah, kolestrol serum total, atau LDL (Hooper et al. 2008). Komposisi kimia pada kedelai kuning dan kedelai hitam dapat dilihat pada Tabel 2.1.
Tabel 2.1 Komposisi kimia kedelai hitam dan kuning
Komposisi Kedelai Hitam Malika Kedelai Kuning
5 Kedelai hitam merupakan komoditi pertanian yang belum banyak dimanfaatkan dibandingkan kedelai kuning. Tingginya antosianin yang berfungsi sebagai antioksidan eksternal dalam kedelai hitam biasanya terletak pada warna hitam pada kulitnya (Michihiro 2006). Selain antosianin, komponen bioaktif lain dalam kedelai yang ikut berperan dalam mengatur homeostasis gula darah dan resistensi insulin adalah isoflavon dengan jumlah total 154-440 mg/100g (Sabuluntika 2013). Isoflavon kedelai utama yang berperan menghambat pelepasan insulin dari pankreas dan membantu penyerapan glukosa ke dalam sel yaitu genistein (Handayani 2009 dan Liu 2010). Bentuk isoflavon dalam kedelai 99% berbentuk glukosida, 64% genistin, 23% daidzin, dan 13% glisitin (Naim 1974). Sedangkan pada produk olahannya (fermentasi ataupun nonfermentasi) tersedia dalam bentuk aglikon (genistein, daidzein, dan glisitein) (Kusumaningsih 2006). Daya serap isoflavon bentuk aglikon lebih tinggi daripada bentuk glukosidanya (Murota 2002) sedangkan isoflavon dalam bentuk glikosida tidak bisa diserap kedalam tubuh sebelum dihidrolisis oleh enzim β-glukosidase menjadi bentuk aglikonnya agar mudah diserap tubuh (Donkor 2008).
Tahu Kedelai Hitam
Tahu kedelai hitam merupakan produk olahan sari kedelai hitam yang diekstrak proteinnya lalu digumpalkan dengan koagulan berupa batu tahu (kalsium sulfat), whey tahu, asam asetat, atau glucono delta lactone (GDL) (Ginting et al. 2009). Tahu terbuat dari sari kedelai yang mengandung lesitin. Lesitin yang terkandung di dalamnya juga mempunyai peran yang baik dalam pengendalian kandungan glukosa darah dan kolesterol darah (Suriawiria 2002). Tahu merupakan produk olahan kedelai yang umum dikonsumsi sebagai subtitusi protein susu, daging, dan telur. Tahu memiliki daya cerna protein yang tinggi sekitar 95% sehingga aman dikonsumsi semua golongan umur (Kusbiantoro 1993). Tahu kaya akan protein, rendah lemak jenuh, tinggi asam lemak tidak jenuh, bebas kolesterol, sumber ß-vitamin yang baik, mineral, isoflavon, dan antioksidan (karotenoid, vitamin C dan E, komponen fenol dan thiol (SH), serta asam amino esensial (Poysa dan Woodrow 2002; Shokunbi et al. 2011).
Asupan protein dan isoflavon kedelai mampu menurunkan tekanan diastolik darah, kolesterol total serum, atau LDL-kolesterol pada responden normal dan responden dengan kolesterol tinggi (Anderson et al. 1995; Hooper et al. 2008; Taku et al. 2007). Protein kedelai yang tinggi kandungan glisin dan argininnya dapat menurunkan insulin dalam darah. Protein kedelai menurunkan glukosa posprandial, meningkatkan toleransi terhadap glukosa, dan menurunkan jumlah hemoglobin glikosilasi (Bhathena dan Velasquez 2001). Protein kedelai menyebabkan penurunan yang nyata dalam kolesterol darah. Protein kedelai menurunkan penyerapan kolesterol dan asam empedu pada usus halus demi menginduksi peningkatan ekskresi fekal asam empedu dan steroid. Sehingga hati akan lebih banyak mengubah kolesterol menjadi empedu dan produksi kolesterol dalam darah pun menurun serta meningkatkan aktivitas reseptor kolesterol LDL (Messina 2002).
6
(mendidih), pencucian dalam air, penyaringan, koagulasi, dan kehilangan whey selama pembuatan tahu (Chung et al. 2011). Menurut Shih et al. (2002), tahu yang berbahan dasar kedelai hitam memiliki kapasitas antioksidan lebih tinggi dibanding -tokoferol dengan kapasitas menghambat pembentukan peroksida pada asam lemak linoleat berkisar 81.30%-85.89% dibandingkan dengan tokoferol hanya 76.60%.
Profil Lipid
Menurut Tungland dan Meyer (2002), serat pangan lebih dapat menurunkan kadar kolesterol dalam darah penderita hiperlipidemik sedangkan pada responden normal serat pangan lebih menurunkan kadar trigliserida. Mekanisme penurunan kadar kolesterol oleh serat pangan yang dapat difermentasi adalah bahwa serat pangan tersebut dapat mengikat asam empedu sehingga akan meningkatkan ekskresinya melalui feses serta menurunkan sintesis kolesterol dalam hati (Anderson et al.1987). Efek hipokolesterolemik serat pangan juga disebabkan oleh karena adanya SCFA (Short Chain Fatty Acid) yag dihasilkan dari fermentasi serat. Propionat dilaporkan dapat menghambat metabolisme asam lemak yang mempunyai peranan penting dalam sintesis kolesterol (Demigne et al. 1995).
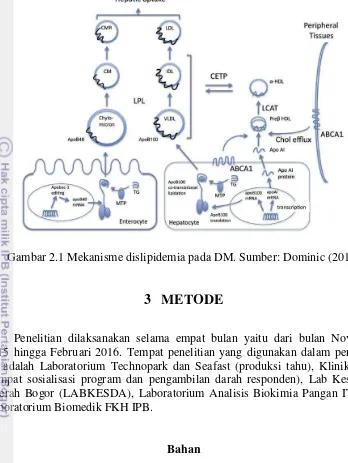
Keadaan dislipidemia pada DM tipe 2 ditunjukkan Gambar 2.1. Menurut Dominic (2013), keadaan dislipidemia DM tipe 2 ditandai dengan (1) meningkatnya produksi VLDL hati yang berlebihan (meningkatnya ketersediaan trigliserida, meningkatnya aktivitas microsomal transfer protein (MTP), berkurangnya degradasi apoB100, menurunnya lipoprotein lipase (LPL) clereance), (2) meningkatnya produksi kilomikron usus (meningkatnya ketersediaan trigliserida, meningkatnya aktivitas MTP, menurunnya kerja GLP-1, berkurangnya LPL clereance), (3) LDL densitas kecil (meningkatnya aktivitas cholesterol ester tranfer protein (CETP), meningkatnya triglyceride rich lipoproteins (TRL)), dan (4) penurunan HDL-cholesterol (meningkatnya aktivitas CETP, meningkatnya TRL, menurunnya aktivitas ABCA1).
7
Gambar 2.1 Mekanisme dislipidemia pada DM. Sumber: Dominic (2013)
3
METODE
Penelitian dilaksanakan selama empat bulan yaitu dari bulan November 2015 hingga Februari 2016. Tempat penelitian yang digunakan dalam penelitian ini adalah Laboratorium Technopark dan Seafast (produksi tahu), Klinik Katili (tempat sosialisasi program dan pengambilan darah responden), Lab Kesehatan Daerah Bogor (LABKESDA), Laboratorium Analisis Biokimia Pangan ITP dan Laboratorium Biomedik FKH IPB.
Bahan
Bahan yang digunakan dalam pembuatan tahu kedelai hitam adalah biji kedelai hitam varietas Detam 1 yang diperoleh dari BALITKABI Malang, air, CaSO4 (batu tahu). Bahan yang digunakan untuk analisis Kolesterol, Trigliserida, HDL dan LDL yaitu sampel plasma darah, reagen Cholesterol (Elitech), enzim Triglyceride (Elitech), reagen HDL-Cholesterol (Rajawali Nusindo), reagen glutamic oxalo acetic transaminase (GOT) (Human), reagen glutamic-pyruvic transaminase (GPT) (Human), larutan induk TEP (Sigma Aldrich), HCl 0.25 N (Sigma Aldrich), dan DPPH (Sigma Aldrich).
Alat
8
termometer, pengaduk, wadah cetakan tahu, pisau, lemari pendingin dan kompor gas. Alat yang digunakan untuk analisis adalah syringe 3 cc, tabung sentrifuse 15 ml, sentrifuse, micro tube 2 mL, microplate, micropipet 10 μL, 100 μL, 1000 μL, Microplate reader (Bio Rad, Japan) dan Spektrofotometer Microlab 300 (Viral Scientific).
Metode Penelitian
Penelitian ini dilakukan dalam 5 tahap, yaitu seleksi responden, pembuatan produk tahu kedelai hitam kaya serat, intervensi responden, pengambilan darah, dan analisis plasma darah.
Seleksi responden
Skrining awal adalah mencari calon responden diabetes melitus tipe 2 di sekitar kampus IPB Dramaga, Kabupaten Bogor.
Kriteria inklusi sebagai subjek penelitian adalah penderita diabetes: a. Pasien DM tipe 2 berusia 40-70 tahun.
b. Pasien tidak menderita gangren, penyakit kronis (berdasarkan pemeriksaan) dengan kadar glukosa darah puasa > 126 mg/dL.
c. Pasien menerima konsumsi produk (sop tahu kedelai hitam kaya serat dalam intervensi selama waktu yang telah ditentukan yaitu 30 hari). Untuk kelompok kontrol, tidak diberikan konsumsi produk namun hanya dikontrol pola makannya dengan melihat pola makan berdasarkan food recall (Lampiran 1).
d. Pasien menyatakan bersedia ikut serta dalam penelitian dengan menandatangani lembar informed consent (Lampiran 2).
Adapun kriteria eksklusi dalam penelitian ini antara lain: pasien non DM tipe 2, pasien berumur di atas 70 tahun, pasien menderita gangren dan penyakit kronis, pasien menolak mengonsumsi sop tahu kedelai hitam kaya serat, dan pasien menyatakan tidak bersedia ikut serta dalam penelitian dengan tidak menandatangani informed consent.
Skrining awal yang dilakukan terhadap calon responden adalah mengetahui kadar glukosa darah sewaktu >200 mg/dL. Setelah diperoleh dan dikelompokan kadar glukosa >200 mg/dL maka dilakukan skrining tahap 2 untuk melihat apakah ada perubahan kadar glukosa darah pada pengecekan awal. Pada tahap 2 pengecekan glukosa darah puasa >126 mg/dL.
Berdasarkan rumus Lameshow et al. 1997, jumlah responden (n) untuk penelitian ini dihitung berdasarkan rumus:
2 (S)2(Zα + Zβ)2 (X1 – X2)2 Keterangan:
n = jumlah responden
S = standar deviasi = 42 mg/dL (Chang et al. 2008)
Zα = 1.96 (α = 5%)
9 X1 = mean kadar glukosa darah dalam plasma setelah intervensi kedelai:
110 mg/dL (Chang et al. 2008)
X2 = mean kadar glukosa darah dalam plasma sebelum intervensi kedelai: 170 mg/dL (Chang et al. 2008)
Berdasarkan rumus di atas diperoleh nilai n adalah 8.55, dengan power of test (Zβ) adalah 5% maka jumlah n = 8.97 atau setara dengan 9. Artinya jumlah responden yang digunakan dalam penelitian ini minimal berjumlah 9 orang untuk masing-masing kelompok. Responden dibagi menjadi 2 kelompok yaitu kelompok responden intervensi tahu (perlakuan) sebanyak 9 orang (4 orang laki-laki dan 5 orang perempuan) dan kelompok kontrol sebanyak 9 orang (4 orang laki-laki dan 5 perempuan). Selanjutnya subjek intervensi dan kontrol akan mengikuti kegiatan sosialisasi di klinik dr. Katili Dramaga, Bogor meliputi pemberian materi edukasi kesehatan, pengambilan darah serta pelaksanaan penlitian. Penelitian ini dilakukan atas persetujuan dari Komisi Etika Penelitian Unika Atma Jaya melalui ethical clearance No: 1154/III/LPPM-PM.10.05/10/2015 (Lampiran 3).
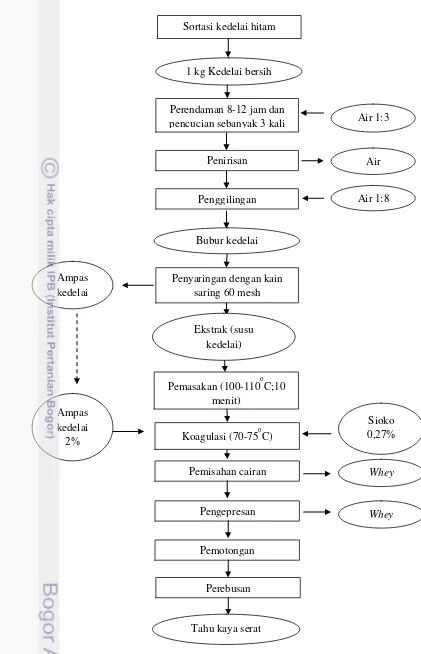
Pembuatan tahu kedelai hitam kaya serat
Proses pengolahan tahu kedelai hitam kaya serat dilakukan dengan beberapa tahap yang mengacu pada Muchtadi (2010). Diagram alir proses pembuatan tahu kedelai hitam dapat dilihat pada Gambar 3.1. Proses pembuatan tahu diawali dengan sortasi kedelai hitam. Biji kedelai yang diperoleh dilakukan penyortiran untuk memperoleh biji kedelai yang baik dengan cara memisahkan dari kotoran serta memilih kedelai dengan biji yang utuh. Kedelai yang telah disortasi kemudian direndam dengan perbandingan berat biji kedelai dengan air adalah 1:3 (b/v). Perendaman dilakukan selama 12 jam, hal ini telah dilakukan secara umum di masyarakat. Menurut Muchtadi (2010), pada umumnya kedelai yang telah dibersihkan dari kotoran direndam dalam air bersih selama 8-12 jam. Perendaman selama 12 jam sudah cukup untuk melunakkan biji kedelai sehingga mudah dilakukan proses penggilingan (pengecilan ukuran). Setelah dilakukan perendaman biji kedelai dibersihkan dan dicuci dengan perbandingan air yang sama 1:3 (sekitar 3 L dalam 1 kg kedelai) sebanyak 3 kali sehingga diperoleh kedelai basah yang bersih.
10
dengan tekanan 2kg/cm2 selama 15 menit. Selanjutnya dilakukan pemotongan dan penyimpanan tahu pada suhu 4 0C.
Intervensi tahu kedelai hitam kaya serat
Tahap intervensi merupakan tahap pemberian produk secara rutin ke rumah responden selama 30 hari pada kelompok intervensi. Produk yang diberikan berupa tahu kedelai hitam dalam bentuk sup tahu yang diberikan setiap sore (pukul 16.00-17.00 WIB) kepada masing-masing responden. Jumlah tahu yang diberikan sebanyak ± 80 gram (mengandung 42.29 g protein dan 9.17 g serat pangan basis kering).
Pengambilan darah responden
Pengambilan darah dilakukan 2 kali selama rangkaian penelitian, yaitu pada tahap awal (sebelum intervensi dimulai, hari ke-0) dan pada akhir kegiatan setelah (hari ke-30). Pengambilan darah diambil oleh tenaga medis klinik dr. Katili. Pengambilan darah diambil melalui vena median cubital sebanyak 10 mL dengan menggunakan syringe 3 cc (BD 3 mL Syringe, Singapore) lalu dimasukkan ke vacutainer (BD Vacutainer, USA) berisi antikoagulan EDTA. Pemisahan sampel plasma dilakukan di Laboratorium Biokimia Pangan Departemen Ilmu dan Teknologi Pangan IPB. Pemisahan plasma dilakukan menggunakan sentrifus pada kecepatan 3000 rpm selama 10 menit. Terdapat 3 lapisan pada hasil sentrifus yaitu plasma, buffy coat, dan eritrosit. Plasma dipisahkan menggunakan syringe 3 cc, lalu dimasukkan ke dalam beberapa eppendorf dan plasma disimpan pada suhu -20oC.
Prosedur Analisis
Analisis komponen bioaktif kedelai hitam dan tahu
a. Analisis kapasitas antioksidan metode DPPH (Xu dan Chang 2008) Persiapan Sampel
Sebanyak 1 gram sampel kering diekstrak menggunakan 10 mL aseton 80 %, dan dimaserasi selama 24 jam pada suhu ruang dengan kecepatan 30 rpm. Ekstrak kemudian disentrifus dengan kecepatan 3000 rpm selama 15 menit. Supernatan kemudian dipisahkan untuk dilakukan pengujian kapasitas antioksidan.
Aktivitas Pengikatan Radikal Bebas DPPH
11
Gambar 3.1 Diagram alir pembuatan tahu kedelai hitam kaya serat Sortasi kedelai hitam
1 kg Kedelai bersih
Perendaman 8-12 jam dan pencucian sebanyak 3 kali
Penirisan
Air 1:3
Air
Penggilingan
Penyaringan dengan kain saring 60 mesh
Air 1:8
Bubur kedelai
Ekstrak (susu kedelai)
Pemasakan (100-110oC;10 menit)
Ampas kedelai
Koagulasi (70-75oC)
Sioko 0,27%
Pemisahan cairan
Pengepresan Ampas
kedelai 2%
Pemotongan
Perebusan
Tahu kaya serat
Whey
12
b. Analisis total fenol (Hodzic et al. 2009)
Sampel kering ditimbang sebanyak 100 mg dan ditambahkan 5 mL etanol 95%, kemudian divortex dalam tabung reaksi bertutup. Tabung berisi campuran tersebut disentrifus dengan kecepatan 3000 rpm selama 15 menit. Supernatan sampel maupun larutan standar diambil sebanyak 0.5 mL dan dimasukkan kedalam tabung reaksi yang bersih. Selanjutnya ditambahkan 0.5 mL etanol 95%, 2.5 mL aquades, dan 2.5 mL reagen Folin-Ciocalteau 50%. Campuran kemudian didiamkan selama 5 menit lalu ditambahkan 0.5 mL Na 5% dan divortex. Tabung reaksi dibungkus dengan aluminium foil dan disimpan diruang gelap selama 1 jam. Setelah itu dilakukan pengukuran absorbansi pada spektrofotometer uv dengan panjang gelombang 725 nm. Analisis kuantitatif total fenol dilakukan dengan membuat kurva standar asam galat konsentrasi (0 ppm, 50 ppm, 100 ppm, 150 ppm, 200 ppm, dan 250 ppm), selanjutnya kadar total fenol sampel dihitung menggunakan kurva standar asam galat yang diperoleh.
c. Analisis kadar antosianin (AOAC 2005)
Sebanyak 1 gram sampel kering dimasukkan ke dalam tabung Erlenmeyer, kemudian ditambah dengan 10 mL HCl 2% dalam metanol (v/v). Sampel kemudian diektraksi selama 15 menit menggunakan magnetic bar, kemudian dilanjutkan dengan proses sentrifugasi dengan kecepatan 3000 rpm selama 15 menit.
Reagen yang digunakan dalam uji ini berupa larutan buffer KCl 0.025 M pH 1.0 dan larutan buffer Natrium Asetat 0.4 M pH 4.5. Sebanyak 2 mL ekstrak sampel dipipet ke dalam labu takar 10 mL, kemudian ditera dengan masing-masing larutan buffer, sehingga untuk tiap sampel terdapat 2 larutan dengan pH berbeda. Masing-masing larutan kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 520 nm dan 700 nm.
Untuk menentukan konsentrasi pigmen antosianin (sianidin-3-glukosida) menggunakan persamaan :
Antosianin (cyanidin-3-glucoside equivalents, mg/L) = A x BM x FP x 1000 ɛ x 1
Keterangan:
A = (A520nm – A700nm)pH 1.0 - (A520nm – A700nm)pH 4.5 BM = berat molekul untuk cyd-3-glu (449.2 g/mol) FP = faktor pengenceran
1000 = faktor konversi dari ke gram ke milligram
ɛ = koefisien ekstinsi (26900 L mol-1 cm -1)
Analisis plasma darah
a. Analisis total kolesterol
13 kolesterol dilakukan secara otomatis oleh alat tersebut dengan prinsip sebagai berikut:
Konsentrasi kolesterol (mg/dL) = A spesimen/Astandar x 200
b. Analisis trigliserida plasma
Metode analisis trigliserida yang digunakan adalah kolorimetri GPO-PAP. Reagen Triglyceride (Elitech) sebanyak 10-20 mL ditambahkan pada plasma darah sebanyak 500 µL, kemudian diinkubasi selama 425 detik menit pada suhu 37 ºC, disentrifus lalu supernatan diinjeksikan pada alat spektrofotometer Selectra Yunior dan dibaca pada panjang gelombang 500 nm. Penghitungan hasil trigliserida dilakukan secara otomatis oleh alat tersebut dengan prinsip sebagai berikut:
Konsentrasi trigliserida (mg/dL) = A spesimen/Astandar x 200
c. Analisis kadar HDL-cholesteol
Metode analisis kadar HDL-cholesterol yang digunakan adalah berdasarkan prinsip presipitasi. Presipitasi dilakukan dengan cara reagen HDL-Cholesterol (Rajawali Nusindo) sebanyak 500 µL ditambahkan pada plasma darah sebanyak 250 µL, kemudian diinkubasi selama 10 menit pada suhu 37 ºC, disentrifus lalu diperoleh. Supernatan dipipet sebanyak 200 µL dan dimasukkan ke dalam reagen cholesterol sebanyak 10 mL pada alat spektrofotometer Selectra Yunior dan dibaca pada panjang gelombang 546 nm. Prinsip analisis adalah LDL dan VLDL pada sampel diendapkan dengan dengan ion phosphotungstate dan magnesium. Setelah disentrifugasi selama 10 menit (4000 rpm), supernatan yang mengandung fraksi HDL ditentukan berdasarkan prinsip sebagai berikut:
Penghitungan hasil HDL dilakukan secara otomatis oleh alat tersebut dengan prinsip sebagai berikut:
Konsentrasi HDL (mg/dL) = A sampel x 200
d. Perhitungan kadar LDL-cholesterol
Penghitungan hasil LDL-cholesterol menggunakan persamaan: Konsentrasi LDL (mg/dL) = Total kolesterol (mg/dL) – HDL-cholesterol
(mg/dL) - (Trigilserida (mg/dL)/5). e. Analisis kadar malonaldehida metode TBARS
14
Singapura). Campuran dipanaskan dalam waterbath suhu 80oC selama 1 jam. Setelah dingin, campuran disentrifuse 3500 rpm 10 menit suhu 4oC. Supernatan jernih diambil dan diukur absorbansi menggunakan microplate reader Benchmark 540 nm. Kemudian hasil absorbansi diplotkan ke kurva standar TEP untuk menghitung kadar MDA plasma.
f. Kapasitas antioksidan plasma metode DPPH
Pengujian kapasitas antioksidan mengacu pada Quassinti et al. (2013).
Sebanyak 180 μL plasma dipipet ke dalam mikrotube 2 mL, kemudian ditambah
dengan 1620 μL reagen DPPH 0.004% b/v (Sigma Aldrich, Singapura). Kontrol
yang digunakan berupa reagen DPPH sebanyak 1620 μL. Sampel maupun kontrol
kemudian disimpan dalam ruang gelap selama 60 menit, kemudian disentrifus selama 10 menit dengan kecepatan 800 g. Supernatan dipipet ke mikroplate
sebanyak 100 μL, kemudian diukur menggunakan microplate reader Benchmark (Bio Rad, Japan) pada panjang gelombang 540 nm dan analisis dilakukan secara triplo. Absorbansi dari tiap sampel didapat dan kapasitas antioksidannya dihitung dengan menggunakan rumus:
%Kapasitas Antioksidan = x 100%
g. Kadar enzim AST/ALT
Metode analisis aspartate transaminase (AST) dan alanine transaminase (ALT) adalah metode kinetik berdasarkan International Federation of Clinical Chemistry (IFCC) (Schumann dan Klauke 2003). Reagen yang digunakan adalah AST (Human) dan ALT (Human) yang kemudian ditambahkan pada plasma darah lalu diinjeksi pada alat RD-60 Semi Auto Biochemistry Analyzer dan dibaca pada panjang gelombang 340 nm. Penentuan hasil analisis dilakukan otomatis oleh alat tersebut. Hasil pembacaan absorbansi dilakukan setelah 90 detik (initial absorbance) dan dibaca lagi setelah 30, 60, dan 90 detik setelah initial absorbance. Hasil analisis akhir adalah rata-rata perubahan absorbansi tersebut per menit yang dihitung dengan rumus sebagai berikut:
AST/ALT (U/L) = 1746 x delta A340nm/menit
Prosedur analisis data
15
4
HASIL DAN PEMBAHASAN
Komponen Bioaktif Kedelai Hitam dan Tahu Kedelai Hitam Kaya Serat
Tabel 4.1 menunjukkan hasil analisis komponen bioaktif kedelai hitam dan tahu kedelai hitam kaya serat. Kadar isoflavon daidzein dan genistein kedelai hitam adalah 1.18 dan 0.59 (µg/g), sedangkan setelah dilakukan pengolahan menjadi tahu diperoleh isoflavon daidzein 24.18 (µg/g) dan genistein 14.86 (µg/g). Proses pengolahan kedelai hitam menjadi tahu dapat meningkatkan kandungan isoflavon melalui proses pemanasan. Suhu yang tinggi dapat merubah profil asam fenolik dan isoflavon kedelai, tetapi tidak berpengaruh terhadap total isoflavon (Slavina et al. 2013).
Total fenol kedelai hitam mengalami punurunan dari 1401.44 mg/1000g menjadi 673.03 mg/1000g pada tahu kedelai hitam. Kehilangan sebagian senyawa fenolik diakibatkan oleh perlakuan pemanasan (perebusan), pencucian dalam air, penyaringan, koagulasi dan kehilangan whey selama pembuatan tahu (Chung et al. 2011). Selain itu, kapasitas antioksidan pada tahu kedelai hitam mengalami penurunan dibandingkan dalam bentuk kedelai hitam. Menurut Xu dan Chang (2008), proses perebusan dan pengukusan menurunkan total fenol, antosianin, aktivitas antioksidan DPPH, FRAP, dan ORAC pada kedelai hitam jika dibandingkan dengan bahan baku kedelai.
Tabel 4.1 Komponen bioaktif kedelai hitam Detam 1 dan tahu kedelai hitam kaya serat
Parameter Kedelai hitam Tahu kaya serat
Bk Bk
Daidzein (µg/g) 1.18 24.18
Genistein (µg/g) 0.59 14.86
Antosianin (mg/1000g) 705.27 148.85
Kapasitas antioksidan (µg/g) 75.16 22.60
Total fenol (mg/1000g) 1401.44 673.03
bk = basis kering
16
Karaketrisik Responden DM tipe 2
Tabel 4.2 menunjukkan karakteristik umum responden penelitian. Responden penelitian terdiri dari laki-laki 8 orang dan perempuan 10 orang. Subjek penelitian yang mengonsumsi obat DM sebanyak 13 orang. Rata-rata usia subjek adalah 53.44 ± 6.58 tahun untuk kelompok intervensi dan 57.00 ± 6.71 tahun untuk kelompok kontrol, secara statistik tidak terdapat perbedaan usia pada kedua kelompok. Rata-rata tinggi badan, berat badan dan IMT (indeks masa tubuh) kedua kelompok tidak terjadi perbedaan yang signifikan. Rata-rata IMT subjek adalah 25.58 ± 1.92 kg/m2 pada kelompok intervensi dan 27.20 ± 3.94 kg/m2 pada kelompok kontrol. IMT kedua kelompok menunjukkan bahwa subjek tergolong obesitas tingkat 1. Tekanan darah kedua kelompok menunjukkan bahwa tekanan darah tergolong hipertensi. Tekanan darah normal adalah < 130/80 mmHg. Hal ini berbeda dengan karakteristik subjek DM tipe 2 yang memiliki tekanan darah normal 126/80 mmHg (Chang et al. 2008). Berdasarkan skrining glukosa darah puasa, diperoleh rata-rata GDP kelompok intervensi 259.74 ± 63.3 mg/dL dan 218.88 ± 118.3 mg/dL untuk kelompok kontrol. Glukosa darah puasa kedua kelompok tidak menunjukkan perbedaan yang signifikan. Glukosa darah kedua kelompok menunjukkan bahwa subjek tergolong DM tipe 2 dengan glukosa darah puasa > 200 mg/dL (Bilous dan Donelly 2015).
Tabel 4.2 Karakteristik responden DM tipe 2
Karakteristik Kelompok p-value
Intervensi Kontrol
Jumlah (orang) 9 9
Laki-laki (orang) 4 4
Perempuan (orang) 5 5
Mengonsumsi obat DM (orang) 7 6
Rata-rata usia (tahun) 53.44 ± 6.58 57.00 ± 6.71 0.27 Rata-rata tinggi badan (m) 1.51 ± 0.07 1.51 ± 0.08 0.85 Rata-rata berat badan (kg) 58.39 ± 4.25 61.33 ± 7.34 0.38* Rata-rata IMT (kg/m2) 25.58 ± 1.92 27.20 ± 3.94 0.28 Tek. Darah Sistolik (mmHg) 154.67 ± 31.38 163.67 ± 25.37 0.51 Tek. Darah Diastolik (mmHg) 90.33 ± 13.11 89.89 ± 10.11 0.94 Glukosa Darah Puasa (mgl/dL) 259.74 ± 63.3 218.88 ± 118.3 0.22
Nilai significancy >0.05 adalah tidak berbeda nyata berdasarkan independent-t test
*
uji non-parametrik Mann-Whitney
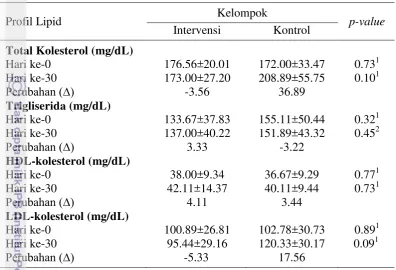
Profil Lipid Responden DM Tipe 2
17 menurun pada kelompok intervensi sedangkan pada kelompok kontrol mengalami kenaikan. Hal yang sama juga terjadi pada penurunan LDL-kolesterol (p=0.09).
Tabel 4.3 Profil lipid responden DM tipe 2 kelompok intervensi dan kontrol
Profil Lipid Kelompok p-value
Intervensi Kontrol Total Kolesterol (mg/dL)
Hari ke-0 176.56±20.01 172.00±33.47 0.731
Hari ke-30 173.00±27.20 208.89±55.75 0.101
Perubahan (∆) -3.56 36.89 Trigliserida (mg/dL)
Hari ke-0 133.67±37.83 155.11±50.44 0.321
Hari ke-30 137.00±40.22 151.89±43.32 0.452
Perubahan (∆) 3.33 -3.22 HDL-kolesterol (mg/dL)
Hari ke-0 38.00±9.34 36.67±9.29 0.771
Hari ke-30 42.11±14.37 40.11±9.44 0.731
Perubahan (∆) 4.11 3.44 LDL-kolesterol (mg/dL)
Hari ke-0 100.89±26.81 102.78±30.73 0.891
Hari ke-30 95.44±29.16 120.33±30.17 0.091
Perubahan (∆) -5.33 17.56
1
Significancyα > 0.05 adalah tidak berbeda nyata berdasarkan independent t-test
2 Significancyα
> 0.05 adalah tidak berbeda nyata berdasarkan ujii non parametrik Man-whitney
Total kolesterol
Berdasarkan independent t-test pada taraf 5%, masing-masing kelompok responden pada hari ke-0 memiliki kadar kolesterol total yang tidak berbeda nyata (p=0.73). Pada Tabel 4.3 dapat dilihat bahwa responden dengan intervensi tahu kedelai hitam kaya serat mengalami penurunan kolesterol, sedangkan pada kelompok kontrol mengalami kenaikan kadar kolesterol setelah 30 hari (p=0.10). Peningkatan kadar kolesterol tidak baik bagi penderita diabetes melitus karena dapat memperparah penyakit. Kadar kolesterol normal dalam darah adalah 140-200 mg/dL. Pada kelompok intervensi diperoleh penurunan kolesterol darah, konsumsi tahu kedelai hitam kaya serat dapat menurunkan kolesterol darah. Menurut Chang et al. 2008, konsumsi kedelai selama 4 minggu tidak memiliki efek penurunan kolesterol yang berbeda terhadap kelompok kontrol.
18
kadar trigliserida. Pada kelompok responden kontrol mengalami kenaikan kadar kolesterol. Peningkatan kadar kolesterol dipengaruhi oleh tingkat konsumsi serat pangan harian responden. Kurangnya konsumsi serat pangan belum mampu menurunkan kolesterol darah. Selain itu, kandungan protein tahu yang mengandung isoflavon berperan dalam menurunkan kolesterol darah. Menurut Crouse et al. (1999), protein kedelai yang mengandung isoflavon signifikan menurunkan kolesterol darah daripada protein kedelai tanpa isoflavon pada manusia.
Trigliserida
Intervensi tahu kedelai hitam kaya serat diharapkan dapat menurunkan dan mengendalikan kadar trigliserida menjadi normal di dalam darah. Pada Tabel 4.3 dapat dilihat bahwa terjadi peningkatan kadar trigliserida di dalam darah kelompok intervensi jika dibandingkan dengan kelompok kontrol. Kadar trigliserida normal di dalam darah adalah berkisar antara 70-150 mg/dL. Pada kelompok intervensi terjadi kenaikan kadar trigliserida sebesar 3,33 mg/dL sedangkan pada kelompok kontrol terjadi penurunan sebesar 3,22 mg/dL. Hasil berbeda ditunjukkan oleh Chang et al. (2008), konsumsi kedelai pada responden diabetes mampu menurunkan kadar trigliserida secara signifikan dibandingkan kelompok kontrol dengan mekanisme serat pangan pada kedelai mampu memperlambat penyerapan glukosa dan asam lemak pada usus halus, sehingga ketersediaan substrat untuk sintesis trigliserida berkurang.
Terjadinya peningkatan trigliserida pada kelompok intervensi dipengaruhi oleh jumlah diet lemak pada beberapa responden yang meningkat. Tetapi, tahu kedelai hitam dapat menjaga kadar trigliserida darah dalam keadaaan normal. Hal ini menunjukkan bahwa konsumsi tahu kedelai hitam belum mampu menurunkan kadar trigliserida plasma yang dipengaruhi oleh peningkatan asupan lemak pada diet responden. Sebaliknya, pada kelompok kontrol penurunan yang terjadi pada kadar trigliserida darah dipengaruhi edukasi diet sehat selama penelitian berlangsung. Penurunan trigliserida darah pada kelompok kontrol tetap masih tergolong hypertrigliserida (>150 mg/dL). Menurut Tungland dan Meyer (2002) pada subyek normal serat pangan lebih menurunkan kadar trigliserida. Serat pangan kedelai signifikan dalam menurunkan kadar trigliserida pada tikus diabetes (Zacharia 1983).
HDL-kolesterol
Kadar HDL normal di dalam darah adalah 35-55 mg/dL. Pada Tabel 4.3 terlihat bahwa terjadi peningkatan kadar HDL pada kedua kelompok responden. Responden kelompok intervensi rata-rata mengalami peningkatan kadar HDL yang lebih tinggi dibandingkan responden kelompok kontrol. Pada kedua kelompok keadaan kolesterol HDL dari hari ke-0 dan ke-30 memiliki kadar HDL-kolesterol yang normal.
19 isoflavon kedelai memiliki efek esterogenik yang bermanfaat dalam meningkatkan kolesterol-HDL dan menurunkan kolesterol-LDL. Menurut Chang et al. (2008), konsumsi kedelai pada responden diabetes tidak berbeda nyata dengan kelompok kontrol dalam meningkatkan HDL-kolesterol. Sedangkan menurut Rucita (2012), konsumsi yogurt kedelai hitam pada pria penderita dislipidemia sebanyak 225 mL selama 21 hari dapat meingkatkan kolesterol-HDL. LDL-kolesterol
Kadar LDL normal di dalam darah adalah <150 mg/dL. Pada Tabel 4.3 dapat dilihat bahwa terjadi penurunan kadar LDL setelah pemberian tahu kedelai hitam kaya serat selama 30 hari. Pada kelompok kontrol terjadi kenaikan setelah 30 hari penelitian, meskipun secara statistik tidak berbeda nyata (p=0.13). Penurunan kadar kolesterol-LDL pada kelompok intervensi diduga karena pengaruh dari protein, serat pangan, isoflavon, dan antioksidan pada tahu kedelai hitam. Sedangkan pada kelompok kontrol berbanding terbalik dikarenakan kurangnya komponen serat pangan, komponen bioaktif dan kontrol diet yang baik. Terjadinya penurunan kolesterol-LDL menunjukkan bahwa komponen gizi dan bioaktif memberikan efek positif. Hal yang sama ditunjukkan oleh Rucita (2012), bahwa konsumsi 115 mL yogurt kedelai hitam selama 21 hari mampu menurunkan kadar LDL penderita dislipidemia. Namun, temuan Chang et al. (2008), konsumsi kedelai selama 28 hari pada penderita diabetes meningkatkan kolesterol-LDL jika dibandingkan dengan kelompok kontrol yang menurun. Konsumsi protein kedelai dapat meregulasi reseptor LDL pada manusia (Sirtori et al. 1995), jumlah reseptor LDL mRNA pada sel mononuklear lebih tinggi pada subjek yang mengonsumsi protein kedelai dibandingkan dengan yang mengonsumsi kasein (Baum et al. 1998). Konsumsi protein kedelai sebanyak 25-50 g per hari aman dan efektif dalam menurunkan kolesterol-LDL sebanyak 4-8%. (Erdman 2000).
Kapasitas Antioksidan
20
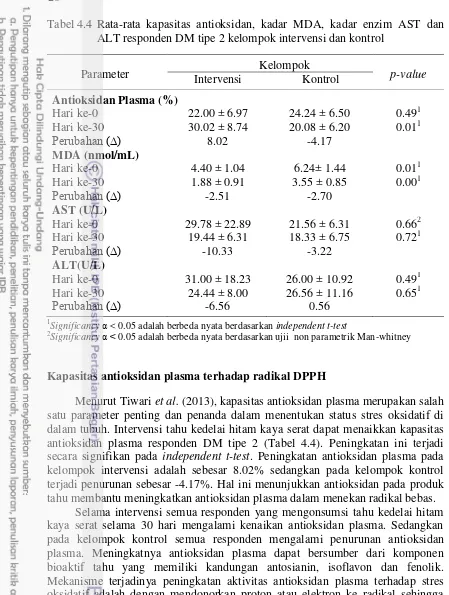
Tabel 4.4 Rata-rata kapasitas antioksidan, kadar MDA, kadar enzim AST dan ALT responden DM tipe 2 kelompok intervensi dan kontrol
Parameter Intervensi Kelompok Kontrol p-value Antioksidan Plasma (%)
< 0.05 adalah berbeda nyata berdasarkan independent t-test
2Significancyα <
0.05 adalah berbeda nyata berdasarkan ujii non parametrik Man-whitney
Kapasitas antioksidan plasma terhadap radikal DPPH
Menurut Tiwari et al. (2013), kapasitas antioksidan plasma merupakan salah satu parameter penting dan penanda dalam menentukan status stres oksidatif di dalam tubuh. Intervensi tahu kedelai hitam kaya serat dapat menaikkan kapasitas antioksidan plasma responden DM tipe 2 (Tabel 4.4). Peningkatan ini terjadi secara signifikan pada independent t-test. Peningkatan antioksidan plasma pada kelompok intervensi adalah sebesar 8.02% sedangkan pada kelompok kontrol terjadi penurunan sebesar -4.17%. Hal ini menunjukkan antioksidan pada produk tahu membantu meningkatkan antioksidan plasma dalam menekan radikal bebas.
21 (2013) menyatakan stres oksidatif menurunkan kapasitas antioksidan (FRAP) pada 22 pasien diabetes yang disebabkan meningkatnya konsentrasi glukosa darah yang dapat menyebabkan kerusakan jaringan. Selain itu, meningkatnya stres oksidatif dapat menurunkan kapasitas antioksidan yang berhubungan dengan komplikasi pasien diabetes seperti kerusakan DNA dan resistensi insulin (Lodovicia et al. 2008)
Kadar malonaldehida
Tabel 4.4 menunjukkan bahwa semua responden DM tipe 2 yang mengonsumsi tahu kedelai hitam kaya serat mengalami penurunan kadar malonaldehida 2.51 nmol/mL, sedangkan pada kelompok kontrol juga terjadi penurunan pada 7 dari 9 orang responden dengan rata-rata perubahan 2.70 nmol/mL. MDA merupakan biomarker utama radikal bebas yang disebabkan oleh kerusakan lipid dan stres oksidatif (Shodehinde dan Oboh 2013).
Secara statistik kadar MDA masing-masing kelompok sebelum dilakukan intervensi tahu kedelai hitam mengalami perbedaan nyata (Tabel 4.4). Kadar MDA kelompok kontrol lebih tinggi dari kelompok intervensi. Hal yang sama juga terjadi setelah intervensi selama 30 hari yaitu kedua kelompok masing-masing mengalami penurunan kadar MDA menjadi 1.88 nmol/mL (kelompok intervensi) dan 3.55 nmol/mL (kelompok kontrol). Secara statistik tidak terjadi perubahan kadar MDA plasma secara signifikan pada kedua kelompok yaitu -2,51 nmol/mL untuk kelompok intervensi dan perubahan sebesar -2.70 nmol/mL untuk kelompok kontrol. Menurut Turk et al. (2002), ditemukan tingginya tingkat TBARS pada pasien diabetes sebesar 4.53 µmol/L. Tingginya kadar MDA responden pada keadaan awal berhubungan erat dengan keadaan dislipidemia yang terjadi pada responden. Lipolisis yang terjadi akibat pembentukan energi baru dari lemak menyebabkan oksidasi lipid yang menghasilkan tingginya kadar MDA di dalam plasma.
Penurunan kadar MDA lebih besar terjadi pada kelompok kontrol yaitu penurunan sebesar 2.70 nmol/mL sedangkan pada kelompok intervensi penurunan hanya sebesar 2.51 nmol/mL. Penurunan MDA yang lebih besar pada kelompok kontrol dipengaruhi oleh penurunan jumlah asupan lemak selama 30 hari berdasarkan food recall sedangkan asupan lemak pada kelompok intervensi sama terjadi peningkatan pada hari ke 30. Hal ini menunjukkan edukasi pengendalian asupan diet, aktivitas fisik, dan manajemen stress berdampak pada penurunan MDA plasma. Menurut Chang et al. (2008), konsumsi kedelai pada responden diabetes tidak berbeda nyata menurunkan kadar MDA plasma dibandingkan dengan kelompok kontrol. Status antioksidan pada pasien diabetes melitus tipe 2 mengalami penurunan dan terjadi peningkatan kadar MDA plasma jika dibandingkan dengan kontrol sehat (Rani dan Mythili 2014). Tingginya kadar MDA plasma berhubungan erat dengan tingginya glukosa darah, HbA1c, dan dislipidemia. Hal ini didukung dengan temuan Bandeira et al. (2012), karakteristik stres oksdatif darah pada pasien diabetes dilaporkan bahwa lipid peroksidasi berhubungan erat dengan tingginya glukosa darah yang diamati dari kadar glukosa darah puasa dan HbA1c.
22
Kadar enzim AST/ALT
Tabel 4.4 menunjukan bahwa rata-rata penurunan nilai AST pada kelompok intervensi sebesar 10.33 U/L sedangkan pada kelompok kontrol sebesar 3.22 U/L. Pada kelompok intervensi dan kontrol sama-sama terjadi perbaikan, meskipun secara statistik tidak berbeda nyata. Selama penelitian terlihat bahwa 7 dari 9 orang yang mengonsumsi tahu kedelai hitam kaya serat mengalami penurunan kadar AST. Walaupun terjadi kenaikan kadar AST pada beberapa responden intervensi, namun kenaikan tersebut masih berada pada batas normal. Penurunan kadar AST pada kelompok kontrol adalah sebanyak 6 dari 9 orang responden, sedangkan 3 responden mengalami kenaikan.
Secara statistik kedua kelompok menunjukkan tidak berbeda nyata (Tabel 4.4). Pada perlakuan intervensi tahu, menunjukkan bahwa konsumsi tahu selama 30 hari dapat menurunkan nilai AST dengan perbaikan melalui komponen bioaktif yang terdapat pada tahu sebagai antioksidan dan komponen gizi protein tahu. Leiter et al. (2015) menyatakan, canagliflozin dengan konsentrasi 100 dan 300 mg dapat memperbaiki fungsi hati dengan menurunnya nilai aspartate transaminase (AST) dan alanine aminotransferase (ALT) secara signifikan dibandingkan dengan plasebo.
Penurunan kadar ALT responden yang mengonsumsi tahu kedelai hitam kaya serat selama 30 hari rata-rata terjadi sebanyak 6.56 U/L. Sedangkan pada kelompok kontrol terjadi peningkatan kadar enzim ALT yaitu 0.56, walaupun secara statistik adalah tidak berbeda nyata. Intervensi tahu kedelai hitam kaya serat dapat menurunkan kadar ALT pada kelompok intervensi, sedangkan pada kelompok kontrol terjadi peningkatan.
23
5
SIMPULAN DAN SARAN
Simpulan
Hasil penelitian menunjukkan bahwa intervensi tahu kedelai hitam kaya serat bermanfaat dalam memperbaiki metabolisme lipid dan meningkatkan kapasitas antioksidan pada diet responden DM tipe 2. Intervensi tahu kedelai hitam dapat menurunkan total kolesterol sebesar 3.56 mg/dL sedangkan pada kelompok kontrol mengalami kenaikan 36.89 mg/dL, intervensi tahu kedelai hitam dapat menurunkan LDL-kolesterol sebanyak 5.33 mg/dL sedangkan kontrol mengalami kenaikan 17.56 mg/dL. Intervensi tahu kedelai hitam dapat meningkatkan kapasitas antioksidan sebesar 8.02% sedangkan kontrol mengalami penurunan 4.17%, intervensi tahu kedelai hitam dapat menurunkan kadar enzim alanine transaminase sebesar 6.56 U/L sedangkan kontrol mengalami kenaikan sebesar 0.56 U/L.
Saran
24
DAFTAR PUSTAKA
Abdel-Aal NM, Ahmad AT, Froelicher ES., Batieha AMS., Hamza MM, Ajlouni KM. 2008. Prevalence of dyslidemia in patients with type 2 diabetes in Jordan. Saudi Med J Vol 29 (10): 1423-1428.
[ADA] American Diabetes Association. 2015. Fast Facts Data and Statistic about Diabetes. http://professional.diabetes.org/search/site/facts [10 Desember 2015]
Anderson, JW, Johnstone, BM, Cook-Newll ME. 1995. Meta analysis of the effects of soy protein intake on serum lipids. New England Journal of Medicine, 333 : 276–282
Anderson JW, Smith BM, Washnock C S. 1999. Cardiovascular and renalbenefits of dry bean and soybean intake. American Journal of Clinical Nutrition 70 : 464S–474.
Anderson JW, Allgood LD, Lawrence A, Altringer LA, Jerdack GR Hengehold DA, Morel JG. 2000. Cholesterol-lowering effects of psyllium intake adjunctive to diet therapy in men and women with hypercholesterolemia: meta-analysis of 8 controlled trials. Am J Clin Nutr. 71:472-479
[AOAC] Association of Official Analytical Chemistry. 2005. Total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines [Internet]. [diunduh 2015 Juni 26]. Tersedia pada https://www.researchgate.net/publication/260264533_AOAC_200502_Total Monomeric_Anthocyanin_Pigment_Content_of_Fruit_Juices_Beverages_N atural_Colorants_and_Wines-_pH_Differential_Method
Atmaja KJW, Sari SP, Azizahwati. 2010. Efek hepatoprotektif infus daun sukun (Artocarpus altilis (Park.) FSB.) terhadap kerusakan hati tikus yang diinduksi dengan karbon tetraklorida. Majalah Ilmu Kefarmasian. 7(2): 27-42
Baum JA, Teng H, Erdman JW Jr, et al. 1998. Long-term intake of soy protein improves blood lipid profiles and increases mononuclear cell low-density-lipoprotein receptor messenger RNA in hypercholesterolemic, postmenopausal women. Am J Clin Nutr. 1998;68:545–551.
Bandeira SDM, Guedes SDG, Fonseca LJS, Pires AS, Gelain DP, dan Moreira JC. 2012. Characterization of blood oxidative stress in type 2 diabetesmellitus patients: increase in lipid peroxidation and SODactivity. OxidativeMedicine andCellular Longevity. vol. 2012. Article ID 819310, hal 12.
Bhathena SJ, Velasquez MT. 2002. Beneficial role of dietary phytoestrogens in obesity and diabetes. Am J Clin Nutr, 76:1191–1201.
Bilous R Donelly R. 2015. Buku Pegangan Diabetes Edisi Ke 4. 3-8. Bumi Medika, Jakarta
Ceriello A, Motz E. 2004. Is oxidative stress the pathogenic mechanism underlying insulin resistance, diabetes and cardiovascular desease? The common soil hypothesis revisited. Arterioscler Thromb Vas Biol. 24: 816-823
25 antioxidant enzyme activity in type 2 diabetes mellitus patients. J Nutrition Research and Practice. 2(3): 152-157.
Chung IM, Seo SH, Ahn JK, Kim SH. 2011. Effect of processing, fermentation and aging treatment to content and profile of phenolic compounds in soybean seed, soy curd andv soy paste. Food Chem. 127: 960-967
Crouse JR III, Morgan T, Terry JG, et al. 1999. A randomized trial comparing the effect of casein with that of soy protein containing varying amounts of isoflavones on plasma concentrations of lipids and lipoproteins. Arch Intern Med. 159:2070 –2076
Demigne C, Morand C, Levrat AM, Besson C, Moundras C, Remesy C. 1995. Effect of propionat on fatty acid and colesterol synthesis and on acetate metabolism in isolated rat hepatocytes. Br J Nutr, 74: 209-219
Dominic S. 2011. Diabetic Dyslipidemia: From Evolving Pathophysiological Insight to Emerging Therapeutic Targets. Can J Diabetes 37: 319-326 Donkor ON, Shah NP. 2008. Production of β-glucosidase and hydrolysis of
isoflavone Phytoestrogens by Lactobaccillusacidophylus, Bifidobacterium lactis, and lactobacillus casei in Soymilk. Journal of Food Science. 73 (1) : 15 – 20.
Erdman JW. 2000. Soy Protein and Cardiovascular Disease A Statement for Healthcare Professionals From the Nutrition Committee of the AHA. Circulation. 102(20):2555-2559.doi: 10.1161/01.CIR.102.20.2555
Ginting E, Sri SA, Sri W. 2009. Varietas unggul kedelai untuk bahan baku industri pangan. Jurnal Litbang Pertanian, 28 (3).
Handayani W, Rudijanto A, Indra MR. 2009. Soybeen milk reduce insulin resistant in rattus norvegicus of type 2 model diabetes melitus. J Kedokteran Brawijaya. XXV (2) : 60–66.
Hodzic Z, H Pasalic, A Memsevic, M Saletovic, M Polkakovic. 2009. The infuence of total phenols content on antioxidant capacity in the whole grain extracts. Eur J. Of Sci Res. 28(3): 471-477
Hooper L, Kroon P A, Rimm E B, Cohn J S, Harvey I, Le Cornu K A. 2008.
Flavonoids, flavonoid-rich foods, and cardiovascular risk: A meta-analysis of randomised controlled trials. American Journal of Clinical Nutrition 88 : 38–50.
Jin-rui X, Ming-weil Z, Xing-hua L, Zhang-xiong L, Rui-fed Z, Ling S and Li-juad Q. 2007. Correlation Between Antioxidation and the Content of Total Phenolics and Anthocyanin in Black Soybean Accessions. Agricultural Sciences in China. 6(2): 150-158. DOI:10.1016/s1671-2927(07)60029-7
Kim HJ, Xu L, Chang KC, Shin SC, Chung JI, Kang D, Kim S, Hur JA, Choi TH,Kim S, Choi J. 2012. Anti-inflammatory effects of anthocyanins from black soybean seed coat on the keratinocytes and ischemia-reperfusion injury in rat skin flaps. Microsurgery. DOI: 10.1002/micr.22019
26
Kusbiantoro B. 1993. Sifat fisiko kimia dan karakteristik protein kedelai (Glycine max (L.) Merril) dalam hubungannya dengan mutu tahu yang dihasilkan. [Tesis]. Bogor : Institut Pertanian Bogor.
Kusumaningsih T, Ariani SRD, Agustina W. 2006. Profil kandungan daidzein dan genistein pada tempe gembus selama proses fermentasi. J. Alchemy. 5(1):45-53. ISSN 1412-4092
Lameshow S, Hosmer Jr, Klar J dan Lwanga SK. 1997. Besar Sampel dalam Penelitian Kesehatan. Gajah Mada University Press.
Leiter LA, Forst T, Polidori D, Balis DA, Xie J, Sha S. 2015. Effect of canagliflozin on liver function tests in patients with type 2 diabetes. Diabete s Metab .DOI:10.1016/j.diabet.2015.10.003
Liu ZM et al. 2010. Effect of soy protein and isoflavone on glycemic control and insulin sensitivity : a 6-mo double-blind, randomized, placebo-controlled trial in postmenopausal Chinese women with prediabetes or untreated early diabetes. Am J Clin Nutr. 91 : 1394 – 1401.
Lodovicia M, Giovannellia L, Pitozzia V, Bigaglia E, Bardinib G, dan Rotellab CM. 2008. Oxidative DNA damage and plasma antioxidant capacity in type 2 diabetic patients with good and poor glycaemic control. Mutation Research. 638: 98–102
Mahrooz A, Parsanasab H, Hashemi-Soteh MB, Kashi Z, Bahar A, Alizadeh A, Mozayeni M. 2014. The role of clinical response to metformin in patients newly diagnosed with type 2 diabetes: a monotherapy study. Clin Exp Med. doi:10.1007/s10238-014-0283-8
Messina MJ. 2002. Soy foods and soybean isoflavones and menopausal health. Nutr Clin Care, 5: 272–282.
Michihiro S. 2006. Soy in health and disease prevention. New York: Taylor and Francis Group.
Muchtadi D. 2010. Kedelai Komponen Untuk Kesehatan. 39-49. Alfabeta, Bandung
Murota K et al. 2002. Unique uptake and transport of isoflavone aglycones by human intestinal caco-2 cells : comparation of isoflavonoids and flavonoids. J American Society for Nutritional Sciences. 132 : 1956 – 1961.
Naim, M.B., Gestetner, S. Zilkah, Y. Bilk, A. Bondi. 1974. Soybean isoflavone, characteristic, determination and antifungal activity. J. Agric. Food Chem. 22(5): 806-809.
Nurrahman. 2015. Evaluasi komposisi zat gizi dan senyawa antioksidan kedelai hitam dan kedelai kuning. Jurnal Aplikasi Teknologi Pangan 4 (3): 89-93. Pardede SO. 2008. Nefropati Diabetic pada Anak. J Sari Pediatri. 10 (1) : 8-17 Poysa V, Woodrow L. 2002. Stability of soybean seed composition and its effect
on soymilk and tofu yield and quality. Food Research International, vol. 35, no. 4, pp. 337–345.
27 Rani AJ, Mythili SV. 2014. Study on Total Antioxidant Status in Relation to Oxidative Stress in Type 2 Diabetes Mellitus. Journal of Clinical and Diagnostic Research. 8(3): 108-110. DOI: 10.7860/JCDR/2014/7603.4121 Rucita A. 2012. Pengaruh pemberian yoghurt kedelai hitam (black soyghurt)
terhadap kadar kolesterol LDL dan HDL pada penderita dislipidemia. [Artikel Penelitian]. Program studi Ilmi Gizi, Fakultas Kedokteran, Universitas Diponegoro.
Sabuluntika G. 2013. Kadar β-karoten, antosianin, isoflavon, dan aktivitas antioksidan pada snack bar ubi jalar kedelai hitam sebagai alternatif makanan selingan penderita diabetes melitus tipe 2. [Artikel Penelitian]. Program Studi Ilmu Gizi, Fakultas Kedokteran : Universitas Diponegoro.
Schumann G, Klauke R. 2003. New IFCC reference procedures for the determination of catalytic activity concentrations of five enzymes in serum: preliminary upper reference limits obtained in hospitalized subjects. Clinica Chimica Acta. 327: 69–79.DOI: 10.1016/S0009-8981(02)00341-8 Setiawan B, Suhartono E. 2005. Stres oksidatif dan peran antioksidan pada
diabetes mellitus. Maj. Kedokt. Indon. 55(2): 86-91
Shih MC, Yang KT, Kuo SJ. 2002. Quality and antioxidative activity of black soybean tofu as affected by bean cultivar. Journal of Food Science, Vol. 67, Nr. 2.
Shodehinde SA, Oboh G. 2013. Antioxidant properties of aqueous extracts of unripe Musa paradisiaca on sodium nitroprusside induced lipid peroxidation in rat pancreas in vitro. Asian Pacific Journal of Tropical Biomedicine. 3(6):449–457
Shokunbi SO, Babajide O, Otaigbe DO, Tayo GO. 2011. Effect of coagulants on the yield nutrient and antinutrient composition of Tofu. Archives of Applied Science Research, vol. 3, no. 3, pp. 522–527.
Singh RP, Murthy KNC, Jayaprakasha GK. 2002. Studies on antioxidant activity of pomegranate (punica granatum) peel and seed extracts using in vitro models. J. Agric. Food Chem. 50(1): 81–86
Sirtori CR, Lovati MR, Manzoni C, et al. 1995. Soy and cholesterol reduction: clinical experience. J Nutr.125:598S-605S.
Skyler JS. 2004. Diabetes mellitus: pathogenesis and treatment strategies.J. Med. Chem. 47:4113–411).
Slavina M, Lu Y, Kaplan N, Yu L. 2013. Effects of baking on cyanidin-3 glucoside content and antioxidant properties of black and yellow soybean cr ackers. Food chemistry 141; 1166-1174. doi:10.1016/J.FOODCHEM.2013. 04.039
Suriawiria U. 2002. Ikan dan Kedelai Sebagai Obat Jantung dan Diabetes. Jakarta: Rapas Sinar Sinanti.
Taku K, Umegaki K., Sato Y, Taki Y, Endoh K., Watanabe S. 2007. Soy isoflavones lower serum total and LDL cholesterol in humans: A meta-analysis of 11 randomised controlled trials. American Journal of Clinical Nutrition, 85 : 1148–1156.