POTENSI EKSTRAK BAKTERI LAUT YANG BERASOSIASI
DENGAN SPONS SEBAGAI ANTIKANKER DAN
ANTIOKSIDAN
ANNISA WULAN AGUS UTAMI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul Potensi Ekstrak Bakteri Laut yang Berasosiasi dengan Spons sebagai Antikanker dan Antioksidan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014 Annisa Wulan Agus Utami
RINGKASAN
ANNISA WULAN AGUS UTAMI. Potensi Ekstrak Bakteri Laut yang Berasosiasi dengan Spons sebagai Antikanker dan Antioksidan. Dibimbing oleh ARIS TRI WAHYUDI dan IRMANIDA BATUBARA.
Kanker merupakan penyakit paling mematikan kedua di dunia setelah penyakit jantung. Kanker disebabkan oleh pertumbuhan sel yang tidak terkendali sehingga dapat mengganggu bentuk dan fungsi jaringan sel lainnya. Salah satu penyebab kanker ialah radikal bebas yang menyebabkan stres oksiidatif pada tubuh manusia. Antioksidan berperan penting bagi tubuh manusia dalam menetralisir radikal bebas yang mengakibatkan penyakit degeneratif termasuk kanker. Jumlah penderita kanker di dunia terus meningkat, saat ini jumlahnya meningkat sekitar 7 juta penderita kanker dari tahun sebelumnya. Menurut WHO, di Indonesia terjadi sebanyak 165 kasus kanker dalam 100 000 penduduk. Kanker leher rahim merupakan salah satu penyebab utama kematian wanita yang berhubungan dengan kanker. Kanker leher rahim menyebabkan 270 000 kematian setiap tahunnya. Sekitar 85% kasus kanker leher rahim terjadi di negara-negara berkembang.
Produk bahan bioaktif yang berasal dari spons telah diteliti memiliki potensi sebagai antikanker dan antioksidan. Namun, pemanfaatan spons sebagai sumber bahan bioaktif tidak efektif karena memerlukan biomassa yang cukup besar dan waktu budidaya yang lama. Isolasi bakteri yang bersimbiosis dengan spons merupakan strategi yang dapat digunakan untuk memproduksi berbagai bahan bioaktif dalam jumlah besar melalui produksi pengkulturan mikroba. Mikroorganisme yang berpotensi menghasilkan bahan bioaktif dicirikan dengan adanya gen penyandi enzim poliketid sintase (PKS) dan nonribosomal poliketid sintase (NRPS) yang dapat dideteksi melalui analisis keberadaan fragmen DNA penyandi domain ketosintase (KS) dan domain adenilase (A). Oleh karena itu, penelitian ini bertujuan menentukan potensi ekstrak dari bakteri laut yang berasosiasi dengan spons sebagai antikanker dan antioksidan serta mendeteksi keberadaan gen penyandi senyawa bioaktif dari bakteri laut yang berasosiasi dengan spons. Metode yang digunakan dalam penelitian ini yaitu dimulai dengan ekstraksi bahan bioaktif, pengujian kandungan kimia, uji antikanker dengan menggunakan metode MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide), uji aktivitas antioksidan dengan metode DPPH (2,2-difenil-1- pikrilhidrazil) dan metode CUPRAC (Cupric Ion Reducing Antioxidant Capacity), serta deteksi gen yang berperan dalam sintesis senyawa bioaktif dari bakteri yang berasosiasi dengan spons dengan cara amplifikasi domain KS dan domain A menggunakan teknik PCR. Bakteri yang berasosiasi dengan spons yang digunakan dalam penelitian ini yaitu SAB 31, SAB 35, SAB 38, SAB 40, SAB E-41, SAB E-57, HAL-08, dan HAL-20 yang merupakan bakteri yang berasosiasi dengan spons Jaspis sp. dan Haliclona sp.
kandungan flavonoid, alkaloid, dan triterpenoid. Selain itu ekstrak bakteri SAB E-38 dan SAB E-41 juga memiliki kandungan steroid. Senyawa dari golongan flavonoid, alkaloid, dan terpenoid telah diteliti memiliki aktivitas sebagai antioksidan dan antikanker. Ekstrak yang memiliki aktivitas antikanker dengan nilai IC50 terbaik dan yang memiliki nilai aktivitas tertinggi dalam meredam radikal bebas DPPH yaitu ekstrak bakteri SAB E-40. Nilai IC50 ekstrak bakteri SAB E-40 yaitu 234.59µg mL-1 dengan aktivitas peredaman radikal bebas DPPH pada konsentrasi 100 µg mL-1 dan 200 µg mL-1 yaitu 10.09% dan 19.34%. Ekstrak yang memiliki nilai kapasitas antioksidan tertinggi adalah ekstrak bakteri HAL-08 sebesar 649.92 µmol troloks/g ekstrak. Isolat HAL-08 dan HAL-20 terdeteksi memiliki DNA penyandi domain KS dan domain A dengan ukuran untuk domain KS yaitu 700 pasang basa dan domain A yaitu 1000 pasang basa. Berdasarkan analisis bioinformatika sekuen fragmen DNA penyandi domain ketosintase menunjukkan isolat HAL-8 dan HAL-20 memiliki tingkat homologi masing-masing sebesar 91% dan 99% dengan sekuen hybrid PKS/NRPS dari kluster gen PKS Bacillus subtilis. Tingkat homologi pada sekuen domain A isolat HAL-08 dan HAL-20 memiliki homologi masing-masing sebesar 51% dan 99% dengan domain adenilase dari kluster gen NRPS Bacillus subtilis.
SUMMARY
ANNISA WULAN AGUS UTAMI.The Potency of Extract from Marine Bacteria are Associated with Sponges as Anticancer and Antioxidant. Supervised by ARIS TRI WAHYUDI and IRMANIDA BATUBARA.
Cancer is the second leading cause of mortality in the world after cardiovascular diseases. This disease is caused by uncontrolled cell growth which interfere the function of another cell. The uncontrolled cell growth happens due to genes mutations that regulate the cell cycle. Apparently, most cancer cells are under oxidative stress from free radicals which disrupt the DNA bases of genetic information and continue to the formation of cancer cells. Antioxidants play an important role for the human body in neutralizing free radicals that lead to degenerative diseases including cancer. The number of cancer patients in the world increase approximately 7 million compared than the previous year. According to WHO, In Indonesia there were 165 cases of cancer in 100 000 population. Cervical cancer is one of the main cancer diseases that cause female mortality. Cervical cancer causes 270 000 deaths annually. Approximately 85% of cervical cancer cases occur in developing countries.
Bioactive from natural product such as sponges had potency as anticancer and antioxidant; however, the utilization of sponges as bioactive compounds are not effective because it requires a large number of biomass and need long time to be cultured the sponge. Isolation of symbiotic bacterial with sponges is a strategy that can be used to produce a wide range of bioactive compounds in large quantities through the production of microbial culturing. Microorganisms which have potency to produce bioactive compounds are characterized by gene that encode the ketosynthase (KS) domain of polyketide synthase (PKS) and adenylase (A) domain of non-ribosomal polyketide synthase (NRPS) which play role in the synthesis of bioactive compounds. This study aimed to find anticancer and antioxidant potency of extracts marine bacteria which associated with sponges and correlated with the synthesis of bioactive compounds. The method used in this study were extraction of bioactive, analysis of chemical content, analysis of anticancer activity by MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide) assay, analysis of antioxidant activity by DPPH (2,2-difenil-1- pikrilhidrazil) and CUPRAC (Cupric Ion Reducing Antioxidant Capacity) assay, and the detection of genes that play role in the synthesis of bioactive compounds from bacteria associated with the sponges by PCR amplification of KS domain and A domain. Bacteria associated with sponges used in this study were the isolates of SAB E-31, SAB E-35, SAB E-38, SAB E-40, SAB E-41, SAB E-57, HAL-08 and HAL-20 from sponges Jaspis sp. and Haliclona sp.
the highest reduced of DPPH free radicals was achieved by the extract of SAB E-40. The IC50 values of SAB E-40 was 234.59 µg mL-1 and the activity value of reducing DPPH free radicals in the concentration of 100 µg mL-1 and 200 µg mL -1
were 10.09% and 19.34% respectively. The highest antioxidant activity was gained by HAL-08 extract with antioxidant capacity was up to 641.38 μmol troloks/g extract. The isolates of HAL-08 and HAL-20 were detected having the KS and A domain-coding DNA with the size of 700 bp and 1000 bp respectively. Sequencing analysis of DNA fragment encodes KS domain using BlastX program indicated that the isolates of HAL-08 and HAL-20 showed 91% and 99% of similarity level to the sequence of the hybrid PKS/NRPS gene cluster of PKS from Bacillus subtilis. The sequence homology level in A domain from the isolates of HAL-08 and HAL-20 showed 51% and 99% of similarity level respectively with the peptide synthase domain of NRPS gene cluster from Bacillus subtilis.
© Hak Cipta Milik IPB, Tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
POTENSI EKSTRAK BAKTERI LAUT YANG BERASOSIASI
DENGAN SPONS SEBAGAI ANTIKANKER DAN
ANTIOKSIDAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Potensi Ekstrak Bakteri Laut yang Berasosiasi dengan Spons sebagai Antikanker dan Antioksidan
Nama : Annisa Wulan Agus Utami NIM : G351130326
Disetujui oleh Komisi Pembimbing
Prof Dr Aris Tri Wahyudi, MSi Ketua
Dr Irmanida Batubara, MSi Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Desember 2013 hingga Juni 2014 ini ialah Potensi Ekstrak Bakteri Laut yang Berasosiasi dengan Spons sebagai Antikanker dan Antioksidan.
Selama menjalani perkuliahan hingga terselesaikannya tesis ini, penulis banyak mendapatkan bantuan moral maupun material dari berbagai pihak. Terima kasih penulis ucapkan kepada Prof Dr Aris Tri Wahyudi, MSi dan Dr Irmanida Batubara, MSi selaku komisi pembimbing atas kesabarannya dalam memberikan saran, bimbingan, dukungan dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Penulis berterima kasih atas sebagian dana penelitian yang didanai oleh Proyek Unggulan Perguruan Tinggi 2012 kepada Prof Dr Aris Tri Wahyudi, MSi. Penulis juga berterimakasih atas beasiswa pendidikan pascasarjana freshgraduate yang diperoleh dari Direktorat Jenderal Pendidikan Tinggi (DIKTI) pada tahun 2013. Terima kasih juga penulis sampaikan kepada Dr Ir Akhmad Endang Zainal Hasan, MSi atas kesediaannya sebagai penguji luar komisi yang telah memberikan saran dan bimbingan dalam penyempurnaan tesis ini. Terima kasih juga penulis sampaikan kepada Prof Dr Anja Meryandini MS atas kesediaannya sebagai penguji mutu lulusan program studi Mikrobiologi Pascasarjana IPB.
Disamping itu, penghargaan penulis sampaikan kepada Ibu Silmi dari Pusat Studi Satwa Primata, Ibu Salina, Ibu Ninuk dan Bapak Endi dari Pusat Studi Biofarmaka LPPM IPB, laboran Mikrobiologi dan laboran Kimia Analitik yang telah membantu selama penelitian. Penulis berterimakasih kepada teman-teman seperjuangan FAST TRACK, teman-teman di laboratorium Mikrobiologi, Biologi angkatan 46, Mikrobiologi angkatan 2012, dan Mikrobiologi angkatan 2013. Ungkapan terima kasih juga disampaikan kepada Ayahanda dan Ibunda tercinta, Umi, Aisyah, Aulia, Falah, dan Nandang Permana serta seluruh keluarga, atas dukungan, doa, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 3
METODE 8
Bahan 9
Alat 9
Metode Penelitian 9
HASIL DAN PEMBAHASAN 12
Hasil 12
Pembahasan 19
SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 24
LAMPIRAN 24
DAFTAR TABEL
1 Aktivitas senyawa bioaktif dari mikroorganisme yang berasosiasi
dengan spons 4
2 Kandungan kimia ekstrak bakteri yang berasosiasi dengan spons 13 3 Aktivitas antikanker ekstrak bakteri yang berasosiasi dengan spons
terhadap sel kanker HeLa 14
4 Aktivitas peredaman radikal bebas DPPH ekstrak bakteri yang berasosiasi dengan spons menggunakan metode DPPH 16 5 Kapasitas antioksidan ekstrak bakteri yang berasosiasi dengan spons 16 6 Hasil analisis bioinformatika sekuen fragmen DNA penyandi domain
ketosintase menggunakan program BLASTX 18
7 Hasil analisis bioinformatika sekuen fragmen DNA penyandi domain
adenilase menggunakan program BLASTX 18
DAFTAR GAMBAR
1 Struktur troloks 7
2 Tahapan kerja penelitian 8
3 Rendemen ekstrak bakteri yang berasosiasi dengan spons 12 4 Sel HeLa pada uji antikanker ekstrak dari bakteri SAB E-40 pada
berbagai konsentrasi 15
5 Elektroforesis pada gel agarose 1% DNA penyandi domain KS yang berukuran 700 bp dan domain A yang berukuran 1000 bp dari bakteri
laut yang berasosiasi dengan spons 17
6 Pohon filogenetik berdasarkan sekuen asam amino domain KS (ketosintase) yang dikonstruksi dengan metode Neighbor-Joining
dengan nilai ulangan bootstrap 1000 18
7 Pohon filogenetik berdasarkan sekuen asam amino domain A (adenilation) yang dikonstruksi dengan metode Neighbor-Joining
dengan nilai ulangan bootstrap 1000 19
DAFTAR LAMPIRAN
1 Komposisi medium sea water complete (SWC) 28
2 Ekstrak bakteri yang berasosisi dengan spons 28 3 Rendemen ekstrak bakteri yang berasosiasi dengan spons 28 4 Contoh perhitungan rendemen ekstrak bakteri yang berasosiasi dengan
spons 29
5 Kandungan kimia ekstrak bakteri yang berasosiasi dengan spons 30 6 Aktivitas antikanker ekstrak bakteri yang berasosiasi dengan spons
terhadap sel HeLa dengan menggunakan metode MTT 31 7 Contoh perhitungan nilai IC50 ekstrak bakteri yang berasosiasi dengan
spons 32
8 Aktivitas antioksidan ekstrak bakteri yang berasosiasi dengan spons
9 Contoh perhitungan aktivitas penghambatan radikal bebas DPPH 33
10 Absorbansi dan kurva standar troloks 34
11 Kapasitas antioksidan ekstrak bakteri yang beraasosiasi dengan spons
menggunakan metode CUPRAC 35
12 Sekuen parsial domain KS dan A 36
13 Publikasi jurnal dari sebagian hasil penelitian di International Journal
PENDAHULUAN
Latar Belakang
Kanker merupakan penyakit yang disebabkan oleh pertumbuhan sel yang tidak terkendali atau abnormal sehingga dapat mengganggu jaringan sel lainnya. Pertumbuhan sel yang abnormal disebabkan mutasi pada gen yang meregulasi siklus sel. Faktor yang menyebabkan mutasi tersebut diantaranya faktor lingkungan yang meliputi nutrisi, agen infektor, gaya hidup dan faktor keturunan atau bawaan genetik (McKelvery & Evans 2003; Nowell et al. 2004). Senyawa radikal bebas juga dapat menyebabkan stres oksidatif yang berpotensi merusak basa DNA sehingga mengacaukan sistem informasi genetik, dan berlanjut pada pembentukan sel kanker (Fiaschi & Chiarugi 2012). Antioksidan berperan penting bagi tubuh manusia dalam menetralisir radikal bebas yang mengakibatkan penyakit degeneratif termasuk kanker (Halliwell & Gutteridge 1999). Jumlah penderita kanker di dunia terus meningkat, saat ini jumlahnya meningkat sekitar 7 juta penderita kanker dari tahun sebelumnya. Menurut WHO, di Indonesia terjadi sebanyak 165 kasus kanker dalam 100.000 penduduk. Kanker leher rahim (servic) merupakan salah satu penyebab utama kematian wanita yang berhubungan dengan kanker. Kanker leher rahim menyebabkan 270.000 kematian setiap tahunnya. Sekitar 85% kasus kanker leher rahim terjadi di negara berkembang (WHO 2013).
Senyawa bioaktif yang berasal dari spons memiliki potensi sebagai antibakteri, anticendawan, antikanker, antioksidan, dan anti-inflamasi (Sipkema et al. 2005; Thakur et al. 2005; Taylor et al. 2007). Namun pengembangan senyawa bioaktif tersebut mengalami hambatan karena memerlukan biomassa spons yang besar untuk mengekstraksi senyawa bioaktif dalam aplikasinya di bidang medis (Proksch et al. 2002). Spons telah diteliti membentuk asosiasi yang erat dengan berbagai mikroba dan menjadi sumber berbagai senyawa bioaktif yang secara umum dapat mencapai 50-60% dari volume jaringan spons (Wang 2006). Komunitas mikroba yang beragam dan berjumlah besar pada hewan spons diduga merupakan sumber dari berbagai senyawa bioaktif tersebut. Isolasi bakteri yang bersimbiosis dengan spons merupakan strategi yang dapat digunakan untuk memproduksi berbagai bahan bioaktif dalam jumlah besar melalui produksi pengkulturan mikroba.
2
tentang deteksi gen penyandi senyawa bioaktif untuk memastikan bahwa bakteri tersebut menghasilkan senyawa bioaktif dan dari data tersebut dapat diketahui keragaman senyawa bioaktif yang dihasilkan. Penelitian yang mengkaji potensi senyawa bioaktif dari bakteri yang berasosiasi dengan spons Jaspis sp. dan Haliclona sp yang diisolasi oleh Tokasaya (2010) dan Abubakar et al. (2011) sebagai antikanker dan antioksidan sampai saat ini belum dilakukan serta keragaman kandungan senyawa metabolit sekunder yang bersifat bioaktif yang dihasilkan oleh bakteri tersebut belum diketahui, oleh karena itu tujuan penelitian ini adalah menentukan potensi ekstrak dari bakteri yang berasosiasi dengan spons sebagai antikanker dan antioksidan serta mendeteksi keberadaan gen penyandi senyawa bioaktif dari isolat bakteri tersebut.
Perumusan Masalah
Salah satu manfaat penting yang dihasilkan spons yaitu kemampuannya dalam menghasilkan senyawa metabolit sekunder yang bersifat bioaktif. Pemanfaatan spons laut saat ini untuk produk komersial senyawa bioaktif umumnya dilakukan dengan cara mengambil langsung di alam. Apabila hal tersebut dilakukan secara berkelanjutan dapat mengakibatkan penurunan populasi secara signifikan. Oleh karena itu dibutuhkan metode produksi senyawa bioaktif yang tetap mempertahankan kelestarian sumber daya alam secara berkesinambungan salah satunya dengan mengekstraksi senyawa bioaktif dari mikrob yang berasosiasi dengan spons. Ekstrak bioaktif yang dihasilkan diharapkan memiliki potensi sebagai antioksidan dan antikanker.
Antioksidan berperan penting bagi tubuh manusia dalam menetralisir radikal bebas, menghalangi terjadinya stres oksidatif, kerusakan jaringan dan timbulnya penyakit degeneratif dan kanker. Penggunaan bahan bioaktif hasil isolasi dari bahan alam terus dikembangkan karena sifatnya yang mudah teruraikan, dan dapat dikeluarkan dari dalam tubuh, sedangkan bahan sintetis dapat menyisakan residu yang berbahaya bagi tubuh. Oleh karena itu pelacakan bahan bioaktif dari bahan alam banyak dilakukan, untuk mendapatkan bahan bioaktif yang berpotensi sebagai antikanker dan antioksidan baru.
Tujuan Penelitian
Tujuan penelitian ini adalah menentukan potensi ekstrak dari bakteri yang berasosiasi dengan spons sebagai antioksidan dan antikanker serta deteksi gen yang berperan dalam sintesis senyawa bioaktif.
Manfaat Penelitian
3 Ruang Lingkup Penelitian
Penelitian ini mencakup ekstraksi bahan bioaktif dari bakteri laut yang berasosiasi dengan spons , uji kandungan kimia, uji antikanker, uji antioksidan, dan deteksi gen yang berperan dalam sintesis senyawa bioaktif.
TINJAUAN PUSTAKA
Bakteri Laut yang Berasosiasi dengan Spons
Spons merupakan hewan metazoa dari filum porifera yang memperoleh makanan dari lingkungannya secara pasif. Spons hidup menempel pada substrat di dasar perairan laut atau tawar. Spons tidak memiliki jaringan yang sebenarnya, tetapi memiliki tipe sel berbeda dengan pembagian fungsi yang jelas. Pinacoderm merupakan lapisan sel yang paling luar dibentuk oleh sel-sel pinacocyte. Pori-pori pada permukaan spons disebut ostia yang merupakan saluran atau kanal. Choanocyte merupakan sel berflagel yang berfungsi untuk menyaring partikel makanan. Partikel makanan akan ditransfer ke mesohyl. Mikroorganisme yang berasosiasi dengan spons umumnya terjadi pada jaringan mesohyl (Taylor et al. 2007).
Interaksi mikroorganisme dengan spons yaitu sebagai makanan, patogen, parasit atau sebagai organisme yang bersimbiosis secara mutualistik. Mikroorganisme yang telah diketahui bersimbiosis dengan spons dikategorikan ke dalam 14 filum bakteri, dua kelompok utama arkea, dan organisme eukariotik berukuran mikroskopik. Berdasarkan analisis sekuen gen 16S rRNA dan Denaturing Gradient Gel Electrophoresis (DGGE) yang dilakukan oleh Taylor et al. (2007) kelompok bakteri yang diketahui bersimbiosis dengan spons antara lain Acidobacteria, Actinobacteria, Bacteroides, Chloroflexi, Cyanobacteria, Deinococcus-Thermus, Firmicutes, Gemmatimonadetes, Nitrospira, Planctomycetes, Poribacteria, Proteobacteria, Sphirochaetes dan Verrucomicrobia. Interaksi spons dan mikroorganisme simbionnya yang memiliki hubungan yang bersifat simbiosis mutualisme yaitu spons bertahan dari gangguan organisme lainnya yaitu dengan mengandalkan berbagai metabolit sekunder yang bersifat bioaktif yang dihasilkan mikroorganisme simbionnya sedangkan mikroorganisme yang bersimbiosis dengan spons mendapatkan pasokan senyawa karbon organik yang dapat dengan mudah digunakan sebagai sumber energi (Müller et al. 2004).
Senyawa Bioaktif dari Mikroorganisme Laut yang Berasosiasi dengan Spons
4
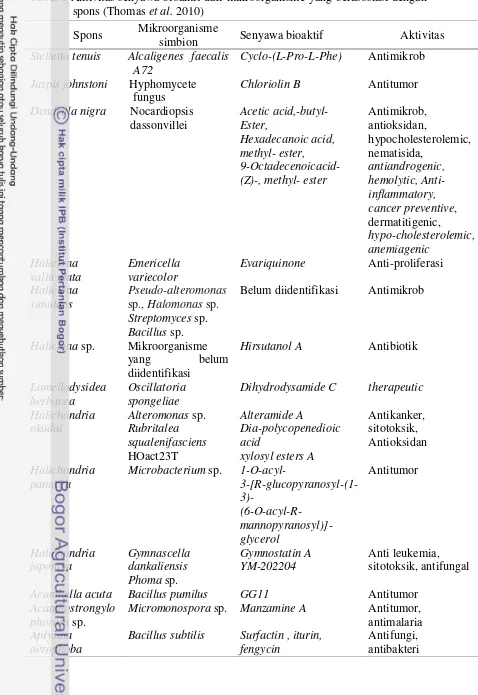
Tabel 1 Aktivitas senyawa bioaktif dari mikroorganisme yang berasosiasi dengan spons (Thomas et al. 2010)
Spons Mikroorganisme
simbion Senyawa bioaktif Aktivitas
Stelletta tenuis Alcaligenes faecalis A72
Cyclo-(L-Pro-L-Phe) Antimikrob Jaspis johnstoni Hyphomycete
fungus
Chloriolin B Antitumor
Dendrilla nigra Nocardiopsis dassonvillei
Microbacterium sp. 1-O-acyl-
3-[R-glucopyranosyl-(1-Acanthella acuta Bacillus pumilus GG11 Antitumor
Acanthostrongylo phorora sp.
Micromonospora sp. Manzamine A Antitumor, antimalaria Aplysina
aerophoba
Bacillus subtilis Surfactin , iturin, fengycin
5 Senyawa bioaktif dari spons memiliki potensi sebagai antibakteri, antifungi, antitumor, antikanker, sitotoksik, antimalaria, dan antioksidan. Pengembangan senyawa bioaktif yang berasal dari spons mengalami hambatan karena memerlukan biomassa spons yang besar untuk mengekstraksi senyawa bioaktif dalam aplikasinya di bidang medis (Proksch et al. 2002). Oleh karena itu dibutuhkan metode produksi senyawa bioaktif yang tetap mempertahankan kelestarian sumber daya alam secara berkesinambungan salah satunya dengan mengekstrak senyawa bioaktif dari mikrob yang berasosiasi dengan spons (Tabel 1).
Gen Penyandi Senyawa bioaktif
Senyawa bioaktif umumnya disintesis oleh enzim Polyketide sintase (PKS) dan nonribosomal peptide sintase (NRPS) (Cane et al. 1998; Moffit & Neilan 2003). Enzim PKS terorganisasi secara modular dan setiap modul memiliki informasi esensial untuk pengenalan, aktivasi dan modifikasi dari suatu substrat menjadi senyawa polimernya. Setiap modul dapat dibagi menjadi beberapa domain yang terlibat dalam reaksi spesifik. Jumlah modul dan organisasi domain-domain pada kluster gen tersebut menentukan struktur senyawa poliketid (Schwarez & Marhiel 2001). Nonribosomal peptides merupakan senyawa bioaktif yang dibentuk dari monomer asam amino yang sederhana. Nonribosomal peptida disintesis oleh gen NRPS yang terdiri dari multimodular dan protein multifungsional.
Enzim PKS dan NRPS disusun oleh tiga domain utama yaitu dua domain berfungsi sebagai katalitik dan satu domain sebagai pembawa (carrier). Domain utama pada PKS antara lain, ketosintase (KS), acyl tranferase (AT), dan acyl carrier protein (ACP) sedangkan pada NRPS kondensasi (C), adenilasi (A), dan peptidyl carrier protein (PCP) (Cane & Walsh 1999). Enzim tersebut memiliki ukuran yang besar sekitar 200 sampai 2000 kDa sebagai enzim mutifungsional yang memiki modul-modul dalam membuat suatu senyawa. Beberapa produk poliketida dan peptida nonribosom dalam dunia medis antara lain, antibakteri vancomycin dan erythromycin, immunosuppressant cyclosporin dan rapamycin, serta antitumor bleomycin dan epothilone. Penggunaan domain KS dan A dalam studi keragaman gen PKS dan NRPS disebabkan domain ketosintase (KS) dan domain adenilasi (A) merupakan domain yang ada dalam tiap modul dan memperlihatkan derajat konservasi yang tinggi di antara domain lainnya (Moffitt & Neilan 2003).
Kanker
6
Milner 2004; Nowell et al. 2004). Senyawa radikal bebas juga berpotensi merusak basa DNA sehingga mengacaukan sistem informasi genetik, dan berlanjut pada pembentukan sel kanker. Antioksidan berperan penting bagi tubuh manusia dalam menetralisir radikal bebas yang mengakibatkan penyakit degeneratif termasuk kanker (Halliwell & Gutteridge 1999). Jumlah penderita kanker di dunia terus meningkat, saat ini jumlahnya meningkat sekitar 7 juta penderita kanker dari tahun sebelumnya. Menurut WHO, di Indonesia terjadi sebanyak 165 kasus kanker dalam 100.000 penduduk. Kanker leher rahim (servic) merupakan salah satu penyebab utama kematian wanita yang berhubungan dengan kanker. Kanker leher rahim menyebabkan 270.000 kematian setiap tahunnya. Sekitar 85% kasus kanker leher rahim terjadi di negara berkembang (WHO 2013). Penelitian epidemiologi menunjukkan lebil dari 90% kanker serviks dihubungkan dengan jenis human papiloma virus (HPV). HPV merupakan faktor inisiator kanker serviks. Onkoprotein E6 dan E7 yang berasal dari HPV merupakan penyebab terjadinya degenerasi keganasan. Onkoprotein E6 akan mengikat p53 sehingga tumor supressor gene (TSG) p53 akan kehilangan fungsinya. Onkoprotein E7 akan mengikat TSG Rb, ikatan ini menyebabkan terlepasnya E2F yang merupakan faktor transkripsi sehingga siklus sel berjalan tanpa kontrol (Garcia 2007).
Pengobatan kanker yang umum dilakukan saat ini adalah dengan cara kemoterapi. Kemoterapi adalah terapi kimia dengan menggunakan zat-zat kemoterapi untuk menekan pertumbuhan kanker dengan menggunakan bahan-bahan bioaktif dari hasil sintesis atau isolasi dari bahan-bahan alam. Penggunaan bahan-bahan bioaktif hasil isolasi dari bahan alam terus dikembangkan karena sifatnya yang mudah teruraikan, dan dapat dikeluarkan dari dalam tubuh, sedangkan bahan sintetis dapat menyisakan residu yang berbahaya bagi tubuh. Hal ini menyebabkan pelacakan senyawa-senyawa antikanker dari bahan alam banyak dilakukan, untuk mendapatkan senyawa yang berpotensi sebagai antikanker baru dalam strategi pengembangan kemoterapi (Ramanthan et al. 1992).
Radikal Bebas
Radikal bebas adalah molekul dengan satu atau lebih elektron yang tidak berpasangan pada orbitalnya. Radikal bebas sangat reaktif, merupakan molekul yang tidak stabil dan bereaksi dengan cepat pada biomolekul melalui banyak jenis reaksi antara lain penangkapan hidrogen, donasi elektron dan penggunaan elektron bersama. Radikal bebas akan melepaskan elektron pada molekul sekitarnya untuk menghasilkan pasangan elektron agar menjadi molekul yang stabil (Hosseinian 2006; Maxwell & Lip 1997).
7 Antioksidan
Antioksidan adalah suatu substansi yang pada konsentrasi kecil secara signifikan mampu menghambat atau mencegah oksidasi pada substrat (Isnindar et al. 2011). Antioksidan menstabilkan radikal bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas yang dapat menimbulkan stres oksidatif. Antioksidan dapat berperan sebagai peredam radikal bebas (free radical scavenger) (Dean 2003). Antioksidan akan bereaksi dengan radikal bebas dan mengubahnya menjadi senyawa yang tidak reaktif dan relatif stabil sehingga tidak menyebabkan kerusakan membran dan permeabilitas sel. Berdasarkan sumbernya, antioksidan dibagi menjadi dua kelompok yaitu antioksidan endogen dan eksogen. Antioksidan endogen terdapat secara alamiah di dalam tubuh contohnya bilirubin, thiols seperti glutathione, N-acetyl cystein, nicotinamide adenine dinucleotide phosphate (NADPH) dan nicotinamide adenine dinucleotide (NADH), ubiquinone, uric acid, enzim superoxide dismutases (SOD) dan glutathione peroxidase. Antioksidan eksogen berasal dari luar tubuh contohnya vitamin C, vitamin E, beta karoten dan polifenol. Antioksidan eksogen dapat berupa antioksidan alami maupun sintetik.
Antioksidan berperan penting bagi tubuh manusia dalam menetralisir radikal bebas, menghalangi terjadinya stres oksidatif, kerusakan jaringan dan timbulnya penyakit degeneratif. Adanya senyawa antioksidan di dalam tubuh dapat memutuskan rantai radikal bebas, mencegah reaksi fenton, mengkatalisis proses oksidasi molekul, mengubah radikal bebas yang reaktif menjadi tidak reaktif, memperbaiki jaringan atau sel yang telah dirusak oleh radikal bebas dan menyediakan lingkungan yang baik sehingga mendorong antioksidan bekerja dengan optimal di dalam tubuh.
Troloks
Troloks merupakan antioksidan sintetis yang memiliki nama dalam IUPAC 6-hidroksi-2,5,7,8-tetrametilkroman-2-asam karboksilat (Gambar 1). Troloks memiliki tekstur bubuk berwarna putih dan mempunyai aktivitas antioksidan yang lebih tinggi dibandingkan α-tokoferol, butylated hydroxyanisole (BHA), serta butylated hydroxytoluen (BHT) (Belitz & Grosch 1999). Troloks umumnya digunakan sebagai standar dalam pengukuran antioksidan yang dapat dinyatakan sebagai ekivalen troloks. Koefisien TEAC (troloks equivalent antioxidant capacity) merupakan konsentrasi troloks yang memiliki kapasitas antioksidan yang ekuivalen dengan ekstrak yang duji. Kapasitas antioksidan dari setiap metode dinyatakan dalam μmol troloks/g ekstrak (Apak et al. 2008).
8
METODE
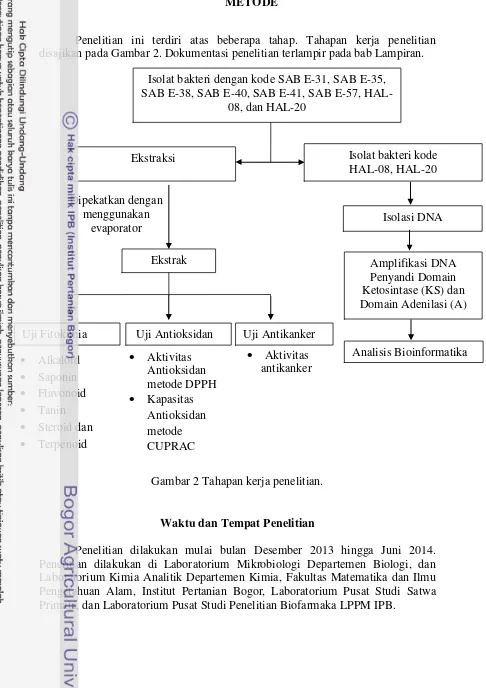
Penelitian ini terdiri atas beberapa tahap. Tahapan kerja penelitian disajikan pada Gambar 2. Dokumentasi penelitian terlampir pada bab Lampiran.
Gambar 2 Tahapan kerja penelitian.
Waktu dan Tempat Penelitian
Penelitian dilakukan mulai bulan Desember 2013 hingga Juni 2014. Penelitian dilakukan di Laboratorium Mikrobiologi Departemen Biologi, dan Laboratorium Kimia Analitik Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, Laboratorium Pusat Studi Satwa Primata, dan Laboratorium Pusat Studi Penelitian Biofarmaka LPPM IPB.
Isolat bakteri dengan kode SAB E-31, SAB E-35, SAB E-38, SAB E-40, SAB E-41, SAB E-57,
HAL-08, dan HAL-20
9 Bahan
Bahan yang digunakan adalah isolat bakteri dengan kode SAB E-31, SAB E-35, SAB E-38, SAB E-40, SAB E-41, dan SAB E-57 yang diisolasi oleh Abubakar et al. (2011) dari spons Jaspis sp dan isolat bakteri dengan kode HAL-08, HAL-20 (Tokasaya 2010) yang diisolasi dari spons Haliclona sp. akuades, etil asetat, etanol, HCl pekat, n-amil alkohol, anhidrida asetat, kloroform-amoniak, H2SO4 2 M, pereaksi Mayer, Dragendorf, Wagner, serbuk Mg, pereaksi FeCl3 1%, NaOH 10%, DPPH (2,2 difenil-1-pikril hidrazil), troloks, CuCl2, Neucoprine, NH4Ac, Dimetyl sulphoxide (DMSO), sel kanker Hela, Dubecco's Modified Eagle's Medium (DMEM), 3-[4,5-dimetiltiazol-2-il]2,5-difeniltetrazolium bromida (MTT), Tris HCL, EDTA, Lisozim, Proteinase-K, Phenol, Kloroform, Agarose 1%, Etidium Bromida, Loading dye, ddH2O,dan master mix PCR.
Alat
Alat yang digunakan adalah peralatan mikrobiologi pada umumnya, Laminar Air Flow Cabinet (Jouan, Prancis), autoklaf, hot plate, evaporator, elektroporator. spektrofotometer, seperangkat alat uji antikanker termasuk Enzyme-Linked Immunosorbent Assay (ELISA) reader dan inkubator CO2, spektrofotometer,seperangkat alat isolasi dan amplifikasi DNA termasuk mesin PCR (Polymerise Chain Reaction), dan peralatan elektroforesis.
Metode Penelitian
Peremajaan bakteri yang berasosiasi dengan spons
Isolat bakteri yang digunakan dalam penelitian yaitu bakteri dengan kode SAB E-31, SAB E-35, SAB E-38, SAB E-40, SAB E-41, dan SAB E-57 yang diisolasi dari spons Jaspis sp oleh Abubakar et al. (2011) dari spons Jaspis sp dan isolat bakteri dengan kode HAL-08, HAL-20 yang diisolasi dari spons Haliclona sp (Tokasaya 2010). Bakteri tersebut diremajakan dalam medium agar Sea Water Complete (SWC).
Ekstraksi bahan bioaktif dari bakteri laut yang berasosiasi dengan spons
Isolat bakteri masing-masing dikulturkan dalam 1000 mL medium cair Sea Water Complete (SWC) (Lampiran 1). Kultur diinkubasi pada mesin penggoyang (100 rpm; 30 °C) selama 72 jam, kemudian ditambahkan 1000 mL etil asetat dan diaduk selama 12 jam. Lapisan etil asetat dievaporasi dan ekstrak yang diperoleh disimpan pada suhu 5 °C (Muller et al. 2004).
Uji kandungan kimia
10
Uji Flavonoid. Ekstrak sebanyak 0.1 g ekstrak ditambah dengan 10 mL akuades, kemudian dipanaskan selama 5 menit. Filtrat sebanyak 10 mL ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok dengan vortex dan hasil uji positif terhadap flavonoid ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Alkaloid . Sebanyak 0.1 g ekstrak ditambah dengan 10 mL CHCl3 dan beberapa tetes NH4OH. Larutan tersebut disaring dan filtratnya ditambahkan 10 tetes H2SO4 2M, lalu dikocok. Lapisan asam dipisahkan kedalam 3 spotplate dan masing-masing ditambahkan dengan pereaksi Mayer menunjukkan hasil uji positif jika terbentuk endapan putih, pereaksi Wagner menunjukkan hasil positif jika terbentuk endapan cokelat, dan pereaksi Dragendorf menunjukkan hasil positif jika terbentuk endapan merah jingga.
Uji Saponin. Ekstrak sebanyak 0.1 g ekstrak ditambah dengan 10 mL akuades, kemudian dipanaskan selama 5 menit. Filtrat sebanyak 10 mL dikocok selama 10 menit dalam keadaan tertutup. Ekstrak yang mengandung saponin akan membentuk buih yang stabil selama 10 menit.
Uji Tanin. Sebanyak 0.1 g ekstrak dalam 10 mL akuades dipanaskan selama 10 menit, kemudian disaring dan filtratnya ditambahkan dengan 5 tetes FeCl3 1%. Ekstrak yang positif mengandung tanin akan membentuk warna biru tua.
Uji Terpenoid dan Steroid. Sebanyak 0.1 g ekstrak dilarutkan dengan 10 mL etanol, disaring, dan diuapkan hingga kering. Residu yang dihasilkan dilarutkan dalam eter, kemudian fase eter tersebut ditambahkan 1 tetes H2SO4 dan 3 tetes anhidrida asetat. Jika terbentuk warna biru kehijauan artinya ekstrak positif mengandung steroid dan jika terbentuk warna ungu artinya ekstrak positif mengandung terpenoid.
Uji aktivitas antikanker menggunakan metode MTT
Uji aktivitas antikanker meggunakan metode MTT (Thakur et al. 2005). Sel kanker yang digunakan dalam penelitian sel kanker leher rahim yaitu sel HeLa ATCC-CCL 2. Sel kanker dalam Dubecco's Modified Eagle's Medium (DMEM) diinokulasikan ke dalam sumuran dengan jumlah inokulan 100 μL (kepadatan 5×103 sel/sumuran) selama 24 jam. Sebanyak 100 μL ekstrak aktif dengan konsentrasi 5 μg mL-1, 25 μg mL-1, 125 μg mL-1, dan 625 μg mL-1 ditambahkan pada inokulan kemudian diinkubasi pada inkubator CO2 pada suhu 37 oC selama 24 jam. Selanjutnya setiap sumuran ditambahkan 100 μL 3-[4,5-dimetiltiazol-2-il]2,5-difeniltetrazolium bromida (MTT) dan diinkubasi kembali selama 4 jam dalam inkubator CO2. Sel hidup akan bereaksi dengan MTT membentuk formazan. Formazan dilarutkan dalam larutan etanol. Serapan dibaca dengan alat Enzyme-Linked Immunosorbent Assay (ELISA) reader pada panjang gelombang 595 nm. Persentase penghambatan sel HeLa dihitung dengan rumus berikut :
11 Nilai penghambatan sel HeLa 50% (IC50) ditentukan dengan menggunakan kurva hubungan antara konsentrasi ekstrak (x) dan nilai persentase penghambatan sel HeLa (y) (Lampiran 7).
Uji aktivitas antioksidan menggunakan metode DPPH
Sebanyak 0.01 g ekstrak dilarutkan dengan 1 mL DMSO sehingga menjadi larutan stok 10 000 µg mL-1. Kemudian Ekstrak 10 000 µg mL-1 dilarutkan dalam etanol dan dibuat dengan konsentrasi 100 µg mL-1 dan 200 µg mL-1 dalam microplate well. Setiap sumur ditambahkan 100 μl larutan D H (1,1 -difenil-2-pikrilhidrazil) dan 100 μl etanol. Kemudian diinkubasi pada suhu 37 ºC selama 30 menit, serapannya diukur pada panjang gelombang 514 nm. Kontrol positif yang digunakan yaitu vitamin C dengan konsentrasi 16 µg mL-1. Persentase aktivitas penghambatan dihitung dari :
enghambatan 1 (Absorbansi sampel Absorbansi kontrol) (Absorbansi blanko Absorbansi kontrol) 100
Dimana Absorbansi kontrol adalah absorbansi kontrol vitamin C, Absorbansi blanko adalah absorbansi kontrol etanol, dan absorbansi sampel adalah absorbans ekstrak (Lampiran 9).
Uji aktivitas antioksidan menggunakan metode CUPRAC
Sebanyak 1 mL 10-2 M CuCl2, 1 mL 7.5×10-3 M Neucoprine, 1 mL 1 M NH4Ac, dan 0.1 mL H2O ditambahkan 1 mL ekstrak dalam etanol. Volume total 4.1 mL diinkubasi selama 30 menit, kemudian diukur absorbansinya pada panjang gelombang 450 nm (Apak et al. 2008). Kurva standar pengukuran kapasitas antioksidan menggunakan troloks dengan konsentrasi 10, 25, 50, 75, 100, 150, 200, dan 250 µM (Lampiran 10). Kapasitas antioksidan dinyatakan dalam µmol troloks/g ekstrak (Lampiran 11).
Amplifikasi DNA penyandi domain ketosintase (KS) dan domain adenilasi
(A)
Isolat bakteri dengan kode HAL-08 dan HAL-20 masing-masing dikulturkan pada medium SWC cair yang telah diinkubasi pada suhu 30 ºC selama 24 jam. Isolasi DNA Genom dilakukan menggunakan metode lisis dengan cetyl trimethyl ammonium bromide (CTAB) (Sambrook & Russel 2001).
12
selama 1 menit pada suhu 94 ºC, annealing pada 50 ºC selama 1 menit, polimerisasi pada 72 ºC selama 1 menit, dan post PCR dilakukan pada suhu 72 ºC selama 10 menit. Amplikon fragmen DNA penyandi domain ketosintase divisualisasi menggunakan teknik elektroforesis dengan gel agarosa (1% b/v), pewarnaan molekul DNA dilakukan menggunakan etidium bromida (5 μg mL-1). Isolat yang mempunyai gen penyandi domain KS menunjukkan terbentuknya pita pada berukuran 700 pb, sedangkan domain A berukuran 1000 pb. Hasil amplifikasi disekuen menggunakan jasa 1st Base Malaysia.
Analisis Bioinformatika
Sekuen DNA dianalisis menggunakan program Basic Local Alignment Search Tools (BLASTX) yang tersedia di situs web http://www.ncbi.nlm.nih.gov. Hasil analisis sekuen DNA diterjemahkan ke dalam runutan protein menggunakan ExPASY Molecular Biology (http://web.expasy.org/cgi-bin/translate/dna_aa). Konstruksi pohon filogenetik berdasarkan sekuen domain KS dan domain A dilakukan dengan menggunakan perangkat lunak Molecular Evolutionary Genetics Analysis (MEGA) versi 5.0 dengan metode neighbor-joining. (Tamura et al. 2011).
HASIL DAN PEMBAHASAN
Hasil
Ekstraksi Bakteri yang Berasosiasi dengan Spons
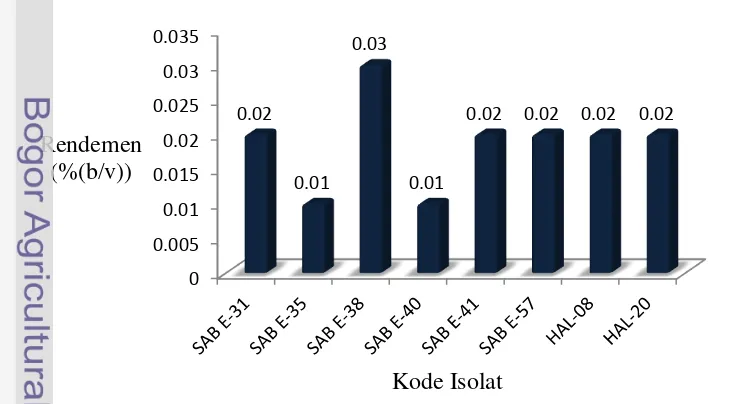
Ekstrak bahan bioaktif yang berasal dari bakteri diekstraksi menggunakan pelarut etil asetat. Rendemen ekstrak etil asetat senyawa bioaktif yang berasal dari bakteri menghasilkan jumlah rendemen 0.01% hingga 0.03% (Gambar 3 & Lampiran 2).
13 Kandungan Fitokimia Ekstrak Bakteri yang Berasosiasi dengan Spons
Ekstrak bakteri yang berasosiasi dengan spons memiliki kandungan flavonoid, alkaloid, dan terpenoid. Selain itu ekstrak bakteri SAB E-38 dan SAB E-41 juga memiliki kandungan steroid (Tabel 2 & Lampiran 5).
Tabel 2 Kandungan kimia ekstrak bakteri yang berasosiasi dengan spons Golongan
senyawa
Ekstrak bakteri yang berasosiasi dengan spons SAB
Keterangan : + = terdeteksi, - = tidak terdeteksi
Aktivitas Antikanker Ekstrak Bakteri yang Berasosiasi dengan Spons
14
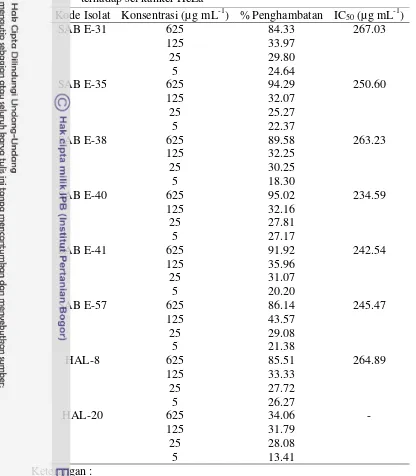
Tabel 3 Aktivitas antikanker ekstrak bakteri yang berasosiasi dengan spons terhadap sel kanker HeLa
Kode Isolat Konsentrasi (µg mL-1) % Penghambatan IC50 (µg mL-1)
- : aktivitas penghambatan ≤ 50 sehingga tidak dapat ditentukan nilai IC50. * Nilai IC50 diperoleh dari hasil 2 kali ulangan.
Aktivitas Antioksidan Menggunakan Metode DPPH
15
(a) (b)
(c) (d)
(e)
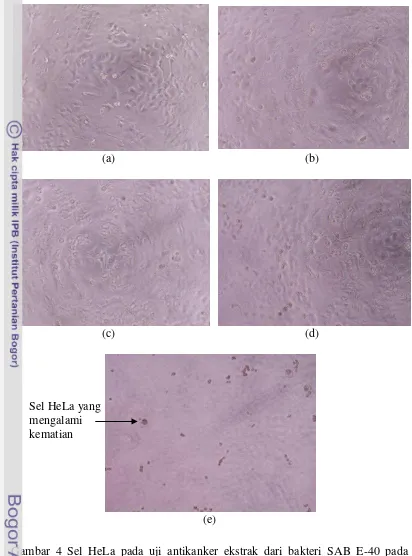
Gambar 4 Sel HeLa pada uji antikanker ekstrak dari bakteri SAB E-40 pada konsentrasi (a) 0 µg mL-1 (kontrol negatif), (b) 5 µg mL-1, (c) 25 µg mL-1, (d) 125 µg mL-1 , (e) 625 µg mL-1 pada perbesaran 100x .
16
Tabel 4 Aktivitas peredaman radikal bebas DPPH ekstrak bakteri yang berasosiasi dengan spons menggunakan metode DPPH
Kode Isolat
Peredaman radikal bebas DPPH (%) pada konsentrasi ekstrak*
*Nilai aktivitas peredaman diperoleh dari hasil 3 kali ulangan
Aktivitas Kapasitas Antioksidan Menggunakan Metode CUPRAC
Kapasitas antioksidan dinyatakan dalam μmol troloks/g ekstrak. Hasil pengukuran kapasitas antioksidan dengan metode CUPRAC menunjukkan sebanyak delapan ekstrak dari bakteri yang berasosiasi dengan spons memiliki aktivitas antioksidan dengan kapasitas antioksidan berkisar 115.94 hingga 649.92 µmol troloks/g ekstrak. Aktivitas antioksidan tertinggi dimiliki oleh ekstrak bakteri HAL-08 dengan kapasitas antioksidan 649.92 µmol troloks/g ekstrak (Tabel 5).
Tabel 5 Kapasitas antioksidan ekstrak bakteri yang berasosiasi dengan spons Kode Isolat Kapasitas Antioksidan
(µmol troloks/g ekstrak)*
*Nilai kapasitas antioksidan diperoleh dari hasil 3 kali ulangan menggunakan metode CUPRAC
Amplifikasi DNA Penyandi Domain Ketosintase (KS) dan Domain Adenilasi (A)
17 kedua domain tersebut dengan ukuran untuk domain KS yaitu 700 pasang basa dan domain A yaitu 1000 pasang basa (Gambar 5).
Gambar 5 Elektroforesis pada agar agarose 1% DNA penyandi domain KS yang berukuran 700 bp dan domain A yang berukuran 1000 bp dari genom (a) isolat HAL-8 (b) isolat HAL-20. M= Marker 1 kb.
Analisis Bioinformatika
Hasil analisis bioinformatika sekuen fragmen DNA penyandi domain ketosintase menggunakan program BLASTX menunjukkan bahwa sekuen fragmen pengkode domain ketosintase dari isolat HAL-08 dan HAL-20 memiliki tingkat homologi masing-masing sebesar 91% dan 99% dengan sekuen hybrid PKS/NRPS dari kluster gen PKS Bacillus subtilis (Tabel 6). Tingkat homologi pada sekuen domain A isolat HAL-08 dan HAL-20 memiliki homologi masing-masing sebesar 51% dan 99% dengan domain peptide syntase dari kluster gen NRPS Bacillus subtilis (Tabel 7).
18
Tabel 6 Hasil analisis bioinformatika sekuen fragmen DNA penyandi domain ketosintase menggunakan program BLASTX
Kode
isolat Homologi Identitas (%) E-value No akses HAL-08 Hybrid NRPS/PKS
Bacillus subtilis 91 2e-81 WP_015252058.1
HAL-20 Hybrid NRPS/PKS
Bacillus subtilis 99 3e-157 WP_015252058.1
Tabel 7 Hasil analisis bioinformatika sekuen fragmen DNA penyandi domain adenilase menggunakan program BLASTX
Kode isolat Homologi Identitas (%) E-value No akses HAL-08 (ketosintase) yang dikonstruksi dengan metode Neighbor-Joining dengan nilai ulangan bootstrap 1000. Angka 0,1 menunjukkan skala jarak kekerabatan (distance scale).
polyketide synthase Bacillus sp. JS
polyketide synthase Bacillus sp. EGD-AK10 polyketide synthase Bacillus subtilis
polyketide synthase of type I Bacillus subtilis E1 polyketide synthase Sporosarcina pasteurii polyketide synthase Bacillus subtilis OH 131.1
polyketide synthase Bacillus atrophaeus HAL 08
SAB E 35 HAL 20
Hybrid NRPS/PKS Bacillus subtilis polyketide synthase Bacillus sp. 5B6
19
Gambar 7 Pohon filogenetik berdasarkan sekuen asam amino domain A (adenilation) yang dikonstruksi dengan metode Neighbor-Joining dengan nilai ulangan bootstrap 1000. Keterangan: Angka 0,1 menunjukkan skala jarak kekerabatan (distance scale).
Pembahasan
Ekstrak bakteri yang berasosiasi dengan spons diekstraksi menggunakan pelarut etil asetat untuk mengambil metabolit atau ekstrak bioaktif yang bersifat semipolar. Jumlah ekstrak bioaktif yang diperoleh dinyatakan dalam rendemen (%(b/v)). Jumlah rendemen ekstrak bakteri yang berasosiasi dengan spons dari pelarut etil asetat sebanyak 1000 mL menghasilkan 0.1 hingga 0.3 gram ekstrak (Gambar 3). Hasil ekstraksi langsung pada jaringan spons diperoleh ekstrak sebesar 24.43 gram dari 1.2 kg spons Haliclona sp. ( Lee et al. 2012), 150 gram ekstrak dari 2 kg spons Jaspis sp. (Tang et al. 2012), dan 80 gram dari 500 gram spons Jaspis splendes (Ebada et al. 2009). Ekstraksi bahan bioaktif dari mikroorganisme lebih menguntungkan dibandingkan ekstraksi dari spons secara langsung karena tidak memerlukan waktu yang lama dalam proses produksi dan tidak membahayakan kelestarian spons karena budi daya spons memiliki waktu
peptide synthetase partial Bacillus sp. EGD-AK10
hypothetical protein BSNT 06684 Bacillus subtilis subsp. natto BEST195
peptide synthetase partial Bacillus subtilis
peptide synthetase partial Sporosarcina pasteurii
nonribosomal peptide synthetase partial Comamonas sp. POUX
peptide synthetase Bacillus vallismortis
peptide synthetase Bacillus sp. JS
nonribosomal peptide synthetase partial Bacillus sp. C53
surfactin synthetase Bacillus subtilis
20
pertumbuhan yang lama untuk dipanen yaitu sekitar 2 hingga 3 tahun (MacMillan 1999).
Potensi suatu bahan bioaktif dapat dikarakterisasi melalui analisis kandungan senyawa kimia yang terkandung dalam suatu ekstrak. Ekstrak dari bakteri yang berasosiasi dengan spons secara umum mengandung flavonoid, alkaloid, dan terpenoid. Selain itu ekstrak bakteri SAB E-38 dan SAB E-41 juga memiliki kandungan steroid (Tabel 3). Senyawa dari golongan flavonoid, alkaloid, dan terpenoid telah diteliti memiliki aktivitas sebagai antioksidan dan antikanker (Ren et al. 2003; Simmons et al. 2005; Ebada et al. 2010). Isoflavon merupakan kelompok senyawa flavonoid yang diisolasi dari mikroorganisme laut Streptomyces sp. yang memiliki aktivitas antikanker (Hu et al. 2008). Ecteinascidin-742 merupakan salah satu senyawa alkaloid yang diisolasi dari bakteri endosimbion Endoecteinascidia frumentesis yang berasosiasi dengan spons Ecteinnascadia tirbinata yang berpotensi sebagai antikanker terhadap sel leukimia, sel kanker serviks, dan sel kanker payudara (Simmons et al. 2005). Senyawa terpenoid yang dihasilkan oleh spons Jaspis stellifera yaitu isomalabaricane triterpenes yang bersifat toksik terhadap sel leukimia P388 (Ebada et al. 2010). Adanya kandungan steroid pada ekstrak bakteri SAB E-38 dan SAB E-41 tidak menunjukkan perbedaan yang signifikan terhadap sel kanker, salah satu senyawa golongan steroid contohnya ptilosaponoside yang diisolasi dari spons Ptilocaulis spiculifer tidak menunjukkan aktivitas sitoksisitas terhadap sel tumor KB (Gabant et al. 2009).
21 Ekstrak yang memiliki nilai IC50 terendah yaitu ekstrak bakteri laut SAB E-40 dengan nilai IC50 234.59µg mL-1. Perbedaan morfologi sel HeLa setelah diberi perlakuan ekstrak SAB E-40 pada berbagai konsentrasi dengan kontrol negatif menunjukkan adanya pengaruh ekstrak terhadap sel HeLa tersebut. Sel HeLa pada perlakuan kontrol (0 µg mL-1) berbentuk poligonal sedangkan sel HeLa yang telah diberi perlakuan ekstrak mengalami perubahan morfologi sel menjadi lebih bulat dan berukuran lebih kecil atau kisut dengan kepadatan sel yang lebih rendah dibandingkan dengan kontrol negatif. Efek sitotoksik ekstrak bakteri laut yang berasosiasi dengan spons terhadap sel HeLa diduga dapat melalui jalur apoptosis (Gambar 4).
Aktivitas antioksidan diukur dengan menggunakan metode DPPH dan metode CUPRAC. Prinsip dasar dari metode DPPH (2,2-difenil-1- pikrilhidrazil) menggunakan DPPH sebagai senyawa radikal bebas yang akan mengambil atom hidrogen yang terdapat dalam suatu senyawa yang melalui mekanisme transfer elektron. Larutan DPPH akan mengoksidasi senyawa dalam ekstrak yang ditandai dengan memudarnya warna larutan dari ungu menjadi kuning. Hasil uji aktivitas antioksidan peredaman radikal bebas DPPH ekstrak bakteri yang berasosiasi dengan spons menggunakan metode DPPH pada konsentrasi 100 µg mL-1 dan 200 µg mL-1 menunjukkan aktivitas tertinggi oleh ekstrak bakteri SAB E-40 (Tabel 5). Beberapa bakteri yang dilaporkan memiliki aktivitas aktivitas antioksidan yang dapat meredam radikal bebas DPPH diantaranya Virgibacillus yang diisolasi dari spons Callyspongia diffusa, Bacillus sp. JS, Bacterium SRCnm yang diisolasi dari Acanthophora dendroides (red algae) dan Sarggassum sabrepandum (brown algae) (Kalijran et al. 2013; Wahab et al. 2013).
22
hidrogen oleh DPPH dari zat antioksidan. Sedangkan, metode CUPRAC menggunakan bis(neokuproin) tembaga(II) (Cu(Nc)22+) sebagai pereaksi kromogenik. Pereaksi Cu(Nc)22+ yang berwarna biru akan mengalami reduksi menjadi Cu(Nc)2+ yang berwarna kuning (Apak et al. 2008).
Mikroorganisme yang berpotensi menghasilkan senyawa bioaktif dicirikan dengan adanya gen penyandi enzim poliketid sintase (PKS) dan nonribosomal poliketid sintase (NRPS) melalui analisis fragmen DNA penyandi domain ketosintase (KS) dan domain adenilase (A). Domain KS dan domain A merupakan domain yang bersifat konservatif pada kluster gen PKS dan NRPS (Moffit & Neilan 2003). Hasil amplifikasi DNA penyandi domain KS dan domain A pada isolat HAL-08 dan HAL-20 menunjukkan kedua isolat tersebut memiliki DNA penyandi kedua domain tersebut dengan ukuran untuk domain KS dan domain A (Gambar 5). Mikroorganisme yang memiliki kedua gen tersebut akan membentuk kluster gen hybrid PKS-NRPS yang berpotensi menghasilkan senyawa bioaktif baru akibat adanya variasi kombinasi modul biosintesis PKS dan NRPS. Contoh dari senyawa bioaktif yang dihasilkan oleh kluster gen hibrid PKS-NRPS yaitu bleomycin yang merupakan senyawa antikanker dari genus Streptomyces (Shen et al. 2001). Enzim PKS terorganisasi secara modular dan setiap modul memiliki informasi esensial untuk pengenalan, aktivasi dan modifikasi dari suatu substrat menjadi senyawa polimernya. Setiap modul dapat dibagi menjadi beberapa domain yang teribat dalam reaksi spesifik. Jumlah modul dan organisasi domain-domain pada kluster gen tersebut menentukan struktur senyawa poliketid (Schwarzer & Marhiel 2001). Nonribosomal peptides merupakan senyawa bioaktif yang dibentuk dari monomer asam amino yang sederhana. Nonribosomal peptida disintesis oleh gen NRPS yang terdiri dari multimodular dan protein multifungsional. Enzim PKS dan NRPS disusun oleh tiga domain utama yaitu dua domain berfungsi sebagai katalitik dan satu domain sebagai pembawa (carrier). Domain utama pada PKS antara lain, ketosintase (KS), acyl tranferase (AT), dan acyl carrier protein (ACP) sedangkan pada NRPS kondensasi (C), adenilasi (A), dan peptidyl carrier protein (PCP) (Cane & Walsh 1999). Beberapa produk poliketida dan peptida nonribosom dalam dunia medis antara lain, antibakteri vancomycin dan erythromycin, immunosuppressant cyclosporin dan rapamycin, serta antitumor bleomycin dan epothilone. Penggunaan domain KS dan A dalam studi keragaman gen PKS dan NRPS disebabkan domain ketosintase (KS) dan domain adenilasi (A) merupakan domain yang ada dalam tiap modul dan memperlihatkan derajat konservasi yang tinggi di antara domain lainnya (Moffitt dan Neilan 2003).
23 membentuk kelompok yang terpisah dengan SAB E-40. Sekuen domain A dari HAL-08 dan HAL-20 memiliki hubungan kekerabatan dengan sekuen peptida sintetase dari genus Bacillus (Gambar 7). Spesies Bacillus subtilis merupakan spesies berpotensi sebagai antioksidan dan antikanker (Newton et al. 2009; Aboul-Ela et al. 2012). Spesies Bacillus subtilis menghasilkan senyawa bacillithiol yang berpotensi sebagai antioksidan (Newton et al. 2009). Spesies Bacillus subtilis juga telah digunakan sebagai starter untuk meningkatkan aktivitas antioksidan pada makanan fermentasi tradisional china okara (Meitauza) (Zhu et al. 2008).
SIMPULAN DAN SARAN
Simpulan
Ekstrak bioaktif dari bakteri laut yang berasosiasi dengan spons memiliki potensi sebagai antikanker dan antioksidan. Ekstrak tersebut memiliki kandungan flavonoid, alkaloid, dan triterpenoid. Ekstrak yang memiliki aktivitas antikanker dengan nilai IC50 terbaik dan yang mampu meredam radikal bebas DPPH tertinggi yaitu ekstrak senyawa bioaktif dari bakteri SAB E-40. Kapasitas antioksidan ekstrak tertinggi berdasarkan metode CUPRAC adalah ekstrak bioaktif dari bakteri HAL-08. Isolat bakteri HAL-08 dan HAL-20 terdeteksi memiliki DNA penyandi domain KS dan domain A dengan ukuran untuk domain KS yaitu 700 pasang basa dan domain A yaitu 1000 pasang basa. Berdasarkan analisis bioinformatika sekuen fragmen DNA penyandi domain ketosintase menunjukkan isolat HAL-8 dan HAL-20 memiliki tingkat homologi masing-masing sebesar 91% dan 99% dengan sekuen hybrid PKS/NRPS dari kluster gen PKS Bacillus subtilis. Tingkat homologi pada sekuen domain A isolat HAL-08 dan HAL-20 memiliki homologi masing-masing sebesar 51% dan 99% dengan domain peptide syntase dari kluster gen NRPS Bacillus subtilis. Berdasarkan analisis hubungan filogeni sekuen asam amino penyusun domain ketosintase, isolat HAL-08 dan HAL-20 memiliki hubungan kekerabatan yang dekat dengan hybrid NRPS/PKS dari Bacillus subtilis.
Saran
24
DAFTAR PUSTAKA
Aboul-Ela HM, Shreadah MA, Abdel-Monem NM, Yakout GA, Soest RWM. 2012. Isolation, cytotoxic activity and phylogenetic analysis of Bacillus sp. bacteria associated with the red sea sponge Amphimedon ochracea. Adv Biosci Biotechnol. 3:815-823.
Abubakar H, Wahyudi AT, Yuhana M. 2011. Skrining bakteri yang berasosiasi dengan spons Jaspis sp. sebagai penghasil senyawa antimikroba. Ilmu Kelautan. 16:35-40.
Apak R, Guclu K, Ozyurek M, Celik SE. 2008. Mechanism of antioxidant capcity assays and the CUPRAC (cupric ion reducing antioxidant capacity) assay. Microchim Acta. 160: 413-419.
Belitz HD, Grosch W. 1999. Food Chemistry. Jerman (DE): Springer.
Boyd MR, Paull KD, Rubinstein LR. 1992. Cytotoxic Anticancer Drugs: Models and Concepts for Drug Discovery and Development. Vleriote FA, Corbett TH, Baker LH, editor. Hingham (US) Kluwer Academic. hlm 11-34.
Bueno PR, Buno CBM, Santos DLM, Santiago LA. 2013. Antioxidant Activity of Ficus pseudopalma Balnco and its cytitoxity effect on Hepatocelullar Carcinoma and Peripheral Blood Mononuclear cell. Curr Res in Bio Pharma Sci. 2(2):14-21.
Cane DE, Walsh CT, Khosla C. 1998. Harnessing the biosynthetic code:
combinations, permutations, and mutations. Science. 282:63-68.
Cane DE, Walsh CT. 1999. This parallel and convergent universes of poliketide synthetase and nonribosomal peptide synthetase. Chem Biol. 6:319-325. Danusantoso H. 2003. Peran radikal bebas terhadap beberapa penyakit paru-paru.
J Ked Tris. 22(1):31-36.
Dean JD. 2003. Flavone: The molecular and mechanistic study of how a simple flavonoid protects dna from oxidative damage. [Thesis]. Tennessee (US): East Tennessee State University.
Ebada SS, Wray V, Voogd NJ, Deng Z, Lin W, Proksch P. 2009. Two new jaspamide derivatives from the marine sponge Jaspis splendes. Mar Drugs.7:435-444.
Ebada SS, Lin WH, Proksch P. 2010. Bioactive sesterterpenes and triterpenes from marine sponges:occurence and pharmacological significance. Marine Drugs. 8:313-346.
Effendi. 2012. Antimicrobial activity of bioactive compounds isolated from marine bacteria associated with sponge Jaspis sp. and their genetic analysis. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Fadhillah M. 2014. Uji toksisitas ekstrak bakteri yang berasosiasi dengan spons
dan analisis keragaman dna yang berperan dalam sintesis senyawa bioaktif [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fiaschi T, Chiarugi P. 2012. Oxidative stress, tumor microenvironment, and metabolic reprogramming: a diabolic liaison. Int J Cell Biol. 2012:1-8. Gabant M, Schmitz-Afonso I, Gallard JF, Menou JL, Laurent D, Debitus C,
25 Garcia AA. 2007. Cervical cancer [internet]. University of Southern California (diunduh pada tanggal 4 Agustus 2014). Tersedia pada : http://www.emedicine.medscape.com/article/253513- overview.
Go VW, Butrum RR, Wong DA. 2003. Diet, Nutrition, and Cancer Prevention: The Postgenomic Era. J Nutr. 133: 3830-3836.
Halliwel JB, Gutteridge JM. 1999. Free Radicals in Biology and Medicine. Third Edition. New York (US). Oxford University Press Inc. hlm 105 115.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Niksolihin S, editor. Bandung (ID): ITB. Terjemahan dari: Phytochemical Methods.
Hosseinian F. 2006. Antioxidant properties of flaxseed lignans using in vitro model systems. [Thesis]. College of Pharmacy and Nutrition. Saskatoon (CA): Universityof Saskatchewan Saskatoon, Canada.
Hu SC, Hong K, Song YC, Liu JY, Tan RX. 2008. Biotransformation of soybean isoflavon by marine Streptomyces sp. 060524 and cytotoxicity of the product. World J Microbiol Biotechnol. 25: 115-121.
Isnindar, Wahyuono S, Setyowati EP. 2011. Isolasi dan identifikasi senyawa antioksidan daun kesemek (Diospyros kaki Thunb.) dengan metode DPPH (2,2-difenil-1-pikrilhidrazil). Majalah Obat Tradisional. 16(3):157-164. Kalirajan A, R anjitsingh A, Jacob A. 2013.Antioxidant potential and biochemical
evaluation of metabolites from the marine bacteria Virgibacillus sp. associated with the sponge Callyspongia diffusa. Free Rad Antiox. 3(1): 47-51.
Lee Y, Jang KH, Jeon J, Yang WY, Sim CJ, Oh KB, Shin J. 2012. Cyclic Bis-1,3-dialkylpyridiniums from the Sponge Haliclona sp. Mar Drugs 10: 2126-2137.
MacMillan SM. 1999. Starting A Succesful Commercial Sponge Aquaculture Farm. Hawaii (US): CTSA Publication.
Maxwell SRJ, Lip GYH. 1997. Free radicals and antioxidants in cardiovascular desease. Br J Clin Pharmacol. 44:307-317.
Mc Cord JM. 2000. The evolution of free radicals and oxidative stress. The Am J Med 108:652-659.
McKelvery KD, Evans JP. 2003. Cancer Genetics in Primary Care. J Nutr. 133: 3767-3772.
Milner JA. 2004. Molecular Targets for Bioactive Food Components. J Nutr. 134: 2492-2498.
Moffitt MC, Neilan BA. 2003. Evolutionary affiliations within the superfamily of
ketosynthases reflect complex pathway associations. J Mol Evol. 56:
446-457
Müller WEG, Grebenjuk VA, Thakur NL, Thakur AN, Batel R, et al. 2004. Oxygen-controlled bacterial growth in the sponge Suberites domuncula: toward a molecular under- standing of the symbiotic relationships between sponge and bacteria. Appl Environ Microbiol. 70: 2332-2341.
Newton GL, Rawat M, Clair JJL, Jothivasan VK, Budiarto T, Hamilton CJ, Claiborne A, Helmann JD, Fahey RC. 2009.Bacillithiol is an antioxidant thiol produced in Bacilli. Nat Chem Biol. 5(9):625-627.
26
Proksch P, Edrada RA, Ebel R. 2002. Drugs from the seas-current status and microbial implications. Appl Microbiol Biotechnol. 59:125-134.
Ramanthan R, Tan CH, Das. 1992. Cytotoxic effect of plant polyphenols & fatsoluble vitamins on malignat human cultured cells. Cancer Letters 62(3):217-224.
Ren W, Qiao Z, Wang H, Zhu L,Zhang L. 2003. Flavonoid: Promising Anticancer Agents. Med Res Rev 23(4):519-534.
Sambrook W, Russel DW. 2001. Molecular Cloning: A Laboratory Manual. Ed ke-3. New York (US): Gold Spring Harbor Laboratory.
Schirmer A, Gadkari R, Reeves CD, Ibrahim F, DeLong EF, Hutchinson CR. 2005. Metagenomic analysis reveal diverse polyketide synthase gene cluster in microorganisme associated with the marine sponge Discodermia dissoluta. Appl Environ Microbiol. 71: 4840-4849.
Schwarez D, Marhiel MA. 2001. Multimodular biocatalysts for natural product assembly. Naturwissenschaften. 88:93-101.
Shen B, L. Du, C. Sanchez, D.J. Edwards, M. Chen, and J.M. Murrell. 2001. The biosynthetic gene cluster for the anticancer drug bleomycin from Streptomyces verticillus ATCC15003 as a model for hybrid peptide polyketide natural product biosynthesis. J Ind Microbiol Biotechnol. 27:378-385.
Simmons TL, Andrianasolo E, McPhail K, Flat P, Gerwick WH. 2005. Marine natural product as anticancer drugs. Mol Canc Ther 4:333-342.
Sipkema D, Franssen MCR, Osinga R, Tramper J, Wijffels RH. 2005. Marine sponges as pharmacy. Mar Biotechnol. 7:142-162.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. MEGA5 Molecular Evolutionary Genetics Analysis using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Mol Biol and Evol. 28:2731-2739.
Tang S, Xu R, Lin W, Duan H. 2012. Jaspiferin A and B: two new secondary metabolites from the south China sea sponge Jaspis stellifera. Rec Nat Prod. 6:398-401.
Taylor MW, Radax R, Steger D, Wagner M. 2007. Sponge-associated microorganisms: evolution, ecology, and biotechnological potential. Microbiol Mol Biol Rev. 71:295-347.
Thakur AN, Thakur NL, Indap MM, Pandit RA, Datar VV, Muller WEG. 2005. Antiangiogenic, antimicrobial, and cytotoxic potential of sponge-associated bacteria. Mar Biotechnol. 7: 245-252.
Thomas TRA, Kavlekar DP, Lokabharati PA. 2010. Marine drugs from sponge-microbe association-A Review. Mar Drugs 8: 1417-1468.
Tokasaya P. 2010. Sponge-associated bacteria producing antimicrobial compounds and their genetic diversity analysis [tesis]. Bogor (ID): Institut Pertanian Bogor.
Utami AWA. 2013. Uji toksisitas senyawa bioaktif dari bakteri yang berasosiasi dengan spons[skripsi]. Bogor (ID): Institut Pertanian Bogor.
27 Wang G. 2006. Diversity and biotechnological potential of the sponges-associated
microbial consortia. J Ind Microbiol Biotechnol. 33: 545- 551.
[WHO]. World Health Organization. 2013. Cancer Health Topic [Internet].
(diunduh 2014 Juni 25). Tersedia pada:
http://www.who.int/cancer/en/index.html.
Widyastuti N. 2009. Pengukuran Aktivitas Antioksidan dengan Metode CUPRAC, DPPH, dan FRAP serta Korelasinya dengan Fenol dan Flvonoid pada Enam Tanaman [skripsi]. Bogor (ID) : Institut Pertanian Bogor.
Zhang L, An R, Wang J, Sun N, Zhang S, Hu J, Kuai J. 2005. Exploring novel bioactive compounds from marine microbes. Curr Opin in Microbiol. 8: 276-281.
28
LAMPIRAN
Lampiran 1 Komposisi medium sea water complete (SWC) Komposisi untuk 1000 mL
Lampiran 2 Ekstrak bakteri yang berasosisi dengan spons (a) SAB E-31, (b) SAB E-41, (c) SAB E-57, (d) SAB E-35, (e) SAB E-40, (f) SAB E-38, (g) HAL-08, (h) HAL-20
29
1000 0.162 0.016
HAL-08 1000 0.209 0.021 0.02
1000 0.208 0.021
1000 0.204 0.020
HAL-20 1000 0.206 0.021 0.02
1000 0.209 0.021
1000 0.208 0.021
Lampiran 4 Contoh perhitungan rendemen ekstrak bakteri yang berasosiasi dengan spons
endemen Volume ekstrak obot ekstrak 100
endemen 1000 mL0.179 g 100
endemen 0.018
ata rata rendemen Ulangan 1 Ulangan 2 Ulangan 3 3
ata rata rendemen 0.018 0.028 0.018 3
30
Lampiran 5 Kandungan kimia ekstrak bakteri yang berasosiasi dengan spons Golongan
senyawa Hasil Uji Keterangan
Flavonoid
Indikasi hasil uji positif : warna kuning, merah, atau jingga pada lapisan amil alkohol
Alkaloid
Indikasi hasil uji positif : pareaksi Wagner
(endapan cokelat); Pareaksi Meyer (endapan putih);
Pareaksi Dragendorff (endapan merah jingga).
Saponin
Indikasi hasil uji positif : adanya busa yang stabil selama ± 10 menit
Tanin
Indikasi hasil uji positif : Warna biru tua atau hitam kehijauan menunjukkan adanya tanin
Terpenoid
Indikasi hasil uji positif : warna merah atau ungu menunjukkan adanya terpenoid
Steroid
31 Lampiran 6 Aktivitas antikanker ekstrak bakteri yang bersasosiasi dengan spons
terhadap sel HeLa dengan menggunakan metode MTT Kode
32
Lampiran 7 Contoh perhitungan nilai IC50 ekstrak bakteri yang berasosiasi dengan spons
Persentase penghambatan pada konsentrasi 625 µg mL-1:
enghambatan Absorbansi kontrol Absorbansi sampel Absorbansi kontrol 100
enghambatan 0.552 0.028 0.552 100
enghambatan 95.018
Kurva hubungan pengaruh konsentrasi ekstrak SAB E-40 (x) dengan persentase penghambatan sel HeLA (y)
IC50 = x saat y=50 Rumus persamaan garis y = 0.1127x + 23.562 50 = 0.1127x + 23.562 x = 234.59 µg mL-1
y = 0.1127x + 23.562 R² = 0.987
0 20 40 60 80 100
0 200 400 600 800
%
P
eng
ha
mbata
n
33 Lampiran 8 Aktivitas antioksidan ekstrak bakteri yang berasosiasi dengan spons
menggunakan metode DPPH Kode
Isolat Konsentrasi Ulangan Asampel+blanko Ablanko Asampel