ISOLASI DAN KARAKTERISASI cDNA GEN PENYANDI
METALLOTHIONEIN TIPE 2 DARI
Melastoma malabathricum
L.
THESIAWATY DIAN FAUZIAH
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Lampiran 1 Hasil sekuensing dengan mesin sekuensing otomatis ABI PRISM 310 Genetic Analyzer
1
Lanjutan Lampiran 1
1
Lampiran 2 Hasil pengurutan sisipan pada pGEM®-T Easy menggunakan primer T7
Keterangan.
: bagian dari DNA vektor : primer Mt2F dan Mt2R
: situs pemotongan EcoR1 : DNA sisipan
TATGGCCGAACTTTCTCTTGCTCCCGGCCGCCATGGCGGCCGCG
G
GAATTC
GATT
TCGAGAAAAATGTCTTGCTGTG
GAGGAAACTGC
GGATGTGGATCTGGCTGCAAGTGCGGCAACGGTTGTGGAGGTTG
CAAAATGTACCCTGACTTGGGATTCTCCGGCGAGACAACCACAA
CTGAGACTTTTGTCTTGGGCGTTGCACCGGCGATGAAGAATCAG
TACGAGGCTTCAGGGGAGAGTAACAACGCTGAGAACGATGCTTG
CAAGTGTGGATCTGACTGCAAGTGTGAT
CCTTGCACCTGCAAGT
GAAG
AATCACTAGT
GAATTC
GCGGCCGCCTGCAGGTCGACCATA
TGGGAGAGCTCCCAACGCGTTGGATGCATAGCTTGAGTATTCTA
TAGTGTCACCTAAATAGCTTAA
Lampiran 3 Hasil analisis kesejajaran urutan nukleotida cDNA MmMt2 dengan data gen di
GeneBank menggunakan program BLASTn
Accession Source
Max score
Total score
Query
coverage E value Max ident
NM_111773.3
Arabidopsis thaliana MT2A (METALLOTHIONEIN 2A) (MT2A) mRNA, complete cds
444 444 100% 6e-122 100%
U15108.1
Arabidopsis thaliana metallothionein-like protein (AtMT-K) mRNA, complete cds
444 444 100% 6e-122 100%
X62818.1 A.thaliana AtMT-1 mRNA for
metallothionein-like protein 439 439 100% 3e-120 99%
Y10850.1
Brassica juncea mRNA for metallothionein-like protein type 2, clone mt2-18
334 334 100% 8e-89 90%
AC011436.7
Arabidopsis thaliana chromosome III BAC F3L24 genomic sequence, complete sequence
331 449 100% 1e-87 100%
DQ244693.1 Zea mays clone 10085 mRNA sequence 325 325 100% 4e-86 89%
D78498.1
Brassica rapa mRNA for
metallothionein-like protein, complete cds
325 325 100% 4e-86 89%
D11394.1
Arabidopsis thaliana AtMT-1G gene for metallothionein-like protein, complete cds
324 437 100% 1e-85 99%
D78494.1
Brassica rapa mRNA for
metallothionein-like protein, complete cds
320 320 100% 2e-84 89%
L31940.1
Brassica campestris L. ssp pekinensis (clone bif98) metallothionein-like protein mRNA, complete cds
316 316 100% 2e-83 88%
AF200712.1
Brassica oleracea cultivar Green King metallothionein-like protein 2 (MT2) mRNA, complete cds
307 307 97% 1e-80 88%
AY333930.1 Pringlea antiscorbutica
metallothionein-like protein type 2 mRNA, complete cds 271 271 100% 8e-70 84%
AY847455.1 Thlaspi caerulescens metallothionein class II (MT2) mRNA, complete cds 264 264 100% 1e-67 83%
Y10852.1
Brassica juncea mRNA for metallothionein-like protein type 2, clone mt2-25
253 253 100% 2e-64 82%
Y10849.1
Brassica juncea mRNA for metallothionein-like protein type 2, clone mt2-4
253 253 100% 2e-64 82%
Y10851.1
Brassica juncea mRNA for metallothionein-like protein type 2, clone mt2-22
246 246 98% 3e-62 82%
Y10853.1
Brassica juncea mRNA for metallothionein-like protein type 2, clone mt2-28
232 232 98% 7e-58 81%
NM_120316.2
Arabidopsis thaliana MT2B (METALLOTHIONEIN 2B) (MT2B) mRNA, complete cds
224 224 100% 1e-55 79%
AK227568.1
Arabidopsis thaliana mRNA for metallothionein 2b, complete cds, clone: RAFL14-16-I02
224 224 100% 1e-55 79%
AF339712.1
Arabidopsis thaliana putative metallothionein 2b protein (At5g02380) mRNA, complete cds
224 224 100% 1e-55 79%
EU280163.1 Vitis vinifera metallothionein (MT) mRNA, complete cds 159 159 100% 4e-36 75%
Accession Source
Max score
Total score
Query
coverage E value Max ident metallothionein-like protein (Mt2)
mRNA, complete cds
DQ132853.1 Nicotiana tabacum metallothionein-like protein mRNA, complete cds 158 158 97% 1e-35 75%
EF421200.1
Nelumbo nucifera metallothionein-like protein class II (MT) mRNA, complete cds
154 154 100% 2e-34 74%
DQ178618.1
Arachis hypogaea type 2 metallothionein (MT2c) mRNA, complete cds
152 152 100% 5e-34 74%
DQ178617.1
Arachis hypogaea type 2 metallothionein (MT2b) mRNA, complete cds
152 152 100% 5e-34 74%
AJ309387.1 Atropa belladonna mRNA for putative
metallothionein-like protein type 2B 152 152 97% 5e-34 76%
EF564345.1 Sesbania drummondii metallothionein type 2 (MT2) mRNA, complete cds 149 149 100% 7e-33 74%
AJ879116.1 Capsicum chinense mRNA for metallothionein-like protein (mtb gene) 145 145 100% 8e-32 74%
U11256.1
Arabidopsis thaliana Columbia ecotype metallothionein (MT2b) gene, complete cds
141 227 100% 1e-30 89%
AB176559.1 Glycine max MET mRNA for type 2
metallothionein, complete cds 140 140 100% 3e-30 73%
AJ297968.1
Atropa belladonna mRNA for methallothioneine-like protein (mt2B gene)
140 140 97% 3e-30 74%
L02306.1 Ricinus communis metallothionein (RCMIT) mRNA, complete cds 138 138 53% 1e-29 84%
EF157297.1 Salix matsudana metallothionein-like protein MT2A mRNA, complete cds 136 136 100% 4e-29 73%
CU227084.1 Populus EST from severe
Lampiran 4 Hasil analisis kesejajaran urutan asam amino deduksi dari cDNA MmMt2 dengan data protein di GeneBank menggunakan program BLASTp
DB:ID Source Length Score Identity
% Positives % E() UNIPROT:MT2 A_ARATH Metallothionein-like protein 2A OS=Arabidopsis thaliana GN=MT2A PE=2 SV=2
81 482 100 100 3e-47
UNIPROT:MT2 _BRARA
Metallothionein-like protein type 2 OS=Brassica rapa PE=3 SV=1
80 443 93 95 1e-42
UNIPROT:MT2 2_BRAJU
Metallothionein-like protein type 2, MT2-18 OS=Brassica juncea PE=3 SV=1
80 443 93 95 1e-42
UNIPROT:A9U KL1_THLCA
Metallothionein class II OS=Thlaspi caerulescens GN=MT2 PE=4 SV=1
81 439 91 95 3e-42
UNIPROT:MT2 _BRARP
Metallothionein-like protein BIF98 OS=Brassica rapa subsp. pekinensis PE=3 SV=1
80 438 92 93 4e-42
UNIPROT:Q9M 697_BRAOL
Metallothionein-like protein 2 OS=Brassica oleracea GN=MT2 PE=4 SV=1
80 428 90 92 5e-41
UNIPROT:Q7X AF3_PRIAN
Metallothionein-like protein type 2 OS=Pringlea antiscorbutica PE=4 SV=1
80 414 88 92 2e-39
UNIPROT:MT2 1_BRAJU
Metallothionein-like protein type 2, MT2-4/MT2-25 OS=Brassica juncea PE=3 SV=1
80 403 86 91 4e-38
UNIPROT:MT2 5_BRAJU
Metallothionein-like protein type 2, MT2-28 OS=Brassica juncea PE=3 SV=1
80 397 83 91 2e-37
UNIPROT:MT2 3_BRAJU
Metallothionein-like protein type 2, MT2-22 OS=Brassica juncea PE=3 SV=1
80 392 82 90 8e-37
UNIPROT:Q0W TI6_ARATH
Metallothionein 2b OS=Arabidopsis thaliana GN=At5g02380 PE=4 SV=1
77 376 80 85 6e-35
UNIPROT:MT2 B_ARATH
Metallothionein-like protein 2B OS=Arabidopsis thaliana GN=MT2B PE=2 SV=1
77 376 80 85 6e-35
UNIPROT:Q8L DX5_ARATH
Metallothionein 2b OS=Arabidopsis thaliana PE=4 SV=1
77 368 79 83 5e-34
UNIPROT:A3F PG0_NELNU
Metallothionein-like protein class II OS=Nelumbo nucifera GN=MT PE=4 SV=1
80 345 71 79 2e-31
UNIPROT:Q45 W72_ARAHY
Metallothionein-like protein (Type 2 metallothionein) OS=Arachis hypogaea GN=MT2d PE=4 SV=1
81 340 70 82 9e-31
UNIPROT:Q75 NI1_SOYBN
Type 2 metallothionein OS=Glycine max GN=MET PE=4 SV=1
79 337 70 83 2e-30
UNIPROT:Q7M 213_SOYBN
Metallothionein OS=Glycine max PE=4 SV=1
79 335 70 81 3e-30
UNIPROT:Q45 W73_ARAHY
Type 2 metallothionein OS=Arachis hypogaea GN=MT2a PE=4 SV=1
80 333 67 80 6e-30
UNIPROT:Q3L TN2_ARAHY
Type 2 metallothionein OS=Arachis hypogaea GN=MT2c PE=4 SV=1
80 333 67 80 6e-30
UNIPROT:Q75 NI3_PHAAU
Type 2 metallothionein OS=Phaseolus aureus GN=MET PE=4 SV=1
79 329 69 80 2e-29
UNIPROT:A7P NM4_VITVI
Chrom osom e chr8 scaffold_23, whole genome shotgun sequence (Metallothionein) OS=Vitis
79 328 70 76 2e-29
vinifera GN=MT PE=4 SV=1 UNIPROT:Q75
NH9_PHAAN
Type 2 metallothionein OS=Phaseolus angularis GN=MET PE=4 SV=1
79 327 69 80 3e-29
UNIPROT:A5G ZZ9_9ROSI
Metallothionein
OS=Bruguiera gymnorhiza PE=4 SV=1
79 327 69 77 3e-29
UNIPROT:A1Z0 N9_9ROSI
Metallothionein-like protein MT2A OS=Salix matsudana PE=4 SV=1
79 327 69 77 3e-29
UNIPROT:MT2 B_SOLLC
Metallothionein-like protein type 2 B OS=Solanum lycopersicum GN=MTB PE=2 SV=1
82 324 70 78 6e-29
UNIPROT:A5JS U2_9FABA
Metallothionein type 2 OS=Sesbania drummondii GN=MT2 PE=4 SV=1
79 323 69 77 8e-29
UNIPROT:O04 688_MESCR
Metallothionein
OS=Mesembryanthemum crystallinum PE=4 SV=1
80 322 67 74 1e-28
UNIPROT:Q94I 87_ATRBE
Putative metallothionein-like protein type 2B OS=Atropa belladonna PE=4 SV=1
81 321 73 80 1e-28
UNIPROT:MT2 _CICAR
Metallothionein-like protein 2 OS=Cicer arietinum PE=3 SV=2
79 321 66 79 1e-28
UNIPROT:MT1 _COFAR
Metallothionein-like protein 1 OS=Coffea arabica GN=METAL1 PE=3 SV=1
80 321 64 72 1e-28
UNIPROT:Q9F R40_PETHY
Putative metallothionein-like protein OS=Petunia hybrida GN=Mt2 PE=4 SV=1
80 320 66 76 2e-28
UNIPROT:A1Z0 P0_9ROSI
Metallothionein-like protein MT2B OS=Salix matsudana PE=4 SV=1
78 319 70 80 2e-28
UNIPROT:Q5D UH5_CAPCH
Metallothionein-like protein OS=Capsicum chinense GN=mtb PE=4 SV=1
81 318 65 73 3e-28
UNIPROT:Q6P ML4_POPJC
Metallothionein 2a
OS=Populus jackii GN=MT2a PE=4 SV=1
79 317 66 75 4e-28
UNIPROT:Q6L 8H8_9ASTR
Metallothionein 2
(Metallothionein-like protein type 2) OS=Codonopsis lanceolata GN=MTII PE=4 SV=1
78 317 64 75 4e-28
UNIPROT:A9Y TZ1_SOLTU
Metallothionein-like protein OS=Solanum tuberosum PE=4 SV=1
82 317 69 76 4e-28
UNIPROT:Q9Z RV0_FAGSY
Metallothionein-like protein class II OS=Fagus sylvatica PE=4 SV=1
79 314 66 75 9e-28
UNIPROT:B3V KV4_SOLNI
Type 2 metallothionein OS=Solanum nigrum GN=MT2b PE=4 SV=1
82 314 68 75 9e-28
UNIPROT:B3V KV3_SOLNI
Type 2 metallothionein OS=Solanum nigrum GN=MT2a PE=4 SV=1
82 314 68 75 9e-28
UNIPROT:Q6P ML3_POPJC
Metallothionein 2b
OS=Populus jackii GN=MT2b PE=4 SV=1
78 312 67 80 2e-27
UNIPROT:A5J0 91_9ROSI
Metallothienein-like protein OS=Kandelia candel PE=4 SV=1
79 312 66 75 2e-27
UNIPROT:A9P ES1_POPTR
Putative uncharacterized protein OS=Populus trichocarpa PE=4 SV=1
78 311 67 80 2e-27
UNIPROT:MT2 _ACTDE
Metallothionein-like protein type 2 OS=Actinidia deliciosa GN=pKIWI504 PE=2 SV=1
78 311 69 75 2e-27
UNIPROT:MT2 _RICCO
Metallothionein-like protein type 2 OS=Ricinus communis GN=MTI PE=3 SV=1
80 310 69 74 3e-27
UNIPROT:Q93 X22_QUESU
Metallothionein-like protein OS=Quercus suber GN=mt PE=4 SV=1
77 309 66 76 3e-27
UNIPROT:Q6P W24_CYNDA
Metallothionein-like protein OS=Cynodon dactylon PE=4 SV=1
81 309 62 75 3e-27
UNIPROT:Q5U 7K6_9POAL
Metallothionein-like protein OS=Saccharum hybrid cultivar PE=4 SV=1
81 309 65 75 3e-27
PENDAHULUAN
Latar Belakang
Tanaman memiliki beberapa mekanisme toleransi terhadap Al antara lain melalui immobilisasi Al di dinding sel, induksi pH di daerah rizosfer, permeabilitas selektif membran sel, kompartementasi Al di vakuola, eksudasi ligan dan asam organik pengkelat, dan induksi sintesis protein pengkelat Al (Taylor 1991). Richards et al. (1998) berhasil mengisolasi gen-gen dari
Arabidopsis thaliana yang ekspresinya terinduksi oleh cekaman Al, yaitu gen-gen penyandi glutathione s transferase (GST),
peroksidase, superoksida dismutase (SOD), dan metallothionein.
Metallothionein (MT) merupakan protein dengan berat molekul rendah (4-8 kDa), kaya akan sistein (25-33%), tidak memiliki asam amino aromatik, bersifat mengikat logam berat, serta diketahui berperan dalam homeostasis dan detoksifikasi ion-ion logam (Wong et al. 2004). Pada tanaman, pengaruh ion logam pada ekspresi gen Mt bervariasi tergantung jenis tanaman dan tipe protein MT (Garcia-Hernandez et al.
1998). Berdasarkan klasifikasi Cobbet dan Goldsbrough (2002), MT dibagi menjadi empat tipe berdasarkan komposisi urutan asam amino sistein (Cys). MT tipe 1 terdiri atas dua domain dengan motif pengikatan logam Cys-X-Cys (-X- merupakan asam amino selain Cys). Pada Arabidopsis, MT1 berperan dalam homeostasis Cu pada akar (Guo et al. 2008). MT tipe 2 memiliki komposisi Cys-Cys pada asam amino ketiga dan keempat dari sekuen asam aminonya, serta memiliki motif Cys-Gly-Gly-Cys pada ujung N-terminal dan motif Cys-X-Cys pada ujung C-teminal. MT2 merupakan MT pertama pada tanaman yang diisolasi (Kagi 1991). Pada tanaman Arabidopsis, MT2 ditemukan terutama pada daun tua dan terlibat dalam mekaninsme sinyal ROS (Reactive Oxygen Species) (Wong et al. 2004). Perlakuan menggunakan tembaga (Cu) meningkatkan transkripsi MT2 ini (van Hoof
et al. 2001). Begitu pula pada Piper nigrum
(black pepper), transkripsi MT2 dideteksi terutama pada daun tuanya. Ekspresi Mt2
yang tinggi pada daun terutama pada trikoma yang berhubungan dengan fungsi sekretori adalah untuk mengeksudasi kelebihan akumulasi logam berat di daun (Garcia-Hernandez et al. 1998). Transkripsi MT2 P. nigrum ini meningkat dengan perlakuan menggunakan Cd, Fe, Cu, Mn, dan Zn
(Ozkuthu et al. 2006). MT tipe 3 yang sering disebut sebagai fitokelatin (PC) memiliki empat asam amino Cys pada N-terminal. Tiga Cys pertama membentuk motif Cys-Gly-Asn-Cys-Asp-Cys. Sedangkan Cys keempat membentuk motif Gln-Cys-X-Lys-Lys-Gly. Pada C-terminal terdapat enam asam amino Cys yang membentuk tiga motif Cys-X-Cys. MT3 berperan dalam transpor Cd dari akar ke pucuk dalam mekanisme pengurangan kelebihan akumulasi Cd di akar (Guo et al. 2008). Sedangkan MT tipe 4 memiliki tiga wilayah yang masing-masing memiliki 5 sampai 6 Cys dan biasanya membentuk motif Cys-X-Cys. MT4 berperan dalam toleransi dan akumulasi yang tinggi terhadap Zn (Guo
et al. 2008).
Melastoma malabathricum L. merupakan tumbuhan yang tersebar di hutan hujan tropis di Asia Tenggara. Tumbuhan ini dapat menyerap dan mengakumulasi Al pada jaringan mesofil dan epidermis atas daun, serta pada seluruh jaringan akar terutama pada sel-sel epidermis dan endodermisnya (Watanabe et al. 1998). Menurut Chenery (1948) dalam Watanabe et al. (1998), tumbuhan yang dapat mengembangkan mekanisme pertahanan dan mengakumulasi lebih dari 1000 mg/kg Al didefinisikan sebagai akumulator Al. Watanabe et al. (1998) juga berhasil mengukur akumulasi Al dalam pucuk daun, daun muda, daun tua, dan ujung akar M. malabathricum, yaitu masing-masing sebesar 8.0, 9.2, 14.4, dan 10.1 mg/g berat basah daun.
Pada M. malabatrichum, MT diduga berperan dalam detoksifikasi ion logam-logam berat, termasuk Al. Berdasarkan peranan MT tersebut, maka isolasi dan karakterisasi dari cDNA gen penyandi Mt2
dari tanaman M. malabatrichum penting dilakukan untuk memahami peran MT2 khususnya dalam ketahanan terhadap cekaman Al. Suharsono et al. (in press) telah berhasil mengisolasi metallothionein tipe 2 dari Melastoma affine. MT2 M. malabatrichum diduga memiliki fungsi yang sama dengan MT2 M. affine karena kedua tumbuhan ini toleran terhadap cekaman Al.
Tujuan
2
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Kegiatan penelitian dilaksanakan mulai bulan Desember 2007 sampai dengan Oktober 2008 di Laboratorium
Biotechnology Research Indonesia – The Netherlands (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Kampus IPB Darmaga, Bogor.
Bahan
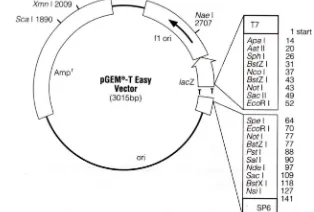
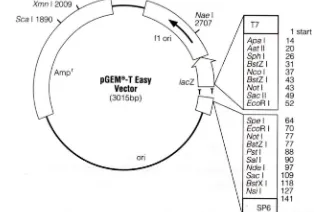
Daun M. malabathrichum digunakan sebagai bahan tumbuhan. Plasmid pGEM®-T
Easy (Gambar 1) digunakan sebagai vektor pengklonan dan Escherichia coli galur DH5 digunakan sebagai inang vektor rekombinan.
Gambar 1 Peta fisik plasmid pGEM®-T Easy.
Primer aktin ActF (ATGGCAGATGCC GAGGATAT) dan ActR (CAGTTGTGCGA CCACTTGCA) digunakan untuk verifikasi cDNA, primer spesifik Mt2F (TCGAGAAA AATGTCTTGCTGTG) dan Mt2R (CTTCAC TTGCAGGTGCAAGG) yang didesain berdasarkan cDNA Arabidopsis thaliana
(Nomor aksesi: AY037263) digunakan untuk mengisolasi cDNA Mt2 dari M. malabatrichum.
Metode
Isolasi RNA total dari daun
Semua alat dan media yang digunakan untuk isolasi RNA total disterilkan (diautoklaf pada 121 °C 20 menit), ddH2O yang digunakan diperlakukan dengan 0.1% (v/v) DEPC (Diethylpirocarbonate) dan disterilkan.
RNA total diisolasi dari daun muda M. malabathricum dengan menggunakan prosedur LiCl (Chang et al. 1993) yang dimodifikasi. Sebanyak 0.5 gram daun yang telah dipisahkan dari tulang daunnya digerus sampai halus bersama 0.3 gram pasir kuarsa, lau ditambahkan 3 ml buffer ekstraksi [2% CTAB (hexadecyl trimethyl amonium
bromide), 2% PVP (Polyvinyl pirolidon), 100 mM Tris-HCl pH 8, 25 mM EDTA, 2 M NaCl, dan 100mM -merkaptoetanol] yang bersuhu 65 °C dan digerus hingga halus, lalu dimasukkan ke dalam tabung 1.5 ml dan diinkubasi pada 65 °C 10 menit sambil dibolak-balik, ditambahkan 1x volume CI (kloroform:isoamilalkohol 24:1), lalu divorteks sebentar dan disentrifugasi 10000 rotasi per menit (rpm) pada 4 °C 10 menit (Jouan BR4i). Supernatan ditambah 1/4 kali volume LiCl 10 M dan diinkubasi pada suhu –20 °C selama 2 jam, lalu disentrifugasi 10000 rpm pada 4 °C 20 menit. Endapan yang terbentuk ditambah 400 l TE (10 mM Tris-HCl pH 7.5, 1 mM EDTA pH 8) dan diekstraksi dengan 1x volume fenol pH 9, divorteks sebentar lalu disentrifugasi 10000 rpm pada 20 °C 10 menit. Supernatan ditambah 1/4 kali volume LiCl 10 M dan diinkubasi pada –20 °C selama 2 jam. Larutan kemudian disentrifugasi 10000 rpm pada 4°C 10 menit. Endapan selanjutnya dicuci dengan etanol 70% (v/v), disentrifugasi, dikeringudarakan, lalu diresuspensi dengan 20 l air DEPC.
Kuantifikasi dan kualifikasi RNA total
Kuantitas RNA total hasil isolasi ditentukan dengan spektrofotometer UV-VIS (Cecil CE 2020) pada panjang gelombang 260 dan 280 nm. Konsentrasi RNA ditentukan dengan penyetaraan bahwa satu satuan absorban pada panjang gelombang 260 nm sebanding dengan 40 g/ml RNA. Kemurnian RNA total diukur melalui perbandingan absorban panjang gelombang 260 nm dengan 280 nm, yaitu antara 1.8 sampai 2 (Sauders & Parker 1999).
Kualitas RNA ditentukan dengan elektroforesis pada gel agarosa 1% (b/v) (Sigma, Germany) dengan larutan penyangga MOPS [4.2/l gram MOPS (3-Morpholino propanesulfonic acid), 0.41 g/l Na-asetat, 0.37 g/l EDTA(2NA)H2O]. Sebanyak 1 l RNA dicampur dengan 12 l larutan premiks [5% 20 kali MOPS, 50% (v/v) formamida, 17.5% (v/v) formaldehid, 27.5% (v/v) air DEPC] dipanaskan pada 65 °C 10 menit, didinginkan di es selama 5 menit, dan diberi 1/6 kali volume loading dye [0.25% (b/v)
bromphenol blue, 0.25% (b/v) xylene cyanol
3
Sintesis cDNA
Sintesis cDNA dilakukan melalui reaksi transkripsi balik menggunakan Superscript III Reverse Transcriptase (Invitrogen). Komposisi reaksi sintesis cDNA ialah 5 g RNA total, 1x RT buffer, 20 pmol primer oligo-dT, 4 mM dNTP, 10 mM DTT, 40 U enzim Superscript TMIII RTase, dan air DEPC dengan volume reaksi 20 l. Kualitas cDNA diperiksa menggunakan PCR dengan primer spesifik aktin. Komposisi reaksi PCR-aktin tersebut ialah 0.5 l cDNA, 1 l buffer Taq (Gen Scr Inc.), 0.2 mM dNTP, 10 pmol primer ActF, 10 pmol primer ActR, 4 % (b/v) DMSO (dimetilsulfoksida), 0.5 U enzim Taq DNA polimerase (Gen Scr Inc.), dan ddH2O hingga volume akhir 10 l. PCR dilakukan dengan kondisi pra-PCR pada 95 °C 5 menit, denaturasi pada 94 °C 30 detik, penempelan primer pada 55 °C 30 detik, dan pemanjangan pada 72 °C 1.5 menit sebanyak 35 siklus, pasca-PCR pada 72 °C 5 menit, dan inkubasi pada 15 °C 10 menit.
Amplifikasi fragmen cDNA MmMt2 dengan primer spesifik
cDNA Mt2 dari M. malabatrichum
(MmMt2) diisolasi dan diamplifikasi menggunakan PCR dengan primer spesifik
Mt2. Sebanyak 1 l hasil reaksi RT ditambah dengan 2 l 10x Taq buffer, 0.2 mM dNTP, 4 % (b/v) DMSO, 20 pmol primer Mt2F, 20 pmol primer Mt2R, 0.5 U enzim taq DNA polimerase (Gen Scr Inc.), dan dH2O hingga volume akhir 20 l. Reaksi PCR dilakukan dengan kondisi pra-PCR pada 95 °C 5 menit, denaturasi pada 94 °C 30 detik, penempelan primer pada 58 °C 30 detik, pemanjangan pada 72 °C 1.5 menit sebanyak 35 siklus, pasca-PCR pada 72 °C 5 menit, dan inkubasi pada 15°C 10 menit.
Pengklonan cDNA MmMt2 ke dalam pGEM®-T Easy
Sebelum di klon ke dalam inang, cDNA
MmMt2 diligasikan ke dalam vektor menggunakan prosedur Promega (1996). Komposisi reaksi ligasi ialah 2 µl 5x buffer
rapid ligase, 1 µl pGEM®-T Easy (10 ng), 1 µl ml T4 DNA ligase (3 U/µl) (Promega), dan 3 µl produk PCR, kemudian diinkubasi pada 4 °C selama semalam. Hasil ligasi diintroduksikan ke dalam E.coli galur DH5 menggunakan metode yang dipublikasikan Suharsono (2002).
Seleksi koloni E. coli yang mengandung vektor rekombinan
Seleksi yang digunakan ialah seleksi resistensi terhadap ampisilin dan seleksi biru-putih. Sebanyak 50 l bakteri hasil transformasi dicawansebarkan pada media 15 ml LB padat [1% bakto tripton, 0.5 % ekstrak khamir, 1% NaCl, 2.5 % agar (b/v)] yang mengandung 100 mg/l ampisilin, 10 l 100 mM isopropiltio- -galaktosida (IPTG), dan 50 l 2% (b/v) X-gal ( 5-bromo-4-chloro-3-indolyl- -D-galactoside), kemudian diinkubasi pada 37 °C selama semalam. Koloni putih yang tumbuh kemudian diambil menggunakan tusuk gigi steril dan digores pada LB padat dengan ampisilin untuk stok dan sisa goresannya digunakan sebagai bahan cetakan PCR untuk mendeteksi keberadaan sisipan cDNA MmMt2 dalam vektor rekombinan. Sisa goresan tersebut disuspensikan ke dalam 6.5 l ddH2O, dipanaskan pada 95 °C 10 menit, dan didinginkan pada 15 °C 5 menit. Suspensi ditambah dengan 1 l 10x buffer taq, 0.2 mM dNTP, 4 % (b/v) DMSO, 20 pmol primer
Mt2F, 20 pmol primer Mt2R, 0.5 U enzim taq DNA polimerase (Gen Scr Inc.) dengan volume akhir 10 l. PCR dilakukan pada kondisi yang sama dengan amplifikasi fragmen cDNA MmMt2.
Analisis cDNA sisipan
Plasmid pGEM®-T Easy rekombinan yang terdapat dalam koloni putih hasil seleksi biru-putih diisolasi menggunakan prosedur yang dipublikasikan oleh Suharsono (2002) dan Anwar (2008). Plasmid rekombinan yang telah diisolasi dikeluarkan sisipannya dengan pemotongan menggunakan enzim EcoR1 (Promega Inc.). Sebanyak 100 ng DNA plasmid dicampur dengan 10 U enzim restriksi EcoR1, buffer 1x, dan ddH2O sampai volume akhir 20 l, kemudian diinkubasi pada 37 °C selama 8 jam.
Pengurutan DNA dan analisisnya
Pengurutan DNA menggunakan DNA Sequencer ABI Prism model 310 versi 3.7. Selanjutnya, urutan cDNA dianalisis homologinya menggunakan program BLAST (basic local alignment search tools) (http://www.ncbi.nlm.nih.gov/blast/). Deduksi asam amino fragmen MmMt2
4
(http://www.tools.neb.com/NEBcutter2/htm). Analisis kesamaan, filogenetik, dan profil berdasarkan urutan nukleotida dan deduksi asam amino dengan Mt2 dari spesies lain menggunakan program MAFFT ver.6.0. (http://align.bmr.kyushu-.ac.jp/mafft/online/ server/) (Katoh et al. 2005). Analisis urutan nukleotida untuk mencari ORF (open reading frame) menggunakan program BESTORF (http://www.softberry/bestorf/). Analisis domain terkonservasi pada cDNA MmMt2
menggunakan program conserved domain
NCBI (http://www.ncbi.nlm.nih. gov/ structure/cdd/wrpsb.cgi).
HASIL DAN PEMBAHASAN
Hasil
Isolasi RNA total dari daun
RNA total dari M. malabatrichum
berhasil diisolasi dari daun muda. Kuantifikasi RNA total dengan spektrofotometer pada 260 menunjukkan bahwa total RNA yang berhasil diisolasi berkisar antara 242-360 g setiap gram bahan tanaman (Tabel 1).
Tabel 1 Hasil isolasi RNA total
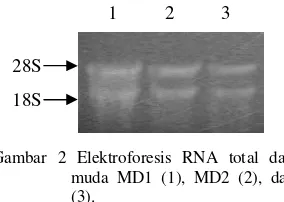
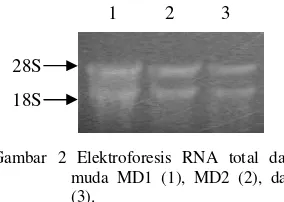
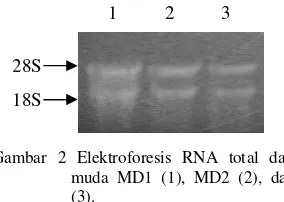
Kualitas RNA total dianalisis dengan melakukan elektroforesis di gel agarosa terdenaturasi oleh formaldehida dengan buffer MOPS 1x. Hasil elektroforesis tersebut menunjukkan adanya 2 pita dominan yang merupakan RNA ribosomal (rRNA) 28S dan 18S (Gambar 2).
Gambar 2 Elektroforesis RNA total dari daun muda MD1 (1), MD2 (2), dan MD3 (3).
Sintesis cDNA
PCR dengan primer spesifik gen aktin digunakan sebagai kontrol untuk melihat keberhasilan sintesis cDNA dan kemurnian RNA total dari hasil reaksi RT. PCR dengan menggunakan primer untuk ekson1-ekson2 dari gen aktin (ActF dan ActR) dan menggunakan cetakan cDNA, menghasilkan pita DNA yang berukuran sekitar 450 pb (Gambar 3).
Gambar 3 Hasil PCR aktin menggunakan cDNA total MD1 (1), MD2 (2), dan MD3 (3) sebagai cetakan.
Amplifikasi fragmen cDNA MmMt2 dengan primer spesifik
Amplifikasi fragmen cDNA MmMt2 dilakukan dengan menggunakan cDNA total dari daun (cDNA MD2) sebagai cetakan dan primer spesifik Mt2F dan Mt2R. Hasilnya ialah satu fragmen cDNA yang berukuran sekitar 250 pb (Gambar 4).
Gambar 4 Fragmen MmMt2 hasil PCR menggunakan cDNA MD2 sebagai cetakan.
Pengklonan cDNA MmMt2 ke dalam pGEM®-T Easy
Setelah 16 jam di media seleksi, E.coli
yang ditransformasi dengan hasil ligasi antara pGEM®-T Easy dan cDNA MmMt2 menghasilkan koloni putih dan biru (Gambar 5).
Absorban pada No Bahan
260 280
Rasio 260/ 280 Total RNA ( g/g sampel) 1
0.5 g daun muda (MD1)
0.451 0.265 1.70 360.4
2
0.5 g daun muda (MD2)
0.303 0.162 1.87 242.4
0.5 g daun muda
(MD3) 0.315 0.190 1.66 252.0 3
M 1 2 3
450 pb
M MmMt2
250 pb
28S
18S
1
1 ATG TCT TGC TGT GGA GGA AAC TGC GGA TGT GGA TCT GGC TGC AAG 45
1 Met Ser Cys Cys Gly Gly Asn Cys Gly Cys Gly Ser Gly Cys Lys 15
46 TGC GGC AAC GGT TGT GGA GGT TGC AAA ATG TAC CCT GAC TTG GGA 90 16 Cys Gly Asn Gly Cys Gly Gly Cys Lys Met Tyr Pro Asp Leu Gly 30
91 TTC TCC GGC GAG ACA ACC ACA ACT GAG ACT TTT GTC TTG GGC GTT 135 31 Phe Ser Gly Glu Thr Thr Thr Thr Glu Thr Phe Val Leu Gly Val 45
136 GCA CCG GCG ATG AAG AAT CAG TAC GAG GCT TCA GGG GAG AGT AAC 180 46 Ala Pro Ala Met Lys Asn Gln Tyr Glu Ala Ser Gly Glu Ser Asn 60
181 AAC GCT GAG AAC GAT GCT TGC AAG TGT GGA TCT GAC TGC AAG TGT 225 61 Asn Ala Glu Asn Asp Ala Cys Lys Cys Gly Ser Asp Cys Lys Cys 75
226 GAT CCT TGC ACC TGC AAG TGA 246 76 Asp Pro Cys Thr Cys Lys End Gambar 5 Koloni E. coli DH5 yang
ditransformasi dengan hasil ligasi pGEM®-T Easy dan cDNA MmMt2 yang tumbuh di media seleksi yang mengandung ampisilin, X-gal dan IPTG.
cDNA MmMt2 yang menyisip pada pGEM®-T Easy di dalam koloni E. coli putih dikonfirmasi dengan PCR yang selanjutnya disebut PCR koloni. PCR koloni terhadap koloni putih menghasilkan fragmen berukuran sekitar 250 pb yang sama dengan cDNA MmMt2 hasil isolasi dengan PCR (Gambar 6A). Selain itu, konfirmasi cDNA sisipan juga dilakukan dengan pemotongan DNA plasmid rekombinan yang telah
diisolasi dari koloni putih menggunakan enzim EcoR1 yang mengapit daerah penyisipan. Pemotongan tersebut menghasilkan dua fragmen yaitu fragmen berukuran sekitar 3000 pb yang merupakan vektor pGEM®-T Easy dan fragmen berukuran sekitar 250 pb (Gambar 6B).
Gambar 6 Hasil analisis sisipan cDNA
MmMt2 dengan PCR koloni (A) dan pemotongan DNA plasmid rekombinan dengan
EcoR1 (B).
Analisis cDNA MmMt2
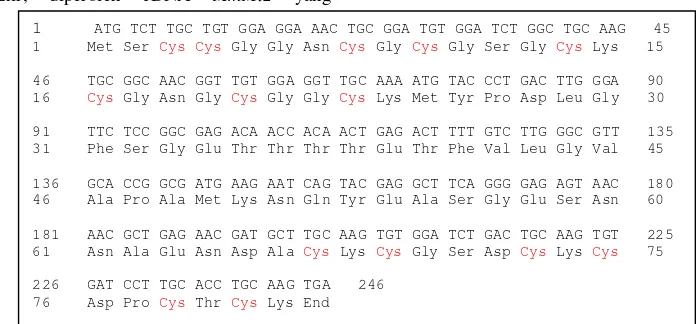
Berdasarkan urutan nukleotida dari kodon awal (ATG) sampai dengan kodon akhir, diperoleh cDNA MmMt2 yang
berukuran 246 pb ORF yang menyandikan 81 asam amino dengan 14 Cys (Gambar 7).
Gambar 7 Urutan nukleotida cDNA MmMt2 dari kodon awal (ATG) sampai dengan kodon akhir serta deduksi asam aminonya.
Analisis keberadaan situs pemotongan enzim restriksi pada cDNA MmMt2
menunjukkan bahwa pada cDNA MmMt2
mempunyai situs BbvI, BsaBI, BtsCI, TseI,
FokI, ApeKI, CspCI, HpyCH4III, PshAI,
BsrFI, SgrAI, AcuI, BtgZI, MboII, SfaNI,
Cac8I, danHpy188I (Gambar 8). Selain itu, tidak ada situs restriksi yang terdapat pada situs multi pengklonan (MCS: multiple cloning sites). sites sites sites sites sites).
koloni putih
koloni biru
3000 pb 1 M M 2
250 pb 250 pb
A B
2
Gambar 8 Peta restriksi yang terdapat pada cDNA MmMt2.
Berdasarkan hasil analisis kesejajaran lokal dengan program BLAST (Lampiran 4 dan 5), diambil Mt2 dari beberapa spesies yang memiliki tingkat kesamaan (max indent) lebih dari 70% termasuk MaMt2 dan GmMt2
(kedelai kultivar Slamet) untuk penyusunan pohon filogenetik berdasarkan kesamaan urutan nukleotida Mt2 dan deduksi asam aminonya (Gambar 9 dan Gambar 10). Berdasarkan pohon filogenetik tersebut, cDNA MmMt2 memiliki kekerabatan yang sangat dekat dengan AtMt2A dari Arabidopsis
thaliana, MaMt2 dari M. affine, GmMt2 dari kedelai kultivar Slamet, BjMt2 dari Brassica juncea, dan BoMt2 dari Brassica oleracea. Selanjutnya, kelima spesies yang sangat dekat kekerabatannya tersebut dianalisis perbandingan motif asam amino Cys-nya (Tabel 2) dan profil domain (Gambar 11). MmMT2, AtMT2A, MaMT2, dan GmMT2 dimasukkan dalam satu kelompok (selanjutnya disebut kelompok MmMT2) karena memiliki kesamaan urutan nukleotida dan asam amino. dan asam amino.
Gambar 9 Pohon filogenetik berdasarkan urutan nukleotida dari Mt2 berbagai spesies.
2
Gambar 10 Pohon filogenetik berdasarkan urutan asam amino dari MT2 berbagai spesies.
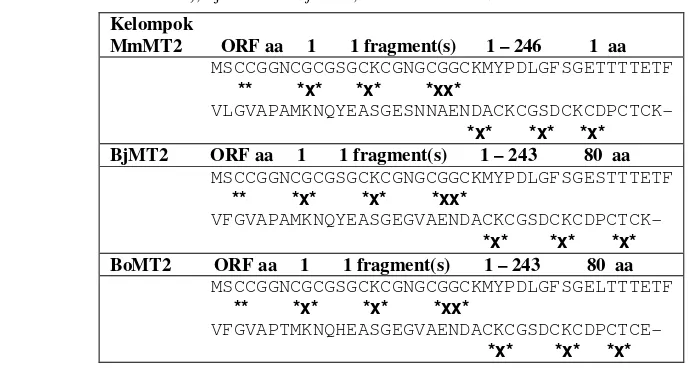
Tabel 2 Perbandingan ORF dan motif asam amino Cys pada kelompok MmMT2 (MmMT2 dari M. malabatrichum, AtMT2A dari A. thaliana, MaMT2 dari M. affine, dan GmMT2 dari kedelai kultivar Slamet), BjMT2 dari B. juncea, dan BoMT2 dari B. oleracea
Kelompok
MmMT2 ORF aa 1 1 fragment(s) 1 – 246 1 aa MSCCGGNCGCGSGCKCGNGCGGCKMYPDLGFSGETTTTETF
** *x* *x* *xx*
VLGVAPAMKNQYEASGESNNAENDACKCGSDCKCDPCTCK-
*x* *x* *x*
BjMT2 ORF aa 1 1 fragment(s) 1 – 243 80 aa MSCCGGNCGCGSGCKCGNGCGGCKMYPDLGFSGESTTTETF
** *x* *x* *xx*
VFGVAPAMKNQYEASGEGVAENDACKCGSDCKCDPCTCK-
*x* *x* *x*
BoMT2 ORF aa 1 1 fragment(s) 1 – 243 80 aa MSCCGGNCGCGSGCKCGNGCGGCKMYPDLGFSGELTTTETF ** *x* *x* *xx*
VFGVAPTMKNQHEASGEGVAENDACKCGSDCKCDPCTCE-
*x* *x* *x*
3
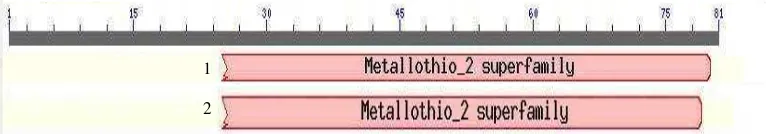
Gambar 11 Perbandingan daerah domain asam amino terkonservasi antara MmMT2, MaMT2, GmMT2, dan AtMT2A (1); serta BjMT2 dan BoMT2 (2).
Pembahasan
RNA total yang diisolasi dalam penelitian ini mempunyai kemurnian dari kontaminan protein yang baik karena mempunyai rasio OD260/OD280berkisar antara 1.66 dan 1.87. Menurut Saunders & Parker (1999), rasio OD260/OD280 sebesar 1.8 sampai 2.0 menunjukkan RNA total yang diisolasi mempunyai kemurnian yang tinggi. Berdasarkan rasio tersebut, maka MD2 yang mempunyai tingkat kemurnian paling tinggi selanjutnya digunakan sebagai cetakan untuk sintesis cDNA total. Hasil elektroforesis RNA total (Gambar 2) menunjukkan adanya dua pita dominan. Hal ini menunjukkan bahwa RNA total mempunyai integritas yang baik.
RNA total yang berhasil diisolasi digunakan sebagai cetakan untuk sintesis cDNA melalui reaksi transkripsi balik (reverse transcription/RT). Oligo(dT) digunakan sebagai primer spesifik reaksi ini supaya hanya mRNA yang disintesis dan diamplifikasi menjadi cDNA karena ciri khas mRNA ialah memiliki ujung poli-A. PCR dengan primer spesifik gen aktin digunakan sebagai kontrol untuk melihat keberhasilan sintesis cDNA dan kemurnian RNA total dari kontaminan DNA genom. Amplifikasi DNA genom ekson1-ekson2 akan menghasilkan fragmen berukuran sekitar 600 pb karena intron yang terdapat antara ekson1 dan ekson2 ikut teramplifikasi. Teramplifikasinya cDNA dengan primer ActF dan ActR dengan ukuran 450 pb tersebut menunjukkan bahwa sintesis cDNA total melalui proses transkripsi balik telah berlangsung dengan baik. Hal ini juga membuktikan bahwa RNA total yang telah diisolasi mempunyai kualitas yang baik karena terbebas dari kontaminasi DNA genom.
E. coli galur DH5 yang ditransformasi dengan hasil ligasi cDNA
MmMt2 dengan pGEM®-T Easy diseleksi dalam media yang mengandung ampisilin, X-gal, dan IPTG. E. coli yang tumbuh dalam media seleksi tersebut disebut transforman
(mengandung vektor plasmid pGEM®-T
Easy). Koloni E. coli putih ialah E. coli yang mengandung plasmid rekombinan (plasmid pGEM®-T Easy yang membawa cDNA
MmMt2), sedangkan koloni biru ialah E. coli
yang mengandung plasmid nonrekombinan (hanya mengandung plasmid pGEM®-T
Easy) (Gambar 5). Gen lacZ menyandikan -galaktosidase ( -gal) yang mengubah substrat X-gal menjadi berwarna biru. Bila cDNA
MmMt2 berhasil menyisip pada gen lacZ, maka gen lacZ tidak dapat berekspresi sehingga muncul koloni E. coli yang berwarna putih. Bila tidak terdapat fragmen yang menyisip pada gen lacZ, maka gen lacZ
akan berekspresi membentuk koloni berwarna biru.
Pengurutan nukleotida terhadap cDNA
MmMt2 dilakukan melalui dua arah menggunakan primer T7 dan SP6 (Lampiran 1). Berdasarkan keseluruhan urutan nukleotida, hanya bagian yang diapit oleh kodon awal (ATG) yang merupakan bagian dari primer Mt2F dan kodon akhir (TGA) yang merupakan bagian dari primer Mt2R, yang akan digunakan untuk analisis lebih lanjut.
Analisis situs restriksi menunjukkan bahwa cDNA MmMt2 tidak mengandung situs yang terdapat pada MCS pGEM®-T
Easy sehingga semua situs yang terdapat pada MCS dapat digunakan untuk mengeluarkan sisipan cDNA MmMt2 dari vektor pGEM®-T
Easy. Analisis situs restriksi sangat penting untuk pemanfaatan cDNA ini dalam rekayasa genetika.
Kesejajaran lokal nukleotida dan asam amino dianalisis menggunakan program BLAST. BLAST dapat digunakan sebagai alat untuk menentukan identitas suatu fragmen DNA yang belum diketahui berdasarkan tingkat homologi dengan gen atau fragmen DNA yang telah diketahui di
GeneBank (Mount 2001). Hasil analisis kesejajaran lokal menunjukkan bahwa cDNA
MmMt2 memiliki kesamaan 100% dengan
1
2
4
bagian AtMt2A (Nomor aksesi: NM111773) dan dengan bagian AtMt-K (U15108), 99% dengan bagian AtMt1 (X62818), 99% dengan bagian AtMt1G (D11394) dari Arabidopsis thaliana, 90% dengan bagian BjMt2 (Y10850 dari Brassica juncea, dan 88% dengan bagian BoMt (AF200712) dari B. oleracea. Analisis kesejajaran lokal cDNA MmMt2
berdasarkan nukleotida dengan BLASTn disajikan dalam Lampiran 3. Hasil analisis kesejajaran lokal berdasarkan peptida menunjukkan bahwa protein yang dideduksi dari cDNA MmMt2 (MmMT2) memiliki kesamaan 100% dengan bagian AtMT2A (P25860) dari A. thaliana, 95% dengan bagian BrMT2 (P69164) dari B. rapa, dan 95% dengan bagian BjMT2 (P69163) dari B. juncea. Analisis kesejajaran lokal peptida MmMT2 dengan BLASTp disajikan pada Lampiran 4. MmMt2 juga memiliki kesamaan urutan nukleotida dengan MaMt2 dari M. affine (Suharsono et al. in press) dan GmMt2
dari kedelai kultivar Slamet (Anwar 2008). Oleh karena urutan nukleotidanya sama, maka urutan asam amino MmMT2, AtMT2A, MaMT2, dan GmMT2 juga sama. Hal ini menunjukkan bahwa MmMT2 memiliki peranan yang sama dengan AtMT2A yaitu mengikat dan mendetoksifikasi logam berat serta membatasi kerusakan oksidatif pada tanaman (Zhou & Goldsbrough 1995).
Hasil deduksi asam amino dari cDNA
MmMt2 (Tabel 2) menunjukkan bahwa motif urutan asam amino Cys pada MmMT2 terdiri atas Cys-Cys (residu 3-4), Cys-X-Cys (8-10, 14-16, 67-69, 73-75, 78-80) dan Cys-X-X-Cys (20-23). Ketiga motif tersebut merupakan tipikal komposisi Cys pada protein MT tipe 2 tanaman. Perbedaan MmMT2, BjMT2, dan BoMT2 terletak pada posisi motif Cys di dalam MT2. Pada BjMT2 dan BoMT2 posisinya ialah Cys-X-Cys (8-10, 14-16, 66-68, 72-74, 77-79).
Analisis domain terkonservasi berfungsi untuk mengetahui pola konservasi dan perbedaan protein dalam evolusi molekular (Marchler-Bauer et al. 2002). Analisis domain konservasi terhadap MmMT2, MaMT2, GmMT2, dan AtMT2A (kelompok MmMT2), BjMT2, dan BoMT2 menunjukkan bahwa domain yang terkonservasi adalah dari asam amino ke-25 sampai dengan asam amino ke-79 walaupun mempunyai urutan yang berbeda (Gambar 11). Urutan asam amino kelompok MmMT2, BjMT2, dan BoMT2 termasuk ke dalam metallothionein 2 superfamily. Namun ada perbedaan letak metallothionein 2
superfamily pada dua kelompok urutan asam amino tersebut. Pada kelompok MmMT2, metallothionein 2 superfamily dijumpai pada asam amino ke-25 sampai urutan ke-80. Sedangkan pada BjMT2 dan BoMt2, metallothionein 2 superfamily dijumpai pada asam amino ke-25 sampai urutan ke-79.
SIMPULAN
cDNA MmMt2 telah berhasil diisolasi dengan ukuran 246 pb dan menyandikan 81 asam amino. MmMt2 ini memiliki urutan nukleotida yang sama dengan AtMt2A dari A. thaliana, MaMt2 dari M. affine, dan GmMt2
dari kedelai kultivar Slamet. MmMT2 diduga memiliki peranan yang sama dengan AtMT2A yaitu mengikat dan mendetoksifikasi logam berat serta membatasi kerusakan oksidatif pada tanaman.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengetahui ekspresi MmMt2. cDNA
MmMt2 yang telah berhasil diisolasi dapat digunakan sebagai pelacak yang digunakan dalam hibridisasi northern.
UCAPAN TERIMA KASIH
Penelitian ini didanai oleh DIPA Biotrop tahun 2005 dengan judul ”Construction of Genomic Library and Isolation of Gene Involved in the Plant Tolerant to Low pH and High Solubility of Aluminium from Melastoma” dengan
contract agreement No: 13.1/PSRP/SP-PEN/IV/2005 atas nama Dr. Ir. Suharsono, DEA.
DAFTAR PUSTAKA
Anwar Y. 2008. Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi Metallothionein dari Kedelai Kultivar Slamet [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. Chang S, Puryear J, Cairney J. 1993. A
simple and efficient method for isolation RNA from pine trees. Plant Mol Biol Rep 11:113-116.
5
Cobbett C, Goldsbrough PB. 2002. Phytochelation and metallothionein: roles in heavy metal detoxification and homeostasis. Annu Rev Biol 53:159-182.
Delhaize E, Ryan PR. 1995. Aluminum toxicity and tolerance in plant. Plant Physiol 107:315-321.
Duncan KER et al. 2006. Peptide folding metal binding mechanism, and binding site structure in metallothioein. Soc Exp Biol Med 15:1488-1499.
Garcia-Hernandez M, Murphy A, Taiz L. 1998. Metallothionein 1 and 2 have distinct but overlapping expression patterns in Arabidopsis. Plant Physiol
118:387-397.
Guo WJ, Meetam M, Goldsbrough PB. 2008. Examining the specific contributions of individual Arabidopsis Metallothioneins to copper distribution and metal tolerance. Plant Physiol 146(2):1697-1706.
Kagi JHR. 1991. Overview of metallothionein. Methods Enzymol
205:613-626.
Katoh K, Kuma K, Toh H, Miyata T. 2005. Improvement in the accuracy multiple sequence alignment program MAFFT.
Gen Infor 16(1):22-33.
Marchler-Bauer A et al. 2002. CDD: a database of conserved domain aligments with links to domain three-dimensional structure. Nuc Acid Res
30(1):281-283.
Mulyani A, Hikmatullah, Subagyo H. 2003.
Karakteristik dan Potensi Tanah Masam Lahan Kering di Indonesia. Prosiding Simposium Nasional Pemberdayaan Tanah Masam Buku I. Bandar Lampung, 29-30 September 2003. Puslitbang Tanah dan Agroklimat Balitbangtan Deptan Bogor.
Ozkuthu F, Sekeroglu N and Kara SM . 2006. Monitoring of cadmium and micronutrients in spices commonly consumed in Turkey. Res J Agric & Biol Sci 2:223-226.
Promega. 1996. Protocol and Application Guide. Ed. Ke-3. USA: Promega Co. Richards KD, Schott EJ, Sharma EK, Davis
KR,Gardner RC. 1998. Aluminum induced oxidative stress genes in
Arabidopsis thaliana. Plant Physiol
116: 409-418.
Saunders GC, Parker HP. 1999. Analytical Molecular Biology: Quality and Validation. Teddington: LGC Press. Snowden KC, Richard KD, Gardner RC.
1995. Aluminium-induced genes induction by toxic metals, low cadmium, wounding and patterns of expression in root tips. Plant Physiol
107: 341-348.
Soepandi D. 2006. Perspeksi Fisiologi Dalam Pengembangan Tanaman Pangan di Lahan Marginal. [Orasi Ilmiah Guru Besar Tetap Fisiologi Tanaman]. Bogor: Fakultas Pertanian Institut Pertanian Bogor.
Suharsono. 2002. Konstruksi pustaka genom kedelai kultivar Slamet. Hayati (3):67-70.
Suharsono,Trisnaningrum N, Sulistyaningsih LD, Widyastuti U. 2008. Isolation and cloning of cDNA of gene encoding for metallothionein type 2 from
Melastoma affine. Biotropia, in press.
Taylor GJ. 1991. Current views of the aluminum stress response: the physiological basis of tolerance. Curr Trop in Plant Biochem and Physiol. 10:57-93.
Van Hoof NALM,Hassinen VH, Hakvoort H, Ballintijn KF, Schat H. 2001. Enhanced copper tolerance in Silene vulgaris (Moench) Garcke populations from copper mines is associated with increased transcript levels of a 2b-type metallothionein gene. Plant Physiol
126:1519–27.
Watanabe T, Osaki M, Yoshihara T, Tadano T. 1998. Distribution and chemical speciation of aluminium in the Al accumulator plant, Melastoma malabathricum L. Plant Physiol
201:165-173
Wong HL, Sakamoto T, Kawasaiki T, Umemura K, shimamoto K. 2004. Down-regulation of metallothionein, a reactive oxygen scavenger, by the small GTPase OsRac 1 in rice. Plant Physiol 135:1447-1456.
Zhou J, Goldsbrough PB. 1995. Structure, organization and expression of the metallothionein gene family in
Arabidopsis. Mol Gen Genet 248:318-328.
ISOLASI DAN KARAKTERISASI cDNA GEN PENYANDI
METALLOTHIONEIN TIPE 2 DARI
Melastoma malabathricum
L.
THESIAWATY DIAN FAUZIAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Isolasi dan Karakterisasi cDNA Gen Penyandi Metallothionein Tipe 2 dari
Melastoma malabatrhicum L.
Nama : Thesiawaty Dian Fauziah
NIM : G34102058
Menyetujui:
Pembimbing I, Pembimbing II,
Dr. Ir. Suharsono, DEA. Dr. Ir. Utut Widyastuti , M.Si.
NIP 131664393 NIP 131851279
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA.
NIP 131578806
PRAKATA
Alhamdulillah, segala puji dan syukur hanya bagi Allah pemilik dan penguasa semesta alam yang telah melimpahkan rahmat, petunjuk, dan nikmat-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini didanai oleh DIPA Biotrop tahun 2005 atas nama Dr. Ir. Suharsono, DEA.
Terima kasih kepada penulis ucapkan kepada Dr. Ir. Suharsono, DEA. dan Dr. Ir. Utut Widyastuti, M.Si. selaku pembimbing atas segala bimbingan, waktu, sarana dan prasarana yang diberikan. Terima kasih kepada Dr. Ir. Achmad Farajallah, M.Si. atas saran dan masukannya yang bermanfaat dalam penyempurnaan karya ilmiah ini. Ucapan terima kasih juga penulis sampaikan kepada Pak Abdul Mulya, Mbak Pepi Elvavina, Mbak Niken Trisnaningrum, S.Ag., Pak Muzuni, M.Si., Kak Yassier Anwar, M.Si., Pak Ulung Anggraito, M.Si., Mas Syarifin Firdaus, M.Si., dan Mbak Ulfah Mushofah S.Ag. atas bantuan teknis dan arahan yang diberikan selama penulis melakukan penelitian; Mbak Rina Kurnianingsih, M.Si., Mbak Laela Sari, M.Si., Ika A. Zahroh, S.Si., Nindya Rachma Santi, S.Si., Ika Madona, S.Si., Bu Sri Listyowati, M.Si., dan Kak Akhmad Amirullah, S.Si. selaku teman seperjuangan di laboratorium; Lulut, Teh Rina, Awi, serta teman-teman Biologi 39 yang telah memberikan dorongan moril. Secara khusus, penulis sampaikan terima kasih kepada orang tua, mertua, kakak, Mas Irfan, dan Nufail tersayang, atas kasih sayang, doa, dan dukungan moril.
Penulis berharap semoga karya ilmiah ini dapat memberi manfaat.
Bogor, Desember 2008
RIWAYAT HIDUP
Penulis dilahirkan di Bojonegoro, Jawa Timur, pada tanggal 17 Januari 1984 sebagai anak ke dua dari dua bersaudara, putri dari pasangan Saiful Bachri dan Sukarsih.
Penulis lulus pada tahun 2002 dari SMU Negeri 5 Surabaya dan diterima di Institut Pertanian Bogor (IPB) pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN).
DAFTAR ISI
Halaman
DAFTAR TABEL ………...
DAFTAR GAMBAR ………...
DAFTAR LAMPIRAN ………...
PENDAHULUAN
Latar Belakang ... Tujuan ...
BAHAN DAN METODE
Waktu dan Tempat Penelitian ... Bahan ... Metode ... Isolasi RNA total dari daun ... Kuantifikasi dan kualifikasi RNA total ... Sintesis cDNA ... Amplifikasi fragmen cDNA MmMt2 dengan primer spesifik ... Pengklonan cDNA MmMt2 ke dalam pGEM®-T Easy ... Seleksi koloni E. coli yang mengandung vektor rekombinan ... Analisis cDNA sisipan ... Pengurutan DNA dan analisisnya ...
HASIL DAN PEMBAHASAN
Hasil ... Isolasi RNA total dari daun ... Sintesis cDNA ... Amplifikasi fragmen cDNA MmMt2 dengan primer spesifik ... Pengklonan cDNA MmMt2 ke dalam pGEM®-T Easy ... Analisis cDNA MmMt2 ... Pembahasan ...
SIMPULAN ...
SARAN ...
DAFTAR PUSTAKA ...
LAMPIRAN ... vii
vii
vii
1 1
1 2 2 2 2 2 3 3 3 3 3
4 4 4 4 4 5 8
9
9
9
DAFTAR TABEL
Halaman
1 2
Hasil isolasi RNA total ... Perbandingan ORF dan motif asam amino Cys pada kelompok MmMT2 (MmMT2 dari M. malabatrichum, AtMT2A dari A. thaliana, MaMT2 dari M. affine, dan GmMT2 dari kedelai kultivar Slamet), BjMT2 dari B. juncea, dan BoMT2 dari B. oleracea ...
4
7
DAFTAR GAMBAR
Halaman
1
2
3
4
5
6
7
8
9
10
11
Peta fisik plasmid pGEM®-T Easy ...
Elektroforesis RNA total dari daun muda MD1 (1), MD2 (2), dan MD3 (3) ...
Hasil PCR aktin menggunakan cDNA total MD1 (1), MD2 (2), dan MD3 (3) sebagai cetakan ...
Fragmen MmMt2 hasil PCR menggunakan cDNA MD2 sebagai cetakan ...
Koloni E. coli DH5 yang ditransformasi dengan hasil ligasi pGEM®-T Easy dan cDNA
MmMt2 yang tumbuh di media seleksi yang mengandung ampisilin, X-gal dan IPTG ...
Hasil analisis sisipan cDNA MmMt2 dengan PCR koloni (A) dan pemotongan DNA plasmid rekombinan dengan EcoR1 (B) ...
Urutan nukleotida cDNA MmMt2 dari kodon awal (ATG) sampai dengan kodon akhir serta deduksi asam aminonya ...
Peta restriksi yang terdapat pada cDNA MmMt2 ...
Pohon filogenetik berdasarkan urutan nukleotida dari Mt2 berbagai spesies ...
Pohon filogenetik berdasarkan urutan asam amino dari MT2 berbagai spesies ...
Perbandingan daerah domain asam amino terkonservasi antara MmMT2, MaMT2, GmMT2, dan AtMT2A (1); serta BjMT2 dan BoMT2 (2) ...
2
4
4
4
4
5
5
5
6
7
8
DAFTAR LAMPIRAN
Halaman
1
2
3
4
Hasil sekuensing dengan mesin sekuensing otomatis ABI PRISM 310 Genetic Analyzer ...
Hasil pengurutan sisipan pada pGEM®-T Easy menggunakan primer T7 ...
Hasil analisis kesejajaran urutan nukleotida cDNA MmMt2 dengan data gen di GeneBank
menggunakan program BLASTn ...
Hasil analisis kesejajaran urutan asam amino deduksi dari cDNA MmMt2 dengan data protein di GeneBank menggunakan program BLASTp ...
12
14
15
ABSTRAK
THESIAWATY DIAN FAUZIAH. Isolasi dan Karakterisasi cDNA Gen Penyandi Metallothionein Tipe 2 dari Melastoma malabatrichum L.. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
Melastoma malabatrichum merupakan tanaman akumulator aluminium (Al) yang mampu tumbuh baik pada tanah asam dengan kelarutan Al tinggi. M. malabatrichum (Mm) diduga memiliki mekanisme detoksifikasi Al dalam pertahanannya terhadap cekaman Al. Salah satu gen yang berperan dalam detoksifikasi logam berat ialah metallothionein (Mt). Penelitian ini bertujuan untuk mengisolasi dan mengkarakterisasi cDNA gen penyandi metallothionein tipe 2 dari M. malabatrichum. RNA total telah diisolasi dari daun M. malabatrichum. cDNA telah disintesis menggunakan RNA total sebagai cetakan dengan transkripsi balik. Melalui teknik PCR, cDNA
MmMt2 berhasil diisolasi dengan menggunakan primer spesifik untuk gen Mt2 yang didesain dari
Arabidopsis thaliana (AtMt2) (Nomor aksesi: AY037263). cDNA MmMt2 telah berhasil disisipkan ke dalam pGEM®-T Easy dan plasmid rekombinan telah berhasil diintroduksikan ke dalan Eschericia coli galur DH5 . Pengurutan sekuen cDNA MmMt2 menghasilkan 246 pb yang menyandikan 81 asam amino. Analisis situs enzim restriksi menunjukkan cDNA MmMt2 tidak mengandung situs enzim restriksi EcoR1. Analisis kesejajaran lokal nukleotida dan asam amino menggunakan program BLAST menunjukkan bahwa cDNA MmMt2 sama dengan cDNA AtMt2A dari A. thaliana (Nomor aksesi: NM_111773).
ABSTRACT
THESIAWATY DIAN FAUZIAH. Isolation and Characterization of cDNA Gene Encoding Metallothionein Tipe 2 from Melastoma malabatrichum L.. Under direction of SUHARSONO and UTUT WIDYASTUTI.
Melastoma malabatrichum is an aluminum (Al) accumulator plant that grows well in acid soil with high level of soluble Al. Therefore, it was supposed that M. malabatrichum (Mm) has specific mechanism of Al detoxification in Al stress condition. One of the genes that play an important role in detoxification of heavy metal was metallothionein (Mt). The objective of this research was to isolate and characterize cDNA encoding metallothionein type 2 from M. malabatrichum. Total RNA was isolated from M. malabatricum’s leaves. Total cDNA was synthesized using the total RNA as template by reverse transcription. By PCR technique, the cDNA of MmMt2 was successfully isolated using Mt2 spesific primer designed from Arabidopsis thaliana (Acc.: AY037263). The MmMt2
cDNA was successfully inserted into pGEM®-T Easy plasmid, then the recombinant plasmid was introduced into Eschericia coli DH5 . Sequencing of MmMt2 cDNA showed that MmMt2 cDNA has 246 bp encoding 81 amino acids. Enzyme restriction sites analysis showed that MmMt2 cDNA did not contain EcoR1 restriction site. Nucleotide and amino acid alignment analysis using BLAST program showed that MmMt2 cDNA was similar with complete cDNA of AtMt2A from A. thaliana
ABSTRAK
THESIAWATY DIAN FAUZIAH. Isolasi dan Karakterisasi cDNA Gen Penyandi Metallothionein Tipe 2 dari Melastoma malabatrichum L.. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
Melastoma malabatrichum merupakan tanaman akumulator aluminium (Al) yang mampu tumbuh baik pada tanah asam dengan kelarutan Al tinggi. M. malabatrichum (Mm) diduga memiliki mekanisme detoksifikasi Al dalam pertahanannya terhadap cekaman Al. Salah satu gen yang berperan dalam detoksifikasi logam berat ialah metallothionein (Mt). Penelitian ini bertujuan untuk mengisolasi dan mengkarakterisasi cDNA gen penyandi metallothionein tipe 2 dari M. malabatrichum. RNA total telah diisolasi dari daun M. malabatrichum. cDNA telah disintesis menggunakan RNA total sebagai cetakan dengan transkripsi balik. Melalui teknik PCR, cDNA
MmMt2 berhasil diisolasi dengan menggunakan primer spesifik untuk gen Mt2 yang didesain dari
Arabidopsis thaliana (AtMt2) (Nomor aksesi: AY037263). cDNA MmMt2 telah berhasil disisipkan ke dalam pGEM®-T Easy dan plasmid rekombinan telah berhasil diintroduksikan ke dalan Eschericia coli galur DH5 . Pengurutan sekuen cDNA MmMt2 menghasilkan 246 pb yang menyandikan 81 asam amino. Analisis situs enzim restriksi menunjukkan cDNA MmMt2 tidak mengandung situs enzim restriksi EcoR1. Analisis kesejajaran lokal nukleotida dan asam amino menggunakan program BLAST menunjukkan bahwa cDNA MmMt2 sama dengan cDNA AtMt2A dari A. thaliana (Nomor aksesi: NM_111773).
ABSTRACT
THESIAWATY DIAN FAUZIAH. Isolation and Characterization of cDNA Gene Encoding Metallothionein Tipe 2 from Melastoma malabatrichum L.. Under direction of SUHARSONO and UTUT WIDYASTUTI.
Melastoma malabatrichum is an aluminum (Al) accumulator plant that grows well in acid soil with high level of soluble Al. Therefore, it was supposed that M. malabatrichum (Mm) has specific mechanism of Al detoxification in Al stress condition. One of the genes that play an important role in detoxification of heavy metal was metallothionein (Mt). The objective of this research was to isolate and characterize cDNA encoding metallothionein type 2 from M. malabatrichum. Total RNA was isolated from M. malabatricum’s leaves. Total cDNA was synthesized using the total RNA as template by reverse transcription. By PCR technique, the cDNA of MmMt2 was successfully isolated using Mt2 spesific primer designed from Arabidopsis thaliana (Acc.: AY037263). The MmMt2
cDNA was successfully inserted into pGEM®-T Easy plasmid, then the recombinant plasmid was introduced into Eschericia coli DH5 . Sequencing of MmMt2 cDNA showed that MmMt2 cDNA has 246 bp encoding 81 amino acids. Enzyme restriction sites analysis showed that MmMt2 cDNA did not contain EcoR1 restriction site. Nucleotide and amino acid alignment analysis using BLAST program showed that MmMt2 cDNA was similar with complete cDNA of AtMt2A from A. thaliana
PENDAHULUAN
Latar Belakang
Tanaman memiliki beberapa mekanisme toleransi terhadap Al antara lain melalui immobilisasi Al di dinding sel, induksi pH di daerah rizosfer, permeabilitas selektif membran sel, kompartementasi Al di vakuola, eksudasi ligan dan asam organik pengkelat, dan induksi sintesis protein pengkelat Al (Taylor 1991). Richards et al. (1998) berhasil mengisolasi gen-gen dari
Arabidopsis thaliana yang ekspresinya terinduksi oleh cekaman Al, yaitu gen-gen penyandi glutathione s transferase (GST),
peroksidase, superoksida dismutase (SOD), dan metallothionein.
Metallothionein (MT) merupakan protein dengan berat molekul rendah (4-8 kDa), kaya akan sistein (25-33%), tidak memiliki asam amino aromatik, bersifat mengikat logam berat, serta diketahui berperan dalam homeostasis dan detoksifikasi ion-ion logam (Wong et al. 2004). Pada tanaman, pengaruh ion logam pada ekspresi gen Mt bervariasi tergantung jenis tanaman dan tipe protein MT (Garcia-Hernandez et al.
1998). Berdasarkan klasifikasi Cobbet dan Goldsbrough (2002), MT dibagi menjadi empat tipe berdasarkan komposisi urutan asam amino sistein (Cys). MT tipe 1 terdiri atas dua domain dengan motif pengikatan logam Cys-X-Cys (-X- merupakan asam amino selain Cys). Pada Arabidopsis, MT1 berperan dalam homeostasis Cu pada akar (Guo et al. 2008). MT tipe 2 memiliki komposisi Cys-Cys pada asam amino ketiga dan keempat dari sekuen asam aminonya, serta memiliki motif Cys-Gly-Gly-Cys pada ujung N-terminal dan motif Cys-X-Cys pada ujung C-teminal. MT2 merupakan MT pertama pada tanaman yang diisolasi (Kagi 1991). Pada tanaman Arabidopsis, MT2 ditemukan terutama pada daun tua dan terlibat dalam mekaninsme sinyal ROS (Reactive Oxygen Species) (Wong et al. 2004). Perlakuan menggunakan tembaga (Cu) meningkatkan transkripsi MT2 ini (van Hoof
et al. 2001). Begitu pula pada Piper nigrum
(black pepper), transkripsi MT2 dideteksi terutama pada daun tuanya. Ekspresi Mt2
yang tinggi pada daun terutama pada trikoma yang berhubungan dengan fungsi sekretori adalah untuk mengeksudasi kelebihan akumulasi logam berat di daun (Garcia-Hernandez et al. 1998). Transkripsi MT2 P. nigrum ini meningkat dengan perlakuan menggunakan Cd, Fe, Cu, Mn, dan Zn
(Ozkuthu et al. 2006). MT tipe 3 yang sering disebut sebagai fitokelatin (PC) memiliki empat asam amino Cys pada N-terminal. Tiga Cys pertama membentuk motif Cys-Gly-Asn-Cys-Asp-Cys. Sedangkan Cys keempat membentuk motif Gln-Cys-X-Lys-Lys-Gly. Pada C-terminal terdapat enam asam amino Cys yang membentuk tiga motif Cys-X-Cys. MT3 berperan dalam transpor Cd dari akar ke pucuk dalam mekanisme pengurangan kelebihan akumulasi Cd di akar (Guo et al. 2008). Sedangkan MT tipe 4 memiliki tiga wilayah yang masing-masing memiliki 5 sampai 6 Cys dan biasanya membentuk motif Cys-X-Cys. MT4 berperan dalam toleransi dan akumulasi yang tinggi terhadap Zn (Guo
et al. 2008).
Melastoma malabathricum L. merupakan tumbuhan yang tersebar di hutan hujan tropis di Asia Tenggara. Tumbuhan ini dapat menyerap dan mengakumulasi Al pada jaringan mesofil dan epidermis atas daun, serta pada seluruh jaringan akar terutama pada sel-sel epidermis dan endodermisnya (Watanabe et al. 1998). Menurut Chenery (1948) dalam Watanabe et al. (1998), tumbuhan yang dapat mengembangkan mekanisme pertahanan dan mengakumulasi lebih dari 1000 mg/kg Al didefinisikan sebagai akumulator Al. Watanabe et al. (1998) juga berhasil mengukur akumulasi Al dalam pucuk daun, daun muda, daun tua, dan ujung akar M. malabathricum, yaitu masing-masing sebesar 8.0, 9.2, 14.4, dan 10.1 mg/g berat basah daun.
Pada M. malabatrichum, MT diduga berperan dalam detoksifikasi ion logam-logam berat, termasuk Al. Berdasarkan peranan MT tersebut, maka isolasi dan karakterisasi dari cDNA gen penyandi Mt2
dari tanaman M. malabatrichum penting dilakukan untuk memahami peran MT2 khususnya dalam ketahanan terhadap cekaman Al. Suharsono et al. (in press) telah berhasil mengisolasi metallothionein tipe 2 dari Melastoma affine. MT2 M. malabatrichum diduga memiliki fungsi yang sama dengan MT2 M. affine karena kedua tumbuhan ini toleran terhadap cekaman Al.
Tujuan
2
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Kegiatan penelitian dilaksanakan mulai bulan Desember 2007 sampai dengan Oktober 2008 di Laboratorium
Biotechnology Research Indonesia – The Netherlands (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Kampus IPB Darmaga, Bogor.
Bahan
Daun M. malabathrichum digunakan sebagai bahan tumbuhan. Plasmid pGEM®-T
[image:31.612.143.300.281.387.2]Easy (Gambar 1) digunakan sebagai vektor pengklonan dan Escherichia coli galur DH5 digunakan sebagai inang vektor rekombinan.
Gambar 1 Peta fisik plasmid pGEM®-T Easy.
Primer aktin ActF (ATGGCAGATGCC GAGGATAT) dan ActR (CAGTTGTGCGA CCACTTGCA) digunakan untuk verifikasi cDNA, primer spesifik Mt2F (TCGAGAAA AATGTCTTGCTGTG) dan Mt2R (CTTCAC TTGCAGGTGCAAGG) yang didesain berdasarkan cDNA Arabidopsis thaliana
(Nomor aksesi: AY037263) digunakan untuk mengisolasi cDNA Mt2 dari M. malabatrichum.
Metode
Isolasi RNA total dari daun
Semua alat dan media yang digunakan untuk isolasi RNA total disterilkan (diautoklaf pada 121 °C 20 menit), ddH2O yang digunakan diperlakukan dengan 0.1% (v/v) DEPC (Diethylpirocarbonate) dan disterilkan.
RNA total diisolasi dari daun muda M. malabathricum dengan menggunakan prosedur LiCl (Chang et al. 1993) yang dimodifikasi. Sebanyak 0.5 gram daun yang telah dipisahkan dari tulang daunnya digerus sampai halus bersama 0.3 gram pasir kuarsa, lau ditambahkan 3 ml buffer ekstraksi [2% CTAB (hexadecyl trimethyl amonium
bromide), 2% PVP (Polyvinyl pirolidon), 100 mM Tris-HCl pH 8, 25 mM EDTA, 2 M NaCl, dan 100mM -merkaptoetanol] yang bersuhu 65 °C dan digerus hingga halus, lalu dimasukkan ke dalam tabung 1.5 ml dan diinkubasi pada 65 °C 10 menit sambil dibolak-balik, ditambahkan 1x volume CI (kloroform:isoamilalkohol 24:1), lalu divorteks sebentar dan disentrifugasi 10000 rotasi per menit (rpm) pada 4 °C 10 menit (Jouan BR4i). Supernatan ditambah 1/4 kali volume LiCl 10 M dan diinkubasi pada suhu –20 °C selama 2 jam, lalu disentrifugasi 10000 rpm pada 4 °C 20 menit. Endapan yang terbentuk ditambah 400 l TE (10 mM Tris-HCl pH 7.5, 1 mM EDTA pH 8) dan diekstraksi dengan 1x volume fenol pH 9, divorteks sebentar lalu disentrifugasi 10000 rpm pada 20 °C 10 menit. Supernatan ditambah 1/4 kali volume LiCl 10 M dan diinkubasi pada –20 °C selama 2 jam. Larutan kemudian disentrifugasi 10000 rpm pada 4°C 10 menit. Endapan selanjutnya dicuci dengan etanol 70% (v/v), disentrifugasi, dikeringudarakan, lalu diresuspensi dengan 20 l air DEPC.
Kuantifikasi dan kualifikasi RNA total
Kuantitas RNA total hasil isolasi ditentukan dengan spektrofotometer UV-VIS (Cecil CE 2020) pada panjang gelombang 260 dan 280 nm. Konsentrasi RNA ditentukan dengan penyetaraan bahwa satu satuan absorban pada panjang gelombang 260 nm sebanding dengan 40 g/ml RNA. Kemurnian RNA total diukur melalui perbandingan absorban panjang gelombang 260 nm dengan 280 nm, yaitu antara 1.8 sampai 2 (Sauders & Parker 1999).
Kualitas RNA ditentukan dengan elektroforesis pada gel agarosa 1% (b/v) (Sigma, Germany) dengan larutan penyangga MOPS [4.2/l gram MOPS (3-Morpholino propanesulfonic acid), 0.41 g/l Na-asetat, 0.37 g/l EDTA(2NA)H2O]. Sebanyak 1 l RNA dicampur dengan 12 l larutan premiks [5% 20 kali MOPS, 50% (v/v) formamida, 17.5% (v/v) formaldehid, 27.5% (v/v) air DEPC] dipanaskan pada 65 °C 10 menit, didinginkan di es selama 5 menit, dan diberi 1/6 kali volume loading dye [0.25% (b/v)
bromphenol blue, 0.25% (b/v) xylene cyanol
3
Sintesis cDNA
Sintesis cDNA dilakukan melalui reaksi transkripsi balik menggunakan Superscript III Reverse Transcriptase (Invitrogen). Komposisi reaksi sintesis cDNA ialah 5 g RNA total, 1x RT buffer, 20 pmol primer oligo-dT, 4 mM dNTP, 10 mM DTT, 40 U enzim Superscript TMIII RTase, dan air DEPC dengan volume reaksi 20 l. Kualitas cDNA diperiksa menggunakan PCR dengan primer spesifik aktin. Komposisi reaksi PCR-aktin tersebut ialah 0.5 l cDNA, 1 l buffer Taq (Gen Scr Inc.), 0.2 mM dNTP, 10 pmol primer ActF, 10 pmol primer ActR, 4 % (b/v) DMSO (dimetilsulfoksida), 0.5 U enzim Taq DNA polimerase (Gen Scr Inc.), dan ddH2O hingga volume akhir 10 l. PCR dilakukan dengan kondisi pra-PCR pada 95 °C 5 menit, denaturasi pada 94 °C 30 detik, penempelan primer pada 55 °C 30 detik, dan pemanjangan pada 72 °C 1.5 menit sebanyak 35 siklus, pasca-PCR pada 72 °C 5 menit, dan inkubasi pada 15 °C 10 menit.
Amplifikasi fragmen cDNA MmMt2 dengan primer spesifik
cDNA Mt2 dari M. malabatrichum
(MmMt2) diisolasi dan diamplifikasi menggunakan PCR dengan primer spesifik
Mt2. Sebanyak 1 l hasil reaksi RT ditambah dengan 2 l 10x Taq buffer, 0.2 mM dNTP, 4 % (b/v) DMSO, 20 pmol primer Mt2F, 20 pmol primer Mt2R, 0.5 U enzim taq DNA polimerase (Gen Scr Inc.), dan dH2O hingga volume akhir 20 l. Reaksi PCR dilakukan dengan kondisi pra-PCR pada 95 °C 5 menit, denaturasi pada 94 °C 30 detik, penempelan primer pada 58 °C 30 detik, pemanjangan pada 72 °C 1.5 menit sebanyak 35 siklus, pasca-PCR pada 72 °C 5 menit, dan inkubasi pada 15°C 10 menit.
Pengklonan cDNA MmMt2 ke dalam pGEM®-T Easy
Sebelum di klon ke dalam inang, cDNA
MmMt2 diligasikan ke dalam vektor menggunakan prosedur Promega (1996). Komposisi reaksi ligasi ialah 2 µl 5x buffer
rapid ligase, 1 µl pGEM®-T Easy (10 ng), 1 µl ml T4 DNA ligase (3 U/µl) (Promega), dan 3 µl produk PCR, kemudian diinkubasi pada 4 °C selama semalam. Hasil ligasi diintroduksikan ke dalam E.coli galur DH5 menggunakan metode yang dipublikasikan Suharsono (2002).
Seleksi koloni E. coli yang mengandung vektor rekombinan
Seleksi yang digunakan ialah seleksi resistensi terhadap ampisilin dan seleksi biru-putih. Sebanyak 50 l bakteri hasil transformasi dicawansebarkan pada media 15 ml LB padat [1% bakto tripton, 0.5 % ekstrak khamir, 1% NaCl, 2.5 % agar (b/v)] yang mengandung 100 mg/l ampisilin, 10 l 100 mM isopropiltio- -galaktosida (IPTG),