DALAM MENGHAMBAT OKSIDASI LEMAK
JAMBAL PATIN
IRIANTI AMIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa penelitian Aplikasi Ekstrak Daun Sirih dalam Menghambat Oksidasi Lemak Jambal Patin adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkab maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2008
IRIANTI AMIN. Application of Betel Leaf Extract to Inhibit The Lipid Oxidation in Jambal Patin. Supervised by DEDI FARDIAZ, SLAMET BUDIJANTO and FARIDA ARYANI.
Jambal Patin is a fisheries product made from striped catfish (Pangasius hypophthalmus) through salting and drying process. Jambal patin contain high fat especially the unsaturated fatty acid so that easy to oxidated that generate rancidity. In others hand, salting and drying process could enhance the lipid oxidation in this product. In this research, betel leaf extract was applied to inhibit the lipid oxidation in jambal patin. Two treatments were applied. First, the combination of 22,5% betel leaf extract and salt solution with ratio of 1:2, 1:3, 1:4, 1:5 and the salt solution without betel leaf extract as control. Second, the storage time for two months. The lipid oxidation inhibition were monitored by determining the TBARS value, anisidine value and fluorescent products every two weeks for two months. Sensory analysis was conducted to determine the sensory changes of jambal patin caused by betel leaf treatments. Two Factorial Completely Randomize Design and Duncan Test were used as statistical analysis. The result showed that betel leaf extract has antioxidant activity better than BHT (IC50 of betel leaf extract was 134 g/ml, lower than BHT that was 197 g/ml). The betel leaf extract with ratio of 1:2, 1:3, 1:4, 1:5 could inhibit the lipid oxidation of jambal patin for 2 months with parameter of TBARS value, anisidine value and fluorescent products. Striped catfish contain 56.83% of unsaturated fatty acid and 43.17% of saturated fatty acid. The highest unsaturated fatty acid is linoleic acid 108.04 mg/g fish oil ( jambal patin with betel leaf extract treatment 1:2), 90.09 mg/g fish oil in control and 113 mg/g fish oil in fresh striped catfish meat.
The control treatment was more rancid than the treatment with betel leaf extract. The colour and taste of betel leaf could influence the colour and taste of jambal patin. However, jambal patin with betel leaf extract 1:5 could inhibit the lipid oxidation and has sensory value better than other betel leaf extract treatments
IRIANTI AMIN. Aplikasi Ekstrak Daun Sirih dalam Menghambat Oksidasi Lemak Jambal Patin. Dibimbing oleh DEDI FARDIAZ, SLAMET BUDIJANTO DAN FARIDA ARYANI.
Jambal patin merupakan produk olahan ikan patin melalui proses penggaraman dan pengeringan. Jambal patin mengandung lemak yang tinggi terutama asam lemak tidak jenuh sehingga mudah mengalami oksidasi lemak yang menimbulkan ketengikan. Selain itu proses pengeringan dan penambahan garam dapat mengkatalis proses oksidasi.
Pada penelitian ini, ekstrak daun sirih diaplikasikan untuk menghambat oksidasi lemak pada jambal patin. Perlakuan yang diukur adalah ekstrak daun sirih dengan 4 perbandingan yaitu ekstrak daun sirih 22.5% : larutan garam 1:2, 1:3, 1:4 dan 1:5 dan kontrol serta perlakuan lama penyimpanan selama 2 bulan Parameter yang diukur adalah angka TBARS, angka anisidin dan produk berfluorosen dan profil asam lemak. Uji sensori yang digunakan adalah atribut warna dan bau untuk jambal patin mentah serta atribut rasa dan bau untuk jambal patin matang. Pengukuran dilakukan tiap 2 minggu sekali. Rancangan percobaan yang digunakan adalah rancangan acak lengkap dua faktor dan uji lanjut yang digunakan adalah uji Duncan.
Ekstrak daun sirih mempunyai aktivitas antioksidan yang lebih baik dibandingkan aktivitas antioksidan sintetis BHT (nilai IC50 ekstrak daun sirih adalah 134 g/ml lebih rendah dibandingkan nilai IC50 BHT yaitu 197 g/ml). Ekstrak daun sirih dengan perbandingan 1:2, 1:3, 1:4 dan 1:5 mampu menghambat oksidasi lemak jambal patin selama penyimpanan 2 bulan dengan parameter angka TBARS, angka anisidin dan produk berfluoresen.
Ikan patin mengandung 56.83% asam lemak tidak jenuh dan 43.17% asam lemak jenuh. Asam lemak tidak jenuh tertinggi adalah asam linoleat 108.04 mg/g minyak ikan pada jambal patin dengan perlakuan ekstrak daun sirih 1:2, 90.09 mg/g minyak ikan pada jambal patin kontrol dan 113 mg/g minyak ikan pada ikan patin segar. Proses penggaraman dan pengeringan pada ikan patin menyebabkan penurunan persentase jumlah asam lemak tidak jenuh dengan ikatan rangkap lebih dari 2 (PUFA) sebesar 11% dari ikan patin segar menjadi jambal patin dengan perlakuan ekstrak sirih 1:2 dan 20% dari ikan patin segar menjadi jambal patin kontrol.
APLIKASI EKSTRAK DAUN SIRIH
DALAM MENGHAMBAT OKSIDASI LEMAK
JAMBAL PATIN
IRIANTI AMIN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Oksidasi Lemak Jambal Patin. Nama Mahasiswa : Irianti Amin
Nomor Pokok : F251050011
Program Studi : Ilmu Pangan (IPN)
Disetujui
Komisi Pembimbing
Prof. Dr. Dedi Fardiaz, M.Sc. Ketua
Dr. Slamet Budijanto, M.Agr. Ir. Farida Aryani, M.App.Sc.
Anggota Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Penguji Luar Komisi pada Ujian Tesis : Dr. Ir. Endang Prangdimurti, M.Si
Tanggal Lulus : Tanggal Ujian : 14 Februari
Oksidasi Lemak Jambal Patin. Nama Mahasiswa : Irianti Amin
Nomor Pokok : F251050011 Program Studi : Ilmu Pangan (IPN)
Disetujui
Komisi Pembimbing
Prof. Dr. Dedi Fardiaz, M.Sc. Ketua
Dr. Slamet Budijanto, M.Agr. Ir. Farida Aryani, M.App.Sc.
Anggota Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti Hariyadi, M.Sc. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Puji dan syukur kehadirat Allah SWT., atas rahmat dan hidayah-Nya sehingga penelitian “Aplikasi Ekstrak Daun Sirih dalam Menghambat Oksidasi Lemak Jambal Patin” dapat diselesaikan. Penelitian ini merupakan satu syarat untuk mendapatkan gelar Magister Sains pada Program Studi Ilmu Pangan Sekolah Pascasarjana Institut Pertanian Bogor. Penelitian ini dibiayai oleh Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan, Badan Riset Kelautan dan Perikanan, Departemen Kelautan dan Perikanan. Penelitian ini terselenggara atas bantuan berbagai pihak sehingga ucapan terima kasih disampaikan kepada:
1. Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan, Badan Riset Kelautan dan Perikanan, Departemen Kelautan dan Perikanan yang telah mendanai penelitian ini
2. Prof. Dr. Dedi Fardiaz, M.Sc selaku Ketua Komisi Pembimbing yang dengan kesempatan, kearifan, kebijakan dan kebaikan beliau mengantarkan penelitian penulis hingga selesai.
3. Dr. Slamet Budijanto, M.Agr selaku Anggota Komisi Pembimbing yang dengan kesempatan, kebaikan dan perhatian beliau dalam mengevaluasi penelitian penulis hingga selesai.
4. Ir. Farida Aryani, M.App.Sc selaku Anggota Komisi Pembimbing, atas kebaikan dan kesediaan beliau mengikutsertakan penulis pada proyek di Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan serta bantuan, arahan dan bimbingan beliau sehingga penelitian penulis selesai. 5. Kepala Balai Pengawas Obat dan Makanan Kendari yang telah memberikan
kesempatan kepada penulis untuk menempuh program S2 pascasarjana IPB atas biaya Badan Pengawas Obat dan Makanan RI Jakarta.
Kelautan dan Perikanan, atas bantuan dan perhatian yang diberikan kepada penulis selama penelitian dilaksanakan.
8. Teman-teman di Pusat Pengujian Obat dan Makanan Nasional terutama ibu Hermini, ibu Tini, mbak Nisa, pak Slamet, pak Junaidi dan mbak Tanti atas bantuan dan perhatian kepada penulis selama melakukan penelitian di laboratorium pangan Pusat Pengujian Obat dan Makanan Nasional.
9. Teman-teman penulis di program studi Ilmu Pangan terutama mbak Rini, mbak Indah, dik Ahyar, mbak Nurha, dik Hana serta teman-teman IPN angkatan 2005 atas bantuan, dorongan semangat dan doa yang diberikan kepada penulis sehingga penelitian ini selesai.
10.Teman-teman di Balai Pengawas Obat dan Makanan Kendari atas bantuan dan doa yang diberikan kepada penulis.
11.Suami tercinta Rusman Prasetya, kedua anak-anak kami Izzat dan Anya serta kedua orang tua kami mama wajo dan mama haji atas kasih sayang, perhatian, kesabaran dan ketabahan dalam mendampingi penulis selama ini.
12.Saudara-saudaraku tercinta Zamri Amin sek, Aminudin sek, Halimu sek, Nunu, Lan, Nia, Ros, Andri dan Tasman atas bantuan doa dan bantuan dana serta perhatian yang diberikan kepada penulis selama ini.
13.Keluarga besar penulis yang tidak bisa disebutkan satu-persatu atas bantuan dan doa yang diberikan kepada penulis.
Kesempurnaan merupakan hal yang amat didambakan, namun tidaklah mungkin dapat tercapai karena kesempurnaan hanyalah milik Allah SWT, karena itu adanya saran dari pembaca terhadap hasil penelitian ini akan diterima dengan senang hati.
Semoga penelitian ini memberikan manfaat bagi pembaca dan semoga Allah SWT., meridhoi setiap usaha yang dilakukan. Amin.
Bogor, Januari 2008
Penulis dilahirkan di Kota Bau-Bau, Sulawesi Tenggara pada tanggal 5 April 1973 sebagai anak ketiga dari delapan bersaudara dari pasangan Bapak M. Amin (alm.) dan ibu Hj. Halima.
Tahun 1991 penulis diterima di Jurusan Kimia, Institut Pertanian Bogor melalui jalur USMI dan penulis menyelesaikan pendidikan sarjana pada November 1995. Tahun 2005 penulis mendapat kesempatan melanjutkan ke program magister pada Program Studi Ilmu Pangan, Institut Pertanian Bogor melalui program beasiswa dari Badan Pengawas Obat dan Makanan RI.
Penulis menjadi dosen luar biasa pada Jurusan Kimia, Universitas Haluoleo mulai januari 1996-1997. Penulis diterima sebagai pegawai negeri sipil di Balai Pengawas Obat dan Makanan di Kendari tahun 1997 sampai sekarang.
DAFTAR TABEL ... xi
3.2.2 Pengujian Aktivitas Antioksidan Ekstrak Daun Sirih ... 18
3.3.3 Aplikasi Ekstrak Daun Sirih Pada Jambal Patin ... 19
a. Pembuatan Larutan Garam Jenuh ... 19
b. Aplikasi Ekstrak Daun Sirih ... 19
3.4 Pengujian Mutu Jambal Patin ... 20
3.4.1 Pengujian Kadar Proksimat Jambal Patin... 20
a. Pengujian Kadar Air ... 20
c. Pengujian Produk Berfluoresen ... 26
4.6 Produk Berfluoresen ... 37
4.7 Profil Asam Lemak... 39
4.8 Evaluasi sensori ... 41
4.8.1 Jambal Patin Mentah ... 41
4.8.2 Jambal Patin Matang ... 44
4.9 Oksidasi Lemak dan Perubahan Sensori Jambal Patin ... 47
V. KESIMPULAN DAN SARAN ... 54
5.1 Kesimpulan ... 54
5.2 Saran ... 55
DAFTAR PUSTAKA ... 56
DAFTAR TABEL
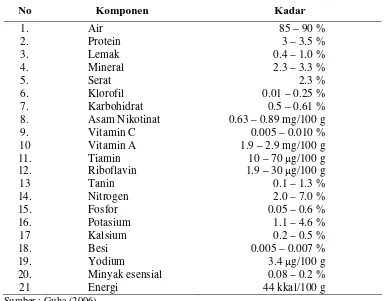
Tabel 1. Kandungan nutrisi dalam daun sirih segar ... 6
Tabel 2. Proksimat jambal patin ... 31
Tabel 3. Aktivitas ekstrak daun sirih dan BHT ... 31
DAFTAR GAMBAR
Gambar 1. Sirih (Piper Betle Linn) ... 5
Gambar 2. Auto-oksidasi asam lemak tidak jenuh ... 10
Gambar 3. Kemungkinan jalur oksidasi lipid pada ikan ... 11
Gambar 4. Grafik angka TBARS jambal patin dengan lama penyimpanan 2 bulan ... 34
Gambar 5. Grafik angka anisidin jambal patin dengan lama penyimpanan 2 bulan ... 36
Gambar 6. Grafik produk berfluoresen jambal patin dengan lama
penyimpanan 2 bulan ... 38
Gambar 7. Grafik uji pembedaan atribut warna jambal patin mentah
penyimpanan 2 bulan ... 42
Gambar 8. Grafik uji pembedaan atribut bau jambal patin mentah
penyimpanan 2 bulan ... 43
Gambar 9. Grafik uji pembedaan atribut rasa jambal patin matang
penyimpanan 2 bulan ... 44
Gambar 10. Grafik uji pembedaan atribut bau jambal patin matang
penyimpanan 2 bulan ... 46
Gambar 11. Grafik persentase jumlah panelis terhadap penilaian sensori
jambal patin matang ... 51
Gambar 12. Grafik persentase jumlah panelis terhadap penilaian sensori
DAFTAR LAMPIRAN
Lampiran 1. Skema pembuatan ekstrak kasar air daun sirih ... 62
Lampiran 2. Skema uji aktivitas ekstrak daun sirih... 63
Lampiran 3. Skema aplikasi ekstrak daun sirih pada jambal patin... 64
Lampiran 4. Skema pengujian kimia ikan patin segar dan jambal patin ... 65
Lampiran 5. Skorsheet uji sensori ... 66
Lampiran 6. Angka TBARS ikan patin segar dan jambal patin penyimpanan 2 bulan (mg MDA/kg ikan) ... 70
Lampiran 7. Hasil sidik ragam dan uji lanjut Duncan angka TBARS... 71
Lampiran 8. Angka anisidin ikan patin segar dan jambal patin penyimpanan 2 bulan ( mol / g minyak ikan) ... 72
Lampiran 9. Hasil sidik ragam dan uji lanjut Duncan angka anisidin ... 73
Lampiran 10. Produk berfluoresen ikan patin segar dan jambal patin penyimpanan 2 bulan ( g/g minyak ikan) ... 74
Lampiran 11. Hasil sidik ragam dan uji lanjut Duncan produk berfluoresen 75 Lampiran 12. Gambar jambal patin mentah ... 76
Lampiran 13. Hasil uji atribut warna jambal patin mentah penyimpanan 2 bulan ... 81
Lampiran14. Hasil sidik ragam dan uji lanjut duncan atribut warna jambal patin mentah ... 82
Lampiran 15. Hasil uji atribut bau jambal patin mentah penyimpanan 2 bulan ... 83
Lampiran 16. Hasil sidik ragam dan uji lanjut duncan atribut bau jambal patin mentah ... 84
Lampiran 17. hasil uji atribut rasa jambal patin matang penyimpanan 2 bulan ... 85
Lampiran 19. Hasil uji atribut bau jambal patin matang penyimpanan
2 bulan ... 87
Lampiran 20. Hasil sidik ragam dan uji lanjut duncan atribut bau
jambal patin matang ... 88
Lampiran 21. Persentase jumlah panelis terhadap penilaian sensori
jambal patin matang ... 89
Lampiran 21. Persentase jumlah panelis terhadap penilaian sensori
1.1 Latar Belakang
Kerusakan bahan pangan terutama yang kaya akan nutrisi umumnya terjadi akibat penguraian oleh mikroba dan kerusakan akibat oksidasi lemak. Lemak atau minyak dalam bahan pangan bertanggung jawab terhadap terjadinya ketengikan rasa dan aroma. Ketengikan tersebut menyebabkan penurunan dalam kualitas gizi, sensori dan keamanan bahan pangan tersebut yang disebabkan oleh terbentuknya senyawa sekunder yang mungkin berpotensi toksik.
Ikan merupakan bahan pangan yang cepat mengalami kemunduran mutu, karena itu ikan setelah tertangkap membutuhkan penanganan yang cepat, tepat, mudah dan murah. Salah satu cara pengolahan ikan untuk memperpanjang umur simpan adalah dengan pengasinan dan pengeringan yang kadang-kadang dikombinasikan dengan fermentasi. Produk ikan yang diasinkan, difermentasi dan dikeringkan dikenal dengan sebutan jambal.
Jambal patin adalah produk olahan dari ikan patin (Pangasius hypophthalmus) yang merupakan jenis ikan air tawar. Kandungan lemak yang cukup tinggi pada ikan patin menyebabkan ikan tersebut mudah mengalami ketengikan sebagai produk oksidasi lemak. Menurut Moeljanto (1992) kerusakan ikan asin banyak disebabkan oleh bakteri, jamur dan oksidasi lemak yang menyebabkan ketengikan. Oksidasi lemak ini dapat berjalan cepat bila suhu penyimpanan cukup tinggi atau terkena sinar matahari. Selain itu adanya garam juga dapat memicu terjadinya oksidasi lemak. Menurut Hultin (1992) oksidasi lemak pada daging ikan dapat dipengaruhi oleh beberapa faktor selama penyimpanan dan penanganan misalnya suhu, oksigen, pH, penggaraman, kontaminasi dari ion logam, cahaya, umur post-mortem dan tingkat kerusakan sel pada saat pemotongan atau pengkulitan.
merupakan asam lemak omega 3. Menurut Jacobsen dan Timm (2001) asam lemak omega 3 maupun omega 6 sangat rentan mengalami oksidasi yang menyebabkan ketengikan, sehingga menurunkan kualitas gizi dan sensori. Oleh karena itu oksidasi lipid ini menjadi masalah dalam kualitas ikan bahkan dalam penyimpanan pada suhu di bawah 0oC (Huss, 1995).
Dalam proses pangan untuk mencegah terjadinya oksidasi lemak sering ditambahkan antioksidan sintetis. Beberapa antioksidan sintetis yang sering digunakan adalah butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT) dan tert-butylhydroquinone (TBHQ) dan α-tocopherol. Beberapa penelitian menyatakan bahwa antioksidan sintetis BHA (Thompson dan Moldeus, 1988) dan BHT (Witschi 1986; Thompson dan Moldeus, 1988) berpotensi karsinogenik. Oleh karena itu untuk mengganti antioksidan sintetis, telah banyak diteliti penggunaan antioksidan alami untuk mencegah terjadinya oksidasi lemak. Antioksidan alami ini telah digunakan secara turun temurun sebelum penelitian ilmiah dilakukan untuk mengetahui aktivitas antioksidannya dan sebelum komponen bioaktifnya diketahui.
Salah satu antioksidan alami yang telah digunakan untuk mencegah proses oksidasi pada daging ikan adalah antioksidan dari tanaman teh. Menurut Yuehua dan Shahidi (1997) Epigallocatechin gallate, Epicatechin gallate, Epigallocatechin dan epicatechin yang diisolasi dari teh mempunyai efektivitas antioksidan yang lebih baik dibandingkan BHA, BHT, TBHQ dan α-tocopherol dalam daging ikan, dan menyatakan bahwa α-tocopherol sangat tidak efektif dalam mencegah penguraian oksidatif pada daging ikan.
serta antioksidan sintetis BHT dan BHA pada butter cakes. Menurut Arambewela et al. (2006) ekstrak etanol daun sirih dapat memperpanjang umur simpan potato chip.
Tanaman sirih selain mempunyai aktivitas antioksidan juga dilaporkan mempunyai aktivitas antibakterial, antifungal. Beberapa peneliti yang menunjukkan aktivitas antibakterial, antifungal atau antioksidan daun sirih adalah Rao dan Rao (1964); Lim dan Mohamed (1999); Jenie et al. (2001); Choundhary dan Kale (2002); Sugiastuti (2002); Santhakumari et al. (2003); Dasgupta dan Bratati (2004); Misra et al. (2004); Paphattarapong et al. (2005); Arambewela et al. (2006); Tripathi et al. (2006).
Dari uraian di atas maka pada penelitian ini akan menguji aplikasi ekstrak daun sirih untuk menghambat oksidasi lemak pada jambal patin (Pangasius hypophthalmus).
1.2 Perumusan Masalah
Ikan patin merupakan golongan catfish yang mengandung asam lemak terutama asam lemak tidak jenuh omega 3 dan omega 6 cukup tinggi. Menurut Nair dan Gopakumar (1978) kandungan eicosapentaenoic acid (EPA) catfish air tawar, air laut dan air payau adalah 3.78%, 5.54% dan 4.36%, sedangkan kandungan docosahexaenoic acid (DHA) adalah 0.28%, 4.83% dan 1.59%. Eun et al. (1994) menyatakan bahwa kandungan EPA dalam catfish adalah 0.72 mg/g daging ikan dan kandungan DHAnya 5.62 mg/g daging ikan.
Asam lemak tidak jenuh terutama PUFA sangat rentan mengalami oksidasi sehingga menyebabkan penurunan kualitas mutu dan sensori serta yang lebih penting adalah kemungkinan terbentuknya senyawa toksik yang bersifat karsinogen. Selain kandungan lemak yang cukup tinggi pada jambal patin, proses pengeringan dan penambahan garam dalam pembuatan jambal patin dapat mempercepat proses oksidasi lemak sehingga jambal patin mudah mengalami ketengikan. Oleh karena itu untuk menghambat oksidasi lemak perlu ditambahkan antioksidan pada bahan pangan tersebut.
Tanaman sirih merupakan salah satu tanaman yang berpotensi sebagai antioksidan (Rao dan Rao 1964; Lim dan Mohamed 1999; Choundhary dan Kale 2002; Sugiastuti 2002; Santhakumari et al. 2003; Dasgupta dan Bratati 2004; Misra et al. 2004; Paphattarapong et al. 2005; Tripathi et al. 2006). Tanaman sirih telah lama digunakan dalam pengobatan, akan tetapi penggunaannya dalam bidang pangan masih sangat minim. Oleh karena itu perlu dikembangkan penelitian aplikasi antioksidan sirih pada bidang pangan.
1.3 Tujuan dan Manfaat
Penelitian ini bertujuan untuk melihat potensi dari ekstrak daun sirih yang mengandung antioksidan dalam menghambat oksidasi lemak yang terjadi pada ikan olahan yaitu jambal patin dengan pembanding BHT dengan masa simpan 2 bulan.
Manfaat dari penelitian ini adalah diharapkan ekstrak daun sirih dapat digunakan sebagai antioksidan pada ikan olahan menggantikan antioksidan sintetis.
1.4 Hipotesis
2.1 Sirih
Menurut Darwis (1992) tanaman sirih merupakan tanaman merambat dengan menggunakan akar tambahan (pembantu) yang pendek dan banyak. Tanaman sirih mempunyai klasifikasi sebagai berikut:
Devisi : Spermatophyta Sub devisi : Angiospermae Kelas : Dicotyledonae Bangsa : Diperales
Marga : Piper
Jenis : Piper betle Linn.
Gambar 1. Sirih (Piper betle Linn)
minyak atsiri daun sirih pada pasta gigi. Menurut Tripathi et al. (2006), daun sirih selain untuk tanaman obat juga digunakan sebagai campuran bumbu di India. Daun sirih juga dilaporkan mempunyai sifat antioksidan, antibakterial, stimulant, antifungal dan nematosidal (Tripathi et al. 2006). Menurut Duke et al. (2002), daun sirih memiliki aktivitas sebagai analgesik, antibakterial, antioksidan, antiperistaltik, antiseptik, astringen, stimulant, digestive, dan diuretic.
Tabel 1. Kandungan nutrisi dalam daun sirih segar
hydroxychavicol, eugenol, piperol A dan B dan piper betol yang diduga banyak berperan sebagai antioksidan dalam daun sirih. Menurut Tripathi et al. (2006) daun sirih mengandung senyawa thiosianat dan phenol, kedua senyawa ini diketahui mempunyai aktivitas secara biologi yaitu sebagai antikanker dan antioksidan. Rao dan Rao (1964) menyatakan bahwa daun sirih mengandung hydroxychavicol (4-allylcatechol) yang bersifat sebagai antioksidan yang kuat terhadap lemak. Menurut Arambewela et al. (2006) aktivitas antioksidan dari daun sirih dihubungkan dengan kandungan senyawa polifenol, alkaloid, steroid, saponin dan tannin yang terdapat pada ekstrak daun sirih.
Menurut Jenie et al. (2001) ekstrak daun sirih varietas kuning memberikan zona penghambatan yang paling besar terhadap Bacillus stearothermophilus dan mempunyai aktivitas bakterisidal terhadap B. stearothermophilus, Pseudomonas fluorescens dan P. aeruginosa. Sedangkan daun sirih varietas hijau menunjukkan aktivitas mikrobial yang paling kuat terhadap semua bakteri pathogen yang diuji yaitu B. cereus, Staphilococcus. aureus, Salmonella typhimurium, Escherichia coli dan Listeria monocytogenes.
Menurut Saravanan et al. (2002) ekstrak daun sirih dengan konsentrasi 100, 200 dan 300 mg/kg berat badan yang diberikan kepada mencit selama 30 hari menunjukkan penurunan aspartate aminotransferase (AST), alanin aminotransferase (ALT), thiobarbituric acid resctive substances (TBARS) dan hidroperoksida lipid. Ekstrak daun sirih juga mampu memperbaiki status antioksidan jaringan dengan meningkatkan kadar antioksidan non enzimatis dan mengaktifkan enzim detoksifikasi radikal bebas seperti superoxida dismutase (SOD), katalase dan glutathione peroxidase (GSH) pada mencit.
Sugiastuti (2002) menyatakan bahwa daun sirih mempunyai aktivitas antibakteri terhadap S. aureus, S. typhimurium, E. coli dan P. fluorescens dan aktivitas antioksidan yang lebih besar dibandingkan dengan BHT (100 ppm konsentrasi ekstrak daun sirih mempunyai nilai faktor protektif mendekati nilai faktor protektif BHT dengan konsentrasi 400 ppm).
dibandingkan daun sereh dan cengkeh serta antioksidan sintetis BHT dan BHA pada butter cakes. Masa simpan butter cakes yang diberi ekstrak kunyit dan daun sirih dapat mencapai 4 minggu.
Menurut Arambewela et al. (2006) ekstrak daun sirih mempunyai aktivitas antioksidan yang lebih baik dari BHT dalam menurunkan ketengikan pada minyak kelapa dan kelapa sawit serta dapat mencegah proses oksidasi pada potato chips sehingga dapat memperpanjang masa simpannya. Arambewela et al. (2006) juga menyatakan bahwa sifat antioksidan ekstrak daun sirih cukup stabil karena tidak berubah sampai 12 bulan pada suhu ruang. Aktivitas antioksidan sirih ini akan menurun jika suhu dinaikkan sampai 200oC. Oleh karenanya, daun sirih berpotensi baik untuk digunakan sebagai antioksidan dalam industri pangan.
2.2 Oksidasi Lemak
Oksidasi lemak merupakan fenomena yang umum dan sering memberikan perubahan kimia yang berdampak pada penurunan kualitas nutrisi, flavor dan perubahan tekstur produk. Perubahan kimia tersebut bertanggung jawab terhadap terjadinya ketengikan flavor dan aroma. Produk oksidasi lemak juga dapat berinteraksi dengan protein dan karbohidrat bahan pangan sehingga menyebabkan perubahan tekstur (Kinsella et al. 1978). Menurut Huss (1995) terdapat dua reaksi penting dalam penguraian lemak ikan yang dapat menurunkan kualitasnya yaitu reaksi oksidasi dan hidrolisis. Kedua reaksi tersebut dapat menghasilkan berbagai produk yang tidak diinginkan, misalnya hidroperoksida, senyawa aldehida, keton, alkohol, atau senyawa alkana.
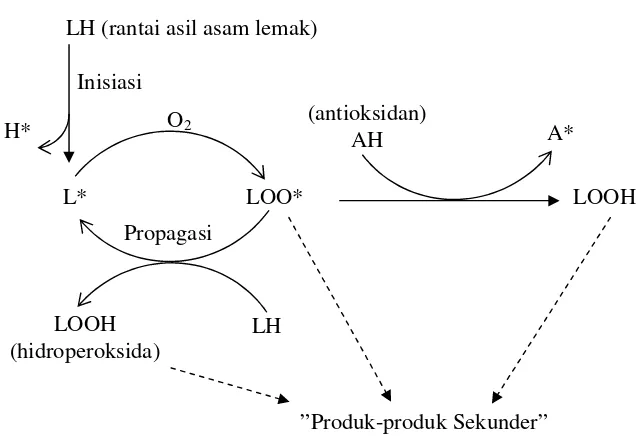
Gambar 2. Auto-oksidasi asam lemak tak jenuh
Menurut Huss (1995) kandungan PUFA dalam ikan sangat tinggi sehingga oksidasi sangat mudah terjadi melalui mekanisme autokatalitik di mana pada tahap inisiasi asam lemak mengalami pemutusan atom hidrogen menghasilkan radikal asam lemak. Radikal asam lemak tersebut bereaksi sangat cepat dengan oksigen membentuk perosida radikal. Peroksida radikal ini selanjutnya dapat bereaksi lagi dengan asam lemak lain menghasilkan hidroperoksida dan radikal asam lemak. Reaksi propagasi ini akan terus berlanjut sampai senyawa radikal tersebut bereaksi dengan radikal lain atau bereaksi dengan antioksidan menghasilkan antioksidan radikal yang lebih tidak reaktif. Hidroperoksida mudah terurai menjadi produk auto-oksidasi sekunder yaitu senyawa dengan rantai karbon lebih pendek terutama aldehida, keton, alkohol, asam karboksilat sederhana dan alkana yang memberikan perubahan bau dan hilangnya warna pada produk (Gambar 2).
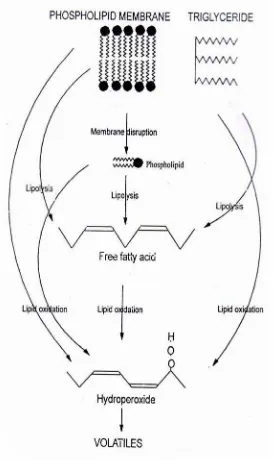
Menurut Ashton (2002), jalur oksidasi lipid yang mungkin terjadi pada ikan selama proses pengolahan dapat dilihat pada Gambar 3. Kerusakan membran sel selama penanganan dan pengolahan ikan menyebabkan Fosfolipid yang terdapat dalam membran sel keluar dari membran. Fosfolipid tersebut dan trigliserida dalam daging ikan selanjutnya mengalami penguraian menjadi asam lemak bebas
oleh kerja enzim fosfolipase dan lipase. Asam lemak bebas tersebut selanjutnya mengalami reaksi oksidasi melalui mekanisme autokatalitik menghasilkan hidroperoksida dan hidroperoksida selanjutnya mengalami dekomposisi menjadi produk yang bersifat volatil. Fosfolipid dan trigliserida juga dapat mengalami reaksi oksidasi dengan oksigen di atmosfir menghasilkan hidroperoksida yang selanjutnya mengalami dekomposisi menjadi produk yang bersifat volatil.
Pokorny et al.. (2001) menyatakan bahwa untuk mengetahui tingkat oksidasi lemak dalam produk pangan dapat dilakukan dengan pengukuran terhadap kehilangan materi lipid misalnya asam lemak atau trigliserida, atau juga dapat dilakukan dengan mengukur produk oksidasi lemak baik primer maupun sekunder. Beberapa metode pengukuran oksidasi lemak antara lain bilangan peroksida, diena terkonyugasi, bilangan oktanoat, produk oksidasi yang dapat berkonyugasi, angka TBARS, angka anisidin serta produk berfluoresen.
Menurut Ashton (2002), produk primer (hidroperoksida lipid) dari oksidasi asam lemak pada ikan umumnya dianggap tidak memberikan pengaruh yang kuat terhadap perubahan flavor, akan tetapi senyawa yang memberikan peningkatan ketengikan adalah produk oksidasi sekunder yang bersifat volatil yang diturunkan dari pemecahan hidroperoksida, sehingga untuk memonitor status oksidasi lemak dalam produk ikan dilakukan pengukuran terhadap produk oksidasi sekunder antara lain angka TBARS, angka anisidin serta produk berfluoresen.
Metode angka TBARS merupakan metode oksidasi lipid yang paling luas digunakan. Menurut Pokorny et al. (2001) prinsip pengukuran angka TBARS adalah pengukuran terhadap produk sekunder dari oksidasi lipid yaitu malonaldehida, di mana reaksi TBA dengan malonaldehida menghasilkan senyawa berwarna yang menyerap pada panjang gelombang 532-535 nm, sehingga dapat diukur secara spektrofotometri.
Angka anisidin merupakan metode pengukuran produk oksidasi sekunder yang bersifat non volatile. Menurut Pokorny et al.. (2001), prinsip pengukuran angka anisidin adalah menentukan jumlah aldehida (terutama 2-alkenals dan 2,4-dienals) dalam lemak, dimana aldehida bereaksi dengan p-anisidin membentuk kromogen yang menyerap pada panjang gelombang 350 nm, sehingga dapat diukur secara spektrofotometri.
sebagai metode kuantitatif untuk mengetahui kerusakan peroksidasi dalam sistim biologi, dimana metode ini relatif sederhana dan reproducible. Prinsip pengukuran produk berfluoresen adalah reaksi antara protein atau amina primer dengan produk oksidasi PUFA dan malonaldehida yang akan memberikan produk berfluoresen berwarna kuning (Fletcher et al., 1973) sehingga dapat diukur dengan spektrofluorometer, menggunakan panjang gelombang eksitasi 320-370 nm dan panjang gelombang emisi adalah 420-470 nm.
2.3 Antioksidan
Schuler (1990) mendefinisikan antioksidan sebagai senyawa yang dapat menunda, memperlambat atau mencegah terjadinya proses oksidasi. Secara umum proses oksidasi terjadi dalam tiga fase yaitu fase inisiasi, fase propagasi dan fase terminasi. Selama fase inisiasi, molekul oksigen bereaksi dengan asam lemak tidak jenuh menghasilkan hidroperoksida dan radikal bebas, kedua senyawa ini sangat reaktif. Adanya inisiator seperti logam transisi (besi atau tembaga), enzim lipoksigenase, panas ataupun cahaya dapat meningkatkan laju reaksi pada fase inisiasi. Produk reaksi fase inisiasi juga akan bereaksi dengan molekul lipid lain membentuk spesies lain yang reaktif. Oksidasi kemudian berlanjut pada fase propagasi di mana terjadi auto-oxidasi dan tahap akhir adalah fase terminasi membentuk produk yang relatif tidak reaktif seperti hidrokarbon, aldehida, dan keton. Reaksi yang terjadi pada setiap fase adalah sebagai berikut:
Inisiasi X* + RH R* + XH Propagasi R* + O2 ROO*
ROO* + RH ROOH + R* Terminasi ROO* + ROO* ROOR + O2 ROO* + R* ROOR
R* + R* RR
berasal dari sintetis reaksi kimia dan antioksidan alami yang berasal dari bahan alami.
Senyawa kimia yang tergolong dalam kelompok antioksidan dan dapat ditemukan dalam tanaman antara lain berasal dari golongan polifenol, bioflavonoid, vitamin C, vitamin E, beta-karoten, katekin dan resveratrol (Hernani dan Raharjo 2005). Antioksidan alami dapat dihasilkan oleh rempah-rempah, tanaman herbal, sayuran dan buah. Beberapa tanaman yang dilaporkan berpotensi sebagai antioksidan adalah sirih (Rao dan Rao 1964; Lim dan Mohamed 1999; Choudhary dan Kale 2002; Saravanan 2002; Sugiastuti 2002; Santhakumari et al. 2003; Dasgupta dan Bratati 2004; Tripathi et al. 2006; Arambewela et al. 2006), biji picung (Anwar 1992), jinten (Andarwulan 1995), rosemary (Wong et al. 1995; Hopia et al. 1996; Serdaroglu and Yildiz-Turp 2004), teh (Yuehua dan Shahidi 1997), daun sereh dan kunyit (Lim dan Mohamed 1999), biji atung (Sarastani 2001), serta jambu biji (Thaipong et al. 2006).
2.4 Jambal Patin
Jambal patin adalah produk olahan dari ikan patin (Pangasius hypophthalmus ) yang merupakan salah satu jenis ikan air tawar. Istilah jambal digunakan oleh masyarakat untuk ikan yang mengalami proses penggaraman yang dilanjutkan dengan fermentasi dan pada tahap akhir dilakukan pengeringan. Ikan jambal ini umumnya dibuat dari ikan menyung dan dikenal oleh masyarakat dengan sebutan jambal roti. Istilah jambal roti sebenarnya nama yang diberikan pada salah satu jenis ikan asin yang berasal dari jenis ikan manyung dan istilah jambal roti digunakan karena setelah digoreng daging ikan tersebut menjadi mudah hancur seperti rapuhnya roti panggang, sehingga analogi ini menyebabkan ikan jambal dikenal dengan nama jambal roti (Burhanuddin et al. 1987).
Cara pembuatan jambal di Jawa pada prinsipnya sama, tetapi setiap daerah memiliki cara khas dengan perbedaan pada lama dan cara penggaraman. Penggaraman jambal dapat dilakukan dengan beberapa cara yaitu penggaraman kering (dry salting), penggaraman basah (brine salting), dan penggaraman campuran. Bahan baku pembuatan jambal adalah ikan, garam dan antioksidan sebagai bahan tambahan untuk mencegah oksidasi serta air dan es sebagai bahan pengawet tambahan (Burhanuddin et al. 1987).
Pengolahan jambal roti dapat digolongkan menjadi dua yaitu jambal roti biasa atau asin dan jambal roti super atau tawar. Jambal roti biasa atau asin memiliki rasa yang relatif lebih asin daripada jambal roti tawar atau super, tekstur yang lebih keras, dan bahan baku biasanya dari ikan yang dies. Sedangkan jambal roti super atau tawar yaitu jambal roti yang memiliki tekstur empuk atau masir dan biasanya menggunakan bahan baku dari ikan manyung segar (Burhanuddin et al. 1987).
satu malam ikan dikeluarkan dari bak penggaraman dan dilakukan pencucian dengan menggunakan sikat untuk menghilangkan sisa garam dan kotoran lainnya. Sebelum ikan dijemur, bagian daging diolesi dengan larutan bawang putih dan gula.
Proses pengolahan jambal roti super atau tawar menurut Burhanuddin et al. (1987) yaitu : ikan manyung segar tanpa dicuci terlebih dahulu dipotong kepalanya dan dibuang isi perutnya, kemudian digarami dengan cara memasukkan garam ke dalam rongga perut ikan. Jumlah garam yang digunakan berkisar 30 – 35 %. Selanjutnya ikan disusun dalam bak penggaraman setelah dasar bak penggaraman diberi lapisan garam secukupnya. Setelah 1 malam, garam dikeluarkan dari rongga perut ikan dan garam tersebut digunakan kembali untuk menggarami bagian luar tubuh ikan. Penggaraman dilanjutkan selama dua sampai tiga malam. Setelah tiga sampai empat hari penggaraman, ikan dibelah dari punggung ke arah perut dilanjutkan pada sisi lain dari bagian perut ke arah punggung, supaya dapat dibuka lebar dua tulang pada bagian dekat sirip punggung dipotong. Setelah pembelahan dilanjutkan dengan pencucian dengan cara ikan dicuci bersih dengan bantuan sikat untuk menghilangkan garam dan kotoran. Sebelum dijemur, ikan diolesi dengan larutan bawang putih dan gula secukupnya.
Selain jambal yang terbuat dari ikan manyung, ikan patin juga dapat diolah menjadi jambal. Menurut Haryati (2006) proses pembuatan jambal patin adalah sebagai berikut: ikan patin segar disiangi bentuk gutted, dicuci, ditiriskan dan ditimbang bobotnya. Ikan kemudian dimasukkan ke dalam wadah semi tertutup dan dibiarkan pada suhu ruang (diautolisis dengan tujuan untuk mendapatkan tekstur jambal yang masir atau empuk) selama 6 jam. Kemudian ikan tersebut digarami dengan cara memasukkan garam ke dalam rongga perut ikan, dan sisa garam dibuat larutan garam jenuh.
Jambal patin mengandung lemak yang cukup tinggi, sehingga mudah mengalami oksidasi lemak yang menyebabkan ketengikan. Menurut Haryati (2006) jambal patin mengandung lemak 13.08% (bk). Kerusakan ikan yang mengalami proses penggaraman dan pengeringan terutama ikan dengan kandungan lemak yang cukup tinggi disebabkan oleh serangan bakteri dan jamur serta oksidasi lemak (Moeljanto 1992). Penggaraman dan pengeringan di bawah sinar matahari pada Indian Mackerel menyebabkan oksidasi lemak dengan hilangnya beberapa asam lemak PUFA (Rao dan Bandyopadhyay 1983).
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April sampai dengan November 2007 di Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan, Badan Riset Kelautan dan Perikanan, Departemen Kelautan dan Perikanan, Jln. Petamburan VI, Slipi Jakarta, Laboratorium Pilot Plan PAU Institut Pertanian Bogor dan Pusat pengujian Obat dan Makanan Nasional, Badan Pengawas Obat dan Makanan RI di Jakarta.
3.2 Bahan dan Alat
3.2.1 Bahan
Bahan yang digunakan dalam penelitian ini adalah daun sirih segar (Piper betle Linn) yang diperoleh dari Balai Tanaman Rempah dan Obat di Bogor sedang ikan patin (Pangasius hypophthalmus) diperoleh dari pembenihan ikan patin darmaga, Bogor. Bahan kimia yang digunakan adalah antioksidan pembanding yaitu BHT, standar Fatty Acid Methyl Ester (FAME), standar quinine sulfate, standar tetraethoxypropane (TEP), asam margarat, 2,2-diphenyl-1-picrylhydrazyl (DPPH), p-anisidine, aquades, garam dapur, H2SO4, CuSO4, Na2SO4, NaOH, HCl, indikator conway (Larutan stok: 200 ml larutan dicampur dengan metil merah 0.1% dalam etanol 50% dan 50 ml larutan metilen biru 0.1% dalam etanol 50%; larutan kerja: 1 bagian volume larutan stok dilarutkan dengan 1 bagian volume larutan etanol absolut dan 2 bagian volume aquadest), metanol, kloroform, KOH 10%, etanol absolute, heksan, KOH 0.5N dalam metanol, HCl 0.7N, BF3 14% dalam metanol, trichloacetic acid (TCA) 10%, thiobarbituric acid (TBA) 0.06M, , asam asetat glasial, dan isooktan.
3.2.1 Alat
Luminiscence spectrometer (Perkin-Elmer, LS-45), dan kromatografi gas (Shimadzu-GC 17-A).
3.3 Metoda
3.3.1 Pembuatan Ekstrak Daun Sirih
Daun sirih yang akan digunakan dalam penelitian ini adalah daun sirih yang sudah tua dan segar. Daun sirih yang telah dipetik, dibersihkan dari kotoran yang menempel, kemudian dicuci sampai tidak ada lagi kotoran yang menempel, dan ditiriskan. Daun sirih kemudian diangin-anginkan pada suhu ruang.
Pembuatan ekstrak daun sirih dilakukan menurut metode Arambewela et al. (2006) yang dimodifikasi. Setelah preparasi, daun sirih kemudian disimpan dalam kulkas selama semalam. Sebelum penggunaan, daun sirih tersebut dibiarkan pada suhu ruang dan ekstraksi dilakukan setelah suhu daun sirih tersebut mencapai suhu ruang.
Konsentrasi ekstrak daun sirih yang digunakan dalam penelitian ini adalah 22.5% yang selanjutnya dicampur larutan garam dengan perbandingan tertentu. Prosedur pembuatan ekstrak daun sirih adalah sebagai berikut: sebanyak 14 kg daun sirih segar dididihkan dengan 60 liter air selama 4 jam, didinginkan pada suhu ruang dan disaring dengan kain nilon ukuran 30 mess. Ampas daun sirih tersebut kemudian diperas lagi dengan air panas hingga volumenya menjadi 62 liter. Ekstrak ini kemudian disimpan dalam jergen berwarna gelap dan disimpan pada suhu 4oC sampai digunakan.
Skema pembuatan ekstrak daun sirih dapat dilihat pada Lampiran 1.
3.3.2 Pengujian Aktivitas Antioksidan Ekstrak Daun Sirih
Persen aktivitas penghambatan dihitung dengan rumus:
A0 = Absorban tanpa ekstrak
Ae = Absorban dengan ekstrak
Nilai IC50 (Konsentrasi ekstrak daun sirih yang dapat menghambat 50% radikal DPPH) ditentukan dengan menggunakan persamaan regresi antara konsentrasi ekstrak daun sirih dengan % aktivitas penghambatan DPPH. Skema pengujian aktivitas ekstrak daun sirih dapat dilihat pada Lampiran 2.
3.3.3 Aplikasi Ekstrak Daun Sirih Pada Jambal Patin
a. Pembuatan Larutan Garam Jenuh
Garam yang digunakan dalam penelitian ini adalah garam kristal ukuran sedang. Konsentrasi larutan garam yang digunakan adalah 30% (30 gram dalam 100 ml campuran larutan perendam, dimana larutan perendam terdiri dari larutan ekstrak daun sirih dan larutan garam sesuai perlakuan yang diberikan). Sebanyak 20 g dari jumlah garam yang akan dibuat larutan garam jenuh diambil untuk dimasukkan ke dalam setiap perut ikan. Larutan garam jenuh dibuat minimal 3 jam sebelum pemakaian dan dilakukan penyaringan terlebih dahulu sebelum digunakan untuk merendam ikan.
b. Aplikasi Ekstrak Daun Sirih
Ikan disusun dalam blong plastik dan diberi campuran larutan perendam dengan perbandingan yang tetap yaitu 1kg ikan : 2 liter campuran larutan. Campuran larutan yang digunakan adalah:
1. Kontrol: Larutan garam jenuh saja, dengan kode A
2. Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 2 ), dengan kode B 3. Ekstrak daun sirih 22.5%: Larutan garam ( 1 : 3 ), dengan kode C 4. Ekstrak daun sirih 22.5%: Larutan garam ( 1 : 4 ), dengan kode D 5. Ekstrak daun sirih 22.5%: Larutan garam ( 1 : 5 ), dengan kode E
Semua larutan garam dalam perlakuan tersebut tetap jenuh setelah penambahan ekstrak daun sirih. Bagian atas ikan diberi pemberat, dan blong ditutup, kemudian disimpan pada suhu ruang selama 48 jam. Kemudian ikan tersebut dicuci, ditiriskan dan dibelah dari arah punggung ke ekor.
Selanjutnya ikan dijemur di bawah sinar matahari selama 4-5 hari atau sampai kering. Setelah kering jambal patin tersebut disimpan dalam kemasan plastik pada suhu ruang selama 2 bulan.
Skema aplikasi ekstrak daun sirih pada jambal patin dapat dilihat pada Lampiran 3.
3.4 Pengujian Mutu Jambal Patin
Pengujian mutu yang dilakukan meliputi pengujian proksimat jambal patin yang terdiri dari pengujian kadar air, kadar abu, protein kasar, lemak total, serta profil asam lemak dan pengujian penghambatan oksidasi lemak yang terdiri dari pengujian angka TBARS, angka anisidin serta produk berfluoresen. Skema pengujian kimia jambal patin dapat dilihat pada Lampiran 4.
3.4.1 Pengujian Kadar Proksimat Jambal Patin
a. Pengujian Kadar Air
Pengujian kadar air dilakukan dengan metode oven (Apriantono et al. 1989). Prinsip penetapan kadar air dengan metode oven adalah berdasarkan berat yang hilang dari sampel setelah pemanasan pada suhu 105oC.
ditimbang. Cawan dimasukkan kembali ke dalam oven lalu didinginkan dalam desikator sampai diperoleh berat yang konstan.
Penetapan kadar air ikan dihitung dengan rumus:
%
W1 = berat sampel sebelum dikeringkan (gram) W2 = berat sampel sesudah dikeringkan (gram)
b. Pengujian Kadar Abu
Pengujian kadar abu dilakukan menurut metode pengabuan kering (Nielsen 1998), dimana prinsip metode ini adalah pembakaran pada suhu tinggi yaitu 525oC atau lebih tinggi.
Sebanyak 5-10 gram sampel ikan ditimbang, dan dimasukan ke dalam krus porselin (yang telah dibakar dalam tanur dan telah diketahui beratnya), kemudian dibakar di atas pembakar Bunsen sampai mengarang dan tidak keluar asap lagi. Setelah dingin krus tersebut dimasukkan ke dalam tanur selama 12-18 jam atau selama semalam pada temperatur 550oC. Kemudian sampel dikeluarkan dari tanur yang telah dimatikan sampai suhu tanur kurang dari 250oC. Setelah dingin, krus yang berisi abu sampel ditimbang.
Kadar abu dihitung dengan rumus:
Penetapan kadar protein dilakukan menurut SNI 01-2354.4-2006 (BSN 2006). Prinsip penetapan kadar protein dengan metode ini adalah amino nitrogen berbagai bahan organik dikonversikan menjadi amonium sulfat dengan adanya asam sulfat, natrium sulfat dan katalisator. Amonia akan didestilasi dari medium alkalin dan diabsorbsikan ke dalam asam borat. Penetapan amonia dilakukan dengan titrasi kembali larutan asam borat.
bagian kristal K2SO4), satu atau dua butir batu didih serta 20 ml asam sulfat pekat. Destruksi dilakukan sampai diperoleh larutan jernih tidak berwarna atau berwarna hijau muda (minimum 2 jam ). Hasil destruksi selanjutnya didinginkan dan dipindahkan secara kuantitatif ke dalam labu ukur 100 ml, dan ditambahkan akuades dengan hati-hati. Sebanyak 50 ml larutan asam borat 5% dipipet ke dalam gelas Erlenmeyer dan ditambahkan 5 tetes indikator tashiro (campuran larutan yang terdiri dari 100 ml metil merah 0.03% dalam etanol 95% dengan 15 ml metil biru 0.1% dalam etanol 95%). Selanjutnya labu dilengkapi dengan kondensor dan diletakkan sedemikian sehingga ujung kondensor (dimana embunan menetes) tercelup ke dalam larutan asam borat. Larutan contoh dipipet 10 ml ke dalam labu yang terpasang pada labu destilasi dengan menggunakan corong dan ditambahkan 3 tetes indikator fenolfetalein 1% dalam etanol 95%. Selanjutnya labu tersebut dipanaskan hingga semua gelembung amonia ke luar (sampai jumlah destilat ± 150 ml). Setelah selesai rangkaian destilasi dilepaskan secara hati-hati, dan ujung kondensor dicuci dengan aquadest, kemudian larutan penampung dititrasi dengan larutan standar HCl 0.1 N hingga berubah warna.
Kadar protein dihitung menggunakan rumus sebagai berikut:
%
A = Volume larutan HCl yang digunakan untuk titrasi (ml) B = Normalitas larutan HCl yang digunakan untuk titrasi C = Berat sampel (gram)
F = Faktor pengenceran
d. Pengujian Kadar Lemak Total
Penetapan lemak total dilakukan dengan metode soxhlet menurut SNI 01 – 2354.3-2006 (BSN 2006). Prinsip Penetapan lemak total dengan metode tersebut adalah ekstraksi pelarut semikontinyu, di mana pelarut pertama mengekstraksi sampel selama 5-10 menit kemudian bergerak kembali ke dalam labu ekstraksi.
dahulu. Kemudian ditambahkan kurang lebih 50 ml dietil eter, lalu dipasang pada pemanas. Laju kecepatan kondensasi diatur sebesar 5 atau 6 tetes perdetik selama 4 jam atau 16 jam pada kecepatan kondensasi 2 atau 3 tetes perdetik. Kemudian solven dalam labu ekstraksi diuapkan dan labu ekstraksi tersebut beserta ekstrak lemak selanjutnya dikeringkan dalam oven pada suhu 100oC selama 60 menit atau sampai beratnya tetap, lalu dinginkan dalam desikator dan ditimbang.
Kadar lemak dalam sampel dihitung dengan rumus:
%
e. Pengujian Profil Asam Lemak
Pengujian profil asam lemak dilakukan menurut Kinsella et al. (1978). Untuk mengukur profil asam lemak terlebih dahulu dilakukan ekstraksi minyak ikan dari daging ikan. Prosedur ekstraksi minyak ikan dilakukan menurut Bligh dan Dyer (1959) sebagai berikut: Sebanyak 30 gram ikan ditimbang, ditambahkan campuran 60 ml metanol dan 30 ml kloroform dan dihomogenisasi dengan blender selama 2 menit. Kemudian ditambahkan kloroform lagi sebanyak 30 ml, dan diblender kembali selama 30 detik, lalu ditambahkan 30 ml aquades. Kemudian homogenat diaduk dengan batang pengaduk, dan disaring dengan kertas whatman No.1. Kemudian filtrat dipindahkan ke corong pisah. Fase yang lebih jernih dialirkan ke dalam labu lemak, selanjutnya dievaporasi dengan vakum rotari evaporator pada suhu 40oC sehingga diperoleh minyak ikan. Minyak ikan tersebut kemudian disimpan pada suhu -40oC untuk analisis berikutnya.
Setelah minyak ikan diperoleh selanjutnya dilakukan derivatisasi asam lemak untuk membentuk Fatty Acid Methyl Ester (FAME) dan tahap terakhir pengujian profil asam lemak adalah analisa FAME dengan Gas Chromatography.
Derivatisasi Asam Lemak (Kinsella et al. 1978)
dipanaskan selama 5 menit pada suhu 90oC untuk menyempurnakan proses metilasi. FAME yang terbentuk diekstraksi dari campuran tersebut sebanyak tiga kali dengan heksana sebanyak 15 ml, dan dipekatkan sampai 0.5 ml. Selanjutnya dikuantifikasi dengan Gas Chromatography.
Analisis Asam Lemak secara Gas Chromatography (Kinsella et al. 1978)
Kandungan dan komposisi FAME dianalisis dengan Gas Chromatography dengan kondisi sebagai berikut:
Gas Pembakar : Hidrogen (45 ml/menit) dan Udara (240 ml/menit) Untuk identifikasi asam lemak dalam sampel dilakukan dengan mencocokkan waktu retensi peak asam lemak sampel dengan waktu retensi peak standar FAME murni yang terdiri dari : C4:0, C6:0, C8:0, C10:0, C11:0, C12:0, C13:0, C14:0, C14:1, C15:0, C15:1, C16:0, C16:1, C17:0, C17:1, C18:0, C18:1n9t, C18:1n9c, C18:2n6t, C18:2n6c, 18:3n3, 18:3n6, C20:0, C20:1, C20:2, C20:3n6, C20:3n3, C20:4n6, C20:5n3, C21:0, C22:0, C22:1n9, C22:2, C22:6n3, C23:0, C24:0 dan C24:1.
• Membandingkan waktu retensi (rt) asam lemak yang terdapat dalam sampel dengan waktu retensi asam lemak dalam standar eksternal.
• Menghitung asam lemak yang teridentifikasi dalam sampel (mg asam lemak A per gram sampel, dengan rumus sbb:
sampel pengukuran angka TBARS adalah pengukuran terhadap produk sekunder dari oksidasi lipid yaitu malonaldehida (MDA), di mana reaksi TBA dengan malonaldehida menghasilkan senyawa berwarna yang menyerap pada panjang gelombang 532 nm, sehingga bisa diukur secara spektrofotometri.
Prosedur pengujian angka TBARS adalah sebagai berikut: sebanyak 10 gram sampel ikan yang telah mendapat perlakuan dihomogenisasi dengan 25 ml air destilata menggunakan homogenizer selama 30 detik pada kecepatan 10.000 rpm. Kemudian ditambahkan 25 ml TCA 10% ke dalam homogenat dan dicampur dengan vortex, lalu disaring. Sebanyak 4 ml filtrat dipipet ke dalam tabung reaksi, ditambah 1ml TBA 0.06 M, kemudian dipanaskan dalam waterbath yang mendidih selama 10 menit untuk pembentukan warna dan didinginkan. Kemudian absorban diukur dengan menggunakan spektrofotometer double-beam pada panjang gelombang 532 nm.
b. Pengujian Angka Anisidin
Pengukuran angka anisidin dilakukan menurut AOCS method Cd 18-90 (AOCS, 1997). Prinsip pengukuran metode ini adalah angka anisidin menentukan jumlah aldehida (terutama 2-alkenals dan 2,4-dienals) dalam lemak. Aldehida bereaksi dengan p-anisidin membentuk kromogen yang diukur secara spektrofotometri.
Prosedur pengukuran angka anisidin adalah sebagai berikut: sebanyak 0.5 – 4 g minyak ikan ditambah 25 ml isooktan dan larutan ekstrak tersebut diukur absorbannya (Ab) pada 350 nm dengan spektrofotometer UV-Vis. Kemudian sebanyak 5 ml ekstrak minyak dipipet ke dalam tabung, kemudian ditambahkan 1 ml p-anisidin 0.25% dalam asam asetat glasial. Tabung ditutup, dikocok dan dibiarkan pada tempat gelap selama 10 menit. Absorban larutan tersebut (As) diukur pada panjang gelombang 350 nm.
Angka anisidin dihitung dengan rumus:
As = absorban setelah reaksi dengan p-anisidin Ab = absorban sebelum reaksi dengan p-anisidin
c. Pengujian Produk Berfluoresen
Prinsip pengukuran produk berfluoresen adalah reaksi antara protein atau amina primer dengan produk oksidasi PUFA dan malonaldehida memberikan produk berfluoresen yang berwarna kuning. Pengujian produk berfluoresen dilakukan menurut Fletcher et al. (1973) menggunakan spektrofluorometer.
Kadar produk berfluoresen dihitung menggunakan rumus:
Daun sirih merupakan tanaman herbal dengan aroma dan rasa yang spesifik, sehingga untuk mengetahui pengaruh perlakuan ekstrak sirih dan lama penyimpanan jambal patin terhadap perubahan mutu sensori, maka dilakukan uji pembedaan atribut pada jambal patin mentah dan jambal patin matang menurut Meilgaard et al. (1999). Uji pembedaan atribut meliputi uji pembedaan warna dan bau untuk jambal patin mentah serta uji pembedaan rasa dan bau untuk jambal patin matang.
Skorsheet uji sensori dapat dilihat pada Lampiran 5.
3.6 Analisis Data
Rancangan percobaan yang digunakan untuk analisis data uji penghambatan oksidasi lemak dan uji sensori adalah Rancangan Acak Lengkap dua faktorial dengan perlakuan perbandingan konsentrasi ekstrak daun sirih dan lama penyimpanan. Model Linear Aditif dari rancangan percobaan ini adalah sebagai berikut (Steel dan Torrie 1993):
4.1 Pembuatan Jambal Patin
Ikan jambal umumnya dibuat dari ikan manyung dan dikenal oleh masyarakat dengan sebutan jambal roti. Istilah jambal roti sebenarnya nama yang diberikan pada salah satu jenis ikan asin yang berasal dari jenis ikan manyung. Pada penelitian ini ikan jambal dibuat dari ikan patin. Berbeda dengan ikan manyung, ikan patin memiliki daging yang lebih tipis sehingga kemungkinan berpengaruh terhadap tekstur jambal yang dihasilkan.
Dalam proses pembuatan jambal pada penelitian ini, sebelum pemberian garam dilakukan autolisis selama 6 jam, karena diharapkan pada tahap ini protein ikan akan mulai mengalami degradasi oleh enzim proteolitik yang terdapat pada daging ikan sehingga tekstur yang dihasilkan lebih empuk. Menurut Huss (1995) enzim katepsin merupakan enzim proteolitik yang berperan penting selama proses degradasi autolisis pada daging ikan. Degradasi oleh enzim tersebut menyebabkan daging ikan menjadi lebih lunak. Autolisis hanya dilakukan selama 6 jam untuk menghindari autolisis berlanjut yang berakhir pada kebusukan. Aktivitas enzim ini akan terhambat dengan pemberian garam. Tahap selanjutnya dalam pembuatan jambal patin adalah pemberian ekstrak daun sirih. Ekstrak daun sirih yang diberikan dibuat dalam konsentrasi 22.5 % (disajikan pada Lampiran 1), kemudian ekstrak daun sirih tersebut dibuat dengan beberapa perbandingan terhadap larutan garam jenuh yaitu 1:2 (kode B), 1:3 (kode C), 1:4 (kode D), 1:5 (kode E) dan kode A tanpa ekstrak daun sirih hanya direndam dalam larutan garam jenuh saja. Pemberian ekstrak daun sirih ini dimaksudkan untuk menghambat oksidasi lemak pada jambal patin. Selanjutnya dilakukan perendaman selama 48 jam untuk memberikan kesempatan ekstrak daun sirih dan larutan garam berpenetrasi ke dalam daging ikan. Ikan kemudian dibersihkan dari garam dan kemudian dibelah dan segera dicuci sehingga warna dari ekstrak daun sirih tidak mengganggu produk.
plastik untuk menghindari kontak langsung dengan udara dan disimpan selama 2 bulan. Pengujian status oksidasi dan uji sensori dilakukan setiap 2 minggu sekali. Produk jambal patin dengan perlakuan ekstrak daun sirih yang dihasilkan dalam penelitian ini memberikan warna yang berbeda dari kontrol. Jambal patin kontrol memberikan warna kuning muda hingga kuning kecoklatan, sedangkan jambal patin yang diberi ekstrak daun sirih memberikan warna coklat muda hingga coklat kehitaman. Perubahan warna jambal patin ini kemungkinan disebabkan oleh komponen minyak atsiri yang terdapat dalam ekstrak sirih. Menurut Darwis (1992) minyak atsiri daun sirih berwarna kuning muda sampai kuning kecoklatan. Perbedaan warna antara kelompok kontrol dan keempat kelompok dengan perlakuan ekstrak sirih dapat dilihat pada Lampiran 12. Jambal patin yang dihasilkan dalam penelitian ini mempunyai tekstur yang tidak terlalu empuk tetapi tidak terlalu keras dan setelah dipanggang dengan mikrowave memberikan rasa yang gurih, namun terdapat kontribusi rasa dari ekstrak daun sirih.
4.2 Proksimat Jambal Patin
Tabel 2. Proksimat jambal patin
Kadar Proksimat (% bb) A B C D E
Kadar Air 22.30 20.46 25.48 23.29 21.30
Kadar Abu 17.55 18.74 19.98 19.19 20.35
Kadar Protein 34.06 35.22 31.25 32.12 32.01
Kadar Lemak 21.97 21.90 21.77 20.20 20.23
Keterangan : A = Kontrol (larutan garam jenuh saja)
B = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 2 ) C = Ekstrak daun sirih 22.5%: Larutan garam ( 1 : 3 ) D = Ekstrak daun sirih 22.5%: Larutan garam ( 1 : 4 ) E = Ekstrak daun sirih 22.5%: Larutan garam ( 1 : 5 )
Pada Tabel 2 terlihat bahwa kadar proksimat jambal patin yang diuji pada minggu ke-0 terlihat adanya sedikit perbedaan antara jambal patin dengan perlakuan ekstrak sirih dan jambal tanpa perlakuan ekstrak sirih. Hal ini kemungkinan disebabkan karena adanya variasi komposisi proksimat di antara tubuh ikan. Menurut Ashton (2002) ikan mempunyai komposisi yang bervariasi baik antar spesies, antar individu dalam satu spesies yang sama dan bahkan antar bagian dalam individu ikan.
4.3 Aktivitas ekstrak Daun sirih
Uji aktivitas ekstrak daun sirih dilakukan dengan metode DPPH. Besarnya aktivitas ekstrak daun sirih diukur dengan % penghambatan DPPH dan dinyatakan dengan IC50. Menurut Dasgupta and Bratati (2004), IC50 adalah konsentrasi ekstrak yang dapat menghambat 50% radikal DPPH. Aktivitas ekstrak daun sirih kemudian dibandingkan dengan antioksidan sintetis BHT. Hasil Uji aktivitas ekstrak daun sirih dapat dilihat pada Tabel 3.
Tabel 3. Aktivitas ekstrak daun sirih dan BHT
Sampel IC50 ( g/ml) Persamaan Regresi
dibandingkan BHT. Menurut Sugiastuti (2002) ekstrak etanol daun sirih mempunyai aktivitas antioksidan yang lebih besar dibandingkan dengan BHT (100 ppm konsentrasi ekstrak etanol daun sirih mempunyai nilai faktor protektif mendekati nilai faktor protektif BHT dengan konsentrasi 400 ppm). Menurut Arambewela et al. (2006) ekstrak etanol daun sirih mempunyai aktivitas antioksidan yang lebih baik dari BHT (nilai EC50 ekstrak etanol daun sirih adalah 6 g/ml dan nilai EC50 BHT adalah 8 g/ml, dimana EC50 adalah konsentrasi efektif yang dapat menghambat 50% radikal bebas DPPH dengan mengukur persen DPPH yang tertinggal atau yang tidak bereaksi dengan ekstrak etanol daun sirih atau BHT). Dasgupta dan Bratati (2004) menyatakan bahwa aktivitas ekstrak air daun sirih dari 3 jenis tanaman sirih yaitu kauri, ghanagete dan bagerhati yang tumbuh di India mempunyai aktivitas antioksidan dengan nilai IC50 berturut-turut 63 g/ml, 126 g/ml dan 272 g/ml.
4.4 Angka TBARS
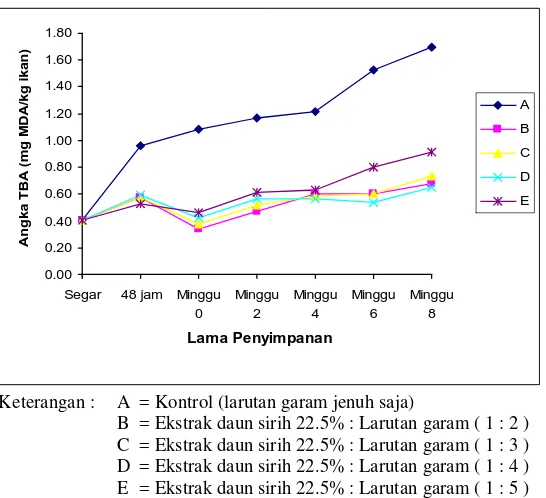
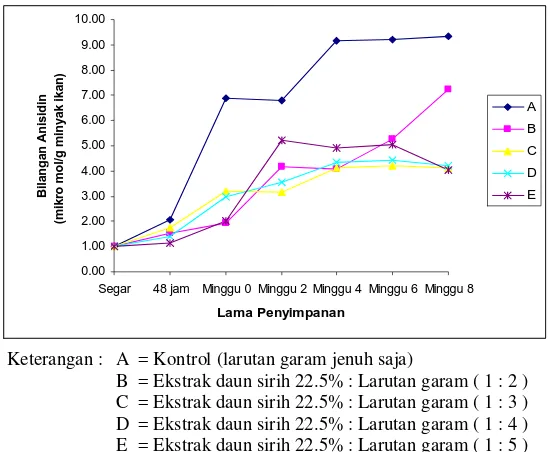
Angka TBARS merupakan parameter yang umum digunakan untuk memantau status oksidasi. Angka TBARS tersebut didasarkan atas reaksi antara malonaldehida sebagai produk oksidasi lemak dengan thiobarbituric acid (Pokorny, 2001). Pada penelitian ini untuk memantau status oksidasi, angka TBARS diukur mulai dari ikan patin segar, setelah perendaman dengan campuran larutan perendam selama 48 jam, kemudian setelah kering (minggu ke-0), dan dilanjutkan dengan penyimpanan minggu ke-2, ke-4, ke-6 dan ke-8. Grafik angka TBARS disajikan pada Gambar 4.
mg MDA/kg ikan dan pada akhir penyimpanan (2 bulan) angka TBARS kelompok A menjadi 1.70 mg MDA/kg ikan sedangkan kelompok dengan perlakuan ekstrak sirih berkisar 0.65-0.91 mg MDA/kg ikan. Peningkatan angka TBARS menunjukkan peningkatan produk sekunder yaitu malonaldehida sebagai hasil reaksi oksidasi lemak.
Peningkatan angka TBARS pada semua kelompok perlakuan juga menunjukkan bahwa penambahan garam mempercepat terjadinya oksidasi lemak. Nambudiry (1980) menyatakan bahwa angka TBARS ikan asin sardin lebih tinggi dari pada ikan kering sardin yang tidak diasinkan. Basmal et al. (1985) juga menyatakan bahwa angka TBARS ikan asin sardin meningkat selama penyimpanan 4 minggu. Menurut McGillvray J (2006) angka TBARS pada catfish oil dengan ekstraksi menggunakan propane dan heksana adalah 1.32 dan 2.61 mg MDA/kg ikan. Silva (1986) juga menyatakan bahwa angka TBARS beberapa spesies catfish pada penyimpanan beku selama 2 bulan berkisar 0.68 sampai 1.4 mg MDA/kg ikan.
Berdasarkan grafik pada Gambar 4 juga terlihat bahwa setelah perendaman 48 jam oksidasi sudah terjadi pada semua kelompok perlakuan. Akan tetapi proses oksidasi lemak lebih cepat terjadi pada kelompok kontrol dibandingkan keempat kelompok dengan perlakuan ekstrak sirih. Gambar 4 memperlihatkan bahwa proses oksidasi selama penyimpanan juga lebih cepat terjadi pada kelompok kontrol dibandingkan keempat kelompok dengan perlakuan ekstrak sirih. Hal ini menunjukkan adanya kemampuan ekstrak daun sirih dalam menghambat oksidasi lemak yang terjadi pada jambal patin. Sugiastuti (2002) menyatakan bahwa ekstrak etanol daun sirih mampu menghambat oksidasi lemak pada daging giling. Lim dan Mohamed (1999) juga menyatakan bahwa ekstrak daun sirih mampu menghambat oksidasi lemak pada butter cakes.
0.00
Keterangan : A = Kontrol (larutan garam jenuh saja)
B = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 2 ) C = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 3 ) D = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 4 ) E = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 5 )
Gambar 4. Grafik angka TBARS jambal patin dengan lama penyimpanan 2 bulan
Hasil sidik ragam angka TBARS memberikan perbedaan yang nyata (p< 0.05) baik untuk perlakuan ekstrak sirih maupun lama penyimpanan. Akan tetapi tidak berbeda nyata (p>0.05) dalam interaksi perlakuan ekstrak sirih dan lama penyimpanan. Hal ini menunjukkan tidak ada interaksi antara pemberian ekstrak sirih dengan lama penyimpanan. Hasil uji lanjut Duncan untuk perlakuan ekstrak sirih menunjukkan bahwa kontrol berbeda dari keempat kelompok yang diberi ekstrak sirih. Akan tetapi dari keempat kelompok yang diberi ekstrak sirih tersebut kelompok dengan ekstrak sirih 1:5 berbeda dari kelompok ekstrak sirih 1:2, 1:3 dan 1:4. Sedangkan hasil uji lanjut Duncan untuk perlakuan lama penyimpanan menunjukkan bahwa penyimpanan minggu ke-0 berbeda dari penyimpanan minggu ke-2 dan ke-4 serta berbeda dari penyimpanan minggu ke-6 dan ke-8. Hasil sidik ragam dan uji Duncan angka TBARS dapat dilihat pada Lampiran 7.
4.5. Angka Anisidin
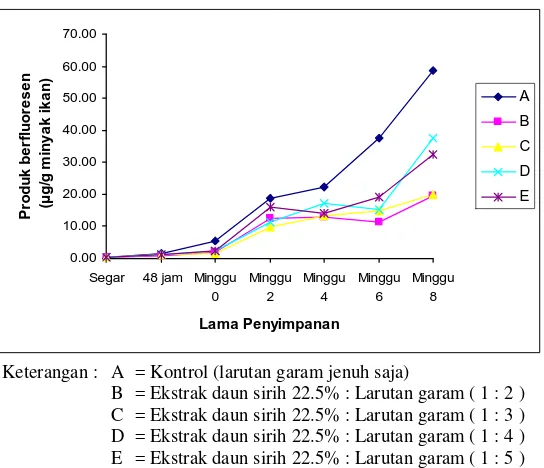
dari ikan patin segar, setelah perendaman selama 48 jam dengan campuran larutan perendam, kemudian setelah kering (minggu ke-0), dan dilanjutkan dengan penyimpanan minggu ke-2, ke-4, ke-6 dan ke-8. Grafik hasil angka anisidin disajikan pada Gambar 5.
Berdasarkan hasil penelitian angka anisidin untuk ikan segar adalah 0.99 mol/g minyak ikan. Setelah perendaman 48 jam angka anisidin kelompok A (kontrol) meningkat menjadi 2.06 mol/g minyak ikan dan kelompok dengan perlakuan ekstrak sirih berkisar 1.12 – 1.52 mol/g minyak ikan. Setelah mengalami proses pengeringan angka anisidin kelompok A menjadi 6.87 mol/g minyak ikan sedangkan kelompok dengan perlakuan ekstrak sirih berkisar 1.93 – 3.21 mol/g minyak ikan dan pada akhir lama penyimpanan (2 bulan) angka anisidin kelompok A mencapai 9.35 mol/g minyak ikan sedangkan kelompok dengan perlakuan ekstrak sirih berkisar 4.02 – 7.24 mol/g minyak ikan. Peningkatan angka anisidin mengindikasikan peningkatan produk oksidasi sekunder terutama 2-alkenal dan 2,4-dienal sebagai produk reaksi oksidasi lemak.
Menurut NHPD (2007) minyak ikan dinyatakan tidak tengik jika angka anisidin kurang dari 20 mol/g minyak ikan. Menurut Chol (2005) minyak ikan komersial dengan angka anisidin 19.8 mol/g minyak dinyatakan tidak berasa dan tidak berbau tengik. Hal ini menunjukkan bahwa sampai akhir penyimpanan baik jambal patin kontrol maupun jambal patin dengan perlakuan ekstrak sirih masih belum dianggap tengik. Kolodziejska et al. (2004) juga menyatakan bahwa pemberian garam pada ikan asap menyebabkan peningkatan angka anisidin. Angka anisidin pada ikan asap jenis mackerel yang disimpan pada suhu 2oC selama 14 hari berkisar 6.1-8.8 mol/g minyak.
0.00
Segar 48 jam Minggu 0 Minggu 2 Minggu 4 Minggu 6 Minggu 8
Lama Penyimpanan
patin. Menurut Daguspta dan Bratati (2004) ekstrak air daun sirih dari keempat jenis sirih yang tumbuh di India mempunyai aktivitas antioksidan yang lebih baik dari tea.
Berdasarkan Gambar 5 juga terlihat bahwa semua kelompok perlakuan memberikan peningkatan angka anisidin yang lebih tinggi selama proses dari ikan patin segar sampai menjadi jambal patin kering dibandingkan selama proses penyimpanan. Hal ini terjadi mungkin disebabkan oleh pengaruh panas matahari dan terekspos oleh udara dari atmosfer pada saat penjemuran. Rao dan Bandyopadhyay (1983) menyatakan bahwa penggaraman dan pengeringan dengan sinar matahari menyebabkan oksidasi lemak pada mackerel.
Keterangan : A = Kontrol (larutan garam jenuh saja)
B = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 2 ) C = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 3 ) D = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 4 ) E = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 5 )
Gambar 5. Grafik angka anisidin jambal patin dengan lama penyimpanan 2 bulan
ekstrak sirih tidak memberikan perbedaan angka anisidin yang nyata (p>0.05). Sedangkan hasil uji lanjut Duncan untuk perlakuan lama penyimpanan menunjukkan bahwa penyimpanan minggu ke-0 berbeda dari penyimpanan minggu ke-2 dan ke-4 serta berbeda dari penyimpanan minggu ke-6 dan ke-8. Hasil sidik ragam dan uji Duncan angka anisidin dapat dilihat pada Lampiran 9.
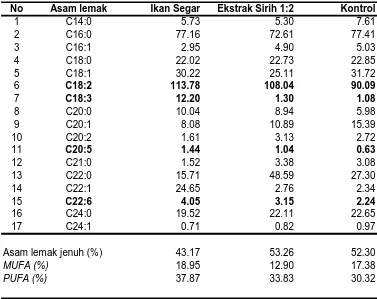
4.6. Produk Berfluoresen
Pengukuran produk berfluoresen merupakan metode pengukuran oksidasi lipid yang sensitif untuk produk ikan. Menurut Aubourg (1999) deteksi fluoresen pada panjang gelombang eksitasi/emisi maksimum memberikan nilai yang akurat untuk penilaian oksidasi lipid dan perubahan kualitas ikan selama proses karena dapat mengukur kadar produk berfluoresen dalam jumlah yang sangat kecil, sehingga analisis produk berfluoresen sangat baik digunakan untuk mengetahui efektivitas suatu antioksidan dalam menghambat oksidasi pada minyak ikan maupun daging ikan.
Parameter ketiga untuk memantau status oksidasi adalah produk berfluoresen yang diukur mulai dari ikan patin segar, setelah perendaman campuran larutan perendam selama 48 jam, kemudian setelah kering (minggu ke-0), dan dilanjutkan dengan penyimpanan minggu ke-2, ke-4, ke-6 dan ke-8. Hasil produk berfluoresen disajikan pada Gambar 6. Kadar produk berfluoresen ikan patin segar pada penelitian ini adalah 0.47 g/g minyak ikan. Setelah perendaman 48 jam kadar produk berfluoresen kelompok A (kontrol) meningkat menjadi 1.40 g/g minyak ikan sedangkan kelompok dengan perlakuan ekstrak sirih berkisar antara 0.86 – 1.26 g/g minyak ikan. Kadar produk berfluoresen setelah mengalami pengeringan pada kelompok kontrol mencapai 5.57 g/g minyak ikan sedangkan kelompok dengan perlakuan ekstrak sirih berkisar antara 1.47 – 2.43 g/g minyak ikan dan pada akhir lama penyimpanan (2 bulan) kadar produk berfluoresen meningkat menjadi 58.70 g/g minyak ikan sedangkan kelompok dengan perlakuan ekstrak sirih berkisar antara 19.44 – 37.51 g/g minyak ikan.
0.00
peningkatan yang lebih tinggi pada kelompok kontrol dibandingkan keempat perlakuan dengan ekstrak sirih. Hal ini juga menunjukkan bahwa ekstrak daun sirih dapat menghambat oksidasi lemak pada jambal patin.
Keterangan : A = Kontrol (larutan garam jenuh saja)
B = Ekstrak daun sirih 22.5% : Larutan garam ( 1 : 2 )
Lubis (1989) menyatakan bahwa bertambahnya lama penyimpanan dan meningkatnya suhu penyimpanan menyebabkan peningkatan produk berfluoresen pada ikan asin kering. Kadar produk berfluoresen pada ikan asin kering jenis sardinops dengan penggaraman 22% dan penyimpanan suhu 30o adalah 3.35 g/g ikan pada minggu ke-0 dan mencapai 12.65 g/g ikan pada minggu ke-6, sedangkan pada penyimpanan suhu 5oC minggu ke-0 adalah 3.35 g/g ikan dan pada minggu ke-24 mencapai 6.881 g/g ikan. Hasil evaluasi sensori pada ikan kering sarden yang disimpan pada suhu 5oC tengik setelah 12 minggu, pada suhu 20oC tengik setelah 8 minggu dan pada suhu 30oC tengik setelah 4 minggu (Lubis 1989).