ABSTRACT
DHIA MARDHIA ENGCONG. Characteristic of Sheep Oocytes from the Ovaries that was Store on Different Temperature and Different Period Of Time. Under direction of NI WAYAN KURNIANI KARJA.
The aim of the study was to investigate the characteristic of sheep oocytes from the ovaries that was stored on different temperature at a different period of time. Ovaries obtained from the slaughter house. The ovaries were then stored at 4 ˚C for the period of 2, 5-7 and 8-10 h, 27-28 ˚C for the 2, 5-7 and 8-10 h, and the third group was stored at 37-38 ˚C for 2, 5-7 and 8-10 h. At the end of the storage, the oocytes were collected from the ovaries using the slicing method. Collected oocytes were graded as A, B, C and D based on the layers of the cumulus cell and images of the cytoplasm. The percentage of the oocytes for grade A, B, C and D that was derived from the ovaries stored at 4 ˚C are no differ than the other group (P>0.05). The percentage of oocytes of A’s grade from the ovaries stored at the temperature of 27-28 ˚C for 2 hours were higher than the oocytes from the ovaries that were stored for 5-7 and 8-10 hours (P>0.05). Meanwhile the quantity of oocytes with the grade of B, C and D that was derived from the ovaries stored at the temperature of 27-28 ˚C did have not change compared to the other group(P>0.05). The quantity of oocytes with A’s grade that was derived from the ovaries that was kept at the temperature 37-38 ˚C for 2 hours and 5-7 hours (P<0.05) did not show any changes, however there are descending number of oocytes with the A’s grade that was derieved after 8-10 hours of storage (P<0.05). The number of oocytes with the B’s grade that was collected after 5-7 hours after storing was higher compared to those stored for 2 and 8-10 hours (P<0.05). The number of oocytes with the D’s grade is increasing parallel with the length of time for the storage at the temperature 37-38 ˚C (P<0.05). The percentage of the number of oocytes of the A and B’s grade did have not different among other group except for the group of ovaries stored at the temperature of 37-38 ˚C for 5-7 and 8-10 h. These result suggested that storing the ovaries at 27-28 ˚C and 37-38 ˚C for the duration of 5-7 hours preserve the quality of the oocytes better in compared to storing the ovaries at the temperature of 4 ˚C.
RINGKASAN
DHIA MARDHIA ENGCONG. Karakteristik Oosit Domba dari Ovarium yang Disimpan pada Suhu dan Waktu Berbeda. Dibimbing oleh NI WAYAN KURNIANI KARJA.
Penelitian ini bertujuan untuk mengetahui karakteristik oosit domba dari ovarium yang disimpan pada suhu dan periode penyimpanan yang berbeda. Ovarium dari rumah potong hewan dibagi menjadi tiga kelompok. Ovarium disimpan dalam larutan NaCl 0.9 % pada suhu 4 ˚C selama 2, 5-7, dan 8-10 jam; pada suhu 27-28 ˚C selama 2, 5-7, dan 8-10 jam; dan pada suhu 37-38 ˚C selama 2, 5-7, dan 8-10 jam. Pada setiap akhir periode penyimpanan, oosit dikoleksi dari ovarium dengan menggunakan metode penyayatan. Oosit kemudian diseleksi dan dibagi menjadi 4 (empat) kelompok yaitu kelompok A, B, C, dan D berdasarkan lapisan sel kumulus dan gambaran sitoplasmanya. Persentase oosit dengan kualitas A, B, C, dan D yang diperoleh dari ovarium yang disimpan pada suhu 4 ˚C tidak berbeda diantara kelompok perlakuan (P>0.05). Oosit dengan kualitas A dari ovarium yang disimpan pada suhu 27-28 ˚C selama 2 jam lebih tinggi dari pada oosit dari ovarium yang di simpan selama 5-7 dan 8-10 jam (P<0.05). Sedangkan oosit dengan kualitas B, C, dan D yang diperoleh dari ovarium yang disimpan pada suhu 27-28 ˚C tidak menunjukkan adanya perbedaan yang nyata diantara kelompok perlakuan (P>0.05). Oosit dengan kualitas A yang dikoleksi dari ovarium yang disimpan pada suhu 37-38 ˚C selama 2 jam sampai 5-7 jam penyimpanan ovarium (P>0.05) tidak berbeda, tetapi terjadi penurunan jumlah oosit dengan kulaitas A yang diperoleh setelah 8-10 jam penyimpanan (P<0.05). Oosit dengan kualitas B yang dikoleksi 5 jam setelah penyimpanan lebih tinggi daripada kelompok 2 dan 8-10 jam (P<0.05). Jumlah oosit dengan kualitas D meningkat seiring dengan lamanya waktu penyimpanan ovarium pada suhu 37-58 ˚C (P<0.05). Persentase jumlah oosit dengan kualitas A dan B tidak berbeda diantara kelompok perlakuan kecuali pada kelompok ovarium yang disimpan pada suhu 37-38 C selama 5 jam berbeda nyata dengan kelompok ovarium yang disimpan pada suhu 37-38 C selama 8-10 jam. Berdasarkan hasil penelitian ini dapat disimpulkan bahwa penyimpanan ovarium pada suhu 27-28 ˚C dan 37-38 ˚C selama 5-7 jam mampu mempertahankan kualitas oosit lebih baik dibandingkan dengan penyimpanan ovarium pada suhu 4 ˚C.
KARAKTERISTIK OOSIT DOMBA DARI OVARIUM YANG
DISIMPAN PADA SUHU DAN PERIODE WAKTU YANG
BERBEDA
DHIA MARDHIA ENGCONG
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul: Karakteristik Oosit Domba dari Ovarium yang Disimpan pada Suhu dan Periode Waktu yang Berbeda adalah benar-benar hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya-karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantum dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
ABSTRACT
DHIA MARDHIA ENGCONG. Characteristic of Sheep Oocytes from the Ovaries that was Store on Different Temperature and Different Period Of Time. Under direction of NI WAYAN KURNIANI KARJA.
The aim of the study was to investigate the characteristic of sheep oocytes from the ovaries that was stored on different temperature at a different period of time. Ovaries obtained from the slaughter house. The ovaries were then stored at 4 ˚C for the period of 2, 5-7 and 8-10 h, 27-28 ˚C for the 2, 5-7 and 8-10 h, and the third group was stored at 37-38 ˚C for 2, 5-7 and 8-10 h. At the end of the storage, the oocytes were collected from the ovaries using the slicing method. Collected oocytes were graded as A, B, C and D based on the layers of the cumulus cell and images of the cytoplasm. The percentage of the oocytes for grade A, B, C and D that was derived from the ovaries stored at 4 ˚C are no differ than the other group (P>0.05). The percentage of oocytes of A’s grade from the ovaries stored at the temperature of 27-28 ˚C for 2 hours were higher than the oocytes from the ovaries that were stored for 5-7 and 8-10 hours (P>0.05). Meanwhile the quantity of oocytes with the grade of B, C and D that was derived from the ovaries stored at the temperature of 27-28 ˚C did have not change compared to the other group(P>0.05). The quantity of oocytes with A’s grade that was derived from the ovaries that was kept at the temperature 37-38 ˚C for 2 hours and 5-7 hours (P<0.05) did not show any changes, however there are descending number of oocytes with the A’s grade that was derieved after 8-10 hours of storage (P<0.05). The number of oocytes with the B’s grade that was collected after 5-7 hours after storing was higher compared to those stored for 2 and 8-10 hours (P<0.05). The number of oocytes with the D’s grade is increasing parallel with the length of time for the storage at the temperature 37-38 ˚C (P<0.05). The percentage of the number of oocytes of the A and B’s grade did have not different among other group except for the group of ovaries stored at the temperature of 37-38 ˚C for 5-7 and 8-10 h. These result suggested that storing the ovaries at 27-28 ˚C and 37-38 ˚C for the duration of 5-7 hours preserve the quality of the oocytes better in compared to storing the ovaries at the temperature of 4 ˚C.
RINGKASAN
DHIA MARDHIA ENGCONG. Karakteristik Oosit Domba dari Ovarium yang Disimpan pada Suhu dan Waktu Berbeda. Dibimbing oleh NI WAYAN KURNIANI KARJA.
Penelitian ini bertujuan untuk mengetahui karakteristik oosit domba dari ovarium yang disimpan pada suhu dan periode penyimpanan yang berbeda. Ovarium dari rumah potong hewan dibagi menjadi tiga kelompok. Ovarium disimpan dalam larutan NaCl 0.9 % pada suhu 4 ˚C selama 2, 5-7, dan 8-10 jam; pada suhu 27-28 ˚C selama 2, 5-7, dan 8-10 jam; dan pada suhu 37-38 ˚C selama 2, 5-7, dan 8-10 jam. Pada setiap akhir periode penyimpanan, oosit dikoleksi dari ovarium dengan menggunakan metode penyayatan. Oosit kemudian diseleksi dan dibagi menjadi 4 (empat) kelompok yaitu kelompok A, B, C, dan D berdasarkan lapisan sel kumulus dan gambaran sitoplasmanya. Persentase oosit dengan kualitas A, B, C, dan D yang diperoleh dari ovarium yang disimpan pada suhu 4 ˚C tidak berbeda diantara kelompok perlakuan (P>0.05). Oosit dengan kualitas A dari ovarium yang disimpan pada suhu 27-28 ˚C selama 2 jam lebih tinggi dari pada oosit dari ovarium yang di simpan selama 5-7 dan 8-10 jam (P<0.05). Sedangkan oosit dengan kualitas B, C, dan D yang diperoleh dari ovarium yang disimpan pada suhu 27-28 ˚C tidak menunjukkan adanya perbedaan yang nyata diantara kelompok perlakuan (P>0.05). Oosit dengan kualitas A yang dikoleksi dari ovarium yang disimpan pada suhu 37-38 ˚C selama 2 jam sampai 5-7 jam penyimpanan ovarium (P>0.05) tidak berbeda, tetapi terjadi penurunan jumlah oosit dengan kulaitas A yang diperoleh setelah 8-10 jam penyimpanan (P<0.05). Oosit dengan kualitas B yang dikoleksi 5 jam setelah penyimpanan lebih tinggi daripada kelompok 2 dan 8-10 jam (P<0.05). Jumlah oosit dengan kualitas D meningkat seiring dengan lamanya waktu penyimpanan ovarium pada suhu 37-58 ˚C (P<0.05). Persentase jumlah oosit dengan kualitas A dan B tidak berbeda diantara kelompok perlakuan kecuali pada kelompok ovarium yang disimpan pada suhu 37-38 C selama 5 jam berbeda nyata dengan kelompok ovarium yang disimpan pada suhu 37-38 C selama 8-10 jam. Berdasarkan hasil penelitian ini dapat disimpulkan bahwa penyimpanan ovarium pada suhu 27-28 ˚C dan 37-38 ˚C selama 5-7 jam mampu mempertahankan kualitas oosit lebih baik dibandingkan dengan penyimpanan ovarium pada suhu 4 ˚C.
©
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
KARAKTERISTIK OOSIT DOMBA DARI OVARIUM YANG
DISIMPAN PADA SUHU DAN PERIODE WAKTU YANG
BERBEDA
DHIA MARDHIA ENGCONG
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Karakteristik Oosit Domba dari Ovarium yang Disimpan pada Suhu dan Periode Waktu yang Berbeda
Nama Mahasiswa : Dhia Mardhia Engcong
NIM : B04088022
Disetujui,
drh. Ni Wayan Kuniani Karja, MP. PhD Pembimbing
Diketahui,
drh. H. Agus Setiyono, MS. Ph.D, AVPVet Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Al-Hamdulillah, puji syukur yang tidak terhingga kepada Allah SWT atas rahmat Allahnya serta shalawat dan salam kepada Nabi Muhammad SAW, Penulis dapat menyelesaikan skripsi yang berjudul Karakteristik oosit domba dari ovarium yang disimpan pada suhu dan periode waktu yang berbeda sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Penulis menyadari bahwa skripsi ini tidak lepas dari bantuan berbagai pihak. Oleh karenanya dalam kesempatan ini Penulis mengucapkan terima kasih yang sebesar-besarnya kepada :
1. drh. Ni Wayan Kuniani Karja, MP. PhD sebagai dosen pembimbing yang telah memberikan pengarahan, bimbingan, saran, dan motivasi dari awal hingga tersusunnya skripsi ini.
2. Hibah bersaing no 15/13.24.4/SPP/PHB/2011 yang telah membiayai penelitian ini.
3. Orang tuaku tercinta (Engcong dan Siti Fatimah), adik-adikku tersayang (Dina, Dana, Dhiqan, Dini, Difa dan Izzan) atas doa dan dukungannya 4. Teman sepejuanganku Siti Astuti, kakak Ari dan kakak Fitra atas
bimbingannya.
5. Staf laboratorium Fertilisasi in vitro Fakultas Kedokteran Hewan
6. Sahabat-sahabatku yang sentiasa memberi semangat dan dukungan, (Kholis, Afifah, Hastin, Rika, Sri, kak Mimi, Ashley, Tizani, kak Nurul Aini, Aulia, Hani, Ibu Marni), serta seluruh sahabat Avenzoar 45.
Penulis menyadari bahwa skripsi ini jauh dari sempurna, untuk itu Penulis mengharapkan kritik dan saran yang membangun dari semua pihak. Penulis berharap agar skripsi ini bermanfaat bagi pihak-pihak yang membutuhkan, dan dapat menambah khazanah ilmu pengetahuan.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 6 Agustus 1989 di Kota Marudu, Sabah, Malaysia. Penulis merupakan anak pertama dari enam bersaudara dari pasangan Bapak Engcong bin Mawalil dan Ibu Siti Fatimah binti Abdullah.
Penulis menempuh pendidikan yang dimulai dari Tadika Khoi Ming selama tiga tahun (1993-1995) kemudian dilanjutkan ke Sekolah Rendah Jenis Kebangsaan Cina Khoi Ming (1996-2000), pada tahun 2001 pindah ke Sekolah Kebangsaan Tagaroh. Penulis melanjutkan pendidikan menengah pertama (SMP) dan Menengah atas (SMA) di Sekolah Menengah Kebangsaan Agama Johor Bahru (2002-2006). Pendidikan lanjutan penulis di Kolej Matrikolasi Labuan selama setahun (2007/2008). Penulis diterima menjadi mahasiswa di Institut Pertanian Bogor pada bulan Agustus 2008 melalui jalur SPMB, pada tahun berikutnya Penulis mendapat beasiswa Kerajaan Negeri Sabah dan diterima sebagai mahasiswa Kedokteran Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
vii
DAFTAR ISI
Halaman
DAFTAR ISI... ... vii
DAFTAR TABEL ... .. viii
DAFTAR GAMBAR ... .. ix
DAFTAR GRAFIK ... .... x
PENDAHULUAN Latar belakang... 1
Tujuan... 2
Hipotesis ... 2
Manfaat... 2
TINJAUAN PUSTAKA Domba... 3
Ovarium... 3
Oogenesis/ folikulogenesis... 3
Oosit ... 4
Transportasi Ovarium... 5
Faktor Suhu... 5
Faktor Waktu... 6
Koleksi oosit... 7
Pengelompokan oosit... 7
BAHAN DAN METODE Waktu dan Tempat... 9
Alat dan Bahan... 9
Koleksi Ovarium... 9
Koleksi Oosit... 9
HASIL DAN PEMBAHASAN...10
KESIMPULAN DAN SARAN...17
viii
DAFTAR TABEL
H
alamanTabel 1 Karakteristik oosit yang diperoleh dari ovarium domba setelah disimpan pada suhu 4 ˚C dengan periode waktu yang berbeda... 12
Tabel 2 Karakteristik oosit yang diperoleh dari ovarium domba setelah disimpan pada suhu 27-28 ˚C dengan periode waktu yang berbeda... 12
ix
DAFTAR GAMBAR
Halaman
Gambar 1 Ovarium domba dengan fase folikuler dan luteal... 11
1
PENDAHULUAN
Latar belakang
Ferilisasi in vitro (IVF) merupakan teknologi yang sedang berkembang
dengan pesat pada dekade terakhir ini. Fertillisasi in vitro merupakan pertemuan gamet jantan dan gamet betina di luar tubuh manusia maupun hewan. Teknologi
IVF adalah bagian dari teknologi in vitro production (IVP). Teknologi in vitro production meliputi in vitro maturation (IVM), in vitro fertilization (IVF) dan in vitro cultur (IVC). In vitro maturation merupakan proses pematangan oosit yang dikoleksi dari ovarium. Oosit yang mengalami pematangan akan dilanjutkan
dengan proses IVF untuk difertilisasi. Apabila oosit telah mengalami fertilisasi
dengan sel spermatozoa, hasil fertilisasi ini akan dilanjutkan dengan kultur in vitro
sebagai persiapan untuk ditransfer ke dalam uterus induk (Jemes et al. 2007; Wilburta et al. 2010).
Umumnya, munculnya teknologi reproduksi digunakan untuk memastikan
keberlangsungan dan keanekaragaman hayati suatu populasi dan spesies hewan
(Alvarez et al. 2009). Pada peternak ruminansia teknologi IVF digunakan untuk meningkatkan tingkat produksi hewan ternak dalam memenuhi kebutuhan pangan
yaitu sumber protein. Sebagai contoh, menurut Schatten dan Gheorghe (2007)
IVF dapat membantu meningkatkan tingkat kebuntingan sapi saat infertile. Begitu
juga jika sapi yang tidak dapat merespon hormon superovulasi, maka sapi dapat
bunting dengan mentransfer embrio hasil IVP pada uterus sapi.
Koleksi sel spermatozoa dan oosit merupakan hal penting dalam teknologi
IVF. Keberhasilan dari teknologi IVF sangat dipengaruhi oleh kualitas dari oosit
dan sel spermatozoa yang digunakan. Kualitas oosit ini sendiri sangat dipengaruhi
oleh penanganan mulai dari ovarium dikeluarkan dari tubuh hewan, selama proses
transportasi hingga sampai ke laboratorium dan saat dikoleksi hingga mengalami
proses maturasi (Choi et al. 2004). Oosit setelah maturasi mempunyai peranan penting terhadap keberhasilan IVF, untuk mendukung perkembangan oosit
menjadi embrio selanjutnya sampai menjadi satu keturunan.
Ovarium yang dikeluarkan dari tubuh hewan, umumnya tidak lagi
2
al. 2011). Kondisi iskemia dapat menyebabkan perubahan pada folikel, karena berkurangnya oksigen, akumulasi hasil metabolisme, berkurangnya glukosa dan
meningkatnya indeks apoptosis pada sel granulosa (Pedersen et al. 2004). Selain
itu, Schatten dan Gheorghe (2007) menyatakan bahwa oosit primer lebih sensitif
terhadap lingkungan, sehingga metode penanganan ovarium selama trasportasi
penting untuk dioptimalkan agar dapat menjaga kondisi oosit tetap baik. Oleh
karena itu, diperlukan penelitian untuk mengetahui kondisi optimum media
transportasi agar kualitas oosit tetap dapat dipertahankan untuk mendukung
keberhasilan IVM, IVF dan IVC.
Tujuan
Penelitian ini dilakukan untuk mengetahui karakteristik oosit domba dari
ovarium yang disimpan pada suhu dan periode penyimpanan yang berbeda
sehingga didapatkan suatu metode penyimpanan ovarium selama transportasi
yang mampu mempertahankan kualitas oosit domba.
Hipotesis
Suhu dan periode penyimpanan ovarium berpengaruh terhadap kualitas
oosit.
Manfaat
1. Hasil penelitian ini diharapkan dapat memberikan informasi tentang sistem
transportasi yang baik sehingga kualitas ovarium dan oosit dapat
dipertahankan secara optimal.
2. Hasil penelitian ini juga diharapkan dapat menjadi model untuk hewan langka
3
TINJAUAN PUSTAKA
Domba
Domba merupakan salah satu sumber protein yang semakin digemari oleh
penduduk Indonesia. Fenomena ini semakin terlihat dengan bertambahnya
warung-warung sate di pinggiran jalan, terutama jalan yang menuju puncak Bogor
dan beberapa tempat wisata di sekitar Bogor. Permintaan domba juga semakin
meningkat seiring dengan bertambahnya jumlah penduduk Indonesia, terutama
pada saat Idul Adha (Harianto 2010).
Ovarium
Ovarium adalah organ reprodusi betina yang terletak di ruang abdomen
seekor hewan. Pada domba bentuk ovarium seperti kacang almond. Ovarium
dapat bekerja sebagai organ eksokrin (menghasilkan sel telur) dan endokrin
(menghasilkan hormon) (Thomas & Joanna 2002). Ovarium dibagi menjadi dua
bagian, yaitu kortek dan medula. Sebagian besar ovarium didominasi oleh kortek.
Kortek dilapisi oleh simple squamous dan epitelium kuboid. Di bagian yang lebih
dalam terdapat jaringan yang tidak beraturan yang disebut tunika albuginea.
Tunika albuginea berhubungan dengan stroma ovarium yang terdiri dari jaringan
ikat longgar yang mengandung folikel dan korpus luteum. Sedangkan daerah
medula terdiri atas pembuluh darah, pembuluh limfe, saraf, jaringan ikat dan otot
polos (Schatten & Gheorghe 2007).
Pada saat fetus, ovarium menghasilkan oogonia melalui pembelahan
mitosis. Sekitar 1 (satu) juta oosit berkembang setelah fetus dilahirkan namun
hanya beberapa ratus oosit yang akan diovulasikan. Umumnya oosit akan
berkurang karena mengalami degenerasi dan atresia (Schatten & Gheorghe 2007).
Oogenesis dan Folikulogenesis
Oogenesis merupakan proses pembentukan gamet betina atau oosit. Proses
ini bersamaan dengan proses pembentukan folikel yang dikenal dengan
folikulogenesis. Folikel primodial yang telah terbentuk sewaktu di dalam
kandungan maupun setelah lahir akan terus berkembang dan mengalami
4
Pada saat hewan lahir, ovarium memiliki sejumlah folikel primodial yang
akan berkembang pada saat pubertas. Folikel ini mengandung oosit dengan inti
berada pada tahap profase dari pembelahan meiosis pertama (oosit primer).
Setelah pubertas, folikel primodial berkembang menjadi folikel primer.
Pembentukan folikel dibagi menjadi empat fase: primodial, primer, sekunder dan
tertier (Schatten & Gheorghe 2007). Follicle stimulating hormone (FSH) dilepaskan dari pituitari anterior untuk menstimuli perkembangan folikel primer
menjadi sekunder, tertier dan akhirnya mencapai bentuk folikel de Graaf (Colville
2002). Folikel primer terbentuk, dimulai dari sel epitel yang mengelilingi oosit
berubah bentuk dari pipih menjadi kuboid (Schatten & Gheorghe 2007). Awalnya,
sel folikel berhubungan erat dengan oosit, kemudian terbentuk zona pelusida yang
berasal dari suatu lapisan zat aseluler dan terdiri dari mukopolisakarida
diendapkan pada permukaan oosit (Thomas & Joanna 2002).
Sel folikel mulai berproliferasi dengan membentuk suatu lapisan seluler
yang tebal yang mengelilingi oosit. Selanjutnaya dibawah pengaruh gonadotropin
dari hipofise anterior, sel-sel folikel terus berkembang menjadi beberapa lapis
seluler hingga membentuk ruang-ruang yang disebut antrum folikel, ini dikenal
sebagai folikel sekunder (Gordon 2003). Folikel yang matang dikenal sebagai
folikel tertier, yang dikelilingi oleh dua lapisan jaringan ikat yaitu teka interna dan
teka externa. Teka interna adalah lapis bagian dalam yang menghasilkan estrogen
dan kaya dengan pembuluh darah sedangkan teka eksterna adalah lapis luar yang
beransur-ansur akan bersatu dengan stroma ovarium. Antrum folikel akan terus
bertambah besar seiring dengan perkembangan folikel tertier sampai menjelang
ovulasi. Pada saat ini folikel terteir disebut folikel de Graaf (Thomas & Joanna
2002).
Oosit
In vitro maturation (IVM) adalah suatu proses yang perlu dilalui oleh oosit agar oosit mengalami perubahan struktur dan biokimiawi menjadi fase metaphase
II melalui pembelahan miosis secara in vitro (Anthony et al. 2011). Umumnya oosit yang dikoleksi dari ovarium adalah oosit primer, oleh karena itu diperlukan
suatu proses kultur yang dikenal dengan nama IVM (Gordon 2003). Kualitas oosit
5
dipengaruhi oleh banyak faktor diantaranya adalah kondisi donor, transportasi
ovarium, seleksi folikel dan IVM (Wang et al. 2011). Kualitas oosit yang digunakan untuk proses maturasi in vitro akan sangat mempengaruhi keberhasilan
IVF selanjutnya. Jika salah satu dari faktor-faktor tersebut tidak ditangani dengan
baik dapat menyebabkan abnormalitas pada hasil IVF dan pembentukan embrio.
Transportasi ovarium merupakan tahap awal dari porses produksi embrio secara in
vitro yang menjadi faktor penting karena dapat mempengaruhi kualitas oosit. Penanganan pada ovarium terdiri dari tiga faktor, yaitu faktor suhu, faktor waktu
dan medium penyimpanan (Gordon 2003). Ketiga faktor ini penting karena
penyimpanan ovarium tanpa suplai darah dapat menurunkan kualitas oosit.
Transportasi ovarium
Transportasi ovarium menuju laboratorium dalam keadaan tidak
mendapatkan suplai darah menyebabkan berkurangnya suplai oksigen dan energi.
Keadaan ini disebut iskemia dan kondisi re-oxygenation (Wang et al. 2011). Metabolisme jaringan yang tidak mendapat suplai oksigen akan berubah kondisi
aerobic menjadi anaerobic dengan hasil metabolismenya adalah asam laktat yang terakumulasi diantara sel (Petrucci et al. 2010). Selain itu, adenosine triphosphate
(ATP) yang dipecahkan tanpa disintesa akan menghasilkan sisa metabolik yaitu
fosfor inorganik. Fosfor yang berinteraksi dengan air akan menjadi asam fosfor,
dimana apabila terjadi akumulasi asam fosfor dan asam laktat akan menyebabkan
terjadinya penurunan pH (Petrucci et al. 2010). Penurunan pH yang disebabkan oleh akumulasi ion H+. Ion H+ yang terakumulasi pada ovarium akan merembes
keluar masuk ke dalam cairan folikular dan menginduksi terjadinya asidosis pada
lingkungan sekitar oosit (Wongsrikaeo et al. 2005). Banyak faktor yang dapat mempengaruhi kualitas oosit selama tranposrtasi ovarium dari rumah potong
hewan sampai oosit dikoleksi koleksi, diantaranya adalah lama periode dan suhu
selama transportasi (Gordon 2003).
Faktor Suhu
Metabolisme sel menurun pada suhu yang lebih rendah dari suhu tubuh
6
mengganggu viabilitas oosit, maturasi, fertilisasi dan perkembangan embrio
setelah IVF. Pada suhu yang tinggi dan periode yang lama dapat meningkatkan
fragmentasi DNA yang diinduksi oleh cairan folikular (Wongsrikaeo et al. 2005).
Banyak penelitian sudah dilakukan pada berbagai spesies yang mengkaji faktor
suhu penyimpanan selama transportasi ovarium dengan hasil yang bervariasi.
Padersen et al. (2004) melaporkan bahwa, ovarium kuda yang disimpan pada suhu
35-37 ˚C dalam waktu kurang dari dua jam masih mempunyai oosit dengan
kualitas yang bagus. Pada babi, Wongsrikaeo et al. (2005) melaporkan bahwa, ovarium babi dapat disimpan pada suhu diantara 25 ˚C hingga 35˚C dalam waktu
enam jam.
Oosit kuda yang dikoleksi segera setelah disembelih mempunyai perbedaan
maturasi yang signifikan dengan oosit yang disimpan pada suhu ruang dan suhu
4 ˚C selama 24 jam (Pedersen et al. 2004). Oosit kuda terpapar pada suhu 35-37
˚C selama 2 jam mempunyai tingkat apoptosis yang tinggi pada sel granulosa dibanding dengan oosit kuda yang terpapar suhu 20 ˚C dan 30 ˚C selama 2 jam
(Pedersen et al. 2004).
Faktor Waktu
Persentase degenerasi oosit meningkat seiring dengan bertambahnya
waktu (Wongsrikaeo. et al. 2005). Pada oosit yang dikoleksi segera setelah disembelih mempunyai kumulus yang expand dan Metaphase II yang lebih baik daripada oosit yang dikolesi selama 15-18 jam pada suhu kamar dan 4 ˚C (Love et
al. 2003). Ovarium babi yang disimpan selama 0-3 jam pada suhu 35 ˚C
menunjukkan kompetensi perkembangan oosit yang lebih baik dibanding
penyimpanan selama 6, 9 dan 12 jam pada suhu 35 ˚C (Wongsrikaeo et al. 2005).
Pada oosit sapi yang terpapar pada suhu rendah selama 48 jam dapat
menyebabkan degenerasi yang tidak diketahui faktor re-programnya (Matsushita
et al. 2004). Sedangkan pada oosit kucing dengan penyimpanan ovarium pada suhu 4 ˚C, diatas 24 jam dan kurang dari 48 jam masih mampu untuk pematangan
secara in vitro (Mihat et al. 2009). Berbeda pada kuda faktor waktu amat berpengaruh untuk mempertahankan morphologi dari kumulus oophorus, ovarium
kuda perlu disimpan pada suhu di antara 35-37 ˚C dan sebaiknya kurang dari 2
7
Koleksi oosit
Oosit dapat dikoleksi dengan dua cara yaitu dengan laparoskopi maupun
mengambil ovarium yang berasal dari rumah potong hewan. Laparoskopi
merupakan metode pengambilan ovarium dengan menggunakan endoskopi,
namun metode ini memerlukan biaya yang sangat mahal, tidak efisien dan
berisiko untuk terjadi infertile pada hewan tersebut (Schatten & Gheorghe 2007).
Cara yang kedua adalah dengan memperoleh oosit dari ovarium yang berasal dari
rumah potong hewan yang masih potensial untuk dimanfaatkan (Herdis 2000).
Ovarium yang diambil dari rumah potong hewan juga merupakan langkah yang
ekonomi untuk produksi embrio secara in vitro (Naowshari 2005).
Koleksi oosit dari ovarium yang berasal dari rumah potong hewan atau
dari hewan yang sudah mati dapat dilakukan dengan tiga metode, yaitu dengan
cara dissecting pada folikel, aspirasi dan menyayat. Metode aspirasi menggunakan
syringe, biasanya digunakan pada ovarium sapi, kerbau dan kuda karena ukuran ovarium dan folikelnya lebih besar sehingga mudah diaspirasi. Koleksi oosit
dengan metode ini dapat dilakukan 3 kali lebih cepat daripada dissecting, namun tingkat kerusakan pada folikel juga tinggi. Metode dissecting sering digunakan pada koleksi oosit domba (Gordon 2003). Sedangkan metode penyayatan
dilakukan dengan meletakkan ovarium di dalam cawan petri yang berisi cairan
saline, lalu dengan menggunakan pisau bedah permukaan ovarium diiris-iris untuk melepaskan oosit dari folikel (Wang et al. 2007). Metode ini dapat mengkoleksi lebih banyak oosit daripada menggunakan metode aspirasi. Metode
ini banyak digunakan pada domba dan kambing, namun metode ini membutuhkan
waktu 3 kali lebih lama daripada metode aspirasi pada satu ovarium (Gordon
2003).
Pengelompokan Oosit
Wood dan Wildt (1997) dan Gordon (2003) mengelompokkan oosit menjadi
4 kelompok yaitu, A, B, C dan D. Kelompok A adalah oosit yang mempunyai
kumulus yang kompak serta multilayer dan mempunyai sitoplasma yang homogen. Kelompok B adalah oosit yang mempunyai kumulus yang kompak,
sitoplasma yang homogen, namun jumlah kumulus oophorus kurang dari lima
8
pelusida masih terlihat jelas, namun sitoplasma yang semakin pudar. Kelopok D
adalah oosit dengan kumulus sudah mulai hilang dan tidak beraturan, zona
pelusida tidak kelihatan atau kelihatan sebagian dan sitoplasma semakin pudar.
Karja (2008) mengelompokkan oosit babi menjadi tiga kategori. Kategori
pertama, oosit mempunyai lebih dari lima lapis sel cumulus yang kompak,
sitoplasma yang homogen. Kategori kedua, oosit dikelilingi dengan kumulus yang
kurang kompak dan ketegori ketiga memperlihatkan sitoplasma yang tidak
beraturan.
Pengelompokkan oosit tersebut bertujuan untuk memisahkan oosit yang
berkualitas bagus dengan oosit yang berkualitas jelek. Menurut Wood dan Wildt
(1997) melaporkan pentingnya untuk megelompokkan oosit kucing dalam proses
in vitro untuk mencapai keberhasilan dalam proses maturasi, fertilisasi selanjutnya perkembangan embrio. Selanjutnya Karja (2008) melaporkan bahwa oosit babi
dengan kualitas bagus (kategori satu dan kategori dua) yang mempunyai kumulus
yang kompak dan sitoplasma yang homogen dapat mendukung maturasi nuklear
lebih baik berbanding kategori 3. Kategori 3 dengan oosit yang kurang kompak
menunjukkan hasil maturasi yang jelek dengan oosit yang mengalami atresia dan
9
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di laboratorium Fertilisasi In Vitro, Bagian Reproduksi
dan Kebidanan, Departement Klinik, Reproduksi dan Patologi, Fakultas
Kedokteran Hewan. Ovarium yang digunakan diambil dari Rumah Potong
Hewan kambing/domba, Kampung Cikanyong Desa Citaringgul Kecamatan
Babakan Madang, Kabupaten Bogor. Penelitian ini berlangsung selama 1 bulan
lebih, mulai tanggal 8 Juli 2011 hingga 17 Agustus 2011.
Alat dan bahan
Alat yang digunakan adalah termos, cooler box, termometer, kantong plastik
(8x5cm), blade, cawan petri, pinset, mikroskop Nikon SMZ800, penangas air dan
pipet sedot. Bahan yang digunakan adalah ovarium, NaCL fisiologi, phosphate buffer saline (PBS), dan es.
Koleksi Ovarium
Jumlah ovarium yang dikoleksi untuk sekali pengambilan rata-rata 10-15
pasang. Ovarium yang diperoleh dibagi sama rata menjadi tiga kelompok, untuk
disimpan pada suhu dan periode waktu yang beda. Ovarium disimpan dalam
larutan NaCl 0.9 % pada suhu 4˚C selama 2 jam, 5-7 jam, dan 8-10 jam; pada
suhu suhu 27-28 ˚C selama 2 jam, 5-7 jam, dan 8-10 jam; dan pada suhu 37-38 ˚C
selama 2 jam, 5-7 jam, dan 8-10 jam.
Koleksi Oosit
Pada akhir periode penyimpanan, oosit dikoleksi dari ovarium dengan
menggunakan metode penyayatan. Penyayatan dilakukan dengan mengiris-iris
bagian permukaan ovarium untuk melepaskan oosit dari folikel. Medium yang
digunakan untuk proses ini adalah phosphate buffer saline (PBS). Oosit yang telah
dikoleksi, kemudian diseleksi menjadi 4 (empat) kelompok yaitu kelompok A, B,
C, dan D berdasarkan lapisan sel kumulus dan gambaran sitoplasmanya menurut
Wood & Wildt (1997) dan Gordon (2003). Oosit dikelompokkan ke dalam
kelompok A jika dilapisi oleh lebih dari lima lapis sel kumulus dengan sitoplasma
10
oleh kurang dari lima lapis sel kumulus dengan sitoplasma yang homogen dan
berwarna hitam. Kelompok C masih terlihat sedikit kumulus, zona pelusida masih
terlihat dan sitoplasma yang sudah tidak homogen. Kelompok D adalah oosit yang
mempunyai sitoplasma transparan, zona pelusida terlihat saparuh atau tidak ada
dan kumulus oophorus hampir hilang atau hilang .
Pengulangan dilakukan sebanyak 5 kali. Oosit yang telah dikelompokkan
dirata-rata dan dipersentasikan kemudian dianalisa menggunakan dua varian
ANOVA dengan perlakuan suhu (4 ˚C, 27-28 ˚C, dan 37-38 ˚C) dan faktor waktu
(2 jam, 5 jam dan 8 jam). Huruf a dan b merupakan indikator jika terdapat
11
HASIL DAN PEMBAHASAN
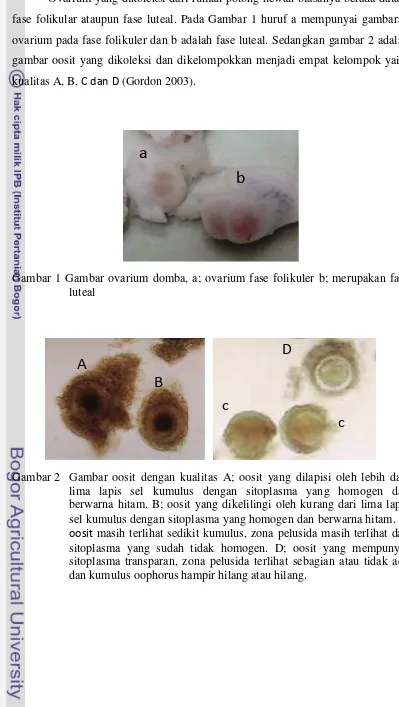
Ovarium yang dikoleksi dari rumah potong hewan biasanya berada dalam
fase folikular ataupun fase luteal. Pada Gambar 1 huruf a mempunyai gambaran
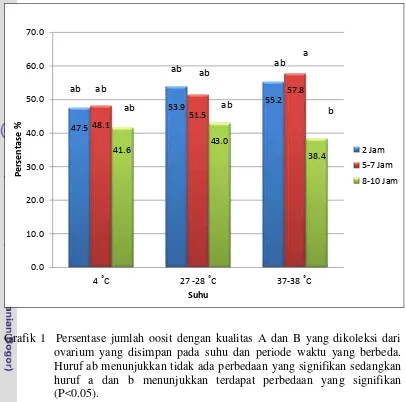
ovarium pada fase folikuler dan b adalah fase luteal. Sedangkan gambar 2 adalah
gambar oosit yang dikoleksi dan dikelompokkan menjadi empat kelompok yaitu
kualitas A, B, C dan D (Gordon 2003).
a
b
Gambar 1 Gambar ovarium domba, a; ovarium fase folikuler b; merupakan fase luteal
A
B
c
c
D
Gambar 2 Gambar oosit dengan kualitas A; oosit yang dilapisi oleh lebih dari lima lapis sel kumulus dengan sitoplasma yang homogen dan berwarna hitam. B; oosit yang dikelilingi oleh kurang dari lima lapis sel kumulus dengan sitoplasma yang homogen dan berwarna hitam. C;
oosit masih terlihat sedikit kumulus, zona pelusida masih terlihat dan
12
Tabel 1 Karakteristik oosit yang diperoleh dari ovarium domba setelah disimpan
pada suhu 4˚C dengan periode waktu yang berbeda.
Kelompok
Jumlah Oosit
Jumlah Oosit dengan Kualitas (% ± SD)
A B C D
2 jam 242 45(18,6 ± 5,3) 70(28,9 ± 7,6) 95(39,3 ± 9,9) 32(13,2 ± 11,1)
5-7 jam 293 56(19,1 ± 13,1) 85(29,0 ± 9,8) 100(34,1 ± 13,6) 52(17,8 ± 11,7)
8-10 jam 291 36(12,4 ± 14,1) 85(29,2 ± 8,9) 108(37,1 ± 9,5) 62( 21,3 ± 11,7) Keterangan: A, B, C, dan D adalah pengelompokan oosit berdasarkan Gordon (2003).
Data pada Tabel 1 merupakan hasil yang diperoleh dari ovarium yang
ditransport pada suhu 4 ˚C dengan waktu penyimpanan yang berbeda. Persentase
oosit yang diperoleh berdasarkan lapisan sel kumulus dan gambaran
sitoplasmanya (kualitas A, B, C, dan D) tidak berbeda diantara kelompok
penyimpanan ovarium (P>0,05).
Tabel 2 Karakteristik oosit yang diperoleh dari ovarium domba setelah disimpan
pada suhu 27-28 ˚C dengan waktu yang berbeda.
Kelompok
Jumlah Oosit
Jumlah Oosit dengan Kualitas (% ± SD)
A B C D
2 jam 180 45(25,0±1,8) a 52(28,9 ± 7,4) 47(26,1 ± 10,9) 35(19,4 ± 4,7)
5-7 jam 206 35(17,0 ± 3,5) b 35(34,5 ± 13,1) 69(33,5 ± 6,4) 31(15,1 ± 11,3)
8-10 jam 263 36(13,7 ± 8,2) b 36(29,3 ± 9,0) 86(32,7 ± 14,1) 64(24,3 ± 13,7) Keterangan: A, B, C, dan D adalah pengelompokan oosit berdasarkan Gordon (2003).
: ᵃ ᵇ Nilai yang mempunyai perbedaan yang signifikan dalam satu kolom yang sama (p<0,05)
Tabel 2 menyajikan oosit yang diperoleh dari ovarium yang ditransport
atau disimpan pada suhu 27-28 ˚C dari rumah potong hewan sampai oosit
dikoleksi. Dari kelompok perlakuan ini, diperoleh oosit dari ovarium yang
disimpan selama 2 jam dengan kualitas A lebih tinggi daripada oosit yang
diperoleh dari ovarium yang disimpan pada suhu yang sama selama 5-7 dan 8-10
jam (P<0,05). Sedangkan oosit dengan kualitas B, C, dan D yang diperoleh tidak
menunjukkan adanya perbedaan yang nyata diantara kelompok perlakuan
13
Tabel 3 Karakteristik oosit yang diperoleh dari ovarium domba setelah disimpan
pada suhu 37-38 ˚C dengan periode waktu yang berbeda.
Kelompok
Jumlah Oosit
Jumlah Oosit dengan Kualitas (% ± SD)
A B C D
2 jam 180 58(27,6 ± 1,7) a 58(27,6 ± 4,5) a 60(28,6 ± 3,8) 34(16,2 ± 4,0) a
5-7 jam 206 48(22,5 ± 8,8) a 75(35,2 ± 2,1) b 68(31,9 ± 13,8) 22(10,3± 7,8) a
8-10 jam 263 39(13,4 ± 6,0) b 73(25,0 ± 4,1) a 105(36,0 ± 12,6) 75(25,7 ± 6.5) b Keterangan: A, B, C, dan D adalah pengelompokan oosit berdasarkan Gordon (2003).
: ᵃ ᵇ Nilai yang mempunyai perbedaan yang signifikan dalam satu kolom yang sama (P<0,05)
Tabel 3 menyajikan oosit yang diperoleh dari ovarium yang ditransport atau
disimpan pada pada suhu 37-38 ˚C dengan waktu yang berbeda. Berdasarkan
kualitas oosit yang diperoleh, oosit dengan kualitas A yang dikoleksi dari ovarium
2 jam dan 5-7 jam penyimpanan ovarium (P>0,05) tidak berbeda, tetapi kemudian
terjadi penurunan jumlah oosit dengan kulaitas A yang diperoleh setelah
penyimpanan 8-10 jam (P<0,05). Oosit dengan kualitas B yang dikoleksi 5-7 jam
setelah penyimpanan lebih tinggi dari pada kelompok 2 dan 8-10 jam (P<0,05).
Tidak ditemukan adanya perbedaan jumlah oosit dengan kualitas C yang
diperoleh pada penelitian ini. Sedangkan jumlah oosit dengan kualitas D
meningkat seiring dengan lamanya waktu penyimpanan ovarium pada suhu
37-38 ˚C (P<0,05).
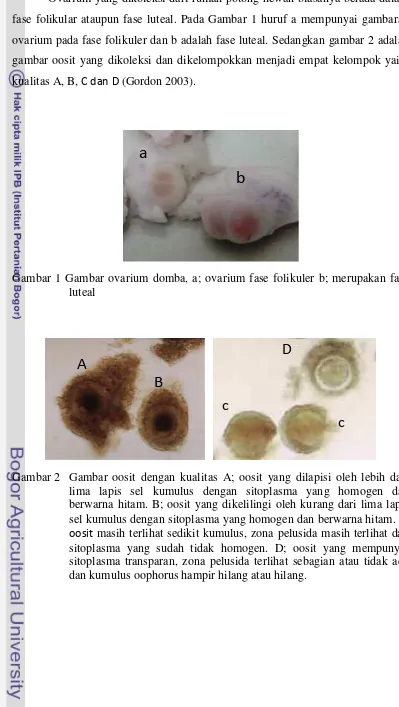
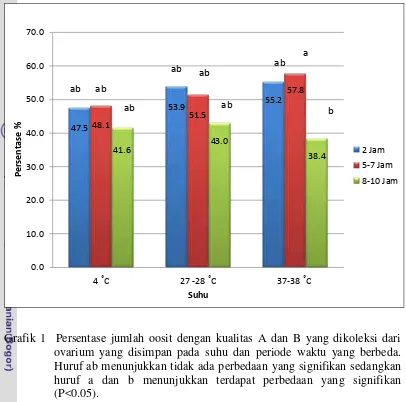
Grafik 1 menyajikan persentase jumlah oosit dengan kualitas A dan B yang
merupakan oosit yang sering dipakai untuk proses produksi embrio in vitro (Gordon 2003). Dari data ini diperoleh bahwa jumlah oosit dengan kualitas A dan
B tidak berbeda diantara kelompok perlakuan kecuali pada kelompok ovarium
yang disimpan pada suhu 37-38 ˚C selama 5-7 jam berbeda nyata dengan
14 47.5 53.9 55.2 48.1 51.5 57.8 41.6 43.0 38.4 0.0 10.0 20.0 30.0 40.0 50.0 60.0 70.0
˚C 27 - 8 ˚C 37- 8 ˚C
P e r sen ta se % Suhu 2 Jam 5-7 Jam 8-10 Jam ab ab ab ab ab ab ab a b
Grafik 1 Persentase jumlah oosit dengan kualitas A dan B yang dikoleksi dari ovarium yang disimpan pada suhu dan periode waktu yang berbeda. Huruf ab menunjukkan tidak ada perbedaan yang signifikan sedangkan huruf a dan b menunjukkan terdapat perbedaan yang signifikan (P<0.05).
Transportasi ovarium dari rumah potong hewan atau dari tempat dimana
hewan tersebut mati tanpa suplai darah dapat menyebabkan penurunan kualitas
oosit (Wongsrikeao et al. 2005). Berhentinya suplai darah pada ovarium menyebabkan terjadi perubahan metabolisme sel dari areobic menjadi anaerobic.
Pada kondisi anaerobic metabolisme sel-sel ovarium akan menghasilkan asam laktat dan asam fosfor yang banyak. Akumulasi asam laktat dan asam fosfor akan
meningkatkan jumlah ion H+. Ion H+ ini mudah masuk ke dalam pori membran
plasma oosit sehingga kondisi oosit (sitoplasma) lebih asam berbanding
lingkungan sekitarnya. Kondisi asam ini menyebabkan kerusakan pada oosit,
15
dan waktu transportasi ovarium yang tepat sangat diperlukan untuk dapat
mempertahankan kualitas oosit (Choi et al. 2004).
Ovarium yang disimpan pada suhu dingin (4 ˚C) merupakan salah satu
metode yang dipakai untuk memperlambat kerja metabolisme selular sehingga
akumulasi asam dapat dihambat sampai dalam waktu tertentu. (Petrucci et.al 2010). Berdasarkan hasil yang diperoleh pada tabel 1, oosit dengan kualitas A, B,
C, dan D tidak menunjukkan perbedaan yang signifikan diantara kelompok
perlakuan, yaitu penyimpanan suhu 4 C pada suhu 2, 5-7, 8-10 jam. Pada
penelitian ini, pengaruh penyimpanan pada suhu 4 ˚C selama 8-10 jam mungkin
menyebabkan metabolisme sel-sel ovarium dan oosit dapat diturunkan sehingga
menurunkan kebutuhan oksigen dan menghemat energi (Taylor 2006). Mithat et al. (2009) melaporkan bahwa ovarium kucing yang disimpan selama 2 jam dan 24 jam pada suhu 4 ˚C tidak menunjukkan perbedaan yang signifikan terhadap
kemampuan oosit untuk mencapai fase metaphase II secara in vitro,
kemampuannya baru menurun setelah disimpan selama 48 jam. Penelitian pada
kuda (Love et al. 2003), anjing (Lee et al. 2006) dan babi (Yuge et al. 2003) menunjukkan tidak adanya perbedaan yang signifikan terhadap kemampuan oosit
untuk mengalami maturasi oosit yang diperoleh setelah disimpan pada suhu 4 ˚C
selama 2 hingga 24 jam. Hal ini berbeda dengan yang dilaporkan oleh Carvalho et
al. (2001) dan Ozen et al. (1996) yang menyatakan bahwa oosit domba lebih rentan terhadap suhu dingin karena membran lipid pada oosit yang tidak mampu
bertahan pada suhu dingin. Paparan terhadap suhu dingin dapat menyebabkan
hilangnya integritas dari membran oosit (Wongsrikeao et al. 2005). Penyimpanan
pada suhu dingin juga dapat menyebabkan terjadinya pengerasan zona pelusida
sehingga mengurangi kemampuan oosit untuk difertilisasi (Parks & Ruffing,
1992).
Suhu ruang (27-28 ˚C) dalam penelitian ini digunakan sebagai kontrol dan
sebagai upaya untuk mengantisipasi apabila di lapangan tidak tersedia es dan air
hangat. Dari data yang diperoleh, pada tabel 2, memperlihatkan perbedaan yang
signifikan pada kelompok oosit dengan kualitas A dengan perbedaan waktu
penyimpanan. Persentasi jumlah oosit dengan qualitas A lebih tinggi pada
16
(14 %). Perdesen et al. (2004) melaporkan bahwa penyimpanan ovarium kuda pada suhu ruang selama 3 jam pertama setelah hewan disembelih tidak terjadi
apoptosis pada sel granulosa, tetapi setelah penyimpanan 5 jam sudah terjadi
apoptosis granulosa sel sebesar 22 % dan terjadi sebesar 78 % pada penyimpanan
ovarium selama 24 jam. Begitu juga halnya pada penelitian ini, oosit dengan
kualitas A yang dikoleksi berkurang dengan bertambahnya waktu penyimpanan
ovarium. Pada penelitian terhadap folikel tikus juga memperlihatkan, gambaran
apoptosis yang terjadi secara progresif seiring bertambahnya waktu penyimpanan.
Selain dari pengaruh apoptosis, jumlah oosit tanpa sel kumulus bertambah dan
kekompakan kumulus oosit berkurang seiring bertambahnya waktu (Perdesen et al. 2004).
Penyimpanan ovarium pada suhu 37-38 ˚C sering digunakan karena suhu ini
mendekati suhu tubuh hewan. Blondin dan Sirard (1995) melaporkan bahwa
penyimpanan ovarium pada suhu 30 ˚C selama 3 hinggga 4 jam dapat
meningkatkan kompetensi perkembangan oosit untuk mencapai fase metaphase II
secara in vitro. Data pada penelitian ini menunjukkan bahwa oosit dengan kualitas
A dan B yang dikoleksi dari ovarium yang disimpan pada suhu 27-28 C dan
37-38 ˚C menunjukkan kencendrungan lebih tinggi selama 2 dan 5-7 jam
penyimpanan daripada penyimpanan 4 C. Menurut Febretrisiana (2012),
lingkungan mikro yang baik pada folikel dapat diciptakan pada 4 jam setelah
pemotongan. Lingkungan mikro ini menyerupai kondisi di dalam tubuh hewan
pada saat terjadi proses preovulatori folikel (sebelum terjadi proses ovulasi). Akan
tetapi, penyimpanan pada suhu ini lebih dari 8 jam menyebabkan penurunan
perolehan oosit dengan kualitas A dan B dan terjadi peningkatan jumlah oosit
dengan kualitas D seiring dengan lama waktu penyimpanan ovarium. Setelah 4
jam lingkungan penyimpanan oosit tidak lagi mampu mendukung kebutuhan
sel-sel untuk mendapatkan nutrisi dimana kemudian akan menyebabkan kondisi
anaerobic. Akumulasi asam dan peningkatan ion-ion akan menyebabkan perubahan pH dan osmolalitas membran selular menjadi permeable, sehingga masuknya air ke dalam intrasel yang menyebabkan degenerasi sel-sel oosit
17
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian ini dapat disimpulkan bahwa penyimpanan
ovarium pada suhu suhu 27-28 ˚C dan 37-38 ˚C selama 5-7 jam mampu
mempertahankan kualitas oosit lebih baik dibandingkan dengan penyimpanan ovarium pada suhu 4˚C.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengetahui kemampuan oosit
dengan kualitas A dan B dari setiap kelompok perlakuan pada penelitian
mencapai fase metaphase II dan mengetahui kemampuan oosit-oosit tersebut
18
DAFTAR PUSTAKA
Alvarez GM, Dalvit GC, Achi MV, Miguez MS, Cetica PD. 2009. Immature oocyte quality and maturational competence of porcine cumulus-oocyte complexes subpopulations. Biocell 33: 3.
Anthony A, Robert L, James T, Robert N. 2011. Prinsiple of Regenerative Medicine. 2th edition. Sun Diego USA: Elservier Incc.
Blondin P, Sirard MA. 1995. Oocyte and folikular morphologi as determing charecteristics for developmental competence in bovine oocyte. Mol. Reprod Dev 1. 54-62.
Carvalho FCA et al. 2001. Effect of Braun-Collin and Saline solution at the different temperature and incubation time on the quality of goat preantral follicles preserved in situ. Animl Reprod Sci 66: 195-20. Choi YH, Roasa LM, Love CC, Brinsko SP, Hinrichs K. 2004. Blastocyts
formation rates in vivo and in vitro- maturation equine oocyts fertilized intracytoplasmic sperm injection. Boil Reprod 70: 1231-1238.
Febretrisiana A, 2012, Kompetisi perkembangan oosit domba dengan penyimpanan ovarium pada suhu dan waktu berbeda. [thesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Gordon. 2003. Laboratory of production cattle embryo 2nd Edition. Cromwell Press: Trowbridge.
Hafez ESE. 2000. Reproduction In Animals. 7th Ed. Lea and Fibiger. Philadelphia Harianto B, Tim penulis MT Farm, 2010. Buku Pintar Beternak dan Bisnis
Domba. PT AgroMedia Pustaka. Jakarta.
Herdis. 2000. Pemanfaatan Ovarium Sebagai Limbah Rumah Potong Hewan Untuk Meningkatkan Populasi Ternak Melalui Teknik Fertilisasi In Vitro. J Sains Tekn Indo 2: 1-7.
James GF et al. 2007. The Mouse In Bio Medicle Research. 2th edition. London: Elserier. Inc.
Juengel JL et al. 2000. Gene Expression in Abnormal Ovarian Structures of Ewes Homozygous for the Inverdale Prolificacy Gene. Bio Reprod 62: 1467–1478.
Karja NWK. 2008. Nuclear Maturation of Porsine Oocytes in vitro: Effect of the Cumulus-Oocytes Complexes Quality. Indo J Biotec 3(2):1078-1084. Lee HS, Yin XJ, Kong IJ. 2006. Sensitivity of canine oocytes to low temperature.
Theriogenology 66: 1468-1470.
Love LB, Choi YM, Love CC, Varner DD, Hinrichs K, 2003. Effect of ovary storage adn oocyte transport method on maturation rate of horse oocytes. Theriogenology 59: 756-774.
19
Mithat E et al. 2009. Devolopmental competence of domestic cat oosit from ovaries at varius duration at 4˚C temperature. Anim Reprod Sci 166:169-172.
Noawshari MA. 2005. The effect of harvesting technique on efficiency of oocyte collection and different maturation media on the nuclear maturation of oocytes in camels (Camelus dromedarius). Theriogenology 63 : 2471– 248.
Ozen B et al. 2006. Effect of different transport temperatures of cattle and sheep ovaries on in vitro maturation of oocytes. Medycyna Wet 62:2.
Ozen BJK, Catts.L, Treland A, Maxwell WMC, Evan G. 1997. In vitro and in vivo developmental capasititu of oocyte from preouberal and adult sheep. Theriogenology 47: 1433-1443.
Padersen HG, Elaine D. Waatson, Evelyn E. 2004. Effect of ovary holding temperature and time on equine granulose cell apoptosis, oocyte chromatin configuration and cumulus morphology. Theriogenology 62: 468-480.
Parks JE, Ruffing NA, 1992. Factor effecting low temperature survival of mammalian oocytes. Theriogenology. 37: 59-73.
Petrucci RH, Herring FG, Madura JD. 2010 General Chemistry Prinsiple and modern Application 10 edition. Person.
Preis KA et al. 2004. In vitro maturation and transfer of equine oocytes after transport of ovarian at 12 or 22˚C. Theriogenology 61: 1215-122. Schatten H, Gheorghe M. 2007. Comparative Reproductive Biology. Blackwell
Publishing. USA
Sirad MA, Blondin P. 1996. Oocyte maturation and IVF in Cattle. Anim Reprod Sci. 42: 417-426.
Taylor MJ. 2006. Biology of cell survival in the cold: The basis for boopreservation of tissues and organs. CRC-Taylor & Francis. pp.15-62.
Thomas C, Joanna MB. 2002. Clinical Anatomy & Fisiologi for Veterinary technicians.. United State of America: Mosby, Inc.
Wang YS et al. 2011. Lowering storage temperature during ovary transport is beneficial to the developmental competence of bovine oocytes used for somatic cell nuclear transfer. Anim Reprod Sci 124 ; 48–54.
Wilburta QL, Marilyn SP, Carol DT, Barbara MD. 2010. Delmar’s Comprehensive Medical assisting: administration and Clinical Competencies 4th edition. NY USA: Nelson Education Lth.
Wongsrikeao P et al. 2005. Effect of Ovary Storage Time and Temperature on DNA Fragmentation and Development Of Porcine Oocytes. J Reprod Dev 51: 1.
Wood TC, Wildt DE. 1997. Effect of the quality of the cumulus-oocyte complex in the domestic cat on the ability of oocytes to mature, fertilize and develop into blastocysts in vitro. J Reprod Fertil 110: 355-360. Yuge M et al. 2003. Effects of Cooling Ovaries Before Oocyte Aspiration On
1
PENDAHULUAN
Latar belakang
Ferilisasi in vitro (IVF) merupakan teknologi yang sedang berkembang
dengan pesat pada dekade terakhir ini. Fertillisasi in vitro merupakan pertemuan gamet jantan dan gamet betina di luar tubuh manusia maupun hewan. Teknologi
IVF adalah bagian dari teknologi in vitro production (IVP). Teknologi in vitro production meliputi in vitro maturation (IVM), in vitro fertilization (IVF) dan in vitro cultur (IVC). In vitro maturation merupakan proses pematangan oosit yang dikoleksi dari ovarium. Oosit yang mengalami pematangan akan dilanjutkan
dengan proses IVF untuk difertilisasi. Apabila oosit telah mengalami fertilisasi
dengan sel spermatozoa, hasil fertilisasi ini akan dilanjutkan dengan kultur in vitro
sebagai persiapan untuk ditransfer ke dalam uterus induk (Jemes et al. 2007; Wilburta et al. 2010).
Umumnya, munculnya teknologi reproduksi digunakan untuk memastikan
keberlangsungan dan keanekaragaman hayati suatu populasi dan spesies hewan
(Alvarez et al. 2009). Pada peternak ruminansia teknologi IVF digunakan untuk meningkatkan tingkat produksi hewan ternak dalam memenuhi kebutuhan pangan
yaitu sumber protein. Sebagai contoh, menurut Schatten dan Gheorghe (2007)
IVF dapat membantu meningkatkan tingkat kebuntingan sapi saat infertile. Begitu
juga jika sapi yang tidak dapat merespon hormon superovulasi, maka sapi dapat
bunting dengan mentransfer embrio hasil IVP pada uterus sapi.
Koleksi sel spermatozoa dan oosit merupakan hal penting dalam teknologi
IVF. Keberhasilan dari teknologi IVF sangat dipengaruhi oleh kualitas dari oosit
dan sel spermatozoa yang digunakan. Kualitas oosit ini sendiri sangat dipengaruhi
oleh penanganan mulai dari ovarium dikeluarkan dari tubuh hewan, selama proses
transportasi hingga sampai ke laboratorium dan saat dikoleksi hingga mengalami
proses maturasi (Choi et al. 2004). Oosit setelah maturasi mempunyai peranan penting terhadap keberhasilan IVF, untuk mendukung perkembangan oosit
menjadi embrio selanjutnya sampai menjadi satu keturunan.
Ovarium yang dikeluarkan dari tubuh hewan, umumnya tidak lagi
2
al. 2011). Kondisi iskemia dapat menyebabkan perubahan pada folikel, karena berkurangnya oksigen, akumulasi hasil metabolisme, berkurangnya glukosa dan
meningkatnya indeks apoptosis pada sel granulosa (Pedersen et al. 2004). Selain
itu, Schatten dan Gheorghe (2007) menyatakan bahwa oosit primer lebih sensitif
terhadap lingkungan, sehingga metode penanganan ovarium selama trasportasi
penting untuk dioptimalkan agar dapat menjaga kondisi oosit tetap baik. Oleh
karena itu, diperlukan penelitian untuk mengetahui kondisi optimum media
transportasi agar kualitas oosit tetap dapat dipertahankan untuk mendukung
keberhasilan IVM, IVF dan IVC.
Tujuan
Penelitian ini dilakukan untuk mengetahui karakteristik oosit domba dari
ovarium yang disimpan pada suhu dan periode penyimpanan yang berbeda
sehingga didapatkan suatu metode penyimpanan ovarium selama transportasi
yang mampu mempertahankan kualitas oosit domba.
Hipotesis
Suhu dan periode penyimpanan ovarium berpengaruh terhadap kualitas
oosit.
Manfaat
1. Hasil penelitian ini diharapkan dapat memberikan informasi tentang sistem
transportasi yang baik sehingga kualitas ovarium dan oosit dapat
dipertahankan secara optimal.
2. Hasil penelitian ini juga diharapkan dapat menjadi model untuk hewan langka
3
TINJAUAN PUSTAKA
Domba
Domba merupakan salah satu sumber protein yang semakin digemari oleh
penduduk Indonesia. Fenomena ini semakin terlihat dengan bertambahnya
warung-warung sate di pinggiran jalan, terutama jalan yang menuju puncak Bogor
dan beberapa tempat wisata di sekitar Bogor. Permintaan domba juga semakin
meningkat seiring dengan bertambahnya jumlah penduduk Indonesia, terutama
pada saat Idul Adha (Harianto 2010).
Ovarium
Ovarium adalah organ reprodusi betina yang terletak di ruang abdomen
seekor hewan. Pada domba bentuk ovarium seperti kacang almond. Ovarium
dapat bekerja sebagai organ eksokrin (menghasilkan sel telur) dan endokrin
(menghasilkan hormon) (Thomas & Joanna 2002). Ovarium dibagi menjadi dua
bagian, yaitu kortek dan medula. Sebagian besar ovarium didominasi oleh kortek.
Kortek dilapisi oleh simple squamous dan epitelium kuboid. Di bagian yang lebih
dalam terdapat jaringan yang tidak beraturan yang disebut tunika albuginea.
Tunika albuginea berhubungan dengan stroma ovarium yang terdiri dari jaringan
ikat longgar yang mengandung folikel dan korpus luteum. Sedangkan daerah
medula terdiri atas pembuluh darah, pembuluh limfe, saraf, jaringan ikat dan otot
polos (Schatten & Gheorghe 2007).
Pada saat fetus, ovarium menghasilkan oogonia melalui pembelahan
mitosis. Sekitar 1 (satu) juta oosit berkembang setelah fetus dilahirkan namun
hanya beberapa ratus oosit yang akan diovulasikan. Umumnya oosit akan
berkurang karena mengalami degenerasi dan atresia (Schatten & Gheorghe 2007).
Oogenesis dan Folikulogenesis
Oogenesis merupakan proses pembentukan gamet betina atau oosit. Proses
ini bersamaan dengan proses pembentukan folikel yang dikenal dengan
folikulogenesis. Folikel primodial yang telah terbentuk sewaktu di dalam
kandungan maupun setelah lahir akan terus berkembang dan mengalami
4
Pada saat hewan lahir, ovarium memiliki sejumlah folikel primodial yang
akan berkembang pada saat pubertas. Folikel ini mengandung oosit dengan inti
berada pada tahap profase dari pembelahan meiosis pertama (oosit primer).
Setelah pubertas, folikel primodial berkembang menjadi folikel primer.
Pembentukan folikel dibagi menjadi empat fase: primodial, primer, sekunder dan
tertier (Schatten & Gheorghe 2007). Follicle stimulating hormone (FSH) dilepaskan dari pituitari anterior untuk menstimuli perkembangan folikel primer
menjadi sekunder, tertier dan akhirnya mencapai bentuk folikel de Graaf (Colville
2002). Folikel primer terbentuk, dimulai dari sel epitel yang mengelilingi oosit
berubah bentuk dari pipih menjadi kuboid (Schatten & Gheorghe 2007). Awalnya,
sel folikel berhubungan erat dengan oosit, kemudian terbentuk zona pelusida yang
berasal dari suatu lapisan zat aseluler dan terdiri dari mukopolisakarida
diendapkan pada permukaan oosit (Thomas & Joanna 2002).
Sel folikel mulai berproliferasi dengan membentuk suatu lapisan seluler
yang tebal yang mengelilingi oosit. Selanjutnaya dibawah pengaruh gonadotropin
dari hipofise anterior, sel-sel folikel terus berkembang menjadi beberapa lapis
seluler hingga membentuk ruang-ruang yang disebut antrum folikel, ini dikenal
sebagai folikel sekunder (Gordon 2003). Folikel yang matang dikenal sebagai
folikel tertier, yang dikelilingi oleh dua lapisan jaringan ikat yaitu teka interna dan
teka externa. Teka interna adalah lapis bagian dalam yang menghasilkan estrogen
dan kaya dengan pembuluh darah sedangkan teka eksterna adalah lapis luar yang
beransur-ansur akan bersatu dengan stroma ovarium. Antrum folikel akan terus
bertambah besar seiring dengan perkembangan folikel tertier sampai menjelang
ovulasi. Pada saat ini folikel terteir disebut folikel de Graaf (Thomas & Joanna
2002).
Oosit
In vitro maturation (IVM) adalah suatu proses yang perlu dilalui oleh oosit agar oosit mengalami perubahan struktur dan biokimiawi menjadi fase metaphase
II melalui pembelahan miosis secara in vitro (Anthony et al. 2011). Umumnya oosit yang dikoleksi dari ovarium adalah oosit primer, oleh karena itu diperlukan
suatu proses kultur yang dikenal dengan nama IVM (Gordon 2003). Kualitas oosit
5
dipengaruhi oleh banyak faktor diantaranya adalah kondisi donor, transportasi
ovarium, seleksi folikel dan IVM (Wang et al. 2011). Kualitas oosit yang digunakan untuk proses maturasi in vitro akan sangat mempengaruhi keberhasilan
IVF selanjutnya. Jika salah satu dari faktor-faktor tersebut tidak ditangani dengan
baik dapat menyebabkan abnormalitas pada hasil IVF dan pembentukan embrio.
Transportasi ovarium merupakan tahap awal dari porses produksi embrio secara in
vitro yang menjadi faktor penting karena dapat mempengaruhi kualitas oosit. Penanganan pada ovarium terdiri dari tiga faktor, yaitu faktor suhu, faktor waktu
dan medium penyimpanan (Gordon 2003). Ketiga faktor ini penting karena
penyimpanan ovarium tanpa suplai darah dapat menurunkan kualitas oosit.
Transportasi ovarium
Transportasi ovarium menuju laboratorium dalam keadaan tidak
mendapatkan suplai darah menyebabkan berkurangnya suplai oksigen dan energi.
Keadaan ini disebut iskemia dan kondisi re-oxygenation (Wang et al. 2011). Metabolisme jaringan yang tidak mendapat suplai oksigen akan berubah kondisi
aerobic menjadi anaerobic dengan hasil metabolismenya adalah asam laktat yang terakumulasi diantara sel (Petrucci et al. 2010). Selain itu, adenosine triphosphate
(ATP) yang dipecahkan tanpa disintesa akan menghasilkan sisa metabolik yaitu
fosfor inorganik. Fosfor yang berinteraksi dengan air akan menjadi asam fosfor,
dimana apabila terjadi akumulasi asam fosfor dan asam laktat akan menyebabkan
terjadinya penurunan pH (Petrucci et al. 2010). Penurunan pH yang disebabkan oleh akumulasi ion H+. Ion H+ yang terakumulasi pada ovarium akan merembes
keluar masuk ke dalam cairan folikular dan menginduksi terjadinya asidosis pada
lingkungan sekitar oosit (Wongsrikaeo et al. 2005). Banyak faktor yang dapat mempengaruhi kualitas oosit selama tranposrtasi ovarium dari rumah potong
hewan sampai oosit dikoleksi koleksi, diantaranya adalah lama periode dan suhu
selama transportasi (Gordon 2003).
Faktor Suhu
Metabolisme sel menurun pada suhu yang lebih rendah dari suhu tubuh
6
mengganggu viabilitas oosit, maturasi, fertilisasi dan perkembangan embrio
setelah IVF. Pada suhu yang tinggi dan periode yang lama dapat meningkatkan
fragmentasi DNA yang diinduksi oleh cairan folikular (Wongsrikaeo et al. 2005).
Banyak penelitian sudah dilakukan pada berbagai spesies yang mengkaji faktor
suhu penyimpanan selama transportasi ovarium dengan hasil yang bervariasi.
Padersen et al. (2004) melaporkan bahwa, ovarium kuda yang disimpan pada suhu
35-37 ˚C dalam waktu kurang dari dua jam masih mempunyai oosit dengan
kualitas yang bagus. Pada babi, Wongsrikaeo et al. (2005) melaporkan bahwa, ovarium babi dapat disimpan pada suhu diantara 25 ˚C hingga 35˚C dalam waktu
enam jam.
Oosit kuda yang dikoleksi segera setelah disembelih mempunyai perbedaan
maturasi yang signifikan dengan oosit yang disimpan pada suhu ruang dan suhu
4 ˚C selama 24 jam (Pedersen et al. 2004). Oosit kuda terpapar pada suhu 35-37
˚C selama 2 jam mempunyai tingkat apoptosis yang tinggi pada sel granulosa dibanding dengan oosit kuda yang terpapar suhu 20 ˚C dan 30 ˚C selama 2 jam
(Pedersen et al. 2004).
Faktor Waktu
Persentase degenerasi oosit meningkat seiring dengan bertambahnya
waktu (Wongsrikaeo. et al. 2005). Pada oosit yang dikoleksi segera setelah disembelih mempunyai kumulus yang expand dan Metaphase II yang lebih baik daripada oosit yang dikolesi selama 15-18 jam pada suhu kamar dan 4 ˚C (Love et
al. 2003). Ovarium babi yang disimpan selama 0-3 jam pada suhu 35 ˚C
menunjukkan kompetensi perkembangan oosit yang lebih baik dibanding
penyimpanan selama 6, 9 dan 12 jam pada suhu 35 ˚C (Wongsrikaeo et al. 2005).
Pada oosit sapi yang terpapar pada suhu rendah selama 48 jam dapat
menyebabkan degenerasi yang tidak diketahui faktor re-programnya (Matsushita
et al. 2004). Sedangkan pada oosit kucing dengan penyimpanan ovarium pada suhu 4 ˚C, diatas 24 jam dan kurang dari 48 jam masih mampu untuk pematangan
secara in vitro (Mihat et al. 2009). Berbeda pada kuda faktor waktu amat berpengaruh untuk mempertahankan morphologi dari kumulus oophorus, ovarium
kuda perlu disimpan pada suhu di antara 35-37 ˚C dan sebaiknya kurang dari 2
7
Koleksi oosit
Oosit dapat dikoleksi dengan dua cara yaitu dengan laparoskopi maupun
mengambil ovarium yang berasal dari rumah potong hewan. Laparoskopi
merupakan metode pengambilan ovarium dengan menggunakan endoskopi,
namun metode ini memerlukan biaya yang sangat mahal, tidak efisien dan
berisiko untuk terjadi infertile pada hewan tersebut (Schatten & Gheorghe 2007).
Cara yang kedua adalah dengan memperoleh oosit dari ovarium yang berasal dari
rumah potong hewan yang masih potensial untuk dimanfaatkan (Herdis 2000).
Ovarium yang diambil dari rumah potong hewan juga merupakan langkah yang
ekonomi untuk produksi embrio secara in vitro (Naowshari 2005).
Koleksi oosit dari ovarium yang berasal dari rumah potong hewan atau
dari hewan yang sudah mati dapat dilakukan dengan tiga metode, yaitu dengan
cara dissecting pada folikel, aspirasi dan menyayat. Metode aspirasi menggunakan
syringe, biasanya digunakan pada ovarium sapi, kerbau dan kuda karena ukuran ovarium dan folikelnya lebih besar sehingga mudah diaspirasi. Koleksi oosit
dengan metode ini dapat dilakukan 3 kali lebih cepat daripada dissecting, namun tingkat kerusakan pada folikel juga tinggi. Metode dissecting sering digunakan pada koleksi oosit domba (Gordon 2003). Sedangkan metode penyayatan
dilakukan dengan meletakkan ovarium di dalam cawan petri yang berisi cairan
saline, lalu dengan menggunakan pisau bedah permukaan ovarium diiris-iris untuk melepaskan oosit dari folikel (Wang et al. 2007). Metode ini dapat mengkoleksi lebih banyak oosit daripada menggunakan metode aspirasi. Metode
ini banyak digunakan pada domba dan kambing, namun metode ini membutuhkan
waktu 3 kali lebih lama daripada metode aspirasi pada satu ovarium (Gordon
2003).
Pengelompokan Oosit
Wood dan Wildt (1997) dan Gordon (2003) mengelompokkan oosit menjadi
4 kelompok yaitu, A, B, C dan D. Kelompok A adalah oosit yang mempunyai
kumulus yang kompak serta multilayer dan mempunyai sitoplasma yang homogen. Kelompok B adalah oosit yang mempunyai kumulus yang kompak,
sitoplasma yang homogen, namun jumlah kumulus oophorus kurang dari lima
8
pelusida masih terlihat jelas, namun sitoplasma yang semakin pudar. Kelopok D
adalah oosit dengan kumulus sudah mulai hilang dan tidak beraturan, zona
pelusida tidak kelihatan atau kelihatan sebagian dan sitoplasma semakin pudar.
Karja (2008) mengelompokkan oosit babi menjadi tiga kategori. Kategori
pertama, oosit mempunyai lebih dari lima lapis sel cumulus yang kompak,
sitoplasma yang homogen. Kategori kedua, oosit dikelilingi dengan kumulus yang
kurang kompak dan ketegori ketiga memperlihatkan sitoplasma yang tidak
beraturan.
Pengelompokkan oosit tersebut bertujuan untuk memisahkan oosit yang
berkualitas bagus dengan oosit yang berkualitas jelek. Menurut Wood dan Wildt
(1997) melaporkan pentingnya untuk megelompokkan oosit kucing dalam proses
in vitro untuk mencapai keberhasilan dalam proses maturasi, fertilisasi selanjutnya perkembangan embrio. Selanjutnya Karja (2008) melaporkan bahwa oosit babi
dengan kualitas bagus (kategori satu dan kategori dua) yang mempunyai kumulus
yang kompak dan sitoplasma yang homogen dapat mendukung maturasi nuklear
lebih baik berbanding kategori 3. Kategori 3 dengan oosit yang kurang kompak
menunjukkan hasil maturasi yang jelek dengan oosit yang mengalami atresia dan
9
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di laboratorium Fertilisasi In Vitro, Bagian Reproduksi
dan Kebidanan, Departement Klinik, Reproduksi dan Patologi, Fakultas
Kedokteran Hewan. Ovarium yang digunakan diambil dari Rumah Potong
Hewan kambing/domba, Kampung Cikanyong Desa Citaringgul Kecamatan
Babakan Madang, Kabupaten Bogor. Penelitian ini berlangsung selama 1 bulan
lebih, mulai tanggal 8 Juli 2011 hingga 17 Agustus 2011.
Alat dan bahan
Alat yang digunakan adalah termos, cooler box, termometer, kantong plastik
(8x5cm), blade, cawan petri, pinset, mikroskop Nikon SMZ800, penangas air dan
pipet sedot. Bahan yang digunakan adalah ovarium, NaCL fisiologi, phosphate buffer saline (PBS), dan es.
Koleksi Ovarium
Jumla