PENGARUH VARIETAS KEDELAI,
MULSA JERAMI DAN APLIKASI PGPR
TERHADAP PENYAKIT PUSTUL BAKTERI
DAN KELIMPAHAN BAKTERI RIZOSFER
TITA
WIDJAYANTI
SEKOLAH
PASCASARJANA
INSTITUT
PERTANIAN
BOGOR
BOGOR
PERNYATAAN
MENGENAI
TESIS
DAN
SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengaruh Varietas Kedelai, Mulsa Jerami dan Aplikasi PGPR terhadap Penyakit Pustul Bakteri dan Kelimpahan Bakteri Rizosfer adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2012
Tita Widjayanti
ABSTRACT
TITA WIDJAYANTI. Effect of Soybean Variety, Straw Mulch and PGPR Application to Bacterial Pustule Disease and The Abundance of Rizhosphere Bacteria. Under direction of ABDJAD ASIH NAWANGSIH and KIKIN
HAMZAH MUTAQIN
Bacterial pustule caused by Xanthomonas axonopodis pv. glycines is one of important bacterial diseases of soybean in Indonesia. The development of alternative control of the disease is required to support Integrated Pests and Diseases Management for sustainable agriculture. This research was conducted to observe the effect of straw mulch, Plant Growth Promoting Rhizobacteria (PGPR) on the incidence of bacterial pustule disease and the abundance of chitinolytic bacteria, heat tolerant bacteria, and fluorescence bacteria on two soybean varieties. All of the factors as combinations were not significant to affect the value of total area under disease progress curve (AUDPC) of bacterial pustule. Factor that significantly affected the values of AUDPC was varieties. Gepak Kuning variety has lowest AUDPC value compare to Anjasmoro variety. In addition, combination of Gepak Kuning variety and straw mulch showed AUDPC value. Abundance of fluorescence bacteria on soybean rhizosphere treated with PGPR is significantly higher compared with those on plants without PGPR. The other treatments and their combination did not significantly affect the abundance of rhizosphere bacteria.
Keyword: PGPR, rhizosphere bacteria, soybean variety, straw mulch,
RINGKASAN
TITA WIDJAYANTI. Pengaruh Varietas Kedelai, Mulsa Jerami dan Aplikasi PGPR terhadap Penyakit Pustul Bakteri dan Kelimpahan Bakteri Rizosfer.
Dibimbing oleh ABDJAD ASIH NAWANGSIH dan KIKIN HAMZAH
MUTAQIN.
Penyakit pustul bakteri merupakan penyakit penting yang mengakibatkan rendahnya produksi kedelai di Indonesia. Kehilangan hasil yang diakibatkan oleh penyakit ini dapat mencapai 50%. Penyebab penyakit pustul ini adalah bakteri Xanthomonas axonopodis pv. glycine. Di Indonesia, pengendalian penyakit pustul bakteri yang bersifat ramah lingkungan diperlukan untuk mendukung sistem pertanian berkelanjutan dan mengurangi ketergantungan terhadap pestisida sintetik.
Pengendalian Hama dan Penyakit Terpadu-Biointensif (PHT-Biointensif) merupakan salah satu solusi dari masalah hama dan penyakit tanaman yang
semakin berat dari tahun ke tahun. PHT-Biointensif merupakan sistem
pengendalian hama dan penyakit tanaman yang menggabungkan beberapa
teknik pengendalian yang efektif, efisien dan ramah lingkungan dengan mengoptimalkan potensi sumberdaya hayati. Adapun strategi yang dapat dilakukan antara lain, penggunaan varietas, penggunaan mulsa organik, dan aplikasi biokontrol. Selain itu, salah satu indikator keberhasilan sistem ini adalah tanah aktif, yaitu tanah yang memiliki kelimpahan dengan mikroorganisme yang bermanfaat. Kelompok bakteri rizosfer yang banyak dimanfaatkan sebagai agen antagonis dan mampu meningkatkan pertumbuhan tanaman adalah bakteri kitinolitik, Bacillus sp, Pseudomonas fluorescens dan Actinomycetes. Penelitian ini bertujuan untuk melihat pengaruh penggunaan varietas kedelai, mulsa jerami dan aplikasi Plant Growth Promoting Rhizobacteria (PGPR) terhadap penyakit pustul bakteri dan kelimpahan bakteri kitinolitik, tahan panas dan fluorescence. Penelitian ini dilakukan di lapangan dan laboratorium. Pengujian di lapangan menggunakan Rancangan Acak Kelompok Faktorial dengan faktor perlakuan pertama varietas (Anjasmoro dan Gepak Kuning), faktor kedua pemberian mulsa jerami (dengan mulsa dan tanpa mulsa) dan faktor ketiga aplikasi PGPR (dengan PGPR dan tanpa PGPR), percobaan dilakukan dalam 3 kali ulangan. Keparahan penyakit dan perkembangan penyakit berupa Area Under Disease Progress Curve (AUDPC) diamati setiap minggu selama 12 minggu.
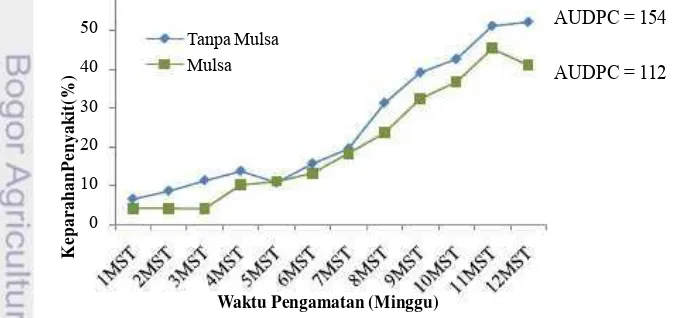
Hasil analisis statistik menunjukkan bahwa perlakuan faktor tunggal varietas menunjukkan pengaruh sangat nyata (p < 0.01) terhadap perkembangan penyakit. Sedangkan, kombinasi perlakuan antara varietas dan pemberian mulsa jerami menunjukkan pengaruh nyata (p < 0.05) terhadap perkembangan penyakit. Penggunaan varietas Gepak Kuning terbukti mampu mengurangi keparahan penyakit pustul bakteri (33%) dibandingkan varietas Anjasmoro (60%). Interaksi antara varietas dan pemberian mulsa jerami juga menunjukkan pengaruh yang berbeda terhadap penekanan perkembangan penyakit. Varietas Gepak Kuning yang diberi mulsa jerami menunjukkan perkembangan penyakit yang lebih rendah dibandingkan jika varietas Gepak Kuning diaplikasikan tunggal. Pemberian mulsa berperan dalam memperbaiki struktur dan aerasi tanah sehingga mendukung pertumbuhan tanaman menjadi lebih vigor dan lebih tahan terhadap penyakit serta meningkatkan kelimpahan bakteri rizosfer.
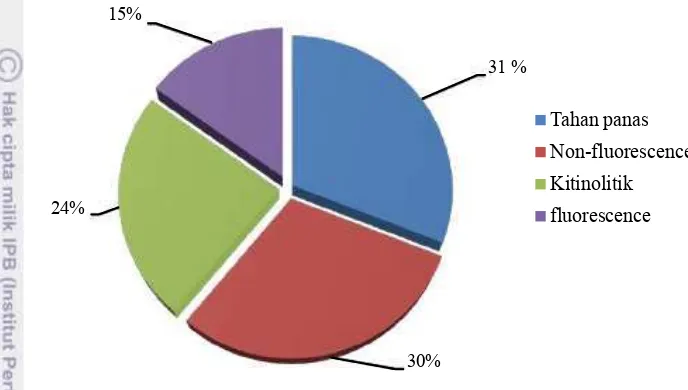
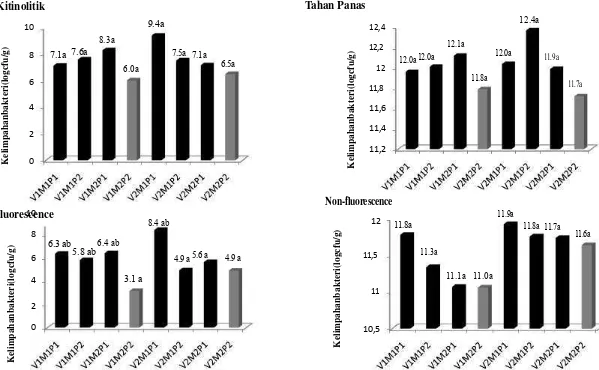
Hasil isolasi bakteri rizosfer menunjukkan kelompok yang mendominasi adalah bakteri tahan panas (31%), non-fluorescence (30%) dan kitinolitik (24%), sedangkan bakteri kelompok fluorescence berjumlah 15%. Secara umum, kombinasi perlakuan varietas, mulsa jerami dan aplikasi PGPR mampu meningkatkan kelimpahan bakteri rizosfer kelompok kitinolitik, tahan panas, fluorescence dan non-fluorescence dibandingkan dengan perlakuan kontrol pada
masing-masing varietas.
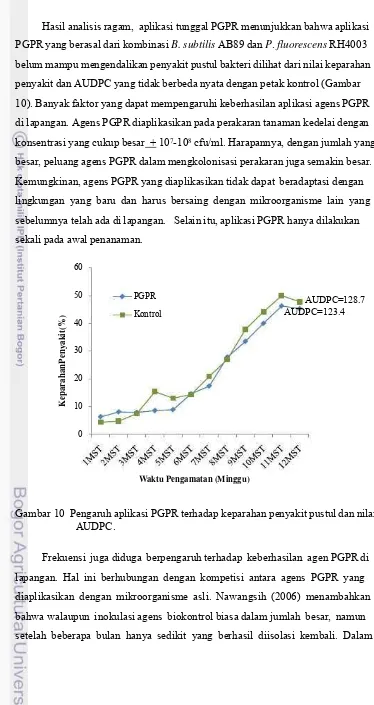
Dari semua perlakuan hanya perlakuan aplikasi PGPR yang berpengaruh sangat nyata hanya terhadap kelimpahan kelompok bakteri fluorescence. PGPR yang diaplikasikan merupakan kombinasi antara B. subtilis AB89 dan P. fluorescens RH4003. Ada kemungkinan bakteri PGPR tersebut mampu bertahan dan berkembang pada rizosfer kedelai. Oleh karena itu, dilakukan karakterisasi secara morfologi dan fisiologi terhadap 5 jenis isolat terbanyak, dengan asumsi bahwa bakteri tersebut merupakan bakteri yang lebih dominan dan mampu bertahan dibandingkan dengan bakteri lain. 5 isolat terbanyak untuk kelompok fluorescence adalah F3, F4, F7, F9 dan F11.
Berdasarkan morfologi ada 2 isolat yang mempunyai karakter koloni yang sama dengan P. fluorescens RH4003 yaitu isolat F4 dan F7 dengan ciri-ciri koloni berpendar hijau dengan tingkat fluorescen kuat, bentuk bulat dengan tepi tidak beraturan, berwarna putih kusam, elevasi datar dan tidak berlendir. Akan tetapi, hasil pengujian secara fisiologis dengan uji LOPAT diketahui bahwa hampir semua isolat terbanyak menunjukkan reaksi yang sama dengan kontrol (P. fluorescens RH4003) kecuali isolat F9.
Kata kunci: Bakteri Rizosfer, mulsa jerami, PGPR, pustul bakteri, varietas
©
Hak
Cipta
milik
IPB,
tahun
2012
Hak
Cipta
dilindungi
Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENGARUH
VARIETAS
KEDELAI,
MULSA
JERAMI
DAN
APLIKASI
PGPR
TERHADAP
PENYAKIT
PUSTUL
BAKTERI
DAN
KELIMPAHAN
BAKTERI
RIZOSFER
TITA
WIDJAYANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Fitopatologi
SEKOLAH
PASCASARJANA
INSTITUT
PERTANIAN
BOGOR
BOGOR
Judul Tesis : Pengaruh Varietas Kedelai, Mulsa Jerami dan Aplikasi PGPR Terhadap Penyakit Pustul Bakteri dan Kelimpahan Bakteri Rizosfer
Nama : Tita Widjayanti
NRP : A352090021
Disetujui
Komisi Pembimbing
Dr. Ir. Abdjad Asih Nawangsih, MSi
Ketua Dr. Ir. Kikin Hamzah Mutaqin, MSi
Anggota Diketahui,
Ketua Program Studi Fitopatologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Sri Hendrastuti Hidayat, MSc Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah
melimpahkan karunia-Nya sehingga penulis dapat menyusun tesis dengan judul
“Pengaruh Varietas Kedelai, Mulsa Jerami dan Aplikasi PGPR Terhadap Penyakit
Pustul Bakteri dan Kelimpahan Bakteri Rizosfer”.
Terima kasih penulis ucapkan kepada Dr. Ir. Abdjad Asih Nawangsih, M.
Si dan Dr. Ir. Kikin Hamzah Mutaqin, M. Si selaku komisi pembimbing yang
telah mengarahkan dan membingbing penulis baik dalam proses penelitian
maupun penulisan karya ilmiah ini. Ucapan terima kasih juga penulis sampaikan
kepada Dr. Ir. Sri Hendrastuti Hidayat M.Sc, selaku Ketua Program Studi Mayor
Fitopatologi yang telah memberikan ijin dilaksanakannya penelitian ini.
Terimakasih juga diucapkan kepada Dr. Ir. Abdul Munif, M.Sc selaku dosen
penguji. Penelitian ini didanai dari proyek penelitian “I-MHERE” dari Institut
Pertanian Bogor kepada Dr. Abdjad Asih Nawangsih, M. Si tahun 2010. Ucapan
terima kasih juga penulis sampaikan pada Tim LPS, bakteri crew, Fitopatologist
2009 dan Pondok Cahaya groups dalam membantu pelaksanaan penelitian.
Terima kasih juga disampaikan kepada ayah, mamah, adik-adik, mas Aan serta
keluarga besar atas segala doa dan kasih sayang yang tak pernah putus.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2012
RIWAYAT
HIDUP
Penulis dilahirkan di Kuningan pada tanggal 19 Agustus 1987 sebagai anak
pertama dari 4 bersaudara dari pasangan Ir. Narsu Wijaya dan Umayati, S.Pd.
Tahun 2005 penulis lulus dari SMA Negeri 5 Tasikmalaya dan pada tahun yang
sama lulus seleksi masuk Universitas Jenderal Soedirman pada jurusan Hama dan
Penyakit Tumbuhan di Fakultas Pertanian. Gelar Sarjana Pertanian diperoleh
pada tahun 2009. Kesempatan untuk melanjutkan ke program magister akhirnya
penulis dapatkan dengan lulus seleksi masuk IPB pada mayor Fitopatologi,
Fakultas Pertanian pada tahun yang sama.
Selama mengikuti program S2, penulis pernah mengikuti International
Student Symposium yang diikuti oleh mahasiwa pascasarjana dari Jepang dan IPB
di Bogor pada bulan September 2010. Selanjutnya, penulis berkesempatan
mengunjungi Jepang untuk menghadiri International Joint Activities di
Universitas Ibaraki Jepang pada bulan Desember 2010 sebagai pemrasaran. Karya
ilmiah yang dipaparkan merupakan bagian dari penelitian S2 penulis. Karya
ilmiah ini juga pernah diseminarkan pada acara International Society for
Southeast Asian Agricultural Sciences (ISSAAS) pada November 2011 di Bogor.
Penulis juga pernah menjadi asisten pada magang dari Balai Besar
Perbenihan dan Proteksi Tanaman Perkebunan Medan dalam pelatihan Agensia
Hayati pada bulan Mei 2011, Asisten praktikum mata kuliah Fitopatologi kelas
khusus dari Perusahaan BISI pada bulan September 2011, Asisten Praktikum mata
kuliah Bakteriologi Pascasarjana pada bulan Agustus-Desember 2011 dan Asisten
Praktikum mata kuliah Dasar-dasar Perlindungan Tanaman mahasiswa Diploma
DAFTAR ISI
Halaman
DAFTAR TABEL ...xii
DAFTAR GAMBAR ...xiii
DAFTAR LAMPIRAN ...x
PENDAHULUAN Latar Belakang ...1
Tujuan Penelitian ...4
Hipotesis ...4
TINJAUAN PUSTAKA Kedelai ...5
Penyakit Pustul Bakteri ...6
Gejala ...6
Organisme Penyebab Penyakit ...7
Siklus Penyakit dan Kisaran Inang ...8
Sistem PHT-Biointensif ...8
Varietas Tahan...9
Mulsa Jerami ...10
Plant Growth Promoting Rhizobacteria (PGPR) ...12
B. subtilis AB89 ...12
P. fluorescens RH4003 ...13
Kelimpahan Bakteri Rizosfer ...14
BAHAN DAN METODE Tempat dan Waktu Penelitian ...19
Percobaan Pengaruh Varietas Kedelai, Mulsa Jerami dan PGPR ...19
Pengamatan Percobaan ...20
Keparahan dan Perkembangan Penyakit... 20
Kelimpahan Bakteri Tahan Panas, Kitinolitik dan Fluorescence 21 Karakterisasi Isolat Bakteri Rizosfer ...22
Pengujian Bakteri Secara Umum ...23
Ciri dan Morfologi Koloni ...22
Uji Gram ...23
Uji Hipersensitif ...24
Karakterisasi Bakteri Tahan Panas ...24
Uji Endospora ...24
Uji Agar Darah ...25
Karakterisasi Bakteri Fluorescence ...25
Uji Levan ...25
Potato Soft Rot ...26
Hidrolisis Arginin ...26
Uji Gram ...26
Karakterisasi Bakteri Kitinolitik ...26
Analisis Data ...27
HASIL DAN PEMBAHASAN Pengaruh Varietas Kedelai, Mulsa Jerami dan Aplikasi PGPR terhadap Penyakit Pustul Bakteri ...29
Pengaruh Varietas Kedelai, Mulsa Jerami dan Aplikasi PGPR terhadap Kelimpahan Bakteri Rizosfer ...38
Karakterisasi Morfologi dan Fisiologi Isolat Terbanyak ...43
Bakteri Tahan Panas ...43
Bakteri Fluorescence ...45
Bakteri Kitinolitik...48
KESIMPULAN ...51
SARAN ...51
DAFTAR TABEL
Halaman
1. Ringkasan hasil analisis ragam (Anova) perlakuan varietas, pemberian mulsa dan aplikasi PGPR terhadap perkembangan
penyakit pustule bakteri (AUDPC) dan kelimpahan bakteri kitinolitik, tahan panas, fluorescence dan non-fluorescence ...31
2. Pengaruh varietas, mulsa jerami dan aplikasi PGPR terhadap keragaman bakteri rizosfer (kelompok kitinolitik, tahan panas,
non-fluorescence dan fluorescence) ...40
3. Pengaruh pemberian mulsa jerami terhadap kelimpahan bakteri rizosfer...40
4. Pengaruh perlakuan varietas, mulsa jerami dan aplikasi PGPR
terhadap kelimpahan bakteri rizosfer ...43
5. Hasil pengujian endospora isolat tahan panas terbanyak ...44
6. Reaksi lisis isolat terbanyak kelompok tahan panas pada medium agar darah ...45
7. Morfologi isolat T42, T70 dan B. subtilis AB89 ...46
DAFTAR GAMBAR
Halaman
1. Gejala pustul bakteri pada daun kedelai... 7
2. Metode pengambilan sampel metode S... 21
3. Seri pengenceran untuk isolasi bakteri dari tanah ...22
4. Gejala awal penyakit pustul bakteri pada 2 MST (a); Gejala lanjut penyakit pustul bakteri pada 7MST pada tanaman yang sama(b) ...29
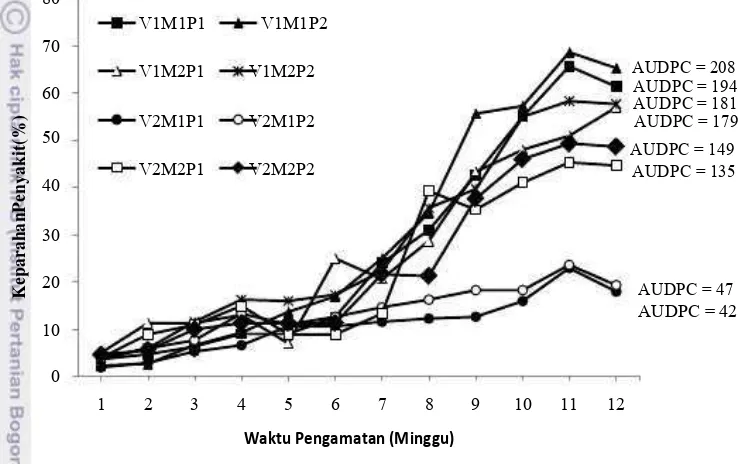
5. Rata-rata keparahan penyakit pustul bakteri pada 1 hingga 12 MST dan nilai AUDPC; V1: varietas Anjasmoro; V2: varietas Gepak Kuning; M1: dengan mulsa jerami; M2:tanpa mulsa jerami; P1: dengan PGPR; P2: tanpa PGPR ...30
6. Pengaruh varietas terhadap keparahan penyakit pustul
bakteri dan nilai AUDPC. ...31
7. Gejala penyakit pustul bakteri pada varietas Anjasmoro (a); Gejala penyakit pustul bakteri pada varietas Gepak Kuning
pada 7 MST (b) ...32
8. Pengaruh kombinasi antara varietas dan pemberian mulsa
jerami terhadap keparahan penyakit pustul dan nilai AUDPC...33
9. Pengaruh pemberian mulsa jerami terhadap keparahan
penyakit pustul dan nilai AUDPC ...35
10. Pengaruh aplikasi PGPR terhadap keparahan penyakit pustul
dan nilai AUDPC ...36
11. Total kelimpahan bakteri (%) pada masing-masing kelompok ... 39
12. Kelimpahan masing-masing kelompok bakteri pada
kombinasi perlakuan dibandingkan dengan kontrol pada masing- masing varietas; V1: varietas Anjasmoro; V2: varietas Gepak Kuning; M1: Dengan Mulsa Jerami; M2:Tanpa Mulsa Jerami; P1: Dengan PGPR; P2: Tanpa PGPR...41
13. Endospora T61 (hijau) didalam sel vegetatifnya (merah),
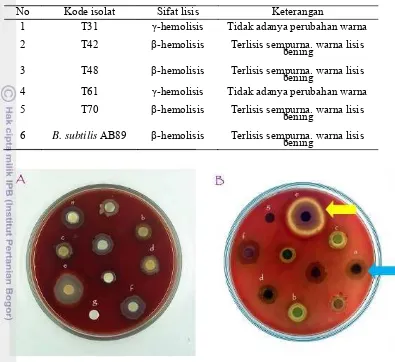
14. Reaksi hemolisis pada agar darah isolat bakteri tahan panas terpilih (tampak depan) (A); Reaksi hemolisis pada agar darah isolat bakteri tahan panas terpilih (tampak belakang) (B); a) T10, b)T31, c) T42, d) T46, e) T48, f) T61, g) T67, h) T70, i) B. subtilis AB89, j) kontrol (LB) ...45
15. Uji levan isolat fluorescence A); Reaksi positif uji levan. koloni seperti kubah (cembung jelas). putih. Mucoid B); Reaksi negatif uji levan. koloni datar. tidak berkilau dan transparan C) ...47
16. Reaksi oksidase isolat fluorescence A); Reaksi oksidase positif (+) berwarna ungu (B.a); Reaksi oksidase negatif (-) tidak terjadi
perubahan warna (B.b) ...47
17. Reaksi potato soft rot positif (+) umbi busuk, kecoklatan, berlendir (A.a); Reaksi potato soft rot negatif (-) umbi segar, tidak terjadi perubahan warna (A.b); Reaksi potato soft rot pada isolat
fluorescence (B) ...48
DAFTAR LAMPIRAN
Halaman
1. Denah lokasi percobaan ...58
2. Hasil analisis ragam (Anova) perlakuan varietas, pemberian mulsa dan aplikasi PGPR terhadap perkembangan penyakit pustul bakteri (AUDPC) ...59
3. Deskripsi varietas kedelai Anjasmoro (Balitkabi 2008) ...60
4. Deskripsi varietas kedelai Gepak Kuning (Balitkabi 2008) ...61
5. Daftar bahan media Kings`B Agar (KBA), Trytic Soy Agar (TSA), kitin agar dan Luria Bertani Broth (LB) ...62
6. Morfologi koloni bakteri tahan panas ...63
7. Morfologi koloni bakteri fluorescence...66
8. Morfologi koloni bakteri non-fluorescence...67
PENDAHULUAN
Latar Belakang
Penyakit pustul bakteri yang disebabkan oleh Xanthomonas axonopodis pv.
glycines merupakan salah satu penyakit penting pada tanaman kedelai di wilayah
tropis dan sub tropis (Sinclair dan Backman 1989). Penyakit ini penting selain
karena sebaran geografisnya juga X. axonopodis pv. glycines mempunyai banyak
strain yang masing-masing menunjukkan genotip dan virulensi yang berbeda
sehingga pengendalian dengan varietas tahan dengan daya tahan vertikal sulit
dilakukan (Rukayadi et al. 1999). Kehilangan hasil yang diakibatkan oleh
penyakit ini pada daerah sentra kedelai di Indonesia seperti Jawa Barat,
Kalimantan Selatan, Jawa Timur dan Daerah Istimewa Yogyakarta sekitar 15.9%
sampai 50% (Dirmawati 2004).
Selama ini upaya pengendalian penyakit pustul bakteri yang disarankan
adalah penanaman varietas resisten, penggunaan benih yang bebas patogen, rotasi
tanaman, sanitasi serta penggunaan pestisida sintetik (Sinclair dan Backman
1989). Agarwal dan Sinclair (1997) menyatakan bahwa bakteri X. axonopodis pv.
glycines dapat terbawa benih dan bertahan dengan mekanisme infeksi laten pada
benih kedelai selama 2.5 tahun tanpa menunjukkan gejala sakit. Sehingga,
penggunaan benih kedelai yang tidak menunjukkan gejala sakit belum tentu
menjamin bahwa benih kedelai tersebut sehat.
Cara pengendalian lain yang lebih praktis adalah pengendalian kimiawi
menggunakan bakterisida, namun cara ini memerlukan biaya tinggi dan beresiko
mencemari lingkungan. Dilihat dari beberapa upaya pengendalian sebelumnya,
pustul bakteri kurang efektif jika ditekan dengan menggunakan satu cara
pengendalian. Oleh karena itu, perlu adanya strategi pengendalian yang
menggabungkan beberapa teknik pengendalian yang efektif, efisien dan ramah
lingkungan.
Wiyono (2007) menyatakan bahwa Pengendalian Hama dan Penyakit
Terpadu Biointensif (PHT-Biointensif) yang mengoptimalkan sumberdaya hayati
yang ada merupakan salah satu solusi masalah hama dan penyakit yang makin
adalah suatu sistem pendekatan untuk pengelolaan hama dan penyakit tanaman
yang didasarkan pada pemahaman ekologi hama dan patogen. Sistem ini
menggabungkan beberapa teknik pengendalian yang efektif, efisien dan ramah
lingkungan dengan mengoptimalkan sumber daya hayati dan menata ulang
agroekosistem pertanian yang bermanfaat bagi agens hayati dan merugikan bagi
patogen.
Dirmawati (2004) mengkaji beberapa komponen pengendalian ramah
lingkungan terhadap penyakit pustul bakteri. Hasilnya diketahui kombinasi pola
tanam tumpangsari kedelai-jagung dengan bakteri biokontrol efektif dalam
menekan perkembangan penyakit pustul, akan tetapi, penurunan laju infeksi tidak
terlalu besar. Oleh karena itu, perlu pengujian secara terpadu dengan kombinasi
perlakuan yang berbeda untuk mengendalikan penyakit pustul bakteri.
Beberapa komponen PHT-Biointensif diantaranya: penggunaan varietas
tahan, pemberian mulsa jerami dan aplikasi Plant Growth Promoting
Rhizobacteria (PGPR). Pengendalian penyakit dengan varietas tahan merupakan
cara pengendalian yang mudah dilakukan di tingkat petani. Varietas kedelai
terbaru rata-rata belum diketahui tanggapannya terhadap penyakit pustul. Dua
diantara varietas tersebut diantaranya varietas Anjasmoro dan varietas Gepak
Kuning. Balitkabi (2008) melaporkan bahwa kedua varietas tersebut merupakan
varietas yang banyak ditanam petani selain karena produktivitasnya tinggi, kedua
varietas tersebut diketahui tahan terhadap beberapa hama tanaman kedelai.
Komponen lain yang diuji adalah pemberian mulsa jerami. Pemberian
mulsa jerami merupakan salah satu cara untuk merekayasa lingkungan untuk
memberikan lingkungan tumbuh yang optimum bagi pertanaman kedelai.
Menurut Doring et al. (2006) mulsa memberikan keuntungan baik dari segi aspek
fisik maupun kimia tanah. Secara fisik mulsa mampu menjaga suhu tanah lebih
stabil dan mampu mempertahankan kelembapan di sekitar perakaran tanaman.
Suhu tanah berhubungan dengan proses penyerapan unsur hara oleh akar,
fotosintesis dan respirasi (Mahmood et al. 2002)
Efek aplikasi mulsa ditentukan oleh jenis bahan mulsa. Bahan yang dapat
digunakan sebagai mulsa di antaranya sisa-sisa tanaman (serasah dan jerami) atau
daya pantul lebih tinggi dibandingkan dengan mulsa plastik. Mahmood et al.
(2002) menambahkan mulsa jerami atau mulsa yang berasal dari sisa tanaman
lainnya mempunyai konduktivitas panas rendah sehingga panas yang sampai ke
permukaan tanah akan lebih sedikit dibandingkan dengan tanpa mulsa atau mulsa
dengan konduktivitas panas yang tinggi seperti plastik.
Cara pengendalian lain yang memungkinkan untuk dikembangkan dan
ramah lingkungan adalah pengendalian secara biologi menggunakan agens
biokontrol. PGPR merupakan rizobakteria yang mampu meningkatkan
produktivitas dan pertumbuhan tanaman serta berpotensi menjadi agen antagonis
patogen tanaman (Widodo 2006). Pemanfaatan Pseudomonas sp. dan Bacillus sp.
telah dilaporkan efektif mengendalikan penyakit tanaman. Kedua kelompok
bakteri tersebut dapat dikombinasikan untuk meningkatkan kemampuannya
dalam menekan penyakit, akan tetapi tidak boleh saling menghambat.
Suskandini dan Eviyati (2007) melaporkan bahwa bakteri P. flourescens G134
dan Bacillus subtilis BB01 telah diketahui efektif menghambat pertumbuhan
bakteri X. axonopodis pv. glycines penyebab penyakit pustul bakteri secara in-
vitro. Nawangsih (2006) juga melaporkan bahwa B. subtilis AB89 dan P.
fluorescens RH4003 dapat menekan penyakit layu bakteri pada tomat sebesar
62% melalui percobaan di rumah kaca. Keberhasilan tersebut menunjukkan
bahwa kombinasi kedua bakteri tersebut berpotensi untuk menjadi agens
biokontrol.
Indikator keberhasilan sistem PHT-Biointensif salah satunya adalah tanah
aktif. Hal ini sangat berhubungan dengan kelimpahan bakteri yang
menguntungkan dalam tanah. Banyak bakteri tanah yang telah diketahui mampu
menghambat pertumbuhan patogen dan meningkatkan pertumbuhan tanaman
diantaranya: kelompok bakteri kitinolitik, Bacillus sp, Pseudomonas fluorescens
Tujuan
1. Mengetahui pengaruh varietas kedelai, mulsa jerami dan aplikasi PGPR
terhadap penyakit pustul bakteri pada tanaman kedelai.
2. Mengetahui pengaruh varietas kedelai, mulsa jerami dan aplikasi PGPR
terhadap kelimpahan bakteri rizosfer kelompok kitinolitik, tahan panas, dan
flourescence.
Hipotesis
Penggunaan varietas kedelai, pemberian mulsa jerami dan aplikasi PGPR
berpengaruh terhadap penekanan perkembangan penyakit pustul bakteri dan
peningkatan kelimpahan bakteri rizosfer kelompok kitinolitik, tahan panas dan
TINJAUAN
PUSTAKA
Kedelai
Kedelai adalah salah satu tanaman polong-polongan yang menjadi bahan
baku makanan terutama dari wilayah Asia seperti kecap, tahu, dan tempe.
Berdasarkan peninggalan arkeologi tanaman ini telah dibudidayakan sejak 3500
tahun yang lalu di Asia Timur. Kedelai putih masuk ke Indonesia dibawa oleh
pedagang dari Cina. Sedangkan kedelai hitam telah dikenal sebelumnya oleh
penduduk Indonesia. Mulai dibudidayakan terutama di daerah Jawa sekitar tahun
1750 (Oarke et al. 1999).
Kedelai yang banyak dibudidayakan di Indonesia terdiri dari dua spesies
yaitu: Glycine max (disebut kedelai putih, biji dapat berwarna kuning, agak putih
atau hijau) dan Glycine soja (disebut kedelai hitam, biji berwarna hitam). G. max
merupakan tanaman asli daerah Asia subtropik seperti RRC dan Jepang Selatan,
sementara G. soja merupakan tanaman asli Asia tropis di Asia Tenggara.
Tanaman ini telah menyebar ke Jepang, Korea, Asia tenggara dan Indonesia
(Rukmana dan Yuniarsih 1996).
Faktor penghambat dalam budidaya kedelai salah satunya adalah hama dan
penyakit. Hama-hama penting yang menyerang tanaman kedelai adalah 1).
perusak bibit: Lalat kacang (Agromyza phaseoli), penggerek pucuk kedelai
(Agromyza dolichostigma), penggerek batang kedelai (Melanagromyza sojae);2).
perusak daun: Kumbang kedelai (Phaedononia inclusa), Ulat grayak (Spodoptera
litura), Ulat jengkal (Chrysodeixis chalcites), penggulung daun (Lamprosema
indicata), penggulung daun (Adoxophyes Privatana); 3). Perusak polong:
Penggerek polong (Etiella zinckenella), pengisap polong (Riptortus linearis),
kepik hijau (Nezara viridulla); 4). Hama lainnya: Hama yang dapat menularkan
penyakit pada tanaman kedelai (vektor) contoh kutu tebu/lalat putih (Bemisia sp.)
(Balitkabi 2008).
Sedangkan, penyakit penting pada tanaman kedelai adalah: 1). Penyakit
yang disebabkan fungi: Penyakit-karat dengan patogen Phakospora pachyrhizi
syringae; pustul bakteri oleh Xanthomonas axonopodis pv. glycines; 3). Penyakit
yang disebabkan virus: Mosaik kedelai (Soybean Mosaic Virus), penyakit Kerdil
kedelai, penyakit Katai kedelai (Soybean Dwarf Virus) (Hartman et al. 1999).
Penyakit Pustul Bakteri
Pustul bakteri merupakan penyakit penting pada tanaman kedelai terutama
di Indonesia. Kehilangan hasil akibat penyakit ini mencapai 15.9% sampai 50%
(Dirmawati 2004).
Gejala
Gejala awal penyakit pustul bakteri berupa bercak berwarna hijau pucat
kekuningan sebesar mata jarum, dengan bagian tengah agak menonjol. Bercak
nampak kebasah-basahan seperti kebanyakan infeksi oleh bakteri. Bercak
berkembang menjadi lebih besar (diameter 3mm) daripada bagian tengahnya,
terutama pada bagian bawah permukaan daun, terdapat tonjolan berwarna coklat
muda, tonjolan (pustul/bisul) terjadi akibat hipertropi dan hiperplasia. Bercak
mempunyai ukuran yang bervariasi, dari satu bercak kecil hingga bercak besar
yang tidak teratur yang terjadi karena bersatunya banyak bercak. Bercak
mengering, mudah sobek, dan gugur lebih awal. Daun kedelai yang gugur
prematur menyebabkan produktivitas tanaman kedelai menurun berkaitan dengan
jumlah polong hampa yang tinggi (Sinclair dan Backman 1989).
Gejala pustul hampir mirip dengan gejala karat yang disebabkan oleh
cendawan P. pachyrhizi Syd. Perbedaannya, pada gejala pustul bakteri terdapat
pada daun-daun muda pada bagian atas tanaman, sedangkan penyakit karat
awalnya terdapat pada daun-daun tua dibagian bawah lalu berkembang ke bagian
daun yang lebih muda di bagian atas. Pada permukaan bawah helai daun kedelai
yang bergejala karat terdapat urediosorus yang tampak seperti gumpalan tanah
berwarna coklat yang terasa kasar jika diraba (Hartman et al. 1999). Menurut
Sudjono et al. (1985) menyatakan bahwa pada polong varietas yang rentan,
penyakit pustul bakteri menyebabkan terjadinya bercak kecil yang berwarna
Organisme Penyebab Penyakit
Penyakit pustul bakteri diketahui disebabkan oleh X. axonopodis pv.
glycines (Nakano) Dye Vauterin. Pada awalnya menurut Machmud (1987)
penyakit bisul bakteri disebabkan oleh X. campestris pv. phaseoli (Smith 1897).
Namun menurut Moffet dan Dye dalam Semangun (1991) di beberapa negara
penyebab penyakit pustul bakteri pada kedelai diidentifikasi sebagai X. campestris
pv. glycines (Nakano) Dye 1978, yang dulu disebut X. phaseoli var. sojense
(Hedges) starr et Burkh., Pseudomonas glycines (Nakano) Mangrou et prevot.
Dalam identifikasi terbaru berdasarkan genotipenya, patogen ini diusulkan sebagai
X. axonopodis pv. glycines (Vauterin 1995 dalam CABI 2005).
Schaad (2001) mengidentifkasi bakteri ini dengan ciri-ciri bakteri X.
axonopodis pv. glycines berukuran 0.5-0.9 x 1.4-2.3 µm, berbentuk batang,
memiliki satu flagel polar dan merupakan bakteri gram negatif. Koloni pada agar
yeast dextrose carbonat (YDC) berwarna kuning pucat yang lama kelamaan
berubah menjadi kuning tua, berukuran kecil, bulat dan tepinya licin.
Gambar 1 Gejala pustul bakteri pada daun kedelai
Bakteri X. axonopodis pv. glycines dapat mencairkan gelatin dalam waktu
6 hari, membentuk asam sitrat dari arabinosa, glukosa, manosa, selobiosa,
trehalosa, dan sukrosa dalam 2 hari, menguraikan protein susu dalam 13 hari,
menghidrolisis pati dalam 2 hari. Suhu optimum untuk pertumbuhan adalah 30-
330C dengan suhu maksimum 380C dan minimum 100C (Schaad 2001). Sinclair
dan Backman (1989) menambahkan bakteri jika ditumbuhkan pada media dapat
Siklus Penyakit dan Kisaran Inang
Bakteri masuk kedalam jaringan tanaman melalui lubang alami seperti
hidatoda dan stomata atau melalui luka mekanik, lalu berkembang dalam ruang
antar sel. Bakteri tersebar melalui percikan air atau hujan. Epidemi penyakit
pustul bakteri terjadi pada kedelai yang masa pembungaannya bertepatan dengan
cuaca basah. Selain itu, bakteri bertahan dalam biji, permukaan sisa-sisa tanaman,
dan dalam rizosfer tanaman gandum (Sinclair dan Backman 1989). Bakteri X.
axonopodis pv. glycines memiliki inang lain yaitu kacang buncis, kacang panjang,
dan kecipir selain itu, di Amerika Serikat X. axonopodis pv. glycines dilaporkan
menginfeksi gulma Brunnicia cirrhosa Gaertn (Sinclair dan Backman 1989).
Maraknya penggunaan pestisida sintetik yang akhir-akhir ini banyak
digunakan petani untuk mengendalikan penyakit ini banyak menimbulkan dampak
negatif jika penggunaannya tidak bijaksana baik terhadap tanaman sendiri,
manusia maupun terhadap lingkungan biotik lain seperti agens hayati patogen.
Oleh karena itu, perlu stategi pengendaliannya yang efektif, efisien dan ramah
lingkungan.
Sistem PHT-Biointensif
Ketergantungan pada penggunaan pestisida sintetik mendasari munculnya
sistem PHT-Biointensif dalam program perlindungan tanaman di seluruh dunia.
Dampak negatif dari pestisida sintetik seperti terjadinya resistensi patogen,
perubahan virulensi patogen, terbunuhnya patogen non-target (agens hayati)
ataupun pencemaran terhadap lingkungan, tanaman itu sendiri dan manusia.
Sistem PHT-Biointensif adalah suatu sistem pendekatan untuk
pengelolaan hama dan penyakit tanaman yang didasarkan pada pemahaman
ekologi hama dan patogen. Diawali dengan langkah-langkah untuk mendiagnosis
sifat dan sumber masalah hama dan penyakit dan pemanfaatan agens hayati untuk
menjaga populasi hama dan patogen dalam batas yang dapat diterima. Manfaat
dari penerapan PHT-Biointensif yaitu dapat mengurangi biaya input kimia,
mengurangi on-farm dan off-farm dampak lingkungan, dan lebih efektif dan
Tujuan utama PHT-biointensif adalah untuk memberikan panduan dan
pilihan bagi manajemen yang efektif dari patogen dan organisme menguntungkan
dalam konteks ekologi. Pada prinsipnya sistem PHT-Biointensif sama dengan
sistem PHT, perbedaannya pada sistem PHT penggunaan pestisida sintetik masih
digunakan walaupun sebagai alternatif terakhir, akan tetapi pada sistem PHT-
Biointensif pestisida sintetik sama sekali tidak digunakan. Adapun, strategi PHT-
Biointensif yang dilakukan antara lain penggunaan varietas tahan, pemberian
mulsa jerami dan aplikasi PGPR.
Varietas Tahan
Penggunaan varietas tahan adalah cara pengendalian penyakit tumbuhan
yang efektif, murah dan ramah lingkungan. Menurut Zadoks dan Schein (1979)
penanaman varietas tahan bertujuan untuk mengurangi jumlah inokulum awal.
Ketahanan suatu varietas terhadap suatu penyakit umumnya tidak berlangsung
selamanya. Jika muncul ras baru yang lebih virulen, maka ketahanan varietas
tersebut akan patah. Oleh karena itu, adanya varietas-varietas baru kedelai yang
tahan terhadap penyakit pustul sangat dibutuhkan dalam upaya pengendalian
penyakit tersebut.
Hasil penelitian Anggraini et al. (1995) yang menguji ketahanan 75
genotip yang terdiri dari 29 varietas lokal, 8 varietas nasional, 23 introduksi dan
15 galur percobaan terhadap penyakit pustul, diketahui hanya 1 genotip yang
menunjukkan reaksi tahan yaitu varietas Si Pinang yang merupakan varietas lokal
dari Langkat, Sumatera Utara dan memiliki ciri-ciri berbiji hitam, berbunga ungu
dan memiliki tinggi sekitar 35 cm. Di Indonesia, kebanyakan petani lebih banyak
menanam varietas kedelai berbiji kuning. Oleh karena itu, penting untuk
mengetahui ketahanan varietas-varietas kedelai yang banyak ditanam petani
terhadap penyakit pustul bakteri.
Balitkabi (2008) melaporkan terdapat 72 varietas unggul kedelai yang
masing-masing memiliki keunggulan tersendiri. Termasuk dua diantaranya adalah
varietas Anjasmoro dan Gepak Kuning. Dari hasil sosialisasi pengembangan
jaringan alih teknologi produksi benih sumber, diketahui varietas kedelai yang
Selain memiliki ukuran biji yang besar, daya hasil varietas ini cukup besar
mencapai 2,03 – 2,25 ton/ha, hal ini menjadi daya tarik tersendiri untuk varietas
ini. Varietas yang dilepas pada tahun 2001 ini memiliki keunggulan lainnya yaitu
memiliki ketahanan terhadap penyakit karat daun dan Cladosporium sp., juga
tahan terhadap rebah dan memiliki sifat polong yang tidak mudah pecah.
Selain varietas Anjasmoro, varietas lain yang baru dilepas pada tahun 2008
yaitu varietas Gepak Kuning juga banyak diminati dan ditanam petani terutama di
wilayah Jawa Timur (Balitkabi 2008). Varietas ini memiliki beberapa keunggulan
diantaranya: berumur genjah dan toleran terhadap penaungan, selain itu, tahan
terhadap beberapa hama kedelai diantaranya ulat grayak, Aphis sp., penggulung
daun, dan Phaedonia sp. dan agak tahan penyakit karat. Varietas ini baik
beradaptasi di lahan sawah dan tegal, baik pada musim hujan maupun kemarau.
Mulsa Jerami
Faktor lain selain penggunaan varietas dalam sistem PHT-Biointensif
adalah penggunaan mulsa jerami. Menurut WAC (2005) Mulsa adalah semua atau
setiap bahan yang digunakan menutup tanah, bahan tersebut dapat berupa sisa
tanaman, lembar plastik, atau susunan batu. Fungsinya untuk melindungi
permukaan tanah dari terpaan hujan, erosi, dan menjaga kelembapan, struktur
serta kesuburan tanah, dan menghambat pertumbuhan gulma. Ada berbagai
macam jenis mulsa, salah satunya adalah mulsa jerami. Berbagai penelitian telah
dilakukan untuk melihat pengaruh penggunaan mulsa jerami terhadap
pertumbuhan dan penekanan penyakit pada berbagai tanaman.
Mulsa dapat memengaruhi kondisi fisik dan biologi tanah. Pengaruhnya
terhadap kondisi fisik tanah adalah sebagai berikut: (1) mengurangi daya tumbuk
langsung butir-butir hujan; (2) menurunkan jumlah dan jarak percikan tanah kalau
ada; (3) menurunkan dispersi butir tanah permukaan sehingga mencegah
pengerasan atau pergerakan permukaan; (4) memperkecil fluktuasi kelembapan
dan suhu tanah; (5) mengurangi aliran permukaan dan erosi internal dan
penyumbatan pori tanah; (6) memperbesar infiltrasi; (7) mengurangi terjadinya
evaporasi; dan (8) mempertahankan kelembapan tanah (Kohnke et al. 1959).
aktivitas mikroba, keberadaan insekta tanah, cacing tanah dan populasi hewan
lainnya yang dekat dengan permukaan tanah, dengan adanya suhu dan
kelembapan yang seimbang dan relatif stabil sehingga dapat mempermudah
pertumbuhan benih secara maksimal (Varadan dan Rao 1983).
Mulsa dapat dibagi menjadi tiga jenis yaitu mulsa organik, mulsa
anorganik, dan mulsa alamiah. Mulsa organik terbuat dari sisa tanaman atau biasa
disebut mulsa sisa tanaman, sedangkan mulsa anorganik berupa alumunium dan
plastik dan mulsa alami dapat berupa susunan batu.
Mulsa organik adalah mulsa yang berasal dari bahan organik sisa tanaman
(jerami padi, batang jagung), pangkasan dari tanaman pagar, daun-daun dan
ranting tanaman. Bahan tersebut disebarkan secara merata di atas permukaan
tanah setebal 2-5 cm sehingga permukaan tanah tertutup sempurna. Mulsa sisa
tanaman dapat memperbaiki kesuburan, struktur, dan cadangan air tanah. Mulsa
juga menghalangi pertumbuhan gulma, dan menyangga (buffer) suhu tanah agar
tidak terlalu panas dan tidak terlalu dingin. Selain itu, sisa tanaman dapat menarik
binatang tanah (seperti cacing), karena kelembaban tanah yang tinggi dan
tersedianya bahan organik sebagai makanan cacing. Adanya cacing dan bahan
organik akan membantu memperbaiki struktur tanah.
Mulsa sisa tanaman akan melapuk dan membusuk. Karena itu perlu
menambahkan mulsa setiap tahun atau musim, tergantung kecepatan pembusukan.
Sisa tanaman dari rumput rumputan, seperti jerami padi, lebih lama melapuk
dibandingkan bahan organik dari tanaman leguminose seperti benguk, Arachis,
dan sebagainya (WAC 2005).
Menurut Sudriatna et al. (1993), jerami padi dapat digunakan sebagai
sumber bahan organik dalam meningkatkan hasil kedelai. Pernyataan tersebut
didukung oleh Mastur dan Sunarlim (1993) yang melaporkan kenaikan hasil
kedelai di Mojosari dan karawang dengan pemberian mulsa masing-masing 5
ton/ha dan 6 ton/ha dapat meningkatkan hasil kedelai sebesar 300 kg/ha dan 492
kg/ha. Adapun kombinasi pemberian mulsa 5 ton/ha dan penempatan biji kedelai
di tunggul bekas padi dapat meningkatkan atau memperbaiki pertumbuhan akar
Plant Growth Promoting Rhizobacteria (PGPR)
Strategi biologi dalam sistem PHT-Biointensif meliputi aplikasi agen hayati,
PGPR. Pemanfaatan Agen hayati telah banyak dilakukan untuk menekan penyakit
pustul bakteri dan bersifat memacu pertumbuhan tanaman. Isolat rizobakteri dapat
berfungsi sebagai pemacu pertumbuhan tanaman dan sebagai agens antagonis
terhadap patogen tanaman disebut PGPR. PGPR yang diaplikasikan merupakan
kombinasi antara Bacillus subtilis AB89 dan Pseudomonas fluorescens RH4003.
B. subtilis AB89
Isolat B. subtilis AB89 merupakan isolat yang berasal dari rizosfer
tanaman tomat. Diketahui, B. subtilis AB89 memiliki karakteristik positif
menghasilkan siderofor setelah diinkubasi selama 3 hari (Nawangsih 2006).
Siderofor berasal dari bahasa Yunani berarti pembawa ion besi, siderofor akan
muncul pada saat kondisi lingkungan dengan ion Fe3+ terbatas dan mengakibatkan
besi tidak tersedia bagi patogen (bersifat kompetisi dengan patogen). Crosa dan
Walsh (2002) melaporkan bahwa siderofor yang dihasilkan B. subtilis adalah
bacillobactin.
Menurut Nawangsih (2006) B. subtilis AB89 memiliki kelebihan
dibandingkan dengan agens biokontrol lain yang digunakan dalam pengujian
antara lain yaitu: menghasilkan zone hambatan dengan diameter paling besar,
menghasilkan penekanan paling tinggi terhadap keparahan penyakit di lapangan
meskipun kemampuan mengkolonisasi perakaran bibit lebih rendah, mampu
menginduksi aktifitas peroksidase paling tinggi, serta menghasilkan siderofor dan
protease. Enzim peroksidase merupakan salah satu enzim yang berperan dalam
proses ketahanan tanaman terhadap patogen (Brimecombe et al. 2001).
Lebih lanjut Stermer (1995) menyatakan peroksidase berfungsi dalam
polimerisasi oksidatif hydroxyccinnamyl alkohol untuk membentuk lignin.
Peranan peroksidase yang lain adalah sebagai sarana pembentukan
“hydroxyproline-rich structural protein” dalam dinding sel sehingga dinding sel
menjadi lebih tahan terhadap degradasi oleh mikroorganisme. Peroksidase juga
Nawangsih (2006) menggunakan isolat B. subtilis AB89 untuk
menghambat perkembangan bakteri patogen Ralstonia solanacearum pada tomat.
Aplikasi agens biokontrol di lapangan menunjukkan bahwa isolat AB89 mampu
menekan perkembangan penyakit layu bakteri. Selain itu, Handini (2011)
melaporkan kombinasi antara B. subtilis AB89 dan bakteri endofit BL10 mampu
menekan perkembangan penyakit layu bakteri pada tomat di lapangan, dan
mampu meningkatkan tinggi tanaman jika dikombinasikan dengan bakteri endofit
BC10.
P. fluorescens RH4003
Sama seperti B. subtilis AB89, isolat P. fluorescens RH4003 merupakan
isolat yang berasal dari rizosfer tanaman tomat. Berdasarkan hasil sekuensing
parsial 16S rDNA, isolat P. fluorescens RH4003 memiliki kesamaan 98% dengan
P. fluorescens. Karakter fisiologi P. fluorescens RH4003 yaitu gram negatif,
tidak membentuk spora, menghasilkan senyawa floresen pada medium King’s B
agar, Levan positif, reaksi oksidase positif, Arginine dihydrolase positif, tidak
menghasilkan reaksi hipersensitif pada tembakau, tidak tumbuh pada 41 0C, tidak
mencairkan gelatin, dan pertumbuhannya positif pada L-arabinosa, D-galaktosa
serta sorbitol. Produksi asam dari xylose positif, lactose negatif, glukosa positif,
maltosa negatif, dan sukrosa positif lemah (Nawangsih 2006).
Isolat P. fluorescens RH4003 juga diketahui tidak menghasilkan zona
hambatan pada media NA tetapi pada media King’s B dan CPMA –Ca2+
menunjukkan adanya zona hambatan. Luas zona hambatan dipengaruhi oleh jenis
media. Media King’s B merupakan media yang memiliki kandungan Fe yang
sangat rendah, hal tersebut sangat cocok bagi pembentukan siderofor oleh P.
fluorescens. Isolat P. fluorescens RH4003 membentuk zona hambatan pada
media yang mengandung glukosa tetapi tidak pada media yang mengandung
mannitol maupun dextrose. Diketahui juga bahwa Isolat P. fluorescens RH4003
menghasilkan siderofor dan mampu meningkatkan aktivitas enzim peroksidase
(Nawangsih 2006). Selanjutnya, Nawangsih (2006) melaporkan pengujian di
perkembangan penyakit layu bakteri, indeks penekanan oleh isolat P. fluorescens
RH4003 yaitu sebesar 62%.
Kelimpahan Bakteri Rizosfer
Indikator keberhasilan sistem PHT-Biointensif salah satunya adalah tanah
aktif. Strategi tanah aktif sangat berkaitan dengan kelimpahan dan keragaman
mikroorganisme tanah. Umumnya jumlah mikroba dalam tanah lebih banyak
daripada dalam air ataupun udara. Bahan organik dan senyawa anorganik lebih
tinggi dalam tanah sehingga cocok untuk pertumbuhan mikroba heterotrof
maupun autotrof. Keberadaan mikroba di dalam tanah terutama dipengaruhi oleh
sifat kimia dan fisika tanah. Komponen penyusun tanah yang terdiri atas pasir,
debu, lempung dan bahan organik maupun bahan penyemen lain akan membentuk
struktur tanah. Struktur tanah akan menentukan keberadaan oksigen dan lengas
dalam tanah. Dalam hal ini akan terbentuk lingkungan mikro dalam suatu struktur
tanah. Mikroba akan membentuk mikrokoloni dalam struktur tanah tersebut,
dengan tempat pertumbuhan yang sesuai dengan sifat mikroba dan lingkungan
yang diperlukan. Dalam suatu struktur tanah dapat dijumpai berbagai mikrokoloni
seperti mikroba heterotrof pengguna bahan organik maupun bakteri autotrof,dan
bakteri aerob maupun anaerob. Untuk kehidupannya, setiap jenis mikroba
mempunyai kemampuan untuk mengubah satu senyawa menjadi senyawa lain
dalam rangka mendapatkan energi dan nutrien. Dengan demikian adanya mikroba
dalam tanah menyebabkan terjadinya daur unsur-unsur seperti karbon, nitrogen,
fosfor dan unsur lain di alam.
Tanah merupakan habitat yang kaya akan mikroorganisme. Mikroorganisme
tersebut ada yang bersifat menguntungkan dan ada yang bersifat merugikan. Salah
satu mikroba tanah yang banyak ditemukan dan dimanfaatkan adalah bakteri
tanah. Beberapa kelompok bakteri tanah mampu menghambat pertumbuhan
patogen. Contoh bakteri tanah yang diketahui bersifat antagonis adalah bakteri
kitinolitik, Actinomycetes, P. fluorescens, Bacillus sp (B. subtilis dan B. Cereus)
(Bolan 1991).
Bakteri kitinolitik merupakan bakteri yang kompeten memproduksi enzim
dan nitrogen (Wu et al. 2001). Kitinase dapat mendegradasi kitin yang merupakan
komponen penting pada dinding sel cendawan, integumen serangga, dan kerangka
luar golongan arthopoda, moluska, nematoda dan protozoa. Dengan demikian,
aktivitas kitinase mampu menghambat pertumbuhan miselia dan perkecambahan
spora cendawan serta merusak integumen serangga. Kitinase yang dihasilkan
mikroorganisme memiliki berat molekul yang berkisar antara 20.000-120.000 kda,
pada bakteri berat molekul antara 60.000-110.000 kda dan pada Actinomycetes
berkisar antara 30.000 atau yang lebih rendah (Wang dan Chang 1997).
Sudjono (1997) melapokan bakteri kitinolitik Arthobacter sp. dan Hafnia sp.
telah diketahui mampu mengendalikan Fusarium sp. dan Sclerotinia sp pada
tanaman tomat dan arbei. Selain itu, Wenuganen (1996) berhasil mengklon gen
kitinase dari Aeromonas caviae isolat WS7b yang diisolasi dari kepulauan
Bangka.
Genus bakteri yang telah banyak dilaporkan menghasilkan Kitinase antara
lain Aeromonas, Alteromonas, Chromobacterium, Enterobacter, Ewingella,
Pseudoalteromonas, Pseudomonas, Serratia dan Vibrio (Chernin et al. 1998).
Beberapa spesies yang telah dipelajari antara lain Aeromonas sp, Bacillus cereus,
B. licheformis (Pleban et al. 1997), Clostridium sp, Enterobacter liquefaciens,
Flavobacterium indolthecium, Klebsiella sp, Micrococcus colpogenes,
Pseudomonas sp, Serratia marcencens, Vibrio parahaemaluticus, V.
Alginolyticus, Bacillus dan Pyrococcus (Gao et al. 2003).
Selain bakteri kelompok kitinolitik, bakteri tanah lain yang diketahui
mampu menghambat pertumbuhan patogen adalah bakteri tahan panas, dan P
fluorescens. Bakteri tahan panas yang telah banyak diketahui adalah bakteri
golongan Bacillus sp. Golongan bakteri ini merupakan bakteri gram postif yang
membentuk spora. Spora berfungsi untuk bertahan hidup pada suhu ekstrim
sekitar 700 sampai 1000 C (Pelchzar dan Chan 1986).
Sebagian besar bakteri genus Bacillus sp. bersifat saprofitik (Schaad
2001). Bakteri saprofitik tidak memiliki kemampuan untuk menyebabkan
penyakit atau reaksi hipersensitif pada tanaman tembakau. Hubungan ini hanya
dimiliki oleh bakteri patogen tumbuhan. Meskipun biasanya bakteri saprofitik
yang lama, populasinya umumnya tetap (Goodman dan Novacky 1996). Bacillus
sp. memiliki daya tahan hidup yang cukup tinggi khususnya terhadap suhu tinggi
karena menghasilkan endospora tahan panas (Compant et al. 2005), sehingga
sangat potensial digunakan sebagai agens pengendali hayati patogen tumbuhan.
Peran Bacillus sp. sebagai agens pengendali hayati sangat bervariasi tergantung
isolat antagonis, patogen dan lingkungannya (Arwiyanto et al. 1999).
Aktivitas antagonisme yang utama disebabkan oleh kemampuan
menghasilkan antibiotik. Senyawa antibiotik golongan polipeptida mempunyai
kemampuan penghambatan dengan melakukan penghambatan sintesis protein,
dinding sel dan membran sel, misalnya pengaruh batricin pada bakteri yaitu
terhadap biosintesis peptidoglikan. Penghambatan ini terjadi karena batricin
mampu mengikat poliprenil pirofosfat yang merupakan salah satu materi penting
dalam sintesis peptidoglikan. Pembentukan antibiotika terjadi ketika proses
sporulasi (Franklin dan Snow 1981 dalam Salamah 1999).
Penggunaan Bacillus spp. sebagai agens pengendalian hayati pada patogen
tanaman telah banyak dilaporkan. Wartono (2010) melaporkan B. subtilis efektif
menekan perkembangan Xanthomonas oryzae pv. oryzae di lapangan serta efektif
dalam meningkatkan bobot gabah kering di lapangan mencapai 69. 2 gram/
rumpun. Arwiyanto et al. (1999) melaporkan bahwa pemanfaatan Bacillus sp.
strain Ba-118 dapat menurunkan indeks penyakit layu bakteri sampai 60 % di
percobaan rumah kaca. Yulianti et al. (1999) melalui pengujian laboratorium
maupun pada tanaman di lapangan menghasilkan kesimpulan bahwa B. cereus
mampu menurunkan serangan patogen R. solanacearum sampai 40%. Menurut
Dropkin (1996), B. penetrans dapat menginfeksi larva Meloidogyne incognita
yang masih aktif sehingga mempunyai potensi yang sangat tinggi sebagai agens
pengendalian hayati. Spora mampu bertahan di dalam tanah, tidak dapat di bunuh
oleh nematisida dan dibawah pengaruh tanaman inang yang rentan terhadap
nematoda puru akar secara terus menerus, tanah dapat menimbun cukup spora
untuk memusnahkan sebagian besar nematoda.
Kelompok bakteri lain yang berpotensi sebagai agens hayati adalah bakteri
P. fluorescens. Bakteri kelompok ini dicirikan dengan menghasilkan pigmen
Pigmen tersebut berupa senyawa flouresein atau pyoverdin yang berpendar di
bawah cahaya ultraviolet (panjang gelombang 266 nm) (Misagi et al. 1982 dalam
Khaeruni 1998).
Penggunaan bakteri Pseudomonas kelompok fluorescence sebagai agens
pengendalian hayati pada patogen tanaman telah banyak dilaporkan. Mariani
(1995) mengisolasi 52 isolat bakteri dari daun kedelai, dan diperoleh 3 isolat
masing-masing isolat B29, B30, dan B39 yang dinyatakan berpotensi untuk
dikembangkan sebagai agens biokontrol. Penelitian Suwanto et al. (1996)
melaporkan bahwa analisis supernatan bebas sel isolat P. flurescens B29 dan B39
tidak menghasilkan senyawa bioaktif yang dapat menghambat pertumbuhan X.
BAHAN
DAN
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Bakteriologi Departemen Proteksi
Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dan Lahan percobaan di
Desa Ciburuy, Kecamatan Cigombong, Sukabumi. Berada pada ketinggian 495 m
dpl, 60, 430 LS, 1060, 48,32 BT. Penelitian dilaksanakan pada bulan Agustus
sampai Juni 2011.
Percobaan Pengaruh Varietas Kedelai, Mulsa jerami dan PGPR
Percobaan pengaruh varietas, mulsa jerami dan PGPR di lapangan
dilakukan dalam Rancangan Acak Kelompok Faktorial yang terdiri dari 3 faktor
perlakuan, masing-masing 2 taraf perlakuan, 3 kali ulangan sebagai berikut:
1. Varietas : Anjasmoro (V1) dan Gepak Kuning (V2)
2. Mulsa Jerami : Dengan mulsa jerami (M1) dan Tanpa mulsa jerami (M2)
3. PGPR : Dengan PGPR (P1) dan Tanpa PGPR (P2)
Lahan percobaan terletak di Desa Ciburuy, Kecamatan Cigombong,
Sukabumi, seluas 1344 m2 yang dibagi menjadi 24 petakan berukuran masing-
masing 8 m x 8 m. Di dalam petak dibuat 8 guludan dengan ukuran 0.7 m x 8 m
dan jarak antar guludan 0.3 m. Tiap guludan dibuat 2 baris tanaman dengan jarak
40 cm.
Varietas kedelai (Anjasmoro dan Gepak Kuning) sebagai faktor perlakuan
pertama masing-masing ditanam dengan jarak tanam 20 cm x 20 cm. Setiap
lubang tanam diisi 2 butir benih. Disamping guludan dibuat parit kecil untuk alur
pupuk NPK dengan komposisi 1:1:1.
Pemberian mulsa jerami padi sebagai faktor perlakuan kedua dilakukan
setelah penanaman. Mulsa dipasang dengan cara menutupi keseluruhan
permukaan tanah dengan jerami padi.
Perlakuan biokontrol yang merupakan formulasi antara bakteri (B. subtilis
AB 89 dan P. fluorescens RH4003) diberikan 2 minggu setelah tanam. Formulasi
kemudian disuspensikan ke dalam 1 liter medium LB, dihomogenkan dengan
inkubator bergoyang selama 24 jam. Apikasi dilakukan dengan cara menyiramkan
50 ml (konsentrasi 107-108 cfu/ml) suspensi disekitar pertanaman tanaman
kedelai.
Pengamatan Percobaan
Peubah pengamatan percobaan pengaruh varietas, mulsa jerami dan PGPR
adalah sebagai berikut.
Keparahan dan Perkembangan Penyakit
Keparahan penyakit diasumsikan sebagai persentase luasnya jaringan
tanaman yang terserang patogen dari total luasan yang diamati, dengan
memprediksi nilai skoringnya berdasarkan kriteria skoring (Sinclair et al. 1989)
dan dihitung nilai keparahan penyakit berdasarkan rumus Townsend dan
Hueberger (dalam Unterstenhofer 1963) sebagai berikut:
x 100%
Keterangan:
KP = Keparahan penyakit
ni = Jumlah tanaman yang terinfeksi pada setiap kategori
vi = Nilai numerik masing-masing kategori serangan
Z = Nilai numerik kategori serangan tertinggi
N = Jumlah tanaman yang diamati
Kriteria penilaian yang digunakan merupakan modifikasi dari gejala penyakit
bercak yang biasanya terjadi pada daun kedelai (Sinclair 1982). Berdasarkan nilai
keparahan penyakit dengan nilai skoring sebagai berikut:
0 = tidak ada serangan
1 = bercak pustul 0 > X > 5% dari total seluruh daun per tanaman
2 = bercak pustul antara 5 < X < 15% dari total seluruh daun per tanaman
3 = bercak pustul antara 15 < X < 30% dari total seluruh daun per tanaman
4 = bercak pustul antara 30 < X < 50% dari total seluruh daun per tanaman
Keparahan penyakit diamati tiap minggu mulain 1 minggu setelah tanam (1
MST) sejak munculnya gejala sampai 12 MST. Selain nilai keparahan penyakit,
dihitung pula nilai Area Under Disease Progress Curve (AUDPC) untuk melihat
perkembangan penyakit. Rumus AUDPC dihitung berdasarkan rumus Van der
Plank (1963):
Dengan yi+1= Data pengamatan ke-i +1
yi = Data pengamatan ke-i
ti +1 = Waktu pengamatan ke-i +1
ti = Waktu pengamatan ke-i
Kelimpahan Bakteri Kitinolitik, Tahan Panas dan Fluorescence
Pengujian diawali dengan pengambilan sampel tanah dari rizosfer tanaman
sampel di lahan percobaan. Tanah diambil pada kedalaman + 10 cm didekat
perakaran tanaman sampel. Pengambilan dilakukan dengan metode pengambilan
sampel metode huruf S (Gambar 4). Sampel tanah diambil setiap satu bulan sekali
selama pengamatan. Pengambilan sampel tanah dilakukan untuk mengetahui
kelimpahan dan keragaman dan dari bakteri kitinolitik, tahan panas, dan
kelompok fluorescence selama pengamatan.
Gambar 2 Metode pengambilan sampel metode S
Penghitungan kelimpahan bakteri kitinolitik, tahan panas, dan kelompok
flourescence dilakukan tiap 1 bulan sekali melalui teknik pengenceran dan
yang mewakili setiap perlakuan. Tanah diambil sekitar 20 cm dekat pertanaman.
Kemudian dilakukan isolasi melalui pengenceran dan pencawanan untuk
menghitung populasinya.
Bakteri rizosfer diisolasi dari tanah di sekitar perakaran tanaman contoh
diambil sebanyak 20 gram pada kedalaman + 20 cm. Contoh tanah diambil pada
saat kedelai berada pada fase vegetatif, tanaman berumur 3 minggu setelah tanam
(MST), fase pembungaan (6 MST) dan fase pengisian polo