DILANJUTKAN PADA TAHAP BLASTOSIS
CANDRANI KHOIRINAYA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Viabilitas Embrio Mencit (Mus musculus albinus) setelah Kriopreservasi dengan Vitrifikasi Ganda pada Tahap Perkembangan Zigot dan Dilanjutkan pada Tahap Blastosis” adalah karya saya dengan arahan pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Mei 2011
Candrani Khoirinaya
CANDRANI KHOIRINAYA. Viabilitas Embrio Mencit (Mus musculus albinus) setelah Kriopreservasi dengan Vitrifikasi Ganda pada Tahap Perkembangan Zigot dan Dilanjutkan pada Tahap Blastosis. Dibimbing oleh ARIEF BOEDIONO dan WAHONO ESTHI PRASETYANINGTYAS.
Perkembangan teknologi pembekuan embrio dengan metode vitrifikasi memungkinkan penyimpanan sel sebagai bank genetik atau sel yang dapat dimanfaatkan di masa mendatang. Penelitian ini bertujuan mengetahui viabilitas embrio mencit setelah vitrifikasi ganda tahap zigot dan dilanjutkan pada tahap blastosis. Embrio mencit galur DDY tahap zigot diperoleh melalui superovulasi dengan menyuntikkan hormon pregnant mare serum gonadotrophin (PMSG) yang diikuti dengan hormon human chorionic gonadotrophin (hCG) 48 setelahnya. Sebelum zigot disimpan dalam nitrogen cair, zigot divitrifikasi dengan memapar dalam medium vitrifikasi yang terdiri atas etilen glikol 15% + dimetilsulfoksida 15% + sukrosa 0.5M di dalam larutan dulbecco’s phosphate buffered saline (DPBS) yang disuplementasi fetal bovine serum (FBS) 20% dan diteteskan pada ujung straw 0.25 ml yang telah disayat (wadah hemi-straw). Proses penghangatan dilakukan pada medium rehidrasi yang terdiri atas larutan sukrosa bertingkat yaitu 0.5M, 0.25M, 0.1M di dalam larutan DPBS yang disuplementasi FBS 20%. Hasil penelitian menunjukkan bahwa kelangsungan hidup setelah vitrifikasi ganda pada tahap zigot dan dilanjutkan pada tahap blastosis berturut-turut mencapai 96.81% dan 92.50%, setelah 2 jam kultur in vitro hasil ini tidak berbeda (P>0.05) dibandingkan kelompok kontrol. Perkembangan embrio tahap blastosis hatched setelah vitrifikasi tunggal pada tahap blastosis mencapai 80%, sedangkan setelah vitrifikasi ganda mencapai 66.22%, tidak berbeda (P>0.05) dibandingkan kelompok kontrol (79.62%). Hasil penelitian ini menunjukkan bahwa embrio mencit dapat dibekukan dengan vitrifikasi ganda pada tahap zigot dan dilanjutkan pada tahap blastosis.
ABSTRACT
CANDRANI KHOIRINAYA. Viability of Mouse (Mus musculus albinus) Embryo after Cryopreservation by Double Vitrification of Zygote Followed by Blastocyst Stage. Under direction of ARIEF BOEDIONO and WAHONO ESTHI PRASETYANINGTYAS.
Development of cryopreservation technology by vitrification method allowed cell storage as a genetic or cell banking that can be utilized in the future. The aim of this research was to find out the viability of mouse embryo after double vitrification at zygote and followed by blastocyst stage. Zygote were obtained from DDY mouse through superovulation by injecting the pregnant mare serum gonadotrophin (PMSG) hormone, followed by human chorionic gonadotrophin (hCG) hormone with interval 48 hours. Before the zygote was being plunged into liquid nitrogen, they were exposed to vitrification medium consist of 15% ethylene glycol + 15% dimethylsulfoxide + 0.5M sucrose in dulbecco’s phosphate buffered saline (DPBS) which supplemented with 20% fetal bovine serum (FBS) and then dropped onto the open inner face of the 0.25 ml straw (hemi-straw carrier). Warming process was done in rehydration medium (sucrose solution leveled by 0.5M, 0.25M, 0.1M in DPBS solution which supplemented with 20% FBS. The result showed that survival rate after double vitrification at zygote and followed by blastocyst stage were 96.81% and 92.50%, respectively, two hours after in vitro culture was similar (P>0.05) compared to control group. The development of hatched blastocyst embryos after single vitrification at blastocyst stage reached 80%, meanwhile after double vitrification reached 66.22%, they were not different (P<0.05) compared to the control group (79.62%). In conclusion, the mouse embryo could be double vitrified at zygote followed by blastocyst stage.
©Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
VIABILITAS EMBRIO MENCIT (Mus musculus albinus)
SETELAH KRIOPRESERVASI DENGAN VITRIFIKASI
GANDA PADA TAHAP PERKEMBANGAN ZIGOT DAN
DILANJUTKAN PADA TAHAP BLASTOSIS
CANDRANI KHOIRINAYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Nama : Candrani Khoirinaya NIM : B04063491
Disetujui
Prof. drh. Arief Boediono, Ph.D, PAVet(K) drh. Wahono Esthi Prasetyaningtyas, M.Si
Pembimbing I Pembimbing II
Diketahui
Dr. Nastiti Kusumorini
Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Bismillahirrahmanirrakhim
Alhamdulillahirabbil’alamin, lantunan rasa syukur kepada Allah SWT untuk setiap petunjuk dan kemudahan yang senantiasa diberikan kepada penulis sehingga dapat menyelesaikan karya ilmiah ini. Penelitian ini telah dilaksanakan pada bulan Januari 2010 hingga Januari 2011 dengan judul “Viabilitas Embrio Mencit (Mus musculus albinus) setelah Kriopreservasi dengan Vitrifikasi Ganda pada Tahap Perkembangan Zigot dan Dilanjutkan pada Tahap Blastosis”. Karya ilmiah ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Upaya penyimpanan gamet, embrio dan jaringan reproduksi dengan metode kriopreservasi telah berkembang pesat. Teknologi kriopreservasi dapat bermanfaat sebagai salah satu bentuk pelestarian plasma nutfah dari satwa langka dan bank gamet atau embrio hasil produksi secara in vivo maupun in vitro. Pada praktek klinik manusia, kelebihan embrio dan adanya kasus Ovarian Hyperstimulation Syndrome (OHSS) setelah stimulasi hormon pada program bayi tabung memerlukan penanganan berupa kriopreservasi embrio untuk bisa dimanfaatkan dikemudian hari tanpa harus mengulang program bayi tabung dari awal. Metode kriopreservasi yang saat ini banyak diterapkan adalah vitrifikasi. Penelitian tentang vitrifikasi ganda pada embrio mencit tahap zigot dan dilanjutkan pada tahap blastosis dengan wadah hemi-straw belum dilakukan. Salah satu indikator keberhasilan vitrikasi adalah viabilitas, oleh karena itu perlu dilakukan penelitian untuk mengetahui viabilitas embrio setelah vitrifikasi ganda dengan menggunakan mencit sebagai hewan model.
Penulis menyadari dalam penyusunan karya ilmiah ini masih terdapat kekurangan. Walaupun demikian, penulis berharap karya ilmiah ini dapat bermanfaat bagi semua pihak.
Bogor, Mei 2011
Dalam menyelesaikan karya ilmiah ini, penulis banyak mendapat bantuan, doa, serta dukungan dari berbagai pihak. Sebagai bentuk rasa syukur kepada Allah SWT, penulis ingin menyampaikan terimakasih dan penghargaan kepada: 1. Prof. drh. Arief Boediono, Ph.D, PAVet (K) sebagai dosen pembimbing skripsi
pertama, atas segala arahan, bimbingan, kesabaran, pikiran, waktu, perhatian dan ketrampilan yang beliau ajarkan selama proses penelitian dan penyusunan karya ilmiah ini.
2. drh. Wahono Esthi Prasetyaningtyas, M.Si, sebagai dosen pembimbing skripsi kedua, yang telah meluangkan waktunya serta memberikan kritik dan saran yang bermanfaat bagi perbaikan karya ilmiah ini.
3. Prof. Dr. drh. Iman Supriatna, sebagai dosen penilai seminar, Prof. Dr. drh. Tuty L. Yusuf, MS dan Dr. drh. Sri Murtini, MS sebagai dosen penguji pada ujian akhir sarjana yang telah memberikan masukan dan arahan bagi penulis sehingga penulis dapat menyempurnakan karya ilmiah ini menjadi lebih baik. 4. Dr. Dra. Hj. Ietje Wientarsih, Apt, M.Sc, sebagai dosen pembimbing
akademik, atas bimbingan, perhatian, arahan dan nasihat yang diberikan. 5. Kedua orang tua tercinta, atas segala doa, cinta, kasih sayang, motivasi
terbaik yang selalu menyertai dalam kondisi apapun dan dimanapun berada. 6. Keluarga besar Laboratorium Embriologi : Dr. Drh. Ita Djuwita, MPhil, drh.
Kusdiantoro Mohamad, M.Si, drh. M. Fakhrudin, Ph.D, Bu Yani dan Pak Wahyu yang telah membantu dan mendukung pelaksanaan penelitian ini. 7. Senior-senior yang banyak membantu penulis, yaitu: Dr.Ir. Thomas Mata
Hine, M.Si, Dr. Ir. Bayu Rosadi, M.Si, Harry Murty, S.Si, Yulnawati, S.KH, M.Si, Sigit Prastowo, S.Pt, M.Si, drh. Rini Widyastuti, drh. Nining Handayani, Tita Yuningsih, S.KH, Deana Rosaria, S.KH, Ir. Irma Indriani, M.Si, Ekayanti M. Kaiin, M.Si, Devi Syafrianti, S.Si, Yeni Risman, S.Si, terimakasih atas segala bentuk tentir, latihan, diskusi, motivasi dan canda tawa.
9. Rekan sepenelitian : Riska Saftiany, Adkhilni Utami dan Vincentia Maria, yang memberikan perhatian, semangat serta doa.
10. Ex-ideutsch: Khoirun Nisa’, Indra B. Priastomo, Arifin Budiman Nugraha, Ikrar Trisnaning H.U, Adkhilni Utami, Ridzki M.F Binol, Vincentia Maria, Ni Made Ferawati, Hadi Putra, Iral Prepinida, Rio Aditya dan Afdi Pratama, atas pelajaran tentang kekuatan impian dan menyadari bahwa kegagalan adalah sukses yang tertunda, Bravo!.
11. Keluarga Besar Yayasan Goodwill International, Ibu Julie, Ibu Mien, Ibu Sri, Mbak Rosa, Mas Broto, Alm. Mrs. Mizue Hara dan Alm. Mr. Yasuo Hara, Australian and New Zealand Association (ANZA), Coca-Cola Foundation, atas kesempatan yang diberikan untuk bergabung dan belajar bersama dengan para trainer handal pada program beasiswa dan pelatihan kepemimpinan (Leadership Development Scholarship Program) periode 2010-2011.
Penulis dilahirkan di Yogyakarta pada tanggal 25 Juli 1988 sebagai putri tunggal dari pasangan Karjito dan Sudilah.
Penulis telah menyelesaikan pendidikan formal di SMAN 17 Makassar pada tahun 2006. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Setelah melewati Tingkat Persiapan Bersama (TPB), penulis tercatat sebagai mahasiswa Fakultas Kedokteran Hewan Institut Pertanian Bogor pada tahun 2007.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
Manfaat ... 3
TINJAUAN PUSTAKA Superovulasi ... 4
Perkembangan Embrio Praimplantasi ... 4
Vitrifikasi ... 6
Hemi-straw ... 7
Krioprotektan ... 8
METODE PENELITIAN Waktu dan Tempat Penelitian ... 10
Bahan Penelitian ... 10
Metode Penelitian Superovulasi ... 10
Koleksi Zigot ... 11
Vitrifikasi Menggunakan Wadah Hemi-straw ... 11
Penghangatan (warming) Embrio ... 13
Kultur In Vitro ... 14
Evaluasi Viabilitas ... 14
Pewarnaan Vital ... 14
Rancangan Percobaan ... 15
Analisis Data ... 15
HASIL DAN PEMBAHASAN Viabilitas berdasarkan morfologi zigot dan blastosis... 16
Pewarnaan vital pada zigot dan blastosis setelah vitrifikasi ... 18
Kelangsungan hidup (survival rate) zigot dan blastosis setelah vitrifikasi.. 20
Kemampuan perkembangan embrio (developmental rate) setelah vitrifikasi ... 23
SIMPULAN DAN SARAN Simpulan ... 30
Saran ... 30
xii Halaman 1 Tahapan dan waktu perkembangan embrio mencit ... 6
2 Kemampuan perkembangan embrio setelah vitrifikasi tunggal dan ganda ... 20
xiii
DAFTAR GAMBAR
Halaman
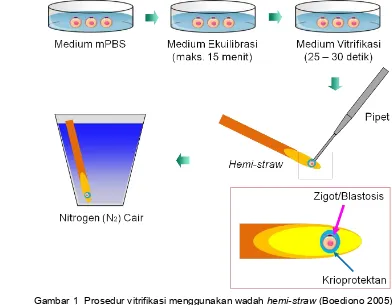
1 Prosedur vitrifikasi menggunakan wadah hemi-straw ... 12
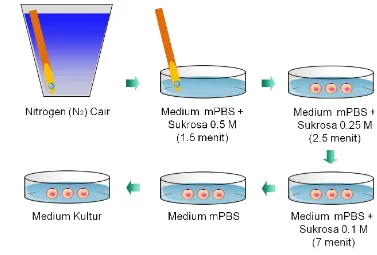
2 Prosedur penghangatan (warming) pada medium sukrosa dengan konsentrasi bertahap ... 13
3 Morfologi zigot pada proses pembekuan dengan vitrifikasi tunggal ... 16
4 Morfologi blastosis pada proses pembekuan dengan vitrifikasi ganda ... 17
5 Gambaran embrio setelah vitrifikasi dengan pewarnaan vital Hoechst-propidium iodide (Hoechst-PI). ... 19
Latar Belakang
Bidang kedokteran hewan memiliki keterkaitan erat dengan bidang kedokteran manusia, antara lain dalam aspek teknologi reproduksi. Dewasa ini, telah banyak upaya teknologi reproduksi berbantuan yang awalnya dilakukan pada hewan, kemudian diaplikasikan pada praktek klinik reproduksi manusia, seperti program bayi tabung atau fertilisasi in vitro (in vitro fertilization, IVF), kultur in vitro, pembekuan (kriopreservasi) gamet (oosit dan sperma) dan embrio, inseminasi buatan dan transfer embrio. Teknologi reproduksi berbantuan pada hewan bertujuan untuk meningkatkan jumlah keturunan dan mengurangi jarak interval keturunan, sedangkan pada praktek klinik manusia bertujuan untuk menanggulangi masalah reproduksi pada pasien infertilitas dan penderita kanker.
Salah satu teknologi reproduksi berbantuan yang saat ini banyak diminati oleh pasien dengan gangguan reproduksi adalah melalui program IVF. Seiring dengan ditemukannya IVF pada tahun 1978, para ahli medis juga telah mengungkapkan resiko-resiko yang harus ditanggung oleh pasangan suami istri yang hendak menggunakan teknologi ini. Menurut Selman et al. (2009), ovarian hyperstimulation syndrome (OHSS) atau sindroma hiperstimulasi ovarium saat ini masih menjadi komplikasi yang paling serius pada wanita yang menjalani program IVF.Akibat kondisi OHSS, embrio yang dihasilkan dari IVF akan ditunda penanamannya (transfer embrio) ke dalam rahim. Hal tersebut berhubungan dengan tingginya kadar hormon estrogen setelah proses stimulasi ovarium sampai periode transfer embrio dan rendahnya kadar hormon progesteron dalam menunjang kehamilan yang disebabkan oleh gonadotropin releasing hormone (GnRH) agonist.
2
(Whittingham 1971), sedangkan pada manusia, keberhasilan kehamilan setelah transfer embrio beku pertama kali dilaporkan oleh Trounson dan Mohr (1983).
Metode kriopreservasi yang banyak digunakan saat ini adalah vitrifikasi dimana pembekuan embrio dilakukan secara cepat pada nitrogen cair (liquid nitrogen) bersuhu -196°C sehingga diharapkan sel dan lingkungan sekitarnya di dalam medium kriopreservasi berubah menjadi vitreus atau glassy state. Vitrifikasi dilakukan dengan menggunakan krioprotektan konsentrasi tinggi sehingga dapat menghindari terbentuknya kristal es yang dapat merusak membran sel saat pembekuan (Rall & Fahy 1985). Prinsip vitrifikasi adalah meningkatkan laju pendinginan dengan meminimalkan penggunaan volume larutan vitrifikasi.
Vitrifikasi tunggal telah banyak dilaporkan pada embrio dan oosit sapi, kuda, unta, kambing, domba, kelinci, hamster, babi dan manusia. Namun demikian, penelitian tentang vitrifikasi ganda pada tahap zigot dan dilanjutkan pada tahap blastosis dengan wadah hemi-straw belum dilakukan. Vitrifikasi ganda atau re-vitrifikasi adalah vitrifikasi ulang yang dilakukan pada embrio yang sama dengan tahapan perkembangan yang berbeda. Isachenko et al. (2003) menyatakan bahwa vitrikasi ganda bertujuan mengetahui resistensi embrio, kualitas fungsional embrio dan sebagai perbaikan prosedur vitrifikasi menjadi lebih baik.
Manfaat dan penerapan vitrifikasi ganda yang terpenting adalah berkaitan dengan waktu perkembangan embrio yang tepat untuk ditransfer pada masing-masing pasien. Sebagai contoh, jika terdapat kelebihan jumlah zigot pada pasien program IVF maka zigot tersebut dapat langsung dibekukan atau dikultur in vitro sampai tahap perkembangan blastosis, lalu kemudian dibekukan lagi untuk ditransfer pada masa yang akan datang. Kegagalan kehamilan akibat OHSS dapat diatasi dengan pengulangan transfer embrio yang sebelumnya dibekukan setelah rahim pasien dalam kondisi normal.
Tujuan
Penelitian ini bertujuan untuk mengetahui viabilitas embrio mencit (Mus musculus albinus) setelah vitrifikasi ganda pada tahap zigot dan dilanjutkan pada tahap blastosis.
Manfaat
Hasil penelitian ini diharapkan dapat bermanfaat memberikan informasi: 1. Vitrifikasi ganda dapat menjadi alternatif kriopreservasi dalam mengatasi
kelebihan produksi embrio dan sindroma hiperstimulasi ovarium pada proses fertilisasi in vitro, yang disimpan dalam bentuk beku, sehingga dapat menunjang dan meningkatkan keberhasilan program transfer embrio dan manipulasi embrio.
2. Keberhasilan penelitian ini dapat digunakan sebagai informasi bahwa tidak perlu lagi mengulangi prosedur fertilisasi in vitro yang membutuhkan biaya yang besar apabila terjadi kegagalan pada proses kehamilan, cukup dengan menghangatkan embrio yang divitrifikasi.
TINJAUAN PUSTAKA
Superovulasi
Superovulasi adalah usaha meningkatkan jumlah sel telur yang diovulasikan dengan stimulasi hormon. Superovulasi pada mencit dapat dilakukan dengan menyuntikkan hormon gonadotropin secara bertahap yaitu Pregnant Mare’s Serum Gonadotropin (PMSG) dan human Chorionic Gonadotropin (hCG). Waktu yang paling tepat untuk penyuntikan hormon PMSG adalah pada pukul empat sore dan diikuti 46-48 jam kemudian dengan hCG (Ittner & Götz 2007). Mekanisme kerja hormon PMSG analog dengan Follicle Stimulating Hormone (FSH) yang berperan dalam pematangan folikel dan sedikit berperan dalam pembentukan korpus luteum. Sedangkan hormon human Chorionic Gonadotropin (hCG) bekerja analog dengan Luteinizing Hormone (LH) yang berperan dalam mempercepat proses ovulasi (Hafez et al. 2000).
Respon mencit terhadap superovulasi dipengaruhi beberapa faktor antara lain strain, umur, berat badan, dosis hormon gonadotropin serta fase siklus estrus. Mencit mencapai dewasa kelamin pada umur 6 mingggu. Jumlah embrio yang dihasilkan pada perkawinan normal adalah 7-10 embrio, sedangkan setelah perlakuan superovulasi dihasilkan 20-30 embrio per individu (Rianti 2005).
Hogan et al. (1994) menjelaskan bahwa secara normal perkawinan pada mencit terjadi saat pertengahan siklus gelap pada siklus 12 jam siklus terang dan 12 jam siklus gelap. Ovulasi merupakan kejadian pelontaran sel telur yang telah matang dari folikel de Graaf dan pada mencit terjadi secara spontan. Ovulasi terjadi pada pertengahan siklus gelap yaitu antara pukul 19.00 - 05.00. Terjadinya perkawinan dapat diamati pada keesokan paginya dengan mengamati terbentuknya masa berwarna putih kekuningan (vaginal plug) yang merupakan campuran antara plasma semen dan lendir vagina dalam lumen vagina.
Perkembangan Embrio Praimplantasi
masing-masing anak hasil pembelahan disebut blastomer. Masing-masing-masing blastomer selanjutnya akan membelah menjadi 4, 8, 16 sel dan seterusnya.
Sel-sel blastomer akan saling menyatu dan menjadi kompak, bergerombol berbentuk seperti anggur, maka embrio tahap ini disebut morula. Pada tahap morula sel bagian tengah akan memadat dibandingkan sel bagian luar. Hubungan antar sel pada sel-sel bagian dalam terjadi melalui gap junction, sedangkan sel-sel permukaan melalui tight junction. Tight junction diyakini menjadikan sel pada daerah permukaan lebih permeabel dibandingkan sel-sel sebelah dalam. Terbentuknya tight junction pada sel-sel permukaan akan merangsang akumulasi cairan dalam morula. Akumulasi cairan ini terjadi karena konsentrasi ion di bagian dalam meningkat sehingga air akan masuk ke dalam embrio, dan mulai membentuk rongga yang disebut blastosul. Embrio yang sudah memiliki rongga blastosul disebut blastosis.
Sel-sel blastomer pada blastosis akan terus bermitosis dan akumulasi cairan akan semakin bertambah. Sel-sel bagian dalam blastosis akan saling berkomunikasi melalui gap junction membentuk inner cell mass (ICM), sedangkan sel-sel di bagian permukaan yang berkomunikasi dengan tight junction akan menjadi trofoblas. Trofoblas memproduksi enzim proteolitik yang berfungsi untuk menipiskan zona pelusida, sehingga zona pelusida mudah pecah. Adanya pertambahan jumlah sel, akumulasi cairan dan melemahnya zona pelusida menyebabkan zona pelusida pecah dan embrio keluar dari zona pelusida. Proses ini disebut hatching (menetas). Selanjutnya embrio tanpa zona ini (hatched) akan berkomunikasi dengan endometrium untuk proses implantasi.
6
Tabel 1 Tahapan dan waktu perkembangan embrio mencit
Tahap Perkembangan Embrio Waktu (Jam)
1 sel 0-20
2 sel 24
4 sel 48
8 sel 52
Morula 72
Blastosis 96
Blastosis hatched – Implantasi 120 Sumber : Theiler (1989).
Vitrifikasi
Pembekuan (kriopreservasi) telah menjadi bagian yang tidak terpisahkan dari teknologi reproduksi berbantuan (Assisted Reproductive Technology, ART). Penelitian dasar dan aplikatif selama ini telah menghasilkan beberapa prosedur kriopreservasi embrio. Berdasarkan prosedur pendinginan dan konsentrasi krioprotektan yang digunakan, dikenal metode konvensional dengan pembekuan lambat (conventional slow freezing), pembekuan cepat (ultra rapid freezing) dan metode vitrifikasi.
Metode konvensional membutuhkan biaya yang relatif mahal karena menggunakan mesin pendingin yang dapat diprogram (program freezer machine) untuk mengatur pendinginan secara bertahap. Selain itu, metode ini juga melibatkan proses pembekuan bertahap dengan menekankan pentingnya proses seeding. Seeding merupakan proses inisiasi pembentukan kristal es ekstraseluler dengan menyentuhkan forceps dingin pada bagian luar straw. Laju pendinginan yang lambat menyebabkan tingginya peluang terbentuknya kristal es yang bersifat letal bagi sel (Boediono 2005). Terbentuknya kristal es intraseluler dapat menyebabkan kerusakan membran, organel sel dan hilangnya kemampuan embrio untuk tumbuh setelah proses pembekuan. Penggunaan metode slow freezing untuk kriopreservasi embrio tahap blastosis pada semua spesies termasuk manusia, memberikan hasil yang kurang memuaskan karena terjadi penurunan viabilitas, ketidakstabilan bentuk dan kemampuan implantasi setelah dilakukan thawing (Lane et al. 1999).
keberhasilan tidak terlepas dari pengoptimalan masing-masing tahap prosedur yang digunakan dalam hubungannya dengan ukuran, permeabilitas, dan sifat fisiologis awal sel tersebut. Dengan demikian keseluruhan prosedur tersebut dapat mempertahankan sel (Rall 1992).
Upaya modifikasi metode pembekuan terus dilakukan sebagai alternatif kriopreservasi metode konvensional slow freezing, antara lain dengan metode pembekuan cepat (rapid dan ultra rapid freezing) sampai pada metode vitrifikasi di mana pembentukan kristal es dihindari pada saat pembekuan. Rall dan Fahy (1985) melaporkan bahwa metode vitrifikasi lebih efektif, cepat, sederhana dan lebih murah tanpa menggunakan alat pembekuan khusus.
Vitrifikasi adalah pembekuan sel ataupun embrio yang dilakukan secara cepat pada nitrogen cair bersuhu -196°C sehingga diharapkan sel dan lingkungan sekitarnya di dalam medium kriopreservasi berubah menjadi vitreus atau glassy state. Keunggulan prosedur vitrifikasi adalah mampu mengeliminasi secara total pembentukan kristal es baik secara intraseluler maupun ekstraseluler, protokol lebih sederhana dan waktu pengerjaan yang lebih singkat. Liebermann et al. (2002) melaporkan bahwa metode ini dapat diaplikasikan secara luas pada embrio mamalia.
Tujuan vitrifikasi adalah menyimpan embrio dalam waktu lama dengan cara menghentikan aktivitas metabolismenya yang dilakukan pada suhu -196ºC dalam nitrogen cair. Dengan metode ini sebagian besar air di dalam sel dikeluarkan sebelum terjadi pembekuan intraseluler dan digantikan dengan krioprotektan, sehingga pada saat pembekuan tidak terjadi kristal es (Rall & Fahy 1985). Banyak faktor yang mempengaruhi keefektifan dan keberhasilan vitrifikasi, antara lain: (1) Jenis dan konsentrasi krioprotektan yang digunakan; (2) Suhu larutan vitrifikasi yang digunakan saat memapar sel; (3) Lama waktu yang digunakan dalam memapar sel pada krioprotektan sebelum dicelupkan dalam nitrogen cair; (4) Jenis wadah yang digunakan untuk vitrifikasi, karena ukuran permukaan pemaparan mempengaruhi laju pendinginan dan (5) Kualitas sel dan jaringan yang divitrifikasi.
Hemi-straw
8
konvensional, embrio dikemas dalam straw ukuran 0.25 ml untuk selanjutnya didinginkan secara cepat langsung dalam nitrogen cair. Namun pada kenyataannya, ketebalan dan bahan dari straw yang digunakan akan mempengaruhi proses pendinginan dan pencairan secara cepat sehingga diduga masih dapat menyebabkan terbentuknya kristal es intraseluler. Sedangkan pada metode vitrifikasi minimalis krioprotektan, volume krioprotektan yang digunakan minimum sehingga dapat menurunkan pengaruh osmosis dan toksisitas (Boediono 2005).
Memperkecil volume krioprotektan dapat dilakukan dengan menggunakan wadah khusus selama proses vitrifikasi. Jenis wadah yang digunakan merupakan salah satu faktor yang mempengaruhi keefektifan dan keberhasilan vitrifikasi. Penggunakan wadah tersebut bertujuan untuk memperoleh laju pendinginan yang tinggi. Beberapa metode menggunakan wadah seperti open pulled straw (OPS; Vajta et al. 1998; Chen et al. 2000a,b; Hurtt et al. 2000; Oberstein et al. 2001), flexipet-denuding pipette (FDP; Liebermann et al. 2002), micro-drops (Papis et al. 2000), electron microscope copper grids (EM; Hong et al. 1999; Chung et al. 2000; Park et al. 2000), hemi-straw system (Vandervorst et al. 2001; Vanderzwalmen et al. 2003), nylon mesh (Matsumoto et al. 2001), cryoloop (Lane et al. 1999; Oberstein et al. 2001; Yeoman et al. 2001; Batan et al. 2009) dan cryotop (Murakami et al. 2011).
Wadah yang digunakan pada penelitian ini adalah modifikasi hemi-straw yang menggunakan straw 0.25 ml yang telah disayat bagian ujungnya, sehingga volume krioprotektan yang digunakan minimum dan proses pendinginan dapat berjalan lebih cepat. Wadah ini awalnya dikembangkan oleh Vandervorst et al. (2001) dengan menempatkan embrio dan sedikit krioprotektan (< 1.0 µl) diatas straw yang telah disayat bagian ujungnya sepanjang 1 cm. Dengan demikian, embrio langsung dicelupkan dalam nitrogen cair dengan posisi vertikal sehingga didapatkan derajat pendinginan yang cukup tinggi.
Krioprotektan
krioprotektan juga dapat menimbulkan kerusakan pada sel akibat sifatnya yang toksik (Fahy 1986; Fahy et al. 1990).
Boediono (2005) mengelompokkan krioprotektan menjadi dua, berdasarkan sifat krioprotektan terhadap permeabilitas membran sel, yaitu: (1) krioprotektan yang dapat masuk ke dalam sel (permeable cryoprotectants), misalnya etilen glikol (EG), dietilen glikol, gliserol, 1.2-propanediol (PROH) dan dimetilsulfoksida (DMSO); (2) krioprotektan yang tidak dapat masuk ke dalam sel (permeable cryoprotectants), misalnya polivinilpirolidon (PVP), protein (susu, kuning telur, albumin, serum), karbohidrat seperti gula (glukosa, sukrosa, trehalosa, manosa, rafinosa).
Penggunaan krioprotektan pada proses kriopreservasi umumnya mengkombinasikan lebih dari satu krioprotektan intraseluler (bersifat permeabel) dan juga menambahkan krioprotektan ekstraseluler (bersifat non-permeabel). Hal ini bertujuan untuk mengurangi efek toksik krioprotektan. Etilen glikol, dimetilsulfoksida, dan gliserol merupakan krioprotektan yang banyak digunakan dalam proses kriopreservasi (Liebermann et al. 2002). Menurut Dattena et al. (2004) penggunaan krioprotektan dengan permeabilitas yang tinggi, seperti etilen glikol dan dimetilsulfoksida, secara tunggal atau kombinasi dapat mengurangi kerusakan sel akibat pembekuan dan mengurangi tahapan pemaparan.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini berlangsung dari bulan Januari 2010 sampai dengan Januari 2011. Penelitian ini dilakukan di Laboratorium Embriologi Departemen Anatomi Fisiologi dan Farmakologi dan UPT Hewan Laboratorium Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Bahan Penelitian
Penelitian ini menggunakan mencit putih (Mus musculus albinus) betina sebanyak 43 ekor dan jantan sebanyak 7 ekor (strain DDY, Biofarma, Bandung) berumur 8-10 minggu yang berasal dari koloni bebas penyakit.
Metode Penelitian
Penelitian ini melibatkan beberapa prosedur kerja, yaitu meliputi: a. Superovulasi
b. Koleksi zigot
c. Vitrifikasi Menggunakan Wadah Hemi-straw d. Penghangatan (warming) Embrio
e. Kultur In Vitro f. Evaluasi Viabilitas g. Pewarnaan Vital
Superovulasi
Koleksi Zigot
Mencit betina yang memperlihatkan sumbat vagina dipisahkan dari mencit jantan ke dalam kandang individu. Hari terlihat adanya vaginal plug, ditandai sebagai hari kebuntingan pertama. Koleksi zigot dilakukan 16 – 18 jam setelah penyuntikan hormon hCG. Mencit betina bunting dimatikan dengan cara dislokasio cervicalis. Bagian oviduk atau tuba Falopii diisolasi dan ditempatkan pada medium dulbecco’sphosphate buffered saline (DPBS, Gibco, BRL, USA) yang telah diberi fetal bovine serum (FBS) 2% dan gentamisin 50µg/ml, yang selanjutnya disebut modified phosphate buffered saline (mPBS).
Bagian oviduk yang menggembung disayat dengan menggunakan jarum suntik 26G. Sambil diamati di bawah mikroskop stereo, zigot yang masih dikelilingi oleh sel-sel kumulus ooforus selanjutnya diinkubasi di dalam medium yang mengandung enzim hyaluronidase 0.3 mg/ml untuk memutus ikatan antara sel-sel kumulus ooforus sehingga zigot dapat dikoleksi dan dievaluasi. Kemudian, zigot tersebut dibilas dengan cara merendamnya berturut-turut 2-3 kali di dalam medium mPBS. Zigot dengan sitoplasma utuh dan homogen (viable) dikoleksi dan dihitung jumlahnya.
Vitrifikasi Menggunakan Wadah Hemi-straw
Vitrifikasi tunggal dilakukan masing-masing pada embrio tahap zigot (VZ) dan embrio tahap blastosis (VB), sedangkan vitrifikasi ganda (VZB) dilakukan pada embrio yang sama, yaitu tahap zigot, kemudian di kultur in vitro sampai mencapai tahap blastosis dan divitrifikasi kembali (ganda) selanjutnya di kultur in vitro sampai mencapai tahap blastosis hatched. Proses vitrifikasi meliputi: (a) ekuilibrasi, yaitu proses pergantian cairan sitoplasma dengan larutan krioprotektan melalui proses difusi ke dalam sel sehingga ruang perivitelin terlihat tampak lebih longgar, (b) pembekuan, tahapan pada saat embrio dan larutan berada dalam nitrogen cair (-196°C), (c) penghangatan yaitu tahap terjadinya perubahan kembali bentuk padatan menjadi cair, serta (d) rehidrasi, yaitu proses masuknya kembali air ke dalam sel untuk menggantikan kedudukan krioprotektan.
12
sepanjang 1 cm untuk meletakkan embrio dalam droplet kecil yang berukuran <1.0 µl di atas permukaan straw tersebut. Hemi-straw sebagai wadah embrio tersebut merupakan modifikasi hemi-straw seperti yang digunakan oleh Vandervorst et al. (2001).
Medium dan metode vitrifikasi serta penghangatan (warming) yang digunakan dalam penelitian ini berdasarkan metode yang telah dilaporkan oleh Boediono (2005) (Gambar 1). Embrio tersebut ditempatkan pada medium ekuilibrasi yang mengandung etilen glikol (EG) 10% (Sigma, St Louis, USA) dengan PBS yang ditambahkan fetal bovine serum (FBS) 20%, maksimal 15 menit, atau hingga embrio kembali ke bentuk semula (re-ekspansi). Embrio kemudian dipindahkan dalam medium vitrifikasi yang mengandung dimetilsulfoksida (DMSO) 15% (Sigma, St Louis, USA), EG 15%, sukrosa 0.5M dan FBS 20%.
Gambar 1 Prosedur vitrifikasi menggunakan wadah hemi-straw (Boediono 2005).
nitrogen cair selama 10 detik dan langsung dimasukkan ke dalam nitrogen cair yang bersuhu -196°C dengan posisi vertikal sehingga diperoleh derajat pendinginan yang cukup tinggi.
Penghangatan (warming) Embrio
Hemi-straw berisi embrio yang telah divitrifikasi dikeluarkan dari nitrogen cair dan didiamkan dalam uap nitrogen cair selama 5-10 detik, kemudian dilakukan proses penghangatan pada suhu kamar. Proses ini dilakukan dengan mencelupkan hemi-straw tersebut ke dalam medium mPBS yang mengandung FBS 20% dan larutan sukrosa 0.5M selama 1.5 menit. Embrio akan segera jatuh dari hemi-straw ke larutan tersebut. Embrio tersebut dipindahkan ke medium mPBS yang mengandung sukrosa 0.25M, kemudian 0.1M, masing-masing selama 2.5 menit dan 7 menit. Selanjutnya embrio dicuci 2-3 kali dalam medium mPBS dan medium kultur (Gambar 2).
Gambar 2 Prosedur penghangatan (warming) pada medium sukrosa dengan
14
Kultur In Vitro
Embrio yang telah dilakukan penghangatan selanjutnya dikultur untuk mengetahui viabilitas setelah divitrifikasi. Medium kultur yang digunakan pada penelitian ini adalah medium kultur sekuensial ISM1TM (Origio, Jyllinge, Denmark) yang berfungsi memberikan nutrisi pada embrio tahap zigot sampai 8 sel dan medium kultur ISM2TM (Origio, Jyllinge, Denmark) untuk perkembangan embrio tahap 8 sel sampai blastosis hatched. Sebanyak 3-5 embrio ditempatkan pada cawan petri (NuncTM, Roskilde, Denmark) yang berisi tetesan-tetesan (drops) dalam 10µl medium kultur yang telah ditutupi dengan minyak mineral (Mineral Oil, Sigma, St Louis, USA) untuk mencegah penguapan medium dan kontaminasi selama kultur. Kemudian, dikultur dalam inkubator CO2 5% pada suhu 37°C.
Evaluasi Viabilitas
Pengamatan terhadap viabilitas embrio dilakukan setelah divitrifikasi. Penilaian kelangsungan hidup (survival rate) didasarkan pada keadaan morfologis embrio setelah dua jam penghangatan (warming) dan pengeluaran krioprotektan (Liebermann & Tucker 2002). Daya tahan hidup embrio secara umum dinilai berdasarkan keutuhan morfologi, re-ekspansi dan perkembangan embrio ke tahap lebih lanjut (Takahashi et al. 2005).
Pewarnaan Vital
Rancangan Percobaan
Rancangan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (complete random design). Penelitian ini terdiri atas kelompok kontrol (kontrol negatif), kelompok vitrifikasi tunggal (kontrol positif) dan kelompok vitrifikasi ganda. Kelompok kontrol adalah kelompok embrio yang dikultur pada tahap zigot sampai blastosis hatched tanpa divitrifikasi. Kelompok vitrifikasi tunggal adalah vitrifikasi embrio yang hanya dilakukan satu kali, masing-masing pada tahap zigot (VZ) dan tahap blastosis (VB). Kelompok vitrifikasi ganda (VZB) adalah vitrifikasi embrio yang dilakukan dua kali, yaitu pada tahap zigot dan dilanjutkan pada tahap blastosis. Vitrifikasi ganda hanya dilakukan pada zigot yang mampu berkembang menjadi blastosis setelah kultur in vitro.
Respon yang diamati adalah viabilitas embrio tahap zigot dan blastosis setelah vitrifikasi, baik vitrifikasi tunggal maupun vitrifikasi ganda. Viabilitas embrio meliputi kelangsungan hidup (survival rate) dan keberhasilan perkembangan setiap tahapan embrio (development rate). Penilaian kelangsungan hidup (survival rate) didasarkan pada keadaan morfologis embrio setelah dua jam penghangatan (warming) dan pengeluaran krioprotektan (Liebermann & Tucker 2002). Selain itu, viabilitas embrio dapat diketahui dengan pewarnaan vital, guna melihat sel-sel embrio yang mati dan yang hidup setelah vitrifikasi (Saha et al. 1996).
Penilaian kemampuan perkembangan embrio (developmental rate) didasarkan pada kemampuan embrio berkembang ke tahapan selanjutnya, baik setelah penghangatan maupun yang tidak dihangatkan (kontrol). Pengamatan perkembangan setiap tahapan embrio dilakukan pada jam ke 24, 48, 72, 96 dan 120 dengan menggunakan mikroskop inverted (Olympus IX70 Japan) setelah kultur in vitro. Perkembangan embrio yang diamati adalah mulai dari tahap zigot, cleavage (2 sel, 4 sel dan 8 sel), morula, blastosis dan blastosis hatching dan blastosis hatched (embrio telah keluar dari zona pelusida).
Analisis Data
HASIL DAN PEMBAHASAN
Viabilitas berdasarkan morfologi zigot dan blastosis
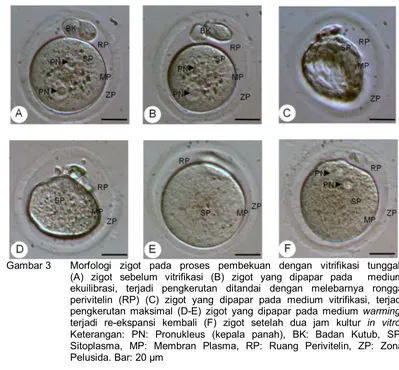
Pada penelitian ini, dilakukan pengamatan terhadap morfologi zigot sebelum dan setelah vitrifikasi tunggal (Gambar 3) dan morfologi blastosis sebelum dan setelah vitrifikasi ganda (Gambar 4). Morfologi zigot pascavitrifikasi tunggal (Gambar 3 (F)) relatif sama seperti zigot pravitrifikasi (Gambar 3 (A)), yaitu ditandai adanya zona pelusida yang utuh, membran plasma, sitoplasma utuh (intact) dan jernih (homogenus) serta tidak terjadi fragmentasi.
Gambar 3 Morfologi zigot pada proses pembekuan dengan vitrifikasi tunggal.
(A) zigot sebelum vitrifikasi (B) zigot yang dipapar pada medium ekuilibrasi, terjadi pengkerutan ditandai dengan melebarnya rongga perivitelin (RP) (C) zigot yang dipapar pada medium vitrifikasi, terjadi
pengkerutan maksimal (D-E) zigot yang dipapar pada medium warming,
terjadi re-ekspansi kembali (F) zigot setelah dua jam kultur in vitro.
Keterangan: PN: Pronukleus (kepala panah), BK: Badan Kutub, SP: Sitoplasma, MP: Membran Plasma, RP: Ruang Perivitelin, ZP: Zona Pelusida. Bar: 20 µm
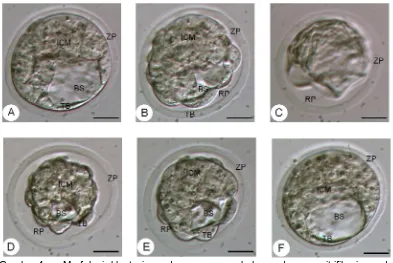
[image:30.595.107.506.282.652.2]Gambar 4 Morfologi blastosis pada proses pembekuan dengan vitrifikasi ganda. (A) blastosis sebelum vitrifikasi (B) blastosis yang dipapar pada medium ekuilibrasi, terjadi pengkerutan ditandai dengan melebarnya rongga perivitelin (RP) (C) blastosis yang dipapar pada medium vitrifikasi, terjadi pengkerutan maksimal (D-E) blastosis yang dipapar pada medium
warming, terjadi re-ekspansi kembali (F) blastosis setelah dua jam kultur in
vitro. Keterangan: RP: Ruang Perivitelin, ZP: Zona Pelusida, BS: Blastosul,
ICM: Inner Cell Mass, TB: Trofoblas. Bar: 20 µm
Keberhasilan vitrifikasi tidak terlepas dari optimalisasi masing-masing tahapan vitrifikasi, mulai dari ekuilibrasi, vitrifikasi, penghangatan, sampai kultur in vitro. Ekuilibrasi embrio dalam krioprotektan sebelum pembekuan dilakukan untuk menarik air dan menggantikan air dengan krioprotektan intraseluler. Pada embrio mencit, air dan krioprotektan intraseluler akan merembes secara perlahan dengan difusi melalui protein aquaporin pada membran plasma (Kasai & Edashige 2007), sehingga ruang perivitelin akan tampak lebih longgar (Gambar 3 & 4(B)). Periode dan suhu ekuilibrasi tergantung krioprotektan yang digunakan, dengan memperhatikan faktor minimalisasi toksisitas dan tekanan osmotik yang disebabkan oleh krioprotektan.
[image:31.595.114.507.96.359.2]18
proses vitrifikasi. Oleh karena itu, keberadaan air dalam blastosul pada embrio tahap blastosis juga akan berdampak negatif terhadap kerusakan sel embrio pada proses vitrifikasi. Pengeluaran sebagian besar air dalam embrio selanjutnya digantikan dengan krioprotektan yang tepat dapat meningkatkan viabilitas embrio pascavitrififikasi. Hal ini berkaitan dengan pencegahan terbentuknya kristal es yang bersifat letal dan upaya mempersingkat waktu ekuilibrasi mengingat krioprotektan yang bersifat toksik terhadap embrio.
Proses pendinginan embrio dilakukan dengan sangat cepat (>20.000°C/menit), sehingga diharapkan embrio dan lingkungan sekitarnya di dalam medium vitrifikasi berubah menjadi vitreus atau glassy state. Medium vitrifikasi memiliki tingkat viskositas yang sangat tinggi sehingga embrio menjadi mengerut (Gambar 3 & 4 (C)). Hal tersebut bertujuan agar menghindari terjadinya pembentukan kristal es ekstraseluler dan intraseluler. Selanjutnya embrio dapat disimpan didalam nitrogen cair bersuhu -196°C.
Berdasarkan berbagai penelitian terdahulu, suhu yang paling ideal untuk menyimpan sel dalam waktu yang lama adalah -196°C (dalam nitrogen cair). Pada suhu tersebut, metabolisme sel berlangsung dengan sangat minimal bahkan nol, sehingga hanya berfungsi untuk mempertahankan kelangsungan hidupnya tanpa melakukan aktivitas apapun (nonaktif). Saat dibutuhkan, sel tersebut dapat direaktivasi kembali dengan cara dihangatkan hingga mencapai suhu awalnya (Halim et al. 2010).
Prosedur penghangatan dapat dilakukan secara cepat dengan dianginudarakan. Pengeluaran krioprotektan intraseluler dapat dilakukan dengan larutan sukrosa yang berfungsi sebagai buffer osmotik sehingga krioprotektan dapat dikeluarkan tanpa pengeluaran air intraseluler secara berlebihan (Gambar 3 & 4 (D-E)).
Pewarnaan vital pada zigot dan blastosis setelah vitrifikasi
Hoechst merupakan pewarna inti sel yang terikat baik pada pasangan basa adenin-timin (AT) dan dapat menembus membran sel hidup, sedangkan PI hanya dapat menembus membran sel yang telah mati (Garner 2009). Inti sel embrio yang terwarnai oleh Hoechst akan berwarna biru, sedangkan yang terwarnai oleh PI akan berwarna merah. Hasil evaluasi menunjukkan bahwa sebagian besar inti sel embrio hasil vitrifikasi, baik vitrifikasi tunggal ataupun ganda, berwarna biru atau terbukti hidup setelah diwarnai dengan pewarna Hoechst-PI (Gambar 5). Hal ini menunjukkan bahwa embrio tersebut masih memiliki kemampuan untuk memperbaiki kerusakan struktural dan melanjutkan perkembangan setelah vitrifikasi.
Gambar 5 Gambaran embrio setelah vitrifikasi dengan pewarnaan vital
Hoechst-propidium iodide (Hoechst-PI). (A) zigot setelah vitrifikasi (B) blastosis hasil kultur in vitro zigot setelah vitrifikasi tunggal zigot (VZ) (C) blastosis hasil kultur in vitro zigot setelah vitrifikasi tunggal blastosis (VB) (D) blastosis hasil
kultur in vitro zigot setelah vitrifikasi ganda. Kepala Panah: PN: Pronukleus,
Sel Mati (Merah), Sel Hidup (Biru). Bar: 20 µm
[image:33.595.108.480.289.620.2]20
yang lebih besar, yaitu 535-617 nm. PI hanya mewarnai sel yang mati (Invitrogen 2009). Pola pewarnaan yang dihasilkan dari kombinasi Hoechst dan PI memungkinkan untuk membedakan populasi sel normal, sel apoptosis dan sel mati (Elstein & Zucker 1994).
Kelangsungan hidup (
survival rate
) zigot dan blastosis setelah
vitrifikasi
[image:34.595.91.522.408.682.2]Hasil pengamatan setelah vitrifikasi tunggal dan ganda terhadap perkembangan embrio dalam penelitian ini disajikan pada Tabel 2. Zigot mampu bertahan hidup setelah divitrifikasi baik vitrifikasi tunggal pada tahap zigot, blastosis atau vitrifikasi ganda pada tahap zigot dan dilanjutkan pada tahap blastosis. Pada penelitian ini, kelangsungan hidup setelah vitrifikasi tunggal tahap zigot (VZ) tidak berbeda nyata (P>0.05) dibandingkan dengan vitrifikasi ganda tahap zigot (VZB), begitu pula dengan kelangsungan hidup blastosis setelah vitrifikasi ganda tahap blastosis (VZB) tidak berbeda (P>0.05) dengan vitrifikasi tunggal tahap blastosis (VB).
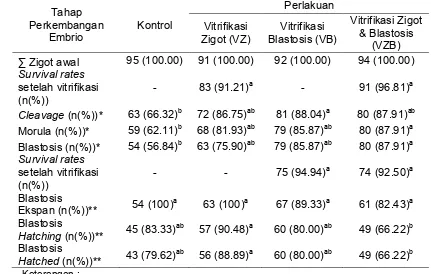
Tabel 2 Kemampuan perkembangan embrio setelah vitrifikasi tunggal dan ganda Tahap Perkembangan Embrio Kontrol Perlakuan Vitrifikasi Zigot (VZ) Vitrifikasi Blastosis (VB) Vitrifikasi Zigot & Blastosis (VZB)
∑ Zigot awal 95 (100.00) 91 (100.00) 92 (100.00) 94 (100.00)
Survival rates setelah vitrifikasi (n(%))
- 83 (91.21)a - 91 (96.81)a
Cleavage (n(%))* 63 (66.32)b 72 (86.75)ab 81 (88.04)a 80 (87.91)ab Morula (n(%))* 59 (62.11)b 68 (81.93)ab 79 (85.87)ab 80 (87.91)a Blastosis (n(%))* 54 (56.84)b 63 (75.90)ab 79 (85.87)ab 80 (87.91)a Survival rates
setelah vitrifikasi (n(%))
- - 75 (94.94)a 74 (92.50)a
Blastosis
Ekspan (n(%))** 54 (100)
a
63 (100)a 67 (89.33)a 61 (82.43)a Blastosis
Hatching (n(%))** 45 (83.33)
ab
57 (90.48)a 60 (80.00)ab 49 (66.22)b Blastosis
Hatched (n(%))** 43 (79.62)
ab
56 (88.89)a 60 (80.00)ab 49 (66.22)b
Keterangan :
Superskrip yang berbeda pada baris yang sama menunjukkan berbeda nyata (P<0,05). Data yang ditampilan berupa jumlah (n) dan %.
* Nilai % dihitung dari jumlah zigot yang digunakan atau jumlah zigot yang survive pada
tahap perkembangan sebelumnya.
** Nilai % dihitung dari jumlah blastosis yang digunakan atau jumlah blastosis yang
Dalam tahap vitrifikasi maupun tahap penghangatan kembali, embrio tersebut masih berpotensi untuk mengalami kerusakan. Biasanya tidak semua embrio yang disimpan beku dapan bertahan hidup melalui vitrifikasi dan penghangatan kembali. Berdasarkan optimasi dari berbagai metode simpan beku yang ada saat ini, vitrifikasi dapat dikatakan cukup berhasil bila viabilitas sel pascavitrifikasi mencapai lebih dari 80% (Halim et al. 2010). Pada penelitian ini, kelangsungan hidup setelah vitrifikasi pada masing-masing perlakuan mencapai lebih dari 80%. Hasil ini membuktikan bahwa metode vitrifikasi ganda dengan wadah hemi-straw efektif dan dapat dilakukan pada embrio, baik tahap zigot ataupun blastosis.
Pernah dilaporkan kesuksesan pembekuan ganda konvensional pada embrio mencit (Vitale et al. 1997), embrio manusia (Baker et al. 1996), dan diikuti dengan vitrifikasi ganda pada embrio sapi tahap blastosis ekspan hingga menghasilkan kebuntingan (Vajta et al. 1998). Penelitian tentang vitrifikasi ganda pada tahap zigot dan dilanjutkan pada tahap blastosis baik pada mencit maupun embrio mamalia lainnya yang menggunakan wadah hemi-straw sampai saat ini belum dilakukan. Namun, vitrifikasi tunggal oosit dan embrio tahap blastosis dengan menggunakan wadah ini telah dilaporkan oleh beberapa peneliti. Vandervorst et al. (2001) melaporkan bahwa kelangsungan hidup (survival rate) blastosis pada manusia setelah divitrifikasi tunggal dengan metode hemi-straw adalah 78%. Hasil yang sama juga dilaporkan oleh Vanderzwalmen et al. (2003), persentase kelangsungan hidup oosit tahap metafase II mencapai 74% dan blastosis mencapai 72%. Murakami et al. (2011) melaporkan tentang viabilitas setelah vitrifikasi tunggal pada tahap pronukleus dengan menggunakan wadah cryotop mencapai 97.6%.
22
hasil penelitian Sheehan et al. (2006) bahwa perkembangan embrio mencit tahap 8 sel pada hari ke-3 dan blastosis pada hari ke-5 tidak dipengaruhi oleh vitrifikasi ganda, namun berefek kurang baik pada proses implantasinya.
Beberapa faktor yang dapat menyebabkan menurunnya atau bahkan hilangnya kelangsungan hidup embrio yaitu jenis dan konsentrasi krioprotektan, jenis wadah serta karakteristik morfologi embrio. Kecenderungan penurunan daya hidup zigot setelah vitrifikasi dapat disebabkan pula oleh kerusakan fisik akibat pembentukan kristal es selama pembekuan, efek toksik krioprotektan dan stress osmotik selama pengeluaran krioprotektan dari sel saat penghangatan.
Krioprotektan dengan konsentrasi tinggi dapat mengakibatkan tingginya tekanan osmotik sehingga memicu rusaknya membran plasma, membran inti bahkan organel sitoplasma. Pemaparan yang lama terhadap embrio ke dalam krioprotektan mengakibatkan efek toksik pada embrio yang dapat menyebabkan tingkat kelangsungan hidup menurun (Nowshari & Brem 2001). Hal ini berkaitan dengan lamanya kontak antara embrio dan krioprotektan, sehingga untuk mengurangi toksisitas krioprotektan pemaparan sebaiknya dilakukan dengan waktu yang tepat. Meskipun krioprotektan bersifat toksik, kombinasi pemakaian krioprotektan intra dan ekstraseluler dapat mengurangi toksisitas krioprotektan serta menurunkan kerusakan akibat tekanan osmosis yang tinggi.
Krioprotektan yang digunakan dalam penelitian ini adalah kombinasi krioprotektan intraseluler, yaitu etilen glikol dan DMSO dengan konsentrasi masing-masing krioprotektan sebanyak 15% dan sukrosa 0.5M sebagai krioprotektan ekstraseluler. Menurut Mukaida et al. (2003), konsentrasi ini efektif untuk mencegah penurunan daya hidup, terbentuknya kristal es dan mengurangi resiko toksik krioprotektan pada saat dilakukan vitrifikasi.
Kombinasi antara krioprotektan intra dengan ekstraseluler, seperti sukrosa dapat mengurangi toksisitas serta kerusakan akibat tekanan osmotik (Rall 1992). Disamping itu, proses penghangatan menggunakan larutan sukrosa dengan konsentrasi bertingkat, yaitu: 0.5M, 0.25M, 0.1M dapat meminimumkan kerusakan akibat tekanan osmotik (Dattena et al. 2004). Massip et al. (1995) melaporkan bahwa sukrosa sangat efektif dalam mempertahankan integritas struktur serta fungsi membran.
telah disayat bagian ujungnya sepanjang 1 cm. Dengan demikian, embrio langsung dicelupkan dalam nitrogen cair dengan posisi vertikal sehingga didapatkan derajat pendinginan yang cukup tinggi. Dinding straw yang lebih tipis dan permukaan krioprotektan yang langsung bersentuhan dengan permukaan nitrogen cair membantu perpindahan panas menjadi lebih cepat.
Penggunaan wadah ini dapat meminimalkan penggunaan volume larutan vitrifikasi, mempercepat laju pendinginan dan memudahkan proses warming sehingga mampu menjaga daya hidup dan viabilitas setelah vitrifikasi (Liebermann & Tucker 2002). Hal serupa diungkapkan oleh Vanderzwalmen et al. (2003) bahwa persentase kelangsungan hidup oosit dan embrio tahap blastosis pada manusia setelah vitrifikasi dengan menggunakan wadah hemi-straw masih tetap tinggi. Dengan demikian, hasil penelitian ini menunjukkan bahwa perlakuan vitrifikasi dengan wadah hemi-straw dan keberhasilan perkembangan zigot setelah divitrifikasi tidak berpengaruh nyata terhadap kelangsungan hidup (survival rate) embrio (P<0.05) jika dibandingkan dengan zigot yang tidak divitrifikasi.
Kemampuan perkembangan embrio (
developmental rate
) setelah
vitrifikasi
Penilaian kemampuan perkembangan embrio (developmental rate) didasarkan pada kemampuan embrio yang dikultur in vitro untuk berkembang lebih lanjut hingga mencapai tahap blastosis hatched baik pada embrio setelah penghangatan maupun embrio kontrol. Tingkat pembelahan embrio (cleavage) mencapai 66.32% dan 86.75% masing-masing pada zigot yang tidak divitrifikasi (kontrol) dan zigot setelah vitrifikasi (P>0.05) (Tabel 2). Persentase perkembangan zigot kontrol menjadi embrio tahap cleavage mengalami penurunan yang sangat signifikan (Tabel 3). Hal ini mungkin disebabkan oleh kualitas zigot yang digunakan, karena zigot dikultur sebelum terjadi pembelahan, sehingga tidak ada parameter morfologi standar untuk membantu proses seleksi. Akibatnya, zigot dengan kompetensi perkembangan yang rendah terkadang ikut dikultur atau dibekukan. Pada penelitian ini ditemukan beberapa kejadian abnormalitas embrio seperti pembelahan asimetris, fragmentasi dan embrio tanpa zona pelusida.
24
[image:38.595.114.512.237.483.2](Gambar 6 (D)) dan blastosis (Gambar 6 (E)) hampir terjadi pada semua perlakuan, baik yang divitrifikasi maupun yang tidak divitrifikasi setelah kultur in vitro. Persentase zigot setelah penghangatan lebih rendah dibandingkan dengan zigot yang tidak divitrifikasi. Hal ini disebabkan zigot yang divitrifikasi setelah dilakukan penghangatan akan mengalami penyesuaian terlebih dahulu terhadap medium kultur sehingga kecepatan perkembangan zigot yang divitrifikasi lebih lambat daripada yang tidak divitrifikasi.
Tabel 3 Laju penurunan perkembangan embrio setelah vitrifikasi
Perkembangan
Embrio Kontrol
Perlakuan Vitrifikasi Zigot (VZ) Vitrifikasi Blastosis (VB) Vitrifikasi Zigot & Blastosis (VZB)
∑ Zigot awal 100 100 100 100
Survival rates setelah
vitrifikasi (%)* - 8.79 - 3.19
Zigot - Cleavage (%)* 33.68 4.46 11.96 8.9 Cleavage – Morula
(%)* 4.21 4.82 2.17 0
Morula - Blastosis (%)* 5.27 6.03 0 0 Survival rates setelah
vitrifikasi (%)** - - 5.61 10.07
Blastosis
Ekspan - Hatching (%)**
16.67 9.52 9.33 16.21
Blastosis Hatching -
Hatched (%)** 3.71 1.59 0 0
Keterangan :
* Nilai % merupakan selisih dari persentase zigot yang hidup (survive) setelah vitrifikasi
dengan jumlah zigot awal atau tahap perkembangan sebelumnya
** Nilai % merupakan selisih dari persentase zigot yang hidup (survive) setelah vitrifikasi
dengan jumlah zigot awal atau tahap perkembangan sebelumnya
embrio pada mencit betina yang disuperovulasi. Namun demikian, hal ini juga dimungkinkan bahwa degenerasi embrio pada mencit yang disuperovulasi disebabkan oleh proses apoptosis.
Apoptosis adalah suatu proses kematian sel yang terprogram, diatur secara genetik, bersifat aktif, ditandai dengan adanya kondensasi kromatin, fragmentasi sel dan fagositosis sel tersebut oleh sel tetangganya. Apoptosis terjadi pada sitoplasma, nukleus dan DNA. Apoptosis berperan penting pada proses embryonic arrest. Proses ini terjadi baik pada perkembangan embrio yang dikultur in vitro maupun in vivo. Embrio yang mengalami proses tersebut menunjukkan abnormalitas pada kromosom. Peningkatan abnormalitas pada kromosom dapat disebabkan ketidakteraturan atau defisiensi sitoskeleton serta adanya gangguan pada proses mitosis dan sitokinesis (Hardy et al. 2001).
Komposisi medium kultur juga berpengaruh pada perkembangan embrio secara in vitro. Pada kultur in vitro embrio mencit, diperlukan medium yang mampu mendukung perkembangan embrio mencit dari zigot menjadi blastosis hatched. Li et al. (2010) melaporkan bahwa pada tahap awal perkembangan (tahap cleavage) embrio mencit biasanya memperlihatkan fenomena cell block. Pada penelitian ini, cell block terjadi pada tahapan dua sel. Pada saat cell block terinisiasi, embrio tidak dapat berkembang lebih lanjut dan degenerasi. Selain itu, terjadi fragmentasi sel berupa pembelahan sel-sel embrio yang tidak beraturan dan tidak sama ukurannya.
Secara umum setiap tahapan embrio memerlukan syarat medium yang berbeda karena pada saat perkembangan terjadi perubahan morfologi, fisiologi dan biokimiawi. Komposisi medium sangat berpengaruh terhadap perkembangan embrio. Oleh karena itu, medium yang digunakan harus sesuai dengan kebutuhan embrio. Pada penelitian ini, jenis medium kultur tidak dibedakan antara embrio yang divitrifikasi maupun yang tidak divitrifikasi. Medium kultur yang digunakan pada penelitian ini adalah medium sekuensial ISM1TM dan ISM2TM. Medium kultur ISM1TM berfungsi memberikan nutrisi pada embrio tahap zigot sampai 8 sel, sedangkan medium kultur ISM2TM untuk perkembangan embrio tahap 8 sel sampai blastosis hatched.
26
fungsi fisiologis yang lain. Larutan buffer digunakan untuk menjaga stabilitas medium kultur dari perubahan pH. Glukosa diperlukan oleh embrio 8 sel untuk perkembangan embrio lebih lanjut, jika tidak ada glukosa perkembangan embrio mencit akan berhenti sampai tahap morula (Gardner 2007). Keberadaaan EDTA (Ethylenediaminetetraacetic acid) dan glutamin dalam medium kultur bermanfaat untuk mengurangi kejadian cell block. EDTA berfungsi sebagai chelator yang dapat mencegah pembentukan radikal bebas oksigen di dalam medium kultur. EDTA yang ada dalam medium kultur sangat esensial untuk tahap cleavage embrio. Glutamin sangat bermanfaat pada 48 jam pertama kultur embrio dan digunakan oleh embrio sebagai substrat energi pengganti glukosa.
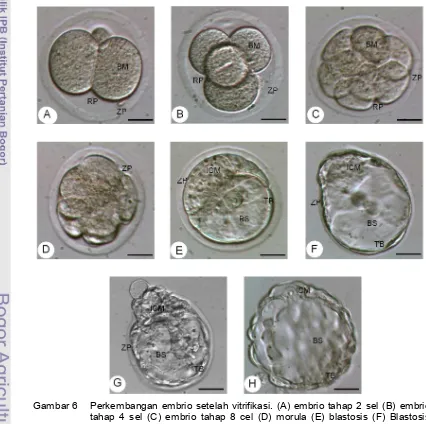
Gambar 6 Perkembangan embrio setelah vitrifikasi. (A) embrio tahap 2 sel (B) embrio tahap 4 sel (C) embrio tahap 8 cel (D) morula (E) blastosis (F) Blastosis
tahap ekspan setelah dikultur 24 jam (G) Blastosis tahap hatching setelah
dikultur 36 – 48 jam (H) Blastosis tahap hatched setalah dikultur 48 – 72
jam. Keterangan: BM: Blastomer, ICM: Inner Cell Mass, TB: Trofoblas, RP:
[image:40.595.80.506.288.712.2]Faktor lingkungan yang mempengaruhi keberhasilan kultur embrio meliputi: O2, CO2, pH, suhu, inkubator, cahaya, volume inkubasi dan jumlah embrio yang
dikultur dalam satu kelompok. Karbondioksida diperlukan untuk mempertahankan pH protein dan asam nukleat oleh embrio mencit pada semua tahap perkembangan sebelum implantasi. Beberapa faktor yang dapat mengurangi tingkat perkembangan embrio sampai ke tahap blastosis diantaranya ialah: fluktuasi pH yang signifikan, fluktuasi suhu pada tahap awal perkembangan embrio, lama waktu pemaparan embrio pada suhu ruang dan jumlah embrio yang dikultur. Mikromanipulasi dan kultur embrio di bawah cahaya redup akan meningkatkan perkembangan embrio (Gardner 2007).
Penelitian ini menggunakan inkubator CO2 5% suhu 37%. Medium berada
di luar inkubator CO2 pada saat handling embrio dan manipulasi embrio. Hal ini
diduga menyebabkan terjadinya fluktuasi pH dan fluktuasi suhu, sehingga mengurangi tingkat perkembangan embrio. Selain itu, koleksi dan manipulasi embrio dilakukan pada suhu ruang dalam waktu relatif lama (lebih dari sepuluh menit) di bawah cahaya terang. Hal tersebut kemungkinan akan menyebabkan embrio mengalami kerusakan sebelum dikultur, sehingga akan mempengaruhi tingkat pembelahan dan perkembangan lebih lanjut. Gardner (2007) menyatakan bahwa tingkat pembelahan dan pembentukan blastosis pada embrio mencit akan meningkat apabila embrio dikultur dalam grup (dengan jumlah 5 – 10 embrio dalam satu drop media). Hal ini karena embrio mamalia tahap preimplantasi memproduksi faktor pertumbuhan (growth factor) yang dapat memberikan pengaruh positif terhadap embrio lainnya.
Persentase kelangsungan hidup dan tingkat perkembangan blastosis setelah vitrifikasi menurun pada pengamatan dua jam setelah penghangatan. Walaupun vitrifikasi dilakukan dengan sederhana melalui laju pendinginan yang cepat, masih memungkinkan perlukaan pada sel akibat efek toksik dari konsentrasi krioprotektan dan stress karena perubahan suhu yang ekstrim (cold shock).
28
mencit maupun manusia mencakup kemampuan untuk tumbuh pada medium in vitro. Parameter perkembangan vitrifikasi meliputi kemampuan re-ekspansi (Gambar 6 (F)), berkembang ke tahap selanjutnya, hatching (Gambar 6(G)) dan hatched atau embrio keluar dari zona pelusida (Gambar 6 (H)).
Hasil pada Tabel 2 menunjukkan bahwa perkembangan blastosis menjadi blastosis ekspan setelah vitrifikasi ganda yang diperoleh setelah kultur 24 jam tidak berbeda (P>0.05) dengan kontrol, vitrifikasi tunggal zigot dan vitrifikasi tunggal blastosis. Hasil yang diperoleh pada blastosis tahap hatching dan hatched setelah vitrifikasi ganda berbeda (P<0.05) dibandingkan vitrifikasi tunggal zigot, namun tidak berbeda nyata (P>0.05) dengan vitrifikasi tunggal blastosis dan kontrol (Tabel 2).
Perolehan jumlah blastosis yang mencapai tahap ekspan pada penelitian ini lebih tinggi dibandingkan hasil penelitian oleh Isachenko et al. (2003) bahwa blastosis tikus hasil vitrifikasi ganda setelah dikultur dalam medium HEPES + TCM-199 mencapai tahap ekspan sebesar 76.3%. Adanya perbedaan sifat individual blastosis untuk berkembang dan beradaptasi pada lingkungan in vitro dan banyaknya jumlah sel-sel blastomer tahap blastosis yang mengalami kerusakan selama proses vitrifikasi, menyebabkan terjadinya variasi daya hidup untuk berkembang setelah dikultur in vitro. Pada penelitian ini, persentase blastosis ekspan mencapai tahap haching setelah vitrifikasi ganda mengalami penurunan sebesar 16.21% (Tabel 3). Demikian pula dengan penurunan persentase perkembangan blastosis tahap hatching mencapai hatched. Hal ini mengindikasikan bahwa tidak semua blastosis ekspan mampu mengalami hatching dan blastosis yang mengalami hatching mampu mencapai tahap hatched.
Tharasanit et al. (2005) melaporkan bahwa perlakuan vitrifikasi pada suhu yang rendah menyebabkan depolimerasi struktur protein dari sitoskeletal oosit, mikrotubuli dan mikrofilamen yang dibutuhkan pada saat pematangan sel. Hal ini memberikan hipotesis bahwa pengerasan dari lipid (stumbling block) menyebabkan deformasi dan gangguan pada sitoskeletal. Menurut Vincent et al. (1990) pengerasan zona pelusida disebabkan oleh lamanya pemaparan dalam krioprotektan yang menyebabkan menipisnya jumlah butiran kortikal yang mendasari permukaan embrio. Pengerasan zona pelusida akibat lamanya pemaparan dapat diatasi dengan perlakuan assisted hatching. Assisted hatching adalah prosedur yang digunakan untuk meningkatkan hatching rate blastosis dengan manipulasi mikro, yaitu dengan menyayat zona pelusida sehingga sel dapat keluar (Hiraoka et al. 2004).
Vitrifikasi ganda setelah penghangatan atau beberapa jam setelah proses kultur secara teori dan prakteknya tentunya akan berdampak pada morfologi embrio. Prosedur vitrifikasi dinilai efektif apabila embrio mampu bertahan hidup setelah proses vitrifikasi ganda dan menunjukkan tingkat pertumbuhan yang tinggi. Perlakuan vitrifikasi tunggal atau ganda akan menghasilkan tingkat kelangsungan hidup (survival rate) dan perkembangan (developmental rate) yang tinggi apabila kualitas embrio yang akan divitrifikasi mempunyai kualitas sangat baik.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil yang diperoleh, dapat disimpulkan bahwa vitrifikasi ganda dapat dilakukan pada embrio mencit (Mus musculus albinus) pada tahap zigot dan dilanjutkan pada tahap blastosis dengan viabilitas yang tinggi setelah dilakukan penghangatan serta kultur in vitro.
Saran
1 Diperlukan pengamatan ultrastruktural pada embrio yang divitrifikasi untuk mengetahui tingkat kerusakan organel sel akibat vitrifikasi.
2 Melakukan transfer embrio kepada resipien untuk mengetahui tingkat implantasi.
Baker A, Check JH, Lurie D, Hourani C, Hoover LM. 1996. Pregnancy achieved with pronuclear-stage embryos that were cryopreserved and thawed twice: a case report. J Assist Reprod Genet 13:713-715.
Batan et al. 2009. Vitrifikasi Blastosis Mencit dengan Metode Kriolup. J Veteriner 10:219-226.
Boediono A. 2005. Kriopreservasi Embrio. Surabaya. Konas II PERMI & Temu Ilmiah II FER, 3-5 Februari.
Chen SU et al. 2000a. Open pulled straws for vitrification of mature mouse oocytes preserve patterns of meiotic spindles and chromosomes better than conventional straws. Hum Reprod 15:2598-2603.
Chen SU et al. 2000b. Cryopreservation of mature human oocytes by vitrification with ethylene glycol in straws. Fertil Steril 74:804-808.
Chung HM et al. 2000. In vitro blastocyst formation of human oocytes obtained from unstimulated and stimulated cycles after vitrification at various maturational stages. Fertil Steril 73:545-551.
Dattena M et al. 2004. Comparison of different vitrification protocols on viability after transfer of ovine blastocyst in vitro produced and in vivo derived. Theriogenology 62:481-493.
Elstein KH, Zucker RM. 1994. Comparison of cellular and nuclear flow cytometric techniques for discriminating apoptotic subpopulations. Exp Cell Res
211(2):322-331 [terhubung berkala].
science/journal/00144827 [22 Februari 2011].
Fahrudin M, Prasetyaningtyas WE, Mohamad K, Boediono A, Djuwita I. 2008. Bahan Ajar Mandiri Praktikum Embriologi & Genetika Perkembangan. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Fahy GM. 1986. The relevance of cryoprotectant toxicity to cryobiology. Cryobiology 23:1-13.
Fahy GM, Lilley TH, Lindsdell H, Douglas MS, Meryman HT. 1990. Cryoprotectant toxicity and cryoprotectant toxicity reduction: In search of molecular mechanism. Cryobiology 27:247-268.
Gardner D, editor. 2007. In Vitro Fertilization: A Practical Approach. New York: Informa Healthcare.
32
Ghaemi SR, Salehnia M, Valojerdi MR. 2008. The effect of progesterone and exogenous gonadotropin on Preimplantation Mouse Embryo Development and Implantation. Exp Anim 57:23-34.
Hafez ESE, Jainudeen MR, Rosnina Y. 2000. Hormones, Growth Factors and Reproduction. Di dalam:ESE Hafez dan B Hafez, editor. Reproduction in Farm Animal. USA: Lippincott Williams & Wilkins.
Halim D et al. 2010. Stem Cell –Dasar Teori & Aplikasi Klinis. Jakarta: Erlangga.
Hardy K et al. 2001. From cell death to embryo arrest: mathematical models of human preimplantation embryo development. Proc Nat Acad Sci USA 98:155-160.
Hiraoka K, Hiraoka K, Kinutani M, Kinutani K. 2004. Assisted hatching at the time of warming improves pregnancy and implantation outcomes for vitrified human expanded blastocyst transfer. J Mamm Ova Res 21:118-122.
Hogan B, Constantini F, Lacy E. 1994. Manipulating the Mouse Embryo: A Laboratory Manual. New York: Cold Spring Harbor Laboratory.
Hong SW et al. 1999. Improved human oocyte development after vitrification: a comparison of thawing methods. Fertil Steril 72:142-146.
Hurtt AE, Landim-Alvarenga F, Seidel GE, Jr, Squires EL. 2000. Vitrification of immature and mature equine and bovine oocytes in an ethylene glycol, ficoll and sucrose solution using open-pulled straws. Theriogenology 54:119-128.
Invitrogen. 2009. Chromatin Condensation/Dead Cell Apoptosis Kit with Hoechst 33342 and PI for Flow Cytometry [terhubung berkala]. http://www.invitrogen.com [5 Desember 2010].
Isachenko V et al. 2003. Double vitrification of rat embryos at different developmental stages using an identical protocol. Theriogenology 60:445-452.
Ittner LM, Götz J. 2007. Pronuclear injection for the production of transgenic mice. Nat Protoc 2:1206-1215.
Kasai M et al. 1990. A simple method for mouse embryo cryopreservation in a low toxicity vitrification solution, without appreciable loss of viability. Soc Reprod Fertil (Abstract) 89:91-97.
Kasai M, Edashige K. 2007. Vitrification in animal reproduction: vitrification of embryo using conventional straws with ethylene glycol-based solutions. Di dalam: Tucker MJ, Liebermann T, editor. Vitrification in Assisted Reproduction. UK: Informa Healthcare. hlm. 75-85.
Lane M, Bavister BD, Lyons EA, Forest KT. 1999. Container-less vitrification of mammalian oocytes and embryos. Nat Biot 17:1234-1236.
Li L, Zheng P, Dean J. 2010. Maternal control of early mouse development. Development 137:859-870.
Liebermann J et al. 2002. Potential Importance of vitrification in reproductive medicine. Biol Reprod 67:1671-1680.
Liebermann J, Tucker MJ. 2002. Effect of carrier system on the yield of human oocytes and embryos as assessed by survival and developmental potential after vitrification. Reproduction 124:483-489.
Massip A, Mermillod P, Dnnyes A. 1995. Morphology and biochemistry of in vitro produced bovine embryos: implication for their cryopreservation. Hum Reprod 10:3004-3011.
Matsumoto H, Jiang JY, Tanaka T, Sasada H, Sato E. 2001. Vitrification of large quantities of immature bovine oocytes using nylon mesh. Cryobiology 42:139-144.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid 1. Bogor: IPB Press.
Miyake T, Kasai M, Zhu SE, Sakurai T, Machida T. 1993. Vitrification of mouse oocytes and embryos at various stages of development in an ethylene glycol based solution by a simple method. Theriogenology 40:121-134.
Mukaida T et al. 2003. Vitrification of human blastocysts using cryoloops: clinical outcome of 223 cycles. Hum Reprod 18:384-391.
Murakami M, Egashira A, Murakami K, Araki Y, Kuramoto T. 2011. Perinatal outcome of twice-frozen-thawed embryo transfers: a clinical follow-up study. Fertil Steril, in press.
Nowshari MA, Brem G. 2001. Effect of freezing rate and exposure time to cryoprotectan on the development of mouse pronuclear stage embryos. Hum Reprod 16:2368-2373.
Oberstein N et al. 2001. Cryopreservation of equine embryos by open pulled straws, cryoloop, or conventional cooling methods. Theriogenology 15:607-613.
Papis K, Shimizu M, Izaike Y. 2000. Factors affecting the survivability of bovine oocytes vitrified in droplets. Theriogenology 15:651-658.
Park SP et al. 2000.Ultra-rapid freezing of human multipronuclear zygotes using electron microscope grids. Hum Reprod 15:1787-1790.
Rall WF, Fahy GM. 1985. Ice-free cryopreservation of mouse embryos at -196ºC by vitrification. Nature 313:573-575.
34
Rianti P. 2005. Perkembangan embrio mencit tahap pra implantasi pada kultur in vitro [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rusiyantono et al. 2000. Pemakaian ethylene glycol dan glycerol untuk vitrifikasi embrio kambing in vitro. Prosiding Seminar Nasional Bioteknologi Pertanian pp:47-51.
Saha S, Rajamahendran R, Boediono A, Sumantri C, Suzuki T. 1996. Viability of bovine blastocyst obtain after 7,8, or 9 day of culture in vitro following vitrification and step rehydration. Theriogenology 46:331-343.
Sato F, Marrs RP. 1989. The effect of pregnant mare serum gonadotropin on mouse embryo fertilized in vivo or in vitro. J In Vitro Embryo Transfer 3:353-357.
Selman H et al. 2009. Vitrification is a highly efficient method to cryopreserve human embryos in in vitro fertilization patients at high risk of developing ovarian hyperstimulation syndrome. Fertil Steril 91 Supl 4:1611-1613.
Sheehan CB, Lane M, Gardner DK. 2006. The cryoloop facilitates re-vitrification of embryos at four successive stage of development without impairing embryo growth. Hum Reprod 21: 2978-2984.
Takahashi K, Mukaida T, Goto T, Oka C. 2005. Perinatal outcome of blastocyst transfer with vitrification using cryoloop: a 4-years follow up study. Fertil Steril 84:88-92.
Tharasanit T, Colenbrander B, Stout TAE. 2005. Effect of cryopresrevation on the cellular integrity of equine embryos. Reproductive 129:789-798.
Theiler K. 1989. The House Mouse: Atlas of Embryonic Development. Heidelberg: Springer Verlag.
Trounson A, Mohr L. 1983. Human pregnancy following cryopreservation, thawing and transfer of an eight-cell embryo. Nature 305:707-709.
Vajta G et al. 1998. Open Pulled Straws (OPS) vitrification: a new way to reduce cryoinjuries of bovine ova and embryos. Mol Reprod Dev 51:53-58.
Van der Auwera I, Hooghe TD. 2001. Superovulation of female mice