Rhizophora mucronata
VONNYA LIDDYANNISA P
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
PENGARUH MEDIA SIMPAN, RUANG SIMPAN DAN LAMA
PENYIMPANAN TERHADAP VIABILITAS PROPAGUL
Rhizophora mucronata
Oleh :
VONNYA LIDDYANNISA P
Skripsi
Sebagai Salah Satu Syarat
Untuk Memperoleh Gelar Sarjana Kehutanan Pada Fakultas Kehutanan
Institut Pertanian Bogor
dan Lama Penyimpanan terhadap Viabilitas Propagul Rhizophora mucronata. Dibimbing oleh Prof. Dr. Ir. Cecep Kusmana, MS dan Ir. Yulianti Bramasto, MSi.
Potensi hutan mangrove di Indonesia telah mengalami penurunan. Oleh karena itu, perlu dilakukan rehabilitasi hutan dalam upaya mempertahankan kelestarian ekosistem. Salah satu upaya yang dilakukan adalah penanaman kembali hutan mangrove. Keberhasilan dalam penanaman tergantung pada ketersediaan benih. Benih tidak bisa didapatkan setiap saat dibutuhkan, sehingga perlu dilakukan penyimpanan benih yang baik agar viabilitas benih dapat dipertahankan dalam suatu periode waktu tertentu sampai pada saat penanaman tiba. Masalah timbul karenaRhizophora mucronata termasuk jenis rekalsitran sehingga pada kadar air tertentu yang relatif tinggi propagul cenderung mudah untuk berakar dan bila kadar air rendah propagul akan mati atau viabilitasnya menurun. Penelitian ini bertujuan untuk mengetahui pengaruh media simpan, ruang simpan dan lama penyimpanan terhadap viabilitas propagul Rhizophora mucronata serta untuk membandingkan daya berkecambah hasil uji cepat viabilitas propagulR. mucronata(uji belah) dengan daya berkecambah propagul hasil uji perkecambahan langsung.
Penelitian ini menggunakan percobaan faktorial dengan rancangan acak lengkap (RAL) faktorial 5x2x2 dengan 3 kali ulangan. Adapun perincian faktor-faktornya adalah sebagai berikut: faktor A (lama penyimpanan) terdiri dari A0 (0 minggu), A1 (1 minggu), A2 (2 minggu), A3 (3 minggu), dan A4 (4 minggu); faktor B (ruang simpan) terdiri dari B1 (ruang AC) dan B2 (ruang kamar); faktor C (media simpan) terdiri dari C1 (serbuk gergaji) dan C2 (sabut kelapa).
Prosedur kerja penelitian ini terdiri dari tahap persiapan (wadah simpan, ruang simpan, media simpan dan media perkecambahan), pengunduhan propagul, seleksi propagul, penyimpanan propagul, uji belah propagul, penyemaian propagul, pemeliharaan dan pengambilan data. Adapun data yang diambil adalah data hasil uji belah propagul, presentase berakar propagul (PB), kadar air (KA), daya berkecambah (DB), nilai perkecambahan (NP), kecepatan tumbuh (KT), nisbah pucuk akar (NPA).
Berdasarkan hasil penelitian ini, dapat diketahui bahwa pengaruh interaksi antara lama penyimpanan, ruang simpan dan media simpan menyebabkan perbedaan secara signifikan terhadap daya berkecambah propagul R. mucronata. Pengaruh antara lama penyimpanan dan ruang simpan menyebabkan perbedaan secara signifikan terhadap persen berakar propagul R. mucronata. Adapun pengaruh antara lama penyimpanan dan media simpan menyebabkan perbedaan secara signifikan terhadap nisbah pucuk akar semaiR. mucronata. Dalam penelitian ini, media simpan sabut kelapa yang diletakkan di ruang AC mampu mempertahankan viabilitas propagul R. mucronata sampai masa penyimpanan selama 4 minggu. Hasil metode pendugaan viabilitas propagul R. mucronata dengan uji belah adalah relatif sama dengan hasil uji perkecambahan secara langsung dari propagul tersebut.
ABSTRACT
VONNYA LIDDYANNISA P. E44062488. The Influence of Storage Media, Storage Room and Time of Storage on Propagules Viability of Rhizophora mucronata. Supervised by Prof. Dr. Ir. Cecep Kusmana, MS and Ir. Yulianti Bramasto, MSi.
The potention of mangrove forests in Indonesia has been decreasing. Therefore, rehabilitation is necessary in order to maintain sustainability of forest ecosystems. One of the efforts is the replanting of mangrove forest. The success of planting depends on the availability of seed. Seeds can not be obtained any time if needed so that storage seed is necessary for seed viability can be maintained within a certain time period until the time of planting arrives. The problem has been arise because of Rhizophora mucronata is a recalcitrant seed, which is at certain moisture content that relatively high, the propagule tend to be easy to germinate and if the moisture content is low, the propagule will be die or loss of their viability. This study aims to investigate the influence of storage media, storage room and time of storage on propagules viability ofRhizophora mucronataand to compare the germination from the rapid test (cutting test) with the germination from the direct test.
This study used a factorial experiment with completely randomized design (CRD) factorial 5x2x2 with 3 replicates. The details of the factors are: factor A (time of storage) consists of A0 (0 weeks), A1 (1 week), A2 (2 weeks), A3 (3 weeks), and A4 (4 weeks); factor B (storage room) consists of B1 (AC room) and B2 (living room); and factor C (storage media) consists of C1 (sawdust) and C2 (coconut husk).
Working procedures of this study consist of the preparation phase (the container store, room storage, storage media and germination media), collecting of propagule, propagule selection, storage of propagule, propagule cutting test, seeding propagule, maintenance and retrieval of data. The data collected is the result of cutting test from propagule, the percentage of rooted propagule (PB), moisture content (MC), germination (DB), germination value (NP), the growth rates (KT), shoot and root ratio (NPA).
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Media
Simpan, Ruang Simpan dan Lama Penyimpanan terhadap Viabilitas Propagul
Rhizophora mucronata adalah benar – benar hasil karya saya sendiri dengan bimbingan Prof. Dr. Ir. Cecep Kusmana, MS dan Ir. Yulianti Bramasto, MSi serta
belum pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga
manapun. Sumber informasi yang berasal atau yang dikutip dari karya yang
diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks
dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2011
Vonnya Liddyannisa P
i
Puji syukur penulis panjatkan ke hadirat Allah SWT, dengan limpahan
rahmat dan kasih sayang-Nya, serta segala kemudahan yang diberikan sehingga
penulis telah dapat menyelesaikan skripsi berjudul “Pengaruh Media Simpan,
Ruang Simpan dan Lama Penyimpanan terhadap Viabilitas Propagul Rhizhopora mucronata” yang disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan pada Fakultas Kehutanan Institut Pertanian Bogor.
Kegiatan penelitian ini dilakukan di Rumah Kaca dan Laboratorium
Silvikultur Institut Pertanian Bogor serta Laboratorium Balai Penelitian Teknologi
Perbenihan (BPTP) Ciheuleut, Bogor selama 4 bulan. Hasil dari penelitian ini
diharapkan dapat memberikan manfaat dalam menemukan teknik penyimpanan
propagulRhizophora mucronatasecara tepat.
Pada kesempatan kali ini, penulis ingin mengucapkan terima kasih kepada:
1. Keluarga, Ayah dan Ibu atas segala doa, motivasi, perhatian dan kasih
sayangnya yang tak ternilai.
2. Prof. Dr. Ir. Cecep Kusmana, MS dan Ir. Yulianti Bramasto, MSi selaku
dosen pembimbing skripsi yang telah banyak memberikan bimbingan dan
saran serta perhatian dengan penuh kesabaran.
3. Seluruh Pegawai di Bagian Ekologi Hutan Fakultas Kehutanan IPB dan
Laboratorium BPTP Bogor yang telah banyak membantu dan memfasilitasi
dalam pelaksanaan penelitian.
4. Muhammad Kalingga F atas perhatian, motivasi, dukungan, semangat, dan
bantuan yang selama ini diberikan dan dicurahkan untuk menemani Penulis.
5. Teman-teman mahasiswa Silvikultur 43 dan semua pihak yang telah
memberikan bantuan dalam proses penelitian.
Dengan menyadari ketidaksempurnaan diri sebagai manusia, penulis
berharap karya ilmiah ini dapat bermanfaat bagi pihak-pihak yang
memerlukannya.
Bogor, Maret 2011
iii
Halaman
KATA PENGANTAR ... i
RIWAYAT HIDUP ... ii
DAFTAR ISI... iii
DAFTAR TABEL... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 2
1.3 Hipotesis ... 2
1.4 Manfaat Penelitian ... 2
BAB II TINJAUAN PUSTAKA 2.1 Tinjauan Umum Hutan Mangrove... 3
2.2 Tinjauan JenisRhizophora mucronata ... 5
2.2.1 Tinjauan UmumRhizophora mucronata... 5
2.2.2 Tinjauan BotanisRhizophora mucronata... 6
2.3 Penyimpanan Benih ... 7
2.4 Ruang dan Wadah Penyimpanan ... 9
2.5 Media Simpan ... 11
2.5.1 Serbuk Gergaji ... 11
2.5.2 Sabut Kelapa ... 11
2.6 Perkecambahan ... 11
2.7 Uji Viabilitas ... 12
2.8 Kemunduran Benih ... 14
BAB III METODOLOGI PENELITIAN 3.1 Tempat dan Waktu Penelitian ... 15
3.2 Bahan dan Alat Penelitian ... 15
3.3 Metode Analisis ... 15
3.4.1 Tahap Persiapan... 17
3.4.2 Pengunduhan Benih ... 17
3.4.3 Seleksi Benih ... 17
3.4.4 Penyimpanan Benih ... 17
3.4.5 Uji Belah (Cutting Test)... 18
3.4.6 Penyemaian Benih ... 19
3.4.7 Pemeliharaan... 19
3.5 Pengambilan Data... 19
3.5.1 Viabilitas Propagul R. mucronata dengan Uji Belah (Cutting Test) dan Uji Perkecambahan Langsung ... 19
3.5.2 Kadar Air (KA) ... 20
3.5.3 Presentase Benih yang Berakar Selama Penyimpanan ...… 21
3.5.4 Daya Berkecambah (DB) ... 21
3.5.5 Kecepatan Tumbuh (KT) ... 22
3.5.6 Nilai Perkecambahan (NP) ... 22
3.5.7 Nisbah Pucuk Akar (NPA) ... 22
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil ... 24
4.1.1 Presentase Propagul yang Berakar pada Setiap Periode Simpan (PB) ... 25
4.1.2 Kadar Air Propagul (KA) ... 26
4.1.3 Daya Berkecambah (DB) ... 28
4.1.4 Nilai Perkecambahan (NP) ... 30
4.1.5 Kecepatan Tumbuh (KT) ... 32
4.1.6 Nisbah Pucuk Akar (NPA) ... 34
4.1.7 Pendugaan Viabilitas Berdasarkan Uji Belah (Cutting Test) dan Uji Perkecambahan Langsung ... 36
4.2 Pembahasan ... 38
v BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan ... 49
5.2 Saran ... 49
DAFTAR TABEL
No. Halaman
1. Beberapa Sifat Benih Ortodoks dan Rekalsitran ... 8
2. Rekapitulasi Hasil Sidik Ragam Perkecambahan Propagul dari Perkecambahan Semai R. mucronata pada setiap Perlakuan
Selama Periode Penelitian ... 24
3. Uji Duncan Pengaruh Interaksi Lama Penyimpanan (A) dan Ruang Simpan (B) terhadap Presentase Berakar Propagul
R.mucronata(PB) ... 26 4. Uji Duncan Pengaruh Faktor Tunggal Lama Penyimpanan (A),
Ruang Simpan (B) dan Media Simpan (C) terhadap Kadar Air
PropagulR. mucronata(KA) ... 28 5. Uji Duncan Pengaruh Interaksi Lama Penyimpanan (A), Ruang
Simpan (B) dan Media Simpan (C) terhadap Daya
Berkecambah PropagulR.mucronata(DB) ... 30 6. Uji Duncan Pengaruh Faktor Tunggal Lama Penyimpanan (A),
Ruang Simpan (B) dan Media Simpan (C) terhadap Nilai
Perkecambahan PropagulR.mucronata(NP) ... 32 7. Uji Duncan Pengaruh Faktor Tunggal Lama Penyimpanan (A),
Ruang Simpan (B) dan Media Simpan (C) terhadap Kecepatan
Tumbuh PropagulR.mucronata(KT) ... 34 8. Uji Duncan Pengaruh Interaksi Lama Penyimpanan (A) dan
Media Simpan (C) terhadap Nisbah Pucuk Akar Semai
vii
No. Halaman
1. Presentase Propagul Berakar pada Setiap Akhir Periode
Simpan ... 25
2. Rata-rata Kadar Air Propagul pada Setiap Perlakuan ... 27
3. Rata-rata Daya Berkecambah Propagul pada Setiap
Perlakuan ... 29
4. Rata-rata Nilai Perkecambahan Propagul pada Setiap
Perlakuan ... 31
5. Rata-rata Kecepatan Tumbuh Propagul pada Setiap
Perlakuan ... 33
6. Rata-rata Nisbah Pucuk Akar Semai Propagul pada Setiap
Perlakuan ... 35
7. Daya Berkecambah Propagul R. mucronataHasil Uji Belah
dan Hasil Uji Perkecambahan Langsung ... 37
8. Daya Berkecambah dan Kadar Air Propagul R. mucronata
pada Berbagai Perlakuan Lama Penyimpanan ... 39
9. Penampakan Struktur Tumbuh PropagulR. mucronatayang
Viabelpada Uji Belah ... 47 10. Penampakan Struktur Tumbuh PropagulR. mucronatayang
DAFTAR LAMPIRAN
No. Halaman
1. Rekapitulasi Hasil Pengamatan PB, KA, DB, NP, KT dan NPA
Rhizophora mucronata ... 54 2. Rekapitulasi Hasil Pengamatan Uji Perkecambahan Langsung
dan Hasil Uji Belah (Cutting Test) Propagul Rhizophora
mucronata ... 56 3. Panjang Rata-rata dan Diameter Rata-rata Propagul
Rhizophora mucronatayang Digunakan dalam Penelitian ... 58 4. Berat Rata-rata Propagul Rhizophora mucronata yang
Digunakan dalam Penelitian ... 58
5. Kondisi Fisik PropagulR. mucronatapada Berbagai Perlakuan
Penyimpanan ... 59
5.1. PropagulR. mucronataTanpa Penyimpanan ... 59 5.2. Penampakkan Fisik Propagul R. mucronata yang
Disimpan Selama 1 minggu ... 59
5.3. Penampakkan Fisik Propagul R. mucronata yang
Disimpan Selama 2 minggu ... 60
5.4. Penampakkan Fisik Propagul R. mucronata yang
Disimpan Selama 3 minggu ... 60
5.5. Penampakkan Fisik Propagul R. mucronata yang
Disimpan Selama 4 minggu ... 61
6. Sidik Ragam Presentase Berakar Propagul Rhizophora
mucronata ... 62 7. Sidik Ragam Kadar Air PropagulRhizophora mucronata ... 62 8. Sidik Ragam Daya Berkecambah Propagul Rhizophora
mucronata ... 62 9. Sidik Ragam Nilai Perkecambahan Propagul Rhizophora
mucronata ... 63 10. Sidik Ragam Kecepatan Tumbuh Propagul Rhizophora
mucronata ... 63 11. Sidik Ragam Nisbah Pucuk Akar Semai Propagul Rhizophora
mucronata ... 63 12. Hasil Uji Beda Rata-rata antara Dugaan Daya Berkecambah
Hasil Uji Perkecambahan Langsung dengan Uji Belah pada
ix
14. Kadar Air Media Simpan PropagulRhizophora mucronata ... 66 15. Kondisi Fisik Propagul pada Uji Belah (Cutting Test) pada
Berbagai Perlakuan Penyimpanan ... 67
15.1. Uji Belah Propagul R. mucronata dengan Periode
Simpan 1 Minggu ... 67
15.2. Uji Belah Propagul R. mucronata dengan Periode
Simpan 2 Minggu ... 68
15.3. Uji Belah Propagul R. mucronata dengan Periode
Simpan 3 Minggu ... 69
15.4. Uji Belah Propagul R. mucronata dengan Periode
BAB I
PENDAHULUAN
1.1 Latar Belakang
Indonesia merupakan negara yang memiliki kawasan hutan mangrove
yang sangat luas. Ekosistem ini mempunyai fungsi yang penting ditinjau dari segi
ekologis dan ekonomis. Fungsi ekologis hutan mangrove antara lain melindungi
pantai dan tebing sungai dari erosi laut (abrasi), menahan hasil proses
penimbunan lumpur sehingga memungkinkan terbentuknya lahan baru, menjadi
wilayah penyangga terhadap rembesan air laut (intrusi), menyaring air laut
menjadi air daratan yang tawar dan habitat alami bagi berbagai jenis biota. Fungsi
ekonomis dari kayunya adalah sebagai kayu bakar, arang, bahan bangunan, serta
bahan baku industri seperti industri chip, pulp dan kertas. Fungsi ekonomis non
kayu antara lain sebagai bahan pangan, obat-obatan dan tempat wisata.
Sejalan dengan semakin pesatnya pembangunan di berbagai sektor,
intensitas pemanfaatan hutan mangrove oleh sektor kehutanan dan sektor non
kehutanan semakin meningkat. Berbagai praktek pemanfaatan hutan mangrove
saat ini seringkali mengabaikan azas kelestarian fungsi ekologisnya, yang lebih
dipentingkan adalah segi ekonomisnya saja. Hal ini mengakibatkan banyak lahan
hutan mangrove yang terdegradasi bahkan hilang sama sekali digantikan dengan
penggunaan lain seperti tambak, perumahan, dan lain-lain.
Mengingat potensi hutan mangrove yang telah mengalami penurunan,
maka perlu dilakukan rehabilitasi hutan dalam upaya mempertahankan kelestarian
ekosistem. Salah satu upaya dalam kegiatan rehabilitasi hutan adalah penanaman
kembali hutan mangrove. Salah satu keberhasilan dalam penanaman tergantung
pada ketersediaan benih dan pengumpulan benih. Benih-benih setelah
dikumpulkan kemudian dilakukan penyimpanan benih agar viabilitas benih dapat
dipertahankan dalam suatu periode waktu yang lama. Hal ini dilakukan mengingat
Salah satu jenis yang dapat digunakan untuk merehabilitasi hutan
mangrove adalah Rhizophora mucronata. Pada saat ini kondisi jumlah tegakan benih Rhizophora mucronata luasnya semakin menurun seiring dengan tingkat kerusakan hutan mangrove yang semakin tinggi. Hal ini berarti kapasitas bibit di
masa yang akan datang kemungkinan tidak mencukupi untuk program penanaman
dalam skala besar atau untuk penanaman pada lahan yang tidak produktif.
Penyimpanan benih jenis ini menjadi sangat penting karena tipe benih
vegetasi mangrove pada umumnya termasuk ke dalam jenis rekalsitran, jenis ini
umumnya tidak tahan terhadap penyimpanan dan waktu berbuahnya tidak setiap
saat. Untuk itu teknik penyimpanan benih merupakan suatu kegiatan yang penting
untuk dikembangkan agar dapat dihasilkan benih dengan viabilitas yang tetap
tinggi selama periode penyimpanan sampai pada periode penanaman benih
tersebut di lapangan.
1.2 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk:
1. Mengetahui pengaruh media simpan, ruang simpan dan lama penyimpanan
terhadap viabilitas propagulRhizophora mucronata.
2. Membandingkan daya berkecambah propagul antara hasil uji cepat viabilitas
propagul R. mucronata (uji belah) dengan daya berkecambah propagul hasil uji perkecambahan langsung.
1.3 Hipotesis
Hipotesis dalam penelitian ini adalah:
1. Lama penyimpanan, ruang simpan dan media simpan dapat mempengaruhi
viabilitas propagulR. mucronata.
2. Daya berkecambah propagul R. mucronata hasil uji belah tidak berbeda dengan hasil uji perkecambahan langsung.
1.4 Manfaat Penelitian
Dari penelitian ini diharapkan dapat menemukan teknik penyimpanan
3
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Umum Hutan Mangrove
Hutan mangrove dapat didefinisikan sebagai suatu tipe hutan yang tumbuh
di daerah pasang surut (terutama di pantai, laguna, dan muara sungai yang
terlindung) yang tergenang pada saat pasang dan bebas dari genangan pada saat
surut, yang komunitas tumbuhannya toleran terhadap garam (kondisi salin).
Adapun ekosistem mangrove adalah merupakan suatu sistem yang terdiri atas
organisme (tumbuhan dan hewan) yang berinteraksi dengan faktor lingkungan dan
dengan sesamanya di dalam suatu habitat mangrove (Kusmanaet al., 2003). Menurut Anwar dan Subandiono (1996), hutan mangrove adalah satu
persekutuan hidup alam hayati dan alam lingkungannya yang terdapat di daerah
pantai laut kawasan tropika. Hutan ini hanya terjadi apabila pantai tadi terekspos
terhadap angin kencang atau gelombang laut yang besar. Oleh karenanya,
kebanyakan hutan mangrove terdapat di sekitar teluk yang lautnya tenang dan
daratannya secara berangsur-angsur melandai ke laut. Hutan mangrove tumbuh di
lapisan yang tergenang di waktu air pasang dan bebas genangan pada waktu air
surut. Kondisi semacam ini banyak dijumpai di muara-muara sungai, di delta
tempat sungai menimbun lumpur, di atas terumbu karang, ataupun di lagun.
Kusmana (1997) memberikan beberapa faktor lingkungan yang didiuga
dapat mempengaruhi pertumbuhan dan perkembangan mangrove, yaitu fisiografi
pantai, salinitas, pasang surut air laut, iklim, tanah, kandungan oksigen terlalut,
dan hara. Hal tersebut ditegaskan oleh Istomo (1992) yang juga mengatakan
bahwa adaptasi mangrove terhadap faktor-faktor tersebut tampak pada fisiologi
dan komposisi, serta struktur tumbuhan mangrove.
Hutan mangrove berdasarkan keadaan vegetasinya dibedakan antara hutan
mangrove primer, hutan mangrove sekunder dan hutan nipa. Hutan mangrove
primer adalah hutan mangrove yang masih utuh, baik struktur maupun komposisi
mangrove dan hutan rawa, ditumbuhi jernis nipa (Nypa Fructicans) (Fakuara,
1991).
Walaupun di setiap pantai yang berdekatan dengan muara-muara sungai
umumnya ditumbuhi oleh mangrove, namun ternyata penyebaran jenisnya
tidaklah secara acak. Penyebaran jenis mangrove selalu berkaitan dengan kadar
garam atau salinitas, lama dan frekuensi penggenangan oleh air laut dan juga
kandungan lumpur tanahnya. Semakin ke arah lautan, semakin tinggi frekuensi
penggenangannya dan mungkin semakin tinggi pula salinitasnya. Kondisi ini
menyebabkan terjadinya zonasi-zonasi dari jenis mangrove (Anwar dan
Subandiono, 1996). Berdasarkan frekuensi air pasang, hutan mangrove dapat
dibagi atas lima zona. Zona-zona tersebut ditumbuhi oleh tipe-tipe vegetasi yang
berbeda-beda dan komposisi jenis pohon dalam setiap zone tergantung jarak
relatif dari sungai dan laut. Zona-zona tersebut adalah :
1. Zona hutan terdekat dengan laut yang didominasi olehAvicenniaspp., dan Sonneratia spp. tumbuh pada lumpur dengan kandungan organik yang tinggi.
2. Zona hutan pada substrat yang sedikit lebih tinggi yang biasanya
didominasi oleh Bruguiera cylindrica. Hutan ini tumbuh pada tanah liat yang cukup keras dan dicapai oleh beberapa air pasang saja.
3. Ke arah daratan lagi, hutan didominasi oleh Rhizophora mucronata dan R. apiculata. R. apiculata lebih banyak dijumpai pada kondisi yang agak basah dan lumpurn yang agak dalam. Pohon-pohon dapat
tumbuh setinggi 35-40m. Pohon lain yang juga terdapat pada hutan ini
adalah Burguiera parviflora dan Xylocarpus granatum. Gundukan lumpur yang dibuat oleh udang lumpur ditumbuhi oleh pakis piai
Acrostrichum aureum.
4. Zona hutan yang didominasi olehBruguiera parviflorakadang-kadang dijumpai tanpa jenis pohon lainnya. Hutan ini juga terdapat dimana
pohonRhizophoraspp. telah ditebang.
5. Zona terakhir didominasi olehBruguiera gymnorrhiza. Semaian pohon ini toleran terhadap naungan pada kondisi dimana Rhizophora tidak
5
mampu tumbuh di bawah induknya. Peralihan antara hutan ini dan
dataran ditandai oleh adanya Lumnitzera racemosa, Xylocarpus moluccensis, Intsia bijuga, Ficus retusa, rotan, pandan, dan nibong pantai Oncosperma tigillaria. Tahap-tahap tidak selalu nyata terutama lokasi dimana hutan terganggu oleh manusia. Di hutan mangrove,
pakis piai terdapat sangat umum dan padat (Fakuara, 1991).
Manfaat yang dapat diperoleh dari hutan mangrove sangat beragam baik
fungsi fisik, biologis maupun ekonomis. Fungsi fisik antara lain menjaga
keseimbangan ekosistem perairan pantai, melindungi pantai dan abrasi, penahan
intrusi air laut ke daratan, menahan dan mengendapkan lumpur serta menyaring
bahan pencemar (Nursidah, 1996). Fungsi biologis adalah sebagai sumber bahan
pelapukan yang merupakan sumber makanan bagi plankton dan invertebrata kecil,
tempat berlindung dan berkembang berbagai macam ikan, kerang, kepiting dan
udang; sebagai sumber plasma nutfah dan merupakan habitat alami bagi berbagai
jenis biota (Anwar dan Subiondono, 1996). Fungsi ekonomis merupakan sesuatu
yang nyata bagi masyarakat pantai yaitu sebagai penghasil kayu baik untuk bahan
bakar, arang maupun bangunan, dan sebagai penghasil bahan baku industri,
penghasil ikan, nener, udang, kerang, kepiting dan madu serta sebagai tempat
pariwisata.
2.2 Tinjauan JenisRhizophora mucronata
2.2.1 Tinjauan UmumRhizophora mucronata
R. mucronata merupakan salah satu jenis tanaman mangrove yang termasuk dalam famili Rhizophoraceae. Taksonomi jenis ini secara lengkap
adalah sebagai berikut :
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotyledonae
Sub kelas : Dialypetalae
Bangsa : Myrtales
R. mucronatadikenal sebagai bangka itam, dongoh korap, bakau hitam, bakau korap, bakau merah, jangkar, lenggayong, belukap dan lalanu. Tinggi
pohon ini mencapai 27 m, jarang melebihi 30 m dengan diameter batang
mencapai 70 cm. Kulit kayu berwarna gelap sampai hitam dan terdapat celah
horizontal.
Kayu R. mucronata bermanfaat sebagai kayu bakar (arang), pulp, plywood, kulit kayu sebagai bahan pengawet dan buahnya dapat dipakai
untuk campuran lauk pauk (Ditjen RRL, 1997). Sementara itu Noor et al. (1999) menyatakan bahwa selain digunakan sebagai bahan bakar dan arang,
R. mucronata kadang-kadang digunakan sebagai obat dalam kasus hematuria (pendarahan pada air seni), tanin dari kulit kayu digunakan sebagai
pewarnaan dan dapat juga ditanam untuk melindungi pematang disepanjang
tambak. Jenis ini mempunyai daerah penyebaran meliputi Afrika Timur,
Madagaskar, Asia Tenggara, seluruh Malaysia dan Indonesia, Melanesia dan
Mikronesia.
2.2.2 Tinjauan BotanisRhizophora mucronata
Menurut Ewusie (1990),R. mucronatamempunyai bentuk akar tunjang yang dapat mendukung berdirinya akar tersebut dan juga berfungsi sebagai
banir pada pohon yang sudah tua. Disamping sebagai
pendukung/memperkokoh berdirinya pohon, akar tersebut berfungsi juga
untuk mengambil unsur hara dan menahan sedimen. Akar R. mucronata memiliki lentisel yang berfungsi sebagai alat pernafasan (Bengen, 2000).
Batang diselimuti kulit berganda (4-5 cm) dan mengandung zat
penyamak. Kulit tersebut retak berkotak-kotak tidak berlentisel dan bagian
dalamnya berwarna kuning sampai orange (Ditjen RRL, 1997).
Noor et al. (1999) mendeskripsikan bahwa daun R. mucronata mempunyai gagang berwarna hijau dengan panjang 2,5-5,5 cm. Bentuknya
elips melebar hingga bulat memanjang dengan ujung meruncing dan
mempunyai ukuran 11-23 x 5-13 cm.
Bunga R. mucronata berada di ketiak daun dengan formasi berkelompok (4-8 bunga perkelompok). Mempunyai daun mahkota sebanyak
7
kuning pucat. Benang sari 8 dan tidak bertangkai. Sementara itu, buah
lonjong/panjang hingga berbentuk telur berukuran 5-7 cm, berwarna hijau
kecoklatan, seringkali kasar dan berbiji tunggal. Hipokotil silindris, kasar dan
berbintil. Leher kotiledon kuning ketika matang. Ukuran hipokotil yaitu
panjang 36-70 cm dan diameter 2-3 cm (Nooret al., 1999).
2.3 Penyimpanan Benih
Menurut Sutopo (2002), penyimpanan benih adalah untuk
mempertahankan viabilitas yang maksimum selama mungkin, sehingga simpanan
energi yang dimiliki benih tidak menjadi bocor dan benih mempunyai cukup
energi untuk tumbuh pada saat ditanam. Maksud dari penyimpanan benih di
waktu tertentu adalah agar benih dapat ditanam pada waktu yang diperlukan dan
untuk tujuan pelestarian benih dari sesuatu jenis tanaman.
Tujuan utama penyimpanan benih menurut Sutopo (2002) adalah untuk
mempertahankan viabilitas benih dalam periode simpan yang sepanjang mungkin.
Untuk tujuan ini, diperlukan suatu periode simpan dari hanya beberapa hari,
semusim, setahun bahkan sampai beberapa puluh tahun bila ditujukan untuk
pelestarian jenis. Bila ditinjau dari viabilitasnya secara umum benih dibedakan
antara berdaya simpan baik, sedang dan jelek. Agar benih memiliki daya simpan
yang baik maka benih harus memiliki kekuatan tumbuh dan daya kecambah yang
semaksimal mungkin.
Viabilitas benih dapat diperpanjang bila benih disimpan pada kondisi yang
terlindung dari panas, uap, air dan oksigen (Aug Pyr de Candolle, 1832 dalam Justice and Bass, 2002). Justice and Bass (2002) juga mengatakan bahwa tujuan
utama penyimpanan benih tanaman bernilai ekonomi ialah untuk mengawetkan
cadangan bahan tanam dari satu musim ke musim berikutnya.
Menurut King dan Roberts (1979) dalam Anggraini (2000), berdasarkan kadar air dan suhu, benih dapat dikelompokkan menjadi dua kelas yaitu benih
pada kelembaban relatif 50% dan tidak dapat disimpan pada waktu yang lama.
Perbedaan kedua tipe benih tersebut dapat secara jelas dilihat dalam Tabel 1.
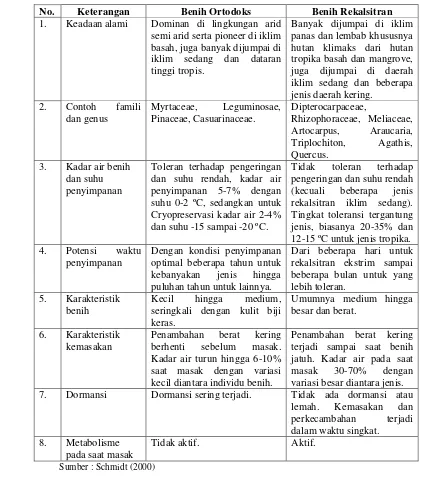
Tabel 1 Beberapa sifat benih ortodoks dan rekalsitran
No. Keterangan Benih Ortodoks Benih Rekalsitran
1. Keadaan alami Dominan di lingkungan arid semi arid serta pioneer di iklim basah, juga banyak dijumpai di iklim sedang dan dataran tinggi tropis.
Banyak dijumpai di iklim panas dan lembab khususnya hutan klimaks dari hutan tropika basah dan mangrove, juga dijumpai di daerah iklim sedang dan beberapa jenis daerah kering.
2. Contoh famili dan genus
Myrtaceae, Leguminosae, Pinaceae, Casuarinaceae.
Dipterocarpaceae,
Rhizophoraceae, Meliaceae, Artocarpus, Araucaria, Triplochiton, Agathis, Quercus.
3. Kadar air benih dan suhu penyimpanan
Toleran terhadap pengeringan dan suhu rendah, kadar air penyimpanan 5-7% dengan suhu 0-2 ºC, sedangkan untuk Cryopreservasi kadar air 2-4% dan suhu -15 sampai -20 ºC.
Tidak toleran terhadap pengeringan dan suhu rendah (kecuali beberapa jenis rekalsitran iklim sedang). Tingkat toleransi tergantung jenis, biasanya 20-35% dan 12-15 ºC untuk jenis tropika. 4. Potensi waktu
penyimpanan
Dengan kondisi penyimpanan optimal beberapa tahun untuk kebanyakan jenis hingga puluhan tahun untuk lainnya.
Dari beberapa hari untuk rekalsitran ekstrim sampai beberapa bulan untuk yang lebih toleran.
5. Karakteristik benih
Kecil hingga medium, seringkali dengan kulit biji keras.
Umumnya medium hingga besar dan berat.
6. Karakteristik kemasakan
Penambahan berat kering berhenti sebelum masak. Kadar air turun hingga 6-10% saat masak dengan variasi kecil diantara individu benih.
Penambahan berat kering terjadi sampai saat benih jatuh. Kadar air pada saat masak 30-70% dengan variasi besar diantara jenis. 7. Dormansi Dormansi sering terjadi. Tidak ada dormansi atau
lemah. Kemasakan dan perkecambahan terjadi dalam waktu singkat. 8. Metabolisme
pada saat masak
Tidak aktif. Aktif.
Sumber : Schmidt (2000)
Menurut Kongsangchai (1988), benih spesies mangrove termasuk benih
9
dianjurkan untuk menanam setelah pengumpulan dari pohon induk. Kandungan
benih menjadi faktor yang sangat penting dalam penyimpanan.
Pada benih rekalsitran, terdapat hubungan yang sangat erat antara kadar air
benih dengan daya kecambah benih. Benih dengan kadar air yang tinggi
cenderung akan mempunyai daya kecambah yang tinggi pula. Oleh karena itu,
penentuan kadar air dari suatu kelompok benih sangat penting dilakukan, karena
laju kemunduran viabilitas benih dalam penyimpanan sangat dipengaruhi oleh
kadar air (Anggraini, 2000).
Ketahanan benih untuk disimpan beraneka ragam tergantung dari jenis
benih, cara dan tempat penyimpanan. Tempat untuk menyimpan benih juga
bervariasi tergantung dari macam benih serta maksud dan lama penyimpanan
(Sutopo, 2002).
Manan (1976) berpendapat bahwa penyimpanan benih yang baik
merupakan usaha pengawetan viabilitas benih, sejak pengumpulan sampai
penyebaran benih di persemaian atau penanaman benih langsung di lapangan.
Pertimbangan-pertimbangan lain dalam hal penyimpanan benih adalah : (1)
musim panen tidak tepat dengan musim penanaman; (2) spesies-spesies tanaman
tidak berbuah setiap tahun; (3) biji-biji harus diangkut dari jarak yang jauh; (4)
biji-biji perlu dimasakkan lebih dulu setelah panen agar perkecambahannya baik.
Umur simpan benih dipengaruhi oleh sifat benih, kondisi lingkungan dan
perlakuan manusia. Daya simpan individu benih dipengaruhi oleh faktor sifat dan
kondisi seperti : pengaruh genetik, pengaruh kondisi sebelum panen, pengaruh
struktur dan komposisi benih, kulit benih, tingkat kemasakan, ukuran, dormansi,
kadar air benih, kerusakan mekanik dan vigor. Sedangkan pengaruh lingkungan
meliputi : suhu, kelembaban dan cahaya (Justice and Bass, 2002).
2.4 Ruang dan Wadah Penyimpanan
Justice dan Bass (2002) menyatakan bahwa setiap kenaikan suhu
penyimpanan 5 ºC dan setiap kenaikan 1% kadar air benih, maka masa hidup
benihnya diperpendek setengahnya. Secara umum viabilitas dan vigor benih
Kondisi ruang simpan mempengaruhi viabilitas benih yang disimpan,
terutama RH dan suhu yang merupakan faktor utama yang harus diperhatikan
dalam mempertahankan daya simpan benih. Penyimpanan benih pada daerah
beriklim tropis seperti Indonesia sering mengalami kendala terutama karena
adanya fluktuasi suhu. Harrington (1972) menyatakan untuk penyimpanan benih
selama mungkin tanpa menghilangkan daya berkecambah dan vigor benih dapat
dilakukan dengan mengkondisikan lingkungan yang kering dan dingin. Untuk
memperpanjang daya berkecambah dan vigor benih dapat dilakukan dengan cara
penyimpanan dalam kamar dingin, penyimpanan dalam ruang simpan yang
dihumidifikasi dan penyimpanan dalam wadah kedap uap air atau wadah yang
resisten terhadap kelembaban.
Pengemasan benih bertujuan untuk melindungi benih dari kerusakan fisik
maupun fisiologis. Pemilihannya didasari pertimbangan tujuan penyimpanan,
jumlah benih yang disimpan dan kondisi ruang simpan maupun lamanya benih
berada dalam wadah simpan (Bass, Te and Winter, 1961dalamAnggraini, 2000). Biji-biji bakau memerlukan penanganan yang hati-hati dan transportasi
yang tidak mudah. Oleh karena itu, penentuan wadah simpan juga harus
memperhatikan karakteristik biji-biji tersebut. Adapun karakteristik yang perlu
diperhatikan adalah :
1. Ukuran dan berat benih yang besar membutuhkan ruang yang cukup besar.
2. Bentuk alami benih vivipar yang menghasilkan pertumbuhan yang
terus-menerus (sejak benih masih melekat di pohon) dan pertumbuhan bijinya
membutuhkan kelembaban tertentu.
3. Bijinya yang mengandung banyak air sangat peka terhadap sengatan
matahari dan luka mekanik. Segera setelah pengumpulan, usahakan untuk
tetap menempatkan biji di bawah naungan untuk menghindari penurunan
kelembaban yang berarti. Saat melakukan transportasi biji-biji tersebut
sebaiknya ditempatkan pada posisi horisontal dan ditutupi oleh karung
goni atau bahan yang lembab serta terlindungi dari panas (Departemen
11
2.5 Media Simpan 2.5.1 Serbuk Gergaji
Media simpan serbuk gergaji merupakan limbah yang berasal
terutama dari industri penggergajian kayu. Limbah tersebut dapat
menimbulkan pengotoran lingkungan apabila tidak dapat diatasi, baik
pembuangan maupun pemanfaatannya (Anggraini, 2000). Serbuk gergaji
kayu mengandung komponen kimia yang sama dengan yang terkandung
dalam batang kayu, yakni komponen selulosa, lignin, hemisellulosa dan
zat ekstraktif. Disamping itu serbuk gergaji juga mengandung 0,24% N,
0,20% P dan 0,45% K. Debu dari kayu cukup kaya akan zat makanan bagi
tumbuh-tumbuhan terutama CaCO3 (Darusman, 1973 dalam Anggraini, 2000).
2.5.2 Sabut Kelapa
Media simpan lain yang digunakan selain serbuk gergaji adalah
sabut kelapa. Sabut kelapa memenuhi kriteria sebagai media perakaran
karena berserat, mempunyai kamampuan menahan air, longgar, ringan,
mudah didapat dan tidak mahal (Kijkar, 1992).
2.6 Perkecambahan
Kramer, Paul dan Kosloswski (1960) dalam Martini dan Zainal (1982) menyatakan bahwa perkecambahan adalah proses dimana embrio tumbuh kembali
menjadi kecambah yang ditandai dengan keluarnya bakal akar dan bakal tanaman
dari kulit biji. Kamil (1982) mengemukakan bahwa secara visual dan morfologis
suatu biji yang berkecambah umumnya ditandai dengan terlihatnya akar (redicle)
atau daun (plumule) yang menonjol keluar dari biji.
Soekotjo (1976) dalam Anggraini (2000) menyatakan bahwa proses fisiologis yang berhubungan dengan perkecambahan biji adalah : (a) absorbsi air,
yang sebagian besar dilakukan dengan imbibisi; (b) permulaan pembesaran sel
dan pembagian sel; (c) meningkatnya jumlah enzim-enzim dan aktivitas enzim
daerah-diferensiasi dari sel-sel menjadi berbagai jaringan dan bagian-bagian suatu anakan
pohon.
Untuk pengujian perkecambahan dapat dipakai berbagai media
perkecambahan. Media perkecambahan yang biasa dipakai untuk pengujian antara
lain : kertas substrat, pasir dan tanah (Kuswanto, 1997). Menurut Manan (1976),
syarat-syarat media yang baik untuk perkecambahan antara lain : (1) mempunyai
porositas yang cukup sehingga terdapat aerasi udara dan drainase air yang perlu
bagi benih yang sedang berkecambah; (2) bebas dari jamur dan jasad renik
lainnya dan (3) tidak beracun terhadap kecambah.
Ada dua tipe perkecambahan yang didasarkan atas letak kotiledon
terhadap permukaan tanah yaitu tipe epigeal dan tipe hypogeal. Tipe epigeal yaitu
dimana kotiledonnya terangkat di atas permukaan tanah sewaktu pertumbuhannya.
Dan tipe hypogeal yaitu bila kotiledonnya tetap tinggal di bawah permukaan tanah
sewaktu pertumbuhannya (Kamil, 1982).
Menurut Kamil (1982), terdapat beberapa faktor yang mempengaruhi
perkecambahan benih, terbagi atas faktor dalam benih dan faktor luar benih.
Faktor dalam benih antara lain adalah tingkat kemasakan benih, ukuran benih,
dormansi rudimeter (benih kurang masak), asal benih, dan daya tembus air dan
unsur-unsur mekanik lainnya pada kulit biji. Sedangkan faktor luar benih meliputi
air, suhu, oksigen, cahaya dan medium.
2.7 Uji Viabilitas
Viabilitas benih merupakan daya hidup benih yang ditunjukkan melalui
fenomena pertumbuhan atau struktur tumbuh kecambah dan gejala
metabolismenya. Viabilitas benih dipengaruhi oleh faktor genetik, kondisi
lingkungan saat proses perkembangan benih pada tanaman induk dan kondisi
lingkungan selama penyimpanan. Sadjad (1993) mengindikasikan viabilitas benih
dalam beberapa tolak ukur, baik tolak ukur yang secara langsung menilai
pertumbuhan benih maupun yang secara tidak langsung menilai gejala
metabolisme atau mengamati beberapa komponen makro molekul sitoplasma dan
aberasi kromosom di dalam inti selnya.
Menurut Sadjad (1980), pengujian benih dalam indikasi tidak langsung
13
matinya sel-sel pada jaringan embrio. Willan (1984) menyatakan bahwa
pendugaan potensial perkecambahan suatu sampel kadang merupakan suatu
metode yang hampir relevan dengan praktek dalam kehutanan. Tetapi pengujian
dengan perkecambahan memerlukan waktu berminggu-minggu, dan untuk jenis
tertentu diperlukan perlakuan pendahuluan. Untuk itu diperlukan metode
pengujian viabilitas benih yang dapat menduga secara akurat namun lebih cepat
daripada pengujian pengecambahan.
Untuk memperoleh keterangan mengenai viabilitas suatu benih dalam
waktu singkat telah dikembangkan beberapa metode uji cepat viabilitas benih atau
uji viabilitas benih secara tidak langsung. Metode pengujian viabilitas yang umum
dilakukan salah satunya adalah uji belah (cutting test). Uji belah merupakan suatu
metode uji cepat yang biasanya digunakan untuk menguji viabilitas benih dalam
jumlah banyak. Uji ini dapat digunakan dilapangan untuk memperkirakan benih
yang masak atau kualitas kumpulan benih dalam kegiatan pengumpulan benih.
Tetapi uji ini cenderung kurang dapat dipercaya hasilnya karena terkadang hanya
dengan melihat penampilannya secara langsung, benih tersebut seperti hidup
padahal kalau dikecambahkan gagal berkecambah (Leloup, 1955 dalam Alfiani, 2003). Menurut Willan (1984), uji belah merupakan salah satu uji viabilitas paling
sederhana dengan cara melihat langsung dengan mata terhadap benih yang telah
dibelah, dibuka dengan pisau atau skalpel. Jika endosperma memiliki warna
normal dengan embrio yang baik maka benih mempunyai kemungkinan
berkecambah. Pengujian ini kurang teliti bagi benih jenis konifer dan
benih-benih kecil lainnya karena menghasilkan angka perkecambahan yang lebih tinggi
dari keadaan sebenarnya.
Sadjad (1980) menyatakan bahwa secara umum pengujian viabilitas benih
itu mencakup pengujian daya kecambah atau daya tumbuh dan pengujian vigor.
Pengujian daya berkecambah atau daya tumbuh memberikan informasi tentang
kemungkinan tanaman berproduksi normal dalam kondisi lapang dan lingkungan
itu, pengujian daya simpan juga berorientasi seperti itu, tetapi hal ini dilakukan
sesudah benih disimpan melalui periode simpan dan keadaan simpan yang wajar.
2.8 Kemunduran Benih
Kemunduran benih merupakan suatu proses merugikan yang dialami oleh
setiap jenis benih yang dapat terjadi segera setelah benih masak dan terus
berlangsung selama benih mengalami proses pengolahan, pengemasan dan
penyimpanan (Justice and Bass, 2002). Kemunduran benih menimbulkan
perubahan yang menyeluruh pada benih baik fisik, fisiologis maupun kimiawi
yang akhirnya mengarah pada kematian (Byrd, 1983).
Byrd (1983) menyatakan beberapa teori tentang penyebab kemunduran
benih yaitu : (1) terjadinya penggumpalan protoplasma, (2) kelaparan lokal, (3)
degradasi mitokondria, (4) terjadinya auto oksidasi lipid pada kadar air yang
rendah, (5) kehabisan substrat atau berkurangnya bahan baku untuk respirasi, (6)
degradasi dari nukleus, (7) degradasi enzim, (8) kerusakan kulit benih, (9)
penggumpalan protein pada embrio secara perlahan dan (10) penimbunan hasil
metabolisme beracun.
Justice dan Bass (2002) menyatakan bahwa gejala kemunduran benih
dapat dilihat dari gejala fisiologi dan kimiawi. Gejala fisiologi seperti perubahan
warna benih, mundurnya pertumbuhan perkecambahan dan meningkatnya
kecambah abnormal. Gejala kimiawi pada benih yang mengalami kemunduran
adalah terjadinya perubahan dalam aktivitas enzim, respirasi, laju sintesa,
perubahan membran, perubahan persediaan makanan dan perubahan kromosom.
Selama penyimpanan benih mengalami kemunduran secara fisiologis
maupun kronologis (Sadjad, 1993). Kemunduran fisiologis merupakan
kemunduran benih akibat berbagai faktor lingkungan simpan. Sedangkan
kemunduran kronologis merupakan kemunduran benih akibat perjalanan waktu.
Proses kemunduran benih tidak dapat dihentikan namun dapat dikendalikan
15
BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di rumah kaca dan laboratorium silvikultur
Institut Pertanian Bogor serta laboratorium Balai Penelitian Teknologi Perbenihan
(BPTP) Ciheuleut, Bogor. Penelitian ini dimulai pada akhir bulan Juli 2010
sampai dengan bulan November 2010.
3.2 Bahan dan Alat Penelitian
Bahan-bahan yang dipergunakan dalam penelitian ini adalah propagul
Rhizophora mucronata yang memiliki rata-rata ukuran panjang 50,68 cm dan diameter 15,20 mm serta memiliki berat rata-rata 48,61 gram, serbuk gergaji,
sabut kelapa, kertas merang, kardus, polybag ukuran 15 x 20 cm, pupuk cair
massmikro, kompos, tanah, pasir, pestisida, air tawar dan garam dapur.
Alat yang digunakan dalam penelitian ini adalah AC, timbangan, oven,
higrometer, termometer, hand sprayer, kamera, kaliper, penggaris, gelas ukur, desikator dan pisau.
3.3 Metode Analisis
Penelitian ini menggunakan rancangan acak lengkap (RAL) faktorial 5 x 2
x 2 dengan tiga kali ulangan. Dengan demikian terdapat 60 satuan percobaan.
Untuk lebih jelasnya masing-masing faktor dapat diperinci sebagai berikut :
Faktor A (Lama penyimpanan)terdiri dari : A0: 0 minggu (langsung tanam)
A1: 1 minggu
A2: 2 minggu
A3: 3 minggu
A4: 4 minggu
Faktor C (Media simpan)terdiri dari : C1: Serbuk gergaji
C2: Sabut kelapa
Model persamaan umum rancangan penelitian ini adalah :
Yijk= μ + Ai+ Bj+ Ck+ (AB)ij+ (AC)ik+ (BC)jk+ (ABC)ijk+ Eijkl Dimana :
Yijk = Nilai hasil pengamatan
μ = Nilai rata-rata
Ai = Pengaruh waktu simpan taraf ke–i
Bj = Pengaruh ruang simpan taraf ke–j
Ck = Pengaruh media penyimpanan ke–k
(AB)ij = Pengaruh interaksi waktu simpan ke–i dan ruang simpan ke–j
(AC)ik = Pengaruh interaksi waktu simpan ke–i dan media penyimpanan
ke–k
(BC)jk = Pengaruh interaksi ruang simpan ke–j dan media penyimpanan
ke –k
(ABC)ijk = Pengaruh interaksi antara taraf ke–i faktor A, taraf ke–j faktor B,
dan taraf ke–k faktor C
Eijkl = Kesalahan percobaan akibat waktu simpan ke–i, ruang simpan ke
–j, media simpan ke–k dan ulangan ke–l
Untuk mengetahui pengaruh faktor dan interaksi antar faktor dilakukan
analisis keragaman dan kemudian diuji dengan uji F. Hipotesis yang digunakan
dalam pengujian tersebut adalah sebagai berikut :
H0 : Perlakuan yang berbeda tidak berpengaruh terhadap perkecambahan benih
H1 : Perlakuan yang berbeda berpengaruh terhadap perkecambahan benih
Dari hipotesis tersebut dilakukan pengambilan keputusan terhadap uji F,
yaitu bila F hitung lebih kecil dari F tabel maka terima H0, sebaliknya bila F
hitung lebih besar dari F tabel maka tolak H0. Selanjutnya bila uji F menunjukkan
pengaruh yang nyata maka dilanjutkan dengan uji beda jarak Duncan (Haeruman,
17
3.4 Pelaksanaan Penelitian 3.4.1 Tahap Persiapan
Wadah Simpan
Wadah simpan yang digunakan adalah kardus berukuran panjang
50 cm, lebar 30 cm dan tinggi 20 cm. Jumlah wadah yang digunakan
sebanyak 48 buah untuk penyimpanan benih dengan masing-masing
perlakuan yang diberikan.
Media Simpan
Media simpan yang digunakan adalah sabut kelapa dan serbuk
gergaji.
Ruang Simpan
Ruang simpan yang digunakan adalah ruang AC dan ruang kamar.
Dalam penelitian ini ruang AC yang digunakan suhunya berkisar antara
19 ºC – 20 ºC, dengan kelembaban 60 - 61 %, sedangkan ruang kamar
bersuhu sekitar 26 ºC–28 ºC, dengan kelembaban 80 - 85 %.
Media Perkecambahan
Dalam penelitian ini media perkecambahan yang digunakan adalah
media tanah campuran yaitu tanah, kompos dan pasir (1:1:1).
3.4.2 Pengunduhan Propagul
Yang dimaksud dengan benih disini adalah propagul Rhizophora mucronata. Propagul yang diunduh berasal dari buah yang telah matang dari tegakan mangrove yang tumbuh di sepanjang pesisir Muara Angke,
Jakarta.
3.4.3 Seleksi Benih/Propagul
Setelah pengunduhan, sebelum penyimpanan dilakukan seleksi
propagul. Propagul yang dipilih adalah propagul yang sehat dan masak
yang ditandai oleh warna kotiledon kekuningan, hipokotil kokoh serta
bebas dari hama penyakit maupun luka mekanis.
3.4.4 Penyimpanan Benih
a. Benih yang akan digunakan untuk penelitian dibagi-bagi untuk
masing-masing perlakuan. Pembagian dilakukan secara acak. Untuk
masing-masing perlakuan digunakan 18 buah yaitu 15 buah untuk
pengujian perkecambahan, 2 buah untuk pengujian kadar air, dan 1
buah untuk uji belah (cutting test).
b. Benih sebelum dan sesudah penyimpanan ditentukan dulu kadar
airnya. Demikian juga dengan media simpannya.
c. Pemasukan serbuk gergaji dan sabut kelapa sebagai media simpan ke
dalam wadah penyimpanan.
d. Benih diletakkan dalam wadah penyimpanan yang telah diisi dengan
media simpan seperti tersebut diatas. Pada setiap wadah simpan
diletakkan 18 benih untuk pengujian perkecambahan, kadar air, dan
uji belah (cutting test). Selanjutnya wadah simpan ditutup dan
dimasukkan ke ruang simpan sesuai dengan perlakuan yang
diberikan.
3.4.5 Uji Belah (Cutting Test)
Persiapan dan Perlakuan Benih
Uji belah ini merupakan uji viabilitas benih yang paling mudah dan
sederhana tanpa menggunakan bahan kimia. Benih yang digunakan
diambil dari hasil seleksi benih. Jumlah benih yang digunakan adalah 1
benih untuk setiap ulangan perlakuan. Kemudian benih sebelum
penyimpanan dan setelah penyimpanan dilembabkan pada kertas merang
selama 24 jam, benih dibelah searah keping benih (memanjang). Setelah
itu, benih tersebut diamati struktur tumbuhnya (embrio dan kotiledon)
dengan mata atau dengan menggunakan kaca pembesar.
Evaluasi Hasil Uji Belah (Cutting Test)
Pengamatan dilakukan dengan melihat warna/penampakan dari
struktur tumbuh benih sehingga dapat diketahui benih tersebut viabel atau non viabel. Benih viabel dicirikan dengan penampakan struktur tumbuh benih yang segar dan berwarna kehijauan atau putih kekuningan,
19
benih yang kering atau layu dan warnanya tampak coklat kehitaman
(Zanzibaret al., 2001). 3.4.6 Penyemaian Benih
Kegiatan pengujian perkecambahan benih dilakukan dengan
menggunakan metode langsung yaitu dengan cara menyemaikan benih
pada setiap akhir periode simpan. Penyemaian dilakukan dengan cara
membenamkan ujung hipokotil sedalam kurang lebih 7 cm sama dengan
petunjuk teknis penanamanRhizophora mucronata. 3.4.7 Pemeliharaan
Kegiatan pemeliharaan yang dilakukan adalah sebagai berikut :
a. Propagul yang ditanam langsung disemprot dengan pupuk cair
dengan dosis 2 ml tiap 1 liter air, kemudian penyemprotan dilakukan
setiap satu minggu sekali selama empat minggu.
b. Penyiraman air garam dengan konsentrasi 2,5% dilakukan sekali
selama penelitian yaitu langsung setelah penyemaian.
c. Penyiraman dengan air tawar satu kali sehari.
d. Pencabutan gulma.
e. Penyemprotan pestisida mulai minggu ketiga dan selanjutnya
dilakukan setiap sepuluh hari sekali. Dosis pestisida yang digunakan
pada setiap kali penggunaan adalah 2 ml per liter air.
3.5 Pengambilan Data
3.5.1 Viabilitas Propagul R. mucronata dengan Uji Belah (Cutting Test) dan Uji Perkecambahan Langsung
Untuk membandingkan data dugaan daya berkecambah hasil uji
belah dengan data daya berkecambah hasil uji perkecambahan langsung
dilakukan analisis dengan menggunakan prosedur uji t (Steel & Torrie,
1991).
Hipotesis yang digunakan adalah sebagai berikut:
H1 : μ1 ≠ μ2 → Nilai rataan dugaan DB hasil uji cepat (uji belah) tidak
sama dengan nilai rataan DB hasil uji perkecambahan
langsung
Sedangkan kaidah uji yang digunakan adalah sebagai berikut:
thit=
thit> t (α/2 ; r1+ r2–2)→ tolak H0
thit>t (α/2 ; r1+ r2+ 2)→ terima H0
Dimana :
Se =
d = selisih nilai rataan daya berkecambah hasil uji cepat dengan
hasil uji perkecambahan
r1.2 = ulangan
JK1.2= jumlah kuadrat daya berkecambah hasil uji cepat dengan
hasil uji perkecambahan
Untuk mengetahui keeratan hubungan antara daya berkecambah
hasil uji belah dengan daya berkecambah hasil uji perkecambahan
langsung dihitung koefisien korelasinya (Steel & Torrie, 1991).
Koefisien korelasi secara sederhana dapat ditulis sebagai berikut:
r = ∑ . ∑ ∑
∑ (∑ ) ∑ (∑ )²
Dimana :
r = koefisien korelasi
n = jumlah ulangan
dx = DB hasil uji cepat
dy = DB hasil uji perkecambahan
3.5.2 Kadar Air (KA)
Untuk menentukan kadar air ini diambil contoh benih/propagul
sebanyak dua buah untuk setiap ulangan perlakuan. Pengukuran kadar air
dilakukan dalam dua tahap. Tahap pertama merupakan tahap pra
21
diperoleh berat basah (BB) benih kemudian dimasukkan ke dalam oven
dengan suhu 130 ºC selama 5 – 10 menit (ISTA, 1996). Setelah
dikeluarkan dari oven, benih dimasukkan ke dalam desikator selama 45
menit, kemudian benih ditimbang lagi sehingga diperoleh berat kering
(BK 1) benih. Pada tahap kedua, sebelum dimasukkan ke oven, benih
dipotong dan dibelah. Suhu oven yang digunakan adalah 105 ºC selama 17
jam. Berat kering (BK 2) benih diperoleh dengan cara menimbang benih
setelah benih dibiarkan dalam desikator selama 45 menit.
Kadar air dihitung berdasarkan rumus yang terdapat dalam
(Kuswanto, 1997), yaitu sebagai berikut :
MC = S1 + S2–
S1+S2
100
Dimana MC = Kadar air dalam persen
S1 = Jumlah air yang hilang pada pemanasan predrying (%) S2 = Jumlah air yang hilang pada pemanasan kedua (%)
3.5.3 Presentase Benih yang Berakar Selama Penyimpanan
Kriteria berakar disini adalah apabila panjang akar yang muncul
lebih dari 0,5 cm. Kriteria tersebut ditetapkan karena panjang akar kurang
dari 0,5 cm diperkirakan masih rentan terhadap kerusakan mekanis.
PB = ∑ benih yang berakar
Jumlah benih yang dismpan x 100%
3.5.4 Daya Berkecambah (DB)
Kriteria perkecambahan normal ditandai dengan munculnya dua
helai daun muda pada hipokotil. Perkecambahan dilakukan selama kurang
lebih 90 hari. Pengamatan perkecambahan dilakukan setiap tiga hari sekali
terhadap kecambah normal. Daya berkecambah (DB) dihitung berdasarkan
3.5.5 Kecepatan Tumbuh (KT)
Kecepatan tumbuh benih dihitung berdasarkan jumlah benih normal
yang tumbuh setiap hari. Kecepatan tumbuh dihitung dengan
menggunakan rumus MaguiredalamAnggraini (2000), yaitu :
KT = X1 E1
+
X2
E2
+ …. +
Xn EnKeterangan X1 = Presentase kecambah normal pengamatan ke–1
E2 = Presentase hari ke–1
3.5.6 Nilai Perkecambahan (NP)
Nilai perkecambahan dihitung menggunakan rumus Czabator (1962),
yaitu sebagai berikut :
GV = PV x FGD
PV = % perkecambahan puncak ∑hari perkecambahan
FGD = % perkecambahan pada akhir pengamatan
∑hari uji
Keterangan GV = Nilai perkecambahan
PV = Perkecambahan puncak
FGD = Perkecambahan harian akhir
3.5.7 Nisbah Pucuk Akar (NPA)
Parameter NPA dihitung dengan cara membandingkan berat kering
pucuk dan berat kering akar semai. Dalam hal ini pucuk dan akar semai
dikeringkan secara terpisah dalam oven selama 2 x 24 jam pada suhu 80
ºC, kemudian ditimbang berat keringnya setelah dimasukkan ke dalam
desikator selama 45 menit.
Selain itu, dalam penelitian ini diamati beberapa data penunjang
23
1. Berat 100 benih
Berat 100 benih diduga dengan cara menimbang 100 propagul
dengan 8 kali ulangan sehingga jumlah totalnya 800 buah.
2. Pengukuran panjang dan diameter rata-rata benih
Pengukuran panjang dan diameter rata-rata benih dilakukan dengan
cara mengukur panjang dan diameter 10 hipokotil dengan 10 ulangan.
3. Pengukuran kadar air media simpan
Pengukuran kadar air media simpan dilakukan pada setiap akhir
periode simpan. Berat basah diperoleh dengan cara menimbang
beratnya sebelum media simpan dimasukkan ke dalam oven. Berat
kering tanur (BKT) diperoleh dengan cara pengovenan media simpan
pada suhu 105 ºC selama 17 jam, kemudian setelah dimasukkan
desikator selama 45 menit, media simpan tersebut ditimbang lagi.
Kadar air tersebut dihitung dengan menggunakan rumus :
KA =BB-BKT
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
PropagulRhizophora mucronatadikecambahkan selama 90 hari (3 bulan) dan diamati setiap 3 hari sekali. Hasil pengamatan setiap variabel pertumbuhan
dari setiap propagulR. mucronata selama periode pengamatan dapat dilihat pada Lampiran 1.
Variabel pertumbuhan yang diamati pada penelitian ini adalah persen
berakar (PB), kadar air (KA), daya berkecambah (DB), nilai perkecambahan (NP),
kecepatan tumbuh (KT), dan nisbah pucuk akar (NPA). Adapun rekapitulasi hasil
sidik ragam pengaruh perlakuan terhadap setiap variabel pertumbuhan dapat
[image:39.612.124.510.390.604.2]dilihat pada Tabel 2.
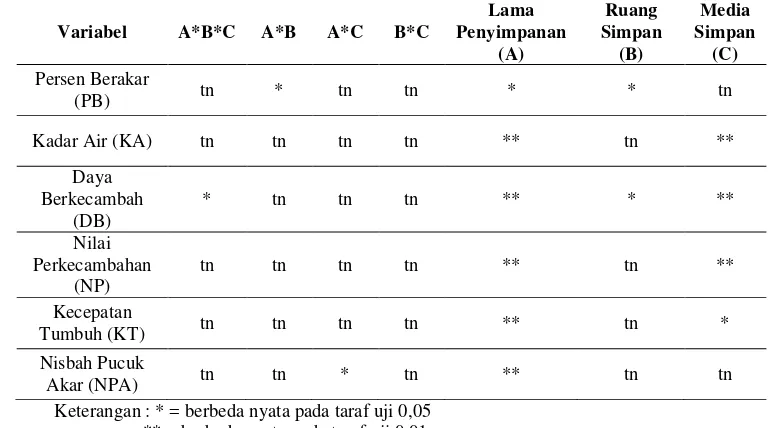
Tabel 2 Rekapitulasi Hasil Sidik Ragam Perkecambahan Propagul dari Perkecambahan semai R. mucronata pada Setiap Perlakuan Selama Periode Penelitian
Variabel A*B*C A*B A*C B*C
Lama Penyimpanan (A) Ruang Simpan (B) Media Simpan (C) Persen Berakar
(PB) tn * tn tn * * tn
Kadar Air (KA) tn tn tn tn ** tn **
Daya Berkecambah
(DB)
* tn tn tn ** * **
Nilai Perkecambahan
(NP)
tn tn tn tn ** tn **
Kecepatan
Tumbuh (KT) tn tn tn tn ** tn *
Nisbah Pucuk
Akar (NPA) tn tn * tn ** tn tn
Keterangan : * = berbeda nyata pada taraf uji 0,05 ** = berbeda nyata pada taraf uji 0,01
tn = tidak nyata
Berdasarkan informasi pada Tabel 2, perbedaan lama penyimpanan
propagulR. mucronatamenyebabkan perbedaan secara signifikan terhadap semua variabel pertumbuhan propagul yang diamati. Begitu pula perbedaan media
0 0 0 0 0 0 0 0
0 0
8,89
0
2,22
0
11,11
6,67
0 0
2 4 6 8 10 12
P
e
rs
e
n
tas
e
B
e
rak
a
r
(%
)
B1C1
B1C2
B2C1
Untuk mengetahui pengaruh interaksi antara lama penyimpanan dan ruang
simpan terhadap rata-rata presentase berakar propagul dapat dilihat pada hasil uji
[image:41.612.126.506.214.362.2]Duncan (Tabel 3). Adapun kondisi fisik propagulR. mucronatapada setiap akhir periode simpan dapat dilihat pada Lampiran 5.
Tabel 3 Uji Duncan Pengaruh Interaksi Lama Penyimpanan (A) dan Ruang Simpan (B) terhadap Presentase Berakar PropagulR.mucronata(PB)
Perlakuan Rata-rata PB (%)
Interaksi 2 Faktor
A2B2 10a
A3B2 3,34b
A4B2 1,11b
A0B1 0b
A1B1 0b
A2B1 0b
A3B1 0b
A1B2 0b
A4B1 0b
A0B2 0b
Pada Tabel 3 di atas menunjukkan bahwa propagul R. mucronata yang disimpan selama dua minggu penyimpanan memberikan nilai rata-rata presentase
berakar propagul yang paling tinggi dan kemudian menurun pada minggu ketiga
dan minggu keempat. Dapat diketahui dari Tabel 3 di atas bahwa interaksi antara
lama penyimpanan selama dua minggu dengan ruang kamar sebagai ruang simpan
memberikan nilai rata-rata presentase berakar propagul paling tinggi (PB = 10 %).
Sedangkan propagul yang disimpan di ruang AC memiliki nilai PB 0 %. Dengan
demikian dapat diketahui bahwa ruang AC dapat menghambat kemunculan akar
propagulR. mucronata.
4.1.2 Kadar Air Propagul (KA)
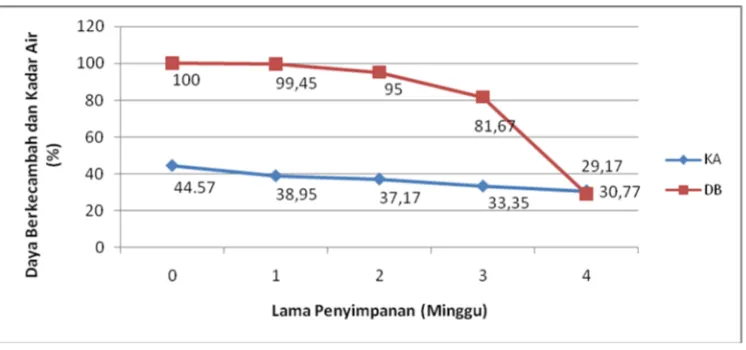
Hasil pengukuran kadar air dalam penelitian ini dapat dilihat pada
Lampiran 1 yang menunjukkan bahwa kadar air propagul menurun dengan
semakin bertambahnya lama waktu penyimpanan. Untuk lebih jelasnya nilai
36,07
34,53
33,27 30,59
39,68
38,57
35,16
34,5
38,85
37,67
29,53
28,62 41,26
37,91 35,44
29,38 44,57
0 5 10 15 20 25 30 35 40 45 50
0 1 2 3 4
K
a
d
a
r
A
ir
(
%
)
Lama Penyimpanan (Minggu)
B1C1
B1C2
B2C1
(Tabel 4) dapat diketahui pada pengaruh faktor media simpan menunjukkan
bahwa rata-rata kadar air propagul yang disimpan dalam media sabut kelapa
(38,11 %) lebih tinggi dibandingkan dengan kadar air propagul yang disimpan
dalam media serbuk gergaji (35,83 %). Sementara itu, propagul yang diberikan
perlakuan penyimpanan mempunyai kadar air yang lebih kecil daripada kadar air
propagul tanpa penyimpanan. Adapun kadar air propagul yang disimpan selama 1
dan 2 minggu relatif lebih besar daripada propagul yang disimpan selama 3 dan 4
minggu.
Fenomena di atas menunjukkan bahwa propaul yang disimpan baik di
ruang AC maupun ruang kamar dengan media sabut kelapa lebih dapat
[image:43.612.113.508.377.568.2]mempertahankan kadar air propagulR. mucronataselama 4 minggu penyimpanan dibandingkan ruang kamar dan media serbuk gergaji.
Tabel 4 Uji Duncan Pengaruh Faktor Tunggal Lama Penyimpanan (A), Ruang Simpan (B) dan Media Simpan (C) terhadap Kadar Air Propagul R. mucronata(KA)
Perlakuan Rata-rata KA (%)
Lama Penyimpanan (A)
0 Minggu (A0) 44,57a
1 Minggu (A1) 38,97b
2 Minggu (A2) 37,17b
3 Minggu (A3) 33,35c
4 Minggu (A4) 30,77c
Ruang Simpan (B)
AC (B1) 37,15a
Kamar (B2) 36,78a
Media Simpan (C)
Sabut Kelapa (C2) 38,11a Serbuk Gergaji (C1) 35,83b
4.1.3 Daya Berkecambah (DB)
Hasil pengamatan perkecambahan selama penelitian (Lampiran 1)
menunjukkan bahwa daya berkecambah propagul R.mucronata tanpa penyimpanan dan penyimpanan selama 1 minggu di ruang AC dengan media
simpan sabut kelapa serta di ruang kamar, baik dengan media serbuk gergaji
97,78 93,33 80 28,89 100 100 86,67 46,67 100 91,11 64,44 25,55 100 95,55 95,56 15,55 100 0 20 40 60 80 100 120
0 1 2 3 4
D a y a B e rk e cam b a h ( % )
Lama Penyimpanan (Minggu)
B1C1
B1C2
B2C1
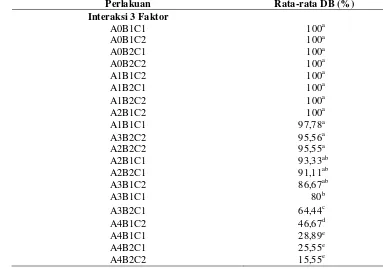
bahwa pada kurun waktu penyimpanan selama 3 minggu, propagul R. mucronata baik yang disimpan di ruang AC maupun ruang kamar dengan media simpan
serbuk gergaji dan sabut kelapa mempunyai DB yang relatif tinggi (DB = 80%),
kecuali propagul yang disimpan di ruang suhu kamar dengan media simpan
serbuk gergaji. Pada periode waktu penyimpanan selama 4 minggu, semua
propagul baik yang disimpan di ruang suhu kamar maupun ruang AC dengan
media simpan serbuk gergaji dan sabut kelapa mempunyai DB yang rendah,
terutama terhadap propagul yang disimpan di media simpan sabut kelapa di ruang
[image:45.612.121.504.330.599.2]bersuhu kamar.
Tabel 5 Uji Duncan Pengaruh Interaksi Lama Penyimpanan (A), Ruang Simpan (B) dan Media Simpan (C) terhadap Daya Berkecambah Propagul R.mucronata(DB)
Perlakuan Rata-rata DB (%)
Interaksi 3 Faktor
A0B1C1 100a
A0B1C2 100a
A0B2C1 100a
A0B2C2 100a
A1B1C2 100a
A1B2C1 100a
A1B2C2 100a
A2B1C2 100a
A1B1C1 97,78a
A3B2C2 95,56a
A2B2C2 95,55a
A2B1C1 93,33ab
A2B2C1 91,11ab
A3B1C2 86,67ab
A3B1C1 80b
A3B2C1 64,44c
A4B1C2 46,67d
A4B1C1 28,89e
A4B2C1 25,55e
A4B2C2 15,55e
4.1.4 Nilai Perkecambahan (NP)
Nilai perkecambahan (NP) merupakan nilai yang menunjukkan kecepatan
dan kesempurnaan propagul untuk berkecambah. Berdasarkan hasil analisis sidik
ragam (Tabel 2) diketahui bahwa pemberian faktor tunggal lama penyimpanan
0,76 0,52 0,32 0,08 0,85 0,71 0,58 0,14 0,75 0,47 0,22 0,05 0,89 0,68 0,48 0,05 0,61 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
0 1 2 3 4
N il a i P e rk e cam b a h a n
Lama Penyimpanan (Minggu)
B1C1
B1C2
B2C1
selama 2, 3 dan 4 minggu. Dalam hal ini propagul yang disimpan selama 4
minggu mempunyai nilai perkecambahan paling rendah (NP = 0,08) bila
dibandingkan dengan propagul yang disimpan selama periode waktu lainnya.
Adapun pengaruh pada faktor media simpan (Tabel 6) menunjukkan
bahwa rata-rata nilai perkecambahan propagul yang disimpan dalam media sabut
kelapa (NP = 0,56) lebih tinggi dibandingkan dengan propagul yang disimpan
dalam media serbuk gergaji (NP = 0,44), baik yang disimpan di ruang AC
maupun di ruang bersuhu kamar.
Fenomena di atas menunjukkan bahwa propagul yang disimpan selama
satu minggu penyimpanan, baik di ruang AC maupun di ruang bersuhu kamar
dengan media sabut kelapa memberikan pengaruh paling baik terhadap nilai
perkecambahan propagulR. mucronata.
Tabel 6 Uji Duncan Pengaruh Faktor Tunggal Lama Penyimpanan (A), Ruang Simpan (B) dan Media Simpan (C) terhadap Nilai Perkecambahan PropagulR.mucronata(NP)
Perlakuan Rata-rata NP
Lama Penyimpanan (A)
1 Minggu (A1) 0,81a
0 Minggu (A0) 0,61b
2 Minggu (A2) 0,59b
3 Minggu (A3) 0,40c
4 Minggu (A4) 0,08d
Ruang Simpan (B)
AC (B1) 0,52a
Kamar (B2) 0,48a
Media Simpan (C)
Sabut Kelapa (C2) 0,56a
Serbuk Gergaji (C1) 0,44b
4.1.5 Kecepatan Tumbuh (KT)
Dari Lampiran 1 dapat diketahui bahwa semakin lama waktu simpan maka
kecepatan tumbuh propagul semakin menurun. Hal ini berarti vigor propagul juga
semakin menurun. Untuk lebih jelasnya nilai KT propagul selama penelitian dapat
[image:47.612.118.508.381.553.2]1,88
1,71
1,38
0,47 1,94
1,84
1,47
0,74 1,92
1,62
1,05
0,38 1,99
1,69 1,61
0,26 1,98
0 0.5 1 1.5 2 2.5
0 1 2 3 4
K
e
ce
p
a
tan
T
u
m
b
u
h
Lama Penyimpanan ( Minggu)
B1C1
B1C2
B2C1
Tabel 7 Uji Duncan Pengaruh Faktor Tunggal Lama Penyimpanan (A), Ruang Simpan (B) dan Media Simpan (C) terhadap Kecepatan Tumbuh PropagulR.mucronata(KT)
Perlakuan Rata-rata KT
Lama Penyimpanan (A)
0 Minggu (A0) 1,98a
1 Minggu (A1) 1,93a
2 Minggu (A2) 1,71b
3 Minggu (A3) 1,38c
4 Minggu (A4) 0,46d
Ruang Simpan (B)
AC (B1) 1,54a
Kamar (B2) 1,45a
Media Simpan (C)
Sabut Kelapa (C2) 1,55a Serbuk Gergaji (C1) 1,44b
Dapat diketahui juga dari hasil uji Duncan di atas bahwa pada pengaruh
faktor media simpan menunjukkan bahwa propagul yang disimpan dengan media
sabut kelapa memiliki rata-rata nilai kecepatan tumbuh yang signifikan lebih
tinggi (KT = 1,55) dibandingkan dengan propagul yang disimpan dengan media
serbuk gergaji (KT = 1,44), baik yang disimpan di ruang AC maupun di ruang
bersuhu kamar.
Fenomena di atas menunjukkan propagul yang mendapat perlakuan tanpa
penyimpanan dan satu minggu penyimpanan, baik di ruang AC maupun di ruang
kamar dengan media sabut kelapa relatif lebih mampu mempertahankan viabilitas
propagulR. mucronata.
4.1.6 Nisbah Pucuk Akar (NPA)
Berdasarkan Lampiran 1 diketahui bahwa nisbah pucuk akar semai R. mucronata menurun dengan semakin bertambahnya lama waktu penyimpanan. Hasil pengamatan nilai rata-rata nisbah pucuk akar semai propagul pada setiap
[image:49.612.123.505.130.289.2]0,07 0,07
0,06 0,05
0,09
0,07
0,05 0,08
0,08
0,05
0,06 0,01
0,06 0,06
0,04 0,01
0 0.02 0.04 0.06 0.08 0.1 0.12
0 1 2 3 4
N
is
b
a
h
P
u
cu
k
A
k
a
r
Lama Penyimpanan (Minggu)
B1C1
B1C2
B2C1