RIZKY PRASETYO
DEPARTEME BIOKIMIA
FAKULTAS MATEMATIKA DA ILMU PE GETAHUA ALAM
I STITUT PERTA IA BOGOR
ABSTRAK
RIZKY PRASETYO. Potensi Nanopropolis Lebah Madu
Trigona spp Asal
Pandeglang sebagai Antibakteri. Dibimbing oleh LAKSMI AMBARSARI dan A.
E. ZAINAL HASAN.
Propolis merupakan salah satu produk alami lebah madu yang banyak
manfaatnya, karena memiliki sifat antara lain sebagai antibakteri, antivirus, dan
antikanker. Penggunaan bentuk nanopropolis diharapkan memberikan aktivitas
antibakteri yang lebih baik dibandingkan dengan bentuk propolis biasa. Penelitian
ini bertujuan untuk menentukan potensi nanopropolis lebah madu
Trigona spp
asal Pandeglang sebagai antibakteri. Nanopropolis dibuat dengan teknik
homogenisasi kecepatan tinggi disertai penyalutan dengan maltodekstrin dan
teknik penguapan pelarut. Ukuran nanopropolis dianalisis dengan SEM. Uji
aktivitas antibakteri dilakukan dengan metode difusi sumur agar. Hasil SEM
menunjukkan nanopropolis berukuran 175/873 nm. Nanopropolis bersifat sebagai
antibakteri baik Gram positif maupun Gram negatif. Nanopropolis mempunyai
efektivitas yang lebih tinggi dibandingkan dengan ekstrak propolis sebesar
208.86%, 211.83%, 227.01%, dan 230.29% masing/masing terhadap
B. subtilis,
S. aureus, E. coli, dan Salmonella sp. Efektivitas nanopropolis jika dibandingkan
dengan ampisilin 10 mg/ml sebesar 43.87%, 49.12%, 42.35%, dan 37.58%.
Konsentrasi Hambat Tumbuh Minimum (KHTM) sebesar 0.15%, 0.075%, 0.15%,
dan 0.313% terhadap B. subtilis, S. aureus, E. coli, dan Salmonella sp.
Pandeglang as Antibacterial Agent. Under the direction of LAKSMI
AMBARSARI and A. E. ZAINAL HASAN.
POTE SI A OPROPOLIS LEBAH MADU
spp
ASAL PA DEGLA G SEBAGAI A TIBAKTERI
RIZKY PRASETYO
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEME BIOKIMIA
FAKULTAS MATEMATIKA DA ILMU PE GETAHUA ALAM
I STITUT PERTA IA BOGOR
NIM : G84060445
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS
Ir. A. E. Zainal Hasan, M.Si
Ketua
Anggota
Diketahui
Dr. I Made Artika, M. App. Sc
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan
karunia/Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul
Potensi Nanopropolis Lebah Madu
Trigona spp Asal Pandeglang sebagai
Antibakteri. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan
dari bulan Maret sampai Agustus di Laboratorium Biokimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Laksmi Ambarsari, MS dan Ir.
A. E. Zainal Hasan, M.Si selaku pembimbing yang telah memberikan ilmu dan
waktunya dalam penyusunan karya ilmiah ini. Penulis juga mengucapkan terima
kasih kepada para laboran di Laboratorium Biokimia yang telah memberikan
pengarahan. Ungkapan terima kasih penulis ucapkan kepada keluarga atas segala
doa, dukungan, dan kasih sayang yang telah diberikan. Tidak lupa untuk teman/
teman Biokimia 43 yang telah memberikan dukungan dan semangat. Semoga
skripsi ini bermanfaat.
Bogor, Januari 2011
Benny Subyarmono dan ibunda Wariyati. Penulis merupakan putra ketiga dari tiga
bersaudara.
Tahun 2006 penulis lulus dari SMA Negeri 1 Purworejo dan pada tahun yang
sama penulis berhasil masuk Institut Pertanian Bogor melalui jalur Undangan
Seleksi Masuk IPB (USMI). Penulis memilih Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Lebah Madu Trigona spp ... 2
Propolis ... 2
Nanopartikel ... 3
Bakteri Uji ... 4
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode ... 6
PEMBAHASAN
Rendemen Ekstrak Propolis ... 7
Nanopropolis ... 8
Hasil Uji Antibakteri ... 10
Konsentrasi Hambat Tumbuh Minimum (KHTM) ... 11
SIMPULAN DAN SARAN
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
Halaman
1
Propolis kasar ... 3
2
Ekstrak pekat propolis ... 8
3
Serbuk nanopropolis ... 9
4
Morfologi SEM nanopropolis ... 9
5
Profil spektrum FTIR propolis, penyalut nanopropolis, dan nanopropolis .. 10
6
Diameter zona bening hasil analisis uji antibakteri ... 11
DAFTAR LAMPIRA
Halaman
1
Alur penelitian ... 17
2
Nilai rendemen ekstrak propolis ... 18
3
Efektivitas antibakteri nanopropolis ... 19
4
Diameter zona bening nanopropolis terhadap B. subtilis ... 20
5
Diameter zona bening nanopropolis terhadap S. aureus ... 21
6
Diameter zona bening nanopropolis terhadap E. coli ... 22
7
Diameter zona bening nanopropolis terhadap Salmonella sp ... 23
8
Analisis statisitik diameter zona bening B. subtilis ... 24
9
Analisis statisitik diameter zona bening S. aureus ... 25
10
Analisis statisitik diameter zona bening E. coli ... 26
11
Analisis statisitik diameter zona bening Salmonella sp ... 27
12
Gambar diameter zona bening B. subtilis ... 28
13
Gambar diameter zona bening S. aureus ... 29
14
Gambar diameter zona bening E. coli ... 30
PE DAHULUA
Masyarakat umumnya memilih antibiotik alami dibandingkan dengan antibiotik sintetik atau obat untuk meminimalkan timbulnya efek samping. Penggunaan antibiotik yang berlebihan dapat menimbulkan resistensi. Oleh karena itu, dipilih alternatif pengobatan dari produk alami yang jarang menimbulkan resistensi dan efek samping lainnya.
Pengujian aktivitas antibakteri pada penelitian ini menggunakan bakteri Gram positif (Staphylococcus aureus dan Bacillus subtilis) dan Gram negatif (Escherichia coli dan Salmonella sp) dengan teknik difusi sumur agar. Keempat bakteri ini dapat mewakili bakteri/bakteri lain penyebab penyakit. Bakteri/bakteri tersebut juga sebagai penghuni saluran pencernaan manusia, apabila dalam jumlah yang berlebih akan mengganggu kesehatan manusia. Selain itu, bakteri tersebut mudah tumbuh, mudah diperoleh, dan merupakan bakteri yang umum terdapat di lingkungan.
Indonesia merupakan negara beriklim tropis yang memiliki tingkat flora dan fauna yang sangat beragam. Kekayaan hayati yang dapat dimanfaatkan salah satunya adalah lebah madu. Selain menghasilkan madu, lebah juga menghasilkan produk lain yang dapat dimanfaatkan, berupa propolis. Selama ini peternak lebah jarang memberdayakan sarang lebah untuk diolah. Padahal propolis pada sarang lebah bisa diekstraksi menjadi produk farmasi, kosmetika, dan pangan fungsional. Propolis dapat berfungsi sebagai antibiotik alami karena kemampuan antimikrobnya dengan kelebihan lebih aman, tidak menimbulkan resistensi, dan efek samping yang kecil serta memiliki selektifitas yang tinggi (Winingsih 2004). Selain sebagai bahan obat, propolis juga dapat menyeimbangkan populasi mikroflora saluran pencernaan yang dapat memacu pertumbuhan ternak. Umumnya lebah madu yang diternakkan adalah jenis Apis spp karena menghasilkan madu lebih banyak dibandingkan Trigona spp. Trigona spp menghasilkan madu yang sedikit dan susah diekstrak, tetapi menghasilkan propolis lebih banyak daripada Apis spp (Singh 1962).
Propolis adalah bahan perekat dari resin yang dikumpulkan lebah pekerja dari kuncup, kulit kayu, dan bagian tumbuhan lainnya (Gojmerac 1983). Resin/resin yang terkumpul dicampur dengan enzim lebah sehingga berbeda dengan resin tumbuhan asalnya. Propolis berwarna kuning sampai coklat tua,
bahkan ada yang transparan. Komponen penting dalam propolis berupa resin (turunan asam benzoat dan flavonoid), wax dan asam lemak, minyak esensial, polen, dan mineral/ mineral. Flavonoid yang dikandung dalam propolis memberikan respon terhadap aktivitas antibakteri serta antikanker dan berperan dalam imunomodulasi (Burdock 1998; Sforcin 2007).
Penelitian/penelitian sebelumnya banyak memberikan informasi bahwa propolis memiliki potensi yang sangat menguntungkan. Saputra (2009) dan Suseno (2009) telah melakukan penelitian yang menunjukkan bahwa mikrokapsulasi propolis Trigona spp memiliki aktivitas antibakteri terhadap cairan rumen sapi. Fahri (2009) menyatakan bahwa nanopropolis 2% memberikan efek positif terhadap pertumbuhan tikus putih (Spraque% Dawley). Propolis Trigona spp memiliki aktivitas terhadap penghambatan pertumbuhan Enterobacter sakazakii (Fitriannur 2009). Penelitian yang dilakukan Anggraini (2006) memberikan penjelasan bahwa propolis hasil ekstrak etanol 70% efektif menghambat pertumbuhan bakteri baik Gram positif maupun Gram negatif. Lasmayanti (2007) memperlihatkan propolis Trigona spp dapat digunakan sebagai antikaries alternatif dalam pasta gigi karena mampu menekan pertumbuhan dan jumlah bakteri kariogenik (Streptococcus mutans), suatu bakteri penyebab karies gigi. Bagjavicenna (2008) mampu menunjukkan propolis dengan konsentrasi 6.25% dapat dijadikan dosis bahan alternatif antiketombe pada sampo. Saat ini, pemanfaatan nanopropolis sebagai zat antibakteri belum pernah dikaji lebih lanjut secara ilmiah.
2
ligannya atau dengan bantuan magnetik (Mohanraj & Chen 2006).
Nanopropolis selanjutnya akan disalut dengan teknik mikroenkapsulasi yang merupakan teknik untuk menyalut suatu senyawa (dapat berupa, padatan, cairan, dan gas) dengan suatu polimer penyalut yang berukuran sangat kecil (mikron) (Yoshizawa 2004). Keuntungan menggunakan mikroenkapsulasi adalah melindungi suatu senyawa aktif dari penguraian dan mengendalikan pelepasan suatu senyawa aktif sehingga mampu mencegah peningkatan konsentrasi obat dalam saluran pencernaan secara mendadak. Menurut Sutriyo et al. (2004), pelepasan obat yang terkendali menjadikan penggunaan obat lebih efisien, memperkecil efek samping, serta mengurangi frekuensi penggunaan obat.
Propolis memiliki kelarutan yang kecil dalam air. Pembuatan sediaan propolis dalam bentuk nano yang akan meningkatkan luas permukaanya sehingga kemampuan untuk melarutnya semakin baik. Propolis yang berukuran nano dapat melewati membran luar bakteri sehingga senyawa/senyawa aktif antibakterinya dapat merusak dinding sel bakteri. Penggunaan bentuk nanopropolis diharapkan memberikan aktivitas antibakteri yang lebih baik dibandingkan dengan bentuk propolis biasa.
Penelitian ini bertujuan untuk menguji aktivitas antibakteri dan menentukan konsentrasi hambat tumbuh minimum nanopropolis lebah madu Trigona spp asal Pandeglang sebagai bahan antibakteri. Hipotesis penelitian ini adalah nanopropolis lebah madu Trigona spp asal Pandeglang berperan sebagai antibakteri terhadap beberapa bakteri uji yang dapat dilihat dari konsentrasi hambat tumbuh minimumnya. Penelitian ini diharapkan memberikan informasi ilmiah mengenai konsentrasi hambat tumbuh minimum nanopropolis lebah madu Trigona spp asal Pandeglang sebagai bahan antibakteri.
TI JAUA PUSTAKA
Lebah Madu spp
Lebah madu Trigona spp merupakan serangga sosial yang hidup berkelompok membentuk suatu koloni. Koloninya dapat mencapai 300/800.000 ekor lebah. Lebah ini banyak dijumpai di daerah beriklim tropis dan subtropis di Amerika Selatan, setengah bagian Afrika Selatan, dan Asia Tenggara (Free 1982). Lebah Trigona spp diklasifikasikan
dalam divisi Animalia, filum Arthropoda, kelas Insecta, ordo Hymenoptera, famili Apidae, genus Trigona, dan spesies Trigona spp (Sihombing 1997). Koloni lebah madu terdiri atas dua golongan, yaitu golongan reproduktif (lebah jantan dan ratu) dan golongan nonreproduktif (lebah pekerja). Keduanya dapat dibedakan dari bentuk, rupa, warna, dan tingkah laku. Setiap koloni lebah hanya memiliki satu ekor ratu, ratusan ekor lebah jantan, dan ribuan ekor lebah pekerja (Sumoprastowo 1980). Trigona spp lebih banyak mencari makan pada pagi hari karena aktivitasnya dipengaruhi oleh intensitas cahaya matahari. Ukuran tubuh juga mempengaruhi jarak terbang lebah mencari makan. Semakin besar tubuh lebah, maka semakin jauh jarak terbangnya. Trigona spp dengan ukuran tubuh 5 mm mampu terbang sejauh 600 m (Nelli 2004).
Menurut Singh (1962), madu yang dihasilkan lebah Trigona spp lebih sedikit dibandingkan lebah lokal seperti Apis spp. Sarang lebah Trigona spp menghasilkan madu kurang lebih 1 kg/tahun, sedangkan Apis spp menghasilkan madu mencapai 75 kg/tahun. Madu yang dihasilkan Trigona spp mempunyai aroma khas, campuran rasa manis dan asam seperti lemon. Aroma madu tersebut berasal dari resin tumbuhan dan bunga yang dihinggapi lebah (Fatoni 2008). Madu dari Trigona juga sulit diekstrak, namun kandungan propolisnya lebih banyak daripada golongan Apis.
Sarang lebah Trigona spp dibuat dengan campuran lilin dan resin propolis dari tanaman. Sarang tersusun atas sel anakan yang dikelilingi dengan pelepah lembut yang disebut involucrum dan sel besar yang terdiri atas madu serta cadangan polen (Free 1982). Sarang lebah terdiri atas sekitar 50% senyawa resin (flavonoid dan asam fenolat), 30% lilin lebah, 105 minyak aromatik, 5% polen, dan 5% berbagai senyawa aromatik. Trigona spp memiliki sengat sisa, namun tidak digunakan sebagai alat pertahanan. Lebah akan menggigit atau membakar kulit musuhnya dengan larutan basa. Lebah ini juga dilengkapi dengan sistem kekebalan untuk menyerang serangga penggangu (Free 1982).
Propolis
Propolis berwarna kuning sampai coklat tua, bahkan ada yang transparan. Perbedaan warna tersebut dipengaruhi oleh kandungan flavonoidnya. Telah diperkirakan bahwa 200.000 lebah madu menghasilkan 20 gram kandungan propolis setiap tahunnya. Propolis berwujud keras dan rapuh pada suhu di bawah 15oC, tetapi kembali lebih lengket pada suhu 24/25oC. Propolis umumnya dapat meleleh pada suhu 60/69oC, namun ada pula yang titik lelehnya di atas 100oC (Woo 2004).
Senyawa kimia utama dalam propolis terdiri atas senyawa golongan flavonoid, fenolik, dan berbagai senyawa aromatik. Senyawa/senyawa tersebut sukar larut dalam air, sebagian besar mudah larut dalam alkohol, dan kadang sulit larut dalam pelarut hidrokarbon (Pietta et al. 2002 dalam Fatoni 2008). Lasmayanty (2007) menunjukkan hasil uji fitokimia terhadap propolis lebah Trigona spp asal Pandeglang mengandung senyawa alkaloid, flavonoid, minyak atsiri, triterpenoid, saponin, dan tanin.
Propolis dapat berfungsi sebagai antibiotik alami karena kemampuan antimikrobnya. Senyawa aktif yang memberikan efek antibakteri adalah pinocembrin, galangin, asam kafeat, dan asam ferulat. Senyawa antifunginya yaitu pinocembrin, pinobaksin, asam kafeat, benzil ester, sukaranetin, dan pterostilnena. Senyewa antiviralnya adalah asam kafeat, lutseolin, dan quersetin. Zat aktif yang diketahui bersifat antibiotik adalah asam ferulat. Zat tersebut efektif terhadap bakteri Gram positif dan Gram negatif (Winingsih 2004).
Lebah madu memerlukan propolis karena lebah madu rentan terhadap infeksi bakteri dan virus (Chinthalapally et al. 1993) dan untuk mengisi celah maupun retakan serta menghaluskan permukaan yang kasar pada sarangnya (Gojmerac 1983).
Gambar 1 Propolis kasar.
anopartikel
Teknologi nano merupakan teknik memanipulasi materi menjadi berskala nanometer dari sekumpulan atomnya melalui
pemurnian bentuk serbuknya. Sebuah ukuran nanometer adalah 1 x 10/9 m atau 1/1000 mm seukuran dengan 50.000 kali lebih kecil dari diameter rambut manusia. Teknologi nano merupakan pengembangan mutidisiplin ilmu fisika, kimia, biologi, teknik, elektronika, proses, materi, aplikasi, dan konsep (Aitken et al. 2004).
Nanopartikel termasuk golongan sistem penghantaran obat koloid padat, dan merupakan dasar dari sistem penghantaran obat yang bersifat dapat diuraikan tubuh dan tidak toksik. Nanopartikel adalah suatu preparat parenteral dan dapat disimpan dalam bentuk padat. Sediaan nanopartikel setelah penyimpanan setahun masih dapat diencerkan kembali menjadi larutan koloid yang baik dan masih mempunyai sifat/sifat in vivo dan in vitro yang tidak berubah (Wiraatmadja 1984).
4
sistem polimernya. Pembuatannya diawali dengan memasukkan dekstran ke dalam rantai hidrokarbon dalam poliakrilamit agar polimernya lebih mudah dimetabolisasi. Sistem yang menggunakan makromolekul alam biasa menggunakan protein dan selulosa sebagai bahan nanopartikel yang dapat didegradasi secara alami (Wiraatmadja 1984).
Keuntungan menggunakan nanopartikel pada obat, antara lain: ukuran partikel dan karakteristiknya permukaannya memudahkan untuk dimanipulasi agar mencapai efek pasif dan aktif terhadap targetnya; meningkatkan efek terapi dari obat; dapat menggunakan berbagai saluran seperti oral, nasal, parenteral, maupun intraokular; kontrol pengeluaran dan degradasi permukaan dapat diatur dari komposisi matriksnya; dan target spesifiknya dapat menempel melalui ligannya atau dengan bantuan magnetik.
Nanopartikel dapat dibentuk dari protein, polisakarida, dan sintesis polimer. Nanopartikel dapat dibentuk menggunakan tiga metode, antara lain: dispersi polimer, polimerasi monomer, dan gelatinasi ion (Mohanraj & Chen 2006). Faktor keterbatasan kelarutan obat yang digunakan secara oral menjadi pendekatan utama untuk meningkat kemampuannya menyerap sehingga dapat terurai menjadi cairan di dalam usus (Hue et al. 2004). Pengurangan atau pengecilan ukuran partikel yang memiliki kelarutan yang kecil akan akan meningkatkan luas permukaan sehingga akan meningkatkan penguraian partikel yang menyebabkan kelarutannya meningkat (Dressman et al. 1998; Horter dan Dressman 2001).
Bakteri Uji
Bakteri merupakan protista prokariot bersel tunggal yang sangat beragam. Bakteri berukuran mikroskopis dalam satuan mikrometer. Sel/sel individu bakteri memiliki bentuk bola (kokus), batang (basilus), dan spiral (spirilium). Pola penataan sel berbentuk tunggal, berpasangan, bergerombol, rantai atau filamen (Pelczar & Chan 1988).
Reproduksi bakteri dilakukan secara pembelahan biner melintang. Namun, beberapa spesies bereproduksi dengan proses tambahan berupa spora reproduktif dan fermentasi. Waktu regenerasi masing/masing spesies tidak sama bergantung kondisi dan nutrisi (Pelczar & Chan 1988).
Bakteri dapat dibedakan berdasarkan komposisi dan struktur dinding selnya, yaitu bakteri Gram positif dan Gram negatif. Perbedaan tersebut dilihat menggunakan
metode pewarnaan Gram. Bakteri Gram positif memberikan warna ungu atau biru, sedangkan bakteri Gram negatif berwarna merah (Pelczar & Chan 1988).
Staphylococcus aureus merupakan bakteri Gram positif yang termasuk famili Micrococaceae. Berbentuk kokus dengan diameter 0.5/1.5 µm dan penataan selnya tunggal, berpasangan, atau bergerombol seperti anggur. Bersifat patogen, nonmotil, tidak berspora, tidak berkapsul, anaerob fakultatif, tetapi tumbuh lebih cepat pada keadaan aerob. Suhu optimum pertumbuhannya 30/37oC. Koloni bakteri ini menghasilkan pigmen putih, kuning, atau kuning oranye (Lay & Hastowo 1992; Pelczar & Chan 1988) .
S. aureus terdapat pada rambut, selaput hidung, mulut, kelenjar keringat, saluran usus, pori/pori dan permukaan kulit, kelenjar susu, serta makanan yang berprotein tinggi (Fardiaz 1983; Pelczar & Chan 1988). Bakteri ini tumbuh optimum pada pH 7/7.5. S. aureus tumbuh baik di dalam medium yang mengandung NaCl 10%, menyebabkan intoksikasi, dan infeksi. S. aureus menghasilkan enterotoksin penyebab keracunan yang bersifat tahan panas dan masih aktif setelah dipanasi pada suhu 100oC selama 30 menit (Fardiaz 1983).
B. subtilis merupakan bakteri Gram positif berbentuk batang, berpasangan atau membentuk rantai, motil dengan flagela peritrik, berspora tahan panas kering dan desinfektan kimia tertentu selama waktu lama, dan bersifat aerob maupun anaerob fakultatif. B. subtilis suhu optimum 25/37oC. Bakteri ini menggunakan sumber nitrogen dan karbon untuk pertumbuhan. B. subtilis banyak ditemukan di tanah, air, udara, saluran pencernaan serta bahan pangan tertentu (Holt et al. 1994)
Salmonella sp termasuk Gram negatif, berbentuk batang, tidak membentuk spora, hidup secara aerobik dan anaerobik fakultatif, umumnya motil dengan flagelum peritrikus. Bakteri ini tergolong keluarga enteril atau Enterobacteriae dengan karakteristik mirip proteobakteri E. coli. Bakteri ini menggunakan sitrat sebagai sumber karbon, tidak memfermentasi laktosa, sukrosa, dan salisin. Sebagian strain ini dapat membentuk gas H2S. Salmonella typhi adalah contoh
strain yang dapat membentuk gas H2S.
ini terutama diakibatkan S. thypi dan S. parathypi. Sejumlah 109 sel S. typhimurium yang diberikan secara oral dapat menyebabkan gejala infeksi toksik. Penular utama Salmonella adalah feses manusia. Masa inkubasi serangan demam ini 10/14 hari. Mengonsumsi makanan dan minuman tercemar Salmonella setelah 8/48 jam dapat menyebabkan gejala dini sakit perut mendadak disertai dengan feses yang encer kadang dengan lendir dam darah, biasanya diikuti mual, muntah, dan demam hingga suhu 38/39oC.
Escherichia coli adalah penghuni saluran pencernaan manusia dan hewan berdarah panas. Biasanya tidak patogenik, tetapi dapat menyebabkan infeksi. Apabila memasuki kandung kemih dapat menyebabkan sititis. E. coli digunakan sebagai indikator pencemaran air dan beberapa galur tertentu menyebabkan gastroenteritis, disentri pada manusia serta dapat menyebabkan diare (Fardiaz 1989; Pelczar & Chan 1988).
Escherichia coli termasuk famili Enterobacteriaceae. Berbentuk batang atau koma, berukuran 1.1/1.5 x 2.0/6.0 µm, tunggal maupun berpasangan, dan dalam rantai pendek serta merupakan bakteri Gram negatif. Bakteri ini tidak berkapsul dan tidak berspora, tumbuh baik pada pH optimum 7.0/ 7.5 serta suhu optimum 37oC. E. coli membentuk koloni berwarna putih hingga kekuningan, dan memiliki permukaan yang bergelombang di atas agar (Fardiaz 1983; Pelczar & Chan 1988). Bakteri ini bersifat nonmotil dan hidup secara anaerob fakultatif (Holt et al. 1994).
Jumlah koloni dan pertumbuhan bakteri dapat ditekan suatu senyawa yang dikenal sebagai zat antibakteri. Berdasarkan toksisitas selektif antibakteri dibedakan menjadi dua, yaitu bakterisidal dan bakteriostatik (Ganiswara et al. 1995). Bakterisidal bersifat mematikan bakteri, sedangkan bakteriostatik bersifat menghambat pertumbuhan bakteri. Beberapa zat antibakteri bersifat bakteriostatik pada konsentrasi rendah dan bersifat bakteriosidal pada konsentrasi tinggi (Wattimena et al. 1991). Mekanisme kerja antibakteri secara umum dibedakan menjadi empat, antara lain antibakteri yang menghambat sintesis dinding sel, menghambat keutuhan permeabilitas dinding sel bakteri, menghambat sintesis protein sel bakteri, dan menghambat sintesis asam nukleat (Jawetz et al. 1996).
Antibakteri yang menghambat sintesis dinding sel bakteri bekerja dengan terikat
pada reseptor sel (beberapa diantaranya adalah enzim transpeptidase), kemudian terjadi reaksi transpeptidase sehingga sintesis peptidoglikan terhambat. Mekanisme diakhiri dengan penghentian aktivitas penghambat enzim autolisis pada dinding sel.
Antibakteri yang menghambat keutuhan permeabilitas dinding sel bakteri bekerja dengan mengganggu membran sitoplasma oleh zat yang bersifat surfaktan sehingga menyebabkan permeabilitas dinding sel berubah dan menjadi rusak. Komponen/ komponen penting yang berada di dalam sel seperti protein, asam nukleat, nukleotida keluar dari sel dan berangsur/angsur sel akan mati.
Antibakteri yang menghambat sintesis protein sel bakteri bekerja berdasarkan kemampuannya mendenaturasi protein yang merupakan komponen esensial bagi kehidupan sel. Senyawa penghambat sintesis protein juga dapat menyebabkan kesalahan dalam pembacaan kode pada mRNA sehingga protein tidak terbentuk, dan sel akan mati.
Antibakteri yang menghambat sintesis asam nukleat berikatan dengan enzim atau komponen yang berperan dalam tahapan sintesis asam nukleat, sehingga reaksi terhenti karena substrat yang direaksikan dan asam nukleat tidak terbentuk.
Berdasarkan efektivitas kerjanya terhadap mikroorganisme, senyawa antibakteri dikelompokkan menjadi dua, yaitu antibakteri berspektrum luas dan antibakteri berspektrum sempit (Schunack et al. 1990). Banyak faktor yang dapat mempengaruhi kerja antibakteri, diantaranya konsentrasi antibakteri, jumlah bakteri, spesies bakteri, temperatur, dan adanya bahan organik (Pelczar & Chan 1988). Salah satu zat antibakteri adalah antibiotik. Antibiotik adalah senyawa kimia khas yang dihasilkan atau diturunkan oleh organisme hidup termasuk struktur analognya yang dibuat secara sintetik, yang dalam kadar rendah mampu menghambat proses penting dalam kehidupan satu spesies atau lebih (Siswandono & Soekardjo 1995).
BAHA DA METODE
Bahan dan Alat
6
klorida, etanol 70%, maltodekstrin, magnesium stearat, KBr, akuades, dan ampisilin.
Alat/alat yang digunakan adalah autoklaf, shaker orbital, rotavapor, pengering vakum, magnetic stirer, laminar air flow cabinet, wrap, cawan petri, jarum ose, penangas air bergoyang, neraca analitik, vortex, kertas saring, spektrofotometer UV, homogenizer Janke and Kunkel IKA®, High Energy Milling (HEM), Scanning Electron Microscopy (SEM), mikropipet, jangka sorong, dan alat/ alat gelas lainnya.
Metode Ektraksi Propolis
Propolis diekstraksi dengan metode Harbone (1987) serta Matienzo dan Lamonera (2004). Ekstraksi dilakukan secara maserasi dengan pelarut etanol 70%. Sebanyak 150 gram propolis yang diperoleh dari sarang lebah madu Trigona spp asal Pandeglang direndam dengan etanol 70%, ditutup lalu disimpan dalam ruangan gelap selama 1 minggu. Setiap hari dilakukan pengocokan. Setelah satu minggu, filtrat diambil dan disaring serta sisanya dilakukan ekstraksi kembali. Selanjutnya filtrat diambil setiap hari selama satu minggu hingga pelarut jernih.
Setelah filtrat ekstrak propolis diperoleh, dilakukan pemekatan dengan menggunakan rotavapor pada suhu 40oC. Ekstrak pekatnya ditimbang sehingga dihasilkan nilai rendemen. Ekstrak ini dilarutkan dalam etanol 70% sebanyak satu kali volumenya yang disebut ekstrak etanol propolis (EEP).
Pembuatan anopropolis 5%
Nanopropolis dibuat menggunakan penggabungan metode modifikasi Bhaskar et al. (2009) dengan Sutriyo et al. (2004). Sebanyak 20 gram ekstrak etanol propolis ditambahkan 120 ml etanol 70%. Bahan penyalut maltodekstrin sebanyak 85 gram dilarutkan dalam akuades 80 ml dan ditambahkan 5 gram Mg/stearat lalu diaduk dengan stirer sampai tercampur rata. Campuran maltodekstrin dihomogenisasi pada kecepatan 22000 rpm selama 30 menit. Propolis yang terlarut dengan etanol 70% dicampurkan dengan campuran penyalut dan dihomogenisasi kembali pada kecepatan 22000 rpm selama 30 menit. Larutan dikeringkan dengan pengering vakum pada suhu 40°C. Serbuk yang terbentuk kemudian dihaluskan dan disamaratakan dengan High Energy Milling (HEM) dengan kecepatan 915 rpm dan frekuensi 28,8 Hz selama 15 menit.
Hasil nanopropolis diidentifikasi menggunakan Scanning Electron Microscopy (SEM). Penggunaan HEM dan SEM dilakukan di Laboratorium BATAN, Puspiptek, Serpong.
Karakterisasi SEM anopropolis
Nanopropolis dikarakterisasi dengan alat JSM/6510LA Analytical Scanning Electron Microscope (Jeol) di BATAN, Puspiptek, Serpong. Sebanyak 0.3 gram serbuk nanopropolis dimasukkan ke dalam plat platinum, kemudian permukaannya dilapisi (coating) dengan emas. Plat platinum yang berisi nanopropolis dimasukkan ke dalam alat SEM S500 coating unit selama 15 menit. Selanjutnya, nanopropolis diamati dengan SEM yang telah terhubung dengan komputer. SEM diatur dalam keadaan vakum dengan tegangan 20 kV. Perbesaran diatur berdasarkan visualisasi terbaiknya.
Profil Spektrum FTIR anopropolis
Serbuk nanopropolis ditimbang sebanyak 1.5 gram dan dicampur dengan 300 gram KBr. Campuran ini kemudian dihaluskan dengan mortar sampai tercampur rata. Selanjutnya bahan yang telah tercampur dimasukkan ke dalam cetakan dan ditutup rapat. Cetakan sampel dimasukkan ke dalam alat pres yang tersambung dengan pompa tekan. Penakanan sampel menggunakan pompa tekan dilakukan selama 15 menit sampai terbentuk pelet. Pelet yang terbentuk selanjutnya dianalisis menggunakan FTIR di Laboratorium Pusat Studi Biofarmaka, Bogor.
Uji Aktivitas Antibakteri
Uji aktivitas antibakteri menggunakan metode difusi sumur agar (Hadioetomo 1990). Kontrol positif yang digunakan yaitu ampisilin tablet 500 mg dengan konsentrasi 10 mg/ml dan kontrol negatifnya digunakan akuades.
Regenerasi Bakteri Uji. Sebelum digunakan, bakteri yang akan dipakai harus diregenerasikan terlebih dahulu. Bakteri yang berasal dari kultur primer mula/mula dibiakkan ke dalam agar miring NA. Sebanyak satu ose bakteri digoreskan ke agar miring NA lalu diinkubasi pada suhu 37oC selama 24 jam. Biakan ini merupakan aktivitas awal stok bakteri yang disimpan pada suhu 4/5oC.
Uji Pendahuluan Aktivitas Antibakteri.
bergoyang dengan suhu 37oC. Setelah itu dari biakan diambil sejumlah bakteri yang disebarkan di dalam cawan petri, lalu dituangkan 20 ml media PYG bersuhu ± 45oC, lalu cawan digoyangkan agar bakteri tersebar merata. Selanjutnya didiamkan pada suhu kamar sampai media agar memadat. Setelah padat, agar dilubangi dengan diameter ± 5 mm. Ke dalam lubang tersebut dimasukkan ekstrak nanopropolis sebanyak 50 µl lalu diinkubasi pada suhu 37oC selama 24 jam. Daerah bening yang terlihat di sekeliling lubang menandakan adanya aktivitas antibakteri pada sampel. Volume bakteri yang diambil berdasarkan nilai absorban yang terukur pada panjang gelombang 600 nm sengan spektrofotometer UV. Jika nilai absorban yang terukur kurang dari 1,000 maka volume bakteri yang diambil sebanyak 100 µl. Jika nilai absorban yang terukur lebih dari 1,000 maka volume yang diambil sebanyak 50 µl (Hadioetomo 1990).
Penentuan Konsentrasi Hambat Tumbuh Minimum
Penentuan KHTM dilakukan setelah diketahui bahwa ekstrak propolis memiliki aktivitas antibakteri. Tahap pertama yaitu pengenceran nanopropolis dengan akuades sehingga didapatkan 10 konsentrasi (0.009% sampai 5% v/v). Setiap konsentrasi sebanyak 50 µl dimasukkan ke dalam lubang media PYG padat yang mengandung bakteri uji, lalu diinkubasi pada suhu 37oC selama 24 jam. Aktivitas antibakteri diperoleh dengan mengukur diamter zona bening di sekitar lubang sampel menggunakan jangka sorong.
Analisis Statistik
Analisis statistik yang digunakan dalam pengolahan data adalah rancangan percobaan dua faktor dalam rancangan acak lengkap. Berikut ini merupakan model rancangannya (Mattjik & Sumertajaya 2002)
Yij = + τi + εij
Yij = Pengamatan pada perlakuan ke/I
dan ulangan ke/j = Pengaruh rataan umum
τ = Pengaruh perlakuan ke/i
ε = Pengaruh acak pada perlakuan ke/i ulangan ke j
Data yang diperoleh dianalisis dengan ANOVA (Analysis of variance) pada tingkat kepercayaan 95% dan taraf α 0.05. Uji lanjut yang digunakan adalah uji Duncan. Seluruh data dianalisis dengan menggunakan program SPSS 16.0.
HASIL DA PEMBAHASA
Rendemen Ekstrak Propolis
Propolis Trigona spp yang dihasilkan berwarna coklat dengan rendemen sebesar 13,33% (Gambar 2). Ekstrak propolis yang didapatkan Fitriannur (2009) sebesar 17,76%, Saputra (2009) sebesar 8,81%, dan Suseno (2009) sebesar 10,62%. Ketiga penelitian yang telah dilakukan sebelumnya menggunakan teknik dan pelarut ekstraksi yang sama, yaitu teknik maserasi dengan pelarut etanol 70%. Perbedaan nilai rendemen yang diperoleh dipengaruhi vegetasi tempat lebah Trigona spp mendapatkan bahan baku propolis, musim, dan lokasi geografi tempat pengambilan propolis (Bankova & Popova 2007). Warna propolis bergantung pada senyawa fenol yang terdapat dalam ekstrak, yaitu senyawa flavonoid. Propolis yang berwarna lebih gelap mengandung flavonoid lebih banyak, sehingga memiliki rendemen yang lebih banyak dibandingkan dengan propolis berwarna lebih muda (Salomao et at. 2004).
Propolis mempunyai sifat keras, dan liat pada suhu 15oC dengan titik didih 60/69oC (Woo 2004). Propolis disimpan pada suhu kurang dari 25oC dan ditempatkan pada tempat gelap agar tidak terkena sinar matahari langsung karena akan merusak senyawa aktif dalam propolis (Krell 2004). Ekstrak lebah madu Trigona spp asal Pandeglang diperoleh menggunakan metode maserasi. Maserasi merupakan teknik ekstraksi yang dilakukan untuk bahan yang tidak tahan panas dengan cara perendaman di dalam pelarut tertentu selama waktu tertentu (Angraini 2006). Pemanasan pada suhu yang sangat tinggi dimungkinkan akan merusak senyawa aktif di dalam propolis.
8
merupakan pelarut terbaik untuk propolis sebagai bahan antibakteri.
Gambar 2 Ektrak pekat propolis.
anopropolis
Nanopropolis yang dihasilkan berbentuk serbuk yang sangat kering, namun masih sangat kasar dan bergerombol. Nanopropolis dihaluskan dan disamaratakan kembali dengan HEM (High Energy Milling). HEM akan menghaluskan dan meratakan suatu partikel dari 3 arah, yaitu vertikal, horisontal, dan rotasi. Nanopropolis dihaluskan menggunakan bola besi (ball mill) yang dimasukkan dalam tabung HEM. Perangakat HEM akan memutar tabung HEM secara vertikal, horisontal, dan berotasi. Serbuk nanopropolis yang dihasilkan berwarna putih agak kecoklatan dan sangat halus (Gambar 3).
Pembentukan nanopropolis diawali dengan pembuatan penyalut propolis menggunakan teknik mikroenkapsulasi. Komponen mikroenkapsulasi terdiri atas bahan inti dan bahan penyalut. Bahan inti adalah bahan yang diperangkap, sedangkan bahan penyalut merupakan bahan yang dapat melindungi bahan inti dalam proses mikroenkapsulasi.
Bahan penyalut yang digunakan adalah maltodekstrin (MDE). Penggunaan MDE dalam industri farmasi masih sangat terbatas atau tidak populer dibandingkan dalam industri makanan yang penggunaannya sudah sangat luas. Maltodekstrin merupakan salah satu produk turunan pati yang dihasilkan dari proses hidrolisis parsial oleh enzim α/amilase dengan nilai dextrose equivalent (DE) kurang dari 20. DE menjelaskan persentase hidrolisis ikatan glikosidik dan penurunan kekuatannya. Maltodekstrin (C6H10O5).nH2O merupakan
polimer dari D/glukosa yang berikatan dengan ikatan α/1,4 glikosidik. Ikatan yang terdapat dalam maltodekstrin ini sangat lemah dan mudah terputus (Moore et al 2005 dalam Sukamdiyah 2009). Alasan pemilihan maltodekstrin sebagai penyalut adalah larut dalam air, tidak berwarna, tidak berbau, dan tidak toksik (Sukamdiyah 2009). Anwar (2004) menyatakan bahwa turunan pati seperti
maltodekstrin bersifat meningkatkan viskositas membentuk matriks hidrogel, dan memiliki daya rekat. Struktur MDE yang lebih pendek dibandingkan pati sehingga saat mikroenkapsulasi menghasilkan mikrokapsul yang kering, berukuran seragam, dan tidak lengket (Suseno 2009). Dalam mikroenkapsulasi, struktur MDE yang berongga akan diisi oleh propolis sebagai inti sehingga senyawa aktif dalam propolis dapat terlindungi oleh MDE.
Magnesium stearat (C36H70MgO4)
umumnya digunakan dalam dunia farmasi sebagai pelicin dengan konsentrasi 0,25/5,0% (Maziyyah 2010). Magnesium stearat memiliki kemampuan mengurangi gesekan antara tablet dengan dinding cetakan saat dikeluarkan dari mesin. Penggunaan magnesium stearat yang berlebih menyebabkan penurunan kekerasan tablet dan memperlambat waktu disintegrasi (Barra & Somma 1996).
Penambahan magnesium stearat 5% dalam penyalutan nanopropolis untuk mengurangi penempelan granul pada wadah pencampur dan vacuum dryer sehingga penyalutan lebih sempurna dan memperbaiki penampilan serbuk nanopropolis. Magnesium stearat mengurangi serbuk nanopropolis teragregasi. Pemilihan penggunaan magnesium stearat dalam nanopropolis dikarenakan magnesium stearat juga tidak berinteraksi dengan senyawa aktif pada nanopropolis. Penggunaan magnesium stearat dalam jumlah yang sedikit agar disintergrasi nanopropolis tidak terlalu lama sehingga disolusi senyawa aktifnya juga tidak terganggu.
Sutriyo et al. (2004) menyatakan kesempurnaan penyalutan dipengaruhi oleh kecepatan dan lama pengadukan. Kecepatan pengadukan yang sangat tinggi menghasilkan tetesan/tetesan partikel yang sangat kecil, begitu pula sebaliknya. Maltodektrin dan magnesium stearat dihomogenisasikan pada kecepatan 22.000 rpm selama 30 menit. Penyalut yang terbentuk kemudian dihomogenisasikan dengan EEP dengan kecepatan dan waktu pengadukan yang sama. Homogenisasi menjadi faktor penting agar komponen aktif dapat tersalut sempurna oleh bahan penyalut. Kecepatan tersebut jauh lebih tinggi dibandingkan dengan penelitian Sutriyo et al. (2004), yaitu 3.000 rpm yang menghasilkan distribusi ukuran partikel antara 425 sampai lebih besar dari 850 mikron.
Pengeringan dilakukan pada suhu 40oC. tujuan pengeringan ini adalah untuk menghilangkan pelarutnya. Penggunaan suhu 40oC untuk melindungi senyawa aktif pada propolis, seperti flavonoid sebagai bahan antimikrob agar tidak rusak karena flavonid tidak tahan panas.
Gambar 3 Serbuk nanopropolis.
Karakterisasi SEM anopropolis
Karakterisasi dengan SEM (Scanning Electron Microscope) untuk mengetahui morfologi dan ukuran nanopropolis. Nanopropolis dikarakterisasi menggunakan alat JSM/6510LA Analytical Scanning Electron Microscope (Jeol) di BATAN, Puspiptek, Serpong.
Hasil observasi nanopropolis dengan SEM terlihat bahwa partikel nanopropolis memiliki bentuk yang tidak seragam dengan tepian yang tidak rata. Partikel nanopropolis terlihat jelas dengan persebaran cukup merata (tidak bergerombol). Observasi yang dilakukan Anwar et al. (2004) terhadap maltodekstrin menunjukkan bentuk partikel yang tidak seragam. Nanopropolis yang dibuat oleh Coneac et al. (2008) dengan bahan penyalut siklodekstrin yang berasal dari turunan pati juga menunjukkan bentuk partikel yang tidak seragam dan tepian yang tidak rata. Menurut Coneac et al. (2008), penggunaan pelarut ekstraksi etanol 96% akan menghasilkan nanopropolis dengan dimensi 100 kali lebih kecil dibandingkan dengan menggunakan etanol 20%.
Pengamatan terhadap nanopropolis dilakukan secara acak dengan perbesaran 3.000 kali. Ukuran terkecil yang masih dapat terukur sebesar 175 nm, 197 nm, dan 307 nm (Gambar 4). Sedangkan ukuran terbesar yang dapat terukur adalah 874 nm. Pada penelitian ini distribusi ukuran partikel tidak dianalisis secara khusus. Mikrokapsul propolis yang dibuat Suseno (2009) dengan teknik penguapan pelarut menghasilkan mikrokapsul propolis dengan ukuran 5/5000 µm.
Sutriyo et al. (2004) menyatakan perbedaan distribusi ukuran partikel
dipengaruhi oleh jumlah bahan penyalut yang digunakan sebagai pembentuk dinding. Ukuran nanopropolis yang dihasilkan pada penelitian ini sesuai dengan pernyataan Mohanraj dan Chen (2006), yaitu bahan organik dalam bentuk nanopartikel memiliki ukuran 10/1000 nm yang dilindungi oleh matriks pembawanya.
Gambar 4 Morfologi SEM nanopropolis. A = 175 nm, B = 197 nm, dan C = 307 nm.
Profil Spektrum FTIR anopropolis
Nanopropolis dilihat profil spektrumnya untuk melihat keberadaan propolis dalam penyalut. Martos et al. (2008) menyatakan bahwa komponen pada propolis yang memiliki aktivitas antibakteri berupa senyawa fenolik dalam bentuk flavonoid (pinocembrin, naringin, dan hesperidin).
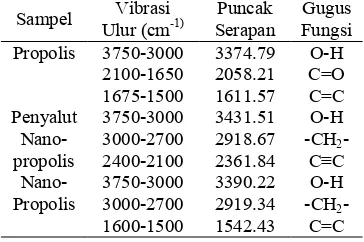
Hasil analisis profil FTIR menunjukkan bahwa propolis memiliki puncak serapan yang khas pada frekuensi 1611.57 cm/1, 2058.21 cm/1, dan 3374.79 cm/1 (Gambar 5). Penyalut nanopropolis memiliki puncak serapan yang khas pada frekuensi 2361.84 cm/1, 2918.67 cm/1 dan 3431.51 cm/1 (Gambar 5). Nanopropolis memiliki gugus C=C (alifatik) dengan puncak serapan 1542.43 cm/1, gugus – CH2/ dengan puncak serapan 2919.34 cm
/1
, dan gugus O/H dengan puncak serapan 3397.80 cm/1 (Gambar 5). Gugus C=C diduga berasal dari propolis karena banyak senyawa yang terkandung dalam propolis berupa senyawa fenolik. Gugus –CH2/ diduga dari
maltodekstrin sebagai penyusun penyalut (carrier) yang merupakan turunan dari pati karena gugus fungsi utamanya terdiri atas gugus karbonil dan hidroksil. Gugus O/H diduga berasal dari maltodekstrin dan propolis. Propolis memiliki banyak senyawa dalam bentuk fenolik sedangkan maltodekstrin memiliki gugus hidroksialdehid dalam strukturnya. Profil spektrum nanopropolis tersebut menunjukkan bahwa propolis telah tersalut pada penyalutnya (carrier) dengan ditunjukkan adanya puncak serapan yang khas dari penyusun/ penyusunnya.
C
Gambar 5 Profil spektrum FTIR propolis ( ), penyalut nanopropolis ( ), dan nanopropolis ( ).
Tabel 1 Gugus fungsi penyusun nanopropolis Sampel Vibrasi
Ulur (cm/1)
Puncak Serapan
Gugus Fungsi Propolis 3750/3000 3374.79 O/H
2100/1650 2058.21 C=O 1675/1500 1611.57 C=C Penyalut
Nano/ propolis
3750/3000 3431.51 O/H 3000/2700 2918.67 /CH2/
2400/2100 2361.84 C≡C Nano/
Propolis
3750/3000 3390.22 O/H 3000/2700 2919.34 /CH2/
1600/1500 1542.43 C=C
Hasil Uji Antibakteri
Aktivitas antibakteri nanopropolis diuji dengan metode difusi sumur agar karena metode ini umum dan mudah digunakan untuk beberapa bakteri uji. Adanya zona bening di sekitar sumur menunjukkan nanopropolis memiliki potensi sebagai antibakteri. Pelczar dan Chan (1988) menyatakan bahwa suatu senyawa memiliki kemampuan sebagai bahan antibakteri dipengaruhi konsentrasi antibakteri, jumlah bakteri, dan jenis bakteri yang digunakan. Semakin besar konsentrasi antibakteri yang digunakan, maka daya hambatnya juga akan semakin besar.
Kontrol positif yang digunakan untuk evaluasi aktivitas antibakteri adalah ampisilin. Penggunaan ampisilin sebagai kontrol positif karena sebagai antiobiotik yang berspektrum luas, artinya dapat menghambat bakteri bakteri Gram positif dan Gram negatif (Siswandono & Soekarjo 1995). Konsentrasi ampisilin yang digunakan sebesar 10 mg/ml.
Nanopropolis mampu membentuk zona bening sebesar 12.64 mm, 15.55 mm, 13.43 mm, dan 12.09 mm untuk B. subtilis, E. coli, S. aureus, dan Salmonella sp. Sedangkan ekstrak propolis hanya mampu membentuk
zona bening sebesar 6.14 mm, 6.34 mm, 6.85 mm, dan 5.25 mm masing/masing terhadap B. subtilis, S. aureus, E. coli, dan Salmonella sp (Gambar 6). Ampisilin 10 mg/ml membentuk zona bening dengan diameter sebesar 28.81 mm, 27.34 mm, 36.72 mm, dan 32.17 masing/ masing terhadap B. subtilis, S. aureus, E. coli, dan Salmonella sp (Gambar 6). Dilihat dari diameter zona bening yang dihasilkan, nanopropolis memiliki daya penghambatan terhadap bakteri yang lebih baik dibandingkan dengan ekstrak propolis, namun lebih rendah dari amipisilin 10 mg/ml.
Nanopropolis mempunyai tingkat efektivitas yang lebih tinggi jika dibandingkan dengan ekstrak propolis sebesar 205.86%, 211.83%, 227.01%, dan 230.29% masing/ masing terhadap B. subtilis, S. aureus, E. coli, dan Salmonella sp (Lampiran 3). Efektivitas nanopropolis terhadap ampisilin 10 mg/ml berturut/turut untuk B. subtilis, S. aureus, E. coli, dan Salmonella sp adalah 43.87%, 49.12%, 42.35%, dan 37.58% (Lampiran 3). Hasil analisis statistik menunjukkan bahwa diameter zona hambat dari nanopropolis berbeda nyata terhadap ekstrak propolis maupun ampisilin untuk semua bakteri uji.
girase yang berperan dalam proses replikasi DNA prokariot. Pertumbuhan prokariot juga akan terhambat karena laju pertumbuhan prokariot sejalan dengan replikasi DNA (Cushnie & Lamb 2005).
Martos et al. (2008) menyatakan bahwa propolis berperan dalam mekanisme penghambatan kerja enzim polimerase DNA bakteri untuk melekat pada DNA sehingga replikasi DNA bakteri tidak terjadi. Selain itu, komponen tersebut juga mampu menghambat kerja enzim endonuklease restriksi sehingga transkripsi tidak terjadi pada DNA yang berakibat pembelahan sel terganggu.
Mohanraj dan Chen (2006) menyatakan bahwa nanopartikel memiliki ukuran yang sangat kecil sehingga luas permukaannya semakin besar. Kim et al. (2008) juga menyatakan bahwa nanopropolis lebih efektif dibandingkan propolis biasa karena bentuk nanopropolis lebih larut dan memiliki permeabilitas yang lebih tinggi dibandingkan propolis biasa. Oleh karena itu, proses pelepasan senyawa aktif dari bahan pelindungnya semakin cepat.
Ampisilin merupakan antibiotik β/laktam dan termasuk ke dalam golongan penisilin semisintetik. Aktivitas ampisilin menggangu proses transpeptidasi. Ampisilin menyerang nukleofil dari gugus hidroksil serin enzim transpeptidase pada karbonil karbon cincin β/ laktam yang bermuatan positif sehingga biosintesis peptidoglikan menjadi terganggu akibatnya dinding sel menjadi lemah. Dinding sel yang lemah tidak akan mampu menahan tekanan turgor dari dalam sehingga sel akan pecah dan berujung pada kematian bakteri (Siswandono & Soekarjo 1995). Mekanisme kerja ampisilin menyebabkan ampisilin memiliki daya antibakteri yang besar dan bersifat bakteriosidal.
Gambar 6 Diameter zona bening hasil uji antibakteri. Nanopropolis ( ), ekstrak propolis ( ), dan ampisilin ( ).
Konsentrasi Hambat Tumbuh Minimum (KHTM)
Penentuan konsentrasi hambat tumbuh minimun dilakukan untuk mengetahui konsentrasi terendah dari nanopropolis yang dapat menghambat pertumbuhan bakteri uji. Variasi konsentrasi nanopropolis yang digunakan adalah 0.009% sampai 5%. Pemilihan konsentrasi tersebut diharapkan memberikan nilai KHTM lebih rendah dari penelitian Angraini (2006) yang hanya menggunakan ekstrak propolis dengan konsentrasi 0.2% sampai 100%. Hasil penelitian memperlihatkan bahwa KHTM nanopropolis terhadap bakteri Gram positif sebesar 0.15% dan 0.075% untuk B. subtilis dan S. aureus. Sedangkan KHTM nanopropolis untuk bakteri Gram negatif sebesar 0.15% dan 0.313% untuk E. coli dan Salmonella sp (Gambar 7). Hasil tersebut juga sejalan dengan pernyataan Silici dan Kaftanoglu (2003) yang menyatakan bahwa senyawa aktif pada propolis memberikan KHTM yang lebih rendah untuk bakteri Gram positif dibandingkan bakteri Gram negatif.
Resistensi bakteri Gram positif dan Gram negatif dipengaruhi penyusun dan struktur dinding selnya. Bakteri Gram negatif memiliki struktur yang lebih kompleks sehingga lebih resisten terhadap senyawa antibakteri. Membran luar bakteri Gram positif memiliki kandungan peptidoglikan yang tebal serta tidak mempunyai lapisan polisakarida. Oleh karena itu, bakteri Gram positif lebih kuat menahan tekanan osmotik dari dalam (Greenwood et al. 1995). Membran luar bakteri Gram negatif kaya akan lipid dan membentuk lipopolisakarida (LPS). Lapisan LPS bersifat semipermeabel dan hanya dapat dilewati molekul/molekul kecil seperti nukleosida, oligosakarida, dan asam amino.
Gambar 7 Konsentrasi hambat tumbuh minimum B. subtilis ( ), S. aureus ( ), E. coli ( ), Salmonella sp ( ).
12
KHTM Bakteri Gram Positif
Konsentrasi nanopropolis terendah yang masih dapat menghambat pertumbuhan B. subtilis adalah 0.15% sedangkan S. aureus masih dapat dihambat pada konsentrasi yang lebih rendah sebesar 0.075% dengan diameter zona bening 5.24 mm dan 5.93 mm.
Penelitian Angraini (2006) menggunakan ekstrak propolis lebah Trigona spp asal Pandeglang dapat menghambat pertumbuhan B. subtilis dan S. aureus pada konsentrasi 0.78% dan 0.39% dengan diameter zona bening 6.450 mm dan 6.142 mm.
Angraini (2006) menduga senyawa aktif dari propolis menghambat pertumbuhan S. aureus dengan cara menempel pada asam teikoat penyusun membran sitoplasma karena asam teikoat bermuatan negatif. Permukaan membran sitoplasma dapat menarik senyawa aktibakteri yang bersifat polar seperti tanin dan flavonoid (Lay & Hastowo 1992).
Penyusun utama dinding sel S. aureus adalah peptidoglikan, ribotol, asam teikoat, dan protein A. Protein A berperan sebagai antifagosit yang akan mencegah antibakteri masuk ke dalam sel (Lay & Hastowo 1992).
KHTM Bakteri Gram egatif
Nanopropolis memiliki KHTM 0.15% terhadap Escherichia coli dengan diameter zona bening 7.25 mm. KHTM nanopropolis terhadap Salmonella sp sebesar 0.313% dengan diameter zona bening 2.66 mm. KHTM Escherichia coli yang diperoleh Angraini (2006) menggunakan ekstrak propolis Trigona spp asal Pandeglang sebesar 0.7812% dengan diameter zona bening 6.042 mm. KHTM ekstrak propolis Trigona spp asal Pandeglang terhadap Salmonella sp sebesar 1.04% dengan diameter zona bening 1.62 mm (Tukan 2008). Khismatullina (2005) dalam Angraini (2006) menyatakan bahwa penambahan ekstrak propolis dapat menambah efek antibiotik E. coli. Propolis bersifat bakteriostatik secara in vitro pada kultur Eschericia coli (Woo 2005).
Tukan (2008) menduga bahwa propolis berperan seperti polimiksin atau streptomiksin. Polimiksin mampu menghancurkan dinding bakteri Gram negatif pada khususnya. Polimiksin berinteraksi kuat dengan fosfolipid membran sel, mengakibatkan kehilangan kontrol osmotik, sehingga terjadi kebocoran ion K+ dan komponen vital bakteri lainnya. Penetrasinya ke dalam menjadi mudah dan merusak struktur membran sel. Kerja antibiotik jenis ini adalah merusak membran sel setelah
bereaksi dengan fosfat pada fosfolipid membran sel (Simanjuntak2005 dalam Tukan 2008).
SIMPULA DA SARA
Simpulan
Rendemen ekstrak propolis yang didapatkan sebesar 13.33%. Hasil SEM menunjukkan ukuran partikel sebesar 175 nm sampai 873 nm. Hasil analisis FTIR menunjukkan bahwa nanopropolis memiliki gugus C=C, /CH2/, dan O/H. Nanopropolis
memberikan efek antibakteri terhadap 4 bakteri uji (Bacilus subtilis, Staphylococcus aureus, Escherichia coli, dan Salmonella sp) dan lebih efektif dibandingkan dengan ekstrak propolis. KHTM B. subtilis dan E. coli adalah 0.15%, S. aureus sebesar 0.075%, dan Salmonella sp sebesar 0.313%.
Saran
Perlu dilakukan optimasi terhadap kecepatan dan waktu homogenisasi untuk menghasilkan nanopropolis yang berukuran kecil dan seragam. Analisis nanopropolis menggunakan PSA (Particle Size Analyzer) perlu dilakukan untuk mengetahui distribusi ukuran nanopropolis. Selain itu, perlu dilakukan penelitian lanjutan untuk mengetahui mekanisme kerja antibakteri nanopropolis.
DAFTAR PUSTAKA
Aitken RJ, Creely KS, Tran CL. 2004. )anoparticle: An occupational hygiene review. Norwegia: St Clements House. Angraini AD. 2006. Potensi propolis lebah
madu Trigona spp sebagai bahan antibakteri [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Anwar E, Joshita D, Yanuar A, Bahtiar A. 2004. Pemanfaatan maltodekstrin pati terigu sebagai eksipien dalam formula sediaan tablet dan niosom. Majalah Ilmu Kefarmasian 5: 34/46.
Bagjavicenna E. 2008. Potensi propolis lebah Trigona spp sebagai bahan antimikrob ketombe [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Barra J, Somma R. 1996. Influence of the physicochemical variability of magnesium stearate on its lubricant properties: possible solutions. Drug Development and Industrial Pharmacy 22: 1105/1120. Bhaskar K et al. Lipid nanoparticles for
transdermal delivery of flurbiprofen: formulation, in vitro, ex vivo and in vivo studies. Lipids in Health and Disease 2009;8(6) . [terhubung berkala]. http://www.lipid world.com/content/8/1/6. html [diakses 1 Februari 2010].
Burdock GA. 1998. Review of the biological properties and toxicity of bee propolis (propolis). Food and Chemical Toxicology 36: 347/363.
Chintalapally V, Rao, Valhalla NY. 1993. Propolis. Medical Journali 53: 1482/1488. Coneac et al. 2008. Propolis extract/β/
cyclodextrin nanoparticles: synthesis, physico/chemical, and multivariate analyses. Journal of Agroalimentary Processes and Technologies 14:58/70. Cunha IBS et al. 2004. Factors that enfluence
the yield and composition of Brazilian propolis extract. J. Braz. Chem. Soc. 15(6). [terhubung berkala]. mailto: ildenize@saofrancisco.edu.br [diakses 2 Oktober 2010].
Dharmayanti NLP, Sulistyowati E, Tejolaksono MN, Prasetyo R. 2000. Efektivitas pemberian propolis lebah dan royal jelly pada abses yang disebabkan Sthaphylococcus aureus. Berita Biologi 5: 41/48.
Dressman JB, Amidon GL, Reppas C, Shah VP. 1998. Dissolution testing as a prognostic tool for oral drug absorption: immediate release dosage forms. Pharmaceutical Research 15: 11/22. Fahri VR. 2009. Potensi nanopropolis Trigona
spp asal Bukittinggi sebagai pemacu pertumbuhan pada tikus putih (Sprague% Dawley) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Fardiaz S. 1983. Mikrobiologi Keamanan Pangan. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Fatoni A. 2008. Pengaruh propolis Trigona
spp. asal Bukittinggi terhadap beberapa bakteri usus halus sapi dan penelusuran
komponen aktifnya [tesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor. Fearnley J. 2005. Bee propolis: )atural
Healing from the Hive. London: Souvenir Pr.
Fitriannur. 2009. Aktivitas antibakteri propolis lebah Trigona spp asal Pandeglang terhadap Enterobacter sakazakii [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Free JB. 1982. Bees and Mankind. London: George Allen & Unkwin.
Gan S et al. 1980. Farmokologi dan Terapi. Ed ke/2. Jakarta: Farmakologi FKUI, Universitas Indonesia.
Ganiswara SG et al. 1995. Farmakologi dan Terapi. Jakarta: UI Pr.
Gojmerac WL. 1983. Bee, Beekeeping, Honey, and Pollination. Westport: Avi. Greenwood D, Slack RCB, Peutherer JF.
1995. Medical Microbiology. Hongkong: Longman.
Hadinegoro SR. 1999. Masalah multi drug resistance pada demam tifoid anak. Cermin Dunia Kedokteran 124:5/10. Hadioetomo. 1990. Mikrobiologi Dasar
dalam Praktik. Jakarta: Gramedia. Hadisaputro S. 1990. Beberapa Faktor yang
Memberi Pengaruh terhadap Kejadian Perdarahan dan atau Perforasi Usus pada Demam Tifoid. Jakarta: Direktorat Pembinaan Penelitian pada Masyarakat, Departemen Pendidikan danKebudayaan. Harborne HB.1987. Metode Fitokimia 1. Ed ke/2, Padwaminat K, penerjemah: Bandung: ITB Pr. Terjemahan dari Phytochemicl Methode.
Holt JG et al. 1994. Bergey’s Manual of Determinative Bacteriology. Baltimore: Williams & Wilkins.
Horter D, Dressman JB. 2001. Influence of physicochemical properties on dissolution of drug in the gastrointestinal tract. Advanced Drug Development and Indutrial Pharmacy 46: 75/87.
14
Jawetz E, Melnick JL, Adelberg EA. 1996. Mikrobiologi Kedokteran. Ed ke/20. Nugroho E, Maulany RF, penerjemah; Jakarta: Kedokteran EGC. Terjemahan dari: Review of Medical Microbiology. Kim et al. 2008. Preparation of propolis
nanofood and application to human cancer. Biol. Pharm. Bull 331:1704/1710.
Krell L. 2004. Value/added product from beekeeping. http://www.fao.org/. pdf [diakses 4 Agustus 2010].
Lasmayanty M. 2007. Potensi antibakteri propolis lebah madu Trigona spp. terhadap bakteri kariogenik (Streptococcus mutans) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lay W, Hastowo S. 1992. Mikrobiologi. Jakarta: Rajawali.
Martos MV et al. 2008. Functional properties of honey, propolis, and royal jelly. Journal of Food Science 73: 117/124.
Matienzo AC, Lamorena M. 2004. Extraction and initial characterization of propolis fron stingless bees (Trigona Biroi Friese). Di Dalam Proceeding of 7thAsian Apicultural Associato Conference and 10th BEE)ET Symposium and Technofora; Los Banos, Februari 2004. Los Banos: Univ Phillipines. hlm: 321/329.
Mattjik AA, Sumettajaya M. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid 1. Bogor: IPB Pr. Maziyyah NN. 2010. Optimasi formula tablet
dispersible Captopril dengan kombinasi bahan penghancur Explotab® dan bahan pengisi Avicel PH 102 [skripsi]. Surakarta: Universitas Muhammadiyah Surakarta. Mohanraj VJ, Chen Y. 2006. Nanoparticles/A
review. Tropical Journal of Pharmaceutical Research 5: 561/573. Nelli. 2004. Waktu pencarian serbuk sari
lebah pekerja Trigona (Apidae: Hymenoptera) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Noer S et al. 1996. Buku Ajar Ilmu Penyakit Dalam. Jakarta: Balai Penerbit FKUI. Pelczar MJ, Chan ECS. 1988. Dasar%Dasar
Mikrobiologi. Volume ke/1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL,
penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Sabir A. 2005. Respons inflamasi pada pulpa gigi tikus setelah aplikasi ekstrak etanol propolis (EEP). Majalah Kedokteran Gigi 38: 77/83.
Saputra I. 2009. Aktivitas antibakteri mikrokapsulasi propolis Trigona spp Pandeglang setelah terpapar cairan rumen sapi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Schunack W, Mayer K, Haake M. 1990. Senyawa Obat. Ed ke/2. Wattimena JR, Subino, penerjemah; Yogyakarta: UGM Pr.
Sforcin JM. 2007. Propolis and the immune system; a review. Journal of Ethnopharmacology 113: 1/14.
Sihombing DTH. 1997. Ilmu Ternak Lebah Madu. Yogyakarta: Gajah Mada Univ Pr. Silici S, Kaftanoglu O. 2003. Antimicrobial
analysis of propolis samples from different regions in Turkey. Uludag Bee Journal 5: 16/18.
Singh S. 1962. Beekeeping in India. New Delhi: Indian Council Agricultural Research.
Siswandono, Soekardjo B. 1995. Kimia Medisinal. Surabaya: Airlangga Univ Pr. Sukamdiyah M. 2009. Pembuatan niosom
berbasis maltodekstrin DE 5/10 dari pati beras (Amylum oryzae) [skripsi]. Yogyakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Islam Indonesia.
Sumoprastowo RM, Agus S. 1980. Beternak Lebah Madu Modern. Jakarta: Bharatara Karya Aksara.
Suseno D. 2009. Aktivitas antibakteri propolis Trigona spp pada dua konsentrasi berbeda terhadap cairan rumen sapi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Tukan G. 2008. Pengaruh propolis Trigona spp. asal Pandeglang terhadap beberapa isolat bakteri usus sapi dan penelurusan komponen aktifnya [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. Wattimena L et al. 1991. Farmakodinami dan
Terapi Antibiotik. Yogyakarta: UGM. Winingsih. 2004. Kediaman lebah sebagai
antibiotik dan antikanker. [terhubung berkala].
http://www.pikiranrakyat.com/cetak/0904/ 16/cakrawala.html [1 Februari 2010]. Wiraatmadja H. 1984. Nanoparticle drug
delivery system. Cermin Dunia Kedokteran 32: 5/8.
Woo KS. 2004. Use of bee venom and propolis for apitherapi in Korea. Di Dalam Proceeding of 7th Asian Apicultural Associato Conference and 10th BEE)ET Symposium and Technofora; Los Banos, Februari 2004. Los Banos: Univ Phillipines. hlm: 311/315.
Lampiran 1 Alur penelitian
Sarang Trigona spp
Ekstraksi Propolis
Nanopropolis
Analisis SEM
Analisis FTIR
Uji Pendahuluan
18
Lampiran 2 Nilai rendemen ekstrak propolis
Bobot propolis
= 150 gram
Bobot ekstrak pekat propolis = 20 gram
Rendemen
= bobot ekstrak pekat propolis x 100%
Lampiran 3 Efektivitas antibakteri nanopropolis
Bakteri uji
Diameter Zona Bening (mm)
Efektivitas
Nanopropolis
terhadap
Ekstrak
Propolis (%)
Efekktivitas
Nanopropolis
terhadap
Ampisilin
10 mg/ml
Nanopropolis EEP
Ampisilin
10 mg/ml
B. subtilis
12.64
6.14
28.81
205.8632
43.87365
S. aureus
13.43
6.34
27.34
211.8297
49.12217
E. coli
15.55
6.85
36.72
227.0073
42.34749
Salmonella sp
12.09
5.25
32.17
230.2857
37.5816
Contoh perhitungan
Efektivitas nanopropolis terhadap ekstrak propolis
= Diameter Zona Bening Nanopropolis x 100%
Diameter Zona Bening Ekstrak Propolis
= 12.64 x 100%
6.14
= 205.86%
Efektivitas nanopropolis terhadap ampisilin 10 mg/ml
= Diameter Zona Bening Nanopropolis x 100%
Diameter Zona Bening Ampisilin 10 mg/ml
= 12.64 x 100%
28.81
20
Lampiran 4 Diameter zona bening nanopropolis terhadap B. subtilis
Sampel
Diameter Zona Bening (mm)
Ulangan 1
Ulangan 2
Ulangan 3
Rata/Rata
Nanopropolis 5%
12.72
13.3
11.92
12.64
Nanopropolis 2.5%
12.05
10.78
10.12
10.98
Nanopropolis 1.25%
10.75
10.08
9.42
10.08
Nanopropolis 0.625% 7.72
9.85
8.58
8.72
Nanopropolis 0.313% 6.22
6.85
6.72
6.60
Nanopropolis 0.15%
4.02
5.38
6.32
5.24
Nanopropolis 0.075% 0
0
0
0
Nanopropolis 0.037% 0
0
0
0
Nanopropolis 0.018% 0
0
0
0
Nanopropolis 0.009% 0
0
0
0
Akuades
0
0
0
0
Ekstrak Propolis 5%
5.02
5.68
7.72
6.14
Lampiran 5 Diameter zona bening nanopropolis terhadap S. aureus
Sampel
Diameter Zona Bening (mm)
Ulangan 1
Ulangan 2
Ulangan 3
Rata/Rata
Nanopropolis 5%
12.92
13.8
13.58
13.43
Nanopropolis 2.5%
12.15
12.68
12.82
12.55
Nanopropolis 1.25%
10.78
12.05
12.02
11.62
Nanopropolis 0.625%
9.42
10.18
11.1
10.23
Nanopropolis 0.313%
7.28
9.52
10.22
9.01
Nanopropolis 0.15%
5.85
7.05
8.25
7.05
Nanopropolis 0.075%
5.35
5.82
6.62
5.93
Nanopropolis 0.037%
0
0
0
0
Nanopropolis 0.018%
0
0
0
0
Nanopropolis 0.009%
0
0
0
0
Akuades
0
0
0
0
Ekstrak Propolis 5%
6.35
6.68
5.98
6.34
22
Lampiran 6 Diameter zona bening nanopropolis terhadap E. coli
Sampel
Diameter Zona Bening (mm)
Ulangan 1
Ulangan 2
Ulangan 3
Rata/Rata
Nanopropolis 5%
14.85
14.18
17.62
15.55
Nanopropolis 2.5%
13.95
12.72
15.68
14.12
Nanopropolis 1.25%
12.47
12.15
14.85
13.16
Nanopropolis 0.625%
9.75
12.21
14.38
12.11
Nanopropolis 0.313%
6.92
9.03
13
9.65
Nanopropolis 0.15%
6.12
8.42
7.22
7.25
Nanopropolis 0.075%
0
0
0
0
Nanopropolis 0.037%
0
0
0
0
Nanopropolis 0.018%
0
0
0
0
Nanopropolis 0.009%
0
0
0
0
Akuades
0
0
0
0
Ekstrak Propolis 5%
8.62
4.78
7.15
6.85
Lampiran 7 Diameter zona bening nanopropolis terhadap Salmonella sp
Sampel
Diameter Zona Bening (mm)
Ulangan 1
Ulangan 2
Ulangan 3
Rata/Rata
Nanopropolis 5%
12.95
12.38
10.95
12.09
Nanopropolis 2.5%
10.72
10.28
9.52
10.17
Nanopropolis 1.25%
8.25
8.45
8.48
8.39
Nanopropolis 0.625%
6.25
6.75
8.18
7.06
Nanopropolis 0.313%
3.05
2.58
2.35
2.66
Nanopropolis 0.15%
0
0
0
0
Nanopropolis 0.075%
0
0
0
0
Nanopropolis 0.037%
0
0
0
0
Nanopropolis 0.018%
0
0
0
0
Nanopropolis 0.009%
0
0
0
0
Akuades
0
0
0
0
Ekstrak Propolis 5%
2.55
5.58
7.61
5.25
24
Lampiran 8 Analisis statistik diameter zona bening B. subtilis
ANOVA
Sum of
Square
df
Mean
Square
F
Sig.
Between
Groups
2353.911
12
196.159
364.944
.000
Within
Groups
13.975
26
.538
Total
2367.886
38
Uji Duncan
Konsentrasi N
Subset for alpha = 0.05
1 2 3 4 5 6 7
Nanopropolis 0.075% 3 .0000
Nanopropolis 0.037% 3 .0000
Nanopropolis 0.018% 3 .0000
Nanopropolis 0.009% 3 .0000
Akuades 3 .0000
Nanopropolis 0.15% 3 5.2400
Ekstrak Propolis 5% 3 6.1400 6.1400
Nanopropolis 0.313% 3 6.5967
Nanopropolis 0.625% 3 8.7167
Nanopropolis 1.25% 3 10.0833
Nanopropolis 2.5% 3 10.9833
Nanopropolis 5% 3 12.6467
Ampisilin 10 mg/ml 3 28.8100
Sig. 1.000 .145 .452 1.000 .145 1.000 1.000
Lampiran 9 Analisis statistik diameter zona bening S. aureus
ANOVA
Sum of
Square
df
Mean
Square
F
Si