PENGARUH LAMA HIDROLISIS H2SO4 DAN KONSENTRASI MOLASE TERHADAP FERMENTASI TEPUNG ONGGOK UNTUK
MENGHASILKAN BIOETANOL
SKRIPSI
Oleh :
Septaristya Umeksi 20110210053
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA YOGYAKARTA
ii BIOETANOL
SKRIPSI
Diajukan Kepada Fakultas Pertanian Universitas Muhammadiyah Yogyakarta Untuk Memenuhi Sebagian Dari Persyaratan Guna Memperoleh Derajat Sarjana Pertanian
Oleh :
Septaristya Umeksi 20110210053
FAKULTAS PERTANIAN
UNIVERSITAS MUHAMMADIYAH YOGYAKARTA YOGYAKARTA
xiv ABSTRACT
The research aimed to study H2SO4 during hydrolysis and the role of molasses in the yield of fermentation. Experiment was designed in CRD (Completely Randomized Design)with six treatments : (1) 3 hours of H2SO4 hydrolisis adding with 10% of molasses, (2) 4 hours of H2SO4 hydrolisis adding with 10% of mollases, (3) 5 hours of H2SO4 hydrolisis adding with 10% of mollases, (4) 3 hours H2SO4 hydrolisis adding with 15% of mollases, (5) 4 hours of H2SO4 hydrolisis adding with 15% of mollases, and (6) 5 hours H2SO4 hydrolisis adding with 15% of mollases.
Result showed that the longer of H2SO4 hydrolisis and the higher of mollases concentration produced higher percentage of sugar. Hydrolysis in 5 hours and mollases concentration of 15% gave the best result on sugar production.
However the highest concentration of ethanol was obtained in 3 hours hydrolysis with mollasees concentration of 15%.
xiii dihasilkan dari fermentasi tepung onggok.
Penelitian ini disusun dalam dua tahap yaitu tahap Hidrolisis H2SO4 dengan lama 3 jam, 4 jam, 5 jam, dan tahap penambahan Molase dengan konsentrasi 10% dan 15% pada proses fermentasi Tepung Onggok setelah tahap Hidrolisis. Penelitian dilaksanakan menggunakan Rancangan Acak Lengkap (RAL) dengan rancangan percobaan Faktor Tunggal, sehingga pada perlakuan ini terdapat enam perlakuan, yaitu Lama Hidrolisis 3 jam dengan Molase 10%, Lama Hidrolisis 3 jam dengan Molase 15%, Lama Hidrolisis 4 jam dengan Molase 10%, Lama Hidrolisis 4 jam dengan Molase 15%, Lama Hidrolisis 5 jam dengan Molase 10%, dan Lama Hidrolisis 5 jam dengan Molase 15%.
Hasil penelitian menunjukkan bahwa semakin lama waktu hidrolisis maka kadar gula yang dihasilkan semakin tinggi, yaitu perlakuan lama waktu hidrolisis terbaik adalah 5 jam. Semakin tinggi konsentrasi molase yang diberikan maka kadar gula juga semakin tinggi, yaitu dengan perlakuan terbaik adalah konsentrasi molase 15%. Perlakuan terbaik dengan kadar etanol tertinggi pada fermentasi 7 hari adalah perlakuan Hidrolisis 3 jam dengan Penambahan Molase 15%.
1
alternatif penanganan limbah secara efektif karena dapat mengurangi pencemaran lingkungan serta meningkatkan nilai guna dan nilai ekonomis onggok. Disamping itu, pengolahan onggok menjadi bioetanol yang diusahakan pada bidang bisnis dapat meningkatkan taraf hidup masyarakat yang didukung kondisi bahan baku pembuatan bioetanol saat ini masih sangat terbatas, sementara jumlah permintaannya terus meningkat dan harganya menjanjikan.
Sejauh ini, seiring dengan banyaknya pabrik tapioka berproduksi mengakibatkan banyaknya limbah onggok yang dihasilkan yang dinilai belum termanfaatkan secara bijak. Asfarinah dkk. (2010) sejauh ini onggok hanya dibuang dan digunakan sebagai pupuk sehingga menumpuk dan menimbulkan bau tidak sedap. Harga jual onggok juga sangat rendah yaitu Rp 500,00 per kilogramnya yang digunakan sebagai pakan ternak dengan kadar proteinnya yang rendah sehingga membutuhkan tambahan sumber protein lain. BPPT dalam ITS (2015) menyebutkan kandungan protein dalam onggok adalah 1,57%.
tersebut juga diikuti oleh permintaan singkong yang meningkat, terutama oleh 150 pabrik tapioka dengan harga yang lebih tinggi. Rata-rata setiap pabrik tapioka membutuhkan 200-1000 ton ubi kayu untuk produksinya. Setiap 1 kuintal ubi kayu menurut Nur dkk. (2016) menghasilkan onggok sebanyak 20 kg. Maka, untuk 150 pabrik tapioka pada tahun 2015 tersebut sendiri menghasilkan onggok 400.000-2.000.000 kg yang dinilai belum dimanfaatkan secara bijak.
Banyaknya onggok yang terbuang tersebut dapat digunakan sebagai bahan baku produksi bioetanol. Menurut ITS (2015) onggok masih mengandung pati cukup tinggi yaitu sekitar 63%. Widayatnim (2015) pati merupakan salah satu turunan karbohidrat dan bahan baku utama pembuatan etanol disamping molases dan tepung kayu. Masih tingginya kandungan pati tersebut, maka onggok dinilai dapat dimanfaatkan sebagai usaha substitusi bahan baku bioetanol.
Bioetanol yang dibutuhkan dengan permintaan tertinggi adalah bioetanol kadar 96%, yaitu bioetanol yang sering digunakan sebagai bahan campuran (aditif) 10% dari bensin, yang biasa disebut dengan Gasohol E-10, meskipun terdapat manfaat lain dari penggunaan bioetanol dengan kadar yang berbeda, misalnya kebutuhan medis dan farmasi, serta sebagai substitusi kebutuhoan minyak tanah. Gasohol E-10 memiliki angka oktan 92 yang hampir sama dengan Pertamax (92-95), bersifat ramah lingkungan dengan hasil pembakarannya berupa H2O dan CO2.
bahwa salah satu upaya untuk mengurangi konsumsi masyarakat terhadap BBM adalah dengan memanfaatkan energi alternatif terbarukan, seperti yang tertuang dalam Peraturan Presiden (Perpres) Republik Indonesia Nomor 5. Tahun 2006 tentang Kebijakan Energi Nasional, adalah melalui pengembangan energi terbarukan berbasis nabati atau yang sering disebut Bahan Bakar Nabati (BBN). Menurut Azizah dkk. (2010) juga menyebutkan bahwa tidak hanya mengeluarkan Perpres no.5 tahun 2006, tetapi pemerintah juga menargetkan pada tahun 2016 pemanfaatan BBN mencapai 5%.
glukosa tertinggi sebesar 30,74 g/L dari perlakuan 0,2M yang digunakan untuk hidrolisis. Berdasarkan hasil penelitian tersebut, maka pada kesempatan ini penulis akan meneliti pengaruh lama hidrolisis H2SO4 2M 3 jam, 4 jam, 5 jam, dengan konsentrasi H2SO4 3% dari volume media dan dengan diberi perlakuan tambahan molase 10% dan 15%. Perlakuan lama waktu hidrolisis asam sulfat yang diberikan bertujuan untuk mendapatkan kadar gula yang semakin tinggi dengan lama hidrolisis yang semakin lama. Begitu juga pada kombinasi perlakuan penambahan molase konsentrasi 10% dan 15%. Harapannya dapat meninggikan kadar gula sehingga mempengaruhi kadar etanolnya. Metode hidrolisis asam yang digunakan pada penelitian ini bertujuan menerapkan metode yang dinilai efektif dan terjangkau dari segi tata cara pelaksanaan, hasil kadar gula yang diperoleh, dan kondisi ekonomi oleh masyarakat, sehingga jika nantinya diperoleh hasil penelitian yang dikehendaki, besar harapan dapat direalisasikan oleh masyarakat di bidang usaha dan bisnis.
B. Rumusan Masalah
Selanjutnya dilakukan penambahan molase agar mendapatkan kadar gula yang lebih tinggi setelah tahap hidrolisis.
C. Tujuan Tujuan penelitian ini adalah :
1. Mengetahui pengaruh lama hidrolisis H2SO4 terhadap kadar gula yang dihasilkan dari fermentasi tepung onggok.
2. Mengetahui pengaruh pemberian konsentrasi molase terhadap kadar bioetanol yang dihasilkan dari fermentasi tepung onggok.
6
II. TINJAUAN PUSTAKA A. Bioetanol
Etanol atau etil alkohol menurut Bambang dan Ega (2009) adalah salah satu turunan dari senyawa hidroksil atau gugus OH yang terdiri dari karbon, hidrogen, dan oksigen dengan rumus kimia C2H5OH. Istilah umum yang sering dipakai untuk senyawa tersebut adalah alkohol. Etanol merupakan zat cair, berbau spesifik, mudah terbakar, tidak berwarna, mudah menguap, mudah larut dalam air, berat molekul 46,1, titik didih 78,3⁰C, membeku pada suhu -117,3⁰C, kerapatannya 0,789 pada suhu 20⁰C, nilai kalor 7077 kal/g panas laten penguapan 204 kal/g dan memiliki angka oktan 91-105.
Etanol atau etil alkohol atau alkohol menurut Bambang (1992) merupakan bahan alami yang dihasilkan dari proses fermentasi yang banyak ditemui dalam produk bir, anggur, spiritus, dan sebagainya. Sebutan alkohol biasanya diartikan sebagai etil alkohol (CH3CH2OH), mempunyai densitas 0,78506 g/ml pada 25ºC, titik didih 78,4ºC, tidak berwarna, dan mempunyai bau serta rasa yang spesifik.
Widayatnim (2015) etanol banyak digunakan sebagai pelarut, germisida, minuman bahan anti beku, bahan bakar, dan senyawa untuk sintesis senyawa-senyawa organik lainnya. Etanol sebagai pelarut banyak digunakan dalam industri farmasi, kosmetika, dan resin maupun laboratorium. Di Indonesia, industri minuman merupakan pengguna terbesar etanol, disusul berturut-turut oleh industri asam asetat, industri farmasi, kosmetika, rumah sakit, dan industri lainnya. Etanol juga digunakan sebagai bahan baku pembuatan senyawa asetaldehid, butadiena, dietel eter, etil asetat, asam asetat, dan sebagainya. Pada industri minuman, etanol merupakan salah satu barang yang diawasi atau dikenal dengan istilah Barang Kena Cukai (BKC). Barang Kena Cukai (BKC) terdiri dari tiga jenis, yaitu etil alkohol, minuman yang mengandung etil alkohol dalam kadar berapapun dan konsentrat yang mengandung etil alkohol, serta hasil tembakau. Minuman yang mengandung alkohol contohnya bir, shandy, anggur, dan lain-lain. Konsentrat yang mengandung alkohol adalah bahan yang mengandung etil alkohol yang digunakan sebagai bahan baku atau bahan penolong dalam pembuatan minum. Pelunasan cukai dilaksanakan dengan cara pembayaran dan pelekatan pita cukai.
produk hasil fermentasi yang dikonsumsi langsung seperti bir dan anggur, serta produk hasil fermentasi yang didestilasi lebih dulu sebelum dikonsumsi seperti whisky. Beberapa jenis minuman seringkali mempunyai nama yang berbeda-beda berdasarkan pada kandungan alkohol yang ada. Contoh, minuman anggur (wine) ada beberapa jenis diantaranya : Appetizer wine (wine yang digunakan sebagai pembuka makanan/perangsang selera makan, misalnya cherry, vermouth), Table wine (terdiri dari red table wine, misalnya claret,burgundy), dan White table wine (rhine wine, sauterne), sweet dessert wine (wine yang dipakai sebagai penutup makan, misalnya port, muscatel, white port, angelica), dan Sparkling wine (misalnya champagne, sparkling burgundy). Disamping itu, wine juga dapat digolongkan berdasarkan kandungan alkoholnya, diantaranya Table wine kurang dari 14%, Dessert wine 14-21%, Blending (industrial wine) lebih dari 21%. Berdasarkan tingkat kemanisan, meliputi Dry wine tanpa atau dengan sedikit gula, Sweet wine dengan manis atau banyak gula. Berdasarkan kandungan CO2, meliputi Still wine tanpa CO2, Sparkling wine terdapat CO2 hasil fermentasi, dan Carbonated wine terdapat CO2 hasil karbonatasi.
mengandung pati (biji-bijian, kentang, tapioka), bahan yang mengandung selulosa (kayu, jerami padi, dan beberapa limbah pertanian lainnya). Secara umum, produksi bioetanol mencakup tiga proses, yaitu hidrolisis, fermentasi, dan pemurnian atau destilasi.
Etanol murni (100%) dapat digunakan sebaagi cairan pencampur pada bensin. Etanol mempunyai angka oktan yang cukup tinggi, sehingga dapat digunakan untuk menaikkan angka oktan. Jenis etanol yang digunakan untuk bahan bakar adalah etanol anhidrous (absolut) dan etanol berair (konsentrasi 85-95%).Baik gasohol (campuran 10-20% volume etanol absolut dengan bensin) maupun etanol berair telah digunakan oleh pemerintah Brasilia. Gasohol dengan kadar etanol 10% volume lazim disebut bahan bakar E-10 (Widayatnim, 2015). Keunggulan etanol dibanding dengan bahan bakar lain diantaranya :
a. Campuran bensin dengan etanol dapat mengurangi emisi gas buang seperti karbon monoksida, dan senyawa organik mudah menguap. Karbon monoksida merupakan gas tidak berwarna, tidak berbau, dan beracun yang dapat mereduksi aliran oksigen pada darah. Campuran bahan bakar etanol-bensin dapat mengurangi emisi karbon monoksida antara 25-30%.
b. Etanol dapat menggantikan senyawa timbal (TEL) sebagai senyawa pengungkit angka oktan bensin. Setiap pencampuran sejumlah 10% etanol, akan menaikkan angka oktan sampai 3 digit.
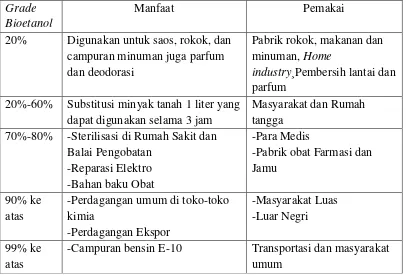
Tabel 1.Pemanfaatan Bioetanol Sesuai dengan Persentasenya Grade
Bioetanol
Manfaat Pemakai
20% Digunakan untuk saos, rokok, dan campuran minuman juga parfum dan deodorasi
Pabrik rokok, makanan dan minuman, Home
industry¸Pembersih lantai dan parfum
20%-60% Substitusi minyak tanah 1 liter yang dapat digunakan selama 3 jam
Masyarakat dan Rumah tangga
70%-80% -Sterilisasi di Rumah Sakit dan Balai Pengobatan
-Reparasi Elektro -Bahan baku Obat
-Para Medis
-Pabrik obat Farmasi dan Jamu
90% ke atas
-Perdagangan umum di toko-toko kimia
-Perdagangan Ekspor
-Masyarakat Luas -Luar Negri 99% ke
atas
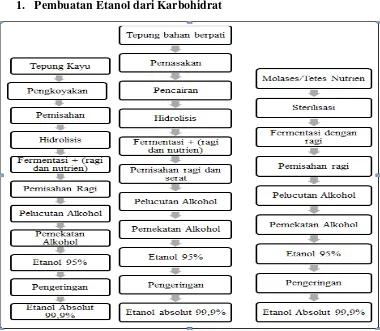
1. Pembuatan Etanol dari Karbohidrat
Gambar 1. Blok Diagram Pembuatan Etanol dengan tiga jenis Karbohirat : Kayu, Tepung Bahan Berpati, dan Tetes
biji-bijian, kentang, tapioka. Sementara bahan yang mengandung selulosa diantaranya kayu, jerami padi, dan beberapa limbah pertanian lainnya. Secara umum, produksi bioetanol mencakup tiga proses, yaitu hidrolisis, fermentasi, dan pemurnian atau destilasi.
2. Tahap Pokok Pembuatan Bioetanol
Pembuatan bietanol pada dasarnya terdapat tiga tahap pokok, yaitu Hidrolisis, Fermentasi, dan Destilasi. Perbedaan teknik pembuatan bioetanol dari satu jenis bahan ke jenis bahan yang lain adalah terletak pada jenis bahan yang digunakan sebagai bahan baku bioetanol yang berpengaruh pada perbedaan perlakuan pra hidrolisis. Berikut merupakan tahap pokok pembuatan bioetanol : a. Hidrolisis
Gigih (2015) proses mengubah karbohidrat menjadi gula sederhana disebut dengan hidrolisis. Pada prinsipnya hidrolisis merupakan proses pemecahan rantai polimer bahan menjadi monomer-monomer sederhana.
Proses hidrolisis asam menurut Adnan (2012) dapat dikatakan sederhana dan dapat langsung diketahui hasilnya, namun memiliki beberapa kekurangan. Proses hidrolisis asam sering menghasilkan produk campuran glukosa, selobiosa, dan produk hidrolisis hemiselulosa, serta degradasi produk dari pemecahan monomer gula menjadi aldehid dan keton. Rendemen glukosa yang tinggi dapat dihasilkan dari hidrolisis asam bila dicapai dengan kondisi yang optimum. Pada metode hidrolisis asam, limbah lignoselulosa dipaparkan dengan asam pada suhu dan tekanan tertentu selama waktu tertentu. Proses hidrolisis asam menghasilkan monomer gula dari polimer selulosa dan hemiselulosa. Sementara pada proses hidrolisis enzimatis dilakukan dengan penambahan enzim alphaamilase dan amiglukosidae. Kelemahan hidrolisis enzim pada bahan ubi kayu yaitu substrat masih menyisakan serat dan sedikit pati. Selain itu metode hidrolisis secara enzimatis juga relatif mahal dan memerlukan waktu yang cukup lama.
b. Fermentasi
Menurut Widayatnim (2015) fermentasi dapat diartikan sebagai semua kegiatan mikrobia hasil aerob maupun annaerob yang menghasilkan suatu proses perubahan kimia spesifik pada suatu substrat organik. Sementara fermentasi alkohol dapat diartikan sebagai perubahan senyawa-senyawa gula (substrat) oleh mikrobia yang menghasilkan alkohol dan gas CO2.
Menurut Retno (2009) fermentasi berasal dari bahasa latin “Ferfere” yang
yang dikendalikan. Pada mulanya istilah fermentasi digunkan untuk menunjukkan proses pengubahan glukosa menjadi etanol yang berlangsung anaerob. Namun, istilah fermentasi berkembang lagi menjadi seluruh perombakan senyawa organik yang dilakukan mikroorganisme.
Reaksi kimia proses fermentasi :
C6H12O6 yeast C2H5OH + 2CO2
Glukosa etanol
Pada proses ini glukosa mengalami proses fermentasi dengan adanya enzim zimase/invertase yang dihasilkan oleh Saccharomyces cerevisiae. Fungsi enzim zimase adalah untuk memecah polisakarida (pati) yang masih terdapat dalam proses hidrolisis untuk diubah menjadi monosakarida (glukosa), sedangkan enzim invertase mengubah monosakarida menjadi alkohol dengan proses fermentasi. Pada awal fermentasi masih diperlukan oksigen untuk pertumbuhan dan perkembangan Saccharomyces cerevisiae, tetapi kemudian tidak dibutuhkan lagi karena kondisi proses yang diperlukan adalah anaerob (Retno, 2009).
Bambang dkk. (1992) dalam pembentukan alkohol melalui proses fermentasi peran mikroorganisme sangat besar dan biasanya mikroorganisme yang digunakan untuk fermentasi mempunyai beberapa syarat sebagai berikut : a. Mempunyai kemampuan untuk memfermentasi karbohidrat yang cocok secara tepat.
b. Bersifat membentuk flokulasi dan sedimentasi (misal sel-sel yeast selalu ada pada bagian bawah tangki fermentasi).
d. Bersifat osmotolerans artinya mikroorganisme tersebut toleran terhadap tekanan osmose yang tinggi.
e. Toleran terhadap kadar alkohol yang tinggi (sampai dengan 14-15%). f. Mempunyai sifat regenerasi yang cepat.
Penggunaan berbagai macam jenis mikroorganisme tersebut disesuaikan dengan substrat/bahan yang akan difermentasi dan kondisi proses yang akan berlangsung. Sebagai contoh, untuk proses yang menggunakan suhu tinggi maka mikroorganisme yang digunakan sedapat mungkin yang bersifat thermofilik, misalnya Clostridium thermocellum, Clostridium thermohydrosulfuricum, dan sebagainya. Mikroorganisme yang lain ada pula yang bersifat tahan terhadap kadar etanol yang tinggi (etanol tolerance), tahan terhadap konsentrasi gula yang tinggi (osmofilik), dan sebagainya. Mikroorganisme yang paling banyak digunakan dalam proses fermentasi alkohol adalah Saccharomyces cerevisiae yang dapat berproduksi tinggi, tahan/toleran terhadap kadar alkohol tinggi, tahan terhadap kadar gula tinggi, dan tetap aktif melakukan aktivitasnya pada suhu 4-32ºC. Pada minuman beralkohol yang dihasilkan tanpa destilasi (hasil fermentasi) biasanya mempunyai kadar alkohol antara 3% sampai 18%. Tujuan mempertinggi kadar alkohol dalam produk seringkali hasil fermentasi didestilasi dan kadar alkohol yang dihasilkan berkisar antara 20% sampai 50% (Bambang dkk. 1992).
Sebelum proses fermentasi dilaksanakan, terdapat beberapa faktor menurut Bambang dkk. (1992) yang perlu diperhatikan dan berpengaruh pada proses fermentasi, yaitu :
Sudah diketahui bahwa proses penghasil etanol secara fermentasi dilakukan oleh mikroba. Jenis mikroba yang digunakan dalam proses fermentasi sangat berpengaruh pada etanol yang dihasilkan. Bila dilihat dari jenisnya, maka terdapat beberapa jenis mikroorganisme yang banyak digunakan dalam proses fermentasi diantaranya khamir, kapang, dan bakteri. Akan tetapi tidak semua mikroorganisme tersebut dapat digunakan secara langsung karena masih diperlukan seleksi untuk menjamin berlangsungnya proses fermentasi. Pemilihan mikroorganisme biasanya didasarkan pada jenis substrat (bahan) yang digunakan sebagai medium, misalnya untuk menghasilkan bioetanol digunakan khamir Saccharomyces cerevisiae, untuk mengoksidasi alkohol menjadi asam asetat digunakan bakteri Acetobacter. Seleksi ini bertujuan untuk mendapatkan mikroorganisme yang mampu tumbuh dengan cepat dan mempunyai toleransi tinggi terhadap konsentrasi gula yang tinggi sehingga dapat menghasilkan kadar bioetanol yang dikehendaki.
b. Sumber Karbon
Sumber karbon yang ada disesuaikan dengan jenis mikroorganisme yang digunakan.Sebagai contoh, laktosa tidak cocok untuk yeast (ragi) karena yeast tidak menghasilkan laktase yang digunakan untuk memecah laktosa. Konsentrasi gula juga berpengaruh terhadap proses fermentasi, dimana pada konsentrasi gula 25% yeast akan mulai terhambat aktivitasnya, sedangkan apabila konsentrasi terlalu rendah (sekitar 5%) maka gula yang ada akan habis untuk energi saja.
Apabila dalam substrat kekurangan unsur nitrogen maka dapat ditambahkan dalam bentuk asam-asam amino, pepton, peptida, ammonium fosfat, maupun ammonium sulfat. Bentuk ammonium merupakan bentuk yang paling mudah digunakan oleh yeast. Unsur hara lain yang dibutuhkan cukup banyak utnuk fermentasi diantaranya P, K ,Mg, dan Ca, sedangkan unsur Fe dan Cu dibutuhkan dalam jumlah kecil.
d. Kadar Alkohol
Kadar alkohol akan mempengaruhi pertumbuhan yeast, yaitu apabila konsentrasi alkohol semakin tinggi maka yeast akan terhambat. Pada kadar alkohol 16% aktivitas yeast mulai terhambat. Yeast umumnya lebih tahan (toleran) terhadap etanol dibanding dengan mikroorganisme lain. Alkohol berantai panjan akan bersifat toksik. Yeast akan terhambat oleh alkohol bila dicapai Delle Unit (DU) sebesar 75-85, sedangkan DU = a + 4,5 c, dimana a adalah presentase gula dalam substrat (berat/volume), dan c adalah presentase etanol (volume/volume).
e. Karbondioksida (CO2)
Karbondioksida berpengaruh pada tekanan saat fermentasi dilakukan, sehingga CO2 yang dihasilkan akan dapat mempengaruhi aktivitas mikroorganisme yang digunakan. Oleh sebab itu CO2 yang dihasilkan harus dialirkan ke luar ruang fermentasi. Yeast akan mulai terhambat pada tekanan 15 g/l CO2.
Temperatur diatur sesuai dengan temperatur optimum sesuai dengan mikroorganisme yang digunakan.
g. Aerasi
Aerasi diberikan untuk suplai oksigen pada yeast sehingga hasil glukosa yang berupa asam piruvat tidak berubah menjadi CO2 melainkan menjadi etanol. Akan tetapi, bila suplai oksigen tersebut terlalu banyak maka piruvat akan dioksidasi melalui siklus Kreb sehingga tidak berbentuk etanol.
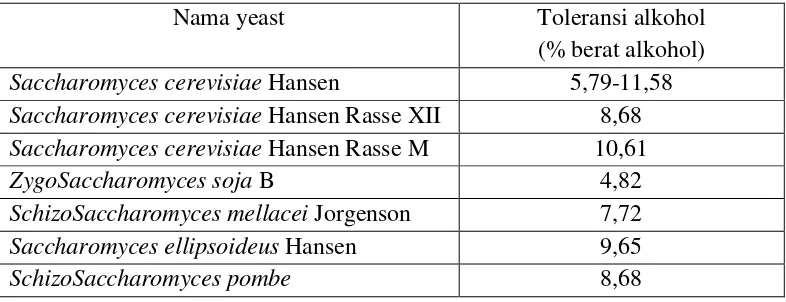
Berikut merupakan tabel toleransi alkohol pada beberapa macam yeast dan macam mikroorganisme yang dapat digunakan untuk fermentasi alkohol dengan substrat yang digunakan menurut Bambang dkk. (1992) :
Tabel 2. Toleransi Alkohol pada Beberapa Macam Yeast
Nama yeast Toleransi alkohol
(% berat alkohol) Saccharomyces cerevisiae Hansen 5,79-11,58 Saccharomyces cerevisiae Hansen Rasse XII 8,68 Saccharomyces cerevisiae Hansen Rasse M 10,61
ZygoSaccharomyces soja B 4,82
SchizoSaccharomyces mellacei Jorgenson 7,72 Saccharomyces ellipsoideus Hansen 9,65
SchizoSaccharomyces pombe 8,68
Tabel 3. Macam Mikroorganisme dan Substrat yang digunakan untuk Fermentasi
Mikroorganisme Substrat
Saccharomyces cerevisiae, S. uvarum (S. carlsbergensis)
Glukosa, Fruktosa, Galaktosa, Maltosa, Sukrosa
Saccharomyces diastaticus Glukosa, Maltosa, Dekstrin, Pati Saccharomyces rouxii Glukosa, Fruktosa, Maltosa,
Sukrosa
Kluyveromyces fragilis, K.lactis Glukosa, Galaktosa, Laktosa Candida pseudotropicalis Glukosa, Galaktosa, Laktosa Pachysolen tannophillus Glukosa, Silosa, Silulosa Scwaniomyces alluvins, S. castelli Dekstrin, Pati
Endomycopsis fibulifera Dekstrin, Pati 2. Golongan bakteri
Zymomonas mobilis Glukosa, Fruktosa, Sukrosa Clostridium thermocellum Glukosa, Selobiosa, Selulosa
Clostridium thermohydrosulfuricum Glukosa, Silosa, Selobiosa, Sukrosa, Pati
Thermoanaerobium brockii Glukosa, Sukrosa, Selobiosa, Pati Thermobacteroides acetoethylicus Glukosa, Sukrosa, Selobiosa Thermoanaerobacter etanolicus D-Silosa, Pati
Gambar 1. Blok Diagram Proses Fermentasi Gula menjadi Etanol
3. Efisiensi Fermentasi
Rumus % efisiensi fermentasi = (alkohol aktual yang diproduksi : alkohol teoritis dari fermentasi gula) x 100
Rumus % plant efficiency = (alkohol aktual yang diproduksi : alkohol teoritis dari karbohidrat yang dipakai) x 100
4. Destilasi
Proses destilasi bertujuan memisahkan bioetanol dan air berdasarkan perbedaan titik didih kedua bahan tersebut yang kemudian diembunkan kembali. Titik didih etanol murni adalah 78ºC sedangkan air 100ºC, pemanasan larutan pada rentang suhu 78-100ºC akan mengakibatkan sebagian besar alkohol menguap, maka perlu dilakukan proses destilasi melalui unit kondensasi sehingga akan dihasilkan etanol berkonsentrasi 95%.
B. Onggok
Onggok merupakan limbah dari industri tapioka yang berbentuk padatan yang diperoleh pada proses ekstraksi. Pada proses ekstraksi ini diperoleh suspense pati sebagai filtratnya dan ampas yang tertinggal sebagai onggok. Komponen penting yang terdapat dalam onggok adalah pati dan serat kasar. Pati dan serat kasar pada onggok dapat diuraikan secara enzimatis maupun kimiawi sebagai bahan baku bioetanol. Menurut Kawid (2013) terdapat dua jenis onggok yang sering ditemui, yaitu onggok basah dan onggok kering. Onggok basah banyak digunakan sebagai bahan pengganti pakan ternak yang mulai kesusahan mencari hijauan pakan terutama di musim kemarau. Sementara onggok kering merupakan onggok basah mengalami proses pengeringan terlebih dulu dan banyak digunakan sebagai bahan baku saus, bahan baku obat nyamuk, bahan perekat lem kertas, campuran kecap, dan lain sebagainya. Daerah penghasil onggok terbesar di Indonesia diantaranya di Propinsi Lampung, Pulau Jawa yang meliputi Kabupaten Pati, Purbalingga, Ajibarang, Wonogiri, Bogor, Sukabumi, dan daerah disekitarnya.
sumber energi. Kandungan pada onggok yaitu protein kasar 2,89%, serat kasar 14,73%, abu 1,21%, lemak kasar 0,38%, dan air 20,31%. Sementara menurut ITS (2015) limbah pada industri tapioka masih mengandung pati cukup tinggi yaitu sebesar 63%. Badan Penelitian dan Pengkajian Teknologi Indonesia menyebutkan bahwa kandungan pati pada ampas tapioka sebesar 67,8%. Analisis kandungan onggok kering yaitu karbohidrat sebesar 68%, protein sebesar 1,57%, lemak sebesar 0,26%, serat kasar 10%, dan kadar air 20%.
1. Kandungan Utama Onggok
Onggok sebagai limbah dari tapioka masih memiliki kandungan pati dan serat kasar karena pada saat ekstraksi tidak semua kandungan pati terikut dan tersaring bersama filtratnya. Pati dan serat kasar merupakan komponen karbohidrat dan onggok yang masih potensial untuk dimanfaatkan.
a. Pati
Widayatnim (2015) struktur polimer glukosa yang bercabang relatif lebih mudah larut seperti amilopektin dibandingkan dengan polimer glukosa berantai lurus seperti amilosa. Kandungan amilosa dalam pati sekitar 20%, sisanya amilopektin.
Anna dkk. (2005) menyebutkan bahwa molekul amilopektin lebih besar daripada molekul amilosa karena terdiri atas lebih dari 1.000 unit glukosa. Butir-butir pati tidak larut dalam air dingin tetapi apabila suspensi dalam air dipanaskan, akan terjadi suatu larutan koloid yang kental. Larutan koloid ini apabila diberi larutan iodium akan berwarna biru. Warna biru tersebut disebabkan oleh molekul amilosa yang membentuk senyawa. Amilopektin dengan iodium akan memberikan warna ungu atau merah lembayung. Amilum yang terdiri dari polisakarid amilopektin dan amilosa dapat dihidrolisis sempurna dengan menggunakan asam sehingga menghasilkan glukosa. Hidrolisis juga dapat dilakukan dengan bantuan enzim amilase.
Pengolahan awal pada tepung bahan berpati meliputi pemasakan, pencairan, dan proses hidrolisis. Pemasakan tepung bahan berpati dilakukan dengan menambahkan air dan mengatur pH pada nilai 4-6, kemudian memanaskan adonan pada temperatur 135-150ºC selama 10-30 menit. Pemanasan akan mempercepat pelarutan amilopektin, dan sekaligus mensterilkan campuran.
Adonan didinginkan sampai temperature 100ºC, kemudian ditambahkan enzim α -amilase. Amilase merupakan enzim yang dapat menghidrolisis ikatan glikosida dalam pati, dengan hasil katabolik glukosa atau maltosa dan maltooligosakarida.
Enzim α-amilase dapat diperoleh dari bakteri Bacillus subtilis dan Bacillus lincheniformis, yang dapat bertahan pada temperatur maksimum. Proses pembentukan glukosa lebih sempurna (konsentrasi glukosa lebih tinggi) dengan menambahkan enzim glukoamilase atau amiloglukosidae. Enzim glukoamilase hanya menyerang ujung-ujung ikatan glikosida yang tidak terputus pada pati, dengan hasil katabolik glukosa. Enzim ini dapat diperoleh dengan menambahkan Aspergillus niger. Enzim glukoamilase mempunyai aktifitas pada temperatur maksimum 60-65ºC, sehingga memerlukan pendinginan campuran adonan ketika menggunakan enzim tersebut. Proses hidrolisis pati juga dapat menggunakan larutan asam. Proses fermentasi dilakukan setelah proses hidrolisis, dengan menambahkan ragi dan nutrien. Proses hidrolisis dengan metode kimia menggunakan larutan asam seperti asam sulfat dan asam klorida. Penggunaan larutan asam pekat memerlukan temperatur rendah sedangkan larutan asam encer memerlukan temperatur operasi tinggi (Widayatnim, 2015).
b. Serat Kasar
Rumus empiris selulosa adalah (C6H10O5)n dengan n adalah jumlah satuan glukosa yang berikatan dan berarti juga polimerisasi glukosa. Selulosa murni memiliki derajat polimerisasi sekitar 14.000, namun dengan pemurnian biasanya akan berkurang menjadi sekitar 2.500 (Widayatnim, 2015).
Hemiselulosa adalah polisakarida non selulosa yang pokok, terkandung dalam serat dengan berat molekul 4.000-15.000. Hemiselulosa terdapat dalam serat dan tergolong senyawa organik. Hemiselulosa juga terdapat di dinding sel bersamaan dengan selulosa, terutama di daerah amorf dan di dalam lamella tengah. Hemiselulosa mirip dengan selulosa yang merupakan polimer gula. Namun, berbeda dengan selulosa yang hanya tersusun dari glukosa, hemiselulosa tersusun dari bermacam-macam jenis gula. Monomer gula penyusun hemiselulosa terdiri dari monomer gula berkarbon 5 (C-5) dan 6 (C-6), misalnya xylosa, mannose, glukosa, galaktosa, arabinosa, dan sejumlah kecil rhamnosa, asam glukoroat, asam metal glukoronat, dan asam galaturonat. Hemiselulosa lebih mudah dihidrolisis dari pada selulosa tetapi gula C-5 lebih sulit difermentasi. Perbedaan selulosa dan hemiselulosa adalah hemiselulosa mudah larut dalam alkali tapi sukar larut dalam asam, sedangkan selulosa adalah sebaliknya. Rantai utama hemiselulosa dapat terdiri atas satu jenis monomer (homopolimer), seperti xilan, atau terdiri atas dua jenis atau lebih dari satu monomer (heteropolimer), seperti glukomanan. Rantai molekul hemiselulosa lebih pendek daripada selulosa (Widayatnim, 2015).
C. Hidrolisis Asam
Widayatnim (2015) Proses hidrolisis dengan metode kimia menggunakan larutan asam, seperti asam sulfat dan asam klorida. Penggunaan larutan asam pekat memerlukan temperatur yang rendah, sementara larutan asam encer memerlukan temperatur tinggi.
Penelitian Ashadi (1988) dalam Adnan (2012) kadar glukosa yang dihasilkan dari proses hidrolisis dipengaruhi oleh konsentrasi asam dan lama waktu hidrolisis. Peningkatan konsentrasi asam yang digunakan akan menurunkan glukosa yang dihasilkan karena glukosa yang terbentuk akan terdegradasi lebih lanjut. Hidrolisis dengan menggunakan asam pada konsentrasi tinggi, gula yang dihasilkan akan diubah menjadi senyawa-senyawa furfural yang akan menghambat proses fermentasi. Lama waktu hidrolisis mempengaruhi proses degradasi selulosa menjadi glukosa dan juga mempengaruhi degradasi glukosa sebagai produk. Waktu hidrolisis yang melebihi waktu optimum akan mendegradasi glukosa menjadi komponen-komponen yang lebih sederhana yang biasanya bersifat racun (Assegaf, 2009 dalam Adnan, 2012).
Disamping itu, juga disebutkan bahwa untuk penelitian selanjutnya disarankan menggunakan bahan lain selain jerami padi karena dari penelitian sendiri dan sebelumnya didapatkan kadar bioetanol yang kecil. Penelitian selanjutnya yaitu penelitian Yusrin dan Mukaromah (2010) yang memberikan hasil hidrolisis H2SO4 3% yang setara dengan 0,2 M selama 3 jam dengan 1% ragi dan waktu fermentasi 32 jam merupakan perlakuan yang memberikan kadar etanol tertinggi sebesar 9,11%. Penelitian Dwi dkk. (2012) memberikan hasil bahwa perlakuan H2SO4 2M selama 4 jam memberikan kadar glukosa tertinggi sebesar 30,74 g/L dari perlakuan 0,2M yang digunakan untuk hidrolisis. Semakin lama waktu yang digunakan untuk menghidrolisis maka proses pemecahan pati pada onggok menjadi glukosa akan lebih maksimal, sehingga mempengaruhi pada banyaknya gula yang akan didapatkan dari proses hidrolisis.
D. Saccharomyces cerevisiae
Gambar 2. Koloni Saccharomyces cerevisiae
Saccharomyces cerevisiae merupakan mikroba fakultatif aerob yang dapat menggunakan sistem aerob maupun anaerob untuk memperoleh energi dari proses pemecahan glukosa, tahan terhadap kadar gula yang tinggi, dan tetap aktif melakukan aktifitasnya pada suhu 28-32ºC. Sel berbentuk silindris, dengan ukuran sel 5-20 mikron dan biasanya 5-10 kali lebih besar dari ukuran bakteri. Khamir ini bersifat non patogenik dan non toksik sehingga banyak digunakan dalam berbagai proses fermentasi seperti pembuatan roti dan alkohol. Saccharomyces cerevisiae merupakan jenis mikroorganisme yang paling banyak digunakan untuk fermentasi alkohol karena mampu menghasilkan etanol dengan rendemen yang lebih tinggi dibandingkan jenis mikroorganisme lainnya. Disamping itu, mikroorganisme ini sangat mudah ditumbuhkan, membutuhkan nutrisi yang sederhana, laju pertumbuhan yang cepat, dan sangat stabil (Susilowati dan Vosiani, 2007).
mikroorganisme bersel satu tidak berklorofil, termasuk kelompok Eumycetes. Tumbuh baik pada suhu 30ºC dan pH 4,8. Beberapa kelebihan Saccharomyces dalam proses fermentasi yaitu mikroorganisme cepat berkembang biak, tahan terhadap alkohol yang tinggi, tahan terhadap suhu yang tinggi, mempunyai sifat stabil dan cepat mengadakan adaptasi. Beberapa spesies Saccharomyces mampu memproduksi etanol hingga 13,01%. Hasil ini lebih bagus dibanding genus lainnya seperti Candida dan Trochosporon. Pertumbuhan Saccharomyces dipengaruhi oleh adanya penambahan nutrisi yaitu unsur C sebagai sumber carbon, unsur N yang diperoleh dari penambahan urea, ZA, ammonium dan pepton, mineral dan vitamin. Suhu optimum untuk fermentasi 28-30ºC. Mikrostruktur Saccharomyces cerevisiae :
1. Kapsul
2. Dinding sel pada sel-sel yang muda sangat tipis, namun semakin lama semakin menebal seiring dengan waktu. Pada dinding sel terdapat struktur yang disebut bekas lahir (bekas yang timbul dari pembentukan oleh sel induk) dan bekas tunas (bekas yang timbul akibat pembentukan anak sel). Setiap sel hanya dapat memiliki satu bekas lahir, namun bisa membentuk banyak bekas tunas. Saccharomyces cerevisiae dapat membentuk 9 sampai 43 tunas dengan rata-rata 24 tunas per sel dan paling banyak lahir pada kedua ujung sel yang memanjang. 3. Membran sitoplasma, nukelus, vakuola, mitokondria
5. Sitoplasma
6. Saccharomyces cerevisiae berkembang biak dengan cara : a. Pertunasan multipolar, dimana tunas muncul dari sekitar ujung sel, b. Pembelahan tunas, yaitu gabungan antara pertunasan dan pembelahan. Pada proses ini mula-mula terbentuk tunas, tetapi tempat melekatnya tunas pada sel induk relatif besar, kemudian terbentuk septa yang memisahkan tunas dari induknya. Pada Saccharomyces, areal tempat melekatnya tunas pada induk sedemikian kecilnya sehingga seolah tidak pernah terbentuk septa (tidak dapat dilihat dengan mikroskop biasa), c. Pembentukan askospora. Pada khamir diploid seperti Saccharomyces cerevisiae, meiosis dapat terjadi langsung dari sel vegetatif. Spora berbentuk bulat atau oval dengan permukaan halus.
Penelitian mengenai Saccharomyces cerevisiae terhadap kaitannya dengan kadar etanol yang dihasilkan diantaranya penelitian etanol dari onggok oleh Akyunul (2008) yang memberikan hasil bahwa kadar etanol tertinggi sebesar 19% didapat pada dosis Saccharomyces cerevisiae 10% dan lama fermentasi 7 hari dengan rendemen 72%.
E. Molase
sangat baik untuk industri pembuatan etanol. Bahan ini merupakan produk sampingan yang dihasilkan selama proses pemutihan gula. Kandungan gula dari molase terutama sukrosa berkisar 40-55% (Riswan, 2004).
Molase masih mengandung kadar gula yang cukup untuk dapat menghasilkan etanol dengan proses fermentasi, biasanya pH molase berkisar antara 5,5-6,5. Molase yang masih mengandung kadar gula sekitar 10-18% telah memberikan hasil yang memuaskan untuk pembuatan etanol. Jenis mikroorganisme yang berperan dalam proses ini adalah golongan khamir Saccharomyces cerevisiae (Riswan, 2004).
Molase dari tebu dapat dibedakan menjadi 3 jenis. Molase kelas 1, kelas 2,
dan “black strap” .Molase kelas 1 didapatkan saat pertama kali jus tebu dikristalisasi. Saat dikristalisasi terdapat sisa jus yang tidak mengkristal dan berwarna bening. Sisa jus ini langsung diambil sebagai molase kelas 1. Molase
kelas 2 atau biasa disebut dengan “Dark” diperoleh saat proses kritalisasi kedua. Warnanya agak kecoklatan sehingga sering disebut juga dengan istilah “Dark”.
Molase kelas terakhir, “Black Strap” diperoleh dari kristalisasi terakhir. Warna
“Black Strap” ini memang mendekati hitam (coklat tua) sehingga tidak salah jika
diberi nama “Black Strap” sesuai dengan warnanya. “Black Strap” ternyata memiliki kandungan zat yang berguna. Zat-zat tersebut antara lain kalsium,
magnesium, potasium, dan besi. “Black Strap” memiliki kandungan kalori yang cukup tinggi karena terdiri dari glukosa dan fruktosa (Riswan, 2004).
0,1-1,1%, MgO 0,03-0,1%, K2O 2,6-5,0%, total abu 7-11%. Berdasarkan penelitian Agustin dan Pertiwi (2013) Saccharomyces cerevisiae sebanyak 5%, 10%, dan 15% (v/v) diinokulasikan pada medium tetes tebu hasil pretreatment dengan kandungan gula 15%, 20%, dan 25% (b/v) pada pH 5 memberikan hasil etanol tertinggi pada konsentrasi inokulum 10% (v/v) dengan konsentrasi sumber gula 15% (b/v) yaitu 8,792 (b/v) dengan yield etanol 65%. Merujuk pada penelitian Agustin dan Pertiwi (2013), maka pada kesempatan penelitian ini penulis akan meneliti bagaimana reaksi dan pengaruh penambahan molase terhadap kadar etanol yang dihasilkan sebagai perlakuan pendukung pada penelitian ini, jika konsentrasi etanol diturunkan menjadi 10%, dan 15%, dengan memperhatikan konsentrasi 15% pada penelitian Agustin dan Pertiwi (2013) merupakan perlakuan konsentrasi paling kecil dan memberikan hasil kadar etanol tertinggi dari konsentrasi gula 20% dan 25%. Disamping itu juga, penambahan molase dengan konsentrasi tertinggi 15% dari 10% maka artinya jumlah total gula yang akan didapatkan akan lebih banyak. Semakin tinggi kadar gula yang didapat sebagai bahan fermentasi maka semakin tinggi juga kadar etanol yang akan didapatkan.
F. Hipotesis
35
III. TATA CARA PENELITIAN A. Tempat dan waktu penelitian
Penelitian ini dilaksanakan di Laboratorium Agrobioteknologi, Jurusan Agroteknologi, Fakultas Pertanian, Universitas Muhammadiyah Yogyakarta pada bulan September 2015.
B. Bahan dan Alat Penelitian
Bahan yang digunakan: tepung onggok (Lampiran 3.1.a), aquades, H2SO4 2M, molase (Lampiran 3.1.c), fermipan, malt extract, pepton, agar, NaOH, HCl,indikator PP, larutan KOH 0,1 N.
Alat yang digunakan: alat tulis, timbangan analitik, label, Erlenmeyer 250 ml, glassware, kompor, labu ukur, termometer, timer, autoklaf, pH meter, destilator, petridish, jarum ose, kertas karton, tabung reaksi, batang pengaduk, rotary shaker, dryglasky, pipet tetes, alkoholmeter, panci, botol jam, plastik, karet, kompor listrik.
C. Metode Penelitian
Penelitian ini terdiri dari 2 tahap yaitu tahap 1 hirolisis H2SO4 2M dengan rancangan lingkungan berupa Rancangan Acak Lengkap (RAL) dan rancangan perlakuan berupa faktor tunggal dengan 3 perlakuan, yaitu :
A. Hidrolisis H2SO4 dengan lama waktu 3 jam
B. Hidrolisis H2SO4 dengan lama waktu 4 jam
C. Hidrolisis H2SO4 dengan lama waktu 5 jam
perlakuan lama waktu hidrolisis dan konsentrasi molase terhadap fermentasi bioetanol, seperti berikut :
P1. Hidrolisis 3 jam dan Konsentrasi Molase 10% P2. Hidrolisis 3 jam dan Konsentrasi Molase 15% P3. Hidrolisis 4 jam dan Konsentrasi Molase 10% P4. Hidrolisis 4 jam dan Konsentrasi Molase 15% P5. Hidrolisis 5 jam dan Konsentrasi Molase 10% P6. Hidrolisis 5 jam dan Konsentrasi Molase 15%
Pada penelitian ini dilakukan dua tahap penelitian, yaitu hidrolisis kemudian penambahan molase. Hal tersebut dilakukan dengan tujuan mendapatkan kadar gula yang lebih tinggi lagi dari kadar gula yang dihasilkan pada proses hidrolisis tepung onggok, dengan tidak sepenuhnya mengandalkan kadar gula tinggi yang diperoleh dari molase 100%. Pengamatan dilakukan berturut-turut selama 7 hari dengan uji kadar pati setelah proses hidrolisis, penambahan molase, dan fermentasi hari 1-7; uji gula total setelah proses hidrolisis, penambahan molase, dan fermentasi hari 1-7; uji pH, jumlah sel Saccharomyces cerevisiae, dan asam tertitrasipada proses fermentasi hari 1-7; uji kadar etanol setelah proses fermentasi.
D. Cara Penelitian
1. Karakterisasi Tepung Onggok
a. Analisa Kadar Protein (Sudarmadji dkk. 2007)
didapat dengan 6,25. Hasil konversi yang didapat tersebut merupakan kandungan protein dalam sampel.
Cara menguji kadar Nitrogen, dilakukan dengan memasukkan sampel sebanyak 2 gram ke dalam labu Kjeidahl dan menambahkan katalis N (CuSO4 dan K2SO4) 0,7 g, H2SO4 pekat 3 ml lalu didestruksi pada suhu 370-410ºC dalam lemari asam sampai jernih kurang lebih 1 jam. Pada tahapan ini asam sulfat pekat mendestruksi sampel menjadi unsur-unsurnya. Elemen Karbon, Hidrogen teroksidasi menjadi CO, CO2, dan H2O, sedangkan Nitrogen-nya (N) akan berubah menjadi (NH4)2SO4.
Selanjutnya sampel masuk pada tahap destilasi. Pada tahap ini Ammonium Sulfat dipecah menjadi ammonia (NH3) dengan penambahan NaOH sampai alkalis kemudian dipanaskan. Setelah melalui tahap destruksi, selanjutnya sampel didinginkan dan menambahkan 15 ml H2O dan 15 ml NaOH 40% yang dimasukkan ke dalam labu destilasi. Hasil destilasi ditampung dalam Erlenmeyer 100 ml yang berisi 25 ml larutan HCl 40% dan meneteskan indikator PP 2-3 tetes. Destilasi berakhir bila semua ammonia terdestilasi sempurna dengan tanda destilat tidak bereaksi basis.
b. Analisa Kadar Abu (AOAC 2003)
Kandungan abu dalam tepung onggok ditentukan dengan AOAC (2003) dalam Setyo dkk. (2012). Teknik penentuan abu yaitu cawan kosong dan bersih dipanaskan pada suhu 600ºC selama 1 jam dalam muffle furnace. Mendinginkan cawan tersebut ke dalam desikator kemudian menimbangnya. Berat cawan kosong sebagai W1. 1 gram sampel tepung onggok ditaruh dalam cawan (W2). Selanjutnya meletakkan cawan tersebut ke dalam muffle furnace pada suhu 400ºC selama 6 jam dan didinginkan dalam desikator. Menimbang cawan dari dalam desikator sebagai W3.
c. Analisa Kadar Serat Metode Gravimetri (Sudarmadji dkk. 2007)
Menimbang sampel 1-2 gram yang dimasukkan ke dalam Erlenmeyer 500 ml dan menambahkan 50 ml H2SO4 1,25% kemudian dipanaskan dan direflux selama 30 menit. Sampel yang telah dipanaskan, disaring menggunakan kertas saring Whatman 42 yang telah diketahui bobotnya. Selanjutnya mencuci sampel dengan 50 ml H2SO4 1,25% dan 50 ml alkohol 36%. Endapan dikeringkan dalam oven pada suhu 105°C dan ditimbang hingga mencapai bobot konstan untuk menghitung kadar serat.
d. Analisa Kadar Air (AOAC 2003)
e. Analisa Kadar Lemak (Sudarmadji dkk. 1984)
Pengujian kadar lemak dilakukan dengan menimbang berat selongsong/kertas saring dan menimbang juga berat selongsong dan sampel 1 gram kemudian menimbang berat selongsong dan sampel serta kapas. Selanjutnya kertas saring, sampel, dan kapas dimasukkan ke dalam oven sampai beratnya konstan kemudian ditimbang. Selanjutnya dimasukkan ke dalam soxhlet selama 4 jam menggunakan pelarut petroleum eter (PE) dan dimasukkan ke dalam oven hingga berat konstan lalu ditimbang.
f. Analisa Karbohirat metode Nelson-Samogyi (Sudarmadji dkk. 1984)
persamaan regresi senyawa standar (glukosa monohydrat). Kadar gula reduksi adalah kadar gula reduksi tanpa enzim amilase.
Untuk menggambarkan kurva hubungan kadar dan absorbansi, dapat digunakan metode kuadrat terkecil (Least-Square) agar diperoleh garis lurus yang konstan. Metode sering digunakan untuk menentukan ketepatan garis yang terbaik pada kurva baku (standar).
Kadar pati = (Kadar gula reduksi setelah diberi enzim amilase – kadar gula reduksi tanpa enzim amilase) x 0,9.
1. Isolasi dan Perbanyakan Saccharomyces cerevisiae a. Sterilisasi Alat dan Media
b. Persiapan Air Steril untuk Pengenceran
Air steril untuk pengenceran pada tabung reaksi dan botol suntik dapat dibuat dengan mencuci bersih tabung reaksi dan botol suntik yang telah direbus dan dikeringkan. Selanjutnya mengisi aquades sebanyak 9 ml untuk tabung reaksi dan 99 ml untuk botol suntik dan disterilisasi menggunakan autoklaf. Botol suntik ditutup menggunakan plastik dan diikat karet. Tabung reaksi ditutup dengan pengumpat kapas dan dibungkus dengan kertas koran yang diikat karet.
c. Pembuatan Medium MEA
Banyaknya komposisi bahan MEA yang disiapkan tergantung dari volume MEA yang akan dibuat. 1000 ml MEA membutuhkan komposisi bahan berupa malt extract 30 gram, pepton 5 gram, dan agar 15 gram. Setelah bahan tersebut disiapkan, langkah selanjutnya yaitu memasukkan malt extract, pepton, dan aquades ke dalam bekker glass kemudian diaduk sampai homogen dan memasaknya hingga mendidih. Menuang larutan tersebut ke dalam Erlenmeyer yang telah diberi agar sesuai takaran dan menggojog larutan tersebut hingga homogen dan selanjutnya mengukur pH hingga media mencapai pH 4,8-5 dan di destilasi menggunakan Autoklaf. Menuang media tersebut sesuai kebutuhan (untuk petridish 8 ml dan tabung miring 5 ml).
d. Isolasi Saccharomyces cerevisiae dari Fermipan
dalam tabung reaksi kedua dan menambahkan 9 ml aquadest steril (pengenceran 10-2). Hal yang sama terus dilakukan hingga pengenceran 10-9.
Membiakkan Saccharomyces cerevisiae dengan larutan hasil pengenceran pada medium MEA dengan cara mengambil 1 ose yang disebarkan pada permukaan medium MEA secara streak dan mendiamkannya selama 72 jam hingga koloni Saccharomyces cerevisiae tumbuh.
e. Karakterisasi Saccharomyces cerevisiae
Mengambil 1 ose koloni tunggal Saccharomyces cerevisiae hasil streak yang dimasukkan ke dalam tabung reaksi berisi 9 ml air steril kemudian dikocok homogen. Selanjutnya, mengambil 0,1 ml dari larutan tersebut dan meletakkannya ke permukaan medium MEA dengan cara streak dan didiamkan selama 72 jam. Mencocokkan koloni yang tumbuh dengan kesesuaian karakteristik koloni Saccharomyces cerevisiae hingga didapatkan koloni yang sama seluruhnya (seragam) dalam petridish. Karakteristik koloni Saccharomyces cerevisiae secara makroskopik yaitu koloni berbentuk bulat, warna kuning muda, permukaan berkilau, licin, tekstur lunak (Lampiran 3.1.d). Karakteristik koloni secara mikroskopik yaitu sel bulat dengan askospora saat diamati menggunakan mikroskop.
f. Perbanyakan Saccharomyces cerevisiae
perbanyakan sebagai kultur stok dan 13 kali perbanyakan yang akan digunakan untuk fermentasi sebanyak 126 perlakuan.
g. Pembuatan Inokulum Saccharomyces cerevisiae sebagai starter fermentasi
Memindahkan 2 ose koloni ke masing-masing 3 tabung MEC 9 ml untuk setiap perlakuan dan diinkubasi selama 72 jam sampai Saccharomyces cerevisiae tumbuh. Selanjutnya memindahkan 3 tabung MEC tersebut ke Erlenmeyer 250 ml yang berisi MEC dengan volume 140 ml untuk setiap perlakuan dan melakukan shaker Erlenmeyer tersebut selama 48 jam.
Volume inokulum 140 ml dari setiap Erlenmeyer 250 ml ditentukan dari 10% volume media fermentasi. Volume media fermentasi dari setiap unit percobaan dihitung dari jumlah komponen media, berupa 40 gram tepung onggok dan 160 ml aquades. 10% dari setiap volume media fermentasi 200 ml adalah 20 ml. Setiap perlakuan dilakukan uji dan pengamatan berurutan selama 7 hari, sehingga total volume inokulum dari setiap perlakuan adalah 140 ml (20 ml x 7 hari) yang disiapkan dalam 1 erlenmeyer.
2.
Persiapan Bahan Baku Tepung Onggok a. Pengeringan Onggok
Membuat tepung onggok dengan cara mengeringkan onggok basah yang didapat dari produksi tapioka dibawah sinar matahari selama 2-3 hari atau pengeringan oven dengan suhu 80ºC selama 4 jam. Menghaluskan onggok kering tersebut dengan cara giling atau grinder menjadi tepung onggok dan siap digunakan.
b. Pemasakan dan Pencairan Tepung Onggok
Memasukkan tepung onggok dan aquades dengan perbandingan 1:4, yaitu 40 gram tepung onggok dan 160 ml aquades untuk 126 botol jam sehingga total dibutuhkan 5040 gram tepung onggok dan 20.160 ml aquades, kemudian memasak tepung onggok tersebut menjadi bubur onggok (Lampiran 3.1.b) menggunakan panci hingga memiliki tekstur menggeliat rata seperti lem atau mencapai suhu 82ºC. Setelah mendidih, bubur onggok didiamkan hingga dingin kemudian dibagi dengan volume per 200 ml ke 126 botol jam yang telah diberi label perlakuan. Menghitung kadar pati pada bubur onggok sebelum melaksanakan hidrolisis bubur onggok.
3. Hidrolisis Tepung Onggok
Menambahkan larutan H2SO4 2M sebanyak 3% dari volume media dengan lama waktu 3 jam, 4 jam, dan 5 jam sesuai perlakuan ke dalam masing-masing bubur onggok. Selanjutnya memasukkan Erlenmeyer berisi bubur onggok tersebut ke dalam autoklaf dengan suhu 121ºC selama 15 menit, kemudian didinginkan. Menghitung kadar pati dan gula total setelah hidrolisis bubur onggok.
Banyaknya H2SO4 2M sebanyak 3% yang akan digunakan ditentukan berdasarkan penelitian Yusrin dkk. (2010) yang memberikan hasil kadar etanol tertinggi pada onggok yaitu sebesar 9,11% dari perlakuan hidrolisis H2SO4 3% selama 3 jam. Penelitian Citra dkk. (2012) yang memberikan hasil kadar etanol tertinggi pada kayu karet yaitu 4,60% yang diperoleh dari perlakuan hidrolisis H2SO4 3%.
4. Fermentasi Tepung Onggok
pati, gula total, pH, asam tertitrasi, dan menghitung jumlah sel Saccharomyces cerevisiae yang tumbuh menggunakan metode plate count.
Lama fermentasi 1,2,3,4,5,6,7 hari ditentukan berdasarkan penelitian Sutiyono dkk. (2013) yang memberikan hasil kadar etanol tertinggi pada onggok yaitu 15,82% diperoleh pada fermentasi 6 hari dengan starter Saccharomyces cerevisiae 10%. Selain lama fermentasi 6 hari, kadar etanol pada penelitian Sutiyono dkk. (2013) juga tidak jauh beda pada perlakuan fermentasi 8 hari yaitu 15,23%. Selanjutnya, penelitian Akyunul (2008) yang memberikan hasil kadar etanol onggok tertinggi yaitu 19% diperoleh dari lama fermentasi 7 hari dengan dosis Saccharomyces cerevisiae 10%.
5. Destilasi
Memisahkan larutan dari residu kemudian memasukkan larutan tersebut ke dalam destilator untuk dihasilkan etanol. Selanjutnya menghitung kadar etanol dari fermentasi hari 1,2,3,4,5,6, dan 7 serta menghitung efisiensi fermentasi.
6. Uji Parameter Penelitian
a. Kadar Gula dan Pati metode Nelson Samogyi
didinginkan sampai mencapai suhu kamar, kemudian ditambahkan 1 ml larutan arsenomolybdat. Larutan sampel digojog, kemudian ditambahkan aquades 7 ml dan digojog lagi. Larutan sampel diukur penyerapan (absorbansi) cahaya tampak (visible) pada panjang gelombang 540 nm. Nilai absorbansi sampel - nilai absorbansi blanko kemudian dikonversi ke mg/ml gula reduksi berdasarkan persamaan regresi senyawa standar (glukosa monohydrat). Kadar gula reduksi adalah kadar gula reduksi tanpa enzim amilase.
Untuk menggambarkan kurva hubungan kadar dan absorbansi, dapat digunakan metode kuadrat terkecil (Least-Square) agar diperoleh garis lurus yang konstan. Metode ini sering digunakan untuk menentukan ketepatan garis yang terbaik pada kurva baku (standar).
Kadar pati = (Kadar gula setelah diberi enzim amilase – kadar gula tanpa enzim amilase) x 0,9.
b. Uji pH dengan pH meter
Pengamatan pH berfungsi sebagai indikator pertumbuhan Saccharomyces cerevisiae. Caranya dengan memasukkan kertas pH ke dalam media fermentasi dan mencocokkan warna yang dihasilkan pada label tempat pH (Lampiran 3.3.a). c. Uji Asam Total (metode Titrasi)
dari pengaruh macam inokulum secara kuantitatif. Asam adalah bentuk lain dari hasil proses sakarifikasi dan fermentasi suatu biomassa. Pada proses sakarifikasi, asam terbentuk bersamaan dengan proses sakarifikasi. Pengamatan dilakukan pada hari 1,2,3,4,5,6,dan 7 dengan menggunakan metode titrasi KOH.
d. Jumlah Sel Saccharomyces cerevisiae
Mengencerkan 1 ml cairan hasil fermentasi secara bertingkat sampai 10-9 ml dengan cara mengambil 1 ml larutan sampel hasil fermentasi kemudian memasukkannya ke dalam botol suntik yang berisi 99 ml aquades steril (pengenceran 10-2). Menggojog sampai homogen. Membuat seri pengenceran kelipatan 10-4 – 10-6 kemudian dilanjutkan dengan pengenceran kelipatan 10-7 sampai 10-8 dengan mengambil 1 ml pada pengenceran sebelumnya ke dalam tabung reaksi yang berisi aquades steril 9 ml. Menyiapkan petridish dengan 3 kali pengulangan untuk setiap pengenceran yang berisi medium MEA kurang lebih 8 ml dan masing-masing diberi label untuk pengenceran 10-7,10-8,10-9 sesuai perlakuan. Menginokulasikan masing-masing suspensi hasil pengenceran 10-7,10 -8
,10-9 sebanyak 0,1 ml pada petridish yang berisi medium. Meratakan suspensi mikrobia dengan menggunakan driglasky steril. Menginokulasikan petridish yang berisi mikrobia pada temperatur kamar (Lampiran 3.3.c), kemudian menghitung jumlah mikrobia yang tumbuh menggunakan metode plate count.
e. Kadar Bioetanol
destilat menunjukkan kadar alkohol pada sampel yang diuji. Tahapan penelitian bioetanol tepung onggok terlampir pada lampiran 3.
E. Parameter yang Diamati 1. Karakterisasi Tepung Onggok
a. Analisa Kadar Protein
b. Analisa Kadar Abu
Keterangan : W2 = berat cawan + 1 gram sampel (g) W3 = berat cawan + sampel dari desikator (g)
c. Analisa Kadar Serat Metode Gravimetri
% serat kasar = [(a-b)/c] x 100%
Keterangan : a = berat kertas saring ditambah sampel kering (g) b = berat kertas saring (g)
c = berat sampel (g) d. Analisa Kadar Air
Keterangan : W1 = berat pengeringan sampel pertama
W2 = berat pengeringan sampel terakhir (konstan) e. Kadar Lemak
Pengujian kadar lemak dilakukan sebelum penelitian/prapenelitian dengan menggunakan rumus :
Keterangan : a = berat selongsong/kertas saring b = berat selongsong dan sampel
c = berat selongsong dan sampel serta kapas
d = kertas saring, sampel, dan kapas beratnya konstan e = berat konstan
f. Kadar Gula dan Pati
Kadar Gula dihitung menggunakan persamaan Least-Square yang menjelaskan satu garis lurus (linier) :
X = aY+b, dengan :
X (absis) = kadar larutan glukosa standar (mg/100 ml) Y (ordinat) = Absorbansi (tanpa enzim amilase)
a dan b = tetapan yang dihitung dari persamaan :
a = –
b = –
dengan
N = Banyaknya pengamatan
Kadar Pati dihitung dengan rumus: (Kadar gula setelah diberi enzim amilase – kadar gula tanpa enzim amilase) x 0,9.
7. Proses Hidrolisis a. Kadar Gula dan Pati
Kadar Gula dihitung menggunakan persamaan Least-Square yang menjelaskan satu garis lurus (linier) :
X = aY+b, dengan :
X (absis) = kadar larutan glukosa standar (mg/100 ml) Y (ordinat) = Absorbansi (tanpa enzim amilase)
a dan b = tetapan yang dihitung dari persamaan :
a = –
b = –
dengan
N = Banyaknya pengamatan
b. Uji Asam Total
Menghitung kadar asam tertitrasi menggunakan rumus :
Keterangan : ml KOH = volume KOH yang digunakan untuk titrasi N KOH = normalitas KOH yang digunakan untuk titrasi BE asam malat = bilangan equivalen asam malat (67)
8. Proses Fermentasi a. Kadar Gula dan Pati
Kadar Gula dihitung menggunakan persamaan Least-Square yang menjelaskan satu garis lurus (linier) :
X = aY+b, dengan :
X (absis) = kadar larutan glukosa standar (mg/100 ml) Y (ordinat) = Absorbansi (tanpa enzim amilase)
a dan b = tetapan yang dihitung dari persamaan :
a = –
b = –
N = Banyaknya pengamatan
Kadar Pati dihitung dengan rumus: (Kadar gula setelah diberi enzim amilase – kadar gula tanpa enzim amilase) X 0,9.
b. Uji Asam Total
Menghitung kadar asam tertitrasi menggunakan rumus :
Keterangan :
c. Uji pH
Menggunakan alat pH meter.
d. Jumlah Sel Saccharomyces cerevisiae
Jumlah sel = (X1 + X2 +…+Xn) : n Keterangan :
X1, X2,…, Xn = jumlah sel terhitung sesuai syarat pada ulangan 1,2,…
hingga ulangan ke n
n = jumlah banyaknya ulangan dengan beberapa syarat :
a. Jumlah koloni tiap cawan petri antara 30-300 koloni.
b. Tidak ada koloni yang menutup lebih besar dari setengah luas cawan (spreader) perbandingan jumlah koloni dari pengenceran berturut-turut antara pengenceran yang lebih besar dari pengenceran sebelumnya. Jika sama atau ebih kecil dari 2 maka hasilnya rata-rata, dan jika lebih besar dari 2 maka yang dipakai adalah jumlah koloni dari hasil pengenceran sebelumnya.
c. Jika dengan ulangan setelah memenuhi syarat maka hasilnya dirata-rata.
e. Uji Kadar Bioetanol
Menggunakan alat Alkoholmeter. Nilai yang terbaca pada alat dicatat dan kadar alkohol
F. Analisis Data
53
IV. HASIL DAN PEMBAHASAN A. Karakterisasi Tepung Onggok
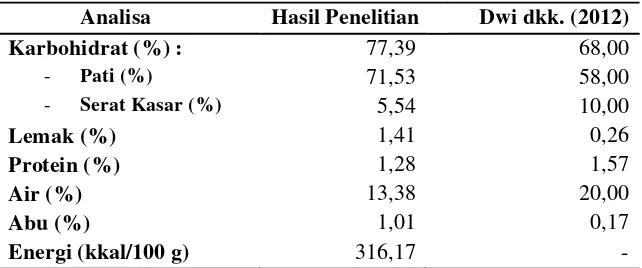
[image:60.612.161.482.383.517.2]Karakterisasi tepung onggok dapat dilakukan dengan menganalisa kandungan atau komponen tepung onggok melalui uji proximat. Analisis proximat adalah suatu metode analisis kimia untuk mengidentifikasi kandungan nutrisi seperti protein, karbohidrat, lemak, pada suatu zat makanan dari bahan pakan atau pangan. Analisis proximat memiliki manfaat sebagai penilaian kualitas pakan atau bahan pangan terutama pada standar zat makanan yang terkandung di dalamnya. Hasil analisis tepung onggok pada penelitian ini tertera pada Tabel 4.
Tabel 1. Hasil Analisis Proximat Tepung Onggok
Analisa Hasil Penelitian Dwi dkk. (2012)
Karbohidrat (%) : 77,39 68,00
- Pati (%) 71,53 58,00
- Serat Kasar (%) 5,54 10,00
Lemak (%) 1,41 0,26
Protein (%) 1,28 1,57
Air (%) 13,38 20,00
Abu (%) 1,01 0,17
Energi (kkal/100 g) 316,17 -
rendah, tidak dapat menunjukkan bahwa hal tersebut merupakan hal yang lebih baik maupun tidak.
Tepung onggok yang digunakan sangat tergantung pada kadar airnya untuk menjaga kuantitas dan kualitas kandungannya. Tepung onggok yang terlalu lembab akan mudah ditumbuhi jamur sehingga menurunkan kuantitas dan kualitas kandungannya. Begitu halnya dengan tepung onggok yang terlalu kering, akan memiliki kuantitas kandungan yang lebih rendah.
Komponen utama yang digunakan sebagai bahan baku pembuatan etanol pada tepung onggok adalah pati. Pati yang dihidrolisis akan berubah menjadi gula. Semakin banyak pati yang terhidrolisis maka akan semakin banyak kadar gula yang diperoleh untuk selanjutnya mengalami proses fermentasi melalui bantuan mikroba fermentatif sehingga menghasilkan bioetanol. Banyaknya fermentasi kadar gula akan mempengaruhi kadar etanol yang dihasilkan.
yang sesuai bagi enzim dapat berfungsi sebagai energi enzim bekerja, diantaranya enzim amilase yang bekerja merombak pati menjadi gula. Meskipun hasil hidrolisis protein bukan berupa gula, namun dengan protein yang banyak terhidrolisis maka energi bagi enzim bekerja juga semakin banyak, sehingga enzim dapat bekerja maksimal sesuai tugasnya. Selanjutnya, kadar abu. Menurut Slamet (1989) abu merupakan zat organik sisa hasil pembakaran bahan organik yang erat kaitannya dengan mineral bahan berupa garam organik dan anorganik, sehingga abu memiliki sifat kondoktivitas (kemampuan menghantarkan panas). Artinya, meskipun abu tidak dapat dijadikan bahan yang dapat dirombak menjadi etanol, namun dengan sifat kondoktivitasnya tersebut, abu dapat membantu mempercepat proses pemasakan tepung onggok menjadi bubur, serta proses hidrolisis untuk membantu memecah rantai kompleks karbohidrat menjadi monomer yang lebih sederhana.
B. Hidrolisis H2SO4
bersifat ramah lingkungan, tidak menghasilkan residu yang mencemari lingkungan, hasil sirup glukosa lebih jernih dan bersih, namun membutuhkan banyak enzim sementara enzim masih import dengan harga relative mahal. Sementara pada hidrolisis asam cenderung bersifat toksik jika dipanaskan mencapai suhu 120-160ºC dan glukosa yang dihasilkan relatif lebih rendah. Namun ketersediaannya tidak perlu import dengan harga lebih terjangkau.
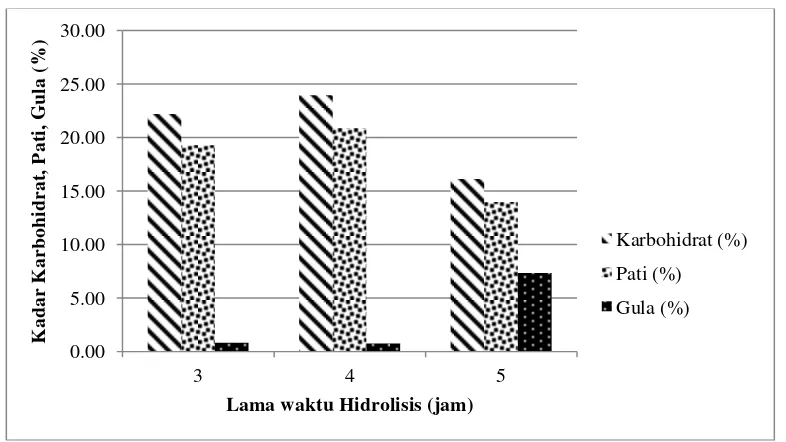
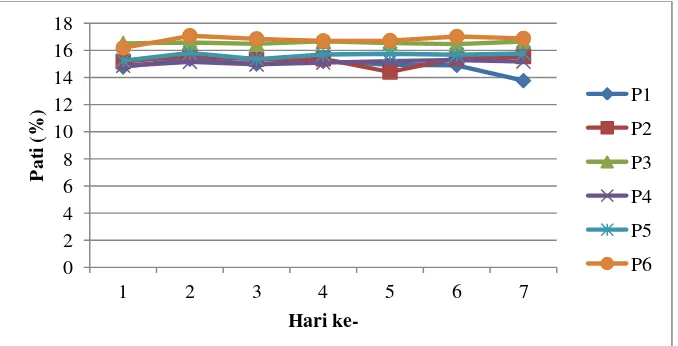
[image:63.612.125.518.330.551.2]Berikut merupakan hasil hidrolisis berupa kadar pati dan kadar gula yang disajikan dalam bentuk persen terhadap jangka lama hidrolisis pada gambar 4 :
Gambar 1. Histogram Hidrolisis H2SO4
Berdasarkan gambar 4 Histogram H2SO4 menunjukkan bahwa gula tertinggi terdapat pada perlakuan hidrolisis 5 jam, yaitu sebesar 7,32%, yang kadarnya lebih tinggi dibanding perlakuan hidrolisis 3 jam dan 4 jam, dengan kadar gula 0,83% dan 0,75%. Paling tingginya kadar gula pada perlakuan hidrolisis 5 jam tersebut
0.00 5.00 10.00 15.00 20.00 25.00 30.00
3 4 5
K a da r K a rbo hid ra t, P a ti, G ula ( %)
Lama waktu Hidrolisis (jam)
Karbohidrat (%)
Pati (%)
disebabkan oleh persentase kadar karbohidrat dan pati paling rendah dibanding perlakuan lain, yang menunjukkan bahwa pada lama hidrolisis 5 jam, jumlah karbohidrat yang terombak menjadi pati lebih banyak dan jumlah pati yang terombak menjadi gula juga lebih banyak dibanding perlakuan lain. Hal tersebut menunjukkan bahwa lama waktu hidrolisis 5 jam merupakan lama waktu terbaik untuk menghidrolisis dibanding lama waktu hidrolisis 3 jam dan 4 jam.
C. Penambahan Molase sebelum Proses Fermentasi
Riswan (2004) molase berupa sejenis sirup yang merupakan sisa dari proses pengkristalan gula pasir. Penambahan molase dengan konsentrasi 10% dan 15% setelah proses hidrolisis H2SO4 pada penelitian ini bertujuan untuk sedikit menaikkan kadar gula yang diperoleh dari hasil hidrolisis H2SO4 sehingga etanol yang diperoleh nanti tidak sepenuhnya merupakan hasil fermentasi gula dari molase, melainkan juga adanya gula dari bahan substitusi molase berupa tepung onggok yang dapat memanfaatkan limbah terbuang secara bijak dan mengatasi permasalahan molase yang persediaannya terbatas.
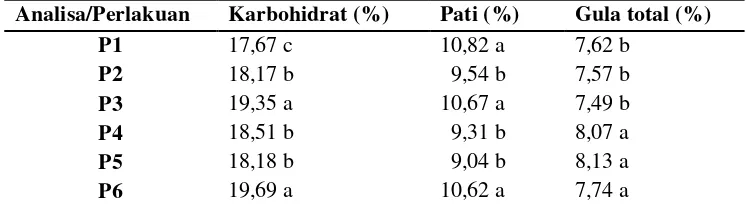
Besarnya peningkatan gula total pada penambahan molase ini dapat dilihat pada tabel 5.
Tabel 2. Rerata Sidik Ragam Uji Karbohidrat, Pati, dan Gula Total Setelah Penambahan Molase
Analisa/Perlakuan Karbohidrat (%) Pati (%) Gula total (%)
P1 17,67 c 10,82 a 7,62 b
P2 18,17 b 9,54 b 7,57 b
P3 19,35 a 10,67 a 7,49 b
P4 18,51 b 9,31 b 8,07 a
P5 18,18 b 9,04 b 8,13 a
P6 19,69 a 10,62 a 7,74 a
Keterangan :angka yang diikuti huruf sama menunjukkan tidak beda nyata P1 = Hidrolisis 3 jam dengan Penambahan Molase 10 %
P2 = Hidrolisis 3 jam dengan Penambahan Molase 15% P3 = Hidrolisis 4 jam dengan Penambahan Molase 10% P4 = Hidrolisis 4 jam dengan Penambahan Molase 15% P5 = Hidrolisis 5 jam dengan Penambahan Molase 10% P6 = Hidrolisis 5 jam dengan Penambahan Molase 15%
Jika dibandingkan dengan kadar karbohidrat, pati, dan gula sebelum dilakukan penambahan molase, berdasarkan tabel 5 penambahan molase menunjukkan adanya penurunan kadar karbohidrat dan pati yang artinya H2SO4 yang diberikan masih aktif menghidrolisis. Selanjutnya terdapat peningkatan gula cukup tinggi sebagai akibat dari hasil hidrolisis pati dan efek penambahan molase.
1. Karbohidrat
molase 15% berbeda nyata dengan perlakuan hidrolisis 3 jam dengan penambahan molase 15%, perlakuan hidrolisis 4 jam dengan penambahan molase 10%, perlakuan hidrolisis 5 jam dengan penambahan molase 10%, serta berbeda nyata juga dengan perlakuan hidrolisis 3 jam dengan penambahan molase 10% (Lampiran 4.1.a).
Perlakuan lama waktu hidrolisis 3 jam molase 10% merupakan perlakuan dengan kadar karbohidrat terendah yaitu sebesar 17,67%. Hal tersebut menunjukkan bahwa jumlah karbohidrat yang terombak pada perlakuan hidrolisis 3 jam molase 10% adalah paling tinggi dibanding perlakuan lain sehingga menyebabkan kadar pati tertinggi pada tabel 5 yaitu 10,82%.
Selanjutnya, jika diperhatikan lebih lanjut, terdapat peningkatan kadar karbohidrat pada proses penambahan molase, yaitu pada perlakuan hidrolisis perlakuan hidrolisis 5 jam molase 10% yaitu dari 16,11% menjadi 18,18% dan perlakuan hidrolisis 5 jam molase 15% dari 16,11% menjadi 19,69%. Hal tersebut dapat terjadi diduga karena adanya proses perubahan bentuk terhidrolisisnya protein dan lemak berupa asam amino dan gliserol lemak menjadi karbohidrat. Winarno (2004) menyebutkan bahwa karbohidrat dapat dibentuk dari beberapa asam amino dan sebagian gliserol lemak.
2. Pati
hidrolisis 3 jam dengan penambahan molase 15%, hidrolisis 4 jam dengan penambahan molase 15%, dan hidrolisis 5 jam dengan penambahan molase 10% (Lampiran 4.1.b).
Berdasarkan tabel 5 kadar karbohidrat terendah ditunjukkan pada perlakuan hidrolisis 3 jam molase 10% sehingga mempengaruhi kadar pati yang dihasilkan tinggi dari banyaknya karbohidrat yang terombak. Perlakuan tersebut juga tidak berbeda nyata dengan perlakuan hidrolisis 4 jam molase 10% dan hidrolisis 5 jam molase 15%. Semakin banyak pati yang dihasilkan dan terombak, mempengaruhi tingginya gula yang dihasilkan.
3. Gula
menunjukkan bahwa lama waktu hidrolisis 5 jam merupakan lama waktu hidrolisis terbaik dibanding lama waktu hidrolisis