Pengaruh Lama Hidrolisis dan Konsentrasi Larutan Pati
pada Pembuatan Sirup Glukosa dari Biji Jagung Muda
secara Hidrolisis Asam
SKRIPSI
RONA MONIKA SIHALOHO
080822007
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
M E D A N
PERSETUJUAN
Nama : RONA MONIKA SIHALOHO
NIM : 080822007
Judul : PENGARUH LAMA HIDROLISIS DAN KONSENTRASI
LARUTAN PATI PADA PEMBUATAN SIRUP GLUKOSA DARI BIJI JAGUNG MUDA SECARA HIDROLISIS ASAM
Jurusan : S1 Kimia Ekstensi
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
Disetujui di,
Medan, Oktober 2009
Mengetahui,
Komisi Pembimbing II, Komisi Pembimbing I,
(Dra. Emma Zaidar, Msi) (Dr. Rumondang Bulan, MS)
NIP. 131 653 985 NIP. 131 459 466
Ketua Departemen Kimia
FMIPA USU,
(Dr. Rumondang Bulan, MS)
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi ini adalah benar – benar hasil kerja saya
sendiri, kecuali ada beberapa kutipan diambil dari berbagai berbagai sumber.
Medan, Oktober 2009
RONA MONIKA SIHALOHO
PENGHARGAAN
Bagi DIA-lah sumber kekuatan dan sumber syukur diatas segala. Terimakasih
banyak penulis ucapkan kepada Tuhan Yesus Kristus, atas kasih dan karunia-Nyalah
sehingga penulis dapat menyelesaikan skripsi ini.
Tak lupa juga penulis sampaikan kepada Ibu Rumondang Bulan selaku dosen
pembimbing I dan Ibu Emma Zaidar Nasution selaku dosen pembimbing II yang telah
banyak membantu penulis dalam membimbing dan mengarahkan penulis mulai dari
penelitian sampai penyusunan skripsi ini, terimakasih juga penulis sampaikan kepada
Bapak dan Ibu dosen jurusan Kimia FMIPA USU, yang telah memberikan ilmu
kepada penulis selama masa kuliah, terimakasih juga penulis sampaikan kepada
semua staff administrasi FMIPA USU yang telah banyak membantu penulis dalam
menyelesaikan segala keperluan administrasi selama kuliah. Tak lupa saya ucapkan
terimakasih banyak yang sebesar – besarnya kepada Ibunda tersayang H. Sinaga yang
telah banyak membantu ku baik dalam memenuhi segala kebutuhan kuliah dan
memberikan doa yang tulus kepada penulis, terimakasih juga saya ucapkan kepada
keluarga ku yang tercinta, yang selalu memberikan dukungan sepenuhnya kepada
penulis, dan saya juga mengucapkan terimakasih banyak kepada semua teman –
teman kuliah ku yang telah memberikan semangat kepadaku selama kuliah, semoga
Pengaruh Lama Hidrolisis dan Konsentrasi Larutan Pati Biji Jagung Muda pada Pembuatan Sirup Glukosa dari Biji Jagung Muda secara Hidrolisis Asam
ABSTRAK
The Influence of Hydrolysis Time and Concentration of Young Corn Starch in The Manufacture of Glucose Syrup from Corn Kernels with Method of
Hydrolysis Acid
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak iv
Abstract v
Daftar Isi vi
Daftar Tabel x
Daftar Gambar xi
Daftar Lampiran xii
Bab 1. Pendahuluan
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Pembatasan Masalah 3
1.4 Lokasi Penelitian 3
1.5 Tujuan Penelitian 3
1.6 Manfaat Penelitian 4
1.7 Metodologi Penelitian 4
Bab 2. Tinjauan Pustaka
2.1 Tanaman Jagung 6
2.1.1 Klasifikasi Jagung 6
2.1.1 Komposisi Biji Jagung 7
2.1.3 Pemanfaatan Biji Jagung 7
2.1.3.1 Pemanfaatan Bidang Non Pangan 7
2.1.3.2 Pemanfaatan Bidang Pangan 8
2.2 Karbohidrat 8
2.2.1 Glukosa 8
2.2.2 Polisakarida 9
2.4 Gula Cair 12
2.4.1 Pemanfaatan Sirup Glukosa 15
2.4.2 Standard Mutu Sirup Glukosa 15
Bab 3. Metodologi Penelitian
3.1 Alat dan Bahan 16
3.1.1 Alat – alat 16
3.1.2 Bahan 17
3.2 Prosedur Penelitian 17
3.2.1 Pembuatan Reagen 17
3.2.1.1 Pembuatan Luff Schrool 17
3.2.1.2 Pembuatan Larutan Standard Na2S2O3 0,1 N 18
3.2.1.3 Pembuatan HCl 3 % 19
3.2.1.4 Pembuatan Indikator Amilum 19
3.2.1.5 Pembuatan H2SO425 % 19
3.2.1.6 Pembuatan Larutan NaOH 1 % 19
3.2.1.7 Pembuatan KI 20 % 19
3.2.2 Pemisahan Pati Jagung 20
3.2.3 Pembuatan Sirup Glukosa 20
3.2.4 Pengukuran Parameter 21
3.2.4.1 Penentuan Kadar Glukosa 21
3.2.4.2 Pembuatan Blanko 21
3.2.4.3 Penentuan Total Padatan Terlarut (Total Soluble Solid = TSS) 22
3.2.4.4 Penentuan Kadar Abu 22
3.2.4.5 Uji Organoleptik Warna 23
3.3 Bagan Penelitian 24
3.3.1 Pemisahan Pati Jagung 24
3.3.2 Pembuatan Sirup Glukosa 25
3.3.3 Penentuan Kadar Glukosa 26
3.3.4 Penentuan Total Padatan Terlarut (Total Soluble Solid = TSS) 27
3.3.5 Penentuan Organoleptik Warna 27
Bab 4. Hasil dan Pembahasan
4.1 Hasil Penelitian 29
4.2 Pengolahan Data 30
4.2.1 Kombinasi Perlakuan (tc) dengan Banyaknya Ulangan (n) 30
4.2.2 Uji Signifikan Data (S) Metode Chauvenent Criterion Test (CCT) 30
4.2.3 Perhitungan Kadar Glukosa 31
4.3 Uji Statistik Analisa Varians (anava) metode Rancangan AcakLengkap (RAL) 32
4.4. Pembahasan 34
4.4.1 Reaksi Hidrolisis Pati menjadi Glukosa 34
4.4.2 Kadar Glukosa 35
4.4.2.1 Pengaruh Kadar Glukosa terhadap Waktu Hidrolisis 35
4.4.2.2 Pengaruh Kadar Glukosa terhadap Konsentrasi Larutan Pati 36
4.4.2.3 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Kadar Glukosa 37
4.4.3 Total Padatan Terlarut(Total Solid Solubility = TSS ) 38
4.4.3.1 Pengaruh Nilai TSS terhadap Waktu Hidrolisis 38
4.4.3.2 Pengaruh Nilai TSS terhadap Konsentrasi Larutan Pati Biji Jagung
Muda 39
4.4.3.3 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Nilai TSS 40
4.4.4 Kadar Abu 41
4.4.4.1 Pengaruh Kadar Abu terhadap Waktu Hidrolisis 41
4.4.4.2 Pengaruh Kadar Abu terhadap Konsentrasi Larutan Pati 42 4.4.4.3 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Kadar Abu 43
4.4.5 Nilai Organoleptik Warna 44
4.4.5.1 Pengaruh Nilai Organoleptik Warna terhadap Waktu Hidrolisis 44
4.4.5.2 Pengaruh Nilai Organoleptik Warna terhadap Konsentrasi Larutan
Pati 45
4.4.5.3 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Bab 5. Kesimpulan dan Saran
5.1 Kesimpulan 47
5.2 Saran 47
Daftar Pustaka 48
DAFTAR TABEL
Halaman
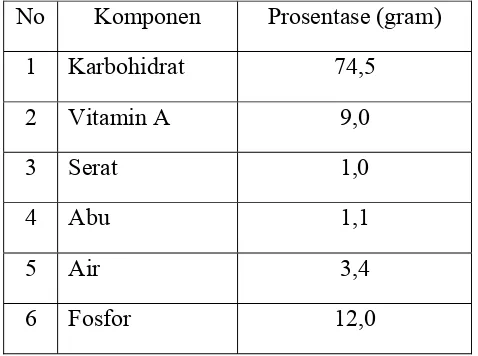
Tabel 2.1 Komposisi Kimia Biji Jagung Muda setiap 100 gram 7
Tabel 2.2 Syarat Mutu Sirup Glukosa 15
Tabel 4.1 Pengaruh Waktu Hidrolisis terhadap Parameter yang diamati 29
Tabel 4.2 Pengaruh Konsentrasi Larutan Pati Biji Jagung Muda terhadap
DAFTAR GAMBAR
Halaman
Gambar 2.1 Struktur Utama Biji Jagung 7
Gambaran proyeksi Haworth struktur glukosa (α-D glukosa) 8
Gambar 2.3 Pembuatan Pati Jagung 11
Gambar 2.4 Skema Pemecahan Zat Pati menjadi Dekstrosa (D-glukosa) dengan
Katalis Asam 14
Gambar 4. 1 Pengaruh Kadar Glukosa terhadap Waktu Hidrolisis 36
Gambar 4.2 Pengaruh Kadar Glukosa terhadap Konsentrasi Larutan Pati 36
Gambar 4.3 Hubungan Pengaruh Interakasi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Kadar Glukosa 37
Gambar 4.4 Pengaruh Nilai TSS terhadap Waktu Hidrolisis 38
Gambar 4.5 Pengaruh Nilai TSS terhadap Konsentrasi Larutan Pati 39
Gambar 4.6 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Nilai TSS 40
Gambar 4.7 Pengaruh Kadar Abu terhadap Waktu Hidrolisis 41
Gambar 4.8 Pengaruh Kadar Abu terhadap Konsentrasi Larutan Pati 42
Gambar 4.9 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Kadar Abu 43
Gambar 4.10 Pengaruh Nilai Organoleptik Warna terhadap Waktu Hidrolisis 44
Gambar 4.11 Pengaruh Nilai Organoleptik Warna terhadap Konsentrasi Larutan Pati 45
Gambar 4.12 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
DAFTAR LAMPIRAN
Halaman
Tabel 1. Data Kadar Glukosa (%) pada Sirup Glukosa dari Biji Jagung Muda 50
Tabel 2. Data Analisa Sidik Ragam Kadar Glukosa (%) 50
Tabel 3. Data Pengamatan Nilai TSS (o Brix) pada Sirup Glukosa dari Biji Jagung
Muda 51
Tabel 4. Data Analisa Sidik Ragam Nilai TSS (oBrix) 51
Tabel 5. Data Kadar Abu (%) pada Sirup Glukosa dari Biji Jagung Muda 52
Tabel 6. Data Analisa Sidik Ragam Kadar Abu (%) 52
Tabel 7. Data Perhitungan Nilai Organoleptik Warna pada Sirup Glukosa dari Biji
Jagung Muda 53
Tabel 8. Data Analisa Sidik Ragam Organoleptika Warna 53
Tabel 9. Data Standard Kadar Luff Schrool 54
Pengaruh Lama Hidrolisis dan Konsentrasi Larutan Pati Biji Jagung Muda pada Pembuatan Sirup Glukosa dari Biji Jagung Muda secara Hidrolisis Asam
ABSTRAK
The Influence of Hydrolysis Time and Concentration of Young Corn Starch in The Manufacture of Glucose Syrup from Corn Kernels with Method of
Hydrolysis Acid
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Pada saat ini pemerintah menghimbau masyarakat dan pengusaha untuk
meningkatkan ekspor non migas sebagai sumber devisa negara. Sangat diharapkan
dari sektor pertanian, hal ini disebabkan karena Indonesia adalah negara agraris. Pada
umumnya hasil pertanian sangat mudah mengalami kerusakan dan tidak tahan lama
disimpan, sehingga produksi yang tinggi tidak menjamin kenaikan pendapatan petani.
Tidak jarang produksi tersebut rusak sebelum dipasarkan. Disamping mudah
mengalami kerusakan, harganya juga relatif murah karena pemasarannya kebanyakan
hanya dalam bentuk bahan baku. (Rukmana, R.,1997)
Dalam program Gema Pelagung 2006 menyatakan produksi jagung tahun
2004 sebesar 11 juta ton, 2005 sebesar 11,5 juta ton dan 2006 telah mencapai 12 juta
ton. Target produksi telah dicapai maka akan ada kelebihan produksi untuk ekspor.
Thailand dan Malaysia merupakan 2 negara tujuan ekspor jagung tersebut. Hal lain
yang mendorong petani menanam jagung adalah jaminan harga yang cukup baik.
Melemahnya rupiah terhadap dollar AS menyebabkan harga jagung impor relatif lebih
mahal dibandingkan harga jagung dalam negeri. Akibatnya produksi jagung dalam
negeri akan terserap pasar (Adisarwanto, T., 1999).
Untuk meningkatkan nilai tambah dari hasil pertanian perlu dilakukan
pengolahan untuk memperoleh bahan setengah jadi menjadi bahan jadi. Seperti
jagung, selama ini kebanyakan digunakan sebagai bahan pakan ternak, tepung jagung,
emping dan untuk berbagai jenis masakan. Untuk mendapatkan nilai ekonomi jagung
yang lebih tinggi, jagung dapat diolah menjadi sirup glukosa.
Sirup glukosa adalah suatu larutan kental termasuk golongan monosakarida
yang diperoleh dari pati dengan cara hidrolisis dengan katalis asam atau katalis
enzime, selanjutnya dimurnikan serta dikentalkan. (Kirk, R.E.,1949). Keuntungan
gula yang lebih tinggi dibandingkan dengan proses dengan katalis enzime.
Penggunaan katalis enzime tingkat hidrolisisnya terbatas sesuai dengan kemampuan
enzime yang dipergunakan sehingga untuk memperoleh nilai derajat konversi yang
lebih tinggi, katalisnya harus digantikan dengan enzym yang sesuai derajat dekstrosa
larutan sampel. (Meyer, L.H.,1970)
Menurut Ida Bagus (1969), asam yang digunakan dalam proses hidrolisis
adalah asam kuat seperti HCl, H2SO4. Bila proses hidrolisis menggunakan katalis HCl maka sirup yang dihasilkan dapat dinetralkan dengan larutan soda abu (Na2CO3). Jumlah garam NaCl yang terbentuk relatip kecil dan biasanya dibiarkan dalam larutan
karena tidak mempengaruhi rasa sirup yang dihasilkan. Menurut Stout dan Ryberg
(1939), konsentrasi pati yang terbaik adalah 10 % sampai 20 % larutan pati, untuk
waktu hidrolisis yang baik tidak lebih dari 180 menit. Semakin tinggi konsentrasi pati
yang digunakan, semakin singkat waktu yang dipergunakan untuk proses hidrolisis.
Bila hidrolisis terlalu singkat maka pengamatan terhadap hasil yang diperoleh sukar
dilakukan.
Pemilihan biji jagung muda sebagai bahan dasar pembuatan sirup glukosa
karena biji jagung muda lebih banyak mengandung karbohidrat, vitamin A dan fosfor
yang cukup tinggi dibandingkan biji jagung tua. (http://ianrpubs.unl.edu/fieldcrops/).
Oleh sebab itu, dalam kesempatan ini penulis berkeinginan untuk melakukan
penelitian yang berjudul : ’’ Pengaruh Lama Hidrolisis dan Konsentrasi Larutan Pati
pada Pembuatan Sirup Glukosa dari Biji Jagung Muda secara Hidrolisis Asam ’’.
1.2 Permasalahan
Di Indonesia, khususnya di kota Medan, pada dasarnya masyarakat setempat belum
memanfaatkan biji jagung secara maksimal. Pada umumnya lebih banyak digunakan
sebagai pakan ternak, tepung jagung, emping dan untuk berbagai jenis masakan,
sehingga timbul permasalahan bagaimana memberi variasi pada pemanfaatan biji
jagung yang memberikan nilai ekonomi yang lebih tinggi dan mengandung zat gizi
yang diperlukan oleh tubuh. Dalam hal ini penulis ingin memanfaatkan biji jagung
waktu hidrolisis dan variasi konsentrasi larutan pati dalam pembuatan sirup glukosa
dari biji jagung.
1.3 Pembatasan Masalah
Dalam penelitian ini permasalahan dibatasi pada :
1. Bahan baku adalah biji jagung muda (jenis baby corn) yang diambil dari
Sinaksak Pematangsiantar.
2. Hidrolisis asam menggunakan HCl 3 %.
3. Parameter yang dianalisa dalam pembuatan sirup glukosa adalah kadar
glukosa, nilai total padatan terlarut (total solid solubility = TSS ), kadar abu
dan nilai organoleptik warna.
4. Variasi konsentrasi larutan pati per 200 ml larutan terdiri dari 4 tahap, yaitu :
K1 = 10 gram; K2 = 20 gram; K3 = 30 gram dan K4 = 40 gram.
5. Variasi waktu hidrolisis terdiri dari 4 tahap, yaitu : H1 = 1 jam; H2 = 1,5 jam; H3 = 2 jam dan H4 =2,5 jam.
6. Larutan pentiter yang digunakan adalah Na2S2O3 0,1 N 7. Indikator yang digunakan adalah larutan amilum.
1.4 Lokasi Penelitian
Penelitian dilakukan di :
1. Laboratorium Biokimia / Kimia Bahan Makanan FMIPA USU Medan
2. Laboratorium Kimia Analitik FMIPA USU Medan
1.5 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
Untuk mengetahui pengaruh waktu hidrolisis dan konsentrasi larutan pati terhadap
1.6 Manfaat Penelitian
Melalui penelitian ini, diharapkan akan diperoleh pemecahan masalah penganeka
ragaman hasil olahan biji jagung muda dengan nilai ekonomi yang lebih tinggi
sekaligus dapat menambah penghasilan masyarakat petani.
1.7 Metodologi Percobaan
Penelitian ini bersifat eksperimen laboratorium. Dengan menggunakan 3 variabel
yaitu variabel tetap, variabel bebas dan variabel terikat.
1. Variabel tetap meliputi : jenis sampel, temperatur, pH, konsentrasi asam.
2. Variabel bebas meliputi : massa pati, lama hidrolisis.
3. Variabel terikat meliputi : kadar gula (%), kadar abu (%), nilai total padatan
terlarut (total solid solubility = TSS) (o Brix) dan nilai organoleptik warna.
1.7.1 Pemisahan Pati Jagung
Biji jagung muda (300 gram) dicuci, diblender dan ditambahkan air bersih (200 ml).
Kemudian diremas dan disaring dengan menggunakan kain saring. Ditambah air
bersih (100 ml) pada ampas hasil penyaringan kemudian diblender kembali serta
diremas dan disaring. Filtrat akhir yang diperoleh dicampur dengan filtrat yang
diperoleh semula, kemudian diendapkan selama 24 jam, kemudian dipisahkan pati
dengan larutan. Diambil patinya lalu dikeringkan dibawah sinar matahari selama ± 48
jam, kemudian dikeringkan dalam oven pada suhu 80oC sampai kadar air pati 10 %.
1.7.2 Pembuatan Sirup Glukosa
Pati biji jagung muda ditimbang 10 gram, kemudian dimasukkan ke dalam erlenmeyer
dan ditambah 200 ml air panas kemudian dipanaskan sambil diaduk selama ± 1 jam
sampai terbentuk larutan pati kental berwarna kuning. Ditambah HCl 3 % sampai
pH = 6,5 - 6,8 dan disaring. Filtrat yang diperoleh diuapkan sampai diperoleh larutan
kental. Dilakukan perlakuan yang sama terhadap pati 20 gram, 30 gram dan 40 gram
dengan lama hidrolisis 1 jam; 1,5 jam; 2 jam dan 2,5 jam. Kemudian dilakukan
pengukuran parameter terhadap :
1. Penentuan kadar glukosa dengan menggunakan metode Luff Schrool.
2. Penentuan kadar abu dilakukan dengan metode pengabuan dalam tanur.
3. Pengukuran nilai TSS dilakukan dengan menggunakan handrefraktometer.
BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Jagung
Sumber genetik (plasma nutfah) tanaman jagung berasal dari benua Amerika. Konon,
bentuk liar tanaman jagung disebut pod maize, telah tumbuh 4.500 tahun yang lalu di
pegunungan Andes, Amerika Selatan. Literatur lain menyebutkan bahwa jagung
tumbuh subur di kawasan Meksiko, kemudian menyebar ke Amerika Tengah dan
Amerika Selatan.
Linnaeus (1737), seorang ahli botani memberikan nama Zea mays untuk
tanaman jagung. Zea berasal dari bahasa Yunani yang digunakan untuk
mengklasifikasikan jenis padi – padian. Adapun mays berasal dari bahasa indian yaitu
Mahiz atau Marisi yang kemudian digunakan untuk sebutan spesies. Sampai sekarang
nama latin jagung Zea mays.
2.1.1 Klasifikasi Jagung
Dalam sistematika (taksonomi) tumbuhan, kedudukan tanaman jagung dapat
diklasifikasikan sebagai berikut :
Kingdom : Plantae (tumbuh – tumbuhan)
Divisi : Spermatophyta (tumbuhan berbiji)
Subdivisi : Angiospermae (berbiji tertutup)
Kelas : Monocotyledonae (biji berkeping satu)
Ordo : Poales
Famili : Poaceae
Genus : Zea
Spesies : Zea mays
2.1.2 Komposisi Biji Jagung
Biji jagung terdiri dari kulit ari (pericarp), lembaga (germ), tip cap dan endosperma.
Sebagian besar pati (85 %) terdapat pada endosperma. Pati terdiri dari raksi
amilopektin (73 %) dan amilosa (27 %). Serat kasar terutama terdapat pada kulit ari.
Komponen utama serat kasar adalah hemiselulosa (41,16 %). Gula terdapat pada
lembaga (57 %) dan endosperma (15 %). Protein sebagian besar terdapat pada
endosperma.
Gambar 2.1 Struktur Utama Biji Jagung
Sumber : www.warintek.ristek.go.id/pangan/umum/tanaman_penghasil_pati.
Tabel 2.1 Komposisi Kimia Biji Jagung Muda Setiap 100 gram
No Komponen Prosentase (gram)
1 Karbohidrat 74,5
2 Vitamin A 9,0
3 Serat 1,0
4 Abu 1,1
5 Air 3,4
6 Fosfor 12,0
Sumber : http://ianrpubs.unl.edu/fieldcrops/g1115.html
2.1.3 Pemanfaatan Biji Jagung
2.1.3.1 Pemanfaatan Bidang Non Pangan
Biji jagung muda yang biasanya dimasak untuk menjadi makanan, ternyata punya
manfaat lain yaitu sebagai penghilang bercak-bercak hitam pada wajah akibat bekas
jerawat atau penyakit cangkrang. (www.digilib.ui.ac.id/abstrakpdf)
Belakangan ini biji jagung mulai dioperasikan sebagi bahan yang berpotensi sebagai
2.1.3.2 Pemanfaatan Bidang Pangan
Biji jagung biasa digunakan untuk tujuan utama: sebagai bahan makanan pokok
terutama di daerah tropis, makanan untuk ternak hewan dan unggas, terutama di
negara-negara industri di daerah temperate, dan sebagai bahan baku untuk banyak
hasil-hasil industri. Hasil industri utama berupa tepung jagung, minyak jagung, sirup.
(www.bdpunib.org/akta/artikelakta/EdisiKhusus2007/pemanfaatan biji jagung)
2.2 Karbohidrat
Karbohidrat merupakan komponen pangan yang menjadi sumber energi utama dan
sumber serat makanan. Komponen ini disusun oleh 3 unsur utama, yaitu karbon (C),
hidrogen (H) dan oksigen (O). Jenis – jenis karbohidrat sangat beragam dan mereka
dibedakan satu dengan yang lain berdasarkan susunan atom – atomnya, panjang /
pendeknya rantai serta jenis ikatan akan membedakan karbohidrat yang satu dengan
lainnya. Dari kompleksitas strukturnya dikenal kelompok karbohidrat sederhana
(seperti monosakarida dan disakarida) dan karbohidrat dengan struktur yang kompleks
atau polisakarida (seperti pati, glikogen, selulosa dan hemiselulosa).
(http ://www.chem-is-try.org).
2.2.1 Glukosa
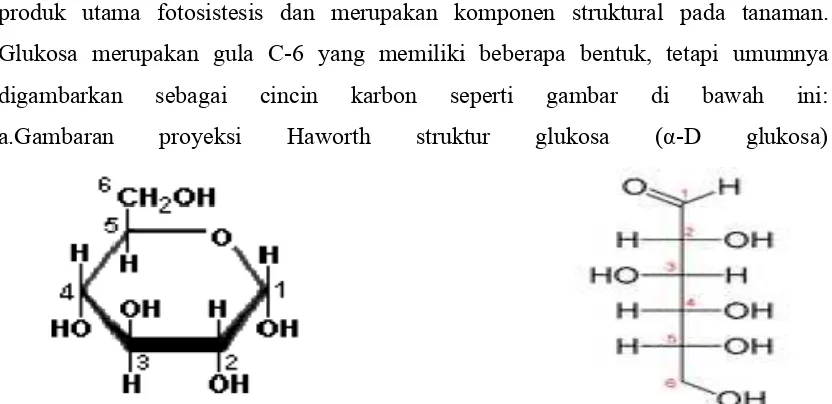
Glukosa (C6H12O6) adalah gula sederhana (monosakarida). Glukosa adalah salah satu produk utama fotosistesis dan merupakan komponen struktural pada tanaman.
Glukosa merupakan gula C-6 yang memiliki beberapa bentuk, tetapi umumnya
digambarkan sebagai cincin karbon seperti gambar di bawah ini:
a.Gambaran proyeksi Haworth struktur glukosa (α-D glukosa)
Untuk mengetahui jumlah gula reduksi dapat dilakukan dengan metode Luff
Schoorl, yang ditentukan bukan kuprooksida yang mengendap tetapi dengan
menentukan kuprioksida dalam larutan sebelum direaksikan dengan sampel gula
reduksi (titrasi sampel). Penentuannya dengan titrasi menggunakan Na-tiosulfat.
Selisih titrasi blanko dengan titrasi sampel ekuivalen dengan kuprooksida yang
terbentuk dan juga ekuivalen dengan jumlah gula reduksi yang ada dalam bahan /
larutan. Reaksi yang terjadi selama penentuan karbohidrat dengan cara ini mula –
mula kuprioksida yang ada dalam reagen akan membebaskan iod dari garam
K-iodida. Banyaknya iod yang dibebaskan ekuivalen dengan banyaknya kuprioksida.
Banyaknya iod dapat diketahui dengan titrasi dengan menggunakan Na-tiosulfat.
Untuk mengetahui bahwa titrasi sudah cukup maka diperlukan indikator amilum.
Apabila larutan berubah warnanya dari biru menjadi putih berarti titrasi sudah selesai.
Agar perubahan warna dari biru menjadi putih dapat tepat maka penambahan amilum
dapat dilakukan pada saat titrasi hampir selesai. Reaksi yang terjadi dalam penentuan
gula dengan cara Luff Schoorl dapat dituliskan sebagai berikut :
R – COH + CuO Cu2O + R – COOH (endapan)
H2SO4 + CuO CuSO4 + H2O CuSO4 + 2KI CuI2 + K2SO4 2 CuI2 + I- CuI2 + I2 I2 + Na2S2O3 Na2S4O6 + NaI I2 + amilum biru
Gula reduksinya dapat ditentukan dengan menggunakan tabel gula reduksi.
(Sudarmadji, S., 1989).
2.2.2 Polisakarida
Polisakarida adalah karbohidrat kompleks yang tidak larut dalam air, berwujud bubuk
putih, tawar dan tidak berbau, (seperti pati). Pati merupakan bahan utama yang
dihasilkan oleh tumbuhan untuk menyimpan kelebihan glukosa (sebagai produk
fotosintesis) dalam jangka panjang. Pati tersusun oleh amilosa dan amilopektin.
monomernya. Tiap-tiap monomer terhubung dengan ikatan 1,6-glikosidik. Amilosa
merupakan polimer tidak bercabang yang bersama-sama dengan amilopektin menjadi
komponen penyusun pati. Amilopektin merupakan polisakarida yang tersusun dari
monomer α-glukosa (dibaca: alfa glukosa). Amilopektin merupakan molekul raksasa dan mudah ditemukan karena menjadi satu dari dua senyawa penyusun pati,
bersama-sama dengan amilosa. Walaupun tersusun dari monomer yang bersama-sama, amilopektin
berbeda dengan amilosa, yang terlihat dari karakteristik fisiknya. Secara struktural,
amilopektin terbentuk dari rantai glukosa yang terikat dengan ikatan 1,6-glikosidik,
sama dengan amilosa. Namun demikian, pada amilopektin terbentuk cabang-cabang
(sekitar tiap 20 mata rantai glukosa) dengan ikatan 1,4-glikosidik. Pemisahan antar
fraksi amilosa dan amilopektin dapat menggunakan elektrodiase atau dengan
n-butanol atau thymol. Amilopektin larut dalam n-n-butanol sedangkan amilosa tidak
larut. Amilosa memberikan warna biru dengan larutan iodin dan amilopektin
memberikan warna merah violet.
(http://www.scientificpsychic.com/fitness/carbohydrates.html)
Karbohidrat golongan polisakarida akan memberikan reaksi dengan larutan
iodin dan memberikan warna spesifik bergantung pada jenis karbohidratnya. Amilosa
dengan iodin akan berwarna biru; Amilopektin dengan iodin akan memberikan warna
merah violet; glikogen maupun dekstrin dengan iodin akan berwarna merah coklat.
(Sudarmadji, S., 1989).
2.3 Pembuatan Pati
Menurut Holleman dan Aten (1956), secara garis besarnya proses pembuatan pati
terbadi atas beberapa fase :
Penghancuran sel – sel dan pemisahan butir – butiran pati dari benda lain yang tidak larut. Fase ini meliputi waktu pengupasan, pencucian dan pemarutan
sampel dari bahan yang mengandung karbohidrat.
Mengurangi air yang terkandung dalam pati basah dangan cara menebarkan pati tersebut pada tampi – tampi bambu dan kemudian menjemurnya dibawah
sinar matahari atau dikeringkan dengan alat pengering. Menggiling tapioka yang masih kasar dan pengayakan.
Pengendapan bertujuan untuk memisahkan pati dari benda – benda bukan pati seperti
protein, lemak dan lain – lain. Pada waktu proses pengendapan ini berlangsung, akan
terjadi juga perubahan kimia dan biokimia yang disebabkan oleh adanya kegiatan
enzime dan mikroorganisme. (Ciptadi, W., 1976).
Tujuan dari pengeringan adalah mengurangi kadar air sampai batas dimana
perkembangan mikrobia yang dapat menyebabkan pembusukan terhambat atau
terhenti dan mencegah perubahan – perubahan yang diakibatkan oleh kegiatan
enzime. (Allister, M., 1975). Tetapi pada umumnya untuk pengeringan pati ditetapkan
sampai kadar air 14,5 – 17 %. Kadar air yang terlalu tinggi akan memudahkan
tumbuhnya jamur dan berbau sehingga tepung menjadi rusak dan kwalitasnya
menurun. Pati dengan kadar air 10 % dipergunakan dalam pembuatan gula cair
(sirup).
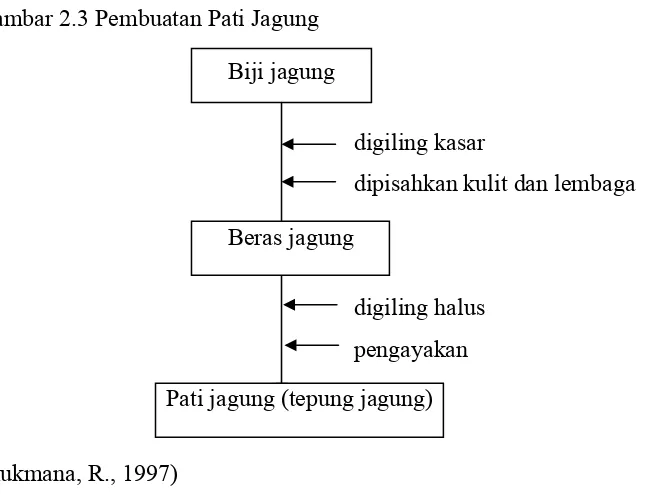
Gambar 2.3 Pembuatan Pati Jagung
digiling kasar
dipisahkan kulit dan lembaga
digiling halus
pengayakan
(Rukmana, R., 1997)
Biji jagung
Beras jagung
2.4 Gula Cair
Umumnya gula cair dikenal masyarakat dengan nama ” Sirup glukosa atau Sirup
Fruktosa ” (Anonymous., 1977). Sirup glukosa ialah suatu larutan kental termasuk
golongan monosakarida yang diperoleh dari pati dengan cara hidrolisis lengkap
dengan menggunakan katalis asam atau enzime, selanjutnya dimurnikan serta
dikentalkan. Untuk memperoleh gula cair dapat ditempuh dengan jalan memasak pati
ke dalamnya ditambahkan sejumlah kecil zat kimia (HCl) selama beberapa jam.
Dengan pemasakan itu akan diperoleh suatu cairan yang rasanya manis, yang
disebabkan karena sebagian besar dari pati yang ada telah diubah menjadi gula
(glukosa). Selain cara tersebut, pembuatan gula cair dari pati atau tepung dapat
mempergunakan mikroorganisme (yeast) dan proses ini disebut peragian. Kedua cara
tersebut akan menghasilkan gula yaitu cairan yang dapat langsung dikonsumsi dalam
bentuk sirup (sirup glukosa). (Anonymous., 1977)
Sirup ini bukanlah suatu produk yang murni, tetapi merupakan campuran
antara glukosa, maltosa dan dekstrin, sehingga mempunyai derajat kemanisan yang
lebih rendah dibandingkan dengan glukosa atau sukrosa murni. (Kirk, R.E., 1949).
Mutu Sirup glukosa ditentukan oleh kadar bahan kering, kadar abu, warna dan
kejernihan. Sirup glukosa yang bermutu tinggi mempunyai kadar abu serendah
mungkin dan warna yang bening serta jernih (seperti air). (Anonymous., 1977)
Menurut Noller (1966) komponen heksosa dapat menghasilkan hidroksi metil
fulfural dan asam levulinat. Bila sirup glukosa / gula cair dipanaskan dalam
lingkungan asam dan pada waktu hidrolisis lebih dari 2 jam, maka akan terbentuk
hidroksi metil fulfural yang menyebabkan warna kekuning – kuningan pada sirup
glukosa / gula cair, disamping itu dapat juga terjadi peristiwa ” browning =
Reaksi pembentukan hidroksi metil fulfural adalah sebagai berikut :
Pembuatan sirup glukosa pada prinsipnya dilakukan dengan dua cara, yaitu:
1. Proses hidrolisis pati dengan katalis asam.
2. Proses hidrolisis pati dengan katalis enzime.
Kedua cara hidrolisis diatas mempunyai keuntungan dan kerugian. Keuntungan
hidrolisis dengan katalis asam yaitu dapat menghasilkan derajat konversi pati menjadi
gula yang lebih tinggi daripada proses katalis enzime, sedangkan keuntungan
hidrolisis enzimatik adalah karena dapat mencegah kehilangan flavour dan warna
sirup. Pada hidrolisis enzime tingkat hidrolisisnya terbatas sesuai dengan kemampuan
enzime yang dipergunakan sehingga untuk memperoleh nilai derajat konversi yang
lebih tinggi, katalisnya harus diganti dengan enzime lain yang sesuai dengan derajat
dekstrosa larutan (D-glukosa). (Meyer, L.H.,1970). Bila pada proses hidrolisis
dengan air kapur (Ca(OH)2). Bila pada proses hidrolisis digunakan katalis asam klorida (HCl) maka sirup yang dihasilkan dapat dinetralkan dengan larutan soda abu
(Na2CO3) atau natrium karbonat. Jumlah garam NaCl yang terbentuk relatif kecil dan biasanya dibiarkan dalam larutan karena tidak mempengaruhi rasa sirup yang
dihasilkan. (Greenwood, C.T., 1964)
Menurut Mac Allister (1975), proses penetralan dapat dilakukan secara
“Batch” maupun kontiniu dengan penambahan Na2CO3 sehingga diperoleh larutan dengan pH 4,5 - 5. Pada hasil penelitian dengan Na2CO3 disamping terbentuk garam
NaCl juga terbentuk gas CO2 yang harus segera diuapkan untuk mencegah pembentukan busa. (Brautlecht, C.A., 1953). Filtrat hasil penyaringan diuapkan di
dalam evaporator pada kondisi suhu 80oC dan tekanan rendah antara 0,78 – 0,80 atm selama 1 jam dari proses ini dihasilkan sirup glukosa yang encer, pada skala
laboratorium, penguapan dilakukan pada suhu 80oC dengan bantuan pompaa vakum atau pompa isap. (Anonymous., 1976). Pada proses perubahan pati oleh aktifitas asam
untuk menghasilkan glukosa terdapat variasi waktu, temperatur dan tekanan, jenis
asam dan kepekatan asam serta tergantung pada sifat dari bahan baku dan hasil yang
diinginkan. (Othmer, D.P., 1949)
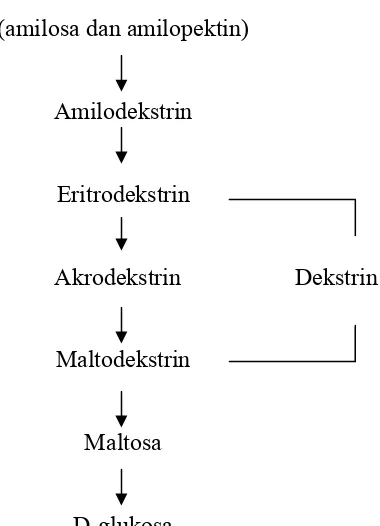
Zat pati
(amilosa dan amilopektin)
Amilodekstrin
Eritrodekstrin
Akrodekstrin Dekstrin
Maltodekstrin
Maltosa
D-glukosa
Gambar 2.4 Skema Pemecahan Zat Pati menjadi Dekstrosa (D-glukosa) dengan
2.4.1 Pemanfaatan Sirup Glukosa
Sirup glukosa (gula cair) banyak digunakan dalam pembuatan bon – bon, es krim,
pengolahan buah – buahan, campuran obat – obatan, campuran tembakau, campuran
semir sepatu, pembuatan sabun, pembuatan perekat dan sebagainya. Penggunaannya
tergantung kadar dekstrosa (D-glukosa) dan kemurnian sirup. (Jacobs, M.B.,1944)
2.4.2 Standard Mutu Sirup Glukosa
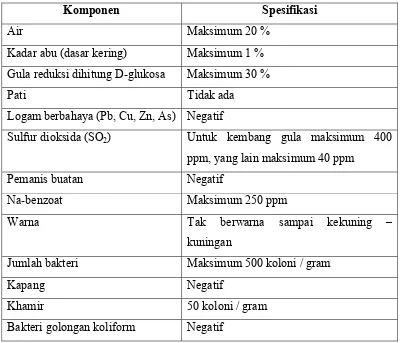
Tabel 2.2 Syarat mutu sirup glukosa :
Komponen Spesifikasi
Air Maksimum 20 %
Kadar abu (dasar kering) Maksimum 1 %
Gula reduksi dihitung D-glukosa Maksimum 30 %
Pati Tidak ada
Logam berbahaya (Pb, Cu, Zn, As) Negatif
Sulfur dioksida (SO2) Untuk kembang gula maksimum 400
ppm, yang lain maksimum 40 ppm
Pemanis buatan Negatif
Na-benzoat Maksimum 250 ppm
Warna Tak berwarna sampai kekuning –
kuningan
Jumlah bakteri Maksimum 500 koloni / gram
Kapang Negatif
Khamir 50 koloni / gram
Bakteri golongan koliform Negatif
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat – Alat
─ Termometer Fisher
─ Kapas penyumbat
─ Buret Pyrex
─ Labu erlenmeyer Pyrex
─ Labu ukur Pyrex
─ Labu leher dua Pyrex
─ Stop watch
─ Blender Philips
─ Corong Pyrex
─ Baskom
─ Penangas air Fisons
─ Oven Memmert
─ Gelas ukur Pyrex
─ Neraca analitik Mettler Toledo
─ Botol akuades
─ Batang pengaduk
─ Kain panjang
─ Kompor
─ Karet dan plastik
─ Statif dan klem
─ Handrefraktometer
─ Pisau
─ Indikator universal
─ Batu didih
─ Desikator
─ Gelas beaker Pyrex
─ Pendingin balik
─ Aluminium foil
─ Hot plate Fisher
─ Kertas saring Whatman no. 42
3.1.2 Bahan
─ Biji jagung muda
─ Akuades
─ Larutan Luff Schrool
─ HCl (p) p.a.(E.Merck)
─ NaOH p.a.(E.Merck)
─ Na2CO3anhidrat p.a.(E.Merck)
─ KI p.a.(E.Merck)
─ Na2S2O3 0,1 N p.a.(E.Merck)
─ H2SO4 p.a.(E.Merck)
─ Larutan kanji p.a.(E.Merck)
─ Pb(CH3COO)2 netral p.a.(E.Merck)
─ CuSO4. 5H2O p.a.(E.Merck)
3.2 Prosedur Penelitian
3.2.1 Pembuatan Reagen
3.2.1.1 Pembuatan Larutan Luff Schrool
Larutkan 143,8 gram Na2CO3 anhidrat dalam 300 ml akuades. Sambil diaduk ditambahkan 50 gram asam sitrat yang telah dilarutkan dengan 50 ml akuades.
Tambahkan 25 gram CuSO4. 5H2O yang telah dilarutkan dengan 100 ml akuades. Pindahkan larutan tersebut ke dalam labu ukur 1000 ml, tepatkan sampai tanda garis
Pengecekan Ketelitian Larutan Luff Scrhool :
1. Larutan Luff Scrhool 10 ml dimasukkan ke dalam labu ukur 100 ml,
kemudian ditambahkan akuades sampai garis tanda, dan dihomogenkan.
2. Dari pengenceran larutan Luff Scrhool dimasukkan sebanyak 10 ml ke
dalam erlenmeyer.
3. Ditambahkan 25 ml KI 3 %.
4. Ditambahkan 25 ml H2SO4 25 %. 5. Titrasi dengan Na2S2O3 0,1 N
6. Ditambah 2 tetes larutan amilum pada saat mendekati titik akhir titrasi
(iod berwarna kuning muda).
7. Dititrasi kembali dengan Na2S2O3 0,1 N sampai warna biru hilang.
Catatan : Larutan Luff Scrhool dikatkan standard jika volume Na2S2O3 0,1 N yang dibutuhkan sebanyak 25 ml (sesuai tabel Luff Scrhool).
3.2.1.2 Pembuatan Larutan Standard Na2S2O3 0,1 N
Ditimbang kasar (dengan neraca analitis) sebanyak 6,2 gram Na2S2O3 .5H20, kemudian larutkan dengan akuades dingin (setelah didihkan) ke dalam labu ukur 500
ml, biarkan semalam, saring dan ambil larutan jernih. Tambahkan 0,2 gram Na2CO3 (sebagai pengawet) per 25 gram Na2S2O3 dan simpan dalam botol yang bersih.
Standarisasi Na2S2O3 0,1 N :
1. Larutkan 5 gram KI dan 4 gram NaHCO3 ke dalam gelas erlenmeyer yang berisi 300 ml akuades.
2. Kemudian tambahkan HCl 1 M perlahan – lahan sambil digoyang
sampai tidak ada lagi CO2(g) yang keluar, lanjutkan penambahan HCl sebanyak 10 ml.
3. Tambahkan 25 ml K2Cr2O7 0,1 N; goyang perlahan gelasnya (agar homogen); kemudian diamkan selama 10 menit.
4. Turunkan larutan pentiter Na2S2O3; tepat berwarna kuning muda, tambahkan 2 tetes indikator amilum dan teruskan pentitrasian secara
perlahan. Hentikan tepat warna biru hilang dan warna hijau muda (dari
3.2.1.3 Pembuatan HCl 3 %
Diencerkan 6,9 ml HCl (p) ke dalam labu ukur 100 ml, ditambah akuades sampai garis tanda, kemudian dihomogenkan.
3.2.1.4 Pembuatan Indikator Amilum A. NaCl (saring dahulu) 500 ml
Asam asetat glasial 80 ml
Akuades 20 ml
Campurkan ketiga bahan tersebut ke dalam gelas beaker 1000 ml.
B. Amilum 3 gram
Masukkan amilum (bagian B) sambil diaduk ke dalam campuran A, tutup gelas
beaker lalu panaskan sampai mendidih, dan teruskan pendidihan selama 2 menit
sampai larutan bening, lalu dinginkan. Simpan dalam botol bersih.
3.2.1.5 Pembuatan Larutan H2SO4 25 %
Diencerkan 16,4 ml H2SO4 (p) ke dalam labu ukur 100 ml, ditambah akuades sampai garis tanda, kemudian dihomogenkan.
3.2.1.6 Pembuatan Larutaan NaOH 1 %
Dilarutkan 1 gram NaOH ke dalam labu ukur 100 ml, ditambah akuades sampai garis
tanda, kemudian dihomogenkan.
3.2.1.7 Pembuatan Larutan KI 20 %
Dilarutkan 20 gram KI ke dalam labu ukur 100 ml, ditambahkan akuades sampai garis
3.2.2 Pemisahan Pati Jagung
─ Biji jagung muda (300 gram), dicuci, dan diblender serta ditambah air bersih (200 ml).
─ Diremas dan diperas dengan menggunakan kain saring.
─ Ditambahkan air bersih (100 ml) pada ampas hasil penyaringan.
─ Diblender dan diperas kembali.
─ Diendapkan suspensi selama 24 jam.
─ Dipisahkan pati dari airnya.
─ Dikeringkan pati yang didapat dibawah sinar matahari selama ± 48 jam.
─ Dikeringkan kembali dalam oven pada suhu 80oC hingga kadar air pati 10 %.
3.2.3 Pembuatan Sirup Glukosa
─ Ditimbang pati biji jagung muda 10 gram dan dimasukkan ke dalam erlenmeyer.
─ Ditambahkan air panas 200 ml.
─ Diaduk dan dipanaskan hingga diperoleh larutan pati kental berwarna kuning.
─ Ditambahkan HCl 3 % sampai pH = 2.
─ Dihidrolisis pada suhu 115oC selama 1 jam.
─ Dikeluarkan dan didinginkan hingga suhu mencapai 75oC.
─ Dinetralkan dengan NaOH 1 % sampai pH 6,5 – 6,8.
─ Dilakukan penyaringan
─ Diuapkan filtrat yang diperoleh sampai menjadi larutan kental.
─ Dilakukan analisis terhadap parameter kadar glukosa, nilai TSS, kadar abu dan organoleptik warna.
Catatan : Dilakukan perlakuan yang sama untuk massa pati 20 gram, 30 gram dan 40
3.2.4 Pengukuran Parameter
3.2.4.1 Penentuan Kadar Glukosa
─ Dimasukkan 25 ml gula cair ke dalam labu ukur 100 ml.
─ Ditambah 50 ml akuades.
─ Ditambah Pb(CH3COO)2 netral setetes demi setetes sampai larutan tidak keruh.
─ Ditambah akuades sampai garis tanda kemudian dihomogenkan.
─ Disaring.
─ Ditampung filtrat ke dalam labu ukur 250 ml.
─ Ditambah Na2CO3 anhidrat sedikit demi sedikit sampai tidak ada lagi endapan putih.
─ Ditambah akuades sampai garis tanda kemudian dihomogenkan.
─ Disaring.
─ Dimasukkan 25 ml filtratnya ke dalam labu leher dua.
─ Ditambah 25 ml larutan Luff Schrool.
─ Ditambah beberapa butir batu didih.
─ Dihubungkan dengan pendingin balik.
─ Dipanaskan selama ± 15 menit pada suhu 100oC.
─ Didinginkan.
─ Ditambah 15 ml KI 20 % secara perlahan – lahan.
─ Ditambah 25 ml H2SO4 25 %.
─ Dititrasi dengan Na2S2O3 0,1 N .
─ Ditambah 2 tetes indikator amilum pada saat mendekati titik akhir titrasi (iod berwarna kuning muda).
─ Dititrasi kembali dengan Na2S2O3 0,1 N sampai warna biru hilang.
─ Diukur volume yang terpakai Na2S2O3 0,1 N .
3.2.4.2 Pembuatan Blanko
─ Dimasukkan 25 ml akuades ke dalam labu leher dua.
─ Ditambah 25 ml larutan Luff Schrool.
─ Dihubungkan dengan pendingin balik.
─ Didinginkan.
─ Ditambah 15 ml KI 20 % secara perlahan – lahan.
─ Ditambah 25 ml H2SO4 25 % .
─ Dititrasi dengan Na2S2O3 0,1 N .
─ Ditambah 2 tetes indikator amilum pada saat mendekati titik akhir titrasi (iod berwarna kuning muda).
─ Dititrasi kembali dengan Na2S2O3 0,1 N sampai warna biru hilang.
─ Diukur volume yang terpakai Na2S2O3 0,1 N .
3.2.4.3 Penentuan Total Padatan Terlarut (Total Soluble Solid = TSS)
─ 10 ml sirup glukosa.
─ Dimasukkan ke dalam labu ukur 100 ml.
─ Diencerkan dengan akuades sampai garis tanda.
─ Diaduk sampai homogen kemudian disaring.
─ Diteteskan filtrat yang diperoleh pada kaca sensor handrefraktometer.
─ Dibaca nilai oBrix.
3.2.4.4 Penentuan Kadar Abu
─ Ditimbang cawan porselin kosong.
─ Ditempatkan 10 ml gula cair dalam cawan porselin.
─ Dikeringkan dalam oven pada suhu 100oC selama 2 jam.
─ Didinginkan cawan ke dalam desikator selama 20 menit.
─ Ditimbang berat kering setelah dingin.
─ Diulangi terus sampai diperoleh berat konstan.
─ Dimasukkan ke dalam tanur pada suhu 500 oC - 600oC sampai diperoleh abu. berwarna keputih – putihan.
─ Didinginkan dalam desikator.
─ Ditimbang abu yang diperoleh.
─ Diulang terus sampai diperoleh berat konstan.
3.2.4.5 Uji Organoleptik Warna
Uji ini hanya meliputi warna yang ditentukan dengan uji kesukaan oleh 10
orang panelis. Uji ini ditentukan dengan skala hedonik sebagai berikut :
Uji Kesukaan (Skala Hedonik) Skala Numerik
Kuning pucat 1
Agak kekuningan 2
Kekuningan 3
3.3 Bagan Penelitian
3.3.1 Pemisahan Pati Jagung
Dicuci, diblender serta ditambah air bersih
(200 ml)
Diremas dan diperas dengan kain saring
Ditambah air bersih (100 ml) kemudian diblender
Diremas dan diperas kembali
Digabungkan dengan filtrat sebelumnya
Diendapkan selama 24 jam
(dibuang)
Dikeringkan dibawah sinar matahari selama ± 48 jam
Diovenkan pada suhu 80oC hingga kadar air 10 %
Biji jagung muda (300 gram)
Biji jagung halus
Residu Filtrat
Residu Filtrat
Campuran filtrat
Pati Larutan keruh
Pati kering
3.3.2 Pembuatan Sirup Glukosa
Dimasukkan ke dalam erlenmeyer Ditambah 200 ml air mendidih
Dipanaskan sambil diaduk ± 1 jam
Ditambah HCl 3 % sampai pH = 2
Ditutup dengan kapas
Dihidrolisis pada suhu 115oC selama 1 jam Didinginkan hingga suhu 75oC
Dinetralkan dengan NaOH 1 % sampai
pH = 6,5 – 6.,8
Disaring
Diuapkan sampai diperoleh larutan kental
Catatan : Dilakukan perlakuan yang sama untuk massa pati 20 gram, 30 gram dan 40
gram dengan lama hidrolisis 1 jam; 1,5 jam; 2 jam dan 2,5 jam. Pati jagung 10 gram
Larutan pati
Larutan pati kental berwarna kuning
Filtrat Residu
3.3.3 Penentuan Kadar Glukosa
Ditambah Na2CO3 anhidrat sedikit demi sedikit sampai tidak ada lagi
3.3.4 Penentuan Total Padatan Terlarut (Total Soluble Solid = TSS)
Dimasukkan ke dalam labu ukur 100 ml
Diencerkan dengan akuades sampai garis
batas
Diaduk sampai homogen
Disaring
Diteteskan pada kaca sensor handrefraktometer
Dibaca dan dicatat angka Brix
3.3.5 Penentuan Organoleptik Warna
Dilakukan uji warna kepada panelis
Ditentukan skor nilainya 10 ml sampel
Filtrat Residu
HASIL
Sirup glukosa
3.3.6 Penentuan Kadar Abu
Ditempatkan dalam cawan porselin
Dikeringkan dalam oven pada suhu
100oC selama 2 jam
Didinginkan cawan dalam desikator
selama 20 menit
Ditimbang berat kering dan diulang terus
sampai diperoleh berat konstan
Dimasukkan dalam tanur pada suhu
500 oC - 600oC
Didinginkan dalam desikator
Ditimbang abu yang diperoleh dan
Diulang sampai diperoleh berat konstan
Dihitung kadar abunya
10 ml gula cair
HASIL Gula cair kering
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Secara umum dari hasil waktu hidrolisis dan variasi konsentrasi larutan pati biji
jagung muda pada pembuatan sirup glukosa dari biji jagung muda memberikan
pengaruh terhadap kadar glukosa, kadar abu, kadar TSS dan nilai organoleptik warna.
Hal ini dapat dilihat pada tabel berikut :
Tabel 4.1 Pengaruh Waktu Hidrolisis terhadap Parameter yang diamati :
Waktu Hidrolisis
Tabel 4.2 Pengaruh Konsentrasi Larutan Pati Biji Jagung Muda terhadap Parameter
4.2 Pengolahan Data
4.2.1 Kombinasi Perlakuan (tc) dengan Banyaknya Ulangan (n)
Penelitian dilaksanakan dengan model Rancangan Acak Lengkap (RAL) yang terdiri
dari 2 faktorial yaitu :
Kombinasi perlakuan (tc) adalah 4 x 4 = 16 dengan banyak ulangan (n), adalah :
Tc (n – 1) ≥ 15
4.2.2 Uji Signifikan Data (S) Metode Chauvenent Criterion Test (CCT)
Contoh uji signifikan data nilai TSS pada waktu hidrolisis 1 jam dan konsentrasi
V1 0.821
Berdasarkan data di atas htabel > hhitung yang menyatakan data signifikan.
(Gaspersz, V., 1990)
4.2.3 Perhitungan Kadar Glukosa
Penentuan kadar glukosa dari biji jagung muda dapat dihitung sebagai berikut :
Volume larutan Na2S2O3 0.1052 yang dibutuhkan adalah : (a – b) dimana : a = volume blanko --- x N b = volume sampel 0.1
Contoh perhitungan kadar glukosa pada waktu hidrolisis 1 jam dan konsentrasi larutan
4.3 Uji Statistik Analisa Varians (anava) metode Rancangan Acak Lengkap (RAL)
Dalam hal ini RAL merupakan suatu metode untuk pelengkap penentu anava. Karena
data anava yang akan diperoleh dilakukan dengan menggunakan statistik hitung (F)
taraf signifikan 5 % dan 1 %. Statistik F dapat dihitung dengan rumus :
KT perlakuan dimana : KT perlakuan = kuadrat tengah perlakuan F hitung = --- KT galat = kuadrat tengah galat KT galat
Dengan ini maka hipotesa Ho dan Hi diuji dengan :
1. Ho : X1 = X2 = X3
Bila tidak ada pengaruh waktu hidrolisis dan variasi konsentrasi larutan pati
biji jagung muda terhadap pembuatan sirup glukosa dari biji jagung muda.
2. Hi : X1≠ X2 ≠ X3
Bila terdapat pengaruh waktu hidrolisis dan variasi konsentrasi larutan pati biji
jagung muda terhadap pembuatan sirup glukosa dari biji jagung muda.
JKP 98584,67
KT perlakuan = --- = --- = 98584,67 DBP 1
JKG 98285,8
KT galat = --- = --- = 3276,19 DBG 30
KT perlakuan 98584,67
F hitung = --- = --- = 30,09 KT galat 3276,19
Dimana : FK = faktor koreksi
Σ
Xtotal = jumlah X totaln = total ulangan
JKU = jumlah kuadrat umum
X = X1, X2, X3
JKP = jumlah kuadrat perlakuan
r = banyaknya perulangan
JKG = jumlah kuadrat galat
DBT = derajat bebas total
DBP = derajat bebas perlakuan
DBG = derajat bebas galat
Dari lampiran.... jika dibandingkan antara F hitung dengan F tabel maka F hit > F tab yaitu (30,09> 4,17) untuk α = 0,05 dan (30,09 > 7,56) untuk α = 0,01. Dari hasil tersebut berarti Ho ditolak dan Hi diterima dengan arti bahwa terdapat pengaruh waktu
hidrolisis terhadap kadar glukosa pada sirup glukosa dari biji jagung muda.
4.4 Pembahasan
4.4.1 Reaksi Hidrolisis Pati menjadi Glukosa
(C6H10O5)x + H2O (C6H10O5)y + H2O (C6H10O5)z + H2O Pati amilodekstrin eritrodekstrin
(C6H10O5)v + H2O C12H22O11 + H2O C6H12O6 akhrodekstrin maltosa glukosa
(Silitongan Melva.,2009)
H CH2OH H CH2OH H O H O
H O H + H2O OH H OH H
H OH H OH
X
Pati (Amilosa)
H CH2OH H CH2OH H O H O
H O H + H2O OH H OH H
H OH H OH
Y
Amilodekstrin
H CH2OH H CH2OH H O H O
H O H + H2O OH H OH H
H OH H OH
Z
H CH2OH H CH2OH H O H O
H O H + H2O OH H OH H
H OH H OH
V
Akhrodekstrin
H CH2OH H H CH2OH H
O O δ- δ+ H O H + HO — H
OH OH H OH H OH
H OH H OH
Amilosa
H CH2OH H H CH2OH H O O
H + H
OH OH H OH OH OH H OH
H OH H OH
Glukosa Glukosa
4.4.2 Kadar Glukosa
4.4.2.1 Pengaruh Kadar Glukosa terhadap Waktu Hidrolisis
Dari tabel 4.1 dapat dilihat bahwa setiap perlakuan berbeda sangat nyata
antara satu dengan yang lainnya. Kadar glukosa tertinggi diperoleh pada waktu
0
Dari hasil analisa sidik ragam pada tabel 2 (pada lampiran) menunjukkan bahwa
waktu hidrolisis memberikan pengaruh yang berbeda nyata terhadap kadar glukosa.
Hal ini dapat juga dilihat dari gambar grafik 4.1 Semakin lama waktu hidrolisis maka
kadar glukosa semakin meningkat. Peningkatan kadar glukosa ini disebabkan karena
semakin lama waktu hidrolisis semakin sempurna pemecahan pati menjadi glukosa
sehingga kadar glukosa semakin meningkat.
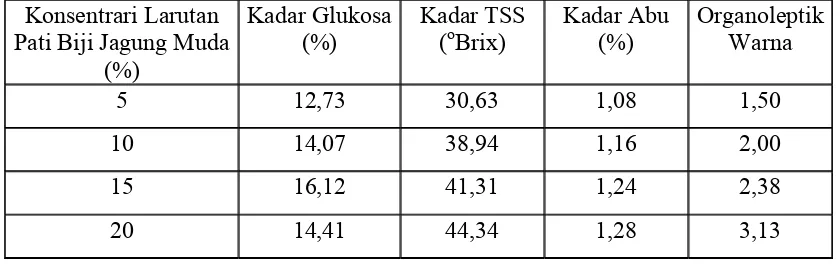
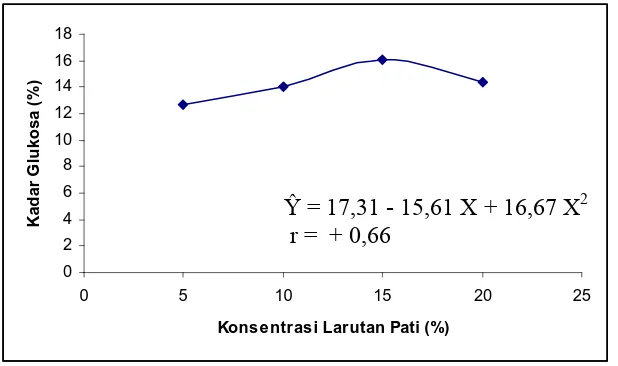
4.4.2.2 Pengaruh Kadar Glukosa terhadap Konsentrasi Larutan Pati
Dari tabel 4.2 dapat dilihat bahwa setiap perlakuan berbeda sangat nyata
antara satu dengan yang lainnya. Kadar glukosa tertinggi diperoleh 15 % (30 gram/
200 ml) tetapi pada 20 % (40 gram/ 200 ml) turun mengikuti garis regresi kuadratik.
Gambar 4.2 Pengaruh Kadar Glukosa terhadap Konsentrasi Larutan Pati
Ŷ = 17,31 - 15,61 X + 16,67 X2 r = + 0,66
Dari hasil analisa sidik ragam pada tabel 2 (pada lampiran) menunjukkan bahwa
0
Semakin meningkat konsentrasi larutan pati maka kadar glukosa meningkat juga pada
konsentrasi 15 %, tetapi pada konsentrasi 20 % turun mengikuti garis kuadratik
(sesuai grafik 4.4.1.2). Peningkatan kadar glukosa karena pada konsentrasi larutan
pati 15 % (30 gram/ 200 ml) semakin sempurna pemecahan pati menjadi glukosa,
sehingga didapat kadar glukosa yang lebih tinggi dan pada konsentrasi 20 % terjadi
penurunan kadar glukosa. Hal ini disebabkan karena pemecahan pati menjadi glukosa
kurang sempurna akibat konsentrasi pati terlalu tinggi atau kadar air berkurang
sehingga proses hidrolisis terganggu, selain itu terjadinya penurunan kadar glukosa
pada konsentrasi 20 % karena adanya reaksi dehidrasi glukosa yang dikenal dengan
reaksi pencoklatan.
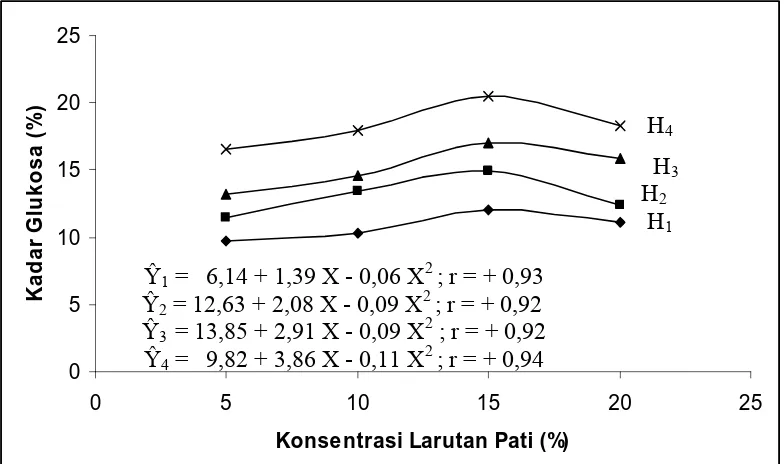
4.4.2.3 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi Larutan Pati terhadap Kadar Glukosa
Dari tabel 1 (pada lampiran) dapat dilihat bahwa setiap level kombinasi
perlakuan lama hidrolisisis dengan tingkat konsentrasi larutan pati menunjukkan
pengaruh yang berbeda nyata pada Fhit > F tab (30,09 > 4,17) untuk α = 0,05 dan (30,09 > 7,56) untuk α = 0,01 terhadap kadar glukosa. Semakin lama hidrolisis dan perbedaan tingkat konsentrasi larutan pati pada keasaman tertentu yaitu pH = 2 maka
kadar glukosa meningkat sampai batas tertentu dan kemudian menurun mengikuti
regresi kuadratik seperti gambar berikut.
Gambar 4.3 Hubungan Pengaruh Interakasi Waktu Hidrolisis dan Konsentrasi
0
Penurunan kadar glukosa disebabkan karena pemecahan pati menjadi glukosa kurang
sempurna akibat konsentrasi pati terlalu tinggi atau kadar air berkurang sehingga
proses hidrolisis terganggu, selain itu terjadinya penurunan kadar glukosa pada
konsentrasi 20 % karena adanya reaksi dehidrasi glukosa yang dikenal dengan reaksi
pencoklatan.
4.4.3 Total Padatan Terlarut(Total Solid Solubility = TSS ) 4.4.3.1 Pengaruh Nilai TSS terhadap Waktu Hidrolisis
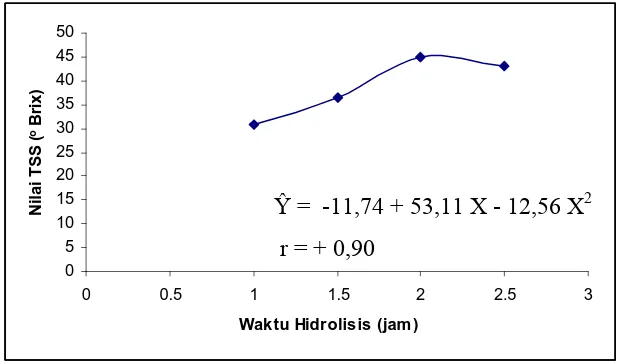
Dari tabel 4.1 dapat dilihat bahwa setiap perlakuan berbeda sangat nyata
antara satu dengan yang lainnya. Nilai TSS tertinggi diperoleh pada waktu hidrolisis 2
jam, tetapi pada waktu hidrolisis 2,5 jam turun mengikuti garis regresi kuadratik.
Gambar 4.4 Pengaruh Nilai TSS terhadap Waktu Hidrolisis
Ŷ = -11,74 + 53,11 X - 12,56 X2 r = + 0,90
Dari hasil analisa sidik ragam pada tabel 4 (pada lampiran) menunjukkan bahwa
waktu hidrolisis memberikan pengaruh yang berbeda sangat nyata terhadap nilai TSS.
Semakin lama waktu hidrolisis maka nilai TSS meningkat juga pada waktu hidrolisis
2 jam, tetapi pada waktu hidrolisis 2,5 jam turun mengikuti garis kuadratik (sesuai
grafik 4.4).
Terjadinya perbedaan nilai TSS pada sirup glukosa disebabkan semakin lama
waktu hidrolisis maka semakin sempurna penguraian pati menjadi glukosa, sehingga
nilai TSS semakin tinggi hingga lama hidrolisis 2 jam. Kemudian terjadi penurunan
nilai TSS akibat perombakan glukosa menjadi levulinat dan asam formiat dalam
0
reaksi pencoklatan dimana pada reaksi pencoklatan terjadi pengeluaran H2O(l) sehingga beratnya berkurang.
4.4.3.2Pengaruh Nilai TSS terhadap Konsentrasi Larutan Pati Biji Jagung Muda
Dari tabel 4.2 dapat dilihat bahwa setiap perlakuan berbeda sangat nyata
antara satu dengan yang lainnya. Nilai TSS tertinggi diperoleh pada konsentrasi 20 %,
dan terendah pada konsentrasi 5 % mengikuti garis regresi kuadratik.
Gambar 4.5 Pengaruh Nilai TSS terhadap Konsentrasi Larutan Pati
Ŷ = 42,56 + 0,45 X - 0,05 X2 r = - 0,95
Dari hasil analisa sidik ragam pada tabel 4 (pada lampiran) menunjukkan bahwa
konsentrasi larutan pati memberikan pengaruh yang berbeda nyata terhadap nilai TSS.
Meningkatnya konsentrasi larutan pati maka nilai TSS akan semakin meningkat. Hal
ini dapat dijelaskan bahwa nilai TSS merupakan suatu analisa untuk menentukan
banyaknya padatan gula yang terlarut dalam suatu larutan yang dinyatakan dalam o
Brix. Dimana setiap kenaikan konsentrasi larutan pati akan meningkatkan kenaikan
nilai TSS (http://www.refractometer.com). Disamping itu juga disebabkan karena
semakin banyaknya glukosa dan zat lain yang terlarut dalam proses hidrolisis.
Terjadinya peningkatan kadar glukosa akibat penguraian pati menjadi glukosa
0
4.4.3.3 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi Larutan Pati terhadap Nilai TSS
Dari tabel 3 (pada lampiran) dapat dilihat bahwa setiap level kombinasi
perlakuan lama hidrolisisis dengan tingkat konsentrasi larutan pati menunjukkan
pengaruh yang berbeda sangat nyata pada Fhit > F tab (6385,19 > 4,17) untuk α = 0,05 dan (6385,19 > 7,56) untuk α = 0,01 terhadap nilai TSS. Semakin lama hidrolisis dan perbedaan tingkat konsentrasi larutan pati yang tinggi maka TSS akan semakin
meningkat mengikuti garis regresi kuadratik seperti gambar berikut.
Gambar 4.6 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Nilai TSS
Dari gambar diatas dapat dilihat, bahwa kombinasi perlakuan konsentrasi larutan pati
yang tinggi akan meningkatkan nilai TSS sebaliknya, semakin lama waktu hidrolisis
0
meningkat. Hal ini dapat dijelaskan bahwa nilai TSS merupakan suatu analisa untuk
menentukan banyaknya padatan gula yang terlarut dalam suatu larutan yang
dinyatakan dalam oBrix. Dimana setiap kenaikan konsentrasi larutan pati akan meningkatkan kenaikan nilai TSS (http://www.refractometer.com).
Terjadinya perbedaan nilai TSS pada sirup glukosa disebabkan semakin lama
waktu hidrolisis maka semakin sempurna penguraian pati menjadi glukosa, sehingga
TSS semakin tinggi sampai batas tertentu, kemudian terjadi penurunan TSS akibat
perombakan glukosa menjadi levolonat dan asam formiat dalam pemanasan yang
terlalu lama terlebih – lebih dalam suasana asam. Disini juga terjadi reaksi
pencoklatan dimana pada reaksi pencoklatan terjadi pengeluaran H2O(l) sehingga beratnya berkurang.
4.4.4 Kadar Abu
4.4.4.1 Pengaruh Kadar Abu terhadap Waktu Hidrolisis
Dari tabel 4.1 dapat dilihat bahwa setiap perlakuan berbeda sangat
nyata antara satu dengan yang lainnya. Kadar abu tertinggi diperoleh pada waktu
hidrolisis 1 jam, tetapi pada waktu hidrolisis 2,5 jam turun mengikuti garis regresi
kuadratik.
Gambar 4.7 Pengaruh Kadar Abu terhadap Waktu Hidrolisis
1.05
Dari hasil analisa sidik ragam pada tabel 6 (pada lampiran) menunjukkan bahwa
waktu hidrolisis memberikan pengaruh yang berbeda nyata terhadap kadar abu.
Semakin lama waktu hidrolisis maka kadar abu menurun mengikuti garis kuadratik
(sesuai grafik 4.7). Terjadinya penurunan kadar abu pada sirup glukosa disebabkan
akibat terjadinya penggabungan molekul glukosa dengan garam – garam mineral
seperti ion besi (III) dengan glukosa membentuk gula besi (Sacharas ferricus)
(Pharmakope Nederland, 1929)
4.4.4.2Pengaruh Kadar Abu terhadap Konsentrasi Larutan Pati
Dari tabel 4.2 dapat dilihat bahwa setiap perlakuan berbeda nyata antara satu
dengan yang lainnya. Kadar abu terendah diperoleh pada konsentrasi larutan pati 5 %,
tertinggi pada konsentrasi larutan pati 20 % mengikuti garis regresi kuadratik.
Gambar 4.8 Pengaruh Kadar Abu terhadap Konsentrasi Larutan Pati
Ŷ = 1,06 + 0,011 X r = + 0,89
Dari hasil analisa sidik ragam pada tabel 6 (pada lampiran) menunjukkan bahwa
konsentrasi larutan pati memberikan pengaruh yang berbeda nyata terhadap kadar
abu. Berdasarkan grafik 4.8 terlihat bahwa semakin meningkat konsentrasi larutan
pati, maka kadar abu semakin meningkat, mengikuti garis regresi kuadratik.
Terjadinya peningkatan kadar abu diduga akibat konsentrasi larutan pati yang
semakin tinggi, sehingga semakin banyak garam – garam mineral yang terlarut yang
0
Dari tabel 5 (pada lampiran) dapat dilihat bahwa setiap level kombinasi
perlakuan lama hidrolisisis dengan tingkat konsentrasi larutan pati menunjukkan
pengaruh yang berbeda nyata pada Fhit > F tab (17,67 > 4,17) untuk α = 0,05 dan (17,67 > 7,56) untuk α = 0,01 terhadap kadar abu. Semakin lama hidrolisis dan perbedaan tingkat konsentrasi larutan pati yang tinggi maka kadar abu akan semakin
meningkat mengikuti garis regresi kuadratik seperti gambar berikut.
Gambar 4.9 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Kadar Abu
Dari gambar diatas dapat dilihat, bahwa semakin lama waktu hidrolisis dan semakin
tinggi konsentrasi larutan pati maka kadar abu semakin meningkat. Hal ini terjadi
karena semakin tinggi tingkat konsentrasi larutan pati, semakin banyak juga
mineralnya, dimana mineral – mineral ini akan semakin banyak terlarut bila hidrolisis
lebih lama. Dengan demikian, kadar abu akan semakin tinggi sesuai dengan
0
Dari tabel 4.1 dapat dilihat bahwa setiap perlakuan berbeda sangat nyata
antara satu dengan yang lainnya. Kadar abu tertinggi diperoleh pada waktu hidrolisis
1 jam, tetapi pada waktu hidrolisis 2,5 jam turun mengikuti garis regresi kuadratik.
Gambar 4.10 Pengaruh Nilai Organoleptik Warna terhadap Waktu Hidrolisis
Ŷ = 1,25 + 0,62 X - 0,13 X2 r = + 0,64
Dari hasil analisa sidik ragam pada tabel 8 (pada lampiran) menunjukkan bahwa
waktu hidrolisis memberikan pengaruh yang berbeda sangat nyata terhadap nilai
organoleptik warna. Semakin lama waktu hidrolisis maka nilai organoleptik warna
meningkat mengikuti garis kuadratik (sesuai grafik 4.10). Peningkatan ini disebabkan
karena semakin lama waktu hidrolisis maka tejadi perombakan glukosa menjadi
levolonat dan asam formiat dalam pemanasan yang terlalu lama terlebih – lebih dalam
suasana asam. Disini juga terjadi reaksi pencoklatan dimana pada reaksi pencoklatan
0 Dari tabel 4.2 dapat dilihat bahwa setiap perlakuan berbeda nyata antara satu
dengan yang lainnya. Nilai organoleptik warna terendah diperoleh pada konsentrasi
larutan pati 5 %, tertinggi pada konsentrasi larutan pati 20 % mengikuti garis regresi
kuadratik.
Gambar 4.11 Pengaruh Nilai Organoleptik Warna terhadap Konsentrasi Larutan Pati
Dari hasil analisa sidik ragam pada tabel 8 (pada lampiran) menunjukkan bahwa
konsentrasi larutan pati memberikan pengaruh yang berbeda nyata terhadap nilai
organoleptik warna. Meningkatnya konsentrasi larutan pati maka nilai organoleptik
warna akan semakin meningkat. Peningkatan nilai organoleptik warna ini disebabkan
karena panelis lebih menyukai warna sirup yang agak pekat, dimana semakin tinggi
konsentrasi larutan pati maka warna sirup yang dihasilkan juga semakin gelap dan
kental.
4.4.5.3 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi Larutan Pati terhadap nilai Organoleptik Warna
Dari tabel 7 (pada lampiran) dapat dilihat bahwa setiap level kombinasi
perlakuan lama hidrolisisis dengan tingkat konsentrasi larutan pati menunjukkan
0
hidrolisis dan perbedaan tingkat konsentrasi larutan pati yang tinggi maka kadar abu
akan semakin meningkat mengikuti garis regresi kuadratik seperti gambar berikut.
Gambar 4.12 Hubungan Pengaruh Interaksi Waktu Hidrolisis dan Konsentrasi
Larutan Pati terhadap Kadar Abu
Dari gambar diatas dapat dilihat, bahwa semakin lama waktu hidrolisis dan semakin
tinggi konsentrasi larutan pati maka nilai organoleptik warna semakin meningkat. Hal
ini terjadi karena semakin lama waktu hidrolisis maka tejadi perombakan glukosa
menjadi levolonat dan asam formiat dalam pemanasan yang terlalu lama terlebih –
lebih dalam suasana asam. Disini juga terjadi reaksi pencoklatan dimana pada reaksi
pencoklatan terjadi pengeluaran H2O(l). Dengan juga dengan konsentrasi larutan pati, semakin tinggi konsentrasi larutan pati maka warna sirup yang dihasilkan juga
semakin gelap dan kental. Pada umumnya panelis lebih menyukai warna sirup yang
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian yang sudah dilakukan dapat diambil kesimpulan sebagai
berikut :
1. Lama hidrolisis memberikan pengaruh berbeda nyata terhadap kadar glukosa
dan nilai organoleptik warna, dan memberikan pengaruh berbeda sangat nyata
terhadap nilai TSS dan kadar abu.
2. Konsentrasi larutan pati memberikan pengaruh berbeda nyata terhadap kadar
glukosa dan nilai organoleptik warna, dan memberikan pengaruh berbeda
sangat nyata terhadap nilai TSS dan kadar abu.
3. Interaksi perlakuan lama hidrolisis dan konsentrasi larutan pati memberikan
pengaruh berbeda sangat nyata pada kadar glukosa, nilai TSS, kadar abu dan
nilai organoleptik warna.
5.2 Saran
Untuk kesempurnaan penelitian ini disarankan kepada peneliti selanjutnya
untuk memperhatikan pengenceran yang tepat dalam penggunaan HCl sebelum
DAFTAR PUSTAKA
Adisarwanto, T.,1999. Budi Daya Jagung. Jilid Kedua. Surabaya : Penerbit Kendang Sari.
Allister, M., 1975. Enzym in Food Processing. New York: Acadic Press.
Anonymous, L., 1977. Akhirnya Singkongpun menjadi Gula. Medan : Harian Sinar Indonesia Baru.
Brautlecth, C.A., 1953. Starch, It’s Sources. Production and Uses. New York : Reinhold Publishing Corporation.
Greenwood, C.T., 1964. Food Chemistry. Heidenburg : Springer Venag Berlin.
http : //www.balitsereal.litbang.deptaan.go.id/ Pengolahan Jagung. html. 2006. Diakses 24 Mei 2009.
http : //www.bdpunib.org/ Edisi Khusus 2007/ Pemanfaatan Biji Jagung. Diakses 24 Mei 2009.
http : //www.ianrpubs. unl. edu/ Fieldcorps/ html. 2003. Diakses 22 Juni 2009.
http : //www. scientificpsychic.com/ Carbohydrates/ html. 1997.Diakses 30 Juni 2009
http : //www. warintek.ristek.go.id / Tanaman- Penghasil-Pati/ html. 2002. Diakses 14 Juni 2009
Jacobs, M.B., 1994. The Chemical Analysis of Food and Food Product 2nd. New York : D. Van Nostran Company Inc.
Judoamidjojo, M., A.A. Darwis dan E. G. Sa’id., 1992. Tekonologi Fermentasi. Bogor : IPB Press.
Lambau, M. B., 1958. Effect of Curing, Storage and Dehydration Mono & Disacarida of Sweet Potato. Food Technology 12 No.3. Roma : Italy.
Meyer, L.H., 1970. Food Chemistry. New York : Reinhold Publishing Corporation.
Mulyono, H.A., 2004. Membuat Reagen Kimia. Jakarta : Bumi Aksara.
Othmer, D.P., 1949. Starch Production Technology. London : Applied Science Publishing Ltd.
Rukmana, R., 1997. Usaha Tani Jagung. Cetakan Pertama. Surabaya : Penerbit Kendang Sari.
Somaatmadja, D., 1970. Sirup Pati Ubi Kayu. Bogor : Balai Penelitian Kimia Bogor.
Stout, L.E and Ryberg., 1939. Polysacharida Chemistry. New York : Academic Press Inc.
Sudarmadji, S., 1989. Analisa Bahan Makanan dan Pertanian. Edisi Pertama. Cetakan Pertama. Yogyakarta : Penerbit Liberty Yogyakarta.
Sudjana, M.A.,1992. Metode Statistika. Edisi Kelima. Bandung : Tarsito.
Sutrisno Hadi., 2000. Metodologi Research. Jilid Keempat. Yogyakarta : Penerbit Andi.
Tabel 3. Data Pengamatan Nilai TSS (o Brix) pada Sirup Glukosa dari Biji
Tabel 4. Data Analisa Sidik Ragam Nilai TSS (o Brix)
Tabel 9. Data Standard Kadar Luff Schrool
ml 0,1 N Na2S2O3 *)
glukosa, fruktosa, gula invert mg C6H12O6 ∆ 1. 2.4 2.4 2. 4.8 2.4 3. 7.2 2.5 4. 9.7 2.5 5. 12.2 2.5 6. 14.7 2.5 7. 17.2 2.6 8. 19.8 2.6 9. 22.4 2.6 10. 25.0 2.6 11. 27.6 2.7 12. 30.3 2.7 13. 33.0 2.7 14. 35.7 2.8 15. 38.5 2.8 16. 38.5 2.9 17. 44.2 2.9 18. 47.1 2.9 19. 50.0 3.0 20. 53.0 3.0 21. 56.0 3.1 22. 59.1 3.1 23. 62.2 - 24. - -