SINTESIS DAN KARAKTERISASI
SENYAWA DIBUTILTIMAH(IV) DIKLOROBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK
(Tesis)
Oleh
HASTIN KURNIASIH
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
SYNTHESIS AND CHARACTERIZATION OF DIBUTYLTIN(IV) DICHLOROBENZOATE AS INHIBITOR CORROSION FOR MILD STEEL
By
Hastin Kurniasih
In this research, the synthesis, and characterization of dibutyltin(IV) di-2-chlorobenzoate, dibutyltin(IV) di-3-chlorobenzoate and dibutyltin(IV) di-4-chlorobenzoate were succesfully performed and the inhibitor corrosion activity test on mild steel for these compounds have been performed using potensiostat method. The preparations of dibutyltin(IV) dichlorobenzoate compound series was commenced from the synthesis of dibutyltin(IV) oxide from dibutyltin(IV) dichloride with NaOH in methanol. The dibutyltin(IV) oxide compound was then reacted with ligands of 2-chlorobenzoate acid, 3-chlorobenzoate acid, and 4-chlorobenzoate acid to produce dibutyltin(IV) di-2-4-chlorobenzoate, dibutyltin(IV) di-3-chlorobenzoate, and dibutyltin(IV) di-4-chlorobenzoate, respectively . The precentage yields of the synthesis of dibutyltin(IV) dichlorobenzoate series at the optimum reflux time of 4 hours was 97.55; 90.80; dan 98.16%. These compounds were well characterized by spectroscopy techniques of infra red (IR), ultraviolet (UV-Vis), 1H NMR and 13C NMR as well as based on the microelemental analyzer. The results of inhibitor corrosion test of the compounds synthesized toward mild steel showed that the percentage efficiency inhibition (%EI) value for the dibutyltin(IV) di-2-chlorobenzoate, dibutyltin(IV) di-3-chlorobenzoate, and dibutyltin(IV) di-4-chlorobenzoate was 53.70; 50.84; and 48.31% respectively at concentration of 100 ppm.
ABSTRAK
SINTESIS DAN KARAKTERISASI
SENYAWA DIBUTILTIMAH(IV) DIKLOROBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK
Oleh Hastin Kurniasih
Pada penelitian ini telah dilakukan sintesis, karakterisasi dan uji aktivitas inhibitor korosi pada baja lunak dari senyawa dibutiltimah(IV) di-2-klorobenzoat, dibutiltimah(IV) di-3-klorobenzoat, dan dibutiltimah(IV) di-4-klorobenzoat, dengan metode potensiostat. Sintesis senyawa-senyawa dibutiltimah(IV) diklorobenzoat, dimulai dari sintesis dibutiltimah(IV) oksida dengan mereaksikan dibutiltimah(IV) diklorida dengan NaOH dalam metanol. Senyawa dibutiltimah(IV) oksida direaksikan dengan ligan asam 2-klorobenzoat, asam 3-klorobenzoat, dan asam 4-klorobenzoat menghasilkan dibutiltimah(IV) di-2-klorobenzoat, dibutiltimah(IV) di-3-di-2-klorobenzoat, dan dibutiltimah(IV) di-4-klorobenzoat. Ketiga senyawa memberikan rendemen kristal masing masing sebanyak 97,55; 90,80; dan 98,16 %, dengan waktu refluks 4 jam. Seluruh senyawa tersebut dikarakterisasi dengan menggunakan spektrofotometer IR, UV-Vis, 1H NMR, 13C NMR dan mikroanalisis unsur dengan menggunakan microelemental analyzer. Aktivitas inhibitor korosi senyawa-senyawa produk diujikan pada baja lunak memberikan efek inibisi untuk senyawa dibutiltimah(IV) di-2-klorobenzoat, dibutiltimah(IV) di-3-klorobenzoat, dan dibutiltimah(IV) di-4-klorobenzoat masing-masing sebesar 53,70; 50,84; dan 48,31% pada konsentrasi 100 mg/L.
SINTESIS DAN KARAKTERISASI
SENYAWA DIBUTILTIMAH(IV) DIKLOROBENZOAT SEBAGAI INHIBITOR KOROSI PADA BAJA LUNAK
Oleh
HASTIN KURNIASIH
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar MAGISTER SAINS
Pada
Program Pascasarjana Magister Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
PROGRAM PASCASARJANA MAGISTER KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Penulis dilahirkan di Pringsewu, pada tanggal 04 Desember 1975, sebagai anak ke delapan dari delapan bersaudara, dari pasangan berbahagia Bapak Kaidi Hadi Suwarno dan Ibu Aisyah. Pada tanggal 22 Januari 2006 penulis menikah dengan Zulchan Afandi, S.Pd. dan dianugerahi buah hati yang sholeh Fachri Akhdan Rasyid.
Pendidikan Sekolah Dasar (SD) diselesaikan di SDN 1 Pringsewu pada tahun 1988, Sekolah Menengah Pertama (SMP) di SMPN 1 Pringsewu pada tahun 1991, Sekolah Menengah Atas (SMA) di SMAN 1 Pringsewu pada tahun 1994, dan gelar Sarjana Sains jurusan kimia diperoleh di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 1999 dan melanjutkan pendidikan AKTA IV di Universitas Lampung lulus tahun 2000.
Pada tahun 2005, Penulis diangkat menjadi Pegawai Negeri Sipil sebagai pendidik di SMA N 1 Sekampung Kabupaten Lampung Timur, tahun 2013 terdaftar
Dengan Rasa Syukur Kupersembahkan Karya ini untuk:
Ibunda Aisyah dan Ayahanda Kaidi Hadi Suwarno
Sebagai Tanda Hormat dan Baktiku
Suamiku tercinta Zulchan Afandi dan Ananda Fachri Akhdan Rasyid
Sebagai Tanda Kasih Sayangku
Kakak-kakakku
Yundha Yanti+Mas Harno, Mas Hery+Mb Siti, Yundha Tri+Bang Erbin, Mas Edy+Mb Luluk, Yundha Eny+Mas Andi, Mas Bambang+Mb Eha,
Mas Hendi+Mb Ely, Mb Istinganah+ Bang Firnando
Keponakanku
Titis, Ageng, Zidan, Dika, Deny, Pipit, Indah, Luthfy, Hafiz, Hansen, Rafi, Iffan, Erlang, Galih, Radhit, Rara, Hana, Faris, Affan,
Nisa, Fina, Faqih, Wafa
Bersyukurlah....
Allah tidak akan memberi apa yang kita harapkan
tetapi Allah akan memberi apa yang kita perlukan
SANWACANA
Puji syukur Penulis ucapkan kehadirat Allah Subhanahu Wa Ta’ala, karena hanya dengan rahmat dan ridho-Nya tesis ini dapat diselesaikan.
Tesis dengan judul “Sintesis dan Karakterisasi Senyawa Dibutiltimah(IV)
Diklorobenzoat sebagai Inhibitor Korosi pada Baja Lunak” adalah Sebagai Salah Satu Syarat untuk Mencapai Gelar Magister Sains pada Program Pascasarjana Magister Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam di Universitas Lampung.
Pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Bapak Prof. Sutopo Hadi, M.Sc., Ph.D. selaku Pembimbing Utama,
Pembimbing Akademik, dan Ketua Program Studi Magister Kimia yang telah meluangkan waktu, pikiran, dan tenaga untuk memberi masukan, arahan, dan bimbingan dalam proses penyelesaian tesis ini;
2. Bapak Dr. Hardoko Insan Qudus, M.S. selaku Pembimbing Kedua dan Kepala Laboratorium Kimia Analitik FMIPA Universitas Lampung atas bimbingan, saran, dan kritik dalam proses penyelesaian tesis ini;
3. Ibu Prof. Dr. Buhani, S.Pd., M.Si. selaku Penguji atas saran dan kritik dalam proses penyelesaian tesis ini;
5. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T. selaku Ketua Jurusan Kimia FMIPA Universitas Lampung;
6. Bapak Dr. Rudi T.M. Situmeang, M.Sc. selaku Kepala Laboratorium Kimia Anorganik-Fisik FMIPA Universitas Lampung;
7. Ibu Dra. Nuning Nurcahyani, M.Sc. selaku Ketua Jurusan Biologi dan Ibu Dra. Yulianty, M.Si. selaku Kepala Laboratorium Botani FMIPA Universitas Lampung;
8. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung; 9. Bapak dan Ibu Staf Administrasi FMIPA Universitas Lampung; 10. Kedua orang tuaku Ibunda Aisyah dan ayahanda Kaidi Hadi Suwarno,
mertuaku almarhumah/almarhum Ibu Ponirah dan Bapak Kusno, dan keluarga besarku yang selalu mendukungku dengan doa dan kesabarannya; 11. Suamiku tercinta Zulchan Afandi dan ananda tersayang Fachri Akhdan
Rasyid yang selalu menghiburku, menemaniku dengan doa-doanya dan selalu memberi semangat;
12. Mas Bambang Iswantoro, Pak Muhamad Nurissalam, dan Hapin Afriyani atas bantuan dan kerjasamanya menyelesaikan tesis ini;
13. Riskawati, SKM. atas doa dan bantuannya dalam menyelesaikan tugas-tugas kuliah;
14. Bapak Drs. Yulizar, M.M., seluruh guru, dan staf Tata Usaha SMA Negeri 1 atas perhatian, motivasi, dan kebaikannya;
16. Mbak Liza, Mbak Putri, Mbak Nora, Mas Nomo, dan Pak Gani atas semua bantuan yang diberikan;
17. Semua pihak terkait yang tidak bisa disebutkan satu per satu yang telah membantu.
Semoga Allah Subhanahu Wa Ta’ala memberikan balasan atas semua kebaikan dan bantuan yang telah diberikan. Akhir kata, Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan, akan tetapi Penulis berharap semoga tesis ini dapat bermanfaat bagi kita semua.
Bandar Lampung, Juli 2015 Penulis
DAFTAR ISI
1. Senyawa Organotimah Halida ……….. 11
2. Senyawa Organotimah Hidroksida dan Oksida …………... 12
3. Senyawa Organotimah(IV) Diklorobenzoat ……….. 13
4. Aplikasi Senyawa Organotimah ……….. 15
D. Korosi ………. 16
E. Inhibitor Korosi ……….. 19
F. Baja Lunak ………. 21
G. Potensiostat ……… 23
H. Karakterisasi ……….. 25
1. Spektroskopi IR Senyawa Organotimah ………. 25
2. Spektroskopi UV-Vis Senyawa Organotimah ………. 27
3. Resonansi Magnetik Nuklir (NMR) ……… 28
B. Alat dan Bahan ………. 32
C. Metode ………. 33
1. Sintesis Senyawa Dibutiltimah(IV) Oksida [(C4H9)2SnO]... 33
2. Sintesis senyawa dibutiltimah(IV) di-2-klorobenzoat [(C4H9)2Sn(2-OCOC6H4Cl)2] ……… 34
3. Sintesis senyawa dibutiltimah(IV) di-3-klorobenzoat [(C4H9)2Sn(3-OCOC6H4Cl)2] ……… 34
4. Sintesis senyawa dibutiltimah(IV) di-4-klorobenzoat …… 35
[(C4H9)2Sn(4-OCOC6H4Cl)2] 5. Preparasi Baja Lunak ………. 36
6. Pembuatan Medium Korosif ... 36
7. Pembuatan Larutan Inhibitor ………. 36
8. Pengaturan Pemindaian dengan Potensiostat ... 37
9. Pengujian Korosi dan Analisis Data ……….. 37
10.Analisis Kualitatif Korosi ... 39
IV. HASIL DAN PEMBAHASAN ... 41
A. Sintesis Senyawa Dibutiltimah(IV) Oksida [(C4H9)2SnO] ... 41
B. Sintesis Senyawa-Senyawa Dibutiltimah(IV) diklorobenzoat.. 45
1. Karakterisasi Menggunakan Spektrofotometer IR ... 49
2. Karakterisasi Menggunakan Spektrofotometer UV-Vis ... 52
3. Karakterisasi Menggunakan NMR ... 55
4. Analisis Unsur Menggunakan Microelemental Analyzer ... 60
C. Preparasi Baja Lunak ... 60
D. Pengujian Aktifitas Inhibitor korosi ... 62
1. Dibutiltimah(IV) diklorida ... 62
2. Dibutiltimah(IV) Oksida ... 64
3. Dibutiltimah(IV) diklorobenzoat ... 67
E. Analisis kualitatif permukaan baja ... 73
F. Mekanisme Inhibisi Korosi Dibutiltimah(IV) diklorobenzoat .. 75
V. SIMPULAN DAN SARAN ... 85
A. Simpulan ... 85
B. Saran ... 86
DAFTAR PUSTAKA ………... 87
DAFTAR TABEL
Tabel Halaman
1. Nilai pKa pada beberapa asam ………. 14 2. Perbandingan antikorosi beberapa material terhadap logam
aluminium pada media elektrolit ……… 16
3. Bilangan gelombang untuk gugus fungsi-gugus fungsi yang
terdapat dalam senyawa dibutiltimah(IV) ... 26 4. Persen rendemen hasil sintesis dibutiltimah(IV) oksida. ... 42 5. Hasil sintesis dibutiltimah(IV) di-2-klorobenzoat dengan variasi
waktu refluks. ... 47 6. Hasil sintesis dibutiltimah(IV) di-3-klorobenzoat dengan variasi
waktu refluks. ... 48 7. Hasil sintesis dibutiltimah(IV) di-4-klorobenzoat dengan variasi
waktu refluks. ... 48 8. Perbandingan pergeseran λmax senyawa awal, ligan dan hasil
sintesis. ... 55 9. Spektra 1H dan 13C pada senyawa hasil sintesis. ... 57 10. Hasil mikroanalisis dan teoritis komposisi unsur C dan H (%). ... 60 11. Data efisiensi inhibisi penambahan senyawa dibutiltimah(IV)
diklorida dibandingkan kontrol DMSO-HCl. ... 64 12. Data efisiensi inhibisi penambahan senyawa dibutiltimah(IV)
oksida dibandingkan kontrol DMSO-HCl. ... 66 13. Data efisiensi inhibisi penambahan senyawa dibutiltimah(IV)
DAFTAR GAMBAR
5. Kristal senyawa dibutiltimah(IV) oksida ……… 41
6. Spektrum IR (a) dibutiltimah(IV) diklorida dan (b) dibutiltimah(IV) oksida. ……… 43
7. Spektrum UV-Vis (a) dibutiltimah(IV) diklorida dan (b) dibutiltimah(IV) oksida. ……… 44
8. Mekanisme reaksi (a) dibutiltimah(IV) di-2-klorobenzoat, (b) dibutiltimah(IV) di-3-klorobenzoat, (c) dibutiltimah(IV) di-4-klorobenzoat. ………... 46
9. Kristal senyawa (a) dibutiltimah(IV) di-2-klorobenzoat (b) dibutiltimah(IV) di-3-klorobenzoat (c) dibutiltimah(IV) di-4-klorobenzoat. ………... 47
10. Spektrum IR (a) asam 2-klorobenzoat, (b) asam 3-klorobenzoat, dan (c) asam 4-klorobenzoat. ………... 50
11. Spektrum IR (a) dibutiltimah(IV) oksida (b) dibutiltimah(IV) di-2-klorobenzoat (c) dibutiltimah(IV) di-3-klorobenzoat (d) dibutiltimah(IV) di-4-klorobenzoat. ………. 51
13. Struktur (a) dibutiltimah(IV) di-2-klorobenzoat, (b) dibutiltimah(IV)
di-3-klorobenzoat, dan (c) dibutiltimah(IV) di-4-klorobenzoat... 56 14. Spektrum 1H NMR (a) dibutiltimah(IV) di-2-klorobenzoat,
(b) dibutiltimah(IV) di-3-klorobenzoat, dan (c) dibutiltimah(IV)
di-4-klorobenzoat. ………... 58 15. Spektrum 13C NMR (a) dibutiltimah(IV) di-2-klorobenzoat,
(b) dibutiltimah(IV) di-3-klorobenzoat, dan (c) dibutiltimah(IV)
di-4-klorobenzoat. ………... 59 16. (a) Potongan baja sebelum diamplas dan (b) Potongan baja setelah
Diamplas ………... 61 17. (a) Pemindaian pada katoda dan (b) pemindaian pada anoda... 62 18. Grafik hasil pemindaian senyawa dibutiltimah(IV) diklorida
terhadap kontrol medium korosif tanpa inhibitor. …………... 63 19. Grafik hasil pemindaian senyawa dibutiltimah(IV) oksida terhadap
kontrol medium korosif tanpa ihibitor. …………... 65 20. Grafik persen efisiensi inhibisi pada senyawa dibutiltimah(IV)
diklorida dengan dibutiltimah(IV) oksida. …………... 66 21. Grafik hasil pemindaian senyawa (a) dibutiltimah(IV)
di-2-klorobenzoat, (b) dibutiltimah(IV) di-3-klorobenzoat,
dan (c) dibutiltimah(IV) di-4-klorobenzoat. …………... 68 22. Grafik persen efisiensi inhibisi senyawa dibutiltimah(IV)
di-2-klorobenzoat, dibutiltimah(IV) di-3-klorobenzoat, dan
dibutiltimah(IV) di-4-klorobenzoat. …………... 71 23. Perendaman permukaan baja pada (a) medium korosif tanpa inhibitor,
(b) penambahan senyawa dibutiltimah(IV) 2-klorobenzoat, (c) penambahan senyawa dibutitimah(IV) 3-klorobenzoat,
(d) penambahan senyawa dibutiltimah(IV) 4-klorobenzoat. ... 73 24. Permukaan baja pada (a) medium korosif tanpa inhibitor korosi
penambahan senyawa dibutiltimah(IV)di-2-klorobenzoat. ... 74 25. Kurva polarisasi anoda (a) dibutiltimah(IV) di-2-klorobenzoat
(b) dibutiltimah(IV) di-3-klorobenzoat, dan (c) dibutiltimah(IV)
di-4-klorobenzoat. ... 78 26. Kurva polarisasi katoda (a) dibutiltimah(IV) di-2-klorobenzoat
(b) dibutiltimah (IV) di-3-klorobenzoat, dan (c) dibutiltimah(IV)
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Korosi adalah istilah yang biasa digunakan untuk kerusakan logam akibat proses elektrokimia. Peristiwa korosi yang terjadi di sekitar kita antara lain: karat pada besi, noda pada perak, dan “platina” hijau terbentuk pada tembaga dan kuningan.
Korosi mengakibatkan kerusakan parah pada bangunan, jembatan, kapal, dan mobil. Kerugian akibat korosi logam bagi perekonomian AS diperkirakan
mencapai lebih dari 100 miliar dolar (sekitar 1.250 triliun rupiah) setahun (Chang, 2005). Di Indonesia, kerugian akibat korosi diperkirakan mencapai angka triliun rupiah, perhitungan ini meliputi biaya pemeliharaan, penggantian material, jam kerja dan keuntungan yang hilang akibat produksi yang berhenti, mengecewakan pelanggan, biaya administrasi, kerugian fisik, dan pengobatan, sehingga korosi harus dikendalikan karena sangat penting bagi segi ekonomi dan keamanan (Supardi, 2008).
Senyawa organotimah(IV) karboksilat merupakan bagian dari senyawa
organotimah(IV) karboksilat dan turunannya di beberapa negara seperti Belgia (de Vos et al., 1998; Gielen, 2003), China (Li et al., 2008), Pakistan (Shahid et al., 2003; Bhatti et al., 2005) dan Italia (Pellerito and Nagy, 2002) telah
berkembang sangat pesat. Senyawa organotimah(IV) dan turunannya terbukti sangat banyak digunakan dalam bermacam-macam uji biologis, sehingga perlu dikembangkan penelitian dalam bidang ini di Indonesia agar diperoleh manfaat secara lebih luas, dan hal ini merupakan tantangan yang menarik untuk diketahui hasilnya.
Ketertarikan terhadap senyawa organotimah(IV) tidak hanya karena sifat kimia dan strukturnya yang sangat menarik (Tiekink, 1991; Shahid et al., 2003; Bhatti et al., 2005), tetapi juga karena penggunaannya yang terus meningkat diantaranya
sebagai biosida pertanian (Bonire et al., 1998; Pellerito and Nagy, 2002; Gielen, 2003), pengawet kayu (Blunden and Hill, 1991), antioksidan bagi polipropilena (Bevilacqua et al., 1996), penstabil untuk polivinilklorida (Evans and Karpel, 1985), antifouling bagi cat kapal di lautan (Blunden and Hill, 1987), antifungi (Bonire et al., 1998; Hadi et al., 2009), sebagai katalis (Blunden et al., 1987), antikanker (de Vos et al., 1998; Gielen, 2003; Li et al., 2008; Hadi and Rilyanti, 2010; Hadi et al., 2012) dan senyawa golongan organotimah(IV) karboksilat dan turunannya sebagai penghambat/ inhibitor korosi atau dikenal sebagai antikorosi (Rastogi et al., 2005; Singh et al., 2010; Rastogi et al., 2011; Hadi, S. et al., 2015).
inhibitor korosi. Penambahan inhibitor korosi merupakan salah satu cara yang paling efektif untuk mencegah korosi karena dalam penggunaannya memerlukan biaya yang relatif murah dan prosesnya sederhana. Salah satu metoda untuk menghambat kerusakan yang terjadi adalah dengan cara menggunakan inhibitor. Inhibitor korosi adalah senyawa kimia yang dapat mencegah atau memperlambat proses korosi. Sejauh ini, penggunaan inhibitor merupakan salah satu cara yang paling efektif untuk mencegah korosi, karena biayanya yang relatif murah dan prosesnya yang sederhana. Biasanya proses korosi logam berlangsung secara elektrokimia yang terjadi secara simultan pada daerah anoda dan katoda yang membentuk rangkaian arus listrik tertutup. Inhibitor biasanya ditambahkan dalam jumlah sedikit, baik secara kontinu maupun periodik menurut selang waktu tertentu (Butarbutar dan Sunaryo. 2011).
Salah satu senyawa yang sangat prospektif sebagai bahan inhibitor korosi dan memiliki kemampuan untuk meningkatkan ketahanan baja terhadap korosi adalah senyawa organotimah(IV) karboksilat. Dalam penelitian ini akan dikembangkan penggunaan senyawa organotimah(IV) karboksilat sebagai inhibitor korosi untuk baja. Dari hasil uji terhadap senyawa turunan yang telah dilakukan dengan metode polarisasi potensiodinamik diketahui bahwa senyawa organotimah(IV) karboksilat mampu menahan laju korosi terhadap baja dan logam alumunium 25 - 100 kali lebih efektif bila dibandingkan tanpa menggunakan senyawa
organotimah(IV) atau dengan bahan antikorosi yang lain (Singh et al., 2010).
meningkatkan ketahanan baja terhadap korosi. Bahan awal yang digunakan yaitu dibutiltimah(IV) diklorida dengan variasi ligan asam 2-klorobenzoat, asam 3-klorobenzoat, dan asam 4-klorobenzoat. Hasil sintesis akan dikarakterisasi menggunakan spektrofotometer IR, spektrofotometer UV-Vis, 1H NMR, 13C NMR, dan microelemental analyzer.
Hasil sintesis senyawa turunan organotimah(IV) karboksilat yaitu:
dibutiltimah(IV) di-2-klorobenzoat, dibutiltimah(IV) di-3-klorobenzoat, dan dibutiltimah(IV) di-4-klorobenzoat akan diuji aktifitas laju korosinya terhadap baja lunak Hot Roller Plate (HRP) menggunakan alat ukur potensiodinamik EA466 Potentiostat. Metode yang digunakan untuk memonitor laju korosi yang
terjadi adalah metode polarisasi potensiodinamik. Metode polarisasi
B. Tujuan
Tujuan dari penelitian ini adalah sebagai berikut:
1. Mensintesis dan mengkarakterisasi senyawa dibutiltimah(IV)
di-2-klorobenzoat, dibutiltimah(IV) di-3-di-2-klorobenzoat, dan dibutiltimah(IV) di-4-klorobenzoat.
2. Menguji senyawa hasil sintesis terhadap aktifitas inhibitor korosi
sehingga diharapkan mendapatkan bahan inhibitor korosi yang efektif untuk meningkatkan ketahanan baja lunak terhadap pengaruh korosi.
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Timah
Timah atau stannum (Sn) merupakan logam berwarna putih keperakan yang dapat ditempa dan liat pada suhu biasa, tetapi pada suhu rendah menjadi getas karena berubah menjadi suatu modifikasi alotropi yang berlainan. Logam ini dapat larut dengan lambat dalam asam klorida encer dan asam sulfat encer, dengan
membentuk garam-garam timah(II). Asam nitrat encer melarutkan timah dengan lambat tanpa pelepasan gas apapun, dan terbentuk ion-ion timah(II) dan amonium:
4Sn + 10 H+ + NO3- 4Sn2+ + NH4+ + 3H2O (2.1)
Timah dengan asam nitrat pekat terjadi reaksi yang keras dan menghasilkan zat padat putih, biasanya dirumuskan sebagai timah(IV) oksida terhidrasi SnO2.xH2O atau asam metastanat.
3 Sn + 4HNO3 + (x – 2)H2O 4NO + 3 SnO2.xH2O (2.2)
Timah dapat membentuk bivalen dan tetravalen dalam senyawa-senyawanya.
1. Senyawa timah(II) atau stano, biasanya tidak berwarna. Dalam larutan asam, kita dapatkan ion-ion timah(II) Sn2+, sedangkan dalam larutan basa, kita dapatkan ion-ion tetrahidroksostanat(II) atau ion stanit [Sn(OH)4]2-. Kedua ion ini mudah berubah satu sama lain:
Sn2+ + 4OH- [Sn(OH)
4]2- (2.3)
Ion timah(II) merupakan zat pereduksi yang kuat
2. Senyawa timah(IV) atau stani lebih stabil. Dalam larutan airnya, senyawa – senyawa ini bisa terdapat sebagai ion timah(IV) Sn4+ atau sebagai ion heksahidroksostanat(IV) atau stanat [Sn(OH)6]2- . Ion-ion ini juga membentuk sistem kesetimbangan:
Sn4+ + 6OH- [Sn(OH)6]2- (2.4) Dalam larutan asam, kesetimbangan bergeser ke arah kiri, sedangkan dalam suasana basa kesetimbangan bergeser ke kanan (Vogel, 1990).
Dalam tabel periodik timah termasuk golongan 14. Timah mempunyai titik didih 2270°C dan titik lebur 231,97°C. Unsur ini dijumpai sebagai timah(IV) oksida dalam bijih seperti kasiterit (SnO2) dan stanit (Cu2FeSnS4), serta diekstraksi melalui reduksi dengan karbon (Daintith, 1990).
B. Senyawa Organologam
Senyawa organologam adalah senyawa yang di dalamnya terdapat karbon yang terikat langsung ke suatu atom logam (seperti raksa, seng, timbal, magnesium, litium) atau ke metaloid-metaloid tertentu (seperti silikon, arsen, selen)
(Fessenden dan Fessenden, 1986). Untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa organologam. Sebagai contoh suatu alkoksida seperti (C3H7O)4Ti tidak termasuk senyawa organologam, karena gugus organiknya terikat pada Ti melalui atom oksigen, sedangkan senyawa
(C6H5)Ti(OC3H7)3 adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti.
Jenis-jenis ikatan yang terbentuk pada senyawa organologam: 1. Senyawa ionik dari logam elektropositif
2. Senyawa yang memiliki ikatan sigma (-σ)
Senyawaan organo yang sisa organiknya terikat pada suatu atom logam dengan suatu ikatan yang digolongkan sebagai ikatan kovalen (walaupun masih ada karakter-karakter ionik dari senyawaan ini) yang dibentuk oleh kebanyakan logam dengan keelektropositifan yang relatif lebih rendah dari golongan pertama di atas, dan sehubungan dengan beberapa faktor berikut:
a. Kemungkinan penggunaan orbital d yang lebih tinggi, seperti pada SiR4 yang tidak tampak dalam CR4.
b. Kemampuan donor alkil atau aril dengan pasangan elektron menyendiri. c. Keasaman Lewis sehubungan dengan kulit valensi yang tidak penuh
seperti ada BR2 atau koordinasi tak jenuh seperti ZnR2.
d. Pengaruh perbedaan keelektronegatifan antara ikatan logam-karbon (M-C) atau karbon-karbon (C-C).
3. Senyawa yang terikat secara nonklasik
Dalam beberapa senyawa organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan
kelebihan pasangan elektron menyendiri. Senyawa ini terbagi menjadi dua golongan:
a. Senyawa organologam yang terbentuk antara logam-logam transisi dengan alkena, alkuna, benzena, dan senyawa organik tak jenuh lainnya.
b. Senyawa organologam yang memiliki gugus-gugus alkil berjembatan (Cotton dan Wilkinson, 1989).
C. Senyawa Organotimah
Senyawa organotimah mempunyai sejumlah kegunaan dalam cat anti pencemaran laut, fungisida, pengawet kayu, dan sebagai katalis untuk perawatan resin silicon dan resin epoksi (Cotton dan Wilkinson, 1989). Senyawa organotimah adalah senyawa yang mengandung sedikitnya satu ikatan kovalen Sn-C. Sebagian besar senyawa ini dapat dianggap sebagai turunan dari RnSnX4-n (n = 1-4) dan
diklasifikasikan sebagai mono-, di-, tri-, dan tetra- organotimah(IV), tergantung dari jumlah alkil (R) atau aril (Ar) yang terikat pada atom logam. Anion yang terikat (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002; Hadi et al., 2008).
Penggabungan SnR4 melalui gugus alkil tidak teramati sama sekali. Senyawa-senyawa dengan rumus R3SnX atau R2SnX2 tergabung secara luas melalui jembatan X sehingga meningkatkan bilangan koordinasi Sn menjadi lima, enam atau bahkan tujuh. Dalam hal ini, F lebih efektif dibandingkan unsur-unsur halogen lainnya. Sebagai contoh Me3SnF memiliki struktur trigonal bipiramida, Me2SnF2 memiliki struktur oktahedral sedangkan jembatan Cl yang lebih lemah memiliki struktur terdistorsi.
Empat tipe utama penstabil timah berdasarkan gugus alkilnya yaitu: oktil, butil, fenil dan metal. Gugus oktil timah memiliki kandungan timah paling sedikit, paling kurang efisien. Ligan-ligan utama yang digunakan untuk membedakan berbagai penstabil timah yaitu asam tioglikolat ester dan asam karboksilat (Van Der Weij, 1981).
1. Senyawa organotimah halida
Rumus umum senyawa organotimah halida: RnSnX4-n (n = 1-3; X = Cl, Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif. Organotimah halida ini dapat disintesis secara langsung melalui logam timah, Sn(II) atau Sn(IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida.
Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui reaksi di bawah ini:
Metode lain yang sering digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi tetraalkiltimah dengan timah(IV) klorida. Caranya dengan mengubah perbandingan material awal, seperti pada reaksi berikut:
3 R4Sn + SnCl4 4 R3SnCl (2.6) R4Sn + SnCl4 2 R2SnCl2 (2.7) Senyawa organotimah klorida digunakan sebagai starting material (bahan dasar) untuk sintesis organotimah halida lainnya, melalui penggantian langsung ion kloridanya dengan menggunakan logam halida lain yang sesuai, seperti pada reaksi berikut:
RnSnCl4-n + (4-n) MX RnSnX4-n + (4-n) MCl (2.8) (X = F, Br atau I; M = K, Na, NH4) (Wilkinson, 1982).
2. Senyawa organotimah hidroksida dan oksida
Produk kompleks yang diperoleh melalui hidrolisis dari trialkiltimah halida atau senyawa R3SnX, merupakan rute utama pada trialkiltimah oksida dan trialkiltimah hidroksida. Tahapan intermediet ditunjukkan pada reaksi di bawah ini:
OH
R3SnX R2Sn XR2SnOSnR2X XR3SnOSnR3OH R2SnO (2.9) X atau
3. Senyawa organotimah(IV) diklorobenzoat
Senyawa organotimah(IV) diklorobenzoat merupakan turunan dari senyawa organotimah karboksilat. Senyawa organotimah karboksilat umumnya dapat disintesis melalui dua cara yaitu dari organotimah oksida atau organotimah hidroksidanya dengan garam karboksilat dan dari organotimah halidanya dengan garam karboksilat. Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah menggunakan organotimah halida sebagai material awal.
Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau hidroksida dilakukan melalui dehidrasi azeotropik dari reaktan dalam toluena, seperti reaksi berikut:
R2SnO + 2 R’COOH R2Sn(OCOR’)2 + H2O (2.10) R3SnOH + R’COOH R3SnOCOR’ + H2O (2.11) (Wilkinson, 1982).
Pada penelitian ini disintesis senyawa dibutiltimah(IV) diklorobenzoat dari bahan awal dibutiltimah(IV) diklorida direaksikan dengan NaOH dengan reaksi:
(C4H9)2SnCl2 + 2NaOH (C4H9)2SnO + 2NaCl + H2O (2.12) Hasil reaksi dicuci dengan akuabides dan metanol p.a, kemudian senyawa hasil reaksi dibutiltimah(IV) oksida direaksikan dengan asam kloro benzoat sebagai ligan. Nilai pKa dari asam klorobenzoat dapat dilihat pada Tabel 1. Asam kloro benzoat yang digunakan ada 3 jenis yaitu:
a. Asam 2-klorobenzoat
b. Asam 3-klorobenzoat
Rumus molekul C7H5ClO2, berat molekul 156,57 g/mol, dan titik lebur antara 153 - 157°C
c. Asam 4-klorobenzoat
Rumus molekul C7H5ClO2, berat molekul 156,57 g/mol, dan titik lebur antara 238 - 241°C
(Sigma-Aldrich, 2014)
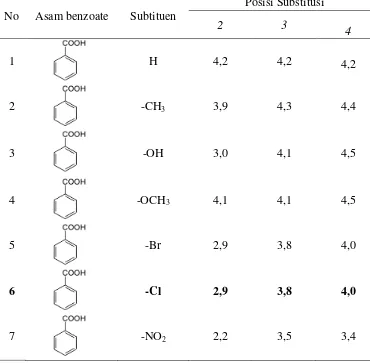
Tabel 1. Nilai pKa pada beberapa asam
No Asam benzoate Subtituen
Posisi Substitusi
2 3
4
1 H 4,2 4,2 4,2
2 -CH3 3,9 4,3 4,4
3 -OH 3,0 4,1 4,5
4 -OCH3 4,1 4,1 4,5
5 -Br 2,9 3,8 4,0
6 -Cl 2,9 3,8 4,0
7 -NO2 2,2 3,5 3,4
Pada Tabel 1, jika di bandingkan antara asam o-klorobenzoat atau asam 2-klorobenzoat, asam m-klorobenzoat atau asam 3-klorobenzoat dan asam
p-klorobenzoat atau asam 4-p-klorobenzoat, maka dilihat bahwa asam 2-p-klorobenzoat memiliki nilai pKa yang terkecil sehingga keasaman asam 2-klorobenzoat lebih kuat dibandingkan keasaman asam 3-klorobenzoat dan asam 4-klorobenzoat (Fessenden and Fessenden, 1986).
Reaksi yang terjadi pada dibutiltimah(IV) oksida dengan asam klorobenzoat membentuk dibutiltimah(IV) diklorobenzoat adalah:
(C4H9)2SnO + 2 C7H5ClO2 (C4H9)2Sn(C7H4ClO2)2 + H2O (2.13)
4. Aplikasi Senyawa Organotimah
Senyawa organotimah memiliki aktivitas biologis yang kuat yang dipengaruhi oleh jumlah dan gugus organik yang terikat pada atom pusat Sn. Aplikasi
senyawa organotimah dalam industri antara lain sebagai senyawa penstabil PVC, pestisida nonsistematik, katalis antioksidan, antifouling agent dalam cat, penstabil pada plastik dan karet sintetik, sebagai stabilizer untuk parfum dan berbagai macam peralatan yang berhubungan dengan medis dan gigi (Pellerito and Nagy, 2002).
organotimah yang dapat dimanfaatkan sebagai inhibitor korosi (Rastogi et al., 2005; Singh et al., 2010; Rastogi et al., 2011). Berdasarkan hasil yang telah dilaporkan oleh Singh et al. (2010) bahwa dengan adanya senyawa
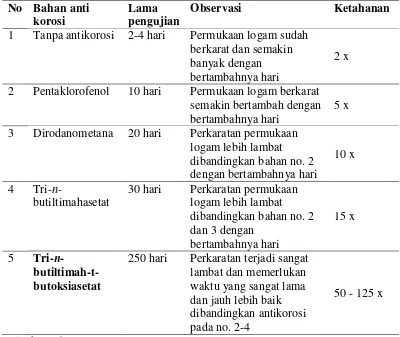
organotimah(IV), akan meningkatkan ketahanan material terhadap korosi sampai 25 kali atau bahkan mencapai 100 kali. Hal ini seperti terlihat pada Tabel 2.
Tabel 2. Perbandingan antikorosi beberapa material terhadap logam alumunium pada media elektrolit
1 Tanpa antikorosi 2-4 hari Permukaan logam sudah berkarat dan semakin banyak dengan bertambahnya hari
2 x
2 Pentaklorofenol 10 hari Permukaan logam berkarat semakin bertambah dengan bertambahnya hari
5 x
3 Dirodanometana 20 hari Perkaratan permukaan logam lebih lambat
30 hari Perkaratan permukaan logam lebih lambat
250 hari Perkaratan terjadi sangat lambat dan memerlukan
reaksi setengah sel yang melepaskan elektron (reaksi oksidasi pada anodik) dan reaksi setengah sel yang menerima elektron (reaksi reduksi pada katodik). Kedua reaksi ini berlangsung sampai terjadi kesetimbangan dinamis sehingga jumlah elektron yang dilepas sama dengan jumlah elektron yang diterima. Suatu logam yang dicelupkan pada larutan elektrolit, maka akan terbentuk dua lokasi yang disebut anoda dan katoda. Pada anoda, tempat terjadinya reaksi oksidasi dan biasanya terkorosi yaitu:
M Mz+ + ze- (2.14)
Pada katoda, tempat terjadinya reaksi reduksi dan tidak mengalami korosi. Dua reaksi penting yang umum terjadi pada katoda, tergantung pH larutan:
pH < 7 : 2H+ + 2e- H
2 (2.15)
pH ≥7 : O2 + 2H2O + 4e- 4OH- (2.16)
(Butarbutar dan Sunaryo, 2011)
Bentuk-bentuk korosi
Berdasarkan bentuknya, korosi dapat dibagi menjadi enam jenis:
1. Korosi batas butir
Pada korosi batas butir ini timbul keretakan pada logam akibat korosi melalui batas butir. Retak yang ditimbulkan korosi jenis ini disebut stress corrosion cracking (SCC) yang terdiri atas retak interglanular dan retak transgranular.
2. Korosi merata
Korosi merata merupakan bentuk korosi yang sering terjadi pada besi yang mengalami perendaman dalam larutan asam. Logam besi akan menjadi tipis secara merata pada permukaannya dengan kecepatan yang hampir sama, sehingga daerah-daerah anoda dan katoda tersebar pada seluruh permukaan. Contohnya sebatang besi (Fe) atau seng (Zn) direndam dalam larutan H2SO4, keduanya akan larut dengan laju yang merata pada permukaan logam.
3. Korosi sumuran
Korosi sumuran adalah bentuk penyerangan korosi setempat yang menghasilkan sumur pada logam ditempat tertentu. Logam mula-mula terserang korosi pada suatu titik di permukaannya atau pada daerah tertentu yang sangat kecil dan diteruskan menuju ke dalam logam. Penyebab korosi sumuran umumnya adalah serangan selektif terhadap logam di tempat-tempat yang lapisan pelindung permukaannya tergores atau pecah akibat perlakuan mekanik. Korosi ini terjadi pada permukaan oksida pelindung logam sebagai stimulasi dari reaksi anoda, aktivasi anion, reaksi katoda melalui kehadiran agen pengoksidasi dan melalui permukaan katoda efektif dengan polarisasi rendah. Korosi sumuran akan terjadi jika logam memenuhi potensial korosi minimum yang selanjutnya disebut sebagai potensial pitting.
4. Korosi celah
Korosi celah terjadi pada suatu logam di daerah yang berhubungan langsung dengan bahan lain yang bukan logam. Umumnya terjadi karena terdapat
5. Korosi galvanik
Korosi galvanik terjadi karena perbedaan potensial antara dua logam yang tidak sama, bila kedua logam ini bersinggungan akan menghasilkan aliran elektron diantara kedua logam tersebut. Logam yang lebih mulia bersifat katodik dan akan diserang korosi lebih kecil, sedangkan logam yang kurang mulia bersifat anodik akan lebih mudah diserang korosi.
6. Korosi Erosi
Korosi erosi disebabkan oleh gabungan peristiwa korosi akibat aliran fluida sehingga proses terjadinya korosi lebih cepat. Korosi ini cirinya ada
gelombang dan lembah dengan suatu pola tertentu (Fontana, 1986).
E. Inhibitor korosi
Inhibitor korosi adalah senyawa kimia yang dapat mencegah atau memperlambat proses korosi. Inhibitor korosi apabila ditambahkan dalam jumlah relatif sedikit ke dalam sistem logam-media elektrolit akan menurunkan laju korosi logam (Fontana, 1986). Sampai saat ini, penggunaan inhibitor merupakan salah satu cara yang paling efektif untuk mencegah korosi, karena biayanya yang relatif murah dan prosesnya yang sederhana. Biasanya proses korosi logam berlangsung secara elektrokimia yang terjadi secara simultan pada daerah anoda dan katoda yang membentuk rangkaian arus listrik tertutup. Inhibitor biasanya ditambahkan dalam jumlah sedikit, baik secara kontinu maupun periodik dengan selang waktu tertentu
3. Menambah hambatan listrik dipermukaan logam
4. Menangkap atau menjebak zat korosif dalam larutan melalui pembentukan senyawa yang tidak agresif
Mekanisme kerja inhibitor dapat dibedakan menjadi:
1. Inhibitor teradsorpsi pada permukaan logam dan membentuk suatu lapisan tipis dengan ketebalan beberapa molekul inhibitor. Lapisan ini tidak dapat dilihat oleh mata biasa, namun dapat menghambat penyerangan lingkungan terhadap logamnya.
2. Melalui pengaruh lingkungan, misalnya pH menyebabkan inhibitor dapat mengendap dan selanjutnya teradsopsi pada permukaan logam serta
melidunginya terhadap korosi. Endapan yang terjadi cukup banyak, sehingga lapisan yang terjadi dapat teramati oleh mata.
3. Inhibitor lebih dulu mengkorosi logamnya, dan menghasilkan suatu zat kimia yang kemudian melalui peristiwa adsorpsi dari produk korosi tersebut
membentuk suatu lapisan pasif pada permukaan logam.
4. Inhibitor menghilangkan konstituen yang agresif dari lingkungannya.
Secara umum inhibitor korosi dibagi menjadi: 1. Inhibitor Anodik
potensial korosi yang tinggi atau inhibitor anodik menaikkan polarisasi anodik. Senyawa yang biasa digunakan sebagai inhibitor anodik adalah: kromat, nitrit, nitrat, molibdat, silikat, fosfat, borat.
2. Inhibitor Katodik
Inhibitor katodik menurunkan laju korosi dengan cara memperlambat reaksi katodik. Inhibitor katodik bereaksi dengan OH- untuk mengendapkan senyawa-senyawa tidak larut pada permukaan logam sehingga dapat menghalangi masuknya oksigen. Contoh inhibitor tipe ini antara lain: Zn, CaCO3, Polifosfat (Butar-butar dan Sunaryo, 2011).
F. Baja Lunak
Baja dibedakan menjadi dua yaitu baja karbon dan baja padanan. Baja karbon adalah baja yang bukan hanya tersusun atas padanan besi dan karbon, tetapi juga unsur lain yang tidak mengubah sifat baja. Baja karbon diproduksi dalam bentuk balok, profil, lembaran dan kawat.
Jenis-jenis baja karbon antara lain:
1. Baja karbon rendah yang mengandung 0,022 – 0,3 % C yang dibagi menjadi empat bagian menurut kandungannya yaitu :
a. Baja karbon rendah mengandung 0,04 % C digunakan untuk plat-plat strip.
b. Baja karbon rendah mengandung 0,05 % C digunakan untuk badan kendaraan.
d. Baja karbon rendah mengandung 0,05 – 0,3 % digunakan untuk baut paku keling, karena kepalanya harus di bentuk.
2. Baja karbon menengah
Baja karbon ini memiliki sifat –sifat mekanik yang lebih baik dari pada baja karbon rendah. Baja karbon menengah mengandung 0,3 – 0,6 % C dan memiliki ciri khas Lebih kuat dan keras dari pada baja karbon rendah, tidak mudah dibentuk dengan mesin, lebih sulit dilakukan untuk pengelasan dan dapat dikeraskan dengan baik.
3. Baja karbon tinggi.
Baja karbon tinggi memiliki kandungan antara karbon antara 0,6 – 1,7 % karbon memiliki ciri-ciri sangat kuat, dan getas/rapuh, sulit dibentuk mesin, mengandung unsur sulfur dan posfor, dan dapat dilakukan proses heat treatment dengan baik (Amanto dan Daryanto, 2006).
Pada penelitian ini digunakan baja berkarbon rendah dengan kadar karbon
berkisar 0,04% yang diproses melalui pemanasan dan berupa lembaran, jenis ini dikenal dengan nama HRP. Contoh baja jenis ini seperti terdapat pada Gambar 1.
G. Potensiostat
Potensiostat merupakan peralatan yang digunakan pada penelitian elektrokimia untuk mengamati fenomena yang terjadi selama proses korosi terjadi.
Potensiostat akan mengaplikasikan tegangan listrik inputan kepada benda uji sehingga nilai arus selama proses korosi dapat diperoleh. Peralatan potensiostat biasanya dilengkapi dengan tiga jenis elektroda yaitu:
a. Elektroda kerja (working electrode)
elektroda ini dibentuk dari logam benda uji yang akan diteliti, terkoneksi dengan sambungan listrik, dan permukaannya harus digerinda atau diamplas untuk menghilangkan oksida-oksida yang mungkin ada.
b. Elektroda bantu (auxiliary electrode)
elektroda yang khusus digunakan untuk mengalirkan arus hasil proses korosi yang terjadi dalam rangkaian sel.
c. Elektroda acuan (reference electrode)
suatu elektroda yang tegangan sirkuit terbukanya (open-circuit potential) konstan dan digunakan untuk mengukur potensial elektroda kerja.
Gambar 2. Sketsa mesin eDAQ dan benda uji (Butarbutar dan Febrianto, 2009)
Analisis data dengan EChem
EChem adalah suatu program yang biasa digunakan dalam penelitian elektrokimia. Dalam pelaksanaannya EChem ini dihubungkan dengan
potensiostat sehingga arus yang dihasilkan pada setiap tegangan yang diberikan dapat direkam oleh komputer secara langsung. Dalam pengujian korosi ini digunakan potensio dinamik untuk melakukan analisis tafel dalam rangka mendapatkan data arus korosi (Icorr) dan laju korosi (CorrRate).
Arus data korosi yang diperoleh dari pertemuan garis ekstrapolasi dapat digunakan untuk menghitung laju korosi berdasarkan Persamaan 2.17:
) ... (2.17)
Rmpy : laju korosi (mili inch/year)
Icorr :densitas arus korosi ( � �
e : berat ekivalen material (g)
: densitas material (g/� (Butarbutar dan Febrianto, 2009)
(
... (2.18) %EI : persen efisiensi penghambatan;
: arus sebelum ditambahkan inhibitor (mA)
: arus sesudah ditambahkan inhibitor (mA).(Rastogi et al., 2011).
H. Karakterisasi
Hasil penelitian yang diperoleh pada penelitian ini dikarakterisasi menggunakan spektrofotometer IR, spektrofotometer UV-Vis, 1H NMR, 13C NMR, dan analisis unsur C dan H menggunakan alat microelemental analyzer.
1. Spektrofotometer IR senyawa organotimah
Bila sinar inframerah dilewatkan melalui cuplikan, maka sejumlah frekuensi diserap sedangkan frekuensi yang lain diteruskan.di transmisikan tanpa diserap. Setiap ikatan mempunyai frekuensi rentangan/stretching dan bending yang karakteristik dan dapat menyerap sinar pada frekuensi tersebut (Sastrohamidjojo, 1985).
Spektra IR memberikan absorpsi yang bersifat aditif atau bisa juga
sebab itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Puncak-puncak yang muncul pada daerah 4000-1450 cm-1 biasanya berhubungan dengan energi untuk vibrasi uluran diatomik. Daerahnya dikenal dengan group frequency region (Sudjadi, 1985).
Secara umum, spektrum serapan IR dapat dibagi menjadi tiga daerah:
a. Inframerah dekat, dengan bilangan gelombang antara 14.300 hingga 4.000 cm-1, fenomena yang terjadi ialah absorpsi overtone C-H.
b. Inframerah sedang, dengan bilangan gelombang antara 4.000 hingga 650 cm-1, fenomena yang terjadi ialah vibrasi dan rotasi.
c. Inframerah jauh, dengan bilangan gelombang 650 hingga 200 cm-1, fenomena yang terjadi ialah penyerapan oleh ligan atau spesi lainnya yang berenergi rendah.
Bilangan gelombang untuk gugus fungsi yang terdapat pada senyawa dibutiltimah(IV) dapat dilihat pada Tabel 3.
2. Spektrofotometer UV-Vis senyawa organotimah
Pada Spektrofotometer UV-Vis, senyawa yang dianalisis akan mengalami transisi elektronik sebagai akibat penyerapan radiasi sinar UV dan sinar tampak oleh senyawa yang dianalisis. Transisi tersebut pada umumnya antara orbital ikatan atau pasangan elektron bebas dan orbital antiikatan. Panjang gelombang serapan merupakan ukuran perbedaan tingkat energi dari orbital-orbital. Agar elektron dalam ikatan sigma tereksitasi diperlukan energi paling tinggi dan memberikan serapan pada 120-200 nm (1 nm = 10-7cm = 10 Å). Daerah ini dikenal sebagai daerah ultraviolet hampa, karena pada pengukuran tidak boleh ada udara, sehingga sukar dilakukan dan relatif tidak banyak memberikan keterangan untuk penentuan struktur.
Di atas 200 nm merupakan daerah eksitasi elektron dari orbital p, d, dan
orbital π terutama sistem π terkonjugasi mudah pengukurannya dan
spektrumnya memberikan banyak keterangan. Kegunaan spektrofotometer UV-Vis ini terletak pada kemampuannya mengukur jumlah ikatan rangkap
atau konjugasi aromatik di dalam suatu molekul. Spektrofotometer ini dapat secara umum membedakan diena terkonjugasi dari diena tak terkonjugasi, diena terkonjugasi dari triena dan sebagainya. Letak serapan dapat
dipengaruhi oleh subtituen dan terutama yang berhubungan dengan subtituen yang menimbulkan pergeseran dalam diena terkonjugasi dari senyawa karbonil (Sudjadi, 1985).
eksitasinya. Hal ini berarti suatu elektron dalam orbital ikatan (bonding) dieksitasikan ke orbital antiikatan. Identifikasi kualitatif senyawa organik dalam daerah ini jauh lebih terbatas daripada dalam daerah inframerah, dikarenakan pita serapan pada daerah UV-Vis terlalu lebar dan kurang
terperinci. Tetapi gugus-gugus fungsional tertentu seperti karbonil, nitro, dan sistem tergabung menunjukkan puncak karakteristik dan dapat diperoleh informasi yang berguna mengenai ada tidaknya gugus tersebut dalam molekul (Day dan Underwood, 1998).
Spektrofotometer UV-Vis yang diukur pada penelitian ini pada panjang
gelombang 190-380 nm, dari UV-Vis akan dilihat perubahan serapan bilangan gelombang akibat perubahan gugus dari dibutiltimah(IV) diklorida menjadi dibutiltimah(IV) oksida serta senyawa hasil sintesis. Adanya penggantian ligan klorida dengan oksida atau asam klorobenzoat dapat menyebabkan efek hipokromik dan batokromik yang menyebabkan terjadi pergeseran bilangan gelombang (Sudjadi, 1985).
3. Resonansi Magnetik Nuklir (NMR)
struktur. Dalam spektroskopi NMR juga dapat memberikan informasi tambahan yang terkait dengan kopling spin-spin (Takeuchi, 2006).
Sampel diletakkan di antara kedua kutub magnet dan disinari (iradiasi) dengan gelombang radio. Bila proton-proton membalik dari keadaan paralel ke keadaan anti paralel, penyerapan energy akan dideteksi oleh suatu
indicator daya (power). Dalam suatu macam spectrometer NMR, radio frekuensinya dibuat tetap pada 60 MHz, sedangkan kuat medan luar (H0) diubah-ubah dalam suatu range kecil, dan frekuensi absorpsi direkam untuk berbagai H0. Jadi spektrum NMR ialah grafik dari banyaknya energy yang diserap (I atau intensitas) versus kuat medan magnet. Proton yang lebih mudah terbalik akan menyerap energy pada H0 lebih rendah dan
menimbulkan peak bawah-medan (downfield, lebih ke kiri), proton yang sukar membalik akan menyerap energy pada H0 lebih tinggi dan
menimbulkan peak atas-medan (upfield, lebih ke kanan) (Fessenden and Fessenden, 1982).
Pada 1H NMR, setiap proton dalam molekul dikelilingi elektron, sehingga menimbulkan sedikit perbedaan lingkungan elektronik dari satu proton dengan proton lainnya. Proton – proton dilindungi oleh elektron – elektron yang mengelilinginya sehingga efek dari perlindungan elektron menghasilkan medan magnet yang disebut dengan nilai pergeseran kimia (chemical shift).
Pergeseran kimia memiliki simbol δ, yang dinyatakan sebagai bagian tiap juta
Gambar 3. 1H-NMR
Sumber: Silverstein et al., 2005.
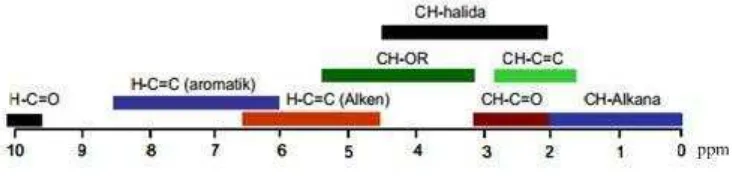
Pergesaran sinyal 13C NMR dan bentuk sinyal dari gugus metil (CH3) berbentuk quartet (q), metilen (CH2) berbentuk triplet (t), metin berbentuk doublet (d) sedangkan karbon quartener berbentuk singlet (s) dan rentang pergeseran 13C NMR dari 0 – 220 ppm (Ramiro et al., 2012; Yu-Chia et al., 2012; Wyk et al., 2007; Joseph, 1999; Roe, 1996). Rentang pergeseran 13 C-NMR disajikan pada Gambar 4.
Gambar 4. 13C-NMR
Sumber: Silverstein et al., 2008
4. Microelemental analyzer
microelemental analyzer. Hasil yang diperoleh dari mikroanalisis ini
dibandingkan dengan perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda, perbedaan biasanya antara 1–5%, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costecsh Analytical Technologies, 2011).
Prinsip dasar dari microelemental analyzer yaitu sampel dibakar pada suhu tinggi. Produk yang dihasilkan dari pembakaran tersebut merupakan gas yang telah dimurnikan kemudian dipisahkan berdasarkan masing-masing komponen dan dianalisis dengan detektor yang sesuai. Pada dasarnya, sampel yang diketahui jenisnya dapat diperkirakan beratnya dengan
III. METODE PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilakukan pada bulan Januari sampai dengan April 2015 dan analisis senyawa menggunakan spektrofotometer UV-Vis dilakukan di Laboratorium Kimia Anorganik, analisis kualitatif korosi menggunakan mikroskop trinokuler dilakukan di Laboratorium Botani, dan uji aktifitas terhadap baja lunak di Laboratorium Kimia Analitik FMIPA Universitas Lampung. Analisis senyawa menggunakan spektrofotometer IR di Laboratorium Instrumentasi FMIPA Universitas Islam Indonesia dan spektrofotometer NMR di Universiti Sains Malaysia dan analisis unsur menggunakan microelemental analyzer di School of
Chemical and Food Technology, Universiti Kebangsaan Malaysia.
B. Alat dan Bahan
ER466 Potentiostat, dan untuk mengetahui bentuk morfologi korosi logam secara
kualitatif menggunakan mikroskop trinokuler.
Bahan-bahan yang digunakan dalam penelitian ini yaitu, dibutiltimah(IV) diklorida, NaOH, metanol p.a., akuabides, asam 2-klorobenzoat, asam
3-klorobenzoat, asam 4-3-klorobenzoat, toluen, DMSO ((CH3)2SO)-HCl, aseton, dan air KCKT (Kromatografi Cair Kinerja Tinggi).
C. Metode
Prosedur untuk mensistesis senyawa organotimah(IV) diklorobenzoat pada penelitian ini berdasarkan prosedur yang telah digunakan pada penelitian sebelumnya (Hadi et al., 2009; Hadi and Rilyanti, 2010; Hadi et al., 2012) yang merupakan hasil adaptasi dari Szorcsik et al., (2002).
1. Sintesis senyawa dibutiltimah(IV) oksida [(C4H9)2SnO]
Dibutiltimah(IV) diklorida [(C4H9)2SnCl2] sebanyak 0,030 mol (9,120 gram) direaksikan dengan 0,060 mol (2,400 gram) NaOH untuk mengganti ligan klor dengan oksida dalam 50 mL pelarut metanol p.a., kemudian dipanaskan sampai suhu kurang dari atau sama dengan 60° dalam stirer. Endapan yang dihasilkan disaring menggunakan kertas saring Whatman No. 42, kemudian dicuci dengan akuabides dan metanol p.a. Endapan didiamkan dalam desikator sampai
2. Sintesis senyawa dibutiltimah(IV) di-2-klorobenzoat [(C4H9)2Sn(2-OCOC6H4Cl)2]
Senyawa dibutiltimah(IV) oksida [(C4H9)2SnO] sebanyak 0,747 gram direaksikan dengan asam 2-klorobenzoat (2-C6H4ClCOOH) sebanyak 0,939 gram dengan perbandingan mol 1:2 dalam 30 mL pelarut metanol p.a. dan direfluks dengan variasi waktu 3, 4, dan 5 jam dengan pemanas pada suhu
60C. Setelah reaksi sempurna, metanol diuapkan dan dikeringkan di dalam
desikator sampai diperoleh kristal kering dengan waktu kurang lebih 2 minggu, kemudian direkristalisasi dengan pelarut toluen sebanyak 10 mL. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks siap untuk dikarakterisasi menggunakan spektrofotometer IR, spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), 1H NMR, 13C NMR, dan dianalisis kandungan unsur C dan H dengan alat microelemental
analyzer serta diuji aktifitas inhibitor korosi menggunakan mikropipet, kertas
amplas mulai dari grit 240, 360, 400, 500, 600, dan 800, kemudian diukur menggunakan potensiodinamik ER466 Potentiostat.
3. Sintesis senyawa dibutiltimah(IV) di-3-klorobenzoat [(C4H9)2Sn(3-OCOC6H4Cl)2]
Senyawa dibutiltimah(IV) oksida [(C4H9)2SnO] sebanyak 0,747 gram direaksikan dengan asam 3-klorobenzoat (3-C6H4ClCOOH) sebanyak 0,939 gram dengan perbandingan mol 1:2 dalam 30 mL pelarut metanol p.a. dan direfluks dengan variasi waktu 3, 4, dan 5 jam dengan pemanas pada suhu 60C. Setelah reaksi sempurna, metanol diuapkan dan dikeringkan di dalam
kemudian direkristalisasi dengan pelarut toluen sebanyak 10 mL. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks siap untuk dikarakterisasi menggunakan spektrofotometer IR, spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), 1H NMR, 13C NMR, dan dianalisis kandungan unsur C dan H dengan alat microelemental
analyzer serta diuji aktifitas inhibor korosi menggunakan mikropipet, kertas
amplas mulai dari grit 240, 360, 400, 500, 600, dan 800, kemudian diukur menggunakan potensiodinamik ER466 Potentiostat.
4. Sintesis senyawa dibutiltimah(IV) di-4-klorobenzoat [(C4H9)2Sn(4-OCOC6H4Cl)2]
Senyawa dibutiltimah(IV) oksida [(C4H9)2SnO] sebanyak 0,747 gram direaksikan dengan asam 4-klorobenzoat (4-C6H4ClCOOH) sebanyak 0,939 gram dengan perbandingan mol 1:2 dalam 30 mL pelarut metanol p.a. dan direfluks dengan variasi waktu 3, 4, dan 5 jam dengan pemanas pada suhu
60C. Setelah reaksi sempurna, metanol diuapkan dan dikeringkan di dalam
desikator sampai diperoleh kristal kering dengan waktu kurang lebih 2 minggu, kemudian direkristalisasi dengan pelarut toluen sebanyak 10 mL. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks siap untuk dikarakterisasi menggunakan spektrofotometer IR, spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), 1H NMR, 13C NMR, dan dianalisis kandungan unsur C dan H dengan alat microelemental
analyzer serta diuji aktifitas inhibitor korosi menggunakan mikropipet, kertas
5. Preparasi Baja Lunak
Preparasi baja lunak dilakukan dengan memotong plat dengan ukuran (2x1) cm dan mengamplas dengan kertas amplas mulai dari grit 240, 360, 400, 500, 600, dan 800. Setelah permukaan baja lunak rata atau homogen selanjutnya
mencuci dengan akuades, larutan HCl encer, dan aseton secara berturut-turut.
6. Pembuatan Medium Korosif
Medium korosif dibuat dengan komposisi larutan DMSO 0,02 M, dan HCl 0,2 M (Rastogi et al., 2005, Rastogi et al., 2011) dengan perbandingan 1:1. 0, 14 ml DMSO p.a. dengan kadar 99 % dilarutkan dengan air KCKT dalam labu 100 mL sehingga diperoleh larutan DMSO 0,02 M, sedangkan larutan HCl 0,2 M dibuat dengan 1,67 mL larutan HCl p.a. dilarutkan pada labu 100 mL dengan pelarut air KCKT. Kedua larutan tersebut kemudian dicampurkan dengan perbandingan 1:1 dan dihomogenkan.
7. Pembuatan Larutan Inhibitor
inhibitor 400 mg/L secara berturut-turut sebanyak 1,25; 2,5; 3,75; 5; dan 6,25 mL yang diencerkan dalam labu 25 mL hingga tepat pada batas tera.
8. Pengaturan Pemindaian dengan Potensiostat
Pemindaian dilakukan dengan software Echem v2 1.8 pada menu bar Technique, liniear sweep, dan pengaturan pemindaian batasan arus pada
keseluruhan pemindaian adalah 100 mA. Hal ini disebabkan karena pada pemindaian anoda, menunjukan nilai arus yang sangat tinggi melebihi 50 mA sehingga dipilih rentang arus 100 mA untuk menghindari arus yang overflow sehingga akan mempengaruhi hasil pemindaian. Waktu pemindaian yang dibutuhkan untuk melakukan sekali pemindaian baik anoda maupun katoda adalah 200 s.
9. Pengujian Korosi dan Analisis Data
Untuk pengujian korosi berdasarkan penelitian dari Hadi et al., (2015). Alat potensiostat yang digunakan terdiri dari tiga elektroda, yaitu elektroda
komputer melalui kabel USB dan software E-chem v.2 1.8 dibuka dan pemindaian anoda diatur, selanjutnya ketiga elektroda tersebut dibiarkan berinteraksi dengan medium korosif selama 10 menit.
Setelah dibiarkan selama 10 menit, pemindaian dilakukan dengan memilih start pada potensiostat dan setelah 200 s diperoleh voltammogram hasil
pemindaian yang menyatakan hubungan antara nilai beda potensial dan arus. Data yang didapatkan dari hasil pengujian dapat diperoleh dengan memilih seluruh voltammogram kemudian memilih menu edit pada menu bar, copy special, as text, calculated current, dan kemudian ok. Data tersebut dapat
disalin pada software Microsoft Office Excel dengan memilih menu paste. Laju korosi berbagai variasi konsentrasi inhibitor ditentukan dengan metode pemindaian anoda dan katoda yang sama dengan perbandingan volume uji dari larutan inhibitor dan medium korosif sebesar 1:5.
Setelah diperoleh data besarnya beda potensial dan arus, dilakukan analisis tafel untuk menentukan besarnya logaritma normal dari nilai kerapatan arus (Ln |J|) dengan overpotensial (ɳ) yang selanjutnya diekstrapolasi ke dalam bentuk grafik. Analisis Tafel dan pembuatan grafik dikerjakan pada Microsoft Office Excel. Pembuatan grafik dilakukan dengan memilih data ln |J| dan ɳ dari hasil pemindaian anoda untuk masing masing pengujian, kemudian dipilih menu insert, charts, scatter kemudian memilih menu scatters with smoth lines and markes. Setelah data terplotkan dalam bentuk grafik, grafik dipindahkan
untuk laju selusur katoda dipilih nilai ln |J| pada pemindaian anoda sebagai absis dan ɳ sebagai ordinat pada pemindaian katoda dari masing-masing uji. Setelah diperoleh grafik antara laju selusur katoda dan anoda dari masing-masing pemindaian, ditentukan titik potong ln |J| kedua grafik tersebut pada nilai ɳ = 0. Nilai ln |J| tersebut selanjutnya dieksponensialkan sehingga diperoleh nilai kerapatan arus korosi (Jcorr). Nilai kerapatan arus korosi
selanjutnya dikalikan dengan luas permukaan elektroda kerja terukur untuk menentukan besarnya arus korosi (Icorr) sesuai dengan Persamaan 3.1:
���� = ���� � ... (3.1)
dengan
Icorr : Besaran arus korosi (mA)
Jcorr : Kerapatan arus korosi (mA/cm2)
A : Luas permukaaan elektroda kerja terukur (cm2)
Dari data yang diperoleh dapa menentukan nilai persen proteksi inhibitor untuk mengetahui tingkat efisiensi inhibitor berdasarkan persamaan 2.18.
10. Analisis Kualitatif Korosi
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan penelitian yang telah dilakukan, maka diperoleh simpulan sebagai berikut:
1. Sintesis senyawa dibutiltimah(IV) di-2-klorobenzoat, dibutiltimah(IV) di-3-klorobenzoat, dan dibutiltimah(IV) di-4-klorobenzoat telah berhasil dilakukan dengan karakterisasi menggunakan spektrofotometer IR, UV-Vis, 1H dan 13C NMR dan mikroanalisis unsur menggunakan microelemental analyzer
menunjukkan bahwa senyawa hasil sintesis adalah murni. Rendemen masing-masing senyawa sebesar 97,55; 90,80 dan 98,16%.
2. Senyawa dibutiltimah(IV) di-2-klorobenzoat, dibutiltimah(IV) di-3-klorobenzoat dan dibutiltimah(IV) di-4-di-3-klorobenzoat yang diuji aktifitas inhibitor korosi pada baja lunak dengan metode potensiostat secara
Perlu dilakukan penelitian lebih lanjut untuk mengetahui mekanisme proses penghambatan korosi pada baja lunak dengan senyawa-senyawa dibutiltimah(IV) diklorobenzoat, sehingga dapat diketahui dengan pasti mekanisme
penghambatannya melalui proses pelapisan permukaan baja oleh
DAFTAR PUSTAKA
Amanto, H dan Daryanto. 2006. Ilmu Bahan. Penerbit Bumi Aksara. Jakarta. Bevilacqua, M., M. Pereye, and B. Mailarad. 1996. Thio-organotin Antioxidants
for Polypropylene: Reactivity towards t-Butyl Hydroperoxide. Applied Organometallic Chemistry, 10: 477-484.
Bhatti, M.H., S. Ali., F. Huma. and S. Shahzadi. 2005. Organotin(IV) Derivatives of N-Maleoylamino Acids: Their Synthesis and Structural Elucidation, Turk. J. Chem. 29, 463-476.
Blunden, S.J., P. A. Cusack. and R. Hill. 1987. in The Industrial uses of tin Chemicals. The Royal Society of Chemistry. London.
Blunden, S.J. and R. Hill. 1987. in Surface Coating 1. Wilson, A.D., J.W Nicholson,. and H.J. Prosser. (Eds). Elsevier Applied Science Publisher, pp. 17 – 167.
Blunden, S.J. and R. Hill. 1991. Bis(tributyltin) oxide as a wood preservative: Its conversion to tributyltin carboxylates in Pinus sylvestris. Applied
Organometallic Chemistry, 4: 63-68.
Bonire, J.J., G.A. Ayoko, P.F. Olurinola, J.O. Ehinmidu, N.S.N. Jalil and A.A. Omachi. 1998. Syntheses and Antifungal Activity of some
organotin(IV)carboxylates. Metal-Based Drugs. 5 (4), 233 - 236.
Butarbutar, S. L. dan Febrianto. 2009. Pengujian Mesin eDAQ untuk Mengukur Laju Korosi. Sigma Epsilon. 13 (2): 54-58.
Butarbutar, S. L. dan G. R. Sunaryo. 2011. Analisis Mekanisme Pengaruh
Inhibitor Siskem Pada Material Baja Karbon. Prosiding Seminar Nasional ke-17 Teknologi dan Keselamatan PLTN Serta Fasilitas Nuklir Yogyakarta ISSN: 0854 - 2910.
Bonire, J.J., G.A. Ayoko, P.F. Olurinola, J.O. Ehinmidu, N.S.N. Jalil and A.A. Omachi. 1998. Syntheses and Antifungal Activity of some
Caprette, D.R. 2007. Using a Caunting Chamber. Lab Guides. Rice University. Chang, R. 2005. Kimia Dasar Konsep-Konsep Inti Jilid 2. Erlangga. Jakarta. Costech Analytical Technologies. 2011. Elemental Combiustion System CHNS.
http://costech analytical.com/. Diakses pada 10 Februari 2013. Cotton, F.A. dan G. Wilkinson. 1989. Kimia Anorganik Dasar. UI Press.
Jakarta.
Daintith, J. 1990. Kamus Lengkap Kimia (Oxford). Erlangga. Jakarta.
Day, R.A. dan A.L. Underwood. 1998. Analisis Kimia Kuantitatif Edisi Keenam. Terjemahan oleh A.H. Pudjaatmaka. Erlangga. Jakarta.
De Vost, D., R. Willem., M. Gielen., K.E. Van Wingerden, and K. Nooter. 1998. The Development of Novel Organotin Anti-Tumor Drugs: Structure and Activity. Metal-Based Drugs. 5 (4): 179-188.
Evans, C.J. and S. Karpel. 1985. Organotin Compounds in Modern Technology. Elsevier, Amsterdam.
Fessenden, R.J. and J.S. Fessenden. 1986. Kimia Organik Dasar Edisi Ketiga. Jilid 1. Terjemahan oleh A.H. Pudjaatmaka. Erlangga. Jakarta. Fessenden, R.J. and J.S. Fessenden. 1986. Kimia Organik Dasar Edisi Ketiga.
Jilid 2. Terjemahan oleh A.H. Pudjaatmaka. Erlangga. Jakarta.
Fontana, M.G. 1986. Corrosion Engineering, Third Edition. McGraw Hill Book Company. Singapura.
Gielen, M. 2003. An Overview of Forty Years Organotin Chemistry Developed at the Free Universities of Brussels ULB and VUB. J. Braz. Chem. Soc., 14 (6): 870-877.
Hadi, S., B. Irawan and Efri. 2008. The Antifungal Activity Test of Some Organotin(IV) Carboxylates. Journal of Applied Sciences Research. 4 (11): 1521-1525.
Hadi, S., M. Rilyanti, and Nurhasanah. 2009. Comparative Study on the Antifungal Activity of Some Di- and Tributyltin(IV) Carboxylate Compounds. Modern Applied Science. 3 (2): 12-17.
Hadi, S., M. Rilyanti and Suharso. 2012. In Vitro Activity and Comparative Studies Of Some Organotin(IV) Benzoate Derivatives Against Leukemia Cancer Cell, L-1210. Indonesian Journal of Chemistry, 12 (1): 172-177. Hadi, S., H. Afriani., W.D. Anggraini., H.I. Qudus., and T. Suhartati. 2015. The
Synthesis and Potency Study of Some Dibutyltin(IV) Dinitrobenzoate Compounds as Corrosion Inhibitor for Mild Steel HRP in DMSO-HCl Solution. Asian Journal of Chemistry, 27 (4), 1509-1512.
Joseph, P.H. 1999. Teaching NMR Using Online Textbooks. Journal Molecules 4(12): 353-365.
Lambert, J.B. and E.P. Mazolla. 2004. Nuclear Magnetic Resonance Spectroscopy: An Introduction to Principles, Applications, and Experimental Methods. Pearson Education.
Li, Y., Y. Li., Y. Niu., L. Jie., X. Shang., J. Guo. and Q. Li. 2008. Synthesis and antitumor activity of a new mixed-ligand complex
di-n-butyl-(4-chlorobenzohydroxamato)tin(IV) chloride. Journal of Bioinorganic Chemistry, 102: 1731–1735.
McMurry, J. 2008. Organic Chemistry. 7th edition. Graphic World Inc. p. 440-469.
Owen, S.M. and A.T. Brooker. 1991. A guide to Modern Inorganic Chemistry. Longman Group. UK. Limited.
Pellerito, L. and L. Nagy. 2002. Organotin(IV)n+ Complexes Formed with Biologically Active Ligands: Equilibrium and Structural Studies, and Some Biological Aspects, Coord. Chem. Rev. 224: 111 – 150.
Purcell, K.F. and F. Keith. 1980. An Introduction to Inorganic Chemistry. Souders College. Phladelphia. P 52-59.
Ramiro, Q.L., M.C. Rolando., G.F. Ricardo., L. Hartmut., J.V. María., H.M. Humberto., T.G. Patricia., T.G. Reyes., and R.P. Cristina. 2012. Bioassay-Guided Isolation and Identification of Cytotoxic Compounds from
Gymnosperma glutinosum Leaves. Molecules Journal, 17: 11229-11241.
Rastogi, R.B., M.M. Singh., K. Singh., and M. Yadav. 2005. Organotin dithiohydrazodicarbonamides as corrosion inhibitors for mild steel
dimethyl sulfoxide containing HCl. Port. Electrochim. Acta, 22, 315–332. Rastogi, R.B., M.M. Singh., K. Singh., and M. Yadav. 2011. Organotin
Roe, J.E., W.E. Prenttice., and J. P. Hornak., 1996. Multipurpose MRI Phantom Based on a Reverse Micelle Solution. Magn. Reson. Med. 35 p.136-141.
Sastrohamidjodjo, H. 1985. Spektroskopi. Liberty Yogyakarta. Yogyakarta. Sigma-Aldrich. 2014. Section 1: Identification of the substance/mixture and of
company/Undertaking.
Silverstein, R.M., F.X. Webster., and D.J. Kiemle. 2005. Spectrometric
Identification Of Organic Compounds. 7th edition. State University of New York. John Wiley & Sons, Inc.
Singh, R., P. Chaudary and N.K. Khausik. 2010. A Review: Organotin
Compounds in Corrosion Inhibition. Rev. Inorg. Chem. 30 (4): 275 – 294. Shahid, K., S. Ali., S. Shahzadi., and Z. Akhtar. 2003. Organotin(IV) Complexes
on Aniline Derivaties Part-II-Synthesis and Spectroscopic Characterization of Organotin(IV) Derivatives of 2-[4-Bromoanailine)carboxyl]benzoic Acid, Turk. J. Chem. 27, 209-215.
Sudjadi. 1985. Penentuan Struktur Senyawa Organik. Ghalia Indonesia. Jakarta.
Sukarjo.1992. Kimia Koordinasi. P.T. Bina Aksara. Jakarta. Halaman 101-111 Supardi, R. Korosi dan Kegagalan yang Terjadi pada Pengecatan Otomotif.
http://www.dprin.go.id/data/industry/abstech/abs_0710.htm, diakses tanggal 20 Februari 2008.
Szorcsik, A., L. Nagy, K. Gadja-Schrantz, L. Pallerito, E. Nagy and E.T.
Edelmann. 2002. Structural Studies on Organotin(IV) Complexes Formed with Ligands Containing {S, N, O} Donor Atoms, J. Radioanal. Nucl. Chem. 252 (3): 523 – 530.
Takeuchi, Y. 2006. Buku Pengantar Kimia Online. Penerjemah Ismunandar. Iwanawi Publishing Company. 272 halaman.
Tiekink, E.R.T. 1991. Structural Chemistry of Organotin Carboxylates: a Review of the Crystallographic Literature. App. Organomet. Chem. 5: 1-30. Van Der Weij, F.W. 1981. Kinetics and Mechanism of Urethane Formation
Catalysed by Organotin Compound. Journal Science Polymer Chemistry. 19 (2): 381-388.
Wilkinson, J.B. 1982. Comprehensive Organometallic Chemistry. International Tin Research Institude, Publication No. 618. Pergamon Press.
www.tokobesionline.com. Gambar Hot Roller Plate. Diakses tanggal 2 Juli 2014.
Wyk, A. W.W., P.W. Froneman., K.S. Bernard., and M.T.D. Coleman. 2007. New isocopalane diterpene diester from a sub-Antarctic marine
nudibranch. J. Arkivoc, 9: 121-128.
Yu-Chia, C., T. Shang-Wei., T. Li-Lian., Y. Chou., H. Yuan-Shing., L. Mei-Chin., and S. Jui-Hsin. 2012. Cytotoxic Sesterpenoid from a Sponge