Lampiran 2. Data analisis karakteristik Polisakarida Larut Air (PLA) Bengkuang
Parameter Ulangan Rataan Standar
deviasi
I II III
Lampiran 3. Daftar analisis sidik ragam uji toleransi glukosa
SK Db JK KT F hit. F.05 F.01
Perlakuan 3 1320,667 440,222 4,86 ** 1,1147 1,1663
Galat 16 724,00 90,50
Total 19 2044,667
Keterangan:
FK = 90.133,33 KK = 10,98%
Lampiran 4. Daftar analisis sidik ragam berat badan mencit percobaan
SK db JK KT F hit. F.05 F.01
Perlakuan 15 0,268 0,018 1,926 * 1,8256 2,3317
P 3 0,181 0,060 6,499 ** 2,7482 4,1033
M 3 0,049 0,016 1,773 tn 2,7482 4,1033
B Lin 1 0,033 0,033 3,547 tn 3,9909 7,0483
B Kuad 1 0,014 0,014 1,490 tn 3,9909 7,0483
B Kub 1 0,003 0,003 0,283 tn 3,9909 7,0483
PxM 9 0,038 0,004 0,452 tn 2,0298 2,6980
Galat 64 0,594 0,009
Total 79 0,862
Keterangan:
FK = 0,5191
KK = 5,782% ** = sangat nyata
Lampiran 5. Daftar analisis sidik ragam kadar glukosa darah mencit percobaan
Keterangan:
FK = 0,5191
KK = 5,782% ** = sangat nyata
* = nyata tn = tidak nyata
SK Db JK KT F hit. F.05 F.01
Perlakuan 15 23662,688 1577,513 9,538 ** 1,8256 2,3317 P 3 17862,738 5954,246 36,002 ** 2,7482 4,1033 M 3 3455,738 1151,913 6,965 ** 2,7482 4,1033 M Lin 1 3381,423 3381,423 20,445 ** 3,9909 7,0483 M Kuad 1 43,513 43,513 0,263 tn 3,9909 7,0483 M Kub 1 30,803 30,803 0,186 tn 3,9909 7,0483 PxM 9 2344,212 260,468 1,575 ** 2,0298 2,6980
Galat 64 10584,800 165,388
Lampiran 6. Gambar penelitian
Umbi bengkuang Polisakarida larut air bengkuang
Blood Glucose Test Meter Strip Gluko Dr sebagai alat ukur glukosa darah
Injeksi streptozotocin Pemberian PLA dengan oral
DAFTAR PUSTAKA
Adi, L. T. 2008. Tanaman Obat dan Jus, Untuk mengatasi Penyakit Jantung, Hipertensi, Kolesterol, dan Stroke. Agromedia Pustaka, Jakarta.
Angulo-Bejarono, P. I., N. M. Verdugo-Montoya, E. O. Cuevas-Rodri’guez, J. Mila’n-Carrillo, R. M. Escobedo, J. A. Lopez-Valenzuela, J. A Garzo’n-Tiznado, dan C. R. Moreno. 2008. Tempeh flour from chickpea (Cicer arietinum L.) nutritional and physicochemical properties. Food Chem. 106: 106-112.
Anonimus. 2010. Susu kedelai, yoghurt kedelai, saus atau sambel cabai, awetan/manisan jahe, laru tempe. Tekno Pangan dan Agroindustri. Vol. 1, No. 1: 8-9.
Apriyantono, A., Fardiaz, D., Puspitasari, N. L., Sedarnawati, dan Budiyanto, S. 1989. Petunjuk Laboratorium Analisis pangan. Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Arora, S., Ojha, S. K., dan Vohora, D. 2009. Characterisation of streptozotocin induced diabetes mellitus in Swiss Albino Mice. Global Journal of Pharmacology. 3(2): 81-84.
Astawan, M. 2009. Antioksidan Tingkatkan Pamor Bengkuang. [2 April 2015].
Badan SDM Pertanian Binjai. 2011. Potensi Bengkuang Binjai.
[25 September 2015]
Bonner-Weir, S., Trent, D. F.,. Honey, R. N., dan Weir, G. C.1981. responses of neonatal rat isets to streptozotocin : limited β-cell regenaration and hyperglycemia. Diabetes. 30: 64-69.
Chronakis, I. S. 1998. On the moleculer charactersitics, compositional properties and structural-functional mechanisms of maltodextrins: a review. Critical Review in Food Science. 38(7) : 502-507.
Dokic, L., Jakovljevic, J., dan Dokic, P. 2004. Relation between viscous characteristics and dextrose equivalent of malto dextrins. Faculty of Technology-University of Navi Sad, Serbia and Montenegro. Starch-Journal.56: 520-525.
Erwin, Etriwati, dan Rusli. 2012. Mencit (Mus musculus) Galur Balb-C yang diinduksikan Streptozotocin berulang sebagai hewan model diabetes mellitus. Jurnal Kedokteran Hewan. 6(1) : 47-50.
Gozan, M. 2006. Absorpsi, Leaching, dan Ekstraksi pada Industri Kimia. UI-Press, Jakarta
Guyton, A. C. dan Hall, J. E. 2006. Text Book of Medical Physiology. 11rded W. B Saunders Company, London.
Hanachi, P., R. H. Moghadam, dan A. L. Lattiffah. 2009. Investigation of lipid profiles and lipid peroxidation in patients with Type-2 Diabetes. European J. Of sci. Res. 28(1) : 6-13.
Harijono, Estiasih, T., Sunarharum, W. B., dan Suwita, I. K. 2012. Efek hipoglikemik polisakarida larut air gembiliki (Dioscorea esculenta) yang diekstrak dengan berbagai metode. Jurnal Teknologi dan Industri Pangan. 23(1) : 1-8.
Helmawati, T. 2014. Hidup Sehat Tanpa Diabetes Cara Pintar Mendeteksi, Mencegah, dan Mengobati Diabetes. Notebook, Yogyakarta.
Henningsson, A. M., I. M. E. Bjorck, dan E. M. G. L. Nyman. 2002. Combination of indigestible carbohydrates affect shortchain fatty acid formation in the hindgut of rats. J. Nutr. 132: 3098-3104.
Hernawati, W. Manalu, A. Suprayogi, dan D. A, Astuti. 2013. Suplementasi serat pangan karagenan dalam diet untuk memperbaiki parameter lipid darah mencit hiperkolesterolemia. Makara Seri Kesehatan. 17(1): 1-9.
Hilman. A. 2012. Karakteristik Polisakarida Larut Air (PLA) Umbi Bengkuang (Pachyrhizus erosus L.) dari Berbagai Metode Ektraksi. Skripsi. Fakultas Pertanian Universitas Sumatera Utara, Medan.
Hokputsa, S., Gerddit, W., Pingsamart, S., Inngjerdngen, K., Heinze, T., Koschella, A., Harding, S. E., dan Paulsen, B. S. 2004. Water-soluble polysaccharides with pharmaceutical importance from durian rinds (Durio ziberthinuss Murr.) isolation, fractionation, characterisation, and bioactivity. Carbohydrate Polymers. 56: 471-481.
Izumi, K., Yamada, K. A., Matsukawa, M., dan Zorumski, C. F. 2003. Effect of insuline on long-term potention in hippocampal slices from diabetic rats. Journal Diabetologia. 46: 1007-1012.
Kementerian Kesehatan Republik Indonesia. 2013. Diabetes Mellitus Penyebab Kematian Nomor 6 di Dunia: Kemenkes Tawarkan Solusi CERDIK
Melalui Posbindu[26 September 2015].
Kusnandar, F. 2010. Kimia Pangan Komponen Makro. Penerbit Dian Rakyat, Jakarta.
Lee, C. L., Hung, H. K., Wang, J. J., dan Pan, T. M., 2007. Improving the ratio of monacolin K to citrinin production of Monascus purpureus NTU 568 under Dioscorea medium through the mediation of pH value and ethanol addition. J. Agric. Food Chem. 16: 6493-6502.
Lingga, L. 2010. Cerdas Memilih Sayuran. Agromedia Pustaka. Jakarta.
Lintang, J. A. 2014. Aktivitas Antioksidan Ekstrak Umbi Bengkuang Pada Berbagai Umur Panen Dengan Metode DPPH (2,2-diphenyl-l-picrylhydrazyl). Skripsi. Fakultas Pertanian Universitas Sumatera Utara, Medan.
Liu, Y. W., Shang, H. F., Wang, C. K., Hsu, F. L., dan Hou, W. C. 2007. Immunomodulatory activity of dioscorin, the storage protein of yam (Dioscorea alata cv. Tainong no. 1) tuber. Food and Chem Toxico. 45: 2312:2318.
Lunn, J. dan Buttriss, J. L. 2007. Carbohydrates and dietary fibre. Nutrition Bulletin. 32: 21-64.
Maradona, S. 2011. Wew! Penderita Diabetes di Indonesia Melonjak Pesat.
McNeill, J. H. 1999. Experimental Models of Diabetes (Edited Version). New York : CRC Press. Hal 82-85.
Mortensen, A., Kulling, S. E., Schwart, H., Rowland, I., Ruefer, C. E., Rimbach, G., Cassidy, A., Magee, P., Millar, J., Hall, W. L., Birkved, F. B., Sorensen, I. K., dan Sontag, G. 2009. Analytical and compositional aspect of isoflavones in food and their biological effect. Mol. Nutr. Food Res. 53. Muhilal. 1991. Teori radikal bebas dalam gizi dan kedokteran. Cermin Dunia
Kedokteran. 73:9-11.
Nugroho, A. E. 2006. Hewan percobaan diabetes mellitus: patologi dan mekanisme aksi diabetogenik. Biodiversivitas. 7(4) : 378-382.
Prakongpan, T., A. Nitithamyong, dan P. Luangpituksa. 2002. Extraction and aplication of dietary fiber and cellulosa from pineapple cores. Journal of Food Science. 67: 2213-2218.
Pusat Inovasi LIPI. 2011. Bioproses Produksi Minyak Kelapa Menggunakan Laru Tempe
Retnaningsih, C., Widowati, W., dan Lindayani. 2007. Isolasi Senyawa Antioksidan dan Antidiabetes dari Biji Kacang Koro (Mucuna pruriens). Laporan Hasil Penelitian, Universitas Katolik Soegijapranata.
Rosalina. 2013. Ancaman Diabetes di Dindonesia Meningkat [20 November 2015].
Rowland, N. E. dan L. L. Bellush. 1989. Diabetes mellitus: Stress, neurochemistry, and behavior. Neuroscience and Biobehavioral Reviews. 13(4): 99-206.
Rudrappa, U. 2009. Jicama (Yam Bean) Nutrition Fact. http://nutrition-and-you.com [2 April 2015].
Ruzaidi, A., A. Maleyki, I. Amin, A.G. Nawalyah, H. Muhajir, M. B. S. M J. Pauliena, dan M.S., Muskinah. 2008. Hypoglycaemic properties of Malaysian cocoa (Theobroma cacao) polyphenols-rich extract. International Food Research Journal. 15(3): 41-44.
Sianturi, P. L. L. 2011. Viabilitas Benih Bengkuang (Pachyrhizus erosus L.) Selama Peyimpanan 4 Bulan dengan Tingkat Kadar Air Berbeda Dalam Beberapa Jenis Kemasan. Skripsi. Fakultas Pertanian, USU. Medan. Sirait, M. dan Hargono, D. 1991. Penapisan Farmakologi, Pengujian Fitokimia,
dan Pengujian Klinik. Yayasan Pengembangan Obat Bahan Alam Phyto Medica, Pusat Pemeriksaan Obat dan Makanan Departemen Kesehatan Republik Indonesia.
Soegondo, S., Pradana, S., Slamet, S., dan Sarwono, W. 2002. Penatalaksanaan Diabetes Mellitus Terpadu. Fakultas Kedokteran, UI. Jakarta.
Sofyan. 2010. Manfaat Bengkuang untuk Kesehatan . Yogyakarta: Syura Media Utama Tensiska.
Somogyi, M. J. 1952. Notes on sugar determination. J. Biol. Chem. 195(1): 19-29. Song, T., Barua, K., Buseman, G., dan Murphy, P. A. 1998. Soy isoflavone snalysis: quality control and new internal standar 1-3. Am J Clin Nutr 1998: 68(suppl):1474S-9S.
Sorensen, P. G., Lutkenhaus, J., Young, K., Eveland, S. S., Anderson, M. S., dan Raetz, C. R. 1996. Regulation of UDP-3-O-(R-3-hydroxymyristoryl)-N-acetylglucomine diacetylase in Eschericia coli. The second of lipid biosynthesis. J. Bio. Chem. 271 : 25898-25905.
Standar Nasional Indonesia (06-1451-1989). 1989. Dekstrin untuk Industri Non-Pangan. Badan Standarisasi Nasional, Jakarta.
Sudarmadji, S., B. Haryono, dan Suhardi. 1996. Prosedur Analisa untuk Bahan Makanan. Penerbit Liberty, Yogyakarta.
Sukardjo. 2002. Kimia Fisika. Rineka Cipta, Jakarta.
Sulistyani, E., Barid, I., dan Isnaini., K. 2007. Pengaruh stressor rasa nyeri pada waktu perdarahan tikus wistar jantan. Denta Jurnal Kedokteran Gigi FK UHT. 1(2): 81-84.
Suryawanshi, N. P., Bhutey, A. K., Nagdeota, Jadhav, A. A., dan Manoorkar, G. S. 2006. Study of lipid peroxide and lipid profile in diabetes mellitus. Ind. J. Clinic. Biochem. 21(1) : 126-130
Szkudelski, T. 2001. The mechanism of alloxan and streptozotocin action in β cells of the rat pancreas, Phsiology Research. 50 (6) : 536-546.
Tensiska, 2008. Serat Makanan. Makalah. Jurusan Teknologi Industri Pangan. Fakultas Teknologi Industri Pertanian. Universitas Padjajaran. Bandung. Tormo, Gil-Exojo, M. A., Romero de Tejada, A. I., dan Campillom, J. E. 2006.
White bean amylase inhibitor administered orally reduce glycemia in type 2 diabetic rats, British Journal of Nutrition. 96(3) : 539-544.
Utama, R. P. 2011. Uji Akivitas Anti Diabetes Fraksi Etil Asetat Daun Kersen (Muntingia calabura L.) Pada Mencit Diabetes Akibat Induksi Aloksan. Skripsi. Fakultas Farmasi, Universitas Jember. Jember.
Utomo, Hanafiah, H. A., Oen, L. H., Suyatna, F. D., dan Asikin, N. 1991. Radikal bebas, peroxide lipid, dan penyakit jantung koroner. Medika. 5: 373-379. Van Steenis, CGGJ. 2005. Flora. PT. Pradnya Paramita. Jakarta.
Wada, T., Sugatani, J., Terada, E., Ohguchi, M., dan Miwa, M. 2005. Physicochemical characterization and biological effects of inulin enzymatically synthesized from sucrosae. Journal of Agriculture Food Chem. 53: 1246-1253.
Weickert, M. O. dan Pfeiffer. 2008. Metabolic effect of dietary fiber consumption and prevention of diabetes. American Society for Nutriotion. Journal Nutrition. 138 : 439-442.
Wild, Gijka, S. R., Anders, G., Richard, S., dan Hilary, K. 2004. Global prevalence of diabetes. Diabetes Care. 27 (5).
Wurzbug, O. B. 1986. Modified Starches: Propeties and Uses. CRC Press, Inc. Boca Raton. Florida.
Xie, J. T., Wu, J. A., Mehendale, S., Aung, H. H., dan Yuan, C. S. 2004. Anti-hyperglycemic effect of the polysaccharides fraction from American ginseng berry extract in ob/ob mice. Phytomedicine. 11: 182-187.
Yuliasih, I., Irawadi, T. T., Sailah, I., Pranamuda, H., Setyowati, K., dan Sunarti, T. C. 2011. Pengaruh proses fraksinasi pati sagu terhadap karakteristik fraksi amilosa. J. Tek. Ind. Pert. 17(1) : 29-36.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Mei hingga Agustus 2015 di Laboratorium Teknologi Pangan Fakultas Pertanian, Laboratorium Analisa Kimia Bahan Pangan Program Studi Ilmu dan Teknologi Pangan Fakultas Pertanian USU, serta Laboratorium Fisiologi dan Anatomi Hewan FMIPA Universitas Sumatera Utara.
Bahan Penelitian
Bahan yang digunakan dalam penelitian ini meliputi bahan baku dan bahan kimia. Bahan baku yang digunakan dalam pembuatan pati dan polisakarida larut air bengkuang adalah umbi bengkuang varietas gajah dengan umur panen lima bulan dan laru tempe. Umbi bengkuang diperoleh dari petani bengkuang di Kelurahan Bhakti Karya, Kecamatan Binjai Selatan, Sumatera Utara. Hewan uji yang digunakan adalah mencit putih jantan galur wistar berjumlah 28 ekor, umur 2-3 bulan dengan berat badan berkisar 25-30 gram dan sehat.
Reagensia
Alat Penelitian
Peralatan yang digunakan untuk pembuatan pati bengkuang dan polisakarida larut air bengkuang yaitu ember, pisau, baskom, blender (mesin giling), loyang, plastik kajang, oven pengeringan, ayakan 80 mesh dan 100 mesh. Peralatan yang digunakan untuk karakteristik polisakarida larut air bengkuang meliputi viscometer SO (83434, ASTM D445, Japan), spectrophotometer (Genesys 20, 3SGH318015, USA), vortex (Lab Dancer V, 01-717079, Germany), neraca analitik (Sartorius AG Gottingen TE 2145, 18210336, Germany), oven blower (Status, ME/68/HYD, England), stirer (11-501-7S, 56900308, USA), hotplate (S&J Juniper & Co. Harlow Essex, England), electromantle MV (Electrothermal, 0250/CE, England, dan magnetic stirer hotplate (Stuart Scientific, England), erlenmeyer, dan peralatan gelas lainnya. Pada pengujian in vivo alat yang digunakan antara lain timbangan hewan, strip glukotes, alat suntik, oral sunde, dan blood glucose test meter.
Metode Penelitian
Kegiatan yang dilakukan dalam penelitian ini terdiri dari tiga tahap, yaitu : Tahap 1 : Pembuatan pati bengkuang.
Tahap 2 : Pembuatan Polisakarida Larut Air (PLA) bengkuang.
Tahap 3 : Pengujian in vivo Polisakarida Larut Air (PLA) terhadap mencit percobaan dengan 3 parameter yaitu uji toleransi glukosa, penimbangan berat badan, dan efek hipoglikemik.
glukosa darah setelah pemberian PLA bengkuang 400 mg/kg berat badan dan glukosa 2 g/kg berat badan yang terdiri dari 4 taraf, yaitu:
T1 = 30 menit T2 = 60 menit T3 = 90 menit T4 = 120 menit
Setiap perlakuan dibuat dalam 5 kali ulangan.
• Pada penelitian dengan parameter penimbangan berat badan dan efek hipoglikemik menggunakan Rancangan Acak Lengkap (RAL) dengan dua faktor, yaitu:
Faktor I : Jenis perlakuan yang terdiri dari 4 taraf, yaitu :
P1 = Kelompok kontrol yaitu pemberian aquadest selama 28 hari. P2 = Kelompok negatif yaitu disuntik streptozotocin sebanyak 180
mg/kg berat badan selama 3 hari, dan kemudian diberi aquadest selama 28 hari.
P3 = Kelompok positif yaitu pemberian aquadest selama 3 hari selanjutnya pemberian Polisakarida Larut Air (PLA) sebanyak 400 mg/kg berat badan selama 28 hari.
P4 = Kelompok perlakuan yaitu disuntik streptozotocin 180 mg/kg berat badan 3 hari dan kemudian diberi Polisakarida Larut Air (PLA) selama 28 hari.
Faktor II : Waktu penentuan kadar gluko sayang terdiri dari 4 taraf, yaitu: M1 = Minggu ke-1
M3 = Minggu ke-3 M4 = Minggu ke-4
Semua perlakuan dibuat ulangan sebanyak 5 kali.
Model Rancangan
Penelitian ini dilakukan dengan tiga tahap, yaitu: Tahap 1 : Pembuatan pati bengkuang.
Tahap 2 : Pembuatan Polisakarida Larut Air (PLA) bengkuang.
Tahap 3 : Pengujian in vivo Polisakarida Larut Air (PLA) terhadap mencit percobaan dengan 3 parameter yaitu uji toleransi glukosa, penimbangan berat badan, dan efek hipoglikemik.
Penelitian dengan parameter uji toleransi menggunakan Rancangan Acak Lengkap (RAL) faktor tunggal dengan model sebagai berikut:
Ŷij= µ +αi+ εij
dimana:
Ŷij : Hasil pengamatan dari faktor U pada taraf ke-i dalam ulangan ke-j µ : Efek nilai tengah
αi : Efek perlakuan ke-i
εij : Efek galat perlakuan ke-i dengan ulangan ke-j
Apabila diperoleh hasil yang berbeda nyata dan sangat nyata maka uji dilanjutkan dengan uji beda rataan, menggunakan uji Least Significant Range (LSR).
Ŷijk = µ +αi+ βj + (αβ)ij + εijk
dimana:
Ŷij : hasil pengamatan dari faktor K pada taraf ke-i dan faktor U pada taraf ke-j dalam ulangan ke-k
µ : efek nilai tengah
αi : efek faktor K pada taraf ke-i βj : efek faktor U pada taraf ke-j
(αβ)ij : efek interaksi faktor K pada taraf ke-i dan faktor U pada taraf ke-j
εijk : efek galat dari faktor K pada taraf ke-i dan faktor U pada taraf ke-j dalam ulangan ke-k
Apabila hasil yang diperoleh berbeda nyata dan sangat nyata maka uji dilanjutkan dengan uji beda rataan menggunakan uji Least Significant Range (LSR).
Pelaksanaan Penelitian
Pembuatan pati
Pembuatan polisakarida larut air
Pati bengkuang sebanyak 30 g ditambahkan air dengan perbandingan 1:2. Filtratnya diambil dan ditambahkan laru tempe sebanyak 0,3% kemudian diinkubasi selama 3 hari. Dilakukan pemisahan pati dan penggumpalan PLA dengan etanol (Yuliasih, et al., 2011) dengan konsentrasi 75% dan dilanjutkan dengan konsentrasi 95% dengan perbandingan masing-masing 1:4 (Hokputsa, et al., 2004). Gumpalan PLA basah dipisahkan dari etanol kemudian disaring, kemudian dikeringkan pada suhu 40 oC selama 24 jam. Hasil bubuk PLA yang telah kering dihaluskan dan diayak dengan saringan 100 mesh sehingga diperoleh ekstrak PLA bubuk kering. Proses pembuatan polisakarida larut air umbi bengkuang dapat dilihat pada Gambar 5.
Polisakarida larut air bengkuang yang dihasilkan dianalisis sifat fisik dan kimia meliputi viskositas (Sukardjo, 2002), daya larut (SNI 06-1451-1989), dextrose equivalent (Dokic, et al., 2014), derajat polimerasi (Wurzburg, 1986), kadar pati (Apriyantono, et al., 1989), kadar glukosa (Somogyi, 1952), total gula (Dubois, et al., 1956), dan kadar gula pereduksi (Apriyantono, et al., 1989).
Pengujian in vivo terhadap mencit percobaan
Pengujian in vivo yang dilakukan terhadap mencit putih jantan galur wistar terdiri dari uji toleransi glukosa, penimbangan berat badan, dan efek hipoglikemik.
Uji toleransi glukosa (GTT, Glukosa Toleransi Test)
Mencit putih jantan galur wistar dengan berat 25-30 gram dan berumur 8-10 minggu disediakan sebanyak 5 ekor mencit. Mencit diadaptasikan selama 1
yang selalu dijaga pada suhu 20-25 oC dan diberi makan dan minum secara ad libitum. Kemudian mencit wistar dipuasakan selama 16 jam. Masing-masing mencit dilakukan pengujian toleransi terhadap glukosa yaitu dengan cara diberikan polisakarida larut air (PLA) bengkuang sebanyak 400 mg/kg berat badan dan larutan glukosa 20 mg/kg berat badan kepada mencit secara oral. Pemeriksaan kadar glukosa darah dilakukan dengan mengambil darah dari ekor mencit pada menit ke 0, 30, 60, 90, dan 120 sesudah pemberian PLA bengkuang dan larutan glukosa. Uji toleransi glukosa pada mencit percobaan dapat dilihat pada Gambar 6.
Pengujian efek hipoglikemik (Ruzaidi, et al., 2008) dan berat badan mencit percobaan
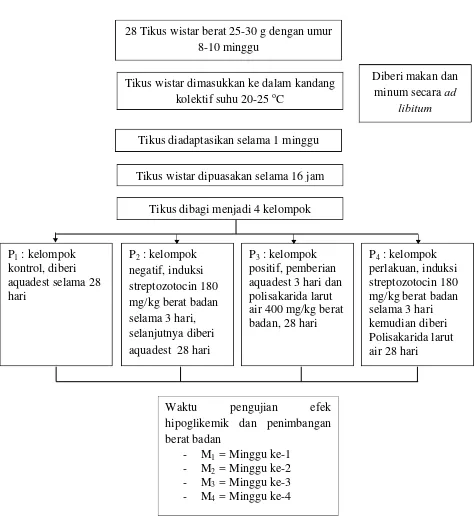
Pengujian untuk ekstrak Polisakarida Larut Air (PLA) umbi bengkuang dilakukan sebagai berikut: sebanyak 28 ekor mencit Wistar dimasukkan ke dalam kandang kolektif dengan suhu ruang 20-25 oC. Mencit diberi pakan dan minum secara ad libitum. Semua mencit diadaptasikan selama 1 minggu sebelum diberi perlakuan. Percobaan dilakukan selama 4 minggu, kadar glukosa darah mencit dianalisis setiap minggu. Mencit dibagi ke dalam 4 kelompok, 3 kelompok sesuai perlakuan metode ekstraksi Polisakarida Larut Air (PLA) umbi bengkuang dan 1 kelompok kontrol. Setiap kelompok terdiri dari 7 ekor mencit.
Masing-masing kelompok mencit diberi ransum diet standar yang dibeli dari PT. Charoen Pokhphan Medan. Pemberian Polisakarida Larut Air (PLA) umbi bengkuang dilakukan setiap hari selama 28 hari secara force feeding dengan dosis 400 mg/kg berat badan.
dilakukan 3 hari sebelum mencit diberi perlakuan. Setelah dipuasakan selama 16 jam, mencit diambil darahnya untuk mengetahui kadar glukosa awal, dan kemudian diinjeksi streptozotocin secara intraperitoneal dengan konsentrasi 180 mg/kg berat badan.
Tiga hari setelah injeksi streptozotocin, darah diambil melalui ekor dan diukur dengan glukometer untuk memastikan bahwa mencit pada kondisi hiperglikemik. Sebelum diambil darahnya, mencit dipuasakan terlebih dahulu selama 13 jam. Hanya mencit dengan kadar glukosa darah puasa >126 mg/dL yang digunakan. Penentuan kadar glukosa darah dan penimbangan berat badan dilakukan pada minggu penelitian ke 0, 1, 2, 3, dan 4. Pengujian efek hipoglikemik polisakarida larut air bengkuang dapat dilihat pada Gambar 7.
Prosedur penelitian yang dilakukan telah mendapat sertifikat laik etik dari komisi Etik – Universitas Sumatera Utara.
Parameter Penelitian
Penentuan total gula (Dubois, et al., 1956)
Penentuan kurva standard
melihat absorbansinya. Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya (Lampiran 1).
Penetapan total gula
Ditimbang bahan yang sudah dihaluskan sebanyak 5 g tergantung kadar gula reduksinya, dan pindahkan ke dalam beaker glass 100 ml, ditambahkan alkohol 80% ± 10-20 ml, kemudian distirer selama 1 jam. Disaring dengan kertas saring whatman no. 1 di dalam beaker glass 250 ml ditera sampai 200 ml. Dipanaskan dalam waterbath selama 1 jam untuk menghilangkan alkohol. Setelah dingin dimasukkan ke dalam labu ukur 250 ml. Ditambah aquades sampai tanda tera dan distirer. Diambil 1 ml dimasukkan ke dalam labu ukur 100 ml dan ditambah akuades sampai batas tera. Setelah itu diambil 1 ml campuran larutan dan dimasukkan ke dalam tabung reaksi. Dilakukan penambahan fenol 5% sebanyak 0,5 ml dan digojog dengan vortex. Kemudian ditambahkan H2SO4 pekat sebanyak 2,5 ml dituang tepat di tengah dengan tegak lurus hingga larutan berubah warna jingga. Didiamkan selama 10 menit setelah itu digojog dengan vortex. Dipanaskan di penangas air selama 15 menit, biarkan dingin. Ditera dengan spektrophotometer pada panjang gelombang 490 nm untuk melihat absorbansinya.
Konsentrasi gula (μg/ml) x Faktor pengencer
Total Gula = x 100% Bobot Sampel (g) x 1000000
Penentuan kadar glukosa (Somogyi, 1952)
Pembuatan Reagensia Nelson dan Arsenomolybdat
Natrium karbonat anhidrat, 12,5 gram garam Rochelle, 10 gram Natrium karbonat dan 100 gram Natrium sulfat anhidrat dalam 350 air suling. Encerkan sampai 500 ml. Reagensia Nelson B: Larutkan 7,5 gram CuSO4.5H2O dalam 50 ml air suling dan tambahkan 1 tetes asam sulfat pekat. Reagensia Nelson dibuat dengan mencampur 25 bagian reagensia Nelson A dan 1 bagian reagensia Nelson B. Pencampuran reagensia A dan B dikerjakan pada setiap akan menggunakan (Sudarmadji, et al., 1989).
Larutan Arsenomolybdat dibuat dengan menimbang 25 gram Ammonuim molybdat dalam 450 ml air suling dan tambah 25 ml asam sulfat pekat. Larutkan pada tempat yang lain 3 g Na2HAsO4.7H2O dalam 25 ml air suling, kemudian larutan ini dituang ke dalam larutan pertama. Laruta disimpan dalam botol kaca yang gelap dan diinkubasi pada suhu 37 oC selama 24 jam. Reagensia ini baru bisa digunakan setelah masa inkubasi tersebut (Sudarmadji, et al., 1989).
Penentuan kurva standar
Disiapkan larutan contoh yang mempunyai kadar glukosa sekitar 10 mg/100ml. Dari larutan glukosa standar tersebut dilakukan 6 pengenceran
sehingga diperoleh larutan glukosa dengan konsentrasi: 2, 4, 6, 8 dan 10 mg/100ml. Disiapkan 7 tabung reaksi yang bersih, masing-masing diisi dengan
Setelah semua endapan Cu2O larut sempurna, tambahkan 7 ml air suling, digojog dengan vortex. Ditera sampai tanda “optical density” (OD) pada panjang gelombang 540 nm dan dibuat kurva standar yang menunjukkan hubungan antara konsentrasi glukosa dan OD (Lampiran 1).
Penetapan kadar glukosa
Disiapkan larutan contoh yang mempunyai kadar gula reduksi sekitar 7 mg/100 ml. Dipipet 1 ml larutan contoh yang jernih tersebut ke dalam tabung reaksi yang bersih. Dilakukan perlakuan seperti larutan standar diatas. Diukur absorbansinya pada panjang gelombang 540 nm.
Konsentrasi glukosa (mg/100ml) x Faktor pengencer
Kadar Glukosa = x 100% Bobot Sampel (g) x 1000
Penentuan gula pereduksi (Metode DNS, Apriyantono, et al., 1989)
Prinsip metode ini adalah dalam suasana alkali gula pereduksi akan mereduksi 3,5-dinitrolisilat (DNS) membentuk senyawa yang dapat diukur absorbansinya pada panjang gelombang 550 nm.
Persiapan pereaksi DNS
Pereaksi DNS dibuat dengan melarutkan 10,6 g asam 3,5-dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air ditambahkan ke dalam larutan tersebut
106 g NaK-tartarat. 7,6 ml fenol (cairkan pada suhu 50ºC) dan 8,3 g Na-metabisulfit, dicampur merata. Dilakukan standarisasi dengan melakukan
Penentuan kurva standar
Kurva standar dibuat dengan mengukur untuk mengetahui nilai gula pereduksi pada glukosa pada selang 0,2-0,5 mg/l. Masing-masing konsentrasi sebanyak 1 ml ditambahkan dengan 3 ml pereaksi DNS. Ditempatkan dalam air mendidih selama 15 menit. Dibiarkan dingin sampai suhu ruang. Selanjutnya intensitas warna yang terbentuk diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm. Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya (Lampiran 1).
Penetapan gula pereduksi
Ditimbang sampel sebanyak 2 g yang telah dihaluskan dimasukkan ke dalam beaker glass100 ml, lalu ditambahkan alkohol 80% ± 10-20 ml, kemudian distirer selama 1 jam. Kemudian disaring ke dalam beaker glass 250 ml. Filtrat ditera sampai 200 ml. Dipanaskan dalam waterbath selama 1 jam untuk menghilangkan alkohol. Setelah dingin dimasukkan ke dalam labu ukur 250 ml. Ditambah aquadest sampai tanda tera dan distirer. Diambil 1 ml dan 19 ml aquadest yang kemudian dimauskkan ke dalam erlenmeyer dan digojog. Setelah itu diambil 1 ml larutan tersebut dan dimasukkan ke dalam tabung reaksi tertutup. Dilakukan penambahan DNS sebanyak 3 ml dan digojog dengan vortex. Kemudian dipanaskan selama 5 menit dan didinginkan selama 30 menit. Ukur absorbansi dengan spektrophotometer pada panjang gelombang 550 nm.
Konsentrasi gula (mg/ml) x Faktor pengencer
Penentuan kadar pati (Apriyantono, et al., 1989)
Ditimbang sampel sebanyak 2 g yang telah dihaluskan dimasukkan ke dalam beaker glass 250 ml, lalu ditambahkan 50 ml akuadest dan diaduk menggunakan magnetik stirer selama 1 jam. Kemudian suspensi tersebut disaring dengan kertas saring dan dicuci dengan akuadest sampai volume filtrat 250 ml. Filtrat ini mengandung karbohidrat yang terlarut dan digunakan untuk pengujian kadar gula pereduksi. Residu pati dipindahkan secara kuantitatif dari kertas saring ke dalam erlenmeyer 500 ml dengan cara pencucian 200 ml akuadest dan ditambahkan 20 ml HCl 25%. Kemudian ditutup dengan pendingin balik dan dipanaskan di atas penangas air sampai mendidih selama 2,5 jam pada suhu 100 oC. Dibiarkan dingin dan dinetralkan dengan larutan NaOH 45% dan diencerkan sampai volume 500 ml sampai ± pH 7. Kemudian disaring kembali campuran di atas pada kertas saring, selanjutnya ditentukan kadar gula yang dinyatakan sebagai glukosa dari filtrat yang diperoleh. Setelah persiapan sampel selesai diukur gula reduksi dengan cara diambil 1 ml sampel dan dimasukkan ke dalam tabung reaksi bertutup, ditambahkan 3 ml pereaksi DNS. Ditempatkan dalam air mendidih selama 15 menit. Dibiarkan dingin sampai suhu ruang. Selanjutnya intensitas warna yang terbentuk diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm. Digunakan aquadest sebagai blanko.
Kadar gula pereduksi (mg/ml) x Faktor pengenceran
Penentuan viskositas (Sukardjo, 2002)
Penentuan waktu alir zat pada viskosimeter oswald (t2) dilakukan dengan cara yaitu diambil 10 ml sampel dan dimasukkan ke dalam viskosimeter oswald. Sampel diisap dengan bola bub sampai batas tanda yang terdapat pada alat viskosimeter. Sampel dibiarkan mengalir kebawah sampai batas tanda yang terdapat pada alat. Dicatat waktu yang diperlukan dengan menggunakan stopwatch. Penentuan massa jenis zat (ρ2) dilakukan dengan cara yaitu diambil 10 ml sampel kemudian diukur beratnya. Massa jenis adalah hasil pembagian antara berat zat dengan volum zat. Dilakukan perhitungan viskositas dengan menggunakan rumus sebagai berikut:
Daya larut (SNI 06-1451-1989)
Ditimbang teliti 2 g sampel, kemudian dimasukkan ke dalam labu ukur 200 ml. Dibilas botol timbang dengan air aquadest sampai volume kira kira 150 ml. Kemudian dikocok dan dibiarkan beberapa jam sambil sesekali digoyangkan. Ditambahkan air sampai tanda tera dan dibiarkan sampai 24 jam di dalam oven pada suhu 37oC. Disaring dan pipet 10 ml filtrat dimasukkan ke dalam kurs porselin 50 ml yang diketahui beratnya. Dipanaskan dalam oven selama 3 jam hingga bobot tetap.
Daya larut dalam air =
Keterangan : A = Berat cawan (cawan + isi) B = Berat akhir
C = Berat sampel (A-B) C
Penentuan dextrose equivalent (Dokic, et al., 2004)
Dextrose equivalent (DE) merupakan tingkat konversi dari hidrolisa pati yang diukur dari total penurunan dari seluruh gula yang dihasilkan pada hidrolisa terhadap reagen tembaga fehling. Nilai ini dapat diukur dengan membandingkan nilai gula pereduksi terhadap total gula yang dihasilkan pada hidrolisis. DE dihitung dengan menggunakan rumus:
DE =
Penentuan derajat polimerasi (Wurzburg, 1986)
Derajat Polimerasi (DP) merupakan indikasi dari nilai rata-rata unit monomer dari molekulnya. Ini menunjukkan nilai dari unit glukosanya. Nilai DP dekstrosa1 dan DP maltosa 2. Derajat polimerasi dihitung dengan menggunakan rumus:
DP =
Pengujian toleransi terhadap glukosa (GTT, Glucose Tolerance Test) (Xie, et al., 2004)
Sebanyak 5 ekor mencit dilakukan pemberian Polisakarida Larut Air (PLA) bengkuang sebanyak 400 mg/kg berat badan dan glukosa 2 mg/kg berat badan setelah sebelumnya dipuasakan selama 13 jam. Kadar glukosa darah ditentukan dengan mengambil darah melalui ekor dan diukur dengan glukometer pada menit ke 0, 30, 60, 90 dan 120 setelah pemberian Polisakarida Larut Air (PLA) umbi bengkuang dan glukosa secara oral. Angka yang tertera di alat glukometer kemudian dicatat sebagai kadar glukosa darah mencit tersebut.
Gula reduksi
Total gula x 100
Penimbangan berat badan hewan percobaan
Sebanyak 28 ekor mencit dikelompokkan menjadi 4 kelompok perlakuan. Masing-masing kelompok mencit diberikan perlakuan yang berbeda-beda. Masing-masing hewan percobaan ditimbang dengan timbangan dan angka yang didapat dicatat. Berat badan mencit percobaan ditimbang pada minggu penelitian ke 0, 1, 2, 3, dan 4.
Pengujian efek hipoglikemik (Ruzaidi, et al., 2008)
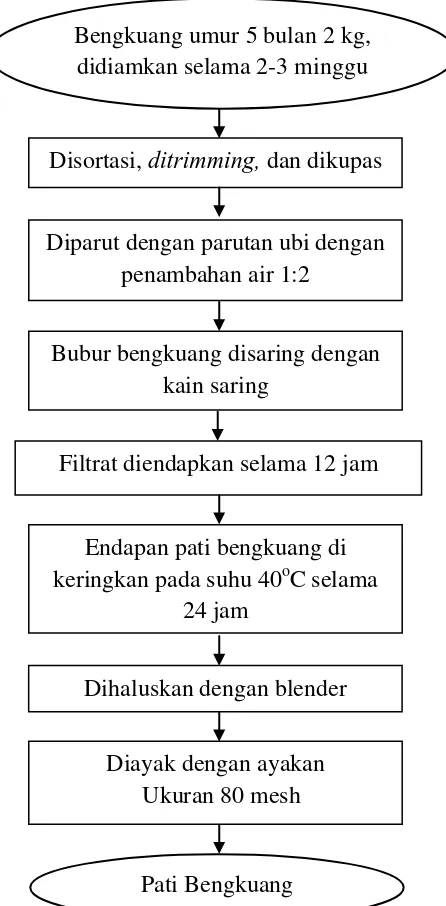
Gambar 4. Skema pembuatan pati bengkuang Dihaluskan dengan blender
Diayak dengan ayakan Ukuran 80 mesh Endapan pati bengkuang di keringkan pada suhu 40oC selama
24 jam
Filtrat diendapkan selama 12 jam Diparut dengan parutan ubi dengan
penambahan air 1:2 Disortasi, ditrimming, dan dikupas
Bengkuang umur 5 bulan 2 kg, didiamkan selama 2-3 minggu
Pati Bengkuang
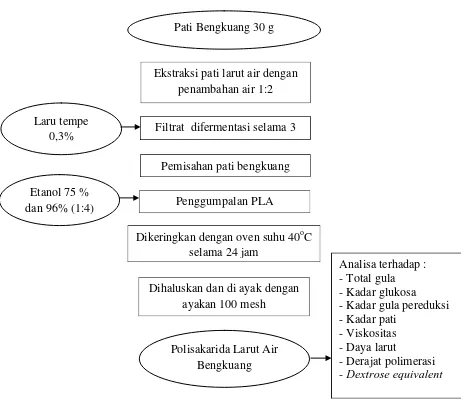
Gambar 5. Skema ektraksi polisakarida larut air (PLA) bengkuang
Ekstraksi pati larut air dengan penambahan air 1:2
Filtrat difermentasi selama 3
Pemisahan pati bengkuang Pati Bengkuang 30 g
Dikeringkan dengan oven suhu 40oC selama 24 jam
Mencit wistar dimasukkan ke dalam kandang kolektif suhu 20-25 oC Mencit diadaptasikan selama 1 minggu
Diberi makan dan minum secara ad
libitum Mencit dipuasakan selama 16 jam
Diberikan PLA bengkuang 400 mg/kg berat badan dan glukosa 20 mg/kg berat badan secara
5 mencit wistar berat 25-30 g dengan umur 8-10 minggu
Ditentukan kadar glukosa darah dengan glukometer - T1 = 30 menit
- T2 = 60 menit - T3 = 90 menit - T4 = 120 menit
Gambar 7. Skema pengujian in vivo mencit percobaan terhadap penimbangan berat badan mencit percobaan dan efek hipoglikemik PLA bengkuang
Waktu pengujian efek
Tikus wistar dimasukkan ke dalam kandang kolektif suhu 20-25 oC
Tikus diadaptasikan selama 1 minggu
Diberi makan dan minum secara ad
libitum
Tikus wistar dipuasakan selama 16 jam Tikus dibagi menjadi 4 kelompok 28 Tikus wistar berat 25-30 g dengan umur
Karakteristik Fisik dan Kimia Polisakarida Larut Air Bengkuang
Pengujian karakteristik dan kimia dilakukan berdasarkan total gula, kadar glukosa, kadar gula pereduksi, kadar pati, daya larut, viskositas, derajat polimerasi, dan dextrose equivalent. Hasil pengujian karakteristik fisik dan kimia Polisakarida Larut Air (PLA) bengkuang bengkuang dapat dilihat pada Tabel 3. Tabel 3. Karakteristik fisik dan kimia polisakarida larut air bengkuang
Keterangan: Data terdiri dari 3 ulangan ± standar deviasi
Total gula
Penentuan total gula adalah untuk mengetahui berapa banyak kadar gula pereduksi dan non pereduksi yang merupakan hasil hidrolisis pati di dalam bahan. Pada penelitian ini dilakukan metode ekstraksi dengan menggunakan laru tempe yang berfungsi untuk memperoleh polisakarida larut air (PLA) dari umbi bengkuang yang lebih murni. Laru tempe mempunyai aktivitas amilolitik dan proteolitik. Aktivitas inilah yang dapat mendegradasi pati sehingga polisakarida yang terdapat di dalam bahan lebih mudah terpisah. Angulo-Bejarano, et al., (2008) menyatakan bahwa kapang tempe mempunyai aktivitas relatif yang dapat menghidrolisis pati.
Parameter Kadar per 100 gram
Total gula (%) 12,6633±1,3035
Kadar glukosa (%) 1,8860±0,0049
Kadar gula pereduksi (%) 0,0681±0,0008
Kadar pati (%) 0,0775±0,0031
Daya larut (%) 80,7286±0,2487
Viskositas (cP) 0,9633±0,0075
Derajat polimerasi 17,1140±2,2269
Hasil penelitian diperoleh total gula yang terkandung dalam polisakarida larut air bengkuang adalah sebanyak 12,6633±1,3035%. Kandungan total gula tersebut cukup besar karena polisakarida yang terdapat pada bengkuang telah terdegradasi menjadi senyawa yang lebih sederhana seperti oligosakarida dan monosakarida. Hal ini dikarenakan adanya aktivitas enzim pada proses fermentasi dari kapang Rhizopus oligosporus yang mampu memecah karbohidrat pada pati umbi bengkuang menjadi komponen yang lebih sederhana. Hal ini sesuai dengan pendapat Tensiska, (2008) yang menyatakan bahwa proses hidrolisis pada PLA akan menghasilkan bermacam-macam monosakarida antara lain rhamnosa, fruktos (metil pentosa), arabinosa, glukosa, mannosa, galaktosa, asam D-galakturonat, asam D-D-galakturonat, atau asam D-gilikoronat.
Kadar glukosa
Kadar gula pereduksi
Semua monosakarida (glukosa, fruktosa, dan galaktosa) dan disakarida (laktosa dan maltosa) kecuali sukrosa dan polisakarida termasuk ke dalam golongan gula pereduksi. Hasil penelitian yang dilakukan, kadar gula pereduksi yang terkandung dalam polisakarida larut air bengkuang yaitu sebanyak 0,0681±0,0008%. Kapang yang paling sering ditemukan pada laru tempe adalah Rhizopus oligosporus, Rhizopus oryzae, dan Rhizopus stolionifer. Gula pereduksi yang terbentuk ini akibat adanya proses fermentasi oleh kapang Rhizopuz oligosporus yang terdapat pada laru tempe. Kapang tempe akan mensintesa enzim-enzim yang mampu memecah komponen karbohidrat pada pati menjadi gula-gula sederhana termasuk gula pereduksi. Hal ini sesuai dengan pendapat Harijono, et al. (2012) dan Mortensen, et al. (2009) yang menyatakan bahwa pada proses fermentasi PLA dihasilkan enzim amilase dan protease yang mampu menghidrolisis PLA sehingga terjadi peningkatan kadar gula bebas.
Kadar pati
kadar pati sebanyak 0,0775±0,0031%. Hal ini menunjukkan polisakarida larut air bengkuang yang dihasilkan cukup murni.
Daya Larut
Pengamatan daya larut PLA bengkuang dilakukan dengan menggunakan sampel sebanyak 1 g dalam 10 ml aquadest. Semakin tinggi nilai daya larut suatu bahan maka semakin mudah bahan tersebut larut dalam air. Daya larut PLA bengkuang yang dihasilkan adalah sebesar 80,7286±0,2487%, dalam hal ini nilai daya larut tersebut cukup tinggi. Berdasarkan hasil Hilman (2012) bahwa daya larut PLA bengkuang yang tertinggi adalah yang diekstraksi dengan laru tempe dibandingkan PLA bengkuang yang diekstraksi dengan air dan ragi roti. Hal tersebut dikarenakan ektraksi PLA bengkuang yang diperoleh melalui fermentasi dengan laru tempe dapat melarutkan senyawa-senyawa organik, sehingga daya larut menjadi semakin tinggi dengan berkurangnya partikel pada PLA bengkuang. Pusat Inovasi LIPI (2011) menyatakan bahwa peran air sebagai pelarut pada proses ekstraksi umbi bengkuang dapat lebih maksimal dengan adanya proses fermentasi.
Viskositas
viskositas yang paling rendah adalah PLA bengkuang yang diekstrak dengan laru tempe dibandingkan dengan ektraksi PLA bengkuang dengan ragi roti dan air.
Dextrose equivalent
Dextrose equivalent (DE) adalah istilah untuk menyatakan jumlah total gula reduksi seperti D-Glukosa dalam basis kering (Kusnandar, 2010). Dextrose equivalent dari PLA umbi bengkuang yang digunakan adalah 5,8432±0,7500. Produk PLA bengkuang diperoleh dari proses hidrolisis dengan penambahan air sebanyak 2 bagian dan reaksi katalitik dari laru tempe. Proses hidrolisis dan fermentasi dengan laru tempe dapat mengubah pati menjadi monomer-monomer sakarida yang lebih sederhana. Produk hasil hidrolisis umunya menghasilkan unit-unit monomer sakarida selain D-Glukosa yaitu D-Fruktosa (Chronakis, 1998). Hal ini sesuai dengan pendapat Lingga (2010) yang menyatakan Polisakarida Larut Air (PLA) termasuk dalam golongan oligosakarida, yang penyusunnya terdiri inulin. Inulin tersusun oleh polimer unit glukosa dan fruktosa yang saling berikatan dalam rantai karbohidrat (Wada, dkk., 2005).
Derajat polimerasi
Pengujian in vivo Polisakarida Larut Air (PLA) bengkuang terhadap mencit percobaan
Hasil uji in vivo yang telah dilakukan terhadap hewan percobaan, diperoleh hasil bahwa perlakuan pada tiap-tiap kelompok mencit memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap efek hipoglikemik dan uji toleransi glukosa, serta berpengaruh nyata (P<0,05) terhadap berat badan.
Uji toleransi glukosa (GTT, Glucose Toleransi Test)
Uji toleransi glukosa menunjukkan kemampuan penyerapan glukosa sesaat setelah glukosa masuk ke dalam pencernaan mencit percobaan. Mencit percobaan diberikan polisakarida larut air bengkuang sebanyak 400 mg/kg berat badan dan larutan glukosa sebanyak 20 mg/kg berat badan secara oral. Kadar glukosa darah diukur pada menit ke-30, 60, 90, dan 120.
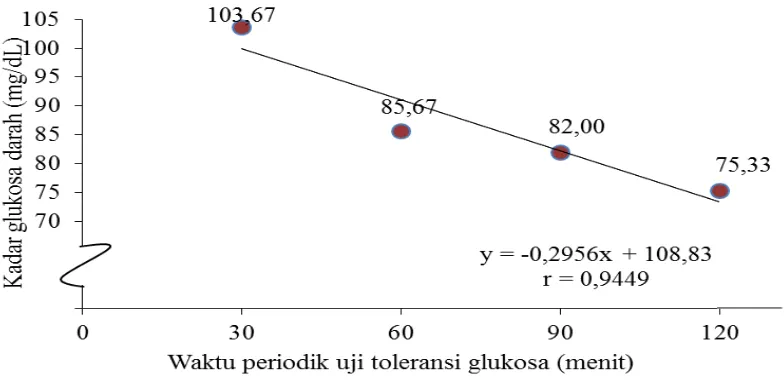
Daftar sidik ragam (Lampiran 3) dapat dilihat bahwa periodik pengujian toleransi glukosa berpengaruh sangat nyata (P<0,01) terhadap kadar glukosa darah mencit percobaan. Hasil uji LSR pengaruh waktu periodik pengujian toleransi glukosa terhadap kadar glukosa darah pada mencit percobaan dapat dilihat dari Tabel 4.
Tabel 4. Uji LSR efek utama waktu penentuan kadar glukosa darah terhadap kadar glukosa mencit (mg/dL)
Jarak LSR Waktu penentuan Rataan Notasi
0,05 0,01 KGD mencit 0,05 0,01
- - - T1 = 30 103,67 a A
2 8,101 11,051 T2 = 60 85,67 ab AB
3 8,505 11,526 T3 = 90 82,00 b B
4 8,760 11,842 T4 = 120 75,33 b B
Keterangan: notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% dan berbeda sangat nyata pada taraf 1%.
terhadap T3 dan T4. Waktu uji T3 berbeda tidak nyata terhadap T4. Kadar glukosa darah tertinggi terdapat pada T1 (Menit ke-30) yaitu 103,67 mg/dL dan terendah terdapat pada T4 (Menit ke-120) yaitu 75,33 mg/dL. Hubungan antara waktu periodik pengujian toleransi glukosa terhadap kadar glukosa darah mencit percobaan dapat dilihat pada Gambar 8.
Gambar 8 menunjukkan bahwa PLA bengkuang menyebabkan penyerapan glukosa yang diberikan secara oral menurun secara signifikan (P<0,01). Adanya pemberian PLA bengkuang menyebabkan perlambatan peningkatan kadar glukosa darah. Hal ini menunjukkan salah satu mekanisme penurunan kadar glukosa darah yaitu PLA bengkuang dapat menghambat penyerapan glukosa dalam pencernaan.
Gambar 8. Hubungan antara waktu periodik uji toleransi glukosa dengan kadar glukosa darah mencit (mg/dL)
103,67 mg/dL, dalam hal ini kadar glukosa darah mencit mengalami kenaikan dari kadar glukosa puasa yakni sebesar 88 mg/dL. Hal ini sesuai dengan dengan literatur yang menyatakan bahwa absorpsi glukosa dalam tubuh memerlukan waktu sekitar 30-60 menit dan akan menurun setelah 2-3 jam pemberian sediaan uji (Sirait dan Hargono, 1991).
Gambar 8 menunjukkan bahwa kadar glukosa darah mencit menurun pada waktu uji 120 menit menjadi 75 mg/dL. Hal ini membuktikan bahwa PLA bengkuang yang diberikan dapat menghambat penyerapan glukosa sehingga kadar glukosa darah rendah atau menurun.Weickert and Pfeiffer (2008) melaporkan bahwa serat makanan dapat menurunkan glukosa postprandial yang berkaitan dengan sifatnya yang dapat membentuk gel. Serat larut merupakan senyawa yang dapat membentuk gel ketika tersedia air dalam perut dan usus halus, gel yang terbentuk memperlambat pengosongan perut, mempercepat waktu transit di usus halus, dan mengendalikan penyerapan nutrisi (Lunn dan Buttriss, 2007). Hal ini yang menyebabkan ekstrak PLA bengkuang mampu menghambat penyerapan glukosa.
Berat badan mencit percobaan
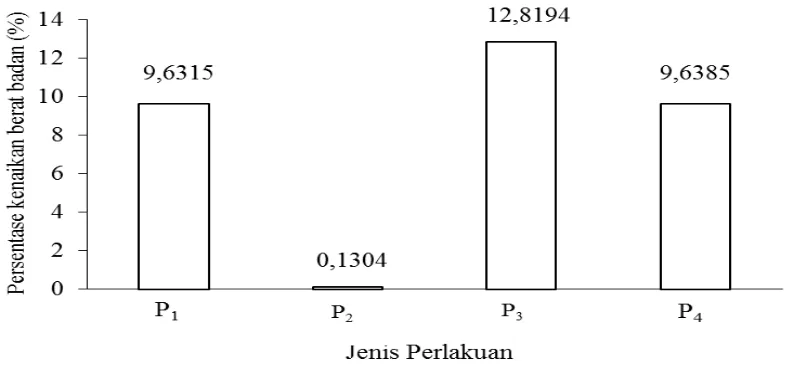
Pengaruh jenis perlakuan terhadap persentase kenaikan berat badan mencit percobaan
Daftar sidik ragam (Lampiran 4), dapat dilihat bahwa pengaruh jenis perlakuan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap rata-rata persentase kenaikan berat badan hewan percobaan dan dapat dilihat pada Tabel 5.
Tabel 5. Uji LSR efek utama pengaruh jenis perlakuan terhadap persentase kenaikan berat badan mencit (%)
Jarak LSR Kelompok Rataan Notasi
0,05 0,01 Perlakuan 0,05 0,01
- - - P1 = Kelompok kontrol 9,632 a A
2 0,061 0,081 P2 = Kelompok negatif 0,130 b B 3 0,064 0,084 P3 = Kelompok positif 12,819 a A 4 0,066 0,087 P4 = Kelompok perlakuan 9,639 a A Keterangan: Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5%
(huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Tabel 5 menunjukkan bahwa persentase kenaikan berat badan tertinggi terdapat pada perlakuan P3 yaitu sebesar 12,819% dan yang terendah terdapat pada perlakuan P2 yaitu sebesar 0,130%. Hubungan antara jenis perlakuan pada mencit perlakuan percobaan dengan persentase kenaikan berat badan mencit percobaan dapat dilihat pada Gambar 9.
Keterangan: P1= kelompok kontrol, P2= kelompok negatif, P3= kelompok positif, P4= kelompok perlakuan.
Gambar 9 memperlihatkan bahwa berat badan mencit percobaan pada perlakuan P2 mengalami kenaikan paling rendah yaitu sebesar 0,1304%. Hal ini dikarenakan adanya induksi streptozotocin dengan dosis 180 mg/kg berat badan yang mengakibatkan mencit dalam keadaan diabetes mellitus tipe 1 yang disebabkan hilangnya fungsi sel beta pankreas. Pada keadaan diabetes mellitus, glukosa yang ada di dalam pembuluh darah tidak dapat diserap sel-sel tubuh dan masuk ke dalam jaringan adiposa (Arora, et al., 2009). Sel-sel tubuh menjadi kekurangan energi sehingga merangsang peningkatan produksi glukagon melalui perombakan jaringan lemak sebagai tempat penyimpanan cadangan makanan pada tubuh sehingga mengakibatkan seseorang akan tampak sangat kurus karena kehilangan berat badan yang drastis (Helmawati, 2004). Selain itu penurunan berat badan disebabkan karena tubuh tidak mampu memanfaatkan energi secara optimal meskipun kadar glukosa dalam darah sangat tinggi sehingga energi diperoleh melalui peningkatan katabolisme protein (Erwin, et al., 2012).
mempercepat waktu transit di usus halus, dan memperbaiki proses penyerapan nutrisi.
Pengaruh waktu periodik penimbangan berat badan terhadap berat badan mencit percobaan
Daftar sidik ragam (Lampiran 4) menunjukkan bahwa waktu periodik penimbangan berat badan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap berat badan mencit percobaan, sehingga uji LSR tidak dilanjutkan.
Pengaruh interaksi antara jenis perlakuan dan waktu periodik penimbangan berat badan terhadap persentase kenaikan berat badan mencit percobaan
Daftar sidik ragam (Lampiran 4) menunjukkan bahwa interaksi antara jenis perlakuan dan waktu penimbangan berat badan memberikan pengaruh berbeda tidak nyata (P>0,05) terhadap persentase kenaikan berat badan mencit percobaan, sehingga uji LSR tidak dilanjutkan.
Efek hipoglikemik Polisakarida Larut Air (PLA) Bengkuang
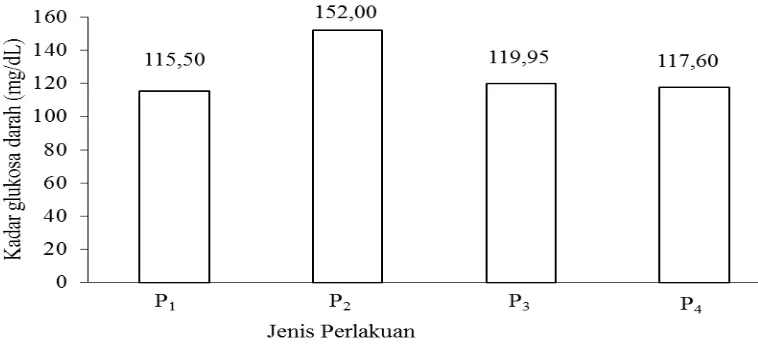
Pengaruh jenis perlakuan terhadap kadar glukosa darah mencit percobaan
Daftar sidik ragam (Lampiran 5) menunjukkan bahwa jenis perlakuan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap kadar glukosa darah mencit percobaan. Hasil uji LSR pengaruh jenis perlakuan terhadap kadar glukosa darah mencit percobaan dapat dilihat pada Tabel 6.
Tabel 6. Uji LSR pengaruh jenis perlakuan terhadap kadar glukosa darah mencit percobaan selama 4 minggu (mg/dL)
Keterangan: Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Tabel 6 menunjukkan bahwa perlakuan P2 (kelompok negatif) memiliki kadar glukosa darah yang paling tinggi yaitu 152,00 mg/dL dan paling terendah terdapat pada perlakuan P1 (kelompok kontrol) yaitu 115,50 mg/dL. Perlakuan P1 (kelompok kontrol) berbeda sangat nyata dengan P2 (kelompok negatif) serta tidak berbeda nyata dengan P3 (kelompok positif) dan P4 (kelompok perlakuan). Perlakuan P2 (kelompok negatif) berbeda sangat nyata dengan P3 (kelompok positif) dan P4 (kelompok perlakuan). Perlakuan P3 (kelompok positif) tidak berbeda nyata dengan P4 (kelompok perlakuan). Hubungan antara jenis perlakuan
dengan kadar glukosa darah mencit percobaan dapat dilihat pada Gambar 10. Keterangan: P1= kelompok kontrol, P2= kelompok negatif, P3= kelompok positif, P4= kelompok
perlakuan.
Gambar 10. Hubungan antara jenis perlakuan dengan kadar glukosa darah mencit percobaan
percobaan dalam keadaan diabetes. Hal ini sesuai dengan Erwin dkk., (2012) yang menyatakan bahwa streptozotocin dapat membuat hewan dalam keadaan diabetes yang bekerja dengan cara membentuk radikal bebas yang sangat reaktif yang dapat menimbulkan kerusakan pada membran sel, protein, dan DNA.
Gambar 10 menunjukkan mencit dengan perlakuan P4 (kelompok perlakuan) memiliki kadar glukosa darah yang mendekati mencit dengan perlakuan P1 (kelompok kontrol) dan P3 (kelompok positif). Setelah dalam waktu 4 minggu kadar glukosa darah mencit dengan perlakuan P4 (kelompok perlakuan) kembali dalam keadaan normal yaitu 117,6 mg/dL, dimana kadar glukosa darah mencit yang mengalami diabetes adalah sebesar >126 mg/dL. Adanya pemberian polisakarida larut air bengkuang yang diekstraksi dengan laru tempe pada kelompok mencit perlakuan P4 (kelompok perlakuan) menunjukkan kerja polisakarida larut air bengkuang yang dapat menurunkan kadar glukosa darah. Hal ini sesuai dengan Weickert dan Pfeiffer (2008) yang menyatakan bahwa serat makanan dapat menurunkan glukosa postprandial yang berkaitan dengan sifatnya yang membentuk gel dan larutan yang kental. Serat makanan dapat menghambat pengosongan perut sehingga dapat mengatur penyerapan glukosa.
Pengaruh waktu periodik pengujian terhadap kadar glukosa darah mencit percobaan
Hasil LSR terhadap pengaruh waktu periodik pengujian terhadap kadar glukosa darah mencit percobaan dapat dilihat pada Tabel 7.
Tabel 7. Uji LSR pengaruh waktu periodik pengujian terhadap kadar glukosa darah mencit percobaan (mg/dL)
Keterangan: Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbeda sangat nyata pada taraf 1% (huruf besar).
Tabel 7 menunjukkan bahwa perlakuan M1 (minggu ke-1) memiliki kadar glukosa darah yang paling tinggi yaitu 136,00 mg/dL dan paling terendah terdapat pada perlakuan M4 (minggu ke-4) yaitu 118,00 mg/dL. Perlakuan M1 (minggu ke-1) berbeda nyata dengan M2 (minggu ke-2), dan berbeda sangat nyata dengan M3 (minggu ke-3) dan M4 (minggu ke-4). Perlakuan M2 (minggu ke-2) berbeda sangat nyata dengan M3 (minggu ke-3) dan M4 (minggu ke-4). Perlakuan M3 (minggu ke-3) berbeda nyata dengan M4 (minggu ke-4).
Hubungan antara waktu periodik pengujian dengan kadar glukosa darah mencit percobaan dapat dilihat pada Gambar 11. Rata-rata kadar glukosa darah mencit pada minggu ke-1 adalah sebesar 126 mg/dL yang merupakan kadar glukosa darah paling tinggi dan semakin lama akan semakin menurun. Hal ini dikarenakan pada minggu ke-1 dan minggu ke-2 masih adanya kerja dari streptozotocin. Setelah minggu ke-3 maka yang berperan adalah polisakarida larut air bengkuang. Polisakarida Larut Air (PLA) bengkuang bekerja dalam memperbaiki proses penyerapan nutrisi dan memperlama proses pengosongan lambung sehingga dapat mengatur proses penyerapan glukosa. Hasil penelitian
Jarak LSR Waktu pengujian Rataan Notasi
0,05 0,01 0,05 0,01
- - - M1 = Minggu ke-1 136,00 a A
Harijono, et al. (2012) menunjukkan bahwa efek hipoglikemik paling tinggi adalah ekstraksi PLA gembili dengan laru tempe dibandingkan ekstraksi dengan papain dan air setelah masa penelitian 28 hari.
Gambar 11. Hubungan antara waktu periodik pengujian dengan kadar glukosa darah mencit percobaan
Pengaruh interaksi antara jenis perlakuan dan waktu periodik pengujian terhadap kadar glukosa darah mencit percobaan
Daftar sidik ragam (Lampiran 5), dapat dilihat bahwa pengaruh interaksi antara jenis perlakuan dan waktu periodik pengujian terhadap kadar glukosa darah mencit percobaan memberikan pengaruh yang berbeda sangat nyata (P<0,01) terhadap rata-rata kadar glukosa darah hewan percobaan. Hasil LSR pengaruh interaksi antara jenis perlakuan dan waktu periodik pengujian terhadap kadar glukosa darah mencit percobaan dapat dilihat pada Tabel 8.
Tabel 8. Uji LSR pengaruh jenis perlakuan dan waktu periodik pengujian terhadap kadar glukosa darah mencit percobaan (mg/dL)
Jarak LSR Perlakuan Rataan Notasi
0,05 0,01 0,05 0,01
- - P1M1 115,00 bc B
2 16,270 21,636 P1M2 123,00 b B
3 17,116 22,557 P1M3 119,40 bc BC
4 17,674 23,178 P1M4 104,60 c C
5 18,076 23,644 P2M1 156,60 a A
6 18,393 24,006 P2M2 150,00 a A
7 18,640 24,305 P2M3 151,60 a A
8 18,847 24,558 P2M4 149,80 a A
9 19,020 24,771 P3M1 136,60 ab AB
10 19,169 24,961 P3M2 118,00 bc BC
11 19,296 25,122 P3M3 112,40 bc BC
12 19,405 25,271 P3M4 112,80 bc BC
13 19,503 25,404 P4M1 135,80 bb AB
14 19,589 25,519 P4M2 119,40 bc BC
15 19,664 25,628 P4M3 110,40 bc BC
16 19,733 25,731 P4M4 104,80 c C
Keterangan: Notasi huruf yang berbeda menunjukkan pengaruh yang berbeda nyata pada taraf 5% (huruf kecil) dan berbedan sangat nyata pada taraf 1% (huruf besar)
Keterangan: M1= minggu ke-1, M2= minggu ke-2, M3= minggu ke-3, M4= minggu ke-4
Gambar 12 menunjukkan bahwa pada mencit dengan perlakuan P4 (kelompok perlakuan) terjadi penurunan kadar glukosa darah yang signifikan dibandingkan kelompok mencit percobaan yang lain.
Penurunan kadar glukosa darah yang paling tajam terdapat pada perlakuan P4 (Kelompok perlakuan) yaitu induksi streptozotocin 180 mg/kg berat badan dan pemberian PLA bengkuang sebanyak 400 mg/kg berat badan diikuti oleh perlakuan P3 (Kelompok positif) yaitu pemberian PLA bengkuang sebanyak 400 mg/kg berat badan. Dari Gambar 12 menunjukkan bahwa kadar glukosa darah mencit hiperglikemia pada perlakuan P4 (Kelompok perlakuan) kembali normal (<126 mg/dL) setelah pemberian PLA bengkuang selama 2 minggu.
Ekstraksi PLA gembili dengan menggunakan laru tempe mempunyai kemampuan penurunan kadar glukosa darah yang paling tinggi dibandingkan ekstraksi PLA dengan papain dan air (Harijono, 2012). PLA yang merupakan serat larut air yang dapat menurunkan glukosa postprandial yang berkaitan dengan sifatnya yang membentuk gel dan larutan kental. Larutan tersebut dapat membentuk viskositas yang tinggi yang dapat menghambat penyerapan gula di
pencernaan akibat gula terperangkap dalam struktur gel yang lemah (Weickert dan Pfeiffer, 2008). Didukung oleh hasil penelitian Lee, dkk. (2007)
Kesimpulan
1. Pada uji toleransi glukosa terbukti bahwa polisakarida larut air (PLA) bengkuang dapat menghambat penyerapan glukosa ke dalam darah yang ditandai dengan penurunan kadar glukosa darah secara signifikan (p<0,01). 2. Kelompok perlakuan (P4) yaitu induksi streptozotocin 180 mg/kg berat badan
dan pemberian polisakarida larut air bengkuang 400 mg/kg berat badan merupakan kelompok mencit percobaan yang mengalami penurunan kadar glukosa darah yang paling signifikan (P<0,01) dibandingkan dengan kelompok lain.
3. Hasil penelitian menunjukkan PLA bengkuang dengan dosis 400 mg/kg berat badan secara signifikan (P<0,01) dapat menurunkan kadar glukosa darah dan meningkatkan berat badan selama 4 minggu pada mencit yang diinduksi streptozotocin.
Saran
TINJAUAN PUSTAKA
Umbi Bengkuang
Bengkuang termasuk famili Leguminosae yang merupakan tanaman semak yang tumbuh melilit. Batang tanaman ini bulat, berambut, dan berwarna hijau. Daun tanaman bengkuang tunggal, berbentuk bulat telur, ujung daun runcing, pangkal daun tumbul, tepi daun rata, dan pertulangan daun menyirip. Daun tanaman bengkuang berbulu, memiliki panjang 7-10 cm, lebar 5-9 cm, dan berwarna hijau. Ukuran umbi bengkuang bervariasi sesuai dengan kondisi pertumbuhan. Bunga tanaman bengkuang berjumlah majemuk dan berbentuk tandan. Buah bengkuang berbentuk polong dan lanset putih. Tanaman bengkuang memiliki akar tunggang dan berumbi. Umbi dari bengkuang banyak dikonsumsi sebagai makanan fungsional karena memiliki berbagai kandungan gizi (Adi, 2008). Gambar umbi bengkuang dapat dilihat pada Gambar 1.
Gambar 1. Umbi bengkuang
Bengkuang dapat diklasifikasikan sebagai berikut (Van Steenis, 2005): Kingdom : Plantae
Kelas : Dicotyledoneae Ordo : Fabales
Famili : Fabaceae Genus : Pachyrhizus
Spesies : Pachyrhizus erosus L.
Salah satu daerah sentra penghasil bengkuang di Sumatera Utara adalah Kota Binjai. Badan SDM Pertanian Binjai pada Tahun 2011 melaporkan bahwa daerah Binjai telah menghasilkan umbi bengkuang sebanyak 7-7,5 ton/ha. Selain Binjai, Kota Padang dan Kebumen, Jawa Tengah merupakan sentra penghasil bengkuang di Indonesia. Varietas dari tanaman bengkuang yang biasa ditanam di Indonesia adalah varietas gajah dan badur. Kedua jenis varietas berbeda pada waktu panennya. Waktu panen bengkuang varietas gajah relatif lebih cepat dari pada varietas badur. Bengkuang varietas gajah dapat dipanen pada umur empat sampai lima bulan sedangkan bengkuang varietas badur dipanen ketika berusia tujuh sampai sebelas bulan (Sianturi, 2011).
Bengkuang memiliki potensi dalam pengembangan industri tepung. Hal ini dikarenakan rendemen tepung bengkoang 9-14% dengan 50% pati di dalamnya. Selain itu, bengkuang juga memiliki berbagai zat gizi yang sangat berpotensi untuk dikembangkan menjadi berbagai produk olahan. Komposisi zat gizi bengkuang dan karakteristik fisik dan kimia ekstrak pati bengkuang dapat dilihat pada Tabel 1 dan Tabel 2.
Tabel 1. Komposisi zat gizi umbi bengkuang
Zat Gizi Dasar Kadar per 100g Persentase RDA(%)
Tabel 2. Sifat kimia ekstrak PLA bengkuang umur 5 bulan
Komposisi kimia Kadar per 100 gram
Kadar air (%) 4,7499
Kadar abu (%) 0,9618
Kadar protein (%) 1,403
Kadar lemak (%) 0,1328
Kadar karbohidrat (%) 92,7522
Kadar amilosa (%) 6,2867
Kadar serat kasar (%) 2,2441
Sumber: Hilman, 2012.
Bengkuang mengandung serat yang tinggi, terutama serat larut air yang berguna untuk menurunkan kadar indeks glikemik dan memperlancar pencernaan. Bengkuang dapat mencegah sariawan karena mengandung vitamin C yang tinggi. Bengkuang juga mengandung komponen bioaktif yang bertindak sebagai antioksidan karena senyawa isoflavon yang dihasilkan menurunkan kadar kolesterol jahat (Lingga, 2010). Isoflavon yang terdapat pada tanaman fungsional terbukti dapat menangkal radikal bebas dan kemudian dapat mencegah penyakit kardiovaskular (Song, et al., 1998).
Mekanisme kerja berbagai tanaman sebagai antidiabetes adalah sebagai berikut:
1. Mempunyai kemampuan sebagai astringen yaitu dapat mempresitasikan protein selapur lendir usus dan membentuk suatu lapisan yang melindungi usus, sehingga menghambat asupan glukosa sehingga laju peningkatan glukosa darah tidak terlalu tinggi. Beberapa tanaman yang termasuk dalam kelompok ini adalah alpukat, buncis, bengkuang, jagung, jambu biji, lamtoro, mahoni, dan salam.
mempercepat filtrasi dan eksresi ginjal meningkat sehingga kadar glukosa dalam darah menurun. Beberapa tanaman yang termasuk dalam kelompok ini adalah bawang putih, daun sendok, suwet atau jamblang, keji beling, kumis kucing, dan labu parang.
3. Mempercepat keluarnya glukosa melalui peningkatan metabolisme atau memasukkan ke dalam deposit lemak. Proses ini melibatkan pankreas untuk memproduksi insulin. Beberapa tanaman yang termasuk kelompok ini adalah lidah buaya, brotowali, pare, dan sambiloto.
Sumber : Retnanigsih, et al., 2007.
Diabetes Mellitus
Diabetes mellitus adalah suatu penyakit yang timbul dari adanya kadar gula darah yang tinggi (hiperglikemia). Hal ini disebabkan oleh kelainan yang berkaitan dengan hormon insulin yang berfungsi sebagai penyeimbang kadar gula darah. Gangguan hormon insulin sendiri disebabkan oleh kurangnya produksi insulin oleh organ pankreas. Tingginya kadar gula darah juga disebabkan oleh asupan makanan yang menjadi sumber gula secara berlebihan (Helmawati, 2014). Faktor lain yang juga menyebabkan penyakit diabetes mellitus adalah stress oksidatif. Stress oksidatif adalah kondisi dimana radikal bebas yang terdapat dalam tubuh yang berupa molekul reaktif merusak membran sel dan menyebabkan berbagai gangguan fungsi tubuh (Hanachi, et al., 2009).
Diabetes mellitus terdiri dari beberapa tipe, yaitu (Helmawati, 2014): 1. DM Tipe I yaitu diabetes yang bergantung pada insulin. Penyakit diabetes tipe I
kebutuhan untuk mengatur kadar gula darah dengan tepat. Gangguan pada pankreas disebabkan oleh hancurnya sel beta dalam pankreas yang berperan dalam memproduksi hormon insulin.
2. DM Tipe II yaitu diabetes yang tidak bergantung pada insulin, insulin diproduksi dalam jumlah cukup akan tetapi sel-sel tubuh tidak dapat merespons insulin dengan baik. Akibatnya glukosa yang dikonsumsi tidak dapat diubah menjadi energi tetapi akan secara utuh terdapat di dalam darah. Pada saat yang sama akan terjadi resistensi insulin pada penderita diabetes tipe II karena insulin yang diproduksi tidak digunakan.
3. Gestasional adalah diabetes yang disebabkan oleh kondisi kehamilan dimana si ibu tidak mampu menghasilkan insulin yang cukup untuk tubuh si ibu dan janin.
Diabetes mellitus dapat diakibatkan oleh beberapa faktor yaitu: • Kelainan fungsi sel-sel β-pankreas yang bersifat genetik (menurun),
• Faktor lingkungan (virus dan obesitas), adanya virus seperti virus penyebab penyakit gondongan dan coxackievirus B4. Virus ini akan berperan sebagai pemicu pengrusakan pankreas. Obesitas akan menyebabkan gangguan toleransi glukosa dan diabetes mellitus tipe II.
• Gangguan sistem imunitas, sistem imun salah mengenali sel β pankreas
sebagai benda asing, sistem kekebalan tubuh yang bertugas memerangi
bakteri dan virus malah menghancurkan sel β pankreas yang memproduksi insulin di dalam pankreas.
Pada penelitian menggunakan hewan percobaan, untuk mengkondisikan hewan percobaan tersebut dalam keadaan diabetes mellitus dapat dilakukan dengan injeksi streptozotocin, aloksan, asam urat, asam dehidroaskorbat, asam dialurat, dan asam ksanturenat yang dapat mengakibatkan kerusakan pada sel beta Langerhans pankreas (Rowland dan Bellush, 1989; Wilson dan LeDoux, 1989).
Hormon insulin dihasilkan oleh sel-sel β pankreas pada pulau-pulau langerhans pankreas sebagai reaksi langsung terhadap keadaan hiperglikemia. Konsentrasi insulin dalam darah berpengaruh dengan konsentrasi glukosa darah. Pemberian insulin dapat mengakibatkan hipoglikemia seketika. Zat-zat lain yang menyebabkan pelepasan insulin adalah asam amino, asam lemak bebas, beban keton, glukagon, dan sekretin. Insulin akan meningkatkan penyerapan glukosa di jaringan seperti jaringan adiposa dan otot secara langsung dan secara tidak langsung akan meningkatkan penyerapan jangka panjang glukosa oleh hati (Utama, 2011).
Penelitian in vivo mengenai diabetes mellitus didasarkan pada patogenesis penyakit pada manusia yang bersifat kronis atau berlangsung menahun. Kondisi patologis pada hewan model bertujuan untuk melakukan pencegahan, menetapkan diagnosa, mengetahui patogenesis, dan terapi yang digunakan dalam penanganan penyakit diabetes mellitus (Erwin, et al., 2012).
Polisakarida Larut Air (PLA)
polimer dari unit-unit fruktosa. Polisakarida Larut Air (PLA) atau inulin tersusun atas fruktosa dan bersifat larut dalam air (Hernawati, et al., 2013).
Polisakarida larut air (PLA) merupakan prebiotik yang berfungsi untuk kesehatan pencernaan. PLA termasuk ke dalam golongan oligosakarida yang tersusun oleh inulin (Gambar 2). Inulin ini berfungsi untuk melancarkan proses pencernaan di dalam tubuh dan meningkatkan kesehatan usus sehingga membantu penyerapan kadar gula darah secara optimal (Lingga, 2010).
Gambar 2. Struktur kimia inulin (Scientific Psychic, 2011)
Pada pembuatan polisakarida larut air dilakukan metode ekstraksi. Ekstraksi merupakan metode pemisahan berdasarkan perbedaan koefisien distribusi zat terlarut dalam 2 larutan yang berbeda fasa dan tidak saling bercampur. Ekstraksi dilakukan dengan beberapa pertimbangan faktor, yaitu kemudahan dan kecepatan proses, kemurnian produk yang tinggi dan efektivitas serta selektivitas yang tinggi. Ekstraksi tidak melibatkan perubahan fasa sehingga tidak membutuhkan energi (Gozan, 2006). Ekstraksi dengan laru tempe mempunyai aktivitas hidrolitik yang mendegradasi makromolekul menjadi komponen dengan berat molekul rendah. Selama fermentasi akan terbentuk isoflavon aglikon yang mempunyai bioaktivitas yang lebih baik dari isoflavon dalam bentuk glikosida (Mortensen, et al., 2009). Polisakarida larut air bengkuang yang terbentuk dari metode ekstraksi dengan menggunakan laru tempe terbukti lebih baik daripada ekstraksi dengan ragi tape dan air (Hilman, 2012).
Streptozotocin
Gambar 3. Struktur kimia streptozotocin
Streptozotocin adalah senyawa yang dihasilkan dari Streptomyces acromogenes yang merupakan suatu senyawa urea analog glukosa. Streptozotocin mudah larut dalam air, sedikit larut dalam alkohol dan keton (McNeill, 1999). Senyawa ini dapat digunakan untuk menginduksi penyakit diabetes mellitus tipe 1 dan diabetes mellitus tipe 2 pada hewan percobaan. Untuk menginduksi diabetes mellitus tipe 2, streptozotocin diinduksi secara intaperitoneal dengan dosis 100 mg/kg berat badan tikus yang berumur 2 hari kelahiran, pada 8-10 minggu tikus mengalami gangguan respon terhadap glukosa dan sensitivitas sel β terhadap glukosa (Bonner-Weir, et al., 1981; Szkudelski, 2001; Tormo, et al., 2006).
PENDAHULUAN
Latar Belakang
Salah satu pemicu penyakit degeneratif adalah adanya perubahan pola makan sehari-hari. Kecenderungan masyarakat untuk mengkonsumsi makanan cepat saji seperti junk food dan fast food dikarenakan waktu dan kesibukan yang membatasi. Adanya perubahan ini menyebabkan masyarakat tidak lagi memperhatikan kandungan gizi makanan yang dikonsumsi. Perubahan pola makan ini terjadi hampir diseluruh dunia termasuk di Indonesia. Salah satu penyakit degeneratif yang sering terjadi akibat hal ini adalah diabetes mellitus.
Berdasarkan laporan Global Status Report yang dirilis Organisasai Kesehatan Dunia (WHO) pada 2010 disebutkan diabetes mellitus menduduki peringkat keenam sebagai penyebab kematian kategori penyakit degeneratif. International Diabetes Federation pada 2012 melaporkan penderita diabetes mellitus di seluruh dunia mencapai 371 juta orang (Rosalina, 2013). Pada tahun 2013, Indonesia memiliki sekitar 8,5 juta penderita diabetes yang merupakan jumlah ke-4 terbanyak di Asia dan ke-7 di dunia. Pada tahun 2030 diperkirakan diabetes mellitus menempati urutan ke-7 penyebab kematian dunia jika tidak ditangani dengan baik, sedangkan untuk Indonesia diperkirakan pada tahun 2030 akan memiliki penyandang diabetes mellitus sebanyak 21,3 juta jiwa (Kementerian Kesehatan Republik Indonesia, 2013).
Diabetes mellitus merupakan penyakit kronis yang menciri dengan adanya abnormalitas metabolisme karbohidrat, lipid, protein, dan berkaitan dengan
defisiensi insulin (Suryawanshi, dkk., 2006). Gangguan insulin disebabkan oleh ketidakmampuan organ pankreas dalam memproduksi insulin secara optimal.
Sekarang ini hampir semua jenis pangan yang semula menjadi kebanggaan bangsa tertentu dengan mudah diperoleh dan dimanfaatkan oleh bangsa lain. Sudah sepantasnya di masa mendatang bangsa Indonesia tidak perlu menggantungkan diri pada produk pangan fungsional dan suplemen yang diproduksi di manca negara tetapi bahan bakunya berasal dari Indonesia, atau diproduksi dengan lisensi/paten dari manca negara padahal komponen bioaktif yang digunakan untuk pangan tersebut berasal dari sumberdaya pangan Indonesia. Tanaman bengkuang dikategorikan sebagai salah satu tanaman yang pemanfaatannya belum optimal. Bengkuang adalah salah satu tanaman legum yang menghasilkan umbi akar yang dapat dikonsumsi. Sejauh ini umbi bengkuang di Indonesia hanya dimanfaatkan sebagai bahan konsumsi segar namun sebenarnya memiliki potensi industri yang cukup besar.
Bengkuang (Pachyrizus erosus L.) termasuk tanaman polong hortikultura yang mempunyai potensi sangat baik untuk dikembangkan karena manfaat dari tanaman bengkoang sangat banyak diantaranya adalah umbi bengkuang mengandung inulin yang tidak bisa dicerna sehingga dapat digunakan sebagai pengganti gula, kandungan pati bengkuang yang dapat digunakan sebagai bahan kosmetik, serta sebagai bahan dasar obat untuk penyakit kanker, diabetes mellitus, nyeri perut, dan dapat diolah sebagai bahan makanan.
bagi penderita diabetes atau orang yang melakukan diet rendah kalori (Lingga, 2010). Keberadaan isoflavon dan PLA pada umbi bengkoang menambah pamor bengkoang sebagai tanaman yang berkhasiat untuk mencegah kerusakan oksidatif membran sel, aterosklerosis akibat teroksidasinya LDL (kolesterol jahat), penyakit jantung koroner, penyakit kardiovaskular, dan kerusakan oksidatif DNA. Selain itu daya antioksidan isoflavon juga berguna untuk memberi efek antiproliferatif dan menghambat pertumbuhan sel melanoma (salah satu pemicu kanker) (Astawan, 2009), sedangkan PLA berguna bagi kesehatan flora yang hidup di dalam usus seperti Lactobaciillus sp (Lingga, 2010).
Bengkuang memiliki kandungan serat pangan yang cukup tinggi. Serat pangan merupakan bagian makanan yang tahan terhadap pencernaan dan absorpsi dinding usus halus, yang kemudian difermentasi di dalam usus besar, maka serat dapat berfungsi sebagai prebiotik bagi mikroflora usus serta dapat menurunkan kadar kolesterol dan glukosa darah. Oligosakarida merupakan polimer dari unit-unit fruktosa. Inulin bersifat larut air, tidak dapat dicerna oleh enzim-enzim pencernaan, tetapi difermentasi mikroflora kolon (Hernawati, dkk., 2013).