KETAHANAN TANAMAN TERUNG BELANDA
(
Solanum betaceum
Cav) SETELAH DIINDUKSI DENGAN
SINAR UV TERHADAP
Colletotrichum
sp.
SKRIPSI
ROSIMA SIMANJUNTAK 080805051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
KETAHANAN TANAMAN TERUNG BELANDA
(
Solanum betaceum
Cav) SETELAH DIINDUKSI DENGAN
SINAR UV TERHADAP
Colletotrichum
sp.
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ROSIMA SIMANJUNTAK 080805051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul : Ketahanan Tanaman Terung Belanda (Solanum betaceum Cav) Setelah Diinduksi Dengan Sinar UV Terhadap Colletotrichum sp.
Kategori : Skripsi
Nama : Rosima Simanjuntak
Nomor Induk Mahasiswa : 0808085051
Program Studi : SARJANA (S1) BIOLOGI Departemen : BIOLOGI
Fakultas : Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara
Disetujui di Medan, Juli 2013
Komisi Pembimbing:
Pembimbing 2 Pembimbing 1
Dra. Isnaini Nurwahyuni, M.Sc Dra. Elimasni, M.Si
NIP. 19600523 198502 2 001 NIP. 19650524 199003 2 001
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
KETAHANAN TANAMAN TERUNG BELANDA (Solanumbetaceum Cav) SETELAH DIINDUKSI DENGAN SINAR UV TERHADAP Colletotrichum sp.
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2013
Puji dan syukur penulis ucapkan pada Tuhan Yesus Kristus karena atas berkat dan kasih karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul: “Ketahanan Tanaman Terung Belanda (Solanum betaceum Cav) Setelah Diinduksi Sinar UV Terhadap Colletotrichum sp.
Ucapan terima kasih penulis sampaikan kepada; Ibu Dra. Elimasni, MSi., Ibu Dra. Isnaini Nurwahyuni, MSc. selaku pembimbing, Bapak Drs. Muhammad Zaidun S. M.Si., dan Ibu Dra. Nunuk Priyani, M.Sc., selaku penguji yang telah memberi arahan dan bimbingan kepada penulis dalam menyelesaikan hasil skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Bapak/Ibu dosen dan pegawai di Departemen Biologi FMIPA USU.
KETAHANAN TANAMAN TERUNG BELANDA (Solanum betaceum Cav) SETELAH DIINDUKSI DENGAN UV TERHADAP Colletotrichum sp.
ABSTRAK
Ketahanan tanaman terung belanda (Solanum betaceum Cav) setelah diinduksi dengan UV terhadap Colletotrichum sp. telah dilakukan dari Februari sampai Desember 2012 di Departemen Biologi FMIPA dan rumah kaca Fakultas Pertanian, Universitas Sumatera Utara, Medan. Penelitian ini menggunakan metode rancangan acak lengkap faktorial dengan dua faktor yaitu faktor daya UV (0, 10, 20, dan 30 watt) dan faktor lama penyinaran UV (30, 60, dan 90 detik). Induksi UV dilakukan dengan penyinaran UV pada kecambah Solanum betaceum Cav dengan kombinasi daya UV dan lama penyinaran UV. Analisis kromosom dilakukan dengan metode pencet. Hasil pengamatan terhadap kariotipe Solanum
betaceum Cav tidak berpengaruh terhadap jumlah kromosom (12n) tetapi
beberapa kromosom mengalami perubahan dari metasentrik menjadi submeta sentrik. Hasil penelitian terhadap morfologi, kadar protein total dan intensitas serangan secara statistika berbeda nyata tetapi tidak berbeda nyata terhadap aktivitas peroksidase dan polifenol oksidase.
ABSTRACT
The of resistance of tamarillo (Solanum betaceum Cav) after UV induction to
Colletotrichum sp. has been done from February to December 2012 at Biology
Departement, Faculty of Mathematic and Natural Science and Greenhouse Agriculture Faculty, Sumatera Utara University, Medan. This research used complete factorial randomized design with two factors, which are UV power (0, 10, 20 and 30 watt) and length of UV induction (30, 60 and 90 second). The induction was done by UV light power combined with length of UV exposure to the sp.rout. Chromosome analysis was observed used squash method. The results indicate that the power and duration of UV light had no effect on the number of chromosomes (12n), but some chromosomes are deformed from metacentric to submetacentric. Statistical analysis showed that plant morphology, protein standart content and onset intensity were significantly different while peroxidase and polyphenoloxidase activities were not significant.
Bab 4. Hasil dan Pembahasan
4.1. Kromosom 17
4.2. Pengamatan Morfologi 18
4.3. Intensitas Serangan Pada Daun 20
4.4. Kadar Protein 22
4.5. Aktivitas Peroksidase 23
4.6. Aktivitas Polifenol Oksidase 24
Bab 5. Kesimpulan dan Saran 5.1. Kesimpulan 26
5.2. Saran 26
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1. Pengamatan Morfologi Terung Belanda 16 4.2. Jumlah dan Tipe Kromosom Terung Belanda 18 4.3. Intensitas Serangan Pada Daun Terung Belanda 19
4.4. Kadar Protein Terung Belanda 21
Nomor Judul Halaman Gambar
3.4.3. Biakan Colletotrichum sp. pada media GYB 13 4.1. Pengaruh lama penyinaran daya UV terhadap rata-rata tinggi 17
Terung belanda
4.2. Sel akar terung belanda (Solanum betaceum Cav) perbesaran 18 1000X dengan pewarna asetokarmin
4.3. Pengaruh daya UV terhadap rata-rata intensitas serangan 20
Colletotrichum sp. pada daun terung belanda
DAFTAR LAMPIRAN 16. Data Pengukuran Aktivitas Peroksidase dengan Spektrofotometer 45
Pada Panjang Gelombang 420 nm
17. Data Pengukuran Aktivitas Polifenol Oksidase dengan 46 Spektrofotometer Pada Panjang Gelombang 420 nm
18. Data Kadar Protein 47
ABSTRAK
Ketahanan tanaman terung belanda (Solanum betaceum Cav) setelah diinduksi dengan UV terhadap Colletotrichum sp. telah dilakukan dari Februari sampai Desember 2012 di Departemen Biologi FMIPA dan rumah kaca Fakultas Pertanian, Universitas Sumatera Utara, Medan. Penelitian ini menggunakan metode rancangan acak lengkap faktorial dengan dua faktor yaitu faktor daya UV (0, 10, 20, dan 30 watt) dan faktor lama penyinaran UV (30, 60, dan 90 detik). Induksi UV dilakukan dengan penyinaran UV pada kecambah Solanum betaceum Cav dengan kombinasi daya UV dan lama penyinaran UV. Analisis kromosom dilakukan dengan metode pencet. Hasil pengamatan terhadap kariotipe Solanum
betaceum Cav tidak berpengaruh terhadap jumlah kromosom (12n) tetapi
beberapa kromosom mengalami perubahan dari metasentrik menjadi submeta sentrik. Hasil penelitian terhadap morfologi, kadar protein total dan intensitas serangan secara statistika berbeda nyata tetapi tidak berbeda nyata terhadap aktivitas peroksidase dan polifenol oksidase.
RESISTANCE OF TAMARILLO (Solanum betaceum Cav) AFTER UV INDUCTION TO Colletotrichum sp.
ABSTRACT
The of resistance of tamarillo (Solanum betaceum Cav) after UV induction to
Colletotrichum sp. has been done from February to December 2012 at Biology
Departement, Faculty of Mathematic and Natural Science and Greenhouse Agriculture Faculty, Sumatera Utara University, Medan. This research used complete factorial randomized design with two factors, which are UV power (0, 10, 20 and 30 watt) and length of UV induction (30, 60 and 90 second). The induction was done by UV light power combined with length of UV exposure to the sp.rout. Chromosome analysis was observed used squash method. The results indicate that the power and duration of UV light had no effect on the number of chromosomes (12n), but some chromosomes are deformed from metacentric to submetacentric. Statistical analysis showed that plant morphology, protein standart content and onset intensity were significantly different while peroxidase and polyphenoloxidase activities were not significant.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Terung belanda mempunyai aspek fungsional yang tinggi sebagai antioksidan
karena mengandung vitamin A, C, E dan B6 (Kumalaningsih & Suprayogi, 2006).
Terung belanda juga mengandung mineral penting seperti potassium, fosfor dan
magnesium berguna menjaga dan memelihara kesehatan. Terung belanda
dimanfaatkan untuk pembuatan sirup, jus, selai hiasan es krim dan acar
(Zeladmin, 2012).
Pentingnya peranan terung belanda untuk dikomsumsi maka produksinya
harus ditingkatkan. Tanaman ini dapat diserang berbagai jamur seperti Fusarium sp., Colletotrichum sp. dan lain-lain. Sementara itu, tanaman yang tumbuh di Berastagi sebagian besar terserang penyakit terutama antraknosa yang disebabkan
oleh Colletotrichum sp. Jamur ini sangat berbahaya karena dapat menyerang daun menyebabkan nekrosis. Jamur ini juga menyerang buah mentah dan tinggal
dorman selama 3 bulan. Tanaman terung belanda seragam dan rentan terhadap
penyakit tersebut sehingga perlu mutan untuk memperoleh tanaman yang tahan.
Tanaman mutan diperoleh dengan induksi UV.
Keberhasilan induksi mutasi pada tanaman tergantung jenis mutagen, konsentrasi
mutagen, lama perlakuan mutagen, umur dan organ yang diperlakukan (Yanti,
2011). Mutagen fisik adalah berbagai tipe radiasi (contoh sinar-X, gamma,
ultraviolet) (Nasir, 2002). Sinar UV dapat menyebabkan terbentuknya ikatan
kovalen antara dua molekul timin yang menghasilkan dimer timin. Sinar UV ini
mempunyai pengaruh yang sangat kuat terhadap kelangsungan dan keefektifan
2
DNA berakibat pada perubahan pada kromosom dan sintesis protein terganggu.
Supriharti et al. (2007) menyatakan penyusunan kromosom dilakukan berdasarkan ukuran dan tipe/bentuknya disebut kariotipe. Ginting (2010) menyatakan
peningkatan energi lampu UV sampai 60 watt seiring dengan peningkatan waktu
penyinaran sampai 4 jam menyebabkan penurunan tinggi tanaman.
Elimasni (2010 Laporan Penelitian) menyatakan secara in vitro telah dilakukan penelitian pengaruh UV terhadap aktivitas peroksidase dan polifenol
oksidase menggunakan daya UV 10, 20, 30 watt dan lama penyinaran UV 30, 60,
90 detik. Aktivitas enzim PO tertinggi terdapat pada perlakuan U1T3 dan U2T2.
Sedangkan aktivitas enzim PPO tertinggi terdapat pada perlakuan U2T3. Agrios
(2005) dan Purnama (2009) menyatakan induksi mutasi dan patogen pada
tanaman dapat meningkatkan aktivitas peroksidase dan polifenol oksidase. Enzim
ini berperan dalam ketahanan pada tanaman. Pada tanaman yang tahan terjadi
peningkatan aktivitas peroksidase dan polifenol oksidase. Oleh karena itu, perlu
dilakukan induksi UV untuk mengetahui aktivitas peroksidase dan polifenol
oksidase terung belanda yang tahan terhadap Colletotrichum sp.
1.2Permasalahan
Terung belanda mempunyai banyak manfaat karena kandungan nutrisinya
yang tinggi, namun perhatian terhadap kualitas dan kuantitasnya masih kurang.
Sampai saat ini sudah banyak penelitian yang dilakukan untuk meningkatkan
kualitas dan kuantitas terung belanda misalnya dengan menggunakan kolkisin dan
UV namun belum didapat mutan yang tahan terhadap Colletotrichum sp. Oleh karena itu, peneliti mencoba dengan menginduksi biji terung belanda dengan UV
1.3Tujuan Penelitian
a. Untuk mengetahui kariotipe dan pertumbuhan terung belanda (Solanum
betaceum Cav) setelah diinduksi UV.
b. Untuk mengetahui aktivitas enzim PO dan PPO terung belanda (Solanum
betaceum Cav) mutan yang tahan terhadap Colletotrichum sp.
1.4 Hipotesis
a. Perbedaan daya dan lama penyinaran lampu UV berpengaruh terhadap
kariotipe dan pertumbuhan terung belanda.
b. Inokulasi filtrat Colletotrichum sp. berpengaruh terhadap intensitas serangan, aktivitas enzim PO dan PPO.
1.5 Manfaat Penelitian
a. Dengan penelitian ini diharapkan memperoleh terung belanda yang
mempunyai kualitas dan kuantitas yang lebih baik.
BAB 2
TINJAUAN PUSTAKA
2.1 Terung Belanda (Solanum betaceum Cav)
Buah Tamarillo atau terung belanda sangat popular di New Zealand. Tanaman ini
berasal dari Peru dan masuk ke Indonesia dikembangkan antara lain di Bali, Jawa
Barat, dan Tanah Karo Sumatera Utara (Kumalaningsih & Suprayogi, 2006).
Menurut Tjitrosoepomo (2003), klasifikasi terung belanda sebagai berikut:
Kingdom : Plantae
Division : Spermatophyta
Sub Divisio : Angiospermae
Kelas : Dicotyledonae
Ordo : Solanales
Famili : Solanaceae
Genus : Solanum
Spesies : Solanum betaceum Cav
Terung belanda dapat bertahan hidup pada ketinggian 1000-2000 m dpl,
jika suhu bulanan rata-ratanya tetap diatas 10oC. Di dataran rendah, terung
belanda tidak mampu berbunga, sedangkan udara sejuk malam dapat mendorong
pembungaan. Tanaman ini berbuah matang pada suhu dingin di daerah subtropik,
dan jika ditanam di daerah tropik buah matang sesudah terjadi udara dingin. Buah
berasa lebih manis pada musim kemarau yang panas dibandingkan pada musim
dingin di dataran tinggi. Terung belanda tumbuh baik di tanah yang baik
drainasenya dengan bahan organik dan kelembaban sedang, tetapi tidak tahan
terhadap genangan walaupun hanya untuk 1-2 hari. Tanaman ini berakar dangkal
Terung belanda berupa perdu yang rapuh, tingginya 2-3 m, pangkal
batangnya pendek, percabangannya lebat. Daunnya bulat, berselang-seling,
berbulu, bunga muncul dalam rangkaian kecil dari ketiak daun, berwarna merah
jambu hingga biru muda, berbau harum. Buahnya berbentuk buah buni bulat
lonjong dengan meruncing ke ujung. Daging buahnya mengandung sari buah,
agak asam, berwarna kuning kehitaman. Bijinya pipih dan tipis (Tubagus, 2007).
2.2 Kromosom Terung Belanda (Solanum betaceum Cav)
Kromosom terung belanda berjumlah 24 (n= 12). Kromosom ini mepunyai dua
tipe yaitu metasentrik dan submetasentrik. Penyusunan kromosom dilakukan
berdasarkan ukuran dan tipe/bentuknya disebut kariotipe (Supriharti et al, 2007). Metode yang digunakan dalam pengamatan kromosom ini adalah metode pencet
dengan pewarna asetokarmin.
Pengamatan kromosom dilakukan pada stadium metaphase, sebab pada
stadium ini kromosom tampak jelas karena mengalami kondensasi, yaitu
kromatin menggumpal karena menggulung dan melipat rapat. Bagian kromosom
yang mengalami kondensasi dan menyempitan disebut sentromer. Sentromer
dapat terletak di tengah dan di ujung kromosom. Pada saat pembelahan, benang
sitoplasmik dari sentriol menempel pada sentromer dan tertarik kearah kutub
pembelahan. Dengan adanya sentromer maka kromosom terbagi menjadi dua
bagian, masing-masing bagian tersebut dinamakan lengan kromosom. Jumlah
kromosom pada suatu organisme tetap, tetapi ada variasi dalam jumlah dan jenis
pola garis kromosomnya (Irawan, 2008).
2.3 Mutasi UV
Mutasi berasal dari kata mutatus (bahasa latin) yaitu perubahan. Mutasi
6
Istilah mutasi pertama kali digunakan oleh Hugo de Vries, untuk mengemukakan
perubahan fenotip mendadak pada bunga Oenothera lamarckiana dan bersifat menurun. Ternyata perubahan tersebut terjadi karena penyimpangan kromosom.
Mutasi adalah perubahan materi genetik suatu makhluk yang terjadi secara
tiba-tiba, acak dan merupakan dasar sumber variasi organisme hidup. Mutasi ada dua
macam yaitu mutasi gen dan mutasi genom. Peristiwa terjadinya mutasi disebut
mutagenesis. Makhluk hidup yang mengalami mutasi disebut mutan dan faktor
penyebab mutasi disebut mutagen (Warianto, 2011).
Mutagen digunakan untuk induksi mutasi pada tanaman tingkat tinggi.
Secara umum mutagen dikelompokkan dalam mutagen kimia dan fisik. Mutagen
kimia adalah berbagai senyawa kimia (contoh kolkisin, EMS). Mutagen fisik
adalah berbagai tipe radiasi (contoh sinar-X, gamma, ultraviolet) (Nasir, 2002).
Sinar ultraviolet (UV) adalah tipe radiasi elektromagnetik yang digunakan untuk
induksi mutasi. Secara umum, tiga kelas radiasi UV yaitu; UV-A ( = 320-400
nm), UV-B ( = 280-320 nm) dan UV-C ( = 250-290 nm). UV-A dan UV-B ada
pada cahaya matahari dan UV-C pada lapisan ozon. Gelombang pendek UV-C
digunakan sebagai agen mutagen. Panjang gelombang UV-C 254 merupakan
penyerapan maksimal asam nukleat (DNA) (Harten, 1998).
Sinar UV dapat menyebabkan terbentuknya ikatan kovalen antara dua
molekul timin yang menghasilkan dimer timin. Sinar UV ini mempunyai
pengaruh yang sangat kuat terhadap kelangsungan dan keefektifan transformasi
DNA dari suatu spesies (Setiawan, 2012). Terganggunya aktivitas DNA berakibat
pada perubahan pada kromosom dan sintesis protein terganggu. Daryono (1998)
menyatakan variasi jumlah dan pola garis kromosom terjadi apabila ada pengaruh
dari luar seperti penyinaran radioaktif, dan zat mutagenik.
Mutagenesis dengan UV pada Kluyveromyces masxianus menyebabkan penurunan persentase sel hidup, peningkatan pertumbuhan diameter koloni mutan,
seiring dengan peningkatan waktu penyinaran sampai 4 jam menyebabkan
penurunan tinggi tanaman, panjang dan lebar daun, berat basah dan berat kering
tanaman, tidak berpengaruh terhadap penurunan jumlah daun dan berpengaruh
terhadap peningkatan kadar klorofil. Menurut Purnama (2009), pemberian
mutagen seperti EMS berpengaruh terhadap aktivitas enzim seperti PO dan PPO.
2.4 Enzim
Enzim adalah protein yang khusus disintesis oleh sel hidup untuk mengkatalisis
reaksi yang berlangsung di dalamnya (Martoharsono, 1998). Enzim juga disebut
katalisator untuk reaksi-reaksi kimia di dalam sistem biologi. Katalisator
mempercepat reaksi kimia. Walaupun katalisator ikut serta dalam reaksi, ia
kembali ke keadaan semula bila reaksi telah selesai. Enzim adalah katalisator
reaksi-spesifik karena semua reaksi biokimia perlu dikatalisis oleh enzim. Hampir
setiap senyawa organik terdapat satu enzim pada beberapa organisme hidup
mampu bereaksi dan mengkatalisis beberapa perubahan kimia (Indah, 2004).
Dalam suatu organisme suatu reaksi tertentu tidak harus dikatalisis oleh
satu enzim saja. Suatu sel mengandung enzim-enzim yang strukturnya mirip dan
menggunakan mekanisme katalisis yang sama tetapi parameter kinetik berbeda
untuk memenuhi kebutuhan sel. Enzim seperti ini disebut isoenzim atau isozim
(McGilvery & Goldstein, 1996). Isozim merupakan bentuk enzim berbeda yang
mengkatalisis reaksi kimia yang sama. Isozim ini berasal dari duplikasi gen.
Isozim dapat memperlihatkan perbedaan ringan dalam sifat sensivitas terhadap
faktor regulatorik tertentu atau afinitas substrak yang mengadaptasikan isozim
kejaringan atau lingkungan tertentu (Santoso, 2010).
Pada beberapa enzim yang mengkatalisis reaksi kimia tertentu berada
dalam bentuk multiple di dalam organisme. Bentuk multiple isozim ini disusun
oleh beberapa macam polipeptida (Shahib, 1992). Suatu organisme mempunyai
8
lingkungan. Jika lingkungan berubah, isozim paling aktif melaksanakan fungsinya
dan membantu organisme bertahan hidup. Disamping itu, satu isozim sering
terdapat pada satu jaringan atau organ dan yang lain pada jaringan atau organ
yang berbeda dengan fungsi berbeda. Isozim yang berbeda kadang dijumpai pada
sel yang sama. Setiap isozim terpajan pada lingkungan kimia yang berbeda di
dalam sel, dan masing-masing berperan dalam urutan reaksi (lintasan metabolik)
yang berlainan. Jadi, didalam tiap organel, sel atau jaringan setiap organisme,
keberadaan lebih dari satu isozim berguna untuk beradaptasi terhadap perubahan
lingkungan (Salisbury & Ross, 1995).
Penggunaan penanda isozim seperti PO dan PPO mempunyai kelebihan
karena diatur oleh gen tunggal dan bersifat kodominan dalam pewarisan,
bersegregasi secara normal menurut nisbah Mendel, kolinier dengan gen dan
merupakan produk gen. Penanda ini bersifat stabil karena tidak dipengaruhi oleh
faktor lingkungan, lebih cepat dan akurat karena tidak menunggu tanaman sampai
bereproduksi (Cahyarini et al., 2004).
2.4.1 Peroksidase (PO)
Peroksidase termasuk anggota enzim oksidoreduktase. Enzim peroksidase mudah
dideteksi karena aktivitasnya yang tinggi dan dapat menggunakan sejumlah
substrak sebagai donor hidrogen. Peroksidase pada tanaman merupakan isoenzim
yang berperan dalam pertumbuhan, diferensiasi dan pertahanan (Cahyarini et al., 2004). Menurut Gaspar (1984) dalam Yanti (2011), peroksidase terdapat
di vakuola atau ruang interseluler dan dinding sel dengan berat molekulnya 40
kDa.
Peroksidase berfungsi mengoksidasi fenol dan meningkatkan laju
polimerisasi senyawa-senyawa seperti lignin yang terdeposit dalam dinding sel
dan papila serta mengganggu pertumbuhan dan perkembangan patogen (Agrios,
patogen dan induksi mutagen. Tanaman tahan penyakit memiliki aktivitas enzim
peroksidase yang tinggi. Menurut Gaston dan Davies (1970), mekanisme tanaman
mengahadapi cekaman karena serangan patogen adalah dengan pembentukan
dinding sel baru yang tidak tembus air dan pembentukan fitoaleksin melalui
aktivitas peroksidase.
2.4.2 Polifenol Oksidase (PPO)
Enzim polifenol oksidase (PPO) adalah enzim oksidoreduktase yang mengandung
tembaga (Cu) yang berperan dalam proses melanisasi pada hewan dan
pencoklatan pada tanaman. Enzim PPO tersebar luas di alam, mempunyai berat
molekul 128 kDa dalam keadaan murni, tidak berwarna, dan stabil pada pH netral.
Konsentrasi enzim yang tinggi ditemukan pada umbi kentang, apel, pisang,
alpukat, daun teh, biji kopi dan daun tembakau. Selain pada tanaman, enzim PPO
juga ditemukan pada bakteri dan mamalia. Enzim polifenol oksidase atau PPO
dalam tanaman berperan terhadap sistem ketahanan dan penyembuhan jaringan
yang terluka. Peningkatan aktivitas PPO dalam jaringan tanaman terserang
penyakit sejalan dengan bertambah luasnya serangan, makin parah serangan maka
jumlah sel yang terangsang menghasilkan PPO akan semakin banyak
(Julhasratman, 2012).
Banyak penyakit berkaitan dengan pengaruh enzim seperti kekurangan
jumlah dan aktivitas PO dan PPO. Hal ini disebabkan karena kelainan genetik,
kekurangan gizi atau toksin. Biosintesis enzim merupakan suatu proses kompleks
yang melibatkan proses di inti sel dan sitoplasma. Adanya gangguan pada
biosintesis tersebut mengakibatkan perubahan efektifitas dalam pembentukan
enzim yang berdampak pada jumlah enzim (Santoso, 2010). Enzim PO dan PPO
berperan dalam mengkatalisis berbagai proses oksidatif pada reaksi perubahan
warna, cita rasa, dan pembentukan senyawa toksin sebagai reaksi atas serangan
10
Beberapa senyawa fenolik (fenol) dan hasil oksidasi enzimnya (quinon)
menghasilkan ketahanan terhadap penyakit melalui reaksi penghambatan terhadap
enzim pektinolitik dan enzim patogen lain, tetapi bukan terhadap patogen itu
sendiri. Pada beberapa penyakit pada jaringan yang lebih tahan, kandungan
fenolnya lebih tinggi dan fenol tersebut tidak menghambat pertumbuhan patogen.
Fenol tersebut menghambat enzim pektinolitik dan memberi peranan dalam
ketahanan terhadap patogen (Agrios, 1996).
2.5 Jamur Collectotrichum sp.
Colletotrichum merupakan jamur yang bersifat kosmopolitan, sehingga jamur ini
dapat menyebabkan penyakit pada beberapa jenis tanaman. Menurut Wahyuni
(2011), pengamatan mikrokropis koloni Colletotrichum sp. memperlihatkan hifa bersepta tipis, konidiofor pendek tidak bercabang, konidium bersel satu, jorong
memanjang, tidak bersekat, dan terbentuk pada ujung konidiofor.
Penyakit Colletotrichum atau antraknosa menunjukkan simpton pada daun, batang, dan buah. Penyakit ini menyebabkan nekrosis pada daun. Gejala ini yang
disebut sebagai hawar daun (leaf blight). Daun muda yang sakit dapat juga membentuk bintik-bintik kecil dan biasanya rontok. Pada daun dewasa,
bercak-bercak nekrosis tidak teratur. Bercak-bercak-bercak ini dapat menjadi lubang (Semangun,
2000). Serangan lebih berat pada musim hujan. Pada serangan berat, batang dan
buah terserang juga (Tjahjadi, 1989). Cuaca yang sangat lembap membantu jamur
membentuk banyak spora pada bagian tanaman yang sakit. Pada bagian-bagian
bunga terjadi bintik-bintik kecil berwarna hitam dan akan menyebabkan sebagian
atau seluruh kuncup bunga rontok (Semangun, 1996).
Penyakit antraknosa tersebar melalui biji atau benih, angin dan sisa
tanaman yang terserang. Pengendalian dilakukan dengan pemusnahan bagian
tanaman yang terserang, pergiliran tanaman dan penyemprotan fungisida yang
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari sampai Desember 2012 di
Laboratorium sentral, Mikrobiologi, Genetika, Departemen Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam, dan Rumah Kaca, Fakultas Pertanian,
Universitas Sumatera Utara, Medan.
3.2 Alat dan Bahan
Alat yang digunakan adalah cawan petri, gelas benda, gelas penutup, mikroskop,
kamera digital, polibag, gelas ukur, corong, Erlenmeyer, gelas beker, tabung
reaksi, rak tabung reaksi, spatula, tangkai pengaduk, neraca analitik, pinset, pisau,
lampu spiritus, oven, inkubator, autoklaf, kulkas, silet, vortex, gunting, pipet
volume, mikro pipet, pipet serologi, pensil, penggaris, mortar, semprot tangan,
aluminium poil, thermos, spektrofotometer dan sentrifus.
Bahan yang digunakan adalah biji terung belanda (Solanum betaceum Cav) varietas berastagi, media kompos : pasir : humus (1:1:1), sinar UV, kertas
saring, akuades, gliserin, asetokarmin, HCl 1N, asam asetat, filtrat Colletotrichum sp., media PDA, media GYB, alkohol 70%, H2SO4 5%, H2O2, Triton X 100 0,15
%, nitrogen cair, buffer fosfat , buffer Tris-HCl, BSA, Quick Strat Bradford, dan
12
3.3 Metode Penelitian
Penelitian ini dirancang dengan menggunakan metode Rancangan Acak Lengkap
Faktorial. Faktorial dengan dua faktor yaitu:
1. Faktor Daya UV (U)
Banyak perlakuan adalah kombinasi kedua faktor yaitu intensitas lampu
UV dan lama penyinaran yaitu 4x3 = 12 perlakuan, dengan 3 ulangan. Unit
percobaan berjumlah 36. Penelitian dibuat sebanyak 2 set yaitu satu set untuk
pengamatan kromosom dan satu set lainnya untuk mengevaluasi aktivitas enzim
PO dan PPO.
3.4 Prosedur Kerja
3.4.1 Persiapan dan Penanaman Biji Terung Belanda
Biji terung belanda diambil dari buah yang masak, dikering anginkan dan
dipilih biji yang baik secara visual. Biji direndam di dalam air kemudian
dikecambahkan dengan media kertas saring di dalam cawan petri sampai
didapatkan kecambah yang berumur 1 minggu. Kecambah diperlakukan dengan
UV sesuai dengan uraian metode penelitian. Setelah penyinaran, kecambah di
tanam dalam polibag dengan media kompos : pasir : humus (1:1:1)
3.4.2 Pengamatan Kromosom
Setelah kecambah berumur 2 minggu, preparat dibuat dari bagian ujung akar
untuk mengamati kromosom. Pembuatan preparat untuk mengamati kromosom
menggunakan ujung akar meristematis dengan metode pencet (Suntoro, 1983).
Ujung akar difiksasi dengan asam asetat 45% dan dimasukkan pada lemari
pendingin selama 15 menit. Ujung akar yang telah difiksasi dibilas dengan
akuades sebanyak 3 kali dan didiamkan selama 30 detik didalam HCl 1N pada
suhu 500 C. Ujung akar dimasukkan pada larutan pewarna asetokarmin dan
dibiarkan selama 30 menit. Ujung akar diambil, diletakkan diatas objek gelas,
ditetesi dengan gliserin dan ditutup dengan gelas penutup. Ujung akar dipencet
hingga hancur. Preparat diamati dibawah mikroskop, difoto dengan perbesaran
1000X dan hasil foto diolah dengan photoshop CS3. Kromosom disusun membentuk kariotipe Solanum betaceum Cav (Lampiran 3, hal. 30).
3.4.3 Isolasi dan Pembuatan Filtrat Colletotrichum sp.
Isolat Colletotrichum sp. diisolasi dari akar, batang dan daun terung belanda. Disterilisasi dengan alkohol 70% dan ditumbuhkan pada media PDA. Jamur yang
tumbuh dimurnikan dan diidentifikasi menurut Alexopoulus (1972).
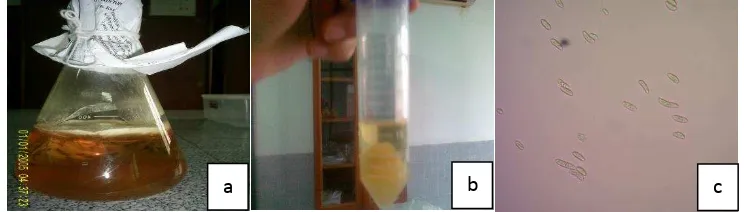
Gambar 3.4.3 Biakan Colletotrichum sp pada media GYB (a), filtrat Colletotrichum sp. (b), konidia Colletotrichum sp. (c)
Isolat Colletotrichum sp. ditumbuhkan di dalam media GYB dan diinkubasi ±2 minggu. Kerapatan konidia dihitung sampai 108 sel/ml. Filtrat
c b
14
Colletotricum sp. dibuat dengan memsentrifius media GYB yang berisi
Colletotrichum sp. dengan kecepatan 12.000 rpm selama 30 menit sehingga
terbentuk endapan dan supernatan. Supernatan diambil dan disaring. Supernatan
digunakan sebagai filtrat. Konsentrasi filtrat yang terbentuk dianggap 1000 ppm
(Komunikasi pribadi, Elimasni, 2012). Dari stok filtrat dibuat pengenceran 0,025,
0,050, 0,075, 0,100 dan 0,125 ppm.
3.4.4 Perlakuan Tanaman dengan Filtrat Colletotrichum sp.
Tanaman yang tumbuh baik diperlakukan dengan filtrat Colletotrichum sp. dengan konsentrasi 0,025, 0,050, 0,075, 0,100 dan 0,125 ppm. Penyemprotan
filtrat dilakukan satu kali seminggu dengan volume penyemprotan 10 ml.
Pertumbuhan vegetatif tanaman dan intensitas serangan jamur Colletotrichum sp. pada daun terung belanda diamati (Lampiran 2, hal. 29).
3.4.5 Ekstraksi Daun
Pembuatan ekstrak kasar daun terung belanda dilakukan sesuai penelitian
yang dilakukan oleh Widiyanto (1992). Daun terung belanda diambil 0,2 g dari
masing-masing perlakuan filtrat Colletotrichum sp., ditambahkan nitrogen cair dan digerus hingga terbentuk larutan. Ekstrak kemudian dihomogenkan dengan 2
ml buffer Tris-HCl (0,05 M, pH 8) dan Triton X 100 0,15 %. Selanjutnya larutan
tersebut disentrifus dengan kecepatan 14.000 rpm selama 20 menit pada suhu 00 C
hingga terbentuk 2 bagian yaitu supernatan dan endapan. Supernatan dipakai
untuk determinasi protein dan penentuan aktivitas enzim (Lampiran 5, hal. 32).
3.4.6 Penentuan Kadar Protein
Menurut Bradford (1976), penentuan kadar protein menggunakan 0,1 ml
larutan ekstrak daun dimasukkan ke dalam tabung reaksi dan dicampur dengan 5
dengan menggunakan spektrofotometer pada panjang gelombang 596 nm
(Lampiran 6, hal. 32).
3.4.7 Penentuan Aktivitas Enzim PO dan PPO
Penentuan aktivitas PO dan PPO dilakukan menurut metode Karr dan
Mishra (1976). Prosedur ini berdasarkan kemampuan PO dan PPO dalam
mengoksidasi pyrogallol. Aktivitas enzim diuji dengan mencampur 10 mM
pyrogallol dan 0,1 M buffer fosfat (pH 6,8, suhu 250 C). Penentuan pyrogallol
yang bereaksi adalah dengan mengektrapolasikan nilai absorbansi dengan kurva
pyrogallol.
3.4.7.1 Peroksidase (PO)
Pengujian enzim PO menggunakan 30 µl ekstrak daun ditambah dengan 5
ml pyrogallol 10 mM, dan 0,1 ml buffer fosfat 0,1 mM pada pH 6,8. Selanjutnya
campuran ditambahkan dengan 0,1 ml H2O2 10 mM, didiamkan selama 5 menit
pada suhu 250C, dan ditambahkan 0,5 ml H2SO4 5% untuk menghentikan reaksi.
Pengukuran absorbansi dilakukan dengan menggunakan spektrofotometer pada
panjang gelombang 420 nm (Lampiran 7, hal. 33).
3.4.7.2 Polifenol Oksidase (PPO)
Pengujian aktivitas enzim PPO menggunakan 70 µl ekstrak daun ditambah
dengan 5 ml pyrogallol 10 mM dan 0,1 ml buffer fosfat 0,1 mM pada pH 6,8.
Campuran didiamkan selama 5 menit dan ditambahkan 0,5 ml H2SO4 5% untuk
menghentikan reaksi. Pengukuran absorbansi dilakukan dengan menggunakan
16
3.5 Parameter pengamatan
Parameter yang diamati dalam penelitian ini adalah:
a. Kariotipe terung belanda, diamati pada umur 2 minggu.
b. Pertumbuhan Tanaman yang meliputi: tinggi tanaman dan jumlah daun
seminggu sampai selesai.
c. Intensitas serangan Colletotrichum sp., dilakukan 1 minggu setelah penyemprotan suspensi tanaman.
d. Penentuan kadar protein
e. Penentuan aktivitas Peroksidase (PO)
f. Penentuan aktivitas Polifenol Oksidase (PPO)
3.6 Analisis Data
Data penelitian menggunakan RAL selanjutnya dianalisis menggunakan
ANOVA. Sedangkan untuk menguji beda antara perlakuan dilakukan uji jarak
BAB 4
HASIL DAN PEMBAHASAN
4.1 Kromosom
Pada Gambar 4.1 dapat dilihat gambar sel dengan nukleus terung belanda dengan
menggunakan mikroskop cahaya pada perbesaran 1000X. Di dalam nukleus
terdapat kromosom. Kromosom merupakan benang-benang halus yang terpilin
dan menebal yang mengandung materi genetik yaitu DNA dan RNA. Kromosom
di dalam nukleus tersebar dan berada pada tahap metafase sehingga dapat dilihat
dengan menggunakan mikroskop cahaya. Menurut Suryo (1995), apabila
menggunakan mikroskop cahaya, maka pada umumnya kromosom tampak
sebagai badan berupa batang yang lurus atau bengkok.
Gambar 4.1 Sel akar terung belanda (Solanum betaceum Cav) perbesaran 1000X dengan pewarna asetokarmin (A) Kromosom (B) nukleus
Perbedaan kariotipe tanaman terung belanda kontrol dengan perlakuan
dapat dilihat pada Tabel 4.1 dan Lampiran 20 (hal. 48). Lama penyinaran UV dan
daya penyinaran UV tidak berpengaruh terhadap jumlah kromosom.
18
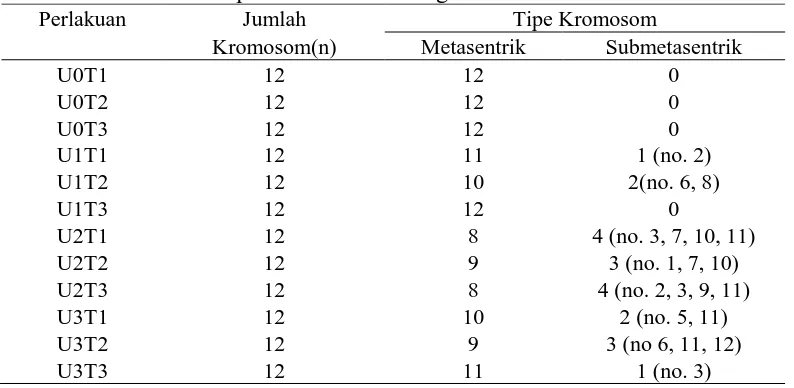
Tabel 4.1 Jumlah dan Tipe Kromosom Terung Belanda
Perlakuan Jumlah Tipe Kromosom
Kromosom(n) Metasentrik Submetasentrik
Perbedaan kariotipe tanaman terung belanda kontrol dengan perlakuan
dapat dilihat pada Tabel 4.1. Lama penyinaran UV dan daya penyinaran UV tidak
berpengaruh terhadap jumlah kromosom (n= 12) tetapi berpengaruh pada tipe
kromosom tanaman. Tipe kromosom tanaman ini ada dua yaitu metasentris dan
submetasentris. Tanaman kontrol dan perlakuan U1T3 tidak memiliki tipe
submetasentris. Tipe kromosom submetasentris tertinggi terdapat pada U2T1 dan
U2T3 sebanyak 4. Dari semua perlakuan, submetasentris paling banyak terdapat
pada kromosom no 11. Hal ini sama dengan penelitian Limbong (2013) pada
tanaman kacang kedelai bahwa mutasi induksi UV dengan daya 10, 20, dan 30
watt dan lama penyinaran 5, 10 dan 15 menit dapat mengubah tipe kromosom.
Menurut Deleeuw et al. (2003), radiasi UV merupakan mutagen yang kuat terhadap DNA. (Menurut Lloyd (1986), induksi UV menyebabkan dimer timin
yaitu terjadi ikatan kovalen antara timin dengan timin yang disebelahnya.
Terjadinya ikatan kovalen dapat mengganggu aktivitas DNA.
4.2 Pengamatan Morfologi
nyata terhadap daya UV tetapi berbeda nyata terhadap lama penyinaran UV
(Lampiran 10, hal. 38). Jumlah daun tidak berbeda nyata terhadap daya UV dan
lama penyinaran (Lampiran 11, hal. 39). Data pengamatan morfologi terung
belanda ditampilkan pada Tabel 4.2.
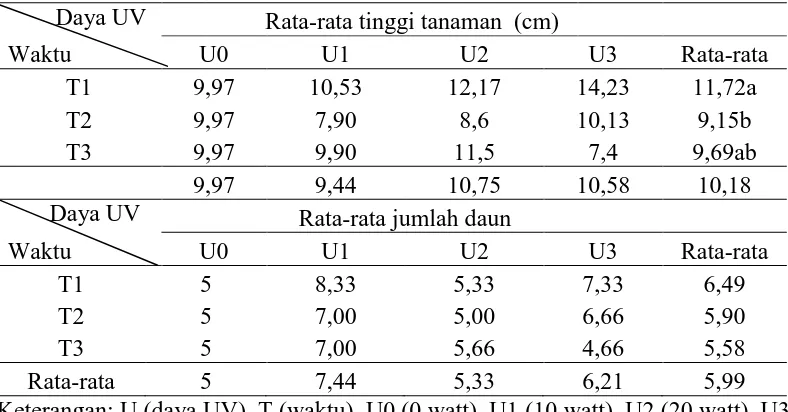
Tabel 4.2 Pengamatan Morfologi Terung Belanda
Daya UV Rata-rata tinggi tanaman (cm)
Berdasarkan Tabel 4.2, rata-rata tinggi tanaman paling tinggi terdapat pada
perlakuan U3T1 (14,23 cm) dan terendah terdapat pada perlakuan U3T3 (7,4 cm).
Rata-rata jumlah daun tertinggi terdapat pada U1T1 (8,33) dan terendah terdapat
pada U3T3 (4,66). Batang tertinggi tidak mengikuti daun paling banyak,
sedangkan batang terendah diikuti dengan jumlah daun yang sedikit. Hal ini
terjadi karena mutasi UV terjadi secara acak dan berpengaruh terhadap perubahan
fenotip sehingga hasil didapat tidak konsisten.
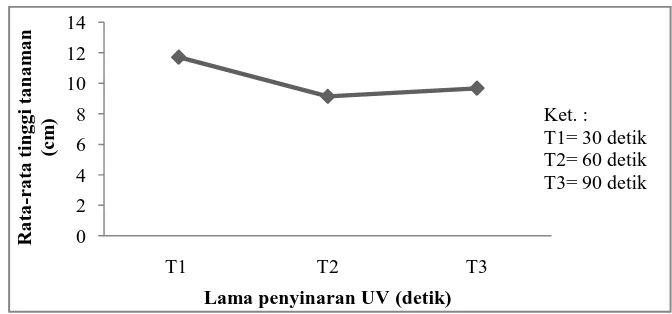
Daya UV yang tinggi menyebabkan penurunan tinggi tanaman dan jumlah
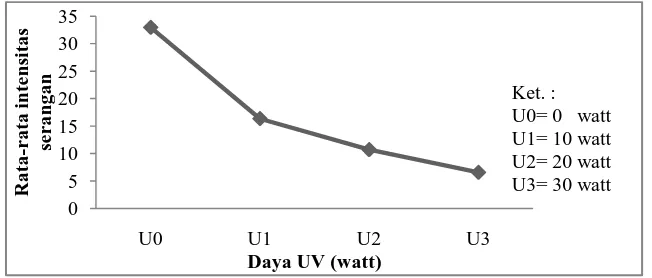
daun. Hal ini berbeda dengan penyinaran UV pada kacang kedelai yang dilakukan
oleh Limbong (2013) bahwa pengaruh peningkatan daya (30 watt) dan lama
20
Gambar 4.2 Pengaruh lama penyinaran UV terhadap rata-rata tinggi terung belanda
4.3 Intensitas Serangan Colletotrichum sp. Pada Daun
Tabel sidik ragam intensitas serangan pada daun terung belanda menunjukkan
tidak berbeda nyata terhadap lama penyinaran UV tetapi berbeda nyata terhadap
daya UV (Lampiran 12, hal. 40). Data intensitas serangan Colletotrichum sp. pada daun terung belanda dapat dilihat pada Tabel 4.3 di bawah ini.
Tabel 4.3 Intensitas Serangan Colletotrichum sp. Pada Daun Terung Belanda Daya UV Intensitas serangan (%)
Berdasarkan Tabel 4.3, intensitas serangan Colletotrichum sp. pada daun terung belanda tertinggi terdapat pada perlakuan U1T3 (34,55%) dan terendah
perlakuan U1T3. Sinar UV berperan terhadap ketahanan karena daya UV yang
tinggi menurunkan intensitas serangan. Intensitas serangan patogen terhadap
tanaman selain dipengaruhi oleh mutagen juga dapat dipengaruhi oleh faktor
lingkungan. Menurut Soenartiningsih dan Haris (2010), intensitas serangan
penyakit antraknosa dipengaruhi oleh kelembaban dan curah hujan. Menurut
Semangun (1996), Cuaca yang sangat lembap membantu jamur membentuk
banyak spora pada bagian tanaman sakit sehingga intensitas serangan juga
meningkat.
Kurva respon rata-rata intensitas serangan Colletotrichum sp. pada daun terung belanda terhadap daya UV dapat dilihat pada Gambar 4.3. Semakin tinggi
daya UV maka semakin rendah intensitas serangan Colletotrichum sp. pada daun atau sebaliknya.
Gambar 4.3 Pengaruh daya UV terhadap rata-rata intensitas serangan
Colletotrichum sp. pada daun terung belanda
Menurut Semangun (1996, 2000), penyakit antraknosa oleh
Colletotrichum sp. pada daun muda menyebabkan daun mati dan pada daun
dewasa menyebabkan terjadinya bercak-bercak nekrosis sampai menjadi lubang.
Pada bagian-bagian bunga terjadi bintik-bintik kecil berwarna hitam dan akan
menyebabkan sebagian atau seluruh kuncup bunga rontok. Serangan
Colletotrichum sp. pada daun terung belanda dapat mengurangi hasil fotosintesis
karena tempat untuk fotosintesis telah berkurang akibat jaringan daun mati. Hasil
fotosintesis berkurang menyebabkan penurunan kualitas dan kuantitas tanaman.
22
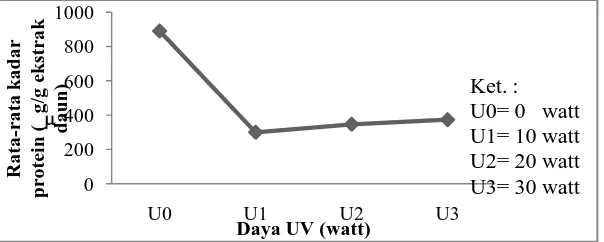
4.4 Kadar Protein
Pengamatan kadar protein dilakukan karena kadar protein diperlukan untuk
perhitungan aktivitas enzim. Tabel sidik ragam kadar protein terung belanda
menunjukkan berbeda nyata pada perlakuan dan daya penyinaran UV tetapi tidak
berbeda nyata terhadap lama penyinaran UV (Lampiran 13, hal. 41). Hasil
pengukuran kadar protein terung belanda dapat dilihat pada Tabel 4.4.
Tabel 4.4 Kadar Protein Terung Belanda
Daya UV Kadar Protein (µg/g ekstrak daun)
Waktu U0 U1 U2 U3 Rata-rata
T1 890,691 314,096 351,329 394,947 487,7658
T2 890,691 410,904 130,053 306,649 434,5743
T3 890,691 171,542 555,585 417,287 508,7763
890,691aA 298,8473cC 345,6557aAbB 372,961bbcC 477,0388
Keterangan: U (daya UV), T (waktu), U0 (0 watt), U1 (10 watt), U2 (20 watt), U3 (30 watt), T1 (30 detik), T2 (60 detik) dan T3(90 detik), huruf kecil yang berbeda menyatakan berbeda nyata 5% dan huruf besar yang berbeda menyatakan berbeda nyata 1% setelah uji duncan
Dari Tabel 4.4, terung belanda yang diperlakukan dengan filtrat
Colletotrichum sp. 0,125 ppm mempunyai kadar protein yang berbeda-beda pada
setiap perlakuan. Pengaruh daya UV terhadap kadar protein daun terung belanda
dapat dilihat pada Gambar 4.4. Kadar protein daun tanaman perlakuan UV
meningkat dengan meningkatnya daya UV.
Dari Tabel 4.4 dan Gambar 4.4 dapat dilihat kadar protein tertinggi
terdapat pada kontrol sebesar 890,691 µg/g ekstrak daun dan terendah terdapat
pada U2T2 sebesar 130,053 µg/g ekstrak daun. Hal ini terjadi karena aktivitas
metabolisme protein terganggu. Metabolisme protein terganggu akibat induksi
sinar UV (mutagen) sehingga kadar protein daun berkurang. Menurut Wang &
John (1991), sinar UV dapat menyebabkan dimer timin. Dimer timin dapat
mengurangi atau mengakhiri kemampuan struktural dan regulatory protein untuk
mengikat dan berfungsi dengan baik.
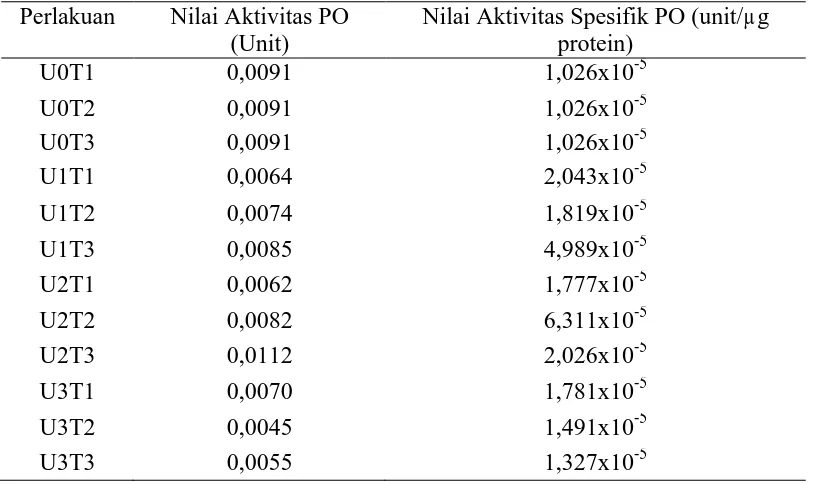
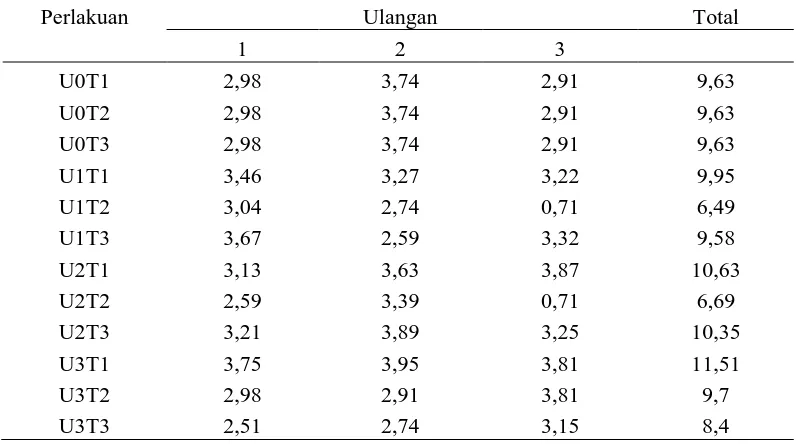
4.5 Aktivitas Peroksidase
Tabel sidik ragam aktivitas peroksidase terung belanda menunjukkan tidak
berbeda nyata (Lampiran 16, hal. 44). Hasil pengukuran aktivitas peroksidase
dapat dilihat pada Tabel 4.5.
Tabel 4.5 Aktivitas Peroksidase (PO) Terung Belanda
Perlakuan Nilai Aktivitas PO
24
spesifik tertinggi terdapat pada tanaman perlakuan U2T2 berkisar 6,311x10-5
unit/µg protein dan terendah terdapat pada tanaman kontrol berkisar 1,026x10-5
unit/µg protein. Nilai aktivitas dan nilai aktivitas spesifik PO dipengaruhi induksi
UV dan patogen.
Menurut Purnama (2009), aktivitas PO meningkat jika diinduksi dengan
mutagen (EMS) dan patogen. Semakin meningkat konsentrasi EMS maka
semakin meningkat juga aktivitas peroksidase kalus terung belanda. Perlakuan
lama perendaman EMS memberikan waktu yang fluktuatif terhadap aktivitas
peroksidase.
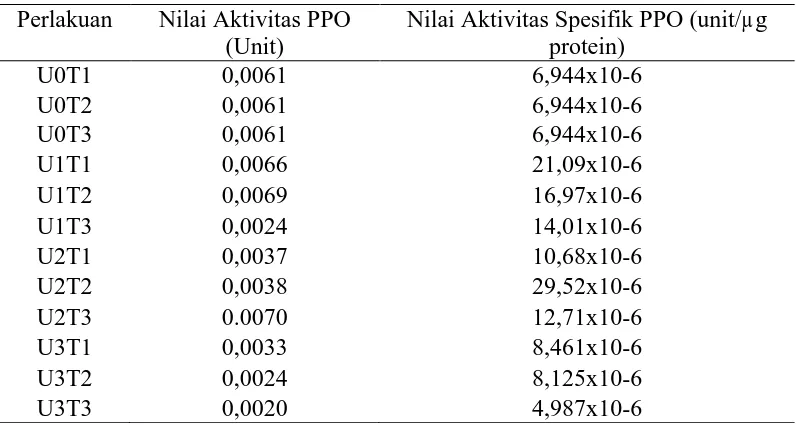
4.6 Aktivitas Polifenol Oksidase
Tabel sidik ragam aktivitas polifenol oksidase terung belanda menunjukkan tidak
berbeda nyata pada perlakuan, lama penyinaran UV dan daya UV (Lampiran 17,
hal. 45). Hasil pengukuran aktivitas dapat dilihat pada Tabel 4.6.
Tabel 4.6 Aktivitas Polifenol Oksidase (PPO) Terung Belanda
Perlakuan Nilai Aktivitas PPO
Dari Tabel 4.6 dapat dilihat nilai aktivitas dan nilai aktivitas spesifik PPO
Aktivitas PPO tertinggi terdapat pada perlakuan U2T3 (0,0070 unit) dan terendah
pada U3T3 (0,0020 unit). Untuk aktivitas spesifik enzim PPO terdapat pada
perlakuan U2T2 (29,52x10-6 unit/µg protein) dan terendah pada U3T3 (4,987x
10-6 unit/µg protein). Daya penyinaran UV yang tinggi (30 watt) dan lama
penyinaran yang tinggi (90 detik) menurunkan aktivitas enzim dan aktivitas
spesifik enzim PO dan PPO. Tinggi rendahnya aktivitas enzim PPO dipengaruhi
faktor luar seperti induksi UV dan serangan patogen Colletotrichum sp. Aktivitas spesifik enzim PPO dipengaruhi kadar protein. Semakin tinggi kadar protein
tanaman maka semakin rendah aktifitas spesifiknya.
Induksi mutasi UV pada terung belanda mempengaruhi aktivitas polifenol
oksidase. Menurut Micke 1996; Silverio et al. 2007 dalam Yanti 2011, mutagen dapat menyebabkan perubahan DNA sehingga struktur gen mengalami perubahan,
yang menimbulkan: 1) perubahan pada aktivitas enzim 2) perubahan DNA
sehingga enzim gagal disintesis.
Dari perbandingan Tabel 4.3, Tabel 4.5 dan Tabel 4.6, aktivitas enzim PO
dan PPO terhadap intensitas serangan sejalan. Semakin rendah intensitas serangan
maka semakin rendah juga aktivitas PO dan PPO. Menurut Julhasratman (2012),
peningkatan aktivitas PPO dalam jaringan tanaman terserang penyakit sejalan
dengan bertambah luasnya serangan, makin parah serangan maka jumlah sel yang
terangsang menghasilkan PPO akan semakin banyak. Menurut Santoso (2010),
kekurangan jumlah dan aktivitas PO dan PPO juga disebabkan kelainan genetik,
kekurangan gizi atau toksin.
Menurut Agrios (1996), beberapa senyawa fenolik dan hasil oksidasinya
menghasilkan ketahanan terhadap penyakit melalui reaksi penghambatan terhadap
enzim pektinolitik dan enzim patogen lain, tetapi bukan terhadap patogen itu
sendiri. Pada beberapa penyakit, jaringan yang lebih tahan kandungan polifenol
lebih tinggi. Fenol tersebut menghambat enzim pektinolitik dan memberi peranan
26
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Induksi sinar UV pada terung belanda berpengaruh terhadap tinggi tanaman,
ukuran dan tipe kromosom tetapi tidak untuk jumlah daun dan jumlah
kromosom (12n).
b. Tanaman yang tahan terhadap Colletorichum sp. adalah perlakuan U3T2. Tanaman perlakuan ini mempunyai aktivitas enzim PO dan PPO yang rendah.
5.2 Saran
a. Perlu adanya penelitian pengaruh UV dan induksi Colletotrichum sp. terhadap terung belanda pada tingkat DNA
DAFTAR PUSTAKA
Agrios, G.N. 1996. Ilmu Penyakit Tumbuhan. Edisi ke-3. Gadjah Mada University Press. Yogyakarta.
Agrios, G.N. 2005. Plant Pathology. Edition 5. San Diego Academic Press.
Alexopoulus, C. J. 1907. Mycology. Third edition. John Wiley & Sons. US.
Bradford, M.M. 1976. A Rapid and Sensitive Methode For The Kuantitation Of Microgram Quantities Of Protein Utilizing The Principle Of Protein-Dye Binding. Anal. Biochem. 72: 248-254.
Cahyonugroho, O.H. 2010. Pengaruh Intensitas Ultra Violet dan Pengadukan terhadap Reduksi Jumlah Bakteri E. coli. Jurnal Ilmu Teknik Lingkungan. 2(1): 19.
Daryono, B.S. 1998. Pengaruh Kolkisin Terhadap Pembentukan Sel-Sel Melon Tetraploid. Buletin Agro Industri. 5: 2-11.
Elimasni. 2010. Regenerasi Tanaman Terung Belanda (Solanum betaceum Cav) Hasil Metagenesis In Vitro Melalui Pembentukan Embriosomatik dalam
Galston, A.W. and D.J. Davies. 1970. Control Mechanisms in Plant Development. Prentice-Hall, Inc. Engliword Clifs. New Jersey.
Harten, A.M.V. 1998. Mutation Breeding: Theory and Practical Application. Cambridge University Press. New York.
Indah, M. 2004. Enzim. Medan: Fakultas Kedokteran, Universitas Sumatera Utara.
Irawan, B. 2008. Genetika Molekuler. Airlangga University Press. Surabaya.
28
Kar, M. and D. Mishra. 1976. Catalase, Peroksidase, and Polyphenoloxidase Activities During Rice Leaf Senescence. Plant Physiol. 57: 315-319.
Kumalaningsih, S. dan Suprayogi. 2006. Tamarillo (Terung Belanda). Cetakan 1. Trubus Agrisarana. Surabaya.
Limbong, R. 2013. Analisis Pertumbuhan dan Kariotipe kacang Kedelai (Glycine
max L.) Setelah Diinduksi Sinar UV. [Skripsi]. Medan. Universitas
Sumatera Utara.
Lloyd, J.R. 1986. Genes and Chromosomes. Macmillan Education LTD. London.
Martoharsono, S. 1998. Biokimia. Jilid 1. Cetakan 15. Gadjah Mada University Press. Yogyakarta.
McGilvery dan Gerald W.G. 1996. Biokimia Suatu Pendekatan Fungsional. Edisi ke 3. Airlangga University Press. Virginia.
Nasir, M. 2002. Bioteknologi, Potensi dan Keberhasilan dalam Bidang Pertanian. PT. Raja Gravindo Persada. Jakarta.
Purnama, S.W. 2009. Aktivitas Enzim Peroksidase dan Polifenol Oksidase Pada Kalus Terung Belanda (Solanum betaceum Cav) Setelah Diinduksi EMS (Ethyl Methane Sulphonate). [Skripsi]. Medan: Universitas Sumatera Utara.
Salisbury, F.B. dan Cleon, W.R. 1995. Fisiologi Tumbuhan. Jilid 2. Penerbit ITB. Bandung.
Santoso. 2010. Enzimologi. Edisi 2010. Semarang.
Semangun, H. 1996. Pengantar Ilmu Penyakit Tumbuhan. Cetakan 1. Gadjah Mada University Press. Yogyakarta.
Semangun, H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. University Press. Yogyakarta.
Steel, G.D. dan Torrie J.H. 1991. Prinsip dan Prosedur Statistik (Suatu Pendekatan Biometrik Alih Bahasa: Sumantri, B.). Gramedia Pustaka Utama. Jakarta.
Soenartiningsih dan Haris T. 2010. Intensitas Serangan Penyakit Antraknosa (Colletotrichum sp) Pada Varietas/Galur dan Hasil Sorgum.
Suntoro, S.H. 1983. Metode Pewarnaan. Bhratara Karya Aksara. Jakarta.
Supriharti, D., Elimasni, dan Emita, S. 2007. Identifikasi Kariotipe Terung Belanda (Solanum betaceum Cav) Kultivar Berastagi Sumatera Utara. Jurnal Biologi Sumatera. 2(1): 8.
Tjahjadi, N. 1989. Hama dan Penyakit Tanaman. Penerbit Kanisius. Yogyakarta.
Tjitrosoepomo, G. 2003. Taksonomi Tumbuhan. Gadjah Mada University Press. Yogyakarta.
Tubagus, D.P.K. 2007. Pemanfaatan Tepung Kulit Buah Terong Belanda (Cyphomandra betacea) Fermentasi (Aspergillus niger) Terhadap Produksi Telur Burung Puyuh (Coturnix-coturnix japonica). [Skripsi]. Medan: Universitas Sumatera Utara.
Wahyuni, S. 2011. Pengendalian Serangan Colletotrichum sp Pada tanaman Kakao (Theobroma cacao L) Menggunakan Isolat Bakteri Kitinolitik. Tesis. Medan: Universitas Sumatera Utara.
Wang, C. dan John S.T. 1991. Site-specific Effect Of Thymine Dimer Formation On dAn.dTn Tract Bending And Its Biological Implications. Proc.Natl.Acad.Sci.USA. 88: 9075.
30
Lampiran 1. Alur Kerja Persiapan dan Penanaman Biji Terung Belanda
dikering anginkan
dipilih biji yang baik
dikecambahkan selama 1 minggu
diperlakukan dengan sinar UV sesuai dengan
uraian metode penelitian dan dibiarkan 1
hari ditempat yang gelap
ditanam dalam polibag dengan media
kompos : pasir : humus (1:1:1)
Lampiran 2. Alur Kerja Perlakuan Tanaman Terung Belanda dengan
Filtrat Colletotrichum sp.
Dillakukan penyemprotan filtrat Colletotrichum sp. Secara bertahap dangan konsentrasi 0,025, 0,050,
0,075, 0,100, dan 0,125 ppm
Diamati intensitas serangan pada daun Biji Terung Belanda
Kecambah Terung Belanda
Hasil
Hasil
Lampiran 3. Alur Kerja Pengamatan Kromosom
dipotong akarnya sepanjang 1 cm dan
difiksatif dengan asam asetat 45%
dimasukkan ke dalam lemari pendingin
selama 15 menit
dibilas dengan akuades
dihidrolisis dengan HCl 1N yang telah
dipanaskan pada suhu 500C selama 30 detik
dimasukkan ke dalam pewarna acetocarmin
selama 30 menit
diletakkan akar diatas objek gelas, ditetesi
dengan gliserin dan ditutup dengan gelas
penutup
dipencet hingga akar hancur
diamati dibawah mikroskop dan difoto
perbesaran 1000X
diolah hasil foto secara komputerisasi
dengan Photoshop CS3 L
Kecambah Terung Belanda
32
Lampiran 4. Alur Kerja Pembuatan Kurva Standard BSA
Dibuat konsentrasi 0; 3; 6; 9; 1,2; dan 1,5 g/ml
Diambil 0,1 ml dan dimasukkan ke dalam tabung
reaksi sesuai dengan konsentrasinya
Ditambahkan reagen Quick Start Bradford sebanyak
5 ml
Dihomogenkan
Dimasukkan kedalam kuvet Spektrofotometer
Diukur absorbasi pada panjang gelombang 595 nm
Ditentukan persamaan garis regresi kurva standar
larutan protein dengan metode teast square
BSA
Larutan
Absorbansi
Lampiran 5. Alur Kerja Ekstraksi Daun
Diambil 0,2 g
Ditambahkan nitrogen cair
secukupnya
Digerus
Dihomogenkan dengan 2 ml
buffer Tris HCl 0,05 M, pH8
dan Triton X 100 0,15 %
Disentrifuse dengan
kecepatan 14.000 rpm suhu
00C selama 20 menit
Alur Kerj
Lampiran 6. Alur Kerja Determinasi Protein
Diambil sebanyak 0,1 ml
Dimasukkan kedalam tabung reaksi
Dicampur dengan 5 ml larutan reagen Quick Start
Bradford
Dihomogenkan dan didiamkan 5 menit
Diukur Absorbasinya pada panjang gelombang 595
nm Daun
Larutan
Endapan Protein Daun
Ekstrak Daun
34
Lampiran 7. Alur Kerja Penentuan Aktivitas Peroksidase (PO)
Ditambahkan 5ml pyrogallol10 mM
Ditambahkan 0,1 ml buffer fosfat 0,1mM,
pH 6,8 dan suhu 250C
Diukur pada panjang gelombang 420 nm
Lampiran 8. Alur Kerja Penentuan Aktivitas Polifenol Oksidase (PPO)
Ditambahkan 5 ml Pyrogallol 10 mM
Ditambahkan 0,1 ml buffer fosfat 0,1 mM,
pH 6,8 dan suhu 250C
Diukur pada panjang gelombang 420 nm 30 l Ekstrak Daun
Absorbansi
70 l Ekstrak Daun
Lampiran 10. Data Tinggi Tanaman Pada Minggu Terakhir
Data Tinggi Tanaman Minggu Terakhir Setelah Transformasi (Y+0,5)0,5
Perlakuan Ulangan Total
40
Galat 24 10,22 0,42 - - -
Keterangan: tb ( tidak berbeda nyata), * (berbeda nyata) Lampiran 11. Data Jumlah Daun Minggu Terakhir
Perlakuan Ulangan Total
Data Jumlah Daun Minggu Terakhir Setelah Transformasi (Y+0,5)0,5
Galat 24 111,36 4,64 - - -
Keterangan: tb ( tidak berbeda nyata)
Lampiran 12. Data Intensitas Serangan Pada Daun Setelah Penyemprotan 0,125 ppm (%)
Perlakuan Ulangan Total
1 2 3
Data Hasil Transformasi Sin-1 Intensitas Serangan Pada Daun Setelah Penyemprotan 0,125 ppm
Perlakuan Ulangan Total
1 2 3
Tabel Sidik Ragam RALF 4x3x3 Intensitas Serangan
42
Keterangan: tb ( tidak berbeda nyata), * (berbeda nyata), ** (sangat berbeda nyata)
Data Kadar Protein Setelah Transformasi (Y+0,5)0,5
Perlakuan Ulangan Total
Tabel Sidik Ragam RALF 4x3x3 Kadar Protein
Keterangan: tb ( tidak berbeda nyata), * (berbeda nyata), ** (sangat berbeda
Maka, persamaan regresinya adalah Y = 0,03875 + 0,00094X
y = 0,00094x + 0,03875
0 200 400 600 800 1000 1200
Maka, persamaan regresinya adalah Y = 0,106 + 0,0541X
Lampiran 16. Data Pengukuran Aktivitas Peroksidase (PO) dengan Sfektrofotometer Pada Panjang Gelombang 420 nm
Perlakuan Ulangan Total Rata-rata
1 2 3
Data Pengukuran Aktivitas Peroksidase dengan Sfektrofotometer Pada Panjang Gelombang 420 nm Setelah Transformasi (Y+0,5)0,5
Perlakuan Ulangan Total Rata-rata
1 2 3
Tabel Sidik Ragam RALF 4X3X3 PO Setelah Transformasi (Y+0,5)0,5
46
Keterangan: tb ( tidak berbeda nyata), * (berbeda nyata), ** (sangat berbeda nyata)
Lampiran 17. Data Pengukuran Aktivitas Polifenol Oksidase (PPO) dengan Sfektrofotometer Pada Panjang Gelombang 420 nm
Perlakuan Ulangan Total Rata-rata
1 2 3
Data Pengukuran Aktivitas Polifenol Oksidase dengan Sfektrofotometer Pada Panjang Gelombang 420 nm Setelah Transformasi (Y+0,5)0,5
Perlakuan Ulangan Total Rata-rata
1 2 3
Tabel Sidik Ragam RALF 4X3X3 PPO Setelah Transformasi (Y+0,5)0,5
Galat 24 0,1640 0,0068 - - -
Keterangan: tb ( tidak berbeda nyata), * (berbeda nyata) Lampiran 18. Data Kadar Protein
Dapat dihitung dengan menggunakan persamaan regresi, yaitu Y = a+bX
Dimana nilai a = 0,03875
b = 0,00094
maka, X = =
BSA PROTEIN
Konsentrasi Absorbansi Perlakuan Absorbansi Kadar protein
0 0 U0T0 0,876 890,691
Lampiran 19. Data Nilai Aktivitas Enzim PO dan PPO
Pyrogallol Perlakuan PO PPO
48
U3T3 0,295 0,0055 1,327x10-5 0,177 0,0020 4,987x10-6
Perhitungan Nilai Aktivitas Enzim PO dan PPO
Dilakukan dengan menggunakan persamaan regresi Y = a+bX
Maka nilai X diperoleh dengan persamaan, X =
X =
Aktivitas enzim PO atau PPO (unit) =
Aktivitas Enzim Spesifik enzim PO atau PPO =
Dimana : a = 0,106 BM Pyrogallol = 126,11
b = 0,0541 Y = absorbansi
Lampiran 20. Kariotipe Terung Belanda (Solanum betaceum Cav)
Kontrol U1T1
U1T2 U1T3
50
U2T3 U3T1
U3T2 U3T3
Lampiaran 21. Indeks Sentromer (IS) Kromosom Setiap Perlakuan
Kromosom
haploid (n) Indeks Sentromer (%)
Kontrol U1T1 U1T2 U1T3 U2T1 U2T2 U2T3 U3T1 U3T2 U3T3
1 42,37 39,46 39,44 49,77 39,05 28,51 49,50 49,89 48,83 50,00
2 45,41 33,74 50,00 42,93 43,82 47,24 36,81 47,75 43,42 50,00
3 49,82 50,00 49,85 50,00 28,19 46,71 32,16 47,55 39,46 29,9
4 49,82 39,09 47,24 42,14 45,83 47,29 39,76 46,71 50,00 43,23
5 39,43 40,51 47,40 47,92 42,61 45,24 43,72 35,10 38,28 48,95
6 49,60 49,74 47,67 48,00 45,80 47,54 49,76 48,00 34,89 46,31
7 45,83 49,71 36,72 44,83 36,47 33,02 46,23 49,33 45,03 46,58
8 37,62 42,10 47,13 50,00 36,06 42,31 49,73 37,61 50,00 50,00
9 46,92 50,00 28,63 39,39 45,49 41,24 34,55 48,72 39,44 45,70
10 44,90 48,35 45,75 42,86 32,48 27,37 38,63 41,99 44,80 46,60
11 47,03 40,22 49,37 44,16 27,91 48,94 32,63 22,22 26,83 50,00