Senyawa Heteropolyacid Sebagai Katalis Pada Sistem Homogen
Dalam Pelarut Organik
Andriayani
Jurusan Kimia
Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
1. PENDAHULUAN
Penggunaan heteropolyacid dan senyawa polioksometalat dan turunannya sebagai katalis dalam reaksi-reaksi senyawa organik hingga saat ini terus berkembang. Hal ini dikarenakan senyawa heteropolyacid dan garam-garamnya memiliki berbagai sifat yang khas dan memiliki kelebihan dibandingkan asam mineral yang umum seperti H2SO4, HNO3 dan lain-lain. Heteropoyacid sebagai katalis memiliki banyak keuntungan secara ekonomi maupun lingkungan reaksi. Merupakan asam Bronsted yang kuat mendekati superacid dan memiliki sifat redoks. Dalam bentuk padatan memiliki sifat yang khas.
Heteropolyacid sebagai katalis dalam larutan organik telah banyak digunakan pada industri-industri, karena memiliki aktifitas katalitik yang tinggi akibat sifat keasamannya dan memiliki kelarutan yang sangat tinggi dalam pelarut polar seperti alkohol tingkat rendah, keton, eter, ester dan lain-lain. Dalam pelarut organik aktifitas molar katalitik 100-1000 kali lebih tingggi dari H2SO4. Ini memungkinkan untuk menjalankan proses katalitik pada tekanan rendah dan/atau pada temperatur rendah. Hateropolyacid juga lebih mudah ditangani (handle) dan lebih aman.
Beberapa proses organik telah menggunakan katalis heteropolyacid dalam pelarut organik seperti reaksi cleavage, polimerisasi tetrahidrofuran, kondensasi, esterifikasi dan dekomposisi ester, sintesis metal tert-butil eter, alkilasi dan dealkilasi, hidrogensai dan lain-lain.
2. SINTESIS SENYAWA HETEROPOLYACID
Heteropolyacid dibuat dalam larutan dengan pengasaman dan pemanasan dalam range pH (1,49-5,4). Sebagai contoh 1,2-tungstoposfat dibentuk pada persamaan (1). Asam bebas disintesis dengan dua metode berikut:
1. Ekstraksi dengan eter dari pengasaman larutan berair. 2. Dengan penukar ion dari garam heteropolyacid.
Heteropolyanion jenis Dauson, X2W18O626-, diisolasi sebagai garam amonium atau kalium yang larut sebagai asam bebas dengan mengekstraksi ke dalam eter [1].
12WO42- + HPO22- + 23H+→ PW12O403- + 12H2O (1)
Campuran addenda heteropolianion dengan substitusi regiospesifik memrlukan pembuatan secara hati-hati dengan menggunakan heteropolianion yang kosong. Jika pembuatan dari larutan berarir pada oxoanion yang sesuai, produk adalah campuran heteropolianion yang memiliki komposisi yang berbeda pada atom addenda. Prosedur umum untuk sintesis dari berbagai jenis heteropolyacid.
2 1. Jika atom pusat adalah unsur non transisi, kelarutan molibdate atau tungstate dapat
dilarutkan dengan kelarutan garam yang mengandung atom pusat dalam tingkat oksidasi yang tepat.
2. Jika atom pusat adalah unsur transisi, garam sederhana pada unsurnya dapat dicampur dengan molibdat atau tungstate yang larut dalam larutan panas pada pH yang tepat.
3. Oksida yang mengandung atom pusat dalam tingkat oksidasi yang tepat bisa dididihkan dalam larutan asam molibdate atau tungstate.
4. Oksida molibdenum (VI) atau tungstate (VI) dapat dididihkan dalam larutan garam yang mudah larut yang mengandung atom pusat dalam tingkat oksidasi yang tepat.
5. Senyawa koordinasi dapat didekomposisi dalam larutan panas molibdate atau tungstate. 6. Pencampuran yang tepat pada asam sederhana atau asam anhidrad.
7. Metatesis garam.
8. Oksidasi garam heteropolianian dengan aqua regia. 9. Ekstraksi dengan eter dari larutan berair yang diasamkan.
3. KEASAMAN HETEROPOLYACID DALAM BENTUK GARAM
Sifat asam dari senyawa heteropoly dalam keadaan padat adalah sangat mudah dipengaruhi oleh kounter kation, unsur-unsur penyusun pada polianion dan struktur tersier. Bagian dari komposisi hidrolisa dan dalam homogenitas dihasilkan sealama pembuatannjuga penting dalam menentukan sifat asam. Ada beberapa kemungkinan tipe yang menjadi asal mula keasaman [1]:
1. Disosiasi dari air yang terkoordinasi, Contoh: Ni(H2O)m2+→ Ni(H2O)m-1(OH)+ + H+ 2. Keasaman Lewis dai ion logam
3. Pembentukan proton melalui reduksi ion logam, contoh: Ag+ + ½ H2 → Ag0 + H+
4. Adanya proton dalam garam asam seperti CsxH3-xPW12O40 5. Hidrolisis parsial selama proses pembuatan, seperti: PW12O403-→ PW11O39-7 + WO42- + 6H+
Untuk jenis (1) Niyama dan kawan-kawan dalam [1] menyarankan bahwa proton diperoleh dari disosiasi air dan kesetimbangan disosiasi adalah fungsi elektronegatifitas kation logam. Pembentukan sisi asam Bronsted dalam garam amonium H3PW12O40 sebagai hasil disosiasi air pada 5730 K yang dikonfirmasikan melalui spektra IR pada penyerapan piridin oleh Baba dan kawan-kawan dalam [1].
Adanya keasaman Lewis jenis (2) atau keasaman Bronsted Jenis (1) diperoleh melalui spektra IR pada penyerapan piridin pada Al1,5PW12O40 telah diteliti oleh Baba dan kawan-kawan. Penyerapan NH3 pada Cu1,5PW12O40 dikemukan oleh Saito dan kawan-kawan dalam [1] . Ghos dan Moffat dalam [1] telah mengukur keasaman garam H3PW12O40 dengan indikator Hammet. Kekuatan asam bertambah dengan meningkatnya jumlah muatan yang mengelilingi atom oksigen pada polianion: Zr > Al > Zn > Mg > Ca > Na.
resonansi pada 9,3 ppm. Pe5rbedaan yang kuat ini menunjukkan perbedaan interaksi antara proton polianion [1].
4. REAKSI KATALIS HETEROPOLY DALAM PELARUT ORGANIK PADA SISTEM
HOMOGEN
4.1. Katalis Heteroply Dalam Pelarut Organik
Senyawa heteropoly sebagai katalis akan lebih aktif dalam larutan anorganik umum dan asam organik. Sifat yang sangat penting diperhitungkan dapa aktifitas katalitik yang tinggi berupa kekuatan asam, kelunakan keteropolianion, konsentrasi katalis dan sifat pelarut.
Dalam pelarut CH3CN aktifitas katalitik meningkat dengan bertambahnya kekuatan asam seperti pada asam heteropolyacid dengan atom Co<B<Ge<Si<P. Kekuatan polianion juga mempengaruhi aktifitas katalitik hal ini disebabkan kemampuan membentuk komplek intermediet polianion seperti yang diamati pada H4SiW12O40 dalam reaksi dibutil eter dengan asetat anhidrid akan lebih aktif daripada H3PW12O40 walupun kekuatan asam berlaku sebaliknya dimana kelunakan polianoin SiW12O404- > PW12O403-. Konsentrasi katalis juga menentukan, hal ini dapat diamati untuk hidrasi butena dalam larutan dengan konsentrasi tinggi. Polimerisasi THF akan berlangsung efesien jika konsentrasi H3PW12O40 diatur [1].
4.2. Reaksi dalam Larutan Organik 4.2.1. Reaksi Cleavage
H3PW12O40 memperlihatakn aktifitas yang tinggi untuk alkoholisis epoksida (persamaan 2) daripada H2SO4, PTS atau HclO4 oleh Izumi dan kawan-kawan dalam [3]. Sementara deaktivitas yang cepat diamati pada H2SO4, yang mungkin disebabkan pada pembentukan alkil sulfat, H3PW12O40 tetap mempertahankan aktifitas katalitiknya yang tinggi.
R
2R
1C
−
CH
2O + R
3OH
→
R
2R
1C
−
CH
2+ R
2R
1C
−
CH
2(2)
O R
3O OH HO OR
3Tetrahidrofuran dipecah dengan asam asetat mehasilkan 1,4-diasetoksi asetat. Urutan aktifitas adalah H3PW12O40 > H4SiW12O40 > H3PmoO14 > H2SO4. Pemecahan dibutil eter dengan asam asetat juga dikatalis dengan heteropolyacid. H3PW12O40 adalah heteropolyacid yang paling aktif mungkin disebabkan kelunakan yang lebih tinggi, Izumi dan kawan-kawan dalam [3].
4.2.2. Polimerisasi Tetrahidrofuran
Polimerisasi tetrahidrofuran (THF) digunakan untuk membuat polioksitetrametilen glikol (PTMG), yang digunakan pada pabrik kertas Spandex dan poliuretana. PTMG secara komersil dihasilkan melalui dua tahap proses termasuk pembukaan cincin polimerisasi THF dengan katalis asetat anhidrid dan dengan HClO4, diikuti dengan hidrolisis asetat terminal dalam prepolimer. Izumi dan kawan-kawan dalam [3,4] menemukan heteropolyacid lebih aktif daripada HClO4 dalam polimerisasi THF. Aosima dan kawan-kawan dalam [3,4] telah mengembangkan proses satu tahap untuk polimerisasi THF secara langsung menghasilkan PTMG (persaman 3).
nTHF + 12O → HO(CH2)4O]H (3)
fase atas THF. Kecepatan reaksi bertambah dengan menurunnya perbandingan H2O/PW, dan begitu juga dengan berat molekul polimer, proses berlangsung terus menerus. PTMG dengan berat molekul pada 500-2000 dan membatasi distribusi berat molekul yang diperoleh dari fase THF dalam Aoshima dalam [3]. Polimerisasi fase tansfer diilustrasikan seperti pada gambar 1:
[image:4.612.165.432.128.500.2]4 Gambar 1. Model Reaksi Polimerisasi Fase Transfer [1]
4.2.3. Reaksi Kondensasi
Polimerisasi 1,3-trioksana, siklotrimer formaldehida dikatalis oleh H3PMo12O40. Polimerisasi sangat cepat pada konsentrasi katalis di bawah 10-6 mol dm-3. Untuk memperoleh perbandingan kecepatan menggunakan katalis BF3, konsentrasinya diperlukan 10-3 mol m-3. Kondensasi aseton menghasilkan mesitilena yang dikatalis H3PW12O40 pada temperatur kamar
[3].
Kozhevnikof dan kawan-kawan dalam [3] telah memperlihatkan bahwa heteropolyacid katalis yang efesien untuk kondensasi isopitol dengan 2,3,5-trimetilhidrokuinon (TMHQ) menjadi
α-tokoperol, yang mana bentuk aktif pada vitamin E. Reaksi berlangsung pada fasa homogeneus (sperti butil asetat atau asam asetat) atau dalam sistem heterogen (misalnya toluene) dengan ∼1% berat heteropolyacid berdasrkan pada TMHQ, secara praktik hasilnya sama dan katalis komersil yang paling baik. Bagaimanapun ZnCl2 digunakan secara stoikiometri, menhasilkan limbah yang besar. Sedangkan heteropolyacid dapat diperoleh kembali dan digunakan kembali.
4.2.4. Esterifikasi dan Dekomposisi Ester
Reaksi ini secara luas telah dikaji dengan adanya katalis heteropolyacid struktur Keggin dan Dawson sebagai katalis homogen. Secara umum reaksi dilakukan dalam media air dan organik yang mempunyai pengaruh luas pada kecepatan rekasi. Aktifitas katalitik selalu diikuti dengan kekuatan asamnya, seperti yang diharapkan sebagai katalis Bronsted. Walau bagaimanapun asam Mo memiliki potensial oksidasi yang lebih tinggi, dapat memperlihatkan aktivitas yang lebih rendah seperti yang diharapkan dari asam-asamnya yang menyebabkan dapat direduksi oleh medium reaksi [3]. Akhir-akhir ini Misono dan kawan-kawan dalam [3] telah mengkaji rangkaian reaksi homogen seperti dekomposisi isobutilpropionat (IBP), transesterifikasi IBP dengan asam asetat dan n-propilalkohol dan esterifikasi asam propionate dengan isobutilalkohol seperti persamaan 4 di bawah ini [3]:
(1). C2H5COOCH2CH(CH3)2 → (CH3)2 = CH2 + C2H5COOH
(2). C2H5COOCH2CH(CH3)2 + CH3COOH → CH3COOCH2CH(CH3)2 + C2H5COOH (3). C2H5COOCH2CH(CH3)2 + n-C3H7OH → C2H5COOC3H7 + (CH3)2CHCH2OH (4). (CH3)2CHCH2OH + C2H5COOH → C2H5COOCH2CH(CH3)2 + H2O (4)
untuk reaksi (2) tanpa air. Bertolak belakang dengan rekasi (1), penambahan air mempercepat reaksi (2) dan perubahan mungkin disebabkan proses melalui hidrolisis IPB menjadi asam propionate dan isobutil alkohol, diikuti dengan esterifikasi isobutil alkohol dengan asam asetat.ebaliknya untuk rekasi (3) dan (4) tidak ada perbedaan yang signifikan antara heteropolyacid dan H2SO4 yang diamati mungkin disebabkan pengaruh leveling dari reaktan alkohol pada kekuatan asam dari katalis.
Dialkil phtalat yang digunakan sebagai plastisier, diperoleh melalui esterifikasi phtalat anhidrid dengan alkohol C8-C10 pada suhu 100-1200C dengan adanya PW (1-2%) sebagai katalis homogen. Aktifitas katalis heteropolyacid secara signifikan lebih tinggi dari H2SO4 dan TsOH. Heteropolyacid yang disupport pada karbon dapat digunakan sebagai katalis heterogen. Walaupun heteropolyacid/C sedikit aktif daripada katalis PW homogen, tetapi dengan mudah dapat dipisahkan dari campuran reaksi dan digunakan kembali [3].
Sintesis glikosida yang dikatalisis oleh heteropolyacid adalah penting secara industri. Glikosida digunakan sebagai surfaktan yang baru dan bidegradable. Heteropolyacid beberapa kali lebih aktif daripada katalis konvensional seperti TsOH dan ZnCl2. Jadi monosakarida yang terasetilasi dengan cepat berinteraksi dengan alkohol pada fase homogen dengan adanya heteropolyacid 2% dengan baik pada turunan gula pada suhu 70-1300C menghasilkan 70-90% glikosida oleh Kiromasa dan kawan-kawan dalam [3].
Heteropolyacid dapat juga dipakai sebagai aktif dan selektif dalam alkoholisis epoksida (epiklorohidrin, 1,2-epoksibutana, isobutena oksida, stirena oksida dan lain-lain) di bawah kondisi lunak pada suhu 450C dan alkohol berlebih Izumi dan kawan-kawan dalam [3], sesuai dengan persamaan 5.
R
1R
2C
−
CH
2+ ROH
→
R
1R
2C
−
CH
2+ R
1R
2C
−
CH
2O OR OH OH OR
Heteropolyacid aktifitasnya lebih tinggi dari TsOH dan H2SO4. Dengan H2SO4 bertolak belakang dengan heteropolyacid deaktifitas dengan cepat pada katalis setelah diamati mungkin disebabkan pembentukan alkilsulfat, menghasilkan keasaman yang hilang. Demikian juga dalam asetolisis epoksida, tetrahidrofuran dan ester linier yang dilakukan dalam asam asetat berlebih, heteropolyacid yang jauh lebih efektif daripada katalis asam lain seperti TsOH dan BF3-H2O dan seperti H2SO4 aktifitas TsOH menurun pada reaksi disebabkan pembentukan tosil ester [3].
Esterifikasi asam p-nitrobenzoat adalah suatu tahap sintesis obat bius. Etil p-nitrobenzoat diperoleh sebanyak 99% melalui esterifikasi asam p-nitrobenzoat dengan etanol dengan adanya PW (3-7 wt%) pada 750C. Air yang dibentuk selama re4aksi terpisah melalui distilasi azeotrop dengan toluena. Pada awalnya adalah homogen, campuran reaksi menjadi dua fase pada akhir reaksi. Fase atas mengandung produk, pada fase bawah adalah larutan pekat heteropolyacid dalam etanol. Fase katalis dengan mudah dapat dipisahkan dan digunakan kembali [3].
Asetoksilasi dan hidrasi dihidromircene (DHM) menhasilkan dihidromircenol (DHM-OH) dan dihidromircenyl (DHM-Oac) yang masing-masing digunakan sebagai bahan pewangi. Reaksi-reaksi terjadi secara simultan pada dua fase dengan adanya heteropolyacid pada 14-300C. Fase atas sebagian besar terdiri dari DHM dan fase lebih bawah adalah larutan pekat PW dalam asam asetat. Asam asetat akan terdistrubusi diantara dua fase. Proses reaksi dalam fase katalis akan membentuk DHM-OH dan CDHM-Oac yang ditransfer ke fase DHM. Proses mencapai kesetimbangan pada pengubahan DHM ∼30% dan akan dilengkapi dengan kuat dengan katalis asam pada isomerisasi dan siklisasi dari DHM. Metode ini memberikan selektifitas 90% pada
DHM-OH dan DHM-OAc pada pengubahan 21%. Fase katalis dapat digunakan kembali tanpa kehilangan aktifitas [3].
Asam 12-Tungstoposforat dan garam asamnya H3PW12O40, CsxH3-xPW12O40 (x=1;2,2;23 dst), BaxH3-2xPW12O40 (x=0,5;1,25 dan 1,5) dan CexH3-3xPW12O40 (x=0,33;0,66;0,87) telah digunakan sebagai katalis asam untuk esterifikasi asam benzoate dengan 1 butanol tanpa pelarut dengan tekanan atmosfir N2. Dalam reaksi ini, heteropolyacid Cs1 dan Ba0,5 dan Ce0,33 yang mana jumlah H+ adalah sama, memperlihatkan aktifitas katalitik yang tinggi [5].
4.2.5. Sintesis Metil Tert-Butil Eter (MTBE)
Metil tert-butil eter (MTBE) adalah gas pendorong oktan yang dihasilkan secara industri dalam skala besar dengan mereaksikan isobutene dengan metanol dengan adanya katalis asam seperti resin penukar ion (persamaan 6).
(CH3)2 = CH2 + CH3OH → CH3OC(CH3)3 (6)
[image:7.612.119.454.404.655.2]Heteropolyacid dan garam-garamnya juga mensintesa MTBE sebagai katalis homogen dan heterogen. Maksimov dan Kozhevnikof dalam [1,3] memperlihatkan bahwa reaksi homogen pada 420C, heteropolyacid tipe Keggin seperti PW dan SiW, 2-4 kali lebih efektif dari katalis konvensional dalam kecepatan reaksi per unit sisi proton. Dengan menarik, heteropolyacid jenis Dawson H6P2W18O62 memperlihatkan aktifitas dua kali lebih tinggi dari PW tipe Keggin. Aktifitas per unit katalis H2SO4 , katalis heteropolyacid esterifikasi tert-butil alkohol dengan metanol dan etanol masing-masing telah dikaji. Tabel 2 memperlihatkan perbandingan aktifitas katalitik untuk fase l;iquid sintesis MTBE dari isobutilena dan metanol oleh Maksinov dan kawan-kawan dalam [1].
4.2.6. Alkilasi dan Dealkilasi
Nomiya dan kawan-kawan dalam [1] memperlihatkan bahwa alkilasi dan dealkilasi (persamaan 7) berlangsung dengan adanya H4SiMo12O40.
NPhCH2OH → (− C6H4 − CH2 − )n
ArH + CH3COCl → ArCOCH3 (7)
Dalam larutan asam asetat H3PW12O40 dealkilasi 2,4-di-tert-butil penol menhasilkan 2-tert-butilpenol berlangsung pada 357 K. Aktifitas katalitik H3PW12O40 100 kali lebih besar dari H2SO4 oleh Kozhevnikof dalam [1].
4.2.7.Miscellaneuse Reaksi
Ijumi dan Fujita melaporkan dalam [3] suatu garam iminium dibuat dengan interaksi N,N-dimetilformamida dengan epiklorohidrin dengan adanya PW atau SiW secara efektif seabagai katalis dalam penyusunan kembali sikloheksana menjadi ε-caprolaktam di bawah kondisi yang lunak 950-9600C. Produk laktam telah mencapai 200. Heteropolyacid telah dikenal sebagai katalis yang efesien untuk dekomposisi cumene hidroperoksida menjadi fenol dan aseton (persamaan 8)
PhC(CH3)2OOH → PhOH + CH3COCH3 (8)
Dengan cara yang sama , trihidroksibenzene dibentuk melalui dekomposisi 1,3,5-triprofilbenzena hidroperoksida pada 50-1000C deangan selektifitas 97% pada perubahan hidroperoksida 89% [3].
1,2-Diols(1,2-propanadiol; 2,3-butanadiol dan 2,3-dimetil-2,3-butanadiol) dengan cepat berlangsung menata kembali pinacol menhasilkan senyawa karbonil yang sesuai (propanal, 2-butanon dan 3,3-dimetil-2,3-butanadiol) dengan adanya PW, SiW, PMo dan SiMo, 1,4- dan 1,5-diol di bawah kondisi selektif membentuk siklik eter.
4.2.8. Reaksi Hidrogenasi
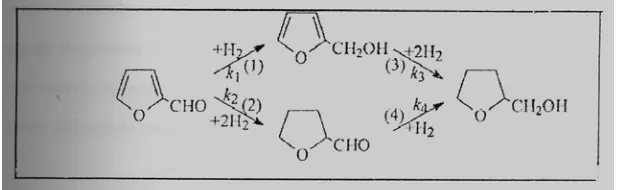
Fase liquid hidrogensai selektif furfural pada nikel Raney telah dimodifikasi melalui impregnasi garam (termasuk logam alkali, logam alkali tanah dan logam-logam transisi) dari heteripolyacid (HPA) yang memiliki struktur Keggin. Pengaruh kondisi reaksi pada aktifitas katalitik dan selektifitas telah diuji. Telah ditemukan bahwa semua katalis nikel Raney; 12-molibdoposfat memberikan hasil yang baik diantara modifikasi-modifikasi. Sejauh ini pengrauh kompetitif kation pada sifat katalis adalah diperhatikan, logam transisi lebih baik daripada logam alkali dan alkali tanah. Diantara logam-logam transisi, garam Cu adalahy super dalam sifat. Katalis nikel Raney yang terdiri dari 7,1% Cu3/2PMo12O40 telah ditempatkan di bawah kondisi 353 K, tekanan hidrogen 2,0 Mpa dan jumlah katalis bahan furfural dan secara selektif untuk furfural alkohol masing-masing dengan hasil yang tinggi 98% dan 98,5%. Dalam pekerjaan ini garam heteropolyacid hanya berperan sebagai zat modifikasi daripada bertindak sebagai katalis. Ini dapat menunjukkan bahwa garam heteropolyacid yang ditempatkan pada karbon aktif tidak ada aktifitas katalitik dan hidrogenasi selektif pada furfural pada kondisi yang sama. Reaksi hidrogenasi furfural dapat dinyatakan melalui skema I [6].
[image:8.612.147.460.585.680.2]Hidrogenasi cinnamaldehida menjadi cinnamil alkohol dilakukan menggunakan katalis cobalt Raney yang dimodifikasi dengan Cu3/2PMo12O40. Pengubahan cinnamaldehida menurun secara substansi dengan bertambahnya jumlah Cu3/2PMo12O40 yang telah ditempatkan pada katalis cobalt Raney. Hasil maksimum pada cinnamil alkohol yang bervariasi dengan jumlah deposit Cu3/2PMo12O40. Modifikasi deposit, hasil cinnamil alkohol maksimum dapat dicapai. Dengan 2,8% Cu3/2PMo12O40 yang dimodifikasi cobalt Raney, selektifitas untuk cinnamil alkohol tidak berubah dengan temperatur dan waktu reaksi. Jadi, ini mirip bahwa selektifitas 80% untuk cinnamil alkohol menyatakan harga yang spesifik yang berhubungan dengan sifat permukaan modifier Cu3/2PMo12O40. Pengaruh heteropolianion dan kation kompetitif pada perubahan selektifitas juga diteliti. Telah ditemukan bahwa garam tembaga dari heteropolianion yang berbeda bertindak sebagai modifier katalis, membawa perbedaan kenaikan selktifitas dalam batasan anion heteropolyacid adlah PMo12O403- > SiMO12O404- > PW12O403-. Ada sedikit perbedaan selektifitas melalui modifikasi dengan (NH4)Mo7O24 dan Cu2SiMo12O40. Modifikasi katalis Raney dengan ½-molibdoposfat yang mengandung kation alkali, alkali tanah dan logam transisi memberikan selektifitas yang mirip kira-kira 75%. Diantara semua 12-molibdoposfat mencapai 83% ketika sejumlah Cu3/2PMo12O40 2,8% dideposit pada katalis. Hidrogenasi cinnamaldehida dapat dinyatakan melalui skema II berikut [7].
[image:9.612.130.490.298.392.2]
Gambar 3. Skema Hidrogenasi Cinnamaldehida
4.2.9. Reaksi-reaksi lain
Heteropolyacid tipe Keggin seperti Pmo, PW dan SiW mengkatalisis siklotrimerisasi aldehida, seperti etanal, propanal, butanal, 2-metilpropanal dan lain-lain meghasilkan 2,4,6-trialkil-1,3,5-trioksana dengan hasil yang tinggi (persamaan 9), seperti yang dilaporkan oleh Sato dan kawan-kawan dalam [1].
(9)
O
O
Katalis turnover number lebih dari 10.000 untuk propanal siklotrimerisasi. Pada pengubahan yang tinggi dari aldehida, campuran reaksi secara spontan terpisah ke dalam dua fase, fase produk dan fase katalis yang tergantung pada aldehida dapat menjadi padatan aatau cairan. Untuk propanal siklotrimerisasi, campuran reaksi terpisah ke dalam dua fase liquid dan fase katalis diperoleh kembali dan dapat digunakan. Fase uap trimerisasi dari formaldehida menjadi trioksan yang dikatalis H4PMo11VO40 yang disupport pada 1100C oleh Eming dalam [3].
O
R
R
R
3RCHO
10 PW > TsOH >> H2SO4. Untuk beberapa reaksi antara senyawa karbonil dan diol campuran reaksi secara spontan terpisah ke dalam dua fase liquid yang memungkinkan untuk recycling.
Timofeeva dan Kozhevnikof dalam [3] melakukan reaksi alkilasi hidrokuinon dengan isobutena menghasilkan 2-di-ter-butilhidrokuinon yang dikatalis oleh H3PW12O40, H6P2W18O62 dan H6P2W21O7, di bawah kondisi fase trasfer dalam sistem bifase, termasuk toluena (fase atas) dan heteropolyacid dioksan eterat, HPA XC4H8O2-YH2O (fase bawah). Dalam hal ini kedua fase immisible dari yang awal dan produk yang diperoleh dari fase toluena. Hasil 2-ter-butilhidrokuinon bertambah dengan urutan: H6P2W18O62 < H6P2W21O7 < H3PW12O40 dengan H3PW12O40 menjadi 70% (pada suhu 850C). H3PW12O40 memperlihatkan efesiensi yang lebih tinggi daripada H2SO4 atau H3PO4.
5. Kesimpulan
Penggunaan senyawa heteropoly dan turunannya sebagai katalis asam dalam reaksi-reaksi organik memiliki keuntungan yang unik dibandingkan menggunakan asam-asam mineral umum. Hingga saat ini katalisis heteropolyacid berkembang pesat dan telah dikomersilkan pada industri-industri negara maju. Heteropolyacid memiliki keunggulan baik dari sifat kimi berupa kekuatan asam Bronsted, juga dapat diterapkan pada sistem menofase (homogen) atau difase dalam larutan berair dan pelarut organik. Senyawa heteropolyacid juga memiliki keuntungan dari segi lingkungan reaksi. Contoh-contoh reaksi yang diuraikan di atas memperlihatkan bahwa senyawa hateroply dapat diterapkan dalam berbagai reaksi sintesa senyawa organik.
DAFTAR PUSTAKA
1. Okuhara, T., Mizono, N. dan Misono, M., (1996).”Advances in Catalysis (Catalytic Chemistry of Heteropoly Coumpound)”. Volume 41, Academic Press. Inc.
2. Kauffman, G.B. dan Vartanian, P.F., (1970).”Journal of Chemical Education, Volume 47, Number 3, 212-217
3. Kozhevnikof, I.V. (1998). Chem. Rev., 98(1), 171-198
4. Onoue, Y., Mizutani, Y., Akiyama, S. dan Izumi, Y., (1978). CHEMTECH, 432 5. Koyano, G., Veno, K., dan Misono, M., (1999).”Applied Catalysis A:General, 181, 2, 267-275 6. Baijun, L., Lianhai, L., Tianxi, C. dan Katsuyoshi, I., (1999). Applied Catalysis A: General,
171, 1, 117-122
7. Baijun, L., Lianhai, L., Tianxi, C. dan Katsuyoshi, I., (1999). Applied Catalysis A: General, 180, 1-2, 105-111
![Gambar 1. Model Reaksi Polimerisasi Fase Transfer [1]](https://thumb-ap.123doks.com/thumbv2/123dok/505815.57112/4.612.165.432.128.500/gambar-model-reaksi-polimerisasi-fase-transfer.webp)
![Tabel 2. Aktifitas Heteropolyacid dalam Sintesis Metil Tert-Butil Eter [1]](https://thumb-ap.123doks.com/thumbv2/123dok/505815.57112/7.612.119.454.404.655/tabel-aktifitas-heteropolyacid-dalam-sintesis-metil-tert-butil.webp)