Erni L. Hutauruk : Studi Keanekaragaman Echinodermata Di Kawasan Perairan Pulau Rubiah Nanggroe Aceh
DI KAWASAN PERAIRAN PULAU RUBIAH NANGGROE ACEH
DARUSSALAM
SKRIPSI
ERNI L. HUTAURUK
050805064
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMETERA UTARA
STUDI KEANEKARAGAMAN ECHINODERMATA
DI KAWASAN PERAIRAN PULAU RUBIAH,
NANGGROE ACEH DARUSSALAM
SKRIPSI
OLEH:
ERNI L. HUTAURUK
050805064
Diajukan Sebagai Salah Satu Syarat untuk Meraih Gelar Sarjana Sains
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMETERA UTARA
PERSETUJUAN
Judul : STUDI KEANEKARAGAMAN ECHINODERMATA
DI KAWASAN PERAIRAN PULAU RUBIAH, NANGGROE ACEH DARUSSALAM
Kategori : SKRIPSI
Nama : ERNI L. HUTAURUK
Nomor Induk : 050805064
Program Studi : SARJANA (S1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM
Diusulkan di Medan, Desember 2009
Pembimbing II Pembimbing I
Mayang Sari. Y., S.Si., M.Si Prof. Dr. Ing. Ternala A. Barus, M.Sc
NIP: 197211261998022002 NIP: 195810161987031003
Diketahui/Disetujui oleh
Departeman Biologi FMIPA USU
PERNYATAAN
STUDI KEANEKARAGAMAN ECHINODERMATA DI
KAWASAN PERAIRAN PULAU RUBIAH, NANGGROE ACEH
DARUSSALAM
SKRIPSI
Saya mengakui bahwa skripsi ini hasil karya saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2009
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, yang telah memberikan berkat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “Studi Keanekaragaman Echinodermata di Kawasan Perairan
Pulau Rubiah Nanggroe Aceh Darussalam ” dalam waktu yang telah ditetapkan.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Ing. Ternala Alexander Barus, M.Sc selaku pembimbing I dan Ibu Mayang Sari Yeanny, S.Si., M.Si selaku Dosen Pembimbing II. Panduan ringkas, padat dan profesional telah diberikan kepada penulis agar penulis dapat menyelesaikan tugas ini. Terima kasih kepada Bapak Drs. Nursal, M.Si selaku ketua penguji dan Bapak Dr. Syaf ruddin Ilyas,. MbioMed selaku sekretaris penguji yang telah banyak memberikan saran dan arahan demi penyelesaian skripsi ini. Kepada Ibu Dra. Nunuk Priyani M.Si selaku Dosen Pembimbing Akademik dan kepada Bapak Dr. Dwi Suryanto, M.Sc, selaku Ketua Departemen Biologi FMIPA USU serta seluruh staf pengajar dan pegawai di Departemen Biologi. Saya juga mengucapkan terima kasih kepada Dekan FMIPA USU Prof. Dr. Eddy Marlianto., M.Sc.
Ucapan terima kasih yang tak ternilai penulis ucapkan kepada yang terhormat Ayahanda tercinta R. Hutauruk, dan Ibunda tercinta R. Siregar, buat tiap tetes keringat, air mata, harapan, doa dan dukungan moril sehingga penulis bisa menyelesaikan penulisan skripsi ini. Kepada kakak-kakakku tersayang Lusiana, Lena A.Md, untuk abangku terkasih: Irvan beserta istri, T Nababan, untuk adek-adekku Regina, Putri, dan Hendra serta keponakanku Fadli terima kasih atas semua doa dan semangat yang telah diberikan selama ini. Kepada seluruh keluarga yang tidak dapat penulis sebutkan satu per satu, terima kasih atas doa dan semua dukungan selama ini.
Terima kasih kepada teman-teman seperjuangan dilapangan, Team Sabang; Taripar, Misran S.Si, Sarah, Fitria Rasmita Manurung dan Valen. Team Asahan River; Misran S.Si, Toberni Sartika Situmorang S.Si, Rosida Ambarita S.Si dan juga buat Beca dan Erna S.Si. Terima kasih buat Pak Dekri, B’Arif, B’Eponk dan semua masyarakat Sabang yang telah memberi bantuan terhadap kelancaran penelitian ini. Kepada senior-seniorku tersayang: B’Frans S.Si, B’David Hutauruk S.Si, B’Ginta S.Si (B’Asuh), B’Franhot S,Si, B’Yurik S.Si, B’Boy S.Si, B’Gokmen S.Si, K’Metha S.Si, K’Rini S.Si dan seluruh abang/kakak stambuk 2003 dan stambuk 2004 dan seluruhnya yang tidak dapat saya sebutkan satu per satu. Kepada adek-adekku Buntil, Kotang, Bangol, Jupentus, Jaya, Remon, Siti, Tridola dan seluruh stambuk 2006, 2007, 2008, 2009. Kepada teman-teman 1 kost: K’tiur, Atur bataks, Ature H24, Eka, Oliv, Evan dan seluruh teman-teman Gitar 3A terima kasih atas kebersamaannya selama ini. Terima kasih buat Roy Stepanus Ginting yang saya sayangi, yang selalu memberi kasih sayang, semangat, doa, perhatian selama ini. Tuhan selalu memberkati.
Sarah, Valen, Misran, Taripar, Wulan, Imus, Widya, Winda, Susi, Nikmah, Seneng, Fatimah, Santi, Sarmut, Yanthi, Eri, Dwi, Utin, Elfrida, Kabul, Irfan, Efendi, Rahmat, Ajay, Fifi, Juned, Dahin, Diana, Verta, Nia, Andi, Umi, Dhini, Andini, Kalista.
Penulis menyadari masih banyak kekurangan dalam penyusunan skripsi ini, untuk itu Penulis mengharapkan kritik dan saran yang membangun dari semua pihak demi kesempurnaan hasil penelitian ini.
Medan, Desember 2009
ABSTRAK
Penelitian tentang “Studi Keanekaragaman Echinodermata di Kawasan Perairan Pulau Rubiah Ranggroe Aceh Darussalam” telah dilakukan pada bulan Mei 2009. Penelitian ini dilakukan dengan Metoda Purposive Random Sampling yaitu menentukan 4 stasiun penelitian berdasarkan perbedaan aktivitas yang berlangsung di perairan tersebut. Pengamatan Echinodermata dilakukan pada transek yang berukuran 50 x 4 meter sebanyak 3 transek pada setiap stasiun. Tujuan penelitian ini adalah untuk melihat keanekaragaman echinodermata dan bagaimana hubungannya dengan faktor fisik kimia perairan. Dari hasil identifikasi diperoleh Echinodermata yang tergolong dalam 4 kelas, 5 ordo, 7 famili, 11 genus dan 13 spesies. Nilai kepadatan, kepadatan relatif tertinggi terdapat pada Diadema sp dengan nilai masing-masing sebesar 0,299 ind/m2, 41,134%. Nilai kepadatan dan kepadatan relatif terendah pada Culcita sp,
Actinopyga lecanora, Holothuria edulis dan Protoreaster nodosus sebesar 0,005
ind/m2, 0,709% pada setiap stasiun. Indeks keanekaragaman Echinodermata tertinggi terdapat pada stasiun 2 sebesar 1,859 dan terendah pada stasiun 4 sebesar 1,720. Indeks keseragaman (e) tertinggi pada stasiun 3 sebesar 0,773 dan terendah pada stasiun 4 sebesar 0,692. Persen tutupan karang yang tertinggi pada stasiun 2 sebesar 73,10% (kategori baik) dan terendah pada stasiun 4 sebesar 16,28% (kategori buruk).
STUDY OF ECHINODERMATA DIVERSITY AT THE OCEANIK OF RUBIAH ISLAND NANGGROE ACEH DARUSSALAM
ABSTRACT
The research with the title “Study of Echinodermata Diversity At The Oceanik Of Rubiah Island Nanggroe Aceh Darussalam” have been done at May 2009. This research is done with the method of Purpossive Random Sampling that is determine 4 research stasiun of pursuant to difference of society activity that goes on around this oceanik. Echinodermata survey done at the transect that sized 4 x 50 metres by 3 restating times rill each research stasion. This research target is to see the diversity of Echinodermata and the relation to percent cover of coral reef. From result identify to the Echinodermata obtained in 4 class, 5 ordo, 7 set of family, 11 genus and 13 species. The highest abundance and relative abundance is obtained at Diadema sp that is 0,299 ind./m2 and 41,134%. The lowest abundance and relative abundance at
Culcita sp, Actinopyga lecanora, Holothuria edulis and Protoreaster nodosus that is
0,005 ind/m2, 0,709% at each stasiun. The highest diversity index are at stasiun 2 that is 1,856 while the lowest are at stasiun 4 that is 1,720. Highest similarity index there are at station 3 that is 0,773 while the lowest of similarity index there are at 4 that is 0,692. The highest percent cover of coral reef are at stasiun 2 that is 73,10% (good cathegory) and the lowest are at stasiun 4 that is 16,28% (bad cathegory).
DAFTAR ISI
1.5Manfaat Penelitian 3
Bab 2 Tinjauan Pustaka 4
2.1 Echinodermata 4
2.2 Pembagian Echinodermata 5
2.3 Anatomi dan Morfologi 11
3.3 Pengukuran Faktor Fisik dan Kimia Perairan 18
3.4 Analisa Data 20
Bab 4 Hasil dan Pembahasan 23
4.1 Parameter Biotik 23
4.1.1 Nilai Kepadatan, Kepadatan Relatif, dan
Frekuensi Kehadiran 31
4.1.2 Indeks Keanekaragaman (H’), Keseragaman (E),
dan Persen Tutupan Karang (r) 34
4.2 Parameter Abiotik 36
4.2.1 Suhu Air 37
4.2.2 Penetrasi Cahaya 37
4.2.3 Intensitas cahaya 37
4.2.4 pH Air 38
4.2.5 Oksigen Terlarut 38
4.2.6 Kejenuhan Oksigen 39
4.2.7 BOD5 39
4.2.8 Salinitas 39
4.2.9 Jenis Substrat 40
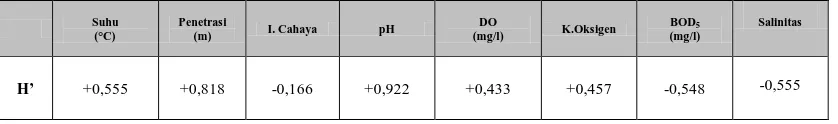
4.3 Nilai Analisis Korelasi Pearson Metoda Komputerisasi
SPSS Ver. 13.00 40
Bab 5 Kesimpulan dan Saran
5.1 Kesimpulan 43
5.2 Saran 44
DAFTAR TABEL
Halaman
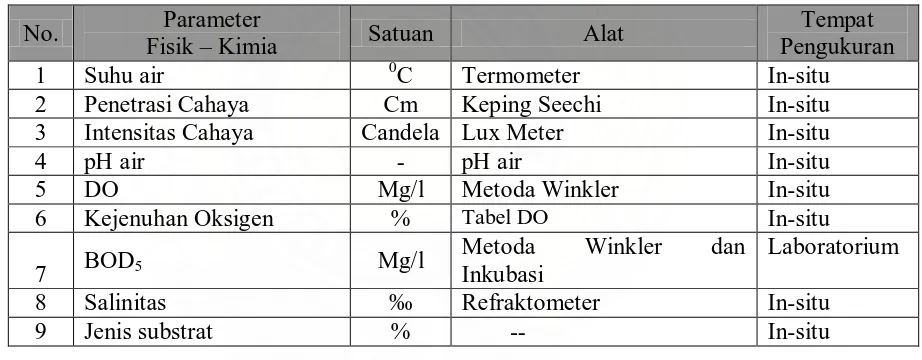
Tabel 3.1: Alat dan Satuan yang Dipergunakan dalam Pengukuran
Faktor Fisik Kimia Perairan 20
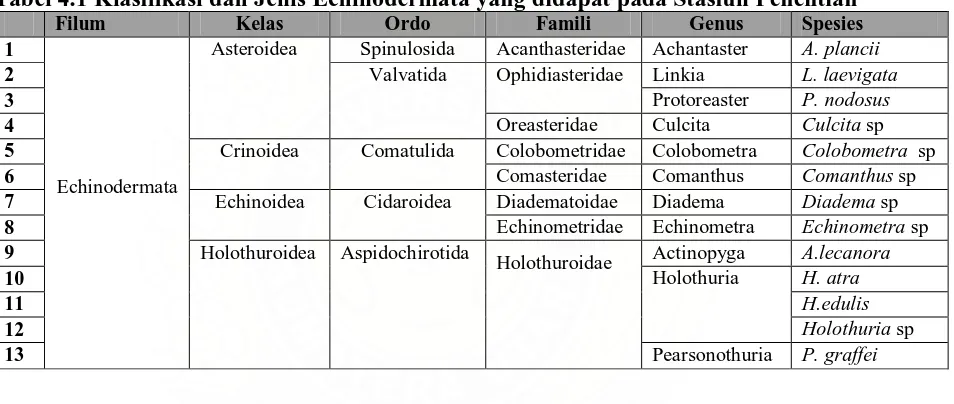
Tabel 4.1: Klassifikasi dan Jenis Echinodermata yang didapat
pada Stasiun Penelitian 23
Tabel 4.2: Nilai Kepadatan Populasi (ind./m2), Kepadatan Relatif (%),
dan Frekuensi Kehadiran (%) pada Setiap Stasiun Penelitian 31 Tabel 4.3: Indeks Keanekaragaman (H’), Persen Tutupan Karang (r)
dan Keseragaman (E) Echinodermata pada Setiap
Stasiun Penelitian 34
Tabel 4.4: Nilai Indeks Similaritas (IS) pada Setiap Stasiun Penelitian 36 Tabel 4.5: Rata-rata Nilai Faktor Fisik Kimia Perairan yang Diperoleh
pada setiap Stasiun Penelitian 36
Tabel 4.6: Nilai Analisis Korelasi Keanekaragaman Echinodermata
dengan Faktor Fisik Kimia Perairan 40
DAFTAR LAMPIRAN
Halaman
Lampiran A: Bagan Kerja Metode Winkler Untuk Mengukur DO 47
Lampiran B: Bagan Kerja Metode Winkler Untuk Mengukur BOD5 48
Lampiran C: Nilai Oksigen Terlarut Maksimum (mg/l) pada
Berbagai Besaran Temperatur Air 49
Lampiran D: Peta Lokasi 50
Lampiran E: Foto Lokasi 51
Lampiran F: Jumlah dan Jenis Echinodermata yang di dapat pada
Setiap Stasiun Penelitian 52
Lampiran G: Contoh Hasil Perhitungan 53
DAFTAR GAMBAR
Halaman
Gambar 2.3.1 Struktur Bintang Laut 6
Gambar 2.3.2 Morfologi Crinoid 7
Gambar 2.3.3 Morfologi Echinoidea 8
Gambar 2.3.4 Morfologi Holothuroidea 9
Gambar 2.3.5 Morfologi Ophiroidea 10
Gambar 4.1.1 Achantaster plancii 24
Gambar 4.1.2 Culcita sp 24
Gambar 4.1.3 Linkia laevigata 25
Gambar 4.1.4 Protoreaster nodosus 25
Gambar 4.1.5 Colobometra sp 26
Gambar 4.1.6 Comanthus sp 26
Gambar 4.1.7 Diadema sp 27
Gambar 4.1.8 Echinometra mathaei 27
Gambar 4.1.9 Holothuria atra 28
Gambar 4.1.10 Holothuria edulis 28
Gambar 4.1.11 Actinopyga lecanora 29
Gambar 4.1.12 Holothuria sp 29
BAB 1
PENDAHULUAN
1.1Latar Belakang
Di Nanggroe Aceh Darussalam terdapat 4 pulau kecil yang mengelilingi Pulau Weh:
sebagai tempat pariwisata menyelam karena terumbu karangnya dan kekayaan biota
laut yang melimpah. Perairan Pulau Rubiah yang termasuk dalam kawasan Taman
Wisata Bawah Laut Pulau Weh yang berada di Kota Sabang memiliki hamparan
terumbu karang dan banyak kegiatan wisata alam di tempat ini seperti naik sampan,
berenang, diving, penggunaan kapal mesin dan lain-lain. Beragam biota laut hidup
dalam ekosistem ini, termasuk anggota Echinodermata yang merupakan salah satu
pembentuk ekosistem terumbu karan
Echinodermata berasal dari bahasa Yunani Echinus berarti landak, dan derma
berarti kulit. Semua jenis Echinodermata hidup dilaut, mulai dari daerah litoral sampai
kedalaman 6.000 m. Termasuk dalam filum Echinodermata antara lain bintang laut,
bulu babi, teripang dan lain-lain. Umumnya berukuran besar, yang terkecil
berdiameter 1 cm (Brotowidjoyo, 1994).
Ekosistem terumbu karang merupakan habitat dari berbagai fauna invertebrata.
Echinodermata merupakan salah satu kelompok biota penghuni terumbu karang yang
cukup menonjol. Kelompok ini dapat hidup menempati berbagai macam mikro habitat
seperti zona rataan terumbu, daerah pertumbuhan alga, padang lamun, koloni karang
hidup dan karang mati dan juga beting karang (rubbles dan boulders). Kehadiran dan
peranan fauna Echinodermata di ekosistem terumbu karang sangat banyak. Fauna
Echinodermata mempunyai peranan pada ekosistem terumbu karang sebagai jaringan
makanan dan juga sebagai herbivora, carnivora, omnivora ataupun sebagai pemakan
detritus. Salah satu contohnya adalah beberapa jenis teripang dan bulu babi
peningkatan kelimpahan bisa membawa perubahan besar dalam struktur komunitas
koral (Clark & Rowe 1971).
Echinodermata merupakan sumber daya hayati perairan laut yang cukup
digemari, Echinodermata diexploitasi oleh masyarakat sebagai sumber pakan,
sehingga populasi echinodermata berkurang, untuk mengatasi hal tersebut pemerintah
telah mengambil kebijakan dalam undang-undang seperti yang tercantum dalam 3 SK
Menteri Kehutanan yakni SK No. 12 Th. 1987 Tentang Flora Fauna yang Dilindungi,
No. 301 Th. 1991 tentang Konversi Sumber Daya Alam dan Ekosistemnya dan No.
882 Th. 1992 tentang Perlindungan Biota Perairan Air Laut (Anonimous, 1993).
Kelangsungan hidup Echinodermata dipengaruhi oleh faktor fisik kimia
perairan seperti suhu, pH, salinitas, oksigen terlarut dan lain-lain. Sejauh ini belum
diketahui jenis-jenis Echinodermata yang terdapat di Pulau Rubiah dan hubungan
faktor fisik kimia perairan dengan keanekaragaman Echinodermata, serta pengaruh
persen tutupan karang terhadap nilai keanekaragaman Echinodermata, oleh sebab itu
dilakukan penelitian “Studi Keanekaragaman Echinodermata di Perairan Pulau
Rubiah Nanggroe Aceh Darussalam”.
1.2 Permasalahan
Perairan Pulau Rubiah merupakan tempat wisata yang memiliki hamparan terumbu
karang yang cukup luas. Echinodermata merupakan salah satu biota yang banyak
terdapat di ekosistem terumbu karang di perairan ini. Sejauh ini belum diketahui
keanekaragaman Echinodermata di perairan Pulau Rubiah Nanggroe Aceh
Darussalam dan bagaimana hubungannya dengan faktor fisik kimia perairan, oleh
1.3 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
1. Untuk mengetahui jenis-jenis Echinodermata di Perairan Pulau Rubiah,
Nanggroe Aceh Darussalam.
2. Untuk mengetahui hubungan faktor fisik kimia perairan dengan nilai
keanekaragaman Echinodermata.
3. Untuk mengetahui hubungan persen tutupan terumbu karang dengan
keanekaragaman Echinodermata.
1.4 Hipotesis
1. Adanya perbedaan keanekaragaman Echinodermata pada setiap stasiun
penelitian di Perairan Pulau Rubiah, Nanggroe Aceh Darussalam.
2. Adanya hubungan faktor fisik kimia perairan dengan nilai keanekaragaman
Echinodermata
3. Adanya perbedaan persen tutupan karang pada setiap stasiun dan berhubungan
dengan keanekaragaman Echinodermata.
1.5 Manfaat
Penelitian ini dapat bermanfaat sebagai informasi bagi penelitian selanjutnya
mengenai keanekaragaman Echinodermata yang terdapat di Perairan Pulau Rubiah
dan sumber data bagi pihak-pihak terkait yang berguna dalam usaha pelestarian biota
BAB 2
TINJAUAN PUSTAKA
2.1 Ekosistem Laut
Indonesia merupakan negara kepulauan terbesar di dunia yang mempunyai luas sekitar
3,1 km2 dengan kawasan pesisir menempati garis pantai sepanjang 81.000 km. Kawasan ini memiliki berbagai ekosistem pendukung yang sangat beragam seperti
ekosistem hutan manggrove, terumbu karang, padang lamun. Keanekaragaman hayati
lainnya terutama bagi potensi pesisir yang khas di perairan tropis dan sangat penting
bagi kehidupan biota lainnya adalah terumbu karang atau (coral reff) (Romimohtarto
& Juwana, 2001).
Terumbu karang adalah karang yang terbentuk dari kalsium karbonat koloni
karang laut yang bernama polip yang bersimbiosis dengan organisme mikroskopis
yang bernama zooxanthellae. Zooxhantellae adalah algae dari kelompok
Dinoflagellata yang bersimbiosis dengan hewan seperti karang, anemon, moluska dan
lain sebagainya. Sebagian besar zooxhantellae berasal dari genus Symbiodinium.
Jumlah zooxhantellae pada karang diperkiran 1 juta sel/cm2 permukaan karang. Dalam
asosiasi ini karang memperoleh keuntungan berupa hasil fotosintesis seperti gula,
asam amino dan oksigen sebagai nutrisi bagi karang dan zooxhantellae dapat memper
oleh tempat tinggal
Banyak biota penghuni ekosistem terumbu karang yang memiliki nilai
ekonomi yang tinggi misalnya: ikan karang, rumput laut, Echinodermata, karang batu
dan lain sebagainya. Pertumbuhan terumbu karang sangat lambat, hanya beberapa cm
per tahun. Terumbu karang yamg kita lihat sekarang sebenarnya adalah hasil karya
karang batu selama ribuan tahun. Untuk melindungi terumbu karang ini telah
2.2 Echinodermata
Echinodermata adalah hewan laut yang memiliki kulit berduri atau berbintil.
Hewan-hewan ini dibagi dalam dibagi dalam 5 kelas utama yakni: teripang (Holothuroidea),
bintang laut (Asteroidea), bintang ular (Ophiuroidea), bulu babi (Echinoidea) dan lili
laut (Crinoidea). Hewan ini sangat umum di jumpai di daerah pantai terutama di
daerah terumbu karang. Di Indonesia dan sekitarnya (kawasan Indi-Pasifik Barat)
terdapat teripang kurang lebih 141 jenis, bintang laut 87 jenis, bintang ular 142 jenis,
bulu babi 84 jenis dan lili laut 91 jenis (Nontji, 1993).
Anggota filum Echinodermata adalah penghuni lingkungan bahari, terutama di
laut bentik. Ciri khasnya adalah tubuh yang menjurus lima tersusun mengelilingi suatu
sumbu polar. Hewan ini memiliki kerangka dalam yang mempunyai duri (spine).
Sistem pencernaan cukup berkembang, tetapi tidak memiliki sistem ekskresi.
Kebanyakan anggota filum Echinodermata diosius, bersaluran reproduksi sederhana,
fertilisasi berlangsung eksternal (Ruppert, 1991). Brotowidjoyo (1994), menyatakan
hewan ini memiliki sistem digesti lengkap walaupun anus tidak berfungsi. Menurut
Niel A. Campbell et al., (2003), bahwa reproduksi seksual anggota filum
Echinodermata pada umumnya melibatkan individu jantan dan betina yang terpisah
(diosius) dan membebaskan gametnya ke dalam air.
2.3 Pembagian Echinodermata
Hyman (1955), menyatakan kelas Echinodermata antara lain : Crinoidea,
Asteroidea, Ophiuroidea, Echinoidea dan Holothuroidea.
Asteroidea atau banyak orang menyebutnya bintang laut, biasanya di jumpai merayap
pada batu, pasir dan terumbu karang dalam laut. Mulut hewan ini berada di sisi bawah
terletak ditengah-tengah cakram dan anus diatas. Asteroidea termasuk karnivora,
makanan berupa ikan, tiram, kerang, teritip, keong, cacing, crustaceae dan lain-lain.
Beberapa jenis merupakan pemakan bangkai. Achantaster merupakan hama pada
terumbu karang yang memakan polip Coelenterata. Warna bintang laut ini menarik,
biasanya ujung duri berwarna kemerahan atau orange sedangkan permukaan lengan
berwarna abu-abu kebiruan. Habitat bintang laut ini adalah terumbu karang terutama
dilereng terumbu pada kedalaman 2 sampai 6 meter (Nontji, 1993).
Seluruh tubuhnya tertutup oleh duri kecuali pada lekuk sisi oral disebut celah
ambulakral dan ada juga yang tidak memiliki duri. Alat gerak berupa kaki tabung.
Branchi muncul diantara papan-papan kapur yang berfungsi sebagai alat pernafasan
dan ekskresi. Hewan ini memiliki sistem saluran air, lambung, madreporit (saluran
keluar masuknya air) dan anus (Gambar 2.3.1). Permukaan tubuhnya terdapat
pediselariae sebagai alat tambahan dan bentuk seperti angkup yang berfungsi untuk
menghilangkan benda-benda asing di permukaan tubuhnya (Vinomo, 2007).
Gambar 2.3.1 Struktur tubuh bintang laut
Reproduksi Asteroid umumnya dioecious, mempunyai lima pasang gonad
pada tiap tangan. Telur dan sperma dilepas ke air, pembuahan diluar dan setelah 2 hari
menjadi blastula yang berenang bebas. Larva mulai makan pada saat saluran
pencernaan sudah terbentuk. Makanan larva adalah fitoplankton dan partikel
tersuspensi. Enam atau tujuh minggu kemudian larva turun ke substrat dan mengalami
yang mencapai 34 tahun (Romimohtarto & Juwana, 2001). Bintang laut dan beberapa
Echinodermata mampu melakukan regenerasi. Bintang laut dapat menumbuhkan
kembali lengan yamg hilang dan bahkan anggota satu genus dapat menumbuhkan
kembali keseluruhan tubuh dari sebuah lengan (Niel A. Campbell et al., 2003).
2.3.2 Kelas Crinoidea
Kelompok hewan ini dinamakan lili laut atau bintang bulu yang mempunyai bentuk
yang indah. Sebagian dari mereka hidup dilaut dan beberapa jenis mendiami laut
dangkal seperti terumbu karang. Ukurannya tidak lebih dari 40 cm panjangnya dan
warna mencolok. Hewan ini memiliki tangkai, kelopak dan lengan. Setiap lengan
bercabang 2 atau lebih. Setiap cabang mempunyai ranting-ranting melintang disebut
pinula dan cabang- cabang ini membuat hewan ini berbulu (Gambar 2.3.2). Hewan
ini memakan plankton kecil dibawa oleh lengan. Hewan ini peka, tetapi mempunyai
kemampuan regenerasi yang tinggi sehingga dapat menyembuhkan diri dari luka
(Nontji, 1993).
Gambar 2.3.3. Morfologi Crinoid
Reproduksi secara seksual dan dioecious. Gonad terdapat pada pangkal
beberapa pinula atau pangkal tangan. Pembuahan di air laut atau dierami. Telur
bintang bulu dilekatkan pada sejumlah pinula. Telur menjadi larva, berenang bebas
untuk beberapa hari. Selanjutnya turun dan melekat pada substrat dan mengalami
proses metamorfosis menjadi bentuk larva bertangkai kecil yang disebut pentacrinoid
yang berukuran 3 mm dan proses metamorfosa membutuhkan waktu 6 minggu hingga
Proses makan hewan ini dengan menyaring air, plankton masuk ke celah
bersilia lalu lengan dan pinula kemudian dialirkan ke mulut. Organ pencernaan ada di
calyx. Makanan dibuang melalui anus yang di dekat mulut. Semua jenis dari
kelompok ini mempunyai nilai ekonomi yang tinggi baik untuk dijadikan bahan
makanan maupun untuk bahan hiasan di akuarium, kecuali bulu seribu, mahkota
seribu atau mahkota duri merupakan jenis yang merusak, karena bila populasinya
berlimpah akan memakan polip-polip karang dan menyebabkan karang berwarna
putih serta lama-kelamaan sebagian populasi karang akan rusak dan mati (Nybakken,
1988).
2.2.3 Kelas Echinoidea
Pada permukaan tubuh hewan ini terdapat tonjolan-tonjolan pendek yang bulat yaitu
tempat menempel duri yang tersusun dari zat kapur atau hewan ini sering disebut
landak laut. Hewan ini terdiri dari duri, kaki tabung, turberkel (Gambar 2.3.3).
Adakalanya duri tersebut panjang, runcing, di dalamnya berlubang dan rapuh ada juga
duri hewan ini pendek dan tumpul. Racunnya sangat keras dan menyakitkan bagi
manusia bila tertusuk. Pedicellaria pada bulu babi juga ada yang beracun, berfungsi
untuk menghalau atau melumpuhkan binatang-binatang kecil yang mengotori atau
mengganggu. Hewan ini biasanya hidup di sela-sela pasir atau bebatuan pantai atau di
dasar laut. Tubuhnya tanpa lengan hampir bulat atau gepeng (Sugiarto, 2007).
Gambar. 2.3.3 Morfologi Echinoidea
Saluran pencernaan lengkap, terdiri atas mulut, esofagus, perut, usus yang
sessile, bangkai, beberapa jenis memakan detritus dan lain-lain. Reproduksi secara
seksual, dioecious dan pembuahan di luar. (Ruppert, 1991).
2.3.4 Kelas Holothuroidea
Sebagai contohnya, teripang atau timun laut (Thyone briereus). Tubuhnya lunak,
berbentuk seperti kantung memanjang. Dalam kulitnya terdapat papan-papan kecil
dari kapur. Pada satu ujung terdapat mulut yang dikelilingi oleh tentakel-tentakel
bercabang (Gambar 2.3.4). Tentakel ini berongga dan dapat memanjang karena
tekanan air, hewan ini tidak memiliki duri (Sugiarto, 2007).
Gambar 2.3.4. Morfologi Timun Laut
Timun laut merayap lambat sekali, biasanya bersembunyi dalam lubang atau
celah batu dan oral atau menanamkan diri dalam lumpur atau pasir laut dan hanya
bagian posteriornya saja yang nampak. Umumnya hewan ini aktif pada malam hari
berkeliaran pada mencari makan. Makanannya ialah bahan organik yang terdapat
dalam sampah substrat atau plankton yang melekat pada lendir tentakel. Satu persatu
tentakel dimasukkan dalam pharink dan ketika ditarik keluar maka butir-butir
makanan akan melekat pada lendir tentakel dan selanjutnya ditelan. Sistem
pencernaan terdiri atas mulut, pharink, esofagus, lambung, usus, cloaca, dan anus
(Brotowidjoyo, 1994).
Teripang (Holothuroidea) merupakan golongan yang paling umum dijumpai.
Hewan ini banyak terdapat di paparan turumbu karang, pantai berbatu atau berlumpur
sekitar 7.000 m. Susunan bentuk dasar tubuh Echinodermata tidak jelas terlihat pada
bentuk luar teripang ini karena karangka luarnya tidak ada. Hewan ini sangat bergerak
lamban sehingga seakan-akan teripang selalu dalam keadaan diam pada waktu kita
lihat di alam bebas. Untuk melindungi diri dari musuh, hewan ini mengeluarkan lendir
yang beracun dari tubuhnya. Ada juga jenis yang menyemprotkan getah yang sangat
lengket dari duburnya apabila diganggu. Banyak jenis hewan ini yang bisa dikonsumsi
bahkan merupakan bahan makanan yang istimewa di restoran Cina (Nontji, 1993).
2.3.5 Kelas Ophiuroidea
Hewan ini memiliki 5 lengan atau tangan yang panjang, berfungsi sebagai alat gerak,
Tangan rapuh dan mudah putus namun akan tumbuh tangan baru (Gambar 2.3.5).
Kelima tangan ini bergerak-gerakkan sehingga menyerupai ular. Oleh karena itu
hewan jenis ini sering disebut bintang ular laut. Hewan ini rentan terhadap lingkungan
dan aktif pada malam hari, berenang dan mencari makan dengan bantuan
tangan-tangannya yang gemulai dan dapat meliuk-liuk seperti ular. Bagian mulut akan
membentuk bagian yang hilang (Ruppert, 1991).
Gambar 2.3.5. Ophiuroidea
Hewan Ofiuroidea hidup dilaut, bersembunyi diantara rumput laut, dalam
lumpur atau dalam pasir yang aktif pada malam hari dan hidup berenang, makanan
terdiri dari moluska, krustacae, jasad renik dan zat organik yang sedang membusuk
yang berada di dasar parairan. Cara makan dengan mengangkat lengan ke atas dalam
air untuk menangkap plankton dan bahan makanan lainnya. Hewan ini tidak memiliki
& Juwana, 2001). Dalam Nontji (1993) menyatakan bintang mengular biasanya sukar
dijumpai karena lebih senang pada tempat-tempat yang agak gelap di bawah batu atau
celah-celah karang. Diatom merupakan makanannya utama, tetapi ada pula yang
memakan berbagai hewan kecil.
Kebanyakan Ophiuroid adalah dioecious. Pembuahan diluar, menghasilkan
larva ophiopluteus yang berenang bebas. Beberapa hari kemudian mengalami
metamorfosa mengalami hidup dewasa. Beberapa jenis mempunyai kantung
pengeraman dan larvanya berenang bebas (Brotowidjoyo, 1994).
2.3 Anatomi dan Morfologi Echinodermata
Hewan Echinodermata bertubuh kasar karena ditutupi tonjolan kerangka atau duri
yang memiliki berbagai fungsi tetapi ada juga sebagian tidak memiliki duri seperti
timun laut. Sistem pencernaan cukup berkembang, tetapi tidak memiliki sistem
ekskresi. Kebanyakan hewan ini diosius, saluran reproduksi sederhana, sedangkan
fertilisasi berlangsung eksternal (Pecherik, 2005).
Sistem pembuluh air berfungsi untuk mengerakkan kaki tabung (tube feet)
dengan cara mengatur masuk dan keluarnya air laut melalui madreporit (saluran
keluar masuknya air). Kontraksi ampula mengatur volume air dalam kaki tabung,
berarti mengatur gerak kaki tabung. Kaki tabung juga berfungsi untuk merayap,
berpegang pada substrat, memegang mangsa atau membantu pertukaran gas O2 dan
CO2 (Nontji, 1993).
Alat pernafasan utama Echinodermata ialah insang kulit yang merupakan
perluasan rongga tubuh yang keluar melalui lubang-lubang kecil di antara osscle
kapur. Rongga tubuh berisi cairan semacam getah bening, mengandung amebocyte
yang berkepentingan dalam peredaran darah, pernafasan dan ekskresi. Didalam
rongga tubuh terdapat organ dalam seperti kelenjar pencernaan (Ruppret, 1991).
Hewan ini bertahan hidup dengan suatu sistem pembuluh air yang unik yang
ditempatkan di bagian bawah dari tubuh. Organ bagian badan terdiri dari suatu lima
bagian simetris termasuk gigi dan struktur seperti lidah yang gemuk (Sugiarto, 2007).
2.5 Faktor Lingkungan yang Mempengaruhi Kehidupan Echinodermata.
2.5.1 Cahaya
Ganggang yang hidup pada terumbu karang (zooxanthella), memerlukan
cahaya yang cukup untuk dapat melakukan fotosintesis. Umumnya Echinodermata
hidup pada pantai berpasir, berlumpur dan melekat pada terumbu karang.
Reksodihardjo-Lilley (1996), menyatakan bahwa Echinodermata hidup pada karang
merupakan hewan yang bersimbiosis dengan zooxanthella. Stowe (1987), berpendapat
bahwa dasar dari rantai makanan pada komunitas terumbu adalah proses fotosintesis
oleh alga yang hidup bersama dalam jaringan biota-biota lain. Nontji (1993),
menyatakan bahwa makanan Echinodermata berupa ikan, tiram, kerang, teritip, keong,
cacing, crustaceae, polip karang, ganggang dan lain-lain. Beberapa jenis merupakan
pemakan bangkai, sedangkan Achantaster merupakan hama pada terumbu karang
yang memakan polip Coelenterata.
2.5.2 Suhu
Pada setiap penelitian perairan, pengukuran suhu adalah hal yang harus dilakukan
sebab kelarutan berbagai gas dalam air serta seluruh aktivitas biologis dan fisiologis
organisme perairan sangat dipengaruhi oleh suhu ( Brehm dan Meijering, 1990 dalam
Barus, 1996). Kinsman (1964) dalam Supriharyono (2002) menyebutkan bahwa batas
minimum dan maksimum suhu berkisar antara 16°C -17° dan 36° C.
Pola temperatur ekosistem akuatik dipengaruhi oleh berbagai faktor seperti
juga oleh faktor kanopi (penutupan oleh vegetasi) dari pepohonan yang tumbuh di tepi
perairan (Brehm et al., 1990 dalam Barus, 1996).
2.5.3 Salinitas
Ciri paling khas pada air laut adalah rasa asin, karena mengandung
bermacam-macam garam dan yang paling utama adalah NaCl. Diperairan Samudra salinitas
biasanya berkisar antara 34-35‰ (Nontji, 1993). Salinitas rata-rata di daerah tropis
adalah sekitar 35‰, dan organisme laut tidak dapat bertahan pada salinitas yang
menyimpang dari salinitas laut normal, 32-35 ‰ (Brotowidjojo et al., 1995). Namun
pengaruh salinitas tergantung pada kondisi perairan laut setempat atau pengaruh alam
seperti badai dan hujan (Supriharyono, 2002).
2.5.4 DO (Disolved Oxygen)
DO merupakan banyaknya oksigen terlarut dalam suatu perairan. Oksigen
terlarut merupakan suatu faktor yang sangat penting di dalam ekosistem perairan,
terutama sekali dibutuhkan untuk proses respirasi bagi sebagian besar organisme air.
Kelarutan oksigen di dalam air terutama sangat dipengaruhi oleh faktor suhu, dimana
kelarutan maksimum terdapat pada suhu 00C, yaitu sebesar 14,16 mg/l O2 sedangkan nilai oksigen terlarut di perairan sebaliknya tidak lebih kecil dari 8 mg oksigen/liter
air. Dengan peningkatan suhu akan menyebabkan konsentrasi oksigen akan menurun
dan sebaliknya suhu yang semakin rendah akan meningkatkan konsentrasi oksigen
terlarut. Sumber utama oksigen terlarut dalam air berasal dari adanya kontak antara
permukaan air dengan udara dan juga dari proses fotosintesis (Barus, 2004). Menurut
Michael (1994), oksigen hilang dari air alam oleh adanya pernafasan biota,
pengurairan bahan organik, aliran masuk air bawah tanah yang miskin oksigen dan
2.5.5 BOD (Biological Oxygen Demand)
BOD adalah peristiwa penguraian bahan buangan organik melalui proses
oksidasi oleh mikroorganisme di dalam air adalah proses alamiah yang mudah terjadi
air memiliki oksigen yang cukup (Wardhana, 2000). Nilai konsentrasi BOD
menunjukkan suatu kualitas perairan yang masih tergolong baik dimana apabila
konsumsi O2 selama periode 5 hari berkisar sampai 5 mg/l O2 maka perairan tersebut
tergolong baik, apabila konsumsi O2 berkisar antara 10 mg/l – 20 mg/l O2 akan
menunjukkan tingkat pencemaran oleh materi organik yang tinggi dan air limbah nilai
BOD umumnya lebih dari 100 mg/l (Brower et al., 1990).
2.5.6 pH (Derajat Keasaman)
Setiap spesies memiliki kisaran toleransi yang berbeda terhadap pH. pH yang
ideal bagi kehidupan organisme akuatik termasuk makrozoobentos pada umumnya
berkisar antara 7 sampai 8,5. Kondisi perairan yang bersifat sangat asam maupun
sangat basa akan membahayakan kelangsungan hidup organisme karena akan
menyebabkan terjadinya gangguan metabolisme dan respirasi. Disamping itu pH yang
sangat rendah akan menyebabkan mobilitas berbagai senyawa logam berat yang
bersifat toksik semakin tinggi yang tentunya akan mengancam kelangsungan hidup
organisme akuatik. Sementara pH yang tinggi akan menyebabkan keseimbangan
antara amonium dan amoniak dalam air akan terganggu, dimana kenaikan pH diatas
akan meningkatkan konsentrasi amoniak yang juga bersifat sangat toksik bagi
organisme (Barus, 2004).
2.5.8 Jenis Substrat Dasar
Menurut Seki (1982), komponen organik utama yang terdapat di dalam air
adalah asam amino, protein, karbohidrat, dan lemak. Sedangkan komponen lain
Tetapi hanya 10% dari material organik tersebut yang mengendap sebagai substrat ke
dasar perairan.
2.5.9
Dengan terbentuknya kedalaman lapisan air intensitas cahaya tersebut akan
mengalami perubahan yang signifikan baik secara kualitatif maupun kuantitatif.
Cahaya gelombang pendek merupakan yang paling kuat mengalami pembiasan yang
menyebabkan kolam air yang jernih akan terlihat berwarna biru dari permukaan. Pada
lapisan dasar, warna air akan berubah menjadi hijau kekuningan, karena intensitas dari
warna ini paling baik ditransmisi dalam air sampai dasar (Barus, 2004).
Menurut Romimohtaro & Juwana (2001), banyaknya cahaya yang menembus
permukaan air laut dan menerangi lapisan permukaan air laut memegang peranan
penting dalam menentukan pertumbuhan fitoplankton. Bagi hewan laut, cahaya
mempunyai pengaruh terbesar yaitu sebagai sumber energi untuk proses fotosintesis
tumbuh-tumbuhan yang menjadi sumber makanannya.
2.5.10 Penetrasi Cahaya
Kemampuan penetrasi cahaya sampai dengan kedalaman tertentu juga akan
mempengaruhi distribusi dan intensitas fotosintesis tumbuhan air di badan perairan
(Brower et al., 1990). Pengaruh utama dari kekeruhan adalah penurunan penetrasi
cahaya secara mencolok. Sehingga menurunkan aktivitas fotosintesis fitoplankton dan
alga, akibatnya akan menurunkan produktivitas perairan.
2.6 Habitat & Manfaat
Di daerah rataan terumbu binatang ini dapat menempati berbagai habitat seperti,
rataan pasir (sand flat), timbunan karang mati (rubbles dan boulders) dan daerah tubir
penyebaran karang batu dan dapat juga ditemukan di daerah pulau-pulau karang atau
daerah pesisir yang ditumbuhi karang batu (fringing reef) (Kobayashi dan Nakamura,
1967).
Zooxanthellae adalah alga ber-sel satu yang hidup di dalam jaringan tubuh
karang batu. Zooxanthelae dan karang memiliki hubungan simbiosis yang saling
menguntungkan. Zooxanthellae menyediakan makanan untuk polip karang
melalui proses memasak yang disebut fotosintesis, sedangkan polip karang
menyediakan tempat tinggal yang aman dan terlindung untuk zooxanthellae
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada 4-8 Mei 2009 di Kawasan Perairan Pulau
Rubiah, Nanggroe Aceh Darussalam. Dimana dalam menentukan titik koordinatnya
digunakan GPS (Global Posisition System). Secara geografis lokasi penelitian ini
berada pada:
a) Stasiun 1, 05o53’018” LU dan 95o15’17,29” BT s/d 05o52’59,2” LU dan 95o15’18,5” BT, dimana daerah ini memiliki terumbu karang yang baik tetapi sebagian rusak akibat pengaruh dari bencana Tsunami
b) Stasiun 2, 5o53’01,4” LU dan 95o15’32,4” BT s/d 5o53’06,6” LU dan 95 o
15’28,1” BT, dimana daerah ini merupakan daerah kontrol tidak terdapat
aktivitas masyarakat.
c) Stasiun 3, 5o52’32,8” LU dan 95o15’34,8” BT s/d 5o52’39,2” LU dan 95o15’35,6” BT, dimana daerah ini merupakan daerah wisata pantai berpasir
juga ditemukan aktifitas masyarakat seperti penginapan, snorkeling tetapi
daerah ini tergolong alami karena memiliki terumbu karang yang baik
d) Stasiun 4 05o52’32,1” LU dan 95o15’31,3” BT s/d 05o52’35,8” LU dan 95o15’28,97” BT, dimana daerah ini memiliki terumbu karang yang rusak atau dalam kriteria buruk karena dekat dengan pemukiman penduduk, lalu
3.2 Metoda Penelitian
Metoda yang digunakan dalam penentuan lokasi sampling adalah “Purposive
Random Sampling”. Ditentukan 4 stasiun pengamatan di daerah penelitian. Dibuat 3
transek pada setiap stasiun pengamatan dengan ukuran 50 x 4 meter sejajar garis
pantai. Jarak setiap transek 10 meter, sedangkan jarak setiap stasiun adalah 300 meter.
Metoda yang digunakan dalam pengamatan sample adalah Foto dan Visual Sensus,
dimana pengamatan sampel dengan cara merenang (snorkling) dan menyelam (diving)
sepanjang transek yang sudah ditentukan. Waktu yang dibutuhkan untuk mengamati
setiap transek kurang lebih 1 jam. Jenis Echinodermata yang diperoleh difoto, diamati
bentuk morfologi tubuh, dihitung dan diidentifikasi.
3.3 Pengukuran Faktor Fisik Kimia Perairan
Faktor fisik kimia perairan yang diukur mencakup:
3.3.1 Suhu (ºC)
Suhu air diukur dengan menggunakan alat termometer. Diambil satu ember
dari sampel air kemudian termometer dimasukkan kedalamnya. Lalu dibaca skala dari
termometer tersebut dan dicatat.
3.3.2 pH (Derajat Keasaman)
Pengkuran pH dengan menggunakan pH meter dengan cara memasukkan pH
meter ke dalam sampel air yang diambil dalam ember. Kemudian dibaca angka yang
3.3.3 Salinitas (‰)
Salinititas perairan diukur dengan menggunakan refraktometer yaitu dengan
cara sampel air diambil dengan menggunakan pipet tetes. Pada permukaan dasar yang
telah dibersihkan diteteskan 1 tetes, ditutup dan dibaca skala penunjuk angka.
3.3.4 Oksigen Terlarut atau Disolved Oxygen (DO) (mg/l)
Disolved Oxygen (DO) diukur dengan menggunakan metoda winkler. Sampel
air diambil dari dasar perairan dan dimasukkan ke dalam botol winkler kemudian
dilakukan pengukuran oksigen terlarut. Dengan menggunakan reagen-reagen kimia
yaitu MnSO4, KOHKI, H2SO4, Na2S2O3, dan amilum. Alur kerja DO dapat dilihat
pada lampiran A.
3.3.5 BOD5
Pengukuran BOD5 dilakukan dengan menggunakan metoda winkler. Sampel air yang diambil dari dasar perairan dimasukkan ke dalam botol winkler. BOD5 diukur dengan menggunakan reagen-reagen kimia yaitu MnSO4, KOHKI, H2SO4, Na2S2O3, dan amilum. Alur kerja BOD5 dapat dilihat pada lampiran B.
3.3.6 Penetrasi cahaya (cm)
Pengukuran penetrasi cahaya dilakukan dengan menggunakan keping secchi
yang dimasukkan kedalam air hingga tidak nampak dari permukaan, kemudian diukur
3.3.7 Kejenuhan Oksigen ( %)
Secara keseluruhan pengukuran faktor fisik kimia berserta satuan dan alat yang
digunakan dapat dilihat pada tabel 3.1
Tabel 3.1 Alat dan Satuan yang Dipergunakan dalam Pengukuran Faktor Fisik Kimia Perairan
2 Penetrasi Cahaya Cm Keping Seechi In-situ
3 Intensitas Cahaya Candela Lux Meter In-situ
4 pH air - pH air In-situ
Data Fauna Echinodermata yang diperoleh dihitung nilai kepadatan populasi,
kepadatan relatif, frekuensi kehadiran, indeks diversitas Shannon-Wienner, indeks
equitabilitas dan indeks similaritas dengan persamaan menurut Michael (1984) dan
3.4.1 Kepadatan Populasi (K)
dengan: ni = jumlah individu spesies 1 ∑N = total individu seluruh spesies
3.4.4 Indeks Diversitas Shannon – Wienner (H’)
H’= -
∑
pilnpidimana :H’ = indeks diversitas Shannon-Wienner pi = proporsi spesies ke-i
In = logaritma nature
dengan nilai H’: 0<H’<2,302 = keanekaragaman rendah 2,302<H’<6,907 = keanekaragaman sedang
H’>6,907 = keanekaragaman tinggi
3.4.5 Indeks Equitabilitas (E)
Indeks equitabilitas (E) =
max H
H'
dimana :H’ = indeks diversitas Shannon-Wienner H maks = keanekaragaman spesies maksimum
= In S (dimana S banyaknya spesies) dengan nilai E berkisar antara 0-1
3.4.6 Indeks Similaritas (IS)
IS = x100%
b a
2c
+
dengan: a = jumlah spesies pada lokasi a b = jumlah spesies pada lokasi b
c = jumlah spesies yang sama pada lokasi a dan b
Bila: IS = 75 – 100% : sangat mirip IS = 50 – 75% : mirip
IS = 25 – 50% : tidak mirip
BAB 4
HASIL DAN PEMBAHASAN
4.1 Parameter Biotik
Hasil penelitian yang telah dilakukan terdapat 13 spesies Echinoermata, terdiri dari: 1
filum, 4 kelas, 5 ordo, 7 famili, 11 genus dan 13 spesies.
Tabel 4.1 Klasifikasi dan Jenis Echinodermata yang didapat pada Stasiun Penelitian Filum Kelas Ordo Famili Genus Spesies 1
Echinodermata
Asteroidea Spinulosida Acanthasteridae Achantaster A. plancii
2 Valvatida Ophidiasteridae Linkia L. laevigata
3 Protoreaster P. nodosus
4 Oreasteridae Culcita Culcita sp
5 Crinoidea Comatulida Colobometridae Colobometra Colobometra sp
6 Comasteridae Comanthus Comanthus sp
7 Echinoidea Cidaroidea Diadematoidae Diadema Diadema sp
8 Echinometridae Echinometra Echinometra sp
9 Holothuroidea Aspidochirotida
Holothuroidae Actinopyga A.lecanora
10 Holothuria H. atra
11 H.edulis
12 Holothuria sp
13 Pearsonothuria P. graffei
Deskripsi jenis Echinodermata yang ditemukan menurut Patrick L. C. & Charles A.
(1995) dan Nontji (1993) , seperti yang tertera dibawah ini:
a. Achantaster plancii (kaki seribu)
Hewan ini dari kelas Asteroidea atau sering disebut kaki seribu yang memiliki
lengan banyak dan seluruh tubuhnya ditutupi oleh duri. Warna tubuh dominan biru
dan bagian tepi berwarna hitam (Gambar 4.1.1 Achantaster plancii). Hewan ini
ditemukan menempel di terumbu karang atau di bawah karang berbentuk meja.
Menurut Patrick L. C. & Charles A. (1995), bintang laut berlengan banyak dan
tubuh hewan ini kira-kira 20-30 cm. Lengannya berjumlah kira-kira 10-20 buah.
Hewan ini memakan polip karang mati atau yang hidup.
(Foto dilapangan) (Foto Patrick L. C. & Charles A.)
Gambar 4.1.1 Achantaster plancii
b. Culcita sp (bantal raja)
Jenis bintang laut yang tidak memiliki lengan, berbentuk seperti segi lima.
Tubuh tebal seperti roti. Warna tubuh hewan ini kuning kecoklatan (Gambar 4.1.2
Culcita sp). Menurut Patrick L. C. & Charles A. (1995), pada saat muda memiliki
bentuk tubuh yang berbeda yaitu pipih, setelah dewasa berbentuk seperti segi lima
dengan diameter kira-kira 20 cm. Hidup di terumbu karang, pasir dan padang lamun.
c. Linkia laevigata (bintang laut)
Berbentuk bintang yang memiliki lengan lima dan warna sangat menjolok atau
kontras dengan lingkungan yaitu coklat muda, coklat tua, biru, jingga. Tiap lengan
berbentuk memanjang dan langsing. Permukaan tubuh halus dan tidak terdapat
tonjolan-tonjolan (Gambar 4.1.3 Linkia laevigata). Nontji (1993), tiap lengan
berbentuk memanjang dan langsing sampai kira-kira 15 cm atau lebih, hidup di
terumbu karang, pasir dan padang lamun.
Gambar 4.1.3 Linkia laevigata (Foto dilapangan)
d. Protoreaster nodosus (bintang laut)
Berbentuk bintang lengan lima dan tergolong besar. Warna coklat kemarahan
dan terdapat tonjolan-tonjolan berwarna hitam. Ujung setiap lengan berwarna hitam
(Gambar 4.1.4 Protoreaster nodosus). Nontji (1993), diameter tubuhnya kira-kira 10
cm. Ukuran hewan ini lebih besar dibanding dengan Linkia laevigata. Hidup di
terumbu karang, pasir dan padang lamun.
Gambar 4.1.4 Protoreaster nodosus (Foto Patrick L. C. & Charles A.)
e. Colobometra sp (lili laut)
Memiliki bentuk tubuh yang indah apabila hewan ini berenang. Warna tubuh
hitam (Gambar 4.1.5 Colobometra sp). Menurut Nontji (1993), memiliki lengan yang
banyak kira-kira sebanyak 12 buah atau lebih. Hewan ini berpegang pada batu atau
tumbuhan dengan alat yang disebut dengan cirri dan hidup di terumbu karang, pasir
dan padang lamun.
Gambar 4.1.5 Colobometra sp (Foto dilapangan)
f. Comanthus sp (lili laut)
Memiliki bentuh tubuh yang indah apabila hewan ini berenang. Warna kuning
dan ujung cirrinya berwarna biru (Gambar 4.1.6 Comanthus sp). Menurut Nontji
(1993), memiliki lengan yang banyak kira-kira sebanyak 12 buah atau lebih. Hewan
ini berpegang pada batu atau tumbuhan dengan alat yang disebut dengan cirri. Hidup
menempel pada terumbu karang, tumbuhan, pasir dan padang lamun.
g. Diadema sp (bulu babi)
Bulu babi (Diadema sp), tubuh berwarna hitam dan ada juga berwarna putih.
Seluruh tubuhnya ditutupi dur i yang tajam, lancip dan sangat rapuh (Gambar 4.1.7
Diadema sp). Hidup berkelompok, satu kelompok dapat terdiri atas 20-40 individu
atau lebih. Nontji (1993), seluruh tubuhnya ditutupi duri yang berukuran kira-kira
mencapai 10 cm. Makanannya alga dan partikel organik atau detritus. Biasanya hidup
berkelompok untuk dapat saling melindungi terhadap ancaman musuh-musuhnya dan
mungkin juga untuk lebih memudahkan terjadinya fertilisasi. Ada juga beberapa ikan
kecil yang senang hidup untuk berlindung disela duri-duri bulu babi.
(Foto dilapangan) (Foto Patrick L. C. & Charles A.)
Gambar 4.1.7 Diadema sp
h. Echinometra sp (bulu babi)
(Foto dilapangan) (Foto Patrick L. C. & Charles A.)
Echinometra sp mirip dengan Diadema sp, bedanya hewan ini memiliki duri
lebih pendek, gemuk dan pendek dibanding Diadema sp. Tubuh berwarna hitam dan
duri berwarna putih (Gambar 4.1.8 Echinometra sp). Menurut Patrick L. C. & Charles
A. (1995), makanannya alga dan partikel organik atau detritus. Hidup di terumbu
karang, karang mati dan batu.
i. Holothuria atra (teripang)
Tubuh berbentuk bulat panjang atau silindris, dengan mulut pada salah satu
ujungnya dan dubur pada salah satu ujungnya. Terdapat tentakel-tentakel bercabang
yang mengelilingi mulut. Warna hitam (Gambar 4.1.9 Holothuria atra). Menurut
Patrick L. C. & Charles A. (1995), tubuh berotot tebal, lembek atau licin, kulitnya
halus. Sering dijumpai membenamkan diri dalam pasir atau dipermukaan pasir,
panjang tubuh kira-kira sekitar 10-30 cm.
Gambar 4.1.9 Holothuria atra ((Foto Patrick L. C. & Charles A.)
j. Holothuria edulis (teripang pasir)
Tubuh berbentuk bulat panjang atau silindris, dengan mulut pada salah satu ujungnya
dan dubur pada salah satu ujungnya. Warna tubuh bagian atas warna hitam sedangkan
bagian bawah warna merah (Gambar 4.1.10 Holothuria edulis). Menurut Patrick L.
C. & Charles A. (1995), terdapat tentakel-tentakel bercabang yang mengelilingi mulut.
diri dalam pasir, dipermukaan pasir padang lamun dan terumbu karang dan
panjangnya kira-kira sekitar 10-30 cm.
Gambar 4.1.10 Holothuria edulis (Foto dilapangan)
k. Actinopyga lecanora (teripang)
Tubuh berbentuk bulat panjang atau silindris, dengan mulut pada salah satu
ujungnya dan dubur pada salah satu ujungnya. Terdapat tentakel-tentakel bercabang
yang mengelilingi mulut. Warna coklat dan terdapat bercak-bercak hitam (Gambar
4.1.11 Actinopyga lecanora). Nontji (1993), tubuh berotot tebal, lembek dan
permukaan kulit kasar dan panjangnya kira-kira sekitar 10-30 cm. Sering dijumpai
membenamkan diri dalam pasir dan dipermukaan pasir padang lamun dan terumbu
karang.
Gambar 4.1.11 Actinopyga lecanora (Foto Patrick L. C. & Charles A.)
Tubuh berbentuk bulat panjang atau silindris dan terdapat mulut pada salah
satu ujungnya dan dubur pada salah satu ujungnya. Tubuh berotot tebal, lembek atau
licin, kulitnya halus. Warna abu-abu dan memiliki garis di punggung atau sisinya
berwarna hitam (Gambar 4.1.12 Holothuria sp). Menurut Patrick L. C. & Charles A.
(1995), terdapat tentakel-tentakel bercabang yang mengelilingi mulut dan panjangnya
kira-kira sekitar 10-30 cm. Sering dijumpai membenamkan diri dalam pasir atau
dipermukaan pasir.
Gambar 4.1.12 Holothuria sp (Foto dilapangan)
m. Pearsonothuria graffei
Tubuh berbentuk bulat panjang atau silindris dan berotot tebal, permukaan
tubuh kasar. Warna abu-abu kekuningan dan bulat-bulat berwarna coklat
(Gambar 4.1.13 Pearsonothuria graffei). Menurut Patrick L. C. & Charles A. (1995),
Dengan mulut pada salah satu ujungnya dan dubur pada salah satu ujungnya. Terdapat
tentakel-tentakel bercabang yang mengelilingi mulut. Sering dijumpai membenamkan
diri dalam pasir, dipermukaan pasir padang lamun dan terumbu karang. Panjangn
kira-kira sekitar 10-30 cm.
4.1.1 Nilai Kepadatan, Kepadatan Relatif, dan Frekuensi Kehadiran Echinodermata.
Dari hasil penelitian yang telah dilakukan pada masing-masing stasiun penelitian
diperoleh nilai Kepadatan Populasi (ind./m2), Kepadatan Relatif (%) dan Frekuensi Kehadiran (%) pada setiap stasiun penelitian pada Tabel 4.2 berikut:
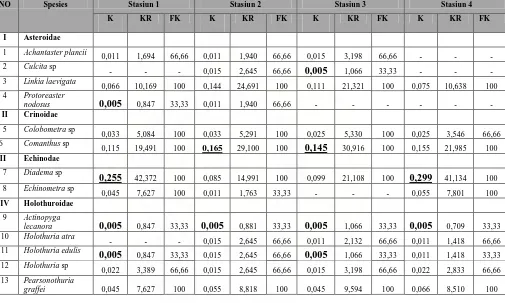
Tabel 4.2 Nilai Kepadatan Populasi (ind./m2), Kepadatan Relatif (%) dan Frekuensi Kehadiran (%) pada setiap stasiun penelitian
NO Spesies Stasiun 1 Stasiun 2 Stasiun 3 Stasiun 4
Ket: Stasiun 1: Daerah terkena tsunami Stasiun 2: Daerah kontrol.
Stasiun 3: Daerah tempat wisata
Stasiun 4: Daerah terkena tsunami dan dekat pemukiman masyarakat
Hasil perhitungan pada stasiun 1 mendapatkan bahwa spesies Diadema sp
memiliki nilai Kepadatan, Kepadatan Relatif dan Frekuensi Kehadiran tertinggi
sebesar 0,255 ind/m2 (K), 42,372% (KR) dan 100% (FK). Nilai Kepadatan, Kepadatan Relatif dan Frekuensi Kehadiran yang terendah pada 3 spesies yaitu Protoreaster
ini, karena hewan ini menyukai terumbu karang yang rusak atau mati dan batuan.
Menurut Romimohtarto & Juwana (2001), habitat hewan ini adalah koloni karang
mati, pasir, batu dan terumbu karang. Pada stasiun ini tidak ada ditemukan Culcita sp
dan Holothuria atra, hal ini karena rendahnya persen tutupan karang pada stasiun ini,
selain itu hewan ini sering hidup pada substrat yang berupa rumput laut atau padang
lamun sedangkan substrat di tempat ini berupa batu, pasir, koloni karang. Kondisi
lingkungan di stasiun ini memiliki terumbu karang yang rusak karena pengaruh dari
tsunami yang terjadi pada tahun 2004, tidak terdapat aktivitas masyarakat atau bahan
pencemar yang merusak kondisi lingkungannya. Kondisi faktor fisik kimia perairan
masih tergolong alami dan tidak terdapat bahan-bahan pencemar yang merusak
lingkungan.
Hasil pada stasiun 2 mendapatkan bahwa spesies Comanthus sp memiliki nilai
Kepadatan, Kepadatan Relatif dan Frekuensi Kehadiran tertinggi sebesar 0,165 ind/m2 (K), 29,100% (KR) dan 100% (FK). Nilai Kepadatan, Kepadatan Relatif dan
Frekuensi Kehadiran yang terendah pada spesies Actinopyga lecanora, sebesar 0,005
ind/m2 (K), 0,881% (KR) dan 33,33% (FK). Kondisi lingkungan stasiun ini merupakan kontrol, dimana tidak terdapat aktivitas masyarakat atau bahan pencemar
yang merusak kondisi lingkungannya dan memiliki terumbu karang yang baik.
Kondisi faktor fisik kimia perairan (Tabel 4.6) pada daerah ini masih tergolong alami
dan cocok untuk pertumbuhan Echinodermata dan tidak ditemukan bahan-bahan
pencemar yang mempengaruhi perairan ini. Rendahnya Actinopyga lecanora
ditemukan pada stasiun ini karena penelitian dilakukan pada siang padahal hewan ini
aktif pada malam hari. Menurut Brotowidjoyo (1994), teripang (Actinopyga lecanora)
ini jarak ditemukan karena memiliki sifat bergerak/merayap lambat sekali, biasanya
bersembunyi dalam lubang atau celah batu atau menanamkan diri dalam lumpur atau
pasir laut dan hanya bagian posteriornya saja yang nampak. Umumnya hewan ini aktif
pada malam hari berkeliaran pada mencari makan.
Hasil perhitungan pada stasiun 3 diperoleh bahwa spesies Comanthus sp
memiliki nilai Kepadatan, Kepadatan Relatif dan Frekuensi Kehadiran tertinggi
lecanora dan Holothuria edulis sebesar 0,005 ind/m2 (K), 1,066% (KR) dan 33,33%
(FK). Hal ini karena kondisi faktor fisik kimia perairan sesuai bagi pertumbuhan
Comanthus sp misalnya suhu, pH, Intensitas Cahaya dan substrat dasar perairan
berupa pasir, batu dan koloni karang. Stasiun ini merupakan tempat wisata, terdapat
tempat penginapan dan tempat menyelam wisatawan. Daerah ini masih memiliki
terumbu karang yang baik karena aktivitas masyarakat tidak terlalu berpengaruh
terhadap lingkungan. Menurut Koesbiono (1979), kadar organik pada substrat adalah
satu hal yang sangat berpengaruh pada kehidupan makrozoobenthos, dimana kadar
organik ini adalah sebagai nutrisi bagi makrozoobenthos tersebut. Pada perairan yang
kaya bahan organik, umumnya terjadi peningkatan populasi hewan benthos.
Di daerah ini tidak ditemukan Protoreaster nodosus dan Echinometra sp. Hal
ini karena Protoreaster nodosus memiliki bentuk tubuh yang unik dan warna yamg
menarik sehingga banyak masyarakat yang mengambil. Selain itu hewan ini sering
hidup pada substrat yang berupa rumput laut atau padang lamun sedangkan substrat di
tempat ini berupa batu, pasir, koloni karang. Romimohtarto & Juwana (2001),
menyatakan hewan ini peka terhadap lingkungan, tetapi mempunyai kemampuan
regenerasi tinggi sehingga dapat menyembuhkan diri jika ada luka.
Hasil perhitungan pada stasiun 4 mendapatkan bahwa spesies Diadema sp
memiliki nilai Kepadatan, Kepadatan Relatif dan Frekuensi Kehadiran tertinggi,
sebesar 0,299 ind/m2 (K), 41,134 % (KR) dan 100% (FK). Nilai Kepadatan,
Kepadatan Relatif dan Frekuensi Kehadiran yang terendah pada Actinopyga lecanora
sebesar 0,005 ind/m2 (K), 0,709% (KR) dan 33,33% (FK). Jenis Achantaster plancii,
Culcita sp dan Protoreaster nodosus tidak ada ditemukan pada lokasi ini karena
substrat yang dijumpai berupa karang mati, batu, pasir dan sedikit dijumpai karang
hidup sedangkan habitat Echinodermata adalah terumbu karang. Kondisi lingkungan
pada stasiun ini, memiliki terumbu karang yang rusak (kategori buruk). Rusaknya
terumbu karang pada daerah ini bukan karena pengaruh Diadema sp yang banyak,
tetapi karena pengaruh dari tsunami yang terjadi pada tahun 2004 dan terdapat
aktivitas masyarakat seperti pemukiman penduduk, keramba udang, penggunaan kapal
mesin sehingga membuat terumbu karang rusak. Menurut Wargadinata (1995),
lingkungan yang besar dan drastis atau dapat mentolerir faktor lingkungan yang
sangat ekstrim.
Hasil penelitian yang dilakukan bila dibandingkan dengan penelitian Eddy Y.
(2003) yang berada di Aceh Selatan Nanggroe Aceh Darussalam maka diperoleh
keanekaragaman echinodermata di daerah ini lebih banyak dibanding perairan P.
Rubiah. Daerah Aceh Selatan ditemukan sebanyak 20 spesies dari 5 kelas
Echinodermata sedangkan di P. Rubiah terdapat 13 spesies dari 4 kelas
Echinodermata. Rendahnya Echinodermata di P. Rubiah karena pengaruh bencana
tsunami yang melanda tempat ini tahun 2004, dimana terjadi kerusakan terumbu
karang sebagai habitat dari hewan ini sedangkan daerah Aceh Selatan memiliki
lingkungan yang masih baik untuk pertumbuhan Echinodermata.
4.1.2 Indeks Keanekaragaman (H’), Indeks Keseragaman (E) dan Indeks Persen Tutupan Karang (r) pada Setiap Stasiun Penelitian
Dari hasil penelitian yang telah dilakukan pada masing-masing stasiun
penelitian diperoleh nilai Indeks Keanekaragaman (H’), Indeks Keseragaman (E) dan
Indeks Persen Tutupan Karang (r) pada setiap stasiun penelitian pada Tabel 4.3
berikut:
Tabel 4.3 Indeks Keanekaragaman (H’), Indeks Keseragaman (E) dan Indeks Persen Tutupan Karang (r) pada Setiap Stasiun Penelitian
Indeks Stasiun 1 Stasiun 2 Stasiun 3 Stasiun 4
Keanekaragaman (H') 1,764 1,859 1,854 1,720
Persen Tutupan Karang (r) 50,82% 73,10% 59,68% 16,28%
Keseragaman (E) 0,709 0,748 0,773 0,692
Dari hasil perhitungan didapat Indeks Keanekaragaman (H’) tertinggi terdapat
pada stasiun 2 sebesar 1,859 dan terendah pada stasiun 4 sebesar 1,720. Tingginya
nilai Indeks Keanekaragaman pada stasiun 2, karena daerah merupakan kontrol dan
tidak ditemukan aktivitas masyarakat atau bahan pencemar dan memiliki terumbu
karang yang baik. Stasiun 4 memiliki terumbu karang yang rusak akibat dari bencana
tsunami yang melanda tempat ini tahun 2004 dan merupakan daerah pemukiman
keanekaragaman spesies yang tinggi apabila terdapat banyak spesies dengan jumlah
individu masing-masing spesies yang relatif merata. Dari nilai Indeks
Keanekaragaman yang diperoleh berkisar antara 1,720-1,859 dapat digolongkan
bahwa pada daerah ini memiliki nilai keanekaragaman rendah.
Hasil penelitian Taripar N. & Fitria M. (2009) di Pulau Rubiah diperoleh
persen tutupan terumbu karang yang tertinggi diperoleh pada stasiun 2 sebesar 73,10%
dan terendah pada stasiun 4 sebesar 16,28%. Dari hasil penelitian diatas dapat dilihat
hubungan keanekagaman Echinodermata dengan persen tutupan terumbu karang.
Persen tutupan karang yang tinggi akan memiliki keanekaragaman Echinodermata
yang tinggi seperti pada stasiun 3. Pada stasiun 4 memiliki persen terumbu karang
yang rendah (kategori buruk), memiliki keanekaragaman yang sedikit. Kondisi faktor
fisik kimia perairan ini tergolong baik dan cocok untuk pertumbuhan terumbu karang,
misalnya suhu, pH, penetrasi cahaya, salinitas dan lain sebagainya (Tabel 4.6).
Rusaknya terumbu karang di daerah penelitian ini khususnya pada stasiun 1 dan 4
karena bencana alam (Tsunami) dan pengaruh aktifitas masyarakat. Menurut
Keputusan Menteri Lingkungan Hidup No. 4 Tahun 2001, terumbu karang di
kategorikan; buruk (0-24,9 %), sedang (25-49,9 %), baik (50-74,9 %) dan baik sekali
(75- 100 %).
Indeks keseragaman (E) yang diperoleh dari 4 stasiun penelitian berkisar
0,773 – 0,692 dengan indeks keseragaman (E) tertinggi pada stasiun 3 sebesar 0,773
dan terendah pada stasiun 4 sebesar 0,692. Rendahnya nilai keseragaman pada stasiun
4 karena ditemukan beberapa spesies yang mendominasi yaitu Diadema sp karena
memiliki terumbu karang yang rusak sehingga penyebaran tidak marata. Krebs (1985),
menyatakan indeks keseragaman (E) berkisar 0 – 1. Indeks keseragaman yang tinggi
menunjukkan bahwa pembagian jumlah individu pada masing-masing spesies merata
dan sebaliknya jika Indeks Keseragaman semakin kecil maka keseragaman suatu
4.1.3 Indeks Similaritas
Dari hasil penelitian yang telah dilakukan pada masing-masing stasiun penelitian
diperoleh nilai indeks Similaritas (IS) seperti pada tabel berikut:
Tabel 4.4 Nilai Indeks Similaritas (IS) atau Kesamaan pada Stasiun Penelitian
Stasiun 1 2 3 4
1 - 91,66% 81,81% 90,00%
2 - - 91,66% 90,90%
3 - - - 80,00%
4 - - - -
Dari Tabel 4.4 dapat dilihat hasil pengamatan menunjukkan bahwa nilai indeks
similaritas (IS) yang didapat pada stasiun penelitian bervariasi dan berkisar antara
81,81% - 91,66%. Hasil pengamatan menunjukkan bahwa empat stasiun memiliki
nilai IS kriteria sangat mirip (75-100%). Kemiripan ini karena faktor ekologis dan
faktor fisik kimia yang hampir sama antara stasiun sehingga menyebabkan
terdapatnya kesamaan nilai spesies benthos pada stasiun tersebut.
4.2 Parameter Abiotik
Berdasarkan pengukuran faktor fisik kimia perairan pada masing-masing stasiun
pengamatan di Kawasan Perairan Pulau Rubiah Nanggroe Aceh Darussalam diperoleh
rata-rata seperti Tabel 4.6 dibawah ini:
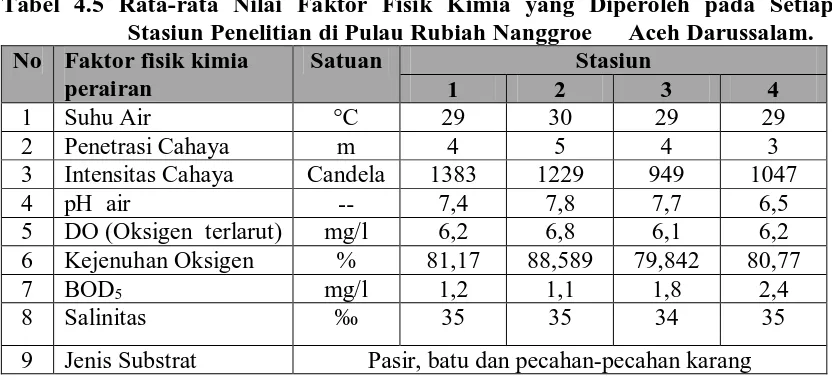
Tabel 4.5 Rata-rata Nilai Faktor Fisik Kimia yang Diperoleh pada Setiap Stasiun Penelitian di Pulau Rubiah Nanggroe Aceh Darussalam.
No Faktor fisik kimia perairan
4.2.1 Suhu
Hasil pengukuran suhu pada 4 stasiun penelitian, berkisar 29-30 °C. Hal ini
menunjukkan bahwa temperatur perairan P. Rubiah masih dalam kisaran normal untuk
perairan tropis. Ini disebabkan karena daerah penelitian ini masih tergolong alami dan
dilindungi, belum terdapat banyak aktivitas masyarakat yang dapat menimbulkan
pencemaran. Menurut Wells (1954), suhu yang baik untuk pertumbuhan karang adalah
berkisar antara 25- 29°C dan batas minimum suhu berkisar 16-17°C serta batas
maksimum 36°C. Menurut Nontji (1993), bahwa suhu permukaan di perairan
Nusantara umunya berkisar antara 28-31°C. Menurut Romimohtarto & Juwana
(2001), bahwa suhu alami air laut berkisar antara suhu dibawah 0°C sampai 33°C dan
perubahan suhu dapat memberi pengaruh besar terhadap sifat-sifat air laut dan
termasuk biota laut.
4.2.2 Penetrasi Cahaya
Penetrasi cahaya yang diperoleh pada 4 stasiun penelitian ini sama yaitu 4-5
meter. Tingginya penetrasi cahaya ini disebabkan karena kondisi perairan di P.
Rubiah masih tergolong baik. Menurut Sastrawijaya (1991), cahaya matahari tidak
dapat menembus dasar perairan jika konsentrasi bahan tersuspensi atau terlarut tinggi,
akibatnya akan mempengaruhi proses fotosintesis di dalam perairan tersebut.
Berkurangnya cahaya matahari disebabkan karena banyak faktor antara lain adanya
bahan yang tidak larut seperti debu, tanah liat maupun mikroorganisme air yang
mengakibatkan air menjadi kotor / tidak jernih.
4.2.3 Intensitas Cahaya
Intensitas cahaya yang tertinggi diperoleh pada stasiun 1 sebesar 1383
Candela dan terendah pada stasiun 3 sebesar 949 Candela. Rendahnya intensitas
cahaya pada stasiun 3 disebabkan karena pada saat pengukuran dilakukan pada pagi
hari, sedangkan pada stasiun 1 dilakukan siang hari, selain ini terdapat banyak pohon
sungai dapat mempengaruhi intensitas cahaya, karena tumbuh-tumbuhan tersebut
mempunyai kemampuan untuk mengabsorbsi cahaya matahari. Bagi organisme air,
intensitas cahaya berfungsi sebagai alat orientasi yang akan mendukung kehidupan
organisme tersebut dalam habitatnya. Faktor cahaya matahari yang masuk dalam
perairan akan mempengaruhi sifat optis air, sebagian cahaya itu akan diabsorbsi dan
sebagian lagi akan dipantulkan ke luar dari permukaan air.
4.2.4 pH air
Derajat keasaman atau kebasaan (pH) tertinggi pada stasiun 2 yaitu 7,8
sedangkan yang paling rendah pada stasiun 4 yaitu 6,5. Rendahnya pH pada stasiun 4
berpengaruh terhadap jenis Echinodermata yang ditemukan, dimana nilai H’, E dan r
rendah. Namun demikian secara keseluruhan nilai pH pada lokasi penelitian masih
dapat mendukung kehidupan makrozoobenthos. Sutrisno (1987), menyatakan pH
optimum untuk spesies makrozoobenthos berkisar 6,0 – 8,0 sedangkan Barus (2004)
menyatakan nilai ideal pH bagi kehidupan organisme air pada umumnya terdapat
antara 7 - 8,5. Kondisi perairan yang sangat basa akan membahayakan organisme
karena akan mengganggu metabolisme dan respirasi, disamping itu nilai pH yang
asam akan menyebabkan mobilitas berbagai senyawa logam berat terutama ion
Aluminium.
4.2.5 Oksigen terlarut ( DO/ Dissolved Oxygen)
Nilai DO yang diperoleh dari 4 stasiun penelitian ini berkisar 6,1-6,8 mg/l.
Nilai DO yang tertinggi pada stasiun 2 yaitu 6,8 mg/l sedangkan terendah pada stasiun
1 sebesar 6,1 mg/l. Menurut Suin (2002), menyatakan bahwa, suhu memiliki peranan
yang besar terhadap kelarutan oksigen galam air, apabila temperatur air naik maka
kelarutan oksigen dalam air menurun. Bersamaan dengan peningkatan aktivitas
metabolisme akuatik, sehingga kebutuhan akan oksigen juga meningkat. Sastrawijaya
(1991), bahwa temperatur mempunyai pengaruh besar terhadap kelarutan oksigen, jika
4.2.6 Kejenuhan Oksigen (%)
Kejenuhan oksigen yang diperoleh dari 4 stasiun penelitian berkisar antara
79,84 – 89,00%. Menurut Barus (2004), menyatakan bahwa disamping pengukuran
konsentrasi biasanya dilakukan pengukuran terhadap tingkat kejenuhan oksigen dalam
air. Hal ini dilakukan untuk mengetahui apakah nilai maksimum atau tidak. Untuk
dapat mengukur tingkat kejenuhan oksigen air, maka diperlukan pengukuran
temperatur dari ekosistem air tersebut. Kehidupan di air dapat bertahan jika ada
oksigen terlarut minimum sebanyak 4 mg/l, selebihnya tergantung pada ketahanan
organisme, derajat keaktifan, kehadiran pencemar, temperatur air dan sebagainya
4.2.7 BOD5 (Biologycal Oxygen Demand)
Hasil BOD5 yang diperoleh di perairan P. Rubiah berkisar antara 1,1- 2,4 mg/l. Nilai BOD5 yang tertinggi pada stasiun 4 yaitu sebesar 2,4 mg/l sedangkan terendah pada stasiun 3 sebesar 1,1 mg/l. Menurut Barus (2002), bahwa nilai BOD menyatakan
jumlah oksigen yang dibutuhkan oleh mikroorganisme aerobik dalam proses
penguraian senyawa organik yang diukur pada suhu 20°C. Pengukuran BOD
didasarkan pada kemampuan mikroorganisme untuk menguraikan senyawa organik,
artinya hanya terhadap senyawa yang mudah diuraikan secara biologis seperti
senyawa yang umumnya terdapat dalam limbah rumah tangga. Brower et al., (1990),
bahwa apabila konsumsi oksigen selama 5 hari berkisar 5 mg/l O2, maka perairan
tersebut tergolong baik. Sebaliknya apabila konsumsi oksigen antara 10-20 mg/l O2
menunjukkan bahwa tingkat pencemaran oleh senyawa organik tinggi.
4.2.6 Salinitas (‰)
Nilai Salinitas yang diperoleh pada 4 stasiun penelitian ini sama yaitu berkisar
34 - 35‰. Nilai salinitas di perairan ini masih tergolong normal seperti yang
dinyatakan oleh Nontji (1986), bahwa, di Samudra umumnya salinitas berkisar antara