ABSTRAK
BIOAKTIVITAS ASAMCIS-EIKOS-9-ENOAT DARIOscillatoriasp. TERHADAPE. coliRESISTENCHLORAMPHENICOL
Oleh
Yulistia Anggraini
Oscillatoria sp. dapat menjadi sumber potensial penghasil senyawa metabolit bioaktif. Hasil uji bioaktivitas awal menunjukkan bahwa fraksi polar dari Oscillatoria sp. berpotensi sebagai senyawa antibakteri terhadap E. coli resisten terhadapchloramphenicol. Isolasi berdasarkan panduan uji bioaktivitas memandu pada isolasi senyawa asam cis-eikos-9-enoat (C20H38O2). Spektrum FTIR menunjukkan karakteristik puncak serapan vibrasi gugus O-H pada daerah 3434,6 dan 2669,0 cm-1;gugus alkil rantai panjang di daerah 2919,7 dan 2849,3 cm-1;dan gugus karbonil di daerah 1702,8 cm-1. Spektrum13C NMR menunjukkan adanya signal padaδC178,7 ppm dari karbon karbonil, δC14,9 dan 22,9 sampai 31,7 ppm dari karbon sp3, serta δC 129,7 dan 130,0 ppm dari karbon sp2. Spektrum 1H NMR menunjukkan adanya signal proton padaδH0,8 ppm (-CH3); δH1,3 sampai 2,4 ppm (-CH2-), dan δH 5,4 ppm (proton pada alkena). Karakteristik ikatan rangkap asamcis-eikos-9-enoat ditunjukkan oleh adanya puncak serapan multiplet pada δH 5,4 ppm dengan J (Hz) = 5,2; 6,1; dan 6,4. Hasil uji bioaktivitas menunjukkan bahwa asamcis-eikos-9-enoat memiliki potensi sebagai antibakteri terhadapE. coliresistenchloramphenicoldengan daya hambat sebesar 7 mm pada dosis 100μg.
ABSTRACT
BIOACTIVITY OF CIS-ICOS-9-ENOIC ACID FROM Oscillatoria sp. AGAINST E. coli RESISTANCE TO CHLORAMPHENICOL
By
YulistiaAnggraini
Oscillatoria sp. could be potential source for bioactive metabolite producer. The bioactivity preliminary test showed that the polar fraction of biomass extract from Oscillatoria sp. has potency as an antibacterial agent against E. coli resistance to chloramphenicol. The bioassay guided separation leads to isolate cis-icos-9-enoic acid (C20H38O2). The FTIR spectrum showed the characteristic vibration peaks of O-H group at 3434.6-2669.0 cm-1 (broadening), alkyl group at 2919.7 and 2849.3 cm-1 (Sharp), and C=O group at 1702.8 cm-1. The 13C NMR spectrum showed the signal at δC 178.7 ppm of carbon carbonyl, δC14.9; 22.9 up to 31.7 ppm of carbon sp3, and δC 129.7 and 130.0 ppm of carbon sp2. The 1H NMR spectrum showed the proton signal at δH 0.8 ppm (-CH3), δH 1.3 up to 2.4 ppm (-CH2), and δH 5.4 ppm (=CH). The double bond characteristic of cis-icos-9-enoic acid is showed by signal 1H NMR at δH 5.4 ppm (m) with J (Hz) = 5.2; 6.1; and 6.4. The result of bioactivity test showed that cis-icos-9-enoic acid has antibacterial potency to against E. coli resistance to chloramphenicol with inhibition zone value 7 mm at 100 μg of dose.
BIOAKTIVITAS ASAMCIS-EIKOS-9-ENOAT DARIOscillatoriasp. TERHADAPE. coliRESISTENCHLORAMPHENICOL
Oleh
YULISTIA ANGGRAINI
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar MAGISTER SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Desa Bakti Negara, Kec. Pakuan Ratu, Kab. Way Kanan
pada tanggal 20 Juli 1988. Penulis merupakan anak pertama dari lima bersaudara,
pasangan Legino S.Pd. dan Siti Musyarofah, S.Pd..
Penulis menyelesaikan pendidikan di SD N 2 Sukoharjo pada tahun 2000, SLTP
N 2 Sukoharjo pada tahun 2003, dan SMA N 3 Kotabumi pada tahun 2006.
Penulis menyelesaikan pendidikan S1 Kimia Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung pada tahun 2012. Penulis kemudian
melanjutkan pendikan ke jenjang Magister di Jurusan Kimia FMIPA Universitas
Lampung pada tahun 2013.
Berbagai kegiatan yang pernah dijalani penulis antara lain menjadi asisten
praktikum Kimia Dasar I dan II, Kimia Organik, di Fakultas MIPA Universitas
Lampung (Selama menjadi menjalani pendidikan S1). Pada tahun 2007-2008
penulis aktif sebagai anggota Himpunan Mahasiswa Kimia (Himaki) FMIPA
Unila dan menjabat sebagai kepala Biro Kesekretariatan pada periode 2008-2009.
Penulis aktif berkarya di Laboratorium Terpadu dan Sentra Inovasi Teknologi
Universitas Lampung pada tahun 2012-2014. Penulis juga pernah aktif dalam
PERSEMBAHAN
Sebuah karya sederhana ini penulis persembahkan
teruntuk:
Ayahanda dan ibunda Tercinta
Yang selalu memberikan kasih sayangnya, dan selalu
mendoakanku dalam sujudnya
Adik-adikku Tersayang
yang selalu menjadi inspirasi dan motivasiku
Guru yang saya hormati dan banggakan, Bapak Andi
Setiawan, Ph.D.
Orang-orang terkasih dan tersayang yang selalu
mendukung
Hidup ini singkat, maka jangan membuatnya lebih singkat lagi
dengan sesuatu yang sia sia
Buat hidupmu sempurna dengan membuat orang di sekitarmu
bahagia. Dan percayalah akan banyak cinta yang datang
menghampiri
Masalah tak seharusnya membuatmu menyerah karena masalah akan
menguatkanmu, jika kamu mau belajar dan mengambil hikmah
Dan ketahuilah bahwa di dalam kesabaran terhadap hal yang engkau
benci terdapat banyak kebaikan. Bahwa pertolongan itu (datang)
setelah kesabaran, dan kelapangan itu (datang) setelah kesempitan
serta bahwa kemudahan itu (datang) setelah kesulitan. (Al Hadist)
(Jika sesuatu digabung dengan yang lain), tidak ada gabungan yang
lebih indah dari kesabaran yang digabung dengan ilmu
SANWACANA
Puji syukur penulis ucapkan ke hadirat Allah SWT atasrahmat dan hidayah-Nya
sehingga penulis dapat menyelesaikan tesis yang berjudul“Bioaktivitas Asam cis-eikos-9-enoat dariOscilatoriasp. TerhadapE. coliResisten Chloramphenicol”.
Atas terselesaikannya tesis ini penulis juga mengucapkan terimakasih kepada:
1. Prof. Suharso, Ph.D., selaku Dekan FMIPA Unila.
2. Bapak Andi Setiawan, Ph.D., selaku pembimbing 1 sekaligus
Pembimbing Akademik yang telah dengan sabar dan penuh perhatian
memberikan arahan, bimbingan, ilmu, dan dukungan dalam menyelesaikan
studi dan penelitian.
3. Dr. Noviany, M.Si. selaku pembimbing II yang selalu memberikan
nasihat, kritik, dan saran kepada penulis selama menyelesaikan tesis.
4. Prof. Dr. Tati Suhartati, M.S. selaku penguji utama pada ujian tesis.
Terimakasih atas kritik dan saran yang telah diberikan.
5. Staf FMIPA Unila, khususnya staf jurusan Kimia FMIPA Unila.
6. Staf serta rekan-rekan di laboratorium Terpadu dan Sentra Inovasi
Teknologi Unila.
8. Kedua orang tua dan adik-adik ku tercinta Muchlis Aditya, Novella
Anggraini, Nirmala Anggraini, dan Nirmaya Anggraini yang selalu
memberikan semangat dan dukungan moral.
9. Teman-teman di Program Studi Magister Kimia FMIPA Unila yang saya
banggakan.
10. Sahabat-sahabat terdekat serta rekan-rekan di Laboratorium Terpadu dan
Sentra Inovasi Teknologi Universitas Lampung dan masih banyak lagi
yang tak mungkin disebutkan satu per satu.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan,karena itu kritik
dan saran yang bersifat membangun sangat penulis harapkan. Semoga sedikit ilmu yang tertuang dalam tesis ini bisa bermanfaat bagi kita semua. Amiiin.
Bandar Lampung, Oktober 2015
Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan ... 4
C. Manfaat ... 4
II. TINJAUAN PUSTAKA... 5
A. Mikroalga... 5
1. Klasifikasi Mikroalga... 5
2.Oscilatoriasp... 7
3. Kultur Mikroalga... 8
4. Teknik Pemanenan ... 9
B. Senyawa Metabolit Sekunder ... 9
1. Senyawa Metabolit Bioaktif Mikroalga ... 10
2. Asam Lemak ... 12
C. Resistensi Obat... 14
D. Metode Isolasi Senyawa Bahan Alam ... 17
2. Kromatografi ... 18
2.1 Kromatografi Lapis Tipis ... 18
2.2 Kromatografi Kolom ... 19
2.3 Kromatografi Cair Bertekanan Sedang atauMedium Pressure Liquid Chromatography(MPLC) ... 20
E. Spektroskopi... 22
1.Fourier Transform Infrared(FTIR)... 22
2.Nuclear Magnetic Resonance(NMR)Spectroscopy... 24
3. Spektroskopi NMR 2 Dimensi (2D) ... 27
3.1 DEPT (Distortionless Enhancement by Polarisation Transfer) ... 27
3.2 H-H COSY (Homonuclear Correlated Spectroscopy). 28 3.3 HMBC (Heteronuclear Multiple Bond Coherence) .... 28
3.4 HSQC (Heteronuclear Single Quantum Correlation).. 30
4. Koplingcisdantranspada spektrum1H NMR ... 30
F. Surfaktan ... 31
III. METODE PENELITIAN... 34
A. Waktu dan Tempat Penelitian... 34
B. Alat dan Bahan... 34
C. Prosedur Penelitian ... 35
1. Kultivasi dan PemanenanOscillatoriasp... 35
2. Ekstraksi... 36
3. Uji Bioaktivitas... 37
4. Isolasi dan Pemurnian Senyawa Bioaktif ... 37
5. Karakterisasi ... 38
5.3 Analisis Spektroskopi NMR... 38
IV. HASIL DAN PEMBAHASAN... 39
A. Kultivasi dan PemanenanOscillatoriasp... 39
B. Ekstraksi... 41
C. Uji Bioaktivitas ... 42
D. Isolasi dan Pemurnian Senyawa Bioaktif ... 43
E. Analisis Spektroskopi... 48
V. KESIMPULAN DAN SARAN... 54
A. Kesimpulan ... 54
B. Saran ... 54
DAFTAR PUSTAKA... 56
LAMPIRAN ... 63
Lampiran 1 ... 63
Lampiran 2 ... 66
Lampiran 3 ... 68
Lampiran 4 ... 75
DAFTAR TABEL
Tabel Halaman
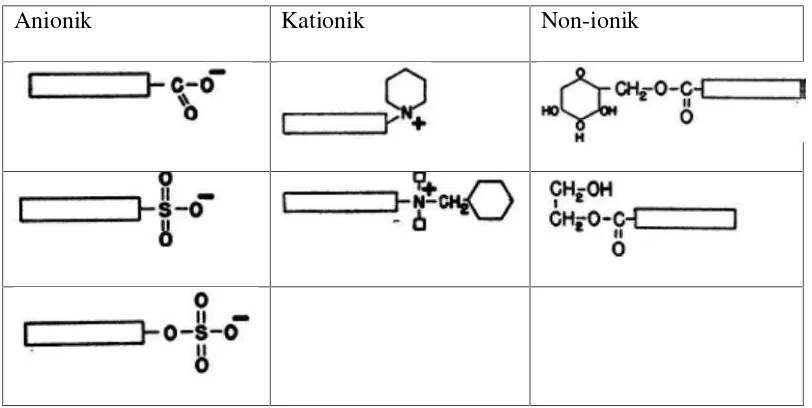
1. Contoh kelompok senyawa surfaktan ... 33
2. Zona hambat fraksi F1-F6 terhadapE. coliresisten ... 47
3. 1H dan13C NMR (500 MHz) senyawa F2.2/3, dalam pelarut
DAFTAR GAMBAR
Gambar Halaman
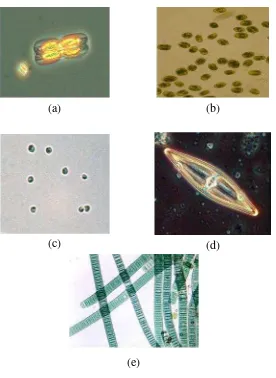
1 Beberapa spesies mikroalga dari beberapa kelas berbeda ... 6
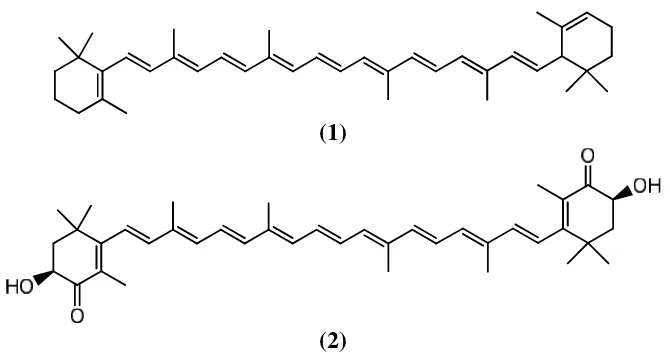
2 Beberapa contoh senyawa metabolit dari mikroalga ... 11
3 Senyawa antibakteri dariOscillatoria redeki... 11
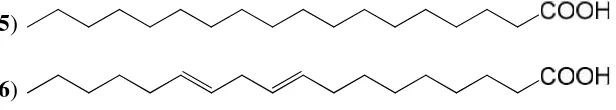
4 Contoh struktur asam lemak jenuh (5) Asam stearat dan asam lemak tak jenuh (6) Asam linoleat ... 13
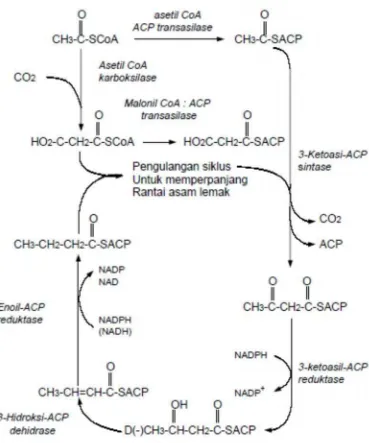
5 Lintasan biosintesis asam lemak ... 14
6 Sistem MPLC... 20
7 Skema contoh interaksi peptida dengan fase diam... 21
8 Skema alat Spektrometer NMR... 24
9 Kopling jarak jauh resonansi karbon terprotonasi... 29
10 Morflogi Oscillatoria sp. dikultivasi pada sistem terbuka (perbesarn 400 X)... 40
11 Hasil uji bioaktivitas ekstrak kasarOscillatoriasp. ... 43
12 Hasil uji KLT ekstrak kasar OB0605 pada plat C18, eluen MeOH-air (9-1)... 44
13 Identifikasi golongan senyawa yang terdapat pada fraksi F1-F6... 45
14 Hasil Uji KLT F1-F3 dengan pereaksi serium sulfat... 46
16 Spektrum FTIR senyawa F2.2/3... 49
17 Struktur parsial senyawa F2.2/3 berdasarkan korelasi 1H-1H
COSY dan HMBC ... 51
BAB I. PENDAHULUAN
A. Latar Belakang
Selama dua dekade terakhir, upaya industri farmasi mendapatkan sumber bahan
alam lebih difokuskan pada potensi mikroorganisme seperti bakteri, fungi, dan
sianobakteria (Liuet al., 2014; Tareqet al., 2014; Pannoet al., 2011; Gutierez,
2008; Babu and Wu, 2008; Daset al., 2006). Sebagaimana diketahui, sebagian
besar senyawa bahan aktif obat yang dipasarkan saat ini (60 % untuk kanker dan
75 % untuk penyakit infeksi) bersumber dari bahan alam. Sejalan dengan
perkembangan teknologi, industri farmasi memanfaatkan teknologi high
throughput screening systems,genomics and bioinformatic tools,rational design
and combinatorial chemistryuntuk mendapatkan senyawa bioaktif baru. Namun
pada kenyataanya, jumlah senyawa baru yang dapat dipasarkan sebagai obat
dalam rentang 9 tahun (1996-2005) menurun dari 53senyawa menjadi 26
senyawa. Berdasarkan pertimbangan aspek finansial, saat ini industri farmasi
menghabiskan dana antara 500-2000 juta US dolar untuk mendapatkan senyawa
obat baru hingga bisa dipasarkan. Sebagai konsekuensinya, jumlah obat-obat baru
yang dapat dipasarkan cenderung relatif lebih sedikit (Singhet al., 2011). Di sisi
2
virus(HIV)–acquired immune deficiency Syndrome(AIDS) terus meningkat
dengan cepat.
Saat ini hanya sepertiga obat-obatan di pasar yang masih efektif digunakan. Hal
ini disebabkan karena meningkatnya resistensi penyakit. Dengan demikian,
identifikasi senyawa baru sangat dibutuhkan untuk pengembangan obat baru.
Untuk memenuhi kebutuhan obat baru serta menurunkan biaya, salah satu hal
yang perlu dipertimbangkan adalah penapisan mikroorganisme yang potensial
seperti sianobakteria (Thomas and Kim, 2013; Meickle, 2010). Sebagaimana
diketahui, manfaat sianobakteria pertama kali dikenal pada tahun 1500 SM ketika
Nostocsp. digunakan untuk mengobati beberapa jenis penyakit kanker dan radang
sendi. Namun kajian sianobakteria secara intensif dengan pendekatan modern
baru dimulai pada tahun 1990-an. Beberapa contoh sianobakteria yang telah
dikaji secara intensif antara lainNostocsp.,Spirulinasp.,Lyngbyasp., dan
Oscillatoriasp. (Singhet al., 2011)
Oscillatoriasp. merupakan salah satu kelompok mikroalga sianobakteria yang
dapat ditemukan dalam ekositem dan habitat laut yang unik. Oscillatoriasp.
dapat tersebar bebas di perairan atau berasosiasi dengan biota laut lainnya, seperti
terumbu karang dan sponga (Guiry, 2014; Leeet al., 2001). Adanya asosiasi
antaraOscillatoriasp. dengan biota laut lainnya membuktikan bahwaOscillatoria
sp. mempunyai sistem pertahanan yang unik sehingga memungkinkan
Oscillatoriasp. laut memiliki kerangka struktur senyawa metabolit yang unik,
3
digunakan sebagai kandidat obat dalam penanganan penyakit yang resisten
terhadap antibiotik (Sjogren, 2006).
Resistensi penyakit merupakan salah satu masalah yang cukup serius dalam dunia
kesehatan. Menurut US Department of Health and Human Services ( 2013) dalam
setiap tahun lebih dari dua juta penduduk Amerika menderita infeksi penyakit
yang sudah resisten terhadap beberapa kelompok antibiotik. Berbagai upaya terus
dilakukan untuk menangani masalah tersebut, salah satunya adalah dengan
pencarian antibiotik baru.
Terkait dengan masalah pencarian obat baru dalam penanganan penyakit yang
resisten terhadap antibiotik, pencarian senyawa bioaktif dariOscillatoriasp.
dengan struktur dan/atau bioaktivitas baru dapat dijadikan sebagai salah satu
kandidat yang menjanjikan. Beberapa penelitian bahkan menggunakan program
komputer untuk memudahkan dalam identifikasi dan evaluasi bioaktivitas
senyawa bioaktif yang sudah diketahui guna mengembangkan senyawa antibiotik
(Amaralet al., 2012). Namun beberapa permasalahan, seperti teknik yang rumit
serta bahan kimia dan peralatan yang mahal, masih menjadi kendala dalam
sintesis senyawa bioaktif. Oleh karena itu, isolasi senyawa bioaktif dari
Oscillatoriasp., dapat menjadi pilihan baru dalam pencarian senyawa antibiotik
untuk menangani masalah resistensi tersebut. Pada penelitian ini, uji bioaktivitas
dilakukan terhadap bakteriE.coliyang resisten terhadap antibiotik
4
B. Tujuan
Tujuan dilakukannya penelitian ini antara lain untuk
1) Mendapatkan senyawa bioaktif dari mikroalgaOscillatoriasp.yang memiliki
bioaktivitas melawan mikrobaE. coli.yang telah resisten terhadap antibiotik
chloramphenicol.
2) Mengkarakterisasi struktur senyawa bioaktif dariOscillatoriasp.yang
memiliki bioaktivitas sebagai antibakteri.
C. Manfaat
Hasil dari penelitian ini tentunya akan bermanfaat sebagai informasi awal
mengenai potensi senyawa bioaktif dariOscillatoriasp. sebagai sumber antibiotik
baru yang nantinya dapat digunakan untuk pengembangan dalam kajian bidang
ilmu kimia dan farmasi, khususnya dalam pengembangan obat untuk penyakit
II. TINJAUAN PUSTAKA
A. Mikroalga
1. Klasifikasi Mikroalga
Alga merupakan mikroorganisme akuatik fotosintesis yang masuk dalam kingdom
protista. Alga menggunakan fotosintesis untuk hidup dan berreproduksi. Alga
dapat diklasifikasikan menjadi beberapa kelas berdasarkan susunan selulernya
dan perbedaan struktur kloroplasnya, misalnya sumber dan jumlah lapisan
membran.
Menurut Lee (1997) dalam Naturwissenchaften (2002) alga digolongkan menjadi
beberapa kelompok berdasarkan susunan membran kloroplasnya. Golongan
pertama adalah golongan yang termasuk sianobakteria prokariotik dimana secara
filogenetik termasuk dalam eubakteria. Golongan kedua merupakan mikroalga
yang kloroplasnya hanya tersusun dari dua lapisan membran pembungkus
kloroplas. Golongan kedua termasuk di dalamnya adalahrhodophyta(alga
merah) dan chlorophyta (greenalga). Golongan ketiga termasuk di dalamnya
6
mikroalga ini tersusun oleh satu tambahan membran pembungkus kloroplas.
Golongan keempat antara laincryptophyta (chryptopytes),chlorara,chianophyta,
heterokontophyta, termasuk diatom danphaeophyceae(alga coklat), dan
haptophyta. Semua alga ini memiliki dua membran tambahan penyusun
kloroplas retikulum endoplastik kloroplastik. Beberapa contoh spesies mikroalga
disajikan dalam Gambar 1.
(a) (b)
(c) (d)
(e)
7
2. Oscillatoria sp.
Oscillatoriasp. merupakan mikroalga yang termasuk dalam golongan
sianobakteria. Menurut Guiry (2011), klasifikasi dariOscillatoriaadalah sebagai
berikut
Kingdom : Protista Divisi : Cyanophyta Kelas : Cyanophyceae Ordo : Oscillatoriales Famili : Oscillatoriaceae Genus : Oscillatoria Spesies :Oscillatoriasp.
SelOscillatoriasp. membentuk filamen panjang yang dapat pecah menjadi
fragmen yang disebut hormogonia. Hormogonia ini dapat tumbuh menjadi
filamen baru yang lebih panjang lagi. Pemecahan filamen biasanya terjadi ketika
ada sel yang mati (necridia). Setiap filamen padaOscillatoriasp. terdiri dari
trikoma yang terbuat dari sel baris. Ujung dari trikoma dapat berosilasi seperti
pendulum (Guiry, 2014). Bentuk morfologi dapat dilihat pada Gambar 1.
Oscillatoriasp. merupakan salah satu kelompok sianobakteria yang berpotensi
menjadi sumber senyawa bioaktif. Sebagai contoh,Oscillatoriasp. merupakan
penghasil daributylated hydroxytoluene(BHT) atau hidroksitoluena terbutilasi
8
(Babu and Wu, 2008). Oscillatoriasp. juga diketahui menghasilkan senyawa
asam lemak yang bersifat sebagai antibakteri (Singhet al., 2011)
3. Kultur Mikroalga
Kultur dapat didefinisikan sebagai suatu lingkungan buatan yang digunakan untuk
pertumbuhan mikroalga. Suatu kultur terdiri dari beberapa komponen antara lain
medium kultur, sel alga, dan udara yang digunakan sebagai media pertukaran CO2
antara media dan atmosfer. Sebagian besar alga yang hidup secara autotropik,
membutuhkan cahaya, aerasi, nutrien dan unsur kelumit untuk pertumbuhannya
melalui proses fotosintesis (Probert and Klaas, 2007). Media umum yang
digunakan untuk pertumbuhan mikroalga adalah media F/2 yang terdiri dari
makronutrien, vitamin, dan unsur kelumit (Anderson, 2005).
Dalam suatu kultur harus diperhatikan parameter fisik seperti cahaya, temperatur,
dan aerasi yang dipergunakan. Suhu yang umum digunakan untuk kultur
mikroalga berada dalam rentang 18-20oC, sementara sistem pencahayaan
digunakan suatu lampufluorescent40 watt dengan panjang 112 cm yang dipasang
horizontal dengan menggunakan siklus gelap:terang (12 jam:12 jam) serta
9
4. Teknik Pemanenan
Ada beberapa teknik yang digunakan pada proses pemanenan mikroalga. Teknik
ini mencakup teknik mikrofiltrasi, pengendapan gravimetri, sentrifugasi dan
flokulasi (Shelef and Sukenik, 1984). Selain teknik tersebut teknik lain yang
digunakan untuk pemanenan mikroalga antara lain dengan ultrasonifikasi (Bosma
et al., 2003). Oscillatoriasp. memiliki ukuran sel yang relatif panjang dan
diameter yang cukup besar (Linet al., 2010) sehingga pemanenan bisa dilakukan
dengan menggunakan kain saring ukuran 380-500 mesh (Vonshak, 2002).
B. Senyawa Metabolit Bioaktif Mikroalga
Metabolit sekunder merupakan senyawa kimia yang terdapat dalam suatu
organisme yang tidak terlibat langsung dalam proses pertumbuhan,
perkembangan, atau reproduksi organisme dan dihasilkan sebagai bentuk adaptasi
organisme terhadap lingkungannya. Fungsi senyawa ini pada suatu organisme di
antaranya untuk bertahan hidup terhadap predator, kompetitor, dan untuk
mendukung proses reproduksi (Sjogren, 2006; Faulkner, 2000). Tanpa senyawa
ini organisme akan menderita kerusakan atau menurunnya kemampuan bertahan
hidup. Beberapa metabolit yang dihasilkan oleh organisme tampaknya
merupakan ciri khas dari tempat organisme itu berada. Pencarian senyawa
metabolit bioaktif baru seringkali difokuskan pada organisme-organisme yang
10
Senyawa metabolit bioaktif umumnya memiliki keragaman struktur yang tinggi
serta kerangka atau susunan struktur yang relatif lebih kompleks dari molekul
sintetik. Mayoritas senyawa ini tergolong dalam satu kelompok kelas,yang
masing-masing memiliki karakteristik struktur khusus tergantung dari cara
terbentuknya di alam (proses biosintesis). Kelas senyawa metabolit sekunder
meliputi poliketida dan asam lemak, terpenoid dan steroid, polifenol,
fenilpropanoid, alkaloid, asam amino dan peptida khusus, serta karbohidrat
tertentu.
1. Senyawa Metabolit Bioaktif Mikrolaga
Senyawa metabolit yang dihasilkan mikroalga memiliki keragaman struktur dan
bioaktivitas. Hampir semua kelas bahan alam dapat dihasilkan oleh mikroalga,
terutama senyawa metabolit yang dicirikan oleh susunan metabolit poliketida dan
peptida (Snyderet al., 2003; Dittmanet al., 2001). Senyawa-senyawa tersebut
diketahui memiliki aktivitas biologis seperti antioksidan, antikanker, antimikroba,
dan antifungi. Beberapa contoh senyawa metabolit bioaktif dari mikroalga dapat
dilihat dalam Gambar 2.
Beberapa senyawa metabolit mikroalga tersebut telah digunakan secara komersil
dalam bidang industri dan kosmetik. Sebagai contoh, senyawa turunan karotenoid
(1) dan astaksantin (2) dari mikroalga laut adalah bahan yang digunakan dalam
11
(1)
(2)
Gambar 2. Beberapa contoh senyawa metabolit dari mikroalga. (1)
Karotenoid (2) astaksantin
(3)
(4)
Gambar 3. Senyawa antibakteri dariOscillatoria redeki(3) α-dimorphecolic acid(4) 13-hydroxy-9Z-11E-octadeca-dienoic
Beberapa kajian lain juga melaporkan aktivitas senyawa dari sianobakteria
sebagai antibakteri. Beberapa contoh senyawa seperticarbamidocyclophanes,
Noscomin, dan senyawa fenolik dariNostocsp. diketahui memiliki aktivitas
sebagai antibakteri (Buiet al., 2007; El-Seekhet al., 2006; Jakiet al., 1999).
Namun informasi mengenai struktur senyawa antibakteri dariOscillatoriasp.
masih sangat terbatas. Contoh senyawa antibakteri dari genusOscillatoriaantara
lain senyawa asam lemak yang bersifat sebagai antibakteri seperti terlihat pada
12
2. Asam Lemak
Struktur asam lemak terdiri dari rantai hidrokarbon alifatik panjang (10-30
karbon) yang memiliki gugus asam karboksilat. Rantai hidrokarbon ini bersifat
nonpolar yang berfungsi untuk menyeimbangkan gugus asam karboksilat yang
bersifat polar. Rantai hidrokarbon asam lemak biasanya berjumlah genap karena
berkaitan denga tambahan dua karbon dari asetil-koenzim A (asetil-CoA) saat
biosintesis asam lemak. Asam lemak dalam makhluk hidup berasal dari hidrolisis
ikatan ester yang berasal dari lemak atau minyak, misalnya trigliserida
(Lehninger, 1982).
Berdasarkan struktur rantai hidrokarbon, asam lemak terdiri dari asam lemak
jenuh (saturated) dan asam lemak tak jenuh (unsaturated). Asam lemak jenuh,
misalnya asam stearat (5), mempunyai rantai hidrokarbon yang lurus dan
berikatan tunggal sedangkan asam lemak tak jenuh, misalnya asam linoleat (6),
memiliki struktur rantai hidrokarbon yang bengkok dan memiliki ikatan rangkap
(Gambar 4). Struktur asam lemak jenuh biasanya lurus dan tersusun secara teratur
satu sama lain, berwujud padat, dan memiliki titik leleh yang lebih tinggi.
Berbeda dengan tipe asam lemak jenuh, tipe asam lemak tak jenuh mempunyai
titik leleh yang lebih rendah, berwujud cair, karena memiliki struktur yang tidak
teratur (Lehninger, 1982 ).
Asam lemak pada tanaman sangat bervariasi dengan berbagai gugus tambahan
asil, epoksi, hidroksi, dan gugus keton atau cincin siklopropena dan siklopentena.
13
struktur isomercisdantrans. Kebanyakan asam lemak tidak jenuh memiliki
struktur isomercisyang kurang stabil daripada struktur isomertransyang lebih
stabil (Connet al.,, 1987). Asam lemak pada tumbuhan umumnya terdapat dalam
bentuk lemak dan minyak. Lemak dan minyak yang tergolong lipida berfungsi
sebagai pembentuk struktur membran sel, sebagai bahan cadangan dan sebagai
sumber energi.
(5)
(6)
Gambar 4. Contoh struktur asam lemak jenuh (5) Asam stearat dan asam
lemak tak jenuh (6) Asam Linoleat.
Asam lemak dibentuk oleh kondensasi berganda unit asetat dari asetil CoA. Pada
reaksi sintesis asam lemak, enzim CoA dan protein pembawa asil (ACP)
mempunyai peranan penting. Enzim-enzim ini berperan membentuk rantai asam
lemak dengan menggabungkan secara bertahap satu gugus asetil turunan dari
asetat dalam bentuk asetil CoA dengan sebanyak n gugus malonil turunan dari
malonat dalam bentuk malonil CoA, seperti ditunjukkan pada reaksi berikut.
(Weete, 1980).
Sintesis asam lemak pada tanaman berlangsung bertahap dengan siklus reaksi
perpanjangan rantai asam lemak hingga membentuk rantai komplit C16 dan C18.
Tahapan reaksi ini dapat ditunjukkan dalam bentuk lintasan biosintesis pada
14
Gambar 5. Lintasan biosintesis asam lemak (Weete, 1980)
C. Resistensi Obat
Resistensi obat adalah suatu perlawanan yang terjadi ketika bakteri, virus, dan
15
sebelumnya menyembuhkan. Menurut US Department of Health and Human
Services (2013) mekanisme terjadinya resistensi dapat terjadi melalui beberapa
cara, antara lain: 1) obat tidak mencapai tempat kerjanya di dalam sel mikroba.
2) aktivasi efflux, yaitu pemompaan obat kembali ke ruang periplasma atau ke
lingkungan luar, 3) inaktivasi obat atau modifikasi obat, yaitu dengan cara
mikroba memproduksi enzim yang merusak antimikroba, 4) mikroba mengubah
binding siteantimikroba.
Saat ini banyak mikroorganisme yang menunjukkan resistensi terhadap beberapa
obat-obatan atau lebih dikenal dengan istilahMulti-Drug Resistance(US
Department of Health and Human Services, 2013). Multi-Drug Resistanceadalah
kondisi yang dapat menyebabkan mikroorganisme penyebab penyakit (bakteri,
virus, fungi, dan parasit) tahan terhadap beberapa antibiotik, sedangkan
mikroorganismenya disebutMulti-Drug Resistant(selanjutnya disingkat MDR).
Beberapa jenis bakteri yang termasuk dalam MDR antara lainStaphylococci,
Enterococci, Gonokokus, Streptococci, Salmonella, serta berbagai bakteri gram
negatif lain danMycobacterium tuberculosis. Contoh utama untuk MDR terhadap
obat antiparasit adalah penyakit malaria (US Department of Health and Human
Services, 2013; Magiorakoset al., 2011; Tapsall, 2001).
Berbagai upaya telah dilakukan untuk menangani masalah resistensi penyakit
terhadap antibiotik. Departemen pelayanan kesehatan yang menangani masalah
penyakit di Amerika melakukan empat tindakan untuk melawan atau mencegah
16
penyebaran resistensi, kedua pelacakan pola resistensi, ketiga penataan layanan
antibiotik: memperbaiki resep dan penggunaan obat, keempat pengembangan
antibiotik baru dan uji diagnosis (US Department of Health and Human Services,
2013). Jika resistensi bakteri terus berkembang, beberapa penyakit mungkin akan
sulit disembuhkan. Oleh karena itu, pencarian senyawa antibiotik baru untuk
penanganan infeksi bakteri sangatlah diperlukan.
Berbagai upaya untuk pengembangan antibiotik baru telah dilakukan, di antaranya
penapisan ekstrak sianobakteria sebagai antibakteri. Namun informasi mengenai
struktur senyawa antibakteri dariOscillatoriasp. masih terbatas. Beberapa
senyawa asam lemak dariOscillatoria redekiHUB051 (Gambar 3) memiliki
aktivitas terhadapB. subtilisSBUG 14,Micrococcus flavusSBUG 16,S. aureus
SBUG 11,S. aureusATCC 25923 (Mundtet al., 2003).
Beberapa contoh senyawa antibakteri lain dari sianobakteria antara lain Noscomin
dariNostoc commune yang memiliki aktivitas terhadapBacillus cereus,
Staphylococcus epidermidis,Escherichia coli. Bhatejaet al.(2006) melaporkan
aktivitas antibakteri dari ekstrakAnabaenaterhadapvancomycin-resistant S.
aureus. Carbamidocyclophanes,merupakanparacyclophanesyang diisolasi dari
Nostocsp. CAVN 10., menunjukkan aktivitas antibakteri terhadapStaphylococcus
aureus. Ravehet al. (2007) mengisolasi sembilan ambiguin dariFischerellasp.,
yang memiliki aktivitas antimikroba. Ambiguin-I isonitril menunjukkan potensi
antibakteri yang lebih besar dibandingkanStreptomycinterhadapBacillus subtilis
17
dariMicrococcus lacustris menunjukkan aktivitas antibakteri terhadapS. aureus,
S. epidermidis, Salmonella Typhi, Vibrio cholarae, B. subtilis, B. cereus, E. coli
danKlebsiela pneumoniae.
D. Metode Isolasi Senyawa Bahan Alam
1. Ekstraksi
Ekstraksi adalah proses penarikan komponen atau zat aktif dari suatu sampel
dengan menggunakan pelarut tertentu. Prinsip ekstraksi didasarkan pada
distribusi zat terlarut dengan perbandingan tertentu antara dua pelarut yang tidak
saling bercampur (Khopkar, 2002). Secara umum, ekstraksi digolongkan ke
dalam dua bagian berdasarkan bentuk fasa yang diekstraksi, yaitu ekstraksi
cair-cair dan ekstraksi cair-cair-padat (Harborne, 1984).
Salah satu langkah penting yang menentukan keberhasilan ekstraksi adalah
pemilihan pelarut. Parameter yang menentukan dalam pemilihan pelarut adalah
koefisien distribusi dan selektifitas. Koefisien distribusi atau koefisien partisi
merupakan konstanta kesetimbangan yang dihubungkan dengan kelarutan relatif
suatu zat terlarut dalam dua pelarut. Selektivitas diartikan sebagai kemampuan
suatu pelarut untuk mengekstrak suatu zat terlarut. Sifat yang diharapkan untuk
suatu pelarut adalah koefisian distribusi tinggi dan selektivitas yang baik. Selain
18
mempengaruhi pemilihan pelarut adalah titik didih, densitas, viskositas, titik nyala
dan toksisitas (Svehla, 1985).
2. Kromatografi
Kromatografi merupakan teknik pemisahan dua atau lebih senyawa yang
terdistribusi antara dua fasa yang saling tidak melarut, yaitu fasa diam dan fasa
gerak. Berdasarkan bentuk kedua fasa tersebut, kromatografi dibagi menjadi tiga,
yaitu kromatografi padat-cair, kromatografi cair-cair, dan kromatografi gas-cair
(Hostettman dkk., 1995).
2.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) merupakan salah satu contoh kromatografi
padat-cair dengan fasa diam dilekatkan pada lempeng tipis alumunium atau
kaca. Teknik ini bermanfaat untuk identifikasi komponen serta pemilihan
fasa gerak untuk kromatografi kolom dan kromatografi cair kinerja tinggi
(KCKT). Sampel yang akan dipisah (berupa larutan) ditotolkan pada plat
KLT, kemudian plat dimasukkan di dalam bejana tertutup rapat yang berisi
larutan pengembang atau eluen (fasa gerak). Pemisahan terjadi selama
perambatan kapiler (Hostettman dkk., 1995). Pada kromatografi lapis tipis,
fasa diam (adsorben) yang sering digunakan adalah serbuk silika gel,
alumina, atau selulosa. Fasa diam silika gel digunakan untuk memisahkan
campuran senyawa lipofilik, sebaliknya fasa diam C18untuk memisahkan
19
Komponen-komponen senyawa yang dianalisis dapat dipisahkan dan
dibedakan berdasar harga Rf (Retention Factor/Faktor retensi). Faktor
retensi didefinisikan sebagai perbandingan jarak perjalanan suatu senyawa
dengan jarak perjalanan suatu pelarut (eluen). Harga Rf ini bergantung pada
beberapa parameter yaitu sistem pelarut, adsorben (ukuran butir, kandungan
air, ketebalan), dan sebagainya (Khopkar, 2002).
Jarak perjalanan senyawa Rf =
Jarak perjalanan eluen
Salah satu keuntungan KLT adalah dapat memisahkan komponen dari sampel
dalam waktu singkat dengan peralatan yang relatif tidak terlalu mahal.
Metode ini memiliki kepekaan cukup tinggi dengan jumlah cuplikan
beberapa mikrogram. Namun, KLT tidak dapat digunakan untuk pemisahan
sampel dalam jumlah besar (Hostettman dkk., 1995).
2.2 Kromatografi Kolom
Proses pemisahan komponen-komponen suatu zat dengan teknik
kromatohgrafi kolom terjadi karena adanya perbedaan daya adsorpsi terhadap
fasa diam dari masing-masing komponen tersebut. Fasa diam diisikan ke
dalam kolom gelas, sedangkan fasa gerak disesuaikan dengan sampel yang
akan dipisahkan. Metode elusi dapat dilakukan dengan elusi isokratik atau
20
tidak berubah selama proses pemisahan berlangsung. Elusi landaian adalah
kebalikan dari elusi isokratik. Komposisi eluen pada sistem landaian
mengalami perubahan saat proses pemisahan berlangsung (Johnson and
Stevenson, 1991).
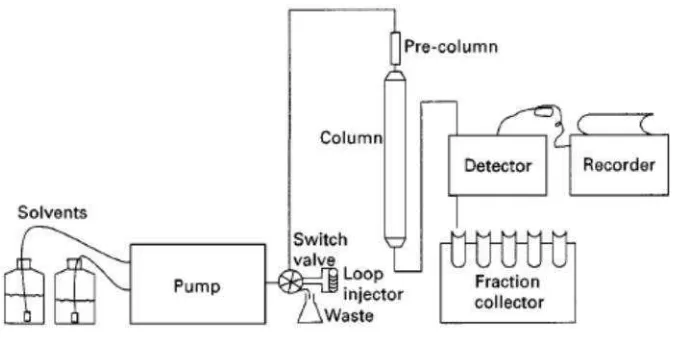
2.3 Kromatografi Cair Bertekanan Sedang atauMedium Pressure Liquid Chromatography(MPLC)
MPLC merupakan salah satu teknik kromatografi yang umum digunakan
dalam isolasi senyawa bahan alam dan uji kemurnian senyawa hasil isolasi.
Pada dasarnya MPLC memiliki prinsip yang sama dengan Kromatografi Cair
Kinerja Tinggi (KCKT), seperti yang terlihat pada Gambar 6, tetapi besarnya
tekanan yang digunakan berbeda. MPLC menggunakan tekanan antara 5-20
bar sedangkan KCKT menggunakan tekanan yang lebih tinggi yaitu >20 bar
(Claesonet al., 1993).
Gambar 6. Sistem MPLC
Teknik ini merupakan hasil pengembangan teknik kromatografi
21
memiliki kapasitas muatan yang besar serta mampu memisahkan senyawa
hingga menghasilkan senyawa dengan kemurnian yang lebih tinggi baik
menggunakan metode fasa terbalik atau pun fasa normal. Metode pemisahan
sampel yang paling umum digunakan adalah fasa terbalik (fasa gerak lebih
polar dari fasa diam), meskipun mekanisme pemisahan fasa normal (fasa
diam lebih polar dari fasa gerak) juga bisa digunakan (Aguilar, 2008).
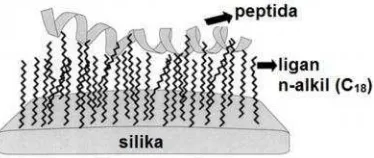
Metode pemisahan fasa terbalik melibatkan pemisahan molekul berdasarkan
hidrofobisitas seperti terlihat pada Gambar 7.
Gambar 7. Skema contoh interaksi peptida dengan fase diam
Hasil pemisahan pada fasa terbalik bergantung pada sifat ikatan hidrofobik
molekul terlarut dalam fasa gerak terhadap ligan hidrofobik amobil yang
terikat pada fasa diam. Secara teknis, campuran zat terlarutmula-mula
diaplikasikan pada kolom menggunakan alat suntik (injector) dan dielusi
dengan pelarut organik sebagai fasa gerak. Seperti pada kromatografi kolom,
proses elusi dapat berupa isokratik atau dengan elusi gradien. Komponen
campuran zat terlarut dielusi berdasarkan peningkatan hidrofobisitas.
Komponen yang bersifat hidrofil akan cenderung lebih mudah terelusi
22
Pemantauan pemisahan komponen menggunakan MPLC umumnya dilakukan
menggunakan detektor UV/Vis (Claesonet al., 1993). Sistem deteksi UV
dapat dikembangkan menggunakan instrumenphotodiode array(PDA).
Detektor ini memiliki sensitivitas rendah dibandingkan dengan detektor
panjang gelombang konvensional, namun permasalahan tersebut sebagian
besar telah diatasi oleh produsen alat. Permasalahan umum pada spektra UV
adalah pelebaran pita serapan yang dapat menyebabkan masalah dalam
identifikasi kualitatif(McCalley, 2002).
E. Spektroskopi
Spektroskopi merupakan ilmu yang mempelajari tentang interaksi antara energi
cahaya dan materi. Beberapa keuntungan dari penggunaan metode spektroskopi
adalah jumlah zat yang diperlukan untuk analisis relatif kecil dan waktu
pengerjaannya relatif cepat (Silversteinet al., 2005). Pada penelitian ini alat
spektroskopi yang digunakan adalahFourier Transform Infra Red(FTIR) dan
Nuclear Magnetic Resonance(NMR)Spectroscopy.
1. SpektroskopiFourier Transform Infra Red(FTIR)
Spektroskopi FTIR merupakan metode yang dapat digunakan untuk
mengidentifikasi gugus fungsi yang terdapat dalam suatu senyawa. Gugus fungsi
ini dapat ditentukan berdasarkan energi vibrasi ikatan antar atom dalam molekul.
23
menghasilkan jenis vibrasi dan serapan yang berbeda-beda pada suatu spektrum
infra merah. Spektrum infra merah/infra red(IR) merupakan grafik antara
panjang gelombang (µm) atau bilangan gelombang (cm-1) dan persen transmisi (%T) atau absorbansi (A) (Silversteinet al., 2005).
Radiasi infra merah antara 10.000–100 cm-1diserap dan dirubah oleh molekul organik menjadi energi molekular vibrasi. Penyerapan ini juga terkuantisasi,
tetapi spektrum vibrasi menunjukan ikatan-ikatan sebagai garis-garis dikarenakan
perubahan suatu energi vibrasi tunggal diikuti dengan perubahan energi rotasi.
Sebagian besar hal ini terjadi antara 4000 sampai 400 cm-1, di sinilah yang perlu menjadi pusat perhatian. Frekuensi atau panjang gelombang absorpsi tergantung
pada massa relatif atom, tetapan gaya dari ikatan-ikatan, dan geometri
atom-atom. Daerah antara 1400-4000 cm-1merupakan daerah yang khusus berguna untuk identifikasi gugus fungsional penting seperti gugus C=O, O-H, dan N-H.
Daerah ini menunjukkan absorpsi yang disebabkan oleh vibrasi uluran. Daerah
antara 1400-900 cm-1(daerah sidik jari) sering sangat rumit karena menunjukkan absorpsi yang disebabkan oleh vibrasi uluran dan tekukan. Tiap molekul
memberikan serapan yang unik pada daerah sidik jari. Daerah antara 900-650 cm -1menunjukkan klasifikasi umum dari molekul. Adanya absorbansi pada daerah
bilangan gelombang rendah dapat memberikan data yang baik akan adanya
24
2. Nuclear Magnetic Resonance(NMR)Spectroscopy
Spektroskopi NMR merupakan metode yang paling sering digunakan dalam
elusidasi struktur molekul. Keunggulan dari teknik ini tidak hanya pada
kemampuannya memberikan gambaran tentang jumlah dan jenis inti yang terdapat
dalam molekul senyawa organik, tetapi juga dalam menjelaskan lingkungan kimia
masing-masing inti dan interkoneksi satu inti dengan lainnya. Informasi yang
diberikan adalah berupa pergeseran kimia, integrasi, konstanta Kopling, dan
perubahan kimia. Spektrum NMR merupakan plot dari frekuensi puncak absorpsi
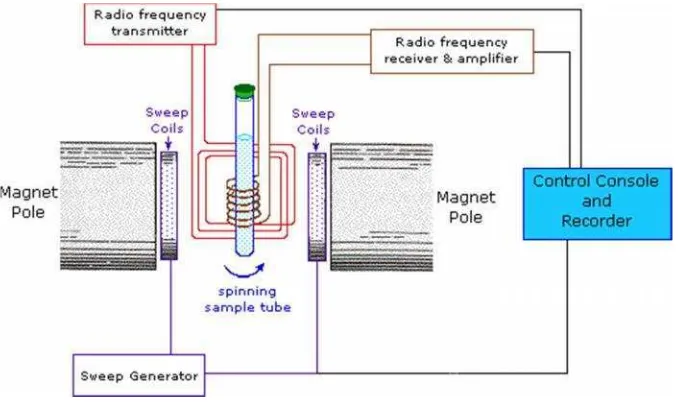
terhadap puncak intensitas. Dalam penentuan senyawa organik, data spektra1H dan13C NMR merupakan data yang paling berguna dalam bidang kimia organik (Byrne, 2008). Skema dari alat spektrometer NMR dapat dilihat pada Gambar 8.
25
Kemampuan atom dalam molekul untuk memberikan serapan NMR didasarkan
pada sifat inti unsur atom tersebut, bukan dari sifat unsurnya. Fenomena
resonansi inti terjadi bila inti atom menyearah terhadap medan magnet yang
digunakan dengan menyerap energi untuk merubah orientasi spin. Dalam medan
magnet, inti dengan bilangan kuantum spin ½ dapat mengisi dua keadaan energi,
keadaan dengan energi yang lebih rendah menyearah terhadap medan magnet
sedangkan keadaan dengan energi yang lebih tinggi pada arah berlawanan.
Dalam medan magnet, inti yang memiliki bilangan kuantum spin nonzero dapat
menyerap radiasi elektromagnetik pada frekuensi radio. Frekuensi tersebut
tergantung pada karakter inti sampel (rasio giromagnetik) dan kekuatan medan
magnet (B). Secara matematika, hubungan tersebut dinyatakan sebagai
Persamaan Lamor:
v= γB/2π
Denganvadalah perbedaan energi (Hertz) antara dua keadaan spin inti, γ adalah
rasio giromagnetik masing-masing inti, danBadalah kekuatan medan magnet
dari alat (Gauss).
Pergeseran kimia proton dan karbon diukur dari standar internal tetrametilsilan
(TMS). Signal TMS diatur sebagai posisi 0 ppm, frekuensi selanjutnya dihitung
ke kiri dalam bilangan positif. Walaupun interpretasi yang teliti dan penentuan
struktur dari data NMR memerlukan tabulasi nilai pergeseran kimia, ada beberapa
26
1) Pergeseran kimia karbon (tetapi tidak untuk proton), dapat diperkirakan
dari hukum tambahan dan susunan parameter tabulasi untuk
memperkirakan jenis senyawa.
2) Gugus CH3pada NMR proton dan karbon memiliki intensitas yang tinggi.
Pergantian H metil oleh C merubah pergeseran kimia ke arahdownfield
sekitar 0,2–0,3 ppm untuk tiap karbon. Nilai pergeseran 13 C NMR
dipengaruhi oleh percabangan 2 dan 3 atom dan dapat dihitung dengan
persamaan sederhana. Rentang pergeseran kimia karbon untuk alkana
sekitar 6-42 ppm.
3) Adanya atom elektronegatif menggeser signal ke arahdownfield.
Perpanjangan pergeseran kimia sesuai dengan elektronegativitas atom.
4) Ikatan rangkap memberikan signal ke arahdownfield.
a. Signal C=C alkena berada pada daerah 110-140 ppm.
b. Proton H pada C=C ada pada rentang 4,0-6,5 ppm, tetapi H pada
cincin aromatik ada pada daerah 6,5-8,0 ppm.
c. Senyawa yang mengandung ikatan rangkap memberikan medan
magnetik intramolekuler spesifik yang menyebabkan pergeseran yang
tidak biasa pada gugus fungsinya.
5) Skala waktu NMR (MHz) lebih lambat dibandingkan dengan skala waktu
rotasi. Hasilnya, pergeseran kimia yang teramati merupakan rata-rata
pergeseran kimia konformer.
6) Senyawa dengan gugus OH dan NH biasanya mengalami perubahan
intermolekular H yang sangat cepat karena adanya jaringan ikatan
27
pergeseran kimia yang mengalami perubahan. Oleh karena itu, proton OH
dan NH ditemukan pada posisi yang berbeda-beda dalam spektrum NMR.
Senyawa asam lemak dicirikan dengan adanya adanya gugus karboksil dan gugus
alkil rantai panjang. Pada proton NMR, ciri tersebut akan muncul pada daerah δH 0,8-2,5 ppmdari rantai alkil dan δHsekitar 11 ppm dari proton O-H. Pada13C NMR, ciri tersebut akan muncul pada daerahδC170-180 ppm dari gugus karbonil
serta δC14,0 -35,0 ppm dari rantai alkil (Silversteinet al., 2005).
3. Spektroskopi NMR 2 Dimensi (2D)
Spektroskopi NMR 2D memberikan informasi tambahan yang sangat berguna
dalam elusidasi struktur molekul. Beberapa teknik spektroskopi NMR 2D yang
sering digunakan antara lain sebagai berikut.
3.1 DEPT (DistortionlessEnhancement byPolarisationTransfer)
DEPT memberikan informasi mengenai berapa jumlah proton yang terikat
pada tiap karbon. Pengukuran DEPT menggunakan variasi sudut putar,θ.
Dengan mengatur sudut putar pembacaan dapat dihasilkan subspektra yang
diedit berdasarkan resonansi multiplisitas (CH, CH2, CH3). Bilaθ45o, spektrum yang semua karbonnya terprotonasi menghasilkan intensitas positif,
28
proton CH2memberikan intensitas yang bernilai negatif. Berdasarkan hasil
ketiga spektra, hasil pengukuran dengan θ 90o, hanya memberikan spektrum proton CH. Hasil pengurangan dari perbedaan spektrum θ 135odengan θ 45o memberikan spektrum proton CH2. Spektrum proton CH3bisa didapat
dengan cara penambahan hasil pengukuran pada θ 135odan 45okemudian dikurangi dengan hasil pengukuran pada θ90o(Gauglitz and Vo-Dinh, 2003).
3.2 COSY,Homonuclear Correlated Spectroscopy
COSY merupakan akronim dariCOrrelationsSpectroscopYdan metode ini
digunakan untuk menemukan inti proton (homonuclear) melalui hubungan
antar ikatan. Pengujian COSY telah dikembangkan sejak awal sejarah
penggunaan 2D NMR. Secara teknis, kedua frakuensi pada sumbu
digunakan untuk memperlihatkan informasi pergeseran kimia proton. Nilai
sesungguhnya spektrum proton dalam pengujian ini terlihat pada sumbu
diagonal di dalam spektrum 2D NMR. Proton individu yang berresonansi
dalam pengukuran dikaitkan dengan proton lainnya melalui besaran skalar
kopling. Sebagai contoh, hubungan protongeminal(2JHH) danvicinal(3JHH)
yang selalu teramati bila besaran skalar kopling antara kedua proton sesuai
(Gauglitz and Vo-Dinh, 2003).
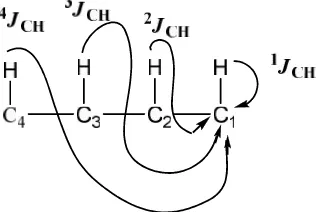
3.3 HMBC (Heteronuclear Multiple Bond Coherence)
Ini merupakan pengukuran proton yang memiliki korelasi dengan karbon
dengan jarak 2 sampai 3 ikatan dari proton tersebut, seperti yang terlihat pada
29
secara tidak langsung dan juga dapat melihat korelasi karbon kuarterner
dengan proton terdekat. Adanya kopling antara 2JCHdan 3JCHdapat
menyulitkan interpretasi data sehingga diperlukan data HMQC atau HSQC
sebagai pendukung.
Interpretasi data HMBC memerlukan fleksibilitas karena kita tidak selalu
menemukan apa yang diharapkan. Tergantung pada hibridisasi karbon dan
faktor lain, beberapa korelasi dua (2JCH) atau tiga (3JCH) ikatan terkadang
tidak nampak. Variasi korelasi yang ditemukan disebabkan oleh variasi
perbesaran konstanta kopling 2JCH, 3JCH, dan 4JCH(Siversteinet al., 2005)
Gambar 9. Kopling jarak jauh resonansi karbon terprotonasi
Beberapa hal yang perlu diketahui untuk interpretasi data NMR:
1) Munculnya korelasi satu ikatan yang disebut artifak. HMBC digunakan
untuk mendeteksi kopling kecil pada interaksi jarak jauh, tetapi ini tidak
sempurna. Artifak ini muncul sebagai doublet denganJ= 1JCH. Splitting
ini merupakan informasi yang cukup berguna. Namun adanya artifak ini
30
2) Tidak semua korelasi akan muncul ataupun muncul dengan intensitas
yang sama pada HMBC. Sebagai catatan, kopling tiga ikatan lebih besar
dari pada kopling dua ikatan.
3.4 HSQC (Heteronuclear Single Quantum Correlation)
HSQC merupakan uji NMR 2D yang memiliki sensitivitas tinggi untuk
menjelaskan hubungan atau korelasi sistem1H yang terikat secara langsung (satu ikatan) dengan inti lain seperti15N atau13C. Skema dasar uji ini melibatkan transfer magnetisasi proton ke pada inti kedua, yaitu15N atau 13C, melalui tahap INEPT (Insensitive nuclei enhanced by polarization
transfer). Setelah waktu tertentu (t1), magnetisasi ditransfer kembali ke
proton melalui tahap retro-INEPT dan signal dicatat oleh perekam. Pada
HSQC, serangkaian eksperimen dicatat dimanat1bertambah. Signal1H dideteksi dalam dimensi pengukuran secara langsung dalam tiap eksperimen,
sementara pergeseran kimia dari15N atau13C dicatat dalam dimensi tidak langsung yang terbentuk dari serangkaian eksperimen (Gauglitz and
Vo-Dinh, 2003).
4. KoplingCisdantranspada spektrum1H NMR
Ada dua istilah yang perlu diketahui:
• Vicinal- Kopling antara hidrogen-hidrogen pada karbon yang bersebelahan
• Geminal- Kopling antara hidrogen nonekuivalen pada atom karbon yang
31
Bila atom hidrogen alkenil pada ikatan rangkap tersubstitusi tidak simetri,
hidrogen dari isomercisdantransakan memberikan pergeseran kimia yang
berbeda pada spektrum NMR nilai konstanta kopling pada isomercislebih
kecil dari pada isomertranssehingga spektrum NMR kedua isomer tersebut
berbeda. Isomercisakan sedikit bergeser ke arahupfield(ke kanan) (5-10
Hz) dantranske arahdownfield(ke kiri) (11-18 Hz) (Willker and Leibfritz,
1998).
ppm
Terkadang kopling akan membuat nilaiJ menjadi rumit dengan variasi yang
luas dikarenakan adanya keterlibatan hubungan antar hidrogen. Ketika ini
terjadi, informasi tetap dapat digunakan untuk penentuan struktur molekul
dengan melihat jumlah signal, pergeseran kimia satu sama lain, integrasi, dan
splittinguntuk mengidentifikasi alkena dengan menggunakan NMR.
F. Surfaktan
Surfaktan adalah senyawa yang dapat mengubah hubungan energi antar
permukaan. Dalam industri, surfaktan digunakan sebagaiwetting agents
(promotor penyebaran cairan pada permukaan atau penetrasi cairan dalam Ciske arahupfield
32
material),detergents(pembersih cairan pada tekstil), danemulsifiying agents
(bahan tambahan dalam campuran yang tidak saling melarut). Senyawa dengan
sifat surfaktan ini dicirikan oleh adanya gugus hidrofilik atau gugus polar dan
gugus hidrofobik atau gugus nonpolar dalam strukturnya. Muatan listrik pada
gugus hidrofolik dalam surfaktan dapat digunakan untuk mengklasifikasikan
senyawa surfaktan, yaitu anionik, kationik, non-ionik, dan amfoterik (Glassman,
1948).
Surfaktan anionik dicirikan oleh adanya keseimbangan struktural antara residu
hidrofobik (rantai parafin, alkil, benzen) dan muatan negatif dalam gugus
hidrofilik (karboksil, sulfat, sulfonat, pospat). Dalam surfaktan kationik, residu
hidrofobik yang sama dapat diseimbangkan dengan muatan positif gugus
hidrofilik (contohnya gugus amonium kuaterner, sulfonium, arsonium,
posponium, atau iodonium). Surfaktan non-ionik diseimbangkan oleh beberapa
gugus hidrofilik yang tak terionisasi sebagai etilen oksida terpolimerisasi atau
alkohol polihidrat. Surfaktan amfoterik adalah senyawa dengan struktur
gabungan antara anionik dan kationik. Senyawa jenis ini saat ini belum memiliki
peranan penting (Glassman, 1948). Beberapa contoh struktur senyawa surfaktan
33
Tabel 1. Contoh Struktur senyawa surfaktan (Glassman, 1948)
BAB III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan di UPT Laboratorium Terpadu dan Sentra Inovasi
Teknologi Universitas Lampung dari bulan Desember 2014 sampai Juni 2015.
Analisis FTIR serta proton dan karbon NMR dilakukan di Laboratorium Tanaka,
Universitas Ryukyus, Okinawa, Jepang.
B. Alat dan Bahan
Adapun alat-alat yang diperlukan dalam penelitian ini antara lain neraca analitik,
autoclave kleinfield-Germany/HV-L25, centrifuge,laminar air flow
ESCO/AVC4A1, mikroskopIlluminating System Zeiss Axio A10, aerator, jarum
ose, pinset, kaca preparat,cover-slip, lampu spiritus, mikropipet, oven,
timbangan, Ultrasonic, penguap putar vakumBuchii/R205, lampu UV
kohler/SN402006, seperangkat alat KLT dan kromatografi kolom, kromatografi
cair bertekanan medium atauMedium Pressure Liquid Chromatography (MPLC)
Buchi/ Sepacotermdengan kolom C18dan dilengkapi dengan detektorphoto diode
35
III, dan alat-alat gelas yang biasa digunakan di laboratorium meliputi gelas piala,
labu Erlenmeyer, gelas ukur, labu takar, dan corong pisah.
Bahan-bahan yang digunakan antara lain media F/2-Si yang terdiri dari
makronutrien, mikronutrien, larutan vitamin dan antibiotik (pembuatan media
dapat dilihat pada Lampiran 1), kloroform, diklorometana, n-heksana, etanol,
metanol (MeOH), n-butanol, isopropanol, ninhidrin, serium sulfat, asam sulfat,
asam asetat glasial, asetonitril, akuades, dan bahan-bahan pendukung seperti tisu,
alumunium foil, dan sebagainya. Biomaterial yang digunakan antara lain isolat
mikroalgaOscilatoriasp.,diperoleh dari UPT Laboratorium Terpadu dan Sentra
Inovasi Teknologi, dan isolat bakteriE. coli, diperoleh dari Rumah Sakit Abdul
Muluk Bandar Lampung.
C. Prosedur Penelitian
1. Kultivasi dan PemanenanOscillatoriasp.
Metode kultivasi mengacu pada metode yang dilakukan Guillard (2005) yang
dimodifikasi. Sebanyak 200 mL media f/2-Si dimasukkan ke dalam labu kultur
dan ditambahkan dengan 25 mL kulturOscilatoriasp.Induk dan dikultivasi
selama satu minggu, pada suhu ruang, dengan sistem aerasi ke dalam media dan
sistem pencahayaan selama 24 jam menggunakan lampu TL 40 watt. Kultur
tersebut kemudian diperbesar hingga skala 10 L. Kultur selanjutnya dibiakkan
36
menggunakan cahaya matahari serta waktu kultivasi selama satu minggu.
Morfologi mikroalgaOscillatoriasp.diidentifikasi menggunakan mikroskop
cahaya dengan perbesaran 400X (Bold and Wynne, 1985).
Pemanenan biomassaOscillatoriasp. dilakukan menggunakan teknik filtrasi atau
penyaringan (Vonshak, 2002). Isolat mikroalgaOscilatoriasp.dipanen setelah
satu minggu. PemanenanOscillatoriasp. dilakukan dengan menggunakan kain
saring 380-500 mesh. Biomassa basah yang diperoleh dikumpulkan dan disimpan
dalam lemari pendingin (suhu 4oC) jika tidak langsung digunakan.
2. Ekstraksi
Biomassa basah diekstraksi menggunakan campuran pelarut
diklorometana-metanol (1-1) kemudian dipartisi menggunakan air. Fase air kemudian diambil
dan dikumpulkan lalu dipekatkan menggunakan penguap putar vakum. Ekstrak
pekat kemudian dilewatkan pada kolom Cosmosil C18menggunakan pelarut
metanol.
Senyawa metabolit dari filtrat air laut hasil pemanenan diekstraksi menggunakan
resin XAD-16 (Martin-Visscheret al., 2008). Sebanyak 5 L filtrat air laut hasil
pemanenan dilewatkan pada kolom yang berisi resin XAD-16 yang sebelumnya
telah dibilas dengan akuades. Kolom kemudian dibilas dengan etanol 30%,
isopropanol 20 %, 40%, dan terakhir dengan isopropanol 70% (yang diasamkan
37
70% pH 2 (selanjutnya diberi kode IPA70) ditampung dan dipekatkan
menggunakan penguap putar vakum.
3. Uji Bioaktivitas
Uji bioaktivitas antibakteri mengacu pada metode yang dilakukan oleh Suleet
al., (2011) dengan beberapa modifikasi. Isolat bakteriE. coliditumbuhkan pada
medianutrient agar(NA). Inokulum dibuat dengan menambahkan satu ose
isolat ke dalam 5 mL media NA yang masih hangat, lalu diaduk menggunakan
vortex mixer. Tuangkan sekitar 20 mL agar NA ke cawan petri steril dan biarkan
hingga memadat (selama ± 15 menit) lalu tuangkan inokulum di atas media agar
yang sudah padat dan biarkan inokulum hingga memadat. Setelah padat,
tanamkanringberdiameter 6 mmke media lalu masukkan 50 μ L senyawacontoh
uji ke lubangring. Total konsentrasi akhir senyawa uji adalah 100μg. Pelarut
yang digunakan adalah metanol. Lakukan uji yang sama terhadap metanol
sebagai kontrol negatif, serta chloramphenicol, dan amoxicillin (dosis 10, 20, dan
30 μ g)sebagai kontrol positif. Cawan kemudian diinkubasi pada suhu 370C
selama 24 jam. Bioaktivitas senyawa dilakukan dengan mengukur diameter zona
hambat.
4. Isolasi dan Pemurnian Senyawa Bioaktif
Ekstrak kasar dariOscillatoriasp. yang memiliki aktivitas antibakteri kemudian
38
gelombang (λ) 220 nm dan 254 nm. Fraksi-fraksi yang dikumpulkan diuji
bioaktivitasnya. Fraksi yang memiliki bioaktivitas terhadapE. colikemudian
diuji secara KLT menggunakan variasi pelarut metanol-air, pereaksi serium
sulfat, ninhidrin, dan Dragendorff. Hasil uji KLT tersebut digunakan sebagai
acuan dalam pemisahan selanjutnya menggunakan kromatografi kolom.
5. Karakterisasi
5.1 Analisis Spektroskopi FTIR
Sekitar 1 mg contoh uji digerus dengan garam KBr lalu dibuat pelet menggunakan
die 7 mm. Pelet kemudian diletakkan padasample holderdan diukur serapannya
menggunakan spektrometer FTIR pada daerah 400-4000 cm-1.
5.2 Analisis Spektroskopi NMR
Analisis spektroskopi NMR mengacu pada metode kodaniet al.(1999). Spektra
1H dan13C NMR contoh uji dianalisis menggunakan spektrometer NMR Bruker
AVANCE III 500 MHz, menggunakan pelarut CDCl3dan standar referensi
BAB V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan pembahasan hasil penelitian ini dapat disimpulkan bahwa
1. Oscillatoriasp. menghasilkan senyawa lemak tak jenuh yang memiliki
bioaktivitas sebagai antibakteri, khususnya terhadapE. coliyang telah
resisten.
2. Berdasarkan hasil analisis spektroskopi FTIR,1H,13C, dan 2D NMR, struktur senyawa antibakteri yang diusulkan adalah asam gadoleat atau berdasarkan
sistem IUPAC dikenal sebagai asamcis-eikos-9-enoat.
3. Asamcis-eikos-9-enoat memiliki aktivitas antibakteri dengan zona hambat 7
mm pada dosis 100 μ g.
B. Saran
Berdasarkan hasil penelitian, ada beberapa hal yang perlu ditindaklanjuti, antara
55
1. Untuk peneletian lebih lanjut, perlu dilakukan isolasi dan pemurnian asam
cis-eikos-9-enoat dalam jumlah yang lebih besar guna mencukupi kebutuhan
analisis.
2. Perlu dilakukan analisis lebih lanjut menggunakan spektroskopi massa
(LC-MS atau GC-(LC-MS) untuk mendapatkan struktur yang lebih tepat dari asam
gadoleat dan struktur analognya.
3. perlu dilakukan uji banding bioaktivitas asamcis-eikos-9-enoat terhadapE.
coliyang normal dan yang resisten terhadapchloramphenicol.
4. Perlu adanya kajian lebih lanjut untuk mengetahui aktivitas antibakteri asam
cis-eikos-9-enoat secara kuantitatif terhadap bakteriE. coliresisten.
5. Perlu dilakukan kajian lebih lanjut untuk mengetahui mekanisme kerja
DAFTAR PUSTAKA
Aguilar, M. I.. 2008. Reversed-Phase High-Performance Liquid
Chromatography. Pp 9-22 In:HPLC of Peptides and Proteins:Methods and Protocols. M.I. Aguilar (ed). Springer-Verlag. New York. Pp 395.
Amaral, A. C., O. N. Silva, N. C. C. R. Mundim, M. J. A. de Carvalho, L.
Migliolo, J. R. S. A. Leite , M. V. Prates, A. L. Bocca, O. L. Franco, M. S. S. Felipe. 2012. Predicting Antimicrobial Peptides from Eukaryotic Genomes: In Silico Dtrategies to develop Antibiotics. Peptides. 37: 301– 308.
Anderson, R.A. 2005. Algal Culturing Technique. Elsevier Academic Press: London.
Babu, B. and J. T. Wu. 2008. Production of Natural Butylated Hydroxytoluene as an Antioxidant by Freshwater Phytoplankton. Journal of Phycology. 44 (6): 1447–1454.
Bhateja, P., T. Mathur, M. Pandya, T. Fatma, and A. Rattan. 2006. Activity of Blue- Green Microalgae Extracts Against in Vitro Generated
Staphylococcus aureusWith Reducedsusceptibility to Vancomycin. Fitoterpia. 77: 233–235.
Bold and M. I. Wynne. 1985.Introduction to The Algae. Prentice Hall,inc. New York. hlm. 70-273.
57
Bui, T. N., R. Jansen, T. L. Pham, and S. Mundt. 2007. Carbamidocyclophanes A-E, Chlorinated Paracyclophanes With Cytotoxic and Antibiotic Activity from the Vietnamese Cyanobacterium.Nostocsp.J. Nat. Prod. 70, 499– 503.
Byrne, L. T.. 2003. Nuclear Magnetic Resonance Spectroscopy: Strategies for Structural Determination inBioactive Natural Products : Detection, Isolation, and Structural Determination. 2ndedition. S. M. Colegate and R. J. Molyneux (eds). CRC Press: New York. Pp 77-124.
Claeson, P., P. Tuchinda, and V. Reutrakul. 1993. Some Empirical Aspect Use of Flash Chromatography and Medium Pressure Liquid Chromatography for the Isolation of Biologically Active Compounds from Plants.
J.Sci.Soc.Thailand. 19:73-86.
Coates, J.. 2000. Interpretation of Infrared Spectra, A Practical Approach in Encyclopedia of Analytical Chemistry. R.A. Meyers (Ed.). John Wiley & Sons Ltd. Chichester. Pp. 10815–10837.
Coblentz Society Collection. 2009. Diakses pada tanggal 8 Agustus 2015 dari http://webbook.nist.gov/cgi/cbook.cgi?ID=C60333&Mask=80#IR-Spec
Conn, E.E., P. K. Stumpf, G. Bruening, and R. Y. Doi. 1987. Outlines of Biochemistry, 5thEdition. John Wiley and Sons Inc. New York, pp. 413-455.
Das, S., P. S. Lyla, S. A. Khan. 2006. Marine Microbial Diversity and Ecology: Importance and Future Perspectives. Current Science. 90(10).
Dittmann, E., B. Neilan, and T. Börner. 2001. Molecular Biology of Peptide and Polyketide Biosynthesis in Cyanobacteria. Applied Microbiology and Biotechnology. 57: 467-473.
EI-Sheekh, M. M., M. E. H. Osman, M. A. Dyab,and M. S. Amer. 2006.
58
Faulkner, D. J.. 2000. Marine Natural Product. Natural Product Reports. 18: 1-49.
Fogg, G. E. 1971. Algal Cultures and Phytoplankton Ecology. University of Wisconsin Press.
Gauglitz, G. and T. Vo-Dinh. 2003. Handbook of Spectroscopy. WILEY-VCH GmbH & Co. KGaA. Weinheim.
Glassman, H. N.. 1948. Surface Active Agents and Their Application in Bacteriology. Bacteriol Rev. 12(2): 105–148.
Guillard, R. R. L.. 2005. Algal Culturing Technique. R. A. Andersen (ed). Elsevier Academic Press. London. Pp117-132.
Guiry, M. D.. 2011. OscillatoriaVaucher ex Gomont.AlgaeBase, 1892: 198.
Guiry , M.D.. 2014.AlgaeBase. World-Wide Electronic Publication, National University of Ireland, Galway. http://www.algaebase.org; searched on 23 December 2014.
Gutierrez, M., T. L. Suyama, N. Engene, J. S. Wingerd, T. Matainaho, W. H. Gerwick,. 2008. Apratoxin D, a Potent Cytotoxic Cyclodepsipeptide from Papua New Guinea Collections of the Marine CyanobacteriaLyngbya majusculaandLyngbya sordida. J. Nat. Prod. 71: 1099–1103.
Harborne, J.B. 1984. Metode Fitokimia: Penentuan Cara Modern Menganalisis Tumbuhan. Alih bahasa oleh K. Padmawinata dan I. Soediro. Penerbit ITB. Bandung. 354 hlm.
Hostettman, K., M. Hostettman, dan A. Marston. 1995. Cara Kromatografi Preparatif. Alih bahasa oleh K. Padmawinata. Penerbit ITB. Bandung. Hlm 1-38.
Jaki, B., J. Orjala, and O. Sticher. 1999. A novel Extracellular Diterpenoid with Antibacterial Activity from the Cyanobacterium. Nostoc Comm.
59
Johnson, E. L. dan R. Stevenson. 1991. Dasar Kromatografi Cair.
Diterjemahkan oleh K. Padmawinata. Penerbit ITB. Bandung. Hlm 50-55.
Kabara, J. J., D. M. Swieczkowski, A. J. Conley, and J. P. Truant. 1972. Fatty Acids and Derivatives as Antimicrobial Agents.Antimicrob. Ag. Chemother. 2(1):. 23-28
Khopkar, S. M.. 2002. Konsep Dasar Kimia Analitik. Alih bahasa oleh A. Saptorahardjo. Penerbit Universitas Indonesia. Jakarta. Hlm 84-311.
Knox, W. E., V. H. Auerbach, K. Zarudnaya, and M. Spirtes. 1949. The Action of Cationic Detergents on Bacteria and Bacterial enzymes. Jbacter. 58:443-452.
Kodani, S., S. Suzuki, K. Ishida, and M. Murakami. 1999. Five New
Cyanobacterial Peptides from Water Bloom Materials of Lake Teganuma (Japan). FEMS Microbiology Letters. 178: 343-348.
Lee, Y. K., J. H. Lee, and H. K. Lee. 2001. Microbial Symbiosis in Marine Sponges. J. Microbiol. 39: 254-264.
Lehninger, A. L.. 1982. Principles of Biochemistry. Diterjemahkan oleh Maggy Thenawidjaya. Penerbit Erlangga. Jakarta
Lin, S., Z. Wu, G. Yu, M. Zhu, B. Yu, R. Li. 2010. Genetic Diversity and Molecular Phylogeny of Planktothrix (Oscillatoriales, Cyanobacteria) Strains from China.Harmful Algae. 9: 87–97.
60
Magiorakos, A. P., A. Srinivasan, R. B. Carey, Y. Carmeli, M. E. Falagas, C. G. Giske, S. Harbarth, J. F. Hindler, G. Kahlmeter, B. Olsson-Liljequist, D. L. Paterson, L. B. Rice, J. Stelling, M. J. Struelens1, A. Vatopoulos, J. T. Weber, and D. L. Monnet. 2011. Multidrug-Resistant, Extensively Drug-Resistant and Pandrug-Drug-Resistant Bacteria: an International Expert Proposal for Interim Standard Definitions for Acquired Resistance. Clinical
Microbiology and Infection. 18(3): 268-281.
Martin- Visscher,L. A., M. J. van Belkum, S. Garneau-Tsodikova, R. M. Whittal, J. Zheng, L. M. McMullen, and J. C. Vederas. 2008. Isolation and
Characterization of Carnocyclin A, a Novel Circular Bacteriocin Produced byCarnobacterium maltaromaticumUAL307.Applied and Environmental Microbiology. 74(15): 4756–4763.
Martinez-Maqueda, D., B. Hernández-Ledesma , L. Amigo , B. Miralles , and J. Ángel Gómez-Ruiz. 2013. Extraction/Fractionation Techniques for Proteins and Peptides and Protein Digestion inProteomics in Foods: Principles and Applications.F. Toldrá and L. M. L. Nollet (eds.). Springer Science+Business Media. New York.. Pp 21-50.
McCalley, D. V. 2002. Review: Analysis of theCinchonaAlkaloids by High Performance Liquid Chromatography and Other Separation Techniques. Journal of Chromatography A. 967: 1–19.
Meickle, T.. 2010. Isolation and Structure Elucidation of Novel Compounds from Marine Cyanobacteria (Dissertation). Florida Atlantic University Boca Raton. Forida.
Mohan, N., Hanumantha R. P., Ranjith K. R., and Sivasubramanian V. 2010.
Mass Cultivation of
C. turgidus
and
Oscillatoria
sp. and
Effective Harvesting of Biomass by Low-cost Methods.
Nature Precedings.doi:10.1038/npre.2010.4331.1.Mondol,M. A. M., J. H. Kim,M. A. Lee, F. S. Tareq, H. S. Lee,Y. J. Lee, and H. J. Shin. 2011. Ieodomycins A_D, Antimicrobial Fatty Acids from a Marine Bacillus sp.J. Nat. Prod. 74: 1606–1612.
61
Mundt, S., S. Kreitlow, and R. Jansen. 2003. Fatty Acids with Antibacterial Activity from the Cyanobacterium Oscillatoria redekei HUB051. J. Appl. Phycol. 15 : 263–267
Naturwissenchaften. 2002. Biologi of toxic Alga: Species of Genus
Craysochromulina (Prymnesiophyceae) and Alexandrium (Dynophyceae) (disertasi). Breman university. Uwe John.
Panno, L., A. Anastasi, S. Voyron, A. Kramer, A. Labes, and G. C. Varese. 2011. Marine Fungi: Extracellular Enzymes Production and Screening of Fungal Strains for Pharmaceutical Properties. World Conference on Marine Biodiversity.
Probert, I., and C. Klaas. Microalgal Culturing. Diakses pada 3 Mei 2007. http://www.nhm.ac.uk/hosted_sites/ina/CODENET/
Putri, A.P. dan I. Atmosukarto. 2006. Mikroba Endofit: Sumber Molekul Acuan Baru yang Berpotensi. Majalah Biotrends. 1(2): 13-15.
Raveh, A. & Carmeli, S. 2007. Antimicrobial Ambiguines from the
Cyanobacterium Fischerella sp. Collected in Israel. J.Nat.Prod. 70: 196– 201.
Shelef, G. and M. Sukenik 1984. Microalgae Harvesting and Processing: A Literatur Review. Technion Research and Development Foundation ltd. Haifa. Israel.
Singh, R. K., S. P. Tiwari, A. K Rai, and T. M. Mohapatra. 20011.
Cyanobacteria: an Emerging Source for Drug Discovery. The Journal of Antibiotics. 64, 401–412.
Silverstein, R.M., F.X, Webster, and D.J. Kiemle. 2005. Spectrometric
Identification of Organic Compound,7thEdition. John Willey and Sons Inc. New York. Pp 71-160.