SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL SERTA
FRAKSI-FRAKSI BUNGA BELIMBING WULUH (Averrhoa bilimbi L.)
TERHADAP BAKTERI Staphylococcus aureus DAN
Klebsiella pneumoniae
SKRIPSI
OLEH: NUR AZMI NIM 091501027
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL SERTA
FRAKSI-FRAKSI BUNGA BELIMBING WULUH (Averrhoa bilimbi L.)
TERHADAP BAKTERI Staphylococcus aureus DAN
Klebsiella pneumoniae
OLEH: NUR AZMI NIM 091501027
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 19 Oktober 2013
Pembimbing I, Panitia Penguji,
Dra. Suwarti Aris, M.Si., Apt. Dr. Marline Nainggolan, M.S., Apt. NIP 195107231982032001 NIP 195709091985112001
Pembimbing II, Dra. Suwarti Aris, M.Si., Apt. NIP 195107231982032001
Dra. Aswita Hafni Lubis, M.Si., Apt. Drs. Awaluddin Saragih, M.Si., Apt. NIP 195304031983032001 NIP 195008221974121002
Drs. Suryadi Achmad, M.Sc., Apt. NIP 195109081985031002
Medan, 27 September 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
SKRINING FITOKIMIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL SERTA
FRAKSI-FRAKSI BUNGA BELIMBING WULUH (Averrhoa bilimbi L.)
TERHADAP BAKTERI Staphylococcus aureus DAN
Klebsiella pneumoniae
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: NUR AZMI NIM 091501027
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT, karena limpahan rahmat serta
karuniaNya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul:
Skrining Fitokimia dan Uji Aktivitas Antibakteri Ekstrak Etanol Serta
Fraksi-Fraksi Bunga Belimbing Wuluh (Averrhoa bilimbi L.) Terhadap Bakteri
Staphylococcus aureus dan Klebsiella pneumoniae. Skripsi ini diajukan
sebagai salah satu syarat untuk memperoleh gelar sarjana farmasi dari Fakultas
Farmasi Universitas Sumatera Utara Medan.
Pada kesempatan ini penulis mengucapkan terimakasih yang tulus dan
ikhlas kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan
Fakultas Farmasi USU Medan yang telah memberikan fasilitas sehingga
penulis dapat menyelesaikan pendidikan sarjana farmasi. Ibu Dra. Suwarti
Aris, M.Si., Apt., dan Dra. Aswita Hafni Lubis, M.Si., Apt., selaku
pembimbing yang telah memberikan waktu, bimbingan dan nasehat selama
penelitian hingga penyusunan skripsi ini dapat diselesaikan. Ibu Dr. Marline
Nainggolan, M.S., Apt., Ibu Dra. Suwarti Aris, M.Si., Apt., Bapak Drs.
Awaluddin Saragih, M.Si., Apt., dan Bapak Drs. Suryadi Achmad, M.Sc., Apt.,
selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada
penulis dalam menyelesaikan skripsi ini. Bapak dan Ibu staf pengajar Fakultas
Farmasi USU Medan yang telah mendidik selama perkuliahan dan Ibu Dra.
Azizah Nasution, M.Sc., Apt., selaku penasehat akademis yang telah
Farmakognosi dan Ibu kepala Laboratorium Mikrobiologi yang telah
memberikan bantuan dan fasilitas selama penulis melakukan penelitian.
Penulis juga mengucapkan terimakasih dan penghargaan yang tiada
terhingga kepada Ayahanda Drs. Nazaruddin, Ibunda Zainar S.pd tercinta dan
adikku Azrul Ruddin, yang tiada hentinya berkorban dan berdoa dengan tulus
ikhlas bagi kesuksesan penulis, juga kepada Beasiswa Peduli Pendidikan
Angkasa Pura II yang telah memberikan bantuan biaya pendidikan selama
penulis menjalani kuliah sampai pada penyelesaian skripsi ini, serta kepada
teman-teman dan sahabat-sahabatku Devy Novitasari, Dzul Azmah, Ovalina
Sylvia, Khadijah Husna, Dita Hafsari, Khairunnisa Rambe, Asih Tria
Wulandari, Yusrina, Riza Maulidiya, Hetti Purnama, Nulika Fitria, Lita
Nelliyani, Syukria Rahmayani, Rina Sari Lubis, kak Nomita Sari Sagala, Kak
Vriezka, Fadlina Aulia, Fifie Primawati, Tri Rizki Wahyuni, Febbi Fenesia,
Putri Anggreini, Lyvana Istiarah, Indriani Kumala Dewi, Linda Marhama,
Ferra Zu’ami, Yusnawati dan Aji Muhiddin Lubis yang selalu setia memberi
doa dan motivasi selama penulis melakukan penelitian.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna,
sehingga penulis mengharapkan kritik dan saran yang membangun untuk
penyempurnaannya. Harapan saya semoga skripsi ini dapat bermanfaat bagi
ilmu pengetahuan kefarmasian.
Medan, Oktober 2013 Penulis
SKRINING FITOKIMIA DAN UJI AKTIVITAS ANTIBAKTERI EKSTRAK ETANOL SERTA FRAKSI-FRAKSI BUNGA BELIMBING WULUH (Averrhoa bilimbi L.) TERHADAP
BAKTERI Staphylococcus aureus DAN Klebsiella pneumoniae
ABSTRAK
Belimbing wuluh (Averrhoa bilimbi L.) merupakan salah satu tanaman yang digunakan sebagai obat tradisional. Bagian dari belimbing wuluh yang digunakan untuk pengobatan meliputi bunga, daun dan buah. Sejak zaman dahulu masyarakat Desa Subur, Kecamatan Air Joman, Kabupaten Asahan telah memanfaatkan untaian bunga belimbing wuluh sebagai obat batuk dan sariawan pada anak-anak. Tujuan penelitian ini adalah untuk mengetahui karaktersitik simplisia, golongan senyawa kimia dan uji aktivitas antibakteri bunga belimbing wuluh terhadap bakteri Staphylococcus aureus dan Klebsiella pneumoniae.
Simplisia diekstraksi secara perkolasi menggunakan pelarut etanol kemudian difraksinasi dengan cara ekstraksi cair-cair menggunakan pelarut
n-heksana dan etilasetat. Selanjutnya dilakukan uji aktivitas antibakteri menggunakan metode difusi agar dengan cara sumuran.
Hasil karakterisasi simplisia diperoleh kadar air sebesar 7,94%, kadar sari yang larut dalam air sebesar 11,97%, kadar sari yang larut dalam etanol sebesar 2,39%, kadar abu total sebesar 8,24% dan kadar abu yang tidak larut dalam asam sebesar 5,52%. Skrining fitokimia menunjukkan adanya golongan senyawa kimia flavonoid, glikosida, tanin dan steroid/triterpenoid. Uji aktivitas antibakteri menunjukkan bahwa ekstrak etanol memberikan daerah hambat yang efektif terhadap pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 200 mg/ml yaitu 15,82 mm dan terhadap bakteri Klebsiella pneumoniae pada konsentrasi 200 mg/ml yaitu 14,73 mm. Fraksi n-heksana memberikan daerah hambat yang kurang efektif terhadap kedua bakteri. Sedangkan fraksi etilasetat juga memberikan daerah hambat yang efektif terhadap pertumbuhan bakteri Staphylococcus aureus pada konsentrasi 200 mg/ml yaitu 15,5 mm dan terhadap bakteri Klebsiella pneumoniae pada konsentrasi 200 mg/ml yaitu 14,5 mm. Sedangkan fraksi air memberikan daerah hambat yang kurang efektif terhadap kedua bakteri.
PHYTOCHEMICAL SCREENING AND ANTIBACTERIAL ACTIVITY
TEST OF ETHANOL EXTRACTS AND FRACTIONS OF PICKLE FRUIT FLOWER (Averrhoa bilimbi L.)
AGAINST Staphylococcus aureus AND Klebsiella pneumoniae
ABSTRACT
Pickle fruit (Averrhoa bilimbi L.) is one of the plant used a traditional medicine. Parts of the pickle fruit used for therapy are flowers, leaves and fruits. Since in immemorial time people in Desa Subur, Kecamatan Air Joman, Kabupaten Asahan have been using pickle fruit flower as cough and thrush medicine for children. The purpose of this study was evaluated simplicia characteristics, the chemical compounds and antibacterial activity of pickle fruit flower against Staphylococcus aureus and Klebsiella pneumoniae.
Simplicia extracted by percolation using ethanol solvent and fractionation of extract with liquid-liquid extraction method using n-hexane and ethylacetate solvents. And continued to antibacterial activity test by using pitting agar diffusion method.
The result of characterization simplicia retrieved the water content is 7.94%, the water soluble extract content is 11.97%, the ethanol soluble extract content is 2.39%, the total ash content is 8.24% and the acid insoluble ash content is 5.52%. Phytochemical screening showed the presence of chemical compounds are flavonoid, glycoside, tannin and steroid/triterpenoid. Antibacterial activity test showed that ethanol extract provide effective inhibitory area to growth of the bacteria Staphylococcus aureus at a concentration of 200 mg/ml is 15.82 mm and Klebsiella pneumoniae at a concentration of 200 mg/ml is 14.73 mm. The n-hexane fraction give the inhibitory area is less effective against both bacteria. While the ethylasetate fraction also provide effective inhibitory area to growth of the bacteria
Staphylococcus aureus at a concentration of 200 mg/ml is 15.5 mm and
Klebsiella pneumoniae at a concentration of 200 mg/ml is 14.5 mm. While the fraction of water also give the inhibitory area is less effective against both bacteria.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian Tumbuhan ... 4
2.1.1 Habitat ... 4
2.1.2 Morfologi ... 4
2.1.3 Sistematika tumbuhan ... 5
2.1.5 Manfaat ... 6
2.2 Metode Ekstraksi ... 7
2.3 Sterilisasi ... 8
2.4 Bakteri ... 10
2.4.1 Morfologi sel bakteri ... 11
2.4.2 Fase pertumbuhan mikroorganisme ... 12
2.4.3 Pengaruh faktor lingkungan ... 12
2.4.4 Staphylococcus aureus ... 16
2.4.5 Klebsiella pneumoniae ... 16
2.5 Media Biakan Mikroba ... 17
2.6 Pengujian Aktivitas Antimikroba ... 21
BAB III METODE PENELITIAN ... 24
3.1 Alat- alat ... 24
3.2 Bahan-bahan ... 25
3.3 Penyiapan Bahan Tumbuhan ... 25
3.3.1 Pengambilan bahan tumbuhan ... 25
3.3.2 Identifikasi tumbuhan ... 26
3.3.3 Pembuatan simplisia ... 26
3.4 Pembuatan Pereaksi ... 26
3.4.1 Pereaksi Mayer ... 26
3.4.2 Pereaksi Dragendorff ... 26
3.4.3 Pereaksi Bouchardat ... 27
3.4.5 Pereaksi Liebermann-Burchard ... 27
3.4.6 Pereaksi larutan besi (III) klorida 1% b/v ... 27
3.4.7 Pereaksi larutan timbal (II) asetat 0,4 M ... 27
3.4.8 Pereaksi larutan natrium hidroksida 2 N ... 27
3.4.9 Larutan asam klorida 2 N ... 27
3.4.10 Pereaksi larutan asam sulfat 2 N ... 28
3.4.11 Larutan kloralhidrat ... 28
3.5 Pemeriksaan Karakteristik Simplisia ... 28
3.5.1 Pemeriksaan makroskopik ... 28
3.5.2 Pemeriksaan mikroskopik ... 28
3.5.3 Penetapan kadar air ... 28
3.5.4 Penetapan kadar sari larut dalam air ... 29
3.5.5 Penetapan kadar sari larut dalam etanol ... 30
3.5.6 Penetapan kadar abu total ... 30
3.5.7 Penetapan kadar abu tidak larut dalam asam ... 30
3.6 Skrining Fitokimia ... 31
3.6.1 Pemeriksaan alkaloid ... 31
3.6.2 Pemeriksaan flavonoid ... 31
3.6.3 Pemeriksaan glikosida ... 32
3.6.4 Pemeriksaan glikosida antrakinon ... 32
3.6.5 Pemeriksaan saponin ... 33
3.6.6 Pemeriksaan tanin ... 33
3.7 Pembuatan Ekstrak ... 33
3.7.1 Pembuatan fraksi-fraksi dari ekstrak etanol ... 34
3.8 Sterilisasi Alat ... 35
3.9 Pembuatan Media ... 35
3.10 Pembuatan Agar Miring ... 36
3.11 Pembuatan Stok Kultur Bakteri ... 37
3.12Penyiapan Inokulum Bakteri ... 37
3.13Pembuatan Larutan Uji dengan Berbagai Konsentrasi ... 37
3.14 Pengujian Aktivitas Antibakteri Secara In Vitro ... 38
BAB IV HASIL DAN PEMBAHASAN ... 39
4.1 Hasil Identifikasi Tumbuhan ... 39
4.2 Hasil Karakterisasi Simplisia ... 39
4.2.1 Pemeriksaan makroskopik ... 39
4.2.2 Pemeriksaan mikroskopik ... 39
4.2.3 Pemeriksaan karakteristik serbuk simplisia ... 40
4.3 Hasil Ekstraksi dan Fraksinasi... 41
4.4 Hasil Skrining Fitokimia ... 41
4.5 Hasil Uji Aktivitas Antibakteri ... 42
BAB V KESIMPULAN DAN SARAN ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 48
DAFTAR PUSTAKA ... 49
DAFTAR TABEL
Tabel Halaman
4.1 Hasil skrining fitokimia simplisia, ekstrak etanol, fraksi n-heksana, fraksi etilasetat, dan fraksi air bunga
belimbing wuluh ... 41
4.2 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus ... 43
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi tumbuhan ... 52
2 Gambar bunga belimbing wuluh (Averrhoa bilimbi L.) ... 53
3 Gambar simplisia bunga belimbing wuluh
(Averrhoa bilimbi L.) ... 54
4 Gambar serbuk simplisia bunga belimbing wuluh
(Averrhoa bilimbi L.) ... 55
5 Gambar mikroskopik serbuk simplisia bunga belimbing wuluh (Averrhoa bilimbi L.) ... 56
6 Bagan metode penelitian ... 57
7 Tabel hasil pemeriksaan karakteristik serbuk simplisia
bunga belimbing wuluh ... 60
8 Perhitungan penetapan kadar air simplisia bunga belimbing wuluh ... 61
9 Perhitungan penetapan kadar sari larut dalam air simplisia bunga belimbing wuluh ... 62
10 Perhitungan penetapan kadar sari larut dalam etanol
simplisia bunga belimbing wuluh ... 63
11 Perhitungan penetapan kadar abu total simplisia
bunga belimbing wuluh ... 64
12 Perhitungan penetapan kadar abu tidak larut dalam asam
simplisia bunga belimbing wuluh ... 65
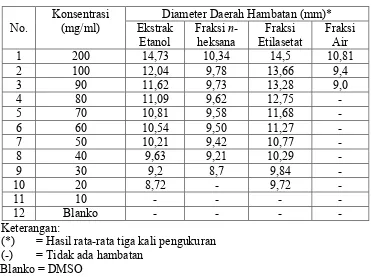
13 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Klebsiella pneumoniae
pada ekstrak etanol bunga belimbing wuluh ... 66
14 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Klebsiellapneumoniae
[image:13.595.128.492.162.744.2]15 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Klebsiellapneumoniae
pada fraksi etilasetat bunga belimbing wuluh ... 68
16 Hasil pengukuran diameter daerah hambatan pertumbuhan bakteri Staphylococcus aureus dan Klebsiellapneumoniae
pada fraksi air bunga belimbing wuluh ... 69
17 Gambar uji aktivitas antibakteri ekstrak etanol bunga belimbing wuluh terhadap bakteri
Staphylococcus aureus ... 70
18 Gambar uji aktivitas antibakteri ekstrak etanol
bunga belimbing wuluh terhadap bakteri
Klebsiella pneumoniae ... 73
19 Gambar uji aktivitas antibakteri fraksi n-heksana bunga belimbing wuluh terhadap bakteri
Staphylococcus aureus ... 76
20 Gambar uji aktivitas antibakteri fraksi n-heksana bunga belimbing wuluh terhadap bakteri
Klebsiella pneumoniae ... 79
21 Gambar uji aktivitas antibakteri fraksi etilasetat bunga belimbing wuluh terhadap bakteri
Staphylococcus aureus ... 82
22 Gambar uji aktivitas antibakteri fraksi etilasetat bunga belimbing wuluh terhadap bakteri
Klebsiella pneumoniae ... 85
23 Gambar uji aktivitas antibakteri fraksi air bunga belimbing wuluh terhadap bakteri
Staphylococcus aureus ... 88
24 Gambar uji aktivitas antibakteri fraksi air bunga belimbing wuluh terhadap bakteri
[image:14.595.131.494.81.652.2]BAB I PENDAHULUAN
1.1 Latar Belakang
Sejak dahulu pengobatan tradisional sudah ada di Indonesia. Umumnya
yang digunakan sebagai obat tradisional berasal dari tumbuhan. Salah satu
tanaman yang sering digunakan sebagai obat tradisional adalah belimbing
wuluh (Averrhoa bilimbi L.). Hampir semua bagian dari tanaman belimbing
wuluh dapat digunakan untuk pengobatan meliputi daun, bunga dan buah
(Mario, 2011).
Untaian bunga belimbing wuluh sering dimanfaatkan sebagai obat
tradisional oleh masyarakat Desa Subur, Kecamatan Air Joman, Kabupaten
Asahan, Provinsi Sumatera Utara untuk mengobati batuk dan sariawan pada
anak-anak.
Ardananurdin (2004), telah melakukan penelitian uji efektivitas dekok
bunga belimbing wuluh sebagai antimikroba terhadap bakteri Salmonella thypi
secara in vitro menggunakan metode dilusi tabung dan dengan penggoresan
pada medium padat, dan diperoleh hasil bahwa bunga belimbing wuluh efektif
sebagai antimikroba terhadap bakteri Salmonella thypi.
Antibakteri adalah senyawa yang mengganggu pertumbuhan dan
metabolisme bakteri, sehingga senyawa tersebut dapat menghambat
pertumbuhan atau bahkan membunuh bakteri (Pelczar dan Chan, 1998).
Staphylococcus aureus merupakan bakteri gram positif yang berbentuk bulat
membran mukosa merupakan barrier yang sangat baik terhadap invasi lokal
Staphylococcus aureus. Dapat menyebabkan infeksi lokal pada kulit, hidung,
uretra, saluran pernafasan dan saluran pencernaan (Harris, et al., 2002).
Klebsiella pneumoniae adalah bakteri gram negatif berbentuk batang yang
dapat menyebabkan infeksi pada saluran pernafasan seperti pneumonia
(Jawetz, et al., 2001). Klebsiella pneumoniae merupakan penghuni normal
traktus digestivus. Selain menginfeksi pernafasan juga dapat menyebabkan
infeksi saluran kemih dan infeksi nosokomial (Susilo, 2004).
Berdasarkan uraian diatas maka penulis melakukan penelitian untuk
mengetahui karakteristik simplisia, golongan senyawa kimia, serta aktivitas
antibakteri ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air
bunga belimbing wuluh (Averrhoa bilimbi L.) terhadap bakteri Staphylococcus
aureus dan Klebsiella pneumoniae menggunakan metode difusi agar dengan
cara sumuran. Peneliti terlebih dahulu melakukan karakterisasi simplisia untuk
mengetahui kelayakan simplisia sebelum dibuat menjadi ekstrak dan digunakan
dalam pembuatan sediaan obat. Sedangkan fraksinasi secara ekstraksi cair-cair
bertujuan untuk menyari kembali senyawa metabolit sekunder berdasakan
tingkat kepolarannya.
1.2 Perumusan Masalah
1. Apakah karakteristik simplisia bunga belimbing wuluh memenuhi
persyaratan?
2. Apakah golongan senyawa kimia yang terdapat di dalam bunga
3. Apakah ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi
air bunga belimbing wuluh memiliki aktivitas antibakteri terhadap
bakteri Staphylococcus aureus dan Klebsiella pneumoniae?
1.3 Hipotesis
1. Karakteristik simplisia bunga belimbing wuluh memenuhi
persyaratan.
2. Golongan senyawa kimia yang terdapat di dalam bunga belimbing
wuluh adalah saponin, flavonoid dan polifenol.
3. Ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi air
bunga belimbing wuluh memiliki aktivitas antibakteri terhadap
bakteri Staphylococcus aureus dan Klebsiella pneumoniae.
1.4 Tujuan Penelitian
1. Untuk mengetahui karakteristik simplisia bunga belimbing wuluh
2. Untuk mengetahui golongan senyawa kimia yang terdapat di dalam
bunga belimbing wuluh.
3. Untuk mengetahui aktivitas antibakteri ekstrak etanol, fraksi n
-heksana, fraksi etilasetat dan fraksi air bunga belimbing wuluh
terhadap bakteri Staphylococcus aureus dan Klebsiella pneumoniae.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah sebagai informasi tentang
karakteristik simplisia, golongan senyawa kimia dan aktivitas antibakteri dari
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tanaman Belimbing Wuluh (Averrhoa bilimbi L.)
Tanaman belimbing wuluh berupa pohon kecil dengan batang yang
tidak begitu besar dan mempunyai garis tengah 30 cm (Lathifah, 2008).
Tanaman ini mudah sekali tumbuh dan berkembangbiak melalui cangkok atau
persemaian biji. Jika ditanam lewat biji, pada usia 3-4 tahun sudah mulai
berbuah. Jumlah setahunnya bisa mencapai 1.500 buah (Mario, 2011).
2.1.1 Habitat
Belimbing wuluh disebut juga belimbing asam adalah sejenis pohon
yang diperkirakan berasal dari kepulauan Maluku. Tanaman ini tumbuh dengan
subur di Indonesia, Filipina, Sri Lanka, Myanmar dan Malaysia. Dapat ditemui
di tempat yang banyak terkena sinar matahari langsung tetapi cukup lembap.
Merupakan salah satu tanaman yang banyak tumbuh dipekarangan rumah atau
tumbuh secara liar di ladang dan hutan. Hidup pada ketinggian 5-500 m di atas
permukaan laut (Yuniarti, 2008).
2.1.2 Morfologi
Pohon belimbing bisa tumbuh dengan ketinggian mencapai 5-10 m.
Batang utamanya pendek, berbenjol-benjol, cabangnya rendah dan sedikit.
Batangnya bergelombang atau tidak rata (Masripah, 2009).
Bentuk daunnya majemuk menyirip ganjil dengan 21-45 pasang anak
ujung runcing, pangkal membulat, tepi rata, panjang 2-10 cm, lebarnya 1-3 cm,
berwarna hijau, permukaan bawah hijau muda (Dalimartha, 2008).
Perbungaan berupa malai, bunganya kecil, berkelompok, keluar
langsung pada batang dan cabang-cabangnya dengan tangkai bunga berambut,
menggantung, panjang 5-20 cm, mahkota bunga biasanya berjumlah 5, panjang
kelopak bunga 5-7 mm; helaian mahkota bunga berbentuk elips; panjang
13-20 mm, berwarna ungu gelap dan bagian pangkalnya ungu muda; benang
sari semuanya subur (Masripah, 2009; Mario, 2011).
Buah belimbing wuluh berbentuk elips hingga seperti torpedo dengan
panjang 4-10 cm. Warna buah ketika muda hijau, dengan sisa kelopak bunga
menempel diujungnya. Jika masak buahnya berwarna kuning pucat. Daging
buahnya berair dan sangat asam. Kulit buah berkilap dan tipis. Bijinya kecil
(6 mm) berbentuk pipih dan berwarna coklat, serta tertutup lendir (Mario,
2011).
2.1.3 Sistematika tumbuhan
Sistematikatumbuhan belimbing wuluh (Heyne, 1987) sebagai berikut:
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Geraniales
Suku : Oxalidaceae
Marga : Averrhoa
2.1.4 Kandungan kimia
Kandungan kimia pada tanaman belimbing wuluh secara lebih rinci
yaitu pada daunnya mengandung tanin, sulfur, asam format, kalium sitrat dan
kalsium oksalat. Sedangkan ibu tangkai daunnya mengandung alkaloid dan
polifenol. Batang pada tanaman belimbing mengandung senyawa saponin,
tanin, glukosida, kalsium oksalat, sulfur, asam format, peroksidase, dan
buahnya mengandung senyawa flavonoid dan triterpenoid (Permadi, 2006).
Menurut Ardananurdin (2004), bunga belimbing wuluh mengandung golongan
senyawa kimia yang bersifat antibakteri seperi saponin, flavonoid dan
polifenol.
2.1.5 Manfaat
Bunga belimbing wuluh dimanfaatkan sebagai obat tradisional untuk
mengobati batuk, flu dan sariawan pada anak-anak (Heyne, 1987; Das, et al.,
2011). Untuk mengobati batuk pada anak-anak dapat dibuat ramuan dengan
cara, tim segenggam bunga belimbing wuluh, beberapa butir adas, gula
secukupnya dan 1 cangkir air selama setengah jam. Setelah dingin disaring,
kemudian bagi untuk 2 kali minum, pagi dan malam sewaktu perut kosong
(Dalimartha, 2008). Sedangkan untuk mengobati sariawan dibuat ramuan
dengan cara segenggam bunga belimbing wuluh, gula jawa secukupnya, dan 1
cangkir air. Direbus sampai kental, setelah dingin disaring. Dipakai untuk
membersihkan mulut dan dioleskan pada sariawan (Mario, 2011). Bunga
belimbing wuluh juga dapat digunakan untuk mengobati demam tifoid
2.2 Metode Ekstraksi
Ekstraksi merupakan penarikan senyawa kimia dari jaringan tumbuhan
ataupun hewan dengan menggunakan penyari tertentu. Cara ekstraksi yang
tepat tergantung pada bahan tumbuhan yang diekstraksi dan jenis senyawa
yang diisolasi (Ditjen POM, 2000). Ekstrak adalah sediaan kering, kental atau
cair dibuat dengan menyari simplisia nabati atau hewani menurut cara yang
cocok, di luar pengaruh cahaya matahari langsung, ekstrak kering harus mudah
digerus menjadi serbuk. Sebagai cairan penyari dapat digunakan air, eter atau
campuran etanol dan air (Ditjen POM, 1979).
Metode ekstraksi dapat dilakukan dengan berbagai cara, antara lain:
I. Cara dingin
a. Maserasi
Maserasi adalah proses penyarian dengan merendam simplisia dalam
pelarut yang sesuai dengan beberapa kali pengocokan atau pengadukan
pada temperatur ruangan dan terlindung dari cahaya (Depkes, 2000).
b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada
temperatur ruangan (Depkes, 2000).
II.Cara panas
a. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan pelarut
terbatas yang relatif konstan dengan adanya pendingin balik (Depkes,
2000).
b. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang dipanaskan hingga
mendidih sehingga uap membasahi serbuk simplisia karena adanya
pendingin balik dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan (Ditjen POM, 2000).
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-50oC (Depkes, 2000).
d. Infus
Infus adalah sediaan cair yang dibuat dengan menyari simplisia dengan
air pada suhu 90oC selama 15 menit (Depkes, 1986).
e. Dekok
Dekok adalah penyarian dengan menggunakan air pada suhu 90oC
selama 30 menit (Goeswin, 2007).
2.3 Sterilisasi
Sterilisasi berarti membebaskan tiap benda atau substansi dari semua
kehidupan dalam bentuk apapun, tujuannya untuk mendapatkan keadaan yang
steril. Sterilisasi dapat dilakukan dengan tiga cara, yaitu: a) Sterilisasi
pemanasan basah dengan menggunakan uap atau air panas, b) Sterilisasi kering
Berdasarkan dari tiga cara tersebut, sterilisasi dapat dibagi menjadi:
I. Sterilisasi kering
Sterilisasi kering dapat dilakukan dengan cara sebagai berikut:
a. Pemijaran
Pemijaran digunakan untuk sterilisasi pada ose, ujung-ujung pinset,
dan sudip (spatula) logam.
b. Jilatan api (Flaming)
Jilatan api digunakan untuk sterilisasi pada skalpel, jarum, mulut
tabung biakan, kaca objek, dan kaca penutup. Benda-benda tersebut
dijilatkan pada api bunsen tanpa membiarkannya memijar.
c. Tanur uap panas (Hot-Air Oven)
Sebagian besar sterilisasi kering dilakukan dengan alat ini. Biasanya
digunakan suhu 160-165ºC selama 1 jam. Cara ini baik dilakukan
terhadap alat-alat kering terbuat dari kaca, seperti tabung reaksi,
cawan petri, labu, pipet, pinset, skalpel, gunting, kapas hapus
tenggorok, dan alat suntik dari kaca. Kadang-kadang dilakukan
sterilisasi pada suhu 170ºC selama 2 jam.
II. Sterilisasi basah
Sterilisasi basah dapat dilakukan dengan cara sebagai berikut:
a. Perebusan dalam air
Cara ini hanya cukup untuk mematikan mikroorganisme yang tidak
berspora. Memang ada spora yang tidak tahan perebusan, tetapi
1-3 jam. Efek pensterilan dengan perebusan dapat diperbaiki dengan
penambahan 2% natrium karbonat.
b. Uap mengalir
Uap mengalir bebas digunakan dalam tempat yang tidak tertutup
rapat, yang dapat menahan uap tanpa tekanan. Air mendidih dan uap
bebas tidak pernah mencapai suhu lebih dari 100ºC (212ºF). Uap
bebas ini kadang-kadang digunakan untuk melakukan sterilisasi
bertingkat atau tindalisasi. Cara ini dipelopori oleh John Tyndall
(1820-1893), adalah suatu proses sterilisasi dengan menggunakan uap
pada suhu 100ºC, yang dialirkan pada benda yang akan disterilkan
untuk beberapa menit berkali-kali (tiga sampai empat kali) dengan
selang waktu 24 jam.
c. Uap dalam tekanan
Pensterilan dengan uap dalam tekanan dilakukan dalam autoklaf.
Dalam autoklaf, sterilisasi dilakukan pada suhu 121ºC di bawah
tekanan 15 ib (2 atmosfer) selama 15-20 menit. Dalam suhu dan
waktu tersebut semua mikroorganisme, baik vegetatif maupun spora
dapat dimusnahkan (Irianto, 2006).
2.4Bakteri
Bakteri merupakan suatu organisme prokariot yang berarti tidak
mempunyai inti sel sejati. Bakteri pada umumnya mempunyai ukuran sel
0,5-1,0 µm kali 2,0-5,0 µm (Fardiaz, 1992). Berdasarkan proses pewarnaan gram,
gram negatif. Bakteri gram positif menyerap zat warna pertama yaitu kristal
violet yang menyebabkan warna ungu, sedangkan bakteri gram negatif
menyerap zat warna kedua yaitu safranin dan menyebabkannya berwarna
merah. Perbedaan hasil dalam pewarnaan gram disebabkan perbedaan struktur,
terutama dinding sel kedua bakteri tersebut (Waluyo, 2010).
2.4.1 Morfologi sel bakteri
Ada beberapa bentuk dasar sel bakteri menurut Fardiaz (1992), yaitu
bulat (tunggal: coccus, jamak: cocci), batang atau silinder (tunggal: bacillus,
jamak: bacilli), dan bentuk spiral.
a. Bentuk bulat (cocci)
Berdasarkan pengelompokkan selnya, bakteri berbentuk bulat dapat
dibedakan atas beberapa jenis, antara lain diplococci (sel yang
berpasangan atau dua sel), streptococci (rangkaian sel yang membentuk
rantai panjang atau pendek), tetrad (empat sel bulat yang membentuk
persegi empat), staphylococci (kumpulan sel yang tidak beraturan seperti
buah anggur), dan sarcina (kumpulan sel berbentuk kubus yang terdiri
dari 8 sel atau lebih).
b. Bentuk bacilli
Sebagian besar bacilli tampak sebagai batang tunggal. Terbagi dalam dua
bentuk yaitu diplobacilli (bentuk berpasangan) dan streptobacilli
c. Bentuk spiral
Bakteri berbentuk spiral (tunggal, spirilium; jamak, spirila) terdapat
secara terpisah-pisah (tunggal), tetapi masing-masing spesies berbeda
dalam panjang, jumlah, dan lekukan spiralnya. Bakteri yang ukurannya
pendek dengan spiral yang tidak lengkap disebut bakteri koma atau
vibrio.
2.4.2 Fase pertumbuhan mikroorganisme
Fase pertumbuhan mikroorganisme menurut Pratiwi (2008) terbagi
menjadi empat macam fase yaitu fase lag, fase log (fase eksponensial), fase
stasioner, dan fase kematian.
I. Fase lag (fase adaptasi), merupakan fase penyesuaian mikroorganisme
pada suatu lingkungan baru. Ciri fase lag adalah tidak adanya
peningkatan jumlah sel, yang ada hanyalah peningkatan ukuran sel. Lama
fase lag tergantung pada kondisi dan jumlah awal mikroorganisme dan
media pertumbuhan.
II. Fase log (fase eksponensial), merupakan fase dimana mikroorganisme
tumbuh dan membelah pada kecepatan maksimum, tergantung pada
genetika mikroorganisme, sifat media dan kondisi pertumbuhan. Sel baru
terbentuk dengan laju konstan dan massa yang bertambah secara
eksponensial.
III. Fase stasioner, merupakan fase dimana pertumbuhan mikroorganisme
berhenti dan terjadi keseimbangan antara jumlah sel yang membelah
IV. Fase kematian, merupakan fase dimana jumlah sel yang mati meningkat.
Faktor penyebabnya adalah ketidaktersediaan nutrisi dan akumulasi
produk buangan yang toksik.
2.4.3 Pengaruh faktor lingkungan pada pertumbuhan
Faktor yang mempengaruhi pertumbuhan mikroorganisme dapat
dibedakan menjadi faktor fisik dan faktor kimia. Faktor fisik meliputi
temperatur, pH, dan tekanan osmosis. Faktor kimia meliputi karbon, oksigen,
trace element dan faktor-faktor pertumbuhan organik termasuk nutrisi yang
terdapat dalam media pertumbuhan (Pratiwi, 2008).
A. Pengaruh faktor fisik pada pertumbuhan
I. Temperatur
Temperatur menentukan aktivitas enzim yang terlibat dalam aktivitas
kimia. Peningkatan temperatur sebesar 10ºC dapat meningkatkan aktivitas
enzim sebesar dua kali lipat. Pada temperatur yang sangat tinggi dapat
menyebabkan denaturasi protein yang tidak dapat balik (irreversible)
sedangkan pada temperatur yang sangat rendah aktivitas enzim akan
berhenti. Pada temperatur pertumbuhan optimal akan terjadi kecepatan
pertumbuhan optimal dan dihasilkan jumlah sel yang maksimal.
Berdasarkan kisaran temperatur tumbuh, mikroorganisme dibagi atas
empat golongan:
a. Psikrofil, tumbuh pada temperatur maksimal 20oC dengan suhu
b. Psikrofil fakultatif/ psikotrof, tumbuh pada temperatur maksimal 30ºC
dengan suhu optimal 20 sampai 30ºC, dapat tumbuh pada 0ºC.
c. Mesofil, tumbuh pada temperatur 15 sampai 45oC dengan suhu
optimal 20 sampai 40oC.
d. Termofil, tumbuh pada temperatur 45 sampai 100oC dengan suhu
optimal 55 sampai 65oC.
II. pH
pH merupakan indikasi konsentrasi ion hidrogen. Peningkatan dan
penurunan konsentrasi ion hidrogen dapat menyebabkan ionisasi
gugus-gugus dalam protein, amino dan karboksilat. Hal ini dapat menyebabkan
denaturasi protein yang mengganggu pertumbuhan sel. Kebanyakan
bakteri memiliki pH optimum terletak antara 6,5 dan 7,5.
III. Tekanan osmosis
Tekanan osmosis merupakan tekanan yang dihasilkan akibat adanya
proses osmosis. Osmosis merupakan perpindahan air melewati membran
semipermeabel karena ketidakseimbangan material terlarut dalam media.
Dalam larutan hipotonik air akan masuk ke dalam sel mikroorganisme,
sedangkan dalam larutan hipertonik air akan keluar dari dalam sel
mikroorganisme sehingga membran plasma mengerut dan lepas dari
dinding sel (plasmolisis), serta menyebabkan sel secara metabolik tidak
B. Pengaruh faktor kimia pada pertumbuhan
I. Nutrisi
Nutrisi merupakan substansi yang diperlukan untuk biosintesis dan
pembentukan energi. Berdasarkan kebutuhannya, nutrisi dibedakan
menjadi dua yaitu makroelemen, yaitu elemen yang diperlukan dalam
jumlah banyak dan mikroelemen yaitu elemen nutrisi yang diperlukan
dalam jumlah sedikit (Pratiwi, 2008).
II. Media kultur
Bahan nutrisi yang digunakan untuk pertumbuhan mikroorganisme
di laboratorium disebut media kultur.
III. Oksigen
Klasifikasi mikroorganisme berdasarkan kebutuhan oksigen dibagi
menjadi 4 golongan, yaitu:
a. Aerob mutlak, oksigen sebagai syarat utama metabolisme.
b. Anaerob mutlak, tidak mentoleransi adanya oksigen atau akan mati
bila ada oksigen.
c. Anaerob fakultatif, mampu tumbuh baik dalam suasana dengan
atau tanpa oksigen.
d. Mikroaerofilik, hanya tumbuh baik pada konsentrasi oksigen yang
rendah yaitu kurang dari 20%, pada konsentrasi oksigen yang
2.4.4 Staphylococcus aureus
Berikut sistematika Staphylococcus aureus (Dwidjoseputro, 1994):
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococaceae
Marga : Staphylococcus
Jenis : Staphylococcus aureus
Staphylococcus aureus adalah bakteri berbentuk bulat (kokus) dengan
diameter 0,7-0,9 µm yang terdapat dalam bentuk tunggal, berpasangan, tetrad,
atau berkelompok seperti buah anggur. Nama bakteri ini berasal dari bahasa
latin “staphele” yang berarti anggur. Staphylococcus aureus merupakan bakteri
gram positif, tumbuh secara anaerobik fakultatif, tumbuh dengan cepat pada
temperatur 37ºC namun pembentukan pigmen yang terbaik yaitu pada
temperatur kamar (25-30ºC), patogen utama pada manusia, biasanya
membentuk koloni abu-abu hingga kuning emas (Fardiaz, 1992; Jawetz, et al.,
2001).
2.4.5 Klebsiella pneumoniae
Berikut sistematika Klebsiella pneumoniae (Dwidjoseputro, 1994):
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Enterobacteriales
Marga : Klebsiella
Jenis : Klebsiella pneumoniae
Klebsiella pneumoniae merupakan salah satu jenis bakteri dari famili
enterobacteriaceae. Dengan ciri-ciri: basil, bergerak dengan flagel yang peritrik
atau tidak bergerak, gram negatif, memiliki kapsul polisakarida yang besar dan
memfermentasikan laktosa dengan menghasilkan gas. Klebsiella pneumoniae
berada dalam sistem pernafasan sehingga bakteri ini dapat menyebabkan
infeksi saluran pernafasan. Nama bakteri ini Klebsiella pneumoniae karena
dapat menyebabkan penyakit pneumonia. Klebsiella pneumoniae dapat dikultur
pada media lempeng agar darah dan media differensial seperti MacConkey
agar. Pada media lempeng agar darah, bakteri Klebsiella pneumoniae tidak
bersifat menghemolisis, sedangkan pada media MacConkey agar membentuk
koloni berwarna merah (Dwidjoseputro, 1994; Jawetz, et al., 2001; Tim
Mikrobiologi FK Unibraw, 2003; Yolanda, 2011).
2.5 Media Biakan Mikroba
Berdasarkan sifat keheterotrofan mikroba, media dapat digolongkan
menjadi beberapa kelompok besar, yaitu:
I. Media hidup
Media hidup pada umumnya dipakai dalam laboratorium virologi untuk
pembiakan berbagai virus, sedangkan dalam laboratorium bakteriologi
hanya beberapa kuman tertentu saja, dan terutama pada hewan
percobaan. Contoh media hidup adalah hewan percobaan, manusia, telur
II. Media mati
Media mati disebut juga sebagai media sintetis. Media sintetis
merupakan media yang memiliki kandungan dan isi bahan yang telah
diketahui secara terperinci.
Berdasarkan konsistensinya, media mati terbagi menjadi beberapa
kelompok yakni:
a) Media padat
Media padat diperoleh dengan cara menambahkan agar-agar. Agar
berasal dari ganggang/ alga yang berfungsi sebagai bahan pemadat.
Media padat biasanya digunakan untuk mengamati penampilan
atau morfologi koloni dan untuk mengisolasi biakan murni.
b) Media setengah padat (semi solid medium)
Media setengah padat dibuat dengan bahan yang sama seperti
media padat, akan tetapi yang berbeda adalah komposisi agarnya.
Media ini digunakan untuk melihat gerak kuman secara
mikroskopik dan kemampuan fermentasi.
c) Media cair
Secara umum media cair adalah media berbentuk cair yang dapat
digunakan untuk berbagai tujuan seperti pembiakan mikroba dalam
jumlah besar, pengamatan fermentasi, dan berbagai macam uji.
Berdasarkan susunan kimianya, media mati dapat digolongkan
a) Media non sintetik
Media non sintetik merupakan media yang susunan kimianya tidak
dapat ditentukan dengan pasti. Media ini banyak digunakan untuk
menumbuhkan dan mempelajari taksonomi mikroorganisme.
Misalnya kaldu nutrien, serum, plasma dan lain-lain.
b) Media sintetik
Media sintetik merupakan media yang susunan kimianya dapat
diketahui dengan pasti. Media ini biasanya digunakan untuk
mempelajari kebutuhan makanan mikroorganisme. Contohnya
cairan Hanks, Locke, Thyrode, Eagle.
c) Media semi sintetik
Media semi sintetik merupakan campuran media sintetik dengan
media non sintetik. Misalnya cairan Hanks yang ditambah serum.
Berdasarkan fungsinya, media mati dapat dibagi menjadi beberapa
kelompok yaitu:
a) Media selektif
Media ini ditambah zat kimia tertentu yang bersifat selektif untuk
mencegah pertumbuhan mikroba lainnya.
b) Media differensial
Media ini mengandung zat-zat kimia tertentu yang memungkinkan
c) Media eksklusif
Merupakan media yang hanya memungkinkan tumbuhnya satu
jenis mikroba tertentu, sedangkan mikroba lainnya dihambat atau
dimatikan.
d) Media penguji
Merupakan media dengan susunan kimia tertentu yang digunakan
untuk pengujian vitamin, asam amino, antibiotika dan sebagainya.
e) Media diperkaya
Media ditambah zat-zat tertentu untuk menumbuhkan
mikroorganisme heterotrof tertentu. Zat-zat tertentu yang
ditambahkan seperti serum, darah, ekstrak tumbuh-tumbuhan.
f) Media khusus
Media ini untuk menentukan tipe pertumbuhan mikroorganisme
dan kemampuannya untuk mengadakan perubahan-perubahan
kimia tertentu.
g) Media persemaian
Media ini yang sangat kaya akan zat makanan dan mempunyai
susunan bahan sedemikian rupa sehingga hanya menyuburkan satu
jenis mikroba yang dicari saja.
h) Media serbaguna
Media ini merupakan media yang paling umum digunakan dalam
mikrobiologi (dapat menunjang pertumbuhan sebagian besar
2.6 Pengujian Aktivitas Antimikroba
Komponen antimikroba dihasilkan oleh tumbuhan dan aktif terhadap
mikroorganisme yang bersifat patogenik terhadap tumbuhan maupun manusia
(Das, et al., 2011). Beberapa bahan antimikrobial tidak bersifat membunuh,
tetapi hanya menghambat pertumbuhan mikroorganisme. Bahan antimikrobial
bersifat menghambat apabila digunakan dalam konsentrasi kecil, namun bila
digunakan dalam konsentrasi tinggi dapat mematikan mikroorganisme.
Berdasarkan ini, perlu diketahui Konsentrasi Hambat Minimum (KHM) yaitu
konsentrasi terendah bahan antimikrobial yang menghambat pertumbuhan dan
Konsentrasi Bunuh Minimum (KBM) bahan antimikrobial terhadap
mikroorganisme. KHM didefinisikan sebagai konsentrasi terendah bahan
antimikrobial yang menghambat pertumbuhan, sedangkan KBM adalah
konsentrasi terendah bahan antimikrobial yang mematikan (Lay, 1994).
Ada beberapa metode yang digunakan untuk uji aktivitas antimikroba,
antara lain:
a. Metode dilusi
Metode ini digunakan untuk menentukan KHM dan KBM dari zat
antimikroba. Metode dilusi dibedakan menjadi dua yaitu dilusi cair (broth
dilution) dan dilusi padat (solid dilution). Untuk metode dilusi cair yaitu
menggunakan satu seri tabung reaksi yang diisi dengan media cair dan
sejumlah tertentu mikroba yang diuji. Kemudian masing-masing tabung
diuji dengan zat antimikroba yang telah diencerkan secara serial. Seri
terjadinya kekeruhan pada tabung. Selanjutnya biakan dari semua tabung
yang jernih diinokulasikan pada media agar padat, diinkubasikan pada suhu
± 36oC selama 18-24 jam. Lalu diamati ada tidaknya koloni bakteri yang
tumbuh (Pratiwi, 2008).
b. Metode difusi
Metode ini merupakan metode yang umum digunakan di laboratorium
dimana didapat kepekaan suatu organisme terhadap senyawa atau obat. Zat
yang akan diuji berdifusi dari pencadang (reservoir) kedalam medium agar
yang telah diinokulasikan dengan bakteri uji. Diinkubasi selama waktu
tertentu dan amati adanya hambatan pertumbuhan bakteri uji. Prinsip
penetapannya yaitu mengukur luas diameter daerah hambatan pertumbuhan
bakteri.
Sebagai cadangan larutan uji dapat digunakan:
a) Silinder gelas atau logam
Silinder yang dipakai terbuat dari gelas atau logam tahan karat
dengan diameter 6-8 milimeter. Keuntungannya jumlah larutan uji
dalam silinder dapat diperbanyak untuk menjamin ketersediaan
larutan uji dalam cadangan selama waktu inkubasi. Kerugiannya
adalah sukar mengatur kedalaman silinder secara manual, sehingga
difusi yang terjadi ada kemungkinan tidak homogen yang ditujukan
b) Cakram kertas (Paper Disc)
Dengan menggunakan cakram kertas ini, jumlah larutan uji yang
diserap dapat diatur homogen sesuai dengan kapasitas dan daya
serap kertas yang tergantung pada diameter dan ketebalan cakram.
c) Cetak lubang
Dilakukan dengan cara melobangi medium agar dengan alat
penghisap agar atau pelobang gabus. Keuntungannya yaitu jumlah
larutan yang berdifusi dapat terukur jumlahnya dan medium yang
digunakan tidak terlalu tebal, namun bila mencetak lubang kurang
sempurna akan mempengaruhi difusi zat uji (Masripah, 2009).
c. Metode turbidimetri
Metode turbidimetri dilakukan berdasarkan hambatan pertumbuhan
mikroba dalam media cair yang mengandung zat antimikroba. Hambatan
pertumbuhan mikroba ditentukan dengan mengukur serapannya dengan
menggunakan spektrofotometer pada panjang gelombang 530 nm (Ditjen
BAB III
METODE PENELITIAN
Metode penelitian yang digunakan adalah metode eksperimental. Tahap
penelitian meliputi pengambilan bahan tumbuhan, identifikasi bahan
tumbuhan, pembuatan simplisia, karakterisasi simplisia, skrining fitokimia,
pembuatan ekstrak dan fraksi-fraksi, selanjutnya dilakukan uji aktivitas
antibakteri menggunakan metode difusi agar dengan cara sumuran. Parameter
yang diamati yaitu besarnya diameter daya hambat pertumbuhan bakteri.
Penelitian ini dilakukan di Laboratorium Farmakognosi dan Mikrobiologi
Fakultas Farmasi Universitas Sumatera Utara Medan.
3.1 Alat
Alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium, autoklaf (Fisons), blender (Miyako), bola karet, desikator, freeze
dryer (Modulio), hot plate (Fisons), inkubator (Fiber Scientific), jangka sorong,
jarum ose, kamera digital (Samsung), krus porselin, laminar air flow cabinet
(Astec HLF 1200L), lemari pendingin (Glacio), lumpang dan alu, mikroskop
(Olympus), neraca listrik (Mettler Tolledo), oven (Memmert), penangas air
(Yenaco), pinset, pipet mikro (Eppendorf), rotary evaporator (Haake D),
seperangkat alat penetapan kadar air, spektrofotometer visibel (Dynamica) dan
3.2 Bahan
Bahan yang digunakan adalah bunga belimbing wuluh (Averrhoa
bilimbi L.), nutrien agar (NA), nutrient broth (NB), mueller hinton agar
(MHA), bakteri Staphylococcus aureus (ATCC 29737) dan Klebsiella
pneumoniae (ATCC 10031), air suling. Bahan kimia yang digunakan
berkualitas pro analisis, kecuali dinyatakan lain yaitu dimetilsulfoksida
(DMSO), alfa naftol, amil alkohol, asam klorida pekat, asam asetat anhidrida,
asam nitrat, asam sulfat pekat, besi (III) klorida, bismuth (III) nitrat, etanol,
etilasetat, n-heksana, benzen, eter, iodium, isopropanol, kalium iodida,
kloralhidrat, kloroform, metanol, natrium hidroksida, natrium klorida, natrium
sulfat anhidrida, raksa (II) klorida, serbuk magnesium, serbuk zinkum, timbal
(II) asetat, dan toluena.
3.3 Penyiapan Bahan
Penyiapan bahan tumbuhan meliputi pengambilan bahan tumbuhan,
identifikasi bahan tumbuhan dan pembuatan simplisia bunga belimbing wuluh
(Averrhoa bilimbi L.).
3.3.1 Pengambilan bahan tumbuhan
Pengambilan bahan tumbuhan dilakukan secara purposif yaitu tanpa
membandingkan dengan tumbuhan yang sama dari daerah lain. Bahan
tumbuhan yang digunakan adalah untaian bunga segar belimbing wuluh
(Averrhoa bilimbi L.) yang diperoleh dari Desa Subur, Kecamatan Air Joman,
3.3.2 Identifikasi bahan tumbuhan
Identifikasi bahan tumbuhan dilakukan di “Herbarium Bogoriense”,
Bidang Botani Pusat Penelitian dan Pengembangan Biologi-LIPI, Cibinong
Bogor. Hasil identifikasi dapat dilihat pada Lampiran 1, Halaman 52.
3.3.3 Pembuatan simplisia
Pembuatan simplisia dilakukan dengan cara bunga belimbing wuluh
(Averrhoa bilimbi L.) segar yang telah dikumpulkan, dibersihkan dari pengotor
yang melekat, lalu dicuci dengan air sampai bersih dan ditiriskan. Bahan
tumbuhan dikeringkan dengan cara diangin-anginkan terlebih dahulu kemudian
dikeringkan di dalam lemari pengering sampai simplisia rapuh ketika diremas.
Selanjutnya diblender menjadi serbuk dan disimpan dalam wadah plastik yang
tertutup rapat. Bagan penelitian dapat dilihat pada Lampiran 6, Halaman 57.
3.4 Pembuatan Pereaksi 3.4.1 Pereaksi Mayer
Larutan raksa (II) klorida P 2,266% b/v sebanyak 60 ml dicampur
dengan 10 ml larutan kalium iodida P 50% b/v, kemudian ditambahkan air
secukupnya hingga 100 ml (Depkes, 1995).
3.4.2 Pereaksi Dragendorff
Larutan bismuth (III) nitrat P 40% b/v dalam asam nitrat P sebanyak
20 ml dicampur dengan 50 ml kalium iodida P 54,4% b/v, didiamkan sampai
memisah sempurna. Lalu diambil lapisan jernihnya dan diencerkan dengan air
3.4.3 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida P dilarutkan dalam air suling secukupnya
kemudian ditambahkan 2 g iodida P sedikit demi sedikit, cukupkan dengan air
suling sampai 100 ml (Depkes, 1995).
3.4.4 Pereaksi Molish
Sebanyak 3 g α-naftol P dilarutkan dalam asam nitrat 0,5 N hingga
diperoleh larutan 100 ml (Depkes, 1995).
3.4.5 Pereaksi Liebermann-Burchard
Campurkan 5 ml asam sulfat pekat dengan 50 ml etanol. Tambahkan
hati-hati 5 ml asam asetat anhidrida ke dalam campuran tersebut (Depkes,
1995).
3.4.6 Pereaksi besi (III) klorida 1% b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling sampai
100 ml (Depkes, 1980).
3.4.7 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat P dilarutkan dalam air suling bebas
CO2 hingga 100 ml (Depkes, 1980).
3.4.8 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling
sampai 100 ml (Ditjen POM, 1979).
3.4.9 Pereaksi natrium hidroksida 2 N
Sebanyak 8,001 g natrium hidroksida ditimbang, kemudian dilarutkan
3.4.10 Larutan asam sulfat 2 N
Larutan asam sulfat pekat sebanyak 9,8 ml ditambahan air suling
sampai 100 ml (Ditjen POM, 1979).
3.4.11 Larutan kloralhidrat
Sebanyak 50 g kristal kloralhidrat ditimbang lalu dilarutkan dalam
20 ml air suling (Depkes, 1979).
3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik,
mikroskopik, penetapan kadar air, penetapan kadar sari yang larut dalam air,
penetapan kadar sari yang larut dalam etanol, penetapan kadar abu total dan
penetapan kadar abu yang tidak larut dalam asam.
3.5.1 Pemeriksaan makroskopik
Pemeriksan makroskopik dilakukan dengan mengamati bentuk, ukuran,
bau, rasa, dan warna dari bunga belimbing wuluh.
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia bunga
belimbing wuluh. Serbuk simplisia ditaburkan diatas kaca objek yang telah
ditetesi dengan kloralhidrat dan ditutup dengan kaca penutup, kemudian dilihat
dibawah mikroskop. Gambar mikroskopik dapat dilihat pada Lampiran 5,
Halaman 56.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi
labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi
selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit,
kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
Kemudian ke dalam labu yang berisi toluen jenuh tersebut dimasukkan 5 g
serbuk simplisia yang telah ditimbang seksama, dipanaskan hati-hati selama
15 menit. Setelah toluen mendidih, kecepatan tetesan diatur lebih kurang
2 tetes tiap detik, hingga sebagian air tersuling, kemudian naikkan kecepatan
penyulingan hingga 4 tetes tiap detik. Setelah semua air tersuling, bagian
dalam pendingin dibilas dengan toluen. Penyulingan dilanjutkan selama
5 menit, kemudian tabung penerima dibiarkan mendingin sampai suhu kamar.
Setelah air dan toluen memisah sempurna, volume dibaca dengan ketelitian
0,05 ml. Selisih kedua volume air dibaca sesuai dengan kandungan air yang
terdapat dalam bahan yang diperiksa (WHO, 1998).
3.5.4 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml
air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter) dalam labu
bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan
selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai
kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa
dipanaskan pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari yang
3.5.5 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml
etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam
pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk
menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan sampai kering
dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara.
Sisa dipanaskan pada suhu 105oC sampai diperoleh bobot tetap. Kadar sari
yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan
(Depkes, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pijaran dilakukan
pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai
diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah
dikeringkan (Depkes, 1995).
3.5.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring, dipijarkan, kemudian didinginkan
dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam
3.6 Skrining Fitokimia 3.6.1 Pemeriksaan alkaloida
Serbuk simplisia ditimbang 0,5 g kemudian ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit,
didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk uji alkaloida
sebagai berikut:
a. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Mayer, maka akan
terbentuk endapan menggumpal berwarna putih atau putih kekuningan.
b. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Bouchardat, maka akan
terbentuk endapan berwarna coklat.
c. Filtrat 3 tetes ditambah 2 tetes larutan pereaksi Dragendorff, maka akan
terbentuk endapan warna merah atau jingga.
Alkaloida positif jika endapan atau kekeruhan paling sedikit dua dari
tiga percobaan diatas (Depkes, 1995).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 g serbuk simplisia ditambahkan 10 ml air panas,
dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml
filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan
2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoida positif jika
terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol
3.6.3 Pemeriksaan glikosida
Sebanyak 3 g serbuk simplisia ditimbang, lalu disari dengan 30 ml
campuran dari 7 bagian etanol 95% dan 3 bagian air suling. Kemudian
ditambahkan 10 ml HCl 2 N dan direfluks selama 10 menit, didinginkan, lalu
disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal
(II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat disari
dengan 20 ml campuran 2 bagian isopropanol dan 3 bagian kloroform,
perlakuan ini diulangi sebanyak 3 kali. Sari air dikumpulkan dan ditambahkan
Na2SO4 anhidrat, disaring kemudian diuapkan pada temperatur tidak lebih dari
50oC, sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk
percobaan berikut: sepersepuluh ml larutan percobaan dimasukkan dalam
tabung reaksi, kemudian diuapkan di atas penangas air. Pada sisa ditambahkan
2 ml air dan 5 tetes larutan pereaksi Molish, lalu ditambahkan dengan hati-hati
2 ml asam sulfat pekat, terbentuk cincin ungu pada batas kedua cairan,
menunjukkan adanya ikatan gula (glikon) (Depkes, 1995).
3.6.4 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia ditimbang, kemudian ditambahkan
5 ml asam sulfat 2 N, dipanaskan sebentar, setelah dingin ditambahkan 10 ml
benzena, dikocok dan didiamkan. Lapisan benzena dipisahkan dan disaring,
kocok lapisan benzena dengan 2 ml NaOH 2 N, didiamkan. Lapisan air
berwarna merah dan lapisan benzena tidak berwarna menunjukan adanya
3.6.5 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia disari dengan 10 ml air suling lalu
disaring, filtratnya diencerkan dengan air sampai tidak berwarna. Larutan
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida
1 %. Jika terjadi warna biru atau kehitaman menunjukkan adanya tanin
(Depkes, 1989).
3.6.6 Pemeriksaan saponin
Sebanyak 0,5 g serbuk simplisia dimasukan ke dalam tabung reaksi,
lalu ditambahkan 10 ml air panas, dinginkan kemudian dikocok kuat-kuat
selama 10 detik. Jika terbentuk busa setinggi 1-10 cm yang stabil tidak kurang
dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N
menunjukan adanya saponin (Depkes, 1995).
3.6.7 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml eter selama
2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa
ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat
(pereaksi Liebermann-Burchard), diteteskan pada saat akan mereaksikan
sampel uji. Timbulnya warna biru atau biru hijau menunjukan adanya steroid,
sedangkan warna merah, merah muda atau ungu menunjukkan adanya
triterpenoid (Harborne, 1987).
3.7 Pembuatan Ekstrak Etanol Bunga Belimbing Wuluh
Pembuatan ekstrak dilakukan secara perkolasi. Sebanyak 200 g serbuk
dituangi sampai semua simplisia terendam, biarkan sekurang-kurangnya
selama 3 jam. Pindahkan massa sedikit demi sedikit ke dalam perkolator
sambil tiap kali di tekan hati-hati, tuangi cairan penyari secukupnya sampai
cairan mulai menetes dan di atas simplisia masih terdapat selapis cairan
penyari, perkolator ditutup dan dibiarkan selama 24 jam. Cairan dibiarkan
menetes dengan kecepatan 1 ml tiap menit, cairan penyari ditambahkan
berulang-ulang secukupnya hingga selalu terdapat selapis cairan penyari diatas
simplisia. Perkolasi dihentikan hingga 500 mg perkolat yang keluar terakhir
diuapkan tidak meninggalkan sisa. Perkolat yang diperoleh dipekatkan dengan
alat penguap rotary evaporator. Kemudian dikeringkan dengan freeze dryer
(Depkes, 1986).
3.7.1 Pembuatan fraksi-fraksi dari ekstrak etanol
Pembuatan fraksi-fraksi dilakukan secara ekstraksi cair-cair (ECC)
menggunakan pelarut n-heksana dan etilasetat. Sebanyak 5 g ekstrak etanol
ditambahkan etanol dan 10 ml air suling, lalu dimasukkan kedalam corong
pisah, kemudian ditambahkan 40 ml n-heksana, dikocok, didiamkan sampai
terdapat 2 lapisan yang terpisah, lapisan n-heksana (lapisan atas) diambil
dengan cara dekantasi, dan fraksinasi dilakukan sampai warna lapisan
n-heksana jernih, kemudian ditambahkan 50 ml etilasetat pada lapisan air,
dikocok, didiamkan sampai terdapat 2 lapisan yang terpisah, lapisan etilasetat
(lapisan atas) diambil dengan cara dekantasi, dan fraksinasi dilakukan sampai
fraksi yang diperoleh diuapkan sampai diperoleh ekstrak kental.
Masing-masing fraksi yang diperoleh dilakukan uji aktivitas antibakteri.
3.8 Sterilisasi Alat
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini, disterilkan
terlebih dahulu sebelum dipakai. Alat-alat gelas disterilkan didalam oven pada
suhu 170°C selama 1 jam. Media disterilkan di autoklaf pada suhu 121°C
selama 15 menit. Jarum ose dan pinset disterilkan dengan lampu bunsen (Lay,
1994).
3.9 Pembuatan Media
3.9.1 Media nutrient agar (NA)
Komposisi: Bacto beef extract 3,0 g
Bacto peptone 5,0 g
Bacto agar 15,0 g
Cara pembuatan:
Sebanyak 23 g nutrient agar dilarutkan dalam air suling steril sebanyak
1000 ml kemudian dipanaskan hingga semua larut, dalam keadaan panas
larutan tersebut kemudian dimasukkan dalam erlenmeyer. Lalu disterilkan di
autoklaf 121ºC selama 15 menit (Difco, 1997).
3.9.2 Media nutrient broth (NB)
Komposisi: Bacto beef extract 3,0 g
Cara pembuatan:
Sebanyak 8 g nutrient broth dilarutkan dalam air suling steril sebanyak
1000 ml kemudian dipanaskan hingga semua larut, dalam keadaan panas
larutan tersebut kemudian dimasukkan dalam erlenmeyer. Lalu disterilkan di
autoklaf 121ºC selama 15 menit (Difco, 1997).
3.9.3 Media Mueller Hinton agar (MHA)
Komposisi: Beef infusion from 300 g
Casein hydrolysate 17,5 g
Starch 1,50 g
Bacto-Agar 17,0 g
pH = 7,4
Cara pembuatan:
Ditimbang sebanyak 38 g serbuk MHA kemudian disuspensikan dalam
Erlenmeyer dengan air suling yang ditambahkan sedikit demi sedikit hingga
1000 ml, dipanaskan hingga mendidih sambil sekali-kali diaduk sampai bahan
larut sempurna dan jernih. Tutup erlenmeyer dengan kapas yang dilapisi
dengan alumunium foil. Lalu disterilkan di autoklaf 121ºC selama 15 menit
(Difco, 1997).
3.10 Pembuatan Media Agar Miring
Ke dalam tabung reaksi yang steril dimasukkan 3 ml media nutrient
agar steril yang sudah dicairkan, didiamkan pada temperatur kamar sampai
memadat pada posisi miring membentuk sudut 30-45º. Kemudian disimpan
3.11 Pembuatan Stok Kultur
Biakan bakteri Staphylococcus aureus dari strain utama diambil dengan
jarum ose steril lalu diinokulasikan pada permukaan media nutrient agar
miring dengan cara menggores, kemudian diinkubasi dalam inkubator pada
suhu 35 ± 2oC selama 18-24 jam (Ditjen POM, 1995). Hal yang sama juga
dilakukan pada biakan bakteri Klebsiella pneumoniae.
3.12 Penyiapan Inokulum Bakteri
Koloni bakteri Staphylococcus aureus diambil dari stok kultur
menggunakan jarum ose steril kemudian disuspensikan ke dalam 10 ml media
nutrient broth steril lalu diinkubasikan pada suhu 35 ± 2oC sampai didapat
kekeruhan dengan transmitan 25% menggunakan alat spektrofotometer UV
panjang gelombang 580 nm (Ditjen POM, 1995). Hal yang sama juga
dilakukan untuk koloni bakteri Klebsiella pneumoniae.
3.13 Pembuatan Larutan Uji Ekstrak Etanol, Fraksi n-Heksana, Fraksi Etilasetat dan Fraksi Sisa Bunga Belimbing Wuluh (Averrhoa bilimbi L.) dengan Berbagai Konsentrasi
Ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan fraksi sisa,
masing-masing ditimbang sebanyak 1 g, kemudian dilarutkan dalam
dimetilsulfoksida (DMSO) cukupkan hingga 5 ml. Konsentrasi ekstrak adalah
200 mg/ml. Kemudian dibuat pengenceran sampai diperoleh ekstrak dengan
konsentrasi 100 mg/ml, 90 mg/ml, 80 mg/ml, 70 mg/ml, 60 mg/ml, 50 mg/ml,
3.14 Pengujian Aktivitas Antibakteri Secara In Vitro
Sebanyak 0,1 ml inokulum (106 CFU/ml) dimasukkan ke dalam cawan
petri steril, setelah itu dituang media Mueller Hinton agar (MHA) yang telah
dicairkan sebanyak 20 ml dengan suhu 45-50oC dihomogenkan sampai media
dan bakteri tercampur rata, kemudian dibiarkan sampai media memadat. Pada
media yang telah padat, dibuat lubang lalu ditetesi dengan 0,1 ml larutan uji
ekstrak etanol bunga belimbing wuluh dengan berbagai konsentrasi, kemudian
diinkubasi dalam inkubator pada suhu 35 ± 2oC selama 18-24 jam. Selanjutnya
diukur diameter daerah hambat di sekitar larutan penguji dengan menggunakan
jangka sorong. Hal yang sama dilakukan terhadap larutan uji fraksi n-heksana,
fraksi etilasetat dan fraksi sisa bunga belimbing wuluh. Percobaan ini
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di “Herbarium Bogoriense”
Bidang Botani Pusat Penelitian dan Pengembangan Biologi–LIPI Bogor, di
Cibinong menunjukkan bahwa bahan tumbuhan adalah bunga belimbing
wuluh, jenis Averrhoa bilimbi L., suku Oxalidaceae.
4.2 Hasil Karakterisasi Simplisia 4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik dari untaian bunga segar belimbing
wuluh yaitu bunganya kecil muncul langsung dari batang, mahkota bunga
berjumlah 5 berwarna merah lila dengan bagian dalam mahkota yang melekat
pada bakal buah berwarna putih, benang sari berjumlah 10 dan berwarna putih,
kelopak bunga berjumlah 5 dan berwarna lebih muda dari mahkota, panjang
bunga ± 2 cm, dan tangkai bunganya berbulu halus. Dalam keadaan segar
bunga berwarna merah lila, dan setelah kering bunga menjadi warna coklat tua.
Sedangkan serbuk simplisia bunga belimbing wuluh berwarna coklat tua.
4.2.2 Pemeriksaan mikroskopik
Hasil pemeriksaan mikroskopik dari serbuk simplisia bunga belimbing
wuluh (Averrhoa bilimbi L.) memperlihatkan adanya epidermis atas daun
mahkota, parenkim dan trakea, rambut penutup dari tangkai bunga, serbuk sari
4.2.3 Hasil pemeriksaan karakteristik serbuk simplisia
Hasil pemeriksaan karakteristik serbuk simplisia diperoleh kadar air
sebesar 7,94%, kadar sari yang larut dalam air sebesar 11,97%, kadar sari yang
larut dalam etanol sebesar 2,39%, kadar abu total sebesar 8,24% dan kadar abu
yang tidak larut dalam asam sebesar 5,52%.
Penetapan kadar air pada simplisia dilakukan untuk mengetahui jumlah
air yang terkandung dalam simplisia yang digunakan. Kadar air simplisia
ditetapkan untuk menjaga kualitas simplisia karena kadar air berkaitan dengan
kemungkinan pertumbuhan jamur/kapang (Depkes, 1986). Pada penetapan
kadar sari dapat dilihat bahwa kadar sari yang larut dalam air lebih tinggi
daripada kadar sari yang larut dalam etanol, hal ini menunjukkan bahwa
senyawa yang terlarut dalam air lebih besar daripada senyawa yang terlarut
dalam etanol. Senyawa-senyawa yang dapat larut dalam air adalah glikosida,
tanin, saponin dan flavonoid sedangkan senyawa-senyawa yang dapat larut
dalam etanol seperti glikosida, steroid, dan flavonoid (Depkes, 1986).
Penetapan kadar abu total dilakukan untuk mengetahui unsur mineral
dan zat anorganik yang terkandung dalam simplisia, sedangkan penetapan
kadar abu tidak larut dalam asam untuk mengetahui zat anorganik yang tidak
larut dalam asam. Dari hasil karakterisasi dapat dilihat bahwa kadar abu total
dan kadar abu yang tidak larut dalam asam pada bunga belimbing wuluh cukup
tinggi, hal ini dapat terjadi karena pada tanaman belimbing wuluh mengandung
unsur mineral dan zat anorganik yang cukup banyak seperti sulfur, kalsium dan
4.3 Hasil Ekstraksi dan Fraksinasi
Sebanyak 200 g simplisia bunga belimbing wuluh diekstraksi dengan
cara perkolasi menggunakan pelarut etanol 96%, agar diharapkan
senyawa-senyawa aktif yang terkandung di dalamnya dapat tersari sempurna. Hasilnya
diperoleh ekstrak etanol bunga belimbing wuluh 15,67g. Kemudian dilakukan
ekstraksi cair-cair secara berturut-turut menggunakan pelarut n-heksana dan
air, dari 10 g ekstrak diperoleh fraksi n-heksana 3,28 g, selanjutnya fraksi air di
fraksinasi dengan etilasetat sehingga diperoleh fraksi etilasetat 2,32 g dan
fraksi air 2,14 g.
4.4 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap simplisia bunga belimbing wuluh
(Averrhoa bilimbi L.) dan ekstrak etanol, fraksi n-heksana, fraksi etilasetat dan
[image:55.595.113.499.508.692.2]fraksi air dapat dilihat pada Tabel 4.1 sebagai berikut.
Tabel 4.1 Hasil skrining fitokimia simplisia, ekstrak etanol, fraksi n-heksana, fraks