KARAKTERISASI MANANASE Streptomyces sp. GALUR 45I-3
Oleh:
Dwi Ambarawati
G 34101051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DWI AMBARAWATI. Karakterisasi Mananase
Streptomyces sp. Galur 45I -3.
Dibimbing oleh ANJA MERYANDINI dan NISA RACHMANIA MUBARIK.
Hemiselulosa menyusun 20-35% berat kayu yang terutama terdiri atas manan (softwoods) dan xilan (hardwoods). Hemiselulosa dapat digunakan oleh mikrob sebagai sumber karbon. Mananase dan xilanase adalah enzim kompleks yang dapat mendegradasi hemiselulosa. Aktivitas mananase
Streptomyces sp. galur 45I -3 diuji pada media locust bean gum 0.5% dan bungkil kelapa 0.5% dengan metode asam dinitrosalisilat (DNS). Kadar protein diukur dengan kolorimeter menggunakan coomasie blue. Aktivitas mananase dan xilanase juga diuji menggunakan media
birchwood xylan dan oatspelt xylan. Mananase Streptomyces sp. galur 45I -3 mempunyai suhu optimum 40 oC dan pH optimum 6.0. Penambahan 1mM kation Mg 2+ dan Zn 2+ masing-masing meningkatkan aktivitas mananase sebesar 29.2% dan 80.2%, sedangkan Mn 2+, Ca 2+ dan Co 2+ masing-masing menurunkan aktivitasnya sebesar 67%, 100%, dan 59.7%. Penambahan senyawa pengkelat logam etilen diamina tetraasetat (EDTA) dengan konsentrasi akhir 1 mM hanya sedikit menurunkan aktivitasnya. Media yang mengandung birchwood xylan dan oatspelt xylan
menginduksi pembentukan mananase namun dengan aktivitas yang lebih rendah dari xilanase.
ABSTRACT
DWI AMBARAWATI. Mannanase Characterization of
Streptomyces sp. Strain
45I -3. Supervised by ANJA MERYANDINI and NISA RACHMANIA
MUBARIK
Hemicelluloses constitute 20 -35% of total wood weight which contain major component of mannans (softwoods) and xylans (hardwoods). Hemicelluloses are used by microbes as a carbon sources. Mannanase and xylanase are enzyme complexs that are able to degrade hemicelluloses. Mannanase activity from Streptomyces strain 45I-3 was tested in locust bean gum 0.5% and coconut meal 0.5% medium and detected by dinitrosalysilic acid (DNS) method. Protein concentration was measured using colorimeter method employing coomasie blue. Mannanase and xylanase activity were also detected by using birchwood xylan and oatspelt xylan medium. The optimum temperature and pH of Streptomyces mannanase strain 45I-3 was 40 oC and 6.0, respectively. The addition 1 mM of Mg 2+ and Zn 2+ at final concentration increased the
mannanase activity for about 29.2% and 80.2%, while 1 mM Mn 2+ , Ca 2+ and Co 2+ decreased its activity for about 67%, 100%, and 59.7%, respectively. The addition of 1 mM ethylene diamine tetraacetic acid (EDTA) tend to decreased the enzyme activity. The medium which contain
KARAKTERISASI MANANASE Streptomyces sp. GALUR 45I-3
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Dwi Ambarawati
G 34101051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul
: KARAKTERISASI MANANASE Streptomyces sp. GALUR 45I -3
Nama
: Dwi Ambarawati
NIM
: G 34101051
Menyetujui,
Pembimbing 1 Pembimbing 2
Dr. Anja Meryandini, M.S. Dr. Nisa Rachmania Mubarik, M.Si.
NIP. 131663016 NIP.1320455531
Mengetahui,
Dekan Fakultas MIPA
Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131473999
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan nikmat dan karunia-Nya sehingga penulis berhasil menyelesaikan skripsi ini. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dari bulan Maret 2005 sampai September 2005 dengan judul Karakterisasi Mananase Streptomyces sp. galur 45I-3.
Ucapan terima kasih penulis sampaikan kepada ibu Dr. Anja Meryandini, M.S. selaku pembimbing 1, Ibu Dr. Nisa Rachmania Mubarik, M.Si. selaku pembimbing 2, Dr. Ir. Nampiah Sukarno selaku dewan penguji atas bimbingan, kritik dan saran selama penulisan karya ilmiah, dan Dr. Ir. Yulin Lestari yang telah membantu menyumbangkan isolat untuk penelitian ini. Penulis juga m engucapkan terima kasih kepada seluruh staf Laboratorium Mikrobiologi yaitu Mbak Heni, Pak Endang, Pak Jaka, Bu Kokoy dan Pak Husein atas bantuannya.
Ucapan terima kasih terbesar penulis sampaikan kepada kedua orang tua, adikku Nansi dan Mala serta Mas Alip yang senantiasa mendukung dan mendoakan. Ucapan terima kasih juga tidak lupa disampaikan kepada teman-teman di Laboratorium Mikrobiologi Mba Elsi, Mba Dini, Mba Kiki, Kak Tono, Wulan, Mas Prima, Mas Ozy, Henry dan yang terpenting adalah Irma, Deri, Trio, Dini, Made, Fitri, Duti, Anne, Aries, Nana, Bekti, dan Lucky. Terima kasih juga kepada warga CD 47 (Rika, Nick, Hesti, Nina, Kiki), Pak Joni, Pak Agus, dan Pak Edi, serta teman-teman Angkatan 38 sehingga skripsi ini menjadi lancar.
Penulis berharap skripsi ini dapat dimanfaatkan bagi semua pihak.
Bogor, Desember 2005
RIWAYAT HIDUP
Penulis merupakan putri pertama dari tiga bersaudara pasangan Sriyono dan Kamsiyah, S.Pd. yang dilahirkan di Klaten pada tanggal 26 Maret 1984. Tahun 1995 penulis lulus dari Sekolah Dasar Negeri Krikilan II Bayat, tahun 1998 lulus dari Sekolah Menengah Pertama Negeri 1 Bayat dan pada tahun 2001 penulis lulus dari Sekolah Menengah Umum Negeri I Cawas, Klaten dan masuk di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur USMI.
Selama mengikuti perkuliahan penulis menjadi asisten mata kuliah Biologi Alga dan Bryophyta tahun 2003-2004 dan 2004-2005, Genetika Dasar tahun 2004-2005, Mikrobiologi Dasar 2004-2005, Fisiologi Mikroba tahun 2004-2005, serta Botani Umum tahun 2004-2005 dan 2005-2006. Penulis melaksanakan Praktik Lapangan di Rumah Sakit Umum Pusat Dr. Soeradji Tirtonegoro, Klaten pada tahun 2004 dengan tema Pengukuran Kadar Hemoglobin di Rumah Sakit Umum Pusat Dr. Soeradji Tirtonegoro, Klaten.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...vii
DAFTAR LAMPIRAN ...vii
PENDAHULUAN...1
BAHAN DAN METODE...2
Bahan... ...2
Metode...2
Peremajaan Isolat...2
Produksi Enzim Mananase... ... 2
Penetapan Aktivitas Mananase dan Pengukuran Kadar Protein...2
Karakterisasi Mananase...3
Uji Substrat... 3
HASIL... 3
Produksi Mananase dan Kurva Aktivitas Mananase Isolat 45I-3... 3
Karakterisasi Mana nase Isolat 45I-3... 3
Uji Substrat...4
PEMBAHASAN...4
SIMPULAN DAN SARAN... 6
Simpulan...6
Saran...6
DAFTAR PUSTAKA...7
DAFTAR GAMBAR
Halaman
1 Struktur galaktomanan beserta letak titik potong oleh kompleks mananase... 1
2 Struktur xilan beserta posisi ikatan rantai sampingnya ... 1
3 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada pH 7.0 suhu 37 oC
dalam media locust bean gum 0.5% ... 3
4 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada pH 7.0 suhu 37 oC
dalam media bungkil kelapa 0.5%... 3
5 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada berbagai pH yang diuk ur
pada suhu 37 oC ... 3
6 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada berbagai suhu yang diukur
pada pH 6.0... 4
7 Pengaruh penambahan berbagai kation dengan konsentrasi akhir 1 mM terhadap
aktivitas relatif mananase Streptomyces sp. galur 45I-3 pada pH 6.0 dan suhu 40 oC ... 4
DAFTAR LAMPIRAN
Halaman
1 Pengukuran aktivitas mananase dengan metode DNS berdasarkan Purwadaria et al. (1994) ...10
2 Kurva standar manosa ...10
3 Kurva standar xilosa ...10
4 Aktivitas mananase Streptomyces sp. galur 45I-3 pada media locust bean gum 0.5% pH 7.0 dan suhu 37 oC... ...11
5 Aktivitas mananase Streptomyces sp. galur 45I-3 pada media bungkil kelapa 0.5% pH 7.0 dan suhu 37 oC ...11
6 Pengaruh pH terhadap aktivitas mananase Streptomyces sp. galur 45I -3 pada suhu 37 o C...11
7 Pengaruh suhu terhadap aktivitas mananase Streptomyces sp. galur 45I -3 pada pH 6.0...11
8 Pengaruh penambahan berbagai kation dengan konsentrasi akhir 1 mM terhadap aktivitas
mananase Streptomyces sp. galur 45I -3 pada pH dan suhu optimum...12
1
PENDAHULUAN
Hemiselulosa merupakan polisakarida linier atau bercabang yang banyak ditemukan sebagai heteroglikan pada tumbuhan tingkat tinggi. Dua jenis hemiselulosa yang penting dalam industri ialah hetero-1,4-D -manan dan hetero -1,4-D -xilan (Hilge et al. 1998).
Manan adalah komponen hemiselulosa pada soft woods atau kayu lunak yang terdapat pada gimnospermae (Marga 1996) yang merupakan polimer dari manosa sedangkan galaktomanan adalah polimer manosa yang diselingi galaktosa (Lehninger 1982). Galaktomanan umumnya ditemukan pada tanaman legum sebagai penyusun biji namun juga pada tanaman lain seperti pada endosperma palem (Vries & Visser 2001).
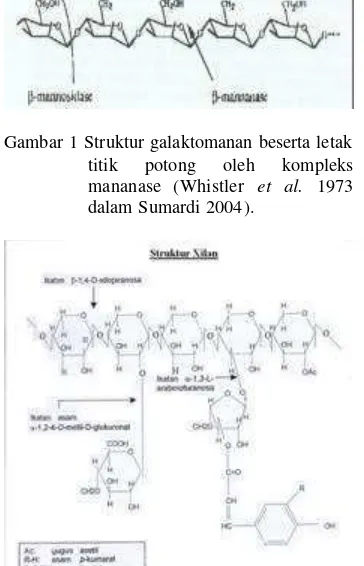
Bungkil kelapa dapat dimanfaatkan sebagai pakan ternak yang memiliki kadar protein tinggi. Kandungan manan dan galaktomanan yang tinggi pada pakan ternak ini melindungi struktur protein sehingga susah dicerna. Pemanfaatan bungkil kelapa sebagai pakan ternak secara optimal dapat dibantu dengan adanya enzim yang dapat menguraikan manan dan galaktomanan sehingga protein mudah dicerna oleh ternak. Untuk dapat mendegradasi senyawa manan dengan sempurna, mikroorganisme harus menghasilkan sedikitnya 3 enzim yaitu ß-mananase, ß–manosidase, dan a-galaktosidase (Duffaud et al. 1997). Mananase mengkatalisis hidrolisis ikatan ß-1,4-manosa pada ß-1,4-manan, glukomanan, dan galaktomanan (Kansoh & Nagieb 2004). ß-manosidase adalah eksoenzim yang mengubah manooligo sakarida menjadi manosa, sedangkan a-galaktosidase bekerja untuk memutus galaktosa yang ada pada rantai samping galaktomanan (Vries &Visser 2001). Mananase dapat digunakan sebagai campuran pada pakan ternak untuk meningkatkan daya cernanya (Iriani et al. 1994). Di samping itu mananase dapat pula digunakan untuk mengurangi viskositas pada proses ekstraksi minyak sayur dari biji legum dan ekstrak kopi pada pembuatan kopi instan (Kansoh & Nagieb 2004). Pada industri pulp dan kertas, mananase dapat dikombinasikan dengan xilanase sebagai agen prebleacing untuk soft wood pulp untuk mengurangi penggunaan bahan kimia klorin (Marga et al. 1996). Struktur galaktomanan beserta letak titik potong oleh kompleks mananase terlihat pada Gambar 1.
Xilan adalah polisakarida kompleks yang terdiri atas tulang punggung residu xilosa
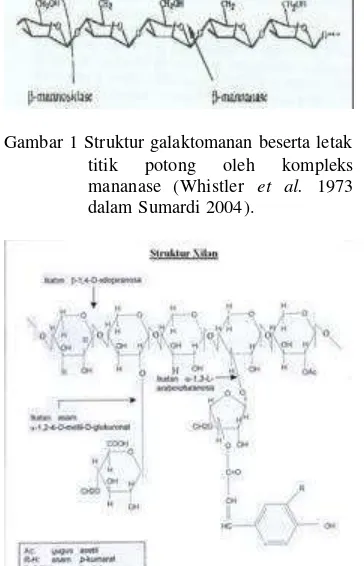
yang terikat oleh ikatan ß-1,4-glikosidik (Kapoor et al. 2001). Rantai tulang punggung xilan ini dapat mengandung substituen O-asetil, a -L-arabinofuranosil, glukoronat atau asam metil glukoronat (Saha 2003). Enzim pendegradasi xilan berperan penting dalam memecah struktur komplek xilan atau hemiselulosa untuk industri kertas dan pembuatan bahan bakar (Saha 2003). Hidrolisis xilan menjadi gula sederhana melibatkan dua tipe enzim utama yaitu endo-ß-1,4-xilanase dan ß-xilosidase (Ali et al. 2004). Struktur xilan beserta posisi ikatan rantai sampingnya terlihat pada Gambar 2.
Gambar 1 Struktur galaktomanan beserta letak titik potong oleh kompleks mananase (Whistler et al. 1973 dalam Sumardi 2004).
Gambar 2 Struktur xilan beserta posisi ikatan rantai sampingnya (Kapoor 2001).
2
dan mensekresikan beragam enzim ekstraseluler dan ribuan produk metabolit lain. Aktinomiset penghasil enzim ekstraseluler banyak ditemukan di tanah (Balows et al.
1981). Salah satu spesies aktinomiset yaitu
Streptomyces lividans dapat mendegradasi hemiselulosa seperti manan dan xilan (Kansoh & Nagieb 2004).
Mikroorganisme lain yang diketahui dapat menghasilkan mananase ialah Bacillus pumillus DYP 2 (Aurora 2003), Geobacillus
stearothermophilus (Sumardi 2004),
Thermotoga neopolitana 5068 (Duffaud et al.
1997), Vibrio sp. galur MA-138 (Tamaru et al. 1995), Flavobacterium sp. (Zakaria et al.
1998), Thermomonospora fusca (Hilge et al. 1998), Pycnoporus sanguinis (Nurdiani 1997),
Sclerotium rolfsii (Gubitz et al. 1996),
Ganoderma spp. (Yunaeni 1998).
Meryandini (2005, Komunikasi Pribadi) melaporkan bahwa Streptomyces sp. galur 45I-3 asal Kalimantan mempunyai aktivitas mananolitik dan xilanolitik. Aktivitas xilanolitik dari isolat ini optimum pada pH 5.0 dan suhu 50 oC, serta penambahan kation Ca2+ dengan konsentrasi akhir 1 mM meningkatkan aktivitasnya sebesar 30%. pH dan suhu optimum xilanase ini akan dipakai untuk pengujian aktivitas xilanase dalam penelitian ini.
Penelitian ini bertujuan untuk mengetahui kondisi optimum mananase (pH, suhu), kation yang berperanan, dan substrat yang dapat menginduksi pembentukan mananase dari
Streptomyces sp. galur 45I-3.
Penelitian ini dilaksanakan dari bulan Maret sampai September 2005 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan
Isolat Streptomyces sp. galur 45I-3 merupakan koleksi dari Dr. Ir. Yulin Lestari di Laboratorium Mikr obiologi, Departemen Biologi, FMIPA IPB. Bahan yang digunakan ialah locust bean gum, oatspelt xylan, birchwood xylan (Sigma USA), bungkil kelapa, dan reagen dinitrosalisilat (DNS) (Sigma USA).
Alat-alat yang digunakan antara lain penangas air, spektrofotometer (Spectronic 21), penangas bergoyang (Precision), sentrifusa (Jouan), dan autoklaf.
Metode
Peremajaan Isolat. Isolat ditumbuhkan pada media agar-agar Basal Salt Medium
(BSM) yang mengandung locust bean gum
(locust bean gum 0.5%; KNO3 0.2%; K2HPO4
0.1%; MgSO4.7H2O 0.05%; NaCl 0.05%; FeSO4 0.001%; CaCO3 0.3%; agar-agar 1.5%)
dan diinkubasi selama 7 hari pada suhu ruang. Produksi Enzim Mananase. Dengan menggunakan sedotan plastik steril berdiameter 0.5 cm, koloni isolat dari media agar-agar BSM dengan locust bean gum
diinokulasikan ke dalam 100 ml media cair BSM yang mengandung locust bean gum atau bungkil kelapa dengan konsentrasi 0.5% dalam erlenmeyer 500 ml. Suspensi diinkubasi dalam penangas bergoyang pada suhu ruang. Setiap hari selama 5-7 hari, 6 ml kultur bakteri diambil untuk pengujian aktivitas enzim dan kadar protein. Ekstrak kasar enzim dipisahkan dari massa sel dengan sentrifugasi pada kecepatan 5000 rpm (4500 g) selama 10 menit. Aktivitas tertinggi ditentukan sebagai waktu panen enzim untuk karakterisasi mananase.
Penetapan Aktivitas Mananase dan Pengukuran Kadar protein. Aktivitas mananase dilakukan dengan menguji ekstrak kasar enzim dengan metode asam dinitrosalisilat (DNS) berdasarkan Purwadaria
et al. (1994) (Lampiran 1). Sebanyak 1 ml ekstrak kasar enzim direaksikan dengan 1 ml substrat locust bean gum (0.5%) lalu diinkubasi pada suhu 37 oC selama 30 menit. Reaksi dihentikan dengan penambahan 2 ml reagen DNS. Kontrol merupakan substrat yang direaksikan dengan DNS kemudian ditambahkan ekstrak kasar enzim. Kemudian sampel dan kontrol dididihkan selama 15 menit, didinginkan dalam air es. Gula pereduksi yang dihasilkan diukur absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm. Satu nkat aktivitas mananase adalah banyaknya enzim yang dapat memproduksi 1 nanomol manosa dalam satu detik. Kurva standar manosa (Lampiran 2) dibuat dengan cara melarutkan 2 ml berbagai konsentrasi manosa yaitu 0.15-0.75 mg/ml dari 0.1 g/100 ml larutan stok dengan 2 ml DNS, dididihkan pada suhu 100
o
KARAKTERISASI MANANASE Streptomyces sp. GALUR 45I-3
Oleh:
Dwi Ambarawati
G 34101051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DWI AMBARAWATI. Karakterisasi Mananase
Streptomyces sp. Galur 45I -3.
Dibimbing oleh ANJA MERYANDINI dan NISA RACHMANIA MUBARIK.
Hemiselulosa menyusun 20-35% berat kayu yang terutama terdiri atas manan (softwoods) dan xilan (hardwoods). Hemiselulosa dapat digunakan oleh mikrob sebagai sumber karbon. Mananase dan xilanase adalah enzim kompleks yang dapat mendegradasi hemiselulosa. Aktivitas mananase
Streptomyces sp. galur 45I -3 diuji pada media locust bean gum 0.5% dan bungkil kelapa 0.5% dengan metode asam dinitrosalisilat (DNS). Kadar protein diukur dengan kolorimeter menggunakan coomasie blue. Aktivitas mananase dan xilanase juga diuji menggunakan media
birchwood xylan dan oatspelt xylan. Mananase Streptomyces sp. galur 45I -3 mempunyai suhu optimum 40 oC dan pH optimum 6.0. Penambahan 1mM kation Mg 2+ dan Zn 2+ masing-masing meningkatkan aktivitas mananase sebesar 29.2% dan 80.2%, sedangkan Mn 2+, Ca 2+ dan Co 2+ masing-masing menurunkan aktivitasnya sebesar 67%, 100%, dan 59.7%. Penambahan senyawa pengkelat logam etilen diamina tetraasetat (EDTA) dengan konsentrasi akhir 1 mM hanya sedikit menurunkan aktivitasnya. Media yang mengandung birchwood xylan dan oatspelt xylan
menginduksi pembentukan mananase namun dengan aktivitas yang lebih rendah dari xilanase.
ABSTRACT
DWI AMBARAWATI. Mannanase Characterization of
Streptomyces sp. Strain
45I -3. Supervised by ANJA MERYANDINI and NISA RACHMANIA
MUBARIK
Hemicelluloses constitute 20 -35% of total wood weight which contain major component of mannans (softwoods) and xylans (hardwoods). Hemicelluloses are used by microbes as a carbon sources. Mannanase and xylanase are enzyme complexs that are able to degrade hemicelluloses. Mannanase activity from Streptomyces strain 45I-3 was tested in locust bean gum 0.5% and coconut meal 0.5% medium and detected by dinitrosalysilic acid (DNS) method. Protein concentration was measured using colorimeter method employing coomasie blue. Mannanase and xylanase activity were also detected by using birchwood xylan and oatspelt xylan medium. The optimum temperature and pH of Streptomyces mannanase strain 45I-3 was 40 oC and 6.0, respectively. The addition 1 mM of Mg 2+ and Zn 2+ at final concentration increased the
mannanase activity for about 29.2% and 80.2%, while 1 mM Mn 2+ , Ca 2+ and Co 2+ decreased its activity for about 67%, 100%, and 59.7%, respectively. The addition of 1 mM ethylene diamine tetraacetic acid (EDTA) tend to decreased the enzyme activity. The medium which contain
KARAKTERISASI MANANASE Streptomyces sp. GALUR 45I-3
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Dwi Ambarawati
G 34101051
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul
: KARAKTERISASI MANANASE Streptomyces sp. GALUR 45I -3
Nama
: Dwi Ambarawati
NIM
: G 34101051
Menyetujui,
Pembimbing 1 Pembimbing 2
Dr. Anja Meryandini, M.S. Dr. Nisa Rachmania Mubarik, M.Si.
NIP. 131663016 NIP.1320455531
Mengetahui,
Dekan Fakultas MIPA
Dr. Ir. Yonny Koesmaryono, M.S.
NIP. 131473999
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan nikmat dan karunia-Nya sehingga penulis berhasil menyelesaikan skripsi ini. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB dari bulan Maret 2005 sampai September 2005 dengan judul Karakterisasi Mananase Streptomyces sp. galur 45I-3.
Ucapan terima kasih penulis sampaikan kepada ibu Dr. Anja Meryandini, M.S. selaku pembimbing 1, Ibu Dr. Nisa Rachmania Mubarik, M.Si. selaku pembimbing 2, Dr. Ir. Nampiah Sukarno selaku dewan penguji atas bimbingan, kritik dan saran selama penulisan karya ilmiah, dan Dr. Ir. Yulin Lestari yang telah membantu menyumbangkan isolat untuk penelitian ini. Penulis juga m engucapkan terima kasih kepada seluruh staf Laboratorium Mikrobiologi yaitu Mbak Heni, Pak Endang, Pak Jaka, Bu Kokoy dan Pak Husein atas bantuannya.
Ucapan terima kasih terbesar penulis sampaikan kepada kedua orang tua, adikku Nansi dan Mala serta Mas Alip yang senantiasa mendukung dan mendoakan. Ucapan terima kasih juga tidak lupa disampaikan kepada teman-teman di Laboratorium Mikrobiologi Mba Elsi, Mba Dini, Mba Kiki, Kak Tono, Wulan, Mas Prima, Mas Ozy, Henry dan yang terpenting adalah Irma, Deri, Trio, Dini, Made, Fitri, Duti, Anne, Aries, Nana, Bekti, dan Lucky. Terima kasih juga kepada warga CD 47 (Rika, Nick, Hesti, Nina, Kiki), Pak Joni, Pak Agus, dan Pak Edi, serta teman-teman Angkatan 38 sehingga skripsi ini menjadi lancar.
Penulis berharap skripsi ini dapat dimanfaatkan bagi semua pihak.
Bogor, Desember 2005
RIWAYAT HIDUP
Penulis merupakan putri pertama dari tiga bersaudara pasangan Sriyono dan Kamsiyah, S.Pd. yang dilahirkan di Klaten pada tanggal 26 Maret 1984. Tahun 1995 penulis lulus dari Sekolah Dasar Negeri Krikilan II Bayat, tahun 1998 lulus dari Sekolah Menengah Pertama Negeri 1 Bayat dan pada tahun 2001 penulis lulus dari Sekolah Menengah Umum Negeri I Cawas, Klaten dan masuk di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur USMI.
Selama mengikuti perkuliahan penulis menjadi asisten mata kuliah Biologi Alga dan Bryophyta tahun 2003-2004 dan 2004-2005, Genetika Dasar tahun 2004-2005, Mikrobiologi Dasar 2004-2005, Fisiologi Mikroba tahun 2004-2005, serta Botani Umum tahun 2004-2005 dan 2005-2006. Penulis melaksanakan Praktik Lapangan di Rumah Sakit Umum Pusat Dr. Soeradji Tirtonegoro, Klaten pada tahun 2004 dengan tema Pengukuran Kadar Hemoglobin di Rumah Sakit Umum Pusat Dr. Soeradji Tirtonegoro, Klaten.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...vii
DAFTAR LAMPIRAN ...vii
PENDAHULUAN...1
BAHAN DAN METODE...2
Bahan... ...2
Metode...2
Peremajaan Isolat...2
Produksi Enzim Mananase... ... 2
Penetapan Aktivitas Mananase dan Pengukuran Kadar Protein...2
Karakterisasi Mananase...3
Uji Substrat... 3
HASIL... 3
Produksi Mananase dan Kurva Aktivitas Mananase Isolat 45I-3... 3
Karakterisasi Mana nase Isolat 45I-3... 3
Uji Substrat...4
PEMBAHASAN...4
SIMPULAN DAN SARAN... 6
Simpulan...6
Saran...6
DAFTAR PUSTAKA...7
DAFTAR GAMBAR
Halaman
1 Struktur galaktomanan beserta letak titik potong oleh kompleks mananase... 1
2 Struktur xilan beserta posisi ikatan rantai sampingnya ... 1
3 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada pH 7.0 suhu 37 oC
dalam media locust bean gum 0.5% ... 3
4 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada pH 7.0 suhu 37 oC
dalam media bungkil kelapa 0.5%... 3
5 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada berbagai pH yang diuk ur
pada suhu 37 oC ... 3
6 Kurva aktivitas mananase Streptomyces sp. galur 45I-3 pada berbagai suhu yang diukur
pada pH 6.0... 4
7 Pengaruh penambahan berbagai kation dengan konsentrasi akhir 1 mM terhadap
aktivitas relatif mananase Streptomyces sp. galur 45I-3 pada pH 6.0 dan suhu 40 oC ... 4
DAFTAR LAMPIRAN
Halaman
1 Pengukuran aktivitas mananase dengan metode DNS berdasarkan Purwadaria et al. (1994) ...10
2 Kurva standar manosa ...10
3 Kurva standar xilosa ...10
4 Aktivitas mananase Streptomyces sp. galur 45I-3 pada media locust bean gum 0.5% pH 7.0 dan suhu 37 oC... ...11
5 Aktivitas mananase Streptomyces sp. galur 45I-3 pada media bungkil kelapa 0.5% pH 7.0 dan suhu 37 oC ...11
6 Pengaruh pH terhadap aktivitas mananase Streptomyces sp. galur 45I -3 pada suhu 37 o C...11
7 Pengaruh suhu terhadap aktivitas mananase Streptomyces sp. galur 45I -3 pada pH 6.0...11
8 Pengaruh penambahan berbagai kation dengan konsentrasi akhir 1 mM terhadap aktivitas
mananase Streptomyces sp. galur 45I -3 pada pH dan suhu optimum...12
1
PENDAHULUAN
Hemiselulosa merupakan polisakarida linier atau bercabang yang banyak ditemukan sebagai heteroglikan pada tumbuhan tingkat tinggi. Dua jenis hemiselulosa yang penting dalam industri ialah hetero-1,4-D -manan dan hetero -1,4-D -xilan (Hilge et al. 1998).
Manan adalah komponen hemiselulosa pada soft woods atau kayu lunak yang terdapat pada gimnospermae (Marga 1996) yang merupakan polimer dari manosa sedangkan galaktomanan adalah polimer manosa yang diselingi galaktosa (Lehninger 1982). Galaktomanan umumnya ditemukan pada tanaman legum sebagai penyusun biji namun juga pada tanaman lain seperti pada endosperma palem (Vries & Visser 2001).
Bungkil kelapa dapat dimanfaatkan sebagai pakan ternak yang memiliki kadar protein tinggi. Kandungan manan dan galaktomanan yang tinggi pada pakan ternak ini melindungi struktur protein sehingga susah dicerna. Pemanfaatan bungkil kelapa sebagai pakan ternak secara optimal dapat dibantu dengan adanya enzim yang dapat menguraikan manan dan galaktomanan sehingga protein mudah dicerna oleh ternak. Untuk dapat mendegradasi senyawa manan dengan sempurna, mikroorganisme harus menghasilkan sedikitnya 3 enzim yaitu ß-mananase, ß–manosidase, dan a-galaktosidase (Duffaud et al. 1997). Mananase mengkatalisis hidrolisis ikatan ß-1,4-manosa pada ß-1,4-manan, glukomanan, dan galaktomanan (Kansoh & Nagieb 2004). ß-manosidase adalah eksoenzim yang mengubah manooligo sakarida menjadi manosa, sedangkan a-galaktosidase bekerja untuk memutus galaktosa yang ada pada rantai samping galaktomanan (Vries &Visser 2001). Mananase dapat digunakan sebagai campuran pada pakan ternak untuk meningkatkan daya cernanya (Iriani et al. 1994). Di samping itu mananase dapat pula digunakan untuk mengurangi viskositas pada proses ekstraksi minyak sayur dari biji legum dan ekstrak kopi pada pembuatan kopi instan (Kansoh & Nagieb 2004). Pada industri pulp dan kertas, mananase dapat dikombinasikan dengan xilanase sebagai agen prebleacing untuk soft wood pulp untuk mengurangi penggunaan bahan kimia klorin (Marga et al. 1996). Struktur galaktomanan beserta letak titik potong oleh kompleks mananase terlihat pada Gambar 1.
Xilan adalah polisakarida kompleks yang terdiri atas tulang punggung residu xilosa
yang terikat oleh ikatan ß-1,4-glikosidik (Kapoor et al. 2001). Rantai tulang punggung xilan ini dapat mengandung substituen O-asetil, a -L-arabinofuranosil, glukoronat atau asam metil glukoronat (Saha 2003). Enzim pendegradasi xilan berperan penting dalam memecah struktur komplek xilan atau hemiselulosa untuk industri kertas dan pembuatan bahan bakar (Saha 2003). Hidrolisis xilan menjadi gula sederhana melibatkan dua tipe enzim utama yaitu endo-ß-1,4-xilanase dan ß-xilosidase (Ali et al. 2004). Struktur xilan beserta posisi ikatan rantai sampingnya terlihat pada Gambar 2.
Gambar 1 Struktur galaktomanan beserta letak titik potong oleh kompleks mananase (Whistler et al. 1973 dalam Sumardi 2004).
Gambar 2 Struktur xilan beserta posisi ikatan rantai sampingnya (Kapoor 2001).
2
dan mensekresikan beragam enzim ekstraseluler dan ribuan produk metabolit lain. Aktinomiset penghasil enzim ekstraseluler banyak ditemukan di tanah (Balows et al.
1981). Salah satu spesies aktinomiset yaitu
Streptomyces lividans dapat mendegradasi hemiselulosa seperti manan dan xilan (Kansoh & Nagieb 2004).
Mikroorganisme lain yang diketahui dapat menghasilkan mananase ialah Bacillus pumillus DYP 2 (Aurora 2003), Geobacillus
stearothermophilus (Sumardi 2004),
Thermotoga neopolitana 5068 (Duffaud et al.
1997), Vibrio sp. galur MA-138 (Tamaru et al. 1995), Flavobacterium sp. (Zakaria et al.
1998), Thermomonospora fusca (Hilge et al. 1998), Pycnoporus sanguinis (Nurdiani 1997),
Sclerotium rolfsii (Gubitz et al. 1996),
Ganoderma spp. (Yunaeni 1998).
Meryandini (2005, Komunikasi Pribadi) melaporkan bahwa Streptomyces sp. galur 45I-3 asal Kalimantan mempunyai aktivitas mananolitik dan xilanolitik. Aktivitas xilanolitik dari isolat ini optimum pada pH 5.0 dan suhu 50 oC, serta penambahan kation Ca2+ dengan konsentrasi akhir 1 mM meningkatkan aktivitasnya sebesar 30%. pH dan suhu optimum xilanase ini akan dipakai untuk pengujian aktivitas xilanase dalam penelitian ini.
Penelitian ini bertujuan untuk mengetahui kondisi optimum mananase (pH, suhu), kation yang berperanan, dan substrat yang dapat menginduksi pembentukan mananase dari
Streptomyces sp. galur 45I-3.
Penelitian ini dilaksanakan dari bulan Maret sampai September 2005 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan
Isolat Streptomyces sp. galur 45I-3 merupakan koleksi dari Dr. Ir. Yulin Lestari di Laboratorium Mikr obiologi, Departemen Biologi, FMIPA IPB. Bahan yang digunakan ialah locust bean gum, oatspelt xylan, birchwood xylan (Sigma USA), bungkil kelapa, dan reagen dinitrosalisilat (DNS) (Sigma USA).
Alat-alat yang digunakan antara lain penangas air, spektrofotometer (Spectronic 21), penangas bergoyang (Precision), sentrifusa (Jouan), dan autoklaf.
Metode
Peremajaan Isolat. Isolat ditumbuhkan pada media agar-agar Basal Salt Medium
(BSM) yang mengandung locust bean gum
(locust bean gum 0.5%; KNO3 0.2%; K2HPO4
0.1%; MgSO4.7H2O 0.05%; NaCl 0.05%; FeSO4 0.001%; CaCO3 0.3%; agar-agar 1.5%)
dan diinkubasi selama 7 hari pada suhu ruang. Produksi Enzim Mananase. Dengan menggunakan sedotan plastik steril berdiameter 0.5 cm, koloni isolat dari media agar-agar BSM dengan locust bean gum
diinokulasikan ke dalam 100 ml media cair BSM yang mengandung locust bean gum atau bungkil kelapa dengan konsentrasi 0.5% dalam erlenmeyer 500 ml. Suspensi diinkubasi dalam penangas bergoyang pada suhu ruang. Setiap hari selama 5-7 hari, 6 ml kultur bakteri diambil untuk pengujian aktivitas enzim dan kadar protein. Ekstrak kasar enzim dipisahkan dari massa sel dengan sentrifugasi pada kecepatan 5000 rpm (4500 g) selama 10 menit. Aktivitas tertinggi ditentukan sebagai waktu panen enzim untuk karakterisasi mananase.
Penetapan Aktivitas Mananase dan Pengukuran Kadar protein. Aktivitas mananase dilakukan dengan menguji ekstrak kasar enzim dengan metode asam dinitrosalisilat (DNS) berdasarkan Purwadaria
et al. (1994) (Lampiran 1). Sebanyak 1 ml ekstrak kasar enzim direaksikan dengan 1 ml substrat locust bean gum (0.5%) lalu diinkubasi pada suhu 37 oC selama 30 menit. Reaksi dihentikan dengan penambahan 2 ml reagen DNS. Kontrol merupakan substrat yang direaksikan dengan DNS kemudian ditambahkan ekstrak kasar enzim. Kemudian sampel dan kontrol dididihkan selama 15 menit, didinginkan dalam air es. Gula pereduksi yang dihasilkan diukur absorbansinya dengan spektrofotometer pada panjang gelombang 540 nm. Satu nkat aktivitas mananase adalah banyaknya enzim yang dapat memproduksi 1 nanomol manosa dalam satu detik. Kurva standar manosa (Lampiran 2) dibuat dengan cara melarutkan 2 ml berbagai konsentrasi manosa yaitu 0.15-0.75 mg/ml dari 0.1 g/100 ml larutan stok dengan 2 ml DNS, dididihkan pada suhu 100
o
3
Standar protein yang digunakan ialah bovin serum albumin (BSA) dengan konsentrasi 0.01-0.10 mg/ml.
Karakterisasi Mananase. Untuk mengetahui kondisi optimum aktivitas mananase, ekstrak kasar enzim diujikan pada berbagai suhu (30-90 oC) dengan selang 10 oC dan pada berbagai pH (3.0-9.0) dengan selang 0.5 unit. Bufer yang digunakan ialah sitrat fosfat 0.2 M (pH 3.0-5.5), fosfat 0.2 M (6.0-8.0), tris HCl 0.2 M (8.5 -9.0).
Pengaruh penambahan kation dilakukan dengan menambahkan beberapa jenis kation (Mn2+, Ca2+, Mg2+, Co2+, dan Zn2+) yang berasal dari garam MgCl2, CaCl2, CoCl2,
MnCl2 dan ZnCl2 serta senyawa pengkelat
logam EDTA dengan konsentrasi akhir 1mM. Uji Substrat. Uji substrat dilakukan dengan cara menumbuhkan isolat pada media yang mengandung substrat manan dan xilan kemudian dari masing-masing media diukur aktivitas mananase dan xilanase pada pH dan suhu optimum keduanya. Aktivitas xilanase diukur dengan metode DNS berdasarkan
Miller (1959). Kurva standar xilosa (Lampiran 3) dibuat dari larutan stok xilosa
0.1 g/100 ml akuades. Substrat yang digunakan ialah locust bean gum, oatspelt xylan dan birchwood xylan.
Semua data dari penelitian ini berdasarkan rata-rata yang diambil dari dua ulangan percobaan.
HASIL
Produksi Mananase dan Kurva Aktivitas Mananase Isolat 45I-3
Isolat 45I-3 yang telah ditumbuhkan pada media yang mengandung locust bean gum
0.5% atau bungkil kelapa 0.5% diuji aktivitasnya. Aktivitas mananase di media
locust bean gum 0.5% menunjukkan aktivitas mananase tertinggi pada hari ke-2 yaitu 0.179 nkat/ml, kadar protein sebesar 0.168 mg/ml, dan aktivitas spesifik 1.065 nkat/mg (Gambar 3, Lampiran 4).
Pada hari pertama inkubasi di media bungkil kelapa sudah terdeteksi adanya aktivitas mananase, kemudian mengalami penurunan pada hari ke-2, dan naik kembali pada hari ke-3 hingga diperoleh aktivitas tertinggi pada hari ke-4 sebesar 0.051 nkat/ml, kadar protein sebesar 0.139 mg/ml, dan aktivitas spesifik 0.367 nkat/mg (Gambar 4, Lampiran 5). 0 0,05 0,1 0,15 0,2
1 2 3 4 5 6 7
Hari Aktivitas mananase (nkat/ml) 0 0,2 0,4 0,6 0,8 1 1,2
Aktivitas spesifik (nkat/mg)
Aktivitas mananase Aktivitas spesifik
Gambar 3 Kurva aktivitas mananase
Streptomyces sp. galur 45I-3 pada pH 7.0 suhu 37 oC dalam media locust bean gum 0.5%.
0 0,01 0,02 0,03 0,04 0,05 0,06
1 2 3 4 5
Hari Aktivitas mananase (nkat/ml) 0 0,1 0,2 0,3 0,4 0,5 Aktivitas spesifik (nkat/mg)
Aktivitas mananase Aktivitas spesifik
Gambar 4 Kurva aktivitas m ananase
Streptomyces sp. galur 45I-3 pada pH 7.0 suhu 37 oC dalam media bungkil kelapa 0.5%.
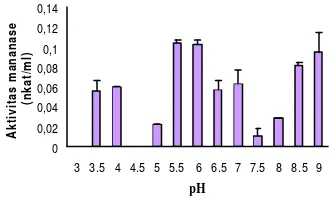
Karakterisasi Mananase Isolat 45I-3 Mananase isolat 45I -3 menunjukkan aktivitas yang tinggi pada pH 5.5, 6.0 dan 9.0 dengan aktivitas mananase sebesar 0.105 nkat/ml, 0.103 nkat/ml dan 0.096 nkat/ml (Gambar 5, Lampiran 6). Setelah dilakukan pengujian lebih lanjut mananase Streptomyces
sp. galur 45I-3 aktivitasnya tetap tinggi pada pH 6.0 sehingga pH tersebut dipakai sebagai pH optimum. 0 0,02 0,04 0,06 0,08 0,1 0,12 0,14
3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9
pH
Aktivitas mananase
(nkat/ml)
Gambar 5 Aktivitas mananase Streptomyces
4
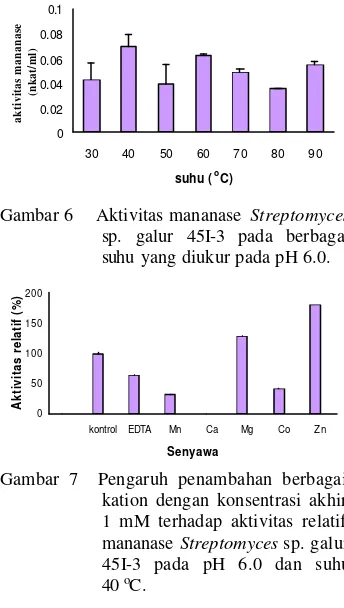
Suhu optimum mananase Streptomyces sp. galur 45I-3 ialah 40 oC dengan aktivitas sebesar 0.070 nkat/ml (Gambar 6, Lampiran 7). Mananase Streptomyces sp. galur 45I-3 juga mempunyai aktivitas yang tinggi pada suhu 60 oC dan 90 oC dengan aktivitas sebesar 0.062 nkat/ml dan 0.055 nkat/ml.
Penambahan kation Mg2+ dan Zn2+ dengan konsentrasi akhir 1 mM akan meningkatkan aktivitas mananase sebesar 29.2% dan 80.2%, sedangkan penambahan kation Mn2+, Ca2+, Co2+ menurunkan aktivitasnya sebesar 67%, 100% dan 59.7%. Penambahan EDTA juga menurunkan aktivitas mananase sebesar 35.9% (Gambar 7, Lampiran 8).
0 0.02 0.04 0.06 0.08 0.1
30 40 50 60 70 80 90 suhu ( oC)
aktivitas mananase
(nkat/ml)
Gambar 6 Aktivitas mananase Streptomyces
sp. galur 45I-3 pada berbagai suhu yang diukur pada pH 6.0.
0 50 100 150 200
kontrol EDTA Mn Ca Mg Co Zn
Senyawa
Aktivitas relatif (%)
Gambar 7 Pengaruh penambahan berbagai kation dengan konsentrasi akhir 1 mM terhadap aktivitas relatif mananase Streptomyces sp. galur 45I-3 pada pH 6.0 dan suhu 40 oC.
Uji Substrat
Media locust bean gum 0.5% dengan kondisi optimum mananase yaitu pH 6.0 dan suhu 40 oC, dapat menginduksi pembentukan mananase dan xilanase. Aktivitas mananase lebih tinggi dari pada xilanase yaitu sebesar 0.090 nkat/ml dengan aktivitas spesifik sebesar 0.533 nkat/mg. Aktivitas xilanase di media locust bean gum 0.5% pada kondisi optimum mananase ialah 0.057 nkat/ml dengan aktivitas spesifik sebesar 0.340 nkat/mg.
Media birchwood xylan dapat
menginduksi mananase dan xilanase. Aktivitas mananase dan xilanase di media
birchwood xylan (pH 6.0 dan suhu 40 oC) ialah 0.805 nkat/ml dan 7.567 nkat/ml dengan aktivitas spesifik sebesar 3.979 nkat/mg dan 37.421 nkat/mg. Aktivitas mananase dan xilanase pada kondisi optimum xilanase (pH 5.0 dan suhu 50 oC) ialah 0.257 nkat/ml dan 9.072 nkat/ml dengan aktivitas spesifik sebesar 1.271 nkat/mg dan 44.869 nkat/mg.
Media oat speltxylan juga dapat menginduksi pembentukan mananase dan xilanase. Aktivitas mananase dan xilanase (kondisi optimum mananase) pada media ini ialah 0.257 nkat/ml dan 2.592 nkat/ml dengan aktivitas spesifik sebesar 1.014 nkat/mg dan 11.012 nkat/mg. Pada kondisi optimum xilanase, aktivitas mananase dan xilanase ialah 0.552 nkat/ml dan 8.138 nkat/ml dengan aktivitas spesifik sebesar 2.219 nkat/mg dan 34.574 nkat/mg. Tabel aktivitas mananase dan xilanase pada beberapa media produksi dapat dilihat pada Lampiran 9.
PEMBAHASAN
Uji aktivitas mananase Streptomyces sp. galur 45I-3 dilakukan dengan pereaksi dinitrosalisilat. Pereaksi dinitrosalisilat dengan komponen utama asam 3,5-dinitrosalisilat (kuning) akan mengalami reduksi menjadi asam 3-amino-5-nitrosalisilat. Reaksi reduksi pada gugus nitro tersebut diakibatkan adanya gula pereduksi yang merupakan hasil hidrolisis substrat oleh mananase (Miller 1959).
Aktivitas tertinggi mananase Streptomyces
sp. galur 45I-3 dalam media locust bean gum
0.5% didapat pada saat biakan berumur 2 hari. Setelah berumur 2 hari aktivitas mananase
Streptomyces sp. galur 45I-3 menurun. Penurunan aktivitas ini karena adanya represi katabolit. Kadar monosakarida seperti manosa dan galaktosa sebagai hasil dari hidrolisis dapat menekan sintesis enzim yang digunakan untuk menguraikan polisakarida (galaktomanan). Setelah hari keempat aktivitas mananase mulai meningkat lagi karena monosakarida yang digunakan sebagai sumber karbon untuk pertumbuhan mulai berkurang sehingga bakteri mulai memproduksi enzim kembali untuk menguraikan polisakarida.
Pengukuran aktivitas mananase
5
bungkil kelapa 0.5%. Locust bean gum lebih dapat menginduksi pembentukan mananase
Streptomyces sp. galur 45I-3 daripada bungkil kelapa karena kandungan galaktomanan pada
locust bean gum lebih tinggi dibandingkan di bungkil kelapa yaitu sebesar 88% sedangkan dibungkil kelapa hanya 61%. Sumardi (2004) melaporkan bahwa G. stearothermophilus L-07 menunjukkan aktivitas mananase pada media yang mengandung locust bean gum, kolang kaling, dan umbi suweg tetapi tidak pada media yang mengandung bungkil kelapa. Hal ini diduga karena kandungan logam pada bungkil kelapa yang cukup tinggi sehingga bersifat racun terhadap G. stearothermophilus. Kandungan logam yang tinggi pada bungkil kelapa ini antara lain P, Ca, Co, Mn, Mg, Zn, dan Cu. Berbeda dengan hasil penelitian Anggreandari (2005) yang melaporkan bahwa isolat RA05 yang berasal dari tempat pembuangan limbah kopra kabupaten Pasaman, Sumatera Barat menunjukkan aktivitas mananase yang lebih tinggi pada media bungkil kelapa dibandingkan dengan
locust bean gum.
Mananase Streptomyces sp. galur 45I-3 mempunyai suhu optimum 40 oC dengan aktivitas sebesar 0.070 nkat/ml. Setelah melewati suhu optimum aktivitas enzim menurun karena kemungkinan kerusakan enzim akibat denaturasi semakin besar. Tamaru et al. (1995) melaporkan bahwa mananase dari Vibrio sp. galur MA-138 mempunyai suhu optimum 40 oC (Tamaru et al. 1995). Mananase S. galbus NR juga mempunyai suhu optimum 40 oC (Kansoh &
Nagieb 2004).
Mananase Streptomyces sp. galur 45I-3 mempunyai pH optimum 6.0 dengan aktivitas sebesar 0.103 nkat/ml. Mananase
Streptomyces sp. galur 45I -3 juga mempunyai aktivitas yang tinggi pada pH 5.5 dan 9.0. Adanya 3 pH yang menunjukkan aktivitas yang tinggi karena enzim yang diukur masih berupa ekstrak kasar sehingga masih dalam bentuk protein campuran. Aktivitas yang tinggi pada 3 pH juga diduga karena
Streptomyces sp. Galur 45I -3 menghasilkan 3 enzim dari kompleks mananase. Tetapi untuk lebih menyakinkan harus dilakukan pemurnian enzim dan uji substrat spesifik untuk komp leks enzim mananase. Menurut Denniston et al. (2001) perubahan pH dapat menyebabkan perubahan derajat ionisasi gugus ionik dari asam amino pada rantai protein. Peningkatan aktivitas enzim disebabkan oleh ionisasi gugus ionik pada sisi
aktif yang menyebabkan konformasi sisi aktif lebih efektif dalam mengikat dan mengubah substrat menjadi produk. Mananase dari S. galbus NR (Kansoh & Nagieb 2004), Vibrio
sp. galur MA-138 (Tamaru et al. 1995) dan
Clostridium tertium KT -5A (Kataoka & Tokiwa 1998) mempunyai pH optimum 6.5 (Kansoh & Nagieb 2003).
Penambahan kation menunjukkan pengaruh yang berbeda-beda terhadap aktivitas mananase Streptomyces sp. galur 45I-3. Penambahan Mg2+ dan Zn2+ dengan konsentrasi akhir 1 mM meningkatkan aktivitas mananase hingga 29.2% dan 80.2%. Menurut Kansoh & Nagieb (2004) kation Mg2+ dapat meningkatkan aktivitas mananase
dari S. galbus NR. Penambahan kation Mn2+, Ca2+, Co2+ (1 mM) ternyata dapat menghambat aktivitas mananase Streptomyces sp. galur 45I-3. Kation Mn2+ juga menurunkan aktivitas mananase dari Vibrio sp. galur MA-138 (Tamaru et al. 1995) dan C. tertium K T-5A (Kataoka & Tokiwa 1998). Penambahan EDTA menurunkan aktivitas mananase sebesar 35.9% karena senyawa EDTA mengkelat kation yang ada pada enzim yang dibutuhkan untuk aktivitasnya. Menurut Whitaker (1994) kation dapat berperan penting sebagai komponen pada sisi aktif enzim, kofaktor, atau komponen yang dapat menjaga konformasi sisi aktif enzim.
Uji substrat yang dilakukan menggunakan media locust bean gum menunjukkan adanya aktivitas mananase dan xilanase. Kemampuan mikroorganisme untuk memproduksi enzim pada suatu substrat bergantung jenis mikroorganisme dan substratnya. Media
locust bean gum lebih dapat menginduksi pembentukan mananase daripada xilanase.
Locust bean gum merupakan substrat yang mengandung galaktomanan yang berasal dari tanaman Ceratonia siliqua. Media ini dapat menginduksi pembentukan kompleks mananase yang dapat menghidrolisis rantai tulang punggung galaktomanan maupun rantai sampingnya. Locust bean gum terdiri atas komponen galakto-D-manoglikan 88%, pentan 4%, protein 6%, selulosa 1% dan mineral 1% (Whistler et al. 1973 dalam Sumardi 2004). Kansoh & Nagieb (2004) melaporkan bahwa media yang mengandung substrat galaktomanan dapat lebih menginduksi pembentukan mananase daripada xilanase dari S. galbus NR.
Media birchwood xylan dan oatspelt xylan
2
Tabel 1 Aktivitas mananase dan xilanase dari beberapa bakteri
dibandingkan xilanase karena substrat xilan lebih dapat menginduksi pembentukan xilanase daripada mananase. Meryandini (2005, Komunikasi Pribadi) melaporkan bahwa xilanase Streptomyces sp. galur 45I-3 mempunyai aktivitas yang tinggi pada pH 5-6.5 dan suhu 40-60 oC. Hal ini menunjukkan bahwa kisaran pH untuk kerja mananase lebih sedikit daripada xilanase karena dari hasil uji substrat, xilanase tetap mempunyai aktivitas yang tinggi pada kondisi optimum mananase. Nagieb & Kansoh (2004) melaporkan adanya aktivitas mananase pada media yang mengandung substrat xilan pada
S. galbus NR dengan aktivitas yang lebih rendah dari pada xilanase.
Berdasarkan hasil penelitian mananase dan xilanase dari spesies lainnya (Tabel 1), dapat diketahui bahwa aktivitas mananase
Streptomyces sp. galur 45I-3 sangat kecil sekali dibandingkan dengan mananase dari organisme lain kemungkinan karena masih dalam bentuk ekstrak kasar. Aktivitas xilanase dari Streptomyces sp. galur 45I-3 pada media yang mengandung sumber karbon xilan ternyata cukup tinggi sehingga berpotensi untuk dipekatkan, diproduksi, serta dikarakterisasi.
Menurut Kansoh & Nagieb (2004), mananase dapat diproduksi pada beberapa sumber karbon. Nilai aktivitas tertinggi dicapai ketika galaktomanan dipakai sebagai sumber karbon sedangkan untuk xilanase mencapai aktivitas tertinggi menggunakan sumber karbon xilan. Adanya kesamaan rantai samping pada substrat manan dan xilan diduga dapat menginduksi pembentukan kompleks enzim mananase ataupun xilanase. Manan dan xilan
mempunyai kesamaan adanya rantai samping galaktosa dan asetil yang dapat dipotong oleh kompleks enzim mananase atau xilanase.
SIMPULAN DAN SARAN
Simpulan
Aktivitas mananase Str eptomyces sp. galur 45I-3 pada media locust bean gum
0.5% tertinggi dicapai pada hari kedua dengan aktivitas 0.179 nkat/ml dengan aktivitas spesifik sebesar 1.065 nkat/mg, sedangkan pada media bungkil kelapa 0.5% tinggi pada hari ke-4 yaitu 0.051 nkat/ml dengan aktivitas spesifik sebesar 0.367 nkat/mg. Hasil karakterisasi mananase menunjukkan bahwa enzim ini memiliki suhu optimum 40 oC, pH optimum 6.0 dan penambahan kation Mg2+ dan Zn2+ (konsentrasi akhir 1 mM) akan meningkatkan aktivitas sebesar 29.2% dan 80.2%. Media yang mengandung substrat
birchwood xylan dan oatspelt xylan dapat menginduksi pembentukan mananase dengan aktivitas yang lebih rendah daripada xilanase.
Saran
Karakterisasi sebaiknya dilakukan dengan mengukur aktivitas enzim pada berbagai kombinasi pH dan suhu agar diketahui kombinasi yang tepat untuk aktivitas enzim yang optimal. Isolat ini berpotensi untuk menghasilkan xilanase sehingga penelitian berikutnya dapat berupa pemekatan protein, pemurnian, dan karakterisasi.
Bakteri
Akt. enzim (nkat/ml)
pH dan suhu optimum
Kation yang
mengaktifkan Referensi
Mananase
Clostridium tertium
KT-5A 42.7 pH 6.5 suhu 55 0C Ca 2+
Kataoka & Tokiwa (1998)
Vibrio sp. galur
MA-138 7884 pH 6.5 suhu 40 0C Mg 2+, Ca 2+
T amaru et al. (1995)
S. galbus N R 113 pH 6.5 suhu 40 0C Mg 2+, Ca 2+, Na +, K +
Kansoh & Nagieb (2004) Xilanase
S. achromogenes
ISP 5028 196.5 pH 6.5 suhu 60 0C
Belfaquih et al. (2002)
Streptomyces sp.
QG-11-3 1350 pH 8.6 suhu 60 0C Ca 2+
Beg et al. (2000)
S. galbus N R 136.9 pH 6.5 suhu 50 0C Na +, K +
7
DAFTAR PUSTAKA
Ali MK, Rudolf FB, Bennet GN. 2004. Thermostable xylanase 10B from
Clostridium acetobotilicum
ATCC824. Ind Microbiol Technol
31: 229 -234.
Anggreandari R. 2005. Optimasi produksi dan karakterisasi mananase isolat RAO -5 [Skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Aurora DD. 2003. Isolasi dan karakterisasi enzim mananase Bacillus pumilus
DYP 2 [Skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Balows A. 1981. The Prokaryotes, A Handbook on the Biology of Bacteria: Ecophisiology, Isolation, Identification, Aplication. Vol 1 Ed ke-2. New York: Springer-Verlag , Inc.
Beg QK, Bhuson B, Kapoor M, Hoondal GS. 2000. Production and characterization of thermostable xylanase and pectinase from
Streptomyces sp. QG-11-3. Ind Microbiol Biotechnol 24:396-402. Belfaquih N, Jaspers C, Kurzatkowski W,
Penninckx MJ. 2002. Properties of
Streptomyces sp. endo-ß-xylanase in relation to their applicability a kraf pulp bleaching. World Microbiol Biotechnol 18: 699-705. Bradford MM. 1976. A rapid and sensitive
method for quantitation of microgram quantities of protein utilizing the a principle of protein dye binding. Anal Biochem 72: 248-254.
Denniston KJ, Topping JJ, Caret RL. 2001.
General, Organic, and Biochemistry. Ed ke-3. New York: McGraw Hill, Inc.
Duffaud GD, McCutchen CM, Leduc P, Parker KN, Kelly RM. 1997. Purification and characterisation of ext remely thermostable ß-mananase, ß–manosidase and a-galaktosidase from hyperthermophilic eubacterium
Thermotoga neopolitana 5068.
Appl Environ Microbiol 63:169-177.
Gubitz GM, Hayn M, Sommerauer M, Steiner W. 1996. Mannan degrading enzymes from Sclerotium rolfsii: characterisation and sinergism of two endo mananase and ß-manosidase. Biores Technol
58:127-135.
Hilge M et al. 1998. High-resolution native and complex structure of thermostable ß-mananase from
Thermomonospora fusca-substrat specificity in glycosyl hydrolase family 5. Structure 6:1433-1444. Iriani N, Purwadaria T, Haryati T, Darma J.
1994. Produksi mananase beberapa isolat kapang mananolitik pada substrat bungkil kelapa. Prosiding Seminar Hasil Penelitian dan
Pengembangan Bioteknologi;
Cibinong, 6-7 September 1994. hal 474-479.
Kansoh AL, Nagieb ZA. 2004. Xylanase and mananase enzymes from
Streptomyces galbus NR and their use in biobleaching of softwood
kraf pulp. Antonie van
Leeuwenhoek 85:103-114.
Kapoor M, Mahajan L, Hoondal GS. 2001. Microbial xylanases and their industrial applications. Appl Microbiol Biotechnol 56: 326 -338. Kataoka N, Tokiwa Y. 1998. Isolation and
characterization of an active mananase producing anaerobic bacterium Clostridium tertium
KT5A from lotus soil. Appl Microbiol 84: 357-367.
Lehninger AL. 1982. Dasar-Dasar Biokimia. Thenawijaya M, penerjemah; Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry. Madigan et al. 2000. Brock Biology of
Microorganisms. Ed ke-9. New Jersey: Prentice Hall International, Inc.
Marga F, Ghakis C, Dupont C, Morosoli R, Kleupfel D. 1996. Improved production of mananase by
Streptomyces lividans. Appl Environ Microbiol : 4656-4658. Miller GL. 1959. Use dinitrosalycilic acid
8
Nurdiani D. Penetapan aktivitas lignoselulolitik Pynoporus sanguinis dan Schizophyllum commune [Skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Matematika dan Ilmu pengetahuan Alam.
Purwadaria T, haryati T, Darma J. 1994. Isolasi dan seleksi kapang mesofilik penghasil mananase.
Ilmu dan Peternakan 7:26-29. Saha BC. 2003. Hemicellulose bioconversion.
J Microbiol Biotechnol 30: 279-291.
Sumardi. 2004. Isolasi, karakterisasi dan produksi ß-mananase ekstraseluler dari Geobacillus stearothermo
philus L-07 [Disertasi]. Bogor: Institut Pertanian Bogor, Fakultas Pasca Sarjana.
Tamaru Y, Araki T, Amagoi H, Mori H, Morishita T. 1995. Purification and characterization of an extracellular ß-1,4-mananase from a marine bacterium, Vibrio sp. strain MA-138. App l Environ Microbiol: 4454-4458.
Vries RP de, Visser J. 2001. Aspergillus
enzymes involved in degradation of plant cell wall polysaccarides.
Microbiol Mol Biol Rev 65:497-522.
Whitaker Jr. 1994. Principles of Enzymology for the Food Science. Ed ke-2. New York: Marcel Dekker, Inc. Yunaeni Y. 1998. Aktivitas Mananase dan
xilanase [Skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Zakaria MM, Ashiuchi M, Yamamoto S, Yagi T. 1998. Optimization for ß-mananase production of a psycrophilic bacterium,
Flavobacterium sp. Biosci
10
Lampiran 1 Pengukuran aktivitasmananase dengan metode DNS berdasarkan Purwadaria et al. (1994)
Aktivitas mananase (U/ml) = (X sampel – X kontrol) x 1000 (Waktu inkubasi x BM manosa)
Keterangan :
X = kadar manosa (mg/ml) yang berasal dari persaman regrasi dari kurva standar manosa BM manosa = 180.16
1 U/ml = 16.67 nkat/ml
Lampiran 2 Kurva standar manosa
y = 1.86x + 0.0052
R2 = 0.9749
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
0.15 0.25 0.35 0.45 0.55 0.65 0.75 0.85
Konsentrasi manosa (mg/ml)
OD 540 nm
Lampiran 3 Kurva standar xilosa
y = 1.9419x + 0.0177 R2 = 0.9942
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6
0.15 0.35 0.55 0.75 0.95
Konsentrasi xilosa (mg/ml)
OD 540 nm
Sampel (ml) Kontrol (ml) Blanko (ml)
Substrat (locust bean gum
0.5% dalam 0.2 M bufer pH
tertentu) 1 1 1
1
Enzim mananase 1
Akuades
Inkubasi 30 menit Tanpa inkubasi
DNS 2 2
Enzim mananase 1
Dididihkan selama 15 menit dan didinginkan dalam air es
11
Lampiran 4 Aktivitas mananase Streptomyces sp. galur 45I-3 pada media locust bean gum 0.5% pada pH 7.0 dan suhu 37 0C
Hari
Aktivitas mananase (nkat/ml)
Aktivitas spesifik (nkat/mg)
Kadar protein (mg/ml)
1 0.036 0.466 0.078
2 0.179 1.065 0.168
3 0.095 0.767 0.123
4 0.032 0.76 0.041
5 0.043 0.502 0.086
6 0.063 0.775 0.081
7 0.050 0.568 0.088
Lampiran 5 Aktivitas mananase Streptomyces sp. galur 45I-3 pada media bungkil kelapa 0.5% pada pH 7.0 dan suhu 37 0C
Hari
Aktivitas mananase (nkat/ml)
Aktivitas spesifik (nkat/mg)
Kadar protein (mg/ml)
1 0.050 0.407 0.123
2 0.008 0.057 0.139
3 0.029 0.203 0.143
4 0.051 0.367 0.139
5 0.017 0.122 0.139
Lampiran 6 Pengaruh pH terhadap aktivitas mananase Streptomyces sp. galur 45I-3 pada suhu 37 o C
pH Aktivitas mananase (nkat/ml)
3.00 0
3.50 0.056
4.00 0.060
4.50 0
5.00 0.023
5.50 0.105
6.00 0.103
6.50 0.057
7.00 0.063
7.50 0.012
8.00 0.030
8.50 0.082
9.00 0.096
Lampiran 7 Pengaruh suhu terhadap aktivitas mananase Streptomyces sp. galur 45I-3 pada pH 6.0
Suhu (0C) Aktivitas mananase (nkat/ml)
30 0.043
40 0.070
50 0.039
60 0.062
70 0.048
80 0.036
12
Lampiran 8 Pengaruh penambahan berbagai kation dengan konsentrasi akhir 1 mM terhadap aktivitas mananase Streptomyces sp. galur 45I-3 pada pH dan suhu optimum
Kation Aktivitas spesifik (nkat/mg) Aktivitas relatif (%)
Kontrol 0.206 100
EDTA 0.132 64.1
M n2+ 0.068 33
Ca2+ 0 0
M g2+ 0.291 129.2
Co2+ 0.083 40.3
Z n2+ 1.043 180.2
Lampiran 9 Aktivitas mananase dan xilanase Streptomyces sp. galur 45I-3 pada beberapa media produksi
Media
Aktivitas enzim (nkat/ml) Kadar protein
(mg/ml) pH 6.00 suhu 40 ºC pH 5.00 suhu 50 ºC
Locust bean gum
mananase 0.090 0.168
xilanase 0.057
Birchwood xilan
mananase 0.805 0.257 0.202
xilanase 7.567 9.073
Oatspelt xylan
mananase 0.257 0.522 0.235
xilanase 2.592 8.139