PEMBUATAN DAN KARAKTERISASI SABUN NATRIUM
9, 10, 12-TRIHIDROKSI STEARAT CAMPURAN YANG
DITURUNKAN DARI MINYAK JARAK ( Ricinus communis Linn )
SKRIPSI
SITI ARMINA
NIM. 030802038
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PEMBUATAN DAN KARAKTERISASI SABUN NATRIUM 9,10,12-TRIHIDROKSI STEARAT CAMPURAN YANG DITURUNKAN
DARI MINYAK JARAK ( Ricinus communis Linn )
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SITI ARMINA NIM. 030802038
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
iii
PERSETUJUAN
Judul : PEMBUATAN DAN KARAKTERISASI SABUN
NATRIUM 9,10,12-TRIHIDROKSI STEARAT CAMPURAN YANG DITURUNKAN DARI MINYAK JARAK (Ricinus communis Linn)
Kategori : SKRIPSI
Nama : SITI ARMINA
Nomor Induk Mahasiswa : 030802038
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, November 2007
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Darwis Surbakti, MS Drs. Mimpin Ginting, M.S.
NIP. 131 283 733 NIP. 131 570 500
Diketahui/Disetujui oleh : Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PEMBUATAN DAN KARAKTERISASI SABUN NATRIUM 9,10,12-TRIHIDROKSI STEARAT CAMPURAN YANG DITURUNKAN
DARI MINYAK JARAK ( Ricinus communis Linn )
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2007
v
PENGHARGAAN
Puji dan Syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas kasih dan karunia-Nya sehingga skripsi ini dapat diselesaikan dengan baik pada waktunya.
Ucapan terima kasih saya sampaikan kepada Bapak Drs. Mimpin Ginting, MS sebagai Dosen Pembimbing I dan kepada Bapak Drs. Darwis Surbakti, MS selaku Dosen Pembimbing II atas kesabaran dan bimbingannya selama penulis menyusun skripsi ini. Ucapan terima kasih juga ditujukan kepada Ketua Departemen Kimia, Dr. Rumondang Bulan Nst., M.S., dan Sekretaris Departemen Kimia, Drs. Firman Sebayang, M.S., kepada
Kepala Laboratorium Kimia Organik, Ibu dan Bapak staf dosen Kimia Organik dan Dr. Daniel, M.Si., kepada Abdi Suranta Sebayang, S.Si atas waktu dan perhatiannya.,
kepada seluruh staf asisten Laboratorium Kimia Organik; Herry, William, Sanni, Firdaus, Marisi, Desi, Raskita, staf Laboratorium Kimia Anorganik dan rekan-rekan mahasiswa Kimia’03; Hilda, Laura, Vina, Puput, Siska, Yana serta teman-teman lain yang tidak mungkin disebutkan seluruhnya. Buat sahabat-sahabatku Christine, Era, Dina, Septi, Novi, dan yang lainnya. Tidak lupa penulis juga berterimakasih kepada seluruh keluarga yang senantiasa memberikan dorongan dan semangat terutama kepada kedua orang tua yang sangat saya hormati, B. Karo-Karo dan R. br Tarigan dan adik-adik yang saya sayangi Yuni Kristina, Trya Endacya dan Sri Karina Putri; serta seluruh pihak yang terkait dalam penyusunan skripsi ini yang tidak disebutkan namanya.
ABSTRAK
vii
MAKING AND CHARACTERIZATION SODIUM SOAP OF 9,10,12-TRIHIDROXY STEARIC ACID FROM CASTOR OIL (Ricinus communis Linn)
ABSTRACT
DAFTAR ISI
Daftar Grafik xiii
Daftar Lampiran xiv
Bab 1 : Pendahuluan
1.6.1 Pembuatan Metil Ester Asam Lemak Campuran dari 4 Minyak Jarak
1.6.2 Pembuatan 9,10,12-Trihidroksi Metil Stearat Campuran 4 1.6.2 Pembuatan Sabun Natrium 9,10,12-Trihidroksi
Stearat Campuran 4
ix
Bab 3 : Metodologi Penelitian
3.1 Alat-alat 18 3.3.1.8 Standarisasi Larutan KOH dengan Larutan
H2C2O4 0,1 N 21
3.3.1.9 Pembuatan Larutan Indikator PP 21 3.3.1.10 Pembuatan Larutan Alkohol Netral 21
3.3.1.11 Pembuatan larutan KI 10% 21
3.3.1.12 Pembuatan Larutan Na2S2O3 0,1 N 21 3.3.1.13 Pembuatan Lautan BaCl2
3.3.2 Ekstraksi Minyak Jarak dari Biji Jarak
10 % 21
3.3.1.14 Pembuatan Larutan Indikator Amilum 21
3.3.1.15 Pembuatan Reagen Asetilasi 21
(Ricinus comunnis Linn) 22
3.3.3 Pembuatan Metil Ester Asam Lemak Campuran
dari Minyak Jarak 22
3.3.4 Pembuatan 9,10,12-Trihidroksi Metil Stearat Campuran 22 3.3.4 Pembuatan Sabun Natrium 9,10,12-Trihidroksi
Stearat Campuran 23
3.3.6.5 Uji HLB (Hydrophilic Lipophilic Balance) 25
3.3.6.6 Penentuan Tegangan Permukaan 25
3.3.6.7 Analisis Alkalinitas Bebas 26
3.3.6.8 Uji Kekuatan dan Stabilitas Busa 26 3.4Bagan Penelitian
3.4.1 Ekstraksi Minyak Jarak dari Biji Jarak
(Ricinus comunnis Linn) 27
3.4.2 Pembuatan Metil Ester Asam Lemak Campuran
dari Minyak Jarak 28
3.4.3 Pembuatan 9,10,12-Trihidroksi Metil Stearat Campuran 29 3.4.3 Pembuatan Sabun Natrium 9,10,12-Trihidroksi Stearat
Campuran 30
3.4.5.1 Analisis Bilangan Iodin 31
3.4.5.2 Analisis Bilangan Hidroksi 32
3.4.5.3 Analisis Bilangan Penyabunan 33
3.4.5.4 Analisis Bilangan Asam 34
3.4.5.5 Penentuan Tegangan Permukaan 35
3.4.5.6 Analisis Alkalinitas Bebas 36
3.4.5.7 Uji Kekuatan dan Stabilitas Busa 37
Bab 4 : Hasil dan Pembahasan
4.1 Hasil 38
4.2 Pembahasan 42
Bab 5 : Kesimpulan dan Saran
5.1 Kesimpulan 50
5.2 Saran 50
Daftar Pustaka
xi
DAFTAR GAMBAR
Halaman Gambar 2.1 Skema Penampang Melintang Misel Sabun 13 Gambar 2.2 Skala Petunjuk Fungsi Surfaktan Berdasarkan Nilai HLB 16 Gambar 4.1 Spektrum FT-IR Senyawa Metil Ester Asam Lemak Campuran
dari Minyak Jarak 39
DAFTAR TABEL
Halaman
Tabel 2.1 Komposisi Asam Lemak Minyak Jarak 5
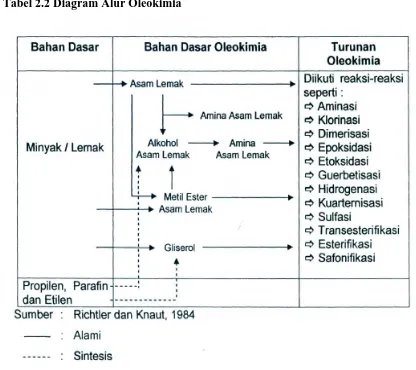
Tabel 2.2 Diagram Alur Oleokimia 7
Tabel 2.3 Nilai HLB Beberapa Surfaktan 16
Tabel 2.4 Harga HLB Gugus Fungsi 17
Tabel 4.1 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Natrium
9,10,12-Trihidroksi Stearat dari Minyak Jarak 41 Tabel 4.2 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Natrium
Asam Lemak dari Minyak Jarak 41
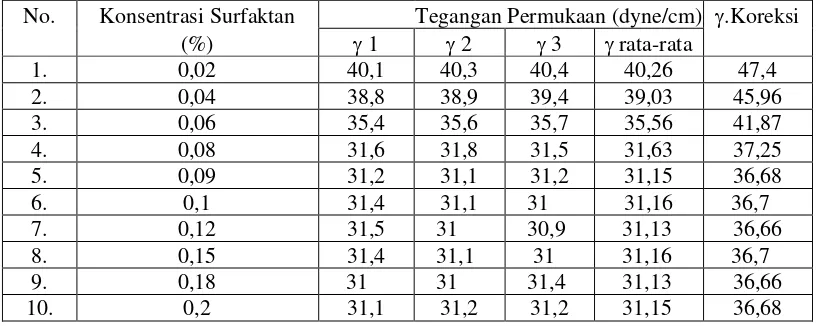
Tabel 4.3 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Natrium Stearat 41 Tabel 4.4 Data Hasil Penentuan Tegangan Permukaan (γ) Sabun Natrium
9,10,12-Trihidroksi Stearat Campuran 42
Tabel 4.5 Data Hasil Penentuan Tegangan Permukaan (γ) Sabun Natrium
xiii
DAFTAR GRAFIK
Halaman
Grafik 4.1 Grafik Hasil Uji Kekuatan Busa 47
Grafik 4.2 Grafik Hasil Uji Stabilitas Busa 47
Grafik 4.3 Grafik Hasil Penentuan Tegangan Permukaan Sabun Natrium
9,10,12-Trihidroksi Stearat Campuran dari Minyak Jarak 48 Grafik 4.4 Grafik Hasil Penentuan Tegangan Permukaan Sabun Natrium
DAFTAR LAMPIRAN
Halaman
Data Penentuan Bilangan Iodin 51
Data Penentuan Bilangan Hidroksi 52
Data Penentuan Bilangan Penyabunan 53
Data Penentuan Bilangan Asam 54
Perhitungan Harga HLB Menggunakan Metode Titrasi 55
vi
ABSTRAK
MAKING AND CHARACTERIZATION SODIUM SOAP OF 9,10,12-TRIHIDROXY STEARIC ACID FROM CASTOR OIL (Ricinus communis Linn)
ABSTRACT
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Minyak jarak (castor oil) merupakan suatu trigliserida yang dapat dibedakan dengan gliserida lainnya dari komposisi asam lemaknya, viskositas, bilangan asetil dan kelarutannya dalam alkohol yang sangat tinggi. Biji jarak (Ricinus communis Linn) mengandung 54% minyak yang disusun oleh beberapa asam lemak sebagai gliserida diantaranya asam risinoleat (75-87,5%), oleat (7-15%), linoleat (3,5-8%), asam palmitat (2-5%), asam stearat (0,5-2%), asam linolenat (0,5-2%).( (Ketaren,1988; Johnson, 1989 dan Sujadmoko,1992).
Asam risinoleat yang merupakan komposisi utama dari trigliserida minyak jarak adalah asam lemak yang memiliki keunikan struktur tersendiri, dibandingkan asam lemak lainnya yaitu turunan asam oleat (C18:1) yang pada posisi ω-7 memiliki gugus hidroksil serta mengandung ikatan π pada posisi ω-9 (Miller,1984). Dengan demikian memberikan suatu pemikiran untuk mengubah senyawa ini ke berbagai bentuk senyawa kimia lainnya yang diharapkan bermanfaat dalam bidang oleokimia.
Sintesis senyawa 12-(Asetoksi) metil okta deka-9-enoat dari metil risinoleat yang dipisahkan dari minyak jarak dengan mengubah gugus hidroksilnya menjadi asetoksi (Purba,A.,1996). Demikian juga sintesis nonanil dirisinoleat melalui reaksi interesterifikasi metil risinoleat dengan nonanil diasetat dimana metil risinoleat diturunkan dari minyak jarak (Johnny,2000)
Adanya ikatan π pada senyawa organik seperti halnya asam lemak tidak jenuh melalui reaksi epoksidasi yang dilanjutkan hidrolisis akan menghasilkan senyawa poliol, seperti halnya epoksidasi senyawa alkena dalam pembentukan senyawa diol ( Fessenden, R.J, 1994)
Garam natrium atau kalium dari asam lemak adalah bahan yang telah lama digunakan sebagai pembersih yang dikenal sebagai sabun. Adanya gugus hidroksil pada garam asam lemak akan menaikkan sifat hidrofil sekaligus harga HLB (hydrophilic Lipophilic Balance) akan meningkat sehingga kegunaan sabun poliol dari garam asam lemak dapat dimanfaatkan sebagai sabun yang baik untuk bahan pencuci dalam air sadah. Penggunaan dan pembuatan sabun poliol ini ternyata telah dilakukan sebelumnya yakni senyawa natrium dihidroksi asam stearat (DHSA) yang diperoleh dari asam oleat dimana bahan tersebut dapat digunakan sebagai bahan pencuci pada air sadah (Awang,R dkk.,2001).
Atas dasar ini peneliti tertarik untuk memanfaatkan asam risinoleat dari minyak jarak sebagai bahan pembuatan sabun poliol natrium 9,10,12-trihidroksi stearat campuran yang diturunkan dari minyak jarak (Ricinus communis Linn).
3
1.2 Permasalahan
Berdasarkan latar belakang yang telah diuraikan di atas, maka sebagai permasalahan dalam penelitian ini adalah:
1. Apakah dari minyak jarak dapat dihasilkan sabun natrium 9,10,12-trihidroksi stearat melalui reaksi metanolisis, epoksidasi dan dilanjutkan penyabunan dengan NaOH
2. Apakah ada perbedaan nilai tegangan permukaan dan sifat kekuatan dan stabilitas busa dari pengaruh gugus hidroksil pada sabun natrium 9,10,12-trihidroksi stearat campuran bila dibandingkan dengan sabun natrium stearat (tidak memiliki gugus hidroksil) dan sabun natrium asam lemak dari minyak jarak (memiliki 1 gugus hidroksil).
1.3 Tujuan Penelitian
Untuk pembuatan dan sekaligus karakterisasi sabun natrium 9,10,12-trihidroksi stearat yang diturunkan dari minyak jarak (Ricinus communis Linn) serta membandingkannya dengan sabun natrium stearat dan sabun minyak jarak dalam hal karakteristiknya.
1.4 Manfaat Penelitian
Sabun natrium 9,10,12-trihidroksi stearat campuran yang diperoleh diharapkan disamping dapat meningkatkan penggunaan minyak jarak, juga dapat lebih baik dan berguna apabila dikembangkan selain daripada sabun natrium stearat maupun sabun yang diturunkan dari asam lemak sumber lainnya.
1.5 Lokasi Penelitian
1.6 Metodologi Penelitian
1.6.1 Pembuatan Metil Ester Asam Lemak Campuran dari Minyak Jarak
Minyak jarak yang diperoleh dari ekstraksi dengan 2-propanol direfluks dengan metanol dan benzena sebagai pelarut serta H2SO4(p) sebagi katalis selama 5 jam. Kelebihan metanol dan pelarut diuapkan dengan alat rotarievaporator. Residu yang diperoleh diekstraksi dengan n-heksana dan dicuci dengan akuades sebanyak 2 kali. Lapisan atas diambil lalu dikeringkan dengan Na2SO4 anhidrous dan disaring. Filtratnya dirotarievaporasi sehingga diperoleh metil ester asam lemak campuran dari minyak jarak dan dikonmfirmasikan strukturnya secara FT-IR, dianalisis bilangan iodin, bilangan hidroksi dan diuji harga HLB.
1.6.2 Pembuatan 9,10,12-Trihidroksi Metil Stearat Campuran
Asam format 90% dan H2O2 30% distirer pada suhu 40-45oC selama 1 jam. Kemudian ditambah metil ester asam lemak campuran dari minyak jarak melalui corong penetes. Dipertahankan suhunya pada 40-45oC sambil diaduk. Didiamkan selama 1 malam dan dirotarievaporasi kemudian ditambah dengan pelarut eter dan diekstraksi, lapisan eter diambil dan dicuci dengan akuades kemudian dikeringkan dengan Na2SO4 anhidrous dan disaring. Selanjutnya filtrat dirotarievaporasi sehingga diperoleh 9,10,12-trihidroksi metil stearat dan dikonfirmasikan strukturnya secara FT-IR, dianalisis bilangan iodin, bilangan hidroksi dan diuji harga HLB.
1.6.3 Pembuatan Sabun Natrium 9,10,12-Trihidroksi Stearat Campuran
BAB 2
TINJAUAN PUSTAKA
2.1 Minyak Jarak
Tanaman jarak (Ricinus communis Linn) termasuk famili Euphorbiceae, merupakan tanaman tahunan yang hidup di daerah tropik maupun subtropik dan dapat tumbuh pada ketinggian sekitar 800 m dari permukaan laut .
Adapun komposisi dari biji jarak adalah 75% kernel (daging biji ) dan 25 % kulit dan terdiri dari 13% karbohidrat, 54% minyak, 12,5% serat , 2,5% abu dan 18 % protein (Ketaren.,1984).
Tabel 2.1 Komposisi Asam Lemak dari Minyak Jarak
Asam Lemak Persentase
Asam Palmitat Asam Stearat Asam Oleat Asam Linoleat Asam Linolenat Asam Risinoleat
1,5 % 0,5 % 5 ,0 % 4,0 % 0,5 % 87,5 %
(Johnson,R.,1989)
pada suhu kamar serta pelarut organik yang polar dan sedikit larut dalam pelarut hidrokarbon alifatis.
Minyak jarak mempunyai sifat yang sangat beracun disamping kandungan asam lemak essensialnya yang sangat rendah sehingga minyak jarak tidak dapat digunakan sebagai minyak makan dan bahan pangan.
Minyak jarak dan turunannya digunakan dalam industri cat, pelumas, tinta cetak, linoleum, oil cloth dan bahan baku industri plastik dan nilon. Dalam jumlah kecil minyak jarak dan turunannya juga digunakan untuk pembuatan kosmetik, semir dan lilin (Ketaren., 1984).
2.2 Oleokimia
Oleokimia pada dasarnya merupakan cabang ilmu kimia yang mempelajari trigliserida yang berasal dari minyak dan lemak menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi, maupun sabun. Oleokimia merupakan turunan gliserol dengan asam lemak yang berubah dalam bentuk turunannnya yang digunakan baik sebagai surfaktan, deterjen, polimer, aditif bahan bakar dan sebagainya. Bahan dasar oleokimia seperti gliserol, asam lemak, alkil ester asam lemak, amina asam lemak dan alkohol asam lemak dapat diperoleh dengan mengubah lipida baik dari yang berasal hewan maupun tumbuhan menmjadi gliserol dan turunan asam lemak.
Penggunaan terbesar daripada asam lemak adalah dengan mengubahnya menjadi alkohol asam lemak, amida, garam asam lemak dan juga plastik termasuk nilon (hampir mencapai 40% dari total penggunaannya). Penggunaan terbesar
berikutnya sebesar 30% untuk dijadikan sabun, deterjen, dan kosmetik. Asam lemak juga digunakan sebagai bahan dasar pembuatan resin dan cat sekitar
7
Tabel 2.2 Diagram Alur Oleokimia
2.3 Ester Asam Lemak
Asam lemak di alam terdapat dalam bentuk ester dimana gliserol dengan asam lemak, ataupun terkadang ada gugus hidroksinya yang teresterkan tidak dengan asam lemak melainkan dengan posfat seperti phospolipid. Di samping itu ada juga ester antara asam lemak dengan alkoholnya yang membentuk monoester seperti yang terdapat pada minyak jojoba. Dalam hal ini, ester asam lemak yang dimaksud adalah ester hasil sintesis ataupun transformasi, untuk menghasilkan ester asam lemak dengan monoalkohol maupun polialkohol.
Reaksi transesterifikasi antara metanol dengan gliserida dapat dilakukan dengan dua cara, yakni:
1. Metanolisis trigliserida dengan katalis asam yang memerlukan pemanasan. Reaksi ini dapat berjalan walaupun trigliserida tersebut mengandung air dan asam lemak bebas lebih besar dari 2,5%.
2. Metanolisis trigliserida dengan katalis basa tanpa pemanasan dengan bantuan pengadukan kecepatan tinggi. Reaksi ini menghendaki gliserida yang bebas air serta kadar asam lemak bebas tidak lebih dari 2,5% (Mittlebach dan Tritthart.,1988).
2.4 Epoksidasi
Alkena dapat dioksidasi menjadi anekaragam produk, bergabung pada reagensia yang digunakan. Reaksi yang melibatkan oksidasi ikatan rangkap karbon-karbon dapat dikelompokkan menjadi dua gugus umum :
1. Oksidasi ikatan pi tanpa memutuskan ikatan sigma 2. Oksidasi ikatan pi yang memutuskan ikatan sigma.
Produk oksidasi tanpa pemutusan ikatan sigma ialah suatu epoksida atau 1,2-diol.Reagensia yang paling popular dipakai untuk mengubah alkena menjadi suatu 1,2-diol adalah larutan kalium permanganat (dalam air) basa dan dingin (meskipun biasanya reagensia ini memberikan rendemen yang rendah). Osmium tetraoksida (OsO4) diikuti reduksi dengan reagensia seperti Na2SO3 atau NaHSO3 menghasilkan diol dengan rendemen yang lebih baik, tetapi penggunaan terbatas karena mahal dan bersifat racun (Fessenden,R.J.,1997).
9
Adapun contoh reaksi epoksidasi terhadap senyawa alkena dan menghasilkan senyawa diol adalah sebagai berikut:
Ada empat teknik yang dapat digunakan untuk menghasilkan epoksida dari molekul olefin:
1. Epoksida dengan asam perkarboksilat yang sering digunakan dalam industri dan dapat dipercepat dengan bantuan katalis atau enzim
2. Epoksida dengan peroksida organik dan anorganik, termasuk epoksidasi alkali dengan hydrogen peroksida nitril dan epoksida yang dikatalisis logam transisi. 3. Epoksida dengan halohidrin, menggunakan asam hipohalogen (HOX) dengan
garamnya sebagai reagen, dan epoksida olefin dengan defisiensi elektron ikatan rangkap.
4. Epoksida dengan menggunakan molekul oksigen, untuk minyak nabati jarang digunakan karena dapat menyebabkan degadrasi dari minyak menjadi senyawa yang lebih kecil seperti aldehid dan keton atau asam dikarboksilat berantai pendek sehingga oksidasi dengan O2
2.5 Surfaktan
merupakan metode yang tidak efisien untuk epoksida minyak nabati (Goud, dkk.,2006).
mempunyai peran penting untuk menurunkan tegangan permukaan bahan yang dikenai. Penggunaan surfaktan terbagi atas tiga golongan, yaitu sebagai bahan pembasah (wetting agent), bahan pengemulsi (emulsifying agents), dan sebagai bahan penglarut (solubilizing agents). Aktifitas kerja suatu surfaktan karena sifat ganda dari molekul tersebut (Pavia D.,1976).
Struktur kimia surfaktan mempengaruhi sifat kelarutan yang cocok untuk aktifitas surfaktan tersebut tergantung pelarut dan dan kondisi yang digunakan. Di dalam bentuk surfaktan yang umum , “kepala” menggambarkan gugus yang larut dalam air, sering disebut gugus hidrofil atau gugus lipofob dan “ekor” menggambarkan gugus lipofil atau hidrofob di dalam air.
Klasifikasi kimia yang paling berguna dari surfaktan didasarkan pada sifat hidrofil dan lipofilnya. Di bawah ini ada empat klasifikasi dasar dari surfaktan yaitu :
1. Surfaktan anionik, memiliki gugus hidrofil yang bermuatan negatif seperti gugus karboksilat (RCOO- M+), sulfonasi (RSO3- M+), sulfat (ROSO3- M+) atau posfat (ROPO3- M+
2. Surfaktan kationik, gugus hidrofil memiliki muatan positif. Sebagai contoh ammonium halida kwartener (R
).
4N+ X
-3. Surfaktan nonionik, dimana gugus hidrofil tidak memiliki muatan tetapi turunannya memiliki kelarutan yang besar terhadap air dibandingkan gugus polar tertinggi seperti senyawa (POE atau R-OCH
).
2CH2
4. Surfaktan amfoter (zwitter ion) memiliki muatan positif dan muatan negatif, sebagai contoh sulfobetain RN
O-) R adalah gugus poliol termasuk gula.
+
(CH3)2CH2CH2SO3
-Secara umum, gugus hidrofob memiliki lebih banyak variasi dibandingkan gugus hidrofil. Selain gugus hidrokarbon berantai panjang, di bawah ini merupakan variasi struktur gugus hidrofob lainnya, yaitu:
.
1. Gugus alkil rantai panjang lurus (n = C8-C22 dengan substitusi dari gugus kepala) CH3(CH2)n
2. Gugus alkil rantai panjang bercabang (n = C -S
11
3. Rantai alkena tidak jenuh, contohnya turunan dari minyak nabati CH3(CH2)nCH=CH(CH2)m
4. Alkil benzena (C
-S
8-C15C6H4 dengan bentuk substitusi yang berbeda-beda) C9H19(C6H4
5. Alkil naftalena (alkil R biasanya C )-S
3 atau lebih besar) Rn-C10H(7-n) 6. Gugus Fluroalkil (n > 4, sebagian atau seluruhnya terfluoronasi) CF
-S 3(CF2)n 7. Polidimetilsiloksan, CH
-S 3-(Osi[CH3]2O)n
8. Turunan polioksipropilena glikol CH -S
3CH(OH)-CH2-O(-CH(CH3)CH2O)n 9. Biosurfaktan
-S
10.Turunan polimer alami dan sintetik
Dengan banyaknya variasi struktur senyawa yang dapat digunakan sebagai surfaktan maka akan memberikan banyak aplikasi surfaktan yang dihasilkan tergantung kepada kegunaannya (Myers,D.,2006)
2.5.1 Sabun
Sabun kalium disebut sabun lunak dan digunakan sebagai sabun untuk bayi. Asam lemak yang digunakan untuk sabun umumnya adalah asam palmitat atau stearat. Dalam industri, sabun tidak dibuat dari asam lemak tetapi langsung dari minyak yang berasal dari tumbuhan. Minyak adalah ester asam lemak tidak jenuh dengan gliserol. Melalui proses hidrogenasi dengan bantuan katalis logam Pt atau Ni, asam lemak tidak jenuh diubah menjadi asam lemak jenuh dan melalui proses penyabunan dengan basa NaOH atau KOH akan terbentuk sabun dan gliserol (Poejiadi,A., 1994).
Molekul sabun terdiri atas rantai hidrokarbon panjang dan atom karbon dengan gugus yang sangat polar atau ionik pada satu ujungnya. Rantai karbon bersifat lipofilik (tertarik pada atau larut dalam lemak dan minyak), dan ujung polar yang hidrofilik (tertarik atau larut dalam air).
Bila sabun dikocok dengan air akan membentuk dispersi koloid, bukannya larutan sejati. Larutan sabun ini mengandung agregat molekul sabun yang disebut misel (Hart, H.,2003).
Setiap molekul sabun memiliki gugus hidrofil dan hidrofob dimana dapat ditulis sebagai RCOONa. Ketika sabun dilarutkan ke dalam air maka akan terionisasi menjadi RCOO-Na+. Bagian yang berperan aktif dalam sifat deterjennya ialah RCOO
-a. Mereduksi atau menurunkan tegangan permukaan dari air
dan menghasilkan anion, sehingga sabun dimasukkan ke dalam jenis suirfaktan anion.
Fungsi dari sabun ialah untuk menghilangkan kotoran dari permukaan seperti kulit, lantai atau pakaian. Kotoran biasanya campuran bahan berlemak dan partikel padat. Meskipun dapat berupa kotoran tanpa lemak, partikel padat dapat berupa pigmen, karbon, karat besi. Lemak yang dihasilkan dari kulit ataupun sumber lain dapat dihilangkan dari permukaan dengan menggunakan deterjen dengan cara :
b. Memindahkan atau mengangkat kotoran c. Mendispersikan kotoran
13
Partikel berkarat akan ikut bersama bagian hidrofil dari molekul deterjen dan akan diangkut bersama bagian hidrofob (Parasuram, K.S.,1995).
2.5.2 Misel
Air memiliki tegangan permukaan yang tinggi, tetapi ketika surfaktan dilarutkan ke dalam air maka tegangan permukaan dari larutan itu akan turun sampai tercapainya suatu konsentrasi. Konsentrasi dimana tegangan permukaan turun disebut CMC (konsentrasi misel kritis). CMC ini dapat ditentukan dari ketika sejumlah kecil dari surfaktan ditambahkan ke dalam air, ion-ion surfaktan (atau molekul pada surfaktan nonionik) terkonsentrat pada permukaan tipis dari cairan.
Pada permukaan cairan, ion-ion surfaktan terorientasi pada gugus hidrofil ke dalam air dan gugus hidrofob ke udara (menjauhi air). Secara bersamaan, jika surfaktan dapat dilarutkan dalam minyak maka gugus hidrofob akan ikut dengan minyak dan gugus hidrofil akan ke udara (menjauhi minyak). Pada CMC, larutan menjadi jenuh dalam keadaan normal, tetapi pada kebanyakan surfaktan, apabila dilarutkan pada cairan maka akan membentuk misel. Misel ini adalah kumpulan ion-ion surfaktan atau molekul surfaktan yang berkumpul menjadi satu bentuk, dengan gugus hidrofil di luar dan terikat pada air sedangkan gugus hidrofob berada di dalam untuk membentuk globulan-globulan minyak. Dalam hal surfaktan yang terionisasi, akan ada beberapa gegenion (seperti ion Na+ pada garam NaCl atau Cl- dari surfaktan kationik) kemungkinan ikut pada misel dan berpengaruh kepada titik CMC.
Kelarutan dari surfaktan berubah sesuai temperatur dan temperatur sangat penting dikenal dengan titik Krafft, dimana kelarutan naik secara cepat dengan berubahnya bentuk dari misel.
Misel merupakan bagian dari larutan surfaktan yang menyebabkan larutan itu disebut dengan larutan koloid murni dan sangat penting hubungannya dengan sifat deterjen karena :
• Misel mempertahankan permukaan larutan agar tetap jenuh dan tegangan permukaan dari larutan berada pada titik minimumnya
• Misel dapat melarutkan bahan berlemak. Bagian misel yang hampir menyerupai pelarut hidrokarbon yang mana dapat melarutkan bahan berminyak dan membawanya dalam proses pencucian. Sifat ini digunakan ketika larutan sabun digunakan untuk melarutkan kresol untuk menghasilkan Lysol (sejenis desinfektan) serta penggunaan yang sama lainnya.
(Woollatt, E.,1985)
2.5.3 Tegangan Permukaan
Tegangan permukaan (γ) suatu cairan dapat didefenisikan sebagai banyaknya kerja yang dibutuhkan untuk memperluas permukaan cairan sebanyak satu satuan luas. Tegangan permukaan suatu larutan akan bergantung pada sifat zat terlarut. Bila molekul zat terlarut cenderung untuk mengumpul pada permukaan, tegangan permukaan akan turun. Misalnya pada sabun, molekul-molekul sabun terdiri dari bagian hidrofobik yaitu rantai hidrokarbon yang panjang dan bagian hidrofilik yaitu gugus karboksilat –COO- Na+
Tegangan permukaan cairan (γ), berbeda-beda bergantung pada jenis cairan dan suhu. Pada umumnya cairan yang memiliki gaya tarik antara molekulnya besar seperti air, maka tegangan permukaannya juga besar. Sebaliknya pada cairan seperti bensin karena gaya tarik antara molekulnya kecil maka tegangan permukaannya kecil.
15
Tegangan permukaan cairan turun bila suhu naik, karena dengan bertambahnya suhu molekul-molekul cairan bergerak lebih cepat dan pengaruh interaksi antara molekulnya berkurang sehingga tegangan permukaannya menurun. Pada suhu yang sama tegangan permukaan logam cair dan lelehan garam lebih besar bila dibandingkan dengan cairan organik.
Adanya zat terlarut pada cairan dapat menaikkan atau menurunkan tegangan permukaan bergantung sifat zat terlarutnya. Untuk air adanya elektrolit anorganik dan nonelektrolit tertentu seperti sukrosa dan gliserin menaikkan tegangan permukaan. Sedangkan adanya zat-zat seperti sabun, deterjen, dan alkohol adalah efektif dalam menurunkan tegangan permukaan atau tegangan antarmuka. Zat ini sering disebut dengan surface active agents atau surfaktan. Penurunan tegangan permukaan oleh sabun menyebabkan perluasan film air dengan pembentukan gelembung atau busa.
Adanya hubungan antara besar kecilnya tegangan permukan cairan dengan kemampuannya untuk membasahi benda. Makin kecilnya nilai tegangan permukaan suatu cairan maka makin besar kemampuan zat tersebut untuk membasahi benda. Hubungan ini banyak dimanfaatkan dalam kehidupan sehari-hari; misalnya untuk menghasilkan cucian pakaian agar lebih bersih dapat digunakan air panas atau air sabun. Keduanya dapat menurunkan tegangan permukaan air sehingga meningkatkan kemampuan air untuk membasahi kotoran pakaian. Akibatnya kotoran mudah larut dan terbawa oleh air pada saat pembilasan (Yazid,E.,2005).
2.5.4 Penentuan Uji HLB (Hydrophilic Lipophilic Balance)
Gambar 2.2 Skala Petunjuk Fungsi Surfaktan Berdasarkan Nilai HLB
HLB dari sejumlah senyawa dapat dihitung dengan menggunakan rumus sebaagi berikut :
HLB = 20 (1 – S/A)
Dimana S adalah bilangan penyabunan senyawa tersebut dan A adalah bilangan asam senyawa tersebut.
Tabel 2.3 Nilai HLB Beberapa Surfaktan
Zat HLB
Asam Oleat
Gliseril Monostearat Sorbitan mono-oleat Sorbitan monolaurat Trietanolamin oleat
Polioksitilena sorbitan mono-oleat Polioksitilena sorbitan monolaurat Natrium oleat
Natrium lauril sulfat
17
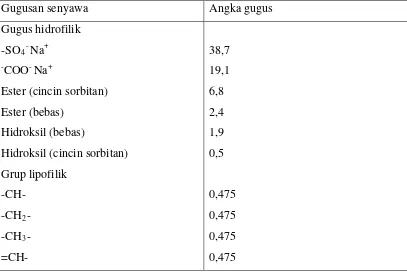
Davies telah menghitung nilai HLB untuk zat aktif permukaan dengan memecah berbagai molekul surfaktan ke dalam gugus-gugus penyusunnya, yang masing-masing diberi suatu angka gugus. Penjumlahan dari angka-angka gugus untuk suatu surfaktan tertentu memungkinkan perhitungan nilai HLB-nya menurut persamaan berikut :
HLB = Σ (angka-angka gugus hidrofilik) - Σ (angka-angka gugus lipofilik) + 7
Tabel 2.4 Harga HLB Gugus Fungsi
BAB 3
BAHAN DAN METODE PENELITIAN
3.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah :
- Labu leher tiga Pyrex
- Termometer 2100
- Kondensor bola Pyrex
C Fisons
- Buret (10 mL ± 0,05 mL) Pyrex
- Rotarievaporator Heidolph
- Hotplate stirrer Fisons
- Oven Fisons
- Botol Akuades
- Magnetik Bar
- Mortar dan Stamfer
- Corong Pisah Pyrex
- Tabung CaCl2
- Spektrofotometer FT-IR Shimadzu
Pyrex
- Tensiometer Cincin Du-Nuoy Kruss
- Alat Vakum Fisons
- Kertas Saring Biasa
- Neraca Analitis Mettler PM 480
- Alat shaker KL 2 Edmund Buhler
- Gelas Ukur 100 mL Pyrex
- Gelas Beaker 250 mL Pyrex
- Gelas Erlenmeyer 250 mL Pyrex
19
- Hidrogen peroksida 30% p.a. E.Merck
- Asam formiat 90% Fisons
- Natrium hidroksida(pellet) p.a. E.Merck
- Asam klorida 37 % p.a. E.Merck
- Barium klorida(s) p.a. E.Merck
- Phenolptalein p.a. E.Merck
- Natrium klorida(s) p.a. E.Merck
- Alkohol 95% teknis
- Pyridin Fisons
- Asam Asetat Anhidrida p.a. E.Merck
- Kalium Hidroksida(pellet) p.a. E.Merck
- Asam Oksalat(s) p.a. E.Merck
- Natrium Karbonat(s) p.a. E.Merck
- Fenolftalein(s) p.a. E.Merck
- Larutan Wijs p.a. E.Merck
- Sikloheksana p.a. E.Merck
- Kalium Iodida p.a. E.Merck
- Amilum p.a. E.Merck
- Natrium Sulfat Anhidrous p.a. E.Merck
- Natrium Tiosulfat(s) p.a. E.Merck
3.3 Prosedur Penelitian
3.3.1 Pembuatan Reagen dan Standarisasi
3.3.1.1 Pembuatan Larutan HCl 0,5 N
Diukur sebanyak 10,45 ml larutan HCl(p) 37% lalu diencerkan dengan
akuades dalam labu takar 250 ml sampai garis batas dan distandarisasi dengan
menggunakan larutan Na2CO3 0,5 N.
3.3.1.2 Pembuatan Larutan HCl 0,1 N
Sebanyak 20 mL larutan HCl 0,5 N diencerkan dengan akuades dalam labu
takar 100 mL.
3.3.1.3 Pembuatan Larutan Na2CO3 0,5 N
Sebanyak 6,623 gram Na2CO3 dilarutkan dengan akuades dalam labu takar
250 mL.
3.3.1.4 Pembuatan Larutan KOH-Alkohol 0,5 N
Ditimbang KOH sebanyak 7,0125 gram dan dilarutkan dengan alkohol dalam
labu takar 250 ml sampai garis batas.
3.3.1.5 Pembuatan Larutan KOH 0,1 N
Ditimbang KOH sebanyak 1,4 gram dan dilarutkan dengan akuades dalam
labu takar 250 mL sampai garis batas.
3.3.1.6 Pembuatan Larutan KOH 0,02 N
Diukur sebanyak 50 mL larutan KOH 0,1 N dan diencerkan dalam labu takar
250 mL dengan menggunakan akuades.
3.3.1.7 Pembuatan Larutan H2C2O4 0,1 N
Ditimbang 1,575 gram H2C2O4.2H2O dimasukkan ke dalam labu takar 250
21
3.3.1.8 Standarisasi Larutan KOH dengan Larutan H2C2O4 0,1 N
Dipipet sebanyak 5 mL larutan KOH 0,1 N lalu ditambahkan 3 tetes indikator
phenolphthalein dan dititrasi dengan larutan H2C2O4 0,1 N sampai larutan berwarna
merah lembayung, dicatat volume H2C2O4
3.3.1.11 Pembuatan Larutan KI 10%
yang dipakai.
3.3.1.9 Pembuatan Larutan Indikator PP
Ditimbang 1 gram fenolftalein dan diencerkan dengan alkohol dalam labu
takar 100 mL .
3.3.1.10 Pembuatan Alkohol Netral
Sebanyak 200 mL alkohol 96%, ditanbahkan 4 tetes indikator fenolftalein dan
ditetesi dengan larutan KOH 0,1 N hingga menjadi larutan merah muda.
Ditimbang 10 gram kristal KI dilarutkan dengan akuades dalam labu takar 100
mL sampai garis tanda.
3.3.1.12 Pembuatan Larutan Na2S2O3 0,1 N
Ditimbang 6,25 gram kristal Na2S2O3.5 H2O dilarutkan dengan akuades dan
diencerkan dalam labu takar 250 mL sampai garis tanda Lalu distandarisasi dengan
larutan K2Cr2O7 0,1 N.
3.3.1.13 Pembuatan larutan BaCl2 10 %
Ditimbang 10 gram kristal BaCl2.2H2O dan diencerkan dengan akuades dalam
labu takar 100 mL.
3.3.1.14 Pembuatan Larutan Indikator Amilum
Ditimbang 1 gram serbuk amilum dan dilarutkan dengan 100 mL akuades dan
dipanaskan di atas pemanas hingga mendidih dan disaring dalam keadaan panas.
3.3.1.15 Pembuatan Reagen Asetilasi
Sebanyak 25 mL asam asetat anhidrida dimasukkan ke dalam labu takar 100
3.3.2 Ekstraksi Minyak Jarak dari Biji Jarak (Ricinus communis Linn)
Biji jarak dipisahkan dari cangkang lalu dikeringkan dan dihaluskan. Serbuk
biji jarak halus sebanyak 500 gram dimaserasi dengan 2-propanol selama ± 2 hari.
Ekstrak disaring dan filtrat ditambahkan Na2SO4 anhidrous kemudian disaring. Filtrat
diuapkan melalui rotarievaporator untuk memperoleh minyak jarak.
3.3.3 Pembuatan Metil Ester Asam Lemak Campuran dari Minyak Jarak
Ke dalam labu alas bulat leher tiga dimasukkan sebanyak 100 mL minyak
jarak, 50 mL metanol dan 100 mL benzena sambil diaduk dan didinginkan dan
melalui corong penetes diteteskan sebanyak 2 mL H2SO4(p) secara perlahan-lahan,
kemudian dirangkai alat refluks dan dilengkapi dengan tabung CaCl2, dan direfluks
selama 5 jam. Kelebihan metanol dan pelarut diuapkan dengan alat rotarievaporator.
Residu yang diperoleh diekstraksi dengan 100 mL n-heksana dan dicuci dengan
25 mL akuades sebanyak 2 kali. Lapisan atas diambil lalu ditambahkan Na2SO4
anhidrous dan disaring. Filtratnya dirotarievaporasi sehingga diperoleh metil ester
asam lemak campuran dari minyak jarak dan dikonfirmasikan strukturnya melalui
analisis FT-IR, analisis bilangan iodin, bilangan hidroksi dan uji harga HLB.
3.3.4 Pembuatan 9,10,12-Trihidroksi Metil Stearat Campuran
Kedalam labu leher tiga dimasukkan 60 mL HCOOH 90% dan ditambah
30 mL H2O2 30% setetes demi setetes. Kemudian distirer pada suhu 40-45oC selama
1 jam. Kemudian ditambah 50 mL metil ester asam lemak campuran dari minyak jarak
melalui corong penetes. Dipertahankan suhunya pada 40-45oC sambil diaduk.
Didiamkan selama 1 malam kemudian dirotarievaporasi. Residu yang diperoleh
dilarutkan dengan 100 mL dietil eter. Lapisan eter dicuci dengan 25 mL akuades
sebanyak dua kali. Hasil pencucian dikeringkan dengan Na2SO4 anhidrous kemudian
disaring. Filtrat diuapkan melalui rotarievaporator untuk mendapatkan senyawa
9,10,12-trihidroksi metil stearat campuran dan dikonfirmasikan strukturnya melalui
23
3.3.5 Pembuatan Sabun Natrium 9,10,12-Trihidroksi Stearat Campuran
Sebanyak 33,6 gram larutan 9,10,12-trihidroksi metil stearat dimasukkan ke
dalam labu alas kemudian ditambah 5 gram NaOH dan 50 mL alkohol 95%. Direfluks
campuran selama 1 jam pada suhu 78oC. Produk dituangkan ke dalam larutan NaCl
jenuh dan diaduk selama 15 menit lalu disaring kemudian residu dibilas dengan
alkohol 70% dan produk dikeringkan di dalam oven pada suhu 105oC. Hasilnya
dikonfirmasikan strukturnya melalui spektrofotometer FT-IR, dilanjutkan
karakterisasinya dengan menentukan alkalinitas bebas, tegangan permukaan, uji
kekuatan dan stabilitas busa yang dibandingkan dengan sabun yang tidak memiliki
gugus hidroksi (natrium stearat), dan sabun natrium asam lemak dari minyak jarak
yang mengandung 1 gugus hidroksi.
3.3.6 Prosedur Analisis
3.3.6.1 Analisis Bilangan Iodin
Analisis ini dilakukan terhadap metil ester asam lemak dari minyak jarak dan
9,10,12-trihidroksi metil stearat campuran.
Ditimbang sampel sebanyak ± 0,5 gram ke dalam gelas erlenmeyer 250 mL
yang bertutup lalu ditambahkan 20 mL sikloheksana kemudian dikocok/diguncang
untuk memastikan sampel telah benar-benar larut. Ditambahkan 25 mL larutan Wijs
ke dalamnya kemudian ditutup dan dikocok agar campuran telah benar-benar
bercampur dan disimpan tabung tersebut dalam ruang gelap selama ± 30 menit.
Diambil bahan tersebut dari tempat penyimpanan dan ditambahkan 20 mL larutan
KI 15%, dan 150 mL air suling. Dititrasi dengan larutan Na2S2O3
Bilangan Iodin =
kuning hampir hilang (kuning pucat). Ditambahkan 1-2 mL indikator pati ke
dalamnya dan dititrasi kembali sampai warna biru hilang. Dilakukan hal yang sama
terhadap larutan blanko dan dihitung dengan :
(B-S) x N x 12,69
3.3.6.2 Analisis Bilangan Hidroksi
Analisis ini dilakukan terhadap metil ester asam lemak dari minyak jarak dan
9,10,12-trihidroksi metil stearat campuran.
Ditimbang 1 gram sampel ke dalam labu dan ditambahkan 5 mL reagen
asetilasi (asam asetat anhidrida dalam pyridin) dan direfluks pada suhu 95-100o
Bilangan OH = + A.V
Berat sample (gram)
Dimana: T = Normalitas KOH-Etanol
Vo = Volume KOH-Etanol untuk titrasi blanko (mL)
V = Volume KOH-Etanol untuk titrasi sampel (mL)
AV = Bilangan asam dari ester
3.3.6.3 Analisis Bilangan Penyabunan
Analisis ini dilakukan terhadap metil ester asam lemak dari minyak jarak dan
9,10,12-trihidroksi metil stearat campuran.
Ditimbang 0,1 gram sampel dan dimasukkan ke dalam gelas Erlenmeyer.
Kemudian ditambahkan 25 mL larutan KOH-Alkohol 0,5 N dan direfluks selama
30 menit. Didinginkan dan ditambah 3 tetes indikator fenolftalein kemudian dititrasi
dengan larutan HCl 0,5 N hingga warna merah lembayung hilang. Dicatat volume HCl
0,5 N yang dipakai dan dihitung bilangan penyabunan dengan rumus :
( V blanko – V titrasi). N
C
selama 1 jam. Setelah selesai didinginkan dan ditambah 1 mL akuades, dan
dipanaskan selama 10 menit. Setelah dingin ditambah 5 mL alkohol netral dan
dipindahkan larutan ke dalam gelas erlenmeyer kemudian ditambahkan 2-3 tetes
indikator fenolftalein selanjutnya dititrasi dengan larutan KOH-Etanol 0,5 N.
Dilakukan titrasi terhadap larutan blanko pada kondisi sama. Ditentukan bilangan
asam terhadap sampel dan dihitung bilangan hidroksi.
56,1 x T x (Vo-V)
HCl Bilangan Penyabunan =
25
3.3.6.4 Analisis Bilangan Asam
Analisis ini dilakukan terhadap metil ester asam lemak dari minyak jarak dan
9,10,12-trihidroksi metil stearat campuran.
Sebanyak 0,1 gram sampel dimasukkan ke dalam gelas erlenmeyer. Kemudian
ditambah 10 mL larutan alkohol netral. Erlemeyer tersebut ditutup dengan plastik dan
dipanaskan selama 30 menit sambil diaduk. Larutan tersebut didinginkan dan
ditambahkan 3 tetes indikator fenolftalein dan dititrasi dengan larutan KOH 0,02 N
sampai terbentuk warna merah lembayung. Dihitung volume KOH yang digunakan
untuk menitrasi sampel dan dihitung bilangan asam dengan menggunakan rumus :
VKOH.NKOH Bilangan Asam =
Massa sampel (gram)
3.3.6.5 Uji HLB (Hydrophilic Lipophilic Balance)
Analisis ini dilakukan terhadap metil ester asam lemak dari minyak jarak dan
9,10,12-trihidroksi metil stearat campuran.Harga HLB dapat diperoleh dari bilangan
asam dan bilangan penyabunan dari senyawa ester dengan menggunakan rumus :
HLB = 20 (1-S/A)
Dimana : S = Bilangan penyabunan senyawa ester
A = Bilangan asam senyawa ester
3.3.6.6 Penentuan Tegangan Permukaan.
Analisis ini dilakukan sabun natrium asam lemak dari minyak jarak dan sabun natrium
9,10,12-trihidroksi stearat campuran.
Ke dalam labu takar, dilarutkan sabun dengan akuades dengan kadar (%) 0,02;
0,04; 0,06; 0,08; 0,09; 0,1; 0,12; 0,14; 0,15; 0,18 dan 0,2. Alat tensiometer dikalibrasi
pada suhu 30
.56,1
o
C, menggunakan akuades (tegangan permukaan = 72.75 dyne/cm, suhu
30oC). Kemudian diukur tegangan permukaan dari masing-masing larutan sabun.
Selanjutnya ditetapkan harga sebenarnya dengan menggunakan faktor koreksi.
Kemudian dimasukkan harga-harga tegangan permukaan tersebut ke dalam kurva
tegangan permukaan Vs Konsentrasi larutan sabun. Melalui kurva akan diperoleh
3.3.6.7 Analisis Alkalinitas Bebas
Analisis ini dilakukan untuk sabun natrium stearat dan sabun natrium asam lemak
dari minyak jarak dan sabun natrium 9,10,12-trihidroksi stearat campuran.
Sebanyak 5 gram sabun dilarutkan dalam 100 mL alkohol netral panas dan
ditambahkan 20 ml larutan BaCl2 10%. Ditambah 4 tetes indikator fenolftalein.
Warna merah muda dari larutan menunjukkan adanya alkali bebas. Larutan dititrasi
dengan HCl 0,1 N sampai warna merah muda hilang. Alkalinitas bebas dapat dihitung
dengan :
% Alkalinitas bebas = (0,4 V) / W
Dimana: V = Volume dari HCl 0,1 N (mL)
W = Berat Sampel (gram)
3.3.6.8 Uji Kekuatan dan Stabilitas Busa
Analisis ini dilakukan untuk sabun natrium stearat dan sabun natrium asam lemak
dari minyak jarak dan sabun natrium 9,10,12-trihidroksi stearat campuran.
Sebanyak 50 ml larutan sabun 0,2%; 0,4%; 0,6%; 0,8% dan 1% dimasukkan
ke dalam gelas ukur 100 mL lalu ditutup. Larutan dikocok selama 30 detik dengan
menggunakan alat shaker. Volume busa dicatat setelah 30 detik (Vo) dan 3 menit
(Vs). Stabilitas busa ditunjukkan sebagai perbandingan (rasio) dari volume busa pada
27
3.4 Bagan Penelitian
3.4.1 Ekstraksi minyak jarak dari biji jarak (Ricinus communis Linn)
Dikeringkan
Dihaluskan
Dimaserasi dengan 2-propanol selama
± 2 hari
Disaring
Dikeringkan dengan Na2SO4
Disaring
anhidrous
Dirotarievaporasi
Serbuk jarak
Filtrat Residu
Filtrat Residu
Minyak jarak
3.4.2 Pembuatan Metil Ester Asam Lemak Campuran dari Minyak Jarak
Dimasukkan ke dalam labu alas
Ditambah 50 mL metanol
Ditambah 100 mL benzena
Diaduk dan diteteskan 2 mL
H2SO4(p)
Direfluks pada suhu 80o
Dirotarievaporasi pada suhu 80 C selama
5 jam
o
C
Diekstraksi dengan 100 mL n-Heksana
Dicuci dengan 25 mL akuades sebanyak 2 kali
Dikeringkan dengan Na2SO4
Disaring
anhidrous
Dirotarievaporasi
100 mL Minyak Jarak
Campuran
Residu Pelarut
Lapisan Atas Lapisan Bawah
Filtrat Residu
Metil Ester Asam
Lemak Campuran
Pelarut
Analisa FT-IR Penentuan
Bilangan Iodin
Penentuan Bilangan Hidroksi
29
3.4.3 Pembuatan 9,10,12-Trihidroksi Metil Stearat Campuran
Dimasukkan ke dalam labu leher
tiga
30 mL metil ester minyak jarak
campuran melalui corong penetes
Diaduk pada suhu 40-45o
Didiamkan selama 1 malam C
Dikeringkan dengan Na2SO4 anhidrous dan disaring
Analisa Penentuan Bilangan Penentuan Uji HLB
Lapisan atas (eter) Lapisan Bawah
Filtrat Residu
3.4.4 Pembuatan Sabun Natrium 9,10,12-Trihidroksi Stearat Campuran
Dimasukkan ke dalam labu alas
Ditambah 5 gram NaOH dan
50 mL alkohol 96%
Direfluks sambil diaduk pada suhu
78o
C
Dimasukkan ke dalam larutan NaCl
jenuh
• Dilakukan perlakuan yang sama untuk pembuatan sabun natrium stearat dan
sabun natrium dari minyak jarak
Residu (Padatan) Filtrat
Analisa
31
3.4.5 Bagan Analisis
3.4.5.1 Analisis Bilangan Iodin
Dimasukkan ke dalam gelas
erlenmeyer yang bertutup
Ditambah 20 mL sikloheksana dan
diaduk sampai larut
Ditambah 25 mL larutan wijs, ditutup
dan dikocok agar campuran
benar-benar larut
Disimpan dalam ruang gelap selama ±30 menit
Ditambah 20 mL larutan KI 10% dan
150 mL air suling
Dititrasi dengan Na2S2O3
Ditambah1-2 mL indikator amilum 0,1 N sampai
warna kuning pucat
Dititrasi kembali sampai warna biru
hilang
Dicatat volume Na2S2O3 0,1 N
*Dilakukan terhadap senyawa metil ester asam lemak campuran dari minyak jarak dan
senyawa 9,10,12-trihidroksi metil stearat campuran. Sampel (± 0,5 gram)
3.4.5.2 Analisis Bilangan Hidroksi
Dimasukkan ke dalam labu alas bulat
Ditambah 5 mL reagen asetilasi (asetat
anhidrida dalam pyridin)
Direfluks selama ± 1 jam pada suhu
95-1000
Diangkat dan didinginkan C
Ditambah 1 mL akuades
Dipanaskan selama ± 10 menit
Ditambah 5 mL alkohol netral
Dimasukkan kedalam gelas erlenmeyer
Ditambah 3 tetes indikator fenolftalein
Dititrasi dengan larutan KOH-alkohol
0,5 N
Dicatat volume KOH-alkohol 0,5 N
*Dilakukan terhadap senyawa metil ester asam lemak campuran dari minyak jarak dan
senyawa 9,10,12-trihidroksi metil stearat campuran. Hasil
Sampel ( ± 1 gram)
Campuran
33
3.4.5.3 Analisis Bilangan Penyabunan
Dimasukkan ke dalam gelas
erlenmeyer
Ditambah 25 mL KOH-alkohol 0,5N
Direfluks selama 30 menit
Didinginkan
Ditambah 3 tetes indikator
fenolftalein
Dititrasi dengan HCl 0,5 N
Dicatat volume HCl 0,5 N
*Dilakukan terhadap senyawa metil ester asam lemak campuran dari minyak jarak dan
senyawa 9,10,12-trihidroksi metil stearat campuran. Sampel (± 0,1 gram)
Larutan Merah Muda
Larutan Bening
3.4.5.4 Analisis Bilangan Asam
Dimasukkan ke dalam gelas
erlenmeyer
Ditambah 10 mL alkohol netral
Dipanaskan selama 30 menit
Didinginkan
Ditambah 3 tetes indikator
fenolftalein
Dititrasi dengan KOH 0,02 N
Dicatat volume KOH 0,02 N
*Dilakukan terhadap senyawa metil ester asam lemak campuran dari minyak jarak dan
senyawa 9,10,12-trihidroksi metil stearat campuran. Sampel (± 0,1 gram)
Larutan Bening
Larutan Merah Muda
35
3.4.5.5 Penentuan Tegangan Permukaan
Diencerkan dalam labu takar dengan
konsentrasi (%) 0,02; 0,04; 0,06;
0,08; 0,09; 0,1; 0,12; 0,15; 0,18 dan
0,2 dengan menggunakan akuades
Dikalibrasi alat tensiometer pada
suhu 300
Diukur tegangan permukaan
masing-masing C
• Dilakukan perlakuan yang sama untuk sabun natrium stearat dan sabun natrium asam lemak dari minyak jarak
Sampel
3.4.5.6 Analisis Alkalinitas Bebas
Dilarutkan dengan 100 mL alkohol
netral panas
Ditambah 20 mL larutan BaCl2
Ditambah 3 tetes indikator
fenolftalein
10%
Dititrasi dengan HCl 0,1 N
Dicatat volume HCl 0,1 N
• Dilakukan perlakuan yang sama untuk sabun natrium stearat dan sabun natrium asam lemak dari minyak jarak
Sampel (± 5 gram)
Larutan Merah Muda
Larutan Bening
37
3.4.5.7 Uji Kekuatan dan Stabilitas Busa
Dibuat konsentrasi (%) 0,2; 0,4; 0,6;
0,8; 1 dan diencerkan dalam labu
takar dengan menggunakan akuades
Ditutup dengan plastik dan dikocok
dengan menggunakan alat shaker
Diukur volume busa yang dihasilkan
masing-masing setelah 30 detik (Vo)
dan 3 menit (Vs)
• Dilakukan perlakuan yang sama untuk sabun natrium stearat dan sabun natrium asam lemak dari minyak jarak
Sampel
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil
Minyak jarak yang digunakan dalam penelitian ini diperoleh secara ekstraksi
maserasi menggunakan pelarut 2-propanol. Dari 500 gram biji jarak halus diperoleh
minyak jarak sebanyak 245 gram (49%). Selanjutnya minyak jarak diinteresterifikasi
dengan metanol menggunakan katalis asam H2SO4 dan pelarut Benzena sehingga
dihasilkan metil ester asam lemak campuran dengan rendemen sebesar 89%.
Metil risinoleat merupakan komposisi utama metil ester asam lemak campuran
dari minyak jarak disamping metil ester asam lemak lainnya yakni metil oleat,
linolenat, linoleat dan stearat dalam jumlah yang kecil. Senyawa metil ester asam
lemak campuran ini dianalisis dengan menggunakan spektrofotometer FT-IR dan
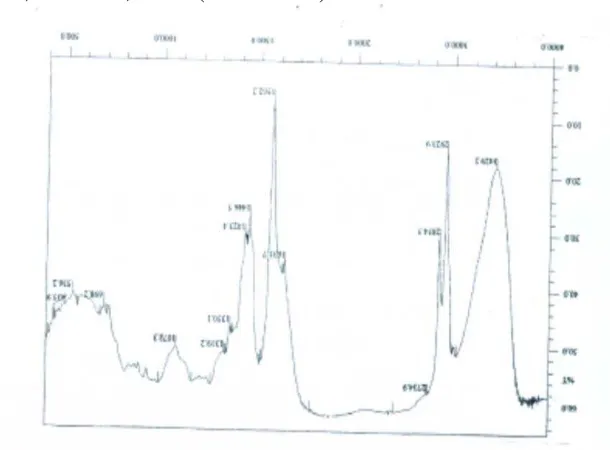
diperoleh spektrum yang memberikan puncak-puncak di daerah bilangan gelombang
3444,6 cm-1, 3000,8 cm-1, 2927,7 - 2854,5 cm-1, 1743 cm-1, 1651,0 cm-1, 1458,1 -
1438,8 cm-1, dan 1172,6 cm-1 (Gambar 4.1).
39
Adapun analisis lain yang dilakukan yaitu analisis bilangan iodin, analisis
bilangan hidroksi dan uji HLB (Hydrophylic Lipophylic Balance). Bilangan iodin
untuk senyawa metil ester asam lemak campuran dari minyak jarak ialah sebesar
82,85 dan analisis bilangan hidroksi sebesar 221,51 serta nilai HLB untuk senyawa
metil ester asam lemak campuran dari minyak jarak yang diperoleh sebesar 11,44.
Epoksida ikatan rangkap pada atom C9 dan C10 dari senyawa metil risinoleat
yang merupakan komposisi utama metil ester asam lemak dari minyak jarak, dengan
cara mereaksikannya dengan campuran HCOOH 90% dan H2O2 30% dan diikuti
dengan proses hidrolisis sehingga dihasilkan senyawa 9,10,12-trihidroksi metil stearat
campuran dengan rendemen sebesar 83%. Asam formiat dan hidrogen hidroksida
direaksikan akan membentuk senyawa perasid pada suhu 40-45oC yang selanjutnya
diikuti penambahan metil ester asam lemak campuran dari minyak jarak, dan karena
adanya air akan menyebabkan reaksi hidrolisis pada cincin epoksida. Dari hasil
analisis senyawa 9,10,12-trihidroksi metil stearat dengan menggunakan
spektrofotometer FT-IR diperoleh puncak-puncak serapan pada daerah bilangan
gelombang 3444,6 cm-1, 2931,6 - 2858 cm-1, 1724,2 cm-1, 1461,9 - 1438,8 cm-1,1184,2
cm-1
Gambar 4.2 Spektrum FT-IR Senyawa 9,10,12-Trihidroksi Metil Stearat Campuran (Gambar 4.2).
Analisis lain yang dilakukan yaitu analisis bilangan iodin, analisis bilangan
senyawa 9,10,12-trihidroksi metil stearat adalah sebesar 38,54 dan analisis bilangan
hidroksi dari senyawa 9,10,12-trihidroksi metil stearat adalah sebesar 347,33 serta
nilai HLB untuk senyawa 9,10,12-trihidroksi metil stearat ialah sebesar 15,18.
Reaksi penyabunan 9,10,12-trihidroksi metil stearat campuran dengan larutan
basa kuat NaOH dan pelarut alkohol akan menghasilkan sabun natrium
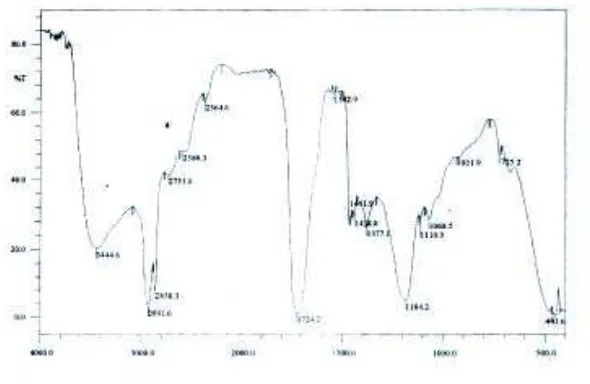
9,10,12-trihidroksi stearat campuran sebagai komponen utama. Dari hasil analisis dengan
menggunakan spektrofotometer FT-IR diperoleh puncak-puncak serapan pada daerah
bilangan gelombang 3429,2 cm-1, 2923,9 – 2854,5 cm-1, 1446,5 – 1423,4 cm-1, 1631
cm-1
Gambar 4.3 Spektrum FT-IR Sabun Natrium 9,10,12-Trihidroksi Stearat
Campuran
Analisis lain yang dilakukan untuk mengetahui karakteristik sabun natrium
9,10,12-trihidroksi stearat campuran yang diperoleh ialah penentuan alkalinitas bebas,
uji tegangan permukaan dan uji kekuatan dan stabilitas busa. Analisis sabun ini juga
didukung dengan melakukan uji yang sama terhadap sabun natrium asam lemak dari
minyak jarak dan sabun natrium stearat. Alkalinitas bebas sabun natrium
9,10,12-trihidroksi campuran dari minyak jarak diperoleh sebesar 0,2%, alkalinitas bebas
sabun natrium asam lemak dari minyak jarak adalah sebesar 0,28% dan alkalinitas
41
Uji tegangan permukaan yang dilakukan dengan menggunakan tensiometer
metode cincin Du-nuoy untuk sabun natrium 9,10,12-trihidroksi metil stearat
campuran diperoleh sebesar 34,5 dyne/cm dengan titik konsentrasi misel kritis (CMC)
ialah 0,1 %. Sabun natrium asam lemak dari minyak jarak yang diukur memiliki
tegangan permukaan sebesar 36,68 dyne/cm dengan titik konsentrasi misel kritis
(CMC) ialah 0,09%. Sabun natrium stearat sulit diukur tegangan permukaannya.
Data hasil uji kekuatan dan stabilitas busa yang diperoleh dapat dilihat pada tabel
sebagai berikut:
Tabel 4.1 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Natrium
9,10,12-Trihidroksi Stearat Campuran dari Minyak Jarak
No. Variasi Konsentrasi (%) Volume Busa (mL) Vs/Vo
30 Detik (Vo) 3 Menit (Vs)
Tabel 4.2 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Natrium Asam
Lemak dari Minyak Jarak
No. Variasi Konsentrasi (%) Volume Busa (mL) Vs/Vo
Tabel 4.3 Data Hasil Uji Kekuatan dan Stabilitas Busa Sabun Natrium Stearat
No. Variasi Konsentrasi (%) Volume Busa (mL) Vs/Vo
Keterangan : Vo = Volume Busa pada saat 30 detik
Data hasil penentuan tegangan permukaan yang diperoleh dapat dilihat pada tabel
sebagai berikut:
Tabel 4.4 Data Hasil Penentuan Tegangan Permukaan (γ) Sabun Natrium
9,10,12-Trihidroksi Stearat Campuran dari Minyak Jarak
No. Konsentrasi Surfaktan Tegangan Permukaan(dyne/cm) γ Koreksi
(%) γ 1 γ 2 γ 3 γ rata-rata
Faktor Koreksi : 1,1776
Tabel 4.5 Data Hasil Penentuan Tegangan Permukaan (γ) Sabun Natrium Asam
Lemak dari Minyak Jarak
No. Konsentrasi Surfaktan Tegangan Permukaan (dyne/cm) γ.Koreksi
43
Trigliserida Metanol Gliserol Metil Ester Asam Lemak Campuran 4.2 Pembahasan
Minyak jarak yang diperoleh dengan cara maserasi dengan menggunakan
pelarut 2-propanol. Minyak jarak dimetanolisis secara refluks menggunakan katalis
H2SO4 dan pelarut benzena pada suhu 80o
Metil risinoleat ialah komposisi terbesar (utama) yang terdapat dalam metil
ester asam lemak campuran dari minyak jarak. Metil risinoleat merupakan ester dari
asam lemak tidak jenuh yang memiliki gugus -OH pada atom C
C diharapkan membentuk metil ester asam
lemak campuran dari minyak jarak dengan reaksi sebagai berikut :
12 sehingga ester dari
asam lemak ini bersifat lebih polar dibandingkan asam lemak lainnya.
Spektrum FT-IR metil ester asam lemak campuran dari minyak jarak (Gambar
4.1) menunjukkan puncak serapan pada daerah bilangan gelombang 3444,6 cm-1 yang
merupakan serapan khas untuk gugus hidroksil (-OH), pada bilangan gelombang
3008,7 cm-1 merupakan puncak serapan untuk CH sp2 dari gugus –CH=CH-, dan
didukung dengan serapan pada bilangan gelombang 1651,0 cm-1 yang merupakan
serapan khas dari ikatan C=C. Pada bilangan gelombang 1743,5 cm-1 merupakan
serapan khas dari gugus karbonil (C=O) dari ester dan didukung dengan puncak
vibrasi -C-O-C- pada daerah bilangan gelombang 1172,6 cm-1,sehingga dapat
H C
menunjukkan adanya vibrasi stretching dari CH sp3 yang didukung vibrasi bending
CH sp3 pada bilangan gelombang 1458,1-1438,8 cm-1.
Kemudian metil ester asam lemak campuran dari minyak jarak yang memiliki
metil risinoleat sebagai komposisi utama diepoksidasi dengan campuran HCOOH
90% dan H2O2 30% dan dilanjutkan dengan hidrolisis dengan reaksi sebagai berikut :
Disamping senyawa 9,10,12-trihidroksi metil stearat yang terbentuk sesuai
dengan adanya campuran asam lemak lain, juga dalam hal ini terbentuk hidroksi
stearat dari senyawa metil oleat, linoleat dan linolenat dalam jumlah yang kecil.
Senyawa 9,10,12-trihidroksi metil stearat campuran yang diperoleh ini dianalisis
dengan spektrofotometer FT-IR (gambar 4.2) menunjukkan puncak serapan pada
daerah bilangan gelombang 3444,6 cm-1 yang merupakan serapan khas dari gugus
hidroksi (OH). Pada daerah ini puncak serapan semakin melebar karena sebelum
diepoksida hanya memiliki 1 gugus hidroksi dan setelah diepoksida yang dilanjutkan
hidrolisis maka gugus hidroksi bertambah menjadi 3 buah. Pada bilangan gelombang
2931,6- 2838,3 cm-1 menunjukkan serapan khas dari vibrasi stretching CH sp3 dan
pada daerah bilangan gelombang 1461,9-1438,8 cm-1 menunjukkan serapan khas dari
vibrasi bending CH sp3. Pada bilangan gelombang 1724,2 cm-1 menunjukkan serapan
khas gugus karbonil (C=O) dan bilangan gelombang 1184,2 cm-1menunjukkan
45
Analisis bilangan iodin dari metil ester asam lemak campuran dari minyak
jarak yaitu sebesar 82,85 dan 9,10,12-trihidroksi metil stearat yaitu sebesar 38,54
menunjukkan adanya penurunan jumlah ikatan rangkap maka ada terjadinya reaksi
oksidasi terhadap ikatan rangkap pada senyawa metil risinoleat. Dan analisis bilangan
hidroksi dari senyawa metil ester asam lemak campuran dari minyak jarak yaitu
sebesar 221,51 dan senyawa 9,10,12-trihidroksi metil stearat yaitu sebesar 347,33
menunjukkan adanya kenaikan gugus hidroksi maka dapat dikatakan adanya terjadi
reaksi epoksidasi yang diikuti reaksi hidrolisis pada senyawa metil risinoleat. Uji HLB
yang dilakukan terhadap senyawa metil ester asam lemak campuran dari minyak jarak
diperoleh sebesar 11,44 dan HLB dari senyawa 9,10,12-trihidroksi metil stearat
diperoleh sebesar 15,18 menunjukkan adanya kenaikan nilai HLB maka senyawa
9,10,12-trihidroksi metil stearat campuran bersifat semakin hidrofil.
Selanjutnya senyawa 9,10,12-trihidroksi metil stearat campuran yang
diperoleh disafonifikasi dengan menggunakan basa kuat yaitu NaOH dan diendapkan
dengan menggunakan garam NaCl sehingga diperoleh sabun natrium
9,10,12-trihidroksi stearat sebagai komposisi utama yang kemungkinan sebesar 87,5 %,
natrium oleat sebesar 5%, natrium linoleat sebesar 4%, natrium palmitat sebesar 1,5%,
natrium stearat sebesar 0,5 % dan natrium linolenat sebesar 0,5%.
Sabun natrium 9,10,12-trihidroksi stearat campuran selanjutnya dianalisis
dengan menggunakan spektrofotometer FT-IR (gambar 4.3) menunjukkan puncak
serapan pada bilangan gelombang 3429 cm-1 yang merupakan serapan khas gugus
hidroksil (OH). Pada bilangan gelombang 2923,9 – 2854,5 cm-1 menunjukkan serapan
khas dari vibrasi stretching CH sp3 dan bilangan gelombang 1446,5 – 1423,4 cm-1
menunjukkan serapan khas dari vibrasi bending CH sp3. Pada bilangan gelombang
1631,7 cm-1 menunjukkan serapan khas gugus karbonil (C=O) untuk senyawa garam
C
Sabun Natrium Asam Lemak dari Minyak Jarak
H3C (CH2)16 C
O
ONa
Sabun Natrium Stearat
Selanjutnya sabun natrium 9,10,12-trihidroksi stearat campuran dibandingkan
dengan sabun natrium stearat dan sabun natrium asam lemak dari minyak jarak dalam
analisis alkalinitas bebas, uji tegangan permukaan dan uji kekuatan dan stabilitas busa
dimana struktur dari kedua jenis sabun ini adalah sebagai berikut :
Pada uji kekuatan dan stabilitas busa, sabun dibuat menjadi 5 konsentrasi,
kemudian dikocok dengan menggunakan alat shaker dan diukur volume busa yang
diperoleh setelah 30 detik dan 3 menit, sehingga diperoleh hasil untuk sabun natrium
9,10,12-trihidroksi stearat campuran (tabel 4.1), sabun natrium asam lemak dari
minyak jarak (tabel 4.2) dan sabun natrium stearat (tabel 4.3). Dari ketiga data,
diperoleh hasil kekuatan busa dari sabun natrium 9,10,12-trihidroksi stearat campuran
lebih besar dibandingkan sabun natrium asam lemak dari minyak jarak dan sabun
natrium stearat (grafik 4.1). Hal ini mengambarkan bahwa adanya gugus hidroksil
pada sabun natrium 9,10,12-trihidroksi stearat dapat meningkatkan kekuatan busa.
Pada uji stabilitas diperoleh hasil dimana sabun natrium stearat lebih baik stabilitasnya
dibandingkan sabun natrium asam lemak dari minyak jarak dan sabun natrium
9,10,12-trihidroksi stearat campuran (grafik 4.2). Hal ini juga disebabkan kepolaran
sabun natrium 9,10,12-trihidroksi stearat campuran ini lebih hidrofil sehingga
stabilitas lebih rendah dibandingkan natrium stearat. Pada tabel hasil uji kekuatan dan
stabilitas busa diperoleh data yang tidak teratur, hal ini dipengaruhi oleh stabilitas
47
Sabun Natrium Asam Lemak dari Minyak Jarak
Sabun Natrium 9,10,12-Trihidroksi Stearat Campuran
Sabun Natrium Stearat
Grafik 4.1 Grafik Hasil Uji Kekuatan Busa
Uji Stabilitas Busa
Sabun Natrium Asam Lemak dari Minyak Jarak
Sabun Natrium Stearat
Pada analisis alkalinitas bebas sabun natrium 9,10,12-trihidroksi stearat
campuran diperoleh kadar alkalinitas sebesar 0,2 %, sabun natrium asam lemak dari
minyak jarak diperoleh sebesar 0,28 % dan sabun natrium stearat diperoleh sebesar
0,25 %.
Pada hasil analisis penentuan tegangan permukaan untuk sabun natrium
9,10,12-trihidroksi stearat campuran (tabel 4.4) dan sabun natrium asam lemak dari
minyak jarak (tabel 4.5) maka diperoleh hasil dimana titik CMC untuk sabun natrium
9,10,12-trihidroksi stearat campuran berada pada konsentrasi 0,1 % dan diperoleh
tegangan permukaan sebesar 34,5 dyne/cm (grafik 4.3). Dan untuk sabun natrium
asam lemak dari minyak jarak, titik CMC berada pada konsentrasi 0,09 % dan
diperoleh tegangan permukaan sebesar 36,68 dyne/cm (grafik 4.4). Lebih rendahnya
tegangan permukaan sabun natrium 9,10,12-trihidroksi stearat campuran
dibandingkan sabun natrium asam lemak dari minyak jarak, maka makin mudah sabun
tersebut untuk membasahi benda sehingga meningkatkan kemampuan untuk
membersihkan kotoran.
Grafik 4.3 Grafik Hasil Penentuan Tegangan Permukaan CMC
49
Grafik 4.4 Grafik Hasil Penentuan Tegangan Permukaan. Tegangan Permukaan Sabun Natrium Asam Lemak dari
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hal yang dapat disimpulkan dari penelitian ini adalah:
1. Sabun natrium 9,10,12-trihidroksi stearat yang berupa campuran dapat
diturunkan dari minyak jarak melalui reaksi metanolisis, epoksidasi yang
diikuti reaksi hidrolisis dengan HCOOH/H2O2
2. Hasil pemeriksaan spektrum FT-IR memberikan dukungan bahwa hasil
metanolisis minyak jarak adalah metil ester asam lemak campuran, dan hasil
epoksidasi yang dilanjutkan hidrolisis adalah senyawa 9,10,12-trihidroksi
metil stearat campuran.
dan dilanjutkan safonifikasi
dengan NaOH
3. Harga HLB yang ditentukan melalui metode titrasi diperoleh sebesar 11,44
untuk metil ester asam lemak campuran dari asam lemak dan harga HLB untuk
senyawa 9,10,12-trihidroksi metil stearat campuran dari minyak jarak adalah
sebesar 15,18.
4. Sifat-sifat dari sabun natrium 9,10,12-trihidroksi stearat campuran dari minyak
jarak ialah :
- Titik konsentrasi misel kritis (CMC) berada pada konsentrasi 0,1 %
- Tegangan Permukaan sebesar 34,5 dyne/cm
- Memiliki kekuatan busa lebih baik dibandingkan sabun natrium asam
lemak campuran dari minyak jarak dan sabun natrium stearat
- Memiliki alkalinitas bebas sebesar 0,2%.
5.2 Saran
Diharapkan kepada peneliti berikutnya supaya lebih mengembangkan senyawa
trihidroksi metil stearat untuk uji deterjen, biodegradasi dan uji sifatnya terhadap air
DAFTAR PUSTAKA
Awang, R.,Ahmad,S.,Grazmah,G.,2001. Properties of Sodium Soap Derived from
Palm-Based Dihidroxystrearic Acid. Malaysia: Journal of Oil Palm
Research. Vol.13.33
Biemann,K.1983. Tables of Spectral Data for Structure Determinations of Organic Compounds. Germany: Springer-Verlag Berlin Heidelberg
Bird,T.,1990. Kimia Fisik Untuk Universitas. Jakarta: Erlangga
Fessenden,R.J dan Fessenden,J. 1994. Kimia Organik. Jilid 2. Edisi Ketiga. Jakarta: Erlangga
Ginting,M.,Sihotang,H dan Ginting,K.,2006. Dehidrasi Risinoleat Menjadi Linoleat yang Terdapat dalam Minyak Jarak (Ricinus communis Linn) Menggunakan Molekular Shive Secara Refluks dalam Beberapa Pelarut Organik. Medan: Jurnal Komunikasi Penelitian,Vol 18(3):17
Goud,V.V.,Pradhan,N.C., dan Patwardhan,A.V. 2006. Epoxidation of Karanja Oil by H2O2. USA: J.Am.Oil.Chem.Soc. Vol 83.635
Hart,H. 2003. Kimia Organik. Edisi Kesebelas. Jakarta: Erlangga
Johnson,R.W dan Pritz,E. 1989. Fatty Acid in Industry. New York: Marcell Dekler.Inc
Ketaren,S. 1986. Pengantar Teknologi Lemak dan Minyak Pangan. Jakarta: UI-Press
Miller,A.J dan Newel,F.E. 1988. Modern Experimental Organic Chemistry. Western Washington University-Press
Mittlebach,M dan Tritthart,P. 1988. Diesel Fuel Derived From Vegetable Oils,
Emision Test Using Methyl Esters of Used Frying Oils. USA: J.Am.Oil.Chem.Soc. Vol: 65.1185
Myers,D. 2006. Surfactans Science and Technology. New York: John Wiley and Sons
Parasuram,K.S. 1995.Soap And Detergents. London: McGraw Hill Book Company
Pavia,D.1976. Introduction for Organic Laboratory Techniques. Philadelphia: Saunders Company
Poejiadi,A.1994. Dasar-Dasar Biokimia. Edisi Keempat. Jakarta: UI-Press
Rumamurthi,S.,Manakar,V.,dan Mani,V.V,S.,1998. Characterization of Fatty Acid
Isomers in Dehydrated Castor Oil and GC-MS Techniques. USA:
J.Am.Oil.Chem.Soc.Vol 75.1297
Solomons, T.W.G. 2004. Organic Chemistry. New York: John Wiley and Sons
Silverstein, R.M., Bassler, G.C. dan Morill,T.C. 1981. Spectrometric Identification of Organic Compounds. Fourth Edition. New York: John Wily and Sons
Martin,A., Swarbick,J., dan Cammarata,A.1993. Farmasi Fisik. Jilid 2. Edisi Ketiga. Jakarta: UI-Press
Woollatt,E. 1985. The Manufacture of Soaps, Other Detergents and Glicerine. New York: John Wiley and Sons