ALAMI YANG MEMILIKI KEMAMPUAN
ANTIOKSIDASI
PUSPITA SARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Potensi Antosianin Buah Duwet (Syzygium cumini) sebagai Pewarna Pangan Alami yang Memiliki Kemampuan Antioksidasi adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2011
PUSPITA SARI. The Potency of Jambolan (Syzygium cumini) Fruit Anthocyanins as Natural Food Colorant with Antioxidation Capability. Under the directions of CHRISTOFORA HANNY WIJAYA, DONDIN SAJUTHI, and UNANG SUPRATMAN.
There is a worldwide interest in the use of natural red colorant in foods. Anthocyanins have been suggested as potential colorants due to their attractive red colors and non-toxicity. Jambolan (Syzygium cumini) fruit, a tropical fruit is found in Indonesia, is rich in anthocyanin pigments especially in its peel part. It has a potency for natural food colorant. In this study, the utilization of jambolan anthocyanins for natural food colorant was studied. The anthocyanins of jambolan fruit were characterized for their composition, stability properties, improvement of color intensity and stability through intermolecular copigmentation reaction, and capability as antioxidant. The content of total monomeric anthocyanin in the ripe fruit was 161 mg/100 g fresh fruit (731 mg/100 g skin on wet basis). Anthocyanins were identified as 3,5-diglucoside derivatives of delphinidin (41%), petunidin (28%), malvidin (26%), cyanidin (4%), and peonidin (1%). Native jambolan anthocyanins had low color intensity with pH ranging from 1 to 8 and relatively unstable during heating at 80 and 98oC, exposed to white fluorescent light and storage at room and refrigeration temperature, absence of light. However, they showed better stability to all treatments tested than enocianin, a commercial anthocyanin colorant. During light exposure and storage treatment, native jambolan anthocyanins showed comparable stability to red cabbage anthocyanins (acylated structure). Intermolecular copigmentation of jambolan anthocyanins with cinnamic acid (sinapic acid, ferulic acid, caffeic acid) and rosemary polyphenol extract increased the color intensity. Copigmentation with rosemary polyphenol extract produced the best color enhancement. Copigmentation with sinapic acid, caffeic acid, and rosemary polyphenol extract also increased stability on light exposure and storage treatments (room and refrigeration temperatures), not on heat treatments at 80 and 98oC. Moreover, jambolan anthocyanins, native or copigmented, in the form of extract, isolate, or added to a model beverage as colorant showed antioxidant activities. The anthocyanin isolate showed higher antioxidant activity as compared to extract from pulp or peel. Copigmentation jambolan anthocyanins with sinapic acid, caffeic acid, ferulic acid, and rosemary polyphenol extract on a model beverage increased the total polyphenol content and antioxidant activity as compared to model beverage with native anthocyanins. These results indicated that anthocyanins obtained from jambolan fruit can be utilized as a functional natural colorant for low pH foods.
Pewarna Pangan Alami yang Memiliki Kemampuan Antioksidasi. Dibimbing oleh CHRISTOFORA HANNY WIJAYA, DONDIN SAJUTHI, dan UNANG SUPRATMAN.
Buah duwet (Syzygium cumini) mengandung antosianin terutama pada bagian kulit. Buah duwet matang memiliki kulit berwarna ungu kehitaman menunjukkan adanya kandungan antosianin. Antosianin telah digunakan secara luas sebagai pewarna alami yang aman untuk pangan serta menunjukkan aktivitas biologis. Penelitian tentang antosianin buah duwet untuk penggunaan sebagai pewarna pangan alami yang fungsional belum dikaji secara lengkap dan mendalam. Untuk itu, penelitian ini dilakukan untuk mengetahui potensi antosianin buah duwet sebagai pewarna pangan alami yang fungsional dengan melakukan karakterisasi antosianin buah duwet meliputi identifikasi jenis dan komposisi antosianin, stabilitas warna antosianin, perbaikan intensitas dan stabilitas warna antosianin, serta aktivitas antioksidatif.
Identifikasi jenis dan komposisi antosianin buah duwet dilakukan menggunakan kromatografi cair kinerja tinggi-diode array detection (KCKT-DAD), analisis spektral UV-visibel, dan reaksi fisiko-kimia. Untuk keperluan identifikasi, antosianin diekstraksi secara maserasi menggunakan pelarut metanol yang mengandung 0,1% HCl. Selanjutnya ekstrak dipurifikasi menggunakan solid phase extraction (SPE) dengan C18 Sep-Pak cartridge.
Untuk pengujian warna dan stabilitas antosianin, antosianin buah duwet diekstraksi menggunakan pelarut etanol secara maserasi. Karakteristik warna dan stabilitas antosianin buah duwet dibandingkan dengan antosianin kubis merah dan pewarna enosianin (pewarna antosianin komersial). Warna antosianin buah duwet dan sampel pembanding dikarakterisasi pada kisaran nilai pH 1-8 menggunakan larutan buffer potasium klorida (pH 1-4) dan buffer sodium asetat (pH 5-8). Karakteristik warna diukur menggunakan spektrofotometer pada panjang gelombang 350-700 nm untuk mendapatkan pola spektra. Pengujian stabilitas warna antosianin dilakukan dalam minuman model (buffer sitrat, pH 3) terhadap pengaruh suhu pemanasan (80 dan 98oC), pencahayaan dengan lampu fluoresens putih, dan kondisi penyimpanan (suhu refrigerasi dan ruang). Analisis stabilitas meliputi retensi warna, indeks degradasi, warna polimerik (metode
bleaching bisulfit), dan warna kromasitas (CIELAB). Waktu paruh (t1/2) dihitung berdasarkan kinetika reaksi orde pertama.
Sep-Pak cartridge untuk memperoleh fraksi polifenol antosianin dan fraksi polifenol non-antosianin. Ekstrak dan fraksi polifenol dianalisa kandungan total polifenol (metode folin-ciocalteau), kandungan total antosianin monomerik (metode perbedaan pH), serta aktivitas antioksidan. Aktivitas antioksidan dianalisa berdasarkan kemampuan scavenging terhadap radikal bebas difenil pikrilhidrasil (DPPH), radikal hidroksil/OH• (metode deoksiribosa), dan radikal anion superoksida/O2• yang dihasilkan dari reaksi enzimatis xantin oksidase-hipoxantin. Selain itu juga dilakukan pengujian aktivitas penghambatan peroksidasi lipid menggunakan lipoprotein LDL dengan mengukur produk oksidasi sekunder, malonaldehid. Minuman model yang diberi warna antosianin buah duwet (tanpa kopigmentasi dan terkopigmentasi intermolekular) juga diuji kandungan total antosianin dan total polifenol, serta aktivitas antioksidan berdasarkan kemampuan scavenging radikal DPPH.
Kandungan total antosianin monomerik buah duwet matang rata-rata sebesar 161 mg/100 g buah segar (bb) dan pada bagian kulit sebesar 731 mg/100 g kulit buah (bb). Bagian kulit buah duwet mengandung antosianin ~4.5 kali lebih banyak dibandingkan buah utuh. Kulit buah duwet mengandung antosianin lebih tinggi dibandingkan pada anggur yang mengandung antosianin pada kisaran nilai 6-600 mg/100 g. Kulit buah duwet memiliki potensi untuk digunakan sebagai bahan baku sumber antosianin. Komposisi antosianin buah duwet terdiri dari delfinidin-3,5-diglukosida (41%), petunidin-3,5-diglukosida (28%), malvidin-3,5-diglukosida (26%), sianidin-3,5-diglukosida (4%), dan peonidin-3,5-diglukosida (1%). Delfinidin-3,5-diglukosida, petunidin-3,5-diglukosida, dan malvidin-3,5-diglukosida merupakan antosianin utama buah duwet.
Warna antosianin buah duwet dipengaruhi oleh pH. Nilai absorbans antosianin buah duwet pada nilai pH 1-2 menunjukkan nilai yang tinggi dan berwarna merah. Peningkatan pH hingga pH 6 menunjukkan penurunan nilai absorbans dan warna menjadi pudar serta menjadi tidak berwarna pada pH 4-6. Pada nilai pH 7-8 terjadi peningkatan nilai absorbans pada kisaran 570-600 nm dan warna antosianin berubah menjadi biru. Antosianin buah duwet mempunyai intensitas warna merah atau biru yang lebih rendah pada nilai pH 1-8 dibandingkan antosianin kubis merah dan pewarna enosianin. Struktur antosianin buah duwet dalam bentuk glikosilasi 3,5-diglukosida menyebabkan intensitas warna rendah. Pada pengujian stabilitas menunjukkan warna antosianin buah duwet relatif tidak stabil selama perlakuan pemanasan, pencahayaan, dan penyimpanan. Antosianin buah duwet menunjukkan karakteristik warna yang lebih stabil dibandingkan antosianin pewarna enosianin. Struktur antosianin buah duwet dalam bentuk glikosilasi 3,5-diglukosa menjadikan antosianin buah duwet lebih stabil. Stabilitas warna antosianin buah duwet sebanding dengan stabilitas warna antosianin kubis merah terutama pada perlakuan pencahayaan dan penyimpanan. Penyimpanan pada suhu refrigerasi memberikan karakteristik stabilitas warna yang lebih tinggi dibandingkan pada penyimpanan suhu ruang.
ekstrak polifenol rosemary memberikan peningkatan nilai absorbans pada vis-maks yang paling besar hingga ~120% pada konsentrasi 4 mg/ml. Pengujian stabilitas warna kompleks antosianin-kopigmen menunjukkan bahwa dengan penambahan kopigmen asam sinapat, asam kafeat, dan ekstrak polifenol rosemary (konsentrasi 1 mg/ml) dapat meningkatkan stabilitas warna pada perlakuan pencahayaan dan penyimpanan, sedangkan pada perlakuan pemanasan tidak meningkatkan stabilitas warna antosianin.
Buah duwet mengandung senyawa polifenol utamanya antosianin sebesar ~83%. Antosianin buah duwet memberikan kontribusi utama terhadap aktivitas antioksidan. Ekstrak dan isolat antosianin buah duwet yang utamanya mengandung senyawa polifenol antosianin dapat digunakan sebagai pewarna pangan. Ekstrak dan isolat antosianin buah duwet menunjukkan aktivitas antioksidan yang diuji berdasarkan kemampuan dalam scavenging radikal DPPH, hidroksil (OH•), dan superoksida (O2•), serta menghambat oksidasi lipoprotein LDL. Isolat antosianin buah duwet yang mengandung lima jenis antosianin menunjukkan aktivitas antioksidan lebih tinggi dibandingkan ekstrak antosianin buah duwet dan ekstrak antosianin kubis merah serta mempunyai aktivitas sedikit lebih rendah dibandingkan dengan sampel standar, katekin dan asam askorbat. Ekstrak kulit duwet memiliki aktivitas antioksidan sedikit lebih rendah dibandingkan dengan ekstrak kubis merah. Antosianin buah duwet (tanpa kopigmentasi dan terkopigmentasi intermolekular) yang ditambahkan ke dalam minuman model sebagai pewarna juga menunjukkan aktivitas antioksidan. Perlakuan kopigmentasi (intermolekular) pada minuman model menggunakan asam sinamat dan ekstrak polifenol rosemary dapat meningkatkan kandungan total polifenol dan aktivitas antioksidan, serta tidak dijumpai adanya efek sinergisme.
Antosianin yang utamanya terkandung dalam kulit buah duwet dapat dikembangkan sebagai pewarna alami untuk pangan yang sekaligus memiliki aktivitas antioksidan (pewarna pangan fungsional). Pewarna berbasis antosianin buah duwet dapat digunakan untuk mewarnai produk pangan berbasis asam untuk memberikan warna merah. Untuk memperoleh warna merah yang kuat, lebih stabil, serta aktivitas antioksidan yang lebih tinggi dapat digunakan asam sinapat, asam kafeat, dan ekstrak polifenol rosemary sebagai kopigmen (kopigmentasi intermolekular).
Keywords: Syzygium cumini, buah duwet, antosianin, stabilitas warna, kopigmentasi intermolekular, aktivitas antioksidan, pewarna pangan fungsional
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
ALAMI YANG MEMILIKI KEMAMPUAN
ANTIOKSIDASI
PUSPITA SARI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi/Mayor Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi Ujian Tertutup: Dr. Ir. Nuri Andarwulan, MSi.
(Departemen Ilmu dan Teknologi Pangan, FATETA, IPB)
Prof. Dr. Suminar Setiati Achmadi (Departemen Kimia, FMIPA, IPB)
Penguji Luar Komisi Ujian Terbuka: Prof. Dr. Ir. Latifah K. Darusman (Departemen Kimia, FMIPA, IPB) Ir. Achmad Subagyo, MAgr. Ph.D.
Nama : PUSPITA SARI
NIM : F261060041
Program Studi : Ilmu Pangan
Disetujui Komisi Pembimbing
Prof. Dr. Ir. C. Hanny Wijaya, MAgr. Ketua
Prof. drh. Dondin Sajuthi, MST, Ph.D Prof. Unang Supratman, Ph.D, MSi. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc. Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
“ Sesun gguhn y a sesudah kesul i t an i t u ……… past i ada kemudahan ”
INNA MA’AL “ USRI YUSRON
(QS Al am Nasy r oh : 6-7)
Kar ya ini kuper sembahkan buat kedua or ang t ua, suami t er cint a Adlhan
Z uhr iansyah ser t a ananda Rayya Rumaisha Zuhr iansyah unt uk bimbingan,
Alhamdulillahirobbil’alamin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian ini adalah antosianin buah duwet, dengan judul Potensi Antosianin Buah Duwet (Syzygium cumini) sebagai Pewarna Pangan Alami yang Memiliki Kemampuan Antioksidasi. Karya ilmiah ini dibuat sebagai salah satu syarat untuk memperoleh gelar doktor pada Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan terima kasih dan penghargaan yang tinggi kepada Prof. Dr. Ir. C. Hanny Wijaya, MAgr. selaku ketua komisi pembimbing, Prof. drh. Dondin Sajuthi, MPh, Ph.D dan Prof. Unang Supratman, MSi, Ph.D selaku anggota komisi pembimbing atas segala perhatian, kepercayaan, kesabaran, bimbingan dan arahan, wawasan ilmu yang diberikan, kritik, saran/masukan, serta waktu yang disediakan selama penulisan proposal, pelaksanaan penelitian, penulisan disertasi, serta dalam mempersiapkan seminar dan ujian hingga akhirnya penulis dapat menyelesaikan karya ilmiah ini serta menyelesaikan studi doktor di IPB.
Terima kasih disampaikan kepada Dr. Ir. Nuri Andarwulan, MSi. dan Prof. Dr. Suminar Setiati Achmadi yang telah bersedia menjadi penguji luar
komisi pada ujian tertutup. Terima kasih juga disampaikan kepada Prof. Dr. Ir. Latifah K. Darusman dan Ir. Achmad Subagyo, MAgr. Ph.D., atas kesediaannya menjadi penguji luar komisi pada ujian terbuka serta Dr. Ir. Sugiyono, MSc. selaku pimpinan sidang pada ujian tertutup dan ujian terbuka. Terima kasih untuk arahan, kritik, dan saran/masukan yang diberikan untuk perbaikan dan penyempurnaan disertasi ini.
Ucapan terima kasih disampaikan kepada Rektor Universitas Jember, Dekan Fakultas Teknologi Pertanian, Universitas Jember, atas izin yang diberikan kepada penulis untuk melanjutkan program doktor di Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor. Terima kasih kepada Dr. Ir. Maryanto, MSc, Ir. Achmad Subagyo, MAgr. Ph.D., dan Prof. Dr. Ir. Tedjasari, MSc., yang memberikan surat rekomendasi saat mendaftar di IPB.
Pendidikan Nasional serta International Foundation for Science (IFS)-Swedia bekerjasama dengan Organisation for the Prohibition of Chemical Weapon
(OPCW)-The Netherland atas bantuan dana penelitian yang diberikan untuk pengembangan penelitian tentang antosianin dari bahan-bahan alam Indonesia.
Terima kasih juga disampaikan kepada Ketua Program Studi Ilmu Pangan dan seluruh staf pengajar Program Studi Ilmu Pangan yang telah memberikan wawasan dan pengetahuan tentang ilmu pangan. Terima kasih kepada pegawai di Program Studi Ilmu Pangan, teknisi di laboratorium SEAFAST Center (gedung PAU) dan Departemen Ilmu dan Teknologi Pangan, serta petugas perpustakaan untuk segala bantuannya. Terima kasih juga disampaikan kepada Reza, bu Irma, Mathelda, Ayusta, Findya, Silvana untuk bantuan literatur (jurnal, text book, e-book tentang antosianin, polifenol, antioksidan, dan pewarna) yang berguna dalam pengembangan penelitian dan penulisan karya ilmiah.
Penulis juga menyampaikan terima kasih kepada teman-teman di Program Studi Ilmu Pangan, terutama bu Rika, bu Irma, dik Nurhayati, bu Triana, bu Yusda, bu Didah, bu Elvira, Mathelda, Findya, Reza, Ayusta, bu Rini, serta teman-teman satu bimbingan (Oktafrina, Silvana, bu Wiwied, Isak, pak Rudi, pak Maijon, pak Syahrir, bu Susi, pak Zaim). Terima kasih untuk persahabatan dalam suka dan duka serta segala bantuan yang tulus selama penulis menempuh studi di program studi Ilmu Pangan.
Terima kasih kepada keluarga tercinta Adlhan Zuhriansyah, SE (suami) dan ananda Rayya Rumaisha Zuhriansyah (anak) atas pengorbanan, pengertian, kesabaran, doa tulus, kasih sayang, serta dukungan moril dan bantuan materiil. Ucapan terima kasih yang tak terhingga juga penulis sampaikan kepada Ayahanda Drs. Soeparno (alm.), ibu Dra. Sulistini, serta semua saudara (Puspita Rini, SPd, Puspita Dewi, SE dan Sonya Sulistiyono, ST, MT) atas segala doa, perhatian, dukungan moril, dan kasih sayang.
Semoga Allah yang Maha Pemurah membalas segala kebaikan yang telah diberikan dengan balasan yang lebih sempurna. Akhirnya penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi masyarakat luas dan dapat memperkaya bidang ilmu pangan Indonesia.
Penulis dilahirkan di Sidoarjo, Jawa Timur, pada tanggal 1 Maret 1972 sebagai anak ketiga dari empat bersaudara pasangan Drs. Soeparno (alm.) dan Dra. Sulistini. Penulis menikah dengan Adlhan Zuhriansyah, SE pada tanggal 25 Mei 2001 dan dikarunai seorang putri bernama Rayya Rumaisha Zuhriansyah, yang lahir 4 Maret 2002.
Pendidikan formal SD hingga SMA ditempuh di Krian, Sidoarjo. Penulis menempuh pendidikan di SD Negeri IV tahun 1978-1984, SMP Negeri 2 tahun 1984-1987, dan SMA Negeri 1 tahun 1987-1990. Pada tahun 1990 penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dan tahun 1991 penulis diterima di Jurusan Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, IPB. Pendidikan S-1 diselesaikan pada tahun 1995 dengan skripsi berjudul: ”Pra-studi Kelayakan Pendirian Industri Kecil Tepung Terasi di Kabupaten Sidoarjo, Jawa Timur” di bawah bimbingan Ir. Soesarsono Wijandi, MSc. (alm.). Tahun 1999 penulis menempuh pendidikan program master di Department Applied Biochemistry, Graduate School of Agriculture and Biological Sciences, Osaka Prefecture University, Jepang dengan beasiswa JINNAI International Scholarship, Jepang. Pendidikan program master diselesaikan tahun 2001 dengan thesis berjudul: “Studies on Antioxidative Properties of Cacao Polyphenolic” di bawah bimbingan Prof. Dr. Naofumi Morita. Pada tahun 2006, penulis mendapat kesempatan untuk melanjutkan pendidikan program doktor pada program studi Ilmu Pangan, IPB dengan beasiswa BPPS dari Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan, Indonesia. Sejak tahun 1998 sampai sekarang, penulis bekerja sebagai staf pengajar di Jurusan Teknologi Hasil Pertanian, Fakultas Teknologi Pertanian, Universitas Jember. Penulis adalah anggota Perhimpunan Ahli Teknologi Pangan Indonesia (PATPI) dan aktif mengikuti kegiatan yang diselenggarakan himpunan profesi terutama kegiatan seminar. Penulis juga menjadi mitra bestari (reviewer) pada Jurnal Agritech, Fakultas Teknologi Pertanian, UGM (mulai tahun 2010).
xv
Halaman
DAFTAR TABEL ... xvii
DAFTAR GAMBAR ... xix
1 PENDAHULUAN UMUM ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
Ruang Lingkup Penelitian ... 4
2 TINJAUAN PUSTAKA ... 5
Tanaman Duwet dan Kegunaan ... 5
Antosianin ... 8
Pewarna Pangan ... 16
Radikal Bebas dan Sistem Antioksidan ... 19
Mekanisme Antioksidan Polifenol ... 22
3 KANDUNGAN TOTAL ANTOSIANIN MONOMERIK DAN KOMPOSISI ANTOSIANIN BUAH DUWET (Syzygium cumini) Pendahuluan ... 25
Bahan dan Metode ... 26
Hasil dan Pembahasan ... 30
Simpulan ... 38
4 STABILITAS ANTOSIANIN BUAH DUWET (Syzygium cumini) DALAM MINUMAN MODEL Pendahuluan ... 39
Bahan dan Metode ... 40
Hasil dan Pembahasan ... 45
Simpulan ... 62
5 PERBAIKAN INTENSITAS DAN STABILITAS WARNA ANTOSIANIN BUAH DUWET (Syzygium cumini) SECARA KOPIGMENTASI INTERMOLEKULAR Pendahuluan ... 65
Bahan dan Metode ... 66
Hasil dan Pembahasan ... 71
Simpulan ... 86
6 AKTIVITAS ANTIOKSIDAN ANTOSIANIN BUAH DUWET (Syzygium cumini) SECARA IN VITRO Pendahuluan ... 89
Bahan dan Metode ... 90
Hasil dan Pembahasan ... 98
Simpulan ... 117
xvii
Halaman
2.1 Substitusi kation flavilium untuk membentuk antosianidin .. 9
2.2 Komposisi antosianin dalam bahan pangan yang mengandung antosianin terasilasi (kopigmentasi intramolekular) ……… 14
2.3 Certified colorants yang diijinkan untuk digunakan ... 17
2.4 Pewarna alami (uncertified colorants) untuk makanan dan minuman (didaftar oleh FDA) ………... 17
2.5 Klasifikasi pigmen alami ……… 18
2.6 Spesies oksigen dan nitrogen reaktif ... 19
3.1 Kandungan antosianin beberapa buah dan sayuran ... 31
3.2 Ciri kromatogram KCKT dan spektrum dari antosianin buah duwet terhidolisis asam (antosianidin) ... 32
3.3 Ciri kromatogram KCKT dan spektrum dari antosianin buah duwet ... 35
4.1 Karakteristik warna (kromasitas) antosianin buah duwet, kubis merah, dan pewarna enosianin ... 51
4.2 Perubahan warna dan waktu paruh antosianin dalam minuman model bufer sitrat pH 3 pada perlakuan pemanasan suhu 80 dan 98oC ... 52
4.3 Perubahan warna dan waktu paruh antosianin dalam minuman model bufer sitrat pH 3 pada perlakuan penyimpanan suhu refrigerasi dan ruang ... 58
4.4 Perubahan warna dan waktu paruh antosianin dalam minuman model bufer sitrat pH 3 pada perlakuan pencahayaan fluoresens ... 61
5.1 Karakteristik warna kromasitas dari antosianin buah duwet yang dikopigmentasi secara intermolekular dengan asam sinamat dan ekstrak polifenol rosemary ... 78
xviii
5.4 Perubahan warna dan waktu paruh antosianin dalam minuman model tanpa dan dengan kopigmentasi pada
perlakuan penyimpanan suhu ruang dan refrigerasi ... 85
6.1 Kandungan total polifenol dan antosianin dalam ekstrak
dan fraksi ... 99
6.2 Kandungan polifenol dalam ekstrak dan isolat antosianin
buah duwet, serta kubis merah ... 101
6.3 Nilai IC50 dari ekstrak duwet, isolat antosianin, dan
senyawa pembanding ... 104
6.4 Konsentrasi malonaldehid dari LDL termodifikasi (oksidasi Cu2+) tanpa dan dengan ditambahkan ekstrak dan isolat
xix
Halaman
2.1 Tanamam dan buah duwet ……….. 7
2.2 Antosianidin yang umum ada di bahan pangan ………... 9
2.3 Unit glikosil dari antosianin ... 10
2.4 Unit asil yang berikatan dengan antosianin ... 11
2.5 Struktur kimia antosianin ... 11
2.6 Mekanisme stabilisasi antosianin melalui kopigmentasi intramolekular dan intermolekular ... 13
2.7 Mekanisme stabilisasi antosianin terasilasi (kopigmentasi intramolekuler), mono- dan diasil pigmen ... 13
2.8 Efek hiperkromikdan pergeseran batokromik antosianin beras merah yang dikopigmentasi dengan asam ferulat ... 15
2.9 Penangkapan spesies oksigen reaktif/SOR (R•) oleh senyawa flavonoid ... 23
2.10 Struktur dasar utama yang berhubungan dengan aktivitas antioksidan flavonoid ... 24
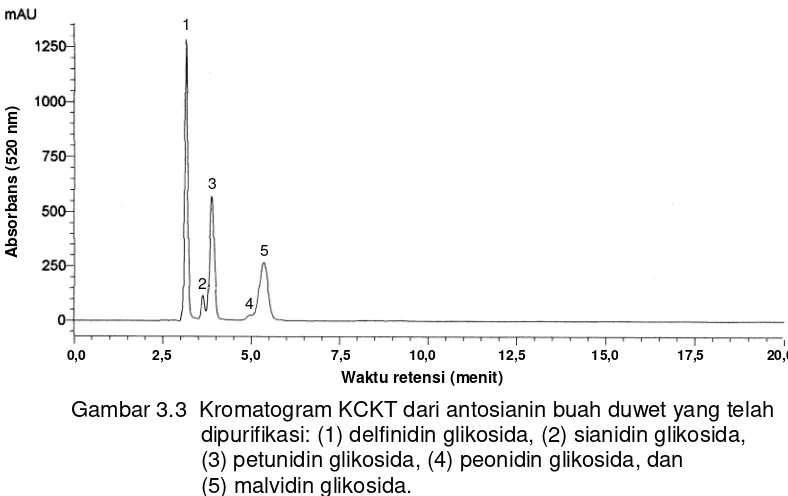
3.1 Kromatogram KCKT dari antosianin buah duwet terhidrolisis asam (antosianidin) ………. 32
3.2 Struktur antosianidin buah duwet ……….. 33
3.3 Kromatogram KCKT dari antosianin buah duwet yang telah dipurifikasi ………. 34
3.4 Antosianin duwet, kubis, dan strawberi dibawah radiasi ultraviolet (366 nm), pemisahan antosianin dengan KLT-ODS ... 35
3.5 Pemisahan gula dengan KLT-silika ... 36
3.6 Struktur antosianin buah duwet ... 36
4.1 Ekstrak antosianin kulit buah duwet ... 42
xx
4.4 Pengaruh pH pada interkonversi dan perubahan warna
antosianin ……….. 49
4.5 Minuman model (bufer sitrat pH 3) mengandung antosianin
buah duwet, kubis merah, dan pewarna enosianin ... 51
4.6 Pengaruh perlakuan pemanasan suhu 80 dan 98oC pada retensi warna antosianin (%) dari antosianin buah duwet, kubis merah, dan pewarna enosianin dalam minuman model
bufer sitrat pH 3 ... 52
4.7 Mekanisme degradasi untuk antosianidin 3,5-diglikosida dan
3-diglikosida ... 56
4.8 Pengaruh kondisi penyimpanan (suhu refrigerasi dan ruang) pada retensi warna (%) dari antosianin buah duwet, kubis merah, dan pewarna enosianin dalam minuman model bufer
sitrat pH 3, kondisi perlakuan tanpa cahaya ………. 58
4.9 Pengaruh pencahayaan dengan lampu fluoresens pada retensi warna (%) dari antosianin buah duwet, kubis merah, dan pewarna enosianin dalam minuman model bufer sitrat
pH 3 ... 61
5.1 Bubuk daun rosemary dan ekstrak polifenol rosemary …….. 67
5.2 Struktur kimia kopigmen yang digunakan dalam
penelitian ... 71
5.3 Pengaruh penambahan asam sinamat dan ekstrak polifenol rosemary terhadap karakteristik spektral (visibel) warna
antosianin duwet ... 72
5.4 Pergeseran batokromik dan efek hiperkromik dari antosianin buah duwet yang direaksikan dengan asam sinamat dan
ekstrak polifenol rosemary ... 74
5.5 Pembentukan kompleks antosianin-kopigmen secara transfer muatan (charge-transfer) atau interaksi
-
(interaksi antosianin dengan senyawa fenolik) ... 75
5.6 Kompleks molekular antosianin-kopigmen melalui interaksi intermolekular antara delfinidin 3-glukosida dan rutin
(Williams & Hrazdina, 1979) dan awobanin (delfinidin
3-(6-O-trans-p-kumaril-ß-D-glukosida)-5-(ß-D-glukosida) dan
xxi
5.8 Pengaruh pemanasan terhadap retensi warna antosianin buah duwet tanpa dan dengan penambahan kopigmen
(1 mg/mL) pada minuman model pH 3 ... 79
5.9 Pengaruh pencahayaan dengan lampu fluoresens putih terhadap retensi warna antosianin buah duwet tanpa dan dengan penambahan kopigmen (1 mg/mL) pada minuman
model pH 3 ... 81
5.10 Pengaruh penyimpanan suhu refrigerasi dan ruang terhadap retensi warna antosianin buah duwet tanpa dan dengan penambahan kopigmen (1 mg/mL) pada minuman
model pH 3 ... 83
5.11 Contoh stabilisasi antosianin melalui pembentukan komplek secara transfer muatan (charge-transfer) atau interaksi
-
(interaksi antosianin dengan senyawa fenolik) ... 86
6.1 Ekstrak polifenol, fraksi polifenol antosianin, dan fraksi
polifenol non-antosianin dari buah duwet ... 98
6.2 Aktivitas scavenging radikal DPPH dari ekstrak polifenol, fraksi polifenol antosianin dan fraksi polifenol non-antosianin
buah duwet ... 100
6.3 Skema scavenging radikal DPPH oleh antioksidan (RH) 102
6.4 Aktivitas scavenging radikal DPPH dari ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), asam askorbat, katekin,
dan kuersetin ... 103
6.5 Aktivitas scavenging radikal hidroksil (OH•) dari ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat
antosianin duwet (IAD), ekstrak kubis merah (EKM), dan
katekin 106
6.6 Aktivitas scavenging radikal anion superoksida (O2•) dari ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), asam
askorbat, dan katekin ... 108
6.7 Efek penghambatan oksidasi lipoprotein LDL oleh ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), ekstrak kubis merah (EKM), isolat antosianin duwet (IAD), dan katekin.
Kontrol, LDL + Cu2+; EDTA, LDL + Cu2+ + EDTA ... 110
xxii
1 mg/ml ... 114
6.10 Kapasitas antioksidan minuman model yang diberi warna antosianin buah duwet baik tanpa dan dengan perlakuan
kopigmentasi. Penambahan kopigmen 1 mg/ml ... 115
6.11 Delokalisasi elektron tidak berpasangan disekitar cincin
aromatik pada radikal fenol ... 116
6.12 Mekanisme stabilisasi radikal semikuinon dari sianidin
Latar Belakang
Semakin meningkatnya kesadaran manusia untuk hidup lebih sehat mendorong meningkatnya penggunaan bahan tambahan pangan (BTP) yang alami dalam bahan pangan. Salah satu BTP alami yang dapat memberi warna pada produk pangan agar lebih terlihat menarik adalah pewarna alami pangan. Pewarna alami pangan adalah pewarna untuk pangan yang berasal dari bahan alam. Pewarna alami sudah banyak digunakan dalam bahan pangan seperti klorofil yang dapat memberikan warna hijau, karotenoid yang dapat memberikan warna kuning, serta antosianin yang dapat memberikan warna merah pada produk pangan berbasis asam. Dewasa ini, penggunaan pewarna alami pada produk pangan semakin meningkat. Beberapa produk pangan yang ada dipasaran Indonesia sudah menggunakan pewarna alami. Peningkatan ini terjadi karena pewarna alami selain dapat memberi warna pada bahan pangan, juga dapat memberikan manfaat lain terutama yang berkaitan dengan kesehatan manusia. Hal ini mendorong berbagai penelitian yang terkait dengan pengembangan pewarna alami termasuk pewarna alami berbasis antosianin.
Antosianin merupakan pigmen yang termasuk dalam kelompok flavonoid dari senyawa polifenol telah digunakan secara luas sebagai pewarna alami yang aman untuk pangan (Mateus & Freitas 2009). Antosianin yang ditemukan pada tanaman pangan umumnya dalam bentuk glikosida dan asilglikosida dari 6 antosianidin (aglikon) utama, yaitu pelargonidin, sianidin, delfinidin, peonidin,
petunidin, dan malvidin (Castaňeda-Ovando et al. 2009). Berbagai bahan pangan ditemukan mengandung antosianin seperti anggur, blackcurrant, blackberry,
Meskipun antosianin tidak bersifat toksik dan aman dikonsumsi, ada keterbatasan dalam aplikasi antosianin pada produk pangan terutama masalah kestabilan. Stabilitas antosianin sangat dipengaruhi oleh struktur kimia dan konsentrasi antosianin; pH; suhu; keberadaan enzim, oksigen dan cahaya; serta keberadaan senyawa lain seperti asam askorbat, kopigmen, protein, logam, dan gula (Markakis 1982; Francis 1989; Jackman & Smith 1996; Castañeda-Ovando
et al. 2009). Warna dan stabilitas antosianin umumnya dapat diperbaiki dengan reaksi kopigmentasi baik secara intramolekular dan intermolekular sehingga warna antosianin dapat ditingkatkan intensitasnya dan lebih stabil (Malien-Aubert
et al. 2001; Eiro & Heinonen 2002; Mazzaracchhio et al. 2004; Gris et al. 2007; Yawadio & Morita 2007).
Selain sebagai pewarna alami, antosianin juga memiliki peranan penting untuk kesehatan manusia. Antosianin telah dilaporkan menunjukkan aktivitas biologis seperti aktivitas antioksidan dan scavenging radikal (Wang et al. 1997; Wang et al. 1999, Espin et al. 2000, Kong et al. 2003; Bao et al. 2005), antiinflamasi (Wang et al. 1999), antikarsinogenik (Wang & Mazza 2002; Katsube
et al. 2003); antitumor (Kong et al. 2003), antidiabetik (Jayaprakasam et al. 2005), neuroprotektif (Youdim et al. 2000; Galli et al. 2002), antimutagenik dan hepatoprotektif (Kong et al. 2003). Antosianin juga dapat mengurangi resiko penyakit jantung koroner melalui aktivitas vasoprotektif (Lietti et al. 1976), penghambatan agregasi platelet (Morazzoni & Magistretti 1990; Ghiselli et al. 1998), dan penghambatan oksidasi lipoprotein LDL (low density lipoprotein) (Abuja et al. 1998; Ghiselli et al. 1998; Heinonen et al. 1998).
Selama ini buah duwet belum banyak dimanfaatkan sehingga menjadi buah langka. Buah duwet biasanya dikonsumsi secara langsung dalam bentuk buah segar, sedangkan bagian biji dan daunnya oleh masyarakat Indonesia digunakan untuk pengobatan tradisional penyakit diabetes. Beberapa penelitian telah dilakukan untuk mengetahui manfaat kesehatan dari beberapa bagian tanaman duwet seperti kulit batang, daun, biji, dan buah. Kulit batang tanaman memiliki aktivitas antibakteri (Warrier et al. 1996) dan antiinflamasi (Muruganandan et al. 2001). Bagian buah dan biji digunakan untuk pengobatan diabetes (Kedar & Chakrabarti 1983; Nair & Santhakumari 1986; Warrier et al. 1996;) dan memiliki aktivitas antioksidan (Banerjee et al. 2005; Lestario et al. 2005a; Lestario et al. 2005b; Veigas et al. 2007). Bagian daun juga digunakan untuk pengobatan diabetes (Teixeira et al. 1997), konstipasi, dan antibakteri (Warrier et al. 1996).
Untuk melengkapi informasi ilmiah yang sudah dilakukan oleh peneliti sebelumnya maka pada penelitian disertasi ini dilakukan penelitian mengenai potensi buah duwet untuk dikembangkan sebagai pewarna alami pangan berbasis antosianin yang sekaligus dapat memberikan fungsi tambahan sebagai antioksidan yang dapat memberikan efek menguntungkan bagi kesehatan. Hingga saat ini penelitian tentang antosianin buah duwet untuk penggunaan sebagai pewarna pangan alami yang fungsional belum dikaji secara lengkap dan mendalam. Oleh karena itu, perlu dilakukan penelitian mengenai karakterisasi antosianin buah duwet seperti kandungan dan komposisi antosianin buah duwet, karakteristik warna dan stabilitas antosianin buah duwet, upaya perbaikan warna dan stabilitas antosianin buah duwet, serta aktivitas hayati terutama sifat antioksidatifnya sehingga dapat diperoleh informasi yang lengkap untuk melihat potensinya sebagai pewarna pangan yang fungsional.
Tujuan Penelitian
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi bahwa antosianin buah duwet dapat dimanfaatkan untuk pewarna pangan fungsional yang aman dan menyehatkan. Tersedianya pewarna pangan fungsional berbasis antosianin dapat menggantikan pewarna merah sintetik yang masih banyak digunakan di industri pangan serta dapat menambah ketersediaan jumlah pewarna antosianin yang selama ini masih diimpor. Pemanfaatan antosianin buah duwet untuk pewarna pangan diharapkan juga dapat meningkatkan nilai guna dan ekonomis buah duwet.
Ruang Lingkup Penelitian
Pada penelitian ini dilakukan serangkaian kegiatan yang terdiri dari empat kajian, yaitu (1) identifikasi jenis dan komposisi antosianin serta kandungan total antosianin monomerik dalam buah duwet, (2) karakteristik warna dan stabilitas antosianin buah duwet, (3) upaya untuk meningkatkan intensitas dan stabilitas warna antosianin buah duwet melalui reaksi kopigmentasi secara intermolekular, dan (4) untuk melihat fungsi lain dari antosianin buah duwet selain sebagai pewarna maka dilakukan pengujian aktivitas antioksidan dengan menguji kemampuan antosianin buah duwet menangkap radikal bebas (DPPH/difenil pikrilhidrasil dan spesies oksigen reaktif/SOR: O2• dan OH•) dan menghambat oksidasi lipoprotein LDL yang dapat memicu kejadian aterosklerosis.
Tanaman Duwet dan Kegunaan
Tanaman duwet berasal dari daerah subtropis Himalaya, India, Srilangka, Malaysia, Australia dan saat ini telah ditanam di seluruh daerah tropis dan subtropis. Duwet dikenal memiliki berbagai nama di antaranya jambolan (Inggris), jamélongue (Perancis), jamblang atau duwet (Indonesia), jambulana atau jambulan (Malaysia), duhat (Filipina), thabyay-hpyoo (Myanmar), pringbay (Kamboja), wa (Thailand), vói rung atau trám móc (Vietnam) (Verheij & Coronel 1997). Di Indonesia dikenal berbagai nama di antaranya adalah jambolan, jambolana, jamblang, jambul dan jamun. Duwet juga mempunyai banyak nama lokal, di Jawa Barat menamakan duwet sebagai jamblang, nama ini mirip dengan nama jambelang (duwet yang ada di Malaya); di Jawa Tengah menamakan dengan juwet atau duwet, sebutan ini sama dengan sebutan di Jawa Timur; di Madura menamakan duwet sebagai dhalas atau dhuwak; di Bali menamakan duwet dengan jujutan. Ada juga yang menamakan duwet dengan dalas, plum jawa, ataupun anggur sepat.
Duwet termasuk dalam keluarga jambu-jambuan atau Myrtaceae yang biasa berbuah pada musim panas (Kloppenburg-Versteegh 1988). Klasifikasi botani tanaman duwet adalah kingdom Plantae, divisi Magnoliophyta, kelas
Magnoliopsida, ordo Myrtales, famili Myrtaceae, genus Syzygium, dan spesies
Syzygium cumini (L.) Skeels. Sinonim dari Syzygium cumini (L.) Skeels adalah
Myrtus cumini L. (1753), Eugenia jambolana Lamk (1789), Syzygium jambolanum
(Lamk) DC. (1828), dan Eugenia cumini (L.) Druce (1914) (Verheij & Coronel 1997).
Ishwara et al. 2002). Lebih lanjut menurut Verheij dan Coronel (1997); Morton (1987), beberapa nama varietas duwet adalah Early Wild, Late Wild, Pharenda,
Small Jaman, Dabka, Krian Duat, Super Duhat.
Tanaman duwet merupakan tanaman pekarangan atau tumbuh liar di hutan-hutan. Duwet dapat tumbuh baik di daerah tropis pada ketinggian 600 meter diatas permukaan laut, dijumpai juga tumbuh pada ketinggian sampai 1800 meter diatas permukaan laut. Pohon duwet merupakan pohon yang kokoh dengan tinggi 20-30 m dan diameter batangnya 40-90 cm dengan percabangan pohon rendah dan tidak beraturan (Verheij & Coronel 1997). Tanaman buah duwet dapat dikenali dengan daunnya yang tebal bersirip seling dan pada ujungnya sedikit berlekuk. Kayunya diselimuti kulit yang berwarna coklat gelap pada bagian bawah dan agak muda dibagian atasnya, berserat kasar dan keras. Bunganya berwarna putih atau merah. Buahnya sebesar biji rambutan, berwarna ungu tua, berbentuk bulat telur, sering melengkung. Daging buahnya berwarna kuning abu-abu atau ungu muda, berair dengan rasa kelat sedikit asam manis dan hampir tidak beraroma (Tampubolon 1995). Buah duwet memiliki panjang 1-5 cm dan bergerombol mencapai 40 butir. Biji berbentuk lonjong dan panjangnya sampai 3,5 cm, sedikit pahit dan keping biji berwarna hijau sampai coklat (Verheij & Coronel 1997). Gambar tanaman dan buah duwet disajikan pada Gambar 2.1.
Gambar 2.1 Tanamam dan buah duwet.
menunjukkan aktivitas antioksidan (Banerjee at al. 2005; Lestario et al. 2005a; Lestario et al. 2005b; Veigas et al. 2007). Bagian daun juga digunakan untuk pengobatan diabetes (Teixeira et al. 1997), konstipasi, dan antibakteri (Warrier et al. 1996).
Antosianin
Sumber Antosianin
Antosianin (dari bahasa Yunani, anthos = bunga dan kianos = biru) merupakan salah satu kelompok pigmen utama yang tersebar luas pada tanaman terutama pada bagian buah, sayuran, bunga, daun, akar, umbi, legum, dan sereal. Antosianin merupakan pigmen yang larut dalam air yang dapat memberikan warna biru, ungu, violet, merah (Bridle & Timberlake 1997; Crozier 2003; Giusti & Wrolstad 2003). Beberapa bahan pangan yang mengandung pigmen alami antosianin adalah famili Vitaceae (anggur), Rosaceae (cherry, plum, raspberry, strawberi, blackberry, apel, persik), Solanaceae (tamarillo),
Saxifragaceae (red dan black currant), Ericaceae (blueberry, cranberry),
Cruciferae (kubis merah) (Jackman & Smith 1996). Sebanyak 258 antosianin telah ditemukan dalam buah, sayuran, dan biji-bijian (Mazza & Miniati 1993) dan sampai sekarang telah dilaporkan lebih dari 500 antosianin berasal dari berbagai tanaman (Andersen & Jordhein 2006).
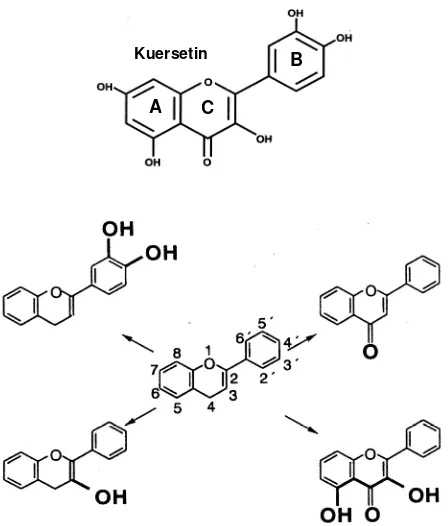
Struktur Kimia Antosianin
(Gambar 2.2). Aglikon (antosianidin) berbeda pada jumlah gugus hidroksil dan metoksil pada cincin B dari kation flavilium (Brouillard 1982; Giusti & Wrolstad 2003).
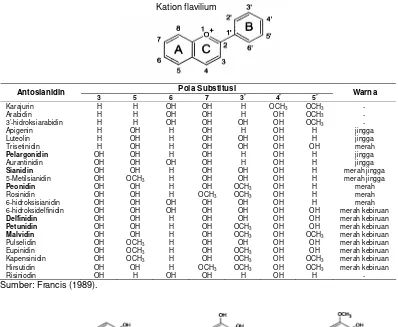
Tabel 2.1 Substitusi kation flavilium untuk membentuk antosianidin
Pola Substitusi Antosianidin
3 5 6 7 3’ 4’ 5’ Warna
Karajurin H H OH OH H OCH3 OCH3 -
Arabidin H H OH OH H OH OCH3
-3’-hidroksiarabidin H H OH OH OH OH OCH3
-Apigenin H OH H OH H OH H jingga
Luteolin H OH H OH OH OH H jingga
Trisetinidin H OH H OH OH OH OH merah
Pelargonidin OH OH H OH H OH H jingga
Aurantinidin OH OH OH OH H OH H jingga
Sianidin OH OH H OH OH OH H merah jingga
5-Metilsianidin OH OCH3 H OH OH OH H merah jingga
Peonidin OH OH H OH OCH3 OH H merah
Rosinidin OH OH H OCH3 OCH3 OH H merah
6-hidroksisianidin OH OH OH OH OH OH H merah
6-hidroksidelfinidin OH OH OH OH OH OH OH merah kebiruan
Delfinidin OH OH H OH OH OH OH merah kebiruan
Petunidin OH OH H OH OCH3 OH OH merah kebiruan
Malvidin OH OH H OH OCH3 OH OCH3 merah kebiruan
Pulselidin OH OCH3 H OH OH OH OH merah kebiruan
Eupinidin OH OCH3 H OH OCH3 OH OH merah kebiruan
Kapensinidin OH OCH3 H OH OCH3 OH OCH3 merah kebiruan
Hirsutidin OH OH H OCH3 OCH3 OH OCH3 merah kebiruan
Risiniodin OH H OH OH H OH H -
Sumber: Francis (1989).
[image:32.595.113.511.179.506.2]
Gambar 2.2 Antosianidin yang umum ada di bahan pangan (Brouillard 1982).
Umumnya antosianidin tidak ditemukan terakumulasi dalam tanaman, pigmen yang ada di bunga, buah, dan sayuran utamanya dalam bentuk glikosilasi. Antosianidin bersifat tidak stabil di air dan sedikit larut dibandingkan
Pelargonidin Sianidin Peonidin
Delfinidin
Malvidin Petunidin
antosianin. Glikosilasi menjadikan pigmen lebih mudah larut dan stabil (Brouillard 1982). Antosianin yang ditemukan pada tanaman pangan umumnya dalam bentuk glikosida dan asilglikosida dari 6 antosianidin (aglikon) utama, yaitu
pelargonidin, sianidin, delfinidin, peonidin, petunidin, dan malvidin (Castaňeda -Ovando et al. 2009).
Antosianin secara umum tersusun dari aglikon (antosianidin), molekul gula, dan pada beberapa antosianin, residu gula diasilasi oleh asam-asam organik. Kebanyakan gugus gula adalah monosakarida seperti glukosa, galaktosa, ramnosa, xilosa dan arabinosa. Di- dan trisakarida yang dibentuk oleh kombinasi dari monosakarida juga dijumpai. Gugus gula terletak pada C-3 dari aglikon. Pada diglikosida, dua monosakarida terletak pada C-3 dan C-5 dan jarang terletak pada C-3 dan C-7. Tetapi ada kemungkinan juga, 2 monosakarida keduanya terletak pada C-3. Pada triglikosida, monosakarida terletak pada aglikon dimana 2 monosakarida pada C-3 dan satu monosakarida pada C-5 atau C-7 (Brouillard 1982). Lebih lanjut menurut De Ancos et al. (1999); Kähkönen et al. (2003), di- dan trisakarida yang sering ditemukan pada antosianin adalah rutinosa, soforosa, sambubiosa, dan glukorutinosa. Gambar 2.3 menunjukkan unit glikosil dari antosianin.
Gambar 2.3 Unit glikosil dari antosianin.
Pada beberapa antosianin, residu gula diasilasi dengan asam-asam aromatik meliputi asam p-kumarat, kafeat, ferulat, sinapat, galat atau p -hidroksibenzoat serta asam-asam alifatik seperti asam malonat, asetat, malat, suksinat, dan oksalat. Asam-asam organik berikatan dengan unit glikosil melalui ikatan ester. Gugus asil umumnya berikatan pada C-3 gugus gula, diesterifikasi pada gugus 6-OH atau 4-OH dari gula. Antosianin dengan dua atau lebih gugus asil telah dilaporkan (Giusti & Wrolstad 2003). Asam fenolik aromatik dan alifatik
β-D-Glukosa α-L-Ramnosa
(6-deoksi-L-Manosa)
β-D-Galaktosa α-L-Arabinosa β-D-Xilosa
Soforosa
β
-D-Glukosil-D-glukosida
Rutinosa
α-L-Ramnosil-
D-glukosida
Sambubiosa
β-Xilosil-
yang umumnya berikatan dengan antosianin ditunjukkan pada Gambar 2.4. Gambar 2.5 menunjukkan beberapa macam antosianin yang berikatan dengan gugus gula dan asam organik.
[image:34.595.114.515.294.700.2]Gambar 2.4 Unit asil yang berikatan dengan antosianin.
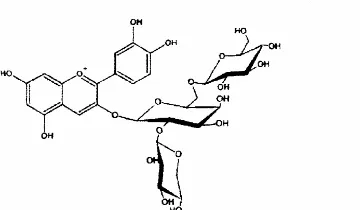
Gambar 2.5 Struktur kimia antosianin.
asam kumarat asam kafeat asam sinapat asam ferulat asam galat
asam asetat asam oksalat asam malonat asam malat asam suksinat
Antosianin monoglukosida Sianidin 3-(2”-xilosil-6”-glukosil)-galaktosida
Malvidin 3,5-diglukosida Sianidin 3-(2”-xilosil-6”-(6-kumaril)-glukosil)-galaktosida
[image:34.595.363.543.303.408.2]Stabilitas dan Kopigmentasi Antosianin
Seperti kebanyakan pewarna alami lainnya, antosianin relatif bersifat tidak stabil dan umumnya antosianin lebih stabil dalam kondisi asam. Warna dan stabilitas antosianin sangat dipengaruhi oleh substituen gugus gula dan asil pada aglikon. Degradasi antosianin terjadi tidak hanya selama ekstraksi dari jaringan tanaman, tetapi juga selama proses dan penyimpanan (Elbe & Schwartz 1996). Hidrolisis gugus gula pada molekul antosianin merupakan penyebab degradasi pigmen selama proses (Garzon & Wrolstad 2001). Antosianin mengalami degradasi dengan beberapa kemungkinan mekanisme yang mengubah warna antosianin menjadi produk larut tidak berwarna atau berwarna cokelat serta produk tidak larut (Jackman & Smith 1996). Faktor-faktor utama yang mempengaruhi degradasi antosianin adalah struktur dan konsentrasi antosianin, pH, suhu, serta keberadaan oksigen dan cahaya. Degradasi enzimatik dan interaksi dengan komponen pangan lainnya (seperti asam askorbat, ion logam, gula serta produk degradasinya, sulfur dioksida, dan kopigmen) sedikit berpengaruh pada degradasi antosianin (Markakis 1982; Francis 1989; Elbe & Schwartz 1996; Jackman & Smith 1996).
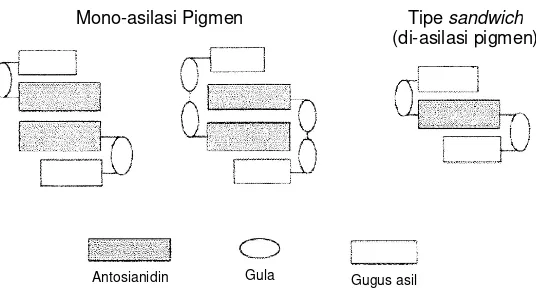
Gambar 2.6 Mekanisme stabilisasi antosianin melalui kopigmentasi intramolekular dan intermolekular (Jackman & Smith 1996).
Gambar 2.7 Mekanisme stabilisasi antosianin terasilasi (kopigmentasi intramolekuler), mono- dan diasil pigmen (Giusti & Wrolstad 2003).
Beberapa sumber bahan pangan yang mengandung antosianin terasilasi (kopigmentasi intramolekular) disajikan pada Tabel 2. Beberapa penelitian juga sudah dilakukan untuk memperbaiki warna dan stabilitas antosianin secara kopigmentasi intermolekuler misalnya antosianin murni yang dikopigmentasi
Penyusunan secara Intramolekular
(Tipe sandwich)
Asilasi
Penyusunan secara Intermolekular
(Tipe kiral)
Kopigmentasi Self-association
Antosianidin Kopigmen
(contoh : flavon) Gugus asil Gula
Antosianidin Gula Gugus asil
Tipe sandwich (di-asilasi pigmen)
Penyusunan secara Intramolekular
[image:36.595.173.441.454.598.2]dengan asam fenolik (Eiro & Heinonen 2002), antosianin murni yang dikopigmentasi dengan senyawa organik pangan (Mazzaracchio et al. 2004), ekstrak antosianin anggur merah yang dikopigmentasi dengan ekstrak polifenol rosemary (Brenes et al. 2005), antosianin beras hitam yang dikopigmentasi dengan asam karboksilat (asam kumarat, asam ferulat, asam sinapat, dan asam lipoat) (Yawadio & Morita 2007), ekstrak antosianin anggur Carbenet Sauvignon
yang dikopigmentasi dengan asam kafeat (Gris et al. 2007).
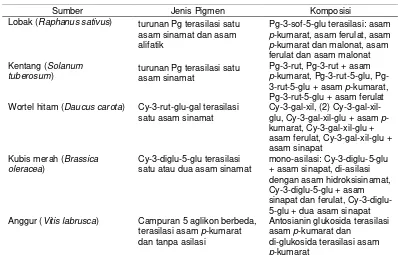
Tabel 2.2 Komposisi antosianin dalam bahan pangan yang mengandung antosianin terasilasi (kopigmentasi intramolekular)
Sumber Jenis Pigmen Komposisi
Lobak (Raphanus sativus) turunan Pg terasilasi satu
asam sinamat dan asam alifatik
Pg-3-sof-5-glu terasilasi: asam
p-kumarat, asam ferulat, asam
p-kumarat dan malonat, asam ferulat dan asam malonat
Kentang (Solanum
tuberosum) turunan Pg terasilasi satu asam sinamat
Pg-3-rut, Pg-3-rut + asam
p-kumarat, 3-rut-5-glu, Pg-3-rut-5-glu + asam p-kumarat, Pg-3-rut-5-glu + asam ferulat Wortel hitam (Daucus carota) Cy-3-rut-glu-gal terasilasi
satu asam sinamat
Cy-3-gal-xil, (2) Cy-3-gal-xil-glu, Cy-3-gal-xil-glu + asam p -kumarat, Cy-3-gal-xil-glu + asam ferulat, Cy-3-gal-xil-glu + asam sinapat
Kubis merah (Brassica oleracea)
Cy-3-diglu-5-glu terasilasi satu atau dua asam sinamat
mono-asilasi: Cy-3-diglu-5-glu + asam sinapat, di-asilasi dengan asam hidroksisinamat, Cy-3-diglu-5-glu + asam sinapat dan ferulat, Cy-3-diglu-5-glu + dua asam sinapat
Anggur (Vitis labrusca) Campuran 5 aglikon berbeda,
terasilasi asam p-kumarat dan tanpa asilasi
Antosianin glukosida terasilasi asam p-kumarat dan
di-glukosida terasilasi asam
p-kumarat
Pg, pelargonidin; sof, soforosa; glu, glukosa; rut, rutinosa; Cy, sianidin; gal, galaktosa; xil, xilosa. Sumber: Giusti dan Wrolstad (2003).
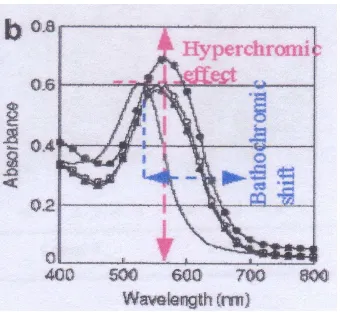
[image:37.595.111.509.271.526.2]Gambar 2.8 Efek hiperkromikdan pergeseran batokromik antosianin beras merah yang dikopigmentasi dengan asam ferulat. = kontrol, -
●
-
= 2 mg/ml asam ferulat, -О- = 4 mg/ml asam ferulat, -▲- = 6 mg/mL asam ferulat (Yawadio & Morita 2007).
Peranan Antosianin
Antosianin telah digunakan secara luas sebagai pewarna alami untuk pangan selain kurkumin, lutein, karotenoid, betalain, klorofil, gula karamel, anato (Henry 1996; Bridle & Timberlake 1997; Mateus & Freitas 2009). Antosianin telah banyak digunakan oleh industri makanan untuk mewarnai makanan yang dihasilkan seperti pada produk minuman, confectionary, dessert, snack serta produk pangan lainnya (Henry 1996). Beberapa bahan pangan sudah digunakan secara komersial di Amerika Serikat sebagai bahan baku pewarna alami berbasis antosianin seperti kulit anggur, kubis merah, dan wortel hitam (Delgado-Vargas & Paredes-Lopez 2003).
Selain sebagai pewarna, antosianin juga memiliki peranan penting untuk kesehatan manusia (Kong et al. 2003). Konsumsi bahan pangan dan minuman yang mengandung antosianin dapat mengurangi resiko dari beberapa penyakit degeneratif seperti aterosklerosis, penyakit jantung, kanker, dan diabet. Antosianin dikenal sebagai senyawa penangkap (scavenger) radikal bebas dan juga dilaporkan potensial sebagai agensia kemopreventif (Jayaprakasam et al. 2005). Beberapa penelitian telah melaporkan aktivitas biologis dari antosianin seperti seperti aktivitas antioksidan dan scavenging radikal (Wang et al. 1997; Wang et al. 1999, Espin et al. 2000, Kong et al. 2003; Bao et al. 2005), antiinflamasi (Wang et al. 1999), antikarsinogenik (Wang & Mazza 2002; Katsube
hepatoprotektif (Kong et al. 2003). Antosianin juga dapat mengurangi resiko penyakit jantung koroner melalui aktivitas vasoprotektif (Lietti et al. 1976) dan penghambatan agregasi platelet (Morazzoni & Magistretti 1990; Ghiselli et al. 1998) dan penghambatan oksidasi lipoprotein LDL (low density lipoprotein) (Abuja et al. 1998; Ghiselli et al. 1998; Heinonen et al. 1998).
Pewarna Pangan
Warna di dalam bahan pangan merupakan salah satu faktor yang penting dalam menentukan kualitas bahan pangan disamping tekstur, rasa, dan atribut sensori lainnya. Warna pada bahan pangan dapat disebabkan oleh pigmen alami atau pewarna yang sengaja ditambahkan (DeMan 1997; Joshi & Brimelow 2002). Warna suatu senyawa organik disebabkan oleh adanya gugus-gugus tertentu dalam molekulnya yang dikenal dengan gugus pembawa warna (gugus kromofor). Dalam suatu senyawa zat warna, bagian dari molekul yang mengandung gugus kromofor disebut kromogen. Untuk menimbulkan warna, cukup dengan adanya satu gugus kromofor pada inti. Suatu zat warna biasanya mengandung lebih dari satu gugus kromofor (Woodroof & Philips 1975). Kromofor mengandung banyak ikatan rangkap terkonjugasi yang dapat menyerap atau memantulkan sinar.
International Food Information Council Foundation/IFIC (1994) mendefinisikan pewarna pangan sebagai zat yang digunakan untuk memberikan atau meningkatkan warna suatu produk pangan sehingga menciptakan image
tertentu dan membuat produk lebih menarik. Pewarna ditambahkan dalam produk pangan umumnya bertujuan untuk: (1) memperkuat warna yang sudah
ada pada produk pangan yang mempunyai intensitas warna rendah, (2) memperoleh warna yang seragam pada produk pangan, (3) memperbaiki
penampakan produk pangan yang warnanya telah berubah akibat pengolahan, (4) memberikan warna pada produk pangan yang tidak berwarna (Henry 1996).
Schwartz (1996); Nielsen et al. (2002), ada dua kategori pewarna yaitu certified colorants dan uncertified colorants. Certified colorants merupakan pewarna yang membutuhkan sertifikasi dari FDA (Food and Drugs Administration) untuk penggunaannya di dalam bahan pangan. Pewarna yang termasuk dalam certified colorants adalah pewarna sintetik seperti FD&C dye dan FD&C lake. FD&C dye
memiliki sifat mudah larut dalam air sedangkan FD&C lake memiliki sifat tidak mudah larut dalam air/larut dalam minyak. Uncertified colorants merupakan pewarna yang tidak membutuhkan sertifikasi dari FDA untuk penggunaan dalam bahan pangan. Pewarna yang bebas dari sertifikasi adalah pewarna alami/pigmen alami (dari tanaman dan hewan) dan pewarna identik-alami seperti
β-karoten. Contoh pewarna yang termasuk certified colorants dan uncertified colorant dapat dilihat pada Tabel 2.3 dan 2.4.
Tabel 2.3 Certified colorants yang diijinkan untuk digunakan Status
Pewarna
Dye Lake
FD&C Blue No. 1 Tetap sementara
FD&C Blue No. 2 Tetap sementara
FD&C Green No. 3 Tetap sementara
FD&C Red No. 3 Tetap sementara
D&C Red No. 40 Tetap sementara
FD&C Yellow No. 5 Tetap sementara
FD&C Yellow No. 6 Tetap sementara
Sumber: Elbe dan Schwartz (1996).
Tabel 2.4 Pewarna alami (uncertified colorants) untuk makanan dan minuman (didaftar oleh FDA)
Pewarna Alami
Ekstrak anato Β-Apo-8’-karotenala Β-karotena
Bubuk bit Kantaxantina Karamel Minyak wortel
Cochineal, karmin
Tepung biji kapas, dipanggang Jus buah dan sayuran
Ekstrak warna anggur Ekstrak kulit anggur
Paprika dan oleoresin paprika Riboflavin
Safron
Kunyit dan oleoresin kunyit
a
hanya sebagai pewarna identik-alami
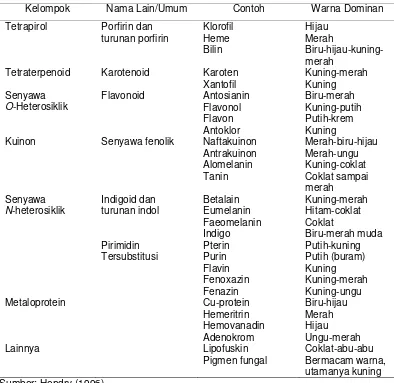
Lebih lanjut menurut DeMan (1997), pewarna alami atau pigmen alami dapat digolongkan menjadi beberapa kelas berdasarkan struktur kimia yang berupa turunan tetrapirol (klorofil, heme, bilin), turunan isoprenoid (karotenoid), turunan benzopiran (antosianin dan flavonoid), turunan artifisial (melanoidin dan karamel), dan turunan lainnya seperti betalain. Sedangkan menurut Hendry (1996), pigmen alami diklasifikasikan berdasarkan struktur utamanya meliputi tetrapirol, tetra-terpenoid, kuinon, O-heterosiklik, N-heterosiklik dan metalo-protein. Klasifikasi pigmen alami secara lengkap disajikan pada Tabel 2.5.
Tabel 2.5 Klasifikasi pigmen alami
Kelompok Nama Lain/Umum Contoh Warna Dominan
Tetrapirol Porfirin dan turunan porfirin Klorofil Heme Bilin Hijau Merah Biru-hijau-kuning- merah
Tetraterpenoid Karotenoid Karoten Xantofil
Kuning-merah Kuning Senyawa
O-Heterosiklik
Flavonoid Antosianin
Flavonol Flavon Antoklor Biru-merah Kuning-putih Putih-krem Kuning
Kuinon Senyawa fenolik Naftakuinon
Antrakuinon Alomelanin Tanin Merah-biru-hijau Merah-ungu Kuning-coklat Coklat sampai merah Senyawa N-heterosiklik Indigoid dan turunan indol Betalain Eumelanin Faeomelanin Indigo Kuning-merah Hitam-coklat Coklat Biru-merah muda Pirimidin Tersubstitusi Pterin Purin Flavin Fenoxazin Fenazin Putih-kuning Putih (buram) Kuning Kuning-merah Kuning-ungu
Metaloprotein Cu-protein
Hemeritrin Hemovanadin Adenokrom Biru-hijau Merah Hijau Ungu-merah
Lainnya Lipofuskin
Pigmen fungal
Radikal Bebas dan Sistem Antioksidan
Radikal bebas didefinisikan sebagai spesies atau molekul yang mengandung satu atau lebih elektron yang tidak berpasangan pada orbital luarnya (Halliwell & Gutteridge 2006). Elektron yang tidak berpasangan selalu mencari elektron lainnya sehingga menjadi berpasangan, sehingga radikal bebas umumnya bersifat reaktif dan menyerang molekul lain. Ada beberapa radikal yang tidak reaktif dan cukup stabil untuk waktu yang lama (Noguchi & Niki 1998). Sebagian besar molekul oksigen reaktif bersifat radikal. Contoh radikal oksigen (spesies oksigen reaktif/SOR) meliputi anion superoksida (O2•-), peroksil (ROO•), alkoksil (RO•), hidroksil (HO•) dan nitrik oksida (NO•). Radikal hidroksil dan alkoksil sangat reaktif dan dengan cepat menyerang molekul lain. Sebaliknya anion superoksida, lipid hidroperoksida, dan nitrat oksida sedikit reaktif. Di dalam organisme hidup terdapat juga spesies oksigen lain yang non-radikal seperti oksigen singlet (1O2), hidrogen peroksida (H2O2), dan asam hipoklorit (HOCl) (Pietta 2000). Spesies oksigen reaktif (SOR) dibedakan menjadi dua yaitu radikal oksigen dan non-radikal turunan dari O2. Dengan kata lain, semua radikal oksigen adalah SOR tetapi tidak semua SOR adalah radikal oksigen (Halliwell & Gutteridge 2006). Pada Tabel 2.6 disajikan beberapa spesies oksigen dan nitrogen reaktif.
Tabel 2.6 Spesies oksigen dan nitrogen reaktif
Radikal bebas Non-radikal
SOR (spesies oksigen reaktif) SOR (spesies oksigen reaktif)
Superoksida, O2•- Hidrogen peroksida, H2O2
Hidroksil, OH• Ozon, O3
Hidroperoksil, HO2• Oksigen singlet, 1O2
Peroksil, RO2• Asam peroksinitrit, ONOOH
Alkoksil, RO•
SNR (spesies nitrogen reaktif) SNR (spesies nitrogen reaktif)
Nitrogen dioksida, NO2• Asam nitrous, HNO2
Nitrik oksida, NO• Peroksinitrit, ONOO
-Nitarat radikal, NO3•
Sumber: Halliwell (2006).
Sumber eksogen radikal bebas berasal dari asap rokok, polusi, radiasi, olah raga berlebihan, diet tinggi asam lemak tidak jenuh ganda (ALTJ), reperfusi, dan karsinogen (Langseth 1995; Kevin et al. 2007).
Pada keadaan normal, secara fisiologis sel memproduksi radikal bebas sebagai konsekuensi logis pada reaksi biokimia dalam kehidupan aerobik. Radikal bebas tersebut memiliki peran fisiologis pada fagositosis, fertilitas, sintesa DNA dan protein (Halliwell & Gutteridge 1990). Lebih lanjut dijelaskan oleh Pietta (2000); Papas (1998), spesies oksigen reaktif berperan positif secara
in vivo yaitu terlibat dalam produksi energi, fagositosis, pengaturan pertumbuhan sel, signaling intercelluler, dan sintesis senyawa-senyawa penting secara biologis.
Bagaimanapun, radikal bebas dan SOR sangat berbahaya karena dapat menyerang lemak di dalam membran sel, protein dalam jaringan atau enzim, karbohidrat, dan DNA yang menginduksi oksidasi sehingga menyebabkan kerusakan membran, modifikasi protein (termasuk enzim), dan kerusakan DNA. Kerusakan oksidatif ini berperan sebagai penyebab penuaan dini dan beberapa penyakit degeneratif seperti penyakit jantung, katarak, disfungsi kognitif, dan kanker (Pietta 2000). Lebih lanjut menurut Halliwell dan Gutteridge (1990), dalam upaya penstabilan diri atau pemenuhan keganjilan elektronnya, elektron yang tidak berpasangan pada radikal bebas secara cepat ditransfer atau menarik elektron makromolekul biologis disekitarnya seperti asam lemak tak jenuh ganda (ALTJ), protein, asam nukleat dan asam deoksiribonukleat (DNA). Makromolekul yang teroksidasi akan terdegradasi dan jika makromolekul tersebut merupakan bagian dari sel atau organelnya maka berakibat pada kerusakan sel.
Di dalam organisme aerobik yang sehat, produksi spesies oksigen reaktif (SOR) dan spesies nitrogen reaktif (SNR) diseimbangkan oleh sistem pertahanan antioksidan tubuh. Sistem pertahanan antioksidan ini tidak selalu sempurna sehingga keseimbangan terganggu. Kondisi ini disebut sebagai kondisi stres oksidatif, terjadi ketidakseimbangan antara produksi SOR/SNR dan sistem pertahanan antioksidan. Kondisi stres oksidatif ini dapat memicu kerusakan secara oksidatif (Halliwell & Gutteridge 2006).
hidrogen peroksida, dan lipid peroksida sehingga mencegah pembentukan radikal toksik hidroksil, serta b) sistem pertahanan antioksidan non-enzimatis seperti glutation, histidin-peptida, melatonin. Antioksidan eksogenus yang berasal dari pangan diperlukan untuk melengkapi efisiensi antioksidan endogenus. Antioksidan yang berasal dari pangan dapat berupa vitamin C, E, A, karotenoid, serta polifenol (Pietta 2000; Papas 1998).
Penangkap (scavenger) radikal bebas adalah suatu substansi atau molekul yang dapat bereaksi dengan radikal bebas dan berfungsi menetralkan radikal bebas atau disebut antioksidan. Sistem antioksidan tubuh melindungi jaringan dari efek negatif radikal bebas. Ada 3 kelompok antioksidan dalam tubuh yaitu :
1) Antioksidan primer yang bekerja dengan cara mencegah pembentukan radikal bebas baru. Antioksidan ini mengubah radikal bebas menjadi molekul yang kurang berbahaya sebelum radikal bebas tersebut mempunyai kesempatan bereaksi atau mencegah pembentukan radikal bebas baru dari molekul lain. Contoh antioksidan primer adalah superoksida dismutase (SOD) dan glutation peroksidase (GPx).
a. Superoksida dismutase (SOD) terdapat dalam sitosol dan mitokondria dimana enzim ini mengubah O2•- menjadi hidrogen peroksida (H2O2). 2O2•- + 2H+ H2O2 + O2
b. Glutation peroksidase (GPx) yang mengubah hidrogen peroksida dan lipid peroksida menjadi molekul yang kurang berbahaya sebelum membentuk radikal bebas.
2GSH + H2O2 GSSG + 2H2O
LOOH + 2GSH LOH + GSSG + H2O
GSH mempunyai peran penting dalam metabolisme xenobiotik dan sintesis leukotrin dan ditemukan dalam sel manusia. GPx mengandung selenium yang diperlukan dalam fungsi katalitiknya.
2) Antioksidan sekunder, antioksidan yang menangkap radikal bebas dan mencegah terjadinya reaksi rantai. Contohnya adalah vitamin E (α-tokoferol), vitamin C, β-karoten, asam urat, bilirubin, albumin, serta berbagai macam antioksidan alami yang sudah ditemukan sekarang termasuk antioksidan polifenol yang dapat beraksi menghentikan reaksi radikal bebas (Shahidi & Naczk 1995).
Radikal tokoferol akan dihilangkan oleh vitamin C:
Tokoferol - O• + Vitamin C Tokoferol - OH + Vitamin C• Radikal tokoferol juga dapat dihilangkan oleh ubiquinol dalam mitokondria:
Tokoferol -O• + CoQH2 Tokoferol-OH + CoQH•
3) Antioksidan tersier, antioksidan ini akan memperbaiki kerusakan biomolekuler yang disebabkan oleh radikal. Contohnya enzim-enzim yang memperbaiki DNA dan metionin sulfoksida reduktase (Randox 1994; Nabet 1996; Asikin 2001).
Mekanisme Antioksidan Polifenol
Flavonoid dapat berperan mengurangi radikal bebas seperti radikal superoksida, peroksil, alkoksil, dan hidroksil dengan menyumbangkan atom hidrogennya: Fl-OH + R• Fl-O• + RH, Fl-OH adalah flavonoid dan R• adalah radikal superoksida, peroksil, alkoksil, dan hidroksil. Aroksil radikal (Fl-O•) beraksi dengan radikal lainnya membentuk struktur kuinon yang stabil, Gambar 2.9 (Pietta 2000).
Gambar 2.9 Penangkapan spesies oksigen reaktif/SOR (R•) oleh senyawa flavonoid (Pietta 2000).
Gambar 2.10 Struktur dasar utama yang berhubungan dengan aktivitas antioksidan flavonoid (Bravo 1998).
A C
B
PENDAHULUAN
Antosianin adalah pigmen yang termasuk dalam kelompok flavonoid dari senyawa polifenol merupakan glikosida dari turunan polihidroksi dan polimetoksi dari kation 2-fenilbenzopirilium atau kation flavilium (Brouillard 1982; Kong et al. 2003). Antosianin yang ditemukan pada tanaman pangan umumnya dalam bentuk glikosida dan asilglikosida dari 6 antosianidin (aglikon) utama, yaitu pelargonidin, sianidin, delfinidin, peonidin, petunidin, dan malvidin (Castaňeda -Ovando et al. 2009). Sebanyak 258 antosianin telah ditemukan dalam buah, sayuran, dan biji-bijian (Mazza & Miniati 1993) dan sampai sekarang telah dilaporkan lebih dari 500 antosianin berasal dari berbagai tanaman (Andersen & Jordhein 2006).
Sejumlah kajian telah mengidentifikasi antosianin dalam beberapa bahan pangan dan pewarna yang mengandung antosianin dengan menggunakan kromatografi cair kinerja tinggi-diode array detection (KCKT-DAD) (Hong & Wrolstad 1990a; Hong & Wrolstad 1990b) dan kromatografi cair kinerja
tinggi-electrospray ionization tandem mass spectrometry (KCKT-ESI-MS/MS) (Giusti et al. 1999; Wu & Prior 2005a; Wu & Prior 2005b). Selain itu, antosianin dapat diidentifikasi dengan menggabungkan metode KCKT dan elusidasi struktur menggunakan spektrometer resonans magnetik inti (Cabrita & Andersen 1999; Cabrita et al. 2000; Hanamura et al. 2005; Lee et al. 2009). Identifikasi antosianin diperlukan untuk mengetahui struktur dan komposisi antosianin dalam suatu bahan pangan karena ciri kimia antosianin berhubungan dengan kestabilan dan aktivitas hayati dari antosianin.
Tujuan dari penelitian ini adalah untuk menentukan kandungan total antosianin monomerik secara spektrofotometri dan mengidentifikasi antosianin buah duwet yang tumbuh di Indonesia dengan menggunakan KCKT-DAD. Identifikasi antosianin dilakukan untuk konfirmasi sehingga diperoleh informasi jenis dan komposisi antosianin buah duwet secara pasti.
BAHAN DAN METODE
Tempat Penelitian
Penelitian dilakukan di Laboratorium Kimia Pangan SEAFAST Center
(Gedung PAU), IPB; Laboratorium Biokimia Pangan, Departemen ITP, FATETA, IPB; Laboratorium Terpadu Mikrobiologi Medik, Fakultas Kedokteran Hewan, IPB; dan Laboratorium Kimia-Biokimia jurusan TPHP, FTP, Universitas Gadjah Mada.
Bahan dan Alat Penelitian
Bahan utama yang digunakan pada penelitian ini adalah buah duwet matang berwarna ungu kehitaman yang diperoleh dari hutan di Probolinggo, Jawa Timur. Sampel buah duwet telah mendapat pengesahan determinasi jenis tanaman dari LIPI Biologi, Bogor.
Bahan kimia yang digunakan berspesifikasi pro analisis. Metanol, asam klorida (HCl), kalium klorida (KCl), natrium asetat, etil asetat, 2-propanol, asam ortofosfat, asetonitril, asam asetat, aluminum klorida (AlCl3), asam format, difenilamin, piridin, dan anilin diperoleh dari Merck (Darmstadt, Germany). Standar antosianidin (delfinidin, sianidin, dan pelargonidin) diperoleh dari Extrasynthese (France). Gas nitrogen diperoleh dari suplier bahan kimia di Bogor.
Peralatan yang digunakan adalah pisau baja tahan-karat, hand blender, pengering beku, timbangan analitik, pengaduk/stirer, batang stirer, sentrifugasi, kertas Whatman no 1, pompa vakum, vakum evaporator putar, pH-meter, pipet mikrometer, vortek, spektrofotometer UV-Vis, SPE (solid-phase extraction), C18 Sep-Pak cartridge, penangas air, plat kromatografi lapis tipis (KLT) ODS dan silika gel, wadah pengembang, penyemprot KLT, membran filter PP Whatman 0,45 m, seperangkat kromatografi cair kinerja tinggi-diode array detection
Metode Penelitian
Persiapan sampel
Buah duwet disortasi, dic