ALAMI YANG MEMILIKI KEMAMPUAN
ANTIOKSIDASI
PUSPITA SARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Dengan ini saya menyatakan bahwa disertasi Potensi Antosianin Buah
Duwet (Syzygium cumini) sebagai Pewarna Pangan Alami yang Memiliki Kemampuan Antioksidasi adalah karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Februari 2011
Puspita Sari NIM F261060041
PUSPITA SARI. The Potency of Jambolan (Syzygium cumini) Fruit
Anthocyanins as Natural Food Colorant with Antioxidation Capability.
Under the directions of CHRISTOFORA HANNY WIJAYA, DONDIN SAJUTHI, and UNANG SUPRATMAN.
There is a worldwide interest in the use of natural red colorant in foods. Anthocyanins have been suggested as potential colorants due to their attractive red colors and non-toxicity. Jambolan (Syzygium cumini) fruit, a tropical fruit is found in Indonesia, is rich in anthocyanin pigments especially in its peel part. It has a potency for natural food colorant. In this study, the utilization of jambolan anthocyanins for natural food colorant was studied. The anthocyanins of jambolan fruit were characterized for their composition, stability properties, improvement of color intensity and stability through intermolecular copigmentation reaction, and capability as antioxidant. The content of total monomeric anthocyanin in the ripe fruit was 161 mg/100 g fresh fruit (731 mg/100 g skin on wet basis). Anthocyanins were identified as 3,5-diglucoside derivatives of delphinidin (41%), petunidin (28%), malvidin (26%), cyanidin (4%), and peonidin (1%). Native jambolan anthocyanins had low color intensity with pH ranging from 1 to 8 and relatively unstable during heating at 80 and 98oC, exposed to white fluorescent light and storage at room and refrigeration temperature, absence of light. However, they showed better stability to all treatments tested than enocianin, a commercial anthocyanin colorant. During light exposure and storage treatment, native jambolan anthocyanins showed comparable stability to red cabbage anthocyanins (acylated structure). Intermolecular copigmentation of jambolan anthocyanins with cinnamic acid (sinapic acid, ferulic acid, caffeic acid) and rosemary polyphenol extract increased the color intensity. Copigmentation with rosemary polyphenol extract produced the best color enhancement. Copigmentation with sinapic acid, caffeic acid, and rosemary polyphenol extract also increased stability on light exposure and storage treatments (room and refrigeration temperatures), not on heat treatments at 80 and 98oC. Moreover, jambolan anthocyanins, native or copigmented, in the form of extract, isolate, or added to a model beverage as colorant showed antioxidant activities. The anthocyanin isolate showed higher antioxidant activity as compared to extract from pulp or peel. Copigmentation jambolan anthocyanins with sinapic acid, caffeic acid, ferulic acid, and rosemary polyphenol extract on a model beverage increased the total polyphenol content and antioxidant activity as compared to model beverage with native anthocyanins. These results indicated that anthocyanins obtained from jambolan fruit can be utilized as a functional natural colorant for low pH foods.
Keywords: Syzygium cumini, anthocyanin, color stability, copigmentation intermolecular, antioxidant activity, functional natural food colorant
Pewarna Pangan Alami yang Memiliki Kemampuan Antioksidasi. Dibimbing
oleh CHRISTOFORA HANNY WIJAYA, DONDIN SAJUTHI, dan UNANG SUPRATMAN.
Buah duwet (Syzygium cumini) mengandung antosianin terutama pada bagian kulit. Buah duwet matang memiliki kulit berwarna ungu kehitaman menunjukkan adanya kandungan antosianin. Antosianin telah digunakan secara luas sebagai pewarna alami yang aman untuk pangan serta menunjukkan aktivitas biologis. Penelitian tentang antosianin buah duwet untuk penggunaan sebagai pewarna pangan alami yang fungsional belum dikaji secara lengkap dan mendalam. Untuk itu, penelitian ini dilakukan untuk mengetahui potensi antosianin buah duwet sebagai pewarna pangan alami yang fungsional dengan melakukan karakterisasi antosianin buah duwet meliputi identifikasi jenis dan komposisi antosianin, stabilitas warna antosianin, perbaikan intensitas dan stabilitas warna antosianin, serta aktivitas antioksidatif.
Identifikasi jenis dan komposisi antosianin buah duwet dilakukan menggunakan kromatografi cair kinerja tinggi-diode array detection (KCKT-DAD), analisis spektral UV-visibel, dan reaksi fisiko-kimia. Untuk keperluan identifikasi, antosianin diekstraksi secara maserasi menggunakan pelarut metanol yang mengandung 0,1% HCl. Selanjutnya ekstrak dipurifikasi menggunakan solid
phase extraction (SPE) dengan C18 Sep-Pak cartridge.
Untuk pengujian warna dan stabilitas antosianin, antosianin buah duwet diekstraksi menggunakan pelarut etanol secara maserasi. Karakteristik warna dan stabilitas antosianin buah duwet dibandingkan dengan antosianin kubis merah dan pewarna enosianin (pewarna antosianin komersial). Warna antosianin buah duwet dan sampel pembanding dikarakterisasi pada kisaran nilai pH 1-8 menggunakan larutan buffer potasium klorida (pH 1-4) dan buffer sodium asetat (pH 5-8). Karakteristik warna diukur menggunakan spektrofotometer pada panjang gelombang 350-700 nm untuk mendapatkan pola spektra. Pengujian stabilitas warna antosianin dilakukan dalam minuman model (buffer sitrat, pH 3) terhadap pengaruh suhu pemanasan (80 dan 98oC), pencahayaan dengan lampu fluoresens putih, dan kondisi penyimpanan (suhu refrigerasi dan ruang). Analisis stabilitas meliputi retensi warna, indeks degradasi, warna polimerik (metode
bleaching bisulfit), dan warna kromasitas (CIELAB). Waktu paruh (t1/2) dihitung berdasarkan kinetika reaksi orde pertama.
Perbaikan intensitas dan stabilitas warna antosianin buah duwet dilakukan melalui reaksi kopigmentasi intermolekular dengan menggunakan kopigmen: asam sinamat (asam sinapat, asam kafeat, asam ferulat) dan ekstrak polifenol rosemary. Larutan antosianin dalam bufer sitrat pH 3 ditambahkan kopigmen (konsentrasi 0; 0,5; 1; 1,5; 2; 2,5; 3; 3,5; dan 4 mg/mL) lalu diinkubasi selama 60 menit pada 27oC. Untuk melihat interaksi antara antosianin dan kopigmen (pembentukan kompleks antosianin-kopigmen) dianalisa spektra absorpsi menggunakan spektrofotometer UV-visibel (efek hiperkromik/ΔA dan pergeseran batokromik/Δλvis-maks). Warna yang dihasilkan dari kompleks antosianin-kopigmen diuji stabilitas terhadap pengaruh pemanasan (suhu 80 dan 98oC), pencahayaan dengan lampu fluoresens putih, dan kondisi penyimpanan (suhu refrigerasi dan ruang) dengan menganalisa retensi warna, warna polimerik, warna kromasitas, serta menghitung waktu paruh (t1/2) berdasarkan kinetika reaksi orde pertama.
Sep-Pak cartridge untuk memperoleh fraksi polifenol antosianin dan fraksi polifenol non-antosianin. Ekstrak dan fraksi polifenol dianalisa kandungan total polifenol (metode folin-ciocalteau), kandungan total antosianin monomerik (metode perbedaan pH), serta aktivitas antioksidan. Aktivitas antioksidan dianalisa berdasarkan kemampuan scavenging terhadap radikal bebas difenil pikrilhidrasil (DPPH), radikal hidroksil/OH• (metode deoksiribosa), dan radikal anion superoksida/O2• yang dihasilkan dari reaksi enzimatis xantin oksidase-hipoxantin. Selain itu juga dilakukan pengujian aktivitas penghambatan peroksidasi lipid menggunakan lipoprotein LDL dengan mengukur produk oksidasi sekunder, malonaldehid. Minuman model yang diberi warna antosianin buah duwet (tanpa kopigmentasi dan terkopigmentasi intermolekular) juga diuji kandungan total antosianin dan total polifenol, serta aktivitas antioksidan berdasarkan kemampuan scavenging radikal DPPH.
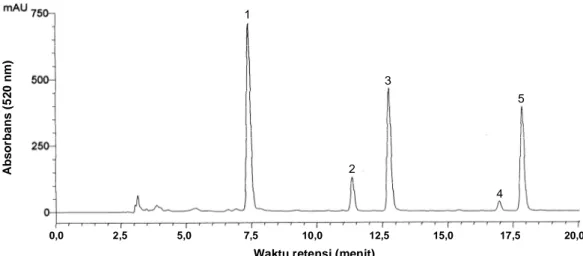
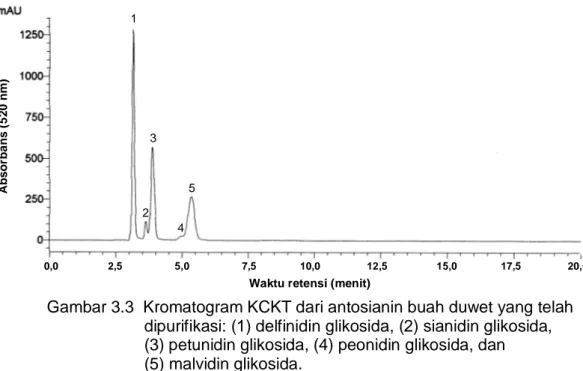
Kandungan total antosianin monomerik buah duwet matang rata-rata sebesar 161 mg/100 g buah segar (bb) dan pada bagian kulit sebesar 731 mg/100 g kulit buah (bb). Bagian kulit buah duwet mengandung antosianin ~4.5 kali lebih banyak dibandingkan buah utuh. Kulit buah duwet mengandung antosianin lebih tinggi dibandingkan pada anggur yang mengandung antosianin pada kisaran nilai 6-600 mg/100 g. Kulit buah duwet memiliki potensi untuk digunakan sebagai bahan baku sumber antosianin. Komposisi antosianin buah duwet terdiri dari delfinidin-3,5-diglukosida (41%), petunidin-3,5-diglukosida (28%), malvidin-3,5-diglukosida (26%), sianidin-3,5-diglukosida (4%), dan peonidin-3,5-diglukosida (1%). Delfinidin-3,5-diglukosida, petunidin-3,5-diglukosida, dan malvidin-3,5-diglukosida merupakan antosianin utama buah duwet.
Warna antosianin buah duwet dipengaruhi oleh pH. Nilai absorbans antosianin buah duwet pada nilai pH 1-2 menunjukkan nilai yang tinggi dan berwarna merah. Peningkatan pH hingga pH 6 menunjukkan penurunan nilai absorbans dan warna menjadi pudar serta menjadi tidak berwarna pada pH 4-6. Pada nilai pH 7-8 terjadi peningkatan nilai absorbans pada kisaran λ 570-600 nm dan warna antosianin berubah menjadi biru. Antosianin buah duwet mempunyai intensitas warna merah atau biru yang lebih rendah pada nilai pH 1-8 dibandingkan antosianin kubis merah dan pewarna enosianin. Struktur antosianin buah duwet dalam bentuk glikosilasi 3,5-diglukosida menyebabkan intensitas warna rendah. Pada pengujian stabilitas menunjukkan warna antosianin buah duwet relatif tidak stabil selama perlakuan pemanasan, pencahayaan, dan penyimpanan. Antosianin buah duwet menunjukkan karakteristik warna yang lebih stabil dibandingkan antosianin pewarna enosianin. Struktur antosianin buah duwet dalam bentuk glikosilasi 3,5-diglukosa menjadikan antosianin buah duwet lebih stabil. Stabilitas warna antosianin buah duwet sebanding dengan stabilitas warna antosianin kubis merah terutama pada perlakuan pencahayaan dan penyimpanan. Penyimpanan pada suhu refrigerasi memberikan karakteristik stabilitas warna yang lebih tinggi dibandingkan pada penyimpanan suhu ruang.
Adanya kompleks antosianin-kopigmen yang terbentuk melalui interaksi intermolekular dapat meningkatkan intensitas warna dan menstabilkan antosianin buah duwet. Kopigmentasi intermolekular dengan asam sinapat, asam ferulat, asam kafeat, dan ekstrak polifenol rosemary menyebabkan terjadinya pergeseran panjang gelombang (efek batokromik) yang ditunjukkan adanya perubahan nilai Δλvis-maks pada kisaran 1,16-1,94% serta meningkatnya nilai absorbans pada λmaks (efek hiperkromik) yang ditunjukkan dari nilai ΔA yang
ekstrak polifenol rosemary memberikan peningkatan nilai absorbans pada λvis-maks yang paling besar hingga ~120% pada konsentrasi 4 mg/ml. Pengujian stabilitas warna kompleks antosianin-kopigmen menunjukkan bahwa dengan penambahan kopigmen asam sinapat, asam kafeat, dan ekstrak polifenol rosemary (konsentrasi 1 mg/ml) dapat meningkatkan stabilitas warna pada perlakuan pencahayaan dan penyimpanan, sedangkan pada perlakuan pemanasan tidak meningkatkan stabilitas warna antosianin.
Buah duwet mengandung senyawa polifenol utamanya antosianin sebesar ~83%. Antosianin buah duwet memberikan kontribusi utama terhadap aktivitas antioksidan. Ekstrak dan isolat antosianin buah duwet yang utamanya mengandung senyawa polifenol antosianin dapat digunakan sebagai pewarna pangan. Ekstrak dan isolat antosianin buah duwet menunjukkan aktivitas antioksidan yang diuji berdasarkan kemampuan dalam scavenging radikal DPPH, hidroksil (OH•), dan superoksida (O2•), serta menghambat oksidasi lipoprotein LDL. Isolat antosianin buah duwet yang mengandung lima jenis antosianin menunjukkan aktivitas antioksidan lebih tinggi dibandingkan ekstrak antosianin buah duwet dan ekstrak antosianin kubis merah serta mempunyai aktivitas sedikit lebih rendah dibandingkan dengan sampel standar, katekin dan asam askorbat. Ekstrak kulit duwet memiliki aktivitas antioksidan sedikit lebih rendah dibandingkan dengan ekstrak kubis merah. Antosianin buah duwet (tanpa kopigmentasi dan terkopigmentasi intermolekular) yang ditambahkan ke dalam minuman model sebagai pewarna juga menunjukkan aktivitas antioksidan. Perlakuan kopigmentasi (intermolekular) pada minuman model menggunakan asam sinamat dan ekstrak polifenol rosemary dapat meningkatkan kandungan total polifenol dan aktivitas antioksidan, serta tidak dijumpai adanya efek sinergisme.
Antosianin yang utamanya terkandung dalam kulit buah duwet dapat dikembangkan sebagai pewarna alami untuk pangan yang sekaligus memiliki aktivitas antioksidan (pewarna pangan fungsional). Pewarna berbasis antosianin buah duwet dapat digunakan untuk mewarnai produk pangan berbasis asam untuk memberikan warna merah. Untuk memperoleh warna merah yang kuat, lebih stabil, serta aktivitas antioksidan yang lebih tinggi dapat digunakan asam sinapat, asam kafeat, dan ekstrak polifenol rosemary sebagai kopigmen (kopigmentasi intermolekular).
Keywords: Syzygium cumini, buah duwet, antosianin, stabilitas warna, kopigmentasi intermolekular, aktivitas antioksidan, pewarna pangan fungsional
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk laporan apa pun tanpa izin IPB.
ALAMI YANG MEMILIKI KEMAMPUAN
ANTIOKSIDASI
PUSPITA SARI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi/Mayor Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Penguji Luar Komisi Ujian Tertutup: Dr. Ir. Nuri Andarwulan, MSi.
(Departemen Ilmu dan Teknologi Pangan, FATETA, IPB)
Prof. Dr. Suminar Setiati Achmadi (Departemen Kimia, FMIPA, IPB) Penguji Luar Komisi Ujian Terbuka: Prof. Dr. Ir. Latifah K. Darusman (Departemen Kimia, FMIPA, IPB) Ir. Achmad Subagyo, MAgr. Ph.D.
(Jurusan Teknologi Hasil Pertanian, Fakultas Teknologi Pertanian, Universitas Jember)
Nama : PUSPITA SARI
NIM : F261060041
Program Studi : Ilmu Pangan
Disetujui Komisi Pembimbing
Prof. Dr. Ir. C. Hanny Wijaya, MAgr. Ketua
Prof. drh. Dondin Sajuthi, MST, Ph.D Prof. Unang Supratman, Ph.D, MSi. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc. Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
“Sesungguhnya sesudah kesulitan itu ……… pasti ada kemudahan”
INNA MA’AL “USRI YUSRON
(QS Alam Nasyroh : 6-7)
Karya ini kupersembahkan buat kedua orang tua, suami tercinta Adlhan Zuhriansyah serta ananda Rayya Rumaisha Zuhriansyah untuk bimbingan,
Alhamdulillahirobbil’alamin, puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian ini adalah antosianin buah duwet, dengan judul Potensi Antosianin Buah Duwet (Syzygium cumini) sebagai Pewarna Pangan Alami yang Memiliki Kemampuan Antioksidasi. Karya ilmiah ini dibuat sebagai salah satu syarat untuk memperoleh gelar doktor pada Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan terima kasih dan penghargaan yang tinggi kepada Prof. Dr. Ir. C. Hanny Wijaya, MAgr. selaku ketua komisi pembimbing, Prof. drh. Dondin Sajuthi, MPh, Ph.D dan Prof. Unang Supratman, MSi, Ph.D selaku anggota komisi pembimbing atas segala perhatian, kepercayaan, kesabaran, bimbingan dan arahan, wawasan ilmu yang diberikan, kritik, saran/masukan, serta waktu yang disediakan selama penulisan proposal, pelaksanaan penelitian, penulisan disertasi, serta dalam mempersiapkan seminar dan ujian hingga akhirnya penulis dapat menyelesaikan karya ilmiah ini serta menyelesaikan studi doktor di IPB.
Terima kasih disampaikan kepada Dr. Ir. Nuri Andarwulan, MSi. dan Prof. Dr. Suminar Setiati Achmadi yang telah bersedia menjadi penguji luar
komisi pada ujian tertutup. Terima kasih juga disampaikan kepada Prof. Dr. Ir. Latifah K. Darusman dan Ir. Achmad Subagyo, MAgr. Ph.D., atas kesediaannya menjadi penguji luar komisi pada ujian terbuka serta Dr. Ir. Sugiyono, MSc. selaku pimpinan sidang pada ujian tertutup dan ujian terbuka. Terima kasih untuk arahan, kritik, dan saran/masukan yang diberikan untuk perbaikan dan penyempurnaan disertasi ini.
Ucapan terima kasih disampaikan kepada Rektor Universitas Jember, Dekan Fakultas Teknologi Pertanian, Universitas Jember, atas izin yang diberikan kepada penulis untuk melanjutkan program doktor di Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor. Terima kasih kepada Dr. Ir. Maryanto, MSc, Ir. Achmad Subagyo, MAgr. Ph.D., dan Prof. Dr. Ir. Tedjasari, MSc., yang memberikan surat rekomendasi saat mendaftar di IPB.
Ucapan terima kasih juga disampaikan kepada pemerintah Republik Indonesia khususnya Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan Nasional yang telah memberikan beasiswa BPPS (Beasiswa
Pendidikan Nasional serta International Foundation for Science (IFS)-Swedia bekerjasama dengan Organisation for the Prohibition of Chemical Weapon (OPCW)-The Netherland atas bantuan dana penelitian yang diberikan untuk pengembangan penelitian tentang antosianin dari bahan-bahan alam Indonesia.
Terima kasih juga disampaikan kepada Ketua Program Studi Ilmu Pangan dan seluruh staf pengajar Program Studi Ilmu Pangan yang telah memberikan wawasan dan pengetahuan tentang ilmu pangan. Terima kasih kepada pegawai di Program Studi Ilmu Pangan, teknisi di laboratorium SEAFAST Center (gedung PAU) dan Departemen Ilmu dan Teknologi Pangan, serta petugas perpustakaan untuk segala bantuannya. Terima kasih juga disampaikan kepada Reza, bu Irma, Mathelda, Ayusta, Findya, Silvana untuk bantuan literatur (jurnal, text book,
e-book tentang antosianin, polifenol, antioksidan, dan pewarna) yang berguna
dalam pengembangan penelitian dan penulisan karya ilmiah.
Penulis juga menyampaikan terima kasih kepada teman-teman di Program Studi Ilmu Pangan, terutama bu Rika, bu Irma, dik Nurhayati, bu Triana, bu Yusda, bu Didah, bu Elvira, Mathelda, Findya, Reza, Ayusta, bu Rini, serta teman-teman satu bimbingan (Oktafrina, Silvana, bu Wiwied, Isak, pak Rudi, pak Maijon, pak Syahrir, bu Susi, pak Zaim). Terima kasih untuk persahabatan dalam suka dan duka serta segala bantuan yang tulus selama penulis menempuh studi di program studi Ilmu Pangan.
Terima kasih kepada keluarga tercinta Adlhan Zuhriansyah, SE (suami) dan ananda Rayya Rumaisha Zuhriansyah (anak) atas pengorbanan, pengertian, kesabaran, doa tulus, kasih sayang, serta dukungan moril dan bantuan materiil. Ucapan terima kasih yang tak terhingga juga penulis sampaikan kepada Ayahanda Drs. Soeparno (alm.), ibu Dra. Sulistini, serta semua saudara (Puspita Rini, SPd, Puspita Dewi, SE dan Sonya Sulistiyono, ST, MT) atas segala doa, perhatian, dukungan moril, dan kasih sayang.
Semoga Allah yang Maha Pemurah membalas segala kebaikan yang telah diberikan dengan balasan yang lebih sempurna. Akhirnya penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi masyarakat luas dan dapat memperkaya bidang ilmu pangan Indonesia.
Bogor, Februari 2011
Penulis dilahirkan di Sidoarjo, Jawa Timur, pada tanggal 1 Maret 1972 sebagai anak ketiga dari empat bersaudara pasangan Drs. Soeparno (alm.) dan Dra. Sulistini. Penulis menikah dengan Adlhan Zuhriansyah, SE pada tanggal 25 Mei 2001 dan dikarunai seorang putri bernama Rayya Rumaisha Zuhriansyah, yang lahir 4 Maret 2002.
Pendidikan formal SD hingga SMA ditempuh di Krian, Sidoarjo. Penulis menempuh pendidikan di SD Negeri IV tahun 1978-1984, SMP Negeri 2 tahun 1984-1987, dan SMA Negeri 1 tahun 1987-1990. Pada tahun 1990 penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dan tahun 1991 penulis diterima di Jurusan Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, IPB. Pendidikan S-1 diselesaikan pada tahun 1995 dengan skripsi berjudul: ”Pra-studi Kelayakan Pendirian Industri Kecil Tepung Terasi di
Kabupaten Sidoarjo, Jawa Timur” di bawah bimbingan Ir. Soesarsono Wijandi,
MSc. (alm.). Tahun 1999 penulis menempuh pendidikan program master di Department Applied Biochemistry, Graduate School of Agriculture and Biological Sciences, Osaka Prefecture University, Jepang dengan beasiswa JINNAI International Scholarship, Jepang. Pendidikan program master diselesaikan tahun 2001 dengan thesis berjudul: “Studies on Antioxidative Properties of Cacao
Polyphenolic” di bawah bimbingan Prof. Dr. Naofumi Morita. Pada tahun 2006,
penulis mendapat kesempatan untuk melanjutkan pendidikan program doktor pada program studi Ilmu Pangan, IPB dengan beasiswa BPPS dari Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan, Indonesia. Sejak tahun 1998 sampai sekarang, penulis bekerja sebagai staf pengajar di Jurusan Teknologi Hasil Pertanian, Fakultas Teknologi Pertanian, Universitas Jember. Penulis adalah anggota Perhimpunan Ahli Teknologi Pangan Indonesia (PATPI) dan aktif mengikuti kegiatan yang diselenggarakan himpunan profesi terutama kegiatan seminar. Penulis juga menjadi mitra bestari (reviewer) pada Jurnal Agritech, Fakultas Teknologi Pertanian, UGM (mulai tahun 2010).
Selama mengikuti program pendidikan S-3, penulis aktif mengikuti seminar nasional dan internasional di Salatiga (2007), Palembang (2008), Jakarta (2009 dan 2010), dan Bali (2010). Penulis juga pernah menulis sebuah artikel tentang antosianin di majalah Food Review Indonesia (2009). Seluruh hasil penelitian disertasi telah dipublikasikan melalui seminar nasional dan
Intermolekular terhadap Warna dan Stabilitas Antosianin Buah Duwet (Syzygium
cumini)” telah disampaikan dalam bentuk poster dan oral pada Seminar Nasional PATPI di Jakarta (3-4 November 2009). Kedua tulisan terpilih dan mendapat penghargaan sebagai naskah yang layak publikasi internasional dan nasional. Tulisan lainnya berjudul “Color Stability of Jambolan (Syzygium cumini) Fruit
Anthocyanins in a Model Beverage” juga telah disampaikan pada seminar
internasional yang diselenggarakan PATPI bekerjasama dengan Food Ingredient Asia (FAI) di Jakarta (22-23 September, 2010). Selain itu, tulisan berjudul: “Antioxidant Activity of Jambolan (Syzygium cumini) Fruit Anthocyanins” juga telah disampaikan dalam bentuk poster pada International Conference on Nutraceuticals and Functional Food di Bali (12-15 Oktober, 2010) yang diselenggarakan oleh ISNFF (International Society of Nutraceutical and Functional Food). Poster yang dipresentasikan mendapat penghargaan sebagai pemenang kedua pada Student Poster Competition. Sebuah artikel berjudul “Identifikasi Antosianin Buah Duwet (Syzygium cumini) Menggunakan
Kromatografi Cair Kinerja Tinggi-Diode Array Detection” telah dipublikasikan
pada J. Teknol. dan Industri Pangan Vol. XX No. 2 Th. 2009, terakreditasi nasional. Karya-karya ilmiah tersebut merupakan bagian dari disertasi di program studi Ilmu Pangan. Penelitian untuk disertasi pendidikan program doktor mendapat bantuan dana dari Direktorat Jenderal Pendidikan Tinggi (DIKTI)-Kementrian Pendidikan Republik Indonesia serta dari International Foundation
for Science (IFS)-Swedia bekerjasama dengan Organisation for the Prohibition of Chemical Weapon (OPCW)-The Netherland.
xv
Halaman
DAFTAR TABEL ... xvii
DAFTAR GAMBAR ... xix
1 PENDAHULUAN UMUM ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
Ruang Lingkup Penelitian ... 4
2 TINJAUAN PUSTAKA ... 5
Tanaman Duwet dan Kegunaan ... 5
Antosianin ... 8
Pewarna Pangan ... 16
Radikal Bebas dan Sistem Antioksidan ... 19
Mekanisme Antioksidan Polifenol ... 22
3 KANDUNGAN TOTAL ANTOSIANIN MONOMERIK DAN KOMPOSISI ANTOSIANIN BUAH DUWET (Syzygium cumini) Pendahuluan ... 25
Bahan dan Metode ... 26
Hasil dan Pembahasan ... 30
Simpulan ... 38
4 STABILITAS ANTOSIANIN BUAH DUWET (Syzygium cumini) DALAM MINUMAN MODEL Pendahuluan ... 39
Bahan dan Metode ... 40
Hasil dan Pembahasan ... 45
Simpulan ... 62
5 PERBAIKAN INTENSITAS DAN STABILITAS WARNA ANTOSIANIN BUAH DUWET (Syzygium cumini) SECARA KOPIGMENTASI INTERMOLEKULAR Pendahuluan ... 65
Bahan dan Metode ... 66
Hasil dan Pembahasan ... 71
Simpulan ... 86
6 AKTIVITAS ANTIOKSIDAN ANTOSIANIN BUAH DUWET (Syzygium cumini) SECARA IN VITRO Pendahuluan ... 89
Bahan dan Metode ... 90
Hasil dan Pembahasan ... 98
Simpulan ... 117
xvii
Halaman
2.1 Substitusi kation flavilium untuk membentuk antosianidin .. 9
2.2 Komposisi antosianin dalam bahan pangan yang mengandung antosianin terasilasi (kopigmentasi intramolekular) ……… 14
2.3 Certified colorants yang diijinkan untuk digunakan ... 17
2.4 Pewarna alami (uncertified colorants) untuk makanan dan minuman (didaftar oleh FDA) ………... 17
2.5 Klasifikasi pigmen alami ……… 18
2.6 Spesies oksigen dan nitrogen reaktif ... 19
3.1 Kandungan antosianin beberapa buah dan sayuran ... 31
3.2 Ciri kromatogram KCKT dan spektrum dari antosianin buah duwet terhidolisis asam (antosianidin) ... 32
3.3 Ciri kromatogram KCKT dan spektrum dari antosianin buah duwet ... 35
4.1 Karakteristik warna (kromasitas) antosianin buah duwet, kubis merah, dan pewarna enosianin ... 51
4.2 Perubahan warna dan waktu paruh antosianin dalam minuman model bufer sitrat pH 3 pada perlakuan pemanasan suhu 80 dan 98oC ... 52
4.3 Perubahan warna dan waktu paruh antosianin dalam minuman model bufer sitrat pH 3 pada perlakuan penyimpanan suhu refrigerasi dan ruang ... 58
4.4 Perubahan warna dan waktu paruh antosianin dalam minuman model bufer sitrat pH 3 pada perlakuan pencahayaan fluoresens ... 61
5.1 Karakteristik warna kromasitas dari antosianin buah duwet yang dikopigmentasi secara intermolekular dengan asam sinamat dan ekstrak polifenol rosemary ... 78
5.2 Perubahan warna dan waktu paruh antosianin buah duwet dalam minuman model tanpa dan dengan kopigmentasi pada perlakuan pemanasan suhu 80 dan 98oC ... 80
xviii
5.4 Perubahan warna dan waktu paruh antosianin dalam minuman model tanpa dan dengan kopigmentasi pada
perlakuan penyimpanan suhu ruang dan refrigerasi ... 85 6.1 Kandungan total polifenol dan antosianin dalam ekstrak
dan fraksi ... 99 6.2 Kandungan polifenol dalam ekstrak dan isolat antosianin
buah duwet, serta kubis merah ... 101 6.3 Nilai IC50 dari ekstrak duwet, isolat antosianin, dan
senyawa pembanding ... 104 6.4 Konsentrasi malonaldehid dari LDL termodifikasi (oksidasi
Cu2+) tanpa dan dengan ditambahkan ekstrak dan isolat
antosianin buah duwet, ekstrak kubis merah, dan katekin 110
xix
Halaman
2.1 Tanamam dan buah duwet ……….. 7
2.2 Antosianidin yang umum ada di bahan pangan ………... 9
2.3 Unit glikosil dari antosianin ... 10
2.4 Unit asil yang berikatan dengan antosianin ... 11
2.5 Struktur kimia antosianin ... 11
2.6 Mekanisme stabilisasi antosianin melalui kopigmentasi intramolekular dan intermolekular ... 13
2.7 Mekanisme stabilisasi antosianin terasilasi (kopigmentasi intramolekuler), mono- dan diasil pigmen ... 13
2.8 Efek hiperkromik dan pergeseran batokromik antosianin beras merah yang dikopigmentasi dengan asam ferulat ... 15
2.9 Penangkapan spesies oksigen reaktif/SOR (R•) oleh senyawa flavonoid ... 23
2.10 Struktur dasar utama yang berhubungan dengan aktivitas antioksidan flavonoid ... 24
3.1 Kromatogram KCKT dari antosianin buah duwet terhidrolisis asam (antosianidin) ………. 32
3.2 Struktur antosianidin buah duwet ……….. 33
3.3 Kromatogram KCKT dari antosianin buah duwet yang telah dipurifikasi ………. 34
3.4 Antosianin duwet, kubis, dan strawberi dibawah radiasi ultraviolet (366 nm), pemisahan antosianin dengan KLT-ODS ... 35
3.5 Pemisahan gula dengan KLT-silika ... 36
3.6 Struktur antosianin buah duwet ... 36
4.1 Ekstrak antosianin kulit buah duwet ... 42
xx
4.4 Pengaruh pH pada interkonversi dan perubahan warna
antosianin ……….. 49
4.5 Minuman model (bufer sitrat pH 3) mengandung antosianin
buah duwet, kubis merah, dan pewarna enosianin ... 51 4.6 Pengaruh perlakuan pemanasan suhu 80 dan 98oC pada
retensi warna antosianin (%) dari antosianin buah duwet, kubis merah, dan pewarna enosianin dalam minuman model
bufer sitrat pH 3 ... 52 4.7 Mekanisme degradasi untuk antosianidin 3,5-diglikosida dan
3-diglikosida ... 56 4.8 Pengaruh kondisi penyimpanan (suhu refrigerasi dan ruang)
pada retensi warna (%) dari antosianin buah duwet, kubis merah, dan pewarna enosianin dalam minuman model bufer
sitrat pH 3, kondisi perlakuan tanpa cahaya ………. 58
4.9 Pengaruh pencahayaan dengan lampu fluoresens pada retensi warna (%) dari antosianin buah duwet, kubis merah, dan pewarna enosianin dalam minuman model bufer sitrat
pH 3 ... 61 5.1 Bubuk daun rosemary dan ekstrak polifenol rosemary …….. 67 5.2 Struktur kimia kopigmen yang digunakan dalam
penelitian ... 71 5.3 Pengaruh penambahan asam sinamat dan ekstrak polifenol
rosemary terhadap karakteristik spektral (visibel) warna
antosianin duwet ... 72 5.4 Pergeseran batokromik dan efek hiperkromik dari antosianin
buah duwet yang direaksikan dengan asam sinamat dan
ekstrak polifenol rosemary ... 74 5.5 Pembentukan kompleks antosianin-kopigmen secara
transfer muatan (charge-transfer) atau interaksi
-
(interaksi antosianin dengan senyawa fenolik) ... 75 5.6 Kompleks molekular antosianin-kopigmen melalui interaksi
intermolekular antara delfinidin 3-glukosida dan rutin
(Williams & Hrazdina, 1979) dan awobanin (delfinidin
3-(6-O-trans-p-kumaril-ß-D-glukosida)-5-(ß-D-glukosida) dan
xxi
5.8 Pengaruh pemanasan terhadap retensi warna antosianin buah duwet tanpa dan dengan penambahan kopigmen
(1 mg/mL) pada minuman model pH 3 ... 79 5.9 Pengaruh pencahayaan dengan lampu fluoresens putih
terhadap retensi warna antosianin buah duwet tanpa dan dengan penambahan kopigmen (1 mg/mL) pada minuman
model pH 3 ... 81 5.10 Pengaruh penyimpanan suhu refrigerasi dan ruang
terhadap retensi warna antosianin buah duwet tanpa dan dengan penambahan kopigmen (1 mg/mL) pada minuman
model pH 3 ... 83 5.11 Contoh stabilisasi antosianin melalui pembentukan komplek
secara transfer muatan (charge-transfer) atau interaksi
-
(interaksi antosianin dengan senyawa fenolik) ... 86 6.1 Ekstrak polifenol, fraksi polifenol antosianin, dan fraksi
polifenol non-antosianin dari buah duwet ... 98 6.2 Aktivitas scavenging radikal DPPH dari ekstrak polifenol,
fraksi polifenol antosianin dan fraksi polifenol non-antosianin
buah duwet ... 100 6.3 Skema scavenging radikal DPPH oleh antioksidan (RH) 102 6.4 Aktivitas scavenging radikal DPPH dari ekstrak pulp duwet
(EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), asam askorbat, katekin,
dan kuersetin ... 103 6.5 Aktivitas scavenging radikal hidroksil (OH•) dari ekstrak
pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), dan
katekin 106
6.6 Aktivitas scavenging radikal anion superoksida (O2•) dari ekstrak pulp duwet (EPD), ekstrak kulit duwet (EKD), isolat antosianin duwet (IAD), ekstrak kubis merah (EKM), asam
askorbat, dan katekin ... 108 6.7 Efek penghambatan oksidasi lipoprotein LDL oleh ekstrak
pulp duwet (EPD), ekstrak kulit duwet (EKD), ekstrak kubis merah (EKM), isolat antosianin duwet (IAD), dan katekin.
Kontrol, LDL + Cu2+; EDTA, LDL + Cu2+ + EDTA ... 110 6.8 Pengikatan trace logam oleh senyawa polifenol (flavonoid) 113
xxii
1 mg/ml ... 114 6.10 Kapasitas antioksidan minuman model yang diberi warna
antosianin buah duwet baik tanpa dan dengan perlakuan
kopigmentasi. Penambahan kopigmen 1 mg/ml ... 115 6.11 Delokalisasi elektron tidak berpasangan disekitar cincin
aromatik pada radikal fenol ... 116 6.12 Mekanisme stabilisasi radikal semikuinon dari sianidin
Latar Belakang
Semakin meningkatnya kesadaran manusia untuk hidup lebih sehat mendorong meningkatnya penggunaan bahan tambahan pangan (BTP) yang alami dalam bahan pangan. Salah satu BTP alami yang dapat memberi warna pada produk pangan agar lebih terlihat menarik adalah pewarna alami pangan. Pewarna alami pangan adalah pewarna untuk pangan yang berasal dari bahan alam. Pewarna alami sudah banyak digunakan dalam bahan pangan seperti klorofil yang dapat memberikan warna hijau, karotenoid yang dapat memberikan warna kuning, serta antosianin yang dapat memberikan warna merah pada produk pangan berbasis asam. Dewasa ini, penggunaan pewarna alami pada produk pangan semakin meningkat. Beberapa produk pangan yang ada dipasaran Indonesia sudah menggunakan pewarna alami. Peningkatan ini terjadi karena pewarna alami selain dapat memberi warna pada bahan pangan, juga dapat memberikan manfaat lain terutama yang berkaitan dengan kesehatan manusia. Hal ini mendorong berbagai penelitian yang terkait dengan pengembangan pewarna alami termasuk pewarna alami berbasis antosianin.
Antosianin merupakan pigmen yang termasuk dalam kelompok flavonoid dari senyawa polifenol telah digunakan secara luas sebagai pewarna alami yang aman untuk pangan (Mateus & Freitas 2009). Antosianin yang ditemukan pada tanaman pangan umumnya dalam bentuk glikosida dan asilglikosida dari 6 antosianidin (aglikon) utama, yaitu pelargonidin, sianidin, delfinidin, peonidin, petunidin, dan malvidin (Castaňeda-Ovando et al. 2009). Berbagai bahan pangan ditemukan mengandung antosianin seperti anggur, blackcurrant, blackberry,
bilberry, cranberry, blueberry, stroberi, cherry, plum, delima, blood orange, leci
(kulit), apel (kulit), Perilla spp, rosela, bawang merah, kubis merah, yam ungu (umbi), kedelai hitam, jagung ungu, lobak merah, ubi jalar ungu (Mazza & Miniati 1993; Jackman & Smith 1996; Bridle & Timberlake 1997). Beberapa bahan pangan tersebut bahkan sudah digunakan secara komersial di Amerika Serikat sebagai bahan baku pewarna alami berbasis antosianin seperti kulit anggur, kubis merah, dan wortel hitam (Delgado-Vargas & Paredes-Lopez 2003).
Meskipun antosianin tidak bersifat toksik dan aman dikonsumsi, ada keterbatasan dalam aplikasi antosianin pada produk pangan terutama masalah kestabilan. Stabilitas antosianin sangat dipengaruhi oleh struktur kimia dan konsentrasi antosianin; pH; suhu; keberadaan enzim, oksigen dan cahaya; serta keberadaan senyawa lain seperti asam askorbat, kopigmen, protein, logam, dan gula (Markakis 1982; Francis 1989; Jackman & Smith 1996; Castañeda-Ovando
et al. 2009). Warna dan stabilitas antosianin umumnya dapat diperbaiki dengan
reaksi kopigmentasi baik secara intramolekular dan intermolekular sehingga warna antosianin dapat ditingkatkan intensitasnya dan lebih stabil (Malien-Aubert
et al. 2001; Eiro & Heinonen 2002; Mazzaracchhio et al. 2004; Gris et al. 2007;
Yawadio & Morita 2007).
Selain sebagai pewarna alami, antosianin juga memiliki peranan penting untuk kesehatan manusia. Antosianin telah dilaporkan menunjukkan aktivitas biologis seperti aktivitas antioksidan dan scavenging radikal (Wang et al. 1997; Wang et al. 1999, Espin et al. 2000, Kong et al. 2003; Bao et al. 2005), antiinflamasi (Wang et al. 1999), antikarsinogenik (Wang & Mazza 2002; Katsube
et al. 2003); antitumor (Kong et al. 2003), antidiabetik (Jayaprakasam et al. 2005),
neuroprotektif (Youdim et al. 2000; Galli et al. 2002), antimutagenik dan hepatoprotektif (Kong et al. 2003). Antosianin juga dapat mengurangi resiko penyakit jantung koroner melalui aktivitas vasoprotektif (Lietti et al. 1976), penghambatan agregasi platelet (Morazzoni & Magistretti 1990; Ghiselli et al. 1998), dan penghambatan oksidasi lipoprotein LDL (low density lipoprotein) (Abuja et al. 1998; Ghiselli et al. 1998; Heinonen et al. 1998).
Dewasa ini perhatian peneliti dunia terhadap antosianin sebagai pewarna alami dan senyawa antioksidan dalam bahan pangan semakin meningkat. Eksplorasi bahan pangan dengan kandungan antosianin sebagai pewarna alami dan senyawa antioksidan telah banyak dilakukan terutama oleh peneliti luar negeri. Indonesia mempunyai beraneka ragam sumber hayati yang dapat dimanfaatkan sebagai sumber antosianin seperti buah duwet (Syzygium cumini). Buah duwet yang matang memiliki kulit berwarna ungu kehitaman, menunjukkan adanya kandungan antosianin. Salah satu yang mencirikan adanya kandungan antosianin ialah dari warnanya, sesuai yang dinyatakan oleh Bridle dan Timberlake (1997); Giusti dan Wrolstad (2003), antosianin dapat memberikan warna biru, ungu, violet, dan merah.
Selama ini buah duwet belum banyak dimanfaatkan sehingga menjadi buah langka. Buah duwet biasanya dikonsumsi secara langsung dalam bentuk buah segar, sedangkan bagian biji dan daunnya oleh masyarakat Indonesia digunakan untuk pengobatan tradisional penyakit diabetes. Beberapa penelitian telah dilakukan untuk mengetahui manfaat kesehatan dari beberapa bagian tanaman duwet seperti kulit batang, daun, biji, dan buah. Kulit batang tanaman memiliki aktivitas antibakteri (Warrier et al. 1996) dan antiinflamasi (Muruganandan et al. 2001). Bagian buah dan biji digunakan untuk pengobatan diabetes (Kedar & Chakrabarti 1983; Nair & Santhakumari 1986; Warrier et al. 1996;) dan memiliki aktivitas antioksidan (Banerjee et al. 2005; Lestario et al. 2005a; Lestario et al. 2005b; Veigas et al. 2007). Bagian daun juga digunakan untuk pengobatan diabetes (Teixeira et al. 1997), konstipasi, dan antibakteri (Warrier et al. 1996).
Untuk melengkapi informasi ilmiah yang sudah dilakukan oleh peneliti sebelumnya maka pada penelitian disertasi ini dilakukan penelitian mengenai potensi buah duwet untuk dikembangkan sebagai pewarna alami pangan berbasis antosianin yang sekaligus dapat memberikan fungsi tambahan sebagai antioksidan yang dapat memberikan efek menguntungkan bagi kesehatan. Hingga saat ini penelitian tentang antosianin buah duwet untuk penggunaan sebagai pewarna pangan alami yang fungsional belum dikaji secara lengkap dan mendalam. Oleh karena itu, perlu dilakukan penelitian mengenai karakterisasi antosianin buah duwet seperti kandungan dan komposisi antosianin buah duwet, karakteristik warna dan stabilitas antosianin buah duwet, upaya perbaikan warna dan stabilitas antosianin buah duwet, serta aktivitas hayati terutama sifat antioksidatifnya sehingga dapat diperoleh informasi yang lengkap untuk melihat potensinya sebagai pewarna pangan yang fungsional.
Tujuan Penelitian
Penelitian ini bertujuan melakukan karakterisasi antosianin buah duwet untuk penggunaan sebagai pewarna pangan fungsional. Karakterisasi yang dilakukan meliputi identifikasi jenis dan komposisi antosianin, stabilitas warna antosianin, perbaikan intensitas dan stabilitas warna antosianin, serta aktivitas antioksidatif.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi bahwa antosianin buah duwet dapat dimanfaatkan untuk pewarna pangan fungsional yang aman dan menyehatkan. Tersedianya pewarna pangan fungsional berbasis antosianin dapat menggantikan pewarna merah sintetik yang masih banyak digunakan di industri pangan serta dapat menambah ketersediaan jumlah pewarna antosianin yang selama ini masih diimpor. Pemanfaatan antosianin buah duwet untuk pewarna pangan diharapkan juga dapat meningkatkan nilai guna dan ekonomis buah duwet.
Ruang Lingkup Penelitian
Pada penelitian ini dilakukan serangkaian kegiatan yang terdiri dari empat kajian, yaitu (1) identifikasi jenis dan komposisi antosianin serta kandungan total antosianin monomerik dalam buah duwet, (2) karakteristik warna dan stabilitas antosianin buah duwet, (3) upaya untuk meningkatkan intensitas dan stabilitas warna antosianin buah duwet melalui reaksi kopigmentasi secara intermolekular, dan (4) untuk melihat fungsi lain dari antosianin buah duwet selain sebagai pewarna maka dilakukan pengujian aktivitas antioksidan dengan menguji kemampuan antosianin buah duwet menangkap radikal bebas (DPPH/difenil pikrilhidrasil dan spesies oksigen reaktif/SOR: O2• dan OH•) dan menghambat oksidasi lipoprotein LDL yang dapat memicu kejadian aterosklerosis.
Tanaman Duwet dan Kegunaan
Tanaman duwet berasal dari daerah subtropis Himalaya, India, Srilangka, Malaysia, Australia dan saat ini telah ditanam di seluruh daerah tropis dan subtropis. Duwet dikenal memiliki berbagai nama di antaranya jambolan (Inggris), jamélongue (Perancis), jamblang atau duwet (Indonesia), jambulana atau jambulan (Malaysia), duhat (Filipina), thabyay-hpyoo (Myanmar), pringbay (Kamboja), wa (Thailand), vói rung atau trám móc (Vietnam) (Verheij & Coronel 1997). Di Indonesia dikenal berbagai nama di antaranya adalah jambolan, jambolana, jamblang, jambul dan jamun. Duwet juga mempunyai banyak nama lokal, di Jawa Barat menamakan duwet sebagai jamblang, nama ini mirip dengan nama jambelang (duwet yang ada di Malaya); di Jawa Tengah menamakan dengan juwet atau duwet, sebutan ini sama dengan sebutan di Jawa Timur; di Madura menamakan duwet sebagai dhalas atau dhuwak; di Bali menamakan duwet dengan jujutan. Ada juga yang menamakan duwet dengan dalas, plum jawa, ataupun anggur sepat.
Duwet termasuk dalam keluarga jambu-jambuan atau Myrtaceae yang biasa berbuah pada musim panas (Kloppenburg-Versteegh 1988). Klasifikasi botani tanaman duwet adalah kingdom Plantae, divisi Magnoliophyta, kelas
Magnoliopsida, ordo Myrtales, famili Myrtaceae, genus Syzygium, dan spesies Syzygium cumini (L.) Skeels. Sinonim dari Syzygium cumini (L.) Skeels adalah Myrtus cumini L. (1753), Eugenia jambolana Lamk (1789), Syzygium jambolanum
(Lamk) DC. (1828), dan Eugenia cumini (L.) Druce (1914) (Verheij & Coronel 1997).
Tanaman duwet memiliki beberapa varietas, varietas liar disebut dengan duwet kerikil karena buahnya berukuran kecil sebesar kerikil (diameter hanya sekitar 1,5 cm) dan rasa buah tidak enak. Tanaman duwet yang dibudidayakan ada beberapa varietas yaitu duwet biasa (buahnya besar dan berwarna biru keungu-unguan), duwet ireng/item (buahnya berwarna hitam), duwet daging (daging buah tebal dan warna buahnya tidak begitu hitam), duwet bawang (buahnya berwarna putih), dan duwet boentén (buahnya berwarna agak hitam dan tanpa biji). Tidak semua buah duwet dapat dimakan, buah duwet bawang misalnya hanya dipergunakan sebagai bahan obat kencing manis (Tohir 1983;
Ishwara et al. 2002). Lebih lanjut menurut Verheij dan Coronel (1997); Morton (1987), beberapa nama varietas duwet adalah Early Wild, Late Wild, Pharenda,
Small Jaman, Dabka, Krian Duat, Super Duhat.
Tanaman duwet merupakan tanaman pekarangan atau tumbuh liar di hutan-hutan. Duwet dapat tumbuh baik di daerah tropis pada ketinggian 600 meter diatas permukaan laut, dijumpai juga tumbuh pada ketinggian sampai 1800 meter diatas permukaan laut. Pohon duwet merupakan pohon yang kokoh dengan tinggi 20-30 m dan diameter batangnya 40-90 cm dengan percabangan pohon rendah dan tidak beraturan (Verheij & Coronel 1997). Tanaman buah duwet dapat dikenali dengan daunnya yang tebal bersirip seling dan pada ujungnya sedikit berlekuk. Kayunya diselimuti kulit yang berwarna coklat gelap pada bagian bawah dan agak muda dibagian atasnya, berserat kasar dan keras. Bunganya berwarna putih atau merah. Buahnya sebesar biji rambutan, berwarna ungu tua, berbentuk bulat telur, sering melengkung. Daging buahnya berwarna kuning abu-abu atau ungu muda, berair dengan rasa kelat sedikit asam manis dan hampir tidak beraroma (Tampubolon 1995). Buah duwet memiliki panjang 1-5 cm dan bergerombol mencapai 40 butir. Biji berbentuk lonjong dan panjangnya sampai 3,5 cm, sedikit pahit dan keping biji berwarna hijau sampai coklat (Verheij & Coronel 1997). Gambar tanaman dan buah duwet disajikan pada Gambar 2.1.
Nilai gizi buah duwet (per 100 gram) mengandung 84-86 g air; 0,2-0,7 g protein; 0,3 g lemak; 14-16 g karbohidrat; 0,3-0,9 g serat; 0,4-0,7 g abu; 8-15 mg kalsium; 15 mg fosfor; 1,2 mg besi; 0,01 mg riboflavin; 0,3 mg niasin; sedikit sekali vitamin A dan tiamin; 5-18 mg vitamin C; dan energi 277 kJ (Verheij & Coronel 1997). Kandungan kimia lain tanaman duwet meliputi antimelin (suatu glikosida), jambulol atau jambolin, tanin (12-19% pada batang, 12-13% pada daun, dan 8-9% pada kulit batang), asam galat, asam palmitat, amilum, dan fitosterol. Pada buahnya terkandung kalsium dan zat besi (Tampubolon 1995). Tanaman duwet juga dilaporkan mengandung asam asetil oleanolat, triterpenoid, asam elagat, isokuersetin, kuersetin, kaemferol, dan mirisetin (Rastogi & Mehrotra 1990). Asam galat, mirisetin, mirisetin 3-O-α-L-ramnopiranosida, dan mirisetin 3-O-(4”-O-asetil)-α-L-ramnopiranosida ditemukan dalam daun (Mahmoud et al. 2001).
Gambar 2.1 Tanamam dan buah duwet.
Buah duwet dengan ukuran dan mutu baik mempunyai rasa manis, asam dan sedikit astringen (sepat) biasanya dimakan dalam keadaan segar dan juga dibuat tarts, saus, selai, sirup, squash, sherbet, dan anggur (Morton 1987). Rao dan Charyulu (1989); Venkitakrishnan et al. (1997); Garande et al. (1998) meneliti perubahan sifat fisiko-kimia buah duwet selama proses pematangan buah. Kannan dan Thirumanan (2004) membuat minuman, squash, sirup, dan selai serta dianalisa perubahan sifat fisiko-kimia termasuk kandungan total fenolik (tanin) dan antosianin selama penyimpanan. Kegunaan lain tanaman duwet adalah daun dapat digunakan sebagai pakan, bunga mengandung banyak nektar dengan kualitas yang baik, kulit kayu yang berasa sepat dan dapat digunakan sebagai obat kumur dan untuk pewarna, tepung bijinya bermanfaat untuk mengobati kencing manis, disentri, diare, diuretik, dan penyakit lainnya (Verheij & Coronel 1997). Manfaat lain tanaman duwet untuk kesehatan juga sudah diteliti secara ilmiah. Kulit batang tanaman memiliki aktifitas antibakteri (Warrier et al. 1996) dan antiinflamasi (Muruganandan et al. 2001). Bagian buah dan biji digunakan untuk pengobatan diabetes (Warrier et al. 1996; Kedar & Chakrabarti 1983; Nair & Santhakumari 1986). Selain itu, buah duwet juga
menunjukkan aktivitas antioksidan (Banerjee at al. 2005; Lestario et al. 2005a; Lestario et al. 2005b; Veigas et al. 2007). Bagian daun juga digunakan untuk pengobatan diabetes (Teixeira et al. 1997), konstipasi, dan antibakteri (Warrier et
al. 1996).
Antosianin
Sumber Antosianin
Antosianin (dari bahasa Yunani, anthos = bunga dan kianos = biru) merupakan salah satu kelompok pigmen utama yang tersebar luas pada tanaman terutama pada bagian buah, sayuran, bunga, daun, akar, umbi, legum, dan sereal. Antosianin merupakan pigmen yang larut dalam air yang dapat memberikan warna biru, ungu, violet, merah (Bridle & Timberlake 1997; Crozier 2003; Giusti & Wrolstad 2003). Beberapa bahan pangan yang mengandung pigmen alami antosianin adalah famili Vitaceae (anggur), Rosaceae (cherry, plum, raspberry, strawberi, blackberry, apel, persik), Solanaceae (tamarillo),
Saxifragaceae (red dan black currant), Ericaceae (blueberry, cranberry), Cruciferae (kubis merah) (Jackman & Smith 1996). Sebanyak 258 antosianin
telah ditemukan dalam buah, sayuran, dan biji-bijian (Mazza & Miniati 1993) dan sampai sekarang telah dilaporkan lebih dari 500 antosianin berasal dari berbagai tanaman (Andersen & Jordhein 2006).
Struktur Kimia Antosianin
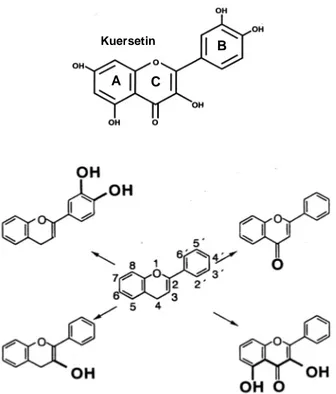
Antosianin termasuk dalam kelompok flavonoid dari senyawa polifenol yang memiliki tipe rangka karbon C6C3C6. Antosianin merupakan glikosida dari turunan polihidroksi dan polimetoksi kation 2-fenilbenzopirilium atau kation flavilium (Brouillard 1982; Kong et al. 2003). Bagian utama antosianin adalah aglikon/kation flavilium (Tabel 2.1) yang mengandung ikatan rangkap terkonjugasi yang berperanan untuk menyerap energi pada panjang gelombang 500 nm sehingga pigmen nampak berwarna merah. Aglikon ini disebut antosianidin yang merupakan penta-substituted (3,5,7,3’,4’) atau
hexa-substituted (3,5,7,3’,4’,5’). Sebanyak 22 antosianidin sudah dikenal dan hanya 6
antosianidin yang umumnya ada dalam bahan pangan (Francis 1989). Enam antosianidin yang umum ditemukan di alam terutama dalam bahan pangan adalah pelargonidin, sianidin, peonidin, delfinidin, malvidin, dan petunidin
(Gambar 2.2). Aglikon (antosianidin) berbeda pada jumlah gugus hidroksil dan metoksil pada cincin B dari kation flavilium (Brouillard 1982; Giusti & Wrolstad 2003).
Tabel 2.1 Substitusi kation flavilium untuk membentuk antosianidin
Pola Substitusi Antosianidin
3 5 6 7 3’ 4’ 5’ Warna
Karajurin H H OH OH H OCH3 OCH3 -
Arabidin H H OH OH H OH OCH3 -3’-hidroksiarabidin H H OH OH OH OH OCH3 -Apigenin H OH H OH H OH H jingga Luteolin H OH H OH OH OH H jingga Trisetinidin H OH H OH OH OH OH merah Pelargonidin OH OH H OH H OH H jingga Aurantinidin OH OH OH OH H OH H jingga
Sianidin OH OH H OH OH OH H merah jingga
5-Metilsianidin OH OCH3 H OH OH OH H merah jingga
Peonidin OH OH H OH OCH3 OH H merah
Rosinidin OH OH H OCH3 OCH3 OH H merah
6-hidroksisianidin OH OH OH OH OH OH H merah 6-hidroksidelfinidin OH OH OH OH OH OH OH merah kebiruan
Delfinidin OH OH H OH OH OH OH merah kebiruan
Petunidin OH OH H OH OCH3 OH OH merah kebiruan
Malvidin OH OH H OH OCH3 OH OCH3 merah kebiruan
Pulselidin OH OCH3 H OH OH OH OH merah kebiruan
Eupinidin OH OCH3 H OH OCH3 OH OH merah kebiruan
Kapensinidin OH OCH3 H OH OCH3 OH OCH3 merah kebiruan
Hirsutidin OH OH H OCH3 OCH3 OH OCH3 merah kebiruan
Risiniodin OH H OH OH H OH H -
Sumber: Francis (1989).
Gambar 2.2 Antosianidin yang umum ada di bahan pangan (Brouillard 1982).
Umumnya antosianidin tidak ditemukan terakumulasi dalam tanaman, pigmen yang ada di bunga, buah, dan sayuran utamanya dalam bentuk glikosilasi. Antosianidin bersifat tidak stabil di air dan sedikit larut dibandingkan
Pelargonidin Sianidin Peonidin
Delfinidin
Malvidin Petunidin
antosianin. Glikosilasi menjadikan pigmen lebih mudah larut dan stabil (Brouillard 1982). Antosianin yang ditemukan pada tanaman pangan umumnya dalam bentuk glikosida dan asilglikosida dari 6 antosianidin (aglikon) utama, yaitu pelargonidin, sianidin, delfinidin, peonidin, petunidin, dan malvidin (Castaňeda-Ovando et al. 2009).
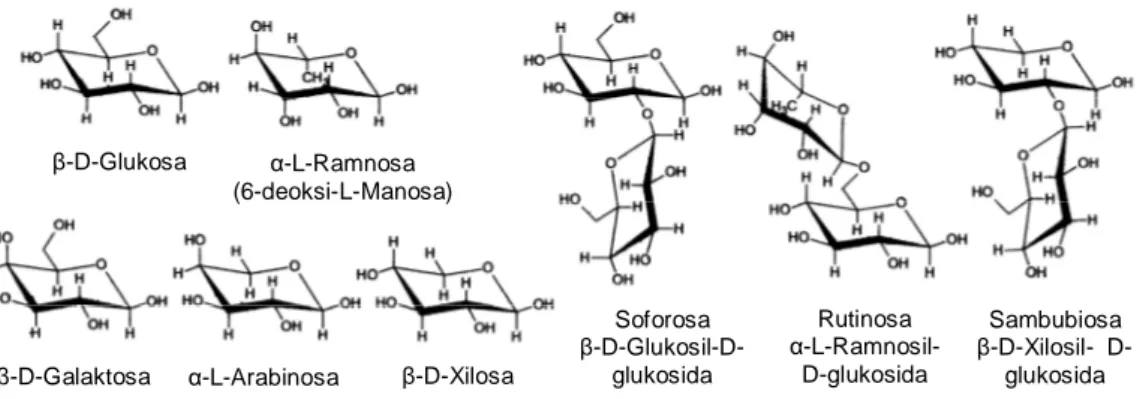
Antosianin secara umum tersusun dari aglikon (antosianidin), molekul gula, dan pada beberapa antosianin, residu gula diasilasi oleh asam-asam organik. Kebanyakan gugus gula adalah monosakarida seperti glukosa, galaktosa, ramnosa, xilosa dan arabinosa. Di- dan trisakarida yang dibentuk oleh kombinasi dari monosakarida juga dijumpai. Gugus gula terletak pada C-3 dari aglikon. Pada diglikosida, dua monosakarida terletak pada C-3 dan C-5 dan jarang terletak pada C-3 dan C-7. Tetapi ada kemungkinan juga, 2 monosakarida keduanya terletak pada C-3. Pada triglikosida, monosakarida terletak pada aglikon dimana 2 monosakarida pada C-3 dan satu monosakarida pada C-5 atau C-7 (Brouillard 1982). Lebih lanjut menurut De Ancos et al. (1999); Kähkönen et
al. (2003), di- dan trisakarida yang sering ditemukan pada antosianin adalah
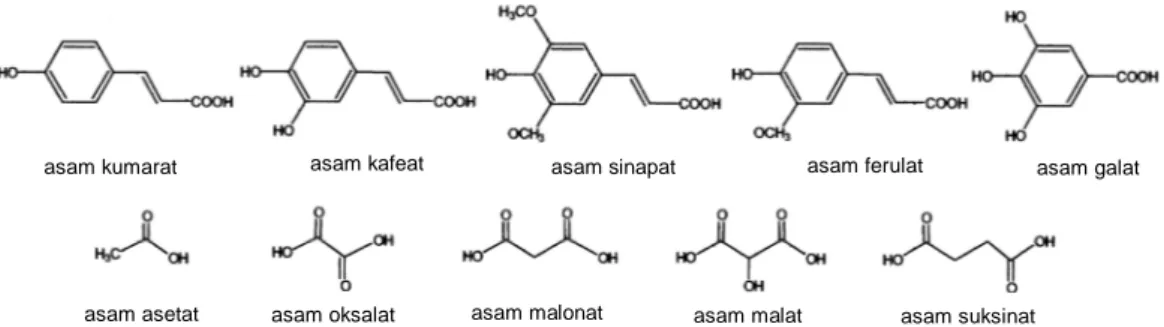
rutinosa, soforosa, sambubiosa, dan glukorutinosa. Gambar 2.3 menunjukkan unit glikosil dari antosianin.
Gambar 2.3 Unit glikosil dari antosianin.
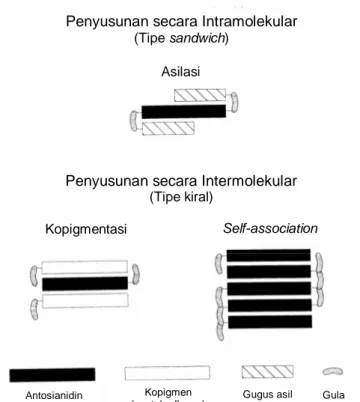
Pada beberapa antosianin, residu gula diasilasi dengan asam-asam aromatik meliputi asam kumarat, kafeat, ferulat, sinapat, galat atau p-hidroksibenzoat serta asam-asam alifatik seperti asam malonat, asetat, malat, suksinat, dan oksalat. Asam-asam organik berikatan dengan unit glikosil melalui ikatan ester. Gugus asil umumnya berikatan pada C-3 gugus gula, diesterifikasi pada gugus 6-OH atau 4-OH dari gula. Antosianin dengan dua atau lebih gugus asil telah dilaporkan (Giusti & Wrolstad 2003). Asam fenolik aromatik dan alifatik
β-D-Glukosa α-L-Ramnosa (6-deoksi-L-Manosa)
β-D-Galaktosa α-L-Arabinosa β-D-Xilosa
Soforosa β-D-Glukosil-D-glukosida Rutinosa α-L-Ramnosil- D-glukosida Sambubiosa β-Xilosil- D-glukosida
yang umumnya berikatan dengan antosianin ditunjukkan pada Gambar 2.4. Gambar 2.5 menunjukkan beberapa macam antosianin yang berikatan dengan gugus gula dan asam organik.
Gambar 2.4 Unit asil yang berikatan dengan antosianin.
Gambar 2.5 Struktur kimia antosianin.
asam kumarat asam kafeat asam sinapat asam ferulat asam galat
asam asetat asam oksalat asam malonat asam malat asam suksinat
Antosianin monoglukosida Sianidin 3-(2”-xilosil-6”-glukosil)-galaktosida
Malvidin 3,5-diglukosida Sianidin 3-(2”-xilosil-6”-(6-kumaril)-glukosil)-galaktosida
Delfinidin 3-soforosida Sianidin 3-((2”-(6-kafeil)-glukosil)-6”-(kumaril)-glukosida)- 5-(6”-(metilmalonil)-glukosida
Stabilitas dan Kopigmentasi Antosianin
Seperti kebanyakan pewarna alami lainnya, antosianin relatif bersifat tidak stabil dan umumnya antosianin lebih stabil dalam kondisi asam. Warna dan stabilitas antosianin sangat dipengaruhi oleh substituen gugus gula dan asil pada aglikon. Degradasi antosianin terjadi tidak hanya selama ekstraksi dari jaringan tanaman, tetapi juga selama proses dan penyimpanan (Elbe & Schwartz 1996). Hidrolisis gugus gula pada molekul antosianin merupakan penyebab degradasi pigmen selama proses (Garzon & Wrolstad 2001). Antosianin mengalami degradasi dengan beberapa kemungkinan mekanisme yang mengubah warna antosianin menjadi produk larut tidak berwarna atau berwarna cokelat serta produk tidak larut (Jackman & Smith 1996). Faktor-faktor utama yang mempengaruhi degradasi antosianin adalah struktur dan konsentrasi antosianin, pH, suhu, serta keberadaan oksigen dan cahaya. Degradasi enzimatik dan interaksi dengan komponen pangan lainnya (seperti asam askorbat, ion logam, gula serta produk degradasinya, sulfur dioksida, dan kopigmen) sedikit berpengaruh pada degradasi antosianin (Markakis 1982; Francis 1989; Elbe & Schwartz 1996; Jackman & Smith 1996).
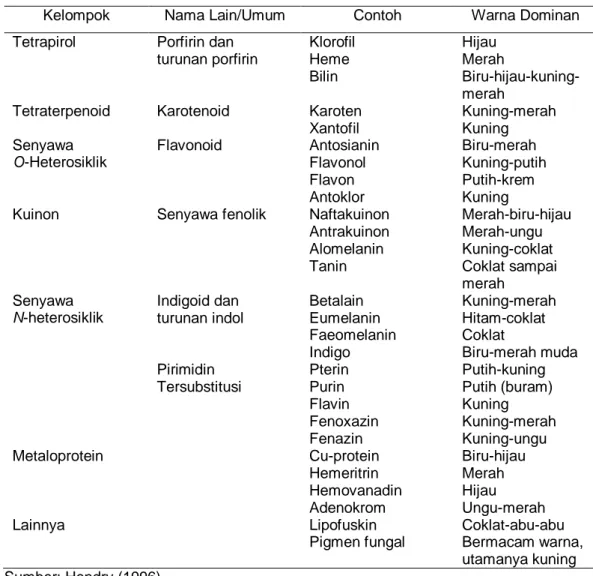
Beberapa upaya dilakukan untuk memperbaiki warna dan stabilitas antosianin. Stabilitas antosianin dapat diperbaiki dengan kopigmentasi baik secara intramolekular dan intermolekular (Malien-Aubert et al. 2001; Eiro & Heinonen 2002; Mazzaracchhio et al. 2004; Gris et al. 2007; Yawadio & Morita 2007). Kopigmentasi antosianin dapat memberikan warna lebih cerah, kuat, dan stabil. Reaksi kopigmentasi dapat terjadi melalui (1) interaksi intramolekuler, asam organik (gugus asil aromatik) atau flavonoid atau kombinasi keduanya berikatan secara kovalen dengan antosianin, serta (2) interaksi intermolekuler, senyawa flavonoid tidak berwarna atau senyawa fenolik lain misal asam fenolik berikatan lemah secara hidrofobik dengan antosianin, Gambar 2.6 dan 2.7 (Eiro & Heinonen 2002). Kopigmentasi intramolekular lebih efektif menstabilkan warna antosianin dibandingkan kopigmentasi intermolekular disebabkan kekuatan ikatan (Francis 1989). Asilasi pada antosianin mempunyai pengaruh menstabilkan antosianin secara kopigmentasi intramolekular melalui penyusunan tipe sandwich dari gugus asil dengan cincin pirilium antosianin (Jackman & Smith 1996). Lebih lanjut dijelaskan oleh Francis (1989) dan Osawa (1982), beberapa faktor yang mempengaruhi kopigmentasi adalah tipe dan konsentrasi antosianin, tipe dan konsentrasi kopigmen, pH, suhu, dan logam.
Gambar 2.6 Mekanisme stabilisasi antosianin melalui kopigmentasi intramolekular dan intermolekular (Jackman & Smith 1996).
Gambar 2.7 Mekanisme stabilisasi antosianin terasilasi (kopigmentasi intramolekuler), mono- dan diasil pigmen (Giusti & Wrolstad 2003).
Beberapa sumber bahan pangan yang mengandung antosianin terasilasi (kopigmentasi intramolekular) disajikan pada Tabel 2. Beberapa penelitian juga sudah dilakukan untuk memperbaiki warna dan stabilitas antosianin secara kopigmentasi intermolekuler misalnya antosianin murni yang dikopigmentasi
Penyusunan secara Intramolekular
(Tipe sandwich) Asilasi
Penyusunan secara Intermolekular
(Tipe kiral)
Kopigmentasi Self-association
Antosianidin Kopigmen
(contoh : flavon) Gugus asil Gula
Antosianidin Gula Gugus asil
Tipe sandwich (di-asilasi pigmen)
Penyusunan secara Intramolekular
dengan asam fenolik (Eiro & Heinonen 2002), antosianin murni yang dikopigmentasi dengan senyawa organik pangan (Mazzaracchio et al. 2004), ekstrak antosianin anggur merah yang dikopigmentasi dengan ekstrak polifenol rosemary (Brenes et al. 2005), antosianin beras hitam yang dikopigmentasi dengan asam karboksilat (asam kumarat, asam ferulat, asam sinapat, dan asam lipoat) (Yawadio & Morita 2007), ekstrak antosianin anggur Carbenet Sauvignon yang dikopigmentasi dengan asam kafeat (Gris et al. 2007).
Tabel 2.2 Komposisi antosianin dalam bahan pangan yang mengandung antosianin terasilasi (kopigmentasi intramolekular)
Sumber Jenis Pigmen Komposisi
Lobak (Raphanus sativus) turunan Pg terasilasi satu
asam sinamat dan asam alifatik
Pg-3-sof-5-glu terasilasi: asam
p-kumarat, asam ferulat, asam p-kumarat dan malonat, asam
ferulat dan asam malonat Kentang (Solanum
tuberosum) turunan Pg terasilasi satu asam sinamat
Pg-3-rut, Pg-3-rut + asam
p-kumarat, 3-rut-5-glu,
Pg-3-rut-5-glu + asam p-kumarat, Pg-3-rut-5-glu + asam ferulat Wortel hitam (Daucus carota) Cy-3-rut-glu-gal terasilasi
satu asam sinamat
Cy-3-gal-xil, (2) Cy-3-gal-xil-glu, Cy-3-gal-xil-glu + asam p-kumarat, Cy-3-gal-xil-glu + asam ferulat, Cy-3-gal-xil-glu + asam sinapat
Kubis merah (Brassica
oleracea)
Cy-3-diglu-5-glu terasilasi satu atau dua asam sinamat
mono-asilasi: Cy-3-diglu-5-glu + asam sinapat, di-asilasi dengan asam hidroksisinamat, Cy-3-diglu-5-glu + asam sinapat dan ferulat, Cy-3-diglu-5-glu + dua asam sinapat
Anggur (Vitis labrusca) Campuran 5 aglikon berbeda,
terasilasi asam p-kumarat dan tanpa asilasi
Antosianin glukosida terasilasi asam p-kumarat dan
di-glukosida terasilasi asam
p-kumarat
Pg, pelargonidin; sof, soforosa; glu, glukosa; rut, rutinosa; Cy, sianidin; gal, galaktosa; xil, xilosa. Sumber: Giusti dan Wrolstad (2003).
Reaksi kopigmentasi dapat dideteksi melalui efek hiperkromik (ΔA), terjadi peningkatan absorbans spektra pada λvis-maks dan pergeseran batokromik (Δλvis-maks), terjadi pergeseran panjang gelombang (nm) lebih tinggi pada absorbans spektra maksimum (λvis-maks) (Eiro & Heinonen 2002). Kopigmentasi dapat menyebabkan pergeseran batokromik dari warna merah ke biru (Francis 1989). Gambar 2.8 menunjukkan terjadinya perubahan panjang gelombang pada absorbans maksimum (pergeseran batokromik) dan intensitas warna (efek hiperkromik) untuk fraksi kaya antosianin dari beras hitam yang dikopigmentasi dengan asam ferulat (Yawadio & Morita 2007).
Gambar 2.8 Efek hiperkromik dan pergeseran batokromik antosianin beras merah yang dikopigmentasi dengan asam ferulat. = kontrol, -
●-
= 2 mg/ml asam ferulat, -О- = 4 mg/ml asam ferulat, -▲- = 6 mg/mL asam ferulat (Yawadio & Morita 2007).
Peranan Antosianin
Antosianin telah digunakan secara luas sebagai pewarna alami untuk pangan selain kurkumin, lutein, karotenoid, betalain, klorofil, gula karamel, anato (Henry 1996; Bridle & Timberlake 1997; Mateus & Freitas 2009). Antosianin telah banyak digunakan oleh industri makanan untuk mewarnai makanan yang dihasilkan seperti pada produk minuman, confectionary, dessert, snack serta produk pangan lainnya (Henry 1996). Beberapa bahan pangan sudah digunakan secara komersial di Amerika Serikat sebagai bahan baku pewarna alami berbasis antosianin seperti kulit anggur, kubis merah, dan wortel hitam (Delgado-Vargas & Paredes-Lopez 2003).
Selain sebagai pewarna, antosianin juga memiliki peranan penting untuk kesehatan manusia (Kong et al. 2003). Konsumsi bahan pangan dan minuman yang mengandung antosianin dapat mengurangi resiko dari beberapa penyakit degeneratif seperti aterosklerosis, penyakit jantung, kanker, dan diabet. Antosianin dikenal sebagai senyawa penangkap (scavenger) radikal bebas dan juga dilaporkan potensial sebagai agensia kemopreventif (Jayaprakasam et al. 2005). Beberapa penelitian telah melaporkan aktivitas biologis dari antosianin seperti seperti aktivitas antioksidan dan scavenging radikal (Wang et al. 1997; Wang et al. 1999, Espin et al. 2000, Kong et al. 2003; Bao et al. 2005), antiinflamasi (Wang et al. 1999), antikarsinogenik (Wang & Mazza 2002; Katsube
et al. 2003); antitumor (Kong et al. 2003), antidiabetik (Jayaprakasam et al. 2005),
hepatoprotektif (Kong et al. 2003). Antosianin juga dapat mengurangi resiko penyakit jantung koroner melalui aktivitas vasoprotektif (Lietti et al. 1976) dan penghambatan agregasi platelet (Morazzoni & Magistretti 1990; Ghiselli et al. 1998) dan penghambatan oksidasi lipoprotein LDL (low density lipoprotein) (Abuja et al. 1998; Ghiselli et al. 1998; Heinonen et al. 1998).
Pewarna Pangan
Warna di dalam bahan pangan merupakan salah satu faktor yang penting dalam menentukan kualitas bahan pangan disamping tekstur, rasa, dan atribut sensori lainnya. Warna pada bahan pangan dapat disebabkan oleh pigmen alami atau pewarna yang sengaja ditambahkan (DeMan 1997; Joshi & Brimelow 2002). Warna suatu senyawa organik disebabkan oleh adanya gugus-gugus tertentu dalam molekulnya yang dikenal dengan gugus pembawa warna (gugus kromofor). Dalam suatu senyawa zat warna, bagian dari molekul yang mengandung gugus kromofor disebut kromogen. Untuk menimbulkan warna, cukup dengan adanya satu gugus kromofor pada inti. Suatu zat warna biasanya mengandung lebih dari satu gugus kromofor (Woodroof & Philips 1975). Kromofor mengandung banyak ikatan rangkap terkonjugasi yang dapat menyerap atau memantulkan sinar.
International Food Information Council Foundation/IFIC (1994)
mendefinisikan pewarna pangan sebagai zat yang digunakan untuk memberikan atau meningkatkan warna suatu produk pangan sehingga menciptakan image tertentu dan membuat produk lebih menarik. Pewarna ditambahkan dalam produk pangan umumnya bertujuan untuk: (1) memperkuat warna yang sudah
ada pada produk pangan yang mempunyai intensitas warna rendah, (2) memperoleh warna yang seragam pada produk pangan, (3) memperbaiki
penampakan produk pangan yang warnanya telah berubah akibat pengolahan, (4) memberikan warna pada produk pangan yang tidak berwarna (Henry 1996).
Ada tiga tipe dari pewarna pangan organik yaitu pewarna sintetik, identik-alami, dan alami. Pewarna sintetik dihasilkan melalui proses sintetis secara kimia. Pewarna identik-alami merupakan pewarna yang disintesis secara kimia sehingga dihasilkan pewarna dengan struktur kimia yang sama seperti pewarna alami misalnya β-karoten, riboflavin, dan kantaxantin. Sedangkan pewarna alami berasal dari sumber-sumber alami yang dapat dimakan/edible (Henry 1996; Delgado-Vargas & Paredes-Lopes 2003). Lebih lanjut menurut Elbe dan
Schwartz (1996); Nielsen et al. (2002), ada dua kategori pewarna yaitu certified
colorants dan uncertified colorants. Certified colorants merupakan pewarna yang
membutuhkan sertifikasi dari FDA (Food and Drugs Administration) untuk penggunaannya di dalam bahan pangan. Pewarna yang termasuk dalam certified
colorants adalah pewarna sintetik seperti FD&C dye dan FD&C lake. FD&C dye
memiliki sifat mudah larut dalam air sedangkan FD&C lake memiliki sifat tidak mudah larut dalam air/larut dalam minyak. Uncertified colorants merupakan pewarna yang tidak membutuhkan sertifikasi dari FDA untuk penggunaan dalam bahan pangan. Pewarna yang bebas dari sertifikasi adalah pewarna alami/pigmen alami (dari tanaman dan hewan) dan pewarna identik-alami seperti β-karoten. Contoh pewarna yang termasuk certified colorants dan uncertified
colorant dapat dilihat pada Tabel 2.3 dan 2.4.
Tabel 2.3 Certified colorants yang diijinkan untuk digunakan Status
Pewarna
Dye Lake
FD&C Blue No. 1 Tetap sementara
FD&C Blue No. 2 Tetap sementara
FD&C Green No. 3 Tetap sementara
FD&C Red No. 3 Tetap sementara
D&C Red No. 40 Tetap sementara
FD&C Yellow No. 5 Tetap sementara
FD&C Yellow No. 6 Tetap sementara
Sumber: Elbe dan Schwartz (1996).
Tabel 2.4 Pewarna alami (uncertified colorants) untuk makanan dan minuman (didaftar oleh FDA)
Pewarna Alami Ekstrak anato Β-Apo-8’-karotenala Β-karotena Bubuk bit Kantaxantina Karamel Minyak wortel Cochineal, karmin
Tepung biji kapas, dipanggang Jus buah dan sayuran
Ekstrak warna anggur Ekstrak kulit anggur
Paprika dan oleoresin paprika Riboflavin
Safron
Kunyit dan oleoresin kunyit
a
hanya sebagai pewarna identik-alami