PENGARUH KOPIGMENTASI TERHADAP STABILITAS
WARNA ANTOSIANIN BUAH DUWET (
Syzygium cumini
)
DIAN INDRAYANI SATYATAMA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengaruh Kopigmentasi Terhadap Stabilitas Warna Antosianin Buah Duwet (Syzygium cumini) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Desember 2008
Dian Indrayani Satyatama
ABSTRACT
DIAN INDRAYANI SATYATAMA. Copigmentation Effect for the Color Stability of Duwet Anthocyanins (Syzygium cumini). Under direction of C. HANNY WIJAYA and DEDE R. ADAWIYAH.
Duwet is a potential fruits utilized as a natural dye due to its anthocyanins contents. Anthocyanins are unstable within a food matrixs. The objective of this research was to achieve an extraction method and part of duwet's fruit with highest antocyanin concentration and to analyze the effect of copigmentation by phenolic acids on the color stability of the anthocyanins during heating, different storage condition, impact of oxidator and light. The phenolic acids which used in this research were ferulic and gallic acid. Anthocyanins from duwet skin were exracted using 3 methods i.e pressing, maceration with etanol and combination of pressing-maceration at room temperature. The highest antocyanin consentration was 3,89 mg/g which was obtained from skin part of duwet fruit using combination of suppressing and maceration as its extract method.
A red purplish color were obtained at skin fruit antocyanin extract when pH 3 was used. The results indicated that the copigmentation treatments were significantly (p<0,05), increasing the color stability of anthocyanins duwet skin in pH 3 toward heating, storaging condition, oxidixing and lighting . During the thermal processing at 40 – 100oC, the highest activation energy was 72,4 kJ/mol observed on the anthocyanin-ferulic acid complex. The activation energy values anthocyanin-gallic acid complex and anthocyanin without copigment were 65,97 kJ/mol and 56,18 kJ/mol. Copigmentations were more effective for the anthocyanins which stored at the room temperature. The highest increasing stability of dye anthocyanins duwet skin were observed on the antocyanins-ferulic acid complex.
RINGKASAN
DIAN INDRAYANI SATYATAMA. Pengaruh Kopigmentasi Terhadap Stabilitas Warna Antosianin Buah Duwet (Syzygium cumini). Dibimbing oleh C. HANNY WIJAYA dan DEDE R. ADAWIYAH.
Warna pada makanan memberi pengaruh pada kualitas produk pangan. Banyaknya masalah yang dapat diakibatkan karena ketidaktahuan masyarakat mengenai aturan kadar dan jenis pewarna buatan yang diizinkan membuat tren yang saat ini beredar dalam masyarakat adalah back to nature. Jenis pewarna yang potensial untuk dikembangkan dengan adanya trend back to nature adalah zat pewarna alami. Antosianin merupakan salah satu pewarna alami yang potensial digunakan untuk produk pangan. Salah satu bahan pangan yang potensial sebagai sumber antosianin adalah buah duwet (Syzygium cumini). Jenis antosianin yang terdapat dalam buah duwet ini diduga ada dua yaitu rhamnosa dan sianidin-3-soporosa namun yang lebih dominan adalah petunidin-3-rhamnosa.
Ekstraksi antosianin buah dan kulit buah duwet pada penelitian ini menggunakan 3 metode ekstraksi yaitu metode pengepresan, maserasi dengan etanol, dan kombinasi pengepresan-maserasi. Proses kopigmentasi antosianin pada penelitian ini menggunakan asam ferulik dan asam galat. Pengamatan dilakukan terhadap stabilitas warna antosianin ekstrak buah duwet karena pengaruh oksidator, cahaya (sinar UV), pemanasan, dan kondisi penyimpanan. Penelitian ini diharapkan dapat meningkatkan potensi buah duwet sebagai bahan pewarna alternatif pada produk pangan dan memberikan informasi mengenai kestabilan zat pewarna alami dari buah duwet yang bermanfaat dalam pengembangan aplikasinya pada produk pangan serta memberikan informasi tentang cara penstabilan pigmen antosianin buah duwet.
Ekstraksi antosianin pada bagian kulit buah duwet dengan menggunakan metode ekstraksi kombinasi pengepresan-maserasi dengan etanol menghasilkan ekstrak kental dengan konsentrasi antosianin tertinggi sebesar 3,89 mg/ g. Ekstrak pigmen antosianin kulit buah duwet dalam penggunaannya pada variasi pH 1 – 8 menunjukkan penurunan intensitas warna merah antosianin dengan semakin meningkatnya nilai pH.
Ekstrak pigmen antosianin kulit buah duwet pada buffer pH 3 menghasilkan warna merah keunguan. Stabilitas warna antosianin kulit buah duwet dalam buffer pH 3 semakin menurun dengan semakin meningkatnya waktu kontak dengan oksidator, sinar ultraviolet, pemanasan dan selama penyimpanan. Proses perubahan warna yang terjadi pada antosianin kulit buah duwet dalam buffer pH 3 selama pemanasan pada suhu 40 sampai 100oC selama 2 jam mengikuti kinetika reaksi ordo satu dengan energi aktivasi sebesar 56,18 kJ/mol.
dikopigmentasi dalam buffer pH 3 selama pemanasan pada suhu 40 sampai 100oC selama 2 jam memiliki energi aktivasi yang lebih besar dibanding perlakuan tanpa kopigmentasi yaitu sebesar 72,4 kJ/mol untuk asam ferulik sebagai kopigmen dan 65,97 kJ/mol untuk asam galat sebagai kopigmen. Secara visual antosianin kulit buah duwet tanpa dan dengan kopigmentasi tidak mengalami pergeseran warna, keduanya masih menunjukkan warna merah keunguan, hanya intensitas warnanya saja yang berubah setelah perlakuan. Antosianin kulit buah duwet yang dikopigmentasi pada pH 3 menunjukkan intensitas warna merah yang lebih tinggi dibandingkan antosianin kulit buah duwet tanpa kopigmentasi setelah perlakuan oksidasi, pencahayaaan, dan pemanasan, begitu juga setelah 30 hari penyimpanan pada suhu ruang dan suhu refrigator.
© Hak Cipta milik IPB, tahun 2008
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya tulis ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENGARUH KOPIGMENTASI TERHADAP STABILITAS
WARNA ANTOSIANIN BUAH DUWET (
Syzygium cumini
)
DIAN INDRAYANI SATYATAMA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Kopigmentasi Terhadap Stabilitas Warna Antosianin Buah Duwet (Syzygium cumini)
Nama : Dian Indrayani Satyatama
NIM : F251050121
Disetujui Komisi Pembimbing
Prof. Dr. Ir. C.Hanny Wijaya, M.Agr Dr. Ir. Dede R.Adawiyah, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Dr. Ir. Ratih Dewanti Hariyadi, M.Sc Prof.Dr.Ir.Khairil A.Notodiputro, M.S.
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 1 September 1984 dari ayah Drs. Giartama, M.Pd dan ibu R.A. Asnani Berlian. Penulis merupakan anak pertama dari satu bersaudara.
Tahun 2001 penulis lulus dari SMU Negeri 1 Indralaya dan pada tahun yang sama lulus seleksi masuk Universitas Sriwijaya melalui jalur PMDK. Penulis memilih Teknologi Hasil Pertanian, Fakultas Pertanian. Penulis lulus tahun 2005. Selanjutnya pada bulan Agustus 2005 atas dukungan orang tua, penulis melanjutkan pendidikan ke sekolah pascasarjana IPB dengan mengambil Program Studi Ilmu Pangan.
PRAKATA
Dengan penuh rasa syukur penulis mengucapkan Alhamdullillah atas limpahan rahmat dan ridha-Nya sehingga penulis dapat menyelesaikan tugas penelitian dan penulisan tesis ini sebagai salah satu syarat untuk mendapatkan gelar Magister Sains pada Program Studi Ilmu Pangan Sekolah Pascasarjana IPB.
Pada kesempatan ini penulis menyampaikan penghargaan dan terima kasih
yang sebesar-besarnya kepada Prof. Dr. Ir. C. Hanny Wijaya, M.Agr dan Dr. Ir. Dede R. Adawiyah, M.Si sebagai komisi pembimbing atas ketulusannya
dalam memberikan bimbingan dan arahannya sejak awal penelitian hingga akhir penulisan tesis ini. Kepada Dr. Ir. Feri Kusnandar, M.Sc, penulis ucapkan terima kasih atas kesediaannya menjadi penguji dan pemberi masukan bagi penulisan tesis ini. Rasa terimakasih juga penulis ucapkan kepada ibu Puspita Sari atas pemberian ide untuk tesis ini.
Penulis mengucapkan terima kasih kepada rekan-rekan IPN 2005 (Mbak Friska, Fitri, Mbak Erni, Bang Akhyar, Lita, Mbak Feni, Mbak Hana, Uni Fitmawati, dan Mbak Anti ), dan IPN 2004-2007 (Yoga, Mbak Silvana, Mbak santi, Mbak Iin) atas kebersamaan dan kerjasamanya selama mengikuti perkuliahan hingga penyelesaian tugas akhir. Penulis juga mengucapkan terima kasih kepada teknisi dan karyawan Laboratorium ITP atas segala bantuan dan kerjasamanya selama pelaksanaan penelitian.
Doa dan terimakasih yang tiada terhingga penulis sampaikan untuk kedua orang tua, semoga Allah SWT memberikan balasan kebaikan yang berlimpah atas segala pengorbanan yang telah diberikan selama mengikuti pendidikan. Terkhusus Bapak, Ibu, Bang Arman dan Sugito, terima kasih atas semangat dan doanya yang selalu menyertai dan menjadi motivasi bagi penulis. Terima kasih penulis ucapkan kepada saudara-saudara dan teman-teman di Palembang, terimakasih atas dukungan dan doanya sejak awal pendidikan hingga akhir penulisan tesis.
Dan pada pihak-pihak lain yang tidak dapat disebutkan satu per satu dimana telah ikut membantu dalam pelaksanaan penelitian dan penulisan tesis, penulis ucapkan terima kasih.
Akhir kata penulis berharap semoga tesis ini bermanfaat bagi yang memerlukan.
Bogor, Desember 2008
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xvi
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
1.3 Manfaat Penelitian ... 4
1.4 Hipotesis ... 4
2 TINJAUAN PUSTAKA ... 5
2.1 Duwet (Syzigium cumini) ... 5
2.2 Pewarna Alami ... 6
2.3 Antosianin ... ... 8
2.3.1 Ekstraksi Antosianin ... 12
2.3.2 Stabilitas Antosianin .. ... 14
2.4 Kopigmentasi ... 16
3 BAHAN DAN METODE ... 18
3.1 Bahan dan Alat ... 18
3.2 Waktu dan Tempat ... 18
3.3 Metodologi Penelitian ... 18
3.3.1 Persiapan bahan ... 19
3.3.2 Optimasi Ekstraksi ... 19
3.3.3 Karakteristik Pigmen Antosianin Kulit Buah Duwet Pada beberapa variasi pH... 20
3.3.4 Stabilitas dan Kopigmentasi Pigmen Antosianin Buah Duwet terpilih ... 21
3.3.4.1 Stabilitas terhadap Oksidator ... 22
3.3.4.2 Stabilitas terhadap sinar UV ...,.... 22
3.3.4.3 Stabilitas terhadap suhu pemanasan... 23
3.3.4.3 Stabilitas terhadap kondisi Penyimpanan... 23
3.3.5 Metode analisa ... 23
3.3.5.1 Total Rendemen Ekstrak ... 23
3.3.5.2 Konsentrasi Antosianin dengan Metoda pH-differential ... 23
3.3.5.3 Rendemen Pigmen Antosianin Analisis Warna dengan Kromameter ... 24
3.3.5.4 Pengukuran Warna dengan Spektrofotometer... 24
3.3.3.5 Analisis Warna dengan Kromameter ... 24
3.3.3.6 Kinetika Degradasi Antosianin terhadap Suhu Pemanasan ... 25
4 HASIL DAN PEMBAHASAN ... 28
4.1 Ekstraksi dan Karakteristik Ekstrak Pigmen Antosianin Buah Duwet ... 28
4.2 Karakterisasi Pigmen Antosianin Kulit Buah Duwet pada Beberapa Variasi pH ... 34
4.3 Stabilitas Pigmen Antosianin Kulit Buah Duwet... 38
4.3.1 Stabilitas terhadap Oksidator ... 38
4.3.2 Stabilitas terhadap sinar UV ...,... 43
4.3.3 Stabilitas terhadap suhu pemanasan... 47
4.3.4 Stabilitas terhadap kondisi Penyimpanan... 54
4.4 Karakterisasi Pigmen Antosianin Kulit Buah Duwet Terkopigmentasi pada Beberapa Variasi pH... 58
4.5 Stabilitas Pigmen Antosianin Kulit Buah Duwet yang Dikopigmentasi dengan Asam Ferulik dan Asam Galat . ... .... 64
4.5.1 Stabilitas Warna Antosianin Ekstrak Kulit Buah Duwet Terkopigmentasi Terhadap Oksidator... 64
4.5.2 Stabilitas Warna Antosianin Ekstrak Kulit Buah Duwet Terkopigmentasi Terhadap sinar UV ... 69
4.5.3 Stabilitas Warna Antosianin Ekstrak Kulit Buah Duwet Terkopigmentasi Terhadap Proses Pemanasan... 73
4.5.4 Stabilitas Warna Antosianin Ekstrak Kulit Buah Duwet Terkopigmentasi Terhadap Kondisi penyimpan ... 82
5 SIMPULAN DAN SARAN ... 89
5.1 Simpulan ... 89
5.2 Saran ... 90
DAFTAR PUSTAKA ... 91
DAFTAR TABEL
Halaman
1 Kandungan nilai gizi buah duwet per 100 g ... 6 2 Gugus pengganti pada stuktur kation flavium untuk membentuk
antosianin... 10 3 Konsentrasi antosianin dari beberapa komoditi buah... 34 4 Perubahan nilai L, a, b dan ohue pada pH 1 sampai 8... 37 5 Perubahan nilai L, a, b dan ohue warna antosianin kulit buah duwet
terhadap pengaruh oksidator pada buffer pH 3... 41 6 Perubahan nilai L, a, b dan ohue warna antosianin kulit buah duwet
terhadap pengaruh sinar UV pada buffer pH 3... 45 7 Pengaruh suhu pemanasan terhadap konstanta laju degradasi
antosianin (k) pada pemanasan ekstrak kulit buah duwet dalam buffer pH 3...
50
8 Perubahan nilai L, a, b dan ohue warna antosianin kulit buah duwet terhadap pengaruh pemanasan selama 2 jam pada beberapa suhu pada buffer pH 3... 52 9 Perubahan nilai L, a, b dan ohue warna antosianin kulit buah duwet
terhadap pengaruh kondisi penyimpanan pada buffer pH 3... 56 10 Perubahan nilai L, a, b dan ohue antosianin ekstrak kulit buah duwet
tanpa dan dengan kopigmentasi pada pH 1 sampai 8... 63 11 Perubahan nilai L, a, b dan ohue warna antosianin kulit buah duwet
tanpa dan dengan kopigmentasi terhadap pengaruh oksidasi pada buffer pH 3... 67 12 Perubahan nilai L, a, b dan ohue warna antosianin kulit buah duwet
tanpa dan dengan kopigmentasi terhadap pengaruh penyinaran dengan sinar UV pada buffer pH 3... 72 13 Pengaruh suhu pemanasan terhadap konstanta laju degradasi
antosianin (k) tanpa dan dengan kopigmentasi pada pemanasan ekstrak kulit buah duwet dalam buffer pH 3...
78
DAFTAR GAMBAR
Halaman
1 Buah Duwet (Syzygium cumini)... 6
2 Rangka stuktur kation flavium dan penomoran atom karbonnya…….. 9
3 Struktur senyawa antosianidin………... 11
4 Stuktur beberapa jenis asam fenolik yang biasa digunakan dalam proses kopigmentasi………... 17
5 Pola kromasitas warna... 25
6 Buah Duwet……… 29
7 Ekstrak kulit buah duwet (Syzigium cumini)……….. 30
8 Total rendemen ekstrak Buah Duwet... 31
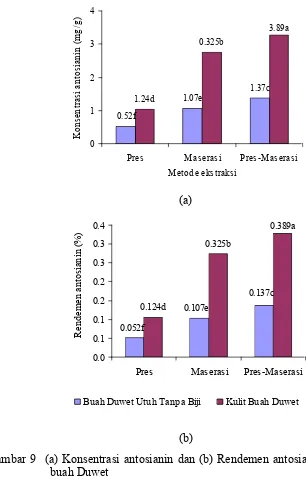
9 (a) Konsentrasi antosianin dan (b) Rendemen antosianin dari ekstrak buah Duwet……… 33
10 Antosianin ekstrak buah duwet pada berbagai tingkat keasaman (a) perubahan absorbansi maksimum pada panjang gelombang 520nm dan (b) pergeseran panjang gelombang maksimum……… Intensitas warna pigmen antosianin kulit buah duwet pada pH 1 – 8… 35 11 Perubahan stuktur antosianin akibat perubahan pH... 36
12 Perubahan warna pigmen antosianin kulit buah duwet pada pH 1 – 8………... 37
13 (a) sebelum penambahan oksidator dan (b) setelah 15 jam kontak dengan oksidator (H2O2)……… 39
14 Perubahan nilai % retensi warna pigmen antosianin akibat pengaruh keberadaan oksidator (H2O2 1%)... 40
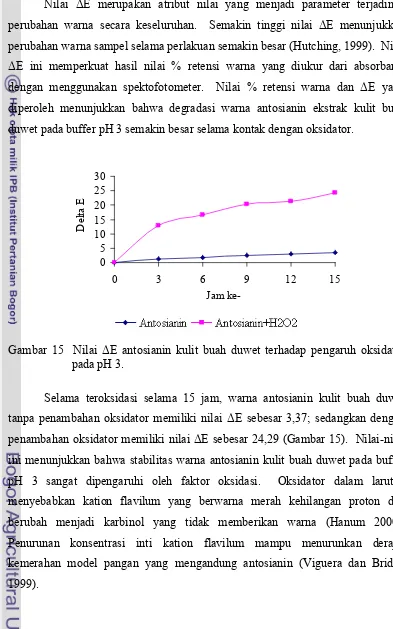
15 Nilai ΔE antosianin kulit buah duwet terhadap pengaruh oksidator pada pH 3……… 42
16 Perubahan warna ekstrak kulit buah duwet akibat pengaruh pencahayaan dengan sinar UV………... 43
17 Nilai retensi warna terhadap sinar UV pada pH 3……….. 44
18 Nilai ΔE antosianin kulit buah duwet terhadap pengaruh penyinaran dengan sinar UV pada pH 3………. 46
19 Warna ekstrak Buah Duwet pada buffer pH 3 setelah 2 jam pemanasan pada suhu 40 sampai 100oC………. 47
20 Perubahan nilai % retensi pada buffer 3 diberbagai suhu pemanasan... 48
22 Hubungan antara nilai ln konstanta laju degradasi antosianin (ln k) dengan kebalikan suhu mutlak (1/T)……….. 51 23 Pengaruh suhu dan lama pemanasan terhadap nilai delta E warna
antosianin ekstrak kulit buah duwet pada buffer pH
3………. 53
24 Antosianin ekstrak kulit buah duwet pada buffer pH 3 (a) sebelum penyimpanan; sesudah 30 hari penyimpanan: (b) suhu ruang dan (c)
suhu refrigator……… 54
25 Pengaruh suhu dan lama penyimpanan terhadap nilai retensi (%) antosianin ekstrak kulit buah duwet pada pH 3………. 55 26 Pengaruh suhu dan lama penyimpanan terhadap nilai ΔE antosianin
ekstrak kulit buah duwet pada buffer pH 3……… 57 27 Antosianin ekstrak buah duwet tanpa dan dengan kopigmentasi pada
berbagai tingkat keasaman (a) perubahan absorbansi maksimum pada panjang gelombang 520nm dan (b) pergeseran panjang gelombang
maksimum………... 59
28 Warna ekstrak Buah Duwet pada kisaran pH 1- 8. (a) tanpa kopigmentasi, (b) kopigmentasi dengan asam ferulik, (c) kopigmentasi dengan asam galat……… 62 29 (a) sebelum penambahan oksidator dan (b) setelah 15 jam kontak
dengan oksidator (H2O2)………. 65 30 Perubahan nilai % retensi warna pigmen antosianin akibat pengaruh
keberadaan oksidator (H2O2 1%)……… 65 31 Nilai ΔE antosianin kulit buah duwet terhadap pengaruh oksidator
pada pH 3……… 68
32 Perubahan warna ekstrak kulit buah duwet (a) hari ke-0 perlakuan, dan (b) Hari ke-7 dengan pencahayaan UV……… 69 33 Nilai retensi warna terhadap sinar UV pada pH 3……….. 70 34 Nilai ΔE antosianin kulit buah duwet tanpa dan dengan kopigmentasi
terhadap pengaruh penyinaran dengan sinar UV pada pH
3……… 73
35 Warna ekstrak Buah Duwet pada berbagai suhu setelah 2 jam pemanasan; (a) tanpa kopigmentasi (b) kopigmentasi dengan asam ferulik dan (c) kopigmentasi dengan asam galat pada buffer pH 3…… 75 36 Perubahan nilai % retensi warna antosianin yang dikopigmentasi
dengan (a) Asam ferulik dan (b) Asam galat pada buffer 3 diberbagai
suhu pemanasan………. 76
37 Hubungan antara nilai ln konstanta laju degradasi antosianin (ln k) tanpa dan dengan proses kopigmentasi dengan kebalikan suhu mutlak
38 Pengaruh suhu dan lama pemanasan terhadap nilai ΔE antosianin ekstrak kulit buah duwet tanpa dan dengan kopigmentasi pada buffer
pH 3……… 81
39 Antosianin kulit buah duwet yang dikopigmentasi pada buffer pH 3 (a) sebelum penyimpanan; sesudah 30 hari penyimpanan: (b) suhu ruang dan (c) suhu refrigator……….. 83 40 Pengaruh kondisi penyimpanan pada (a) suhu ruang (27oC) dan (b)
suhu refrigator (10oC) terhadap nilai retensi warna antosianin ekstrak kulit buah duwet yang dikopigmentasi pada buffer pH 3………... 85 41 Nilai ΔE antosianin kulit buah duwet tanpa dan dengan kopigmentasi
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian………. 98
2 Contoh cara membuat larutan antosianin dan larutan kopigmen……. 99
3 Rendemen ekstrak buah duwet... 100
4 Hasil uji sidik ragam rendemen ekstrak buah duwet……… 100
5 Penentuan konsentrasi antosianin buah duwet... 101
6 Hasil uji sidik ragam rendemen ekstrak buah duwet……… 101
7 Hasil uji sidik ragam konsentrasi ekstrak buah duwet………. 102
8 Absorbansi antosianin ekstrak kulit buah duwet pada berbagai tingkat pH pada panjang gelombang 520 nm……….. 102
9 Pergeseran panjang gelombang maksimum antosianin ekstrak kulit buah duwet pada beberapa variasi pH……….. 103
10 Rata-rata nilai Light antosianin ekstrak kulit buah duwet pada berbagai variasi pH……….. 103
11 Rata-rata nilai a antosianin ekstrak kulit buah duwet pada berbagai variasi pH……….. 104
12 Rata-rata nilai b antosianin ekstrak kulit buah duwet pada berbagai variasi pH………. 104
13 Rata-rata nilai Hue ekstrak antosianin ekstrak kulit buah duwet pada berbagai variasi pH………... 105
14 Perubahan nilai retensi warna (%) antosianin ekstrak kulit buah duwet akibat pengaruh oksidator H2O2 1%... 105
15 Hasil uji sidik ragam pengaruh suhu dan lama kontak dengan H2O2 terhadap % retensi warna antosianin buah kulit buah duwet tanpa penambahan kopigmen………. 106
16 Hasil uji sidik ragam pengaruh suhu dan lama kontak dengan H2O2 terhadap % retensi warna antosianin buah kulit buah duwet dengan penambahan asam ferulik dan asam galat……… 106
17 Perubahan nilai Light antosianin ekstrak kulit buah duwet akibat pengaruh oksidator H2O2 1%... 107
18 Perubahan nilai a antosianin ekstrak kulit buah duwet akibat pengaruh oksidator H2O2 1%... 108
19 Perubahan nilai b antosianin ekstrak kulit buah duwet akibat pengaruh oksidator H2O2 1%... 108
21 Rata-Rata perubahan nilai ΔE antosianin ekstrak kulit buah duwet akibat pengaruh oksidator……… 109 22 Rata-Rata perubahan nilai retensi warna (%) antosianin ekstrak kulit
buah duwet akibat pengaruh sinar UV... 109 23 Hasil uji sidik ragam pengaruh penyinaran dan lama kontak sinar
UV terhadap % retensi warna antosianin buah kulit buah duwet tanpa penambahan kopigmen………... 110 24 Hasil uji sidik ragam pengaruh penambahan kopigmen terrhadap
peningkatan % retensi warna antosianin kulit buah duwet yang disinari UV dibanding dengan antosianin kulit buah duwet yang tidak dikopigmentasi……… 110 25 Hasil uji lanjut BNT (taraf 5%) terhadap pengaruh penambahan
kopigmen terrhadap peningkatan % retensi warna antosianin kulit buah duwet yang disinari UV dibanding dengan antosianin kulit buah duwet yang tidak dikopigmentasi……… 110 26 Rata-Rata perubahan nilai Light antosianin ekstrak kulit buah duwet
akibat pengaruh sinar UV... 111 27 Rata-Rata perubahan nilai a antosianin ekstrak kulit buah duwet
akibat pengaruh sinar UV………. 111 28 Rata-Rata perubahan nilai b antosianin ekstrak kulit buah duwet
akibat pengaruh sinar UV……… 111 29 Rata-Rata perubahan nilai oHue antosianin ekstrak kulit buah duwet
akibat pengaruh sinar UV………. 112 30 Rata-Rata perubahan nilai ΔE antosianin ekstrak kulit buah duwet
akibat pengaruh sinar UV………. 112 31 Rata-rata nilai retensi warna (%) antosianin antosianin ekstrak kulit
buah duwet tanpa kopigmentasi pada berbagai tingkatan suhu……... 112 32 Hasil uji sidik ragam pengaruh suhu dan lama pemanasan terhadap
% retensi warna antosianin buah kulit buah duwet tanpa
penambahan kopigmen………. 113
33 Rata-rata nilai retensi warna (%) antosianin antosianin ekstrak kulit buah duwet yang dikopigmentasi dengan asam ferulik pada berbagai
tingkatan suhu……….. 113
34 Rata-rata nilai retensi warna (%) antosianin antosianin ekstrak kulit buah duwet yang dikopigmentasi dengan asam galat pada berbagai
tingkatan suhu……….. 114
35 Hasil uji sidik ragam pengaruh penambahan asam ferulik dan asam galat % retensi warna antosianin buah kulit buah duwet dibandingkan dengan antosianin tanpa kopigmen pada buffer pH 3
selama pemanasan……… 114
36 Kinetika degradasi antosianin ekstrak kulit buah duwet pada buffer
37 Rata-rata nilai Light antosianin antosianin ekstrak kulit buah duwet tanpa kopigmentasi pada berbagai tingkatan suhu………... 120 38 Rata-rata nilai Light antosianin antosianin ekstrak kulit buah duwet
yang dikopigmentasi dengan asam ferulik pada berbagai tingkatan
suhu……….. 120
39 Rata-rata nilai Light antosianin antosianin ekstrak kulit buah duwet yang dikopigmentasi dengan asam galat pada berbagai tingkatan
suhu……….. 121
40 Rata-rata nilai a antosianin antosianin ekstrak kulit buah duwet tanpa kopigmentasi pada berbagai tingkatan suhu………... 121 41 Rata-rata nilai a antosianin antosianin ekstrak kulit buah duwet yang
dikopigmentasi dengan asam ferulik pada berbagai tingkatan suhu… 122 42 Rata-rata nilai a antosianin antosianin ekstrak kulit buah duwet yang
dikopigmentasi dengan asam galat pada berbagai tingkatan suhu…... 122 43 Rata-rata nilai b antosianin antosianin ekstrak kulit buah duwet
tanpa kopigmentasi pada berbagai tingkatan suhu………... 123 44 Rata-rata nilai b antosianin antosianin ekstrak kulit buah duwet yang
dikopigmentasi dengan asam ferulik pada berbagai tingkatan suhu… 123 45 Rata-rata nilai b antosianin antosianin ekstrak kulit buah duwet yang
dikopigmentasi dengan asam galat pada berbagai tingkatan suhu…... 124 46 Rata-rata nilai oHue antosianin antosianin ekstrak kulit buah duwet
tanpa kopigmentasi pada berbagai tingkatan suhu………... 124 47 Rata-rata nilai oHue antosianin antosianin ekstrak kulit buah duwet
yang dikopigmentasi dengan asam ferulik pada berbagai tingkatan
suhu……….. 125
48 Rata-rata nilai oHue antosianin antosianin ekstrak kulit buah duwet yang dikopigmentasi dengan asam galat pada berbagai tingkatan
suhu……….. 125
49 Rata-rata nilai ΔE antosianin antosianin ekstrak kulit buah duwet tanpa kopigmentasi pada berbagai tingkatan suhu………...
126 50 Rata-rata nilai ΔE antosianin antosianin ekstrak kulit buah duwet
yang dikopigmentasi dengan asam ferulik pada berbagai tingkatan
suhu………... 126
51 Rata-rata nilai ΔE antosianin antosianin ekstrak kulit buah duwet yang dikopigmentasi dengan asam galat pada berbagai tingkatan
suhu………... 127
52 Rata-rata perubahan nilai retensi warna (%) antosianin ekstrak kulit buah duwet selama penyimpanan………. 127
penambahan kopigmen………. 128 54 Hasil uji sidik ragam dan uji lanjut BNT (taraf 5%) pengaruh
penambahan asam ferulik dan asam galat terhadap % retensi warna antosianin buah kulit buah duwet dibandingkan dengan antosianin tanpa kopigmen dalam buffer pH 3 selama perlakuan suhu dan lama
penyimpanan………. 128
55 Rata-rata perubahan nilai Light antosianin ekstrak kulit buah duwet
selama penyimpanan……… 129
56 Rata-rata perubahan nilai a antosianin ekstrak kulit buah duwet selama penyimpanan... 130 57 Rata-rata perubahan nilai b antosianin ekstrak kulit buah duwet
selama penyimpanan……… 130
58 Rata-rata perubahan nilai Hue ekstrak antosianin antosianin ekstrak kulit buah duwet selama penyimpanan………. 131 59 Rata-rata perubahan nilai ΔE ekstrak antosianin antosianin ekstrak
I PENDAHULUAN
1.1 Latar Belakang
Warna pada makanan dapat memberi pengaruh pada kualitas produk pangan. Warna dapat membuat produk menjadi lebih menarik serta meningkatkan kualitas produk pangan tersebut serta mempengaruhi penerimaan konsumen. Penggunaan pewarna antara lain terdapat pada berbagai jenis makanan dan minuman seperti produk jam, jelly dan jus (Winarno, 1997).
Dengan berkembangnya industri pengolahan pangan dan terbatasnya jumlah dan mutu zat pewarna alami, menyebabkan penggunaan zat warna sintetis meningkat. Sejak ditemukannya zat pewarna sintetik penggunaan pigmen sebagai zat warna alami semakin menurun, meskipun keberadaannya tidak menghilang sama sekali (Winarno, 1992). Hal ini dikarenakan zat pewarna sintetik memiliki beberapa kelebihan diantaranya; mudah diproduksi, murah, kekuatan warna dan variasi warna yang lebih baik dibandingkan zat pewarna alami (Nielsen et al., 2002). Akan tetapi, penggunaan pewarna buatan seringkali tidak mengikuti peraturan yang berlaku yaitu penggunaan yang seringkali berlebihan dari semestinya. Banyaknya masalah yang dapat diakibatkan karena ketidakahuan masyarakat mengenai aturan kadar dan jenis pewarna buatan yang diizinkan membuat tren yang saat ini beredar dalam masyarakat adalah back to nature.
Sejak zaman dulu telah banyak digunakan pewarna alami atau pigmen sebagai pewarna bahan makanan (Winarno, 1992). Pigmen merupakan substansi alami yang terdapat dalam sel atau jaringan tumbuhan dan hewan yang memberikan efek warna (Elbe dan Schwartz, 1996). Tidak pernah ditemui adanya masalah terhadap kesehatan manusia terhadap penggunaan pewarna alami yang telah turun temurun tersebut. Contoh dari pewarna alami yang biasa digunakan adalah klorofil, antosianin, dan karotenoid (Winarno, 1992).
Zat pewarna alami yang potensial dikembangkan adalah antosianin. Ant osianin m erupakan sej enis bahan pew arna m akanan bukan
sint et ik yang banyak t erdapat alam i pada buah, kelopak bunga
berbagai m acam w arna sepert i m erah, m erah j am bu, m erun,
ungu m uda dan biru sesuai j enis t um buh- t um buhan dan bagian
yang m engandung ant osianin. Berbagai jenis tanaman dapat dijadikan sebagai sumber antosianin seperti kol merah, strawberry, cherry, plum, radish, anggur dan sebagainya (Jackman dan Smith, 1996)
Salah satu bahan pangan yang memiliki potensi untuk dijadikan pewarna alami yaitu buah duwet (Syzygium cumini). Duwet atau jamblang adalah buah kecil-kecil berwarna ungu yang banyak dijual di pasar-pasar tradisional dengan harga murah dan disukai anak-anak.
Kenampakan kulit buah duwet masak berwarna ungu kehitaman menunjukkan adanya kandungan antosianin. Lebih lanjut disebutkan dalam Leimena (2008), jenis antosianidin yang terdapat dalam buah duwet diduga adalah petunidin sedangkan jenis antosianin yang terdapat dalam buah duwet ini diduga ada dua yaitu petunidin-3-rhamnosa dan sianidin-3-soporosa. Jenis antosianin yang lebih banyak adalah petunidin-3-rhamnosa.
Aplikasi berbagai zat warna, khususnya antosianin di dalam produk pangan membutuhkan stabilitas yang baik (Hanum, 2000). Beberapa penelitian telah dilakukan untuk mengekstrak dan mencari tingkat kestabilan antosianin dari berbagai sumber seperti anggur (Calvi dan Francis, 1978); strawberry (Poei-langston dan Wrolstad, 1981) dan sebagainya. Ekstraksi antosianin pada kulit buah duwet harus dilakukan dengan metode ekstraksi yang sesuai sehingga dapat dihasilkan rendemen yang tinggi.
Sari et al., 2005) yang menyebutkan bahwa antosianin adalah pigmen yang sifatnya polar dan akan larut dengan baik dalam pelarut-pelarut polar.
Untuk penggunaan ekstrak antosianin kulit buah duwet pada pangan, maka perlu diketahui stabilitasnya selama pengolahan dan penyimpanan. Stabilitas antosianin terutama dipengaruhi oleh pH, suhu, cahaya, oksigen, stuktur dan konsentrasi antosianin, dan kehadiran komponen lain seperti flavonoid lain, protein dan mineral. Stabilitas warna antosianin dapat diperbaiki dengan kopigmentasi, dimana molekul antosianin direaksikan dengan komponen alami lain yang terkandung dalam tumbuhan secara langsung atau dengan interaksi yang lemah yang memperkuat dan membantu menstabikan warna (Darias-Martin et al., 2002; Talcot et al., 2003). Kopigmentasi antosianin memberikan kecerahan, kekuatan dan warna yang lebih stabil. Kopigmentasi juga diketahui bertanggung jawab dalam stabilitas warna bluish flowers, berri dan warna dari wine (Brouillard, 1983; Liao et al., 1992; Brouillard and Dangles, 1994; Yabuya et al., 1997; Bloor and Falshaw, 2000; Maarit, 2005).
Kopigmen yang dipakai dalam penelitian ini menggunakan asam ferulik dan asam galat didukung oleh banyak literatur antara lain penggunaan asam ferulik dalam proses kopigmentasi malvin-3,5-diglukosida (Dimitric et al., 2000) dan penggunaan asam ferulik dan asam galat dalam proses kopigmentasi antosianin buah berry (Maarit and Marina, 2002; Maarit, 2005)
1.2 Tujuan
Penelitian ini bertujuan untuk:
1. Mendapatkan metode ekstraksi dan bagian buah duwet yang menghasilkan konsentrasi antosianin paling tinggi
2. Mempelajari stabilitas warna antosianin ekstrak buah duwet terhadap oksidator, cahaya (sinar UV), pemanasan, dan kondisi penyimpanan.
1.3 Manfaat Penelitian
Penelitian ini diharapkan dapat meningkatkan potensi buah duwet sebagai bahan pewarna alternatif pada produk pangan dan memberikan informasi mengenai kestabilan zat pewarna alami dari buah duwet yang bermanfaat dalam pengembangan aplikasinya pada produk pangan serta memberikan informasi tentang cara penstabilan pigmen antosianin buah duwet.
1.4 Hipotesis
II TINJAUAN PUSTAKA
2.1 Duwet (Syzygium cumini)
Duwet atau Jamblang tergolong tumbuhan buah-buahan yang berasal dari Asia dan Australia tropik yang termasuk dalam famili Myrtaceae yang biasa ditanam di pekarangan atau tumbuh liar, terutama di hutan jati. Duwet tumbuh di dataran rendah sampai ketinggian 500 m dpl. Pohon dengan tinggi 10-20 m ini berbatang tebal, tumbuhnya bengkok, dan bercabang banyak. Daun tunggal, tebal, tangkai daun 1-3,5 cm. Helaian daun lebar bulat memanjang atau bulat telur terbalik, pangkal lebar berbentuk baji, tepi rata, pertulangan menyirip, permukaan atas mengilap, panjang 7-16 cm, lebar 5-9 cm, warnanya hijau (Anonim, 2005).
Buah duwet bertipe buni, berbentuk lonjong sampai bulat-telur, seringkali membengkok, bermahkotakan cuping kelopak, panjangnya 1-5 cm, berwarna ungu tua, bergerombol mencapai 40 butir; daging buahnya berwarna kuning-kelabu sampai ungu, mengandung banyak sari buah, hampir tidak berbau, dengan rasa sepat keasaman. Bijinya 0-5 butir, berbentuk lonjong, panjangnya sampai 3,5 cm, berwarna hijau sampai coklat. Rasanya agak asam dan sepat. Kulit buah bisa digunakan sebagai zat pewarna (Anonim, 2005).
Duwet dikenal diberbagai daerah di Indonesia dengan nama yang berbeda-beda antaralain di Sumatera: jambe kleng (Aceh), jambu kling (Gayo), jambu kalang (Minangkabau). Jawa: jamblang (Sunda), juwet, duwet, d. manting (Jawa), dhalas, d. bato, dhuwak (Madura). Sulawesi: raporapo jawa (Makasar), alicopeng (Bugis). Maluku: jambula (Ternate). Melayu: jamlang, jambelang, duwet. Duwet juga dikenal memiliki banyak nama asing diantaranya Hainan pu tao, wu kou guo, zi pu tao (C), waa (T), java plum, black plum, jambolan, jambul (Anonim, 2005).
matang ditaburi dengan garam dan diaduk dalam sebuah mangkuk tertutup untuk melunakkannya. Buah ini juga biasa diolah menjadi sari buah, jeli atau anggur.
Gambar 1 Buah Duwet (Syzygium cumini)
Anggur duwet diproduksi secara komersial di Filipina. Daunnya digunakan sebagai pakan. Bunganya mengandung banyak nektar yang dapat menghasilkan madu dengan kualitas baik. Kulit kayunya terasa sepat dan dapat digunakan sebagai obat kumur. Kulit buahnya dapat digunakan sebagai pewarna. Tepung bijinya bermanfaat untuk mengobati kencing manis, disentri, diare dan penyakit lain (Verheij dan Coronel, 1997). Nilai gizi yang terkandung dalam buah duwet per 100 gramnya dapat dilihat pada Tabel 1.
Tabel 1 Kandungan nilai gizi buah duwet per 100 g*
Kandungan Jumlah (satuan)
Air Protein Lemak Serat kasar Karbohidrat Abu
84 – 86 g 0.2 – 0.7 g
0.3 g 0.3 – 0.9 g
14 – 16 g 0.4 – 0.7 g Verheij dan Coronel (1997)
2.2 Pewarna Alami
bertujuan: (1) memperbaiki penampakan makanan yang memudar akibat pengolahan; (2) memperoleh warna yang seragam pada komoditi yang warna alamiahnya tidak seragam; (3) memperoleh warna yang lebih baik daripada warna aslinya; (4) melindungi vitamin dan flavor yang peka terhadap cahaya selama penyimpanan; (5) sebagai identitas produk dan (6) indikator visual dari kualitas (Hendry, 1996; Francis, 2002).
Menurut Levine (1978), warna merupakan karakteristik cahaya yang dapat diukur intensitas dan panjang gelombangnya. Suatu zat akan berwarna jika zat tersebut melakukan absorbsi selektif sinar yang masuk dan meneruskan sebagian sinar yang tidak diabsorbsi atau sinar yang lewat. Absorbsi timbul karena getaran elektron yang ada dalam molekul suatu zat dan elektron peka terhadap cahaya dengan frekuensi tertentu. Sedangkan, menurut Francis dan Cydesdale, (1975), warna adalah suatu sensasi rangsangan yang berkaitan dengan energi dalam bentuk sinar pada kisaran sinar tampak yang diterima oleh retina mata. Warna yang dapat dilihat oleh mata manusia merupakan sinar tampak pada kisaran panjang gelombang 380 – 780 nm.
Warna suatu senyawa organik disebabkan oleh adanya gugus-gugus tertentu dalam molekulnya yang dikenal dengan gugus pembawa warna (gugus kromofor). Dalam suatu senyawa zat warna, bagian dari molekul yang mengandung gugus kromofor disebut kromagen. Untuk menimbulkan warna cukup dengan adanya satu gugus kromofor pada inti. Suatu zat warna biasanya mengandung lebih dari satu gugus kromofor. Warna suatu senyawa akan menjadi gelap dengan bertambahnya berat molekul, khususnya dengan bertambahnya kromofor (Woodroof et al., 1975).
Warna yang tampak pada makanan dikarenakan dua hal, yaitu penambahan pewarna sintetis dan karena adanya pigmen alami atau tanpa tambahan bahan dari luar. Berdasarkan sumbernya, zat pewarna dapat diklasifikasikan menjadi zat pewarna alami dan zat pewarna sintetik (DeMan, 1997; Winarno, 1997).
Berdasarkan sumbernya selain zat pewarna alami dan sintetik juga terdapat klasifikasi zat pewarna identik alami. Zat pewarna identik alami merupakan zat pewarna yang disintesis secara kimia sehingga menghasilkan zat pewarna dengan stuktur kimia yang sama seperti zat pewarna alami misalnya beta-karoten, klorofil dan sebagainya.
Menurut Nielsen dan Holst (2002), zat pewarna dapat diklasifikasikan menjadi certified colourants dan uncertified colourants. Certified colourants merupakan zat pewarna yang membutuhkan sertifikasi dari FDA (Food and Drugs Administration) untuk penggunaannya di dalam bahan pangan. Contoh zat pewarna yang tergolong dalam certified colourants merupakan zat pewarna sintetik seperti FD&C dye dan FD&C lake. FD&C dye memiliki sifat mudah larut dalam air sedangkan FD&Clake memiliki sifat tidak mudah larut air.
Uncertified colourants merupakan zat pewarna yang tidak membutuhkan sertifikasi dari FDA untuk penggunaannya di dalam bahan pangan. Contoh zat pewarna yang tergolong ke dalam uncertified colourants adalah zat pewarna alami (dari tanaman dan hewan) dan zat pewarna mineral (titanium oksida dan besi oksida) yang tergolong tidak membahayakan untuk kesehatan manusia. Contoh zat pewarna yang termasuk certified colourants antaralain erythrosine, brilliant blue, acid violet, indigotin, dan fast green, sedangkan contoh zat pewarna yang termasuk uncertified colourants antaralain antosianin, klorofil, betasianin, karoten dan titanium oksida (Winarno, 1997).
Zat pewarna sintetik pada umumnya digunakan oleh banyak industri pangan, karena memiliki banyak keunggulan diantaranya stabilitas warna dan variasi warnanya lebih baik dibandingkan zat pewarna alami (Winarno, 1997). Namun demikian, dalam pembuatan zat pewarna sintetik seringkali melibatkan penggunaan asam sulfat dan asam nitrat sehingga membuka peluang kontaminasi dari logam berat dan memiliki efek karsinogenik.
Dampak negatif dari zat pewarna sintetik kini mendorong berkembangnya trend peningkatan penggunaan zat pewarna alami pada beberapa industri pangan (Cai dan Corke, 2000).
Antosianin merupakan zat pewarna alami yang tergolong ke dalam turunan benzopiran. Stuktur utama turunan benzopiran ditandai dengan adanya dua cincin aromatik benzena (C6H6) yang dihubungkan dengan tiga atom karbon yang membentuk cincin. Antosianin merupakan pigmen alami yang dapat menghasilkan warna biru, ungu, violet, magenta dan kuning. Pigmen ini larut dalam air yang terdapat pada bunga, buah dan daun tumbuhan. (Moss, 2002).
Antosianin terdapat dalam vakuola sel bagian tanaman. Vakuola adalah organel sitoplasmik yang berisikan air, serta dibatasi oleh membran yang identik dengan membran tanaman (Kimbal, 1993).
Secara kimia antosianin merupakan turunan garam flavilum atau benziflavilum. Antosianin merupakan satuan gugus glikosida yang terbentuk dari gugus aglkion dan glikon (Markakis, 1982). Terdapat lima jenis gula yang ditemui pada molekul antosianin, yaitu: glukosa, rhamnosa, galaktosa, xilosa dan arabinosa. Sedangkan senyawa-senyawa bentuk lainnya sangat jarang ditemui (Francis, 1985).
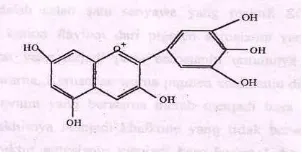
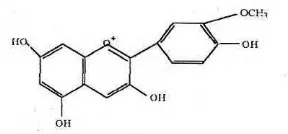
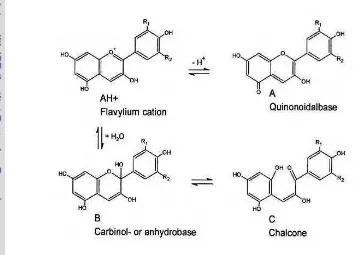
Dua puluh jenis senyawa antosianin telah ditemukan, tetapi hanya enam jenis yang memegang peranan penting di dalam bahan pangan dan sering ditemukan yaitu pelardoginin, sianidin, peonidin, delfidin, petunidin dan malvidin (Sulivan, 1995). Stuktur ke enam jenis antosianidin dapat dilihat pada Gambar 4. Menurut Tranggono (1990), semua antosianidin merupakan derivat dari stuktur dasar kation flavilium. Pada molekul flavilium ini terjadi substitusi dengan molekul OH dan Ome untuk membentuk antosianidin. Adapun rangka stuktur antosianidin dan penomoran atom karbonnya dapat dilihat pada Gambar 2.
Pada setiap inti flavium terdapat sejumlah molekul yang berperan sebagai gugus pengganti. Tabel 1 menunjukkan sejumlah gugus pengganti yang paling umum ditemui pada antosianin. Untuk lebih jelasnya stuktur antosianidin dapat dilihat pada Gambar 2.
Tabel 2 Gugus pengganti pada stuktur kation flavium untuk membentuk antosianin.
Gugus pada Karbon nomor Stuktur Antosianidin
3’ 4’ 5’ Pelargonidin
Sianidin Delpinidin Peonidin Petunidin Malvidin
H OH OH OMe OMe OMe
OH OH OH OH OH OH
H H OH H OH OMe Sumber: Tranggono,1990.
Pelargonidin (3, 5, 7, 4’ kation tetrahidrosiflavium)
Sianidin (3, 5, 7, 3’, 4’ kation pentahidroksiflavium)
Peonidin (3, 5, 7, 4’ kation tetrahidroksi-3’- metoksiflavium)
Petunidin (3, 5, 7, 4’, 5’ kation pentahidroksi-3’-metoksiflavium)
[image:31.595.241.385.107.174.2]Malvidin (3, 5, 7, 4’ kation tetrahidroksi-3’,5’-dimetoksiflavium) Gambar 3 Struktur senyawa antosianidin (Francis, 1985)
Antosianin adalah salah satu senyawa yang reaktif. Sifat reaktif ini disebabkan oleh inti kation flavium dari pigmen antosianin yang kekurangan elektron. Reaksi-reaksi yang terjadi pada antosianin umumnya menyebabkan terjadinya kerusakan warna. Kerusakan warna pigmen antosianin disebabkan oleh berubahnya kation flavium yang berwarna merah menjadi basa karbinol yang tidak berwarna (Francis, 1985).
Warna antosianin berubah dengan berubahnya pH. Pada pH tinggi antosianin akan berwarna biru, kemudian berwarna violet dan akhirnya berwarna merah pada pH rendah (DeMan, 1997). Jumlah gugus hidroksi yang dominan menyebabkan warna cendrung biru dan relatif tidak stabil. Sedangkan jumlah gugus metoksi yang dominan dibandingkan gugus hidroksi pada stuktur antosianidin, menyebabkan warna cendrung merah dan relatif lebih stabil. Selain pengaruh pH, warna antosianin dipengaruhi oleh konsentrasi pigmen dan adanya campuran dengan pigmen lain (kopigmentasi) serta terbentuknya ikatan dengan partikel gula atau koloid (Winarno, 1992).
2.3.1 Ekstraksi Antosianin
Ekstraksi merupakan suatu cara untuk memisahkan campuran beberapa zat menjadi komponen terpisah (Winarno et al., 1973). Waktu ekstraksi zat pewarna alami harus diketahui secara optimal dan juga harus dipertimbangkan dari segi efektifitasnya. Efektifitas ekstraksi tidak dapat dilepaskan dari kemampuan bahan pengekstrak untuk melarutkan senyawa yang diekstrak.
Peristiwa pembentukan larutan dikatakan sebagai interaksi antara pelarut dengan zat yang dilarutkan (Winarno et al., 1973). Bila dikaitkan dengan energi, maka defenisi pelarutan adalah: (1) Peristiwa pemutusan solut-solut yang membutuhkan energi; (2) Peristiwa pemutusan ikatan solven-solven yang membutuhkan energi; (3) Peristiwa pembentukan ikatan solut-solven yang menghasilkan energi. Jadi apabila energi yang dilepaskan pada tahap 3 dapat menutup energi yang dibutuhkan pada tahap 1 dan 2 maka zat dapat terlarut (Petrucci, 1987).
atomnya dengan membagi secara bersama elektron-elektron dari atomnya. Ikatan yang terjadi dikenal sebagai ikatan kovalen (Hart, 1990).
Antosanin dapat diekstrak dengan pelarut agak polar dan jenis pelarut yang digunakan mempunyai kesesuaian kelarutan dengan antosianin, baik dari segi polaritasnya maupun tingkat kelarutannya dalam air atau dapat bercampur dengan air dalam berbagai proporsi. Karena kelarutan suatu zat ke dalam suatu pelarut sangat ditentukan oleh kecocokan sifat antara zat terlarut dengan pelarut, yaitu like disolves like (Sari et al., 2005).
Menurut Markakis (1982), metode ekstraksi yang paling baik untuk bahan yang berasal dari tanaman adalah dengan melarutkan bahan ke dalam 1% HCl dalam metanol. Untuk penerapan dalam pangan, metode ekstraksi yang paling baik adalah dengan melarutkan bahan dengan 1% HCl dalam etanol. Hal ini dikarenakan sifat toksik dari metanol. Berbagai contoh ekstraksi antosianin misalnya ekstraksi dengan menggunakan etanol dengan HCl 1,5N pada kulit buah rambutan, ekstraksi dengan menggunakan etanol pada kulit buah duwet (Wijaya et al. 2001; Sari et al. 2005).
Menurut Strack dan Wray (1993), penambahan asam sebagai pelarut tidak selalu diperlukan. Metode ekstraksi yang digunakan untuk analisis kuantitatif harus diperiksa secara menyeluruh pada tanaman dan jenis pigmen tertentu. Jika terdapat gugus asil pada antosianin misalnya di dalam kubis ungu, maka penggunaan asam sebagai campuran pelarut harus dihindarkan. Hal ini disebabkan ikatan asil ini mudah terhidrolisis (Markakis 1982). Beberapa contoh ekstraksi yang tidak menggunakan asam adalah pada ekstraksi capulin (Prunus serotina Ehrn), sirup blueberry, sorgum hitam, dan kacang polong ungu (Pisum spp). Pelarut yang digunakan pada ekstraksi Capulin adalah aseton, pada ekstraksi sirup blueberry pelarut yang digunakan adalah etanol, pada sorgum hitam pelarut yang digunakan adalah air:aseton (70:30) dan pada kacang polong ungu pelarut yang digunakan adalah 15% aseton (Galindo et al. 1999; Terahara et al. 2000)
lama proses ekstraksi; 3) jumlah tingkat ekstraksi yang dilakukan; 4) suhu ekstraksi dan 5) sifat zat pelarut maupun bahan (Maryanto, 1997).
2.3.2 Stabilitas Antosianin
Menurut Francis (2002), stabilitas warna suatu bahan pangan merupakan salah satu parameter penting dalam quality control. Jika dibandingkan dengan pewarna sintetik pada umumnya zat warna alami dari sumber nabati maupun hewani, memiliki tingkat stabilitas warna yang lebih rendah. Oleh karena itu, berbagai teknologi untuk meningkatkan stabilitas zat pewarna alami di dalam bahan pangan telah banyak dilakukan (Francis, 2002).
Secara umum stabilitas antosianin dapat dipengaruhi oleh beberapa faktor seperti: stuktur dan konsentrasi antosianin, derajat keasaman (pH), oksidator, cahaya, suhu, dan sebagainya (Jackman dan Smith, 1996).
1. Stuktur dan konsentrasi antosianin
Struktur dan konsentrasi antosianin merupakan salah satu faktor yang mempengaruhi stabilitas warna antosianin. Adanya glikosilasi dan asilasi pada struktur antosianin dapat meningkatkan stabilitas antosianin (Rein, 2005). Glikosilasi pada struktur antosianidin umumnya terjadi pada karbon no 3 atau 5 (Eskin, 1979). Beberapa jenis gula yang dapat terglikosilasi misalnya jenis monosakarida hingga disakarida. Glikosilasi stuktur antosianidin dengan disakarida relatif lebih stabil dibandingkan monosakarida. Jumlah gugus gula yang terikat juga mempengaruhi stabilitas warna antosianin. Malvidin-3,5-diglikosida memiliki stabilitas warna lebih tinggi dibandingkan malvidin-3-glikosida (Viguera dan Bridle, 1999).
2. pH
seperti jus, minuman ringan, pikel, acar, puding, yogurt, dan sebagainya (Markakis, 1982).
Harper (1968) berpendapat bahwa pada kisaran pH 1 – 3, pigmen antosianin berada dalam bentuk oksonium (I) yang berwarna merah dan merupakan bentuk yang paling stabil. Bentuk tersebut dapat mengalami hidrolisis pada pH yang lebih tinggi membentuk pseudobasa yang mulai kehilangan warna. Pseudobasa yang terbentuk ini mengalami kesetimbangan tautomerik. Kesetimbangan antara bentuk keto dan bentuk enol menghasilkan alfa diketon yang menghasilkan warna biru.
3. Oksidator
Oksidator dapat menstimulasi terjadinya proses degradasi antosianin secara langsung dan tidak langsung. Secara langsung oksidator mampu menyebabkan oksidasi antosianin membentuk senyawa tidak berwarna yang menurunkan stabilitas warna antosianin (Rein, 2005).
4. Cahaya
Cahaya merupakan faktor yang turut berperan dalam proses degradasi antosianin. Cahaya memiliki energi tertentu yang mampu menstimulasi terjadinya reaksi fotokimia (fotooksidasi) dalam molekul antosianin (Jackman dan Smith, 1996). Reaksi fotokimia (fotooksidasi) dapat menyebabkan pembukaan cincin aglikon pada antosianin yang diawali oleh pembukaan cincin karbon no.2. Pada akhirnya reaksi fotokimia (fotooksidasi) tersebut mampu membentuk senyawa yang tidak berwarna seperti kalkon sebagai indikator degradasi antosianin (Wijaya et al., 2001).
5. Suhu
2.4 Kopigmentasi
Stabilitas warna antosianin dapat dipertahankan atau ditingkatkan dengan reaksi kopigmentasi. Phenomena kopigmentasi telah diamati pertama kali pada tahun 1916 oleh Willstatter dan Zollinger, pada pigmen dari anggur, oenin (malvidin 3-glukosida) dengan penambahan tanin dan asam galat (Maarit, 2005).
Kopigmentasi adalah interaksi antara stuktur antosianin dengan molekul lain seperti logam (Al3+, Fe3+, Sn2+, Cu2+) dan molekul organik lain seperti senyawa flavonoid lain (flavon, flavonon dan juga flavonol), senyawa alkaloid (kafein), dan sebagainya. Adanya kopigmentasi dengan logam dan molekul organik lain cendrung meningkatkan stabilitas warna antosianin (Jackman dan Smith, 1996).
Kopigmentasi secara alami dapat memperbaiki warna antosianin pada produk pangan, dimana stabilitas dan kekuatan warna antosianin dapat ditingkatkan dengan penambahan ekstrak dari tanaman yang berbeda yang kaya akan kopigmen. Hal ini juga didukung oleh penelitian Wilska-Jezka dan Korzuchowska (1996) yang menyatakan bahwa pengaruh kopigmentasi memperkuat dan lebih menstabilkan warna jus berri dari pada warna jus berri tanpa perlakuan kopigmentasi.
Phenomena kopigmentasi ditunjukkan sebagai efek bathokromik (Δ max) yaitu pergeseran absorpsi panjang gelombang maksimumnya ( max) dalam jarak visible peningkatan panjang gelombang dimana juga disebut sebagai bluing effect, seperti warna antosianin berubah dari merah menjadi lebih merak kebiruan karena kopigmentasi (Asen et al., 1972), atau efek hiperkromik (ΔA), dimana dalam hal ini intensitas warna antosianin diperkuat dengan kopigmentasi. Wilska-Jeszka dan Kurchowska (1996) melaporkan bahwa intensitas warna strawberi dan chokeberry meningkat dengan meningkatnya penambahan kopigmen.
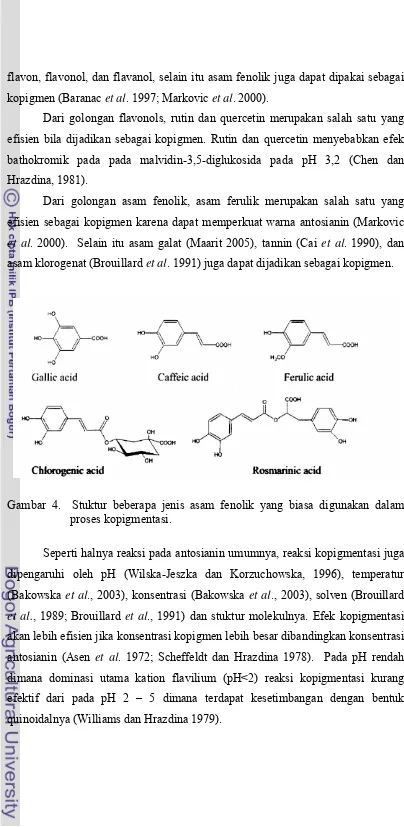
flavon, flavonol, dan flavanol, selain itu asam fenolik juga dapat dipakai sebagai kopigmen (Baranac et al. 1997; Markovic et al. 2000).
Dari golongan flavonols, rutin dan quercetin merupakan salah satu yang efisien bila dijadikan sebagai kopigmen. Rutin dan quercetin menyebabkan efek bathokromik pada pada malvidin-3,5-diglukosida pada pH 3,2 (Chen dan Hrazdina, 1981).
[image:37.595.106.510.15.842.2]Dari golongan asam fenolik, asam ferulik merupakan salah satu yang efisien sebagai kopigmen karena dapat memperkuat warna antosianin (Markovic et al. 2000). Selain itu asam galat (Maarit 2005), tannin (Cai et al. 1990), dan asam klorogenat (Brouillard et al. 1991) juga dapat dijadikan sebagai kopigmen.
Gambar 4. Stuktur beberapa jenis asam fenolik yang biasa digunakan dalam proses kopigmentasi.
III METODOLOGI PENELITIAN
3.1 BAHAN DAN ALAT
Bahan utama yang digunakan dalam penelitian ini adalah buah duwet yang diperoleh dari Jember Jawa Timur. Bahan-bahan lain yang digunakan adalah etanol, aquadest, buffer potasium klorida, buffer sodium asetat, H2O2, HCl 37%, NaOH, DMSO, natrium benzoat, asam ferulik dan asam galat.
Alat yang digunakan adalah alat-alat gelas, neraca, hand blender, hidrolic press, stirer, sentrifus, penyaring vakum, rotary vakum evaporator, freeze drying, vortek, water bath, pH meter, lampu UV, termometer, mikropipet, spektrofotometer dan khromameter.
3.2 Tempat dan Waktu
Penelitian berlangsung dari bulan Maret 2007 sampai Juni 2008. Penelitian dilakukan di laboratorium Kimia Pangan, Biokimia, laboratorium Teknologi Pengolahan Departemen ITP-IPB dan laboratorium Kimia Fakultas MIPA-IPB.
3.3 Metode Penelitian
3.3.1 Persiapan Buah Duwet
Buah duwet yang digunakan adalah buah duwet yang berwarna ungu (sangat matang). Buah duwet dipisahkan dari bijinya sehingga diperoleh kulit-daging buah (buah duwet utuh tanpa biji), sedangkan sebagian buah duwet diambil kulitnya saja dengan menggunakan pisau stainless steel sehingga diperoleh kulit buahnya saja. Kulit buah dan buah duwet utuh tanpa biji secara terpisah diblansir selama 2 menit dengan menggunakan uap panas 80oC untuk mengaktifkan enzim polifenol oksidase. Sampel yang diperoleh dimasukkan ke dalam kantong plastik dan disimpan dalam lemari pembeku untuk tahapan selanjutnya.
3.3.2 Optimasi Ekstraksi Antosianin.
Buah duwet diekstraksi dengan menggunakan 2 perlakuan, yaitu: Bagian Buah duwet yang diekstraksi (A)
A1 = kulit buah duwet
A2 = kulit dan daging buah duwet (buah duwet utuh tanpa biji) Metode ekstraksi (B)
B1 = Pengepresan
B2 = Maserasi dengan pelarut etanol
B3 = Kombinasi pengepresan dan maserasi dengan pelarut etanol Dengan kombinasi:
A1B1 A1B2 A1B3
A2B1 A2B2 A2B3
dengan kecepatan 4000 rpm untuk memisahkan filtrat dan residu. Filtrat yang diperoleh ditampung dalam erlenmeyer, dan residu diekstrak kembali dengan cara yang sama. Filtrat dari hasil maserasi dengan pelarut etanol yang diperoleh digabung, kemudian difiltrasi dengan vakum filter, dan dievaporasi dengan rotary vacumm evaporator pada suhu 36oC, sehingga menghasilkan ekstrak pekat dan di keringkan dengan freeze drying. Untuk ekstraksi dengan menggunakan metode kombinasi pengepresan dan maserasi, sampel berupa bubur buah dipres sehingga menghasilkan filtrat dan residu, kemudian residu diekstraksi kembali dengan metode maserasi dengan menggunakan pelarut etanol sesuai dengan metode sebelumnya, filtrat yang diperoleh dari hasil pengepresan dan ekstraksi dengan pelarut etanol digabungkan dalam erlenmeyer, dievaporasi dan kemudian dikeringkan dengan freeze drying. Setelah dikeringkan, ekstrak yang diperoleh diukur total rendemen ekstrak, konsentrasi antosianin menggunakan metoda pH- differential (Prior et al., 1998) dan rendemen pigmen antosianin.
3.3.3 Karakterisasi Pigmen Antosianin Kulit Buah Duwet pada Beberapa
Variasi pH
Ekstrak kulit buah duwet dianggap sebagai antosianin Petunidin-3-rhamnosa (BM = 463), yang didasarkan dari penelitian sebelumnya oleh Leimena (2008). Karakteristik antosianin ekstrak buah duwet dalam beberapa variasi pH dilakukan dengan cara melarutkan ekstrak (dianggap sebagai petunidin-3-rhamnosa) dalam buffer potasium klorida (0.06 M) untuk pH 1 sampai 4 dan buffer sodium asetat (0.06 M) untuk pH 5 sampai 8 dengan konsentrasi 0.6mM. Larutan antosianin dicampur dengan perbandingan 1:1 dengan buffer pH masing-masing, sehingga konsentrasi akhir larutan antosianin adalah 0.3mM. Kemudian larutan yang telah dicampur diatur pHnya menjadi pH 1 sampai 8 dengan 10M HCl atau 25% NaOH dan didiamkan selama 30 menit.
0.06M (Lampiran 1), sedangkan asam galat dilarutkan dalam 10% DMSO dalam masing-masing buffer dengan konsentrasi 0.06M. Larutan antosianin dan kopigmen dicampur dengan perbandingan 1:1, sehingga konsentrasi akhir larutan campuran adalah 0.3mM antosianin dan 0.03M kopigmen, sehingga perbandingan molar kedua larutan 1:100. Kemudian larutan yang telah dicampur diatur pHnya menjadi pH 1 sampai 8 dengan 10 M HCl atau 25% NaOH dan didiamkan selama 30 menit. Metode kopigmentasi ini didasarkan pada metode yang digunakan oleh Maarit et al. (2002) yang dimodifikasi.
Spektra UV-visibel larutan antosianin pada setiap nilai pH diukur dengan spektrofotometer pada panjang gelombang 400 sampai 650 nm untuk melihat pergeseran panjang gelombang maksimum. Perubahan nilai absorbansi akibat perlakuan pH juga diukur dengan spektrofotometer pada panjang gelombang 520 nm yang merupakan panjang gelombang maksimum ( max) pigmen antosianin buah duwet (Sari et al. 2005).
3.3.4 Uji Stabilitas dan Kopigmentasi Pigmen Antosianin Buah Duwet
Terpilih
Pengujian stabilitas terhadap oksidator, cahaya, suhu pemanasan dan penyimpanan dilakukan pada buffer pH 3 untuk antosianin dari ekstrak buah duwet tanpa dan dengan penambahan asam ferulik dan asam galat sebagai kopigmen untuk mempertahankan kestabilan warna antosianin.
Ekstrak kulit buah duwet dianggap sebagai antosianin Petunidin-3-rhamnosa (BM = 463), yang didasarkan dari penelitian sebelumnya oleh Leimena (2008). Pengujian stabilitas antosianin ekstrak buah duwet dilakukan dengan cara melarutkan ekstrak (dianggap sebagai petunidin-3-rhamnosa) dalam buffer KCl 0.06M dengan konsentrasi 0.6mM. Larutan antosianin dicampur dengan perbandingan 1:1 dengan buffer KCl 0.06M, sehingga konsentrasi akhir larutan antosianin adalah 0.3mM. Kemudian larutan yang telah dicampur diatur pHnya menjadi pH 3 dengan 10M HCl atau 25% NaOH.
DMSO dalam buffer KCl 0.06M dengan konsentrasi 0.06M (Lampiran 1), sedangkan asam galat dilarutkan dalam 10% DMSO dalam buffer KCl 0.06M dengan konsentrasi 0.06M. Larutan antosianin dan kopigmen dicampur dengan perbandingan 1:1, sehingga konsentrasi akhir larutan campuran adalah 0.3mM antosianin dan 0.03M kopigmen, sehingga perbandingan molar kedua larutan 1:100. Kemudian larutan yang telah dicampur diatur pHnya menjadi pH 3 dengan 10M HCl atau 25% NaOH. Metode kopigmentasi ini didasarkan pada metode yang digunakan oleh Maarit et al. (2002) yang dimodifikasi. pH 3 dipilih untuk analisis karena antosianin lebih stabil pada pH 3 dibanding dengan pH asam lainnya (pH 1, 2, 4 dan 5), dan pH 3 umumnya merupakan pH untuk produk pangan asam seperti juice dan minuman berkarbonasi, sehingga dapat menggambarkan penerapannya dalam produk pangan.
Pengujian stabilitas antosianin buah duwet dilakukan dengan melihat karakteristik terhadap beberapa variasi pH, serta mengukur kestabilannya terhadap oksidator, cahaya, suhu pemanasan, dan kondisi penyimpanan (suhu dingin dan suhu ruang),. Stabilitas digambarkan dalam retensi warna atau pigmen (%) yang dihitung dengan menggunakan persamaan: B/A × 100%, dimana A adalah nilai absorbansi antosianin sebelum diberi perlakuan dan B adalah nilai absorbansi antosianin setelah diberi perlakuan.
3.3.4.1 Stabilitas terhadap Oksidator
Larutan antosianin ekstrak dan larutan antosianin ekstrak yang telah ditambah kopigmen ditambah 0.25 ml H2O2 (1%) (volume akhir larutan dijaga tetap 10ml) dimasukkan ke dalam botol gelap dan diukur absorbansinya dengan spektrofotometer ( = 520 nm) serta dilakukan juga pengukuran dengan khromameter pada setiap waktu kontak 0, 3, 6, 9, 12 dan 15 jam.
3.3.4.2 Stabilitas terhadap Sinar
kotak selama 7 hari. Pengukuran absorbansi dilakukan setiap hari dengan spektrofotometer pada panjang gelombang 520 nm dan dengan khromameter.
3.3.4.3 Stabilitas terhadap Suhu Pemanasan
Larutan antosianin tanpa kopigmen dan larutan antosianin ekstrak yang telah ditambah kopigmen dimasukkan ke dalam botol gelap dan diinkubasi pada suhu 30, 40, 50, 60, 70, 80, 90, dan 100oC, selama 2 jam kemudian diukur absorbansinya dengan spektrofotometer pada panjang gelombang 520 nm yang merupakan panjang gelombang maksimum antosianin kulit buah duwet pada pH 3 dan juga dengan khromameter setiap interval waktu 30 menit.
3.3.4.4 Pengaruh Suhu Selama Penyimpanan
Larutan antosianin ekstrak dan larutan antosianin ekstrak yang telah ditambah kopigmen dimasukkan ke dalam botol gelap dan disimpan pada suhu kamar (30oC) dan suhu dingin (10°C), selama 1 bulan. Kemudian dilakukan pengukuran absorbansi dengan spektrofotometer pada panjang gelombang 520 nm dan dengan khromameter dengan interval waktu pengamatan 0, 5, 10, 15, 20, 25 dan 30 hari.
3.3.5 Metode Analisis
Pengamatan meliputi analisis total rendemen, konsentrasi antosianin, rendemen antosianin, dan analisis warna dengan khromameter
.3.3.5.1 Total Rendemen Ekstrak (Sari et al. 2005)
Total rendemen dihitung dalam persen sebagai berat ekstrak yang telah dikeringkan dengan frezee dryer dibagi berat buah duwet basah.
Total Rendemen (%) = 100%
) (
) ( ker
× g duwet buah Berat
g ing ekstrak
Berat
3.3.5.2 Konsentrasi Antosianin dengan Metoda pH-differential (Prior et al. 1998).
Sebanyak masing-masing 0.05 ml sampel dimasukkan ke dalam 2 buah tabung reaksi. Tabung reaksi pertama ditambah larutan buffer potasium klorida (0.025 M) pH 1 sebanyak 4.95 ml dan tabung reaksi kedua ditambahkan larutan buffer sodium asetat (0.4 M) pH 4.5 sebanyak 4.95 ml. Pengaturan pH dalam pembuatan buffer potasium klorida dan sodium asetat menggunakan HCl pekat. Absorbansi dari kedua perlakuan pH diukur dengan spektrofotometer pada panjang gelombang 515 nm dan 700 nm setelah didiamkan selama 15 menit. Nilai absorbansi dihitung dengan rumus : A = [(A515 – A700)pH 1 – (A515 – A700)pH 4.5]. Konsentrasi antosianin dihitung sebagai sianidin-3-glikosida menggunakan koefisien ekstingsi molar sebesar 29 600 L cm-1 dan berat molekul sebesar 448.8. Konsentrasi antosianin (mg/L) = (A x BM x FP x 1000) / (ε x 1), dimana A adalah absorbansi, BM adalah berat molekul (448.8), FP adalah faktor pengenceran (5 ml / 0.05 ml), dan ε adalah koefisien ekstingsi molar (29 600 L cm-1).
3.3.5.3 Rendemen Pigmen Antosianin (Sari et al. 2005)
Rendeman antosianin dihitung dalam persen yang menyatakan banyaknya antosianin yang terdapat dalam sampel berdasarkan berat basah.
Rendemen antosianin (%) = 100%
) (
) (
× g
sampel berat
g antosianin i
Konsentras
3.3.5.4 Pengukuran Warna dengan Spektofotometer
Pengukuran absorbansi dilakukan untuk ekstrak antosianin duwet dengan penambahan buffer dan ekstrak antosianin buah duwet. Absorbansi sampel diukur dengan spektofotometer pada panjang gelombang maksimum antosianin. Panjang gelombang maksimum yang digunakan adalah 520 nm.
3.3.5.5 Analisis Warna dengan Kromameter (Francis, 1998)
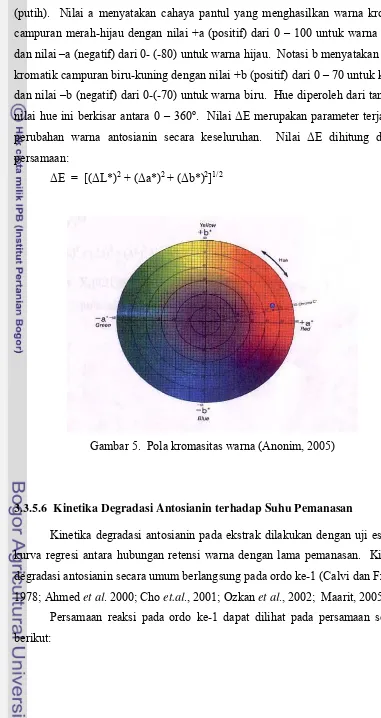
parameter kecerahan (lightness) yang mempunyai nilai dari 0 (hitam) sampai 100 (putih). Nilai a menyatakan cahaya pantul yang menghasilkan warna kromatik campuran merah-hijau dengan nilai +a (positif) dari 0 – 100 untuk warna merah dan nilai –a (negatif) dari 0- (-80) untuk warna hijau. Notasi b menyatakan warna kromatik campuran biru-kuning dengan nilai +b (positif) dari 0 – 70 untuk kuning dan nilai –b (negatif) dari 0-(-70) untuk warna biru. Hue diperoleh dari tan-1 a/b, nilai hue ini berkisar antara 0 – 360o. Nilai ΔE merupakan parameter terjadinya perubahan warna antosianin secara keseluruhan. Nilai ΔE dihitung dengan persamaan:
[image:45.595.99.480.100.818.2]ΔE = [(ΔL*)2 + (Δa*)2 + (Δb*)2]1/2
Gambar 5. Pola kromasitas warna (Anonim, 2005)
3.3.5.6 Kinetika Degradasi Antosianin terhadap Suhu Pemanasan
Kinetika degradasi antosianin pada ekstrak dilakukan dengan uji estimasi kurva regresi antara hubungan retensi warna dengan lama pemanasan. Kinetika degradasi antosianin secara umum berlangsung pada ordo ke-1 (Calvi dan Francis, 1978; Ahmed et al. 2000; Cho et.al., 2001; Ozkan et al., 2002; Maarit, 2005).
kA dt
dA = −
Penentuan variabel kuantitatif degradasi antosianin dilakukan melalui integrasi terhadap persamaan tersebut hingga diperoleh persamaan matematis. Melalui persamaan matematis tersebut dapat diinterpretasikan nilai konstanta degradasi antosianin (Singh, 1994). Persamaan matematis tersebut adalah:
∫
∫
= −−t At A dt k A dA 0 0 /Ln At - ln Ao = -kt Ln At/A0 = -kt + C
Ln (Retensi Warna) = -kt + C Keterangan:
At = konsentrasi antosianin setelah pemanasan A0 = konsentrasi antosianin sebelum pemanasan k = konstanta degradasi antosianin
t = waktu pemanasan
Parameter besarnya ketergantungan laju reaksi terhadap suhu dapat dilihat dalam nilai energi aktivasinya (Lund, 1977). Hal ini dapat dinyatakan dalam persamaan Arrhenius berikut:
k = ko.e-Ea/RT
⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − = T R Ea ko
k ln 1
ln
Dimana:
k = konstanta laju reaksi ko = faktor frekuensi Ea = energi aktivasi
3.4 Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) secara faktorial terdiri dari dua faktor dengan tiga kali ulangan. Adanya perbedaan yang diperoleh akan diuji lanjut dengan uji BNT pada taraf uji 5%.
Yijk = + αi + βj + αβij + εijk
Dimana:
Yijk = nilai pengamatan akibat faktor A taraf ke i faktor B taraf ke j dan ulangan ke k
= rata-rata
αi = pengaruh utama faktor A
βj = pengaruh utama faktor B
αβij = pengaruh interaksi faktor A dan faktor B
IV HASIL DAN PEMBAHASAN
4.1 Ekstraksi dan Karakteristik Ekstrak Pigmen Antosianin Buah Duwet
(Syzygium cumini)
Pigmen antosianin buah duwet diperoleh melalui proses ekstraksi. Ekstraksi adalah suatu cara untuk memisahkan campuran beberapa zat menjadi komponen yang terpisah berdasarkan perbedaan kelarutannya, dengan melarutkan bahan dalam pelarut tertentu, baik pelarut polar maupun nonpolar. Untuk mengekstrak zat warna diperlukan metode yang sesuai dengan sifat bahan agar dihasilkan rendemen dan stabilitas yang tinggi (Winarno 1997; Hanum 2000).
Pada penelitian ini dilakukan proses ekstraksi menggunakan 3 metode yaitu dengan cara maserasi (dengan pelarut etanol), metode pengepresan dan metode kombinasi pengepresan-maserasi. Pemilihan metode pengepresan ini didasarkan pada kepraktisan dan keamanan penerapannya. Sedangkan pemilihan etanol sebagai pelarut disesuaikan dengan kepolaran antosianin. Menurut Jackman dan Smith (1996), antosianin memiliki cincin aromatik yang mengandung gugus polar (hidroksil, karboksil, metoksil) dan residu glikosil yang menghasilkan molekur polar. Dengan keadaannya yang polar, antosianin lebih mudah larut dalam pelarut polar seperti etanol.
Penggunaan etanol sebagai pelarut juga dipilih berdasarkan pertimbangan keamanan, karena tidak bersifat toksik sehingga relatif aman digunakan pada produk pangan. Hal ini didukung oleh Sari et al. yang melaporkan bahwa etanol merupakan salah satu pelarut yang efektif untuk ekstraksi antosianin dari buah duwet. Penambahan asam tidak dilakukan untuk menghindari kerusakan gugus asil. Menurut Markakis (1982), penambahan asam tidak selalu diperlukan untuk menghindari terhidrolisisnya gugus asil.
yang telah matang yang memiliki ciri-ciri berwarna ungu kehitaman dan berkualitas baik. Tingkat kematangan yang digunakan pada penelitian ini sesuai penelitian sebelumnya yang dilakukan oleh Leimena (2008), yang melaporkan bahwa buah duwet dengan tingkat kematangan tinggi yaitu dengan warna kulit ungu kehitaman memiliki kandungan antosianin paling besar.
Gambar 6 Buah Duwet (Syzygium cumini)
Proses ekstraksi pigmen antosianin buah duwet, dimulai dari pemisahan bagian yang akan diekstraksi. Dalam penelitian ini dilakukan ekstraksi pada kulit buah duwet dan buah duwet utuh tanpa biji untuk mengetahui bagian buah duwet yang menghasilkan konsentrasi antosianin terbanyak. Sampel yang sudah dipisahkan dari bagian yang tidak diperlukan diblansir dengan menggunakan uap panas. Menurut Hutching (1994), enzim yang dapat merusak antosianin dapat diaktivasi dengan menggunakan pemanasan. Bagian buah duwet dihancurkan terlebih dahulu untuk memperluas permukaan bahan sehingga laju pelarutan semakin tinggi.
Proses ekstraksi pigmen antosianin pada buah duwet dilakukan dengan 3 cara pengepresan, maserasi menggunakan pelarut etanol dan kombinasi keduanya, ekstraksi dilakukan pada suhu ruang dan kondisi yang gelap. Hal ini dilakukan karena pada umumnya antosianin tidak stabil terhadap cahaya (Sari et al. 2005). Adanya cahaya dapat menyebabkan degradasi pada antosianin (Elbe dan Schwarts, 1996).
menghasilkan filtrat yang berwarna ungu pudar. Hal ini dilakukan untuk mengoptimumkan proses ekstraksi sehingga pigmen antosianin yang terdapat pada sampel bisa terekstrak seluruhnya. Pengadukan dengan stirrer dilakukan untuk menambah efektifitas dari proses ekstraksi tersebut. Setelah itu dilakukan proses sentrifugasi untuk memisahkan filtrat dengan ampas. Pada proses ekstraksi ini juga dilakukan penyaringan menggunakan vacuum filter untuk memisahkan sisa-sisa ampas yang ada setelah proses sentrifugasi.
Filtrat yang dihasilkan kemudian dipekatkan dengan menggunakan rotary vacuum evaporator pada suhu 36oC. Penggunaan suhu yang rendah ini bertujuan untuk menghindari terjadinya degradasi dan hidrolisis dari pigmen antosianin (Timberlake dan Bridle, 1983). Filtrat dipekatkan dengan cara menguapkan etanolnya. Filtrat yang telah dipekatkan kemudian ditambah aquadest dan dipekatkan kembali. Ekstrak kasar yang diperoleh kemudian dimasukkan kedalam botol gelap dan disimpan dalam freezer. Penyimpanan dalam freezer sampai ekstrak digunakan untuk analisis berikutnya ini bertujuan menjaga stabilitas antosianin yang sangat mudah terdegradasi. Ekstrak pekat antosianin dapat dilihat pada Gambar 7.
Gambar 7 Ekstrak kulit buah duwet (Syzigium cumini)
Hasil ekstraksi dari berbagai macam variasi cara ekstraksi dan bagian buah yang diekstrak dalam penelitian ini diukur total rendemen, konsentrasi antosianin dan rendemen antosianinnya, dimana hasil dari bagian buah dan cara ekstraksi yang paling baik digunakan untuk penelitian selanjutnya.
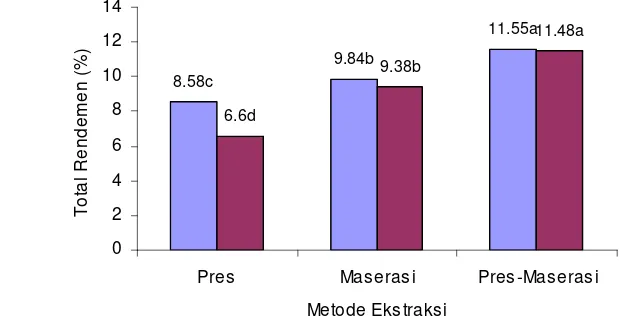
metode ekstraksi memberikan pengaruh sangat nyata terhadap rendemen ekstrak dari bagian buah yang diekstraksi. Pada metode maserasi dan kombinasi pengepresan-maserasi, nilai total rendemen dari kulit dan daging buah duwet utuh tidak berbeda nyata (Lampiran 3 dan 4).
11.55a
9.84b
8.58c 9.38b
11.48a
6.6d
0 2 4 6 8 10 12 14
Pres Mas erasi Pres -Maseras i
Metode Ekstraksi
T
o
ta
l R
e
nd
em
e
n (
%
)
[image:51.595.138.452.182.344.2]Buah Duwet Utuh Tanpa Biji Kulit Buah Duwet
Gambar 8 Total rendemen ekstrak Buah Duwet
Ekstraksi buah duwet utuh tanpa biji dengan metode pengepresan-maserasi (kombinasi) menghasilkan total rendemen tertinggi sebesar 11,55% dan kulit buah duwet memberikan juga memberikan hasil yang tidak berbeda nyata yaitu sebesar 11,48% (Lampiran 3). Hasil penelitian terdahulu oleh Sari et al. (2005) memperoleh rendemen